ルシフェラーゼを含む発光系及びそれを用いたイメージング方法
【課題】本発明は、個体に及ぼす影響が少なく、且つ個体中の標的の細胞又は細胞群を特異的にイメージングすることが可能なイメージング方法並びに前記方法に利用可能な発光系、発光プローブ及び前記プローブで標識された標的細胞の表面を特異的に認識可能な物質を提供することを目的とする。
【解決手段】 以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法を提供する。
【解決手段】 以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、ルシフェラーゼを含む発光系及びそれを用いて個体中の標的の細胞及び細胞群をイメージングする方法に関する。より詳細には、本発明は、有機蛍光色素が結合したルシフェラーゼ誘導体を含む発光系、前記発光系で細胞の表面を特異的に認識する物質を標識した標識化物質、及び前記標識化物質を用いて個体における前記物質によって認識される表面を有する細胞及び細胞群をイメージングする方法に関する。
【背景技術】
【0002】
臓器や腫瘍の病態を把握する方法として、現在は存在診断と形態診断が主に行われている。存在診断とは、臓器や腫瘍の画像から病的な部分を発見することであり、質的診断とは発見された病的部分について、疾患の種類や進行度を診断することである。質的診断は、手術療法並びに化学療法の適応、選択、及び方法を決定する上で特に重要である。しかし、現在診断に使用される方法では、病態の進展様式、進展速度、及び治療への反応を正確に把握し、信頼性のある質的診断をすることは困難である。
【0003】
例えば、腫瘍特異的抗原等を利用した診断・治療法の開発が試みられている。確実且つ安全に抗体治療を行うには、十分量の抗体が標的の抗原に到達し、抗原との結合が十分に持続すること、及び抗体が骨髄などの腫瘍以外の組織へ移行や集積しないことが重要である。よって、抗体治療では、体内での抗体の動向をモニターすることが必要である。しかし、安全性及び経済性を考慮して効率的且つ正確に前記モニターをリアルタイムに行う手段は今のところ開発されていない。
【0004】
現在、腫瘍等のイメージングには放射性プローブ、蛍光プローブ、及び発光プローブ等が用いられている。中でも、特別な施設や設備が不要であることから、蛍光プローブ及び発光プローブといった光プローブが注目されている。発光プローブに関して、最近、ナノ量子ドットとウミシイタケルシフェラーゼとを融合した近赤外光のプローブが報告されたが(非特許文献1)、ナノ無機材料の毒性の問題から、その使用は限られている。また、近赤外光を発する蛍光色素プローブによるイメージングも報告されている。しかし、生体内のプローブに外部からの光を到達させるためには、非常に強い光を当てる必要があり、これによって生体に傷害を与えることとなるため安全性の観点から実用性に欠ける。
【0005】
また、400nm〜630nmの波長の光を発する従来の発光プローブを用いた個体光イメージングでは、生体深度1cm以下までしかイメージングすることができず、400nm-650nmの光を発する発光プローブを用いたとしても生体深度2cmまでのイメージングが限度であると考えられていた(非特許文献3)。さらに肝臓などのヘモグロビンの多い臓器は、650nm以下の光を吸収するため従来方法でイメージングすることは不可能である。
【0006】
一方、特許文献1には、ビオチンで標識したウミホタルルシフェラーゼが記載されている。非特許文献4には、ビオチン標識ウミホタルルシフェラーゼを免疫測定法や各種アッセイに使用することができることが記載されている。しかし、ウミホタルルシフェラーゼの最大発光波長は460nmであり、生体組織の透過性が低いため、それを生体内のイメージング用プローブとして用いたとしても十分な光を検出することは困難である。
【0007】
ルシフェラーゼを発光プローブに使用する場合、基質であるルシフェリンは体内に存在する活性酸素やBSAとも反応し、発光することが知られている。これにより、標的の細胞や組織に無関係な場所でも光が放出され、結果として特異的なイメージングが妨げられることも問題である。
【特許文献1】特開2008−148号公報(特願2007-187738の公開)
【非特許文献1】Min-Kyung So et al., Nature Biotechnology, 24, 339-343, 2006
【非特許文献2】Frangioni, J. V., Curr Opin Chem Biol. Vol. 7, 626-634, 2003
【非特許文献3】Rice BW, et al., In vivo imaging of light-emitting probes, J. Biomedical Optics 6, 432-440, 2001
【非特許文献4】Wu C,et al., Analytical Chemistry 79, 1634-1638, 2007
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、個体に及ぼす影響が少なく、且つ個体中の標的の細胞又は細胞群を特異的にイメージングすることが可能なイメージング方法並びに前記方法に利用可能な発光系、発光プローブ及び前記プローブで標識された標的細胞の表面を特異的に認識可能な物質を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる現状の下、本発明者らは、日夜研究を重ねたところ、ルシフェラーゼと有機蛍光色素を組合せて、ルシフェラーゼから発せられるエネルギーで有機蛍光色素を励起することで、外部から光を照射することなく、個体中で近赤外光を放出させることが可能であることを見出した。本発明者らは、さらに研究を重ね、細胞の表面を特異的に認識する物質と前記ルシフェラーゼと結合させることによって、当該物質によって認識される表面を有する細胞又は細胞群を、前記ルシフェラーゼと有機蛍光色素との複合体で標識し、前記細胞又は細胞群を特異的にイメージングすることが可能であることを見出した。さらに、本発明者らは、鋭意検討を重ねた結果、650nm〜750nmの波長の光を選択的に透過するフィルターを介して個体から発せられる光を検出することにより、ルシフェリンからの非特異的な光(バックグラウンド)を排除することが出来ることを見出した。本発明は、かかる知見に基づき、更なる改良を加えた結果完成したものである。
【0010】
即ち、本発明は、以下の発明を提供するものである。
項1 以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
項2 ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体。
項3 有機蛍光色素がインドシアニングリーン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミンから成る群から選択される少なくとも一種である、項2に記載の誘導体。
項4 ルシフェラーゼがウミホタルルシフェラーゼである、項2又は3に記載の誘導体。
項5 有機蛍光色素が糖鎖を介してルシフェラーゼに結合している、項2〜4のいずれかに記載のルシフェラーゼ誘導体。
項6 項2〜5のいずれかに記載のルシフェラーゼ誘導体が、ビオチン−アビジン物質複合体を介して細胞の表面を特異的に認識する物質と結合した、標識化物質。
項7 有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体が、糖鎖を介して細胞の表面を特異的に認識する物質に結合している、標識化物質。
項8 細胞の表面を特異的に認識する物質が、抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドからなる群から選択される少なくとも1種である、項6又は7に記載の標識化物質。
項9 以下:
(1)請求項6〜8のいずれかに記載の標識化物質を個体に導入する工程;
(2)ルシフェリンを個体に導入する工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【発明の効果】
【0011】
本発明によれば、細胞の表面を特異的に認識する物質によって認識される標的の細胞又は細胞群を、外部から光を照射することなく、より安全且つ正確にイメージングすることが出来る。外部からの光の照射が不要であるため、外部からの励起光が届き難い個体の深部にある細胞や組織をイメージングすることが可能である。例えば、従来は生体表面から2cm以上深い場所を正確にイメージングすることは困難であったが、本発明によれば、2cm以上深い深部をも非侵襲的にイメージングすることが可能である。よって、本発明を利用することにより、腫瘍等、各種疾患の患部を発見することや病態の変化をリアルタイムに非侵襲的にイメージングし、腫瘍の診断や治療に役立てることが出来る。また、放射性プローブ等と比較して、イメージングに特殊な設備を必要としないため、長期間に亘るイメージングをより簡便に行うことも可能である。さらに、細胞の表面を特異的に認識する物質として抗体を用いることにより、抗体医薬の動態をリアルタイムで追跡することも可能であり、抗体医薬のスクリーニングに応用することが出来る。
【発明を実施するための最良の形態】
【0012】
以下、本発明のイメージング方法、並びに前記方法に使用される、ルシフェラーゼ誘導体及び前期ルシフェラーゼ誘導体で標識された標識化物質について詳細に説明する。
【0013】
ルシフェラーゼ
本発明において使用されるルシフェラーゼは、ルシフェリンと反応して発光する性質を有する酵素である。本発明のイメージング方法に使用可能なルシフェラーゼとしては、例えば、ウミホタルルシフェラーゼ、ホタルルシフェラーゼ、鉄道虫ルシフェラーゼ、ヒカリコメツキルシフェラーゼ、イリオモテボタルルシフェラーゼ、及びウミシイタケルシフェラーゼ等を挙げることが出来る。
【0014】
本発明において、ルシフェラーゼは個体に導入されるため、ルシフェラーゼは個体内で安定であることが好ましい。またルシフェラーゼは、糖鎖を有していることが好ましい。これは、本発明の好ましい一実施形態において、ルシフェラーゼは、細胞の表面を特異的に認識する物質及び/又は有機蛍光色素をと結合しており、これらの結合を糖鎖を介して行うことが出来るためである。糖鎖を有するルシフェラーゼは、糖鎖を本来有するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ)を用いてもよく、本来糖鎖を有さないルシフェラーゼをコードする遺伝子を酵母、昆虫細胞、及び哺乳類細胞等の真核細胞で発現させて得られる糖鎖が付加したルシフェラーゼを使用することも出来る。
【0015】
さらに本発明に使用されるルシフェラーゼは、有機蛍光色素を励起して650nm〜750nmの波長の光を放出させることが可能な光を放出することが好ましい。有機蛍光色素を励起して650nm〜750nmの波長の光を放出させることが可能な光は、使用する有機蛍光色素によって異なる。例えば、有機蛍光色素としてインドシアニングリーンを用いる場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてローダミンを使用する場合は、350nm〜500nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてクマリンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてキサンテンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてヘマトポルフィリンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。
【0016】
個体内での安定性及び糖鎖を有するという観点から好ましいルシフェラーゼは、ウミホタルルシフェラーゼである。ウミホタルルシフェラーゼは、最大発光波長460nmの光を放出し、体内温度37℃での半減期が約60時間である安定性の高い酵素である。
【0017】
本発明において使用できるウミホタルルシフェラーゼ、ホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ等は、商業的に入手可能である。また、それらの遺伝子配列及びアミノ酸配列も公知であるため、ルシフェラーゼは公知の遺伝子工学的手法により、常法に従って得ることが出来る。例えば、野生型ウミホタルルシフェラーゼのアミノ酸配列は、NCBIにアクセッションNo.AAB86460、AAA30332、及びBAD08210で登録させている。本明細書に添付される配列表に、配列番号1としてウミホタルルシフェラーゼのアミノ酸配列を示す。また、後述するルシフェラーゼのビオチン化を容易に行うため、アビチンタグ配列を挿入したルシフェラーゼ変異体を使用することも好ましい。アビジンタグを有するウミホタルルシフェラーゼのアミノ酸配列及び塩基配列を各々配列番号2及び3に示す。
【0018】
本発明に使用されるルシフェラーゼは、ルシフェリンと反応して光エネルギーを放出する性質を有する限り、1個又は十数個(例えば、15個、14個、13個、12個、11個、10個、9個、8個、7個、6個、5個、4個、3個、2個)のアミノ酸が置換、付加、欠失、及び/又は挿入された変異型ルシフェラーゼであってもよい。変異型ルシフェラーゼは、上記野生型ルシフェラーゼのアミノ酸配列との間で70%以上のホモロジー、好ましくは80%以上、より好ましくは90%以上、さらに好ましくは95%以上、特に好ましくは98%以上、最も好ましくは99%以上のホモロジーを有する。
【0019】
ルシフェラーゼ改変体の製造は、常法に従って作製することができる。例えば、野生型のルシフェラーゼ遺伝子を、サイトスペシフィック・ミュータゲネシス〔Methods in Enzymology, 154, p350, 367-382 (1987);同100, p468 (1983) ;Nucleic Acids Research, 12,p9441 (1984);続生化学実験講座1「遺伝子研究法II」、日本生化学会編, p105 (1986) 〕で改変することができる。また、リン酸トリエステル法やリン酸アミダイト法などの化学合成手段〔J. Am. Chem. Soc., 89, p4801 (1967);同91, p3350 (1969);Science, 150,p178 (1968) ;Tetrahedron Lett., 22, p1859 (1981);同24, p245 (1983)〕で野生型ルシフェラーゼの遺伝子を改変させることもできる。変異型ルシフェラーゼの作成は、前記のような公知の技術を適宜組み合せて行うことができる。
【0020】
アミノ酸配列の同一性ないしホモロジー(%)は、当該分野で慣用のプログラム(例えば、BLAST、FASTA等)を用いて決定することができる。同一性(%)は、当該分野で公知の任意のアルゴリズム、例えば、Needlemanら(1970)(J.Mol.Biol.48:444−453)、Myers及びMiller(CABIOS,1988,4:11−17)のアルゴリズム等を使用して決定することもできる。Needlemanらのアルゴリズムは、GCGソフトウェアパッケージ(www.gcg.comで入手可能)のGAPプログラムに組み込まれており、同一性(%)は、例えば、BLOSUM 62 matrix又はPAM250 matrix、並びにgap weight:16、14、12、10、8、6若しくは4、及びlength weight:1、2、3、4、5若しくは6のいずれかを使用して決定することができる。
【0021】
ルシフェリン
本発明においてルシフェリンとは、ルシフェラーゼの発光性基質となる物質である。ルシフェリンは、ルシフェラーゼと反応して光エネルギーを発するものであれば特に制限なく使用することができる。具体的には、ウミホタルルシフェリン、ヒカリコメツキルシフェリン、ホタルルシフェリン、ウミシイタケルシフェリン、鉄道虫ルシフェリン、イリオモテボタルルシフェリン等を挙げることができる。また、天然由来のルシフェリンだけでなく、合成された代替ルシフェリン又はルシフェリンの前駆体を使用することもできる。
【0022】
ウミホタルルシフェラーゼを使用する場合は、ウミホタルルシフェリンが好ましい。ヒカリコメツキルシフェラーゼを使用する場合は、ヒカリコメツキルシフェリンが好ましい。ホタルルシフェリンを使用する場合は、ホタルルシフェリンが好ましい。鉄道虫ルシフェラーゼを使用する場合は、鉄道虫ルシフェリンが好ましい。イリオモテボタルルシフェラーゼを使用する場合は、イリオモテボタルルシフェリンが好ましい。
【0023】
ルシフェラーゼを含む近赤外発光系
本発明に関して、ルシフェラーゼを含む近赤外発光系とは、上記のルシフェラーゼとルシフェリンとの反応で生じるエネルギーを、有機蛍光色素が吸収し、励起されることで650nm〜750nmの波長の近赤外光を放出する系である。
【0024】
有機蛍光色素
本発明において使用される有機蛍光色素とは、一定の波長のエネルギーを吸収し、近赤外光を放出する有機物質である。これは、放出した光が生体に存在するヘモグロビン及び水によって吸収されることを避けるためである。好ましい有機蛍光色素は、650nm〜800nmの範囲に含まれる波長の光を放出するものであり、より好ましくは、650nm〜750nmに発光波長を有する有機蛍光色素である。
【0025】
有機蛍光色素は、上記のルシフェラーゼが有する糖鎖との結合を可能にするため、アミノ基又はヒドラジノ基(NH2NH−)を有することが好ましい。好ましい有機蛍光色素としては、インドシアニン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミン等の化合物が挙げられる。前記化合物には、650nm〜750nmの波長の光を発する性質を有している限り、それら誘導体及び類似体が含まれる。より好ましくは、インドシアニングリーン、ヘマトポルフィリン、及びこれらの誘導体であり、最も好ましくはインドシアニングリーン及びその誘導体のようなシアニン系色素である。
【0026】
ルシフェラーゼがドナーとして発した光がアクセプターである有機蛍光色素に到達したときにエネルギー移動が生じて有機蛍光色素からの発光が起こる。このエネルギー移動はドナーとアクセプターの距離が1〜10nmの範囲で効率よく起こる。よって、有機蛍光色素とルシフェラーゼは、互いに1〜10nm以内に位置していることが好ましい。
【0027】
細胞の表面を特異的に認識する物質
本発明において使用される、細胞の表面を特異的に認識する物質(以下、当該物質とも称する。)とは、特定の細胞の表面に提示されているタンパク質、脂質、糖鎖、及び/又は核酸等を特異的に認識する物質である。具体的には、特定の細胞の表面に提示されるタンパク質、脂質、糖鎖及び/又は核酸を特異的に認識する抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドが挙げられる。
【0028】
本発明によれば、従来困難であった深度2cm以上に存在する臓器等をイメージングすることが可能であり、また光を吸収するヘモグロビンなどのヘムタンパク質の多い臓器(例えば、肝臓、心臓、腎臓、脾臓等)をイメージングすることも可能である。従って、一実施形態において、当該物質によって認識される細胞又は細胞群は、生体の表層から2cm以上深い場所(例えば、胃、腸、肝臓、心臓、腎臓、脾臓等)に存在する細胞又は細胞群である。
【0029】
本発明の一実施形態において、好ましい当該物質は、腫瘍細胞の表面に特異的に提示される腫瘍特異抗原及び他の正常細胞にも微量で発現されるが腫瘍細胞で多量の発現される腫瘍関連抗原を特異的に認識する抗体である。抗体は、ポリクローナル抗体であってもモノクローナル抗体であってもよい。抗体の由来は、特に限定されず、ヒト、マウス、ラット、ヤギ、イヌ等の各種動物由来の抗体を利用することができ、キメラ抗体であってもよい。抗体は、特異的な認識・結合能力を有する限り、単鎖抗体及び二本鎖抗体のいずれでもよく、そのフラグメントであってもよい。抗体の結合性フラグメントとしては、例えばF(ab’)2、Fab’、Fab、Fv(variable fragment of antibody)、scFv、dsFv(disulfide stabilised Fv)、sdAb(single domain antibody)を例示することができる。
【0030】
細胞の表面を特異的に認識する抗体としては、例えば、肝臓癌に伴う腫瘍細胞の表面を特異的に認識する抗体として抗AFP抗体、卵巣癌及び子宮癌に伴う腫瘍細胞の表面を特異的に認識する抗CA125抗体及び抗CA602抗体、乳癌に伴う腫瘍細胞を特異的に認識する抗CA15−3抗体、膵臓癌に伴う腫瘍細胞の表面を特異的に認識する抗CA19−9抗体、前立腺癌に伴う腫瘍細胞の表面を特異的に認識する抗PSA抗体、肺癌に伴う腫瘍細胞の表面を特異的に認識する抗CYFRA抗体及び抗NSE抗体、扁平上皮癌に伴う腫瘍細胞の表面を特異的に認識する抗SCC抗体、肝臓癌に伴う腫瘍細胞の表面を特異的に認識する抗DLK抗体及び抗PIVKA−II抗体、癌の種類とは非特異的に腫瘍細胞を認識する抗TPA抗体、抗SLX抗体、抗hCG抗体、抗HEA125抗体、抗CEA抗体などを使用することができる。
【0031】
このように本発明の一実施形態において、細胞の表面を認識する物質によって認識される細胞は、腫瘍細胞である。例えば、肝臓癌、卵巣癌、食道癌、肺癌、胆道癌、前立腺癌、乳癌、胃癌、膵臓癌、大腸癌、子宮癌などに伴う腫瘍細胞を挙げることができる。
【0032】
細胞の表面を特異的に認識するホルモンとしては、タンパク質、ペプチド、ステロイド、アミンからなる各種のホルモンが挙げられる。タンパク質ホルモンとしては成長ホルモンGH、甲状腺刺激ホルモンTSH、黄体ホルモンLHなどが挙げられる。ペプチドホルモンとしては、オキシトシン、バソプレシン、セレクチン、ガストリン、コレシストキニン、インスリン、グルカゴン、レプチン及びカルシトニン等を挙げることができる。ステロイドホルモンとしては、アンドロゲン、エストロゲン、グルココルチコイド及びミネラルチコイド等を挙げることができる。アミンホルモンとしては、アドレナリン及びノルアドレナリンを挙げることができる。
【0033】
本発明の一実施形態において、細胞表層で作用するタンパク質ホルモンやペプチドホルモンを当該物質として使用することが好ましい。例えば、インスリンは脂肪、肝臓、筋肉などの標的細胞で糖代謝を制御するポリペプチドホルモンであるが、肥満患者及びII型糖尿病と肥満とを伴う患者ではインスリン受容体に異常がみられる。そこで、インスリンホルモンが認識する受容体を提示する細胞をイメージングすることにより糖尿病に関連した疾患の評価が可能になる。このように、全身臓器の細胞をターゲットとする各種ホルモンが結合する細胞を標的としてイメージングすることにより各種ホルモン関連の疾患を評価・検出することができる。
【0034】
細胞の表面を特異的に認識する糖鎖とは、例えば、カドヘリン糖タンパク質の糖鎖など、糖タンパク質由来の細胞接着因子の糖鎖が挙げられる。
【0035】
細胞の表面に提示される受容体及びイオンチャンネルのリガンドとしては、例えば、アセチルコリン、セロトニン、グルタミン酸、ATP等が挙げられる。
【0036】
ルシフェラーゼと有機蛍光色素との結合
本発明において、有機蛍光色素はルシフェラーゼからの光エネルギーを吸収して650nm〜750nmの波長の光を放出する。よって、有機蛍光色素はルシフェラーゼの近傍に位置していることが好ましく、より好ましくはルシフェラーゼと結合している。ルシフェラーゼと有機蛍光色素とは、当該技術分野において公知の方法を用いて結合させることができる。これらを結合させることによって本発明のルシフェラーゼ誘導体を得ることができる。当該結合は、シフェラーゼの酵素活性及び安定性、並びに有機蛍光色素の発光特性に影響を与えないことが好ましい。また、当該結合は、ルシフェラーゼから有機蛍光色素への光エネルギー移動を妨げないことが好ましい。これらの点を考慮して好ましい結合は、有機蛍光色素とルシフェラーゼとをルシフェラーゼ糖鎖(好ましくは、ルシフェラーゼ由来の糖鎖)を介して結合することである。
【0037】
糖鎖を有するルシフェラーゼと有機蛍光色素との糖鎖を介した結合は、例えば、次のようにして行うことが出来る。ルシフェラーゼの糖鎖をNaIO4などの過ヨウ素酸塩で処理し、糖鎖のビシナルジオールを開裂してアルデヒドとする。これと蛍光色素が有するアミノ基ないしヒドラジノ基(NH2NH−)とを反応させることによって、有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体を得ることが出来る。
【0038】
以下のスキームを参照して、ウミホタルルシフェラーゼが有する糖鎖に有機蛍光色素を導入する方法を例にさらに詳細に説明する。
【0039】
【化1】

【0040】
ルシフェラーゼを酢酸緩衝液などの適当な緩衝液に溶解し、1当量又は過剰量のNaIO4の溶液と混合する。4℃程度の低温から室温で10分から3時間程度反応させ、必要に応じてカラムで精製し、アルデヒド基を有するルシフェラーゼを得る。このルシフェラーゼを、ヒドラジノ基を有する有機蛍光色素(当量又は過剰量または化学量論量未満の量)と反応させて、有機蛍光色素が連結されたルシフェラーゼ誘導体を得ることができる。有機蛍光色素のアミノ基と連結する場合にはNaBH3CNなどの還元剤を必要に応じて使用することができる。
【0041】
上記の糖鎖を介した有機蛍光色素とルシフェラーゼとの結合方法は、ルシフェラーゼと細胞の表面を特異的に認識する物質との複合体に有機蛍光色素をさらに結合させる場合にも適用できる。
【0042】
細胞の表面を特異的に認識する物質とルシフェラーゼとの結合
上記細胞の表面を特異的に認識する物質とルシフェラーゼとは、当該技術分野に公知の任意の方法によって直接的に又は各種のリンカーを介して結合させることができる。ルシフェラーゼの酵素活性及び前記物質の特異的な認識(結合)に影響を及ぼさないように結合することが好ましい。
【0043】
本発明の一実施形態において、細胞の表面を特異的に認識する物質とルシフェラーゼとは、有機蛍光色素とルシフェラーゼとの結合と同様に、ルシフェラーゼが有する糖鎖を介して結合することができる。ここで、当該物質とルシフェラーゼとの結合に使用される糖鎖は、上記有機蛍光色素とルシフェラーゼとの結合に使用される糖鎖と同一の糖鎖であってもよく、また別の糖鎖であってもよい。糖鎖を介して当該物質のルシフェラーゼへの結合は、例えば、次のようにして行うことができる。まず、1つのルシフェラーゼが2個以上のアルデヒド基を有するようにNaIO4溶液と反応させる。次いで、アルデヒド残基がルシフェラーゼあたり1個以上残存するようにヒドラジノ基又はアミノ基を有する有機蛍光色素を反応させ、有機蛍光色素が糖鎖を介して結合したルシフェラーゼを得る。さらに、アミノ基を有する当該物質をNaBH3CNなどの還元剤の存在下で反応させ、当該物質が残存していた糖鎖を介してルシフェラーゼと連結し、有機蛍光色素−ルシフェラーゼ−当該物質の複合体である標識化物質を得ることができる。または、有機蛍光色素が連結されたルシフェラーゼ誘導体を再度NaIO4の溶液と反応させてアルデヒド基を生成し、次いでアミノ基を有する当該物質をNaBH3CNなどの還元剤の存在下で反応させて有機蛍光色素−ルシフェラーゼ−当該物質の複合体を得ることもできる。
【0044】
本発明の一実施形態において、ルシフェラーゼと細胞の表面を特異的に認識する物質とは、ルシフェラーゼのカルボキシル基をジシクロヘキシルカルボジイミドのような縮合剤で活性化し、当該物質のアミノ基とカップリングさせることによって結合することもできる。また、任意の二価または多価の架橋剤を用いて結合させることもできる。架橋剤は、マレイミド基、スクシンイミド基、活性エステル基、ヒドラジン基などの連結可能な反応性基を少なくとも2個有し、これらの基をアルキレン、アリーレン、アルケニレン、ポリオキシエチレン、ポリオキシプロピレンなどの任意の二価又は多価の基で連結したものが挙げられる。具体的な架橋剤としては、AEDP、AMAS、APG、ASBA、BASED、BMB、BMDB、DTSSP、EMCA、EMCH、EMCS、HBVS、KMUA、SADP、SAEDなどが挙げられる。架橋剤は、当該物質が有する反応性基(アミノ基、SH基、OH基、アルデヒド基またはケトン基など)の種類によって適宜選択することができる。架橋剤は、へテロ二官能性の架橋剤であって、ルシフェラーゼと当該物質を段階的に連結可能なものが好ましい。
【0045】
ルシフェラーゼと細胞の表面を特異的に認識する物質とのビオチンを介した結合
本発明の好ましい実施形態において、細胞の表面を特異的に認識する物質は、ビオチン−アビジン物質複合体を介してルシフェラーゼに結合している。本実施形態において、ビオチンはルシフェラーゼのアミノ基(N末端またはLys由来のアミノ基)、グアニジノ基(Arg)、チオール基(Cys)のいずれを介してルシフェラーゼに結合させてもよい。好ましくは、アミノ基を介した結合である。
【0046】
ウミホタルルシフェラーゼを用いる場合、ビオチンが結合する好ましいアミノ酸残基は、配列番号1に示されるアミノ酸配列において180番目のリジン及び/又は203番目のリジンである。他のルシフェラーゼにビオチンを結合させる場合は、前記アミノ酸の位置に対応する位置のリジンのアミノ基をビオチン化することが好ましい。
【0047】
ウミホタルルシフェラーゼとビオチン残基は、好ましくはポリアルキレングリコール構造を有するスペーサーを介して結合される。ポリアルキレングリコールとしては、ポリエチレングリコール(PEG)、ポリプロピレングリコール(PPG)、ポリブチレングリコール(PBG)、(PEG)−(PPG)−(PEG)ブロック共重合体、(PPG)−(PEG)−(PPG)ブロック共重合体、(PEG)−(PBG)−(PEG)ブロック共重合体、(PBG)−(PEG)−(PBG)ブロック共重合体等を挙げることができる。好ましいポリアルキレングリコールは、PEG、PPG、(PEG)−(PPG)−(PEG)ブロック共重合体、(PPG)−(PEG)−(PPG)ブロック共重合体であり、より好ましいポリアルキレングリコールは、PEGである。好ましいPEGの構造は、下記式で表される:
−(CH2CH2O)n−
(式中、nは2〜500、好ましくは2〜100、より好ましくは2〜50、さらに好ましくは4〜10の整数を示す。)
上記のポリアルキレングリコールは、エステル結合、アミド結合またはチオエーテル結合を介して、好ましくはアミド結合を介してビオチンおよびウミホタルルシフェラーゼと各々結合する。
【0048】
ビオチン標識試薬としては、たとえば下記の構造のものが使用できる:
X1−Y−(CH2)m1−(OCH2CH2)m2−NH−(ビオチニル)、
(式中、X1はスルホコハク酸イミドオキシカルボニル基、コハク酸イミドオキシカルボニル基、テトラフルオロフェノキシカルボニル基、シアノメチルオキシカルボニル基、p−ニトロフェニルオキシカルボニル基、I、Br、及びClなどのアミノ基と反応してアミド(NHCO)又はアミノアルキル基を形成可能な活性エステル残基、ハロゲン原子あるいはマレイミド基を表す。YはCH2CONH、CH2CH2CONHなどの任意の連結基あるいは単結合を示す。m1は2、3又は4を表し、m2は2〜500、好ましくは2〜100、より好ましくは2〜50、さらに好ましくは4〜10の整数を示す。)
ポリアルキレングリコール基を導入可能なビオチン標識試薬としては、たとえばPierce社製のEZ-Link NHS-PEO4 Biotinylation kitやEZ-Link TFP-PEO Biotinylation kitなどの各種ビオチン標識試薬を使用することもできる。
【0049】
ルシフェラーゼをビオチンで標識するためには、上記のようなビオチン標識試薬とルシフェラーゼとを1〜37℃、好ましくは、室温で反応さて行うことができる。ビオチン標識ウミホタルルシフェラーゼは、好ましくは、一分子のルシフェラーゼあたりビオチン残基が1〜10個、好ましくは2〜5個、より好ましくは2〜3個結合している。ビオチン残基が多く結合しすぎると、ルシフェラーゼが失活しやすくなり、ビオチン1個あたりのルシフェラーゼの活性比率が低下するためである。
【0050】
ウミホタルルシフェラーゼは一分子あたり約30のリジン残基を有している。ウミホタルルシフェラーゼのリジン残基とN−ヒドロキシサクシンイミド(NHS)エステルとの反応を利用して、ビオチンを導入することも可能である。この際、ウミホタルルシフェラーゼの失活を避ける条件で行うことが好ましい。特に、リジン基は親水性残基であるが、化学修飾後のたんぱく質の表面に疎水性の部分が生成される。その疎水性の部分は酵素の3次元構造への影響があるので、親水性のスペーサーを解してビオチンを導入することが有効である。親水性のスペーサーは、−(CH2CH2)n−で表されるアルキレン残基の炭素数が4以下、好ましくは3以下、特に2または3のものが挙げられる。アルキレン残基は、O、NH、CONH、NHCOなどのヘテロ原子を含む任意の基(特に極性の基)で連結され得る。
【0051】
タグを介したビオチン化
上記アミノ基をビオチン化する方法以外に、タグ(ペプチド)を利用する方法が知られている。この方法は、ルシフェラーゼのC末端又はN末端に、タグを付加し、そのタグに含まれるリジンをビオチンリガーゼにより、特異的にビオチン化する。この方法に使用することができるタグは、例えば、genecopoeia社製Avi-tagTM(LERAPGGLNDIFEAQKIEWHE又はGLNDIFEAQKIEWHE)及びInvitrogen社製のBioEase TagTM(肺炎桿菌(Klebsiella pneumoniae)オキサロ酢酸脱炭酸酵素のαサブユニットのC末端配列の一部である72残基(アミノ酸残基524-595)のペプチド)を挙げることができる。
【0052】
糖鎖を介したビオチン化
ルシフェラーゼのビオチン化は、ルシフェラーゼが有する糖鎖を介して行うことも可能である。この方法では、上記のルシフェラーゼと有機蛍光色素との結合の項で説明したように、糖鎖にNaIO4などの過ヨウ素酸塩を反応させて、糖鎖中のジオール基を酸化し、アルデヒド基を形成する。次いで、このアルデヒド基と選択的に反応する基(例えば、ヒドラジド基(CONHNH2))を有するビオチン化試薬とを反応させることにより、ウミホタルルシフェラーゼのLysの側鎖アミノ基とは反応せずに、糖鎖に選択的にビオチンを導入することができる。アルデヒド基はビオチン化試薬のアミノ基と反応させてイミンとし、これをNaBH3CNで還元して、ビオチンを結合することもできる。この方法は、ウミホタルルシフェラーゼの活性を保持しつつビオチン化できるので好ましい。前記過ヨウ素酸塩としては、過ヨウ素酸ナトリウム、過ヨウ素酸カリウム、過ヨウ素酸リチウムなどが挙げられる。
【0053】
本発明において、細胞の表面を特異的に認識する物質は、アビジン、ストレプトアビジン、又はニュートラアビジン等のアビジン物質と複合体を形成し、アビジンとビオチンの親和性を利用したビオチン−アビジン物質複合体を介して、上記いずれかの方法でビオチン化されたルシフェラーゼと結合させることができる。また、上記ルシフェラーゼをビオチン化する方法のいずれかを用いて当該物質をビオチン化し、多価アビジンを介してビオチン化されたルシフェラーゼと結合させることもできる。このように細胞の表面を特異的に認識する物質のアビジン化は、常法に従って行うことができるが、当該物質の特異的な細胞表面の認識に影響を与えない態様でのアビジン化又はビオチン化が好ましい。
【0054】
フィルター
本発明のイメージング方法に使用することができるフィルターは、個体内に存在する活性酸素やBSAとルシフェリンとが反応することによって生じる光等の非特異的な光を透過しない性質を有するフィルターであれば、特に限定されず、公知のフィルター及び今後開発されるフィルターを適宜選択して使用することができる。好ましくは、400nm〜550nmの波長を有する光を透過しないフィルターが使用され、より好ましくは350nm〜550nmの波長を有する光を透過しないフィルターが使用される。さらに好ましくは、400nm〜570nmの波長を有する光を透過しないフィルターが使用される。よりさらに好ましくは、350nm〜570nmの波長を有する光を透過しないフィルターが使用される。最も好ましくは、650nm〜750nmの波長の光のみを選択的に透過するフィルターが使用される。このようなフィルターとして、具体的には570nmロングパスフィルターを使用することができる。
【0055】
本発明のイメージングの対象となる個体は、特に限定されないが、植物及び動物から目的に応じて選択することができる。例えば、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等の実験動物を挙げることができる。
【0056】
イメージング方法
本発明のイメージング方法は、例えば、(1)上記に説明した何れかの方法によって作製した有機蛍光色素−ルシフェラーゼ−細胞の表面を特異的に認識する物質の複合体(即ち、標識化物質)を個体に導入し、(2)個体における標的の細胞の表面に前記複合体を集積させ、(3)ルシフェリンを個体に導入し、ルシフェラーゼと反応させ(4)蛍光色素が発する光を350nm〜550nmの波長の光を透過しないフィルターを介して検出し、(5)解析装置を用いてイメージング化することによって行うことができる。前記標識化物質の個体への導入は、当該技術分野に公知の任意の方法で行うことができる。例えば、陰茎背静脈及び尾静脈から注入することができる。
【0057】
また、ルシフェリンの個体への導入も例えば、陰茎背静脈及び尾静脈から注入して行うことが出来る。標識化物質は、血中濃度が5〜40μg/ml程度となるように個体に導入すればよく、好ましくは10〜20μg/ml程度個体に導入すればよい。ルシフェリンは、0.1〜1mg/ml程度の濃度で個体に導入すればよく、好ましくは0.2〜0.5mg/ml程度導入すればよい。
【0058】
ルシフェリンは、その前駆体を個体に導入し、個体内でルシフェリンを生成させることもできる。
【0059】
光の検出は、当該技術分野において使用される650nm〜750nmの波長の光を検出することができる光検出装置(例えば、CCDカメラや冷却CCDカメラ)を使用して行うことができる。
【0060】
一実施形態において、本発明は、ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体である。有機蛍光色素及びビオチンは、上記に説明した各種の方法により、ルシフェラーゼに結合させ、ルシフェラーゼ誘導体とすることができる。
【実施例】
【0061】
以下、本発明を実施例に基づいて更に詳細に説明するが、本発明は実施例の内容に限定されるものではない。
【0062】
実施例1
ビオチン化ウミホタルルシフェラーゼの作成
pcDNA-CLuc(Nakajima Y, et al., Biosci. Biotechnol. Biochem, Vol. 68, 565-70, 2004)をテンプレートとし、KOD-plus-Mutagenesis kit(東洋紡)を用いて、インバースPCR反応により、ウミホタルルシフェラーゼのC末端にAvi-tag(Avidity社製)を挿入したベクター(配列番号3)を調製した。その後、片倉工業のカイコとバキュロウイルスを用いたタンパク質生産サービスで前記ベクターに挿入したウミホタルルシフェラーゼを発現させた。得られたルシフェラーゼについて、Avidity社により添付されたマニュアルに従って、ビオチンリガーゼを用いて、ルシフェラーゼのビオチン化反応を行った。
【0063】
実施例2
ビオチン化ウミホタルルシフェラーゼの糖鎖への蛍光色素の導入及び発光特性の評価
0.1mgのビオチンルシフェラーゼを0.05mlの0.1M アセテートバッファー(pH5.2)で溶解し、0.1Mのアセテートバッファー(pH5.2)にNaIO4を20mMの濃度で溶解した溶液0.05mlと混合し、4℃で0.5時間ゆっくり攪拌した。反応液をGE Health社PD-10カラムに載せ、100mMのリン酸ナトリウム溶液及び150mMのNaCl溶液で溶出し、活性分画のみ(約2mL)を回収した。ミリポア社のBiomax(登録商標)100kで2mL液を約0.02mlまでに濃縮した。1mgのHilyte fluor 647(NH2NH-インドシアニングリーン誘導体;Anaspec社製)を0.1Mのアセテートバッファー(pH5.2)0.1mlで溶かした。これを、前記の濃縮したルシフェラーゼ液0.02mlと同量で混合し、室温で2時間反応させた。反応液をGE Health社製のPD-10カラムに載せ、100mMのリン酸ナトリウム溶液、及び150mMのNaCl溶液を用いて溶出し、活性分画(約2mL)のみを回収した。回収したウミホタルルシフェラーゼ−有機蛍光色素複合体1μlをヘモグロビン溶液(150mg/ml)溶液に加え、45μMのウミホタルルシフェリンを1μl加え、1秒間積算の発光スペクトルを測定した。その結果、460nmを最大とする短波長側の光はヘモグロビンに吸収されるが、ルシフェラーゼからインドシアニングリーンへのエネルギーの移動によって生まれた約650nm〜750nmの波長を有する近赤外光が観察された(図1)。これにより、有機蛍光色素−ビオチン化ルシフェラーゼ複合体から生体透過性の高い光放出されることが確認できた。
【0064】
実施例3
アビジン化腫瘍細胞認識抗体の調製
腫瘍細胞に特異的に結合するモノクローナル抗体である抗dlk抗体(WO2008/056833に準じて作成)(5mg/ml)の0.1Mリン酸緩衝液(pH7.4)1ml、に6 mgの2−メルカプトエタノールアミンを加え、37℃で1.5時間反応を行った。反応液をGE Healthcare社製のPD-10カラムに載せ、100mMのリン酸ナトリウム溶液及び10 mMのEDTA(pH 7.6)溶液で溶出し、紫外線吸収画分(3.5 ml)を回収した。これにPierce社のEZ-Link(登録商標)Maleimide Activated NeutrAvidinTM Protein(5mg)を添加し、1時間反応させた。その後、反応液をカラムクロマトグラフィー(Superdex 200 HR 10/30)で精製し、アビジンが結合した抗dlk抗体を得た。次に、このアビジン化坑dlk抗体(0.025mg/ml)と実施例1で作成した有機蛍光色素−ビオチン化ルシフェラーゼ複合体(0.025mg/ml)とを混合し、アビジン−ビオチン複合体を介して抗dlk抗体と有機蛍光色素−ルシフェラーゼ複合体とが結合した、インドシアニングリーン−ウミホタルルシフェラーゼ−抗dlk抗体の複合体を得た。
【0065】
実施例4
個体イメージング
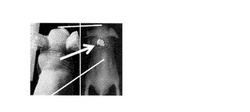
Dlk導入腫瘍細胞(dlk遺伝子を導入したHuh-7細胞)を移植して作製した担癌マウス(BALB/cマウス6週齢)をエーテル麻酔後、実施例3で得たアビジン化抗dlk抗体と蛍光色素で修飾されたビオチン化ルシフェラーゼ0.02 mg(濃度25μg/ml)を陰茎背静脈から導入した。24時間後に再度エーテルで担癌マウスを麻酔した後に、陰茎背静脈よりウミホタルルシフェリン0.4mg(濃度2mg/ml)を注入した。570nmのロングパスフィルターを設置した発光イメージング装置(Photon Imager (Biospace lab社, France)でルシフェリン注入後5−20分の間に30秒間、撮影を行った。結果、腫瘍の部分において発光シグナルが観測された(図2)。この結果は、担癌マウスに導入した本発明の標識化物質である抗体が腫瘍細胞に集積し、ルシフェリン・ルシフェラーゼ反応に発せられたエネルギーによって有機蛍光色素が励起され、570nm以上の組織透過性の高い光を放出したことを示す。よって、本発明の標識化物質を使用することで、非侵襲的に標的の細胞群をイメージングすることができることが明らかとなった。前記ロングパスフィルターを使用しない場合のイメージング結果を比較対照として図3に示す。図3から明らかなように、非特異的な光を排除しない場合、マウスのあらゆる部位からの光を検出してしまうため、目的の腫瘍を的確に特定することは困難である。
【図面の簡単な説明】
【0066】
【図1】図1は、ヘモグロビン溶液中の蛍光色素−ルシフェラーゼ複合体から発せられた光のスペクトルを示す。
【図2】図2は、dlk導入腫瘍細胞を移植した担癌マウスにおける抗dlk抗体−オチン化ウミホタルルシフェラーゼ−蛍光有機色素複合体を用いたイメージング結果を示す。
【図3】図3は、フィルターを使用しない場合のイメージングを示す。
【技術分野】
【0001】
本発明は、ルシフェラーゼを含む発光系及びそれを用いて個体中の標的の細胞及び細胞群をイメージングする方法に関する。より詳細には、本発明は、有機蛍光色素が結合したルシフェラーゼ誘導体を含む発光系、前記発光系で細胞の表面を特異的に認識する物質を標識した標識化物質、及び前記標識化物質を用いて個体における前記物質によって認識される表面を有する細胞及び細胞群をイメージングする方法に関する。
【背景技術】
【0002】
臓器や腫瘍の病態を把握する方法として、現在は存在診断と形態診断が主に行われている。存在診断とは、臓器や腫瘍の画像から病的な部分を発見することであり、質的診断とは発見された病的部分について、疾患の種類や進行度を診断することである。質的診断は、手術療法並びに化学療法の適応、選択、及び方法を決定する上で特に重要である。しかし、現在診断に使用される方法では、病態の進展様式、進展速度、及び治療への反応を正確に把握し、信頼性のある質的診断をすることは困難である。
【0003】
例えば、腫瘍特異的抗原等を利用した診断・治療法の開発が試みられている。確実且つ安全に抗体治療を行うには、十分量の抗体が標的の抗原に到達し、抗原との結合が十分に持続すること、及び抗体が骨髄などの腫瘍以外の組織へ移行や集積しないことが重要である。よって、抗体治療では、体内での抗体の動向をモニターすることが必要である。しかし、安全性及び経済性を考慮して効率的且つ正確に前記モニターをリアルタイムに行う手段は今のところ開発されていない。
【0004】
現在、腫瘍等のイメージングには放射性プローブ、蛍光プローブ、及び発光プローブ等が用いられている。中でも、特別な施設や設備が不要であることから、蛍光プローブ及び発光プローブといった光プローブが注目されている。発光プローブに関して、最近、ナノ量子ドットとウミシイタケルシフェラーゼとを融合した近赤外光のプローブが報告されたが(非特許文献1)、ナノ無機材料の毒性の問題から、その使用は限られている。また、近赤外光を発する蛍光色素プローブによるイメージングも報告されている。しかし、生体内のプローブに外部からの光を到達させるためには、非常に強い光を当てる必要があり、これによって生体に傷害を与えることとなるため安全性の観点から実用性に欠ける。
【0005】
また、400nm〜630nmの波長の光を発する従来の発光プローブを用いた個体光イメージングでは、生体深度1cm以下までしかイメージングすることができず、400nm-650nmの光を発する発光プローブを用いたとしても生体深度2cmまでのイメージングが限度であると考えられていた(非特許文献3)。さらに肝臓などのヘモグロビンの多い臓器は、650nm以下の光を吸収するため従来方法でイメージングすることは不可能である。
【0006】
一方、特許文献1には、ビオチンで標識したウミホタルルシフェラーゼが記載されている。非特許文献4には、ビオチン標識ウミホタルルシフェラーゼを免疫測定法や各種アッセイに使用することができることが記載されている。しかし、ウミホタルルシフェラーゼの最大発光波長は460nmであり、生体組織の透過性が低いため、それを生体内のイメージング用プローブとして用いたとしても十分な光を検出することは困難である。
【0007】
ルシフェラーゼを発光プローブに使用する場合、基質であるルシフェリンは体内に存在する活性酸素やBSAとも反応し、発光することが知られている。これにより、標的の細胞や組織に無関係な場所でも光が放出され、結果として特異的なイメージングが妨げられることも問題である。
【特許文献1】特開2008−148号公報(特願2007-187738の公開)
【非特許文献1】Min-Kyung So et al., Nature Biotechnology, 24, 339-343, 2006
【非特許文献2】Frangioni, J. V., Curr Opin Chem Biol. Vol. 7, 626-634, 2003
【非特許文献3】Rice BW, et al., In vivo imaging of light-emitting probes, J. Biomedical Optics 6, 432-440, 2001
【非特許文献4】Wu C,et al., Analytical Chemistry 79, 1634-1638, 2007
【発明の開示】
【発明が解決しようとする課題】
【0008】
本発明は、個体に及ぼす影響が少なく、且つ個体中の標的の細胞又は細胞群を特異的にイメージングすることが可能なイメージング方法並びに前記方法に利用可能な発光系、発光プローブ及び前記プローブで標識された標的細胞の表面を特異的に認識可能な物質を提供することを目的とする。
【課題を解決するための手段】
【0009】
かかる現状の下、本発明者らは、日夜研究を重ねたところ、ルシフェラーゼと有機蛍光色素を組合せて、ルシフェラーゼから発せられるエネルギーで有機蛍光色素を励起することで、外部から光を照射することなく、個体中で近赤外光を放出させることが可能であることを見出した。本発明者らは、さらに研究を重ね、細胞の表面を特異的に認識する物質と前記ルシフェラーゼと結合させることによって、当該物質によって認識される表面を有する細胞又は細胞群を、前記ルシフェラーゼと有機蛍光色素との複合体で標識し、前記細胞又は細胞群を特異的にイメージングすることが可能であることを見出した。さらに、本発明者らは、鋭意検討を重ねた結果、650nm〜750nmの波長の光を選択的に透過するフィルターを介して個体から発せられる光を検出することにより、ルシフェリンからの非特異的な光(バックグラウンド)を排除することが出来ることを見出した。本発明は、かかる知見に基づき、更なる改良を加えた結果完成したものである。
【0010】
即ち、本発明は、以下の発明を提供するものである。
項1 以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
項2 ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体。
項3 有機蛍光色素がインドシアニングリーン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミンから成る群から選択される少なくとも一種である、項2に記載の誘導体。
項4 ルシフェラーゼがウミホタルルシフェラーゼである、項2又は3に記載の誘導体。
項5 有機蛍光色素が糖鎖を介してルシフェラーゼに結合している、項2〜4のいずれかに記載のルシフェラーゼ誘導体。
項6 項2〜5のいずれかに記載のルシフェラーゼ誘導体が、ビオチン−アビジン物質複合体を介して細胞の表面を特異的に認識する物質と結合した、標識化物質。
項7 有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体が、糖鎖を介して細胞の表面を特異的に認識する物質に結合している、標識化物質。
項8 細胞の表面を特異的に認識する物質が、抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドからなる群から選択される少なくとも1種である、項6又は7に記載の標識化物質。
項9 以下:
(1)請求項6〜8のいずれかに記載の標識化物質を個体に導入する工程;
(2)ルシフェリンを個体に導入する工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【発明の効果】
【0011】
本発明によれば、細胞の表面を特異的に認識する物質によって認識される標的の細胞又は細胞群を、外部から光を照射することなく、より安全且つ正確にイメージングすることが出来る。外部からの光の照射が不要であるため、外部からの励起光が届き難い個体の深部にある細胞や組織をイメージングすることが可能である。例えば、従来は生体表面から2cm以上深い場所を正確にイメージングすることは困難であったが、本発明によれば、2cm以上深い深部をも非侵襲的にイメージングすることが可能である。よって、本発明を利用することにより、腫瘍等、各種疾患の患部を発見することや病態の変化をリアルタイムに非侵襲的にイメージングし、腫瘍の診断や治療に役立てることが出来る。また、放射性プローブ等と比較して、イメージングに特殊な設備を必要としないため、長期間に亘るイメージングをより簡便に行うことも可能である。さらに、細胞の表面を特異的に認識する物質として抗体を用いることにより、抗体医薬の動態をリアルタイムで追跡することも可能であり、抗体医薬のスクリーニングに応用することが出来る。
【発明を実施するための最良の形態】
【0012】
以下、本発明のイメージング方法、並びに前記方法に使用される、ルシフェラーゼ誘導体及び前期ルシフェラーゼ誘導体で標識された標識化物質について詳細に説明する。
【0013】
ルシフェラーゼ
本発明において使用されるルシフェラーゼは、ルシフェリンと反応して発光する性質を有する酵素である。本発明のイメージング方法に使用可能なルシフェラーゼとしては、例えば、ウミホタルルシフェラーゼ、ホタルルシフェラーゼ、鉄道虫ルシフェラーゼ、ヒカリコメツキルシフェラーゼ、イリオモテボタルルシフェラーゼ、及びウミシイタケルシフェラーゼ等を挙げることが出来る。
【0014】
本発明において、ルシフェラーゼは個体に導入されるため、ルシフェラーゼは個体内で安定であることが好ましい。またルシフェラーゼは、糖鎖を有していることが好ましい。これは、本発明の好ましい一実施形態において、ルシフェラーゼは、細胞の表面を特異的に認識する物質及び/又は有機蛍光色素をと結合しており、これらの結合を糖鎖を介して行うことが出来るためである。糖鎖を有するルシフェラーゼは、糖鎖を本来有するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ)を用いてもよく、本来糖鎖を有さないルシフェラーゼをコードする遺伝子を酵母、昆虫細胞、及び哺乳類細胞等の真核細胞で発現させて得られる糖鎖が付加したルシフェラーゼを使用することも出来る。
【0015】
さらに本発明に使用されるルシフェラーゼは、有機蛍光色素を励起して650nm〜750nmの波長の光を放出させることが可能な光を放出することが好ましい。有機蛍光色素を励起して650nm〜750nmの波長の光を放出させることが可能な光は、使用する有機蛍光色素によって異なる。例えば、有機蛍光色素としてインドシアニングリーンを用いる場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてローダミンを使用する場合は、350nm〜500nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてクマリンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてキサンテンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。有機蛍光色素としてヘマトポルフィリンを使用する場合は、350nm〜650nmの波長の光を発するルシフェラーゼ(例えば、ウミホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、ホタルルシフェラーゼ)を用いることが好ましい。
【0016】
個体内での安定性及び糖鎖を有するという観点から好ましいルシフェラーゼは、ウミホタルルシフェラーゼである。ウミホタルルシフェラーゼは、最大発光波長460nmの光を放出し、体内温度37℃での半減期が約60時間である安定性の高い酵素である。
【0017】
本発明において使用できるウミホタルルシフェラーゼ、ホタルルシフェラーゼ、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ等は、商業的に入手可能である。また、それらの遺伝子配列及びアミノ酸配列も公知であるため、ルシフェラーゼは公知の遺伝子工学的手法により、常法に従って得ることが出来る。例えば、野生型ウミホタルルシフェラーゼのアミノ酸配列は、NCBIにアクセッションNo.AAB86460、AAA30332、及びBAD08210で登録させている。本明細書に添付される配列表に、配列番号1としてウミホタルルシフェラーゼのアミノ酸配列を示す。また、後述するルシフェラーゼのビオチン化を容易に行うため、アビチンタグ配列を挿入したルシフェラーゼ変異体を使用することも好ましい。アビジンタグを有するウミホタルルシフェラーゼのアミノ酸配列及び塩基配列を各々配列番号2及び3に示す。
【0018】
本発明に使用されるルシフェラーゼは、ルシフェリンと反応して光エネルギーを放出する性質を有する限り、1個又は十数個(例えば、15個、14個、13個、12個、11個、10個、9個、8個、7個、6個、5個、4個、3個、2個)のアミノ酸が置換、付加、欠失、及び/又は挿入された変異型ルシフェラーゼであってもよい。変異型ルシフェラーゼは、上記野生型ルシフェラーゼのアミノ酸配列との間で70%以上のホモロジー、好ましくは80%以上、より好ましくは90%以上、さらに好ましくは95%以上、特に好ましくは98%以上、最も好ましくは99%以上のホモロジーを有する。
【0019】
ルシフェラーゼ改変体の製造は、常法に従って作製することができる。例えば、野生型のルシフェラーゼ遺伝子を、サイトスペシフィック・ミュータゲネシス〔Methods in Enzymology, 154, p350, 367-382 (1987);同100, p468 (1983) ;Nucleic Acids Research, 12,p9441 (1984);続生化学実験講座1「遺伝子研究法II」、日本生化学会編, p105 (1986) 〕で改変することができる。また、リン酸トリエステル法やリン酸アミダイト法などの化学合成手段〔J. Am. Chem. Soc., 89, p4801 (1967);同91, p3350 (1969);Science, 150,p178 (1968) ;Tetrahedron Lett., 22, p1859 (1981);同24, p245 (1983)〕で野生型ルシフェラーゼの遺伝子を改変させることもできる。変異型ルシフェラーゼの作成は、前記のような公知の技術を適宜組み合せて行うことができる。
【0020】
アミノ酸配列の同一性ないしホモロジー(%)は、当該分野で慣用のプログラム(例えば、BLAST、FASTA等)を用いて決定することができる。同一性(%)は、当該分野で公知の任意のアルゴリズム、例えば、Needlemanら(1970)(J.Mol.Biol.48:444−453)、Myers及びMiller(CABIOS,1988,4:11−17)のアルゴリズム等を使用して決定することもできる。Needlemanらのアルゴリズムは、GCGソフトウェアパッケージ(www.gcg.comで入手可能)のGAPプログラムに組み込まれており、同一性(%)は、例えば、BLOSUM 62 matrix又はPAM250 matrix、並びにgap weight:16、14、12、10、8、6若しくは4、及びlength weight:1、2、3、4、5若しくは6のいずれかを使用して決定することができる。
【0021】
ルシフェリン
本発明においてルシフェリンとは、ルシフェラーゼの発光性基質となる物質である。ルシフェリンは、ルシフェラーゼと反応して光エネルギーを発するものであれば特に制限なく使用することができる。具体的には、ウミホタルルシフェリン、ヒカリコメツキルシフェリン、ホタルルシフェリン、ウミシイタケルシフェリン、鉄道虫ルシフェリン、イリオモテボタルルシフェリン等を挙げることができる。また、天然由来のルシフェリンだけでなく、合成された代替ルシフェリン又はルシフェリンの前駆体を使用することもできる。
【0022】
ウミホタルルシフェラーゼを使用する場合は、ウミホタルルシフェリンが好ましい。ヒカリコメツキルシフェラーゼを使用する場合は、ヒカリコメツキルシフェリンが好ましい。ホタルルシフェリンを使用する場合は、ホタルルシフェリンが好ましい。鉄道虫ルシフェラーゼを使用する場合は、鉄道虫ルシフェリンが好ましい。イリオモテボタルルシフェラーゼを使用する場合は、イリオモテボタルルシフェリンが好ましい。
【0023】
ルシフェラーゼを含む近赤外発光系
本発明に関して、ルシフェラーゼを含む近赤外発光系とは、上記のルシフェラーゼとルシフェリンとの反応で生じるエネルギーを、有機蛍光色素が吸収し、励起されることで650nm〜750nmの波長の近赤外光を放出する系である。
【0024】
有機蛍光色素
本発明において使用される有機蛍光色素とは、一定の波長のエネルギーを吸収し、近赤外光を放出する有機物質である。これは、放出した光が生体に存在するヘモグロビン及び水によって吸収されることを避けるためである。好ましい有機蛍光色素は、650nm〜800nmの範囲に含まれる波長の光を放出するものであり、より好ましくは、650nm〜750nmに発光波長を有する有機蛍光色素である。
【0025】
有機蛍光色素は、上記のルシフェラーゼが有する糖鎖との結合を可能にするため、アミノ基又はヒドラジノ基(NH2NH−)を有することが好ましい。好ましい有機蛍光色素としては、インドシアニン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミン等の化合物が挙げられる。前記化合物には、650nm〜750nmの波長の光を発する性質を有している限り、それら誘導体及び類似体が含まれる。より好ましくは、インドシアニングリーン、ヘマトポルフィリン、及びこれらの誘導体であり、最も好ましくはインドシアニングリーン及びその誘導体のようなシアニン系色素である。
【0026】
ルシフェラーゼがドナーとして発した光がアクセプターである有機蛍光色素に到達したときにエネルギー移動が生じて有機蛍光色素からの発光が起こる。このエネルギー移動はドナーとアクセプターの距離が1〜10nmの範囲で効率よく起こる。よって、有機蛍光色素とルシフェラーゼは、互いに1〜10nm以内に位置していることが好ましい。
【0027】
細胞の表面を特異的に認識する物質
本発明において使用される、細胞の表面を特異的に認識する物質(以下、当該物質とも称する。)とは、特定の細胞の表面に提示されているタンパク質、脂質、糖鎖、及び/又は核酸等を特異的に認識する物質である。具体的には、特定の細胞の表面に提示されるタンパク質、脂質、糖鎖及び/又は核酸を特異的に認識する抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドが挙げられる。
【0028】
本発明によれば、従来困難であった深度2cm以上に存在する臓器等をイメージングすることが可能であり、また光を吸収するヘモグロビンなどのヘムタンパク質の多い臓器(例えば、肝臓、心臓、腎臓、脾臓等)をイメージングすることも可能である。従って、一実施形態において、当該物質によって認識される細胞又は細胞群は、生体の表層から2cm以上深い場所(例えば、胃、腸、肝臓、心臓、腎臓、脾臓等)に存在する細胞又は細胞群である。
【0029】
本発明の一実施形態において、好ましい当該物質は、腫瘍細胞の表面に特異的に提示される腫瘍特異抗原及び他の正常細胞にも微量で発現されるが腫瘍細胞で多量の発現される腫瘍関連抗原を特異的に認識する抗体である。抗体は、ポリクローナル抗体であってもモノクローナル抗体であってもよい。抗体の由来は、特に限定されず、ヒト、マウス、ラット、ヤギ、イヌ等の各種動物由来の抗体を利用することができ、キメラ抗体であってもよい。抗体は、特異的な認識・結合能力を有する限り、単鎖抗体及び二本鎖抗体のいずれでもよく、そのフラグメントであってもよい。抗体の結合性フラグメントとしては、例えばF(ab’)2、Fab’、Fab、Fv(variable fragment of antibody)、scFv、dsFv(disulfide stabilised Fv)、sdAb(single domain antibody)を例示することができる。
【0030】
細胞の表面を特異的に認識する抗体としては、例えば、肝臓癌に伴う腫瘍細胞の表面を特異的に認識する抗体として抗AFP抗体、卵巣癌及び子宮癌に伴う腫瘍細胞の表面を特異的に認識する抗CA125抗体及び抗CA602抗体、乳癌に伴う腫瘍細胞を特異的に認識する抗CA15−3抗体、膵臓癌に伴う腫瘍細胞の表面を特異的に認識する抗CA19−9抗体、前立腺癌に伴う腫瘍細胞の表面を特異的に認識する抗PSA抗体、肺癌に伴う腫瘍細胞の表面を特異的に認識する抗CYFRA抗体及び抗NSE抗体、扁平上皮癌に伴う腫瘍細胞の表面を特異的に認識する抗SCC抗体、肝臓癌に伴う腫瘍細胞の表面を特異的に認識する抗DLK抗体及び抗PIVKA−II抗体、癌の種類とは非特異的に腫瘍細胞を認識する抗TPA抗体、抗SLX抗体、抗hCG抗体、抗HEA125抗体、抗CEA抗体などを使用することができる。
【0031】
このように本発明の一実施形態において、細胞の表面を認識する物質によって認識される細胞は、腫瘍細胞である。例えば、肝臓癌、卵巣癌、食道癌、肺癌、胆道癌、前立腺癌、乳癌、胃癌、膵臓癌、大腸癌、子宮癌などに伴う腫瘍細胞を挙げることができる。
【0032】
細胞の表面を特異的に認識するホルモンとしては、タンパク質、ペプチド、ステロイド、アミンからなる各種のホルモンが挙げられる。タンパク質ホルモンとしては成長ホルモンGH、甲状腺刺激ホルモンTSH、黄体ホルモンLHなどが挙げられる。ペプチドホルモンとしては、オキシトシン、バソプレシン、セレクチン、ガストリン、コレシストキニン、インスリン、グルカゴン、レプチン及びカルシトニン等を挙げることができる。ステロイドホルモンとしては、アンドロゲン、エストロゲン、グルココルチコイド及びミネラルチコイド等を挙げることができる。アミンホルモンとしては、アドレナリン及びノルアドレナリンを挙げることができる。
【0033】
本発明の一実施形態において、細胞表層で作用するタンパク質ホルモンやペプチドホルモンを当該物質として使用することが好ましい。例えば、インスリンは脂肪、肝臓、筋肉などの標的細胞で糖代謝を制御するポリペプチドホルモンであるが、肥満患者及びII型糖尿病と肥満とを伴う患者ではインスリン受容体に異常がみられる。そこで、インスリンホルモンが認識する受容体を提示する細胞をイメージングすることにより糖尿病に関連した疾患の評価が可能になる。このように、全身臓器の細胞をターゲットとする各種ホルモンが結合する細胞を標的としてイメージングすることにより各種ホルモン関連の疾患を評価・検出することができる。
【0034】
細胞の表面を特異的に認識する糖鎖とは、例えば、カドヘリン糖タンパク質の糖鎖など、糖タンパク質由来の細胞接着因子の糖鎖が挙げられる。
【0035】
細胞の表面に提示される受容体及びイオンチャンネルのリガンドとしては、例えば、アセチルコリン、セロトニン、グルタミン酸、ATP等が挙げられる。
【0036】
ルシフェラーゼと有機蛍光色素との結合
本発明において、有機蛍光色素はルシフェラーゼからの光エネルギーを吸収して650nm〜750nmの波長の光を放出する。よって、有機蛍光色素はルシフェラーゼの近傍に位置していることが好ましく、より好ましくはルシフェラーゼと結合している。ルシフェラーゼと有機蛍光色素とは、当該技術分野において公知の方法を用いて結合させることができる。これらを結合させることによって本発明のルシフェラーゼ誘導体を得ることができる。当該結合は、シフェラーゼの酵素活性及び安定性、並びに有機蛍光色素の発光特性に影響を与えないことが好ましい。また、当該結合は、ルシフェラーゼから有機蛍光色素への光エネルギー移動を妨げないことが好ましい。これらの点を考慮して好ましい結合は、有機蛍光色素とルシフェラーゼとをルシフェラーゼ糖鎖(好ましくは、ルシフェラーゼ由来の糖鎖)を介して結合することである。
【0037】
糖鎖を有するルシフェラーゼと有機蛍光色素との糖鎖を介した結合は、例えば、次のようにして行うことが出来る。ルシフェラーゼの糖鎖をNaIO4などの過ヨウ素酸塩で処理し、糖鎖のビシナルジオールを開裂してアルデヒドとする。これと蛍光色素が有するアミノ基ないしヒドラジノ基(NH2NH−)とを反応させることによって、有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体を得ることが出来る。
【0038】
以下のスキームを参照して、ウミホタルルシフェラーゼが有する糖鎖に有機蛍光色素を導入する方法を例にさらに詳細に説明する。
【0039】
【化1】

【0040】
ルシフェラーゼを酢酸緩衝液などの適当な緩衝液に溶解し、1当量又は過剰量のNaIO4の溶液と混合する。4℃程度の低温から室温で10分から3時間程度反応させ、必要に応じてカラムで精製し、アルデヒド基を有するルシフェラーゼを得る。このルシフェラーゼを、ヒドラジノ基を有する有機蛍光色素(当量又は過剰量または化学量論量未満の量)と反応させて、有機蛍光色素が連結されたルシフェラーゼ誘導体を得ることができる。有機蛍光色素のアミノ基と連結する場合にはNaBH3CNなどの還元剤を必要に応じて使用することができる。
【0041】
上記の糖鎖を介した有機蛍光色素とルシフェラーゼとの結合方法は、ルシフェラーゼと細胞の表面を特異的に認識する物質との複合体に有機蛍光色素をさらに結合させる場合にも適用できる。
【0042】
細胞の表面を特異的に認識する物質とルシフェラーゼとの結合
上記細胞の表面を特異的に認識する物質とルシフェラーゼとは、当該技術分野に公知の任意の方法によって直接的に又は各種のリンカーを介して結合させることができる。ルシフェラーゼの酵素活性及び前記物質の特異的な認識(結合)に影響を及ぼさないように結合することが好ましい。
【0043】
本発明の一実施形態において、細胞の表面を特異的に認識する物質とルシフェラーゼとは、有機蛍光色素とルシフェラーゼとの結合と同様に、ルシフェラーゼが有する糖鎖を介して結合することができる。ここで、当該物質とルシフェラーゼとの結合に使用される糖鎖は、上記有機蛍光色素とルシフェラーゼとの結合に使用される糖鎖と同一の糖鎖であってもよく、また別の糖鎖であってもよい。糖鎖を介して当該物質のルシフェラーゼへの結合は、例えば、次のようにして行うことができる。まず、1つのルシフェラーゼが2個以上のアルデヒド基を有するようにNaIO4溶液と反応させる。次いで、アルデヒド残基がルシフェラーゼあたり1個以上残存するようにヒドラジノ基又はアミノ基を有する有機蛍光色素を反応させ、有機蛍光色素が糖鎖を介して結合したルシフェラーゼを得る。さらに、アミノ基を有する当該物質をNaBH3CNなどの還元剤の存在下で反応させ、当該物質が残存していた糖鎖を介してルシフェラーゼと連結し、有機蛍光色素−ルシフェラーゼ−当該物質の複合体である標識化物質を得ることができる。または、有機蛍光色素が連結されたルシフェラーゼ誘導体を再度NaIO4の溶液と反応させてアルデヒド基を生成し、次いでアミノ基を有する当該物質をNaBH3CNなどの還元剤の存在下で反応させて有機蛍光色素−ルシフェラーゼ−当該物質の複合体を得ることもできる。
【0044】
本発明の一実施形態において、ルシフェラーゼと細胞の表面を特異的に認識する物質とは、ルシフェラーゼのカルボキシル基をジシクロヘキシルカルボジイミドのような縮合剤で活性化し、当該物質のアミノ基とカップリングさせることによって結合することもできる。また、任意の二価または多価の架橋剤を用いて結合させることもできる。架橋剤は、マレイミド基、スクシンイミド基、活性エステル基、ヒドラジン基などの連結可能な反応性基を少なくとも2個有し、これらの基をアルキレン、アリーレン、アルケニレン、ポリオキシエチレン、ポリオキシプロピレンなどの任意の二価又は多価の基で連結したものが挙げられる。具体的な架橋剤としては、AEDP、AMAS、APG、ASBA、BASED、BMB、BMDB、DTSSP、EMCA、EMCH、EMCS、HBVS、KMUA、SADP、SAEDなどが挙げられる。架橋剤は、当該物質が有する反応性基(アミノ基、SH基、OH基、アルデヒド基またはケトン基など)の種類によって適宜選択することができる。架橋剤は、へテロ二官能性の架橋剤であって、ルシフェラーゼと当該物質を段階的に連結可能なものが好ましい。
【0045】
ルシフェラーゼと細胞の表面を特異的に認識する物質とのビオチンを介した結合
本発明の好ましい実施形態において、細胞の表面を特異的に認識する物質は、ビオチン−アビジン物質複合体を介してルシフェラーゼに結合している。本実施形態において、ビオチンはルシフェラーゼのアミノ基(N末端またはLys由来のアミノ基)、グアニジノ基(Arg)、チオール基(Cys)のいずれを介してルシフェラーゼに結合させてもよい。好ましくは、アミノ基を介した結合である。
【0046】
ウミホタルルシフェラーゼを用いる場合、ビオチンが結合する好ましいアミノ酸残基は、配列番号1に示されるアミノ酸配列において180番目のリジン及び/又は203番目のリジンである。他のルシフェラーゼにビオチンを結合させる場合は、前記アミノ酸の位置に対応する位置のリジンのアミノ基をビオチン化することが好ましい。
【0047】
ウミホタルルシフェラーゼとビオチン残基は、好ましくはポリアルキレングリコール構造を有するスペーサーを介して結合される。ポリアルキレングリコールとしては、ポリエチレングリコール(PEG)、ポリプロピレングリコール(PPG)、ポリブチレングリコール(PBG)、(PEG)−(PPG)−(PEG)ブロック共重合体、(PPG)−(PEG)−(PPG)ブロック共重合体、(PEG)−(PBG)−(PEG)ブロック共重合体、(PBG)−(PEG)−(PBG)ブロック共重合体等を挙げることができる。好ましいポリアルキレングリコールは、PEG、PPG、(PEG)−(PPG)−(PEG)ブロック共重合体、(PPG)−(PEG)−(PPG)ブロック共重合体であり、より好ましいポリアルキレングリコールは、PEGである。好ましいPEGの構造は、下記式で表される:
−(CH2CH2O)n−
(式中、nは2〜500、好ましくは2〜100、より好ましくは2〜50、さらに好ましくは4〜10の整数を示す。)
上記のポリアルキレングリコールは、エステル結合、アミド結合またはチオエーテル結合を介して、好ましくはアミド結合を介してビオチンおよびウミホタルルシフェラーゼと各々結合する。
【0048】
ビオチン標識試薬としては、たとえば下記の構造のものが使用できる:
X1−Y−(CH2)m1−(OCH2CH2)m2−NH−(ビオチニル)、
(式中、X1はスルホコハク酸イミドオキシカルボニル基、コハク酸イミドオキシカルボニル基、テトラフルオロフェノキシカルボニル基、シアノメチルオキシカルボニル基、p−ニトロフェニルオキシカルボニル基、I、Br、及びClなどのアミノ基と反応してアミド(NHCO)又はアミノアルキル基を形成可能な活性エステル残基、ハロゲン原子あるいはマレイミド基を表す。YはCH2CONH、CH2CH2CONHなどの任意の連結基あるいは単結合を示す。m1は2、3又は4を表し、m2は2〜500、好ましくは2〜100、より好ましくは2〜50、さらに好ましくは4〜10の整数を示す。)
ポリアルキレングリコール基を導入可能なビオチン標識試薬としては、たとえばPierce社製のEZ-Link NHS-PEO4 Biotinylation kitやEZ-Link TFP-PEO Biotinylation kitなどの各種ビオチン標識試薬を使用することもできる。
【0049】
ルシフェラーゼをビオチンで標識するためには、上記のようなビオチン標識試薬とルシフェラーゼとを1〜37℃、好ましくは、室温で反応さて行うことができる。ビオチン標識ウミホタルルシフェラーゼは、好ましくは、一分子のルシフェラーゼあたりビオチン残基が1〜10個、好ましくは2〜5個、より好ましくは2〜3個結合している。ビオチン残基が多く結合しすぎると、ルシフェラーゼが失活しやすくなり、ビオチン1個あたりのルシフェラーゼの活性比率が低下するためである。
【0050】
ウミホタルルシフェラーゼは一分子あたり約30のリジン残基を有している。ウミホタルルシフェラーゼのリジン残基とN−ヒドロキシサクシンイミド(NHS)エステルとの反応を利用して、ビオチンを導入することも可能である。この際、ウミホタルルシフェラーゼの失活を避ける条件で行うことが好ましい。特に、リジン基は親水性残基であるが、化学修飾後のたんぱく質の表面に疎水性の部分が生成される。その疎水性の部分は酵素の3次元構造への影響があるので、親水性のスペーサーを解してビオチンを導入することが有効である。親水性のスペーサーは、−(CH2CH2)n−で表されるアルキレン残基の炭素数が4以下、好ましくは3以下、特に2または3のものが挙げられる。アルキレン残基は、O、NH、CONH、NHCOなどのヘテロ原子を含む任意の基(特に極性の基)で連結され得る。
【0051】
タグを介したビオチン化
上記アミノ基をビオチン化する方法以外に、タグ(ペプチド)を利用する方法が知られている。この方法は、ルシフェラーゼのC末端又はN末端に、タグを付加し、そのタグに含まれるリジンをビオチンリガーゼにより、特異的にビオチン化する。この方法に使用することができるタグは、例えば、genecopoeia社製Avi-tagTM(LERAPGGLNDIFEAQKIEWHE又はGLNDIFEAQKIEWHE)及びInvitrogen社製のBioEase TagTM(肺炎桿菌(Klebsiella pneumoniae)オキサロ酢酸脱炭酸酵素のαサブユニットのC末端配列の一部である72残基(アミノ酸残基524-595)のペプチド)を挙げることができる。
【0052】
糖鎖を介したビオチン化
ルシフェラーゼのビオチン化は、ルシフェラーゼが有する糖鎖を介して行うことも可能である。この方法では、上記のルシフェラーゼと有機蛍光色素との結合の項で説明したように、糖鎖にNaIO4などの過ヨウ素酸塩を反応させて、糖鎖中のジオール基を酸化し、アルデヒド基を形成する。次いで、このアルデヒド基と選択的に反応する基(例えば、ヒドラジド基(CONHNH2))を有するビオチン化試薬とを反応させることにより、ウミホタルルシフェラーゼのLysの側鎖アミノ基とは反応せずに、糖鎖に選択的にビオチンを導入することができる。アルデヒド基はビオチン化試薬のアミノ基と反応させてイミンとし、これをNaBH3CNで還元して、ビオチンを結合することもできる。この方法は、ウミホタルルシフェラーゼの活性を保持しつつビオチン化できるので好ましい。前記過ヨウ素酸塩としては、過ヨウ素酸ナトリウム、過ヨウ素酸カリウム、過ヨウ素酸リチウムなどが挙げられる。
【0053】
本発明において、細胞の表面を特異的に認識する物質は、アビジン、ストレプトアビジン、又はニュートラアビジン等のアビジン物質と複合体を形成し、アビジンとビオチンの親和性を利用したビオチン−アビジン物質複合体を介して、上記いずれかの方法でビオチン化されたルシフェラーゼと結合させることができる。また、上記ルシフェラーゼをビオチン化する方法のいずれかを用いて当該物質をビオチン化し、多価アビジンを介してビオチン化されたルシフェラーゼと結合させることもできる。このように細胞の表面を特異的に認識する物質のアビジン化は、常法に従って行うことができるが、当該物質の特異的な細胞表面の認識に影響を与えない態様でのアビジン化又はビオチン化が好ましい。
【0054】
フィルター
本発明のイメージング方法に使用することができるフィルターは、個体内に存在する活性酸素やBSAとルシフェリンとが反応することによって生じる光等の非特異的な光を透過しない性質を有するフィルターであれば、特に限定されず、公知のフィルター及び今後開発されるフィルターを適宜選択して使用することができる。好ましくは、400nm〜550nmの波長を有する光を透過しないフィルターが使用され、より好ましくは350nm〜550nmの波長を有する光を透過しないフィルターが使用される。さらに好ましくは、400nm〜570nmの波長を有する光を透過しないフィルターが使用される。よりさらに好ましくは、350nm〜570nmの波長を有する光を透過しないフィルターが使用される。最も好ましくは、650nm〜750nmの波長の光のみを選択的に透過するフィルターが使用される。このようなフィルターとして、具体的には570nmロングパスフィルターを使用することができる。
【0055】
本発明のイメージングの対象となる個体は、特に限定されないが、植物及び動物から目的に応じて選択することができる。例えば、ウシ、ウマ、ヒツジ、サル、ブタ、マウス、ラット、ハムスター、モルモット、ウサギ、イヌ等の実験動物を挙げることができる。
【0056】
イメージング方法
本発明のイメージング方法は、例えば、(1)上記に説明した何れかの方法によって作製した有機蛍光色素−ルシフェラーゼ−細胞の表面を特異的に認識する物質の複合体(即ち、標識化物質)を個体に導入し、(2)個体における標的の細胞の表面に前記複合体を集積させ、(3)ルシフェリンを個体に導入し、ルシフェラーゼと反応させ(4)蛍光色素が発する光を350nm〜550nmの波長の光を透過しないフィルターを介して検出し、(5)解析装置を用いてイメージング化することによって行うことができる。前記標識化物質の個体への導入は、当該技術分野に公知の任意の方法で行うことができる。例えば、陰茎背静脈及び尾静脈から注入することができる。
【0057】
また、ルシフェリンの個体への導入も例えば、陰茎背静脈及び尾静脈から注入して行うことが出来る。標識化物質は、血中濃度が5〜40μg/ml程度となるように個体に導入すればよく、好ましくは10〜20μg/ml程度個体に導入すればよい。ルシフェリンは、0.1〜1mg/ml程度の濃度で個体に導入すればよく、好ましくは0.2〜0.5mg/ml程度導入すればよい。
【0058】
ルシフェリンは、その前駆体を個体に導入し、個体内でルシフェリンを生成させることもできる。
【0059】
光の検出は、当該技術分野において使用される650nm〜750nmの波長の光を検出することができる光検出装置(例えば、CCDカメラや冷却CCDカメラ)を使用して行うことができる。
【0060】
一実施形態において、本発明は、ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体である。有機蛍光色素及びビオチンは、上記に説明した各種の方法により、ルシフェラーゼに結合させ、ルシフェラーゼ誘導体とすることができる。
【実施例】
【0061】
以下、本発明を実施例に基づいて更に詳細に説明するが、本発明は実施例の内容に限定されるものではない。
【0062】
実施例1
ビオチン化ウミホタルルシフェラーゼの作成
pcDNA-CLuc(Nakajima Y, et al., Biosci. Biotechnol. Biochem, Vol. 68, 565-70, 2004)をテンプレートとし、KOD-plus-Mutagenesis kit(東洋紡)を用いて、インバースPCR反応により、ウミホタルルシフェラーゼのC末端にAvi-tag(Avidity社製)を挿入したベクター(配列番号3)を調製した。その後、片倉工業のカイコとバキュロウイルスを用いたタンパク質生産サービスで前記ベクターに挿入したウミホタルルシフェラーゼを発現させた。得られたルシフェラーゼについて、Avidity社により添付されたマニュアルに従って、ビオチンリガーゼを用いて、ルシフェラーゼのビオチン化反応を行った。
【0063】
実施例2
ビオチン化ウミホタルルシフェラーゼの糖鎖への蛍光色素の導入及び発光特性の評価
0.1mgのビオチンルシフェラーゼを0.05mlの0.1M アセテートバッファー(pH5.2)で溶解し、0.1Mのアセテートバッファー(pH5.2)にNaIO4を20mMの濃度で溶解した溶液0.05mlと混合し、4℃で0.5時間ゆっくり攪拌した。反応液をGE Health社PD-10カラムに載せ、100mMのリン酸ナトリウム溶液及び150mMのNaCl溶液で溶出し、活性分画のみ(約2mL)を回収した。ミリポア社のBiomax(登録商標)100kで2mL液を約0.02mlまでに濃縮した。1mgのHilyte fluor 647(NH2NH-インドシアニングリーン誘導体;Anaspec社製)を0.1Mのアセテートバッファー(pH5.2)0.1mlで溶かした。これを、前記の濃縮したルシフェラーゼ液0.02mlと同量で混合し、室温で2時間反応させた。反応液をGE Health社製のPD-10カラムに載せ、100mMのリン酸ナトリウム溶液、及び150mMのNaCl溶液を用いて溶出し、活性分画(約2mL)のみを回収した。回収したウミホタルルシフェラーゼ−有機蛍光色素複合体1μlをヘモグロビン溶液(150mg/ml)溶液に加え、45μMのウミホタルルシフェリンを1μl加え、1秒間積算の発光スペクトルを測定した。その結果、460nmを最大とする短波長側の光はヘモグロビンに吸収されるが、ルシフェラーゼからインドシアニングリーンへのエネルギーの移動によって生まれた約650nm〜750nmの波長を有する近赤外光が観察された(図1)。これにより、有機蛍光色素−ビオチン化ルシフェラーゼ複合体から生体透過性の高い光放出されることが確認できた。
【0064】
実施例3
アビジン化腫瘍細胞認識抗体の調製
腫瘍細胞に特異的に結合するモノクローナル抗体である抗dlk抗体(WO2008/056833に準じて作成)(5mg/ml)の0.1Mリン酸緩衝液(pH7.4)1ml、に6 mgの2−メルカプトエタノールアミンを加え、37℃で1.5時間反応を行った。反応液をGE Healthcare社製のPD-10カラムに載せ、100mMのリン酸ナトリウム溶液及び10 mMのEDTA(pH 7.6)溶液で溶出し、紫外線吸収画分(3.5 ml)を回収した。これにPierce社のEZ-Link(登録商標)Maleimide Activated NeutrAvidinTM Protein(5mg)を添加し、1時間反応させた。その後、反応液をカラムクロマトグラフィー(Superdex 200 HR 10/30)で精製し、アビジンが結合した抗dlk抗体を得た。次に、このアビジン化坑dlk抗体(0.025mg/ml)と実施例1で作成した有機蛍光色素−ビオチン化ルシフェラーゼ複合体(0.025mg/ml)とを混合し、アビジン−ビオチン複合体を介して抗dlk抗体と有機蛍光色素−ルシフェラーゼ複合体とが結合した、インドシアニングリーン−ウミホタルルシフェラーゼ−抗dlk抗体の複合体を得た。
【0065】
実施例4
個体イメージング
Dlk導入腫瘍細胞(dlk遺伝子を導入したHuh-7細胞)を移植して作製した担癌マウス(BALB/cマウス6週齢)をエーテル麻酔後、実施例3で得たアビジン化抗dlk抗体と蛍光色素で修飾されたビオチン化ルシフェラーゼ0.02 mg(濃度25μg/ml)を陰茎背静脈から導入した。24時間後に再度エーテルで担癌マウスを麻酔した後に、陰茎背静脈よりウミホタルルシフェリン0.4mg(濃度2mg/ml)を注入した。570nmのロングパスフィルターを設置した発光イメージング装置(Photon Imager (Biospace lab社, France)でルシフェリン注入後5−20分の間に30秒間、撮影を行った。結果、腫瘍の部分において発光シグナルが観測された(図2)。この結果は、担癌マウスに導入した本発明の標識化物質である抗体が腫瘍細胞に集積し、ルシフェリン・ルシフェラーゼ反応に発せられたエネルギーによって有機蛍光色素が励起され、570nm以上の組織透過性の高い光を放出したことを示す。よって、本発明の標識化物質を使用することで、非侵襲的に標的の細胞群をイメージングすることができることが明らかとなった。前記ロングパスフィルターを使用しない場合のイメージング結果を比較対照として図3に示す。図3から明らかなように、非特異的な光を排除しない場合、マウスのあらゆる部位からの光を検出してしまうため、目的の腫瘍を的確に特定することは困難である。
【図面の簡単な説明】
【0066】
【図1】図1は、ヘモグロビン溶液中の蛍光色素−ルシフェラーゼ複合体から発せられた光のスペクトルを示す。
【図2】図2は、dlk導入腫瘍細胞を移植した担癌マウスにおける抗dlk抗体−オチン化ウミホタルルシフェラーゼ−蛍光有機色素複合体を用いたイメージング結果を示す。
【図3】図3は、フィルターを使用しない場合のイメージングを示す。
【特許請求の範囲】
【請求項1】
以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【請求項2】
ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体。
【請求項3】
有機蛍光色素がインドシアニングリーン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミンから成る群から選択される少なくとも一種である、請求項2に記載の誘導体。
【請求項4】
ルシフェラーゼがウミホタルルシフェラーゼである、請求項2又は3に記載の誘導体。
【請求項5】
有機蛍光色素が糖鎖を介してルシフェラーゼに結合している、請求項2〜4のいずれかに記載のルシフェラーゼ誘導体。
【請求項6】
請求項2〜5のいずれかに記載のルシフェラーゼ誘導体が、ビオチン−アビジン物質複合体を介して、細胞の表面を特異的に認識する物質と結合した、標識化物質。
【請求項7】
有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体が、糖鎖を介して細胞の表面を特異的に認識する物質に結合している、標識化物質。
【請求項8】
細胞の表面を特異的に認識する物質が、抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドからなる群から選択される少なくとも1種である、請求項6又は7に記載の標識化物質。
【請求項9】
以下:
(1)請求項6〜8のいずれかに記載の標識化物質を個体に導入する工程;
(2)ルシフェリンを個体に導入する工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【請求項1】
以下:
(1)細胞の表面を特異的に認識する物質の標識として、ルシフェラーゼを含む発光系を個体に導入する工程;
(2)ルシフェリンを個体に導入して前記ルシフェラーゼと反応させる工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して、前記発光系からの光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【請求項2】
ルシフェラーゼに有機蛍光色素とビオチンとが結合した、ルシフェラーゼ誘導体。
【請求項3】
有機蛍光色素がインドシアニングリーン、クマリン、ローダミン、キサンテン、ヘマトポルフィリン、及びフルオレスカミンから成る群から選択される少なくとも一種である、請求項2に記載の誘導体。
【請求項4】
ルシフェラーゼがウミホタルルシフェラーゼである、請求項2又は3に記載の誘導体。
【請求項5】
有機蛍光色素が糖鎖を介してルシフェラーゼに結合している、請求項2〜4のいずれかに記載のルシフェラーゼ誘導体。
【請求項6】
請求項2〜5のいずれかに記載のルシフェラーゼ誘導体が、ビオチン−アビジン物質複合体を介して、細胞の表面を特異的に認識する物質と結合した、標識化物質。
【請求項7】
有機蛍光色素が糖鎖を介してルシフェラーゼに結合したルシフェラーゼ誘導体が、糖鎖を介して細胞の表面を特異的に認識する物質に結合している、標識化物質。
【請求項8】
細胞の表面を特異的に認識する物質が、抗体、ホルモン、糖鎖、並びに受容体及びイオンチャンネルのリガンドからなる群から選択される少なくとも1種である、請求項6又は7に記載の標識化物質。
【請求項9】
以下:
(1)請求項6〜8のいずれかに記載の標識化物質を個体に導入する工程;
(2)ルシフェリンを個体に導入する工程;及び
(3)400nm〜550nmの波長の光を透過しないフィルターを介して光を検出する工程;
を含む、個体における前記物質によって認識される細胞又は細胞群をイメージングする方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−75120(P2010−75120A)
【公開日】平成22年4月8日(2010.4.8)
【国際特許分類】
【出願番号】特願2008−249109(P2008−249109)
【出願日】平成20年9月26日(2008.9.26)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度 文部科学省 「先端融合領域イノベーション創出拠点の形成」委託研究,産業技術強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
【公開日】平成22年4月8日(2010.4.8)
【国際特許分類】
【出願日】平成20年9月26日(2008.9.26)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成20年度 文部科学省 「先端融合領域イノベーション創出拠点の形成」委託研究,産業技術強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(504173471)国立大学法人北海道大学 (971)
【Fターム(参考)】
[ Back to top ]

