レオヌリンの使用およびその組成物
乳酸脱水素酵素(LDH)の放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、ならびに急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物が開示されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は医薬技術の分野に属する。本発明は、乳酸脱水素酵素の放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、ならびに急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物に関する。
【背景技術】
【0002】
漢方医薬であるHerba Leonuri(シソ科植物であるHerba Leonuri、ヤクモソウ(益母草))は、最も古くは「神農本草経」、「本草綱目」等の古文書に収録されており、血行を促進して月経を調節する効果および利尿により浮腫を軽減する効果を有する。「中華人民共和国薬典(中国薬局方)」(2000年版)には、Herba Leonuriが、月経不順、月経困難症、無月経、悪露過多、浮腫および乏尿、急性腎炎に起因する浮腫等の治療に用いられることが収載されている。
【0003】
レオヌリンは、漢方医薬であるHerba Leonuriの主要活性成分の1つであることが知られている。その化学名は、4−ヒドロキシ−3,5−ジメトキシ安息香酸4−グアニジノブチルエステルであり、分子式はC14H21N3O5であり、構造式は下記のとおりである。
【0004】
【化1】

【0005】
分子量:311.33、物理的性質:融点は238℃であり(この温度で分解する)、ペンタノールに溶解する。レオヌリン亜硝酸塩の融点は229〜230℃であり、レオヌリン塩酸塩一水和物の融点は193〜194℃であり、冷水に溶解する一方、熱水にはわずか1〜2%しか溶解しない。
【0006】
毒性:レオヌリンは比較的毒性が低く、毎時2mgのレオヌリンを4日間にわたって連続的に腹腔内投与されたラットは、はっきりとした副作用を示さず、カエルに皮下注射した場合のレオヌリンのMLD(半数致死量)は0.4〜0.6g/kgである。
【0007】
本成分は、Leonurus sibiricus L.の葉と共に、L. heterophyllus SweetおよびL. Artemisiaの薬草から主に得られるが、これらは全てシソ科植物である。
【0008】
レオヌリンの既知の薬効としては、下記のものが挙げられる。
1.子宮への効果
レオヌリンは、ウサギ、ネコ、イヌ、モルモットおよび他の多くの動物の子宮に対し刺激作用を有する。レオヌリンは、発情前期に摘出したラットの子宮または卵巣切除後50mgのエストラジオールを筋肉注射したラットの摘出子宮の収縮幅を増大させることができる。レオヌリンの効果は用量と相関関係にあり、濃度が0.2〜1.0mg/mlの場合には用量と強度との間に直線関係が存在し、濃度が2.0mg/mlを上回ると最大強度に達する。レオヌリンが検体の自発収縮について二相効果を有することが観測される場合がある。最少有効量を用い、あるいは濃度を急激に増大(初期濃度の5倍を上回る量)させると、刺激が誘導される前に10〜20分間の一時阻害が起こることがある。高濃度(>20mg/ml)の場合には、子宮筋層の局所麻酔による阻害効果を有している。レオヌリンによる子宮収縮効果は数時間持続するが、薬剤を洗浄除去することにより停止させることができる。この収縮効果は、2mg/mlのアトロピンにより変化させることができない。レオヌリンAは、ウサギおよびネコの摘出子宮に対し、明らかな刺激を及ぼすが、ウサギの異所性子宮に対しては効果を有しない。
【0009】
2.循環系への効果
少量のレオヌリンの投与は、カエルの摘出心臓の収縮を促進するが、大量投与では、逆に、迷走神経末端の興奮に起因すると思われる阻害を起こす。カエルについて、レオヌリンによる血管かん流を行うと、血管収縮現象を示し、その強度は供試溶液の濃度に比例する。麻酔したネコにレオヌリンを静脈注射(2mg/kg)すると、血圧が低下し、数分後に回復する。このような一時的な血圧の低下は、迷走神経を両側で切断した後でも見られる。最初にアトロピンを用いた場合、その後レオヌリンを注射すると低下した血圧が回復するが、レオヌリンの効果は前者の場合ほど顕著ではない。したがって、血圧の低下に及ぼすレオヌリンの効果は、その迷走神経中枢への効果ではなく、迷走神経末端への効果に起因するものであることが推測される。温血動物の血管は、抗アドレナリン作用を有するレオヌリンに起因する明確な拡張を示す。
【0010】
3.呼吸中枢に対する効果
麻酔したネコにレオヌリンを静脈注射すると、呼吸回数および呼吸振幅が顕著に増大する。しかし、大量投与すると、呼吸が興奮状態から抑制状態に遷移し、微弱かつ不規則になる。迷走神経を両側で切断した後でも、レオヌリンは呼吸に対する興奮効果をなおも有している。結果として、レオヌリンは、呼吸中枢に対する直接的な興奮効果を有していると考えられる。
【0011】
4.他の効果
レオヌリンの少量の投与は、ウサギの摘出腸の弛緩を誘導し、蠕動の振幅を増大させることができるが、レオヌリンの大量投与は、蠕動の振幅を狭くし、頻度を増大させる。ウサギに1mg/kgのレオヌリンを静脈注射すると、尿の容積の有意な増大が観測される。レオヌリンは、カエルの神経筋検体に対しクラーレ様作用を有する。高濃度のレオヌリンは、ウサギの血液懸濁液の溶血を起こす可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0012】
レオヌリンが、外部からのカルシウムイオンの流入および細胞内カルシウムイオンの放出を阻害することにより血管平滑筋の収縮を顕著に抑制しうることは文献に記載されている。しかし、現在までのところ、レオヌリンが乳酸脱水素酵素の放出を抑制し、あるいは心筋梗塞もしくは心不全を予防または治療する能力に関する報告はなされていない。
【課題を解決するための手段】
【0013】
発明の概要
長年の研究の末に、本発明者は、有効な活性成分として作用する多くの動物実験および臨床試験を経て、レオヌリンが乳酸脱水素酵素(LDH)の放出の抑制および心筋梗塞もしくは心不全の予防または治療に対し優れた効果を有するだけでなく、即効性を有し、有害な副作用を殆ど示さないと共に、高い安全性を有することを発見し、実証した。
【0014】
本発明の理解を容易にするために、いくつかの用語を下記のとおり定義する。本発明において定義された用語は、本発明と関連する技術分野における通常の能力を有する者に知られた通常の意味を有する。
【0015】
特に断らない限り、本発明において、「レオヌリン」という用語は、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体を意味し、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物を意味する。「レオヌリン」は、酸、塩または溶媒和物、特に水和物の形態で存在する。この用語には、それぞれのエナンチオマーをさらに含み、各エナンチオマーは、塩または遊離型として存在し得、通常、5%未満、好ましくは2%未満、特に好ましくは1%未満の濃度の他のエナンチオマーと共に用いられ、またはそのような種類のエナンチオマーの任意の割合での混合物として用いられる。エナンチオマーの混合物には、ほぼ同量の2つのエナンチオマーを含むラセミ混合物が含まれる。
【0016】
特に断らない限り、「活性成分の量」とは、レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の重量を意味する。
【0017】
特に断らない限り、本発明において「医薬として許容される塩」という用語は、特に人間および/または哺乳動物に医薬として投与した場合に生理学的に許容される塩であると理解される。塩としては酸付加塩が挙げられ、酸は、例えば、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸である。上述したこれらの酸は単なる説明のためのものであり、これらに限定されない。
【0018】
特に断らない限り、本発明において「医薬として許容される担体」という用語は、丸剤、錠剤、カプセル等において充填剤または担体として用いられている、当技術分野において公知の物質を意味する。通常、これらの物質は医薬の非活性成分として用いられており、このような目的について医療分野の専門家により認識されている。医薬として許容される担体および賦形剤に関する資料としては、「Handbook of Pharmaceutical excipients」(第2版、A. Wade およびP.J. Weller編、米国薬剤師協会(ワシントン)、The Pharmaceutical Press(ロンドン)、1994年)等の参考文献がある。
本発明は、乳酸脱水素酵素(LDH)の放出の低減において、化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の新規な製薬学的用途を提供することを目的とする。また、本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供することを目的とする。さらに本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物を提供することを目的とする。
【0019】
上記の目的のために本発明が提供するものは下記のとおりである。
【0020】
ある態様において、本発明は、LDHの放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供する。
【0021】
他の態様において、本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供する。
【0022】
好ましくは、本発明の使用において、前記化合物レオヌリンは、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体であり、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物である。
【0023】
好ましくは、本発明の使用において、化合物レオヌリンの溶媒和物は、レオヌリンの水和物である。
【0024】
好ましくは、本発明の使用において、化合物レオヌリンの医薬として許容される塩は、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である。
【0025】
好ましくは、本発明の使用において、医薬の剤形は、経口製剤、非経口投与製剤、局所投与製剤、吸入投与製剤および経皮投与製剤からなる群より選択される。
【0026】
さらなる態様において、本発明は、活性成分としての化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物と、1または複数の医薬として許容される担体とを含む、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物を提供する。
【0027】
好ましくは、本発明の医薬組成物において、化合物レオヌリンの溶媒和物は、レオヌリンの水和物である。
【0028】
さらに好ましくは、本発明の医薬組成物において、化合物レオヌリンの医薬として許容される塩は、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である。
【0029】
好ましくは、本発明の医薬組成物において、医薬組成物は、経口製剤、注射剤等の非経口投与製剤、局所投与製剤、吸入投与製剤、または経皮投与製剤である。
【0030】
さらに好ましくは、本発明の医薬組成物において、医薬組成物は、錠剤、カプセル、顆粒剤、丸剤、滴剤、ジュースまたはシロップ剤からなる群より選択される経口投与製剤であり、好ましくは、医薬として許容される担体は、崩壊剤、滑沢剤、結合剤、充填剤、溶剤、香味料、甘味料、抗酸化剤、界面活性剤、保存料、矯味剤、および色素からなる群より選択される。
【0031】
本発明において、組成物の調製には公知の方法を適用し、製剤形態とするのが好ましい。このような方法は、活性成分を、充填剤、結合剤、希釈剤、崩壊剤、滑沢剤、着色料、香味料および保湿剤等の、当技術分野で通常用いられる成分である1または複数の補助成分を構成する担体と混合する工程を含んでいる。
【0032】
経口投与に適した製剤は、所望量の活性成分を含む丸剤、錠剤、またはカプセル、粉末剤または顆粒剤、液剤または懸濁液剤等の調剤単位として調剤することができる。活性成分は、大丸剤またはペースト剤として製剤してもよく、あるいはリポソーム中に封入してもよい。
【0033】
直腸投与用に、製剤を座剤または浣腸剤として調剤してもよい。
非経口投与に好適な製剤としては、水系および非水系の無菌注射剤(活性成分の純度90%以上)が挙げられる。このような製剤は、単位投与形態、または、容器(密封バイアルおよびアンプル等)中に保存され、凍結乾燥下で保存可能であり、使用前に無菌液(水等)の添加のみが必要な多数投与形態に調剤することができる。
【0034】
径鼻投与に好適な製剤としては、用量に応じて計算された量の圧縮エアロゾル剤、噴霧剤、微粉末または吸入剤により生成されるスプレー剤が挙げられる。
【0035】
このような用量単位(錠剤等)を調剤するために、充填剤、着色料、重合性の結合剤等の通常の添加剤の適用が考慮される。一般に、活性成分の機能を阻害しなければ、医薬として許容される任意の添加剤を用いることができる。
【0036】
本発明に適用可能な添加剤および/または担体は、薬草製剤を得るために用いられ、先行技術により当業者に公知の任意の物質である。これらの担体の選択および量は、例えば、経口投与、静脈内投与、腹腔内投与、皮内投与、筋肉投与、径鼻投与、口腔内投与、または局所投与等の薬剤の投与パターンに依存する。錠剤、チュアブル錠剤、コート錠剤、カプセル剤、顆粒剤、滴剤、ジュースまたはシロップ剤が経口投与に好適であり、液剤、懸濁液剤、水に易溶性の乾燥製剤およびスプレー剤が、非経口投与、局所投与、吸入投与に好適である。直腸において検査薬を用いることも可能である。担体膜またはパッチを、必要に応じて皮膚への浸透を促進する他の薬剤とともに溶液状態で保存してもよく、これは経皮投与に好適な典型例である。
【0037】
経口投与用の製剤における担体および添加剤の例は、崩壊剤、滑沢剤、結合剤、充填剤、あるいは溶剤、香味料、甘味料であり、特に担体物質、希釈剤、色素、抗酸化剤等である。座剤用には、ロウおよび脂肪酸エステルを用いることができる。非経口投与の成分としては、担体物質、保存料および懸濁化剤等を用いることができる。患者に投与する活性成分の量は、患者の体重、投与パターンおよび疾患の程度の機能的関係に応じて変動する。経口投与、直腸投与または経皮投与において、本発明の化合物の製剤投与形態からの放出を遅延させることができる。連続放出製剤、特にそれぞれの日に1回のみ(一日一回)投与するための投与形態が、本発明の適応に好適である。
本発明の経口投与用の投与形態の担体は、例えば、水、エタノール、ジメチルメタノール、グリセロール、グリコール、プロピレングリコール、ポリグリコール、ポリプロピレングリコール、グルコース、フルクトース、ラクトース、スクロース、デンプン、加工デンプン、ゼラチン、ソルビルアルコール、イノシトール、マンニトール、微結晶セルロース、メチルセルロース、カルボキシメチルセルロース、酢酸セルロース、シェラック、セチルアルコール、ポリビニルピロリドン、パラフィンロウ、ロウ、天然ゴムおよび合成ゴム、アラビアゴム、アルギン酸、デキストラン、飽和脂肪酸および不飽和合成脂肪酸、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸亜鉛、ステアリン酸グリセリル、ラウリル硫酸ナトリウム、食用油、ゴマ油、ココナッツ油、落花生油、大豆油、レシチン、乳酸ナトリウム、脂肪酸ポリオキシエチレンエステルおよび脂肪酸ポリオキシプロピレンエステル、脂肪酸ソルビタンエステル、ソルビン酸、安息香酸、クエン酸、アスコルビン酸、酒石酸、塩化ナトリウム、塩化カリウム、塩化マグネシウム、塩化カルシウム、酸化マグネシウム、酸化亜鉛、二酸化ケイ素、酸化チタン、二酸化チタン、硫酸マグネシウム、硫酸亜鉛、硫酸カルシウム、炭酸カリウム、リン酸カルシウム、リン酸水素カルシウム、臭化カリウム、ヨウ化カリウム、タルク、カオリナイト、コロイド、クロスポビドン、寒天およびベントナイトであってよい。
【0038】
本発明の医薬および薬用成分は、公知の高度な手段、装置、方法および手順等の医薬製剤手法を用いて調製することができる。例えば、錠剤等の固体製剤については、活性成分(レオヌリン、その医薬として許容される塩または溶媒和物)を、例えば、コーンパウダー、ラクトース、スクロース、ソルビルアルコール、タルク、ステアリン酸マグネシウム、リン酸水素カルシウム、または医薬として許容されるコロイド等の錠剤の通常の成分等の医薬用担体と共に粉砕し、均一に分布したレオヌリンまたはその医薬として許容される塩もしくは溶媒和物を含む単一の固体成分を得ることができる。
【0039】
本発明において「均一に分布した」とは、活性成分(レオヌリン、その医薬として許容される塩または溶媒和物)が、全成分中に均一に分散しており、同一の活性を有する錠剤、丸剤、カプセル等の単位投与形態に容易に分割できることとして理解されうる。固体成分はその後分割され、単位投与形態とされる。本発明の医薬または医薬組成物の錠剤または丸剤は、他の成分によりコーティングされ、または他の成分と混合され、徐放製剤を形成していてもよい。好適なコーティング成分は、ポリ酸、およびポリ酸の混合物、およびポリ酸とシェラック、セチルアルコールおよび/または酢酸セルロース等の他の物質との混合物である。
【0040】
本発明の医薬組成物は、錠剤、カプセル、顆粒剤、経口液剤、経皮投与製剤、座剤等の臨床上許容される投与形態に調製することができる。錠剤、顆粒剤またはカプセル等の経口製剤は、適量の担体を加えることにより調製できる。これらの投与形態は、当業者に周知の方法により調製することができる。錠剤、顆粒剤、カプセル等の成型工程用の担体は共通の助剤であり、例えば、デンプン、ゼラチン、アラビアゴム、ポリグリコール等である。さらに、界面活性剤、滑沢剤、崩壊剤、保存料、矯味剤および色素も用いることができる。
【0041】
化合物レオヌリンのin vivoおよび/またはin vitroでの実験は、本発明者によって後述のとおり行われ、本発明の医薬用途の適用性については、それによって十分に示されている。
【0042】
培地中へのLDHの放出量に及ぼすレオヌリンの効果は、LDHの放出を試験するためのin vitroでの実験により試験する。
【0043】
レオヌリンの梗塞領域への効果、心筋酵素(クレアチンキナーゼ(CK)および乳酸脱水素酵素(LDH))、ならびにアポトーシス遺伝子(BaxおよびBcl−2)のmRNAおよびタンパク質の発現レベルは、左冠動脈前下降枝を結紮した心筋梗塞モデルを用いて試験した。試験結果は、レオヌリンが梗塞領域を減少させ、血漿中の心筋酵素(LDHおよびCK)のレベルを低下させ、Bcl−2についてmRNAおよびタンパク質の発現レベルを増大させ、Baxについてはそれらを減少させることを示す。
【0044】
心機能および血漿中のビタミンCおよびシステインレベルは、左冠動脈前下降枝を結紮した心筋梗塞モデルを用いて試験した。試験結果は、レオヌリンが心室収縮終期圧を減少させ、収縮速度を増大させ、心機能を向上させ、血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることができることを示している。
【0045】
実験結果は、レオヌリンが乳酸脱水素酵素(LDH)の放出量を低減させ、急性心筋梗塞または心不全の予防および/または治療に顕著な効果を有し、急性心筋梗塞または心不全の予防および治療薬の調製に用いることができることを示している。
【0046】
後述する本発明の実施例について、図面を参照しながら詳細に説明する。
【図面の簡単な説明】
【0047】
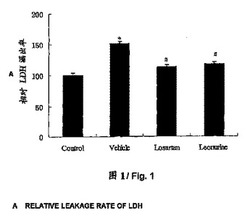
【図1】LDHの相対放出量を示すヒストグラムであり、データは「正常群」(100%)に対する百分率で表されている。「対照群」は非低酸素症群を示し、「ビヒクル」は低酸素症群を示し、「ロサルタン」はロサルタン処置群を示し、「レオヌリン」はレオヌリン処理群を示し、*は正常群との比較(p<0.01)であることを示し、#は低酸素症群との比較(p<0.01)であることを示す。
【図2】レオヌリンが心筋梗塞領域を減少させることを示すグラフであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg/kg」は低用量(7.5mg/kg)のレオヌリンで処置した群を示し、「Leo15mg/kg」は高用量(15mg/kg)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示す。
【図3】レオヌリンが心筋梗塞に罹患したラットの血漿中のLDHを減少させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図4】レオヌリンが心筋梗塞に罹患したラットの血漿中のCKを減少させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図5】レオヌリンが、BaxについてはmRNAの発現レベルを減少させ、Bcl−2については増大させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)を示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図6】レオヌリンが、Baxについてはタンパク質の発現レベルを減少させBcl−2については増大させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【発明を実施するための形態】
【0048】
具体的な実施例を参照しながら本発明についてさらに詳細に説明する。しかし、これらの実施例は本発明の説明のためにのみ用いられ、本発明の範囲を限定するためのものではない。下記の実施例において具体的な条件の記載のない実験方法は、通常、一般的な条件または製造業者により提案されている条件にしたがう。
【実施例】
【0049】
実施例1:レオヌリンがLDHの放出に及ぼす効果を試験するためのin vitro実験
図1に示すように、本実施例ではロサルタンを実薬対照薬として用いると共に、レオヌリンの濃度を10-6mol/Lとした。実験データは、一元配置分散分析(p<0.01)を用いて解析する。結果は、細胞のアポトーシスがLDHの放出を誘発しうることを示している。培地中に放出されたLDHの量を試験および解析した結果は、レオヌリンが、一元配置分散分析(p<0.01)において有意にLDHの放出を低減させることを示している。
【0050】
実施例2:レオヌリンの心筋梗塞モデル試験
図2〜6に示すように、本実施例では当業者に周知の左冠動脈前下降枝を結紮した心筋梗塞モデルを用い、腹腔注射による投与法を適用し、TTC染色法を用いて梗塞領域を試験し、一元配置分散分析を用いて実験データを解析したところ、解析結果は、レオヌリンが有意に(p<0.05)梗塞領域を減少させていることを示している。
【0051】
心筋梗塞は、心筋酵素(LDHおよびCK)の血漿中への放出を起こすが、レオヌリンは、血漿中のLDHおよびCKのレベルを有意に低下させ、心筋のダメージを低減させる(一元配置分散分析、p<0.05)。
【0052】
Baxはアポトーシス促進性の遺伝子であり、Bcl−2は抗アポトーシス遺伝子である。
【0053】
レオヌリンは、BaxのmRNAおよびタンパク質の発現レベルを有意に減少させ、Bcl−2のmRNAおよびタンパク質の発現レベルを顕著に増大させることができる。
【0054】
実験結果は、レオヌリンが急性心筋梗塞の改善および治療に顕著な効果を有しており、急性心筋梗塞の予防および治療用の薬剤の調製に用いることができることを示している。
【0055】
実施例3:レオヌリンの心不全モデル試験
本実施例では当業者に周知の左冠動脈前下降枝を結紮した心不全モデルを用い、腹腔内胃かん流による投与法を適用する。動脈および心室カニューレ挿入法を心機能の試験に用いる。結果は、レオヌリンが心室収縮終期圧を減少させ、収縮速度を増大させ、心機能を向上させることができることを示している(一元配置分散分析、p<0.05)。
【0056】
血漿中のビタミンCおよびシステインの含有量は、キャピラリー電気泳動法で検出する。結果は、レオヌリンが血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることができることを示している(一元配置分散分析、p<0.05)。
【0057】
心不全モデルの心機能試験の結果を表1に示す。この結果は、レオヌリンが心不全に罹患したラットの心機能を増大させることができることを示している。表中、*は心不全群との比較(p<0.05)を示し、#は疑似手術群との比較(p<0.05)を示す。
【0058】
【表1】

【0059】
実験結果を下記の表2に示す。この結果は、レオヌリンが血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることを示していることを示している。表中、*は心不全群との比較(p<0.05)を示し、**は心不全群との比較(p<0.01)を示し、#は疑似手術群との比較(p<0.05)を示す。
【0060】
【表2】

【技術分野】
【0001】
本発明は医薬技術の分野に属する。本発明は、乳酸脱水素酵素の放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用、ならびに急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物に関する。
【背景技術】
【0002】
漢方医薬であるHerba Leonuri(シソ科植物であるHerba Leonuri、ヤクモソウ(益母草))は、最も古くは「神農本草経」、「本草綱目」等の古文書に収録されており、血行を促進して月経を調節する効果および利尿により浮腫を軽減する効果を有する。「中華人民共和国薬典(中国薬局方)」(2000年版)には、Herba Leonuriが、月経不順、月経困難症、無月経、悪露過多、浮腫および乏尿、急性腎炎に起因する浮腫等の治療に用いられることが収載されている。
【0003】
レオヌリンは、漢方医薬であるHerba Leonuriの主要活性成分の1つであることが知られている。その化学名は、4−ヒドロキシ−3,5−ジメトキシ安息香酸4−グアニジノブチルエステルであり、分子式はC14H21N3O5であり、構造式は下記のとおりである。
【0004】
【化1】

【0005】
分子量:311.33、物理的性質:融点は238℃であり(この温度で分解する)、ペンタノールに溶解する。レオヌリン亜硝酸塩の融点は229〜230℃であり、レオヌリン塩酸塩一水和物の融点は193〜194℃であり、冷水に溶解する一方、熱水にはわずか1〜2%しか溶解しない。
【0006】
毒性:レオヌリンは比較的毒性が低く、毎時2mgのレオヌリンを4日間にわたって連続的に腹腔内投与されたラットは、はっきりとした副作用を示さず、カエルに皮下注射した場合のレオヌリンのMLD(半数致死量)は0.4〜0.6g/kgである。
【0007】
本成分は、Leonurus sibiricus L.の葉と共に、L. heterophyllus SweetおよびL. Artemisiaの薬草から主に得られるが、これらは全てシソ科植物である。
【0008】
レオヌリンの既知の薬効としては、下記のものが挙げられる。
1.子宮への効果
レオヌリンは、ウサギ、ネコ、イヌ、モルモットおよび他の多くの動物の子宮に対し刺激作用を有する。レオヌリンは、発情前期に摘出したラットの子宮または卵巣切除後50mgのエストラジオールを筋肉注射したラットの摘出子宮の収縮幅を増大させることができる。レオヌリンの効果は用量と相関関係にあり、濃度が0.2〜1.0mg/mlの場合には用量と強度との間に直線関係が存在し、濃度が2.0mg/mlを上回ると最大強度に達する。レオヌリンが検体の自発収縮について二相効果を有することが観測される場合がある。最少有効量を用い、あるいは濃度を急激に増大(初期濃度の5倍を上回る量)させると、刺激が誘導される前に10〜20分間の一時阻害が起こることがある。高濃度(>20mg/ml)の場合には、子宮筋層の局所麻酔による阻害効果を有している。レオヌリンによる子宮収縮効果は数時間持続するが、薬剤を洗浄除去することにより停止させることができる。この収縮効果は、2mg/mlのアトロピンにより変化させることができない。レオヌリンAは、ウサギおよびネコの摘出子宮に対し、明らかな刺激を及ぼすが、ウサギの異所性子宮に対しては効果を有しない。
【0009】
2.循環系への効果
少量のレオヌリンの投与は、カエルの摘出心臓の収縮を促進するが、大量投与では、逆に、迷走神経末端の興奮に起因すると思われる阻害を起こす。カエルについて、レオヌリンによる血管かん流を行うと、血管収縮現象を示し、その強度は供試溶液の濃度に比例する。麻酔したネコにレオヌリンを静脈注射(2mg/kg)すると、血圧が低下し、数分後に回復する。このような一時的な血圧の低下は、迷走神経を両側で切断した後でも見られる。最初にアトロピンを用いた場合、その後レオヌリンを注射すると低下した血圧が回復するが、レオヌリンの効果は前者の場合ほど顕著ではない。したがって、血圧の低下に及ぼすレオヌリンの効果は、その迷走神経中枢への効果ではなく、迷走神経末端への効果に起因するものであることが推測される。温血動物の血管は、抗アドレナリン作用を有するレオヌリンに起因する明確な拡張を示す。
【0010】
3.呼吸中枢に対する効果
麻酔したネコにレオヌリンを静脈注射すると、呼吸回数および呼吸振幅が顕著に増大する。しかし、大量投与すると、呼吸が興奮状態から抑制状態に遷移し、微弱かつ不規則になる。迷走神経を両側で切断した後でも、レオヌリンは呼吸に対する興奮効果をなおも有している。結果として、レオヌリンは、呼吸中枢に対する直接的な興奮効果を有していると考えられる。
【0011】
4.他の効果
レオヌリンの少量の投与は、ウサギの摘出腸の弛緩を誘導し、蠕動の振幅を増大させることができるが、レオヌリンの大量投与は、蠕動の振幅を狭くし、頻度を増大させる。ウサギに1mg/kgのレオヌリンを静脈注射すると、尿の容積の有意な増大が観測される。レオヌリンは、カエルの神経筋検体に対しクラーレ様作用を有する。高濃度のレオヌリンは、ウサギの血液懸濁液の溶血を起こす可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0012】
レオヌリンが、外部からのカルシウムイオンの流入および細胞内カルシウムイオンの放出を阻害することにより血管平滑筋の収縮を顕著に抑制しうることは文献に記載されている。しかし、現在までのところ、レオヌリンが乳酸脱水素酵素の放出を抑制し、あるいは心筋梗塞もしくは心不全を予防または治療する能力に関する報告はなされていない。
【課題を解決するための手段】
【0013】
発明の概要
長年の研究の末に、本発明者は、有効な活性成分として作用する多くの動物実験および臨床試験を経て、レオヌリンが乳酸脱水素酵素(LDH)の放出の抑制および心筋梗塞もしくは心不全の予防または治療に対し優れた効果を有するだけでなく、即効性を有し、有害な副作用を殆ど示さないと共に、高い安全性を有することを発見し、実証した。
【0014】
本発明の理解を容易にするために、いくつかの用語を下記のとおり定義する。本発明において定義された用語は、本発明と関連する技術分野における通常の能力を有する者に知られた通常の意味を有する。
【0015】
特に断らない限り、本発明において、「レオヌリン」という用語は、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体を意味し、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物を意味する。「レオヌリン」は、酸、塩または溶媒和物、特に水和物の形態で存在する。この用語には、それぞれのエナンチオマーをさらに含み、各エナンチオマーは、塩または遊離型として存在し得、通常、5%未満、好ましくは2%未満、特に好ましくは1%未満の濃度の他のエナンチオマーと共に用いられ、またはそのような種類のエナンチオマーの任意の割合での混合物として用いられる。エナンチオマーの混合物には、ほぼ同量の2つのエナンチオマーを含むラセミ混合物が含まれる。
【0016】
特に断らない限り、「活性成分の量」とは、レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の重量を意味する。
【0017】
特に断らない限り、本発明において「医薬として許容される塩」という用語は、特に人間および/または哺乳動物に医薬として投与した場合に生理学的に許容される塩であると理解される。塩としては酸付加塩が挙げられ、酸は、例えば、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸である。上述したこれらの酸は単なる説明のためのものであり、これらに限定されない。
【0018】
特に断らない限り、本発明において「医薬として許容される担体」という用語は、丸剤、錠剤、カプセル等において充填剤または担体として用いられている、当技術分野において公知の物質を意味する。通常、これらの物質は医薬の非活性成分として用いられており、このような目的について医療分野の専門家により認識されている。医薬として許容される担体および賦形剤に関する資料としては、「Handbook of Pharmaceutical excipients」(第2版、A. Wade およびP.J. Weller編、米国薬剤師協会(ワシントン)、The Pharmaceutical Press(ロンドン)、1994年)等の参考文献がある。
本発明は、乳酸脱水素酵素(LDH)の放出の低減において、化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の新規な製薬学的用途を提供することを目的とする。また、本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供することを目的とする。さらに本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物を提供することを目的とする。
【0019】
上記の目的のために本発明が提供するものは下記のとおりである。
【0020】
ある態様において、本発明は、LDHの放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供する。
【0021】
他の態様において、本発明は、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用を提供する。
【0022】
好ましくは、本発明の使用において、前記化合物レオヌリンは、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体であり、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物である。
【0023】
好ましくは、本発明の使用において、化合物レオヌリンの溶媒和物は、レオヌリンの水和物である。
【0024】
好ましくは、本発明の使用において、化合物レオヌリンの医薬として許容される塩は、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である。
【0025】
好ましくは、本発明の使用において、医薬の剤形は、経口製剤、非経口投与製剤、局所投与製剤、吸入投与製剤および経皮投与製剤からなる群より選択される。
【0026】
さらなる態様において、本発明は、活性成分としての化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物と、1または複数の医薬として許容される担体とを含む、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物を提供する。
【0027】
好ましくは、本発明の医薬組成物において、化合物レオヌリンの溶媒和物は、レオヌリンの水和物である。
【0028】
さらに好ましくは、本発明の医薬組成物において、化合物レオヌリンの医薬として許容される塩は、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である。
【0029】
好ましくは、本発明の医薬組成物において、医薬組成物は、経口製剤、注射剤等の非経口投与製剤、局所投与製剤、吸入投与製剤、または経皮投与製剤である。
【0030】
さらに好ましくは、本発明の医薬組成物において、医薬組成物は、錠剤、カプセル、顆粒剤、丸剤、滴剤、ジュースまたはシロップ剤からなる群より選択される経口投与製剤であり、好ましくは、医薬として許容される担体は、崩壊剤、滑沢剤、結合剤、充填剤、溶剤、香味料、甘味料、抗酸化剤、界面活性剤、保存料、矯味剤、および色素からなる群より選択される。
【0031】
本発明において、組成物の調製には公知の方法を適用し、製剤形態とするのが好ましい。このような方法は、活性成分を、充填剤、結合剤、希釈剤、崩壊剤、滑沢剤、着色料、香味料および保湿剤等の、当技術分野で通常用いられる成分である1または複数の補助成分を構成する担体と混合する工程を含んでいる。
【0032】
経口投与に適した製剤は、所望量の活性成分を含む丸剤、錠剤、またはカプセル、粉末剤または顆粒剤、液剤または懸濁液剤等の調剤単位として調剤することができる。活性成分は、大丸剤またはペースト剤として製剤してもよく、あるいはリポソーム中に封入してもよい。
【0033】
直腸投与用に、製剤を座剤または浣腸剤として調剤してもよい。
非経口投与に好適な製剤としては、水系および非水系の無菌注射剤(活性成分の純度90%以上)が挙げられる。このような製剤は、単位投与形態、または、容器(密封バイアルおよびアンプル等)中に保存され、凍結乾燥下で保存可能であり、使用前に無菌液(水等)の添加のみが必要な多数投与形態に調剤することができる。
【0034】
径鼻投与に好適な製剤としては、用量に応じて計算された量の圧縮エアロゾル剤、噴霧剤、微粉末または吸入剤により生成されるスプレー剤が挙げられる。
【0035】
このような用量単位(錠剤等)を調剤するために、充填剤、着色料、重合性の結合剤等の通常の添加剤の適用が考慮される。一般に、活性成分の機能を阻害しなければ、医薬として許容される任意の添加剤を用いることができる。
【0036】
本発明に適用可能な添加剤および/または担体は、薬草製剤を得るために用いられ、先行技術により当業者に公知の任意の物質である。これらの担体の選択および量は、例えば、経口投与、静脈内投与、腹腔内投与、皮内投与、筋肉投与、径鼻投与、口腔内投与、または局所投与等の薬剤の投与パターンに依存する。錠剤、チュアブル錠剤、コート錠剤、カプセル剤、顆粒剤、滴剤、ジュースまたはシロップ剤が経口投与に好適であり、液剤、懸濁液剤、水に易溶性の乾燥製剤およびスプレー剤が、非経口投与、局所投与、吸入投与に好適である。直腸において検査薬を用いることも可能である。担体膜またはパッチを、必要に応じて皮膚への浸透を促進する他の薬剤とともに溶液状態で保存してもよく、これは経皮投与に好適な典型例である。
【0037】
経口投与用の製剤における担体および添加剤の例は、崩壊剤、滑沢剤、結合剤、充填剤、あるいは溶剤、香味料、甘味料であり、特に担体物質、希釈剤、色素、抗酸化剤等である。座剤用には、ロウおよび脂肪酸エステルを用いることができる。非経口投与の成分としては、担体物質、保存料および懸濁化剤等を用いることができる。患者に投与する活性成分の量は、患者の体重、投与パターンおよび疾患の程度の機能的関係に応じて変動する。経口投与、直腸投与または経皮投与において、本発明の化合物の製剤投与形態からの放出を遅延させることができる。連続放出製剤、特にそれぞれの日に1回のみ(一日一回)投与するための投与形態が、本発明の適応に好適である。
本発明の経口投与用の投与形態の担体は、例えば、水、エタノール、ジメチルメタノール、グリセロール、グリコール、プロピレングリコール、ポリグリコール、ポリプロピレングリコール、グルコース、フルクトース、ラクトース、スクロース、デンプン、加工デンプン、ゼラチン、ソルビルアルコール、イノシトール、マンニトール、微結晶セルロース、メチルセルロース、カルボキシメチルセルロース、酢酸セルロース、シェラック、セチルアルコール、ポリビニルピロリドン、パラフィンロウ、ロウ、天然ゴムおよび合成ゴム、アラビアゴム、アルギン酸、デキストラン、飽和脂肪酸および不飽和合成脂肪酸、ステアリン酸、ステアリン酸マグネシウム、ステアリン酸亜鉛、ステアリン酸グリセリル、ラウリル硫酸ナトリウム、食用油、ゴマ油、ココナッツ油、落花生油、大豆油、レシチン、乳酸ナトリウム、脂肪酸ポリオキシエチレンエステルおよび脂肪酸ポリオキシプロピレンエステル、脂肪酸ソルビタンエステル、ソルビン酸、安息香酸、クエン酸、アスコルビン酸、酒石酸、塩化ナトリウム、塩化カリウム、塩化マグネシウム、塩化カルシウム、酸化マグネシウム、酸化亜鉛、二酸化ケイ素、酸化チタン、二酸化チタン、硫酸マグネシウム、硫酸亜鉛、硫酸カルシウム、炭酸カリウム、リン酸カルシウム、リン酸水素カルシウム、臭化カリウム、ヨウ化カリウム、タルク、カオリナイト、コロイド、クロスポビドン、寒天およびベントナイトであってよい。
【0038】
本発明の医薬および薬用成分は、公知の高度な手段、装置、方法および手順等の医薬製剤手法を用いて調製することができる。例えば、錠剤等の固体製剤については、活性成分(レオヌリン、その医薬として許容される塩または溶媒和物)を、例えば、コーンパウダー、ラクトース、スクロース、ソルビルアルコール、タルク、ステアリン酸マグネシウム、リン酸水素カルシウム、または医薬として許容されるコロイド等の錠剤の通常の成分等の医薬用担体と共に粉砕し、均一に分布したレオヌリンまたはその医薬として許容される塩もしくは溶媒和物を含む単一の固体成分を得ることができる。
【0039】
本発明において「均一に分布した」とは、活性成分(レオヌリン、その医薬として許容される塩または溶媒和物)が、全成分中に均一に分散しており、同一の活性を有する錠剤、丸剤、カプセル等の単位投与形態に容易に分割できることとして理解されうる。固体成分はその後分割され、単位投与形態とされる。本発明の医薬または医薬組成物の錠剤または丸剤は、他の成分によりコーティングされ、または他の成分と混合され、徐放製剤を形成していてもよい。好適なコーティング成分は、ポリ酸、およびポリ酸の混合物、およびポリ酸とシェラック、セチルアルコールおよび/または酢酸セルロース等の他の物質との混合物である。
【0040】
本発明の医薬組成物は、錠剤、カプセル、顆粒剤、経口液剤、経皮投与製剤、座剤等の臨床上許容される投与形態に調製することができる。錠剤、顆粒剤またはカプセル等の経口製剤は、適量の担体を加えることにより調製できる。これらの投与形態は、当業者に周知の方法により調製することができる。錠剤、顆粒剤、カプセル等の成型工程用の担体は共通の助剤であり、例えば、デンプン、ゼラチン、アラビアゴム、ポリグリコール等である。さらに、界面活性剤、滑沢剤、崩壊剤、保存料、矯味剤および色素も用いることができる。
【0041】
化合物レオヌリンのin vivoおよび/またはin vitroでの実験は、本発明者によって後述のとおり行われ、本発明の医薬用途の適用性については、それによって十分に示されている。
【0042】
培地中へのLDHの放出量に及ぼすレオヌリンの効果は、LDHの放出を試験するためのin vitroでの実験により試験する。
【0043】
レオヌリンの梗塞領域への効果、心筋酵素(クレアチンキナーゼ(CK)および乳酸脱水素酵素(LDH))、ならびにアポトーシス遺伝子(BaxおよびBcl−2)のmRNAおよびタンパク質の発現レベルは、左冠動脈前下降枝を結紮した心筋梗塞モデルを用いて試験した。試験結果は、レオヌリンが梗塞領域を減少させ、血漿中の心筋酵素(LDHおよびCK)のレベルを低下させ、Bcl−2についてmRNAおよびタンパク質の発現レベルを増大させ、Baxについてはそれらを減少させることを示す。
【0044】
心機能および血漿中のビタミンCおよびシステインレベルは、左冠動脈前下降枝を結紮した心筋梗塞モデルを用いて試験した。試験結果は、レオヌリンが心室収縮終期圧を減少させ、収縮速度を増大させ、心機能を向上させ、血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることができることを示している。
【0045】
実験結果は、レオヌリンが乳酸脱水素酵素(LDH)の放出量を低減させ、急性心筋梗塞または心不全の予防および/または治療に顕著な効果を有し、急性心筋梗塞または心不全の予防および治療薬の調製に用いることができることを示している。
【0046】
後述する本発明の実施例について、図面を参照しながら詳細に説明する。
【図面の簡単な説明】
【0047】
【図1】LDHの相対放出量を示すヒストグラムであり、データは「正常群」(100%)に対する百分率で表されている。「対照群」は非低酸素症群を示し、「ビヒクル」は低酸素症群を示し、「ロサルタン」はロサルタン処置群を示し、「レオヌリン」はレオヌリン処理群を示し、*は正常群との比較(p<0.01)であることを示し、#は低酸素症群との比較(p<0.01)であることを示す。
【図2】レオヌリンが心筋梗塞領域を減少させることを示すグラフであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg/kg」は低用量(7.5mg/kg)のレオヌリンで処置した群を示し、「Leo15mg/kg」は高用量(15mg/kg)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示す。
【図3】レオヌリンが心筋梗塞に罹患したラットの血漿中のLDHを減少させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図4】レオヌリンが心筋梗塞に罹患したラットの血漿中のCKを減少させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図5】レオヌリンが、BaxについてはmRNAの発現レベルを減少させ、Bcl−2については増大させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)を示し、#は疑似手術群との比較(p<0.05)であることを示す。
【図6】レオヌリンが、Baxについてはタンパク質の発現レベルを減少させBcl−2については増大させることを示すヒストグラムであり、「疑似手術」は疑似手術群を示し、「AMI」は心筋梗塞群を示し、「Leo7.5mg・kg-1」は低用量(7.5mg・kg-1)のレオヌリンで処置した群を示し、「Leo15mg・kg-1」は高用量(15mg・kg-1)のレオヌリンで処置した群を示し、*は心筋梗塞群との比較(p<0.05)であることを示し、#は疑似手術群との比較(p<0.05)であることを示す。
【発明を実施するための形態】
【0048】
具体的な実施例を参照しながら本発明についてさらに詳細に説明する。しかし、これらの実施例は本発明の説明のためにのみ用いられ、本発明の範囲を限定するためのものではない。下記の実施例において具体的な条件の記載のない実験方法は、通常、一般的な条件または製造業者により提案されている条件にしたがう。
【実施例】
【0049】
実施例1:レオヌリンがLDHの放出に及ぼす効果を試験するためのin vitro実験
図1に示すように、本実施例ではロサルタンを実薬対照薬として用いると共に、レオヌリンの濃度を10-6mol/Lとした。実験データは、一元配置分散分析(p<0.01)を用いて解析する。結果は、細胞のアポトーシスがLDHの放出を誘発しうることを示している。培地中に放出されたLDHの量を試験および解析した結果は、レオヌリンが、一元配置分散分析(p<0.01)において有意にLDHの放出を低減させることを示している。
【0050】
実施例2:レオヌリンの心筋梗塞モデル試験
図2〜6に示すように、本実施例では当業者に周知の左冠動脈前下降枝を結紮した心筋梗塞モデルを用い、腹腔注射による投与法を適用し、TTC染色法を用いて梗塞領域を試験し、一元配置分散分析を用いて実験データを解析したところ、解析結果は、レオヌリンが有意に(p<0.05)梗塞領域を減少させていることを示している。
【0051】
心筋梗塞は、心筋酵素(LDHおよびCK)の血漿中への放出を起こすが、レオヌリンは、血漿中のLDHおよびCKのレベルを有意に低下させ、心筋のダメージを低減させる(一元配置分散分析、p<0.05)。
【0052】
Baxはアポトーシス促進性の遺伝子であり、Bcl−2は抗アポトーシス遺伝子である。
【0053】
レオヌリンは、BaxのmRNAおよびタンパク質の発現レベルを有意に減少させ、Bcl−2のmRNAおよびタンパク質の発現レベルを顕著に増大させることができる。
【0054】
実験結果は、レオヌリンが急性心筋梗塞の改善および治療に顕著な効果を有しており、急性心筋梗塞の予防および治療用の薬剤の調製に用いることができることを示している。
【0055】
実施例3:レオヌリンの心不全モデル試験
本実施例では当業者に周知の左冠動脈前下降枝を結紮した心不全モデルを用い、腹腔内胃かん流による投与法を適用する。動脈および心室カニューレ挿入法を心機能の試験に用いる。結果は、レオヌリンが心室収縮終期圧を減少させ、収縮速度を増大させ、心機能を向上させることができることを示している(一元配置分散分析、p<0.05)。
【0056】
血漿中のビタミンCおよびシステインの含有量は、キャピラリー電気泳動法で検出する。結果は、レオヌリンが血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることができることを示している(一元配置分散分析、p<0.05)。
【0057】
心不全モデルの心機能試験の結果を表1に示す。この結果は、レオヌリンが心不全に罹患したラットの心機能を増大させることができることを示している。表中、*は心不全群との比較(p<0.05)を示し、#は疑似手術群との比較(p<0.05)を示す。
【0058】
【表1】

【0059】
実験結果を下記の表2に示す。この結果は、レオヌリンが血漿中のビタミンCの含有量を増大させ、血漿中のシステインの含有量を減少させることを示していることを示している。表中、*は心不全群との比較(p<0.05)を示し、**は心不全群との比較(p<0.01)を示し、#は疑似手術群との比較(p<0.05)を示す。
【0060】
【表2】

【特許請求の範囲】
【請求項1】
乳酸脱水素酵素(LDH)の放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用。
【請求項2】
急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用。
【請求項3】
前記化合物レオヌリンが、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体であり、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物である請求項2記載の使用。
【請求項4】
前記化合物レオヌリンの溶媒和物がレオヌリンの水和物である請求項1から3のいずれか1項記載の使用。
【請求項5】
前記化合物レオヌリンの医薬として許容される塩が、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である請求項1から3のいずれか1項記載の使用。
【請求項6】
前記医薬の剤形が、経口製剤、非経口投与製剤、局所投与製剤、吸入投与製剤および経皮投与製剤からなる群より選択される請求項1から5のいずれか1項記載の使用。
【請求項7】
活性成分として作用する化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物と、1または複数の医薬として許容される担体とを含む、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物。
【請求項8】
前記レオヌリンの溶媒和物がレオヌリンの水和物である請求項7記載の医薬組成物。
【請求項9】
前記化合物レオヌリンの医薬として許容される塩が、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である請求項7記載の医薬組成物。
【請求項10】
前記医薬組成物が、経口製剤、注射剤等の非経口投与製剤、局所投与製剤、吸入投与製剤、または経皮投与製剤である請求項7から9のいずれか1項記載の医薬組成物。
【請求項11】
前記医薬組成物が、錠剤、カプセル、顆粒剤、丸剤、滴剤、ジュースまたはシロップ剤からなる群より選択される経口投与製剤であり、好ましくは、医薬として許容される担体が、崩壊剤、滑沢剤、結合剤、充填剤、溶剤、香味料、甘味料、抗酸化剤、界面活性剤、保存料、矯味剤、および色素からなる群より選択される請求項10記載の医薬組成物。
【請求項1】
乳酸脱水素酵素(LDH)の放出を低減させる効果を有する医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用。
【請求項2】
急性心筋梗塞もしくは心不全の予防および/または治療用の医薬の製造への化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物の使用。
【請求項3】
前記化合物レオヌリンが、レオヌリンのラセミ体、光学的に純粋なレオヌリンの立体異性体であり、特にレオヌリンのエナンチオマーもしくはジアステレオマー、または任意の所望の割合で混合されたレオヌリンの立体異性体の混合物である請求項2記載の使用。
【請求項4】
前記化合物レオヌリンの溶媒和物がレオヌリンの水和物である請求項1から3のいずれか1項記載の使用。
【請求項5】
前記化合物レオヌリンの医薬として許容される塩が、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である請求項1から3のいずれか1項記載の使用。
【請求項6】
前記医薬の剤形が、経口製剤、非経口投与製剤、局所投与製剤、吸入投与製剤および経皮投与製剤からなる群より選択される請求項1から5のいずれか1項記載の使用。
【請求項7】
活性成分として作用する化合物レオヌリンまたはその医薬として許容される塩もしくは溶媒和物と、1または複数の医薬として許容される担体とを含む、急性心筋梗塞もしくは心不全の予防および/または治療用の医薬組成物。
【請求項8】
前記レオヌリンの溶媒和物がレオヌリンの水和物である請求項7記載の医薬組成物。
【請求項9】
前記化合物レオヌリンの医薬として許容される塩が、レオヌリンと、塩酸、硫酸、硫酸水素ナトリウム、亜硫酸、亜硫酸水素ナトリウム、硝酸、リン酸、酢酸、乳酸、メタンスルホン酸、ラクトビオン酸、クエン酸、シュウ酸、グルタミン酸、フマル酸、マレイン酸、アスパラギン酸、クエン酸またはコハク酸からなる群より選択される酸との酸付加塩である請求項7記載の医薬組成物。
【請求項10】
前記医薬組成物が、経口製剤、注射剤等の非経口投与製剤、局所投与製剤、吸入投与製剤、または経皮投与製剤である請求項7から9のいずれか1項記載の医薬組成物。
【請求項11】
前記医薬組成物が、錠剤、カプセル、顆粒剤、丸剤、滴剤、ジュースまたはシロップ剤からなる群より選択される経口投与製剤であり、好ましくは、医薬として許容される担体が、崩壊剤、滑沢剤、結合剤、充填剤、溶剤、香味料、甘味料、抗酸化剤、界面活性剤、保存料、矯味剤、および色素からなる群より選択される請求項10記載の医薬組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2010−535159(P2010−535159A)
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2010−518479(P2010−518479)
【出願日】平成20年8月1日(2008.8.1)
【国際出願番号】PCT/CN2008/001409
【国際公開番号】WO2009/015561
【国際公開日】平成21年2月5日(2009.2.5)
【出願人】(509025670)フダン ユニバーシティー (5)
【Fターム(参考)】
【公表日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願日】平成20年8月1日(2008.8.1)
【国際出願番号】PCT/CN2008/001409
【国際公開番号】WO2009/015561
【国際公開日】平成21年2月5日(2009.2.5)
【出願人】(509025670)フダン ユニバーシティー (5)
【Fターム(参考)】
[ Back to top ]

