レドックス試薬システム用酵素の特性決定方法、電気化学セルおよびこれを備えるシステム
【課題】 s−GDHの変異形態の炭水化物特異性を決定するのに使用する迅速かつ簡単なレドックス試薬システム用酵素の特性決定方法、電気化学セル、およびこれを備えるシステムおよびキットを提供すること。
【解決手段】 レドックス試薬システム用酵素の特性決定方法が提供される。本方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、この電気化学セルを含む電気化学試験片、これを含むシステムおよびキットが提供される。これらはレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【解決手段】 レドックス試薬システム用酵素の特性決定方法が提供される。本方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、この電気化学セルを含む電気化学試験片、これを含むシステムおよびキットが提供される。これらはレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はレドックス試薬システム用酵素の特性決定方法および組成物に関する。さらに詳しくは、本発明はレドックス試薬システム用酵素の特性決定方法、電気化学セルおよびこれを備えるシステムに関する。
【背景技術】
【0002】
生理学的液体またはサンプル、例えば血液または血液由来生成物中の検体の検出は今日の社会においてはその重要性が増す一方である。検体検出試験は、臨床実験室の試験、家庭における試験等を始めとする種々の用途があるが、これらの場合、そのような試験の結果は種々の疾患状態の診断および管理に卓越した役割を果たしている。関心のある検体としては糖尿病管理のためのグルコース、コレステロール等が挙げられる。検体検出の重要性がこのように増大していることに応じて、種々の検体検出プロトコルおよび装置が臨床用と家庭用の双方について開発されている。
【0003】
検体検出に用いられる方法の一つのタイプは電気化学的方法である。かかる方法では少なくとも2つの電極すなわち参照電極と作用電極を備える電気化学セル内の反応ゾーンに水系液体サンプルを置く。分析すべき成分を直接電極と反応させるか、あるいはレドックス試薬と直接または間接に反応させて酸化性(または還元性)物質を分析すべき成分、すなわち検体に相当する量形成する。存在する酸化性(または還元性)物質の量を電気化学的に測定し、最初のサンプル中に存在する検体の量と関連づける。
【0004】
検体に対する多くのそのような電気化学的アプローチにおいて、酵素成分とメディエイター成分とを含む検体酸化信号生成システムが用いられている。この検体酸化信号生成システムでは、酵素成分は関心のある検体を酸化し、次いで電子をメディエイターに伝達し、このメディエイターは、今度は、その電子を電気化学セルの電極に伝達することにより、電気信号を生成し、この電気信号に基づいて検体濃度を決定することができる。
【0005】
電気化学的検体検出試験およびシステムの設計においては、検体に特異的な酵素を用いるのが望ましい。例えば、グルコースを測定するには、可溶性形態のピロロキノリンキノン(PQQ)依存グルコースデヒドロゲナーゼ(以下、s−GDHという)がグルコース酸化シグナル生成システムにおいて使用することができる酵素の一例である。s−GDHは貧電子供与体であるため、好都合なことに、液体サンプル中の酸素の存在に非感受性である。
【0006】
しかしながら、天然または「野生型」s−GDHの欠点は、グルコースだけでなく、マルトース、ガラクトース、ラクトース、マンノース、キシロースおよびリボースを含む他の還元糖を酸化することである。グルコース以外の糖類に対するs−GDHの反応性は、ある場合には、糖尿病患者によっては血中グルコース濃度決定の正確さを損なうことがある。例えば、イコデキストリン(グルコースのポリマー)を措置された腹膜透析患者は血中に高濃度のマルトースを含んでいることがある。
【0007】
このようにs−GDHが特異性を欠いているので、例えば1種以上のアミノ酸が置換したこの酵素の変異種を生成することによってs−GDHを改良する努力がなされるようになった。しかしながら、そのような「変えられた」酵素を使用できるようにするには、検体検出試験に使用するのに適しているか否かを決定する必要がある。
【0008】
時間のかかる分光測光法がs−GDHの活性の測定に使用されてきたが、酵素律速条件下でのみ使用されている。2,6−ジクロロフェノールインドフェノール(DCIP)とフェナジンメトスルフェート(PMS)を人工メディエイターとして使用する分光測光測定法が、例えば特許文献1および特許文献2に記載されている。
【0009】
しかしながら、典型的な市販の、グルコースを使用したグルコース試験片は酵素律速条件を用いていない。その理由は長期間の試験片の性能を保証するように酵素が過剰に存在するからである。組換えタンパク質、例えばs−GDHの変異形態は一般にごく小量だけ産生される。s−GDHのこれらの変異形態の反応性の試験は、酵素を塗布した試験片を作成し、グルコースおよび干渉(すなわち、還元)する可能性のある各糖を種々の濃度で添加した全血または血漿を用いて試験片の各ロットを試験することを含む。s−GDHの各変異形態を塗布した試験片の製造は各変異体を多量に必要とし、時間および労力集約的であり、かつ技術者が生体有害物質である可能性のある、人の血液または血漿を用いて試験片を試験することを必要とする。
【0010】
従って、野生型s−GDHよりもグルコース特異性が改善されているために特定の変異体酵素、例えばs−GDHの大量生産が保証されるかを決定するために迅速かつ安価な、基質律速的試験法が必要とされる。この試験法は、還元糖を添加した全血または血漿サンプルではなく、グルコースまたは干渉糖類を添加した、血液を含まないサンプルにも適用可能でなければならない。
【0011】
【特許文献1】米国特許第6,103,509号明細書
【特許文献2】欧州特許出願公開第1176202号明細書
【特許文献3】米国特許第5,484,708号明細書
【特許文献4】米国特許第5,723,284号明細書
【特許文献5】米国特許第5,834,224号明細書
【特許文献6】米国特許第5,942,102号明細書
【特許文献7】米国特許第5,972,199号明細書
【特許文献8】米国特許第5,997,817号明細書
【特許文献9】米国特許第6,059,946号明細書
【特許文献10】米国特許第6,083,710号明細書
【特許文献11】米国特許第6,103,509号明細書
【特許文献12】米国特許第6,121,009号明細書
【特許文献13】米国特許第6,134,461号明細書
【特許文献14】米国特許第6,179,979号明細書
【特許文献15】米国特許第6,193,973号明細書
【特許文献16】米国特許第6,231,531号明細書
【特許文献17】米国特許第6,284,125号明細書
【特許文献18】米国特許第6,340,428号明細書
【特許文献19】米国特許第6,444,115号明細書
【特許文献20】米国特許第6,716,577号明細書
【特許文献21】米国特許出願公開第2003/0104595号明細書
【特許文献22】国際公開第99/49307号パンフレット
【特許文献23】国際公開第97/18465号パンフレット
【特許文献24】国際公開第01/57510号パンフレット
【特許文献25】国際公開第01/57238号パンフレット
【特許文献26】国際公開第02/48707号パンフレット
【特許文献27】国際公開第02/50609号パンフレット
【特許文献28】国際公開第02/06788号パンフレット
【特許文献29】欧州特許第0969097号明細書
【特許文献30】欧州特許第1176202号明細書
【特許文献31】特開平09−1403378号公報
【特許文献32】英国特許第2304628号明細書
【発明の開示】
【発明が解決しようとする課題】
【0012】
従って、s−GDHの変異形態の炭水化物特異性を決定するのに使用する迅速かつ簡単な方法であって、少量の酵素を使用し、かつ液体サンプル(例えば、全血または血漿)中の検体(例えば、グルコース)を測定するための典型的な電気化学に基づく試験片上の基質律速条件をモデルとするものがこの分野で依然として必要とされている。さらに、酵素活性を迅速かつ簡単に測定する方法も望まれている。従って、本発明の目的は上述のような課題を解決したレドックス試薬システム用酵素の特性決定方法、電気化学セルおよびこれを備えるシステムを提供することである。
【課題を解決するための手段】
【0013】
本発明はレドックス試薬システム用酵素を特性決定する方法および組成物を提供する。本発明の方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、本発明は主題の電気化学セルを含む電気化学試験片並びにこれを含むシステムおよびキットを提供する。本発明はレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【発明の効果】
【0014】
本発明により、レドックス試薬システム用酵素を特性決定する便利かつコスト効率のよい方法、これに用いる電気化学セル、これを備えるシステムを提供することができる。また、血液または血液製品を使用せずに試験することができる。
【発明を実施するための最良の形態】
【0015】
本発明の特長および利点は、本発明の原理を用いる例示的な実施の形態を記載する以下の詳細な説明および添付図面を参照すればよりよく理解される。
【0016】
本発明はレドックス試薬システム用酵素を特性決定する方法および組成物を提供する。本発明の方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、本発明は主題の電気化学セルを含む電気化学試験片並びにこれを含むシステムおよびキットを提供する。本発明はレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【0017】
本発明をさらに詳細に説明する前に、本発明は以下に説明される特定の実施の形態に限定されず、それら特定の実施の形態の変形例が可能でありそれらも依然として特許請求の範囲内であることが了解されるべきである。また、用いられている用語は特定の実施の形態を説明するものであり、なんら限定する意図はなく、本発明の範囲は特許請求の範囲によって決定されることが了解されるべきである。
【0018】
本明細書において、文脈上そうでないとする明確な指示がない限り、単数形の表現は複数の場合も含む。特に別の定義がなされていない限り、ここに使用されている技術用語および科学用語はすべて本発明の属する技術分野において通常の知識を有するものに普通に理解されるのと同じ意味を有する。
【0019】
数値範囲が記載されている場合、文脈上そうでないとする明確な指示がない限り、下限の単位の10分の1までの、その範囲の上限と下限の間にある各中間値、および述べられた範囲内の述べられた値または中間値は本発明の範囲内である。これらの小範囲の上限および下限はより小さい範囲に含まれていてもよく、その場合も本発明の範囲内にある。ただし、述べられた範囲内の特に除外された限界点は除かれる。述べられた範囲が上下限の一方または双方を含む場合、それら含まれている上下限の一方または双方を除外した範囲も本発明の範囲内に含まれる。
【0020】
特に別の定義がなされていない限り、本明細書に使用されている技術用語および科学用語はすべて本発明の属する技術分野において通常の知識を有するものに普通に理解されるのと同じ意味を有する。ここに記載されたものと同様または均等である任意の方法、装置および材料を本発明の実施および試験において使用することができるが、好適な方法、装置および材料を以下に説明する。
【0021】
本明細書において言及されている刊行物はすべて、それら刊行物中に記載されており本発明に関して使用することができる細胞系統、ベクターおよび方法を記載し開示する目的で本明細書において参照され、本発明の一部を構成する。
【0022】
上に要約したように、本発明は酵素を特長付ける方法および組成物を提供する。さらに説明すると、まず、本発明の方法およびそれらの代表的な特定の用途を詳細に説明し、次いで本発明の方法を実施するのに使用される代表的な組成物およびシステムを説明する。
【0023】
方法
上に要約したように、本発明は酵素の特性決定方法を提供する。酵素の特性決定は酵素の特徴またはパラメータを決定することを意味する。この特徴は酵素に特有の特徴、例えば基質特異性、または少なくとも部分的にその環境に依存する特徴、例えば所与の液体媒体中の酵素の濃度、所与の液体媒体中の酵素の活性であってもよい。もちろん、この特徴は特有要因と環境要因との積であってもよい。本発明の方法を用いて決定することができる特定の代表的特徴について以下に詳細に説明する。
【0024】
本発明の方法は、サンプルを含有するレドックス試薬システム用酵素を電気化学セルに適用し、この電気化学セルにより生成された電気信号を検出し、その際検出された信号を用いてサンプル中のレドックス試薬システム用酵素を特性決定する。
【0025】
本発明のある代表的な実施の形態の特長は、電気化学セルに接触したサンプルはレドックス試薬システムの酵素と既知量の酵素基質を含み、一方サンプルが適用される電気化学セルは、サンプル中の酵素が一員であるレドックス試薬システムのメディエイター成分を含む無酵素試薬組成物を含むことである。本発明方法のこれらの実施の形態において用いられるサンプルおよび電気化学セル成分については、別に詳細に説明する。
【0026】
サンプル
本発明方法を実施する際に電気化学セルと接触するサンプルはレドックス試薬システム用酵素と既知量の基質またはその酵素の基質である可能性のあるもの、すなわち酵素基質とを含む。
【0027】
酵素
多くの実施の形態において、サンプルの酵素成分は単一種の酵素または関心のある検体を共働して酸化する複数種の酵素である。換言すれば、酵素のメンバーは、単一検体酸化酵素または関心のある所与の検体を共働して酸化する2種以上の酵素の一群からなっていてもよく、電気化学セル内で以下のように電気化学信号を生成することができるものである。関心のある酵素としては、オキシダーゼ、デヒドロゲナーゼ、リパーゼ、キナーゼ、ジアホラーゼ、キノンタンパク質等が挙げられる。関心のある特定の代表的酵素としては、限定されないが、グルコースオキシダーゼ、グルコースデヒドロゲナーゼ、コレステロールエステラーゼ、コレステロールオキシダーゼ、リポタンパク質リパーゼ、グリセロールキナーゼ、グリセロール−3−燐酸オキシダーゼ、乳酸オキシダーゼ、乳酸デヒドロゲナーゼ、ピルビン酸オキシダーゼ、アルコールオキシダーゼ、ビリルビンオキシダーゼ、ウリカーゼ等が挙げられる。関心のある、ある実施の形態では、酵素は、以下に詳細に説明する、グルコースデヒドロゲナーゼ、例えばs−GDHまたはその変異体である。
【0028】
ある実施の形態では、酵素成分は約35〜450μM、通常約80〜約270μMの範囲内の濃度で存在していてもよい。
【0029】
酵素基質
本発明方法で用いられるサンプルはまた既知量の酵素基質を含む。酵素基質はサンプル中に存在する酵素の既知の基質でもよく、あるいはサンプル中の酵素の候補基質であってもよい。例えば、酵素がグルコースデヒドロゲナーゼである場合、サンプル中の基質はグルコース(同酵素の基質として知られている)または同酵素の基質であることが知られている、あるいは同酵素の基質であることが疑われる他の糖、例えばマルトースであってもよい。既知量とは、サンプルが定義されたまたは所定の量もしくは濃度の基質を有することを意味する。ある実施の形態では、サンプル中の酵素基質の濃度は約0〜約50mM(約0〜約900mg/dL)、通常約0〜約45mM(約0〜約810mg/dL)の範囲内である。ある実施の形態では、酵素基質が確実に存在するときは、サンプル中の酵素基質の濃度は約0.1〜約50mM(例えば約0.01〜約900mg/dL)、通常約0.1〜約45mM(例えば、約0.01〜約810mg/dL)の範囲内である。
【0030】
補酵素
ある実施の形態では、液体媒体のサンプルは酵素成分を活性化する補酵素も含む。関心のある補酵素の一例はピロロキノリンキノン(PQQ)である。他の関心のある補因子(コファクター)としては、限定されないが、試験試薬に適用される酵素のタイプに応じて、ニコチンアミドアデニンジヌクレオチド(NAD)、フラビンアデニンジヌクレオチド(FAD)、チトクローム等が挙げられる。ある実施の形態では、任意の補酵素の濃度は約60〜約670μM、通常約100〜約430μMの範囲内であってもよい。
【0031】
酵素補因子
ある実施の形態では、サンプルはさらに、1種以上の酵素補因子を含む。関心のある酵素補因子としては二価の金属カチオン類、例えばCa2+、Mg2+等が挙げられる。いずれの補因子の濃度も約0.5〜約5mMの範囲内であってもよい。
【0032】
電気化学セル
上に要約したように、本発明方法を実施する際に、無酵素試薬組成物を含む電気化学セルにサンプルを適用する。種々の電気化学セルの構成が知られている、米国特許第5,723,284号、同第5,834,224号、同第5,942,102号、同第5,972,199号、同第5,997,817号、同第6,083,710号、同第6,121,009号、同第6,134,461号、同第6,193,873号および同第6,716,577号明細書に記載されているものが含まれる。上記米国特許公報明細書は本明細書において参照されることにより、本発明の一部を構成する。さらに、他の特許文献、WO99/49307、WO97/18465、WO01/57510、WO01/57238、WO02/50609、EP0969097A2およびGB2304628も含まれる。これらの優先権書類が米国出願である場合は、この米国出願は本明細書に参照されることにより本発明の一部を構成する。当業者に知られている任意の電気化学セルを本発明の組成物を含むように改変することができる。
【0033】
ある実施の形態では、電気化学セルは電気化学試験片に存在する。本発明の電気化学試験片を図2Aおよび図2Bに示す。図2Aは電気化学試験片の展開図であり、この電気化学試験片は作用電極と、参照電極と、これらを分離するスペーサー層からなる。スペーサー層は組み立てられた試験片において反応ゾーンまたは領域を画定する切欠き部を有する。これらの要素は以下においてさらに説明する。図2Bは組み立てられた形のサンプル試験片を示す。種々の部品のそれぞれについて以下にさらに詳細に説明する。
【0034】
電極
本発明に従う試薬組成物を含む電気化学試験片は作用電極と参照電極とを備える。一般に、作用電極と参照電極は細長い矩形状のストリップの形に構成される。典型的には、これら電極の長さは約1.9〜約4.5cm、通常約2〜約2.8cmの範囲内である。これら電極の幅は約0.38〜約0.76cm、通常約0.51〜約0.67cmの範囲内である。参照電極の厚さは、典型的には、約10〜約100nm、通常約18〜約22nmの範囲内である。ある実施の形態では、1つの電極の長さが他の電極の長さが短く、ある実施の形態では、その長さは約0.32cm短い。
【0035】
作用電極と参照電極はさらに、試験片の反応領域に面する、電極の少なくとも表面は導電性材料、例えば金属その他の導電性材料で構成されている。関心のある導電性材料としては、限定されないが、パラジウム、金、白金、銀、イリジウム、炭素、ドープされた酸化スズ、ステンレス鋼等が挙げられる。ある実施の形態では、導電性材料は金または白金である。原則として、電極全体を導電性材料で作製することができるが、各電極は一般に不活性支持材料の表面に電極の導電性材料成分の薄層が存在するものから成る。任意の好適な不活性基材を本発明における電極に用いることができるが、典型的には、基材は電極、ひいては試験片全体に構造的支持を提供することができる剛性材料である。基材として使用することができる好適な材料としては、プラスチック類、例えばPET、PETG、ポリイミド、ポリカーボネート、ポリスチレン、シリコン、セラミック、ガラス等が挙げられる。
【0036】
スペーサー層
本発明の電気化学試験片の特長は、上述の作用電極と参照電極が相互に対向し、ごく短い距離しか離れておらず、電気化学試験片の反応ゾーンまたは領域作用電極と参照電極との間の距離が非常に小さい。本発明の試験片の作用電極と参照電極のスペースがこのように最小になっているのは、作用電極と参照電極との間に配置または挟まれた薄いスペーサー層が存在する結果である。このスペーサー層の厚さは、一般に、約1〜約500μm、通常約100〜約200μmの範囲内である。スペーサー層は切断して反応ゾーンまたは領域と少なくともこの反応ゾーンへの入口と、一般には反応ゾーンからの出口も併せ備える。代表的なスペーサー層構成を図2Aおよび図2Bに示す。スペーサー層はこれらの図においては入口および出口穴またはポートを刻設した円形反応領域を有するものとして示されているが、他の構成、例えば正方形、卵形、三角形、矩形、不規則形状の反応領域等も可能である。スペーサー層は任意の好適な材料で作製することができるが、代表的な好適な材料としてはPET、PETG、ポリイミド、ポリカーボネート等が挙げられる。この場合、スペーサー層の表面を処理してそれぞれの電極に対して接着性を持つようにし、それによって電気化学試験片の構造を維持するようにすることができる。特に関心があるのはダイキャスト両面接着ストリップをスペーサー層として使用することである。
【0037】
反応ゾーン
本発明の電気化学試験片は作用電極、参照電極およびスペーサー層によって画定される反応ゾーンまたは領域を備える。これらの要素は上述した通りである。詳しくは、作用電極と参照電極は反応領域の上面と下面を画定し、一方スペーサー層は反応ゾーンの壁を画定する。反応領域の容積は少なくとも約0.1μL、ふつう少なくとも約1μL、もっとふつうには少なくとも約1.5μLである。この場合、容積は10μLまたはそれ以上であってもよい。上述のように、反応領域は一般に少なくとも入口ポートを備え、多くの実施の形態においては出口ポートも備える。入口ポートと出口ポートの断面積は反応領域に対して液体の有効な出入り口を提供するのに十分な大きさである限り、それぞれ変えてもよいが、一般に約9×10-5〜約5×10-3cm2の範囲内、ふつう約5×10-4〜約2.5×10-3cm2の範囲内である。
【0038】
無酵素試薬組成物
反応ゾーン内には無酵素試薬処方が存在し、この試薬処方は典型的には乾燥形態で存在する。無酵素とは、電気化学セルで測定すべきサンプル中に存在する、少なくともレドックス試薬システム用酵素を含まないことを意味する。そのようなものとして、電気化学セルに適用されるサンプルがグルコースデヒドロゲナーゼを含むならば、電気化学セル中に存在する試薬処方はグルコースデヒドロゲナーゼを含まず、そして多くの実施の形態においては、いずれの酵素も含まない。
【0039】
電気化学セル内に存在する無酵素処方の特長は、レドックスメディエイターが存在することであり、このレドックスメディエイターは1種以上のメディエイター剤を含んでいてもよい。メディエイターは(検体酸化の際に検体から1つ以上の電子を取得した)酵素から電極への電子伝達を容易にする媒介物として動作する。当技術において知られている種々のメディエイター剤を使用することができる。それらのメディエイター剤としてはフェリシアナイド、フェナジンエトスルフェート、フェナジンメトスルフェート、フェニレンジアミン、N,N,N’,N’−テトラメチルフェニレンジアミン、1−メトキシフェナジンメトスルフェート、2,5−ジメチル−1,4−ベンゾキノン、2,6−ジメチル−1,4−ベンゾキノン、2,5−ジクロロ−1,4−ベンゾキノン、フェロセン誘導体、オスミウム−ビピリジル錯体、ルテニウム錯体等が挙げられる。
【0040】
試薬組成物のもう1つの成分はメディエイター安定化緩衝成分である。このメディエイター安定化緩衝成分は、1種以上、例えば2種、3種、4種以上の異なる緩衝剤からなり、緩衝成分は乾燥形態で組成物を保存する間、メディエイターが使用前、例えば保存中にほとんど還元されないように、メディエイターを安定化する。
【0041】
一実施の形態では、緩衝剤はポリカルボン酸類である。ポリカルボン酸とは、緩衝剤が2種以上のカルボン酸官能部分を含ことを意味し、この場合、異なるカルボン酸官能部分の数は約2〜約10、例えば約2〜約8、約2〜約6を含む範囲内であってもよい。この緩衝剤のカルボン酸基または官能部分は、脂肪族、脂環式、芳香族およびヘテロ環式構造を含む多数の異なる構造に結合していてもよい。1種を超えるカルボン酸基が存在していると、少なくとも1つのpKa値を所望の範囲内に与える有利な効果を持つことができる。関心のある特定のポリカルボン酸としては、限定されないが、メリット酸、シトラコン酸、マレイン酸等のポリマーが挙げられる。
【0042】
試薬組成物が乾燥試薬処方の場合、例えば、以下に詳細に説明するように、電気化学試験片に存在しているような場合、その乾燥組成物中に存在する緩衝成分の量は典型的には約0.01〜約40.00%w/w、ふつう約1〜約10%w/wである。
【0043】
試薬組成物はさらに1種以上の下記の追加成分:湿潤剤、洗剤安定剤、粘度調節剤、またはそれらの組み合わせを含んでいてもよい。
【0044】
若干の実施の形態においては湿潤剤を洗剤と組み合わせて試薬組成物に添加して、試薬組成物を電気化学試験片上に均一に塗布するのを容易にすることができる。複数の1種以上の組み合わせの剤を用いてもよい。これらの剤を使用すると試験試薬の溶解を改善するとともに毛細管充填ストリップの灯心特性を向上させることがある。これらの剤としては当技術において知られているもの、例えばポリマー類、消泡剤、界面活性剤が挙げられる。関心のある界面活性剤/洗剤の代表例としては、限定されないが、トリトン、マコール、テトロニクス、シルウェット、ゾニルおよびプルロニックが挙げられる。好適な剤としては、ポリエチレンオキサイドとポリプロピレンオキサイドのブロック共重合体であるプルロニック材料が挙げられる。プルロニック材料の例としては、良好な湿潤性を有するプルロニックP103および良好な洗剤特性を有するプルロニックF87プリルが挙げられる。プルロニックP103とプルロニックF87プリルはともに80℃を超える曇り点を有しており、この性質により乾燥工程中の組成物の相変化が避けられるので好ましい。
【0045】
試薬組成物に安定剤も添加して酵素を安定化し、タンパク質の変性を防止するようにしてもよい。安定剤はまたメディエイター、特に酸化されたレドックスメディエイターのレドックス状態を安定化するのを助ける。安定剤の例としては、限定されないが、炭水化物類(例えば、スクロース、トレハロース、マンニトール、およびラクトース)、アミノ酸類、タンパク質類(例えばBSAおよびアルブミン)および有機化合物、例えばEDTA等が挙げられる。
【0046】
粘度調節剤を試薬に添加して液体試薬のレオロジーを調節するようにしてもよい。そのような粘度調節剤の例としてはポリ(アクリル酸)、ポリ(ビニルアルコール)、デキストラン、BSA等が挙げられる。
【0047】
方法
本発明の方法を実施する際に、第1のステップは、例えば電気化学試験片の電気化学セル内にある量の液体媒体またはサンプルを導入することである。サンプル調製と反応領域への適用との間の時間は変化してもよいが、ある代表的な実施の形態においては、約30秒〜約8時間、例えば約5分〜約3時間の範囲内であり、約30分〜約60分を含む。電気化学セルの反応領域内に導入されるサンプルの量は変化してもよいが、一般に約0.05〜約10μL、ふつう約0.5〜約1.6μLの範囲内である。サンプルは任意の従来の手順を用いて反応領域内に導入することができる。この場合、サンプルを適宜反応領域内に注入したり、反応領域に灯心現象により滲み込ませたりすることができる。
【0048】
反応ゾーンにサンプルを適用した後、作用電極と参照電極を用いて電気化学測定を行う。電気化学測定は試験と電気化学試験片を用いる装置の特定の性質によって、例えば試験が電量測定か、電流測定か、電位差測定であるかによって変化して行ってもよい。一般に、電気化学測定は電荷(電量測定)、電流(電流測定)または電位差(電位差測定)を測定し、ふつうは反応領域内にサンプルを導入した後で所与の期間にわたって行われる。上述の電気化学測定を行う方法の詳細は米国特許第4,224,125号、同第4,545,382号および同第5,266,179号明細書、並びにWO97/18465、WO99/49307に記載されている。これらの記載内容は本明細書において参照されることにより、本発明の一部を構成する。
【0049】
上述のように反応ゾーン内で生成された電気化学信号を検出した後、この信号を用いてサンプルの酵素をある方法で、例えば酵素に対する基質特異性を決定する、電気化学セルに適用されたサンプル中の酵素の濃度を決定する等により特性決定する。この場合、これら2つの代表的応用例は以下に詳細に説明する。ある実施の形態では、電気化学信号測定ステップおよび酵素特性決定ステップは、上述のように、試験片を用いサンプルを電気化学セルに適用した後そのような工程を行うように動作するように設計された装置により自動的に行われる。これらのステップの少なくともあるものを自動的に行うための代表的な読取装置の詳細が米国特許第6,193,873号明細書に記載されている。この記載内容は本明細書において参照されることにより本発明の一部を構成する。
【0050】
用途
上述のように、本発明方法は種々の用途を有する。代表的な用途は上述のような酵素特性決定用途である。
【0051】
本発明方法により達成することができる第1の代表的な酵素特性決定用途は、1種以上の追加の酵素と比較して第1の酵素の基質または検体特異性、例えば変異体グルコースデヒドロゲナーゼのグルコースに対する特異性を他の還元糖、例えばマルトースと比較して決定することである。この場合、特異性は第2のグルコースデヒドロゲナーゼ、例えば野生型デヒドロゲナーゼに関して決定される。
【0052】
本発明のこれらの代表的応用例を実施する際に、少なくとも、第1および第2の酵素を第1および第2の酵素基質と組み合わせて含む1組の液体サンプルを調製し、次いで各調製されたサンプルを個別に電気化学セル内で試験する。個別に試験するとは、上記1組のサンプルの各サンプルをその自身の電気化学セルまたは別の電気化学セル内で試験することを意味する。
【0053】
これらの実施の形態のうちのあるものにおいては、調製され、次いで本発明方法に従って電気化学セルに個別に適用される上記1組のサンプルは下記を含む。
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含有するサンプル;
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含有するサンプル;
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含有するサンプル;および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含有するサンプル。
【0054】
ある実施の形態では、上述の特異性試験は各酵素を第1および第2の酵素基質を異なる濃度で、例えば第1および第2の酵素基質の複数の異なる濃度で試験することを含む。そのような実施の形態において、少なくとも下記の追加のサンプルを調製し、試験する。
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含有するサンプル;
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含有するサンプル;
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含有するサンプル;および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含有するサンプル。
【0055】
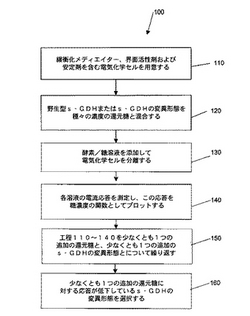
これらの応用例の代表的実施の形態は、異なるs−GDH酵素の基質特異性、すなわち基質としてグルコースを使用するが競合する還元糖を使用しない能力を評価することである。この実施の形態は図1にさらに詳細に示されている。図1は本発明の例示的実施の形態に従ってs−GDHの野生型と変異形態を試験する方法100のフローチャートである。方法100はステップ110に示すように、電気化学セルを用意することを含む。本発明に従う工程を用いて使用することができる典型的な電気化学セルは、図2Aおよび図2Bの展開図および上面図に示すように、試験片200の形で用意される。試験片200は作用電極202と参照電極204とがスペーサー層206で分離されてなる。作用電極202は、緩衝されたメディエイター、界面活性剤および安定剤を含む乾燥した試薬208の帯を備える。スペーサー層206は組立てられた試験片の電気化学セルの反応ゾーンを画定する切欠き部210を備える。
【0056】
上述のように、参照電極204用の好適な材料は作用電極202用に記載したものが挙げられる。対向電極形式の参照電極204用の材料はふつうパラジウムまたは金である。電極が同一平面にある形式の電気化学セルでは、参照電極204はふつう炭素である。
【0057】
参照電極204はふつう、分子構造中にイオウ部分を含有する安定剤をコーティングされている。このコーティングは親水性基と、イオウ含有部分と親水性基との間のスペーサーとを含んでいてもよい。参照電極204のコーティングに使用できる化合物の例としては、限定されないが、2−メルカプトエタンスルホン酸、2−メルカプトエタノール、2−メルカプトエチルアミン、3−メルカプトプロピオン酸、チオフェン、4−カルボキシチオフェン、システイン、ホモシステイン、およびシスチンが挙げられる。参照電極204はふつう2−メルカプトエタンスルホン酸をコーティングした金から成る。
【0058】
乾燥された試薬208は欧州特許出願公開1324038号(A2)明細書に記載されているようなスロットコーティングにより作用電極202上に塗布することができる。同明細書の記載内容は本明細書において参照されることにより本発明の一部を構成する。試薬を塗布する他の方法としては、限定されないが、インクジェット法およびニードルコーティング法が挙げられる。
【0059】
スペーサー層206は切断されて反応ゾーン内への入口ポートを少なくとも有し、一般に反応ゾーンからの出口ポートを有する反応ゾーンを設けている。スペーサー層206は図2Aおよび図2Bにおいて側面に入口穴および出口穴を刻設した円形反応領域を有するものとして示されている。他の反応領域構成としては、限定されないが、正方形、卵形、三角形、矩形、不規則形状の反応領域等が挙げられる。スペーサー層206は任意の好適な材料で作製することができるが、この好適な材料としては、限定されないが、PET、PETG、ポリイミド、ポリカーボネート等が挙げられる。それにより、スペーサー層206の表面を処理して接着性を持つようにすることができる。スペーサー層206は典型的にはダイキャスト両面接着ストリップである。
【0060】
メディエイターとしてはフェリシアナイド、フェナジンエトスルフェート、フェナジンメトスルフェート、フェニレンジアミン、N,N,N’,N’−テトラメチルフェニレンジアミン、1−メトキシフェナジンメトスルフェート、2,5−ジメチル−1,4−ベンゾキノン、2,6−ジメチル−1,4−ベンゾキノン、2,5−ジクロロ−1,4−ベンゾキノン、フェロセン誘導体、オスミウム−ビピリジル錯体、ルテニウム錯体等が挙げられる。好適な緩衝化剤としては二価金属カチオン(例えば、Ca2+)に対してほとんど結合親和性を持たず、シトラコン酸塩、クエン酸塩、リンゴ酸、マレイン酸、燐酸塩、「グッド(Good)」緩衝剤等を使用することができる。さらに、緩衝された溶液はトリトン、マコール、テトロニクス、シルウェット、ゾニルおよびプルロニックを含む界面活性剤または湿潤剤;スクロース、トレハロース、マンニトール、およびラクトースを含む安定剤を含有していてもよい。好適な実施の形態では、メディエイターはフェリシアナイドであり、緩衝剤はシトラコン酸塩であり、界面活性剤はプルロニックであり、安定剤はスクロースである。
【0061】
次に、方法100のステップ120に記載されているように、緩衝された溶液中のs−GDHの野生型または少なくとも1種の変異形態を補酵素、補因子および種々の濃度の第1の還元糖(例えば、グルコース)と混合する。第1の還元糖は、限定されないが、グルコース、ガラクトース、マルトース、キシロースまたはラクトースであってもよい。補酵素はPQQであってもよく、補因子はカルシウムであってもよい。
【0062】
方法100および300(下記参照)を含む本発明の方法において使用されるs−GDHは、任意の天然型のs−GDHまたは変異形態であってもよく、変異形態のs−GDHは天然の酵素のアミノ酸配列中に、限定されないが、1個以上のアミノ酸の置換または欠失させてグルコース特異性を改善することを含む、少なくとも1つの修飾がなされているものである。当業者に知られた技法を用いてこれらの修飾をs−GDHに施すことができるが、これらの技法は上述の米国特許第6,103,509号明細書および欧州特許出願公開第1176202号(A1)明細書に記載されている。これらの記載内容は本明細書において参照されることにより本発明の一部を構成する。野生型酵素の変異体を作製する一般的方法は当業者には周知である。
【0063】
図1のステップ130に示すように、緩衝されたメディエイター、界面活性剤および安定剤を含有するそれぞれ別個の電気化学セルに酵素/等溶液を添加する。次に、ステップ140に示すように、電流応答を測定し、糖濃度の関数としてグラフ化する。電流応答を測定するまで酵素/糖溶液をメディエイターから分離しておくのが有利であるが、その理由は酵素とメディエイターの間の反応速度が速いからである。溶液を電気化学セルに添加する前に酵素とメディエイターが混合されると、電流応答を測定する前に反応が完了またはほぼ完了してしまう。次いで、ステップ150(実施例2〜4)に示すように、少なくとも1種の追加の還元糖と少なくとも1種の追加の変異形態s−GDHについてステップ110ないし140を繰り返す。この少なくとも1種の追加の還元糖は、限定されないが、ガラクトース、マルトース、キシロースまたはラクトースであってもよい。次に、ステップ160およびステップ170に示すように、この少なくとも1種の追加の還元糖に対する応答が低下したs−GDHの変異型を選択する。
【0064】
このようにして、変異形態s−GDHの野生型s−GDHに関する特異性を容易に決定することができる。
【0065】
もう一つの代表的応用例では、本発明方法を用いて液体サンプル中の酵素の濃度または活性を決定する。これらの方法を実施する際に、未知量の酵素と既知量の基質を含有する液体サンプルを電気化学セルに適用する。適用後、検出された電気信号を用いて、適用されたサンプル中の検体の濃度を、例えば上述の検出された電気信号を基準と比較することによって決定する。
【0066】
図3は、サンプル中の野生型のs−GDHとその変異体の活性を測定するための本発明の方法300における一連のステップを示すフローチャートである。方法300は、ステップ310に示すように、界面活性剤と安定剤とともに緩衝液中に乾燥したメディエイターを含む電気化学セルを用意する。次に、ステップ320に示すように、増加する一連の濃度の野生型s−GDHまたはs−GDHの変異形態を一定量のグルコースと混合する。次いで、ステップ330に示すように、各酵素/グルコースサンプルを別個の電気化学セルに添加する。ステップ340に示すように、電流応答を各サンプルについて測定し、電流応答を酵素濃度の関数としてグラフ化して標準曲線を作成し、これを後続のステップにおける基準として用いることができる。次に、ステップ350に示すように、s−GDHの野生型または変異形態の少なくとも1つの追加のロットについてステップ310ないし340を繰り返す。次いで、ステップ360に示すように、このs−GDHの野生型または変異形態の少なくとも1つの追加のロットの酵素濃度を標準曲線すなわち基準から、例えば、検出された信号を基準と比較することにより、読取る。
【0067】
システム
本発明はまた本発明方法を実施する際に使用するシステムを提供する。これらのシステムは、上述のように、レドックス試薬システム用酵素を含む少なくとも1種のサンプルまたは液体媒体と、無酵素試薬組成物を含む電気化学セルとを備える。
【0068】
本発明のシステムは、本発明の試薬組成物を用いるサンプルの電気化学測定に使用する装置を備える。
【0069】
本発明のシステムの装置類およびメーター類は典型的には電気化学的測定装置である。本発明のメーター類は典型的には(a)サンプルが導入された電気化学セルに電位差を印加する手段;および(b)電気化学セル内のセル電流を測定する手段を備える。代表的な電気化学的メーター類および装置類は第5,723,284号、同第5,834,224号、同第5,942,102号、同第5,972,199号、同第5,997,817号、同第6,083,710号、同第6,121,009号、同第6,134,461号および同第6,193,873号明細書に記載されている。上記米国特許明細書は本明細書において参照されることにより、本発明の一部を構成する。さらに、他の特許文献、WO99/49307、WO97/18465、WO01/57510、WO01/57238、WO02/48707、WO02/50609、EP0969097A2およびGB2304628も含まれる。
【0070】
以下の実施例は説明のために提示されるものであって、本発明を限定するものではない。
【0071】
実施例1.
s−GDHの野生型または変異形態を塗布した従来の試験片の性能
種々の糖特異性を持つs−GDHの変異形態をスクリーニングするための試験法を開発するために、s−GDHの野生型および変異形態の還元糖に対する応答を従来の酵素を塗布したグルコース試験片形式で最初に試験した。このスクリーニング試験法は理想的には従来のように酵素を塗布した試験片を用いて、還元糖を添加した全血または血漿で試験した際に示される応答を模倣するものである。試験したs−GDHの変異形態はそれぞれ1個のアミノ酸の置換Asn452ThrおよびAsp167Gluを含んでいた。試験片は、作用電極(金)を、約50〜500kU/mLの野生型または変異形態s−GDH、GDHに対するPQQのモル比が2:1であるPQQ、2mMCaCl2 、750mMフェリシアナイド、pH6.8の67mMシトラコン酸塩、0.1%プルロニックおよび75mMスクロースを含有する緩衝化した試薬溶液でスロットコーティングしたウェブに基づく方法により作成した。試薬溶液中の野生型または変異形態s−GDHの濃度を電気化学セル当たり約13活性単位が使用されるように調整した。従って、試薬溶液のmL当たりの活性単位は使用した酵素のグラム(g)当たりの活性単位によって変動した。各酵素の活性は、DCIP(2、6−ジクロロフェノールインドフェノール)および(PES(フェナジンエトスルフェート)を50mMのPIPES(ピペラジンN,N’−ビス(2−エタンスルホン酸))緩衝液pH6.8に添加した溶液を用いる分光測光測定法に基づいたものである。この測定法では、600nmにおけるDCIPの吸光度の変化を監視し、吸光度の減少速度を上述の酵素の反応速度とした。1分間に1mmolのDCIPを還元する酵素活性を1単位と定義した。pH6.8におけるDCIPのモル吸収係数は17.4mM-1であった。COBAS FARAII遠心分析機を分光測光測定に用いた。
【0072】
欧州特許出願公開第1324038号明細書に記載されているように、赤外エネルギー源を用いて作用電極上の試薬を乾燥した。この記載内容全体が本明細書において参照されることにより本発明の一部を構成する。電気化学セル(または試験片)は乾燥した試薬を有する作用電極を、乾燥したMESAを含有する金の対極に付着させることにより形成して対極の汚染を防止した。
【0073】
内在性グルコースが約80mg/dL(または4.4mM)の全血に高治療濃度(約60mg/dLまたは4mM)または高治療濃度の3倍(約180mg/dLまたは12mM)のいずれかの干渉糖であるキシロースを添加した。添加したサンプルを上述の試験片上に適用し、グルコース濃度を時間電流測定法により決定した。この場合−0.3Vの電位を10秒間印加した後、+0.3Vの電位を5秒間印加した。キシロースを含まない対照サンプルに対する絶対バイアスを各酵素について計算し、図4に示すように、キシロース濃度の関数として表した。野生型s−GDHとAsn452Thr変異体について、絶対バイアスと干渉糖であるキシロースとの間に線形相関があった。このことから、野生型s−GDHとAsn452Thr変異体はともにグルコースだけでなくキシロースも認識することが分かる。しかしながら、Asp167Glu変異体はキシロースに対する応答が低下していた。両変異体は絶対バイアスとガラクトースまたはマルトース(データは示さない)との間に線形相関も示したことから、グルコースだけでなくこれらの炭水化物も認識されることが分かる。従って、s−GDHの変異体をスクリーニングするのに使用される試験法は、Asp167Gluだけがキシロースに対して低下した応答を示すという図4において得られた結果と同様の結果を与える筈である。
【0074】
図4に示す結果は生理学的に関連のある糖濃度の全範囲(すなわち、720mg/dLまたは40mMまで)にわたる試験を含んでいない。従って、野生型s−GDHを塗布した従来の試験片の試験をさらに行って糖濃度の範囲を拡大した。約80mg/dL(または4.4mM)の内生グルコースを含む結晶に40mM以下の5種類の還元糖:グルコース、マルトース、キシロース、ガラクトースおよびラクトースのそれぞれを添加した。添加したサンプルを上述の試験片に適用し、上述のようにグルコース濃度を時間電流測定法により決定した。測定された電流応答を図5に示すように糖濃度の関数としてプロットした。図4に示すように、約10mM未満では、野生型s−GDHは上述の試験した5種類の還元糖のそれぞれと同等に反応した。しかしながら、上述のDCIP/PES分光測光試験で試験すると、同じ糖濃度範囲を通してキシロースおよびグルコースとの反応性が低い(結果は示さない)ことから、分光測光試験は従来の酵素を塗布した試験片については干渉糖に対する酵素の応答をモデルとするには使用できないことが分かる。先に述べたように、分光測光試験法は酵素律速条件を使用するのに対して、従来の酵素を塗布した試験片は過剰の酵素を使用する。従って、各試験法の形式での糖応答における差異を説明している。
【0075】
実施例2.
本発明の電気化学セルを用いる方法における還元糖に対する野生型s−GDHの応答の試験
作用電極(金)を、750mMフェリシアナイド、pH6.8の67mMシトラコン酸塩、0.1%プルロニックおよび75mMスクロースを含有する緩衝化した試薬溶液でスロットコーティングしたウェブに基づく方法により作成した電気化学セル(すなわち、試験片)を用いて野生型s−GDHの還元糖に対する応答を測定した。実施例1と同様に、赤外エネルギー源を用いて作用電極上で試薬を乾燥させた。電気化学セルは乾燥した試薬を有する作用電極を、乾燥したMESAを含有する金の対極に付着させることにより形成して対極の汚染を防止した。
【0076】
GDHに対するPQQのモル比が2:1であるPQQおよび2mMCaCl2 を含むpH6.8の67mMシトラコン酸塩に溶解した野生型s−GDHを生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合した。各溶液のs−GDHの濃度を、電気化学セル当たり約13活性単位となるように調整した。各酵素/糖−含有溶液を、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない(濃度については上記参照)電気化学セル上に適用した。電流応答を測定し、3つの測定値の平均を、図6に示すように、糖濃度の関数としてグラフ化した。結果は、キシロース濃度10mM未満で実施例1(図4参照)のs−GDHを塗布した試験片から得られた、酵素はグルコースおよびキシロースと等しくよく反応したという結果と同様であった。また、図5において得られたものと同様の結果がすべての還元糖で得られた。従って、この試験法は従来の野生型の酵素を塗布した試験片で得られた応答をモデルとし、以下の利点を持つ。すなわち、(1)酵素を塗布した試験片は酵素の各形態で製造する必要はないので、時間と資源(装置および技術者)を節減でき、酵素の使用量も少ない;および(2)種々の濃度の還元糖を含有する緩衝液システムサンプルを、生物学的に有害な全血または血漿に糖を添加したものの代わりに使用することができる。
【0077】
実施例3.
本発明の電気化学セルを用いる方法において還元糖に対するAsn452Thr(s−GDHの変異形態)の応答の試験
上述の実施例2に記載されたのと同じロットの電気化学セル(すなわち、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まないセルを持つ)を用いてAsn452Thrの還元糖に対する応答を測定した。Asn452Thrを、生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合した。各溶液のAsn452Thrの濃度を、電気化学セル当たり約13活性単位となるように調整した。各酵素/糖−含有溶液を、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セル上に適用した。電流応答を測定し、図7に示すように、糖濃度の関数としてプロットした。結果は、キシロース濃度10mM未満で(すなわち、高治療濃度のほぼ3倍の濃度で)実施例1(図4参照)のAsn452Thrを塗布した試験片から得られた、野生型酵素のようにAsn452Thrはグルコースおよびキシロースと等しくよく反応した、という結果と同様であった。また、データは、s−GDHのこの変異形態は10mM未満の糖濃度において試験した全ての糖類と等しくよく反応することを示している。従って、この試験法はAsn452Thrを塗布した試験片で得られた結果を模倣し、上述の利点を持つ。
【0078】
実施例4.
本発明の電気化学セルを用いる方法において還元糖に対するAsp167Glu(s−GDHのもう1つの変異形態)の応答の試験
上述の実施例3と同様に、還元糖に対するAsp167Gluの応答を測定した。Asp167Gluを、生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合し、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セル上に適用した。電流応答を測定し、図8に示すように、糖濃度の関数としてプロットした。結果は、キシロース濃度10mM未満で(すなわち、高治療濃度のほぼ3倍の濃度で)実施例1(図4参照)のAsp167Gluを塗布した試験片から得られた、s−GDHのこの変異形態はキシロースに対する応答が低下している、という結果と同様であった。この変異体はまた試験した他の還元糖とも等しくよく反応した。従って、本実施例でも、試験法はAsp167Gluを塗布した試験片で得られた結果を有利に模倣しているが、迅速かつ容易に使用できる形式である。
【0079】
上記実施例は本発明の方法が酵素を塗布した試験片をモデルとするのに使用することができること、およびs−GDHの変異形態を糖応答についてスクリーニングするのに使用することができることを実証している。
【0080】
以下の実施例は本発明の方法を使用して酵素活性を測定する方法を実証するものである。
【0081】
実施例5.
本発明方法に従う野生型s−GDHを適用した電気化学セル用の標準曲線
乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セルに約0〜10mg/mLの範囲内の一連の増加する濃度の野生型s−GDHを適用することにより、野生型s−GDH用の標準曲線(図9参照)を作成した。グルコース濃度を450mg/dLに保った。当業者にはs−GDHの任意の変異形態についても標準曲線を作成することができることが分かるであろう。
【0082】
両軸逆数プロット法(すなわち、1/酵素濃度の関数として1/応答)を図9の標準曲線から作成し、図10に示す。電気化学セルの応答と野生型s−GDHの量との間に強い線形相関(r2=0.9986)が存在する。酵素の試験ロットの濃度は、電流応答を測定し、標準曲線から濃度を読み取ることによって、容易に決定することができる。
【0083】
電気化学式でs−GDH用の標準曲線を作成することにより、従来の試験片を製造するのに用いられる、入ってくる酵素の活性を測定し、乾燥ストリップ上に塗布された酵素の安定性を測定し、酵素活性に関して起こり得るストリップの塗布問題を解決することができる。
【0084】
上述の結果および説明は、本発明がレドックス試薬システム用酵素を特性決定する便利かつコスト効率のよい方法を提供することを実証している。本発明の利点は低コストであり、血液または血液製品を使用せずに試験することができることである。そのようなものとして、本発明は当技術に顕著な貢献をしている。
【0085】
本明細書に引用された全ての刊行物および特許は、各個別の刊行物または特許が参照されることが特にかつ個々に示されているかのように、本明細書において参照されることにより本発明の一部を構成する。いずれの刊行物の引用も出願日前の開示に対するものであって、本発明が先発明によりそのような刊行物に先行する資格がないことを自認するものではない。
【0086】
明瞭な理解を目的とする説明と例示のために本発明を詳細に記載したが、添付の特許請求の範囲から逸脱することなく本発明にある変更および改変をなすことができることは、本発明の教示に照らして、当業者には容易にわかることである。
【0087】
好適な実施態様は下記の通りである。
(1)(a)第1のレドックス試薬システム用酵素と既知量の酵素基質とを含むサンプルを、前記レドックス試薬システムのメディエイターを含む無酵素試薬組成物を含む電気化学セルに適用し、かつ
(b)前記電気化学セルにより生成された電気信号を検知する方法。
(2)前記酵素は酸化酵素である実施態様1に記載の方法。
(3)前記酸化酵素はオキシダーゼとデヒドロゲナーゼから選ばれる実施態様2に記載の方法。
(4)前記サンプルは、さらに、酵素補因子を含む実施態様1、2または3に記載の方法。
(5)前記方法は、さらに、前記検出された電気信号を用いて前記第1のレドックス試薬システム用酵素の検体特異性を決定することを含む実施態様1、2、3または4に記載の方法。
【0088】
(6)前記方法は、少なくとも下記のサンプル
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含むサンプル、
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む実施態様5に記載の方法。
(7)前記方法は、さらに、下記のサンプル
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含むサンプル、
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む実施態様6に記載の方法。
(8)前記第1のレドックス試薬システム用酵素の前記決定された検体特異性は前記第2のレドックス試薬システム用酵素に関するものである実施態様7に記載の方法。
(9)前記第1のレドックス試薬システム用酵素は非天然産レドックス試薬システム用酵素である実施態様8に記載の方法。
(10)前記第2のレドックス試薬システム用酵素は天然産レドックス試薬システム用酵素である実施態様8に記載の方法。
【0089】
(11)前記方法は、さらに、前記検出された電気信号を用いて前記サンプル中の前記酵素の活性を決定する実施態様1に記載の方法。
(12) レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル。
(13)
(a)レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル、および
(b)レドックス試薬システム用酵素と既知量の酵素基質とを含む液体媒体
を備えるシステム。
【産業上の利用可能性】
【0090】
上述のように、本発明の方法、電気化学セル、システムおよびキットは検体検出試験、例えば臨床実験室の試験、家庭における試験等を始めとする種々の用途に有用であり、種々の疾患状態の診断および管理に有効である。特に、糖尿病管理のためのグルコース、コレステロール等の検体検出に適している。
【図面の簡単な説明】
【0091】
【図1】本発明の例示的実施の形態に従うs−GDHの野生型とs−GDH変異形態を試験する方法における一連のステップを示すフローチャートである。
【図2】(A)は、本発明の例示的方法において使用することができる試験片の展開図である。(B)は、本発明の例示的方法において使用することができる試験片の上面図である。
【図3】本発明の例示的実施の形態に従う野生型のs−GDHとその変異体の活性を測定するための方法における一連のステップを示すフローチャートである。
【図4】従来の酵素を塗布した試験片を用いた、野生型s−GDHとs−GDHの2つの変異形態(Asn452ThrおよびAsp167Glu)の、干渉糖を含まない対照に対する絶対バイアスをキシロース濃度の関数として示すグラフである。
【図5】酵素が野生型s−GDHである従来の酵素を塗布した試験片について応答を糖濃度の関数として示すグラフである。
【図6】本発明の方法において野生型s−GDHを用いて応答を糖濃度の関数として示すグラフである。
【図7】本発明の方法においてs−GDHの変異形態であるAsn452Thrを用いて応答を糖濃度の関数として示すグラフである。
【図8】本発明の方法においてs−GDHのもう1つの変異形態であるAsp167Gluを用いて応答を糖濃度の関数として示すグラフである。
【図9】本発明の方法において得られた野生型s−GDH用の標準曲線を示すグラフである。
【図10】図9に示す標準曲線を両軸逆数プロット法で示すグラフである。
【符号の説明】
【0092】
100 方法
110 ステップ
130 ステップ
140 ステップ
150 ステップ
160 ステップ
170 ステップ
200 試験片
202 作用電極
204 参照電極
206 スペーサー層
208 試薬
210 切欠き部
300 方法
310 ステップ
320 ステップ
330 ステップ
340 ステップ
350 ステップ
360 ステップ
【技術分野】
【0001】
本発明はレドックス試薬システム用酵素の特性決定方法および組成物に関する。さらに詳しくは、本発明はレドックス試薬システム用酵素の特性決定方法、電気化学セルおよびこれを備えるシステムに関する。
【背景技術】
【0002】
生理学的液体またはサンプル、例えば血液または血液由来生成物中の検体の検出は今日の社会においてはその重要性が増す一方である。検体検出試験は、臨床実験室の試験、家庭における試験等を始めとする種々の用途があるが、これらの場合、そのような試験の結果は種々の疾患状態の診断および管理に卓越した役割を果たしている。関心のある検体としては糖尿病管理のためのグルコース、コレステロール等が挙げられる。検体検出の重要性がこのように増大していることに応じて、種々の検体検出プロトコルおよび装置が臨床用と家庭用の双方について開発されている。
【0003】
検体検出に用いられる方法の一つのタイプは電気化学的方法である。かかる方法では少なくとも2つの電極すなわち参照電極と作用電極を備える電気化学セル内の反応ゾーンに水系液体サンプルを置く。分析すべき成分を直接電極と反応させるか、あるいはレドックス試薬と直接または間接に反応させて酸化性(または還元性)物質を分析すべき成分、すなわち検体に相当する量形成する。存在する酸化性(または還元性)物質の量を電気化学的に測定し、最初のサンプル中に存在する検体の量と関連づける。
【0004】
検体に対する多くのそのような電気化学的アプローチにおいて、酵素成分とメディエイター成分とを含む検体酸化信号生成システムが用いられている。この検体酸化信号生成システムでは、酵素成分は関心のある検体を酸化し、次いで電子をメディエイターに伝達し、このメディエイターは、今度は、その電子を電気化学セルの電極に伝達することにより、電気信号を生成し、この電気信号に基づいて検体濃度を決定することができる。
【0005】
電気化学的検体検出試験およびシステムの設計においては、検体に特異的な酵素を用いるのが望ましい。例えば、グルコースを測定するには、可溶性形態のピロロキノリンキノン(PQQ)依存グルコースデヒドロゲナーゼ(以下、s−GDHという)がグルコース酸化シグナル生成システムにおいて使用することができる酵素の一例である。s−GDHは貧電子供与体であるため、好都合なことに、液体サンプル中の酸素の存在に非感受性である。
【0006】
しかしながら、天然または「野生型」s−GDHの欠点は、グルコースだけでなく、マルトース、ガラクトース、ラクトース、マンノース、キシロースおよびリボースを含む他の還元糖を酸化することである。グルコース以外の糖類に対するs−GDHの反応性は、ある場合には、糖尿病患者によっては血中グルコース濃度決定の正確さを損なうことがある。例えば、イコデキストリン(グルコースのポリマー)を措置された腹膜透析患者は血中に高濃度のマルトースを含んでいることがある。
【0007】
このようにs−GDHが特異性を欠いているので、例えば1種以上のアミノ酸が置換したこの酵素の変異種を生成することによってs−GDHを改良する努力がなされるようになった。しかしながら、そのような「変えられた」酵素を使用できるようにするには、検体検出試験に使用するのに適しているか否かを決定する必要がある。
【0008】
時間のかかる分光測光法がs−GDHの活性の測定に使用されてきたが、酵素律速条件下でのみ使用されている。2,6−ジクロロフェノールインドフェノール(DCIP)とフェナジンメトスルフェート(PMS)を人工メディエイターとして使用する分光測光測定法が、例えば特許文献1および特許文献2に記載されている。
【0009】
しかしながら、典型的な市販の、グルコースを使用したグルコース試験片は酵素律速条件を用いていない。その理由は長期間の試験片の性能を保証するように酵素が過剰に存在するからである。組換えタンパク質、例えばs−GDHの変異形態は一般にごく小量だけ産生される。s−GDHのこれらの変異形態の反応性の試験は、酵素を塗布した試験片を作成し、グルコースおよび干渉(すなわち、還元)する可能性のある各糖を種々の濃度で添加した全血または血漿を用いて試験片の各ロットを試験することを含む。s−GDHの各変異形態を塗布した試験片の製造は各変異体を多量に必要とし、時間および労力集約的であり、かつ技術者が生体有害物質である可能性のある、人の血液または血漿を用いて試験片を試験することを必要とする。
【0010】
従って、野生型s−GDHよりもグルコース特異性が改善されているために特定の変異体酵素、例えばs−GDHの大量生産が保証されるかを決定するために迅速かつ安価な、基質律速的試験法が必要とされる。この試験法は、還元糖を添加した全血または血漿サンプルではなく、グルコースまたは干渉糖類を添加した、血液を含まないサンプルにも適用可能でなければならない。
【0011】
【特許文献1】米国特許第6,103,509号明細書
【特許文献2】欧州特許出願公開第1176202号明細書
【特許文献3】米国特許第5,484,708号明細書
【特許文献4】米国特許第5,723,284号明細書
【特許文献5】米国特許第5,834,224号明細書
【特許文献6】米国特許第5,942,102号明細書
【特許文献7】米国特許第5,972,199号明細書
【特許文献8】米国特許第5,997,817号明細書
【特許文献9】米国特許第6,059,946号明細書
【特許文献10】米国特許第6,083,710号明細書
【特許文献11】米国特許第6,103,509号明細書
【特許文献12】米国特許第6,121,009号明細書
【特許文献13】米国特許第6,134,461号明細書
【特許文献14】米国特許第6,179,979号明細書
【特許文献15】米国特許第6,193,973号明細書
【特許文献16】米国特許第6,231,531号明細書
【特許文献17】米国特許第6,284,125号明細書
【特許文献18】米国特許第6,340,428号明細書
【特許文献19】米国特許第6,444,115号明細書
【特許文献20】米国特許第6,716,577号明細書
【特許文献21】米国特許出願公開第2003/0104595号明細書
【特許文献22】国際公開第99/49307号パンフレット
【特許文献23】国際公開第97/18465号パンフレット
【特許文献24】国際公開第01/57510号パンフレット
【特許文献25】国際公開第01/57238号パンフレット
【特許文献26】国際公開第02/48707号パンフレット
【特許文献27】国際公開第02/50609号パンフレット
【特許文献28】国際公開第02/06788号パンフレット
【特許文献29】欧州特許第0969097号明細書
【特許文献30】欧州特許第1176202号明細書
【特許文献31】特開平09−1403378号公報
【特許文献32】英国特許第2304628号明細書
【発明の開示】
【発明が解決しようとする課題】
【0012】
従って、s−GDHの変異形態の炭水化物特異性を決定するのに使用する迅速かつ簡単な方法であって、少量の酵素を使用し、かつ液体サンプル(例えば、全血または血漿)中の検体(例えば、グルコース)を測定するための典型的な電気化学に基づく試験片上の基質律速条件をモデルとするものがこの分野で依然として必要とされている。さらに、酵素活性を迅速かつ簡単に測定する方法も望まれている。従って、本発明の目的は上述のような課題を解決したレドックス試薬システム用酵素の特性決定方法、電気化学セルおよびこれを備えるシステムを提供することである。
【課題を解決するための手段】
【0013】
本発明はレドックス試薬システム用酵素を特性決定する方法および組成物を提供する。本発明の方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、本発明は主題の電気化学セルを含む電気化学試験片並びにこれを含むシステムおよびキットを提供する。本発明はレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【発明の効果】
【0014】
本発明により、レドックス試薬システム用酵素を特性決定する便利かつコスト効率のよい方法、これに用いる電気化学セル、これを備えるシステムを提供することができる。また、血液または血液製品を使用せずに試験することができる。
【発明を実施するための最良の形態】
【0015】
本発明の特長および利点は、本発明の原理を用いる例示的な実施の形態を記載する以下の詳細な説明および添付図面を参照すればよりよく理解される。
【0016】
本発明はレドックス試薬システム用酵素を特性決定する方法および組成物を提供する。本発明の方法を実施するには、レドックス試薬システム用酵素と既知量の基質を含むサンプルを、レドックス試薬システム用メディエイターを有する無酵素試薬組成物を含む電気化学セルに適用する。また、本発明は主題の電気化学セルを含む電気化学試験片並びにこれを含むシステムおよびキットを提供する。本発明はレドックス試薬システムの特性決定を始めとする種々の用途を有する。
【0017】
本発明をさらに詳細に説明する前に、本発明は以下に説明される特定の実施の形態に限定されず、それら特定の実施の形態の変形例が可能でありそれらも依然として特許請求の範囲内であることが了解されるべきである。また、用いられている用語は特定の実施の形態を説明するものであり、なんら限定する意図はなく、本発明の範囲は特許請求の範囲によって決定されることが了解されるべきである。
【0018】
本明細書において、文脈上そうでないとする明確な指示がない限り、単数形の表現は複数の場合も含む。特に別の定義がなされていない限り、ここに使用されている技術用語および科学用語はすべて本発明の属する技術分野において通常の知識を有するものに普通に理解されるのと同じ意味を有する。
【0019】
数値範囲が記載されている場合、文脈上そうでないとする明確な指示がない限り、下限の単位の10分の1までの、その範囲の上限と下限の間にある各中間値、および述べられた範囲内の述べられた値または中間値は本発明の範囲内である。これらの小範囲の上限および下限はより小さい範囲に含まれていてもよく、その場合も本発明の範囲内にある。ただし、述べられた範囲内の特に除外された限界点は除かれる。述べられた範囲が上下限の一方または双方を含む場合、それら含まれている上下限の一方または双方を除外した範囲も本発明の範囲内に含まれる。
【0020】
特に別の定義がなされていない限り、本明細書に使用されている技術用語および科学用語はすべて本発明の属する技術分野において通常の知識を有するものに普通に理解されるのと同じ意味を有する。ここに記載されたものと同様または均等である任意の方法、装置および材料を本発明の実施および試験において使用することができるが、好適な方法、装置および材料を以下に説明する。
【0021】
本明細書において言及されている刊行物はすべて、それら刊行物中に記載されており本発明に関して使用することができる細胞系統、ベクターおよび方法を記載し開示する目的で本明細書において参照され、本発明の一部を構成する。
【0022】
上に要約したように、本発明は酵素を特長付ける方法および組成物を提供する。さらに説明すると、まず、本発明の方法およびそれらの代表的な特定の用途を詳細に説明し、次いで本発明の方法を実施するのに使用される代表的な組成物およびシステムを説明する。
【0023】
方法
上に要約したように、本発明は酵素の特性決定方法を提供する。酵素の特性決定は酵素の特徴またはパラメータを決定することを意味する。この特徴は酵素に特有の特徴、例えば基質特異性、または少なくとも部分的にその環境に依存する特徴、例えば所与の液体媒体中の酵素の濃度、所与の液体媒体中の酵素の活性であってもよい。もちろん、この特徴は特有要因と環境要因との積であってもよい。本発明の方法を用いて決定することができる特定の代表的特徴について以下に詳細に説明する。
【0024】
本発明の方法は、サンプルを含有するレドックス試薬システム用酵素を電気化学セルに適用し、この電気化学セルにより生成された電気信号を検出し、その際検出された信号を用いてサンプル中のレドックス試薬システム用酵素を特性決定する。
【0025】
本発明のある代表的な実施の形態の特長は、電気化学セルに接触したサンプルはレドックス試薬システムの酵素と既知量の酵素基質を含み、一方サンプルが適用される電気化学セルは、サンプル中の酵素が一員であるレドックス試薬システムのメディエイター成分を含む無酵素試薬組成物を含むことである。本発明方法のこれらの実施の形態において用いられるサンプルおよび電気化学セル成分については、別に詳細に説明する。
【0026】
サンプル
本発明方法を実施する際に電気化学セルと接触するサンプルはレドックス試薬システム用酵素と既知量の基質またはその酵素の基質である可能性のあるもの、すなわち酵素基質とを含む。
【0027】
酵素
多くの実施の形態において、サンプルの酵素成分は単一種の酵素または関心のある検体を共働して酸化する複数種の酵素である。換言すれば、酵素のメンバーは、単一検体酸化酵素または関心のある所与の検体を共働して酸化する2種以上の酵素の一群からなっていてもよく、電気化学セル内で以下のように電気化学信号を生成することができるものである。関心のある酵素としては、オキシダーゼ、デヒドロゲナーゼ、リパーゼ、キナーゼ、ジアホラーゼ、キノンタンパク質等が挙げられる。関心のある特定の代表的酵素としては、限定されないが、グルコースオキシダーゼ、グルコースデヒドロゲナーゼ、コレステロールエステラーゼ、コレステロールオキシダーゼ、リポタンパク質リパーゼ、グリセロールキナーゼ、グリセロール−3−燐酸オキシダーゼ、乳酸オキシダーゼ、乳酸デヒドロゲナーゼ、ピルビン酸オキシダーゼ、アルコールオキシダーゼ、ビリルビンオキシダーゼ、ウリカーゼ等が挙げられる。関心のある、ある実施の形態では、酵素は、以下に詳細に説明する、グルコースデヒドロゲナーゼ、例えばs−GDHまたはその変異体である。
【0028】
ある実施の形態では、酵素成分は約35〜450μM、通常約80〜約270μMの範囲内の濃度で存在していてもよい。
【0029】
酵素基質
本発明方法で用いられるサンプルはまた既知量の酵素基質を含む。酵素基質はサンプル中に存在する酵素の既知の基質でもよく、あるいはサンプル中の酵素の候補基質であってもよい。例えば、酵素がグルコースデヒドロゲナーゼである場合、サンプル中の基質はグルコース(同酵素の基質として知られている)または同酵素の基質であることが知られている、あるいは同酵素の基質であることが疑われる他の糖、例えばマルトースであってもよい。既知量とは、サンプルが定義されたまたは所定の量もしくは濃度の基質を有することを意味する。ある実施の形態では、サンプル中の酵素基質の濃度は約0〜約50mM(約0〜約900mg/dL)、通常約0〜約45mM(約0〜約810mg/dL)の範囲内である。ある実施の形態では、酵素基質が確実に存在するときは、サンプル中の酵素基質の濃度は約0.1〜約50mM(例えば約0.01〜約900mg/dL)、通常約0.1〜約45mM(例えば、約0.01〜約810mg/dL)の範囲内である。
【0030】
補酵素
ある実施の形態では、液体媒体のサンプルは酵素成分を活性化する補酵素も含む。関心のある補酵素の一例はピロロキノリンキノン(PQQ)である。他の関心のある補因子(コファクター)としては、限定されないが、試験試薬に適用される酵素のタイプに応じて、ニコチンアミドアデニンジヌクレオチド(NAD)、フラビンアデニンジヌクレオチド(FAD)、チトクローム等が挙げられる。ある実施の形態では、任意の補酵素の濃度は約60〜約670μM、通常約100〜約430μMの範囲内であってもよい。
【0031】
酵素補因子
ある実施の形態では、サンプルはさらに、1種以上の酵素補因子を含む。関心のある酵素補因子としては二価の金属カチオン類、例えばCa2+、Mg2+等が挙げられる。いずれの補因子の濃度も約0.5〜約5mMの範囲内であってもよい。
【0032】
電気化学セル
上に要約したように、本発明方法を実施する際に、無酵素試薬組成物を含む電気化学セルにサンプルを適用する。種々の電気化学セルの構成が知られている、米国特許第5,723,284号、同第5,834,224号、同第5,942,102号、同第5,972,199号、同第5,997,817号、同第6,083,710号、同第6,121,009号、同第6,134,461号、同第6,193,873号および同第6,716,577号明細書に記載されているものが含まれる。上記米国特許公報明細書は本明細書において参照されることにより、本発明の一部を構成する。さらに、他の特許文献、WO99/49307、WO97/18465、WO01/57510、WO01/57238、WO02/50609、EP0969097A2およびGB2304628も含まれる。これらの優先権書類が米国出願である場合は、この米国出願は本明細書に参照されることにより本発明の一部を構成する。当業者に知られている任意の電気化学セルを本発明の組成物を含むように改変することができる。
【0033】
ある実施の形態では、電気化学セルは電気化学試験片に存在する。本発明の電気化学試験片を図2Aおよび図2Bに示す。図2Aは電気化学試験片の展開図であり、この電気化学試験片は作用電極と、参照電極と、これらを分離するスペーサー層からなる。スペーサー層は組み立てられた試験片において反応ゾーンまたは領域を画定する切欠き部を有する。これらの要素は以下においてさらに説明する。図2Bは組み立てられた形のサンプル試験片を示す。種々の部品のそれぞれについて以下にさらに詳細に説明する。
【0034】
電極
本発明に従う試薬組成物を含む電気化学試験片は作用電極と参照電極とを備える。一般に、作用電極と参照電極は細長い矩形状のストリップの形に構成される。典型的には、これら電極の長さは約1.9〜約4.5cm、通常約2〜約2.8cmの範囲内である。これら電極の幅は約0.38〜約0.76cm、通常約0.51〜約0.67cmの範囲内である。参照電極の厚さは、典型的には、約10〜約100nm、通常約18〜約22nmの範囲内である。ある実施の形態では、1つの電極の長さが他の電極の長さが短く、ある実施の形態では、その長さは約0.32cm短い。
【0035】
作用電極と参照電極はさらに、試験片の反応領域に面する、電極の少なくとも表面は導電性材料、例えば金属その他の導電性材料で構成されている。関心のある導電性材料としては、限定されないが、パラジウム、金、白金、銀、イリジウム、炭素、ドープされた酸化スズ、ステンレス鋼等が挙げられる。ある実施の形態では、導電性材料は金または白金である。原則として、電極全体を導電性材料で作製することができるが、各電極は一般に不活性支持材料の表面に電極の導電性材料成分の薄層が存在するものから成る。任意の好適な不活性基材を本発明における電極に用いることができるが、典型的には、基材は電極、ひいては試験片全体に構造的支持を提供することができる剛性材料である。基材として使用することができる好適な材料としては、プラスチック類、例えばPET、PETG、ポリイミド、ポリカーボネート、ポリスチレン、シリコン、セラミック、ガラス等が挙げられる。
【0036】
スペーサー層
本発明の電気化学試験片の特長は、上述の作用電極と参照電極が相互に対向し、ごく短い距離しか離れておらず、電気化学試験片の反応ゾーンまたは領域作用電極と参照電極との間の距離が非常に小さい。本発明の試験片の作用電極と参照電極のスペースがこのように最小になっているのは、作用電極と参照電極との間に配置または挟まれた薄いスペーサー層が存在する結果である。このスペーサー層の厚さは、一般に、約1〜約500μm、通常約100〜約200μmの範囲内である。スペーサー層は切断して反応ゾーンまたは領域と少なくともこの反応ゾーンへの入口と、一般には反応ゾーンからの出口も併せ備える。代表的なスペーサー層構成を図2Aおよび図2Bに示す。スペーサー層はこれらの図においては入口および出口穴またはポートを刻設した円形反応領域を有するものとして示されているが、他の構成、例えば正方形、卵形、三角形、矩形、不規則形状の反応領域等も可能である。スペーサー層は任意の好適な材料で作製することができるが、代表的な好適な材料としてはPET、PETG、ポリイミド、ポリカーボネート等が挙げられる。この場合、スペーサー層の表面を処理してそれぞれの電極に対して接着性を持つようにし、それによって電気化学試験片の構造を維持するようにすることができる。特に関心があるのはダイキャスト両面接着ストリップをスペーサー層として使用することである。
【0037】
反応ゾーン
本発明の電気化学試験片は作用電極、参照電極およびスペーサー層によって画定される反応ゾーンまたは領域を備える。これらの要素は上述した通りである。詳しくは、作用電極と参照電極は反応領域の上面と下面を画定し、一方スペーサー層は反応ゾーンの壁を画定する。反応領域の容積は少なくとも約0.1μL、ふつう少なくとも約1μL、もっとふつうには少なくとも約1.5μLである。この場合、容積は10μLまたはそれ以上であってもよい。上述のように、反応領域は一般に少なくとも入口ポートを備え、多くの実施の形態においては出口ポートも備える。入口ポートと出口ポートの断面積は反応領域に対して液体の有効な出入り口を提供するのに十分な大きさである限り、それぞれ変えてもよいが、一般に約9×10-5〜約5×10-3cm2の範囲内、ふつう約5×10-4〜約2.5×10-3cm2の範囲内である。
【0038】
無酵素試薬組成物
反応ゾーン内には無酵素試薬処方が存在し、この試薬処方は典型的には乾燥形態で存在する。無酵素とは、電気化学セルで測定すべきサンプル中に存在する、少なくともレドックス試薬システム用酵素を含まないことを意味する。そのようなものとして、電気化学セルに適用されるサンプルがグルコースデヒドロゲナーゼを含むならば、電気化学セル中に存在する試薬処方はグルコースデヒドロゲナーゼを含まず、そして多くの実施の形態においては、いずれの酵素も含まない。
【0039】
電気化学セル内に存在する無酵素処方の特長は、レドックスメディエイターが存在することであり、このレドックスメディエイターは1種以上のメディエイター剤を含んでいてもよい。メディエイターは(検体酸化の際に検体から1つ以上の電子を取得した)酵素から電極への電子伝達を容易にする媒介物として動作する。当技術において知られている種々のメディエイター剤を使用することができる。それらのメディエイター剤としてはフェリシアナイド、フェナジンエトスルフェート、フェナジンメトスルフェート、フェニレンジアミン、N,N,N’,N’−テトラメチルフェニレンジアミン、1−メトキシフェナジンメトスルフェート、2,5−ジメチル−1,4−ベンゾキノン、2,6−ジメチル−1,4−ベンゾキノン、2,5−ジクロロ−1,4−ベンゾキノン、フェロセン誘導体、オスミウム−ビピリジル錯体、ルテニウム錯体等が挙げられる。
【0040】
試薬組成物のもう1つの成分はメディエイター安定化緩衝成分である。このメディエイター安定化緩衝成分は、1種以上、例えば2種、3種、4種以上の異なる緩衝剤からなり、緩衝成分は乾燥形態で組成物を保存する間、メディエイターが使用前、例えば保存中にほとんど還元されないように、メディエイターを安定化する。
【0041】
一実施の形態では、緩衝剤はポリカルボン酸類である。ポリカルボン酸とは、緩衝剤が2種以上のカルボン酸官能部分を含ことを意味し、この場合、異なるカルボン酸官能部分の数は約2〜約10、例えば約2〜約8、約2〜約6を含む範囲内であってもよい。この緩衝剤のカルボン酸基または官能部分は、脂肪族、脂環式、芳香族およびヘテロ環式構造を含む多数の異なる構造に結合していてもよい。1種を超えるカルボン酸基が存在していると、少なくとも1つのpKa値を所望の範囲内に与える有利な効果を持つことができる。関心のある特定のポリカルボン酸としては、限定されないが、メリット酸、シトラコン酸、マレイン酸等のポリマーが挙げられる。
【0042】
試薬組成物が乾燥試薬処方の場合、例えば、以下に詳細に説明するように、電気化学試験片に存在しているような場合、その乾燥組成物中に存在する緩衝成分の量は典型的には約0.01〜約40.00%w/w、ふつう約1〜約10%w/wである。
【0043】
試薬組成物はさらに1種以上の下記の追加成分:湿潤剤、洗剤安定剤、粘度調節剤、またはそれらの組み合わせを含んでいてもよい。
【0044】
若干の実施の形態においては湿潤剤を洗剤と組み合わせて試薬組成物に添加して、試薬組成物を電気化学試験片上に均一に塗布するのを容易にすることができる。複数の1種以上の組み合わせの剤を用いてもよい。これらの剤を使用すると試験試薬の溶解を改善するとともに毛細管充填ストリップの灯心特性を向上させることがある。これらの剤としては当技術において知られているもの、例えばポリマー類、消泡剤、界面活性剤が挙げられる。関心のある界面活性剤/洗剤の代表例としては、限定されないが、トリトン、マコール、テトロニクス、シルウェット、ゾニルおよびプルロニックが挙げられる。好適な剤としては、ポリエチレンオキサイドとポリプロピレンオキサイドのブロック共重合体であるプルロニック材料が挙げられる。プルロニック材料の例としては、良好な湿潤性を有するプルロニックP103および良好な洗剤特性を有するプルロニックF87プリルが挙げられる。プルロニックP103とプルロニックF87プリルはともに80℃を超える曇り点を有しており、この性質により乾燥工程中の組成物の相変化が避けられるので好ましい。
【0045】
試薬組成物に安定剤も添加して酵素を安定化し、タンパク質の変性を防止するようにしてもよい。安定剤はまたメディエイター、特に酸化されたレドックスメディエイターのレドックス状態を安定化するのを助ける。安定剤の例としては、限定されないが、炭水化物類(例えば、スクロース、トレハロース、マンニトール、およびラクトース)、アミノ酸類、タンパク質類(例えばBSAおよびアルブミン)および有機化合物、例えばEDTA等が挙げられる。
【0046】
粘度調節剤を試薬に添加して液体試薬のレオロジーを調節するようにしてもよい。そのような粘度調節剤の例としてはポリ(アクリル酸)、ポリ(ビニルアルコール)、デキストラン、BSA等が挙げられる。
【0047】
方法
本発明の方法を実施する際に、第1のステップは、例えば電気化学試験片の電気化学セル内にある量の液体媒体またはサンプルを導入することである。サンプル調製と反応領域への適用との間の時間は変化してもよいが、ある代表的な実施の形態においては、約30秒〜約8時間、例えば約5分〜約3時間の範囲内であり、約30分〜約60分を含む。電気化学セルの反応領域内に導入されるサンプルの量は変化してもよいが、一般に約0.05〜約10μL、ふつう約0.5〜約1.6μLの範囲内である。サンプルは任意の従来の手順を用いて反応領域内に導入することができる。この場合、サンプルを適宜反応領域内に注入したり、反応領域に灯心現象により滲み込ませたりすることができる。
【0048】
反応ゾーンにサンプルを適用した後、作用電極と参照電極を用いて電気化学測定を行う。電気化学測定は試験と電気化学試験片を用いる装置の特定の性質によって、例えば試験が電量測定か、電流測定か、電位差測定であるかによって変化して行ってもよい。一般に、電気化学測定は電荷(電量測定)、電流(電流測定)または電位差(電位差測定)を測定し、ふつうは反応領域内にサンプルを導入した後で所与の期間にわたって行われる。上述の電気化学測定を行う方法の詳細は米国特許第4,224,125号、同第4,545,382号および同第5,266,179号明細書、並びにWO97/18465、WO99/49307に記載されている。これらの記載内容は本明細書において参照されることにより、本発明の一部を構成する。
【0049】
上述のように反応ゾーン内で生成された電気化学信号を検出した後、この信号を用いてサンプルの酵素をある方法で、例えば酵素に対する基質特異性を決定する、電気化学セルに適用されたサンプル中の酵素の濃度を決定する等により特性決定する。この場合、これら2つの代表的応用例は以下に詳細に説明する。ある実施の形態では、電気化学信号測定ステップおよび酵素特性決定ステップは、上述のように、試験片を用いサンプルを電気化学セルに適用した後そのような工程を行うように動作するように設計された装置により自動的に行われる。これらのステップの少なくともあるものを自動的に行うための代表的な読取装置の詳細が米国特許第6,193,873号明細書に記載されている。この記載内容は本明細書において参照されることにより本発明の一部を構成する。
【0050】
用途
上述のように、本発明方法は種々の用途を有する。代表的な用途は上述のような酵素特性決定用途である。
【0051】
本発明方法により達成することができる第1の代表的な酵素特性決定用途は、1種以上の追加の酵素と比較して第1の酵素の基質または検体特異性、例えば変異体グルコースデヒドロゲナーゼのグルコースに対する特異性を他の還元糖、例えばマルトースと比較して決定することである。この場合、特異性は第2のグルコースデヒドロゲナーゼ、例えば野生型デヒドロゲナーゼに関して決定される。
【0052】
本発明のこれらの代表的応用例を実施する際に、少なくとも、第1および第2の酵素を第1および第2の酵素基質と組み合わせて含む1組の液体サンプルを調製し、次いで各調製されたサンプルを個別に電気化学セル内で試験する。個別に試験するとは、上記1組のサンプルの各サンプルをその自身の電気化学セルまたは別の電気化学セル内で試験することを意味する。
【0053】
これらの実施の形態のうちのあるものにおいては、調製され、次いで本発明方法に従って電気化学セルに個別に適用される上記1組のサンプルは下記を含む。
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含有するサンプル;
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含有するサンプル;
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含有するサンプル;および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含有するサンプル。
【0054】
ある実施の形態では、上述の特異性試験は各酵素を第1および第2の酵素基質を異なる濃度で、例えば第1および第2の酵素基質の複数の異なる濃度で試験することを含む。そのような実施の形態において、少なくとも下記の追加のサンプルを調製し、試験する。
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含有するサンプル;
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含有するサンプル;
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含有するサンプル;および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含有するサンプル。
【0055】
これらの応用例の代表的実施の形態は、異なるs−GDH酵素の基質特異性、すなわち基質としてグルコースを使用するが競合する還元糖を使用しない能力を評価することである。この実施の形態は図1にさらに詳細に示されている。図1は本発明の例示的実施の形態に従ってs−GDHの野生型と変異形態を試験する方法100のフローチャートである。方法100はステップ110に示すように、電気化学セルを用意することを含む。本発明に従う工程を用いて使用することができる典型的な電気化学セルは、図2Aおよび図2Bの展開図および上面図に示すように、試験片200の形で用意される。試験片200は作用電極202と参照電極204とがスペーサー層206で分離されてなる。作用電極202は、緩衝されたメディエイター、界面活性剤および安定剤を含む乾燥した試薬208の帯を備える。スペーサー層206は組立てられた試験片の電気化学セルの反応ゾーンを画定する切欠き部210を備える。
【0056】
上述のように、参照電極204用の好適な材料は作用電極202用に記載したものが挙げられる。対向電極形式の参照電極204用の材料はふつうパラジウムまたは金である。電極が同一平面にある形式の電気化学セルでは、参照電極204はふつう炭素である。
【0057】
参照電極204はふつう、分子構造中にイオウ部分を含有する安定剤をコーティングされている。このコーティングは親水性基と、イオウ含有部分と親水性基との間のスペーサーとを含んでいてもよい。参照電極204のコーティングに使用できる化合物の例としては、限定されないが、2−メルカプトエタンスルホン酸、2−メルカプトエタノール、2−メルカプトエチルアミン、3−メルカプトプロピオン酸、チオフェン、4−カルボキシチオフェン、システイン、ホモシステイン、およびシスチンが挙げられる。参照電極204はふつう2−メルカプトエタンスルホン酸をコーティングした金から成る。
【0058】
乾燥された試薬208は欧州特許出願公開1324038号(A2)明細書に記載されているようなスロットコーティングにより作用電極202上に塗布することができる。同明細書の記載内容は本明細書において参照されることにより本発明の一部を構成する。試薬を塗布する他の方法としては、限定されないが、インクジェット法およびニードルコーティング法が挙げられる。
【0059】
スペーサー層206は切断されて反応ゾーン内への入口ポートを少なくとも有し、一般に反応ゾーンからの出口ポートを有する反応ゾーンを設けている。スペーサー層206は図2Aおよび図2Bにおいて側面に入口穴および出口穴を刻設した円形反応領域を有するものとして示されている。他の反応領域構成としては、限定されないが、正方形、卵形、三角形、矩形、不規則形状の反応領域等が挙げられる。スペーサー層206は任意の好適な材料で作製することができるが、この好適な材料としては、限定されないが、PET、PETG、ポリイミド、ポリカーボネート等が挙げられる。それにより、スペーサー層206の表面を処理して接着性を持つようにすることができる。スペーサー層206は典型的にはダイキャスト両面接着ストリップである。
【0060】
メディエイターとしてはフェリシアナイド、フェナジンエトスルフェート、フェナジンメトスルフェート、フェニレンジアミン、N,N,N’,N’−テトラメチルフェニレンジアミン、1−メトキシフェナジンメトスルフェート、2,5−ジメチル−1,4−ベンゾキノン、2,6−ジメチル−1,4−ベンゾキノン、2,5−ジクロロ−1,4−ベンゾキノン、フェロセン誘導体、オスミウム−ビピリジル錯体、ルテニウム錯体等が挙げられる。好適な緩衝化剤としては二価金属カチオン(例えば、Ca2+)に対してほとんど結合親和性を持たず、シトラコン酸塩、クエン酸塩、リンゴ酸、マレイン酸、燐酸塩、「グッド(Good)」緩衝剤等を使用することができる。さらに、緩衝された溶液はトリトン、マコール、テトロニクス、シルウェット、ゾニルおよびプルロニックを含む界面活性剤または湿潤剤;スクロース、トレハロース、マンニトール、およびラクトースを含む安定剤を含有していてもよい。好適な実施の形態では、メディエイターはフェリシアナイドであり、緩衝剤はシトラコン酸塩であり、界面活性剤はプルロニックであり、安定剤はスクロースである。
【0061】
次に、方法100のステップ120に記載されているように、緩衝された溶液中のs−GDHの野生型または少なくとも1種の変異形態を補酵素、補因子および種々の濃度の第1の還元糖(例えば、グルコース)と混合する。第1の還元糖は、限定されないが、グルコース、ガラクトース、マルトース、キシロースまたはラクトースであってもよい。補酵素はPQQであってもよく、補因子はカルシウムであってもよい。
【0062】
方法100および300(下記参照)を含む本発明の方法において使用されるs−GDHは、任意の天然型のs−GDHまたは変異形態であってもよく、変異形態のs−GDHは天然の酵素のアミノ酸配列中に、限定されないが、1個以上のアミノ酸の置換または欠失させてグルコース特異性を改善することを含む、少なくとも1つの修飾がなされているものである。当業者に知られた技法を用いてこれらの修飾をs−GDHに施すことができるが、これらの技法は上述の米国特許第6,103,509号明細書および欧州特許出願公開第1176202号(A1)明細書に記載されている。これらの記載内容は本明細書において参照されることにより本発明の一部を構成する。野生型酵素の変異体を作製する一般的方法は当業者には周知である。
【0063】
図1のステップ130に示すように、緩衝されたメディエイター、界面活性剤および安定剤を含有するそれぞれ別個の電気化学セルに酵素/等溶液を添加する。次に、ステップ140に示すように、電流応答を測定し、糖濃度の関数としてグラフ化する。電流応答を測定するまで酵素/糖溶液をメディエイターから分離しておくのが有利であるが、その理由は酵素とメディエイターの間の反応速度が速いからである。溶液を電気化学セルに添加する前に酵素とメディエイターが混合されると、電流応答を測定する前に反応が完了またはほぼ完了してしまう。次いで、ステップ150(実施例2〜4)に示すように、少なくとも1種の追加の還元糖と少なくとも1種の追加の変異形態s−GDHについてステップ110ないし140を繰り返す。この少なくとも1種の追加の還元糖は、限定されないが、ガラクトース、マルトース、キシロースまたはラクトースであってもよい。次に、ステップ160およびステップ170に示すように、この少なくとも1種の追加の還元糖に対する応答が低下したs−GDHの変異型を選択する。
【0064】
このようにして、変異形態s−GDHの野生型s−GDHに関する特異性を容易に決定することができる。
【0065】
もう一つの代表的応用例では、本発明方法を用いて液体サンプル中の酵素の濃度または活性を決定する。これらの方法を実施する際に、未知量の酵素と既知量の基質を含有する液体サンプルを電気化学セルに適用する。適用後、検出された電気信号を用いて、適用されたサンプル中の検体の濃度を、例えば上述の検出された電気信号を基準と比較することによって決定する。
【0066】
図3は、サンプル中の野生型のs−GDHとその変異体の活性を測定するための本発明の方法300における一連のステップを示すフローチャートである。方法300は、ステップ310に示すように、界面活性剤と安定剤とともに緩衝液中に乾燥したメディエイターを含む電気化学セルを用意する。次に、ステップ320に示すように、増加する一連の濃度の野生型s−GDHまたはs−GDHの変異形態を一定量のグルコースと混合する。次いで、ステップ330に示すように、各酵素/グルコースサンプルを別個の電気化学セルに添加する。ステップ340に示すように、電流応答を各サンプルについて測定し、電流応答を酵素濃度の関数としてグラフ化して標準曲線を作成し、これを後続のステップにおける基準として用いることができる。次に、ステップ350に示すように、s−GDHの野生型または変異形態の少なくとも1つの追加のロットについてステップ310ないし340を繰り返す。次いで、ステップ360に示すように、このs−GDHの野生型または変異形態の少なくとも1つの追加のロットの酵素濃度を標準曲線すなわち基準から、例えば、検出された信号を基準と比較することにより、読取る。
【0067】
システム
本発明はまた本発明方法を実施する際に使用するシステムを提供する。これらのシステムは、上述のように、レドックス試薬システム用酵素を含む少なくとも1種のサンプルまたは液体媒体と、無酵素試薬組成物を含む電気化学セルとを備える。
【0068】
本発明のシステムは、本発明の試薬組成物を用いるサンプルの電気化学測定に使用する装置を備える。
【0069】
本発明のシステムの装置類およびメーター類は典型的には電気化学的測定装置である。本発明のメーター類は典型的には(a)サンプルが導入された電気化学セルに電位差を印加する手段;および(b)電気化学セル内のセル電流を測定する手段を備える。代表的な電気化学的メーター類および装置類は第5,723,284号、同第5,834,224号、同第5,942,102号、同第5,972,199号、同第5,997,817号、同第6,083,710号、同第6,121,009号、同第6,134,461号および同第6,193,873号明細書に記載されている。上記米国特許明細書は本明細書において参照されることにより、本発明の一部を構成する。さらに、他の特許文献、WO99/49307、WO97/18465、WO01/57510、WO01/57238、WO02/48707、WO02/50609、EP0969097A2およびGB2304628も含まれる。
【0070】
以下の実施例は説明のために提示されるものであって、本発明を限定するものではない。
【0071】
実施例1.
s−GDHの野生型または変異形態を塗布した従来の試験片の性能
種々の糖特異性を持つs−GDHの変異形態をスクリーニングするための試験法を開発するために、s−GDHの野生型および変異形態の還元糖に対する応答を従来の酵素を塗布したグルコース試験片形式で最初に試験した。このスクリーニング試験法は理想的には従来のように酵素を塗布した試験片を用いて、還元糖を添加した全血または血漿で試験した際に示される応答を模倣するものである。試験したs−GDHの変異形態はそれぞれ1個のアミノ酸の置換Asn452ThrおよびAsp167Gluを含んでいた。試験片は、作用電極(金)を、約50〜500kU/mLの野生型または変異形態s−GDH、GDHに対するPQQのモル比が2:1であるPQQ、2mMCaCl2 、750mMフェリシアナイド、pH6.8の67mMシトラコン酸塩、0.1%プルロニックおよび75mMスクロースを含有する緩衝化した試薬溶液でスロットコーティングしたウェブに基づく方法により作成した。試薬溶液中の野生型または変異形態s−GDHの濃度を電気化学セル当たり約13活性単位が使用されるように調整した。従って、試薬溶液のmL当たりの活性単位は使用した酵素のグラム(g)当たりの活性単位によって変動した。各酵素の活性は、DCIP(2、6−ジクロロフェノールインドフェノール)および(PES(フェナジンエトスルフェート)を50mMのPIPES(ピペラジンN,N’−ビス(2−エタンスルホン酸))緩衝液pH6.8に添加した溶液を用いる分光測光測定法に基づいたものである。この測定法では、600nmにおけるDCIPの吸光度の変化を監視し、吸光度の減少速度を上述の酵素の反応速度とした。1分間に1mmolのDCIPを還元する酵素活性を1単位と定義した。pH6.8におけるDCIPのモル吸収係数は17.4mM-1であった。COBAS FARAII遠心分析機を分光測光測定に用いた。
【0072】
欧州特許出願公開第1324038号明細書に記載されているように、赤外エネルギー源を用いて作用電極上の試薬を乾燥した。この記載内容全体が本明細書において参照されることにより本発明の一部を構成する。電気化学セル(または試験片)は乾燥した試薬を有する作用電極を、乾燥したMESAを含有する金の対極に付着させることにより形成して対極の汚染を防止した。
【0073】
内在性グルコースが約80mg/dL(または4.4mM)の全血に高治療濃度(約60mg/dLまたは4mM)または高治療濃度の3倍(約180mg/dLまたは12mM)のいずれかの干渉糖であるキシロースを添加した。添加したサンプルを上述の試験片上に適用し、グルコース濃度を時間電流測定法により決定した。この場合−0.3Vの電位を10秒間印加した後、+0.3Vの電位を5秒間印加した。キシロースを含まない対照サンプルに対する絶対バイアスを各酵素について計算し、図4に示すように、キシロース濃度の関数として表した。野生型s−GDHとAsn452Thr変異体について、絶対バイアスと干渉糖であるキシロースとの間に線形相関があった。このことから、野生型s−GDHとAsn452Thr変異体はともにグルコースだけでなくキシロースも認識することが分かる。しかしながら、Asp167Glu変異体はキシロースに対する応答が低下していた。両変異体は絶対バイアスとガラクトースまたはマルトース(データは示さない)との間に線形相関も示したことから、グルコースだけでなくこれらの炭水化物も認識されることが分かる。従って、s−GDHの変異体をスクリーニングするのに使用される試験法は、Asp167Gluだけがキシロースに対して低下した応答を示すという図4において得られた結果と同様の結果を与える筈である。
【0074】
図4に示す結果は生理学的に関連のある糖濃度の全範囲(すなわち、720mg/dLまたは40mMまで)にわたる試験を含んでいない。従って、野生型s−GDHを塗布した従来の試験片の試験をさらに行って糖濃度の範囲を拡大した。約80mg/dL(または4.4mM)の内生グルコースを含む結晶に40mM以下の5種類の還元糖:グルコース、マルトース、キシロース、ガラクトースおよびラクトースのそれぞれを添加した。添加したサンプルを上述の試験片に適用し、上述のようにグルコース濃度を時間電流測定法により決定した。測定された電流応答を図5に示すように糖濃度の関数としてプロットした。図4に示すように、約10mM未満では、野生型s−GDHは上述の試験した5種類の還元糖のそれぞれと同等に反応した。しかしながら、上述のDCIP/PES分光測光試験で試験すると、同じ糖濃度範囲を通してキシロースおよびグルコースとの反応性が低い(結果は示さない)ことから、分光測光試験は従来の酵素を塗布した試験片については干渉糖に対する酵素の応答をモデルとするには使用できないことが分かる。先に述べたように、分光測光試験法は酵素律速条件を使用するのに対して、従来の酵素を塗布した試験片は過剰の酵素を使用する。従って、各試験法の形式での糖応答における差異を説明している。
【0075】
実施例2.
本発明の電気化学セルを用いる方法における還元糖に対する野生型s−GDHの応答の試験
作用電極(金)を、750mMフェリシアナイド、pH6.8の67mMシトラコン酸塩、0.1%プルロニックおよび75mMスクロースを含有する緩衝化した試薬溶液でスロットコーティングしたウェブに基づく方法により作成した電気化学セル(すなわち、試験片)を用いて野生型s−GDHの還元糖に対する応答を測定した。実施例1と同様に、赤外エネルギー源を用いて作用電極上で試薬を乾燥させた。電気化学セルは乾燥した試薬を有する作用電極を、乾燥したMESAを含有する金の対極に付着させることにより形成して対極の汚染を防止した。
【0076】
GDHに対するPQQのモル比が2:1であるPQQおよび2mMCaCl2 を含むpH6.8の67mMシトラコン酸塩に溶解した野生型s−GDHを生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合した。各溶液のs−GDHの濃度を、電気化学セル当たり約13活性単位となるように調整した。各酵素/糖−含有溶液を、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない(濃度については上記参照)電気化学セル上に適用した。電流応答を測定し、3つの測定値の平均を、図6に示すように、糖濃度の関数としてグラフ化した。結果は、キシロース濃度10mM未満で実施例1(図4参照)のs−GDHを塗布した試験片から得られた、酵素はグルコースおよびキシロースと等しくよく反応したという結果と同様であった。また、図5において得られたものと同様の結果がすべての還元糖で得られた。従って、この試験法は従来の野生型の酵素を塗布した試験片で得られた応答をモデルとし、以下の利点を持つ。すなわち、(1)酵素を塗布した試験片は酵素の各形態で製造する必要はないので、時間と資源(装置および技術者)を節減でき、酵素の使用量も少ない;および(2)種々の濃度の還元糖を含有する緩衝液システムサンプルを、生物学的に有害な全血または血漿に糖を添加したものの代わりに使用することができる。
【0077】
実施例3.
本発明の電気化学セルを用いる方法において還元糖に対するAsn452Thr(s−GDHの変異形態)の応答の試験
上述の実施例2に記載されたのと同じロットの電気化学セル(すなわち、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まないセルを持つ)を用いてAsn452Thrの還元糖に対する応答を測定した。Asn452Thrを、生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合した。各溶液のAsn452Thrの濃度を、電気化学セル当たり約13活性単位となるように調整した。各酵素/糖−含有溶液を、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セル上に適用した。電流応答を測定し、図7に示すように、糖濃度の関数としてプロットした。結果は、キシロース濃度10mM未満で(すなわち、高治療濃度のほぼ3倍の濃度で)実施例1(図4参照)のAsn452Thrを塗布した試験片から得られた、野生型酵素のようにAsn452Thrはグルコースおよびキシロースと等しくよく反応した、という結果と同様であった。また、データは、s−GDHのこの変異形態は10mM未満の糖濃度において試験した全ての糖類と等しくよく反応することを示している。従って、この試験法はAsn452Thrを塗布した試験片で得られた結果を模倣し、上述の利点を持つ。
【0078】
実施例4.
本発明の電気化学セルを用いる方法において還元糖に対するAsp167Glu(s−GDHのもう1つの変異形態)の応答の試験
上述の実施例3と同様に、還元糖に対するAsp167Gluの応答を測定した。Asp167Gluを、生理学的に関連のある糖濃度(約40mMまたは720mg/dL以下)の下記の糖類:グルコース、マルトース、キシロース、ガラクトースおよびラクトースの1種と混合し、乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セル上に適用した。電流応答を測定し、図8に示すように、糖濃度の関数としてプロットした。結果は、キシロース濃度10mM未満で(すなわち、高治療濃度のほぼ3倍の濃度で)実施例1(図4参照)のAsp167Gluを塗布した試験片から得られた、s−GDHのこの変異形態はキシロースに対する応答が低下している、という結果と同様であった。この変異体はまた試験した他の還元糖とも等しくよく反応した。従って、本実施例でも、試験法はAsp167Gluを塗布した試験片で得られた結果を有利に模倣しているが、迅速かつ容易に使用できる形式である。
【0079】
上記実施例は本発明の方法が酵素を塗布した試験片をモデルとするのに使用することができること、およびs−GDHの変異形態を糖応答についてスクリーニングするのに使用することができることを実証している。
【0080】
以下の実施例は本発明の方法を使用して酵素活性を測定する方法を実証するものである。
【0081】
実施例5.
本発明方法に従う野生型s−GDHを適用した電気化学セル用の標準曲線
乾燥したフェリシアナイド、シトラコン酸塩、プルロニックおよびスクロースを含むが酵素は含まない電気化学セルに約0〜10mg/mLの範囲内の一連の増加する濃度の野生型s−GDHを適用することにより、野生型s−GDH用の標準曲線(図9参照)を作成した。グルコース濃度を450mg/dLに保った。当業者にはs−GDHの任意の変異形態についても標準曲線を作成することができることが分かるであろう。
【0082】
両軸逆数プロット法(すなわち、1/酵素濃度の関数として1/応答)を図9の標準曲線から作成し、図10に示す。電気化学セルの応答と野生型s−GDHの量との間に強い線形相関(r2=0.9986)が存在する。酵素の試験ロットの濃度は、電流応答を測定し、標準曲線から濃度を読み取ることによって、容易に決定することができる。
【0083】
電気化学式でs−GDH用の標準曲線を作成することにより、従来の試験片を製造するのに用いられる、入ってくる酵素の活性を測定し、乾燥ストリップ上に塗布された酵素の安定性を測定し、酵素活性に関して起こり得るストリップの塗布問題を解決することができる。
【0084】
上述の結果および説明は、本発明がレドックス試薬システム用酵素を特性決定する便利かつコスト効率のよい方法を提供することを実証している。本発明の利点は低コストであり、血液または血液製品を使用せずに試験することができることである。そのようなものとして、本発明は当技術に顕著な貢献をしている。
【0085】
本明細書に引用された全ての刊行物および特許は、各個別の刊行物または特許が参照されることが特にかつ個々に示されているかのように、本明細書において参照されることにより本発明の一部を構成する。いずれの刊行物の引用も出願日前の開示に対するものであって、本発明が先発明によりそのような刊行物に先行する資格がないことを自認するものではない。
【0086】
明瞭な理解を目的とする説明と例示のために本発明を詳細に記載したが、添付の特許請求の範囲から逸脱することなく本発明にある変更および改変をなすことができることは、本発明の教示に照らして、当業者には容易にわかることである。
【0087】
好適な実施態様は下記の通りである。
(1)(a)第1のレドックス試薬システム用酵素と既知量の酵素基質とを含むサンプルを、前記レドックス試薬システムのメディエイターを含む無酵素試薬組成物を含む電気化学セルに適用し、かつ
(b)前記電気化学セルにより生成された電気信号を検知する方法。
(2)前記酵素は酸化酵素である実施態様1に記載の方法。
(3)前記酸化酵素はオキシダーゼとデヒドロゲナーゼから選ばれる実施態様2に記載の方法。
(4)前記サンプルは、さらに、酵素補因子を含む実施態様1、2または3に記載の方法。
(5)前記方法は、さらに、前記検出された電気信号を用いて前記第1のレドックス試薬システム用酵素の検体特異性を決定することを含む実施態様1、2、3または4に記載の方法。
【0088】
(6)前記方法は、少なくとも下記のサンプル
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含むサンプル、
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む実施態様5に記載の方法。
(7)前記方法は、さらに、下記のサンプル
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含むサンプル、
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む実施態様6に記載の方法。
(8)前記第1のレドックス試薬システム用酵素の前記決定された検体特異性は前記第2のレドックス試薬システム用酵素に関するものである実施態様7に記載の方法。
(9)前記第1のレドックス試薬システム用酵素は非天然産レドックス試薬システム用酵素である実施態様8に記載の方法。
(10)前記第2のレドックス試薬システム用酵素は天然産レドックス試薬システム用酵素である実施態様8に記載の方法。
【0089】
(11)前記方法は、さらに、前記検出された電気信号を用いて前記サンプル中の前記酵素の活性を決定する実施態様1に記載の方法。
(12) レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル。
(13)
(a)レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル、および
(b)レドックス試薬システム用酵素と既知量の酵素基質とを含む液体媒体
を備えるシステム。
【産業上の利用可能性】
【0090】
上述のように、本発明の方法、電気化学セル、システムおよびキットは検体検出試験、例えば臨床実験室の試験、家庭における試験等を始めとする種々の用途に有用であり、種々の疾患状態の診断および管理に有効である。特に、糖尿病管理のためのグルコース、コレステロール等の検体検出に適している。
【図面の簡単な説明】
【0091】
【図1】本発明の例示的実施の形態に従うs−GDHの野生型とs−GDH変異形態を試験する方法における一連のステップを示すフローチャートである。
【図2】(A)は、本発明の例示的方法において使用することができる試験片の展開図である。(B)は、本発明の例示的方法において使用することができる試験片の上面図である。
【図3】本発明の例示的実施の形態に従う野生型のs−GDHとその変異体の活性を測定するための方法における一連のステップを示すフローチャートである。
【図4】従来の酵素を塗布した試験片を用いた、野生型s−GDHとs−GDHの2つの変異形態(Asn452ThrおよびAsp167Glu)の、干渉糖を含まない対照に対する絶対バイアスをキシロース濃度の関数として示すグラフである。
【図5】酵素が野生型s−GDHである従来の酵素を塗布した試験片について応答を糖濃度の関数として示すグラフである。
【図6】本発明の方法において野生型s−GDHを用いて応答を糖濃度の関数として示すグラフである。
【図7】本発明の方法においてs−GDHの変異形態であるAsn452Thrを用いて応答を糖濃度の関数として示すグラフである。
【図8】本発明の方法においてs−GDHのもう1つの変異形態であるAsp167Gluを用いて応答を糖濃度の関数として示すグラフである。
【図9】本発明の方法において得られた野生型s−GDH用の標準曲線を示すグラフである。
【図10】図9に示す標準曲線を両軸逆数プロット法で示すグラフである。
【符号の説明】
【0092】
100 方法
110 ステップ
130 ステップ
140 ステップ
150 ステップ
160 ステップ
170 ステップ
200 試験片
202 作用電極
204 参照電極
206 スペーサー層
208 試薬
210 切欠き部
300 方法
310 ステップ
320 ステップ
330 ステップ
340 ステップ
350 ステップ
360 ステップ
【特許請求の範囲】
【請求項1】
(a)第1のレドックス試薬システム用酵素と既知量の酵素基質とを含むサンプルを、前記レドックス試薬システムのメディエイターを含む無酵素試薬組成物を含む電気化学セルに適用し、かつ
(b)前記電気化学セルにより生成された電気信号を検知する方法。
【請求項2】
前記酵素は酸化酵素である請求項1に記載の方法。
【請求項3】
前記酸化酵素はオキシダーゼとデヒドロゲナーゼから選ばれる請求項2に記載の方法。
【請求項4】
前記サンプルは、さらに、酵素補因子を含む請求項1、2または3に記載の方法。
【請求項5】
前記方法は、さらに、前記検出された電気信号を用いて前記第1のレドックス試薬システム用酵素の検体特異性を決定することを含む請求項1、2、3または4に記載の方法。
【請求項6】
前記方法は、少なくとも下記のサンプル
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含むサンプル、
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む請求項5に記載の方法。
【請求項7】
前記方法は、さらに、下記のサンプル
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含むサンプル、
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む請求項6に記載の方法。
【請求項8】
前記第1のレドックス試薬システム用酵素の前記決定された検体特異性は前記第2のレドックス試薬システム用酵素に関するものである請求項7に記載の方法。
【請求項9】
前記第1のレドックス試薬システム用酵素は非天然産レドックス試薬システム用酵素である請求項8に記載の方法。
【請求項10】
前記第2のレドックス試薬システム用酵素は天然産レドックス試薬システム用酵素である請求項8に記載の方法。
【請求項11】
前記方法は、さらに、前記検出された電気信号を用いて前記サンプル中の前記酵素の活性を決定する請求項1に記載の方法。
【請求項12】
レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル。
【請求項13】
(a)レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル、および
(b)レドックス試薬システム用酵素と既知量の酵素基質とを含む液体媒体
を備えるシステム。
【請求項1】
(a)第1のレドックス試薬システム用酵素と既知量の酵素基質とを含むサンプルを、前記レドックス試薬システムのメディエイターを含む無酵素試薬組成物を含む電気化学セルに適用し、かつ
(b)前記電気化学セルにより生成された電気信号を検知する方法。
【請求項2】
前記酵素は酸化酵素である請求項1に記載の方法。
【請求項3】
前記酸化酵素はオキシダーゼとデヒドロゲナーゼから選ばれる請求項2に記載の方法。
【請求項4】
前記サンプルは、さらに、酵素補因子を含む請求項1、2または3に記載の方法。
【請求項5】
前記方法は、さらに、前記検出された電気信号を用いて前記第1のレドックス試薬システム用酵素の検体特異性を決定することを含む請求項1、2、3または4に記載の方法。
【請求項6】
前記方法は、少なくとも下記のサンプル
(i)第1のレドックス試薬システム用酵素と既知の第1の濃度の第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第1の濃度の第2の酵素基質とを含むサンプル、
(iii)第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第1の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む請求項5に記載の方法。
【請求項7】
前記方法は、さらに、下記のサンプル
(i)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第1の酵素基質とを含むサンプル、
(ii)前記第1のレドックス試薬システム用酵素と既知の第2の濃度の前記第2の酵素基質とを含むサンプル、
(iii)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第1の酵素基質とを含むサンプル、および
(iv)前記第2のレドックス試薬システム用酵素と前記既知の第2の濃度の前記第2の酵素基質とを含むサンプル
から生成される電気信号を検出することを含む請求項6に記載の方法。
【請求項8】
前記第1のレドックス試薬システム用酵素の前記決定された検体特異性は前記第2のレドックス試薬システム用酵素に関するものである請求項7に記載の方法。
【請求項9】
前記第1のレドックス試薬システム用酵素は非天然産レドックス試薬システム用酵素である請求項8に記載の方法。
【請求項10】
前記第2のレドックス試薬システム用酵素は天然産レドックス試薬システム用酵素である請求項8に記載の方法。
【請求項11】
前記方法は、さらに、前記検出された電気信号を用いて前記サンプル中の前記酵素の活性を決定する請求項1に記載の方法。
【請求項12】
レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル。
【請求項13】
(a)レドックス試薬システム用メディエイターを含む無酵素試薬組成物を含む電気化学セル、および
(b)レドックス試薬システム用酵素と既知量の酵素基質とを含む液体媒体
を備えるシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2006−17720(P2006−17720A)
【公開日】平成18年1月19日(2006.1.19)
【国際特許分類】
【外国語出願】
【出願番号】特願2005−190277(P2005−190277)
【出願日】平成17年6月29日(2005.6.29)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
【Fターム(参考)】
【公開日】平成18年1月19日(2006.1.19)
【国際特許分類】
【出願番号】特願2005−190277(P2005−190277)
【出願日】平成17年6月29日(2005.6.29)
【出願人】(596159500)ライフスキャン・インコーポレイテッド (100)
【氏名又は名称原語表記】Lifescan,Inc.
【住所又は居所原語表記】1000 Gibraltar Drive,Milpitas,California 95035,United States of America
【Fターム(参考)】
[ Back to top ]

