レバミピド固形製剤及びその製造方法
【課題】高含有量でレバミピド原薬を含み、崩壊性及び溶出性に優れたレバミピド固形製剤の提供。
【解決手段】薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤を提供する。このレバミピド固形製剤は、レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有するものであり、これらに溶媒40〜110質量部を練合し、湿式造粒、特には押出し造粒を行って得られるものである。
【解決手段】薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤を提供する。このレバミピド固形製剤は、レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有するものであり、これらに溶媒40〜110質量部を練合し、湿式造粒、特には押出し造粒を行って得られるものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、レバミピド固形製剤及びその製造方法に関する。より詳しくは、レバミピド錠剤を小型化するための高含量レバミピド固形製剤とその製造方法等に関する。
【背景技術】
【0002】
レバミピド(2−(4−クロロベンゾイルアミノ)−3−[2(1H)−キノリノン−4−イル]プロピオン酸)は、胃粘膜プロスタグランジンE2増加作用、胃粘液量増加作用、胃粘膜細胞回転賦活作用等を有する薬剤であり、胃潰瘍や、急性胃炎及び慢性胃炎急性憎悪期に現れる胃粘膜病変に対して優れた改善効果を示す。また、レバミピドは、特にヘリコバクターピロリ(Helico bacterpylori)菌の感染者において、胃粘膜細胞への菌の粘着及び浸潤を抑制して、高い炎症抑制効果を発揮する。
【0003】
レバミピドの経口投与用医薬品組成物としては、すでに錠剤及び細粒が市販されている。これまでに、レバミピドの経口投与用医薬組成物に関し、いくつかの検討がなされてきている。
【0004】
例えば、特許文献1には、薬理活性成分の効果を発揮するために必要な量だけを長時間にわたって持続的に放出することによって、薬理活性成分の最高血中濃度の上昇を抑えると共に、適度の血中濃度を維持し得る医薬製剤を提供することを目的として、薬理活性成分、親水性ハイドロゲル形成物質並びにpH非依存型高分子物質を含有する医薬製剤が開示されている。この医薬製剤の薬理活性成分には、レバミピドが含まれる(当該文献段落0009参照)。
【特許文献1】特開2003−267889号
【発明の開示】
【発明が解決しようとする課題】
【0005】
現在市販されているレバミピドの錠剤は、1錠の重量が176mg(レバミピド含有量100mg)、直径8.1mmの錠剤である。この錠剤の大きさは、通常の患者にとっては服用上問題ない大きさとも思われる。しかし、高齢者や嚥下障害を有する患者や多数の錠剤を同時に服用する患者においては服用上の困難が生じ得る大きさであるため、より服用が容易な小型の錠剤が望まれる。錠剤の小型化は、高齢者医療や小児医療領域における患者の服用コンプライアンスの観点からも望ましい。
【0006】
そこで、本発明は、レバミピド錠剤の小型化を実現するため、高含有量でレバミピド原薬を含み、崩壊性及び溶出性に優れたレバミピド固形製剤を提供することを主な目的とする。
【課題を解決するための手段】
【0007】
上記課題解決のため、本発明は、薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤を提供する。
このレバミピド固形製剤は、好適には、前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを含有するものである。
このレバミピド固形製剤は、より好適には、レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有するものであり、これらに溶媒40〜110質量部を練合し、湿式造粒、特には押出し造粒を行って得られるものである。
以上のレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされているため、1錠中の原薬の含有量を減らすことなく、小型化されたレバミピド錠剤を得ることが可能である。
【0008】
また、本発明は、薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含むレバミピド固形製剤の製造方法を提供する。
このレバミピド固形製剤の製造方法では、前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースが好適に練合される。
このレバミピド固形製剤の製造方法は、具体的には、レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部で練合し、湿式造粒、特には押出し造粒を行う工程を含むものである。
このレバミピド固形製剤の製造方法では、0.4〜2mm径の押出しスクリーンが好適に用いられる。
以上のレバミピド固形製剤の製造方法によれば、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされたレバミピド固形製剤が得られるため、1錠中の原薬の含有量を減らすことなく、小型錠剤としてレバミピド錠剤を製造することが可能である。
【発明の効果】
【0009】
本発明により、レバミピド錠剤の小型化を実現するため、高含有量でレバミピド原薬を含み、崩壊性及び溶出性に優れたレバミピド固形製剤が提供される。
【発明を実施するための最良の形態】
【0010】
1.レバミピド固形製剤
(1-1)レバミピド含有量
一般に、1錠中の原薬の含有量をそのままとして、錠剤の重量及び大きさを小型化した場合、崩壊剤や結合剤等の添加剤の配合量を抑える必要が生じるため、適度な崩壊性及び溶出性を示す錠剤を得ることが難しくなる。このため、従来市販されているレバミピド錠剤では、1錠176mg中のレバミピド含有量は60重量%程度(100mg)に留まっていた。
【0011】
これに対して、本発明に係るレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上であることを特徴とする。すなわち、本発明に係るレバミピド固形製剤は、薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上とされている。
【0012】
(1-2)添加剤
本発明に係るレバミピド固形製剤に配合される添加剤は、薬理学的に許容され得るものであって、特に湿式造粒による固形製剤の製造に適当なものである。
【0013】
(1-2-1)崩壊剤
具体的には、本発明に係るレバミピド固形製剤には、崩壊剤として、低置換度ヒドロキシプロピルセルロース、カルボキシメチルスターチナトリウム、カルボシキメチルスターチナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、寒天および部分アルファー化デンプンなどが配合される。これらは、一種または二種以上を配合してもよい。
【0014】
崩壊剤としては、特に、低置換度ヒドロキシプロピルセルロースが好ましい。さらに、低置換度ヒドロキシプロピルセルロースは、レバミピド100質量部に対して5質量部以上配合されることが望ましく、好ましくは5〜30質量部、さらに好ましくは10〜20質量部配合される。崩壊剤の配合比率をこの数値範囲とすることにより、好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0015】
なお、本発明において、「低置換度ヒドロキシプロピルセルロース」とは、極めて少量のヒドロキシプロポキシ基をグルコース環に導入したものであり、ヒドロキシプロポキシ基のモル置換度が0.2〜0.4であるものを指す。
【0016】
(1-2-2)結合剤
本発明に係るレバミピド固形製剤には、結合剤として、ヒドロキシプロピルセルロース、アラビアゴム、アルギン酸ナトリウム、果糖、カルボキシビニルポリマー、カルメロースナトリウム、グァーガム、結晶セルロース、ゼラチン、デキストリン、デンプン、トラガント、ブルラン、ポリビニルアルコール、D−マンニトールなどが配合される。これらは、一種または二種以上を配合してもよい。
【0017】
結合剤としては、特に、ヒドロキシプロピルセルロースが好ましい。さらに、ヒドロキシプロピルセルロースは、レバミピド100質量部に対して0.1質量部%以上配合されることが望ましく、好ましくは0.1〜10質量部、さらに好ましくは1〜2質量部配合される。結合剤の配合比率をこの数値範囲とすることにより、後述する押出し造粒工程において、スクリーンの破損を防止して、効率良く押出しを行うことが可能となり、加えて好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0018】
(1-2-3)賦形剤
本発明に係るレバミピド固形製剤には、賦形剤として、結晶セルロース、デキストラン、トウモロコシデンプン、白糖、粉末セルロース、マルチトース、D−マンニトール、リン酸水素カルシウムなどが配合され得る。これらは、一種または二種以上を配合してもよい。
【0019】
賦形剤としては、特に、結晶セルロースが好ましい。さらに、結晶セルロースは、レバミピド100質量部に対して5質量部以上配合されることが望ましく、好ましくは5〜30質量部、さらに好ましくは10〜20質量部配合される。賦形剤の配合比率をこの数値範囲とすることにより、後述する押出し造粒工程において、スクリーンの破損を防止して、効率良く押出しを行うことが可能となり、加えて好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0020】
(1-2-4)滑沢剤等
さらに、本発明に係るレバミピド固形製剤には、滑沢剤として、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、PEG4000〜8000、水素添加ヒマシ油、モノステアリン酸グリセリン、タルクなどが配合され得る。
【0021】
滑沢剤としては、特に、ステアリン酸マグネシウムが好ましい。さらに、ステアリン酸マグネシウムは、レバミピド100質量部に対して0.1質量部以上配合されることが望ましく、好ましくは0.5〜2質量部配合される。
【0022】
この他、本発明に係るレバミピド固形製剤には、安定化剤、界面活性剤、滑沢剤、甘味剤、矯味剤、抗酸化剤、光沢化剤、着色剤、香料、糖衣剤、崩壊助剤、保存剤、防湿剤などの種々の添加物を適宜配合され得る。
【0023】
2.レバミピド固形製剤の製造方法
(2-1)造粒工程
粒子の造粒法は、一般に、粒子を形成させる過程で溶媒を用いる「湿式造粒」と粒子を形成させる過程で溶媒を用いない「乾式造粒」とに大別される。このうち、本発明に係るレバミピド固形製剤は、特に「湿式造粒」により打錠性の良好な粒子として高収率に製造することができる。すなわち、本発明に係るレバミピド固形製剤の製造方法は、薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含む。より具体的には、本発明に係るレバミピド固形製剤の製造方法は、レバミピドに、上述の崩壊剤及び結合剤を所定の配合量で添加し、溶媒を加えて湿式造粒を行うものである。
【0024】
湿式造粒法としては、押出し造粒、攪拌造粒、流動層造粒、転動造粒、練合造粒等の公知の方法を採用することができるが、このうち特に押出し造粒を採用することが好ましい。押出し造粒は、主剤とする粉体に崩壊剤等を添加して練合し、スクリーンを通過させることで粒子を押出し成形する方法である。さらに、押出し造粒においては、スクリーン径が0.4〜2mmの押出しスクリーンを用いることが好適となる。スクリーン径をこの数値範囲とすることにより、押出し造粒後、整粒した粒子を所定の粒子径として、好適な打錠性を得ることが可能となる。
【0025】
本発明に係るレバミピド固形製剤の製造方法における押出し造粒は、レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、造粒を行う。
【0026】
溶媒には、造粒前の混合工程や造粒後の乾燥工程等に応じて、水、エチルアルコール等のアルコール類などを適宜選択して用いることができる。このうち、溶媒には、特に水を用いることが好ましい。溶媒は、レバミピド100質量部に対して40質量部以上添加されることが望ましく、好ましくは40〜110質量部添加される。
【0027】
本発明に係るレバミピド固形製剤の製造方法においては、以上の条件で押出し造粒を行うことにより、押出し造粒後、乾燥工程を経て整粒を行った粒子の比容及び粒度分布を打錠に適したものをすることができる。すなわち、整粒後の粒子の比容は2〜3mL/g、好適には2.65〜2.90mL/gである。さらに、整粒後の粒度分布は150〜500μmが30%以上である。
【0028】
なお、本発明者の検討により、造粒工程において乾式造粒を採用した場合には、レバミピドが造粒機内や打錠機内に付着してしまい、製剤中のレバミピド含有量の低下やばらつきが生じることが明らかになった。
【0029】
(2-2)打錠工程
本発明に係るレバミピド固形製剤は、造粒後の粒子を、定法により包材や容器に充填して顆粒剤や散剤として、またはカプセルに充填してカプセル剤として、さらには圧縮成型して錠剤として提供され得る。これらの剤形には、発泡錠、速溶錠、マトリックス錠、多層錠、段階的放出錠、丸剤、カプセル剤、顆粒剤またはサシェもしくは瓶詰めの散剤等の経口用製剤が含まれる。
【0030】
このうち、本発明に係るレバミピド固形製剤の剤形は、特に小型錠が好適である。レバミピド錠剤は、造粒後の粒子に、上述した賦形剤や滑沢剤等を添加・混合して得た打錠用粉末を通常の打錠機を用いて打錠することによって製造することができる。この際、本発明に係るレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされているため、1錠中の原薬の含有量を減らすことなく、小型錠剤として打錠することが可能である。
【0031】
3.レバミピド小型錠
上記の造粒・打錠工程により得られる本発明に係るレバミピド錠剤は、1錠中のレバミピド含有量を100mgとした場合、従来の円形錠剤の直径8.1mm,厚さ3.4mmに対して、直径7.6mm,厚さ3.35mmの円形錠剤にまで小型化することができる。
【0032】
本発明に係るレバミピド錠剤は、レバミピドを50〜500mg、好ましくは90〜120mg含有するものであり、さらに好ましくはレバミピドを100mg含む錠剤である。
【0033】
本発明に係るレバミピド錠剤の硬度は、例えば、上記打錠工程によってレバミピド140mgを含有する小型錠を製造した場合、40〜140N、好ましくは60〜110N、さらに好ましくは90Nの硬度を有し得る。なお、錠剤の硬度は、標準的試験(例えば、Schleuniger 6D錠剤試験装置による試験)により測定される。
【0034】
本発明に係るレバミピド錠剤は、製造工程及び保管期間(例えば、密封アルミニウムブリスター包装等の通常包装による2年間又は3年間の保管)において安定である。さらに、以下の実施例において説明するように、従来製品に比して、遜色のない崩壊性及び溶出性を示すものである。
【0035】
本発明に係るレバミピド錠剤は、裸錠(素錠)として、又はこれにコーティングを施したフィルムコート錠として提供され得る。フィルムコート錠は、光に対して安定で、変色がなく、さらに服用が容易である。
【0036】
コーティングは従来公知の方法により行うことができる。この際、コーティング層の重量は、素錠重量に対して5%以下であることが望ましい。コーティング材料としては、例えば、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、アクリル酸エチル・メタアクリル酸メチル共重合体、アミノアルキルメタアクリレートコポリマー、カルボキシビニルポリマー、プルラン、ポリビニルピロリドン、ポリビニルアルコール、ステアリルアルコール、セタノール、セラック、トリアセチン、ポリエチレングリコール、ポリソルベートなどを用いることができる。HPMCとしては、例えば、TC−5S、TC−5E、TC−5R等が用いられ、好ましくは、低粘度のHPMC(例えば、TC−5E)が用いられる。さらに、コーティング層の遮光能及び隠蔽能を向上させるために、酸化チタンを配合したコーティング処方を用いることもできる。酸化チタンには、結晶形が異なるルチル型とアナタース型の2種類があるが、本発明ではいずれも好適に用いることができる。
【実施例】
【0037】
以下に実施例等を挙げて、本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0038】
1.製造実施例
<実施例1>
「表1」に示す処方に従って、以下の(1)〜(6)の工程でレバミピド錠剤を製造した。
(1)レバミピド原薬100質量部(100mg)に対して、低置換度ヒドロキシプロピルセルロース(LH-21、信越化学工業)15.5質量部、精製水で攪拌溶解したヒドロキシプロピルセルロース(HPC-L、信越化学工業)1.5質量部を攪拌造粒機(バーチカルグラニュレーター)内に投入し練合した。
(2)さらに精製水をレバミピド100質量部に対して62.9質量部となるように投入し、追加練合した。
(3)押出し造粒機(ドームグラン)で造粒を行った後、60℃で乾燥し、造粒乾燥粒子を得た。
(4)造粒乾燥粒子を16mesh(径1000μm)によって整粒した整粒粒子に、レバミピド100質量部に対して16質量部の結晶セルロース(101、旭化成ケミカルズ)と、2質量部のステアリン酸マグネシウム(植物性、太平化学酸産業)を添加し、拡散式混合機により混合して、打錠用粒子を得た。
(5)打錠用粒子をロータリー打錠機によって打錠し、裸錠を製造した。
(6)裸錠をハイコーターに入れ、ヒプロメロース、酸化チタン、マクロゴール6000及び精製水で調製したフィルムコーティング液をスプレーした。スプレー終了後、乾燥し、カルナウバロウを添加して、フィルムコート錠を得た。
本実施例では、裸錠重量135mg(フィルムコート錠140mg)、レバミピド含有量が74.1%であって、径が7.64mmのフィルムコート小型錠を製造できた。
【0039】
<実施例2>
実施例2では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースLH-21を16.3質量部、ヒドロキシプロピルセルロースを1.7質量部とし、上記工程(2)の精製水の投入量を43.3質量部として、レバミピド錠剤を製造した。
本実施例では、18号ふるい(径850μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロース(KG802、旭化成ケミカルズ)を16.3質量部、ステアリン酸マグネシウムを1.36質量部とした。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。なお、本実施例では、上記工程(6)のフィルムコーティングは省略した。
【0040】
<実施例3>
実施例3では、実施例2の上記工程(4)で30号ふるい(径500μm)を用いて整粒を行った以外は、実施例2と同様にしてレバミピド錠剤を製造した。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。
【0041】
<実施例4>
実施例4では、実施例3の上記工程(2)の精製水の投入量を108.3質量部とした以外は、実施例3と同様にしてレバミピド錠剤を製造した。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。
【0042】
<実施例5>
実施例5では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースをLH-32(信越化学工業)16.3質量部、ヒドロキシプロピルセルロースを1.7質量部とし、上記工程(2)の精製水の投入量を108.3質量部として、レバミピド錠剤を製造した。
本実施例では、30号ふるい(径500μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースをKG802、30質量部とし、ステアリン酸マグネシウムを1.36質量部とした。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。なお、本実施例では、上記工程(6)のフィルムコーティングは省略した。
【0043】
<比較例1>
比較例1では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースにかえて含水二酸化ケイ素(#80、DSLジャパン)を5質量部添加し、上記工程(2)の精製水の投入量を48.5質量部として、レバミピド錠剤を製造した。
本実施例では、18号ふるい(径850μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースKG802を30質量部、ステアリン酸マグネシウムを1.36質量部とした。
【0044】
<比較例2>
「表2」に示す処方に従って、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースLH21を16.3質量部、ヒドロキシプロピルセルロースHPC-Lを0質量部とし、上記工程(2)の精製水の投入量を65.5質量部として、レバミピド錠剤を製造した。
本比較例では、30号ふるい(径500μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースKG802を16.3質量部、ステアリン酸マグネシウムを1.36質量部とした。
【0045】
実施例及び比較例の各工程において、以下の項目について評価を行った。
(A)押出し性の評価
上記工程(3)において、特に支障をきたすことなく押出し造粒ができたものを「良」、押出し造粒物がスクリーンから出る際に粉状になってしまった等の支障をきたしたものを「不可」で評価した。
【0046】
【表1】

1)LH-21:低置換度ヒドロキシプロピルセルロース
2)LH-32:低置換度ヒドロキシプロピルセルロース
3)HPC-L:ヒドロキシプロピルセルロース
【0047】
表に示すように、本発明である実施例がいずれも押出し造粒の状況が良好であった。
【0048】
(B)打錠性の評価
上記工程(5)において、特に支障をきたすことなく打錠ができたものを「良」、錠剤重量のばらつきが認められたり、錠剤の割れ・欠け等の支障をきたしたものを「不可」で評価した。
【0049】
【表2】

1)LH-21:低置換度ヒドロキシプロピルセルロース
2)LH-32:低置換度ヒドロキシプロピルセルロース
3)HPC-L:ヒドロキシプロピルセルロース
【0050】
表に示すように、本発明である実施例がいずれも打錠性が良好であった。
【0051】
(C)調粒粒子の粒子径分布
上記工程(3)及び(4)の造粒・整粒を行った後の整粒粒子について、粒子径分布を測定した。
【0052】
【表3】

【0053】
表に示すように、本発明である実施例で得られた整粒粒子の粒度分布は、150〜500μmが30%以上であり、いずれも良好な粒子径を有するものであった。
【0054】
2.崩壊・溶出性試験
実施例及び比較例で製造したレバミピド錠剤について、パドル法(第14改正日本薬局方溶出試験法第2法)により、崩壊・溶出性の試験を行った。
【0055】
レバミピド錠剤1錠を、試験液900mL中で、毎分50回転で溶出させた。溶出試験開始10、20、30、40、50、60分後に、溶出液10mLを分取し、直ちに37±0.5℃に加温した試験液10mLを補う。
【0056】
分取した溶出液は、孔径0.45μm以下のメンブランフィルターで直ちにろ過する。溶出液10mlのろ液のうち、ろ過当初の2mL分を除いたろ液8mLから、2mLを正確に量り、溶出試験第2液を加えて10mLとし、試料溶液とした。
【0057】
乾燥減量を測定したレバミピド標準品約22mgを精密に量り、溶出試験第2液に溶かし、正確に100mLとする。この液2mLを正確に量り、溶出試験第2液を加えて正確に20mLとし、標準溶液とした。
【0058】
試料溶液及び標準溶液について、溶出試験第2液を対照とした紫外可視吸光度測定によって、波長326nmにおける吸光度AT(n)及びASを測定した。そして、以下の式(1)によって、表示量に対する溶出率(%)を算出した。
【0059】
【数1】

〔式(1)中、「WS」は、乾燥物に換算したレバミピド標準品の秤取量(mg)を表す。また、「C」は、1錠中のレバミピド(C19H15ClN2O4)の表示量(mg)を表す。〕
【0060】
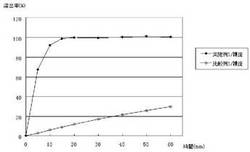
図1に、実施例1及び比較例1で製造したレバミピド錠剤(裸錠)のpH6.8における溶出挙動を示す。
【0061】
実施例1で得られたレバミピド錠剤は、溶出試験開始後10分で溶出率90%以上と優れた崩壊・溶出性を示した。市販のレバミピド錠剤(ムコスタ錠100、大塚製薬)について同様に溶出率を測定した結果、溶出試験開始後15分の溶出率は85%程度であった。このことから、本発明に係るレバミピド錠剤が、従来品に比べても、高い崩壊・溶出性を備えていることが明らかとなった。他方、比較例1で得られたレバミピド錠剤では、溶出試験開始後60分での溶出率が30%程度であった。
【0062】
図2に、実施例1で製造したレバミピド錠剤について、裸錠とフィルムコート錠のpH6.8における溶出挙動を示す。
【0063】
実施例1で得られたフィルムコート錠は、裸錠と同程度の溶出挙動を示し、優れた崩壊・溶出性を備えていることが確認された。
【0064】
同様に、実施例2〜5について溶出率を測定した結果、実施例はいずれも優れた溶出率を示した。
【0065】
3.含量均一性試験
各実施例で製造したレバミピド錠剤について、一錠当たりの平均質量及び質量換算平均を求めた。
【0066】
レバミピド錠剤1錠を、N、N-ジメチルホルムアミド10mL及びメタノール30mL を加え、激しく振り混ぜて錠剤を崩壊させ、約30分間超音波処理した。その後、メタノールを加えて正確に50mLとした液を遠心分離し、上澄液2mLを正確に量った。この上澄液2mLに内標準溶液2 mLを正確に加え、メタノールを加えて50 mLとし、試料溶液とした。
【0067】
乾燥減量を測定したレバミピド標準品約0.2gを精密に量り、N、N-ジメチルホルムアミド20mLに溶かし、メタノールを加えて正確に100mLとした。この液2mLを正確に量り、内標準溶液2mLを正確に加え、メタノールを加えて50mLとし、標準溶液とした。
【0068】
試料溶液及び標準溶液10μLにつき、次の条件で液体クロマトグラフィーによる試験を行い、内標準物質のピーク面積に対するレバミピドのピーク面積の比QT及びQSを求めた。
【0069】
【数2】

【0070】
実施例1で製造したレバミピド錠剤(裸錠)について、3回測定を行った含量平均及び質量平均を「表4」及び「表5」に示す。
【0071】
【表4】

【0072】
【表5】

【0073】
実施例1で得られたレバミピド錠剤は含量均一性に優れていることが確認された。これにより、本発明に係るレバミピド固形製剤が、医薬品製剤に使用し得ることが確認された。
【産業上の利用可能性】
【0074】
本発明に係るレバミピド固形製剤によれば、従来のレバミピド錠剤を、崩壊性及び溶出性を損なうことなく、小型化することが可能である。従って、高齢者や嚥下障害を有する患者や多数の錠剤を同時に服用する患者においても服用が容易なレバミピド錠剤を提供することができ、高齢者医療や小児医療領域における患者の服用コンプライアンスの向上に寄与し得る。
【図面の簡単な説明】
【0075】
【図1】実施例1及び比較例1で製造したレバミピド錠剤(裸錠)のpH6.8における溶出挙動を示す図である。
【図2】実施例1で製造したレバミピド錠剤について、裸錠とフィルムコート錠のpH6.8における溶出挙動を示す図である。
【技術分野】
【0001】
本発明は、レバミピド固形製剤及びその製造方法に関する。より詳しくは、レバミピド錠剤を小型化するための高含量レバミピド固形製剤とその製造方法等に関する。
【背景技術】
【0002】
レバミピド(2−(4−クロロベンゾイルアミノ)−3−[2(1H)−キノリノン−4−イル]プロピオン酸)は、胃粘膜プロスタグランジンE2増加作用、胃粘液量増加作用、胃粘膜細胞回転賦活作用等を有する薬剤であり、胃潰瘍や、急性胃炎及び慢性胃炎急性憎悪期に現れる胃粘膜病変に対して優れた改善効果を示す。また、レバミピドは、特にヘリコバクターピロリ(Helico bacterpylori)菌の感染者において、胃粘膜細胞への菌の粘着及び浸潤を抑制して、高い炎症抑制効果を発揮する。
【0003】
レバミピドの経口投与用医薬品組成物としては、すでに錠剤及び細粒が市販されている。これまでに、レバミピドの経口投与用医薬組成物に関し、いくつかの検討がなされてきている。
【0004】
例えば、特許文献1には、薬理活性成分の効果を発揮するために必要な量だけを長時間にわたって持続的に放出することによって、薬理活性成分の最高血中濃度の上昇を抑えると共に、適度の血中濃度を維持し得る医薬製剤を提供することを目的として、薬理活性成分、親水性ハイドロゲル形成物質並びにpH非依存型高分子物質を含有する医薬製剤が開示されている。この医薬製剤の薬理活性成分には、レバミピドが含まれる(当該文献段落0009参照)。
【特許文献1】特開2003−267889号
【発明の開示】
【発明が解決しようとする課題】
【0005】
現在市販されているレバミピドの錠剤は、1錠の重量が176mg(レバミピド含有量100mg)、直径8.1mmの錠剤である。この錠剤の大きさは、通常の患者にとっては服用上問題ない大きさとも思われる。しかし、高齢者や嚥下障害を有する患者や多数の錠剤を同時に服用する患者においては服用上の困難が生じ得る大きさであるため、より服用が容易な小型の錠剤が望まれる。錠剤の小型化は、高齢者医療や小児医療領域における患者の服用コンプライアンスの観点からも望ましい。
【0006】
そこで、本発明は、レバミピド錠剤の小型化を実現するため、高含有量でレバミピド原薬を含み、崩壊性及び溶出性に優れたレバミピド固形製剤を提供することを主な目的とする。
【課題を解決するための手段】
【0007】
上記課題解決のため、本発明は、薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤を提供する。
このレバミピド固形製剤は、好適には、前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを含有するものである。
このレバミピド固形製剤は、より好適には、レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有するものであり、これらに溶媒40〜110質量部を練合し、湿式造粒、特には押出し造粒を行って得られるものである。
以上のレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされているため、1錠中の原薬の含有量を減らすことなく、小型化されたレバミピド錠剤を得ることが可能である。
【0008】
また、本発明は、薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含むレバミピド固形製剤の製造方法を提供する。
このレバミピド固形製剤の製造方法では、前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースが好適に練合される。
このレバミピド固形製剤の製造方法は、具体的には、レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部で練合し、湿式造粒、特には押出し造粒を行う工程を含むものである。
このレバミピド固形製剤の製造方法では、0.4〜2mm径の押出しスクリーンが好適に用いられる。
以上のレバミピド固形製剤の製造方法によれば、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされたレバミピド固形製剤が得られるため、1錠中の原薬の含有量を減らすことなく、小型錠剤としてレバミピド錠剤を製造することが可能である。
【発明の効果】
【0009】
本発明により、レバミピド錠剤の小型化を実現するため、高含有量でレバミピド原薬を含み、崩壊性及び溶出性に優れたレバミピド固形製剤が提供される。
【発明を実施するための最良の形態】
【0010】
1.レバミピド固形製剤
(1-1)レバミピド含有量
一般に、1錠中の原薬の含有量をそのままとして、錠剤の重量及び大きさを小型化した場合、崩壊剤や結合剤等の添加剤の配合量を抑える必要が生じるため、適度な崩壊性及び溶出性を示す錠剤を得ることが難しくなる。このため、従来市販されているレバミピド錠剤では、1錠176mg中のレバミピド含有量は60重量%程度(100mg)に留まっていた。
【0011】
これに対して、本発明に係るレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上であることを特徴とする。すなわち、本発明に係るレバミピド固形製剤は、薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上とされている。
【0012】
(1-2)添加剤
本発明に係るレバミピド固形製剤に配合される添加剤は、薬理学的に許容され得るものであって、特に湿式造粒による固形製剤の製造に適当なものである。
【0013】
(1-2-1)崩壊剤
具体的には、本発明に係るレバミピド固形製剤には、崩壊剤として、低置換度ヒドロキシプロピルセルロース、カルボキシメチルスターチナトリウム、カルボシキメチルスターチナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、寒天および部分アルファー化デンプンなどが配合される。これらは、一種または二種以上を配合してもよい。
【0014】
崩壊剤としては、特に、低置換度ヒドロキシプロピルセルロースが好ましい。さらに、低置換度ヒドロキシプロピルセルロースは、レバミピド100質量部に対して5質量部以上配合されることが望ましく、好ましくは5〜30質量部、さらに好ましくは10〜20質量部配合される。崩壊剤の配合比率をこの数値範囲とすることにより、好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0015】
なお、本発明において、「低置換度ヒドロキシプロピルセルロース」とは、極めて少量のヒドロキシプロポキシ基をグルコース環に導入したものであり、ヒドロキシプロポキシ基のモル置換度が0.2〜0.4であるものを指す。
【0016】
(1-2-2)結合剤
本発明に係るレバミピド固形製剤には、結合剤として、ヒドロキシプロピルセルロース、アラビアゴム、アルギン酸ナトリウム、果糖、カルボキシビニルポリマー、カルメロースナトリウム、グァーガム、結晶セルロース、ゼラチン、デキストリン、デンプン、トラガント、ブルラン、ポリビニルアルコール、D−マンニトールなどが配合される。これらは、一種または二種以上を配合してもよい。
【0017】
結合剤としては、特に、ヒドロキシプロピルセルロースが好ましい。さらに、ヒドロキシプロピルセルロースは、レバミピド100質量部に対して0.1質量部%以上配合されることが望ましく、好ましくは0.1〜10質量部、さらに好ましくは1〜2質量部配合される。結合剤の配合比率をこの数値範囲とすることにより、後述する押出し造粒工程において、スクリーンの破損を防止して、効率良く押出しを行うことが可能となり、加えて好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0018】
(1-2-3)賦形剤
本発明に係るレバミピド固形製剤には、賦形剤として、結晶セルロース、デキストラン、トウモロコシデンプン、白糖、粉末セルロース、マルチトース、D−マンニトール、リン酸水素カルシウムなどが配合され得る。これらは、一種または二種以上を配合してもよい。
【0019】
賦形剤としては、特に、結晶セルロースが好ましい。さらに、結晶セルロースは、レバミピド100質量部に対して5質量部以上配合されることが望ましく、好ましくは5〜30質量部、さらに好ましくは10〜20質量部配合される。賦形剤の配合比率をこの数値範囲とすることにより、後述する押出し造粒工程において、スクリーンの破損を防止して、効率良く押出しを行うことが可能となり、加えて好適な崩壊性及び溶出性を示す固形製剤を得ることができる。
【0020】
(1-2-4)滑沢剤等
さらに、本発明に係るレバミピド固形製剤には、滑沢剤として、ステアリン酸マグネシウム、ステアリン酸アルミニウム、ステアリン酸カルシウム、PEG4000〜8000、水素添加ヒマシ油、モノステアリン酸グリセリン、タルクなどが配合され得る。
【0021】
滑沢剤としては、特に、ステアリン酸マグネシウムが好ましい。さらに、ステアリン酸マグネシウムは、レバミピド100質量部に対して0.1質量部以上配合されることが望ましく、好ましくは0.5〜2質量部配合される。
【0022】
この他、本発明に係るレバミピド固形製剤には、安定化剤、界面活性剤、滑沢剤、甘味剤、矯味剤、抗酸化剤、光沢化剤、着色剤、香料、糖衣剤、崩壊助剤、保存剤、防湿剤などの種々の添加物を適宜配合され得る。
【0023】
2.レバミピド固形製剤の製造方法
(2-1)造粒工程
粒子の造粒法は、一般に、粒子を形成させる過程で溶媒を用いる「湿式造粒」と粒子を形成させる過程で溶媒を用いない「乾式造粒」とに大別される。このうち、本発明に係るレバミピド固形製剤は、特に「湿式造粒」により打錠性の良好な粒子として高収率に製造することができる。すなわち、本発明に係るレバミピド固形製剤の製造方法は、薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含む。より具体的には、本発明に係るレバミピド固形製剤の製造方法は、レバミピドに、上述の崩壊剤及び結合剤を所定の配合量で添加し、溶媒を加えて湿式造粒を行うものである。
【0024】
湿式造粒法としては、押出し造粒、攪拌造粒、流動層造粒、転動造粒、練合造粒等の公知の方法を採用することができるが、このうち特に押出し造粒を採用することが好ましい。押出し造粒は、主剤とする粉体に崩壊剤等を添加して練合し、スクリーンを通過させることで粒子を押出し成形する方法である。さらに、押出し造粒においては、スクリーン径が0.4〜2mmの押出しスクリーンを用いることが好適となる。スクリーン径をこの数値範囲とすることにより、押出し造粒後、整粒した粒子を所定の粒子径として、好適な打錠性を得ることが可能となる。
【0025】
本発明に係るレバミピド固形製剤の製造方法における押出し造粒は、レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、造粒を行う。
【0026】
溶媒には、造粒前の混合工程や造粒後の乾燥工程等に応じて、水、エチルアルコール等のアルコール類などを適宜選択して用いることができる。このうち、溶媒には、特に水を用いることが好ましい。溶媒は、レバミピド100質量部に対して40質量部以上添加されることが望ましく、好ましくは40〜110質量部添加される。
【0027】
本発明に係るレバミピド固形製剤の製造方法においては、以上の条件で押出し造粒を行うことにより、押出し造粒後、乾燥工程を経て整粒を行った粒子の比容及び粒度分布を打錠に適したものをすることができる。すなわち、整粒後の粒子の比容は2〜3mL/g、好適には2.65〜2.90mL/gである。さらに、整粒後の粒度分布は150〜500μmが30%以上である。
【0028】
なお、本発明者の検討により、造粒工程において乾式造粒を採用した場合には、レバミピドが造粒機内や打錠機内に付着してしまい、製剤中のレバミピド含有量の低下やばらつきが生じることが明らかになった。
【0029】
(2-2)打錠工程
本発明に係るレバミピド固形製剤は、造粒後の粒子を、定法により包材や容器に充填して顆粒剤や散剤として、またはカプセルに充填してカプセル剤として、さらには圧縮成型して錠剤として提供され得る。これらの剤形には、発泡錠、速溶錠、マトリックス錠、多層錠、段階的放出錠、丸剤、カプセル剤、顆粒剤またはサシェもしくは瓶詰めの散剤等の経口用製剤が含まれる。
【0030】
このうち、本発明に係るレバミピド固形製剤の剤形は、特に小型錠が好適である。レバミピド錠剤は、造粒後の粒子に、上述した賦形剤や滑沢剤等を添加・混合して得た打錠用粉末を通常の打錠機を用いて打錠することによって製造することができる。この際、本発明に係るレバミピド固形製剤は、全重量に対するレバミピドの含有量が70重量%以上と高く、かつ、打錠に適した粒子径及び比容とされているため、1錠中の原薬の含有量を減らすことなく、小型錠剤として打錠することが可能である。
【0031】
3.レバミピド小型錠
上記の造粒・打錠工程により得られる本発明に係るレバミピド錠剤は、1錠中のレバミピド含有量を100mgとした場合、従来の円形錠剤の直径8.1mm,厚さ3.4mmに対して、直径7.6mm,厚さ3.35mmの円形錠剤にまで小型化することができる。
【0032】
本発明に係るレバミピド錠剤は、レバミピドを50〜500mg、好ましくは90〜120mg含有するものであり、さらに好ましくはレバミピドを100mg含む錠剤である。
【0033】
本発明に係るレバミピド錠剤の硬度は、例えば、上記打錠工程によってレバミピド140mgを含有する小型錠を製造した場合、40〜140N、好ましくは60〜110N、さらに好ましくは90Nの硬度を有し得る。なお、錠剤の硬度は、標準的試験(例えば、Schleuniger 6D錠剤試験装置による試験)により測定される。
【0034】
本発明に係るレバミピド錠剤は、製造工程及び保管期間(例えば、密封アルミニウムブリスター包装等の通常包装による2年間又は3年間の保管)において安定である。さらに、以下の実施例において説明するように、従来製品に比して、遜色のない崩壊性及び溶出性を示すものである。
【0035】
本発明に係るレバミピド錠剤は、裸錠(素錠)として、又はこれにコーティングを施したフィルムコート錠として提供され得る。フィルムコート錠は、光に対して安定で、変色がなく、さらに服用が容易である。
【0036】
コーティングは従来公知の方法により行うことができる。この際、コーティング層の重量は、素錠重量に対して5%以下であることが望ましい。コーティング材料としては、例えば、ヒドロキシプロピルメチルセルロース(HPMC)、ヒドロキシプロピルセルロース(HPC)、アクリル酸エチル・メタアクリル酸メチル共重合体、アミノアルキルメタアクリレートコポリマー、カルボキシビニルポリマー、プルラン、ポリビニルピロリドン、ポリビニルアルコール、ステアリルアルコール、セタノール、セラック、トリアセチン、ポリエチレングリコール、ポリソルベートなどを用いることができる。HPMCとしては、例えば、TC−5S、TC−5E、TC−5R等が用いられ、好ましくは、低粘度のHPMC(例えば、TC−5E)が用いられる。さらに、コーティング層の遮光能及び隠蔽能を向上させるために、酸化チタンを配合したコーティング処方を用いることもできる。酸化チタンには、結晶形が異なるルチル型とアナタース型の2種類があるが、本発明ではいずれも好適に用いることができる。
【実施例】
【0037】
以下に実施例等を挙げて、本発明をさらに詳細に説明するが、本発明はこれらに限定されるものではない。
【0038】
1.製造実施例
<実施例1>
「表1」に示す処方に従って、以下の(1)〜(6)の工程でレバミピド錠剤を製造した。
(1)レバミピド原薬100質量部(100mg)に対して、低置換度ヒドロキシプロピルセルロース(LH-21、信越化学工業)15.5質量部、精製水で攪拌溶解したヒドロキシプロピルセルロース(HPC-L、信越化学工業)1.5質量部を攪拌造粒機(バーチカルグラニュレーター)内に投入し練合した。
(2)さらに精製水をレバミピド100質量部に対して62.9質量部となるように投入し、追加練合した。
(3)押出し造粒機(ドームグラン)で造粒を行った後、60℃で乾燥し、造粒乾燥粒子を得た。
(4)造粒乾燥粒子を16mesh(径1000μm)によって整粒した整粒粒子に、レバミピド100質量部に対して16質量部の結晶セルロース(101、旭化成ケミカルズ)と、2質量部のステアリン酸マグネシウム(植物性、太平化学酸産業)を添加し、拡散式混合機により混合して、打錠用粒子を得た。
(5)打錠用粒子をロータリー打錠機によって打錠し、裸錠を製造した。
(6)裸錠をハイコーターに入れ、ヒプロメロース、酸化チタン、マクロゴール6000及び精製水で調製したフィルムコーティング液をスプレーした。スプレー終了後、乾燥し、カルナウバロウを添加して、フィルムコート錠を得た。
本実施例では、裸錠重量135mg(フィルムコート錠140mg)、レバミピド含有量が74.1%であって、径が7.64mmのフィルムコート小型錠を製造できた。
【0039】
<実施例2>
実施例2では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースLH-21を16.3質量部、ヒドロキシプロピルセルロースを1.7質量部とし、上記工程(2)の精製水の投入量を43.3質量部として、レバミピド錠剤を製造した。
本実施例では、18号ふるい(径850μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロース(KG802、旭化成ケミカルズ)を16.3質量部、ステアリン酸マグネシウムを1.36質量部とした。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。なお、本実施例では、上記工程(6)のフィルムコーティングは省略した。
【0040】
<実施例3>
実施例3では、実施例2の上記工程(4)で30号ふるい(径500μm)を用いて整粒を行った以外は、実施例2と同様にしてレバミピド錠剤を製造した。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。
【0041】
<実施例4>
実施例4では、実施例3の上記工程(2)の精製水の投入量を108.3質量部とした以外は、実施例3と同様にしてレバミピド錠剤を製造した。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。
【0042】
<実施例5>
実施例5では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースをLH-32(信越化学工業)16.3質量部、ヒドロキシプロピルセルロースを1.7質量部とし、上記工程(2)の精製水の投入量を108.3質量部として、レバミピド錠剤を製造した。
本実施例では、30号ふるい(径500μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースをKG802、30質量部とし、ステアリン酸マグネシウムを1.36質量部とした。
本実施例では、裸錠重量135.66mg、レバミピド含有量が73.7%であって、径が7.5mmの裸錠小型錠を製造できた。なお、本実施例では、上記工程(6)のフィルムコーティングは省略した。
【0043】
<比較例1>
比較例1では、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースにかえて含水二酸化ケイ素(#80、DSLジャパン)を5質量部添加し、上記工程(2)の精製水の投入量を48.5質量部として、レバミピド錠剤を製造した。
本実施例では、18号ふるい(径850μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースKG802を30質量部、ステアリン酸マグネシウムを1.36質量部とした。
【0044】
<比較例2>
「表2」に示す処方に従って、実施例1の上記工程(1)において低置換度ヒドロキシプロピルセルロースLH21を16.3質量部、ヒドロキシプロピルセルロースHPC-Lを0質量部とし、上記工程(2)の精製水の投入量を65.5質量部として、レバミピド錠剤を製造した。
本比較例では、30号ふるい(径500μm)によって上記工程(4)の整粒を行った。また、同工程で添加する結晶セルロースKG802を16.3質量部、ステアリン酸マグネシウムを1.36質量部とした。
【0045】
実施例及び比較例の各工程において、以下の項目について評価を行った。
(A)押出し性の評価
上記工程(3)において、特に支障をきたすことなく押出し造粒ができたものを「良」、押出し造粒物がスクリーンから出る際に粉状になってしまった等の支障をきたしたものを「不可」で評価した。
【0046】
【表1】

1)LH-21:低置換度ヒドロキシプロピルセルロース
2)LH-32:低置換度ヒドロキシプロピルセルロース
3)HPC-L:ヒドロキシプロピルセルロース
【0047】
表に示すように、本発明である実施例がいずれも押出し造粒の状況が良好であった。
【0048】
(B)打錠性の評価
上記工程(5)において、特に支障をきたすことなく打錠ができたものを「良」、錠剤重量のばらつきが認められたり、錠剤の割れ・欠け等の支障をきたしたものを「不可」で評価した。
【0049】
【表2】

1)LH-21:低置換度ヒドロキシプロピルセルロース
2)LH-32:低置換度ヒドロキシプロピルセルロース
3)HPC-L:ヒドロキシプロピルセルロース
【0050】
表に示すように、本発明である実施例がいずれも打錠性が良好であった。
【0051】
(C)調粒粒子の粒子径分布
上記工程(3)及び(4)の造粒・整粒を行った後の整粒粒子について、粒子径分布を測定した。
【0052】
【表3】

【0053】
表に示すように、本発明である実施例で得られた整粒粒子の粒度分布は、150〜500μmが30%以上であり、いずれも良好な粒子径を有するものであった。
【0054】
2.崩壊・溶出性試験
実施例及び比較例で製造したレバミピド錠剤について、パドル法(第14改正日本薬局方溶出試験法第2法)により、崩壊・溶出性の試験を行った。
【0055】
レバミピド錠剤1錠を、試験液900mL中で、毎分50回転で溶出させた。溶出試験開始10、20、30、40、50、60分後に、溶出液10mLを分取し、直ちに37±0.5℃に加温した試験液10mLを補う。
【0056】
分取した溶出液は、孔径0.45μm以下のメンブランフィルターで直ちにろ過する。溶出液10mlのろ液のうち、ろ過当初の2mL分を除いたろ液8mLから、2mLを正確に量り、溶出試験第2液を加えて10mLとし、試料溶液とした。
【0057】
乾燥減量を測定したレバミピド標準品約22mgを精密に量り、溶出試験第2液に溶かし、正確に100mLとする。この液2mLを正確に量り、溶出試験第2液を加えて正確に20mLとし、標準溶液とした。
【0058】
試料溶液及び標準溶液について、溶出試験第2液を対照とした紫外可視吸光度測定によって、波長326nmにおける吸光度AT(n)及びASを測定した。そして、以下の式(1)によって、表示量に対する溶出率(%)を算出した。
【0059】
【数1】

〔式(1)中、「WS」は、乾燥物に換算したレバミピド標準品の秤取量(mg)を表す。また、「C」は、1錠中のレバミピド(C19H15ClN2O4)の表示量(mg)を表す。〕
【0060】
図1に、実施例1及び比較例1で製造したレバミピド錠剤(裸錠)のpH6.8における溶出挙動を示す。
【0061】
実施例1で得られたレバミピド錠剤は、溶出試験開始後10分で溶出率90%以上と優れた崩壊・溶出性を示した。市販のレバミピド錠剤(ムコスタ錠100、大塚製薬)について同様に溶出率を測定した結果、溶出試験開始後15分の溶出率は85%程度であった。このことから、本発明に係るレバミピド錠剤が、従来品に比べても、高い崩壊・溶出性を備えていることが明らかとなった。他方、比較例1で得られたレバミピド錠剤では、溶出試験開始後60分での溶出率が30%程度であった。
【0062】
図2に、実施例1で製造したレバミピド錠剤について、裸錠とフィルムコート錠のpH6.8における溶出挙動を示す。
【0063】
実施例1で得られたフィルムコート錠は、裸錠と同程度の溶出挙動を示し、優れた崩壊・溶出性を備えていることが確認された。
【0064】
同様に、実施例2〜5について溶出率を測定した結果、実施例はいずれも優れた溶出率を示した。
【0065】
3.含量均一性試験
各実施例で製造したレバミピド錠剤について、一錠当たりの平均質量及び質量換算平均を求めた。
【0066】
レバミピド錠剤1錠を、N、N-ジメチルホルムアミド10mL及びメタノール30mL を加え、激しく振り混ぜて錠剤を崩壊させ、約30分間超音波処理した。その後、メタノールを加えて正確に50mLとした液を遠心分離し、上澄液2mLを正確に量った。この上澄液2mLに内標準溶液2 mLを正確に加え、メタノールを加えて50 mLとし、試料溶液とした。
【0067】
乾燥減量を測定したレバミピド標準品約0.2gを精密に量り、N、N-ジメチルホルムアミド20mLに溶かし、メタノールを加えて正確に100mLとした。この液2mLを正確に量り、内標準溶液2mLを正確に加え、メタノールを加えて50mLとし、標準溶液とした。
【0068】
試料溶液及び標準溶液10μLにつき、次の条件で液体クロマトグラフィーによる試験を行い、内標準物質のピーク面積に対するレバミピドのピーク面積の比QT及びQSを求めた。
【0069】
【数2】

【0070】
実施例1で製造したレバミピド錠剤(裸錠)について、3回測定を行った含量平均及び質量平均を「表4」及び「表5」に示す。
【0071】
【表4】

【0072】
【表5】

【0073】
実施例1で得られたレバミピド錠剤は含量均一性に優れていることが確認された。これにより、本発明に係るレバミピド固形製剤が、医薬品製剤に使用し得ることが確認された。
【産業上の利用可能性】
【0074】
本発明に係るレバミピド固形製剤によれば、従来のレバミピド錠剤を、崩壊性及び溶出性を損なうことなく、小型化することが可能である。従って、高齢者や嚥下障害を有する患者や多数の錠剤を同時に服用する患者においても服用が容易なレバミピド錠剤を提供することができ、高齢者医療や小児医療領域における患者の服用コンプライアンスの向上に寄与し得る。
【図面の簡単な説明】
【0075】
【図1】実施例1及び比較例1で製造したレバミピド錠剤(裸錠)のpH6.8における溶出挙動を示す図である。
【図2】実施例1で製造したレバミピド錠剤について、裸錠とフィルムコート錠のpH6.8における溶出挙動を示す図である。
【特許請求の範囲】
【請求項1】
薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤。
【請求項2】
前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを含有する請求項1記載のレバミピド固形製剤。
【請求項3】
レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有することを特徴とする請求項2記載のレバミピド固形製剤。
【請求項4】
レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、湿式造粒して得られる請求項3記載のレバミピド固形製剤。
【請求項5】
前記湿式造粒は、押出し造粒であることを特徴とする請求項4記載のレバミピド固形製剤。
【請求項6】
請求項1〜5のいずれか一項に記載のレバミピド固形製剤を打錠して得られるレバミピド錠剤。
【請求項7】
薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含むレバミピド固形製剤の製造方法。
【請求項8】
前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを練合する請求項7記載の製造方法。
【請求項9】
レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、湿式造粒する工程を含む請求項8記載の製造方法。
【請求項10】
前記湿式造粒は、押出し造粒であることを特徴とする請求項9記載の製造方法。
【請求項11】
押出しスクリーン径が0.4〜2mmであることを特徴とする請求項10記載の製造方法。
【請求項12】
請求項7〜11のいずれか一項に記載の製造方法により得られるレバミピド固形製剤を打錠する工程を含むレバミピド錠剤の製造方法。
【請求項1】
薬理学的に有効量のレバミピドと、薬理学的に許容され得る添加剤と、を含有し、全重量に対するレバミピドの含有量が70重量%以上であるレバミピド固形製剤。
【請求項2】
前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを含有する請求項1記載のレバミピド固形製剤。
【請求項3】
レバミピド100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部含有することを特徴とする請求項2記載のレバミピド固形製剤。
【請求項4】
レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、湿式造粒して得られる請求項3記載のレバミピド固形製剤。
【請求項5】
前記湿式造粒は、押出し造粒であることを特徴とする請求項4記載のレバミピド固形製剤。
【請求項6】
請求項1〜5のいずれか一項に記載のレバミピド固形製剤を打錠して得られるレバミピド錠剤。
【請求項7】
薬理学的に有効量のレバミピドと、湿式造粒に適当な薬理学的に許容され得る添加剤と、を練合し、湿式造粒する工程を含むレバミピド固形製剤の製造方法。
【請求項8】
前記添加剤として、低置換度ヒドロキシプロピルセルロースとヒドロキシルプロピルセルロースを練合する請求項7記載の製造方法。
【請求項9】
レバミピド(原薬)100質量部に対して、低置換度ヒドロキシプロピルセルロースを5〜30質量部、ヒドロキシプロピルセルロースを0.1〜10質量部、溶媒40〜110質量部を練合し、湿式造粒する工程を含む請求項8記載の製造方法。
【請求項10】
前記湿式造粒は、押出し造粒であることを特徴とする請求項9記載の製造方法。
【請求項11】
押出しスクリーン径が0.4〜2mmであることを特徴とする請求項10記載の製造方法。
【請求項12】
請求項7〜11のいずれか一項に記載の製造方法により得られるレバミピド固形製剤を打錠する工程を含むレバミピド錠剤の製造方法。
【図1】


【図2】




【図2】


【公開番号】特開2010−1242(P2010−1242A)
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願番号】特願2008−161189(P2008−161189)
【出願日】平成20年6月20日(2008.6.20)
【出願人】(000169880)高田製薬株式会社 (33)
【Fターム(参考)】
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願日】平成20年6月20日(2008.6.20)
【出願人】(000169880)高田製薬株式会社 (33)
【Fターム(参考)】
[ Back to top ]

