レプチンおよびレプチン類似体コンジュゲートならびにそれらの使用
本発明は、式A-X-B[式中、Aは血液脳関門を横切るかまたは特定細胞型中への化合物の輸送を促進することができるペプチドベクターであり、Xはリンカーであり、そしてBはレプチン、レプチン類似体、またはOB受容体アゴニストである]を有する化合物を特徴とする。本発明の化合物を用いて、レプチンの量の増加を所望する疾患、例えば、肥満および糖尿病を含む代謝疾患を治療することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はペプチドベクターと結合したレプチン、レプチン類似体、またはOB受容体アゴニストを含む化合物に関する。
【背景技術】
【0002】
全世界において、肥満症の罹患率は増加中である。全世界に世界保健機構(World Health Organization)による肥満の成人(肥満度指数(BMI)>30)は3億人を超え、そして過体重の人(BMI>25)は11億人存在する。米国では、成人の半数以上(64.5%)が過体重であり、ほぼ3分の1が肥満である。肥満は2型糖尿病、冠動脈疾患、ある特定の癌の発生率増加、呼吸複合症、および骨関節炎などの症状と関連がある。過体重または肥満は平均余命を低下する周知の因子であり、米国において毎年300,000人の早死の原因であると見積もられる。肥満患者を治療する医療ガイドラインは食習慣の変更および体力の増強を推奨している。肥満の治療を助けるいくつかの治療薬は存在するが、これらは生活様式の変化に置き換わることはできない。
【0003】
肥満および関連障害は脳内の変化に関わると考えられるので、また神経伝達に影響する治療が肥満の治療に必要とされるので、脳に作用する治療薬が有効となるには脳に進入する能力を有しなければならない。血液脳関門(BBB)は中枢神経系(CNS)の障害を治療する薬物の潜在的使用に対する主な障害と考えられる。CNS薬の世界市場は2006年に680億ドルであって心血管薬の世界市場のほぼ半分であり、米国でもCNS障害を患う多くの人は心血管を患う人のほぼ2倍である。この不均衡の理由は、部分的に、全潜在的CNS薬の98%がBBBを横切らないことにある。さらに、世界中のCNS薬開発の99%超はただCNS薬の発見に委ねられ、1%未満がCNS薬送達を指向している。これは主な神経学的疾患に利用可能な治療オプションが不足することを説明しうる。
【0004】
脳は、2つの関門系:BBBおよび血液-脳脊髄液関門(BCSFB)の存在によって潜在的毒性物質に対して遮蔽されている。BBBはその表面積がBCSFBよりほぼ5000倍大きいので血清リガンド取込みの主要な経路であると考えられる。BBBを構成する脳内皮は、多くのCNS障害に対する潜在的薬物の使用に対する主な障害となっている。一般規則として、小さいサイズの親油性分子だけがBBBを横切って、すなわち、循環する全身性血液から脳へ通過することができる。大きいサイズまたはより高い疎水性を有する多数の薬物はCNS標的に高い効力を示すが、これらの薬物はBBBを効果的に横切ることができないので動物に効力がない。従って、治療薬中のペプチドおよびタンパク質は脳毛細管内皮壁の透過性が無視しうるために、一般に血液から脳への輸送が排除される。脳毛細管内皮細胞(BCEC)はタイトな継手により密封され、他器官の毛細管と比較してわずかな開窓とわずかな飲食作用小胞しか有しない。BCECは細胞外マトリックス、星状膠細胞、周皮細胞、および小膠細胞により囲まれている。内皮細胞と星状膠細胞足突起および毛細管基底膜との密接な結合が血液-脳交換のタイトな制御を可能にするBBB特性の発生と維持に重要である。
【0005】
従って、レプチンおよびレプチン類似体などの抗肥満治療薬の脳ならびに他組織への送達を改善する必要性が存在する。
【発明の概要】
【課題を解決するための手段】
【0006】
レプチンのBBBを横切る輸送を改善するために、本発明者らは(a)レプチン、レプチン類似体またはOB受容体アゴニストと(b)ペプチドベクターを含む化合物を開発した。これらの化合物は、BBBを横切るもしくは特定の細胞型中へのポリペプチド治療薬の輸送の増加が所望されるレプチン関連障害(例えば、肥満)を治療するのに有用である。このペプチドベクターは、血液-脳関門(BBB)を横切ってもしくは特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)中にポリペプチド治療薬を輸送することができる。驚くべきことに、本発明者らは、低い用量の例示のポリペプチド治療薬レプチン116-120を本明細書に記載のペプチドベクターとコンジュゲートすると、コンジュゲートしなかった薬剤より体重および食物摂取を減少するのに有効であることを示した。コンジュゲートはBBBの向こうの特定細胞型を標的化するので、コンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストと比較して、より低い用量もしくはより少ない頻度の投与を用いて治療効果を達成することができ、従って、副作用の重症度もしくは発生率を低下し、および/または効力を増加する。本化合物はまた、コンジュゲートしないポリペプチド治療薬と比較して、in vivoにおける安定性の増加、薬物動態学の改善、または分解の低下も示しうる。
【0007】
従って第1の態様において、本発明は式:A-X-B[式中、Aは血液脳関門(BBB)を横切る特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)への輸送が可能なペプチドベクターであり、Xはリンカーであり、そしてBはレプチン、レプチン類似体、およびOB受容体アゴニストからなる群より選択されるポリペプチド治療薬である]で表わされる化合物を特徴とする。BBBを横切る輸送または前記細胞中への輸送は少なくとも10%、25%、50%、75%、100%、200%、500%、750%、1000%、1500%、2000%、5000%、または10,000%だけ増加しうる。本化合物は実質的に純粋であってもよい。本化合物は製薬上許容される担体(例えば、本明細書に記載のいずれかの担体)を用いて製剤化してもよい。
【0008】
他の態様において、本発明は化合物A-X-Bを作る方法を特徴とする。一実施形態において、本方法はペプチドベクター(A)をリンカー(X)とコンジュゲートするステップ、およびペプチドベクター-リンカー(A-X)をレプチン、レプチン類似体、またはOB受容体アゴニスト(B)とコンジュゲートしてそれにより化合物A-X-Bを形成するステップを含むものである。他の実施形態において、本方法はBをリンカー(X)とコンジュゲートするステップ、およびX-Bをペプチドベクター(A)とコンジュゲートしてそれにより化合物A-X-Bを形成するステップを含むものである。他の実施形態において、本方法はペプチドベクター(A)をレプチン、レプチン類似体、またはOB受容体(B)とコンジュゲートするステップを含むものであり、ここでAまたはBは任意にリンカー(X)を含んで化合物A-X-Bを形成する方法である。
【0009】
他の態様において、本発明はポリペプチドである化合物A-X-Bをコードする核酸分子を特徴とする。核酸分子はプロモーターと機能的に連結されていてもよくかつ核酸ベクターの一部分であってもよい。ベクターは細胞、例えば、原核生物細胞(例えば、細菌細胞)または真核細胞(例えば、酵母またはヒト細胞などの哺乳動物細胞)中にあってもよい。
【0010】
他の態様において、本発明は、ポリペプチドである式A-X-Bの化合物を作る方法を特徴とする。一実施形態において、本方法は前記態様の核酸ベクターを細胞で発現してポリペプチドを産生するステップ;およびそのポリペプチドを精製するステップを含むものである。
【0011】
他の態様において、本発明は代謝障害を有する被験体を(例えば、予防として)治療する方法を特徴とする。本方法は、障害を治療するために十分な量の第1の態様の化合物を投与するステップを含むものである。代謝障害は糖尿病(例えば、I型またはII型)、肥満、肥満の結果としての糖尿病、高血糖、異脂肪血症、高トリグリセリド血症、X症候群、インスリン抵抗性、障害性グルコース抵抗性(IGT)、糖尿病異脂肪血症、高脂血症、心血管疾患、または高血圧であってもよい。
【0012】
他の態様において、本発明は被験体による食物摂取を低減する方法、または被験体の体重を低下する方法を特徴とする。前記方法は、本発明の第1の態様の化合物を被験体に食物摂取を低減するかまたは体重を低下するのに十分な量だけ投与するステップを含むものである。被験体は過体重、肥満、または過食症であってもよい。
【0013】
化合物を被験体に投与する任意の方法において、前記十分な量は、ペプチドベクターとコンジュゲートしなかった場合のポリペプチド治療薬(例えば、本明細書に記載のいずれか)の同等の用量に必要な量の90%、75%、50%、40%、30%、20%、15%、10%、5%、4%、3%、2%、1%、または0.1%未満であってもよい。前記十分な量は、ペプチドベクターとコンジュゲートしなかった場合のポリペプチド治療薬の有効量の投与と比較して、副作用(例えば、嘔吐、吐き気、または下痢)を低下することができる。被験体は哺乳動物、例えばヒトであってもよい。
【0014】
前記態様のいずれかにおいて、ペプチドベクターは表1に記載した配列のいずれかまたはその断片と実質的に同一のポリペプチドであってもよい。ある特定の実施形態において、ペプチドベクターはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、Angiopep-3(配列番号107)、Angiopep-4a(配列番号108)、Angiopep-4b(配列番号109)、Angiopep-5(配列番号110)、Angiopep-6(配列番号111)、またはAngiopep-7(配列番号112)の配列を有する。ペプチドベクターまたはコンジュゲートは、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉のいずれか1つ、2つ、3つ、4つ、または5つ)中に効果的に輸送することができるしまたは哺乳動物のBBBを効率的に横切ることができる(例えば、Angiopep-1、-2、-3、-4a、-4b、-5、および-6)。他の実施形態において、ペプチドベクターまたはコンジュゲートは、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉のいずれか1つ、2つ、3つ、4つ、または5つ)に進入することはできるが、BBBを効率的に横切らない(例えば、Angiopep-7を含むコンジュゲート)。ペプチドベクターはいずれの長さ、例えば、少なくとも6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、25、35、50、75、100、200、もしくは500アミノ酸、またはこれらの数の任意の範囲であってもよい。ある特定の実施形態において、ペプチドベクターは長さが10〜50アミノ酸である。ポリペプチドは組み換え遺伝技法または化学合成により作製することができる。
【0015】
表1:例示のペプチドベクター
【表1】




【0016】
ポリペプチド番号5、67、76、および91は、それぞれ、配列番号:5、67、76、および91の配列を含み、かつC-末端がアミド化されている。ポリペプチド番号107、109、および110は、それぞれ、配列番号:97、109、および110の配列を含み、かつN-末端がアセチル化されている。
【0017】
上記態様のいずれかにおいて、ペプチドベクターは式:
X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19
[式中、X1〜X19(例えば、X1〜X6、X8、X9、X11〜X14、およびX16-X19)はそれぞれ独立して、任意のアミノ酸(例えば、天然アミノ酸、例えば、Ala、Arg、Asn、Asp、Cys、Gln、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、およびVal)であるかまたは存在せず、かつX1、X10、およびX15の少なくとも1つ(例えば、2つまたは3つ)はアルギニンである]で表わされるアミノ酸配列を含んでもよい。いくつかの実施形態において、X7はSerもしくはCysであるか;またはX10およびX15はそれぞれ独立してArgもしくはLysである。いくつかの実施形態において、X1〜X19の残基は配列番号:1〜105および107〜116のいずれか1つのアミノ酸配列のいずれか(例えば、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7)と実質的に同一である。いくつかの実施形態において、アミノ酸X1〜X19の少なくとも1つ(例えば、2つ、3つ、4つ、または5つ)はArgである。いくつかの実施形態において、ポリペプチドはポリペプチドのN-末端、C-末端、または両方において1以上のさらなるシステイン残基を有する。
【0018】
以上の態様のいずれかのある特定の実施形態において、ペプチドベクターまたはレプチン、レプチン類似体もしくはOB受容体アゴニストは改変されている(例えば、本明細書に記載のように)。ペプチドベクターまたはポリペプチド治療薬はアミド化、アセチル化、または両方がなされていてもよい。かかる改変はポリペプチドのアミノまたはカルボキシ末端であってもよい。ペプチドベクターまたはポリペプチド治療薬はまた、本明細書に記載のポリペプチドのいずれかのペプチドミメチック(例えば、本明細書に記載のもの)を含むかまたはそのものであってもよい。ペプチドベクターまたはポリペプチド治療薬は多量体、例えば、二量体(システイン残基を介するジスルフィド結合により形成された)であってもよい。
【0019】
ある特定の実施形態において、ペプチドベクターまたはレプチン、レプチン類似体、またはOB受容体アゴニストは少なくとも1つのアミノ酸置換(例えば、2、3、4、5、6、7、8、9、10、11、または12置換)、挿入、または欠失をもつ本明細書に記載のアミノ酸配列を有する。ポリペプチドは例えば、1〜12、1〜10、1〜5、または1〜3アミノ酸置換、例えば、1〜10(例えば、9、8、7、6、5、4、3、2までの)アミノ酸置換を含有してもよい。アミノ酸置換は保存的または非保存的であってもよい。例えば、ペプチドベクターは、配列番号1、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7のいずれのアミノ酸配列の位置1、10、および15に対応する位置の1つ、2つ、または3つにアルギニンを有してもよい。ある特定の実施形態において、レプチン、レプチン類似体、またはアゴニストは、いずれの位置にシステインまたはリシン置換または付加(例えば、N-またはC-末端位置におけるリシン置換)を有してもよい。
【0020】
以上の態様のいずれかにおいて、化合物は特異的に、配列番号:1〜105および107〜116(例えば、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7)のいずれかを含むかまたはそれから成るポリペプチドを除外してもよい。いくつかの実施形態において、本発明のポリペプチドおよびコンジュゲートは配列番号:102、103、104、および 105のポリペプチドを除外する。
【0021】
以上の態様のいずれかにおいて、リンカー(X)は当技術分野で公知のまたは本明細書に記載のいずれのリンカーであってもよい。特別な実施形態において、リンカーは共有結合(例えば、ペプチド結合)、化学連結剤(例えば、本明細書に記載のもの)、アミノ酸またはペプチド(例えば、2、3、4、5、8、10、またはそれ以上のアミノ酸)である。ある特定の実施形態において、リンカーは式:
【化1】

【0022】
[式中、nは2〜15の整数(例えば、 2、3、4、5、6、7、8、9、10、11、12、13、14、または 15)であり;そしてYはA上のチオールでありかつZはB上の一級アミンであるかまたはYはB上のチオールでありかつZはA上の一級アミノである]
で表わされる。
【0023】
ある特定の実施形態において、化合物はペプチドベクター(例えば、Angiopep-2)とポリペプチド治療薬(例えば、ヒトレプチン)を含む融合タンパク質である。
【0024】
以上のいずれかの実施形態において、Bはレプチン(116〜130)、レプチン(22〜56)、レプチン(57〜92)、レプチン(93〜105)、LY396623、メトレレプチン、マウスレプチン類似体、PEG化レプチン、およびメチオニルヒトレプチンであってもよい。レジスチンにはヒト、マウス、およびラットレジスチンが含まれる。レプチンは成熟した配列(例えば、図16に示した、例えば、ヒト配列のアミノ酸22-167)または全長タンパク質(例えば、図16に示した)であってもよい。本発明に用いられるポリペプチドはこれらのペプチドのいずれであってもよくまたはこれらのポリペプチドのいずれかと実質的に同一であってもよい。
【0025】
「ペプチドベクター」は、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、または筋肉)中にまたはBBBを横切って輸送することができる化合物または分子、例えばポリペプチドまたはポリペプチドミメチックを意味する。ある特定の実施形態において、ベクターは癌細胞または脳内皮の細胞上に存在する受容体と結合することができ、それによって癌細胞中にまたはBBBを横切って経細胞輸送により輸送することができる。ベクターは、細胞またはBBB統合性に影響を与えることなく高レベルの経内皮輸送が得られる分子であってもよい。ベクターはポリペプチドまたはペプチドミメチックであってもよく、かつ天然であっても、化学合成もしくは組み換え遺伝技法により作製したものであってもよい。
【0026】
被験体の疾患、障害または症状を「治療する」は、治療薬を被験体に投与することにより、疾患、障害または症状の少なくとも1つの症候を軽減することを意味する。
【0027】
被験体の疾患、障害または症状を「予防として治療する」は、疾患症候群の発症に先立って治療薬を被験体に投与することにより、疾患、障害または症状の発生頻度を低下するかまたは重症度を軽減することを意味する。
【0028】
一例として、代謝障害を治療する被験体は、かかる症状を有すると医師が診断した被験体である。診断は好適な手法により、例えば、本明細書に記載の手法により実施することができる。予防として治療した糖尿病または肥満を発症している被験体は、かかる診断を受けていてもまたは受けてなかってもよい。当業者は、本発明の対象を標準試験に課していてもよいし、または試験無しに1以上のリスク因子、例えば、家族史、肥満、特別な民族性(例えば、アフリカ系米国人およびヒスパニック系米国人)、妊娠性糖尿病または9ポンドを超える体重をもつ赤ちゃんの分娩、高血圧、肥満または糖尿病の素因である病理症状を有すること、トリグリセリドの高い血液レベル、コレステロールの高い血液レベル、分子マーカーの存在(例えば、自己抗体の存在)、および加齢(45歳を超える)の存在によってリスクの高い被験体と同定してもよいことを理解するであろう。個人はその体重が身長にとって望ましい最高体重を20%(女性では25%)以上超える場合、肥満であるとみなされる。100ポンドを超える過体重である成人は病的肥満とみなされる。肥満はまた、30kg/m2を超える肥満度指数(BMI)としても定義される。
【0029】
「代謝障害」は、被験体の代謝の変化からもたらされるいずれかの病理症状を意味する。かかる障害には、例えば、高血糖の変化からもたらされるグルコース恒常性の変化からもたらされる障害が含まれる。本発明によれば、グルコースレベルの変化は典型的には健康な個体のかかるレベルと比較してグルコースレベルの少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、またはさらに100%の増加である。代謝障害には、肥満および糖尿病(例えば、I型糖尿病、II型糖尿病、MODY、および妊娠性糖尿病)、満腹、および加齢による内分泌欠乏が含まれる。
【0030】
「グルコースレベルを低下させる」は、無治療の対照と比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%だけグルコースレベルを低下させることを意味する。望ましくは、グルコースレベルを正常血糖のレベル、すなわち、150〜60mg/dL、140〜70mg/dL、130〜70mg/dL、125〜80mg/dL、そして好ましくは120〜80mg/dLに低下させる。かかるグルコースレベルの低下は、血液からのグルコースのクリアランスに関連する生物学的活性のいずれか1つを増加(例えば、インスリン生産、分泌、または作用の亢進)することによって得ることができる。
【0031】
「被験体」はヒトまたは非ヒト動物(例えば、哺乳動物)を意味する。
【0032】
「同等の用量」は、本発明の化合物において同じモル量のポリペプチド治療薬(例えば、レプチン)を達成するために必要な、コンジュゲートしないポリペプチド治療薬と比較した本発明の化合物の量を意味する。
【0033】
「BBBを横切って効率的に輸送されるポリペプチド」は、少なくともAngiopep-6と同じように効率的にBBBを横切ることができるポリペプチド(すなわち、参照により本明細書に組み込まれる米国特許出願第11/807,597号(2007年5月29日出願)に記載したin situ脳潅流アッセイにおいてAngiopep-1(250nM)より38.5%大きい)を意味する。従って、「BBBを横切って効率的に輸送されないポリペプチド」はより低いレベルで脳へ輸送される(例えば、Angiopep-6より低い効率で輸送される)。
【0034】
「特定の細胞型へ効率的に輸送されるポリペプチドまたは化合物」は、ポリペプチドまたは化合物が(例えば、細胞中への輸送の増加、細胞からの流出の減少、またはそれらの組み合わせによって)対照物質より、または、コンジュゲートの場合にはコンジュゲートしない薬剤と比較して、少なくとも10%(例えば、25%、50%、100%、200%、500%、1,000%、5,000%、または10,000%)大きい範囲で前記細胞型に蓄積し得ることを意味する。かかる活性は、参照により本明細書に組み込まれる国際特許出願公開WO2007/009229号に詳細に記載されている。
【0035】
本発明のその他の特徴と利点は、以下の詳細な説明、図面、および請求項から明らかであろう。
【図面の簡単な説明】
【0036】
【図1A】図1Aおよび1Bは精製前(図1A)および精製後(図1B)のレプチン-AN2(C11)コンジュゲートを示すクロマトグラムである。
【図1B】図1Aおよび1Bは精製前(図1A)および精製後(図1B)のレプチン-AN2(C11)コンジュゲートを示すクロマトグラムである。
【図2】レプチン-AN2(C11)コンジュゲートの精製結果を示すクロマトグラムである。
【図3】in situ脳潅流アッセイを用いて、C3、C6、およびC11レプチン-AN2コンジュゲートの脳、毛細管、および実質への取込みを示すグラフである。
【図4A】図4Aおよび4Bは、痩せたマウスおよび食餌誘発性肥満(DIO)マウス(図4A)におけるレプチン116-130およびレプチン-AN2(C11)コンジュゲートのinsitu脳潅流、ならびに痩せたマウスおよびDIOマウスにおけるレプチンの血漿レベルを示すグラフである(図4B)。
【図4B】図4Aおよび4Bは、痩せたマウスおよび食餌誘発性肥満(DIO)マウス(図4A)におけるレプチン116-130およびレプチン-AN2(C11)コンジュゲートのinsitu脳潅流、ならびに痩せたマウスおよびDIOマウスにおけるレプチンの血漿レベルを示すグラフである(図4B)。
【図5A】図5Aおよび5Bは対照物質注射(生理食塩水)、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける、4時間(図5A)または15時間(図5B)後の食餌摂取を示すグラフである。
【図5B】図5Aおよび5Bは対照物質注射(生理食塩水)、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける、4時間(図5A)または15時間(図5B)後の食餌摂取を示すグラフである。
【図6】対照、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける6日間にわたる体重取得を示すグラフである。
【図7】6日間にわたる毎日IP注入によって対照、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたob/obマウスにおける10日間にわたる体重取得を示すグラフである。
【図8】GSTタグ付きAngiopep構築物を示す模式図である。
【図9】Angiopep-2-レプチン116-130 融合タンパク質を作製するために用いるPCR計画を示す模式図である。
【図10】GSH-セファロースカラム上でのGST-Angiopep2の精製を示すクロマトグラムである。
【図11A】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図11B】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図11C】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図12】in situ脳潅流アッセイにおける、合成および組換え型のAngiopep-2の取込みを示すグラフである。
【図13】in situ脳潅流アッセイにおける、GST、GST-Angiopep-2、GST-レプチン116-130、およびGST-Angiopep-2-レプチン116-130の実質中への取込みを示すグラフである。
【図14】His-タグ付き-マウスレプチンおよびHis-タグ付き-Angiopep-2-マウスレプチン融合タンパク質を示す模式図である。
【図15】His-タグ付き-マウスレプチンおよびヒトレプチン配列の精製を示すゲルのイメージである。
【図16】ヒトレプチン前駆体の配列である。この配列のアミノ酸22-167は成熟したレプチンペプチドを形成する。
【図17A】図17Aおよび17BはHis-タグ付きレプチン(マウス)およびHis-タグ付きAngiopep-2-レプチンコンジュゲートのための例示の精製スキームである。
【図17B】図17Aおよび17BはHis-タグ付きレプチン(マウス)およびHis-タグ付きAngiopep-2-レプチンコンジュゲートのための例示の精製スキームである。
【図18】レプチンとAngiopep-2-レプチンコンジュゲートの小規模発現の成功を示すゲルの写真である。
【図19】His-タグ付きコンジュゲートのトロンビン切断から得られる2つの産物を示すゲルの模式図と写真である。
【図20】レプチンとAngiopep-2-レプチン融合タンパク質のDIOマウス実質中への取込みを示すグラフである。
【図21】組換えレプチンのob/obマウス体重に与える効果を示すグラフである。
【図22】対照、レプチン、His-タグ付きマウスレプチン、またはHis-タグ付きAngiopep-2-レプチンコンジュゲートを受けたDIOマウスの体重変化を示すグラフである。
【発明を実施するための形態】
【0037】
本発明者らは血液脳関門(BBB)を横切るまたは特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)中に進入する高い能力を有するポリペプチド治療薬コンジュゲートを開発し、これをペプチドベクターと例示のポリペプチド治療薬、レプチンとのコンジュゲートの例によって示した。これらの例示のポリペプチド治療薬はOB-R受容体アゴニストとして作用しうる。従って、本発明のコンジュゲートは、治療薬ポリペプチドとBBBを横切る輸送を促進するペプチドベクターとを含むものである。
【0038】
驚くべきことに、本発明者らは本発明の化合物がレプチンの非コンジュゲート型と比較して体重を低下する上でより有効であることを示した。本発明の化合物は非コンジュゲート型ポリペプチドと比較して効力がより大きいので、より少ない用量、より少ない投与、より有効な治療、またはより少ない副作用をもたらしうる。あるいは、より高い用量における効力の増加を得ることができる。
【0039】
レプチンとレプチン類似体
レプチンはアディポサイトカインであり、従って本発明で使用するタンパク質またはペプチドはアディポカインまたはその類似体を含みうる。アディポカインにはアディポネクチン、レプチン、およびレジスチンが含まれる。アディポネクチンにはヒト、マウス、およびラットアディポネクチンが含まれる。レプチンにはレプチン(116-130)、レプチン(22-56)、レプチン(57-92)、レプチン(93-105)、LY396623、メトレレプチン、マウスレプチン類似体、PEG化レプチン、およびメチオニルヒトレプチンが含まれる。レジスチンにはヒト、マウス、およびラットレジスチンが含まれる。レプチンは切断された配列(例えば、図15に示したヒト配列のアミノ酸22-167)または全長タンパク質(例えば、図15に示した)であってもよい。本発明で使用するポリペプチドはこれらのペプチドまたはタンパク質のいずれかであってもまたはこれらのペプチドまたはタンパク質と実質的に同一であってもよい。
【0040】
レプチン類似体はOB受容体アゴニストであってもよい。ある特定の実施形態においてOB受容体アゴニストは、視床下部で見出される主要受容体であるOB-Rb型または血液脳関門に見出されるOB-Rに対するアゴニストであり、レプチン輸送に関わる。
【0041】
ポリペプチド治療薬の改変型
本明細書に記載したレプチン、レプチン類似体、またはOB受容体アゴニストのいずれも改変することができる(例えば、本明細書に記載のようにまたは当技術分野で公知のように)。米国特許第6,924,264号に記載のように、ポリペプチドをポリマーと結合してその分子量を増加することができる。例示のポリマーにはポリエチレングリコールポリマー、ポリアミノ酸、アルブミン、ゼラチン、スクシニル-ゼラチン、(ヒドロキシプロピル)-メタクリルアミド、脂肪酸、多糖類、脂質アミノ酸、およびデキストランが含まれる。
【0042】
一事例においては、ポリペプチドをアルブミン(例えば、ヒトアルブミン)、またはその類似体もしくは断片、または免疫グロブリンのFc部分の付加によって改変する。かかる手法は、例えば、米国特許第7,271,149号に記載されている。
【0043】
一事例においては、ポリペプチドをPCT公報WO98/08871に記載の親油性置換基の付加によって改変する。親油性置換基には、部分的にまたは完全に水素化したシクロペンタノフェナントレン骨格、直鎖または分枝鎖アルキル基;直鎖または分枝鎖脂肪酸のアシル基(例えば、CH3(CH2)nCO-またはHOOC(CH2)mCO-を含む基、ここでnまたはmは4〜38である);直鎖または分枝鎖アルカンα,ω-ジカルボン酸のアシル基;CH3(CH2)p((CH2)q,COOH)CHNH-CO(CH2)2CO-(ここでpおよびqは整数でありかつp+qは8〜33である);CH3(CH2)rCO-NHCH(COOH)(CH2)2CO-(ここでrは10〜24である);CH3(CH2)sCO-NHCH((CH2)2COOH)CO-(ここでsは8〜24である);COOH(CH2)tCO-(ここでtは8〜24である);-NHCH(COOH)(CH2)4NH-CO(CH2)uCH3(ここでuは8〜18である);-NHCH(COOH)(CH2)4NH-COCH((CH2)2COOH)NH-CO(CH2)wCH3(ここでwは10〜16である);-NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NH-CO(CH2)xCH3、(ここでxは10〜16である);または-NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NHCO(CH2)yCH3、(ここでyは1〜22である)が含まれうる。
【0044】
他の実施形態においては、ポリペプチド治療薬を化学反応基、例えば、米国特許第6,593,295号に記載のようにマレイミド基の付加によって改変する。これらの基は血液成分の利用可能な官能基と反応して共有結合を形成することができ、改変されたインスリン分泌性ペプチドの有効治療in vivo半減期を延長することができる。タンパク質の官能基と共有結合を形成するために、化学反応基として広範囲の各種の活性カルボキシル基(例えば、エステル)を利用してもよく、その場合、ヒドロキシル部分はポリペプチドを改変するのに必要なレベルで生理学的に許容可能でなければならない。特別な薬剤には、N-ヒドロキシスクシンイミド(NHS)、N-ヒドロキシ-スルホスクシンイミド(スルホ-NHS)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミドエステル(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)が含まれる。
【0045】
一級アミン類はNHSエステルの主な標的である。タンパク質N-末端およびリシンのε-アミンに存在する、接近しうるα-アミン基はNHSエステルと反応する。NHSエステルコンジュゲーション反応は一級アミン類と反応するとアミド結合を形成してN-ヒドロキシスクシンイミドを放出する。これらのスクシンイミドを含有する反応基を本明細書ではスクシンイミジル基と呼ぶ。本発明のある特定の実施形態において、タンパク質上の官能基はチオール基でありうるし、また化学反応基はマレイミドを含有する基、例えばγ-マレイミド-ブチルアミド (GMBAまたはMPA)でありうる。かかるマレイミドを含有する基を本明細書ではマレイミド基と呼ぶ。
【0046】
マレイミド基は反応混合物のpHが6.5〜7.4の場合にペプチド上のスルフヒドリル基に最も選択性がある。pH7.0において、マレイミド基のスルフヒドリル(例えば、タンパク質、例えば血清アルブミンまたはIgG上のチオール基)との反応速度はアミン類より1000倍速い。従って、マレイミド基とスルフヒドリルとの間の安定なチオエーテル連鎖が形成され、これは生理学的条件下で切断されない。
【0047】
ペプチドベクター
本発明の化合物は本明細書に記載のポリペプチドのいずれか、例えば、表1に記載のペプチドのいずれか(例えば、Angiopep-1またはAngiopep-2)、またはその断片または類似体を特徴としうる。ある特定の実施形態において、ポリペプチドは本明細書に記載のポリペプチドと少なくとも35%、40%、50%、60%、70%、80%、90%、95%、99%、またはさらに100%同一性を有しうる。ポリペプチドは、本明細書に記載の配列の1つと比較して、1以上(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、または15)の置換を有しうる。その他の改変を以下にさらに詳しく記載する。
【0048】
本発明はまた、これらのポリペプチドの断片(例えば、機能性断片)を特徴とする。ある特定の実施形態において、前記断片を特別な細胞型(例えば、肝臓、眼、肺、腎臓、または脾臓)に効率的に輸送もしくは蓄積させることができるかまたは効率的にBBBを横切って輸送する。ポリペプチドの末端切断は、ポリペプチドのN-末端、ポリペプチドのC-末端、またはそれらの組み合わせから1、2、3、4、5、6、7、8、9、10、11、12、またはそれ以上のアミノ酸であってもよい。他の断片には、ポリペプチドの内部の部分が欠失した配列が含まれる。
【0049】
さらなるポリペプチドは本明細書に記載のアッセイまたは方法の1つを用いることにより同定することができる。例えば、候補ポリペプチドを通常のペプチド合成により作製し、パクリタキセルとコンジュゲートし、実験動物に投与してもよい。生物学的に活性のあるポリペプチドコンジュゲートは、例えば、腫瘍細胞を注射し、コンジュゲートで処置した動物の生存を延長する能力に基づいて、コンジュゲートで治療しなかった(例えば、コンジュゲートしない薬剤で治療した)対照と比較して同定することができる。例えば、生物学的に活性のあるポリペプチドは、実質中のその位置に基づいて、in situ脳潅流アッセイで同定することができる。
【0050】
他の組織中の蓄積を測定するアッセイを併せて行うこともできる。ポリペプチドの標識したコンジュゲートを動物に投与し、色々な器官における蓄積を測定してもよい。例えば、検出可能な標識とコンジュゲートしたポリペプチド(例えば、Cy5.5などの近赤外線蛍光標識)は生存中のin vivo可視化を可能にする。かかるポリペプチドを動物に投与し、器官中のポリペプチドの存在を検出し、そして所望の器官におけるポリペプチド蓄積の速度と量を測定することができる。他の実施形態においては、ポリペプチドを放射性同位体(例えば、125I)で標識してもよい。ポリペプチドを次いで動物に投与する。或る時間の後に、動物を犠牲にして器官を抽出する。各器官中の放射性同位体の量を次いで当技術分野で公知のいずれかの手段を用いて測定する。特定器官の候補ポリペプチドの量を標識した対照ポリペプチドの量と比較することにより、特定の組織に進入しかつ蓄積する候補ポリペプチドの能力を確かめることができる。適当なネガティブ対照としては、特定の細胞型中に効率的に輸送されないことが公知のいずれかのペプチドまたはポリペプチド(例えば、BBBを横切らないAngiopepに関係するペプチドまたはいずれかの他のペプチド)が挙げられる。
【0051】
さらなる配列は米国特許第5,807,980号(例えば、本明細書の配列番号102)、第5,780,265号(例えば、配列番号103)、第5,118,668号(例えば、配列番号105)に記載されている。アプロチニン類似体をコードする例示のヌクレオチド配列は
atgagaccag atttctgcct cgagccgccg tacactgggc cctgcaaagc tcgtatcatc cgttacttct acaatgcaaa ggcaggcctg tgtcagacct tcgtatacgg cggctgcaga gctaagcgta acaacttcaa atccgcggaa gactgcatgc gtacttgcgg tggtgcttag;配列番号6;Genbank受託番号 X04666)である。アプロチニン類似体の他の例は、タンパク質BLAST(Genbank:www.ncbi.nlm.nih.gov/BLAST/)を国際出願第PCT/CA2004/000011号に開示された合成アプロチニン配列(またはその部分)を用いて行うことにより見出すことができる。例示のアプロチニン類似体はまた、受託番号CAA37967(GI:58005)および1405218C(GI:3604747)のもとで見出すことができる。
【0052】
改変ポリペプチド
本発明で用いるペプチドベクターとポリペプチド治療薬は改変されたアミノ酸配列を有してもよい。ある特定の実施形態において、改変は所望の生物学的活性(例えば、BBBを横切る能力またはGLP-1アゴニスト活性)を有意に破壊しない。改変は元来のポリペプチドの生物学的活性を(例えば、少なくとも5%、10%、20%、25%、35%、50%、60%、70%、75%、80%、90%、または95%だけ)低下するか、影響を与えないかまたは(例えば、少なくとも5%、10%、25%、50%、100%、200%、500%、または1000%だけ)増加してもよい。改変されたペプチドベクターまたはポリペプチド治療薬は、ポリペプチドの特性、例えばin vivo安定性、バイオアベイラビリティ、毒性、免疫学的活性、免疫学的同一性、およびコンジュゲーション特性を有するかまたは最適化してもよい。
【0053】
改変には、翻訳後プロセシングなどの天然プロセスによるものまたは当技術分野で公知の化学修飾技法によるものが含まれる。改変はポリペプチド骨格、アミノ酸側鎖およびアミノ末端またはカルボキシ末端を含むポリペプチドのあらゆる場所で起こってもよい。同じタイプの改変は所与のポリペプチドのいくつかの部位に同程度または様々な程度で存在してもよく、ポリペプチドは複数のタイプの修飾を含んでもよい。ポリペプチドはユビキチン化の結果として分岐していてもよく、また分岐の有るまたは無い環状であってもよい。環状、分枝、および分枝環状ポリペプチドは翻訳後の天然のプロセシングの結果であってもよく、または合成されたものであってもよい。他の改変には、PEG化、アセチル化、アシル化、アセトアミドメチル(Acm)基の付加、ADPリボシル化、アルキル化、アミド化、ビオチン化、カルバモイル化、カルボキシエチル化、エステル化、フラビン(fiavin)との共有結合、ヘム部分との共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、薬物の共有結合、マーカー(例えば蛍光マーカーもしくは放射マーカー)の共有結合、脂質または脂質誘導体の共有結合、ホスファチジルイノシトールの共有結合、架橋結合、環化、ジスルフィド結合形成、脱メチル化、共有結合架橋の形成、シスチンの形成、ピログルタミン酸の形成、ホルミル化、γ-カルボキシル化、グリコシル化、GPIアンカー形成、ヒドロキシル化、ヨウ素化、メチル化、ミリストイル化、酸化、タンパク質分解処理、リン酸化、プレニル化、ラセミ化、セレノイル化、硫酸化、転移RNAを介したタンパク質へのアミノ酸の付加、例えばアルギニン化およびユビキチン化が含まれる。
【0054】
改変されたポリペプチドはまた、(例えば、このような変化がポリペプチドの生物学的活性を実質的に変化させない場合)ポリペプチド配列へのアミノ酸の挿入、欠失、または保存的もしくは非保存的(例えば、D-アミノ酸、デスアミノ酸)置換を含んでもよい。特に、本発明のポリペプチドのいずれかのアミノまたはカルボキシル末端への1以上のシステイン残基の付加は、例えば、これらのポリペプチドのジスルフィド結合によるコンジュゲーションを促進することができる。例えば、Angiopep-1(配列番号67)、Angiopep-2(配列番号97)、またはAngiopep-7(配列番号112)は、アミノ-末端に単一のシステイン残基(配列番号:71、113、および115、それぞれ)をまたはカルボキシ-末端に単一のシステイン残基(配列番号:72、114、および116、それぞれ)を含むように改変することができる。アミノ酸置換は保存的(すなわち、残基を同じ属のタイプもしくはグループの他の残基により置き換える場合)であってもよくまたは非保存的(すなわち、残基を他のタイプのアミノ酸により置き換える場合)であってもよい。さらに、天然に存在しないアミノ酸を、天然に存在するアミノ酸と置き換えてもよい(すなわち、天然に存在しない保存的アミノ酸置換または天然に存在しない非保存的アミノ酸置換)。
【0055】
合成されたポリペプチドは、天然にはDNAによってコードされないアミノ酸(例えば、天然に存在しないすなわち非天然アミノ酸)の置換を含みうる。天然に存在しないアミノ酸の例は、D-アミノ酸、システインの硫黄原子に結合したアセチルアミノメチル基を有するアミノ酸、PEG化アミノ酸、化学式NH2(CH2)nCOOH(式中、nは2〜6である)のωアミノ酸、中性非極性アミノ酸、例えばサルコシン、t-ブチルアラニン、t-ブチルグリシン、N-メチルイソロイシン、およびノルロイシンなどを含みうる。フェニルグリシンは、Trp、Tyr、またはPheと置換しうる;シトルリンおよびメチオニンスルホキシドは中性非極性であり、システイン酸は酸性であり、オルニチンは塩基性である。プロリンをヒドロキシプロリンで置換し、立体配座付与特性を保持することができる。
【0056】
類似体を置換突然変異誘発によって作製し、元来のポリペプチドの生物学的活性を保持してもよい。「保存的置換」と同定される置換の例を、表2に示す。かかる置換が所望でない変化をもたらせば、表3の「例示の置換」に表示されるかまたはアミノ酸クラスに関して本明細書に更に記載される他のタイプの置換を導入してその産物をスクリーニングする。
【0057】
機能または免疫学的同一性の実質的な改変を達成するには、(a)置換領域におけるポリペプチド骨格の構造(例えば、シートもしくはへリックス構造)、(b)標的部位における分子の電荷もしくは疎水性、または(c)側鎖の体積、を維持する効果が有意に異なる置換を選択する。天然に存在する残基は、共通の側鎖の特性に基づいて次のいくつかのグループに分類される:
(1)疎水性:ノルロイシン、メチオニン(Met)、アラニン(Ala)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、ヒスチジン(His)、トリプトファン(Trp)、チロシン(Tyr)、フェニルアラニン(Phe);
(2)中性親水性:システイン(Cys)、セリン(Ser)、トレオニン(Thr);
(3)酸性/負荷電:アスパラギン酸(Asp)、グルタミン酸(Glu);
(4)塩基性:アスパラギン(Asn)、グルタミン(Gln)、ヒスチジン(His)、リシン(Lys)、アルギニン(Arg);
(5)鎖配向に影響を及ぼす残基:グリシン(Gly)、プロリン(Pro);
(6)芳香族性:トリプトファン(Trp)、チロシン(Tyr)、フェニルアラニン(Phe)、ヒスチジン(His);
(7)極性:Ser、Thr、Asn、Gln;
(8)塩基性正荷電:Arg、Lys、His;および
(9)荷電:Asp、Glu、Arg、Lys、His。
【0058】
他のアミノ酸置換を表3に掲げる。
【0059】
表2:アミノ酸置換
【表2】

【0060】
ポリペプチド誘導体およびペプチドミメチック
天然に存在するアミノ酸からなるポリペプチドに加えて、ペプチドミメチックまたはポリペプチド類似体も本発明に包含され、従って本発明の化合物で使用されるペプチドベクターまたはポリペプチド治療薬を形成することができる。ポリペプチド類似体は、製薬産業において、テンプレートポリペプチドと類似した特性を有する非ペプチド薬として一般的に使用されている。非ペプチド化合物は、「ペプチドミメチック」と呼ばれる(Fauchere et al., Infect. Immun. 54:283-287 ,1986およびEvans et al., J. Med. Chem. 30:1229-1239, 1987)。治療上有用なペプチドまたはポリペプチドと構造的に関連するペプチドミメチックを使用して、同等のもしくは強化された治療または予防効果を得ることができる。一般に、ペプチドミメチックはパラダイムポリペプチド(すなわち、生物学的または薬理学的活性を有するポリペプチド)、例えば、天然に存在する受容体結合ポリペプチドと構造的に類似するが、当技術分野において周知の方法によって、例えば、-CH2NH-、-CH2S-、-CH2-CH2-、-CH=CH-(シスおよびトランス)、-CH2SO-、-CH(OH)CH2-、-COCH2-などの結合により任意に置き換えられた1以上のペプチド結合を有する(Spatola, Peptide Backbone Modifications, Vega Data, 1(3):267, 1983;Spatola et al., Life Sci. 38:1243-1249, 1986;Hudson et al., Int. J. Pept. Res. 14:177-185, 1979;およびWeinstein. B., 1983, Chemistry and Biochemistry, of Amino Acids, Peptides and Proteins, Weinstein編、Marcel Dekker, New-York)。かかるポリペプチドミメチックは天然に存在するポリペプチドより大きな利点を有しうるのであって、その利点としては、より経済的な製造、より高い化学安定性、薬理学的特性(例えば、半減期、吸収、効力、効率)の向上、抗原性の低下などが挙げられる。
【0061】
本明細書に記載したペプチドベクターはBBBを効率的に横切るかまたは特定の細胞型(例えば、本明細書に記載したもの)を標的化しうる一方、その有効性はプロテアーゼの存在によって低下しうる。同じように本発明で使用するポリペプチド治療薬の有効性も同様に低下しうる。血清プロテアーゼは、切断に対してL-アミノ酸とペプチド結合を含む特異的な基質要件を有する。さらに、血清中のプロテアーゼ活性の最も顕著な成分であるエキソペプチダーゼは、通常、ポリペプチドの最初のペプチド結合に作用し、そして遊離したN-末端を必要とする(Powell et al., Pharm. Res. 10:1268-1273, 1993)。この点を考慮すると改変型ポリペプチドの使用はしばしば有利である。改変ポリペプチドは、元来のL-アミノ酸ポリペプチドの構造的特性を保持するが、有利なことに、プロテアーゼおよび/またはエキソペプチダーゼによる切断を容易に受けることはない。
【0062】
コンセンサス配列の1以上のアミノ酸を同じタイプのD-アミノ酸(例えば、エナンチオマー;L-リシンの代わりにD-リシン)と体系的に置き換えることによって、より安定なポリペプチドを生成することができる。従って、本明細書に記載したポリペプチド誘導体またはペプチドミメチックは、すべてL-、すべてD-またはD、L混合のポリペプチドであってもよい。ペプチダーゼはD-アミノ酸を基質として利用することができないので、N-末端またはC-末端のD-アミノ酸の存在は、ポリペプチドのin vivo安定性を向上する(Powell et al., Pharm. Res. 10:1268-1273, 1993)。リバースD-ポリペプチドは、L-アミノ酸を含むポリペプチドに対して逆配列で配置されたD-アミノ酸を含むポリペプチドである。従って、L-アミノ酸ポリペプチドのC-末端残基は、D-アミノ酸ポリペプチドのN-末端になり、以降も同様である。リバースD-ポリペプチドは、L-アミノ酸ポリペプチドと同じ三次構造、従って同じ活性を保持するが、in vitroおよびin vivoでの酵素分解に対してより安定であり、従って元来のポリペプチドより大きな治療効果を有する(Brady and Dodson, Nature 368:692-693, 1994 and Jameson et al., Nature 368:744-746, 1994)。リバースD-ポリペプチドだけでなく、コンセンサス配列または実質的に同一なコンセンサス配列変化を含む拘束されたポリペプチドを、当技術分野において周知の方法によって作製することができる(Rizo et al., Ann. Rev. Biochem. 61:387-418, 1992)。例えば、拘束されたポリペプチドを、ジスルフィド架橋を形成できるシステイン残基の付加によって作製し、それによって環状ポリペプチドを得ることができる。環状ポリペプチドは遊離したN-またはC-末端を持たない。従ってこれらはエキソペプチダーゼによるタンパク質分解を受けない、もっともこれらは、勿論、ポリペプチド末端で切断しないエンドペプチダーゼに対しては感受性である。N-末端またはC-末端D-アミノ酸を有するポリペプチドおよび環状ポリペプチドのアミノ酸配列は、N-末端もしくはC-末端D-アミノ酸残基の
存在またはそれらの環状構造の存在を除けば、それぞれ、対応するポリペプチドの配列と通常同一である。
【0063】
分子内ジスルフィド結合を有する環状誘導体は、アミノ末端およびカルボキシ末端などの環化のために選択した部位に、好適なS-保護システインまたはホモシステイン残基を組み込むとともに、従来の固相合成によって調製することができる。(Sah et al., J. Pharm. Pharmacol. 48:197, 1996)。環化は、ポリペプチド鎖構築の完了後、(1)S-保護基の選択的除去、その結果として起こる対応する2つの遊離SH-官能基の支持体上での酸化(S-S結合を形成する)、それに続く、生成物の支持体からの通常の除去および適当な精製処理によって、または(2)完全な側鎖脱保護と並行したポリペプチドの支持体からの除去、それに続く、高希釈した水溶液中での遊離SH-官能基の酸化によって実施することができる。
【0064】
分子内アミド結合を有する環状誘導体は、環化のために選択した部位に、好適なアミノ側鎖およびカルボキシル側鎖が保護されたアミノ酸誘導体を組み込むとともに、通常の固相合成によって調製することができる。分子内-S-アルキル結合を有する環状誘導体は、環化のために選択した部位に、好適なアミノ基側鎖が保護されたアミノ酸残基および好適なS-保護システインまたはホモシステイン残基を組み込むとともに、従来の固相化学によって調製することができる。
【0065】
ポリペプチドのN-末端またはC-末端残基に作用するペプチダーゼに対して抵抗性を与える他の効果的な手法は、改変されたポリペプチドがもはやペプチダーゼの基質ではないように、ポリペプチド末端に化学基を付加することである。このような化学修飾の1つは、どちらか一方または両方の末端におけるポリペプチドのグリコシル化である。ある特定の化学修飾、特にN-末端グリコシル化は、ヒト血清中のポリペプチドの安定性を向上することが示されている(Powell et al., Pharm. Res. 10:1268-1273, 1993)。血清安定性を向上する他の化学修飾には、限定されるものでないが、アセチル基などの1〜20個の炭素の低級アルキルからなるN-末端アルキル基の付加、および/またはC-末端アミドもしくは置換アミド基の付加が含まれる。特に、本発明はN-末端アセチル基および/またはC-末端アミド基を有するポリペプチドからなる改変ポリペプチドを包含する。
【0066】
また本発明には、その誘導体がポリペプチドの所望の機能的活性を保持するならば、通常はポリペプチドの一部でない更なる化学的部分を有する他のタイプのポリペプチド誘導体も含まれる。かかる誘導体の例としては、(1)アミノ末端または他の遊離アミノ基のN-アシル誘導体(ここでアシル基はアルカノイル基(例えば、アセチル、ヘキサノイル、オクタノイル)、アロイル基(例えば、ベンゾイル)もしくはF-moc(フルオレニルメチル-O-CO-)のようなブロック基であってもよい);(2)カルボキシ末端のまたは他の遊離カルボキシ基もしくはヒドロキシル基のエステル;(3)アンモニアもしくは適当なアミンとの反応によって生じる、カルボキシ末端のまたは他の遊離カルボキシル基のアミド;(4)リン酸化誘導体が挙げられる。
【0067】
本明細書に記載したポリペプチドへのさらなるアミノ酸残基の付加から得られる、より長いポリペプチド配列も本発明に包含される。かかるより長いポリペプチド配列は、上記のポリペプチドと同様の生物学的活性および特異性(例えば、細胞指向性)を有すると期待することができる。かなりの数のさらなるアミノ酸を有するポリペプチドを除外しないものの、いくつかの大きなポリペプチドは有効な配列を遮蔽する立体配置をとり、その結果、標的(例えば、LRPまたはLRP2などのLRP受容体ファミリーの一員)との結合を妨げうると考えられる。これらの誘導体は競合的アンタゴニストとして作用しうる。従って、本発明は、伸張部を有する本明細書に記載したポリペプチドまたはポリペプチドの誘導体を包含するが、望ましくは、その伸張部はポリペプチドまたはその誘導体の細胞を標的化する活性を損なうものではない。
【0068】
本発明に包含される他の誘導体は、直接、またはスペーサーを介してアラニン残基の短い伸張部によりもしくはタンパク質分解の推定部位により(例えばカテプシンにより、例えば、米国特許第5,126,249号および欧州特許第495 049号を参照されたい)お互いに共有結合された、本明細書に記載した2つの同一のあるいは2つの異なるポリペプチドからなる二重ポリペプチドである。本明細書に記載したポリペプチドの多量体は、同じかまたは異なるポリペプチドまたはその誘導体から形成された分子のポリマーから成る。
【0069】
本発明はまた、そのアミノ末端もしくはカルボキシ末端、もしくは両方で、異なるタンパク質のアミノ酸配列と結合した、本明細書に記載したポリペプチドまたはその断片を含有するキメラタンパク質あるいは融合タンパク質であるポリペプチド誘導体を包含する。かかるキメラタンパク質または融合タンパク質は、そのタンパク質をコードする核酸の組換え発現によって作製することができる。例えば、キメラタンパク質または融合タンパク質は記載したポリペプチドの1つと共有する少なくとも6アミノ酸を含有し、望ましくは同等のまたはより大きい機能的活性を有するキメラタンパク質または融合タンパク質をもたらしうる。
【0070】
ペプチドミメチックを同定するアッセイ
上記のように、本明細書に記載したポリペプチドの骨格幾何およびファルマコフォア提示を再現するために作製した非ペプチド化合物(ペプチドミメチック)は、しばしば、より高い代謝的安定性、より高い効力、より長い作用持続時間、ならびにより良いバイオアベイラビリティの特性を有する。
【0071】
本発明のペプチドミメチック化合物は当技術分野において公知のコンビナトリアルライブラリー法での多数の手法のいずれかを用いて入手することができ、前記手法としては、生物学的ライブラリー;空間的に位置指定可能な平行固相もしくは液相ライブラリー;デコンボリューションを必要とする合成ライブラリー法;「1ビーズ1化合物」ライブラリー法、およびアフィニティークロマトクラフィー選択を用いる合成ライブラリー法が挙げられる。生物学的ライブラリー手法はペプチドライブラリーに限定されるが、他の4つの手法は、ペプチド、非ペプチドオリゴマーまたは化合物の小分子ライブラリー(Lam, Anticancer Drug Des. 12:145, 1997)に適用できる。分子ライブラリーの合成方法の例は、当技術分野において、例えば、DeWitt et al.(Proc. Natl. Acad. Sci. USA 90:6909, 1993);Erb et al.(Proc. Natl. Acad. Sci. USA 91:11422, 1994);Zuckermann et al.(J. Med. Chem. 37:2678, 1994);Cho et al.(Science 261:1303, 1993);Carell et al.(Angew. Chem, Int. Ed. Engl. 33:2059, 1994 and ibid 2061);ならびにGallop et al.(Med. Chem. 37:1233, 1994)に見出すことができる。化合物のライブラリーは溶液中で(例えば、Houghten, Biotechniques 13:412-421, 1992)、ビーズ上で(Lam, Nature 354:82-84, 1991)、チップで(Fodor, Nature 364:555-556, 1993)、細菌もしくは胞子(米国特許第5,223,409号)で、プラスミド(Cullら、Proc. Natl. Acad. Sci. USA 89:1865-1869, 1992)で、ファージ上で(ScottおよびSmith, Science 249:386-390, 1990)、またはルシフェラーゼで提示し、そして酵素標識を適当な基質の生成物への変換の測定により検出することができる。
【0072】
いったん本明細書に記載したポリペプチドが同定されると、それを、限定されるものでないが、溶解度の違い(例えば、沈殿)、遠心分離、クロマトグラフィー(例えば、アフィニティー、イオン交換、サイズ排除など)を含む多くの標準方法のいずれかによって、またはペプチド、ペプチドミメチックもしくはタンパク質の精製に使用されるいずれか他の標準技術によって、単離しかつ精製することができる。同定した目的のポリペプチドの機能的特性は、当技術分野において公知のいずれかの機能アッセイを用いて評価することができる。細胞内シグナル伝達における下流受容体機能を評価するアッセイ(例えば、細胞増殖)を使用することが望ましい。
【0073】
例えば、本発明のペプチドミメチック化合物は、下記の3ステップ:すなわち、(1)本明細書に記載したポリペプチドを走査して、本明細書に記載した特定の細胞型を標的化するために必要な二次構造の領域を同定するステップ;(2)立体配座で拘束したジペプチド代替物を使用して骨格幾何を洗練し、これらの代替物に対応する有機基本骨格を提供するステップ;および(3)最良の有機基本骨格を用いて、天然のポリペプチドの望ましい活性を模倣するように設計した候補のライブラリーにおいて有機ファルマコフォアを提示するステップより成るプロセスを用いて入手することができる。さらに詳細には、3ステップは次の通りである。第一ステップでは、リード候補ポリペプチドを走査し、それらの構造を要約し、それらの活性のための要件を同定する。一連の元来のポリペプチドの類似体を合成する。第二ステップでは、立体配座で拘束したジペプチド代替物を用いて、最良のポリペプチド類似体を研究する。インドリジジン-2-オン、インドリジジン-9-オンおよびキノリジジノンアミノ酸(それぞれI2aa、I9aaおよびQaa)を、最良のペプチド候補の骨格幾何を研究するための基本骨格として使用した。これらおよび関連基本骨格(Halab et al., Biopolymers 55:101-122, 2000;およびHanessian et al., Tetrahedron 53:12789-12854, 1997に総括されている)をポリペプチドの特定の領域に導入し、ファルマコフォアを色々な方向に配向することができる。これらの類似体の生物学的評価によって、活性のための幾何学的要件を模倣する改善されたリードポリペプチドが同定される。第三ステップでは、最も活性の高いリードポリペプチド由来の基本骨格を用いて、生来のペプチドの活性に関わるファルマコフォアの有機代替物を提示する。ファルマコフォアと骨格を平行合成フォーマットで組み合わせる。ポリペプチドの誘導と上記ステップは、当技術分野で公知の方法を用いる他の手段により達成してもよい。
【0074】
本明細書に記載したポリペプチド、ポリペプチド誘導体、ペプチドミメチックまたは他の小分子から決定される構造機能相関は、同様のまたはより良い特性を有する類似の分子構造を改善、作製するために使用することができる。従って、本発明の化合物はまた、本明細書に記載したポリペプチドの構造、極性、荷電特性および側鎖特性を共有する分子も包含する。
【0075】
要約すると、当業者は本明細書の開示に基づいて、特定の細胞型(例えば、本明細書に記載したもの)に薬剤を標的化する化合物を同定するのに有用なペプチドおよびペプチドミメチック・スクリーニングアッセイを開発することができる。本発明のアッセイは、ロー(低)スループット、ハイ(高)スループット、またはウルトラハイ(超高)スループットスクリーニング方式用に開発することができる。本発明のアッセイには自動化が可能なアッセイが含まれる。
【0076】
リンカー
ポリペプチド治療薬(例えば、レプチン)をベクターペプチドに直接(例えば、ペプチド結合などの共有結合を介して)結合してもよく、またはリンカーを介して結合してもよい。リンカーには化学連結剤(例えば、切断可能なリンカー)およびペプチドが含まれる。
【0077】
いくつかの実施形態において、リンカーは化学連結剤である。ポリペプチド治療薬とベクターペプチドを、スルフヒドリル基、アミノ基(アミン類)、および/もしくは糖類または任意の適当な反応基を介してコンジュゲートしてもよい。ホモ二官能およびヘテロ二官能クロスリンカー(コンジュゲーション剤)が多数の商業供給源から利用可能である。クロスリンクに利用できる領域は本発明のポリペプチド上に見出すことができる。クロスリンカーは柔軟性のあるアーム、例えば、例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、または15個の炭素原子を含みうる。例示のクロスリンカーとしては、BS3([ビス(スルホスクシンイミジル)スベリン酸エステル];BS3はアクセス可能な一級アミン類を標的化するホモ二官能性N-ヒドロキシスクシンイミドエステルである)、NHS/EDC(N-ヒドロキシスクシンイミドおよびN-エチル-(ジメチルアミノプロピル)カルボジイミド;NHS/EDCは一級アミン基とカルボキシル基とのコンジュゲーションを可能にする)、スルホ-EMCS([N-ε-マレイミドカプロン酸 スルホ-N-スクシンイミジルエステル];スルホ-EMCSはスルフヒドリルおよびアミノ基に対して反応性であるヘテロ二官能性の反応基である(マレイミドおよびNHS-エステル))、ヒドラジド(ほとんどのタンパク質は曝された糖類を含有し、ヒドラジドはカルボキシル基を一級アミン類と連結するために有用な試薬である)、およびSATA(N-スクシンイミジル-S-アセチルチオアセテート;SATAはアミン類に対して反応性であり、保護されたスルフヒドリル基を加える)が挙げられる。
【0078】
共有結合を形成するために、ヒドロキシル部分がペプチドを改変するのに必要なレベルで生理学的に許容しうる場合は化学反応基として色々な種類の活性カルボキシル基(例えば、エステル)を利用することができる。具体的な薬剤には、N-ヒドロキシスクシンイミド(NHS)、N-ヒドロキシ-スルホスクシンイミド(スルホ-NHS)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミド(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)が含まれる。
【0079】
一級アミン類はNHSエステルの主な標的である。接近可能なタンパク質のN末端に存在するα-アミンとリシンのε-アミンはNHSエステルと反応する。NHSエステルコンジュゲーション反応物が一級アミン類と反応するとアミド結合が形成され、N-ヒドロキシスクシンイミドを放出する。これらのスクシンイミドを含有する反応基を本明細書ではスクシンイミジル基と呼ぶ。本発明のある特定の実施形態において、タンパク質上の官能基はチオール基であってもよく、化学反応基はマレイミドを含有する基、例えば、γ-マレイミド-ブチリルアミド(GMBAまたはMPA)であってもよい。かかるマレイミドを含有する基を本明細書ではマレイミド基と呼ぶ。
【0080】
マレイミド基は、反応混合物が6.5〜7.4である場合にペプチドのスルフヒドリル基に対して最も選択性がある。pH7.0においてマレイミド基とスルフヒドリル(例えば、血清アルブミンまたはIgGなどのタンパク質上のチオール基)との反応速度はアミン類とのそれより1000倍速い。従って、マレイミド基とスルフヒドリルの間に安定なチオエーテル連鎖を形成することができる。
【0081】
他の実施形態において、リンカーは少なくとも1つのアミノ酸(例えば、少なくとも2、3、4、5、6、7、10、15、20、25、40、または50アミノ酸のペプチド)を含む。ある特定の実施形態において、リンカーは単一アミノ酸(例えば、Cysなどの任意の天然アミノ酸)である。他の実施形態においては、グリシンの豊富なペプチド、例えば、配列[Gly-Gly-Gly-Gly-Ser]n(ここでnは1、2、3、4、5または6であり、米国特許第7,271,149号に記載の通り使用される)を有するペプチドが使用される。他の実施形態においては、米国特許第5,525,491号に記載のとおり、セリンリッチペプチドリンカーを使用する。セリンリッチペプチドリンカーには式[X-X-X-X-Gly]y(Xの2個以上はThr、残りのXはSer、そしてyは1〜5である)のものが含まれる(例えば、Ser-Ser-Ser-Ser-Glyであってyが2以上である)。いくつかの事例において、リンカーは単一のアミノ酸(例えば、任意のアミノ酸、例えば、GlyまたはCys)である。
【0082】
好適なリンカーの例は、コハク酸、Lys、Glu、およびAsp、またはジペプチド、例えばGly-Lysである。リンカーがコハク酸である場合、その1つのカルボキシル基はアミノ酸残基のアミノ基とアミド結合を形成しうるし、他のカルボキシル基は、例えば、ペプチドまたは置換基のアミノ基とアミド結合を形成しうる。リンカーがLys、Glu、またはAspである場合、そのカルボキシル基はアミノ酸残基のアミノ基とアミド結合を形成しうるし、そのアミノ基は、例えば、置換基のカルボキシル基とアミド結合を形成しうる。Lysをリンカーとして使用する場合、さらなるリンカーをLysのε-アミノ基と置換基の間に挿入してもよい。1つの特定の実施形態において、さらなるリンカーはコハク酸であり、例えば、Lysのε-アミノ基とアミド結合を形成しかつ置換基に存在するアミノ基とアミド結合を形成する。一実施形態において、さらなるリンカーはGluまたはAspであり(例えば、Lysのε-アミノ基とアミド結合を形成しかつ置換基に存在するカルボキシル基と他のアミド結合を形成する)、すなわち、置換基はNε-アシル化リシン残基である。
【0083】
代謝障害治療法
ある特定の実施形態においては、本発明のコンジュゲートを代謝障害を治療するために使用する。かかる障害には糖尿病(I型またはII型)、肥満、高血糖、異脂肪血症、高トリグリセリド血症、症候X、インスリン抵抗性、IGT、糖尿病の異脂肪血症、高脂血症、心血管疾患、および高血圧が含まれる。レプチンは食物摂取を低減し、従って体重を減少するためにおよび食物摂取の低減または体重減少が有利な疾患を治療するために使用することができる。
【0084】
神経学的疾患治療法
本明細書に記載したポリペプチドはBBBを横切って薬剤を輸送することができるため、本発明の化合物はまた、神経学的疾患、例えば、神経変性疾患または中枢神経系(CNS)、末梢神経系、もしくは自律神経系の他の症状(例えば、ニューロンが失われるかまたは損なわれる)の治療にも有用である。多くの神経変性疾患は、運動失調(すなわち、非協調性筋肉運動)および/または記憶障害を特徴とする。神経変性疾患には、アレキサンダー病、アルパース病、アルツハイマー病、筋萎縮性側索硬化症(ALS;すなわち、ルー・ゲーリッグ病)、毛細血管拡張性運動失調症、バッテン病(シュピールマイアー・フォークト・シェーグレン・バッテン病)、牛海綿状脳症(BSE)、カナバン病、コケイン症候群、大脳皮質基底核変性症、クロイツフェルト・ヤコブ病、ハンチントン病、HIV関連認知症、ケネディ病、クラッベ病、レビー小体型認知症、マシャド・ジョセフ病(脊髄小脳失調症3型)、多発性硬化症、多系統萎縮症、ナルコレプシー、神経ボレリア症、パーキンソン病、ペリツェウス・メルツバッハー病、ピック病、原発性側索硬化症、プリオン病、レフサム病、シルダー病(すなわち、副腎白質ジストロフィー)、統合失調症、脊髄小脳失調、脊髄性筋萎縮症、スティール・リチャードソン・オルゼウスキー症候群、および脊髄ろうが含まれる。
【0085】
さらなる適応症
本発明のコンジュゲートはまた、他の器官または組織において見られる疾患を治療するためにも使用することができる。例えば、Angiopep-7(配列番号112)は、肝臓、肺、腎臓、脾臓、および筋肉細胞に効率的に輸送され、これらの組織に関連した疾患(例えば、肝細胞癌および肺癌)の選択的治療を可能にする。本発明の化合物はまた、特定の遺伝子転写産物の下方制御が有用でありうるダウン症候群(すなわち、21トリソミー)のような遺伝障害を治療するためにも使用することができる。
【0086】
投与および用量
本発明はまた、治療有効量の本発明の化合物を含有する医薬組成物を特徴とする。組成物は、様々な薬物送達システムで用いるために製剤化することができる。1以上の生理的に許容される賦形剤または担体を、適当な製剤のために組成物に含有してもよい。本発明に使用するための適当な製剤は、Remington’s Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, PA, 17th ed., 1985に見出される。薬物を送達する方法の簡略な総説は、例えば、Langer(Science 249:1527-1533, 1990)を参照されたい。
【0087】
医薬組成物は予防および/または治療処置のための非経口、鼻腔内、局所、経口、または局部(例えば経皮手段による)投与を意図している。医薬組成物は、非経口的に(例えば、静脈内、筋肉内、または皮下注射によって)、または経口摂取によって、あるいは、血管もしくは癌症状により侵された部位における局所適用または関節内注射によって投与することができる。さらなる投与経路には、血管内、動脈内、腫瘍内、腹腔内、脳室内、硬膜内、ならびに経鼻、点眼、強膜内、眼窩内、直腸、局所、またはエアロゾル吸入投与が含まれる。デポー注射または浸食性インプラントもしくは成分などの方法による持続放出投与も、具体的に本発明に包含される。従って、本発明は、許容される担体、好ましくは、例えば、水、緩衝水、生理食塩水、PBSなどの水性担体に溶解または懸濁した上述の薬剤を含有する非経口投与用組成物を提供する。組成物は近似生理条件に必要とされる製薬上許容される助剤、例えば、pH調整剤および緩衝剤、等張性調整剤、湿潤剤、界面活性剤などを含有してもよい。本発明はまた、経口送達用組成物を提供し、錠剤、カプセルを製剤するために結合剤または充填剤のような不活性成分を含有してもよい。さらに、本発明は局所投与用の組成物を提供し、クリーム、軟膏などを製剤するために溶媒または乳化剤などの不活性成分を含有してもよい。
【0088】
これらの組成物は従来の滅菌技術によって滅菌してもよく、またはろ過滅菌してもよい。得られる水溶液はそのままの使用のために包装しても、凍結乾燥してもよく、凍結乾燥した調製物を投与前に滅菌水性担体と組み合わせてもよい。調製物のpHは典型的には、3〜11、より好ましくは5〜9または6〜8、最も好ましくは7〜8、例えば7〜7.5である。得られる固形の組成物は、それぞれ一定量の上述の薬剤を含有する複数の単回投与単位で、例えば、錠剤またはカプセルの密封包装で包装してもよい。
【0089】
固形の組成物はまた、量を調節できる容器に入れて、例えば、局所に適用可能なクリームまたは軟膏用に作られた絞り出しチューブに入れて包装してもよい。
【0090】
有効量を含有する組成物を予防または治療処置のために投与することができる。予防の適用では、組成物を臨床的に決定した素因、あるいは代謝障害または神経学的疾患に対する感受性の高い患者に投与することができる。本発明の組成物は、臨床疾患の発症を遅延、減少、または好ましくは予防するために十分な量だけ被験体(例えば、ヒト)に投与することができる。治療の適用では、組成物を、既に疾患(例えば、本明細書に記載したような代謝障害または神経学的疾患)に罹患している被験体(例えば、ヒト)に、症状の症候群およびその合併症を治癒する、または少なくとも部分的に抑制するために十分な量で投与する。この目的を達成するために適当な量は「治療有効量」、疾患または病状に関連するいくつかの兆候を実質的に改善するために十分な化合物の量と定義される。例えば、代謝障害(例えば、本明細書に記載した)の治療では、疾患もしくは症状のいずれかの兆候を減少、予防、遅延、抑制、または阻止する薬剤あるいは化合物は治療上有効でありうる。
【0091】
治療有効量の薬剤または化合物は、疾患もしくは症状を治癒する必要はないが、疾患もしくは症状の治療、例えば、個体において、疾患もしくは症状の発症を遅延、阻害、もしくは予防するか、または疾患もしくは症状の症候群を改善するか、または疾患もしくは症状の期間を変えるか、または、例えば、より軽症にするか、または回復を促進する治療を提供するであろう。
【0092】
レプチンを0.001〜3mg/kg(例えば、0.005、0.01、0.05、0.1、0.5、1、2、または3mg/kg)のいずれかの用量で投与してもよい。本発明の化合物を、レプチンについて記載したのと同等の用量で投与してもよく、より高い同等の用量(例えば、10%、25%、50%、100%、200%、500%、1000%より多い用量)で投与してもよく、またはより低い同等の用量(例えば、同等の用量の90%、75%、50%、40%、30%、20%、15%、12%、10%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、または0.1%)で投与することもできる。この使用に有効な量は、疾患もしくは症状の重症度ならびに被験体の体重および全身の状態に応じうる。最初の投与と追加投与に対する好適なレジメンは、典型的には、最初の投与と、引き続いて1以上の毎時間、毎日、毎週、または毎月の間隔の繰り返し用量の投与である。本発明の組成物中に存在する薬剤の総有効量を哺乳動物に、単一用量としてボーラスでもしくは比較的短時間にわたる輸液により投与してもよく、または分割治療プロトコルを用いて投与する、すなわち、複数用量をより長い時間にわたって(例えば、毎4〜6、8〜12、14〜16、または18〜24時間、または毎2〜4日、毎1〜2週、毎月に1用量)投与してもよい。あるいは、血液中の治療有効濃度を維持するのに十分な連続静脈内注射が考えられる。
【0093】
本発明の組成物中に存在しかつ哺乳動物(例えば、ヒト)に適用する本発明の方法で使用する1以上の薬剤の治療有効量は、被験体の年齢、体重、および症状の個体差を考慮して、当業者が決定することができる。本発明のある特定の化合物はBBBを横切る高い能力を示すので、本発明の化合物の用量は、コンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストの治療効果に必要な同等の用量より低くてもよい(例えば、同等の用量の約90%、75%、50%、40%、30%、20%、15%、12%、10%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、または0.1%より低いかまたは等しい)。本発明の薬剤を被験体(例えば、ヒトなどの哺乳動物)に有効な量、すなわち、治療する被験体に望ましい結果(例えば、糖血症の軽減、体重の低下、体重減少の増加、および食物摂取の低下)をもたらす量だけ投与する。治療有効量はまた、当業者が実験的に決定することができる。
【0094】
被験体はまた、1用量あたり約80μg〜240mgの範囲のレプチンと比較した同等の用量の薬剤を、毎週1回以上(例えば、毎週2、3、4、5、6、または7回以上)、例えば、1日あたり1mg〜24mg同等の用量を受けてもよい。
【0095】
有効量を含む本発明の組成物の単回投与または複数回投与を、治療する医師が選択した用量レベルおよびパターンで行うことができる。用量および投与計画は、臨床医が通常行う方法もしくは本明細書に記載した方法によって治療期間にわたってモニターすることができる被験体の疾患または症状の重症度に基づいて決定しかつ調節することができる。
【0096】
本発明の化合物を従来の処置または治療方法と組み合わせて使用してもよく、または従来の処置または治療方法とは別に使用してもよい。
【0097】
本発明の化合物を他の薬剤による治療と組み合わせて投与する場合、それらを順次または同時に個体に投与してもよい。あるいは、本発明による医薬組成物は、本発明の化合物と本明細書に記載した製薬上許容される賦形剤および当技術分野で公知の別の治療薬または予防薬を合体した組み合わせから成ってもよい。
【実施例1】
【0098】
レプチンコンジュゲートの合成
次の手順を用いてレプチン-(C11)-AN2コンジュゲートを作製した。
【化2】

【0099】
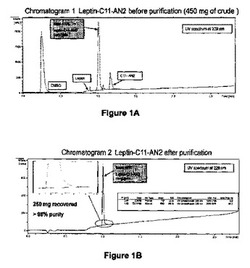
MUA-AN2(264.6mg、91.5μmol、1.2eq.、82%ペプチド含量)を、0.1N NaOH溶液(1.5ml)を加えてpHを3.9〜5.00に調節することにより、H2O/ACN(9/1)(14ml)に溶解した。この溶液をレプチン116-130-NH2(156.5mg、76.2μmol、1eq.、76%ペプチド含量)のPBS 4X(pH 6.61、7mL)中の溶液に加えた。反応を下記の分析法を用いてモニターした。結果を図1Aおよび1B(クロマトグラム1および2)に示す。
【0100】
反応が完了に向かうと濁った懸濁液が観察された。室温にて1時間後、反応(3.62mM)が完了し、その混合物をFPLCクロマトグラフィ(AKTA explorer、クロマトグラム3、表1を参照)により直接精製した。精製はGE Healthcare AKTA explorerカラム(GE Healthcare)30 RPC樹脂(ポリスチレン/ジビニルベンゼン)、95mlを用いて、次の条件で実施した:サンプル負荷:450mgを含む反応バッファー(21ml)、10%ACNを含むH2O、0.05%TFA(60ml)、DMSO.HCl(pH 2.87、6ml)、溶液A:H2O、0.05%TFA、溶液B:ACN、0.05%TFA、流量:5-17ml/min、勾配:10-30% B。
【0101】
精製結果を図2(クロマトグラム 3)に示す。
【0102】
化合物を精製するために用いた勾配を下表に示す。
【表3】

【0103】
アセトニトリルの蒸発と凍結乾燥の後に、白色の固体(250mg、79%、純度>98%)を得た。質量はESI-TOFMS(Bruker Daltonics)によってチェックした。いくらかの残留レプチン(116-130)-NH2が二量化しうる可能性(≦5%、システインペプチドMw=3119.44)を避けるために、直接精製を行い、1.2当量過剰のマレイミド-(C11)-AN2を得た。
【0104】
反応をモニターするために次の分析法を用いた。Waters Acquity UPLC BEHフェニルカラムを備えたWaters Acquity UPLCシステムを用いた(1.7μm、2.1 x 50mm)。検出は229nmで行った。溶液AはH2O、0.1%FAであり、溶液Bはアセトニトリル(ACN)、0.1%蟻酸(FA)であった。流量と勾配を下表に示す。
【表4】

【0105】
質量分析計(ESI-TOF-MS;Bruker Daltonics):計算値4125.53;測定値 4125.06、m/z 1376.01 (+3)、1032.26 (+4)、826.02 (+5)、688.52 (+6)。
【0106】
コンジュゲートを窒素雰囲気下、暗所で20℃未満にて貯蔵した。
【0107】
この手順を用いて作製したレプチンコンジュゲートは11-炭素リンカーに因んでレプチン-AN2(C11)と呼ぶ。レプチン-AN2(C3)およびレプチン-AN2(C6)を含む他の長さの炭素リンカーコンジュゲートも類似の手順を用いて作製した。
【実施例2】
【0108】
レプチン116-130Angiopep-2コンジュゲートのin situ脳潅流
どのレプチンコンジュゲートが最も効率的に血液脳関門を横切るかを確認するために、本発明者らは各コンジュゲートをin situ脳潅流アッセイで試験した。このアッセイまたは類似のアッセイは例えば、米国特許公報第20060189515号に記載されていて、これはDagenais et al., 2000, J. Cereb. Blood Flow Metab. 20(2):381-386に記載の方法に基づく。BBB輸送定数は、先にSmith(1996, Pharm. Biotechnol. 8:285-307)が記載した通り決定した。これらの実験から、レプチン-AN2(C11)は、C3またはC6リンカーを有するコンジュゲートと比較してBBBを横切る輸送が最大であることが示されたので、さらなる実験用に選択した(図3)。
【0109】
レプチンの輸送を、in situ潅流アッセイを用いて、痩せたマウスと食餌に起因する肥満(DIO)マウス(例えば、the Jackson laboratoriesから入手しうる)においてレプチン-AN2(C11)コンジュゲートと比較した。これらの結果から、DIOマウスにおけるBBBを横切るレプチンの輸送は痩せたマウスと比較して低下することがわかった。対照的に、レプチン-AN2(C11)コンジュゲートは、痩せたおよびDIOマウスの両方において遥かに効率的に脳を横切り、コンジュゲートの輸送において痩せたとDIOマウスの間で統計的有意差は観察されなかった(図4A)。血漿レプチンレベルは高脂肪(60%)食餌で3週間後に増加することが観察され、マウスはレプチン抵抗性となることを示唆した(図4B)。
【実施例3】
【0110】
レプチンコンジュゲートの食餌摂取および体重取得に与える効果
マウスに、レプチン-AN2(C11)(1マウス当たりレプチン116-130 1mg同等)、レプチン116-130(1mg/マウス)、または対照(生理食塩水)の静脈内ボーラス投与を行った(1グループ当たりn=5)。マウスの食餌摂取を4時間後(図5A)および15時間後(図5B)にモニターした。両方の事例において、コンジュゲートは、対照マウス、またはレプチン116-130を受けたマウスと比較して、有意に大きい食餌摂取の低下を示した。
【0111】
本発明者らはまた、コンジュゲート(2.5mg/マウス;レプチン116-130 1mg同等/マウス)、レプチン116-130(1mg/マウス)、および対照を受けるDIOマウスの体重変化を6日間にわたって比較した。各マウスは毎日腹腔内注入による処置を受けた。レプチンまたは対照を受けるマウスは類似した量の体重取得を6日間にわたり示したが、コンジュゲートを受けるマウスは対照マウスおよびレプチン116-130を受けるマウスと比較して、体重取得の著しい低下を示した(図6)。
【0112】
本発明者らはさらに、コンジュゲート(2.5mg/マウス;レプチン116-130 1mg同等/マウス)、レプチン116-130(1mg/マウス)、および対照を受けるレプチン欠乏性ob/obマウス体重変化を6日間にわたって比較した。各マウス(1グループ当たりn=5)は毎日腹腔内注入により処置を受けた。コンジュゲートを受けるマウスは、投与期間にレプチン116-130または対照を受けるマウスより低い体重取得を示した(図7)。
【実施例4】
【0113】
組換えAngiopep-2およびAngiopep-2レプチン融合タンパク質の開発
本発明者らはまた、Angiopep-2 融合タンパク質を開発した。最初のステップとして、cDNA(ACC TTT TTC TAT GGC GGC AGC CGT GGC AAA CGC AAC AAT TTC AAG ACC GAG GAG TAT;配列番号117)を創製した。この配列をpGEXベクター系中に挿入し、細菌に発現し、そしてインサートの配列を検証した(図8)。GST-An2-レプチン116-130構築物を、オーバーラップ伸長PCR戦略を利用して作製した(図9)。
【0114】
組換えAngiopep-2を細菌発現系で発現し、GSH-セファロースカラムを用いて精製した。この手順から得たクロマトグラム(図10)を示す。精製したAngiopep-2を、Angiopep-2抗体を用いてウェスタンブロット(図11A)により、液体クロマトグラフィ(図11B)により、および質量分析計(図11C)により分析した。
【0115】
in situ脳潅流アッセイを、組換えAngiopep-2を用いて実施した。結果を合成Angiopep-2と比較した(図12)。類似の取込みレベルをAngiopep-2の両方の型で観察した。実質中への取込みをGST、GST-Angiopep-2、GST-レプチン116-130、および GST-Angiopep-2-レプチン116-130の間で比較した(図 13)。これらの結果は、Angiopep-2 配列を含有する融合タンパク質は実質中に効率的に取込まれるが、Angiopep-2 配列を欠くタンパク質は遥かに低い効率でしか取込まれないことを示す。
【0116】
全長レプチン配列を含有するHis-タグ付きAngiopep-2/マウスレプチン融合タンパク質を作製した(図14)。この融合タンパク質を細菌の発現系において発現させた(図15)。融合タンパク質の例示の精製スキームを図17Aおよび17Bに示す。小規模精製で得た結果を図18に示す。
【0117】
トロンビン切断ステップによって2種の産物が産生し、Angiopep-2配列は図19に示した低アフィニティトロンビン切断部位を含有するという可能性を示唆した。レプチン-Angiopep-2は溶液中で凝固する傾向があるので、凝集を低減しかつ収率を改善する精製条件を試験した。
【実施例5】
【0118】
レプチン融合タンパク質の脳取込みと活性
本発明者らは次いで、in situ脳潅流アッセイを用いてAngiopep-2-レプチン融合タンパク質がDIOマウスの脳実質中に取込まれる能力を、レプチンと比較して試験した(図20)。この実験から、本発明者らは融合タンパク質がレプチンと比較して取込みの増加を示すことを観察した。
【0119】
対照として、組換えレプチンがob/obマウスの体重を低下する能力を、毎日0.1mg/マウスまたは0.25mg/マウスを用いて試験した。図21に示した通り、レプチンはまさに用量に応じてこれらのマウスの体重を低下した。
【0120】
DIOマウスをまた、対照でまたは50μg his-タグ付き融合タンパク質、レプチン、もしくはhis-タグ付きレプチンで処置した。マウスは示したように2つの処置を第3日と第4日に受けた。これらの結果に基づくと、最高の体重減少は融合タンパク質を受けたマウスにおいて観察された(図22)。
【0121】
他の実施形態
米国特許仮出願第61/200,947号および第61/178,837号(それぞれ、2008年12月5日および2009年5月15日出願)を含む、本明細書に記述したすべての特許、特許出願、および公報は、あたかも各独立した特許、特許出願、もしくは公報が具体的にかつ個々に参照により本明細書に組み込まれると示されたのと同程度に本明細書に組み込まれる。
【技術分野】
【0001】
本発明はペプチドベクターと結合したレプチン、レプチン類似体、またはOB受容体アゴニストを含む化合物に関する。
【背景技術】
【0002】
全世界において、肥満症の罹患率は増加中である。全世界に世界保健機構(World Health Organization)による肥満の成人(肥満度指数(BMI)>30)は3億人を超え、そして過体重の人(BMI>25)は11億人存在する。米国では、成人の半数以上(64.5%)が過体重であり、ほぼ3分の1が肥満である。肥満は2型糖尿病、冠動脈疾患、ある特定の癌の発生率増加、呼吸複合症、および骨関節炎などの症状と関連がある。過体重または肥満は平均余命を低下する周知の因子であり、米国において毎年300,000人の早死の原因であると見積もられる。肥満患者を治療する医療ガイドラインは食習慣の変更および体力の増強を推奨している。肥満の治療を助けるいくつかの治療薬は存在するが、これらは生活様式の変化に置き換わることはできない。
【0003】
肥満および関連障害は脳内の変化に関わると考えられるので、また神経伝達に影響する治療が肥満の治療に必要とされるので、脳に作用する治療薬が有効となるには脳に進入する能力を有しなければならない。血液脳関門(BBB)は中枢神経系(CNS)の障害を治療する薬物の潜在的使用に対する主な障害と考えられる。CNS薬の世界市場は2006年に680億ドルであって心血管薬の世界市場のほぼ半分であり、米国でもCNS障害を患う多くの人は心血管を患う人のほぼ2倍である。この不均衡の理由は、部分的に、全潜在的CNS薬の98%がBBBを横切らないことにある。さらに、世界中のCNS薬開発の99%超はただCNS薬の発見に委ねられ、1%未満がCNS薬送達を指向している。これは主な神経学的疾患に利用可能な治療オプションが不足することを説明しうる。
【0004】
脳は、2つの関門系:BBBおよび血液-脳脊髄液関門(BCSFB)の存在によって潜在的毒性物質に対して遮蔽されている。BBBはその表面積がBCSFBよりほぼ5000倍大きいので血清リガンド取込みの主要な経路であると考えられる。BBBを構成する脳内皮は、多くのCNS障害に対する潜在的薬物の使用に対する主な障害となっている。一般規則として、小さいサイズの親油性分子だけがBBBを横切って、すなわち、循環する全身性血液から脳へ通過することができる。大きいサイズまたはより高い疎水性を有する多数の薬物はCNS標的に高い効力を示すが、これらの薬物はBBBを効果的に横切ることができないので動物に効力がない。従って、治療薬中のペプチドおよびタンパク質は脳毛細管内皮壁の透過性が無視しうるために、一般に血液から脳への輸送が排除される。脳毛細管内皮細胞(BCEC)はタイトな継手により密封され、他器官の毛細管と比較してわずかな開窓とわずかな飲食作用小胞しか有しない。BCECは細胞外マトリックス、星状膠細胞、周皮細胞、および小膠細胞により囲まれている。内皮細胞と星状膠細胞足突起および毛細管基底膜との密接な結合が血液-脳交換のタイトな制御を可能にするBBB特性の発生と維持に重要である。
【0005】
従って、レプチンおよびレプチン類似体などの抗肥満治療薬の脳ならびに他組織への送達を改善する必要性が存在する。
【発明の概要】
【課題を解決するための手段】
【0006】
レプチンのBBBを横切る輸送を改善するために、本発明者らは(a)レプチン、レプチン類似体またはOB受容体アゴニストと(b)ペプチドベクターを含む化合物を開発した。これらの化合物は、BBBを横切るもしくは特定の細胞型中へのポリペプチド治療薬の輸送の増加が所望されるレプチン関連障害(例えば、肥満)を治療するのに有用である。このペプチドベクターは、血液-脳関門(BBB)を横切ってもしくは特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)中にポリペプチド治療薬を輸送することができる。驚くべきことに、本発明者らは、低い用量の例示のポリペプチド治療薬レプチン116-120を本明細書に記載のペプチドベクターとコンジュゲートすると、コンジュゲートしなかった薬剤より体重および食物摂取を減少するのに有効であることを示した。コンジュゲートはBBBの向こうの特定細胞型を標的化するので、コンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストと比較して、より低い用量もしくはより少ない頻度の投与を用いて治療効果を達成することができ、従って、副作用の重症度もしくは発生率を低下し、および/または効力を増加する。本化合物はまた、コンジュゲートしないポリペプチド治療薬と比較して、in vivoにおける安定性の増加、薬物動態学の改善、または分解の低下も示しうる。
【0007】
従って第1の態様において、本発明は式:A-X-B[式中、Aは血液脳関門(BBB)を横切る特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)への輸送が可能なペプチドベクターであり、Xはリンカーであり、そしてBはレプチン、レプチン類似体、およびOB受容体アゴニストからなる群より選択されるポリペプチド治療薬である]で表わされる化合物を特徴とする。BBBを横切る輸送または前記細胞中への輸送は少なくとも10%、25%、50%、75%、100%、200%、500%、750%、1000%、1500%、2000%、5000%、または10,000%だけ増加しうる。本化合物は実質的に純粋であってもよい。本化合物は製薬上許容される担体(例えば、本明細書に記載のいずれかの担体)を用いて製剤化してもよい。
【0008】
他の態様において、本発明は化合物A-X-Bを作る方法を特徴とする。一実施形態において、本方法はペプチドベクター(A)をリンカー(X)とコンジュゲートするステップ、およびペプチドベクター-リンカー(A-X)をレプチン、レプチン類似体、またはOB受容体アゴニスト(B)とコンジュゲートしてそれにより化合物A-X-Bを形成するステップを含むものである。他の実施形態において、本方法はBをリンカー(X)とコンジュゲートするステップ、およびX-Bをペプチドベクター(A)とコンジュゲートしてそれにより化合物A-X-Bを形成するステップを含むものである。他の実施形態において、本方法はペプチドベクター(A)をレプチン、レプチン類似体、またはOB受容体(B)とコンジュゲートするステップを含むものであり、ここでAまたはBは任意にリンカー(X)を含んで化合物A-X-Bを形成する方法である。
【0009】
他の態様において、本発明はポリペプチドである化合物A-X-Bをコードする核酸分子を特徴とする。核酸分子はプロモーターと機能的に連結されていてもよくかつ核酸ベクターの一部分であってもよい。ベクターは細胞、例えば、原核生物細胞(例えば、細菌細胞)または真核細胞(例えば、酵母またはヒト細胞などの哺乳動物細胞)中にあってもよい。
【0010】
他の態様において、本発明は、ポリペプチドである式A-X-Bの化合物を作る方法を特徴とする。一実施形態において、本方法は前記態様の核酸ベクターを細胞で発現してポリペプチドを産生するステップ;およびそのポリペプチドを精製するステップを含むものである。
【0011】
他の態様において、本発明は代謝障害を有する被験体を(例えば、予防として)治療する方法を特徴とする。本方法は、障害を治療するために十分な量の第1の態様の化合物を投与するステップを含むものである。代謝障害は糖尿病(例えば、I型またはII型)、肥満、肥満の結果としての糖尿病、高血糖、異脂肪血症、高トリグリセリド血症、X症候群、インスリン抵抗性、障害性グルコース抵抗性(IGT)、糖尿病異脂肪血症、高脂血症、心血管疾患、または高血圧であってもよい。
【0012】
他の態様において、本発明は被験体による食物摂取を低減する方法、または被験体の体重を低下する方法を特徴とする。前記方法は、本発明の第1の態様の化合物を被験体に食物摂取を低減するかまたは体重を低下するのに十分な量だけ投与するステップを含むものである。被験体は過体重、肥満、または過食症であってもよい。
【0013】
化合物を被験体に投与する任意の方法において、前記十分な量は、ペプチドベクターとコンジュゲートしなかった場合のポリペプチド治療薬(例えば、本明細書に記載のいずれか)の同等の用量に必要な量の90%、75%、50%、40%、30%、20%、15%、10%、5%、4%、3%、2%、1%、または0.1%未満であってもよい。前記十分な量は、ペプチドベクターとコンジュゲートしなかった場合のポリペプチド治療薬の有効量の投与と比較して、副作用(例えば、嘔吐、吐き気、または下痢)を低下することができる。被験体は哺乳動物、例えばヒトであってもよい。
【0014】
前記態様のいずれかにおいて、ペプチドベクターは表1に記載した配列のいずれかまたはその断片と実質的に同一のポリペプチドであってもよい。ある特定の実施形態において、ペプチドベクターはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、Angiopep-3(配列番号107)、Angiopep-4a(配列番号108)、Angiopep-4b(配列番号109)、Angiopep-5(配列番号110)、Angiopep-6(配列番号111)、またはAngiopep-7(配列番号112)の配列を有する。ペプチドベクターまたはコンジュゲートは、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉のいずれか1つ、2つ、3つ、4つ、または5つ)中に効果的に輸送することができるしまたは哺乳動物のBBBを効率的に横切ることができる(例えば、Angiopep-1、-2、-3、-4a、-4b、-5、および-6)。他の実施形態において、ペプチドベクターまたはコンジュゲートは、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉のいずれか1つ、2つ、3つ、4つ、または5つ)に進入することはできるが、BBBを効率的に横切らない(例えば、Angiopep-7を含むコンジュゲート)。ペプチドベクターはいずれの長さ、例えば、少なくとも6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、25、35、50、75、100、200、もしくは500アミノ酸、またはこれらの数の任意の範囲であってもよい。ある特定の実施形態において、ペプチドベクターは長さが10〜50アミノ酸である。ポリペプチドは組み換え遺伝技法または化学合成により作製することができる。
【0015】
表1:例示のペプチドベクター
【表1】




【0016】
ポリペプチド番号5、67、76、および91は、それぞれ、配列番号:5、67、76、および91の配列を含み、かつC-末端がアミド化されている。ポリペプチド番号107、109、および110は、それぞれ、配列番号:97、109、および110の配列を含み、かつN-末端がアセチル化されている。
【0017】
上記態様のいずれかにおいて、ペプチドベクターは式:
X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17-X18-X19
[式中、X1〜X19(例えば、X1〜X6、X8、X9、X11〜X14、およびX16-X19)はそれぞれ独立して、任意のアミノ酸(例えば、天然アミノ酸、例えば、Ala、Arg、Asn、Asp、Cys、Gln、Glu、Gly、His、Ile、Leu、Lys、Met、Phe、Pro、Ser、Thr、Trp、Tyr、およびVal)であるかまたは存在せず、かつX1、X10、およびX15の少なくとも1つ(例えば、2つまたは3つ)はアルギニンである]で表わされるアミノ酸配列を含んでもよい。いくつかの実施形態において、X7はSerもしくはCysであるか;またはX10およびX15はそれぞれ独立してArgもしくはLysである。いくつかの実施形態において、X1〜X19の残基は配列番号:1〜105および107〜116のいずれか1つのアミノ酸配列のいずれか(例えば、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7)と実質的に同一である。いくつかの実施形態において、アミノ酸X1〜X19の少なくとも1つ(例えば、2つ、3つ、4つ、または5つ)はArgである。いくつかの実施形態において、ポリペプチドはポリペプチドのN-末端、C-末端、または両方において1以上のさらなるシステイン残基を有する。
【0018】
以上の態様のいずれかのある特定の実施形態において、ペプチドベクターまたはレプチン、レプチン類似体もしくはOB受容体アゴニストは改変されている(例えば、本明細書に記載のように)。ペプチドベクターまたはポリペプチド治療薬はアミド化、アセチル化、または両方がなされていてもよい。かかる改変はポリペプチドのアミノまたはカルボキシ末端であってもよい。ペプチドベクターまたはポリペプチド治療薬はまた、本明細書に記載のポリペプチドのいずれかのペプチドミメチック(例えば、本明細書に記載のもの)を含むかまたはそのものであってもよい。ペプチドベクターまたはポリペプチド治療薬は多量体、例えば、二量体(システイン残基を介するジスルフィド結合により形成された)であってもよい。
【0019】
ある特定の実施形態において、ペプチドベクターまたはレプチン、レプチン類似体、またはOB受容体アゴニストは少なくとも1つのアミノ酸置換(例えば、2、3、4、5、6、7、8、9、10、11、または12置換)、挿入、または欠失をもつ本明細書に記載のアミノ酸配列を有する。ポリペプチドは例えば、1〜12、1〜10、1〜5、または1〜3アミノ酸置換、例えば、1〜10(例えば、9、8、7、6、5、4、3、2までの)アミノ酸置換を含有してもよい。アミノ酸置換は保存的または非保存的であってもよい。例えば、ペプチドベクターは、配列番号1、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7のいずれのアミノ酸配列の位置1、10、および15に対応する位置の1つ、2つ、または3つにアルギニンを有してもよい。ある特定の実施形態において、レプチン、レプチン類似体、またはアゴニストは、いずれの位置にシステインまたはリシン置換または付加(例えば、N-またはC-末端位置におけるリシン置換)を有してもよい。
【0020】
以上の態様のいずれかにおいて、化合物は特異的に、配列番号:1〜105および107〜116(例えば、Angiopep-1、Angiopep-2、Angiopep-3、Angiopep-4a、Angiopep-4b、Angiopep-5、Angiopep-6、およびAngiopep-7)のいずれかを含むかまたはそれから成るポリペプチドを除外してもよい。いくつかの実施形態において、本発明のポリペプチドおよびコンジュゲートは配列番号:102、103、104、および 105のポリペプチドを除外する。
【0021】
以上の態様のいずれかにおいて、リンカー(X)は当技術分野で公知のまたは本明細書に記載のいずれのリンカーであってもよい。特別な実施形態において、リンカーは共有結合(例えば、ペプチド結合)、化学連結剤(例えば、本明細書に記載のもの)、アミノ酸またはペプチド(例えば、2、3、4、5、8、10、またはそれ以上のアミノ酸)である。ある特定の実施形態において、リンカーは式:
【化1】

【0022】
[式中、nは2〜15の整数(例えば、 2、3、4、5、6、7、8、9、10、11、12、13、14、または 15)であり;そしてYはA上のチオールでありかつZはB上の一級アミンであるかまたはYはB上のチオールでありかつZはA上の一級アミノである]
で表わされる。
【0023】
ある特定の実施形態において、化合物はペプチドベクター(例えば、Angiopep-2)とポリペプチド治療薬(例えば、ヒトレプチン)を含む融合タンパク質である。
【0024】
以上のいずれかの実施形態において、Bはレプチン(116〜130)、レプチン(22〜56)、レプチン(57〜92)、レプチン(93〜105)、LY396623、メトレレプチン、マウスレプチン類似体、PEG化レプチン、およびメチオニルヒトレプチンであってもよい。レジスチンにはヒト、マウス、およびラットレジスチンが含まれる。レプチンは成熟した配列(例えば、図16に示した、例えば、ヒト配列のアミノ酸22-167)または全長タンパク質(例えば、図16に示した)であってもよい。本発明に用いられるポリペプチドはこれらのペプチドのいずれであってもよくまたはこれらのポリペプチドのいずれかと実質的に同一であってもよい。
【0025】
「ペプチドベクター」は、特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、または筋肉)中にまたはBBBを横切って輸送することができる化合物または分子、例えばポリペプチドまたはポリペプチドミメチックを意味する。ある特定の実施形態において、ベクターは癌細胞または脳内皮の細胞上に存在する受容体と結合することができ、それによって癌細胞中にまたはBBBを横切って経細胞輸送により輸送することができる。ベクターは、細胞またはBBB統合性に影響を与えることなく高レベルの経内皮輸送が得られる分子であってもよい。ベクターはポリペプチドまたはペプチドミメチックであってもよく、かつ天然であっても、化学合成もしくは組み換え遺伝技法により作製したものであってもよい。
【0026】
被験体の疾患、障害または症状を「治療する」は、治療薬を被験体に投与することにより、疾患、障害または症状の少なくとも1つの症候を軽減することを意味する。
【0027】
被験体の疾患、障害または症状を「予防として治療する」は、疾患症候群の発症に先立って治療薬を被験体に投与することにより、疾患、障害または症状の発生頻度を低下するかまたは重症度を軽減することを意味する。
【0028】
一例として、代謝障害を治療する被験体は、かかる症状を有すると医師が診断した被験体である。診断は好適な手法により、例えば、本明細書に記載の手法により実施することができる。予防として治療した糖尿病または肥満を発症している被験体は、かかる診断を受けていてもまたは受けてなかってもよい。当業者は、本発明の対象を標準試験に課していてもよいし、または試験無しに1以上のリスク因子、例えば、家族史、肥満、特別な民族性(例えば、アフリカ系米国人およびヒスパニック系米国人)、妊娠性糖尿病または9ポンドを超える体重をもつ赤ちゃんの分娩、高血圧、肥満または糖尿病の素因である病理症状を有すること、トリグリセリドの高い血液レベル、コレステロールの高い血液レベル、分子マーカーの存在(例えば、自己抗体の存在)、および加齢(45歳を超える)の存在によってリスクの高い被験体と同定してもよいことを理解するであろう。個人はその体重が身長にとって望ましい最高体重を20%(女性では25%)以上超える場合、肥満であるとみなされる。100ポンドを超える過体重である成人は病的肥満とみなされる。肥満はまた、30kg/m2を超える肥満度指数(BMI)としても定義される。
【0029】
「代謝障害」は、被験体の代謝の変化からもたらされるいずれかの病理症状を意味する。かかる障害には、例えば、高血糖の変化からもたらされるグルコース恒常性の変化からもたらされる障害が含まれる。本発明によれば、グルコースレベルの変化は典型的には健康な個体のかかるレベルと比較してグルコースレベルの少なくとも5%、10%、20%、30%、40%、50%、60%、70%、80%、90%、またはさらに100%の増加である。代謝障害には、肥満および糖尿病(例えば、I型糖尿病、II型糖尿病、MODY、および妊娠性糖尿病)、満腹、および加齢による内分泌欠乏が含まれる。
【0030】
「グルコースレベルを低下させる」は、無治療の対照と比較して少なくとも10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、または100%だけグルコースレベルを低下させることを意味する。望ましくは、グルコースレベルを正常血糖のレベル、すなわち、150〜60mg/dL、140〜70mg/dL、130〜70mg/dL、125〜80mg/dL、そして好ましくは120〜80mg/dLに低下させる。かかるグルコースレベルの低下は、血液からのグルコースのクリアランスに関連する生物学的活性のいずれか1つを増加(例えば、インスリン生産、分泌、または作用の亢進)することによって得ることができる。
【0031】
「被験体」はヒトまたは非ヒト動物(例えば、哺乳動物)を意味する。
【0032】
「同等の用量」は、本発明の化合物において同じモル量のポリペプチド治療薬(例えば、レプチン)を達成するために必要な、コンジュゲートしないポリペプチド治療薬と比較した本発明の化合物の量を意味する。
【0033】
「BBBを横切って効率的に輸送されるポリペプチド」は、少なくともAngiopep-6と同じように効率的にBBBを横切ることができるポリペプチド(すなわち、参照により本明細書に組み込まれる米国特許出願第11/807,597号(2007年5月29日出願)に記載したin situ脳潅流アッセイにおいてAngiopep-1(250nM)より38.5%大きい)を意味する。従って、「BBBを横切って効率的に輸送されないポリペプチド」はより低いレベルで脳へ輸送される(例えば、Angiopep-6より低い効率で輸送される)。
【0034】
「特定の細胞型へ効率的に輸送されるポリペプチドまたは化合物」は、ポリペプチドまたは化合物が(例えば、細胞中への輸送の増加、細胞からの流出の減少、またはそれらの組み合わせによって)対照物質より、または、コンジュゲートの場合にはコンジュゲートしない薬剤と比較して、少なくとも10%(例えば、25%、50%、100%、200%、500%、1,000%、5,000%、または10,000%)大きい範囲で前記細胞型に蓄積し得ることを意味する。かかる活性は、参照により本明細書に組み込まれる国際特許出願公開WO2007/009229号に詳細に記載されている。
【0035】
本発明のその他の特徴と利点は、以下の詳細な説明、図面、および請求項から明らかであろう。
【図面の簡単な説明】
【0036】
【図1A】図1Aおよび1Bは精製前(図1A)および精製後(図1B)のレプチン-AN2(C11)コンジュゲートを示すクロマトグラムである。
【図1B】図1Aおよび1Bは精製前(図1A)および精製後(図1B)のレプチン-AN2(C11)コンジュゲートを示すクロマトグラムである。
【図2】レプチン-AN2(C11)コンジュゲートの精製結果を示すクロマトグラムである。
【図3】in situ脳潅流アッセイを用いて、C3、C6、およびC11レプチン-AN2コンジュゲートの脳、毛細管、および実質への取込みを示すグラフである。
【図4A】図4Aおよび4Bは、痩せたマウスおよび食餌誘発性肥満(DIO)マウス(図4A)におけるレプチン116-130およびレプチン-AN2(C11)コンジュゲートのinsitu脳潅流、ならびに痩せたマウスおよびDIOマウスにおけるレプチンの血漿レベルを示すグラフである(図4B)。
【図4B】図4Aおよび4Bは、痩せたマウスおよび食餌誘発性肥満(DIO)マウス(図4A)におけるレプチン116-130およびレプチン-AN2(C11)コンジュゲートのinsitu脳潅流、ならびに痩せたマウスおよびDIOマウスにおけるレプチンの血漿レベルを示すグラフである(図4B)。
【図5A】図5Aおよび5Bは対照物質注射(生理食塩水)、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける、4時間(図5A)または15時間(図5B)後の食餌摂取を示すグラフである。
【図5B】図5Aおよび5Bは対照物質注射(生理食塩水)、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける、4時間(図5A)または15時間(図5B)後の食餌摂取を示すグラフである。
【図6】対照、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたマウスにおける6日間にわたる体重取得を示すグラフである。
【図7】6日間にわたる毎日IP注入によって対照、レプチン116-130、またはレプチン-AN2(C11)コンジュゲートを受けたob/obマウスにおける10日間にわたる体重取得を示すグラフである。
【図8】GSTタグ付きAngiopep構築物を示す模式図である。
【図9】Angiopep-2-レプチン116-130 融合タンパク質を作製するために用いるPCR計画を示す模式図である。
【図10】GSH-セファロースカラム上でのGST-Angiopep2の精製を示すクロマトグラムである。
【図11A】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図11B】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図11C】図11A〜11Cは組換え体Angiopep-2ペプチドの、ウェスタンブロット(図11A)、液体クロマトグラフィ実験から得たUVスペクトル(図11B)、および質量スペクトル(図11C)を示す。
【図12】in situ脳潅流アッセイにおける、合成および組換え型のAngiopep-2の取込みを示すグラフである。
【図13】in situ脳潅流アッセイにおける、GST、GST-Angiopep-2、GST-レプチン116-130、およびGST-Angiopep-2-レプチン116-130の実質中への取込みを示すグラフである。
【図14】His-タグ付き-マウスレプチンおよびHis-タグ付き-Angiopep-2-マウスレプチン融合タンパク質を示す模式図である。
【図15】His-タグ付き-マウスレプチンおよびヒトレプチン配列の精製を示すゲルのイメージである。
【図16】ヒトレプチン前駆体の配列である。この配列のアミノ酸22-167は成熟したレプチンペプチドを形成する。
【図17A】図17Aおよび17BはHis-タグ付きレプチン(マウス)およびHis-タグ付きAngiopep-2-レプチンコンジュゲートのための例示の精製スキームである。
【図17B】図17Aおよび17BはHis-タグ付きレプチン(マウス)およびHis-タグ付きAngiopep-2-レプチンコンジュゲートのための例示の精製スキームである。
【図18】レプチンとAngiopep-2-レプチンコンジュゲートの小規模発現の成功を示すゲルの写真である。
【図19】His-タグ付きコンジュゲートのトロンビン切断から得られる2つの産物を示すゲルの模式図と写真である。
【図20】レプチンとAngiopep-2-レプチン融合タンパク質のDIOマウス実質中への取込みを示すグラフである。
【図21】組換えレプチンのob/obマウス体重に与える効果を示すグラフである。
【図22】対照、レプチン、His-タグ付きマウスレプチン、またはHis-タグ付きAngiopep-2-レプチンコンジュゲートを受けたDIOマウスの体重変化を示すグラフである。
【発明を実施するための形態】
【0037】
本発明者らは血液脳関門(BBB)を横切るまたは特定の細胞型(例えば、肝臓、肺、腎臓、脾臓、および筋肉)中に進入する高い能力を有するポリペプチド治療薬コンジュゲートを開発し、これをペプチドベクターと例示のポリペプチド治療薬、レプチンとのコンジュゲートの例によって示した。これらの例示のポリペプチド治療薬はOB-R受容体アゴニストとして作用しうる。従って、本発明のコンジュゲートは、治療薬ポリペプチドとBBBを横切る輸送を促進するペプチドベクターとを含むものである。
【0038】
驚くべきことに、本発明者らは本発明の化合物がレプチンの非コンジュゲート型と比較して体重を低下する上でより有効であることを示した。本発明の化合物は非コンジュゲート型ポリペプチドと比較して効力がより大きいので、より少ない用量、より少ない投与、より有効な治療、またはより少ない副作用をもたらしうる。あるいは、より高い用量における効力の増加を得ることができる。
【0039】
レプチンとレプチン類似体
レプチンはアディポサイトカインであり、従って本発明で使用するタンパク質またはペプチドはアディポカインまたはその類似体を含みうる。アディポカインにはアディポネクチン、レプチン、およびレジスチンが含まれる。アディポネクチンにはヒト、マウス、およびラットアディポネクチンが含まれる。レプチンにはレプチン(116-130)、レプチン(22-56)、レプチン(57-92)、レプチン(93-105)、LY396623、メトレレプチン、マウスレプチン類似体、PEG化レプチン、およびメチオニルヒトレプチンが含まれる。レジスチンにはヒト、マウス、およびラットレジスチンが含まれる。レプチンは切断された配列(例えば、図15に示したヒト配列のアミノ酸22-167)または全長タンパク質(例えば、図15に示した)であってもよい。本発明で使用するポリペプチドはこれらのペプチドまたはタンパク質のいずれかであってもまたはこれらのペプチドまたはタンパク質と実質的に同一であってもよい。
【0040】
レプチン類似体はOB受容体アゴニストであってもよい。ある特定の実施形態においてOB受容体アゴニストは、視床下部で見出される主要受容体であるOB-Rb型または血液脳関門に見出されるOB-Rに対するアゴニストであり、レプチン輸送に関わる。
【0041】
ポリペプチド治療薬の改変型
本明細書に記載したレプチン、レプチン類似体、またはOB受容体アゴニストのいずれも改変することができる(例えば、本明細書に記載のようにまたは当技術分野で公知のように)。米国特許第6,924,264号に記載のように、ポリペプチドをポリマーと結合してその分子量を増加することができる。例示のポリマーにはポリエチレングリコールポリマー、ポリアミノ酸、アルブミン、ゼラチン、スクシニル-ゼラチン、(ヒドロキシプロピル)-メタクリルアミド、脂肪酸、多糖類、脂質アミノ酸、およびデキストランが含まれる。
【0042】
一事例においては、ポリペプチドをアルブミン(例えば、ヒトアルブミン)、またはその類似体もしくは断片、または免疫グロブリンのFc部分の付加によって改変する。かかる手法は、例えば、米国特許第7,271,149号に記載されている。
【0043】
一事例においては、ポリペプチドをPCT公報WO98/08871に記載の親油性置換基の付加によって改変する。親油性置換基には、部分的にまたは完全に水素化したシクロペンタノフェナントレン骨格、直鎖または分枝鎖アルキル基;直鎖または分枝鎖脂肪酸のアシル基(例えば、CH3(CH2)nCO-またはHOOC(CH2)mCO-を含む基、ここでnまたはmは4〜38である);直鎖または分枝鎖アルカンα,ω-ジカルボン酸のアシル基;CH3(CH2)p((CH2)q,COOH)CHNH-CO(CH2)2CO-(ここでpおよびqは整数でありかつp+qは8〜33である);CH3(CH2)rCO-NHCH(COOH)(CH2)2CO-(ここでrは10〜24である);CH3(CH2)sCO-NHCH((CH2)2COOH)CO-(ここでsは8〜24である);COOH(CH2)tCO-(ここでtは8〜24である);-NHCH(COOH)(CH2)4NH-CO(CH2)uCH3(ここでuは8〜18である);-NHCH(COOH)(CH2)4NH-COCH((CH2)2COOH)NH-CO(CH2)wCH3(ここでwは10〜16である);-NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NH-CO(CH2)xCH3、(ここでxは10〜16である);または-NHCH(COOH)(CH2)4NH-CO(CH2)2CH(COOH)NHCO(CH2)yCH3、(ここでyは1〜22である)が含まれうる。
【0044】
他の実施形態においては、ポリペプチド治療薬を化学反応基、例えば、米国特許第6,593,295号に記載のようにマレイミド基の付加によって改変する。これらの基は血液成分の利用可能な官能基と反応して共有結合を形成することができ、改変されたインスリン分泌性ペプチドの有効治療in vivo半減期を延長することができる。タンパク質の官能基と共有結合を形成するために、化学反応基として広範囲の各種の活性カルボキシル基(例えば、エステル)を利用してもよく、その場合、ヒドロキシル部分はポリペプチドを改変するのに必要なレベルで生理学的に許容可能でなければならない。特別な薬剤には、N-ヒドロキシスクシンイミド(NHS)、N-ヒドロキシ-スルホスクシンイミド(スルホ-NHS)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミドエステル(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)が含まれる。
【0045】
一級アミン類はNHSエステルの主な標的である。タンパク質N-末端およびリシンのε-アミンに存在する、接近しうるα-アミン基はNHSエステルと反応する。NHSエステルコンジュゲーション反応は一級アミン類と反応するとアミド結合を形成してN-ヒドロキシスクシンイミドを放出する。これらのスクシンイミドを含有する反応基を本明細書ではスクシンイミジル基と呼ぶ。本発明のある特定の実施形態において、タンパク質上の官能基はチオール基でありうるし、また化学反応基はマレイミドを含有する基、例えばγ-マレイミド-ブチルアミド (GMBAまたはMPA)でありうる。かかるマレイミドを含有する基を本明細書ではマレイミド基と呼ぶ。
【0046】
マレイミド基は反応混合物のpHが6.5〜7.4の場合にペプチド上のスルフヒドリル基に最も選択性がある。pH7.0において、マレイミド基のスルフヒドリル(例えば、タンパク質、例えば血清アルブミンまたはIgG上のチオール基)との反応速度はアミン類より1000倍速い。従って、マレイミド基とスルフヒドリルとの間の安定なチオエーテル連鎖が形成され、これは生理学的条件下で切断されない。
【0047】
ペプチドベクター
本発明の化合物は本明細書に記載のポリペプチドのいずれか、例えば、表1に記載のペプチドのいずれか(例えば、Angiopep-1またはAngiopep-2)、またはその断片または類似体を特徴としうる。ある特定の実施形態において、ポリペプチドは本明細書に記載のポリペプチドと少なくとも35%、40%、50%、60%、70%、80%、90%、95%、99%、またはさらに100%同一性を有しうる。ポリペプチドは、本明細書に記載の配列の1つと比較して、1以上(例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、または15)の置換を有しうる。その他の改変を以下にさらに詳しく記載する。
【0048】
本発明はまた、これらのポリペプチドの断片(例えば、機能性断片)を特徴とする。ある特定の実施形態において、前記断片を特別な細胞型(例えば、肝臓、眼、肺、腎臓、または脾臓)に効率的に輸送もしくは蓄積させることができるかまたは効率的にBBBを横切って輸送する。ポリペプチドの末端切断は、ポリペプチドのN-末端、ポリペプチドのC-末端、またはそれらの組み合わせから1、2、3、4、5、6、7、8、9、10、11、12、またはそれ以上のアミノ酸であってもよい。他の断片には、ポリペプチドの内部の部分が欠失した配列が含まれる。
【0049】
さらなるポリペプチドは本明細書に記載のアッセイまたは方法の1つを用いることにより同定することができる。例えば、候補ポリペプチドを通常のペプチド合成により作製し、パクリタキセルとコンジュゲートし、実験動物に投与してもよい。生物学的に活性のあるポリペプチドコンジュゲートは、例えば、腫瘍細胞を注射し、コンジュゲートで処置した動物の生存を延長する能力に基づいて、コンジュゲートで治療しなかった(例えば、コンジュゲートしない薬剤で治療した)対照と比較して同定することができる。例えば、生物学的に活性のあるポリペプチドは、実質中のその位置に基づいて、in situ脳潅流アッセイで同定することができる。
【0050】
他の組織中の蓄積を測定するアッセイを併せて行うこともできる。ポリペプチドの標識したコンジュゲートを動物に投与し、色々な器官における蓄積を測定してもよい。例えば、検出可能な標識とコンジュゲートしたポリペプチド(例えば、Cy5.5などの近赤外線蛍光標識)は生存中のin vivo可視化を可能にする。かかるポリペプチドを動物に投与し、器官中のポリペプチドの存在を検出し、そして所望の器官におけるポリペプチド蓄積の速度と量を測定することができる。他の実施形態においては、ポリペプチドを放射性同位体(例えば、125I)で標識してもよい。ポリペプチドを次いで動物に投与する。或る時間の後に、動物を犠牲にして器官を抽出する。各器官中の放射性同位体の量を次いで当技術分野で公知のいずれかの手段を用いて測定する。特定器官の候補ポリペプチドの量を標識した対照ポリペプチドの量と比較することにより、特定の組織に進入しかつ蓄積する候補ポリペプチドの能力を確かめることができる。適当なネガティブ対照としては、特定の細胞型中に効率的に輸送されないことが公知のいずれかのペプチドまたはポリペプチド(例えば、BBBを横切らないAngiopepに関係するペプチドまたはいずれかの他のペプチド)が挙げられる。
【0051】
さらなる配列は米国特許第5,807,980号(例えば、本明細書の配列番号102)、第5,780,265号(例えば、配列番号103)、第5,118,668号(例えば、配列番号105)に記載されている。アプロチニン類似体をコードする例示のヌクレオチド配列は
atgagaccag atttctgcct cgagccgccg tacactgggc cctgcaaagc tcgtatcatc cgttacttct acaatgcaaa ggcaggcctg tgtcagacct tcgtatacgg cggctgcaga gctaagcgta acaacttcaa atccgcggaa gactgcatgc gtacttgcgg tggtgcttag;配列番号6;Genbank受託番号 X04666)である。アプロチニン類似体の他の例は、タンパク質BLAST(Genbank:www.ncbi.nlm.nih.gov/BLAST/)を国際出願第PCT/CA2004/000011号に開示された合成アプロチニン配列(またはその部分)を用いて行うことにより見出すことができる。例示のアプロチニン類似体はまた、受託番号CAA37967(GI:58005)および1405218C(GI:3604747)のもとで見出すことができる。
【0052】
改変ポリペプチド
本発明で用いるペプチドベクターとポリペプチド治療薬は改変されたアミノ酸配列を有してもよい。ある特定の実施形態において、改変は所望の生物学的活性(例えば、BBBを横切る能力またはGLP-1アゴニスト活性)を有意に破壊しない。改変は元来のポリペプチドの生物学的活性を(例えば、少なくとも5%、10%、20%、25%、35%、50%、60%、70%、75%、80%、90%、または95%だけ)低下するか、影響を与えないかまたは(例えば、少なくとも5%、10%、25%、50%、100%、200%、500%、または1000%だけ)増加してもよい。改変されたペプチドベクターまたはポリペプチド治療薬は、ポリペプチドの特性、例えばin vivo安定性、バイオアベイラビリティ、毒性、免疫学的活性、免疫学的同一性、およびコンジュゲーション特性を有するかまたは最適化してもよい。
【0053】
改変には、翻訳後プロセシングなどの天然プロセスによるものまたは当技術分野で公知の化学修飾技法によるものが含まれる。改変はポリペプチド骨格、アミノ酸側鎖およびアミノ末端またはカルボキシ末端を含むポリペプチドのあらゆる場所で起こってもよい。同じタイプの改変は所与のポリペプチドのいくつかの部位に同程度または様々な程度で存在してもよく、ポリペプチドは複数のタイプの修飾を含んでもよい。ポリペプチドはユビキチン化の結果として分岐していてもよく、また分岐の有るまたは無い環状であってもよい。環状、分枝、および分枝環状ポリペプチドは翻訳後の天然のプロセシングの結果であってもよく、または合成されたものであってもよい。他の改変には、PEG化、アセチル化、アシル化、アセトアミドメチル(Acm)基の付加、ADPリボシル化、アルキル化、アミド化、ビオチン化、カルバモイル化、カルボキシエチル化、エステル化、フラビン(fiavin)との共有結合、ヘム部分との共有結合、ヌクレオチドまたはヌクレオチド誘導体の共有結合、薬物の共有結合、マーカー(例えば蛍光マーカーもしくは放射マーカー)の共有結合、脂質または脂質誘導体の共有結合、ホスファチジルイノシトールの共有結合、架橋結合、環化、ジスルフィド結合形成、脱メチル化、共有結合架橋の形成、シスチンの形成、ピログルタミン酸の形成、ホルミル化、γ-カルボキシル化、グリコシル化、GPIアンカー形成、ヒドロキシル化、ヨウ素化、メチル化、ミリストイル化、酸化、タンパク質分解処理、リン酸化、プレニル化、ラセミ化、セレノイル化、硫酸化、転移RNAを介したタンパク質へのアミノ酸の付加、例えばアルギニン化およびユビキチン化が含まれる。
【0054】
改変されたポリペプチドはまた、(例えば、このような変化がポリペプチドの生物学的活性を実質的に変化させない場合)ポリペプチド配列へのアミノ酸の挿入、欠失、または保存的もしくは非保存的(例えば、D-アミノ酸、デスアミノ酸)置換を含んでもよい。特に、本発明のポリペプチドのいずれかのアミノまたはカルボキシル末端への1以上のシステイン残基の付加は、例えば、これらのポリペプチドのジスルフィド結合によるコンジュゲーションを促進することができる。例えば、Angiopep-1(配列番号67)、Angiopep-2(配列番号97)、またはAngiopep-7(配列番号112)は、アミノ-末端に単一のシステイン残基(配列番号:71、113、および115、それぞれ)をまたはカルボキシ-末端に単一のシステイン残基(配列番号:72、114、および116、それぞれ)を含むように改変することができる。アミノ酸置換は保存的(すなわち、残基を同じ属のタイプもしくはグループの他の残基により置き換える場合)であってもよくまたは非保存的(すなわち、残基を他のタイプのアミノ酸により置き換える場合)であってもよい。さらに、天然に存在しないアミノ酸を、天然に存在するアミノ酸と置き換えてもよい(すなわち、天然に存在しない保存的アミノ酸置換または天然に存在しない非保存的アミノ酸置換)。
【0055】
合成されたポリペプチドは、天然にはDNAによってコードされないアミノ酸(例えば、天然に存在しないすなわち非天然アミノ酸)の置換を含みうる。天然に存在しないアミノ酸の例は、D-アミノ酸、システインの硫黄原子に結合したアセチルアミノメチル基を有するアミノ酸、PEG化アミノ酸、化学式NH2(CH2)nCOOH(式中、nは2〜6である)のωアミノ酸、中性非極性アミノ酸、例えばサルコシン、t-ブチルアラニン、t-ブチルグリシン、N-メチルイソロイシン、およびノルロイシンなどを含みうる。フェニルグリシンは、Trp、Tyr、またはPheと置換しうる;シトルリンおよびメチオニンスルホキシドは中性非極性であり、システイン酸は酸性であり、オルニチンは塩基性である。プロリンをヒドロキシプロリンで置換し、立体配座付与特性を保持することができる。
【0056】
類似体を置換突然変異誘発によって作製し、元来のポリペプチドの生物学的活性を保持してもよい。「保存的置換」と同定される置換の例を、表2に示す。かかる置換が所望でない変化をもたらせば、表3の「例示の置換」に表示されるかまたはアミノ酸クラスに関して本明細書に更に記載される他のタイプの置換を導入してその産物をスクリーニングする。
【0057】
機能または免疫学的同一性の実質的な改変を達成するには、(a)置換領域におけるポリペプチド骨格の構造(例えば、シートもしくはへリックス構造)、(b)標的部位における分子の電荷もしくは疎水性、または(c)側鎖の体積、を維持する効果が有意に異なる置換を選択する。天然に存在する残基は、共通の側鎖の特性に基づいて次のいくつかのグループに分類される:
(1)疎水性:ノルロイシン、メチオニン(Met)、アラニン(Ala)、バリン(Val)、ロイシン(Leu)、イソロイシン(Ile)、ヒスチジン(His)、トリプトファン(Trp)、チロシン(Tyr)、フェニルアラニン(Phe);
(2)中性親水性:システイン(Cys)、セリン(Ser)、トレオニン(Thr);
(3)酸性/負荷電:アスパラギン酸(Asp)、グルタミン酸(Glu);
(4)塩基性:アスパラギン(Asn)、グルタミン(Gln)、ヒスチジン(His)、リシン(Lys)、アルギニン(Arg);
(5)鎖配向に影響を及ぼす残基:グリシン(Gly)、プロリン(Pro);
(6)芳香族性:トリプトファン(Trp)、チロシン(Tyr)、フェニルアラニン(Phe)、ヒスチジン(His);
(7)極性:Ser、Thr、Asn、Gln;
(8)塩基性正荷電:Arg、Lys、His;および
(9)荷電:Asp、Glu、Arg、Lys、His。
【0058】
他のアミノ酸置換を表3に掲げる。
【0059】
表2:アミノ酸置換
【表2】

【0060】
ポリペプチド誘導体およびペプチドミメチック
天然に存在するアミノ酸からなるポリペプチドに加えて、ペプチドミメチックまたはポリペプチド類似体も本発明に包含され、従って本発明の化合物で使用されるペプチドベクターまたはポリペプチド治療薬を形成することができる。ポリペプチド類似体は、製薬産業において、テンプレートポリペプチドと類似した特性を有する非ペプチド薬として一般的に使用されている。非ペプチド化合物は、「ペプチドミメチック」と呼ばれる(Fauchere et al., Infect. Immun. 54:283-287 ,1986およびEvans et al., J. Med. Chem. 30:1229-1239, 1987)。治療上有用なペプチドまたはポリペプチドと構造的に関連するペプチドミメチックを使用して、同等のもしくは強化された治療または予防効果を得ることができる。一般に、ペプチドミメチックはパラダイムポリペプチド(すなわち、生物学的または薬理学的活性を有するポリペプチド)、例えば、天然に存在する受容体結合ポリペプチドと構造的に類似するが、当技術分野において周知の方法によって、例えば、-CH2NH-、-CH2S-、-CH2-CH2-、-CH=CH-(シスおよびトランス)、-CH2SO-、-CH(OH)CH2-、-COCH2-などの結合により任意に置き換えられた1以上のペプチド結合を有する(Spatola, Peptide Backbone Modifications, Vega Data, 1(3):267, 1983;Spatola et al., Life Sci. 38:1243-1249, 1986;Hudson et al., Int. J. Pept. Res. 14:177-185, 1979;およびWeinstein. B., 1983, Chemistry and Biochemistry, of Amino Acids, Peptides and Proteins, Weinstein編、Marcel Dekker, New-York)。かかるポリペプチドミメチックは天然に存在するポリペプチドより大きな利点を有しうるのであって、その利点としては、より経済的な製造、より高い化学安定性、薬理学的特性(例えば、半減期、吸収、効力、効率)の向上、抗原性の低下などが挙げられる。
【0061】
本明細書に記載したペプチドベクターはBBBを効率的に横切るかまたは特定の細胞型(例えば、本明細書に記載したもの)を標的化しうる一方、その有効性はプロテアーゼの存在によって低下しうる。同じように本発明で使用するポリペプチド治療薬の有効性も同様に低下しうる。血清プロテアーゼは、切断に対してL-アミノ酸とペプチド結合を含む特異的な基質要件を有する。さらに、血清中のプロテアーゼ活性の最も顕著な成分であるエキソペプチダーゼは、通常、ポリペプチドの最初のペプチド結合に作用し、そして遊離したN-末端を必要とする(Powell et al., Pharm. Res. 10:1268-1273, 1993)。この点を考慮すると改変型ポリペプチドの使用はしばしば有利である。改変ポリペプチドは、元来のL-アミノ酸ポリペプチドの構造的特性を保持するが、有利なことに、プロテアーゼおよび/またはエキソペプチダーゼによる切断を容易に受けることはない。
【0062】
コンセンサス配列の1以上のアミノ酸を同じタイプのD-アミノ酸(例えば、エナンチオマー;L-リシンの代わりにD-リシン)と体系的に置き換えることによって、より安定なポリペプチドを生成することができる。従って、本明細書に記載したポリペプチド誘導体またはペプチドミメチックは、すべてL-、すべてD-またはD、L混合のポリペプチドであってもよい。ペプチダーゼはD-アミノ酸を基質として利用することができないので、N-末端またはC-末端のD-アミノ酸の存在は、ポリペプチドのin vivo安定性を向上する(Powell et al., Pharm. Res. 10:1268-1273, 1993)。リバースD-ポリペプチドは、L-アミノ酸を含むポリペプチドに対して逆配列で配置されたD-アミノ酸を含むポリペプチドである。従って、L-アミノ酸ポリペプチドのC-末端残基は、D-アミノ酸ポリペプチドのN-末端になり、以降も同様である。リバースD-ポリペプチドは、L-アミノ酸ポリペプチドと同じ三次構造、従って同じ活性を保持するが、in vitroおよびin vivoでの酵素分解に対してより安定であり、従って元来のポリペプチドより大きな治療効果を有する(Brady and Dodson, Nature 368:692-693, 1994 and Jameson et al., Nature 368:744-746, 1994)。リバースD-ポリペプチドだけでなく、コンセンサス配列または実質的に同一なコンセンサス配列変化を含む拘束されたポリペプチドを、当技術分野において周知の方法によって作製することができる(Rizo et al., Ann. Rev. Biochem. 61:387-418, 1992)。例えば、拘束されたポリペプチドを、ジスルフィド架橋を形成できるシステイン残基の付加によって作製し、それによって環状ポリペプチドを得ることができる。環状ポリペプチドは遊離したN-またはC-末端を持たない。従ってこれらはエキソペプチダーゼによるタンパク質分解を受けない、もっともこれらは、勿論、ポリペプチド末端で切断しないエンドペプチダーゼに対しては感受性である。N-末端またはC-末端D-アミノ酸を有するポリペプチドおよび環状ポリペプチドのアミノ酸配列は、N-末端もしくはC-末端D-アミノ酸残基の
存在またはそれらの環状構造の存在を除けば、それぞれ、対応するポリペプチドの配列と通常同一である。
【0063】
分子内ジスルフィド結合を有する環状誘導体は、アミノ末端およびカルボキシ末端などの環化のために選択した部位に、好適なS-保護システインまたはホモシステイン残基を組み込むとともに、従来の固相合成によって調製することができる。(Sah et al., J. Pharm. Pharmacol. 48:197, 1996)。環化は、ポリペプチド鎖構築の完了後、(1)S-保護基の選択的除去、その結果として起こる対応する2つの遊離SH-官能基の支持体上での酸化(S-S結合を形成する)、それに続く、生成物の支持体からの通常の除去および適当な精製処理によって、または(2)完全な側鎖脱保護と並行したポリペプチドの支持体からの除去、それに続く、高希釈した水溶液中での遊離SH-官能基の酸化によって実施することができる。
【0064】
分子内アミド結合を有する環状誘導体は、環化のために選択した部位に、好適なアミノ側鎖およびカルボキシル側鎖が保護されたアミノ酸誘導体を組み込むとともに、通常の固相合成によって調製することができる。分子内-S-アルキル結合を有する環状誘導体は、環化のために選択した部位に、好適なアミノ基側鎖が保護されたアミノ酸残基および好適なS-保護システインまたはホモシステイン残基を組み込むとともに、従来の固相化学によって調製することができる。
【0065】
ポリペプチドのN-末端またはC-末端残基に作用するペプチダーゼに対して抵抗性を与える他の効果的な手法は、改変されたポリペプチドがもはやペプチダーゼの基質ではないように、ポリペプチド末端に化学基を付加することである。このような化学修飾の1つは、どちらか一方または両方の末端におけるポリペプチドのグリコシル化である。ある特定の化学修飾、特にN-末端グリコシル化は、ヒト血清中のポリペプチドの安定性を向上することが示されている(Powell et al., Pharm. Res. 10:1268-1273, 1993)。血清安定性を向上する他の化学修飾には、限定されるものでないが、アセチル基などの1〜20個の炭素の低級アルキルからなるN-末端アルキル基の付加、および/またはC-末端アミドもしくは置換アミド基の付加が含まれる。特に、本発明はN-末端アセチル基および/またはC-末端アミド基を有するポリペプチドからなる改変ポリペプチドを包含する。
【0066】
また本発明には、その誘導体がポリペプチドの所望の機能的活性を保持するならば、通常はポリペプチドの一部でない更なる化学的部分を有する他のタイプのポリペプチド誘導体も含まれる。かかる誘導体の例としては、(1)アミノ末端または他の遊離アミノ基のN-アシル誘導体(ここでアシル基はアルカノイル基(例えば、アセチル、ヘキサノイル、オクタノイル)、アロイル基(例えば、ベンゾイル)もしくはF-moc(フルオレニルメチル-O-CO-)のようなブロック基であってもよい);(2)カルボキシ末端のまたは他の遊離カルボキシ基もしくはヒドロキシル基のエステル;(3)アンモニアもしくは適当なアミンとの反応によって生じる、カルボキシ末端のまたは他の遊離カルボキシル基のアミド;(4)リン酸化誘導体が挙げられる。
【0067】
本明細書に記載したポリペプチドへのさらなるアミノ酸残基の付加から得られる、より長いポリペプチド配列も本発明に包含される。かかるより長いポリペプチド配列は、上記のポリペプチドと同様の生物学的活性および特異性(例えば、細胞指向性)を有すると期待することができる。かなりの数のさらなるアミノ酸を有するポリペプチドを除外しないものの、いくつかの大きなポリペプチドは有効な配列を遮蔽する立体配置をとり、その結果、標的(例えば、LRPまたはLRP2などのLRP受容体ファミリーの一員)との結合を妨げうると考えられる。これらの誘導体は競合的アンタゴニストとして作用しうる。従って、本発明は、伸張部を有する本明細書に記載したポリペプチドまたはポリペプチドの誘導体を包含するが、望ましくは、その伸張部はポリペプチドまたはその誘導体の細胞を標的化する活性を損なうものではない。
【0068】
本発明に包含される他の誘導体は、直接、またはスペーサーを介してアラニン残基の短い伸張部によりもしくはタンパク質分解の推定部位により(例えばカテプシンにより、例えば、米国特許第5,126,249号および欧州特許第495 049号を参照されたい)お互いに共有結合された、本明細書に記載した2つの同一のあるいは2つの異なるポリペプチドからなる二重ポリペプチドである。本明細書に記載したポリペプチドの多量体は、同じかまたは異なるポリペプチドまたはその誘導体から形成された分子のポリマーから成る。
【0069】
本発明はまた、そのアミノ末端もしくはカルボキシ末端、もしくは両方で、異なるタンパク質のアミノ酸配列と結合した、本明細書に記載したポリペプチドまたはその断片を含有するキメラタンパク質あるいは融合タンパク質であるポリペプチド誘導体を包含する。かかるキメラタンパク質または融合タンパク質は、そのタンパク質をコードする核酸の組換え発現によって作製することができる。例えば、キメラタンパク質または融合タンパク質は記載したポリペプチドの1つと共有する少なくとも6アミノ酸を含有し、望ましくは同等のまたはより大きい機能的活性を有するキメラタンパク質または融合タンパク質をもたらしうる。
【0070】
ペプチドミメチックを同定するアッセイ
上記のように、本明細書に記載したポリペプチドの骨格幾何およびファルマコフォア提示を再現するために作製した非ペプチド化合物(ペプチドミメチック)は、しばしば、より高い代謝的安定性、より高い効力、より長い作用持続時間、ならびにより良いバイオアベイラビリティの特性を有する。
【0071】
本発明のペプチドミメチック化合物は当技術分野において公知のコンビナトリアルライブラリー法での多数の手法のいずれかを用いて入手することができ、前記手法としては、生物学的ライブラリー;空間的に位置指定可能な平行固相もしくは液相ライブラリー;デコンボリューションを必要とする合成ライブラリー法;「1ビーズ1化合物」ライブラリー法、およびアフィニティークロマトクラフィー選択を用いる合成ライブラリー法が挙げられる。生物学的ライブラリー手法はペプチドライブラリーに限定されるが、他の4つの手法は、ペプチド、非ペプチドオリゴマーまたは化合物の小分子ライブラリー(Lam, Anticancer Drug Des. 12:145, 1997)に適用できる。分子ライブラリーの合成方法の例は、当技術分野において、例えば、DeWitt et al.(Proc. Natl. Acad. Sci. USA 90:6909, 1993);Erb et al.(Proc. Natl. Acad. Sci. USA 91:11422, 1994);Zuckermann et al.(J. Med. Chem. 37:2678, 1994);Cho et al.(Science 261:1303, 1993);Carell et al.(Angew. Chem, Int. Ed. Engl. 33:2059, 1994 and ibid 2061);ならびにGallop et al.(Med. Chem. 37:1233, 1994)に見出すことができる。化合物のライブラリーは溶液中で(例えば、Houghten, Biotechniques 13:412-421, 1992)、ビーズ上で(Lam, Nature 354:82-84, 1991)、チップで(Fodor, Nature 364:555-556, 1993)、細菌もしくは胞子(米国特許第5,223,409号)で、プラスミド(Cullら、Proc. Natl. Acad. Sci. USA 89:1865-1869, 1992)で、ファージ上で(ScottおよびSmith, Science 249:386-390, 1990)、またはルシフェラーゼで提示し、そして酵素標識を適当な基質の生成物への変換の測定により検出することができる。
【0072】
いったん本明細書に記載したポリペプチドが同定されると、それを、限定されるものでないが、溶解度の違い(例えば、沈殿)、遠心分離、クロマトグラフィー(例えば、アフィニティー、イオン交換、サイズ排除など)を含む多くの標準方法のいずれかによって、またはペプチド、ペプチドミメチックもしくはタンパク質の精製に使用されるいずれか他の標準技術によって、単離しかつ精製することができる。同定した目的のポリペプチドの機能的特性は、当技術分野において公知のいずれかの機能アッセイを用いて評価することができる。細胞内シグナル伝達における下流受容体機能を評価するアッセイ(例えば、細胞増殖)を使用することが望ましい。
【0073】
例えば、本発明のペプチドミメチック化合物は、下記の3ステップ:すなわち、(1)本明細書に記載したポリペプチドを走査して、本明細書に記載した特定の細胞型を標的化するために必要な二次構造の領域を同定するステップ;(2)立体配座で拘束したジペプチド代替物を使用して骨格幾何を洗練し、これらの代替物に対応する有機基本骨格を提供するステップ;および(3)最良の有機基本骨格を用いて、天然のポリペプチドの望ましい活性を模倣するように設計した候補のライブラリーにおいて有機ファルマコフォアを提示するステップより成るプロセスを用いて入手することができる。さらに詳細には、3ステップは次の通りである。第一ステップでは、リード候補ポリペプチドを走査し、それらの構造を要約し、それらの活性のための要件を同定する。一連の元来のポリペプチドの類似体を合成する。第二ステップでは、立体配座で拘束したジペプチド代替物を用いて、最良のポリペプチド類似体を研究する。インドリジジン-2-オン、インドリジジン-9-オンおよびキノリジジノンアミノ酸(それぞれI2aa、I9aaおよびQaa)を、最良のペプチド候補の骨格幾何を研究するための基本骨格として使用した。これらおよび関連基本骨格(Halab et al., Biopolymers 55:101-122, 2000;およびHanessian et al., Tetrahedron 53:12789-12854, 1997に総括されている)をポリペプチドの特定の領域に導入し、ファルマコフォアを色々な方向に配向することができる。これらの類似体の生物学的評価によって、活性のための幾何学的要件を模倣する改善されたリードポリペプチドが同定される。第三ステップでは、最も活性の高いリードポリペプチド由来の基本骨格を用いて、生来のペプチドの活性に関わるファルマコフォアの有機代替物を提示する。ファルマコフォアと骨格を平行合成フォーマットで組み合わせる。ポリペプチドの誘導と上記ステップは、当技術分野で公知の方法を用いる他の手段により達成してもよい。
【0074】
本明細書に記載したポリペプチド、ポリペプチド誘導体、ペプチドミメチックまたは他の小分子から決定される構造機能相関は、同様のまたはより良い特性を有する類似の分子構造を改善、作製するために使用することができる。従って、本発明の化合物はまた、本明細書に記載したポリペプチドの構造、極性、荷電特性および側鎖特性を共有する分子も包含する。
【0075】
要約すると、当業者は本明細書の開示に基づいて、特定の細胞型(例えば、本明細書に記載したもの)に薬剤を標的化する化合物を同定するのに有用なペプチドおよびペプチドミメチック・スクリーニングアッセイを開発することができる。本発明のアッセイは、ロー(低)スループット、ハイ(高)スループット、またはウルトラハイ(超高)スループットスクリーニング方式用に開発することができる。本発明のアッセイには自動化が可能なアッセイが含まれる。
【0076】
リンカー
ポリペプチド治療薬(例えば、レプチン)をベクターペプチドに直接(例えば、ペプチド結合などの共有結合を介して)結合してもよく、またはリンカーを介して結合してもよい。リンカーには化学連結剤(例えば、切断可能なリンカー)およびペプチドが含まれる。
【0077】
いくつかの実施形態において、リンカーは化学連結剤である。ポリペプチド治療薬とベクターペプチドを、スルフヒドリル基、アミノ基(アミン類)、および/もしくは糖類または任意の適当な反応基を介してコンジュゲートしてもよい。ホモ二官能およびヘテロ二官能クロスリンカー(コンジュゲーション剤)が多数の商業供給源から利用可能である。クロスリンクに利用できる領域は本発明のポリペプチド上に見出すことができる。クロスリンカーは柔軟性のあるアーム、例えば、例えば、2、3、4、5、6、7、8、9、10、11、12、13、14、または15個の炭素原子を含みうる。例示のクロスリンカーとしては、BS3([ビス(スルホスクシンイミジル)スベリン酸エステル];BS3はアクセス可能な一級アミン類を標的化するホモ二官能性N-ヒドロキシスクシンイミドエステルである)、NHS/EDC(N-ヒドロキシスクシンイミドおよびN-エチル-(ジメチルアミノプロピル)カルボジイミド;NHS/EDCは一級アミン基とカルボキシル基とのコンジュゲーションを可能にする)、スルホ-EMCS([N-ε-マレイミドカプロン酸 スルホ-N-スクシンイミジルエステル];スルホ-EMCSはスルフヒドリルおよびアミノ基に対して反応性であるヘテロ二官能性の反応基である(マレイミドおよびNHS-エステル))、ヒドラジド(ほとんどのタンパク質は曝された糖類を含有し、ヒドラジドはカルボキシル基を一級アミン類と連結するために有用な試薬である)、およびSATA(N-スクシンイミジル-S-アセチルチオアセテート;SATAはアミン類に対して反応性であり、保護されたスルフヒドリル基を加える)が挙げられる。
【0078】
共有結合を形成するために、ヒドロキシル部分がペプチドを改変するのに必要なレベルで生理学的に許容しうる場合は化学反応基として色々な種類の活性カルボキシル基(例えば、エステル)を利用することができる。具体的な薬剤には、N-ヒドロキシスクシンイミド(NHS)、N-ヒドロキシ-スルホスクシンイミド(スルホ-NHS)、マレイミド-ベンゾイル-スクシンイミド(MBS)、γ-マレイミド-ブチリルオキシスクシンイミド(GMBS)、マレイミドプロピオン酸(MPA)、マレイミドヘキサン酸(MHA)、およびマレイミドウンデカン酸(MUA)が含まれる。
【0079】
一級アミン類はNHSエステルの主な標的である。接近可能なタンパク質のN末端に存在するα-アミンとリシンのε-アミンはNHSエステルと反応する。NHSエステルコンジュゲーション反応物が一級アミン類と反応するとアミド結合が形成され、N-ヒドロキシスクシンイミドを放出する。これらのスクシンイミドを含有する反応基を本明細書ではスクシンイミジル基と呼ぶ。本発明のある特定の実施形態において、タンパク質上の官能基はチオール基であってもよく、化学反応基はマレイミドを含有する基、例えば、γ-マレイミド-ブチリルアミド(GMBAまたはMPA)であってもよい。かかるマレイミドを含有する基を本明細書ではマレイミド基と呼ぶ。
【0080】
マレイミド基は、反応混合物が6.5〜7.4である場合にペプチドのスルフヒドリル基に対して最も選択性がある。pH7.0においてマレイミド基とスルフヒドリル(例えば、血清アルブミンまたはIgGなどのタンパク質上のチオール基)との反応速度はアミン類とのそれより1000倍速い。従って、マレイミド基とスルフヒドリルの間に安定なチオエーテル連鎖を形成することができる。
【0081】
他の実施形態において、リンカーは少なくとも1つのアミノ酸(例えば、少なくとも2、3、4、5、6、7、10、15、20、25、40、または50アミノ酸のペプチド)を含む。ある特定の実施形態において、リンカーは単一アミノ酸(例えば、Cysなどの任意の天然アミノ酸)である。他の実施形態においては、グリシンの豊富なペプチド、例えば、配列[Gly-Gly-Gly-Gly-Ser]n(ここでnは1、2、3、4、5または6であり、米国特許第7,271,149号に記載の通り使用される)を有するペプチドが使用される。他の実施形態においては、米国特許第5,525,491号に記載のとおり、セリンリッチペプチドリンカーを使用する。セリンリッチペプチドリンカーには式[X-X-X-X-Gly]y(Xの2個以上はThr、残りのXはSer、そしてyは1〜5である)のものが含まれる(例えば、Ser-Ser-Ser-Ser-Glyであってyが2以上である)。いくつかの事例において、リンカーは単一のアミノ酸(例えば、任意のアミノ酸、例えば、GlyまたはCys)である。
【0082】
好適なリンカーの例は、コハク酸、Lys、Glu、およびAsp、またはジペプチド、例えばGly-Lysである。リンカーがコハク酸である場合、その1つのカルボキシル基はアミノ酸残基のアミノ基とアミド結合を形成しうるし、他のカルボキシル基は、例えば、ペプチドまたは置換基のアミノ基とアミド結合を形成しうる。リンカーがLys、Glu、またはAspである場合、そのカルボキシル基はアミノ酸残基のアミノ基とアミド結合を形成しうるし、そのアミノ基は、例えば、置換基のカルボキシル基とアミド結合を形成しうる。Lysをリンカーとして使用する場合、さらなるリンカーをLysのε-アミノ基と置換基の間に挿入してもよい。1つの特定の実施形態において、さらなるリンカーはコハク酸であり、例えば、Lysのε-アミノ基とアミド結合を形成しかつ置換基に存在するアミノ基とアミド結合を形成する。一実施形態において、さらなるリンカーはGluまたはAspであり(例えば、Lysのε-アミノ基とアミド結合を形成しかつ置換基に存在するカルボキシル基と他のアミド結合を形成する)、すなわち、置換基はNε-アシル化リシン残基である。
【0083】
代謝障害治療法
ある特定の実施形態においては、本発明のコンジュゲートを代謝障害を治療するために使用する。かかる障害には糖尿病(I型またはII型)、肥満、高血糖、異脂肪血症、高トリグリセリド血症、症候X、インスリン抵抗性、IGT、糖尿病の異脂肪血症、高脂血症、心血管疾患、および高血圧が含まれる。レプチンは食物摂取を低減し、従って体重を減少するためにおよび食物摂取の低減または体重減少が有利な疾患を治療するために使用することができる。
【0084】
神経学的疾患治療法
本明細書に記載したポリペプチドはBBBを横切って薬剤を輸送することができるため、本発明の化合物はまた、神経学的疾患、例えば、神経変性疾患または中枢神経系(CNS)、末梢神経系、もしくは自律神経系の他の症状(例えば、ニューロンが失われるかまたは損なわれる)の治療にも有用である。多くの神経変性疾患は、運動失調(すなわち、非協調性筋肉運動)および/または記憶障害を特徴とする。神経変性疾患には、アレキサンダー病、アルパース病、アルツハイマー病、筋萎縮性側索硬化症(ALS;すなわち、ルー・ゲーリッグ病)、毛細血管拡張性運動失調症、バッテン病(シュピールマイアー・フォークト・シェーグレン・バッテン病)、牛海綿状脳症(BSE)、カナバン病、コケイン症候群、大脳皮質基底核変性症、クロイツフェルト・ヤコブ病、ハンチントン病、HIV関連認知症、ケネディ病、クラッベ病、レビー小体型認知症、マシャド・ジョセフ病(脊髄小脳失調症3型)、多発性硬化症、多系統萎縮症、ナルコレプシー、神経ボレリア症、パーキンソン病、ペリツェウス・メルツバッハー病、ピック病、原発性側索硬化症、プリオン病、レフサム病、シルダー病(すなわち、副腎白質ジストロフィー)、統合失調症、脊髄小脳失調、脊髄性筋萎縮症、スティール・リチャードソン・オルゼウスキー症候群、および脊髄ろうが含まれる。
【0085】
さらなる適応症
本発明のコンジュゲートはまた、他の器官または組織において見られる疾患を治療するためにも使用することができる。例えば、Angiopep-7(配列番号112)は、肝臓、肺、腎臓、脾臓、および筋肉細胞に効率的に輸送され、これらの組織に関連した疾患(例えば、肝細胞癌および肺癌)の選択的治療を可能にする。本発明の化合物はまた、特定の遺伝子転写産物の下方制御が有用でありうるダウン症候群(すなわち、21トリソミー)のような遺伝障害を治療するためにも使用することができる。
【0086】
投与および用量
本発明はまた、治療有効量の本発明の化合物を含有する医薬組成物を特徴とする。組成物は、様々な薬物送達システムで用いるために製剤化することができる。1以上の生理的に許容される賦形剤または担体を、適当な製剤のために組成物に含有してもよい。本発明に使用するための適当な製剤は、Remington’s Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, PA, 17th ed., 1985に見出される。薬物を送達する方法の簡略な総説は、例えば、Langer(Science 249:1527-1533, 1990)を参照されたい。
【0087】
医薬組成物は予防および/または治療処置のための非経口、鼻腔内、局所、経口、または局部(例えば経皮手段による)投与を意図している。医薬組成物は、非経口的に(例えば、静脈内、筋肉内、または皮下注射によって)、または経口摂取によって、あるいは、血管もしくは癌症状により侵された部位における局所適用または関節内注射によって投与することができる。さらなる投与経路には、血管内、動脈内、腫瘍内、腹腔内、脳室内、硬膜内、ならびに経鼻、点眼、強膜内、眼窩内、直腸、局所、またはエアロゾル吸入投与が含まれる。デポー注射または浸食性インプラントもしくは成分などの方法による持続放出投与も、具体的に本発明に包含される。従って、本発明は、許容される担体、好ましくは、例えば、水、緩衝水、生理食塩水、PBSなどの水性担体に溶解または懸濁した上述の薬剤を含有する非経口投与用組成物を提供する。組成物は近似生理条件に必要とされる製薬上許容される助剤、例えば、pH調整剤および緩衝剤、等張性調整剤、湿潤剤、界面活性剤などを含有してもよい。本発明はまた、経口送達用組成物を提供し、錠剤、カプセルを製剤するために結合剤または充填剤のような不活性成分を含有してもよい。さらに、本発明は局所投与用の組成物を提供し、クリーム、軟膏などを製剤するために溶媒または乳化剤などの不活性成分を含有してもよい。
【0088】
これらの組成物は従来の滅菌技術によって滅菌してもよく、またはろ過滅菌してもよい。得られる水溶液はそのままの使用のために包装しても、凍結乾燥してもよく、凍結乾燥した調製物を投与前に滅菌水性担体と組み合わせてもよい。調製物のpHは典型的には、3〜11、より好ましくは5〜9または6〜8、最も好ましくは7〜8、例えば7〜7.5である。得られる固形の組成物は、それぞれ一定量の上述の薬剤を含有する複数の単回投与単位で、例えば、錠剤またはカプセルの密封包装で包装してもよい。
【0089】
固形の組成物はまた、量を調節できる容器に入れて、例えば、局所に適用可能なクリームまたは軟膏用に作られた絞り出しチューブに入れて包装してもよい。
【0090】
有効量を含有する組成物を予防または治療処置のために投与することができる。予防の適用では、組成物を臨床的に決定した素因、あるいは代謝障害または神経学的疾患に対する感受性の高い患者に投与することができる。本発明の組成物は、臨床疾患の発症を遅延、減少、または好ましくは予防するために十分な量だけ被験体(例えば、ヒト)に投与することができる。治療の適用では、組成物を、既に疾患(例えば、本明細書に記載したような代謝障害または神経学的疾患)に罹患している被験体(例えば、ヒト)に、症状の症候群およびその合併症を治癒する、または少なくとも部分的に抑制するために十分な量で投与する。この目的を達成するために適当な量は「治療有効量」、疾患または病状に関連するいくつかの兆候を実質的に改善するために十分な化合物の量と定義される。例えば、代謝障害(例えば、本明細書に記載した)の治療では、疾患もしくは症状のいずれかの兆候を減少、予防、遅延、抑制、または阻止する薬剤あるいは化合物は治療上有効でありうる。
【0091】
治療有効量の薬剤または化合物は、疾患もしくは症状を治癒する必要はないが、疾患もしくは症状の治療、例えば、個体において、疾患もしくは症状の発症を遅延、阻害、もしくは予防するか、または疾患もしくは症状の症候群を改善するか、または疾患もしくは症状の期間を変えるか、または、例えば、より軽症にするか、または回復を促進する治療を提供するであろう。
【0092】
レプチンを0.001〜3mg/kg(例えば、0.005、0.01、0.05、0.1、0.5、1、2、または3mg/kg)のいずれかの用量で投与してもよい。本発明の化合物を、レプチンについて記載したのと同等の用量で投与してもよく、より高い同等の用量(例えば、10%、25%、50%、100%、200%、500%、1000%より多い用量)で投与してもよく、またはより低い同等の用量(例えば、同等の用量の90%、75%、50%、40%、30%、20%、15%、12%、10%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、または0.1%)で投与することもできる。この使用に有効な量は、疾患もしくは症状の重症度ならびに被験体の体重および全身の状態に応じうる。最初の投与と追加投与に対する好適なレジメンは、典型的には、最初の投与と、引き続いて1以上の毎時間、毎日、毎週、または毎月の間隔の繰り返し用量の投与である。本発明の組成物中に存在する薬剤の総有効量を哺乳動物に、単一用量としてボーラスでもしくは比較的短時間にわたる輸液により投与してもよく、または分割治療プロトコルを用いて投与する、すなわち、複数用量をより長い時間にわたって(例えば、毎4〜6、8〜12、14〜16、または18〜24時間、または毎2〜4日、毎1〜2週、毎月に1用量)投与してもよい。あるいは、血液中の治療有効濃度を維持するのに十分な連続静脈内注射が考えられる。
【0093】
本発明の組成物中に存在しかつ哺乳動物(例えば、ヒト)に適用する本発明の方法で使用する1以上の薬剤の治療有効量は、被験体の年齢、体重、および症状の個体差を考慮して、当業者が決定することができる。本発明のある特定の化合物はBBBを横切る高い能力を示すので、本発明の化合物の用量は、コンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストの治療効果に必要な同等の用量より低くてもよい(例えば、同等の用量の約90%、75%、50%、40%、30%、20%、15%、12%、10%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、または0.1%より低いかまたは等しい)。本発明の薬剤を被験体(例えば、ヒトなどの哺乳動物)に有効な量、すなわち、治療する被験体に望ましい結果(例えば、糖血症の軽減、体重の低下、体重減少の増加、および食物摂取の低下)をもたらす量だけ投与する。治療有効量はまた、当業者が実験的に決定することができる。
【0094】
被験体はまた、1用量あたり約80μg〜240mgの範囲のレプチンと比較した同等の用量の薬剤を、毎週1回以上(例えば、毎週2、3、4、5、6、または7回以上)、例えば、1日あたり1mg〜24mg同等の用量を受けてもよい。
【0095】
有効量を含む本発明の組成物の単回投与または複数回投与を、治療する医師が選択した用量レベルおよびパターンで行うことができる。用量および投与計画は、臨床医が通常行う方法もしくは本明細書に記載した方法によって治療期間にわたってモニターすることができる被験体の疾患または症状の重症度に基づいて決定しかつ調節することができる。
【0096】
本発明の化合物を従来の処置または治療方法と組み合わせて使用してもよく、または従来の処置または治療方法とは別に使用してもよい。
【0097】
本発明の化合物を他の薬剤による治療と組み合わせて投与する場合、それらを順次または同時に個体に投与してもよい。あるいは、本発明による医薬組成物は、本発明の化合物と本明細書に記載した製薬上許容される賦形剤および当技術分野で公知の別の治療薬または予防薬を合体した組み合わせから成ってもよい。
【実施例1】
【0098】
レプチンコンジュゲートの合成
次の手順を用いてレプチン-(C11)-AN2コンジュゲートを作製した。
【化2】

【0099】
MUA-AN2(264.6mg、91.5μmol、1.2eq.、82%ペプチド含量)を、0.1N NaOH溶液(1.5ml)を加えてpHを3.9〜5.00に調節することにより、H2O/ACN(9/1)(14ml)に溶解した。この溶液をレプチン116-130-NH2(156.5mg、76.2μmol、1eq.、76%ペプチド含量)のPBS 4X(pH 6.61、7mL)中の溶液に加えた。反応を下記の分析法を用いてモニターした。結果を図1Aおよび1B(クロマトグラム1および2)に示す。
【0100】
反応が完了に向かうと濁った懸濁液が観察された。室温にて1時間後、反応(3.62mM)が完了し、その混合物をFPLCクロマトグラフィ(AKTA explorer、クロマトグラム3、表1を参照)により直接精製した。精製はGE Healthcare AKTA explorerカラム(GE Healthcare)30 RPC樹脂(ポリスチレン/ジビニルベンゼン)、95mlを用いて、次の条件で実施した:サンプル負荷:450mgを含む反応バッファー(21ml)、10%ACNを含むH2O、0.05%TFA(60ml)、DMSO.HCl(pH 2.87、6ml)、溶液A:H2O、0.05%TFA、溶液B:ACN、0.05%TFA、流量:5-17ml/min、勾配:10-30% B。
【0101】
精製結果を図2(クロマトグラム 3)に示す。
【0102】
化合物を精製するために用いた勾配を下表に示す。
【表3】

【0103】
アセトニトリルの蒸発と凍結乾燥の後に、白色の固体(250mg、79%、純度>98%)を得た。質量はESI-TOFMS(Bruker Daltonics)によってチェックした。いくらかの残留レプチン(116-130)-NH2が二量化しうる可能性(≦5%、システインペプチドMw=3119.44)を避けるために、直接精製を行い、1.2当量過剰のマレイミド-(C11)-AN2を得た。
【0104】
反応をモニターするために次の分析法を用いた。Waters Acquity UPLC BEHフェニルカラムを備えたWaters Acquity UPLCシステムを用いた(1.7μm、2.1 x 50mm)。検出は229nmで行った。溶液AはH2O、0.1%FAであり、溶液Bはアセトニトリル(ACN)、0.1%蟻酸(FA)であった。流量と勾配を下表に示す。
【表4】

【0105】
質量分析計(ESI-TOF-MS;Bruker Daltonics):計算値4125.53;測定値 4125.06、m/z 1376.01 (+3)、1032.26 (+4)、826.02 (+5)、688.52 (+6)。
【0106】
コンジュゲートを窒素雰囲気下、暗所で20℃未満にて貯蔵した。
【0107】
この手順を用いて作製したレプチンコンジュゲートは11-炭素リンカーに因んでレプチン-AN2(C11)と呼ぶ。レプチン-AN2(C3)およびレプチン-AN2(C6)を含む他の長さの炭素リンカーコンジュゲートも類似の手順を用いて作製した。
【実施例2】
【0108】
レプチン116-130Angiopep-2コンジュゲートのin situ脳潅流
どのレプチンコンジュゲートが最も効率的に血液脳関門を横切るかを確認するために、本発明者らは各コンジュゲートをin situ脳潅流アッセイで試験した。このアッセイまたは類似のアッセイは例えば、米国特許公報第20060189515号に記載されていて、これはDagenais et al., 2000, J. Cereb. Blood Flow Metab. 20(2):381-386に記載の方法に基づく。BBB輸送定数は、先にSmith(1996, Pharm. Biotechnol. 8:285-307)が記載した通り決定した。これらの実験から、レプチン-AN2(C11)は、C3またはC6リンカーを有するコンジュゲートと比較してBBBを横切る輸送が最大であることが示されたので、さらなる実験用に選択した(図3)。
【0109】
レプチンの輸送を、in situ潅流アッセイを用いて、痩せたマウスと食餌に起因する肥満(DIO)マウス(例えば、the Jackson laboratoriesから入手しうる)においてレプチン-AN2(C11)コンジュゲートと比較した。これらの結果から、DIOマウスにおけるBBBを横切るレプチンの輸送は痩せたマウスと比較して低下することがわかった。対照的に、レプチン-AN2(C11)コンジュゲートは、痩せたおよびDIOマウスの両方において遥かに効率的に脳を横切り、コンジュゲートの輸送において痩せたとDIOマウスの間で統計的有意差は観察されなかった(図4A)。血漿レプチンレベルは高脂肪(60%)食餌で3週間後に増加することが観察され、マウスはレプチン抵抗性となることを示唆した(図4B)。
【実施例3】
【0110】
レプチンコンジュゲートの食餌摂取および体重取得に与える効果
マウスに、レプチン-AN2(C11)(1マウス当たりレプチン116-130 1mg同等)、レプチン116-130(1mg/マウス)、または対照(生理食塩水)の静脈内ボーラス投与を行った(1グループ当たりn=5)。マウスの食餌摂取を4時間後(図5A)および15時間後(図5B)にモニターした。両方の事例において、コンジュゲートは、対照マウス、またはレプチン116-130を受けたマウスと比較して、有意に大きい食餌摂取の低下を示した。
【0111】
本発明者らはまた、コンジュゲート(2.5mg/マウス;レプチン116-130 1mg同等/マウス)、レプチン116-130(1mg/マウス)、および対照を受けるDIOマウスの体重変化を6日間にわたって比較した。各マウスは毎日腹腔内注入による処置を受けた。レプチンまたは対照を受けるマウスは類似した量の体重取得を6日間にわたり示したが、コンジュゲートを受けるマウスは対照マウスおよびレプチン116-130を受けるマウスと比較して、体重取得の著しい低下を示した(図6)。
【0112】
本発明者らはさらに、コンジュゲート(2.5mg/マウス;レプチン116-130 1mg同等/マウス)、レプチン116-130(1mg/マウス)、および対照を受けるレプチン欠乏性ob/obマウス体重変化を6日間にわたって比較した。各マウス(1グループ当たりn=5)は毎日腹腔内注入により処置を受けた。コンジュゲートを受けるマウスは、投与期間にレプチン116-130または対照を受けるマウスより低い体重取得を示した(図7)。
【実施例4】
【0113】
組換えAngiopep-2およびAngiopep-2レプチン融合タンパク質の開発
本発明者らはまた、Angiopep-2 融合タンパク質を開発した。最初のステップとして、cDNA(ACC TTT TTC TAT GGC GGC AGC CGT GGC AAA CGC AAC AAT TTC AAG ACC GAG GAG TAT;配列番号117)を創製した。この配列をpGEXベクター系中に挿入し、細菌に発現し、そしてインサートの配列を検証した(図8)。GST-An2-レプチン116-130構築物を、オーバーラップ伸長PCR戦略を利用して作製した(図9)。
【0114】
組換えAngiopep-2を細菌発現系で発現し、GSH-セファロースカラムを用いて精製した。この手順から得たクロマトグラム(図10)を示す。精製したAngiopep-2を、Angiopep-2抗体を用いてウェスタンブロット(図11A)により、液体クロマトグラフィ(図11B)により、および質量分析計(図11C)により分析した。
【0115】
in situ脳潅流アッセイを、組換えAngiopep-2を用いて実施した。結果を合成Angiopep-2と比較した(図12)。類似の取込みレベルをAngiopep-2の両方の型で観察した。実質中への取込みをGST、GST-Angiopep-2、GST-レプチン116-130、および GST-Angiopep-2-レプチン116-130の間で比較した(図 13)。これらの結果は、Angiopep-2 配列を含有する融合タンパク質は実質中に効率的に取込まれるが、Angiopep-2 配列を欠くタンパク質は遥かに低い効率でしか取込まれないことを示す。
【0116】
全長レプチン配列を含有するHis-タグ付きAngiopep-2/マウスレプチン融合タンパク質を作製した(図14)。この融合タンパク質を細菌の発現系において発現させた(図15)。融合タンパク質の例示の精製スキームを図17Aおよび17Bに示す。小規模精製で得た結果を図18に示す。
【0117】
トロンビン切断ステップによって2種の産物が産生し、Angiopep-2配列は図19に示した低アフィニティトロンビン切断部位を含有するという可能性を示唆した。レプチン-Angiopep-2は溶液中で凝固する傾向があるので、凝集を低減しかつ収率を改善する精製条件を試験した。
【実施例5】
【0118】
レプチン融合タンパク質の脳取込みと活性
本発明者らは次いで、in situ脳潅流アッセイを用いてAngiopep-2-レプチン融合タンパク質がDIOマウスの脳実質中に取込まれる能力を、レプチンと比較して試験した(図20)。この実験から、本発明者らは融合タンパク質がレプチンと比較して取込みの増加を示すことを観察した。
【0119】
対照として、組換えレプチンがob/obマウスの体重を低下する能力を、毎日0.1mg/マウスまたは0.25mg/マウスを用いて試験した。図21に示した通り、レプチンはまさに用量に応じてこれらのマウスの体重を低下した。
【0120】
DIOマウスをまた、対照でまたは50μg his-タグ付き融合タンパク質、レプチン、もしくはhis-タグ付きレプチンで処置した。マウスは示したように2つの処置を第3日と第4日に受けた。これらの結果に基づくと、最高の体重減少は融合タンパク質を受けたマウスにおいて観察された(図22)。
【0121】
他の実施形態
米国特許仮出願第61/200,947号および第61/178,837号(それぞれ、2008年12月5日および2009年5月15日出願)を含む、本明細書に記述したすべての特許、特許出願、および公報は、あたかも各独立した特許、特許出願、もしくは公報が具体的にかつ個々に参照により本明細書に組み込まれると示されたのと同程度に本明細書に組み込まれる。
【特許請求の範囲】
【請求項1】
式:A-X-B
[式中、
Aは配列番号1〜105および107〜114からなる群より選択されるいずれか1つの配列と少なくとも70%同一のアミノ酸配列、またはそれらの断片を含むペプチドベクターであり;
Xはリンカーであり;および
Bはレプチン、レプチン類似体、またはOB受容体アゴニストである]
で表わされる化合物。
【請求項2】
AはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つの配列と少なくとも70%同一のアミノ酸配列を有するポリペプチドである、請求項1に記載の化合物。
【請求項3】
前記配列同一性は少なくとも90%である、請求項2に記載の化合物。
【請求項4】
前記ポリペプチドはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つのアミノ酸配列を含む、請求項3に記載の化合物。
【請求項5】
前記ポリペプチドはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つのアミノ酸配列から成る、請求項4に記載の化合物。
【請求項6】
AはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、またはAngiopep-2-cys(配列番号114)を含む、請求項5に記載の化合物。
【請求項7】
Bは全長ヒトレプチン、成熟ヒトレプチン(図16の全長ヒトレプチンのアミノ酸22-167)、またはレプチン116-130である、請求項1に記載の化合物。
【請求項8】
Xは式:
【化1】

[式中、nは2〜15の整数であり;YはA上のチオールでありかつZはB上の一級アミンであるかまたはYはB上のチオールでありかつZはA上の一級アミンである]
で表わされる、請求項1〜7のいずれか1項に記載の化合物。
【請求項9】
nは3、6、または11である、請求項8に記載の化合物。
【請求項10】
構造:
【化2】

を有する化合物。
【請求項11】
前記レプチンまたはレプチン類似体は全長ヒトレプチン、成熟ヒトレプチン(全長ヒトレプチンのアミノ酸22-167)、またはレプチン116-130である、請求項10に記載の化合物。
【請求項12】
Xはペプチド結合である、請求項1に記載の化合物。
【請求項13】
Xは少なくとも1つのアミノ酸であり;そしてAとBはそれぞれペプチド結合によりXと共有結合されている、請求項1〜9のいずれか1項に記載の化合物。
【請求項14】
請求項12または13に記載の化合物をコードする核酸分子。
【請求項15】
前記核酸はプロモーターと機能的に連結された、請求項14に記載の核酸分子を含むベクター。
【請求項16】
細胞にて請求項15のベクターがコードするポリペプチドを発現するステップ、および該ポリペプチドを精製するステップを含むものである、請求項12または13に記載の化合物の作製方法。
【請求項17】
前記化合物を固体支持体上で合成するステップを含むものである、請求項12または13に記載の化合物の作製方法。
【請求項18】
代謝障害を有する被験体を治療する方法であって、前記障害を治療するために十分な量の請求項1〜13のいずれか1項に記載の化合物を投与するステップを含むものである上記方法。
【請求項19】
前記十分な量がペプチドベクターとコンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストの同等の用量のために必要な量の50%未満である、請求項18に記載の方法。
【請求項20】
前記量が15%未満である、請求項19に記載の方法。
【請求項21】
前記代謝障害が糖尿病、肥満、肥満の結果としての糖尿病、高血糖、異脂肪血症、高トリグリセリド血症、症候X、インスリン抵抗性、障害性グルコース抵抗性(IGT)、糖尿病異脂肪血症、高脂血症、心血管の疾患、または高血圧である、請求項18に記載の方法。
【請求項22】
前記障害が糖尿病である、請求項18に記載の方法。
【請求項23】
前記障害がII型糖尿病である、請求項22に記載の方法。
【請求項24】
前記障害が肥満である、請求項18に記載の方法。
【請求項25】
被験体の食物摂取を低減するか、または体重を低減する方法であって、請求項1〜13に記載の化合物を被験体に、食物摂取を低減するかまたは体重を低減するために十分な量で投与するステップを含むものである上記方法。
【請求項26】
前記被験体が過体重または肥満である、請求項25に記載の方法。
【請求項27】
前記被験体が過食症である、請求項25に記載の方法。
【請求項1】
式:A-X-B
[式中、
Aは配列番号1〜105および107〜114からなる群より選択されるいずれか1つの配列と少なくとも70%同一のアミノ酸配列、またはそれらの断片を含むペプチドベクターであり;
Xはリンカーであり;および
Bはレプチン、レプチン類似体、またはOB受容体アゴニストである]
で表わされる化合物。
【請求項2】
AはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つの配列と少なくとも70%同一のアミノ酸配列を有するポリペプチドである、請求項1に記載の化合物。
【請求項3】
前記配列同一性は少なくとも90%である、請求項2に記載の化合物。
【請求項4】
前記ポリペプチドはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つのアミノ酸配列を含む、請求項3に記載の化合物。
【請求項5】
前記ポリペプチドはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、およびAngiopep-2-cys(配列番号114)からなる群より選択されるいずれか1つのアミノ酸配列から成る、請求項4に記載の化合物。
【請求項6】
AはAngiopep-1(配列番号67)、Angiopep-2(配列番号97)、cys-Angiopep-2(配列番号113)、またはAngiopep-2-cys(配列番号114)を含む、請求項5に記載の化合物。
【請求項7】
Bは全長ヒトレプチン、成熟ヒトレプチン(図16の全長ヒトレプチンのアミノ酸22-167)、またはレプチン116-130である、請求項1に記載の化合物。
【請求項8】
Xは式:
【化1】

[式中、nは2〜15の整数であり;YはA上のチオールでありかつZはB上の一級アミンであるかまたはYはB上のチオールでありかつZはA上の一級アミンである]
で表わされる、請求項1〜7のいずれか1項に記載の化合物。
【請求項9】
nは3、6、または11である、請求項8に記載の化合物。
【請求項10】
構造:
【化2】

を有する化合物。
【請求項11】
前記レプチンまたはレプチン類似体は全長ヒトレプチン、成熟ヒトレプチン(全長ヒトレプチンのアミノ酸22-167)、またはレプチン116-130である、請求項10に記載の化合物。
【請求項12】
Xはペプチド結合である、請求項1に記載の化合物。
【請求項13】
Xは少なくとも1つのアミノ酸であり;そしてAとBはそれぞれペプチド結合によりXと共有結合されている、請求項1〜9のいずれか1項に記載の化合物。
【請求項14】
請求項12または13に記載の化合物をコードする核酸分子。
【請求項15】
前記核酸はプロモーターと機能的に連結された、請求項14に記載の核酸分子を含むベクター。
【請求項16】
細胞にて請求項15のベクターがコードするポリペプチドを発現するステップ、および該ポリペプチドを精製するステップを含むものである、請求項12または13に記載の化合物の作製方法。
【請求項17】
前記化合物を固体支持体上で合成するステップを含むものである、請求項12または13に記載の化合物の作製方法。
【請求項18】
代謝障害を有する被験体を治療する方法であって、前記障害を治療するために十分な量の請求項1〜13のいずれか1項に記載の化合物を投与するステップを含むものである上記方法。
【請求項19】
前記十分な量がペプチドベクターとコンジュゲートしないレプチン、レプチン類似体、またはOB受容体アゴニストの同等の用量のために必要な量の50%未満である、請求項18に記載の方法。
【請求項20】
前記量が15%未満である、請求項19に記載の方法。
【請求項21】
前記代謝障害が糖尿病、肥満、肥満の結果としての糖尿病、高血糖、異脂肪血症、高トリグリセリド血症、症候X、インスリン抵抗性、障害性グルコース抵抗性(IGT)、糖尿病異脂肪血症、高脂血症、心血管の疾患、または高血圧である、請求項18に記載の方法。
【請求項22】
前記障害が糖尿病である、請求項18に記載の方法。
【請求項23】
前記障害がII型糖尿病である、請求項22に記載の方法。
【請求項24】
前記障害が肥満である、請求項18に記載の方法。
【請求項25】
被験体の食物摂取を低減するか、または体重を低減する方法であって、請求項1〜13に記載の化合物を被験体に、食物摂取を低減するかまたは体重を低減するために十分な量で投与するステップを含むものである上記方法。
【請求項26】
前記被験体が過体重または肥満である、請求項25に記載の方法。
【請求項27】
前記被験体が過食症である、請求項25に記載の方法。
【図1A】


【図1B】


【図2】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17A】


【図17B】


【図18】


【図19】


【図20】


【図21】


【図22】




【図1B】


【図2】


【図3】


【図4A】


【図4B】


【図5A】


【図5B】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11A】


【図11B】


【図11C】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17A】


【図17B】


【図18】


【図19】


【図20】


【図21】


【図22】


【公表番号】特表2012−510797(P2012−510797A)
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願番号】特願2011−538810(P2011−538810)
【出願日】平成21年12月7日(2009.12.7)
【国際出願番号】PCT/CA2009/001780
【国際公開番号】WO2010/063123
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(511093410)アンジオケム インコーポレーテッド (9)
【Fターム(参考)】
【公表日】平成24年5月17日(2012.5.17)
【国際特許分類】
【出願日】平成21年12月7日(2009.12.7)
【国際出願番号】PCT/CA2009/001780
【国際公開番号】WO2010/063123
【国際公開日】平成22年6月10日(2010.6.10)
【出願人】(511093410)アンジオケム インコーポレーテッド (9)
【Fターム(参考)】
[ Back to top ]

