レボドパエステルプロドラッグを合成する方法
レボドパエステルプロドラッグ、その塩およびその合成中間体を合成する方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はレボドパエステルプロドラッグおよびその合成中間体を合成する方法に関する。
【背景技術】
【0002】
パーキンソン病は、1000人に一人が罹患する障害性進行性疾患で、通常50歳を越えた人に発症する。パーキンソン病に罹患した患者では、黒質の変性に起因する黒質線条体路の崩壊の結果、脳内神経伝達物質ドーパミンの欠乏が見られる。ドーパミンの直近の前駆体であるレボドパ(L-ドーパまたはL-3,4-ジヒドロキシフェニルアラニン)は、この疾患の治療で最も一般的な処方薬である。
【化1】

【0003】
経口投与後、レボドパは、上部小腸に存在するアミノ酸トランスポーターを介して速やかに吸収される。このトランスポーターシステムの局所的分布のため、レボドパを吸収できる窓口は限られており、吸収量は薬剤が上部消化管を通り過ぎる速度に依存し得る。
【0004】
レボドパの腸代謝は、薬剤の初回通過損失の主な原因となる。レボドパの投薬量の約35%が、患者の経口投与後に完全なレボドパとして体循環に到達する(Sasahara, J. Pharm. Sci 1990, 69, 261)。一度吸収されると、レボドパは、芳香族L-アミノ酸デカルボキシラーゼ(AADC)酵素によって末梢組織(例えば、腸および肝臓)内で速やかにドーパミンに代謝される。したがって、レボドパは、通常、カルビドパまたはベンセラジドのようなデカルボキシラーゼ酵素阻害剤と共投与される。カルビドパと共に投与された場合、完全なレボドパの血漿濃度が上昇し、より多くのレボドパが利用可能となり、レボドパがドーパミンに変換される中枢神経系中に輸送される。カルビドパおよびベンセラジドは、ほとんど血液脳関門を横断しないため、脳内ではレボドパからドーパミンへの必要な変換を阻害しない。
【0005】
レボドパの薬理動態を改善するためレボドパのプロドラッグの使用が、提唱されている。小腸及び大腸の両方で吸収されるように設計されたレボドパプロドラッグおよびそのようなプロドラッグの合成方法がXiangらの米国特許第7,323,585号、米国特許出願公開第2008/0103200号、米国特許第7,342,131号、米国特許第7,534,813号、米国特許第7,563,821号、米国特許出願公開第2008/0171789号および米国特許出願公開第2008/0214663号に記載されている(それぞれ参照によりその全てが本願に組み込まれる)。これらのレボドパプロドラッグは、経口投与したときのレボドパの経口バイオアベイラビリティよりも、モル当量基準で少なくとも2倍大きいレボドパの経口バイオアベイラビリティを達成できる。さらに具体的には、Xiangらの米国特許第7,342,131号には、アモルファスまたは結晶性形態の化合物(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩酸塩(Xiangらの実施例8を参照されたい)が開示され、Xiangらの米国特許第7,563,821号には、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホナート塩が開示されている。Xiangらによって記載されたプロドラッグは、患者に経口投与すると、持続放出製剤中に有効に取り込まれ、レボドパに対する持続的全身曝露を提供することができる。
【0006】
Xiangらの米国特許第7,144,877号には、Boc-保護されたL-ドーパをハロゲン化物と塩基(例えば、アルカリ金属重炭酸塩または炭酸塩)の存在下で反応させ、続いて、Boc保護基を酸性条件下で加水分解し、対応するアシルオキシアルキルL-ドーパプロドラッグを提供することによる、L-ドーパのアシルオキシアルキルプロドラッグの合成が記載されている。さらに、Xiangらの米国特許第7,144,877号には、Boc保護されたL-ドーパとアルコール中間体との通常のカップリング条件下でのカップリングを経由し、続いて、Boc保護基の除去によりL-ドーパプロドラッグを合成する別の経路も記載されている。Xiangらの米国特許出願公開第2008/0171789号および米国特許出願公開第2008/0214663号には、ジオール、ハロゲン化2-ヒドロキシエチルまたはジハロゲン化エチレンからのアシルオキシアルキルL-ドーパプロドラッグの合成が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第7,323,585号
【特許文献2】米国特許出願公開第2008/0103200号
【特許文献3】米国特許第7,342,131号
【特許文献4】米国特許第7,534,813号
【特許文献5】米国特許第7,563,821号
【特許文献6】米国特許出願公開第2008/0171789号
【特許文献7】米国特許出願公開第2008/0214663号
【特許文献8】米国特許第7,144,877号
【非特許文献】
【0008】
【非特許文献1】Sasahara, J. Pharm. Sci 1990, 69, 261
【発明の概要】
【発明が解決しようとする課題】
【0009】
合成的に着実であり、所望のレボドパプロドラッグを高収率かつ十分な純度で提供する、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよび(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の薬学的に許容できる塩を合成する別の方法が開示される。
【課題を解決するための手段】
【0010】
第1の態様において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを含む、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法が開示される。
【0011】
第2の態様において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと、アルコールと水との混合物中で、約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を合成する方法が開示される。
【0012】
第3の態様において、化合物3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩が開示される。
【0013】
当業者には理解されるように、添付の図面は例示する目的のみである。図面は本発明の範囲を限定する目的ではない。
【図面の簡単な説明】
【0014】
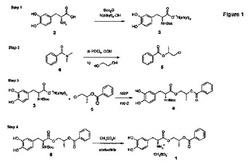
【図1】図1は(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよびXがハロゲンである合成中間体の合成ステップを示す。
【発明を実施するための形態】
【0015】
化合物、組成物および方法の特定の実施形態について詳細に記載する。開示された実施形態は特許請求の範囲を限定する目的ではない。逆に、特許請求の範囲は全ての他の手段、変更および同等物を含む目的である。
【0016】
本開示により提供される方法は(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1((2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメシラートとも呼ばれる)
【化2】

および(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の薬学的に許容できる塩を合成する方法を含む。
【0017】
特定の実施形態において、開示される(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法は、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを含む。
【0018】
特定の実施形態において、テトラアルキルアンモニウム塩はテトラメチルアンモニウム塩、テトラエチルアンモニウム塩、テトラプロピルアンモニウム塩およびテトラブチルアンモニウム塩から選択される。特定の実施形態において、テトラアルキルアンモニウム塩はテトラエチルアンモニウム塩であり、特定の実施形態において、テトラブチルアンモニウム塩である。
【0019】
特定の実施形態において、第1溶媒はN-メチル-2-ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、1,4-ジオキサンおよびこれらの混合物から選択される。
【0020】
特定の実施形態において、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートである。
【0021】
特定の実施形態において、第1溶媒はN-メチル-2-ピロリドンである。
【0022】
特定の実施形態において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-クロロ-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップは約70℃〜約80℃の範囲の温度で行われる。
【0023】
特定の実施形態において、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを酸と第2溶媒中で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供することを含む。
【0024】
特定の実施形態において、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供することを含む。
【0025】
特定の実施形態において、第2溶媒はアセトニトリル、アセトン、酢酸エチル、トルエン、イソプロパノール、ジクロロメタンおよびこれらの混合物から選択される。
【0026】
特定の実施形態において、第2溶媒はアセトニトリルおよびジクロロメタンから選択される。特定の実施形態において、第2溶媒はアセトニトリルである。
【0027】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップは約30℃〜約50℃の範囲の温度で行われる。
【0028】
特定の実施形態において、本方法は、さらに、第2溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成することを含む。
【0029】
特定の実施形態において、本方法は、さらに、結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを冷却した第2溶媒にシードする(seed、種晶として加える)ステップを含む。
【0030】
特定の実施形態おいて、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップを含む。
【0031】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの再結晶は、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを第3溶媒に溶解するステップ、第3溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップを含む。
【0032】
特定の実施形態において、第3溶媒はアセトニトリル、アセトン、酢酸エチル、水およびこれらの混合物から選択される。
【0033】
特定の実施形態において、第3溶媒はアセトニトリルおよび、アセトニトリルと水との混合物から選択される。
【0034】
特定の実施形態において、(1R)-2-ハロゲン-イソプロピルベンゾエートを調製するには、N,N-ジメチルベンズアミドをハロゲン化ホスホリルと第4溶媒中で反応させてジメチルベンズアミドビルスマイヤー塩を提供し、ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させて(1R)-2-ハロゲン-イソプロピルベンゾエートを提供する。
【0035】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートである。
【0036】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートであり、N,N-ジメチルベンズアミドをハロゲン化ホスホリルと反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップは約70℃〜約95℃の範囲の温度で行われる。
【0037】
特定の実施形態において、第4溶媒はジクロロメタンである。
【0038】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートであり、ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエートを提供するステップは約0℃〜約10℃の範囲の温度で行われる。
【0039】
特定の実施形態において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を調製するには、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させて3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供する。
【0040】
特定の実施形態において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップは、アルコールと水との混合物中で行われる。
【0041】
特定の実施形態において、アルコールと水との混合物は約0%b.v.〜約4%b.v.の水を含む。
【0042】
特定の実施形態において、アルコールはメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択される。
【0043】
特定の実施形態において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップは約30℃〜約50℃の範囲の温度で行われる。
【0044】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1および合成中間体の合成ステップは図1に示されている。
【0045】
第1反応ステップにおいて、Boc-L-ドーパテトラアルキルアンモニウム塩3(3-(3,4-ジヒドロキシフェニル-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩)は、L-ドーパ 2を二炭酸ジ-tert-ブチル(Boc-無水物、Boc2O)および水酸化テトラアルキルアンモニウムとアルコール/水混合物中で約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させることにより調製できる。アルコール/水混合物中の水の量は約0%b.v.〜約5%b.v.、約1%b.v.〜約4%b.v.、約1%b.v.〜約3%b.v.の範囲であることができ、特定の実施形態において、約2%b.v.である。特定の実施形態において、アルコールはメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択することができ、特定の実施形態において、アルコールはメタノールである。また、本反応は双極性非プロトン性溶媒、例えば、N-メチル-2-ピロリドン(NMP)、ジメチルホルムアミド(DMF)、ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)またはこれらの混合物中で行うことができる。特定の実施形態において、反応温度は約30℃〜約60℃、約35℃〜約55℃の範囲、特定の実施形態において、約40℃の温度であることができる。
【0046】
(1R)-2-クロロ-イソプロピルベンゾエート5はN,N-ジメチルベンズアミドをハロゲン化ホスホリル(例えば、塩化ホスホリル(オキシ塩化リンII、POCl3))と、有機溶媒(例えば、ジクロロメタン)中、不活性雰囲気下で反応させ、(クロロフェニルメチレン)ジメチルアミドクロリド塩(ビルスマイヤー塩)中間体を提供することにより調製することができ、その後、(R)-1,2-プロパンジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエート5を提供することができる。イミニウム中間体の形成は約65℃〜約105℃、約75℃〜約95℃の範囲、特定の実施形態において、約85℃の温度で行うことができる。ジオールカップリング反応は、約0℃〜約10℃の温度を保持しながら、ジオールを反応混合物に加えることにより行うことができ、その後、反応混合物を約15℃〜約35℃の範囲、特定の実施形態において、約25℃の温度に暖め、ビルスマイヤー塩中間体が消費されるまで反応させることができる。
【0047】
第3ステップにおいて、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩3を、不活性雰囲気下で、(1R)-2-クロロ-イソプロピルベンゾエート5と反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート6を提供することができる。
【0048】
この反応は双極性非プロトン性溶媒、例えば、N-メチル-2-ピロリドン(NMP)、ジメチルホルムアミド(DMF)、ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)、1,4-ジオキサンまたはこれらの混合物中で行うことができる。特定の実施形態において、溶媒はN-メチル-2-ピロリドン(NMP)である。反応温度は約50℃〜約120℃、約70℃〜約80℃の範囲、特定の実施形態において、約75℃の温度であることができる。
【0049】
第4ステップにおいて、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート6をメタンスルホン酸と反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を提供することができる。この反応はイソプロパノール、アセトニトリル、トルエン、ジクロロメタンおよびこれらの混合物から選択される溶媒中で行うことができる。特定の実施形態において、溶媒はアセトニトリルおよびジクロロメタンから選択される。この反応は約20℃〜約60℃、約30℃〜約50℃の範囲の温度で、特定の実施形態においては約40℃の温度で行うことができる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は結晶性固体、すなわち、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1として溶液から沈殿させることができる。
【0050】
適切な反応条件(例えば、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1の合成についてステップ4に記載されるような条件)を使用して、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の塩を調製できる。例えば、メタンスルホン酸を別の酸と置き換え、適切な溶媒を使用し、適切な温度で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供することができる。特定の実施形態において、酸は塩酸、硫酸、リン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸および4-トルエンスルホン酸から選択され、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートの薬学的に許容できる塩が製造される。
【0051】
「薬学的に許容できる」とは、連邦政府または州政府の規制当局によって認可されているまたは認可され得るということ、または、動物(より好ましくはヒト)に使用するための米国薬局方または一般に認められている薬局方に掲載されているということを意味する。「薬学的に許容される塩」とは、その親化合物の所望の薬理活性を有している化合物の塩を意味する。かかる塩は:(1)酸付加塩、無機酸、例えば、塩酸、臭化水素酸、硫酸、硝酸、リン酸等と共に形成されるか、;または有機酸、例えば酢酸、プロピオン酸、ヘキサン酸、シクロペンタンプロピオン酸、グリコール酸、ピルビン酸、乳酸、マロン酸、コハク酸、リンゴ酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、3-(4-ヒドロキシベンゾイル)安息香酸、ケイ皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、1,2-エタン-ジスルホン酸、2-ヒドロキシエタンスルホン酸、ベンゼンスルホン酸、4-クロロベンゼンスルホン酸、2-ナフタレンスルホン酸、4-トルエンスルホン酸、ショウノウスルホン酸、4-メチルビシクロ[2.2.2]-オクタ-2-エン-1-カルボン酸、グルコヘプタン酸、3-フェニルプロピオン酸、トリメチル酢酸、第三級ブチル酢酸、ラウリル硫酸、グルコン酸、グルタミン酸、ヒドロキシナフトエ酸、サリチル酸、ステアリン酸、ムコン酸等と共に形成される;あるいは(2)親化合物中に存在する酸性プロトンが金属イオン、例えば、アルカリ金属イオン、アルカリン土類金属イオンまたはアルミニウムイオンに置換されて形成される塩;または有機塩基、例えば、エタノールアミン、ジエタノールアミン、トリエタノールアミン、N-メチルグルカミン等による配位体を含む。特定の実施形態において、薬学的に許容できる塩は塩酸塩であり、特定の実施形態において、ナトリウム塩である。特定の実施形態において、薬学的に許容できる塩はメタンスルホン酸塩である。
【0052】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を再結晶するには、最初に、その化合物を、アセトニトリル、イソプロパノール、トルエン、水、およびこれらのいずれかと微量の水との混合物から選択される溶媒に溶解することができる。特定の実施形態において、溶媒はアセトニトリルおよびアセトニトリルと水との混合物から選択される。その後、溶液を濾過し、徐々に冷却して結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を沈殿させることができる。本明細書に開示される方法を使用して、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を約20%〜約25%の全収率、約95%純度よりも高い純度、約97%よりも高い純度、特定の実施形態において、約98%よりも高い純度で合成することができる。
【0053】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は数種の互変異性型で存在し得る。したがって、特に明記しない限り、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの全ての可能な互変異性型が含まれる。特に明記しない限り、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの、同位体で標識された全ての形態も含まれる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートに組み込まれ得る同位体の例は2H、3H、11C、13C、14C、15N、18O、および17Oを含むが、これらに限定されない。
【0054】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は結晶性である。特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートのCu-Kα放射線を使用するX線粉末回折図は、特徴的散乱角°2θを、少なくとも、4.7±0.2°、5.0±0.2°、8.5±0.2°、9.6±0.2°、13.6±0.2°、15.0±0.2°、17.0±0.2°、17.4±0.2°、17.7±0.2°、19.1±0.2°、19.5±0.2°、20.0±0.2°、20.4±0.2°、21.1±0.2°、22.3±0.2°、22.9±0.2°、23.1±0.2°、23.3±0.2°、24.3±0.2°、25.0±0.2°、25.3±0.2°、25.7±0.2°、25.8±0.2°、26.9±0.2°、27.3±0.2°、28.2±0.2°、30.1±0.2°、30.5±0.2°、32.0±0.2°、33.8±0.2°、34.3±0.2°、37.6±0.2°および38.4±0.2°で示す。特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートのCu-Kα放射線を使用するX線粉末回折図は特徴的散乱角°2θを、少なくとも、5.0±0.2°、8.5±0.2°、13.6±0.2°、15.0±0.2°、17.0±0.2°、17.7±0.2°、20.4±0.2°、21.1±0.2°、25.0±0.2°、25.8±0.2°、28.2±0.2°、30.1±0.2°および37.6±0.2°で示す。当業者には認識されるように、例えば、使用された個別の回折計、分析者およびサンプル調製技術に基づく、観測される°2θ回折角における僅かな変動を見込むことができる。相対ピーク強度にはより大きい変動が見込まれ得る。回折図の比較は、主として観測された°2θ回折角に基づき得、相対ピーク強度による重要性は低い。
【0055】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは約157℃〜約162℃の範囲の融点を示す。
【0056】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは約164.5℃で、特定の実施形態においては約164.5±2.5℃で吸熱ピークを有する示差走査熱量測定(DSC)サーモグラムにより特徴づけられる。
【0057】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは安定であり、例えば、製剤過程および/または貯蔵条件下で水分を吸収せず、かつ/または別の同型の形態へと変換されない。
【0058】
レボドパプロドラッグはドーパミンの前駆体である。したがって、本発明により提供される方法を使用して合成される(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは、親薬剤であるレボドパが治療上有効であることが現在知られているかまたは今後明らかとなるあらゆる疾患または病気に罹患している患者に投与することができる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは患者(例えば、ヒト)に投与して、疾患または病気(例えば、パーキンソン病)を治療することができる。本方法は、かかる治療を必要とする患者に、治療上有効な量の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを投与することを含む。本発明により提供される治療方法において、治療上有効な量の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは、パーキンソン病、鬱病、注意欠陥障害、統合失調症、躁鬱病、認識機能障害、下肢静止不能症候群、周期性四肢運動障害、遅発性ジスキネジー、ハンチントン病、トゥーレット症候群、高血圧、嗜癖障害、鬱血性心不全または日中過眠症のような疾患に罹患している患者に投与することができる。
【0059】
本明細書では、略語「b.v.」または「bv」は「容積で」を意味する。特に、2種以上の流体の混合物に関し、用語「%b.v.」は、全容積中の1つの流体のパーセンテージを示す。非限定的な例として、10%b.v.水である、メタノールと水との混合物は、10単位(容積)量の水および90単位(容積)量のメタノールからなる。
【実施例】
【0060】
以下の実施例には、本明細書に開示される方法を使用する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよび合成中間体の調製が詳細に記載されている。材料および方法の両方に対する多くの変更を本発明の範囲から逸脱することなく実施できることは当業者には明らかである。
【0061】
実施例1
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の合成
ステップ1:Boc-L-ドーパテトラブチルアンモニウム塩(3)
【化3】

【0062】
オーバーヘッド攪拌器、温度プローブ付きデジタル温度モニター、還流冷却器および窒素ラインを備えた10リットルのジャケット付きパイロットプラント反応容器に、L-ドーパ(2) 986g(5mol)を加え、続いて、二炭酸ジ-tert-ブチル無水物(Boc2O) 2,183g(10mol)とメタノール(MeOH)1Lを、窒素雰囲気下で加えた。得られた懸濁液を40℃に暖めた。水酸化テトラブチルアンモニウム溶液(メタノール中の1M溶液 1,000mL, 1mol)、水(36mL, 2mol)とメタノール(100mL)を、1.136Lずつ5回(合計TBA-OH 5mol、H2O 10mLとMeOH 500mL)、30分かけて加えた。5時間後、追加のBoc2O無水物273g(1.25mol)を加えた。反応混合物を40℃で21時間攪拌した。
【0063】
残っている微量の未反応L-ドーパを、濾過用の粗いガラスフリットを備えた気体分散チューブを使用し、20Lのロータリーエバポレーターフラスコへと真空濾過により、窒素下で濾別した。濾液を真空下で油へと濃縮した。この油を窒素下で酢酸エチル(EtOAc)(16.5L)で希釈した。乳状混合物を室温で40時間攪拌した。この間に、生成物は白色〜オフホワイトの固体として沈殿した。さらに、得られた混合物を、氷浴を使用して1時間冷却した。生成物を遠心分離により回収し、酢酸エチル(EtOAc)(500mL)で洗浄した。得られた白色固体を真空オーブン中、40℃で20時間乾燥させると、Boc-L-ドーパテトラブチルアンモニウム塩(3) 2479.2g(収率92.2%)が得られた。1H NMR(400MHz, CD3CN):δ 0.95(t,J =7.2Hz,12H), 1.33(m,8H), 1.42(s,9H), 1.57(m,8H), 2.88(m,2H), 3.05(m,8H), 3.93(m,1H), 5.40(d, J = 6.4 Hz, 1H), 6.33(dd,J=7.8, 1.6Hz, 1H), 6.47(d,J=8.0Hz,1H), 6.60(d,J= 2.0Hz, 1H)。
【0064】
ステップ2:(1R)-2-クロロ-イソプロピルベンゾエート(5)
【化4】

【0065】
10リットルのミニパイロットプラントにN,N-ジメチルベンズアミド(4) 3133g(21.04mol)を加え、続いて、オキシ塩化リン3,624g(23.7mol)を加えた。得られた懸濁液を窒素下で攪拌し、徐々に暖めた。反応物が暖められるにつれて、懸濁液は透明になった。温度が40℃に達すると発熱が起こり、数分で温度が83℃になった。反応物を83℃で攪拌した。
【0066】
中間体のビルスマイヤー塩の形成は、1H-NMR測定によると、85℃、15分で完了した。反応物をさらに1.5時間攪拌した。得られた透明の黄色溶液を別の10リットルのパイロットプラントに移し、0℃に冷却した後、ジクロロメタン(DCM)2リットルで希釈した。(R)-1,2-プロパンジオール2kg(26.3mol)を、温度を0℃〜10℃に保持しながら、反応混合物に2時間かけて徐々に加えた。
【0067】
ジオールの添加が完了した後、外部冷却を取り外し、反応混合物を室温に暖め、16時間攪拌した。
【0068】
反応混合物2Lを、2相を完全に混合するため、激しく攪拌しながら氷水2Lに加えた。その後、相を分離し、この手順を残りの反応混合物で繰り返した(全部で5回)。合わせた有機相を塩水(500mL)で洗浄し、無水硫酸ナトリウム(Na2SO4)で乾燥し、濃縮すると、暗いオレンジ色の油3,850gが得られた。この油をヘプタン(8L)に溶解し、有機相を水(2L)、続いて、塩水(3×500mL)で洗浄した。生成物を無水硫酸ナトリウム(Na2SO4)で乾燥し、濃縮すると、粗(1R)-2-クロロ-イソプロピルベンゾエート(5) 3,590gが暗い黄色〜オレンジ色の油として得られた。1H NMR(400MHz, CDCl3): δ 1.47(d,J=6.4Hz, 3H), 3.71(m, 2H), 5.35(m, 1H), 7.42(m, 2H), 7.54(t,J = 7.6Hz, 1H), 8.06(d,J= 7.2Hz, 2H)。
【0069】
ステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化5】

【0070】
Boc-L-ドーパテトラブチルアンモニウム塩(3)(2000g, 3.7mol)、N-メチルピロリドン(3700mL)およびステップ2から得られた未精製のクロロベンゾエート、(1R)-2-クロロ-イソプロピルベンゾエート(5)(1171g, 5.91mol)を10Lのミニパイロットプラントに加えた。得られた暗緑色のスラリーを100℃で18時間、窒素下で加熱すると、透明の暗黄色の溶液が得られた。
【0071】
18時間後、反応混合物の試料をメチルtert-ブチルエーテル(MTBE)で希釈し、水で3回抽出した。このワークアップにより、Boc-L-ドーパテトラブチルアンモニウム塩(3)が効果的に水相に抽出された。有機相を蒸発させ、反応の進行をCDCl3中の1H NMRを使用して測定した。
【0072】
冷却後、粗反応混合物を二等分し、それぞれの部分を別々にワークアップした。暗い反応混合物を、冷水(5L)を含む22Lの分液漏斗に移した。その後、この混合物をメチルtert-ブチルエーテル(MTBE, 3L)で抽出した。この手順を粗反応混合物のもう半分で繰り返した。両方のワークアップの有機相を合わせ、水(2L)、塩水(2L)で洗浄し、無水硫酸ナトリウム(Na2SO4)で乾燥させた。溶媒を蒸発させ、得られた油をヘプタンで2回(それぞれ2L)45℃の水浴中でトリチュレート(triturate)した。暖かいヘプタン相をデカンテーションした。さらに、得られた油を真空下で2時間乾燥すると、粗(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 1,500gが暗い油として得られた。1H NMR(CDCl3) δ 1.4(3h,d), 1.45(9h,s), 2.95(2H,d), 4.25(1H,t), 4.2-4.6(4H,m), 5.4(1H, br s), 6.42(2H,m), 6.7(1H,d), 7.43(2H,m), 7.6(1H,m), 8.03(2H,d); MS 482.19(M+Na)+, 458.14(M-H)-。
【0073】
ステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化6】

【0074】
ステップ3から得られた粗(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(1500g)をイソプロパノール(7,400mL)に溶解させた。メタンスルホン酸(376g, 3.9mol)を加えると、温度が49℃に上昇した。混合物を16時間、45℃で攪拌した。
【0075】
反応混合物を5ガロンのプラスチックバケツに移し、5℃で7時間冷却した。結晶化した材料を、バスケット遠心機を使用して濾過し、酢酸エチル(EtOAc)(約4L)で数回洗浄した。固体を真空下、50℃で18時間乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 723gが白色〜オフホワイの固体として得られた。純度:98.5% w/w;97.6% AUC。融点156-158℃。DSC:161.54℃で吸熱。1H NMR (400MHz, CD3OD): δ 1.40(d,J= 6.4Hz, 3H), 2.70(s,3H), 2.98(dd,J = 14.6, 7.8Hz, 1H), 3.10(dd,J = 14.4, 5.6Hz, 1H), 4.24(dd,J = 7.8, 5.8 Hz, 1H), 4.38(dd,J = 12.0, 6.8Hz, 1H), 4.52(dd,J = 311.8, 3.4 Hz, 1H), 5.40(dq,J= 6.4, 3.2Hz, 1H), 6.52(dd,J = 7.8, 2.2Hz, 1H), 6.69(m,2H), 7.48(m,2H), 7.60(m,1H), 8.01(m,2H)。
【0076】
実施例2
別のステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化7】

【0077】
Boc-ドーパTBA塩(3)(50g, 93mmol)、重炭酸塩で洗浄した(1R)-2-クロロイソプロピルベンゾエート(5)(20g, 100mmol)とN-メチルピロリジノン(NMP)(100mL)を250mLの丸底フラスコに加えた。混合物を窒素雰囲気下で攪拌し、オイルバス中、100℃で加熱した。約72時間後、反応物を室温に冷却し、tert-ブチルメチルエーテル(MTBE)(1L)で希釈し、脱イオン水で2回洗浄した(2Lの後、1L)。有機相を分離し、無水硫酸ナトリウム(Na2SO4)で乾燥し、濾過し、減圧下で濃縮すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 35g(76mmol)が黄褐色の粘性のある油として得られた。
【0078】
実施例3
別のステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化8】

【0079】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(35g, 76mmol)をアセトニトリル(CH3CN)(150mL)に溶解させた。混合物を水浴中、40℃で攪拌した後、メタンスルホン酸(7.3g, 4.93mL)を加えた。26℃で、反応物を(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 50mgでシード(seed)した後、さらに21℃に冷却すると粘度が高いスラリーが形成した。このものをアセトニトリル(CH3CN)(150mL)で希釈し、フリーザー中、-20℃で16時間冷却した。その後、沈殿物を濾過により回収し、酢酸エチル(EtOAc)(500mL)で洗浄した。オフホワイトの固体(19.3g, 42mmol)を真空下で乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 19.3g(42mmol)が得られた。1H NMR(DMSO-d6) δ1.30(3h, d), 2.29(3H, s), 2.90(2H, d), 4.25(1H, t), 4.31(1H, dd), 4.39(1H, dd), 5.25(1H, m), 6.41(1H, dd), 6.57(1H, d), 6.59(1H, d), 7.52(2H, m), 7.63(1H, m), 7.93(2H, m), 8.26(3H, br s), 8.85(1H, s), 8.89(1H, s);融点163〜164℃。純度(HPLC):96.1w/w%純度、95.0%純度(AUCによる)。
【0080】
実施例4
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の再結晶
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)(19.3g, 42mmol)をアセトニトリル(CH3CN)(400mL)中に懸濁し、水浴中、80℃で加熱した。その後、脱イオン水(4mL)を加えると、大部分が溶解した。溶液を、焼結ガラス漏斗を通して濾過し、未溶解の固体を除去した。溶液を攪拌し、15℃/時の速度で徐々に冷却した。約60℃で、溶液は結晶化し始めた。温度が21℃に達した際、固体を濾過により回収し、アセトニトリル(CH3CN)(100mL)とtert-ブチルメチルエーテル(MTBE)(100mL)で洗浄した。その後、固体を真空下で24時間乾燥すると、結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 14.7g(32.3mmol)がオフホワイトの固体として得られた。
【0081】
実施例5
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の合成
ステップ1:Boc-L-ドーパテトラブチルアンモニウム塩(3)
【化9】

【0082】
0.8部のメタノール(15kg)中のL-ドーパ(2)(19kg, 96mol)とBoc無水物(42.2kg, 193mol)を、380Lのガラスで裏打ちされた反応器に入れた。その後、反応器に、水(3.6kg, 0.19部)を含む1M水酸化テトラブチルアンモニウムメタノール溶液(80kg, 4.21部)を40℃で入れ、メタノール(4kg, 0.2部)ですすいだ(rinse forward)。混合物の温度を45℃〜最大で50℃に調節し、約5時間攪拌した。Boc無水物(5.3kg, 24mol, Boc2O)を入れ、メタノール(4kg, 0.2部)ですすいだ。反応を、2つの中間体の1つが存在しなくなるか、あるいはTLCによる測定でかすかになり、かつ、HPLCにより、多くても2%になるまでモニターした。濾過後、濾液を4容積部(76L)に濃縮し、残渣を酢酸エチル(EtOAc)(95kg, 15部)と一緒に、4容積部(76L)まで同時蒸発させた。温度を22℃(19〜25℃)に調節した後、酢酸エチル(EtOAc)(287kg, 15部)を入れ、得られた混合物を22℃(19〜25℃)で最短でも6時間攪拌し、3℃(0〜6℃)に冷却し、3℃(0〜6℃)で最短でも10時間攪拌した。生成物を濾過し、酢酸エチル(EtOAc)(19kg, 1部)で洗浄した。このウェットケーキ状のスラリーを、酢酸エチル(EtOAc)(95kg, 5部)中、22℃(19〜25℃)で最短でも6時間洗浄した。濾過し、酢酸エチル(EtOAc)(19kg, 1部)で洗浄後、生成物Boc-L-ドーパテトラブチルアンモニウム塩(3)を最大で55℃の温度で、LODが最大1%となるまで乾燥させた。LOD補正後の収率は40.6kg(78%)であり、純度は最小97A%であった。
【0083】
ステップ2:(1R)-2-クロロ-イソプロピルベンゾエート(5)
【化10】

【0084】
380Lのガラスで裏打ちされた反応器をジクロロメタンで調整して水分を除去した。ジメチルベンズアミド4(30kg, 201mol)とジクロロメタン(63kg, 2.1部)を反応器に入れ、40〜45℃に暖めた。オキシ塩化リン(34.5kg, 225mol, 1.15部)を、定量ポンプを使用し、還流を維持しながら約2時間かけて入れた。ラインおよびポンプをジクロロメタン(17kg, 0.55部)ですすいだ。混合物を還流下で約4時間攪拌した。温度を約5℃に調節した。(R)-1,2-プロパンジオール(19.2kg, 252mol, 0.64部)をドラム缶内でジクロロメタン(26kg, 0.85部)で希釈した。溶液を、2℃〜10℃(目標5℃)の温度を保持しながら、反応器に約5.4時間(最短4時間)かけて加えた。ポンプとラインをジクロロメタン(3kg, 0.1部)ですすいだ。反応器の温度を約80分(最短60分)かけて22℃に調節した。反応物を約11時間攪拌した。その後、反応混合物を、水(150kg, 5部)を含む760Lのガラスで裏打ちされた反応器に、発熱が止まるまで(約1時間)19℃〜40℃の温度を保持しながら移した。反応器の温度を22℃に調節し、中身をさらに約1時間攪拌した。相が分離した。水層をジクロロメタン(51kg, 1.7部)で逆抽出した。有機層を合わせ、重炭酸ナトリウム水溶液(水110kg, 3.65部と重炭酸ナトリウム5.7kg, 0.19部)で洗浄した。有機層(pH≧7)と水層(pH≧9)のpHを測定した後、相を分離した。硫酸ナトリウム(9kg, 0.3部)を有機層に加え、混合物を22℃で約60分間攪拌した。スラリーを濾過して硫酸ナトリウム(Na2SO4)(125L加圧ヌッチェ)を除去すると、最終貯蔵液(269kg, TDS11.3%, HPLC 91.3A%)が得られた。反応器と濾液をジクロロメタン(30kg, 1部)ですすいで、(1R)-2-クロロ-イソプロピルベンゾエート(5)(25.5kg, TDS1.5%, HPLC91.7A%)(収率70.9%)を含むすすぎ液(rinse solution)が得られた。
【0085】
ステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化11】

【0086】
380Lのガラスで裏打ちされた反応器をジクロロメタンで調整して水分を除去した。ステップ2から得られた(1R)-2-クロロ-イソプロピルベンゾエート(5)貯蔵液(205kg, TDS11.3%, 21.3kg, 107.2mol, 1.5当量)を反応器に入れ、蒸留が止まるまで最大でW/G温度50℃で濃縮した。その後、最大でW/G温度40℃で真空にし、濃縮を約1時間続けた。ジクロロメタン含有量1.6%が達成された。
【0087】
1-メチル-2-ピロリドン(NMP)(77.7kg, 2.0部)を反応器に入れ、温度を22℃に調節した。Boc-ドーパTBA(3)(38.7kg, 1.0部, 71.83mol)を反応器にハンドホールを介して入れ、続いて、リン酸水素二カリウム(12.4kg, 71.19mol, 0.32部, 1当量)を入れた。温度を100℃(97〜103℃)に調節し、HPLC測定により反応が完了するまで(20〜36時間)反応させた。反応が完了した後、温度を22℃(19〜25℃)に調節し、固体を濾別した(加圧ヌッチェ)。反応器と濾過器を1-メチル-2-ピロリドン(NMP)(39.2kg, 1.0部)ですすいだ。濾液とすすぎ液を1,900Lのガラスで裏打ちされた反応器に移し、有機物を3回洗浄して未反応出発原料を部分的に除去した。ヘプタン(126kg, 3.25部)を反応器に入れ、続いて、テトラヒドロフラン(9.7kg, 0.25部)を入れ、中身を22℃で約1時間攪拌した。層を約60分間かけて分離させた。
【0088】
1-メチル-2-ピロリドン(NMP)と(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)を含む下側の有機層を380Lのガラスで裏打ちされた反応器に移した。1,900Lの反応器中の残りの有機物を、約60分間の間、15分毎に約10秒間、反応器を揺り動かして有機物を含む全ての生成物を反応器壁から離し、その後、380Lの反応器へと流し出した。有機物を1,900Lの反応器に戻し、THF/ヘプタンで2回洗浄した。最後のTHF/ヘプタン洗浄後、有機層を1900Lの反応器に戻した。メチルtert-ブチルエーテル(MTBE)(39kg, 1部)を380Lの反応器に入れ、攪拌した。水(39kg, 1部)を380Lの反応器に加え、15分間攪拌した。380Lの反応器、ポンプおよびラインをすすいで1,900Lの反応器へ移した。メチルtert-ブチルエーテル(MTBE)(116kg, 3部)を1,900Lの反応器に加え、続いて、水(368kg, 9.5部)を最大で30℃の温度で加えた。水を加えると発熱した。温度を22℃(19〜25℃)に調節し、反応物を約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。
下側の水層を200Lポリエチレンドラム缶に30Lの分液漏斗を使用して移し、上側の有機層を380Lの反応器に移した。水層を1900Lの反応器に戻し、メチルtert-ブチルエーテル(MTBE)(77kg, 2部)を加えた。温度を22℃(19〜25℃)に調節し、混合物を約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。下側の水層を30Lの分液漏斗を使用して排出した。有機生成物を1,900Lの反応器に移し、1,900Lの反応器中のメチルtert-ブチルエーテル(MTBE)有機層と合わせた。380Lの反応器とポンプラインをメチルtert-ブチルエーテル(MTBE)約20kgですすいで1,900Lの反応器へ移した。水(271kg, 7.0部)中の重炭酸ナトリウム(21.3kg, 0.55部)溶液を、反応器の温度を30℃未満に保持しながら有機層に加えた。温度を22℃(19〜25℃)に調節し、約1時間穏やかに攪拌した。
【0089】
攪拌を止め、層を約60分かけて分離させた。目標pHパラメーターは、有機層についてはpH≧7であり、水層についての目標はpH≧9であった。水層をエマルションが目に見えるようになるまでドラム缶に流し出した。珪藻土(10kg)を反応器に加え、混合物を約15〜30分間攪拌した。混合物を、加圧ヌッチェを通して濾過し、濾液をきれいなポリエチレンドラム缶に流し出した。その後、濾液を1900Lの反応器に移した。水(77.4kg, 2部)を反応器に加え、約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。その後、水層をポリエチレンドラム缶に流し出した。硫酸ナトリウム(Na2SO4)(39.2kg, 1部)を加え、混合物を22℃で約60分間攪拌した。125L加圧ヌッチェを使用し、スラリーを濾過して硫酸ナトリウム(Na2SO4)を除去すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(メチルtert-ブチルエーテル(MTBE)貯蔵液214kg, TDS 12.4%, HPLC 51.4 A%, (2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 13.5kg)を含む溶液が得られた。反応器、ポンプラインと濾過器をMTBE(50kg, 2部)ですすぎ、別にドラム缶から出した(98.4kg, TDS 0.83%, HPLC 47.9A%, 0.39kg, 全部で(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 13.9kg, 収率42.4%。期待値35-65%)。
【0090】
ステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化12】

【0091】
ステップ3から得られた(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)の溶液を570Lのガラスで裏打ちされた反応器に加え、メチルtert-ブチルエーテル(MTBE)(312.4kg, 13.9kg)ですすいだ。中身を真空下、最大でW/G温度40℃で、蒸留が止まるまで濃縮した。アセトニトリル(CH3CN)(116kg, 3.0部)を反応器に入れ、蒸留が終わるまで真空蒸留を繰り返した。追加のアセトニトリル(CH3CN)(112kg, 2.9部)を反応器に入れ、温度を40℃(39〜41℃)に調節した。メタンスルホン酸(MeSO3H)(6.97kg, 0.18部)を、温度を40℃(35〜45℃)に保持しながら反応器に入れた。ポンプとラインをアセトニトリル(CH3CN)(3.9kg, 0.1部)ですすいだ。反応は高圧液体クロマトグラフィー(HPLC)による測定によると、40℃(35〜45℃)で、2時間(予想では2〜6時間)後に完了した。混合物の温度を22℃(19〜25℃)に調節し、32時間攪拌した。粗生成物を遠心分離により回収し、反応器、ラインと濾過ケーキをアセトニトリル(CH3CN)(38.7kg, 1部)ですすぎ、できるだけ乾燥するように回転させると、湿った濾過ケーキ(10.9kg)が得られた。湿った濾過ケーキの一部(8.0kg)を570Lのガラスで裏打ちされた反応器に移した。アセトニトリル(CH3CN)(278kg, 10部)を反応器に入れ、中身を攪拌し、温度を還流(80〜82℃)に調節した。水(2.8kg, 0.1部)を、温度を80〜82℃に保持しながら反応器に入れた。懸濁液は透明の溶液になった。混合物を80〜82℃で約30分間攪拌した。その後、溶液を6時間かけて22℃(19〜25℃)に冷却すると、60℃でスラリーが形成した。このスラリーを22℃(19〜25℃)でさらに2時間保持した。生成物(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)を遠心分離により回収し、反応器、ラインと濾過ケーキをメチルtert-ブチルエーテル(MTBE)で3回(それぞれ30kg)すすぎ、遠心乾燥させた。生成物を最大で55℃の温度で、LODが≦0.5%、アセトニトリルがガスクロマトグラフィー(GC)測定により≦400ppmとなるまで乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 5.4kgが得られた。
【0092】
最後に、本明細書に開示される実施形態を実施する別の方法が存在することに注目すべきである。したがって、本発明の上記実施形態は例示として考えられ、限定的ではない。さらに、特許請求の範囲は本明細書に記載された詳細に限定されるものではなく、その全範囲およびその同等物に及ぶ。
【技術分野】
【0001】
本発明はレボドパエステルプロドラッグおよびその合成中間体を合成する方法に関する。
【背景技術】
【0002】
パーキンソン病は、1000人に一人が罹患する障害性進行性疾患で、通常50歳を越えた人に発症する。パーキンソン病に罹患した患者では、黒質の変性に起因する黒質線条体路の崩壊の結果、脳内神経伝達物質ドーパミンの欠乏が見られる。ドーパミンの直近の前駆体であるレボドパ(L-ドーパまたはL-3,4-ジヒドロキシフェニルアラニン)は、この疾患の治療で最も一般的な処方薬である。
【化1】

【0003】
経口投与後、レボドパは、上部小腸に存在するアミノ酸トランスポーターを介して速やかに吸収される。このトランスポーターシステムの局所的分布のため、レボドパを吸収できる窓口は限られており、吸収量は薬剤が上部消化管を通り過ぎる速度に依存し得る。
【0004】
レボドパの腸代謝は、薬剤の初回通過損失の主な原因となる。レボドパの投薬量の約35%が、患者の経口投与後に完全なレボドパとして体循環に到達する(Sasahara, J. Pharm. Sci 1990, 69, 261)。一度吸収されると、レボドパは、芳香族L-アミノ酸デカルボキシラーゼ(AADC)酵素によって末梢組織(例えば、腸および肝臓)内で速やかにドーパミンに代謝される。したがって、レボドパは、通常、カルビドパまたはベンセラジドのようなデカルボキシラーゼ酵素阻害剤と共投与される。カルビドパと共に投与された場合、完全なレボドパの血漿濃度が上昇し、より多くのレボドパが利用可能となり、レボドパがドーパミンに変換される中枢神経系中に輸送される。カルビドパおよびベンセラジドは、ほとんど血液脳関門を横断しないため、脳内ではレボドパからドーパミンへの必要な変換を阻害しない。
【0005】
レボドパの薬理動態を改善するためレボドパのプロドラッグの使用が、提唱されている。小腸及び大腸の両方で吸収されるように設計されたレボドパプロドラッグおよびそのようなプロドラッグの合成方法がXiangらの米国特許第7,323,585号、米国特許出願公開第2008/0103200号、米国特許第7,342,131号、米国特許第7,534,813号、米国特許第7,563,821号、米国特許出願公開第2008/0171789号および米国特許出願公開第2008/0214663号に記載されている(それぞれ参照によりその全てが本願に組み込まれる)。これらのレボドパプロドラッグは、経口投与したときのレボドパの経口バイオアベイラビリティよりも、モル当量基準で少なくとも2倍大きいレボドパの経口バイオアベイラビリティを達成できる。さらに具体的には、Xiangらの米国特許第7,342,131号には、アモルファスまたは結晶性形態の化合物(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩酸塩(Xiangらの実施例8を参照されたい)が開示され、Xiangらの米国特許第7,563,821号には、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホナート塩が開示されている。Xiangらによって記載されたプロドラッグは、患者に経口投与すると、持続放出製剤中に有効に取り込まれ、レボドパに対する持続的全身曝露を提供することができる。
【0006】
Xiangらの米国特許第7,144,877号には、Boc-保護されたL-ドーパをハロゲン化物と塩基(例えば、アルカリ金属重炭酸塩または炭酸塩)の存在下で反応させ、続いて、Boc保護基を酸性条件下で加水分解し、対応するアシルオキシアルキルL-ドーパプロドラッグを提供することによる、L-ドーパのアシルオキシアルキルプロドラッグの合成が記載されている。さらに、Xiangらの米国特許第7,144,877号には、Boc保護されたL-ドーパとアルコール中間体との通常のカップリング条件下でのカップリングを経由し、続いて、Boc保護基の除去によりL-ドーパプロドラッグを合成する別の経路も記載されている。Xiangらの米国特許出願公開第2008/0171789号および米国特許出願公開第2008/0214663号には、ジオール、ハロゲン化2-ヒドロキシエチルまたはジハロゲン化エチレンからのアシルオキシアルキルL-ドーパプロドラッグの合成が開示されている。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】米国特許第7,323,585号
【特許文献2】米国特許出願公開第2008/0103200号
【特許文献3】米国特許第7,342,131号
【特許文献4】米国特許第7,534,813号
【特許文献5】米国特許第7,563,821号
【特許文献6】米国特許出願公開第2008/0171789号
【特許文献7】米国特許出願公開第2008/0214663号
【特許文献8】米国特許第7,144,877号
【非特許文献】
【0008】
【非特許文献1】Sasahara, J. Pharm. Sci 1990, 69, 261
【発明の概要】
【発明が解決しようとする課題】
【0009】
合成的に着実であり、所望のレボドパプロドラッグを高収率かつ十分な純度で提供する、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよび(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の薬学的に許容できる塩を合成する別の方法が開示される。
【課題を解決するための手段】
【0010】
第1の態様において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを含む、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法が開示される。
【0011】
第2の態様において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと、アルコールと水との混合物中で、約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を合成する方法が開示される。
【0012】
第3の態様において、化合物3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩が開示される。
【0013】
当業者には理解されるように、添付の図面は例示する目的のみである。図面は本発明の範囲を限定する目的ではない。
【図面の簡単な説明】
【0014】
【図1】図1は(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよびXがハロゲンである合成中間体の合成ステップを示す。
【発明を実施するための形態】
【0015】
化合物、組成物および方法の特定の実施形態について詳細に記載する。開示された実施形態は特許請求の範囲を限定する目的ではない。逆に、特許請求の範囲は全ての他の手段、変更および同等物を含む目的である。
【0016】
本開示により提供される方法は(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1((2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメシラートとも呼ばれる)
【化2】

および(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の薬学的に許容できる塩を合成する方法を含む。
【0017】
特定の実施形態において、開示される(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法は、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを含む。
【0018】
特定の実施形態において、テトラアルキルアンモニウム塩はテトラメチルアンモニウム塩、テトラエチルアンモニウム塩、テトラプロピルアンモニウム塩およびテトラブチルアンモニウム塩から選択される。特定の実施形態において、テトラアルキルアンモニウム塩はテトラエチルアンモニウム塩であり、特定の実施形態において、テトラブチルアンモニウム塩である。
【0019】
特定の実施形態において、第1溶媒はN-メチル-2-ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、1,4-ジオキサンおよびこれらの混合物から選択される。
【0020】
特定の実施形態において、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートである。
【0021】
特定の実施形態において、第1溶媒はN-メチル-2-ピロリドンである。
【0022】
特定の実施形態において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-クロロ-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップは約70℃〜約80℃の範囲の温度で行われる。
【0023】
特定の実施形態において、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを酸と第2溶媒中で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供することを含む。
【0024】
特定の実施形態において、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供することを含む。
【0025】
特定の実施形態において、第2溶媒はアセトニトリル、アセトン、酢酸エチル、トルエン、イソプロパノール、ジクロロメタンおよびこれらの混合物から選択される。
【0026】
特定の実施形態において、第2溶媒はアセトニトリルおよびジクロロメタンから選択される。特定の実施形態において、第2溶媒はアセトニトリルである。
【0027】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップは約30℃〜約50℃の範囲の温度で行われる。
【0028】
特定の実施形態において、本方法は、さらに、第2溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成することを含む。
【0029】
特定の実施形態において、本方法は、さらに、結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを冷却した第2溶媒にシードする(seed、種晶として加える)ステップを含む。
【0030】
特定の実施形態おいて、本方法は、さらに、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップを含む。
【0031】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの再結晶は、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを第3溶媒に溶解するステップ、第3溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップを含む。
【0032】
特定の実施形態において、第3溶媒はアセトニトリル、アセトン、酢酸エチル、水およびこれらの混合物から選択される。
【0033】
特定の実施形態において、第3溶媒はアセトニトリルおよび、アセトニトリルと水との混合物から選択される。
【0034】
特定の実施形態において、(1R)-2-ハロゲン-イソプロピルベンゾエートを調製するには、N,N-ジメチルベンズアミドをハロゲン化ホスホリルと第4溶媒中で反応させてジメチルベンズアミドビルスマイヤー塩を提供し、ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させて(1R)-2-ハロゲン-イソプロピルベンゾエートを提供する。
【0035】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートである。
【0036】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートであり、N,N-ジメチルベンズアミドをハロゲン化ホスホリルと反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップは約70℃〜約95℃の範囲の温度で行われる。
【0037】
特定の実施形態において、第4溶媒はジクロロメタンである。
【0038】
特定の実施形態において、ハロゲン化ホスホリルは塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートは(1R)-2-クロロ-イソプロピルベンゾエートであり、ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエートを提供するステップは約0℃〜約10℃の範囲の温度で行われる。
【0039】
特定の実施形態において、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を調製するには、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させて3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供する。
【0040】
特定の実施形態において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップは、アルコールと水との混合物中で行われる。
【0041】
特定の実施形態において、アルコールと水との混合物は約0%b.v.〜約4%b.v.の水を含む。
【0042】
特定の実施形態において、アルコールはメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択される。
【0043】
特定の実施形態において、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップは約30℃〜約50℃の範囲の温度で行われる。
【0044】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1および合成中間体の合成ステップは図1に示されている。
【0045】
第1反応ステップにおいて、Boc-L-ドーパテトラアルキルアンモニウム塩3(3-(3,4-ジヒドロキシフェニル-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩)は、L-ドーパ 2を二炭酸ジ-tert-ブチル(Boc-無水物、Boc2O)および水酸化テトラアルキルアンモニウムとアルコール/水混合物中で約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させることにより調製できる。アルコール/水混合物中の水の量は約0%b.v.〜約5%b.v.、約1%b.v.〜約4%b.v.、約1%b.v.〜約3%b.v.の範囲であることができ、特定の実施形態において、約2%b.v.である。特定の実施形態において、アルコールはメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択することができ、特定の実施形態において、アルコールはメタノールである。また、本反応は双極性非プロトン性溶媒、例えば、N-メチル-2-ピロリドン(NMP)、ジメチルホルムアミド(DMF)、ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)またはこれらの混合物中で行うことができる。特定の実施形態において、反応温度は約30℃〜約60℃、約35℃〜約55℃の範囲、特定の実施形態において、約40℃の温度であることができる。
【0046】
(1R)-2-クロロ-イソプロピルベンゾエート5はN,N-ジメチルベンズアミドをハロゲン化ホスホリル(例えば、塩化ホスホリル(オキシ塩化リンII、POCl3))と、有機溶媒(例えば、ジクロロメタン)中、不活性雰囲気下で反応させ、(クロロフェニルメチレン)ジメチルアミドクロリド塩(ビルスマイヤー塩)中間体を提供することにより調製することができ、その後、(R)-1,2-プロパンジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエート5を提供することができる。イミニウム中間体の形成は約65℃〜約105℃、約75℃〜約95℃の範囲、特定の実施形態において、約85℃の温度で行うことができる。ジオールカップリング反応は、約0℃〜約10℃の温度を保持しながら、ジオールを反応混合物に加えることにより行うことができ、その後、反応混合物を約15℃〜約35℃の範囲、特定の実施形態において、約25℃の温度に暖め、ビルスマイヤー塩中間体が消費されるまで反応させることができる。
【0047】
第3ステップにおいて、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩3を、不活性雰囲気下で、(1R)-2-クロロ-イソプロピルベンゾエート5と反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート6を提供することができる。
【0048】
この反応は双極性非プロトン性溶媒、例えば、N-メチル-2-ピロリドン(NMP)、ジメチルホルムアミド(DMF)、ジメチルアセトアミド(DMA)、ジメチルスルホキシド(DMSO)、1,4-ジオキサンまたはこれらの混合物中で行うことができる。特定の実施形態において、溶媒はN-メチル-2-ピロリドン(NMP)である。反応温度は約50℃〜約120℃、約70℃〜約80℃の範囲、特定の実施形態において、約75℃の温度であることができる。
【0049】
第4ステップにおいて、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート6をメタンスルホン酸と反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を提供することができる。この反応はイソプロパノール、アセトニトリル、トルエン、ジクロロメタンおよびこれらの混合物から選択される溶媒中で行うことができる。特定の実施形態において、溶媒はアセトニトリルおよびジクロロメタンから選択される。この反応は約20℃〜約60℃、約30℃〜約50℃の範囲の温度で、特定の実施形態においては約40℃の温度で行うことができる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は結晶性固体、すなわち、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1として溶液から沈殿させることができる。
【0050】
適切な反応条件(例えば、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1の合成についてステップ4に記載されるような条件)を使用して、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートのその他の塩を調製できる。例えば、メタンスルホン酸を別の酸と置き換え、適切な溶媒を使用し、適切な温度で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供することができる。特定の実施形態において、酸は塩酸、硫酸、リン酸、メタンスルホン酸、エタンスルホン酸、ベンゼンスルホン酸および4-トルエンスルホン酸から選択され、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートの薬学的に許容できる塩が製造される。
【0051】
「薬学的に許容できる」とは、連邦政府または州政府の規制当局によって認可されているまたは認可され得るということ、または、動物(より好ましくはヒト)に使用するための米国薬局方または一般に認められている薬局方に掲載されているということを意味する。「薬学的に許容される塩」とは、その親化合物の所望の薬理活性を有している化合物の塩を意味する。かかる塩は:(1)酸付加塩、無機酸、例えば、塩酸、臭化水素酸、硫酸、硝酸、リン酸等と共に形成されるか、;または有機酸、例えば酢酸、プロピオン酸、ヘキサン酸、シクロペンタンプロピオン酸、グリコール酸、ピルビン酸、乳酸、マロン酸、コハク酸、リンゴ酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、3-(4-ヒドロキシベンゾイル)安息香酸、ケイ皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、1,2-エタン-ジスルホン酸、2-ヒドロキシエタンスルホン酸、ベンゼンスルホン酸、4-クロロベンゼンスルホン酸、2-ナフタレンスルホン酸、4-トルエンスルホン酸、ショウノウスルホン酸、4-メチルビシクロ[2.2.2]-オクタ-2-エン-1-カルボン酸、グルコヘプタン酸、3-フェニルプロピオン酸、トリメチル酢酸、第三級ブチル酢酸、ラウリル硫酸、グルコン酸、グルタミン酸、ヒドロキシナフトエ酸、サリチル酸、ステアリン酸、ムコン酸等と共に形成される;あるいは(2)親化合物中に存在する酸性プロトンが金属イオン、例えば、アルカリ金属イオン、アルカリン土類金属イオンまたはアルミニウムイオンに置換されて形成される塩;または有機塩基、例えば、エタノールアミン、ジエタノールアミン、トリエタノールアミン、N-メチルグルカミン等による配位体を含む。特定の実施形態において、薬学的に許容できる塩は塩酸塩であり、特定の実施形態において、ナトリウム塩である。特定の実施形態において、薬学的に許容できる塩はメタンスルホン酸塩である。
【0052】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を再結晶するには、最初に、その化合物を、アセトニトリル、イソプロパノール、トルエン、水、およびこれらのいずれかと微量の水との混合物から選択される溶媒に溶解することができる。特定の実施形態において、溶媒はアセトニトリルおよびアセトニトリルと水との混合物から選択される。その後、溶液を濾過し、徐々に冷却して結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を沈殿させることができる。本明細書に開示される方法を使用して、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1を約20%〜約25%の全収率、約95%純度よりも高い純度、約97%よりも高い純度、特定の実施形態において、約98%よりも高い純度で合成することができる。
【0053】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は数種の互変異性型で存在し得る。したがって、特に明記しない限り、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの全ての可能な互変異性型が含まれる。特に明記しない限り、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートの、同位体で標識された全ての形態も含まれる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートに組み込まれ得る同位体の例は2H、3H、11C、13C、14C、15N、18O、および17Oを含むが、これらに限定されない。
【0054】
特定の実施形態において、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート1は結晶性である。特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートのCu-Kα放射線を使用するX線粉末回折図は、特徴的散乱角°2θを、少なくとも、4.7±0.2°、5.0±0.2°、8.5±0.2°、9.6±0.2°、13.6±0.2°、15.0±0.2°、17.0±0.2°、17.4±0.2°、17.7±0.2°、19.1±0.2°、19.5±0.2°、20.0±0.2°、20.4±0.2°、21.1±0.2°、22.3±0.2°、22.9±0.2°、23.1±0.2°、23.3±0.2°、24.3±0.2°、25.0±0.2°、25.3±0.2°、25.7±0.2°、25.8±0.2°、26.9±0.2°、27.3±0.2°、28.2±0.2°、30.1±0.2°、30.5±0.2°、32.0±0.2°、33.8±0.2°、34.3±0.2°、37.6±0.2°および38.4±0.2°で示す。特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートのCu-Kα放射線を使用するX線粉末回折図は特徴的散乱角°2θを、少なくとも、5.0±0.2°、8.5±0.2°、13.6±0.2°、15.0±0.2°、17.0±0.2°、17.7±0.2°、20.4±0.2°、21.1±0.2°、25.0±0.2°、25.8±0.2°、28.2±0.2°、30.1±0.2°および37.6±0.2°で示す。当業者には認識されるように、例えば、使用された個別の回折計、分析者およびサンプル調製技術に基づく、観測される°2θ回折角における僅かな変動を見込むことができる。相対ピーク強度にはより大きい変動が見込まれ得る。回折図の比較は、主として観測された°2θ回折角に基づき得、相対ピーク強度による重要性は低い。
【0055】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは約157℃〜約162℃の範囲の融点を示す。
【0056】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは約164.5℃で、特定の実施形態においては約164.5±2.5℃で吸熱ピークを有する示差走査熱量測定(DSC)サーモグラムにより特徴づけられる。
【0057】
特定の実施形態において、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは安定であり、例えば、製剤過程および/または貯蔵条件下で水分を吸収せず、かつ/または別の同型の形態へと変換されない。
【0058】
レボドパプロドラッグはドーパミンの前駆体である。したがって、本発明により提供される方法を使用して合成される(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは、親薬剤であるレボドパが治療上有効であることが現在知られているかまたは今後明らかとなるあらゆる疾患または病気に罹患している患者に投与することができる。(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは患者(例えば、ヒト)に投与して、疾患または病気(例えば、パーキンソン病)を治療することができる。本方法は、かかる治療を必要とする患者に、治療上有効な量の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを投与することを含む。本発明により提供される治療方法において、治療上有効な量の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートは、パーキンソン病、鬱病、注意欠陥障害、統合失調症、躁鬱病、認識機能障害、下肢静止不能症候群、周期性四肢運動障害、遅発性ジスキネジー、ハンチントン病、トゥーレット症候群、高血圧、嗜癖障害、鬱血性心不全または日中過眠症のような疾患に罹患している患者に投与することができる。
【0059】
本明細書では、略語「b.v.」または「bv」は「容積で」を意味する。特に、2種以上の流体の混合物に関し、用語「%b.v.」は、全容積中の1つの流体のパーセンテージを示す。非限定的な例として、10%b.v.水である、メタノールと水との混合物は、10単位(容積)量の水および90単位(容積)量のメタノールからなる。
【実施例】
【0060】
以下の実施例には、本明細書に開示される方法を使用する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートおよび合成中間体の調製が詳細に記載されている。材料および方法の両方に対する多くの変更を本発明の範囲から逸脱することなく実施できることは当業者には明らかである。
【0061】
実施例1
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の合成
ステップ1:Boc-L-ドーパテトラブチルアンモニウム塩(3)
【化3】

【0062】
オーバーヘッド攪拌器、温度プローブ付きデジタル温度モニター、還流冷却器および窒素ラインを備えた10リットルのジャケット付きパイロットプラント反応容器に、L-ドーパ(2) 986g(5mol)を加え、続いて、二炭酸ジ-tert-ブチル無水物(Boc2O) 2,183g(10mol)とメタノール(MeOH)1Lを、窒素雰囲気下で加えた。得られた懸濁液を40℃に暖めた。水酸化テトラブチルアンモニウム溶液(メタノール中の1M溶液 1,000mL, 1mol)、水(36mL, 2mol)とメタノール(100mL)を、1.136Lずつ5回(合計TBA-OH 5mol、H2O 10mLとMeOH 500mL)、30分かけて加えた。5時間後、追加のBoc2O無水物273g(1.25mol)を加えた。反応混合物を40℃で21時間攪拌した。
【0063】
残っている微量の未反応L-ドーパを、濾過用の粗いガラスフリットを備えた気体分散チューブを使用し、20Lのロータリーエバポレーターフラスコへと真空濾過により、窒素下で濾別した。濾液を真空下で油へと濃縮した。この油を窒素下で酢酸エチル(EtOAc)(16.5L)で希釈した。乳状混合物を室温で40時間攪拌した。この間に、生成物は白色〜オフホワイトの固体として沈殿した。さらに、得られた混合物を、氷浴を使用して1時間冷却した。生成物を遠心分離により回収し、酢酸エチル(EtOAc)(500mL)で洗浄した。得られた白色固体を真空オーブン中、40℃で20時間乾燥させると、Boc-L-ドーパテトラブチルアンモニウム塩(3) 2479.2g(収率92.2%)が得られた。1H NMR(400MHz, CD3CN):δ 0.95(t,J =7.2Hz,12H), 1.33(m,8H), 1.42(s,9H), 1.57(m,8H), 2.88(m,2H), 3.05(m,8H), 3.93(m,1H), 5.40(d, J = 6.4 Hz, 1H), 6.33(dd,J=7.8, 1.6Hz, 1H), 6.47(d,J=8.0Hz,1H), 6.60(d,J= 2.0Hz, 1H)。
【0064】
ステップ2:(1R)-2-クロロ-イソプロピルベンゾエート(5)
【化4】

【0065】
10リットルのミニパイロットプラントにN,N-ジメチルベンズアミド(4) 3133g(21.04mol)を加え、続いて、オキシ塩化リン3,624g(23.7mol)を加えた。得られた懸濁液を窒素下で攪拌し、徐々に暖めた。反応物が暖められるにつれて、懸濁液は透明になった。温度が40℃に達すると発熱が起こり、数分で温度が83℃になった。反応物を83℃で攪拌した。
【0066】
中間体のビルスマイヤー塩の形成は、1H-NMR測定によると、85℃、15分で完了した。反応物をさらに1.5時間攪拌した。得られた透明の黄色溶液を別の10リットルのパイロットプラントに移し、0℃に冷却した後、ジクロロメタン(DCM)2リットルで希釈した。(R)-1,2-プロパンジオール2kg(26.3mol)を、温度を0℃〜10℃に保持しながら、反応混合物に2時間かけて徐々に加えた。
【0067】
ジオールの添加が完了した後、外部冷却を取り外し、反応混合物を室温に暖め、16時間攪拌した。
【0068】
反応混合物2Lを、2相を完全に混合するため、激しく攪拌しながら氷水2Lに加えた。その後、相を分離し、この手順を残りの反応混合物で繰り返した(全部で5回)。合わせた有機相を塩水(500mL)で洗浄し、無水硫酸ナトリウム(Na2SO4)で乾燥し、濃縮すると、暗いオレンジ色の油3,850gが得られた。この油をヘプタン(8L)に溶解し、有機相を水(2L)、続いて、塩水(3×500mL)で洗浄した。生成物を無水硫酸ナトリウム(Na2SO4)で乾燥し、濃縮すると、粗(1R)-2-クロロ-イソプロピルベンゾエート(5) 3,590gが暗い黄色〜オレンジ色の油として得られた。1H NMR(400MHz, CDCl3): δ 1.47(d,J=6.4Hz, 3H), 3.71(m, 2H), 5.35(m, 1H), 7.42(m, 2H), 7.54(t,J = 7.6Hz, 1H), 8.06(d,J= 7.2Hz, 2H)。
【0069】
ステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化5】

【0070】
Boc-L-ドーパテトラブチルアンモニウム塩(3)(2000g, 3.7mol)、N-メチルピロリドン(3700mL)およびステップ2から得られた未精製のクロロベンゾエート、(1R)-2-クロロ-イソプロピルベンゾエート(5)(1171g, 5.91mol)を10Lのミニパイロットプラントに加えた。得られた暗緑色のスラリーを100℃で18時間、窒素下で加熱すると、透明の暗黄色の溶液が得られた。
【0071】
18時間後、反応混合物の試料をメチルtert-ブチルエーテル(MTBE)で希釈し、水で3回抽出した。このワークアップにより、Boc-L-ドーパテトラブチルアンモニウム塩(3)が効果的に水相に抽出された。有機相を蒸発させ、反応の進行をCDCl3中の1H NMRを使用して測定した。
【0072】
冷却後、粗反応混合物を二等分し、それぞれの部分を別々にワークアップした。暗い反応混合物を、冷水(5L)を含む22Lの分液漏斗に移した。その後、この混合物をメチルtert-ブチルエーテル(MTBE, 3L)で抽出した。この手順を粗反応混合物のもう半分で繰り返した。両方のワークアップの有機相を合わせ、水(2L)、塩水(2L)で洗浄し、無水硫酸ナトリウム(Na2SO4)で乾燥させた。溶媒を蒸発させ、得られた油をヘプタンで2回(それぞれ2L)45℃の水浴中でトリチュレート(triturate)した。暖かいヘプタン相をデカンテーションした。さらに、得られた油を真空下で2時間乾燥すると、粗(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 1,500gが暗い油として得られた。1H NMR(CDCl3) δ 1.4(3h,d), 1.45(9h,s), 2.95(2H,d), 4.25(1H,t), 4.2-4.6(4H,m), 5.4(1H, br s), 6.42(2H,m), 6.7(1H,d), 7.43(2H,m), 7.6(1H,m), 8.03(2H,d); MS 482.19(M+Na)+, 458.14(M-H)-。
【0073】
ステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化6】

【0074】
ステップ3から得られた粗(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(1500g)をイソプロパノール(7,400mL)に溶解させた。メタンスルホン酸(376g, 3.9mol)を加えると、温度が49℃に上昇した。混合物を16時間、45℃で攪拌した。
【0075】
反応混合物を5ガロンのプラスチックバケツに移し、5℃で7時間冷却した。結晶化した材料を、バスケット遠心機を使用して濾過し、酢酸エチル(EtOAc)(約4L)で数回洗浄した。固体を真空下、50℃で18時間乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 723gが白色〜オフホワイの固体として得られた。純度:98.5% w/w;97.6% AUC。融点156-158℃。DSC:161.54℃で吸熱。1H NMR (400MHz, CD3OD): δ 1.40(d,J= 6.4Hz, 3H), 2.70(s,3H), 2.98(dd,J = 14.6, 7.8Hz, 1H), 3.10(dd,J = 14.4, 5.6Hz, 1H), 4.24(dd,J = 7.8, 5.8 Hz, 1H), 4.38(dd,J = 12.0, 6.8Hz, 1H), 4.52(dd,J = 311.8, 3.4 Hz, 1H), 5.40(dq,J= 6.4, 3.2Hz, 1H), 6.52(dd,J = 7.8, 2.2Hz, 1H), 6.69(m,2H), 7.48(m,2H), 7.60(m,1H), 8.01(m,2H)。
【0076】
実施例2
別のステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化7】

【0077】
Boc-ドーパTBA塩(3)(50g, 93mmol)、重炭酸塩で洗浄した(1R)-2-クロロイソプロピルベンゾエート(5)(20g, 100mmol)とN-メチルピロリジノン(NMP)(100mL)を250mLの丸底フラスコに加えた。混合物を窒素雰囲気下で攪拌し、オイルバス中、100℃で加熱した。約72時間後、反応物を室温に冷却し、tert-ブチルメチルエーテル(MTBE)(1L)で希釈し、脱イオン水で2回洗浄した(2Lの後、1L)。有機相を分離し、無水硫酸ナトリウム(Na2SO4)で乾燥し、濾過し、減圧下で濃縮すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 35g(76mmol)が黄褐色の粘性のある油として得られた。
【0078】
実施例3
別のステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化8】

【0079】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(35g, 76mmol)をアセトニトリル(CH3CN)(150mL)に溶解させた。混合物を水浴中、40℃で攪拌した後、メタンスルホン酸(7.3g, 4.93mL)を加えた。26℃で、反応物を(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 50mgでシード(seed)した後、さらに21℃に冷却すると粘度が高いスラリーが形成した。このものをアセトニトリル(CH3CN)(150mL)で希釈し、フリーザー中、-20℃で16時間冷却した。その後、沈殿物を濾過により回収し、酢酸エチル(EtOAc)(500mL)で洗浄した。オフホワイトの固体(19.3g, 42mmol)を真空下で乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 19.3g(42mmol)が得られた。1H NMR(DMSO-d6) δ1.30(3h, d), 2.29(3H, s), 2.90(2H, d), 4.25(1H, t), 4.31(1H, dd), 4.39(1H, dd), 5.25(1H, m), 6.41(1H, dd), 6.57(1H, d), 6.59(1H, d), 7.52(2H, m), 7.63(1H, m), 7.93(2H, m), 8.26(3H, br s), 8.85(1H, s), 8.89(1H, s);融点163〜164℃。純度(HPLC):96.1w/w%純度、95.0%純度(AUCによる)。
【0080】
実施例4
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の再結晶
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)(19.3g, 42mmol)をアセトニトリル(CH3CN)(400mL)中に懸濁し、水浴中、80℃で加熱した。その後、脱イオン水(4mL)を加えると、大部分が溶解した。溶液を、焼結ガラス漏斗を通して濾過し、未溶解の固体を除去した。溶液を攪拌し、15℃/時の速度で徐々に冷却した。約60℃で、溶液は結晶化し始めた。温度が21℃に達した際、固体を濾過により回収し、アセトニトリル(CH3CN)(100mL)とtert-ブチルメチルエーテル(MTBE)(100mL)で洗浄した。その後、固体を真空下で24時間乾燥すると、結晶の(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 14.7g(32.3mmol)がオフホワイトの固体として得られた。
【0081】
実施例5
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)の合成
ステップ1:Boc-L-ドーパテトラブチルアンモニウム塩(3)
【化9】

【0082】
0.8部のメタノール(15kg)中のL-ドーパ(2)(19kg, 96mol)とBoc無水物(42.2kg, 193mol)を、380Lのガラスで裏打ちされた反応器に入れた。その後、反応器に、水(3.6kg, 0.19部)を含む1M水酸化テトラブチルアンモニウムメタノール溶液(80kg, 4.21部)を40℃で入れ、メタノール(4kg, 0.2部)ですすいだ(rinse forward)。混合物の温度を45℃〜最大で50℃に調節し、約5時間攪拌した。Boc無水物(5.3kg, 24mol, Boc2O)を入れ、メタノール(4kg, 0.2部)ですすいだ。反応を、2つの中間体の1つが存在しなくなるか、あるいはTLCによる測定でかすかになり、かつ、HPLCにより、多くても2%になるまでモニターした。濾過後、濾液を4容積部(76L)に濃縮し、残渣を酢酸エチル(EtOAc)(95kg, 15部)と一緒に、4容積部(76L)まで同時蒸発させた。温度を22℃(19〜25℃)に調節した後、酢酸エチル(EtOAc)(287kg, 15部)を入れ、得られた混合物を22℃(19〜25℃)で最短でも6時間攪拌し、3℃(0〜6℃)に冷却し、3℃(0〜6℃)で最短でも10時間攪拌した。生成物を濾過し、酢酸エチル(EtOAc)(19kg, 1部)で洗浄した。このウェットケーキ状のスラリーを、酢酸エチル(EtOAc)(95kg, 5部)中、22℃(19〜25℃)で最短でも6時間洗浄した。濾過し、酢酸エチル(EtOAc)(19kg, 1部)で洗浄後、生成物Boc-L-ドーパテトラブチルアンモニウム塩(3)を最大で55℃の温度で、LODが最大1%となるまで乾燥させた。LOD補正後の収率は40.6kg(78%)であり、純度は最小97A%であった。
【0083】
ステップ2:(1R)-2-クロロ-イソプロピルベンゾエート(5)
【化10】

【0084】
380Lのガラスで裏打ちされた反応器をジクロロメタンで調整して水分を除去した。ジメチルベンズアミド4(30kg, 201mol)とジクロロメタン(63kg, 2.1部)を反応器に入れ、40〜45℃に暖めた。オキシ塩化リン(34.5kg, 225mol, 1.15部)を、定量ポンプを使用し、還流を維持しながら約2時間かけて入れた。ラインおよびポンプをジクロロメタン(17kg, 0.55部)ですすいだ。混合物を還流下で約4時間攪拌した。温度を約5℃に調節した。(R)-1,2-プロパンジオール(19.2kg, 252mol, 0.64部)をドラム缶内でジクロロメタン(26kg, 0.85部)で希釈した。溶液を、2℃〜10℃(目標5℃)の温度を保持しながら、反応器に約5.4時間(最短4時間)かけて加えた。ポンプとラインをジクロロメタン(3kg, 0.1部)ですすいだ。反応器の温度を約80分(最短60分)かけて22℃に調節した。反応物を約11時間攪拌した。その後、反応混合物を、水(150kg, 5部)を含む760Lのガラスで裏打ちされた反応器に、発熱が止まるまで(約1時間)19℃〜40℃の温度を保持しながら移した。反応器の温度を22℃に調節し、中身をさらに約1時間攪拌した。相が分離した。水層をジクロロメタン(51kg, 1.7部)で逆抽出した。有機層を合わせ、重炭酸ナトリウム水溶液(水110kg, 3.65部と重炭酸ナトリウム5.7kg, 0.19部)で洗浄した。有機層(pH≧7)と水層(pH≧9)のpHを測定した後、相を分離した。硫酸ナトリウム(9kg, 0.3部)を有機層に加え、混合物を22℃で約60分間攪拌した。スラリーを濾過して硫酸ナトリウム(Na2SO4)(125L加圧ヌッチェ)を除去すると、最終貯蔵液(269kg, TDS11.3%, HPLC 91.3A%)が得られた。反応器と濾液をジクロロメタン(30kg, 1部)ですすいで、(1R)-2-クロロ-イソプロピルベンゾエート(5)(25.5kg, TDS1.5%, HPLC91.7A%)(収率70.9%)を含むすすぎ液(rinse solution)が得られた。
【0085】
ステップ3:(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)
【化11】

【0086】
380Lのガラスで裏打ちされた反応器をジクロロメタンで調整して水分を除去した。ステップ2から得られた(1R)-2-クロロ-イソプロピルベンゾエート(5)貯蔵液(205kg, TDS11.3%, 21.3kg, 107.2mol, 1.5当量)を反応器に入れ、蒸留が止まるまで最大でW/G温度50℃で濃縮した。その後、最大でW/G温度40℃で真空にし、濃縮を約1時間続けた。ジクロロメタン含有量1.6%が達成された。
【0087】
1-メチル-2-ピロリドン(NMP)(77.7kg, 2.0部)を反応器に入れ、温度を22℃に調節した。Boc-ドーパTBA(3)(38.7kg, 1.0部, 71.83mol)を反応器にハンドホールを介して入れ、続いて、リン酸水素二カリウム(12.4kg, 71.19mol, 0.32部, 1当量)を入れた。温度を100℃(97〜103℃)に調節し、HPLC測定により反応が完了するまで(20〜36時間)反応させた。反応が完了した後、温度を22℃(19〜25℃)に調節し、固体を濾別した(加圧ヌッチェ)。反応器と濾過器を1-メチル-2-ピロリドン(NMP)(39.2kg, 1.0部)ですすいだ。濾液とすすぎ液を1,900Lのガラスで裏打ちされた反応器に移し、有機物を3回洗浄して未反応出発原料を部分的に除去した。ヘプタン(126kg, 3.25部)を反応器に入れ、続いて、テトラヒドロフラン(9.7kg, 0.25部)を入れ、中身を22℃で約1時間攪拌した。層を約60分間かけて分離させた。
【0088】
1-メチル-2-ピロリドン(NMP)と(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)を含む下側の有機層を380Lのガラスで裏打ちされた反応器に移した。1,900Lの反応器中の残りの有機物を、約60分間の間、15分毎に約10秒間、反応器を揺り動かして有機物を含む全ての生成物を反応器壁から離し、その後、380Lの反応器へと流し出した。有機物を1,900Lの反応器に戻し、THF/ヘプタンで2回洗浄した。最後のTHF/ヘプタン洗浄後、有機層を1900Lの反応器に戻した。メチルtert-ブチルエーテル(MTBE)(39kg, 1部)を380Lの反応器に入れ、攪拌した。水(39kg, 1部)を380Lの反応器に加え、15分間攪拌した。380Lの反応器、ポンプおよびラインをすすいで1,900Lの反応器へ移した。メチルtert-ブチルエーテル(MTBE)(116kg, 3部)を1,900Lの反応器に加え、続いて、水(368kg, 9.5部)を最大で30℃の温度で加えた。水を加えると発熱した。温度を22℃(19〜25℃)に調節し、反応物を約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。
下側の水層を200Lポリエチレンドラム缶に30Lの分液漏斗を使用して移し、上側の有機層を380Lの反応器に移した。水層を1900Lの反応器に戻し、メチルtert-ブチルエーテル(MTBE)(77kg, 2部)を加えた。温度を22℃(19〜25℃)に調節し、混合物を約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。下側の水層を30Lの分液漏斗を使用して排出した。有機生成物を1,900Lの反応器に移し、1,900Lの反応器中のメチルtert-ブチルエーテル(MTBE)有機層と合わせた。380Lの反応器とポンプラインをメチルtert-ブチルエーテル(MTBE)約20kgですすいで1,900Lの反応器へ移した。水(271kg, 7.0部)中の重炭酸ナトリウム(21.3kg, 0.55部)溶液を、反応器の温度を30℃未満に保持しながら有機層に加えた。温度を22℃(19〜25℃)に調節し、約1時間穏やかに攪拌した。
【0089】
攪拌を止め、層を約60分かけて分離させた。目標pHパラメーターは、有機層についてはpH≧7であり、水層についての目標はpH≧9であった。水層をエマルションが目に見えるようになるまでドラム缶に流し出した。珪藻土(10kg)を反応器に加え、混合物を約15〜30分間攪拌した。混合物を、加圧ヌッチェを通して濾過し、濾液をきれいなポリエチレンドラム缶に流し出した。その後、濾液を1900Lの反応器に移した。水(77.4kg, 2部)を反応器に加え、約1時間穏やかに攪拌した。攪拌を止め、層を約60分かけて分離させた。その後、水層をポリエチレンドラム缶に流し出した。硫酸ナトリウム(Na2SO4)(39.2kg, 1部)を加え、混合物を22℃で約60分間攪拌した。125L加圧ヌッチェを使用し、スラリーを濾過して硫酸ナトリウム(Na2SO4)を除去すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)(メチルtert-ブチルエーテル(MTBE)貯蔵液214kg, TDS 12.4%, HPLC 51.4 A%, (2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 13.5kg)を含む溶液が得られた。反応器、ポンプラインと濾過器をMTBE(50kg, 2部)ですすぎ、別にドラム缶から出した(98.4kg, TDS 0.83%, HPLC 47.9A%, 0.39kg, 全部で(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6) 13.9kg, 収率42.4%。期待値35-65%)。
【0090】
ステップ4:(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)
【化12】

【0091】
ステップ3から得られた(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエート(6)の溶液を570Lのガラスで裏打ちされた反応器に加え、メチルtert-ブチルエーテル(MTBE)(312.4kg, 13.9kg)ですすいだ。中身を真空下、最大でW/G温度40℃で、蒸留が止まるまで濃縮した。アセトニトリル(CH3CN)(116kg, 3.0部)を反応器に入れ、蒸留が終わるまで真空蒸留を繰り返した。追加のアセトニトリル(CH3CN)(112kg, 2.9部)を反応器に入れ、温度を40℃(39〜41℃)に調節した。メタンスルホン酸(MeSO3H)(6.97kg, 0.18部)を、温度を40℃(35〜45℃)に保持しながら反応器に入れた。ポンプとラインをアセトニトリル(CH3CN)(3.9kg, 0.1部)ですすいだ。反応は高圧液体クロマトグラフィー(HPLC)による測定によると、40℃(35〜45℃)で、2時間(予想では2〜6時間)後に完了した。混合物の温度を22℃(19〜25℃)に調節し、32時間攪拌した。粗生成物を遠心分離により回収し、反応器、ラインと濾過ケーキをアセトニトリル(CH3CN)(38.7kg, 1部)ですすぎ、できるだけ乾燥するように回転させると、湿った濾過ケーキ(10.9kg)が得られた。湿った濾過ケーキの一部(8.0kg)を570Lのガラスで裏打ちされた反応器に移した。アセトニトリル(CH3CN)(278kg, 10部)を反応器に入れ、中身を攪拌し、温度を還流(80〜82℃)に調節した。水(2.8kg, 0.1部)を、温度を80〜82℃に保持しながら反応器に入れた。懸濁液は透明の溶液になった。混合物を80〜82℃で約30分間攪拌した。その後、溶液を6時間かけて22℃(19〜25℃)に冷却すると、60℃でスラリーが形成した。このスラリーを22℃(19〜25℃)でさらに2時間保持した。生成物(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1)を遠心分離により回収し、反応器、ラインと濾過ケーキをメチルtert-ブチルエーテル(MTBE)で3回(それぞれ30kg)すすぎ、遠心乾燥させた。生成物を最大で55℃の温度で、LODが≦0.5%、アセトニトリルがガスクロマトグラフィー(GC)測定により≦400ppmとなるまで乾燥すると、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネート(1) 5.4kgが得られた。
【0092】
最後に、本明細書に開示される実施形態を実施する別の方法が存在することに注目すべきである。したがって、本発明の上記実施形態は例示として考えられ、限定的ではない。さらに、特許請求の範囲は本明細書に記載された詳細に限定されるものではなく、その全範囲およびその同等物に及ぶ。
【特許請求の範囲】
【請求項1】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法であって、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供することを含む、前記方法。
【請求項2】
第1溶媒がN-メチル-2-ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、1,4-ジオキサンおよびこれらの混合物から選択される、請求項1に記載の方法。
【請求項3】
(1R)-2-ハロゲン-イソプロピルベンゾエートが(1R)-2-クロロ-イソプロピルベンゾエートである、請求項1に記載の方法。
【請求項4】
第1溶媒がN-メチル-2-ピロリドンである、請求項3に記載の方法。
【請求項5】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-クロロ-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを約70℃〜約80℃の範囲の温度で行う、請求項3に記載の方法。
【請求項6】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを酸と第2溶媒中で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供するステップを含む、請求項1に記載の方法。
【請求項7】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップを含む、請求項1に記載の方法。
【請求項8】
第2溶媒がアセトニトリル、アセトン、酢酸エチル、トルエン、イソプロパノール、ジクロロメタンおよびこれらの混合物から選択される、請求項7に記載の方法。
【請求項9】
第2溶媒がアセトニトリルおよびジクロロメタンから選択される、請求項8に記載の方法。
【請求項10】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップを約30℃〜約50℃の範囲の温度で行う、請求項7に記載の方法。
【請求項11】
第2溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップを含む、請求項7に記載の方法。
【請求項12】
結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを、冷却した第2溶媒にシードするステップを含む、請求項11に記載の方法。
【請求項13】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップを含む、請求項11に記載の方法。
【請求項14】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップが:
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを第3溶媒に溶解するステップ、
第3溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップ、
を含む、請求項13に記載の方法。
【請求項15】
第3溶媒がアセトニトリル、アセトン、酢酸エチル、水およびこれらの混合物から選択される、請求項14に記載の方法。
【請求項16】
第3溶媒がアセトニトリルおよび、アセトニトリルと水との混合物から選択される、請求項15に記載の方法。
【請求項17】
(1R)-2-ハロゲン-イソプロピルベンゾエートの調製が:
N,N-ジメチルベンズアミドをハロゲン化ホスホリルと第4溶媒中で反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップ、
ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-ハロゲン-イソプロピルベンゾエートを提供するステップを含む、請求項1に記載の方法。
【請求項18】
ハロゲン化ホスホリルが塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートが(1R)-2-クロロ-イソプロピルベンゾエートである、請求項17に記載の方法。
【請求項19】
N,N-ジメチルベンズアミドを塩化ホスホリルと反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップを約70℃〜約95℃の範囲の温度で行う、請求項18に記載の方法。
【請求項20】
第4溶媒がジクロロメタンである、請求項18に記載の方法。
【請求項21】
ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエートを提供するステップを約0℃〜約10℃の範囲の温度で行う、請求項18に記載の方法。
【請求項22】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩の調製が:
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、請求項1に記載の方法。
【請求項23】
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップをアルコールと水との混合物中で行う、請求項22に記載の方法。
【請求項24】
アルコールと水との混合物が約0%b.v.〜約4%b.v.の水を含む、請求項23に記載の方法。
【請求項25】
アルコールがメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択される、請求項23に記載の方法。
【請求項26】
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを約30℃〜約50℃の範囲の温度で行う、請求項22に記載の方法。
【請求項27】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を合成する方法であって、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと、アルコールと水との混合物中、約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、前記方法。
【請求項28】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩化合物。
【請求項1】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートを合成する方法であって、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-ハロゲン-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供することを含む、前記方法。
【請求項2】
第1溶媒がN-メチル-2-ピロリドン、ジメチルホルムアミド、ジメチルアセトアミド、ジメチルスルホキシド、1,4-ジオキサンおよびこれらの混合物から選択される、請求項1に記載の方法。
【請求項3】
(1R)-2-ハロゲン-イソプロピルベンゾエートが(1R)-2-クロロ-イソプロピルベンゾエートである、請求項1に記載の方法。
【請求項4】
第1溶媒がN-メチル-2-ピロリドンである、請求項3に記載の方法。
【請求項5】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を(1R)-2-クロロ-イソプロピルベンゾエートと第1溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを提供するステップを約70℃〜約80℃の範囲の温度で行う、請求項3に記載の方法。
【請求項6】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートを酸と第2溶媒中で反応させ、対応する(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエート塩を提供するステップを含む、請求項1に記載の方法。
【請求項7】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップを含む、請求項1に記載の方法。
【請求項8】
第2溶媒がアセトニトリル、アセトン、酢酸エチル、トルエン、イソプロパノール、ジクロロメタンおよびこれらの混合物から選択される、請求項7に記載の方法。
【請求項9】
第2溶媒がアセトニトリルおよびジクロロメタンから選択される、請求項8に記載の方法。
【請求項10】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-3-(3,4-ジヒドロキシフェニル)-2-[(tert-ブトキシ)カルボニルアミノ]プロパノエートをメタンスルホン酸と第2溶媒中で反応させ、(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを提供するステップを約30℃〜約50℃の範囲の温度で行う、請求項7に記載の方法。
【請求項11】
第2溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップを含む、請求項7に記載の方法。
【請求項12】
結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを、冷却した第2溶媒にシードするステップを含む、請求項11に記載の方法。
【請求項13】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップを含む、請求項11に記載の方法。
【請求項14】
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを再結晶するステップが:
(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを第3溶媒に溶解するステップ、
第3溶媒を冷却し、結晶性(2R)-2-フェニルカルボニルオキシプロピル(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパノエートメタンスルホネートを形成するステップ、
を含む、請求項13に記載の方法。
【請求項15】
第3溶媒がアセトニトリル、アセトン、酢酸エチル、水およびこれらの混合物から選択される、請求項14に記載の方法。
【請求項16】
第3溶媒がアセトニトリルおよび、アセトニトリルと水との混合物から選択される、請求項15に記載の方法。
【請求項17】
(1R)-2-ハロゲン-イソプロピルベンゾエートの調製が:
N,N-ジメチルベンズアミドをハロゲン化ホスホリルと第4溶媒中で反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップ、
ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-ハロゲン-イソプロピルベンゾエートを提供するステップを含む、請求項1に記載の方法。
【請求項18】
ハロゲン化ホスホリルが塩化ホスホリルであり、(1R)-2-ハロゲン-イソプロピルベンゾエートが(1R)-2-クロロ-イソプロピルベンゾエートである、請求項17に記載の方法。
【請求項19】
N,N-ジメチルベンズアミドを塩化ホスホリルと反応させ、ジメチルベンズアミドビルスマイヤー塩を提供するステップを約70℃〜約95℃の範囲の温度で行う、請求項18に記載の方法。
【請求項20】
第4溶媒がジクロロメタンである、請求項18に記載の方法。
【請求項21】
ジメチルベンズアミドビルスマイヤー塩を(2R)-プロパン-1,2-ジオールと反応させ、(1R)-2-クロロ-イソプロピルベンゾエートを提供するステップを約0℃〜約10℃の範囲の温度で行う、請求項18に記載の方法。
【請求項22】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩の調製が:
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、請求項1に記載の方法。
【請求項23】
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップをアルコールと水との混合物中で行う、請求項22に記載の方法。
【請求項24】
アルコールと水との混合物が約0%b.v.〜約4%b.v.の水を含む、請求項23に記載の方法。
【請求項25】
アルコールがメタノール、エタノール、イソプロパノールおよびこれらの混合物から選択される、請求項23に記載の方法。
【請求項26】
(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルと反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを約30℃〜約50℃の範囲の温度で行う、請求項22に記載の方法。
【請求項27】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を合成する方法であって、(2S)-2-アミノ-3-(3,4-ジヒドロキシフェニル)プロパン酸を二炭酸ジ-tert-ブチルおよび水酸化テトラアルキルアンモニウムと、アルコールと水との混合物中、約20℃〜約60℃の範囲の温度で、不活性雰囲気下で反応させ、3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩を提供するステップを含む、前記方法。
【請求項28】
3-(3,4-ジヒドロキシフェニル)-(2S)-[(tert-ブトキシ)カルボニルアミノ]プロパノエートテトラアルキルアンモニウム塩化合物。
【図1】




【公表番号】特表2012−505885(P2012−505885A)
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願番号】特願2011−532096(P2011−532096)
【出願日】平成21年10月19日(2009.10.19)
【国際出願番号】PCT/US2009/005698
【国際公開番号】WO2010/047775
【国際公開日】平成22年4月29日(2010.4.29)
【出願人】(506400373)ゼノポート,インコーポレーテッド (8)
【Fターム(参考)】
【公表日】平成24年3月8日(2012.3.8)
【国際特許分類】
【出願日】平成21年10月19日(2009.10.19)
【国際出願番号】PCT/US2009/005698
【国際公開番号】WO2010/047775
【国際公開日】平成22年4月29日(2010.4.29)
【出願人】(506400373)ゼノポート,インコーポレーテッド (8)
【Fターム(参考)】
[ Back to top ]

