レポーター遺伝子構築物、アッセイキットおよび検出方法
【課題】 転写活性の変化を検出するための手段を提供する。
【解決手段】 環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物。
【解決手段】 環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物。
【発明の詳細な説明】
【技術分野】
【0001】
ここに開示される態様は、一般的に、レポーター遺伝子構築物、アッセイキットおよび検出方法に関する。
【背景技術】
【0002】
現在、疾患特異的ゲノム構造異常を標的とした疾患遺伝子が同定され、それにより、癌などの多くの疾患関連遺伝子が発見されている。これらは疾患の診断用バイオマーカーとして注目されている。バイオマーカーの発現は、疾患化の早期には必ずしも十分得ることが出来ないことから、バイオマーカーの検出による診断は、早期診断としては必ずしも適切ではない。
【0003】
早期診断は、治癒率の向上や患者の負担軽減の視点から不可欠である。一つのアプローチとして、ゲノムの修飾の異常と、それに伴うプロモーター活性の変化の検出により、疾患化の早期の変化を観察することが考えられる。
【0004】
プロモーター活性の変化は、遺伝子発現の確率を制御するものであり、疾患関連遺伝子および疾患関連タンパク質の発現よりも早期に観察される。
【0005】
細胞内の特定プロモーターの活性化状態を検出する方法には、レポーター遺伝子アッセイがある。レポーター遺伝子アッセイは、問題となるプロモーターの下流にプロモーターの活性を可視化するためのレポーター遺伝子、例えば、GFP、βガラクトシダーゼ、ルシフェラーゼ遺伝子などを接続して得たレポーター構築物を、被検細胞に導入し、発現されるレポータータンパク質の活性に基づいてプロモーターの活性化状態を定量化する方法である。レポーター遺伝子アッセイは、細胞のプロモーター活性を定量化する方法として、主に体外診断として使用されている。レポーター遺伝子アッセイを非侵襲な状態で、インビボで行うことも動物実験において試みられているが、これらの方法はいずれも光学的な検出方法である。そのため、体内の深部(概ね2cm以上)における発光および/または蛍光は減衰してしまう等の問題があり、体内の浅部等、適用範囲が限定されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002−238599号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本出願の課題は、電子スピン共鳴法を用いて転写活性の変化を検出するための新規な手段を提供することである。
【課題を解決するための手段】
【0008】
1つの態様に従うと、環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物が提供される。
【0009】
更なる態様に従うと、インビトロにおいて細胞の環境を測定する方法であって、
(1)前記レポーター遺伝子構築物を細胞に導入することと、
(2)前記細胞から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて前記細胞の環境を判定することと
を具備する方法が提供される。
【0010】
更なる態様に従うと、細胞を検出する方法であって、
(1)前記レポーター遺伝子構築物を細胞群に導入することと、
(2)前記細胞群から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて、フリーラジカルを生じた細胞を検出することと
を具備する方法が提供される。
【0011】
もう1つの態様に従うと、インビトロにおいて細胞の環境を測定する方法または細胞を検出する方法を行うためのアッセイキットであって、
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含み、細胞内で発現可能なレポーター遺伝子構築物と、
スピントラップ剤と、
を含むアッセイキットが提供される。
【図面の簡単な説明】
【0012】
【図1】1つの実施形態のベクターの1例であるpSV40−NOS2を示す図。
【図2】1つの実施形態のベクターの1例であるpXRE−SV40−NOS2を示す図。
【図3】1つの実施形態に従う例2の結果を示す図。
【図4】1つの実施形態である磁気共鳴測定装置の1例を示すブロック図。
【図5】1つの実施形態の超伝導フィルタのレイアウト例を示す図。
【図6】1つの実施形態の超伝導フィルタのレイアウト例を示す図。
【図7】1つの実施形態である電子スピン共鳴測定装置の例を示すブロック図。
【図8】1つの実施形態のNO・の発生を指標にした電子スピン共鳴法による細胞検出方法の手順を示すフローチャート。
【図9A】ベクターの例であるpCMV−iNOStrとpCMV−iNOS−Fを示す図。
【図9B】ベクターの例であるpCMV−iNOStrとpCMV−iNOS−Fを示す図。
【図10】例4の結果を示す図。
【発明を実施するための形態】
【0013】
1態様に従う、環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物は、細胞に送達され、細胞の環境に応じてフリーラジカルを発生させる。従って、フリーラジカルの産生の有無またはフリーラジカルの産生量を指標に、転写制御配列の活性化の有無を判定し、それに基づいて、当該レポーター遺伝子構築物が導入された細胞の環境や細胞の状態を予測することが可能である。
【0014】
ここでいう「環境」とは、当該レポーター遺伝子構築物の送達が意図される細胞における種々の状態、例えば、細胞の病的状態、例えば、癌化した状態、および有害物質に暴露された状態、または低酸素環境、低温環境または高温環境に曝された状態などを示す。
【0015】
「環境に依存して活性化される」とは、意図される細胞が、意図された環境に存在する場合に活性化されることをいう。
【0016】
「転写制御配列」とは、当該配列の下流に位置する遺伝子の転写を制御する配列であればよく、例えば、特定遺伝子のエンハンサーおよび/またはプロモーター(以下「エンハンサー/プロモーター」と記す)であってよい。「特定遺伝子」とは、環境に依存して活性化される遺伝子であればよい。
【0017】
「機能的に結合される」とは、意図される機能が維持された状態または意図される機能が発揮できる状態で結合されることをいう。
【0018】
「フリーラジカルを発生させるタンパク質」とは、環境に依存して活性化される転写制御配列の活性化を受けて、一酸化窒素(NO・)、スーパーオキシド(O2−・)およびヒドロキシラジカル(OH・)などのフリーラジカルを産生するタンパク質であればよく、例えば、基質に作用してフリーラジカルを産生する酵素などであってよい。
【0019】
「フリーラジカルを発生させるタンパク質をコードするレポーター遺伝子」とは、前記タンパク質をコードする遺伝子、または前記タンパク質をコードする配列を含む遺伝子、または前記タンパク質のフリーラジカルを産生することが可能な一部分を含む遺伝子、フリーラジカルを産生することが可能な範囲で置換、欠失および/または付加などの変異が含まれる前記タンパク質をコードする遺伝子であってよい。
【0020】
当該レポーター遺伝子構築物は、意図される細胞に送達され、目的とする環境においてレポーター遺伝子を発現することが可能であればよい。当該レポーター遺伝子構築物は、それ自身公知の何れかの手段により細胞内に導入されればよい。例えば、カチオン脂質を用いる方法(リポフェクション)、エレクトロポーレーション、超音波、磁気またはパーティクル・ガンなどにより物理化学的手法により導入されてもよく、それ自身がアデノウイルスなどのウイルスベクターおよびプラスミドベクターとして構築されてもよく、それ自身がカチオン性脂質、塩基性ポリマー、合成ポリペプチドおよび炭酸アパタイトなどのイオンコンプレックス型キャリアなどのキャリア型に構築されてもよい。
【0021】
1態様において、当該レポーター遺伝子構築物は、プロモーター活性を検出するベクターであってもよい。この場合、特定遺伝子のエンハンサー/プロモーターと、フリーラジカルを発生させるタンパク質をコードする遺伝子と、ポリ(A)付加シグナルを連結したDNAを含んでよい。特定遺伝子のエンハンサー/プロモーターは、特定遺伝子のエンハンサーと、任意のプロモーターで構成されていてもよい。本態様においけるエンハンサーとは、基質により活性化された転写因子が結合するゲノム上の特異的な塩基配列であり、転写因子との結合によって下流遺伝子の転写を活性化する機能を持つ塩基配列である。プロモーターとは、RNAポリメラーゼの結合配列を含む、遺伝子の転写開始に不可欠な塩基配列である。
【0022】
[転写制御配列]
転写制御配列は、例えば、エンハンサーおよび/またはプロモーターであってよい。環境に依存して活性化される転写制御配列は、特定遺伝子のエンハンサー/プロモーターであってもよい。ここでいう「特定遺伝子」は、環境に依存して活性化される遺伝子であればよく、測定対象とする細胞の特定の状態において特異的に活性化されるエンハンサー/プロモーターであればよい。測定対象とする細胞の状態としては、癌化した細胞の状態や、有害物質に暴露された細胞の状態や、低酸素環境や低温環境、或いは高温環境に晒された細胞の状態などが挙げられる。例えば、特定の疾患の状態において細胞において活性化される遺伝子、即ち、疾患関連遺伝子のエンハンサーおよび/またはプロモーターであってもよい。例えば、疾患関連遺伝子のエンハンサーおよび/またはプロモーターの例は、癌化した細胞の状態で活性化するエンハンサー/プロモーターであり、例えば、myc遺伝子、fos遺伝子、ras遺伝子のエンハンサー/プロモーターなどが挙げられる。また、有害物質に暴露された細胞の状態で活性化するエンハンサー/プロモーターには、チトクロム1A1遺伝子などの薬剤代謝関連酵素遺伝子群のエンハンサー/プロモーターなどが挙げられる。これらの遺伝子のエンハンサー/プロモーターは、エンハンサー配列のみを分離し、該エンハンサーを任意のプロモーターと連結して用いることも可能である。任意のプロモーターとしては、例えば、サイトメガロウイルス(CMV)の最小プロモーター, シミアンウイルス40(SV40)の初期プロモーター、ヘルペス・シンプレックス・ウイルスのチミジンキナーゼ・プロモーターなどを使用することができる。ただし、本態様の実施において使用可能な任意のプロモーターは、これに限定されるものではなく、プロモーターとしての機能を損なわない限りにおいては、遺伝子配列を改変したものを用いてもよい。
【0023】
例えば、前記転写制御配列が、サイトメガロウイルス・イミディエート・プロモーター、シミアンウイルス40・初期プロモーターおよびヘルペス・シンプレックス・ウイルス・チミジンキナーゼからなる群より選択されたプロモーター配列であり、環境に依存して活性化される遺伝子のエンハンサーの挿入部位を前記プロモーター配列の上流に更に具備するレポーター遺伝子構築物であってもよい。その場合、エンハンサーの挿入部位に特定遺伝子のエンハンサー、例えば、疾患関連遺伝子のエンハンサーを更に組込んで使用されればよい。
【0024】
[レポーター遺伝子]
レポーター遺伝子として使用されるフリーラジカルを発生させるタンパク質遺伝子の例としては、L−アルギニンから一酸化窒素(NO・)を合成する一酸化窒素合成酵素(NOS,NO Synthase)遺伝子群、ヒポキサンチンからキサンチンへの酸化の過程でスーパーオキシド(O2−・)を発生させるキサンチンオキシダーゼ(XO, Xanthine Oxidase)遺伝子などが挙げられる。ただし、これらの遺伝子に限定されるわけではなく、フリーラジカルを発生する活性を持つタンパク質の遺伝子であれば、他の遺伝子を使用してもよい。
【0025】
NOS遺伝子を使用する例を挙げると、哺乳動物には、一般的に3種類のNOS遺伝子、すなわち、iNOS(inducible NOS)、nNOS(neural NOS)、eNOS(endothelial NOS)が存在する。これらのNOS遺伝子はいずれも、本態様において使用することが可能である。これらのNOS遺伝子のうち、nNOSとeNOSは細胞内で構成的に発現しており、その酵素活性(NO・合成の活性)が細胞内のカルシウム濃度で制御される。本態様において、nNOSとeNOSの野生型遺伝子を使用することは可能であるが、より好ましくは、細胞内カルシウム濃度の制御を受けない変異を導入したnNOSとeNOSの変異型遺伝子を使用することが望ましい。これに対して、iNOSは、炎症性サイトカイン(TNF−αやIL−1βやIFN−γなど)により転写レベルで誘導され、その酵素活性は細胞内カルシウムの制御を受けない。したがって、iNOSの場合は、野生型遺伝子を好ましく使用することができるが、本態様におけるiNOS遺伝子の使用は、野生型遺伝子の使用に限定されるわけではない。例えば、フリーラジカルを発生する能力を向上させたiNOSの変異型遺伝子を用いてもよい。例えばNO・合成活性の向上した変異型iNOSや構成的に酵素活性化したiNOSを使用してもよい。本態様における3種類のNOS遺伝子の由来は、哺乳動物であればよい。また、NOS遺伝子の分類の1つとして構成的に存在するcNOS(constitutive NOS)もあるが、cNOSも本態様において使用されてもよい。
【0026】
[転写終結遺伝子]
当該レポーター遺伝子構築物は、レポーター遺伝子の下流に更に転写終結遺伝子を含んでもよい。転写終結遺伝子は、その上流の遺伝子の転写を終結する遺伝子であればよく、例えば、ポリ(A)付加シグナルであってよい。
【0027】
ポリ(A)付加シグナルは、哺乳動物の遺伝子の転写終結に機能するものであればよい。例としては、SV40ウイルスの後期ポリ(A)付加シグナルや、牛成長ホルモン遺伝子のポリ(A)付加シグナルなどが挙げられる。ただし、本態様の実施において使用可能なポリ(A)付加シグナルは、これに限定されるものではなく、ポリ(A)付加シグナルとしての機能を損なわない限りにおいては、遺伝子配列を改変したものを用いてもよい。
【0028】
[ラジカル産生ベクターの作製]
以下、本態様の1つであるベクターの1例について説明する。このベクターは、フリーラジカルを発生させる遺伝子にiNOS遺伝子に用いたベクターの1例である。
【0029】
マウスのiNOS遺伝子の塩基配列を配列番号1に示す。iNOS遺伝子の由来は、哺乳動物に由来するものであればよく、マウス由来のiNOS遺伝子限定されるものではない。例えば、ヒト、サル、ラットなどのiNOS遺伝子であってもよい。また、iNOS遺伝子は、その酵素活性(NO・合成活性)を失わない限りにおいては、配列番号1の塩基配列と完全に一致している必要はない。iNOS遺伝子は、既知の遺伝子工学手法によって取得すればよい。例えば、塩基配列に特異的なプライマーセットによるPCRで増幅して取得してもよい。または全塩基配列を人工的に合成してもよい。また既にベクターに組込まれたものを利用してもよい。
【0030】
本態様で使用するiNOS遺伝子は、変異型遺伝子であってもよい。iNOS変異型遺伝子の塩基配列を配列番号2と3に示す。該変異型遺伝子は、カルボキシ末端の21アミノ酸が欠失したiNOSタンパク質、及び、カルボキシ末端に31アミノ酸が付加されたiNOSタンパク質をそれぞれコードする。配列番号2と3に示した変異遺伝子は、マウス由来であるが、これに限定されるわけではなく、哺乳動物、例えばヒト、サル、ラットに由来する遺伝子であればよく、変異箇所も遺伝子の由来に応じた対応箇所に変異を導入してあればよい。このようなiNOSの変異型遺伝子は、既知の遺伝子工学手法によって取得することができる。例えば、変異を導入した特異的なプライマーセットによるPCRで増幅することが可能である。または変異遺伝子の全塩基配列を人工的に合成してもよい。
【0031】
上述のiNOS遺伝子の5’上流に、特定遺伝子のエンハンサー/プロモーターを、3’下流にポリ(A)付加シグナルを連結することによって、ベクターが作製される。図1に示したpSV40−NOS2が、iNOS遺伝子を組み込んだベクターの1例である。この例では、任意のプロモーターにSV40初期プロモーターを、ポリ(A)付加シグナルにSV40後期ポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。このようなベクターは、iNOS遺伝子を市販のベクターに組込むことによって作製してもよい。このベクターのプロモーター上流に、特定遺伝子のエンハンサーを組み込むことにより、本態様における細胞の状態を測定するベクターを作製することができる。
【0032】
図2に示したpXRE−SV40−NOS2が、上記ベクターのプロモーター上流にエンハンサーを組み込んだベクターの1例である。この例では、エンハンサーとして、チトクロム1A1遺伝子の発癌物質に応答するエンハンサーを組み込んでいる。エンハンサーの塩基配列を配列番号4に示す。このようなエンハンサーは、既知の遺伝子工学手法によって取得することができる。例えば、塩基配列に特異的なプライマーセットによるPCRで増幅して取得することができる。取得したエンハンサーは、既知の遺伝子工学手法によって、ベクターに組み込めばよい。
【0033】
図9に示したpCMV−iNOStrが、カルボキシ末端の21アミノ酸が欠失させた変異型iNOS遺伝子(配列番号2)を組み込んだベクターの1例である。この例では、任意のプロモーターにCMVプロモーターを、ポリ(A)付加シグナルに牛成長ホルモン遺伝子のポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。このようなベクターは、既知の遺伝子工学手法、例えば、PCRなどにより、遺伝子のコードを改変した変異型のiNOS遺伝子を作製して、市販のベクターに組込むことによって作製してもよい。
【0034】
図9に示したpCMV−iNOS−Fが、カルボキシ末端に31アミノ酸を付加した変異型iNOS遺伝子(配列番号3)を組み込んだベクターの1例である。この例では、任意のプロモーターにCMVプロモーターを、ポリ(A)付加シグナルに牛成長ホルモン遺伝子のポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。該変異型遺伝子は、カルボキシ末端にV5−ポリヒスチジン・タグ配列を含む31アミノ酸配列を付加している。このようなベクターは、既知の遺伝子工学手法、例えば、PCRなどにより、遺伝子のコードを改変した変異型iNOS遺伝子を作製して、市販のベクターに予め組み込まれたV5−ポリヒスチジン・タグ配列との融合遺伝子となるように作製してもよい。該変異型遺伝子を組み込む市販のベクターとしては、例えば、pcDNA4/V5−Hisベクターなどが挙げられる。この例では、カルボキシ末端にV5−ポリヒスチジン・タグ配列を含む31アミノ酸配列を付加した変異型iNOS遺伝子を挙げたが、変異型iNOS遺伝子がコードする変異型iNOSのNO・合成活性が向上する限りにおいては、カルボキシ末端に付加する配列は、V5−ポリヒスチジン・タグ配列でなくともよく、また付加するアミノ酸配列の長さも31アミノ酸に限定されるわけではない。
【0035】
[転写制御配列の活性に基づく産生フリーラジカル検出による細胞状態の測定]
本態様においてベクターを使用して、細胞の状態をフリーラジカル発生により測定する。
【0036】
以下に、本態様の1例として、iNOS遺伝子を組み込んだベクターを使用し、フリーラジカルとして一酸化窒素を発生させて細胞の状態を測定する方法について説明する。まず、ベクターを測定対象の細胞に導入して任意の期間にわたり培養する。このとき、測定対象の細胞は、ヒトやサルやマウスやラットなどの哺乳動物の細胞を選択することが望ましい。
【0037】
ベクターを宿主細胞に導入する方法は、既知の細胞工学手法を用いればよい。このような方法としては、例えば、生化学的な方法として、カチオン脂質を用いる方法(リポフェクション)、塩化カルシウムを用いる方法などが挙げられる。例えば、物理化学的な方法として、電気穿孔法などが挙げられる。
【0038】
このようにベクターを宿主細胞に導入した後、細胞を任意の期間にわたり培養する。この培養期間中に測定対象の細胞に対して、必要に応じて所望の細胞の状態を誘発する環境刺激、例えば、化学物質、低酸素ストレスおよび/または温度ストレスなどを与えればよい。これにより、細胞に与えた環境刺激に応じて、刺激に対応して活性化したエンハンサー/プロモーターが、iNOS遺伝子の転写・翻訳を促進し、iNOSタンパク質が合成される。iNOSタンパク質は、細胞内のL-アルギニンから一酸化窒素(NO・)を合成する。この一酸化窒素の合成量を測定することにより、細胞の状態を測定することができる。
【0039】
例えば、一酸化窒素の合成されたことが測定された場合、または合成量が増加した場合に、当該細胞に導入されたエンハンサー/プロモーターが活性化されたことが分かる。即ち、この細胞の状態または環境が、当該エンハンサー/プロモーターが活性化される状態または環境であると判定される。従って、当該エンハンサー/プロモーターが活性化される状態または環境が細胞の癌化であれば、当該細胞が癌化している、または癌化している可能性が高いことが予測できる。或いは、当該エンハンサー/プロモーターが活性化される状態または環境が、低酸素環境であれば、フリーラジカルの産生または産生の大きさにより当該細胞が低酸素環境にあると判定される。
【0040】
一酸化窒素の測定方法としては、電子スピン共鳴装置による方法や一酸化窒素特異的な蛍光プローブを使用する方法がある。電子スピン共鳴装置による方法では、一酸化窒素を直接測定してもよいし、特異的なスピントラップ剤で一酸化窒素をトラップしてから、これを測定してもよい。一酸化窒素のスピントラップ剤としては、例えば、N−メチルグルカミンジチオカルバメート(MGD)やジエチルジチオカルバメート(DETC)やN−ジチオカルボキシルサルコシン(DTCS)やカルボキシPTIOが挙げられる。これらのスピントラップ剤を細胞に暴露した後に、電子スピン共鳴装置で測定することにより、細胞で発生した一酸化窒素を定量的に測定することができる。一酸化窒素特異的な蛍光プローブとしては、例えば、ジアミノフルオロセイン(DAF2)やこの誘導体が挙げられる。このような蛍光プローブを細胞に暴露した後に、蛍光測定装置で測定することにより、細胞で発生した一酸化窒素を定量的に測定することができる。
【0041】
[組織中の転写制御配列活性を産生フリーラジカルにより検出するシステム]
本態様のベクターを用いることにより、組織中において特定遺伝子の転写制御配列が活性化した細胞を検出することも可能である。以下に、本態様の1例として、iNOS遺伝子を組み込んだベクターを使用し、フリーラジカルとして一酸化窒素を発生させて細胞の状態を測定する方法について説明する。まず、pSV40−NOS2ベクターのSV40プロモーターの上流に目的とするプロモーターを組み込んだベクターと、スピントラップ剤、カチオン脂質を混合して、脂質膜小胞内にベクターとスピントラップ剤を封入する。このとき、一酸化窒素のスピントラップ剤としては、例えば、N−メチルグルカミンジチオカルバメートやジエチルジチオカルバメートやN−ジチオカルボキシルサルコシンやカルボキシPTIOが挙げられる。ベクターとスピントラップ剤を内包する脂質膜小胞は、組織への直接の塗布または血中への拡散により、確率的に組織と接触し細胞膜と融合することで、内容物を細胞内へ運搬する。これらの工程は、電子スピン共鳴装置(ESR)の外で行われてもよいが、ベクターとスピントラップ剤の生体への導入工程の後、ESR装置で検出できる体勢をとることが望ましい。
【0042】
次に任意の時間放置することで、目的とするプロモーターが活性化する細胞においては、ベクターが転写活性化され、iNOSタンパク質の発現が誘導される。iNOSタンパク質は、細胞内のL−アルギニンから一酸化窒素を合成するため、目的とするプロモーターの活性化の度合いに応じて、一酸化窒素が産生される。産生した一酸化窒素は細胞内にベクターと共に導入されたスピントラップ剤でトラップされる。任意の時間の後、信号源から任意の周波数のマイクロ波を発振し、スピントラップ剤に特異的なスピンシグナルを検出する。同時に、シグナル取得部位の位置情報を取得することにより、スピンシグナル検出部位を同定することができる。図8にその工程を示した。
【0043】
図8を参照して説明する。まず、対象となる組織に当該レポーター遺伝子構築物とラジカルスピントラップ剤を用意する。これらをカチオン性脂質と混合して脂質膜小胞内に封入する。次に、得られた脂質膜小胞内を生体内組織に接触させ、細胞内へ確率的に導入する。導入された当該レポーター遺伝子構築物におけるレポーター遺伝子が発現し、フリーラジカルが発生するために必要な長さの時間インキュベーションする。対象となる組織に対してマイクロ波を発振させ、スピントラップ剤についてラジカル特異的なスペクトルを検出する。組織においてスペクトルの検出された位置情報を検出する。検出されたスペクトルについての情報と検出位置情報から組織におけるラジカル産生部位を同定する。これにより、組織において当該転写制御配列活性が活性化される環境にある細胞を検出することが可能である。
【0044】
当該レポーター遺伝子からのフリーラジカルは、例えば、電子スピン共鳴測定装置により測定することが可能である。電子スピン共鳴測定装置における測定は、検出しようとする細胞を含む細胞群、組織および/または組織切片などについてインビトロでの検出、並びに生体に含まれる細胞および/または組織についてインビボでの検出が可能である。
【0045】
[電子スピン共鳴測定装置]
実施形態の磁気共鳴測定装置は、検出対象に関する核磁気共鳴(NMR)および/または電子スピン共鳴(ESR)などの磁気共鳴を利用して被測定物を検査または測定する装置である。
【0046】
図4に示すように、実施形態の磁気共鳴測定装置の原理は、マイクロ波信号を生ずるように構成された発信器(20)と、それに接続され、前記発信器からの信号を被測定物である検査試料に対して送るように構成された送信器(21)と、前記検査試料(22)を挟み前記送信器と対向する位置に配置され、前記検査試料からの信号を受けるように構成された受信器(23)と、それに接続された帯域幅BW(MHz)の狭帯域フィルタ(24)と、それに接続され、受信器からの信号を増幅し、予め設定された情報に前記増幅された信号を処理するように構成された受信回路(25)と、前記検査試料(22)に対して磁場を印加するように構成された磁場発生器(26)とを具備する。
【0047】
発信器(20)は、マイクロ波信号を出す信号源と、信号源からの信号を増幅する増幅器と、増幅された信号を検査試料に送る送信器を含んでよい。送信器(11)は、検査試料に対して指向性のあるそれ自身公知の何れかの送信器であればよく、例えば、、送信アンテナである。
【0048】
磁場発生器(26)は、検体試料に対して磁場を与えることが可能な磁場発生器であればよく、例えば、一般的にNMR装置およびESR装置に使用される何れかの磁場発生器であってよい。
【0049】
受信器(23)は、検査試料を得て送られる信号を受けることが可能なそれ自身公知の何れかの受信器であればよく、例えば、受信アンテナである。
【0050】
狭帯域フィルタ(24)は、受信器(23)からの信号から所望の周波数の信号を分離するための手段である。
【0051】
狭帯域フィルタの実施形態として、マイクロストリップラインを用いた超伝導フィルタのレイアウト例を図5に示す。マイクロストリップラインを用いたくし型共振器(303)7個のフィルタであり、A−A’の断面構造を図6に示す。マイクロストリップラインは誘電体基板(304)の片面に信号導体(301)、もう一面がグランド導体(306)からなる一般的な高周波用の導波路であり、くし型共振器(303)の長さが共振周波数を決めており、フィルタとしての通過する周波数帯の中心周波数を決めている。また、入力線路(301)や出力線路(302)とくし型共振器(303)の距離やくし型共振器(303)間の距離を最適にすることにより帯域幅が決定できる。このようなフィルタは、超伝導フィルタ信号導体とグランド導体に超伝導体を用いてよい。
【0052】
超伝導体としてはNb3Sn、MgB2、イットリウム系高温超伝導体(YBa2Cu3O7−x)、ビスマス系高温超伝導体(Bi2Sr2CaCu2O8+x、Bi2Sr2Ca2Cu3O10+x)をはじめ各種材料を利用できる。
【0053】
従来の疾患早期においては、対象となる組織でプロモーター活性が変化している前疾患化状態にある細胞の数は少数である。従って、体外診断を行うために採取した細胞中に当該細胞の含まれる確率は高いとはいえず、インビボにおいて、プロモーター活性を検出することが求められている。現在行われているインビボにおけるプロモーター活性のイメージング技術には、ルシフェラーゼの発光を超高感度CCDを用いて検出する方法や、GFPなどの蛍光を蛍光分子トモグラフィによって検出する方法がある。しかしながら、これらの方法はいずれも光学的な検出である。そのため、体内の深部(概ね2cm以上)における発光および/または蛍光は減衰してしまう。そのため、厚さが概ね2cm以内の組織中の活性を検出する小動物用の検出方法として適用されるにすぎない。
【0054】
本様態の如く、フリーラジカルを指標とすれば光学的手法に限定されず、検出が可能である。非光学的法を適用すれば、従来どおり生体などのサンプル浅部のみならず深部においてもプロモーターおよび/またはエンハンサーなどの転写制御配列の活性化の有無または活性化の程度を測定は可能である。それにより目的とする疾患、例えば、癌化を早期に発見することが可能になる。また、本態様のレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせて測定することにより、サンプル深部におけるプロモーターおよび/またはエンハンサーなどの転写制御配列の活性化の有無を非侵襲性に検出することが可能である。本態様に従うレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせによる検出方法であれば、より正確なより早期の疾患の診断が可能となる。
【0055】
また、例えば、早期癌化細胞を検出する場合、当該細胞を検出するのと同時に、レポーター遺伝子構築物から産生されたフリーラジカルにより疾患細胞を傷害することも可能である。細胞障害性は、レポーター遺伝子構築物の細胞への貯留時間およびそこに含まれるレポーター遺伝子の種類、放出されるラジカル種および量を任意に選択することにより変更することが可能である。
【0056】
また、同様に、細胞群、組織または生体において特定の環境または状態を有する細胞を検出することが可能である。ラジカルをレポーターとすることにより、測定対象に対して非侵襲的に検出が可能であり、例えば、インビボ、インビトロおよびエクスビボなど種々の検出を有利に行うことが可能である。
【0057】
[アッセイキット]
上述の態様に従う電子スピン共鳴測定装置と、当該レポーター遺伝子構築物とを利用して転写制御配列の活性化の有無または活性化の程度を測定する方法において使用するためのアッセイキットも提供される。
【0058】
そのようなアッセイキットは、上述の何れかの当該レポーター遺伝子構築物と、そこに含まれるレポーター遺伝子に対応するスピントラップ剤とを含めばよい。例えば、レポーター遺伝子が何れかのNOSである場合、スピントラップ剤は、一酸化窒素をトラップするための薬剤であればよく、例えば、N−メチルグルカミンジチオカルバメート、ジエチルジチオカルバメート、N−ジチオカルボキシルサルコシンおよびカルボキシPTIOからなる群より少なくとも1選択されるスピントラップ剤であってよい。また、電子スピン共鳴測定装置では、複数の狭帯域フィルタと受信回路とを含む構成とすることにより、異なるラジカル種について同時に測定することも可能である。当該アッセイキットは、複数種類のレポーター遺伝子を夫々に含むレポーター遺伝子構築物と、それらの各レポーター遺伝子により産生されるラジカル種に対応するスピントラップ剤を含んでもよい。更に、当該アッセイキットは、レポーター遺伝子構築物とスピントラップ剤を封入し脂質膜小胞を得るための脂質を更に含んでもよい。そのような脂質は、例えば、カチオン性脂質、塩基性ポリマー、合成ポリペプチドおよび炭酸アパタイトなどのイオンコンプレックス型キャリアであってよい。また更に、当該アッセイキットは、取り扱い説明書および/または脂質膜小胞を調製するための容器を含んでもよい。
【0059】
このようなアッセイキットは、簡便および/または迅速に目的とする方法を行う上で有効である。
【0060】
[例]
例1 iNOSベクターの作製
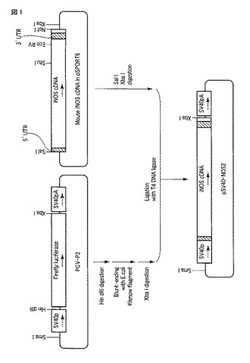
レポーター遺伝子として、一酸化窒素合成酵素2(iNOS)遺伝子を用いたiNOSベクターを作製した。シミアンウイルス40(SV40)初期プロモーター:ホタルのルシフェラーゼ遺伝子::SV40ポリA付加シグナルで構成される発現カセットを持つPGV−P2ベクター(東洋ビーネット)を制限酵素Hin dIIIで消化し、5’突出末端をE.coli DNAポリメラーゼのKlenow fragmentで平滑端化した。さらに制限酵素Xba Iで消化し、ルシフェラーゼ遺伝子を取り除いたPGV−P2のベクター断片を調整した。このベクター断片に、マウスのiNOS遺伝子を組み込んだ。マウスiNOS遺伝子のcDNA配列が組み込まれたpSPORT6ベクター(pNOS2)をライフテクノロジーズより入手し、これを制限酵素Sma IとXba Iで消化してiNOS遺伝子のcDNA断片を得た。このcDNA断片を、先に調整したPGV−P2のベクター断片にT4リガーゼで連結してiNOSベクター:pSV40−NOS2を作製した(図1)。
【0061】
例2 iNOSベクターによる発癌性に応答した一酸化窒素(NO・)の検出
発癌物質に応答するエンハンサー領域をiNOSベクター:pSV40−NOS2に組み込んだ。チトクロム1A1遺伝子の発癌物質(ヘンゾピレン)応答エンハンサー領域(配列番号4)を、マウスのゲノムからPCRで増幅した。増幅したエンハンサー領域の5’末端をT4ポリヌクレオチドキナーゼでリン酸化した後、制限酵素Sma Iで消化しアルカリホスファターゼで5’末端を脱リン酸化したpSV40−NOS2にT4リガーゼで連結してpXRE−SV40−NOS2を作製した(図2)。このベクターを用いて、発癌物質によるエンハンサー領域の活性化と、iNOSによる一酸化窒素(NO・)の合成量の相関を調べた。
【0062】
マウスの神経芽細胞腫Neuro2a(アメリカン・タイプ・セル・カルチャー)を8.0x104細胞/ウェルの密度で24ウェル・プレートに播種し、10%牛胎児血清(FCS)を加えたDMEM/F12等比混合培地(DF1:1培地)を用いて、37℃、5%CO2雰囲気下で一晩培養した。Opti−MEM培地50μLにリポフェクタミン2000(ライフテクノロジーズ)2.0μLを加えて室温に5分間インキュベートした。この溶液と、0.8μgのpXRE−SV40−NOS2を加えたOpti−MEM培地50μLとを混合して室温に20分間インキュベートして一晩培養したNeuro2aに加え、37℃、5%CO2雰囲気下で培養した。24時間後、Neuro2aの培地を取り除き、ジメチルスルホキシド(DMSO)、或いはベンゾピレン(BaP)を1.0μM含むDF1:1培地(10%FCS)を加え、37℃、5%CO2雰囲気下で培養した。24時間後、培地を取り除き、DF1:1培地(w/o FCS)で2回洗浄した後、一酸化窒素(NO・)検出用の蛍光プローブであるジアミノフルオロセイン−2,2酢酸(DAF2−DA、積水メディカル)を10μM含むDF1:1培地(w/o FCS)を加えて37℃にインキュベートした。2時間後、細胞をリン酸緩衝液(PBS)で2回洗浄し、倒立型蛍光顕微鏡でDAF−2DAと一酸化窒素(NO・)の反応生成物(DAF−2T、励起波長:495nm、蛍光波長:515nm)による蛍光を観察した。図3(a)にはジメチルスルホキシド(DMSO)を添加したときの結果を、図3(b)にはベンゾピレン(Bap)を添加したときの結果を示す。
【0063】
図3に示したとおり、ベンゾピレン暴露細胞において、一酸化窒素(NO・)合成量の増加による蛍光の誘導が観察された。ベンゾピレンによるエンハンサー領域の活性化とiNOSによる一酸化窒素(NO・)発生量増加の相関が示された。
【0064】
例3 変異型iNOSベクターの作製
pNOS2を制限酵素Sal I/Eco RVで切断し、iNOS遺伝子の5’−非翻訳領域とコード領域を含む遺伝子断片を切り出した。この断片を制限酵素Sal I/Eco RVで切断したpBluescriptII SK(−)ベクターに組込み、pNOS2−RVを作製した。次に、pNOS2を鋳型に、変異プライマーを用いたPCRにより、iNOS遺伝子3’−末端側を改変したDNA断片を増幅した。変異は、リバースプライマーに導入し、フォワードプライマーは同一のものを用いた。以下に、フォワードプライマーと、2種類の変異を導入したリバースプライマーの塩基配列を示した。
【0065】
フォワードプライマー:5’−GGCAGAGATTGGAGGCCTTGTGT(配列番号5)
リバースプライマー1: 5’−AGGTCTAGATTCAACCGAAGATATCTTCAT (配列番号6、iNOStr)
リバースプライマー2: 5’−CTCTGTCTAGACCGAGCCTCGTGGCTTTGGGC(配列番号7、iNOS−F)
iNOStrは、野生型iNOSのカルボキシ末端(C−末端)から21アミノ酸残基を欠失させるため、リバースプライマーに野生型iNOSの1125番目の終止コドンをグリシンに置換する変異を導入した。iNOS−Fは、野生型iNOSにV5−ポリヒスチジン・タグ配列が付加されるように、リバースプライマーに野生型iNOSの終止コドンを除去する変異を導入した。プライマーには、増幅断片のクローニングを容易にするため、制限酵素の認識配列を付加した(Stu I、或いはXba Iの認識配列)。
【0066】
上記プライマーを用いたPCRで増幅したDNA断片をStu IとXba Iで切断し、これを同様にStu IとXba Iで切断したpNOS2−RVに組込んで、2種類の変異型iNOS遺伝子を作製した(piNOStr、piNOS−F)。
【0067】
最後に、piNOStrとpiNOS−Fを、Kpn IとXba Iで切断して変異iNOS遺伝子を切り出し、これを同様にKpn IとXba Iで切断したpcDNA4/V5−His B(ライフテクノロジーズ)に組込んで、変異型iNOSベクター:pCMV−iNOStrとpCMV−iNOS−Fを作製した。図9Aおよび図9Bにその概要を示す。図9Bは図9Aの続く図面である(図9Aおよび図9B)。図9Aの最下段の矢印とその右側の記載は、図9Bの最上段の矢印とその右側の記載と同一の「消化(digestion)」処理について示すものである。図9Aと図9Bの記載内容の連続性をより分かり易く記載するためのものである。
【0068】
例4 変異型iNOSベクターによる一酸化窒素(NO・)の検出
マウスの神経芽細胞腫Neuro2a(アメリカン・タイプ・セル・カルチャー)を8.0x104細胞/ウェルの密度で24ウェル・プレートに播種し、10%牛胎児血清(FCS)を加えたDMEM/F12等比混合培地(DF1:1培地)を用いて、37℃、5%CO2雰囲気下で一晩培養した。Opti−MEM培地50μLにリポフェクタミン2000(ライフテクノロジーズ)2.0μLを加えて室温に5分間インキュベートした。この溶液と、0.8μgの野生型または変異型iNOSベクター(pCMV−iNOStr、pCMV−iNOS−F、pNOS2)を加えたOpti−MEM培地50μLとを混合して室温に20分間インキュベートして一晩培養したNeuro2aに加え、37℃、5%CO2雰囲気下で培養した。24時間後、Neuro2aの培地を取り除き、DF1:1培地(w/o FCS)で2回洗浄した後、一酸化窒素(NO・)検出用の蛍光プローブであるジアミノフルオロセイン−2,2酢酸(DAF2−DA、積水メディカル)を10μM含むDF1:1培地(w/o FCS)を加えて37℃にインキュベートした。2時間後、細胞をリン酸緩衝液(PBS)で2回洗浄し、倒立型蛍光顕微鏡でDAF−2DAと一酸化窒素(NO・)の反応生成物(DAF−2T、励起波長:495nm、蛍光波長:515nm)による蛍光を観察した。図10の(a)は、野生型iNOS導入細胞についての結果である。図10(b)および図10(c)は変異型iNOS導入細胞についての結果であり、図10(b)はpCMV−iNOStr導入細胞、図10(c)はpCMV−iNOS−F導入細胞についての結果である。
【0069】
図10に示したとおり、変異型iNOS導入細胞(pCMV−iNOStr導入細胞とpCMV−iNOS−F導入細胞)において、一酸化窒素(NO・)合成量の増加による蛍光の増加が観察された。変異型iNOSが、野生型iNOSよりも高い一酸化窒素(NO・)発生量能を有することが示された。
【0070】
例5 アッセイキット
レポーター遺伝子としてNOS遺伝子を含むレポーター遺伝子構築物と、N−メチルグルカミンジチオカルバメート(MGD)と、カチオン性脂質と、脂質膜小胞を調製するための容器と、取り扱い説明書とを含むアッセイキットを組み合わせ、樹脂製包材に梱包してアッセイキットとする。
【0071】
例6 電子スピン共鳴測定装置の例
図7は、当該レポーター遺伝子構築物を用いて細胞検出を行うための電子スピン共鳴測定装置の1例を示す概略ブロック図である。
【0072】
実施形態の電子スピン共鳴測定装置は、発信器として、マイクロ波を生ずるように構成された発信回路と、生じたマイクロ波を増幅する増幅器を含む送信信号発生器(201)を含む。送信信号発生器(201)から出た信号を稼動可能な送信アンテナ(203)から被測定物(205)に印加する。印加に先駆けて、当該レポーター遺伝子構築物とラジカルスピントラップ剤をカチオン性脂質と混合して膜粒子内に封入して脂質膜小胞を準備する。この脂質膜小胞を被測定物(205)の測定領域に添加し、脂質膜小胞内のレポーター遺伝子構築物を当該領域の細胞に導入する。導入された当該レポーター遺伝子構築物におけるレポーター遺伝子が発現し、フリーラジカルが発生するために必要な長さの時間インキュベーションする。その後、被測定物(205)に印加する。
【0073】
またこのとき、被測定物(205)は、磁場発生器(204)から生じた磁場内に位置される。磁場発生器(204)は、磁場変調器(202)により制御され、磁場を変調可能である。印加された磁場内の被測定物(205)からの信号は、受信アンテナ(206)により受信される。このとき、送信アンテナ(203)の位置情報が、送信アンテナ位置の検出手段である位置情報検出器としての画像入力部(213)から得られ、その位置情報は、制御部(210)に送られる。得られた位置情報に基づいた制御による制御部(210)による制御により、可動可能な受信部(230)が移動する。即ち、制御部(210)による制御により、受信部(230)を支持する受信部移動装置(212)が移動し、それにより受信部(230)が位置を移動し、磁場内で送信アンテナ(203)からの信号を印加された被測定物(205)からの信号を受ける。受信部(230)は、受信アンテナ(206)と、それに接続された狭帯域フィルタ(207)と、それに接続された低雑音増幅器(208)と、それに接続された検波部(209)を具備する。受信アンテナ(206)により受信された信号は、狭帯域フィルタ(207)により分波され、得られた分波された信号は低雑音増幅器(208)により増幅され、検波部(209)に送られる。検波部(209)は、ミキサおよびローカル信号源などによる周波数変換器と、信号処理回路とを含む。検波部(209)では、送られた信号について周波数変換器が周波数変換した後、信号の大きさと、画像入力部(213)から得られた位置情報および画像などの情報並びに予め記憶されたプログラムおよび/またはテーブルなどの情報に基づいて、当該周波数変換された信号を、信号処理回路により処理し、表示部(211)に情報を表示する。
【0074】
このような実施形態の電子スピン共鳴測定装置では、送信アンテナ(203)と受信アンテナ(206)の受信位置から被測定物(205)の測定断面位置を変更しての評価することが可能となる。このときに各測定断面位置で、磁場変調器(202)により磁場発生器(204)を制御し、磁場を変調して評価を行うことも可能である。磁場変調器(202)の制御は、予め記憶されたプログラムおよび/またはテーブルなどの情報に基づいて制御部(210)により行われてもよく、更に制御部に接続された入力部(図示せず)から、オペレータにより入力された情報に基づいて制御されてもよい。制御部はコンピュータであってもよい。
【0075】
検波部(209)は、ミキサおよびローカル信号源などによる周波数変換器と、例えば、コンピュータなどの信号処理回路とを含む。当該信号処理回路は、当該磁気共鳴測定装置を構成する他の構成要素、例えば、検波部(209)および/または制御部(210)などと一体化されて具備されてもよく、他の構成要素からは別の構成要素として互いに信号を送受信可能な状態で接続されて具備されてもよい。信号処理回路は、例えば、コンピュータであってよい。
【0076】
表示部(211)への情報の表示は、画像入力装置(213)からの画像と、測定された磁気共鳴信号に基づく評価情報が組み合わされた形式で表示部(211)に表示されてもよい。
【0077】
送信アンテナは、オペレータが手に持って、任意の位置に動かしてもよく、可動可能な支持体に固定して、オペレータの手動により、または制御部の制御により任意の位置に動かしてもよい。
【0078】
2次元のスライス画像や3次元のイメージング画像を作成する場合には一般的なMRI等の装置と同様の方法が利用可能である。例えば、静磁場とは別に、距離に比例した強度を持つ磁場(即ち、傾斜磁場)をかけ、傾斜磁場によって電子スピンの位相や周波数が変化する情報を得ればよい。実際に観測するのは個々の信号の合成されたものであるから、得られた信号を解析する際に二次元ないし三次元のフーリエ変換を行うことで個々の位置の信号(即ち、各位置における電子スピンに比例する)に分解し、画像情報を得ればよい。得られた画像情報を元にESR評価情報の被測定物の表面情報を画像入力装置の実画像に合わせたり、別に取得したMRIやX線CTなどの情報に重ねて表示したりすることが可能である。これにより、より多くの情報を提供することが可能となる。そのような機能を当該磁気共鳴測定装置に付与する場合には、必要に応じてそれ自身公知の構成要素を当該磁気共鳴測定装置の構成要素に追加すればよい。
【0079】
上述した例では、画像情報を元に送信アンテナ位置を特定する例を示したが、送信アンテナ自身にジャイロを内蔵させて基準位置からの変位データを取得する方法など、それ自身公知の何れか他の送信アンテナの位置検出方法も利用することが可能である。
【0080】
従来、電子スピン共鳴法は、非光学的検出として、体内の微弱な電子スピンシグナルを検出することが可能であるが、この電子スピン共鳴法によって、特定プロモーター活性を検出する方法についてはこれまで報告はない。
【0081】
本態様の電子スピン共鳴測定装置と上述した当該レポーター遺伝子構築物とを組み合わせることにより、目的とする疾患、例えば、癌化を早期に発見することが可能になり、生体深部における疾患をも非侵襲性に検出することが可能である。例えば、慢性炎症により正常幹細胞から癌性幹細胞に変化した場合における遺伝子転写環境の変化も生体において検出することが可能になる。従って、本態様に従うレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせによる検出方法により、より正確なより早期の疾患の診断が可能となる。
【0082】
以上のような本態様により、組織中の特定プロモーターを検出し、疾患の早期診断等の用途に利用可能である。また、プロモーター活性に応じたラジカル産生に基づいて、特定のプロモーター活性をラジカル産生量と置換することによって電子スピン共鳴により検出する方法および装置が提供される。これらの方法および装置も本出願の範囲内に含まれる。
【符号の説明】
【0083】
20 発信器、21 送信器、22 検査試料、23 受信器、24 バンドパスフィルタ、25 受信回路、26 磁場発生器、201 送信信号発生器、202 磁場変調器、203 送信アンテナ、204 磁場発生器、205 被測定物、206 受信アンテナ、207 狭帯域フィルタ、208 低雑音増幅器、209 検波部、210 制御部、211 表示部、212 受信部移動器、213 画像入力部、303 くし型共振器、304 誘電体基板、305 信号導体、306 グランド導体
【技術分野】
【0001】
ここに開示される態様は、一般的に、レポーター遺伝子構築物、アッセイキットおよび検出方法に関する。
【背景技術】
【0002】
現在、疾患特異的ゲノム構造異常を標的とした疾患遺伝子が同定され、それにより、癌などの多くの疾患関連遺伝子が発見されている。これらは疾患の診断用バイオマーカーとして注目されている。バイオマーカーの発現は、疾患化の早期には必ずしも十分得ることが出来ないことから、バイオマーカーの検出による診断は、早期診断としては必ずしも適切ではない。
【0003】
早期診断は、治癒率の向上や患者の負担軽減の視点から不可欠である。一つのアプローチとして、ゲノムの修飾の異常と、それに伴うプロモーター活性の変化の検出により、疾患化の早期の変化を観察することが考えられる。
【0004】
プロモーター活性の変化は、遺伝子発現の確率を制御するものであり、疾患関連遺伝子および疾患関連タンパク質の発現よりも早期に観察される。
【0005】
細胞内の特定プロモーターの活性化状態を検出する方法には、レポーター遺伝子アッセイがある。レポーター遺伝子アッセイは、問題となるプロモーターの下流にプロモーターの活性を可視化するためのレポーター遺伝子、例えば、GFP、βガラクトシダーゼ、ルシフェラーゼ遺伝子などを接続して得たレポーター構築物を、被検細胞に導入し、発現されるレポータータンパク質の活性に基づいてプロモーターの活性化状態を定量化する方法である。レポーター遺伝子アッセイは、細胞のプロモーター活性を定量化する方法として、主に体外診断として使用されている。レポーター遺伝子アッセイを非侵襲な状態で、インビボで行うことも動物実験において試みられているが、これらの方法はいずれも光学的な検出方法である。そのため、体内の深部(概ね2cm以上)における発光および/または蛍光は減衰してしまう等の問題があり、体内の浅部等、適用範囲が限定されている。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2002−238599号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
本出願の課題は、電子スピン共鳴法を用いて転写活性の変化を検出するための新規な手段を提供することである。
【課題を解決するための手段】
【0008】
1つの態様に従うと、環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物が提供される。
【0009】
更なる態様に従うと、インビトロにおいて細胞の環境を測定する方法であって、
(1)前記レポーター遺伝子構築物を細胞に導入することと、
(2)前記細胞から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて前記細胞の環境を判定することと
を具備する方法が提供される。
【0010】
更なる態様に従うと、細胞を検出する方法であって、
(1)前記レポーター遺伝子構築物を細胞群に導入することと、
(2)前記細胞群から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて、フリーラジカルを生じた細胞を検出することと
を具備する方法が提供される。
【0011】
もう1つの態様に従うと、インビトロにおいて細胞の環境を測定する方法または細胞を検出する方法を行うためのアッセイキットであって、
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含み、細胞内で発現可能なレポーター遺伝子構築物と、
スピントラップ剤と、
を含むアッセイキットが提供される。
【図面の簡単な説明】
【0012】
【図1】1つの実施形態のベクターの1例であるpSV40−NOS2を示す図。
【図2】1つの実施形態のベクターの1例であるpXRE−SV40−NOS2を示す図。
【図3】1つの実施形態に従う例2の結果を示す図。
【図4】1つの実施形態である磁気共鳴測定装置の1例を示すブロック図。
【図5】1つの実施形態の超伝導フィルタのレイアウト例を示す図。
【図6】1つの実施形態の超伝導フィルタのレイアウト例を示す図。
【図7】1つの実施形態である電子スピン共鳴測定装置の例を示すブロック図。
【図8】1つの実施形態のNO・の発生を指標にした電子スピン共鳴法による細胞検出方法の手順を示すフローチャート。
【図9A】ベクターの例であるpCMV−iNOStrとpCMV−iNOS−Fを示す図。
【図9B】ベクターの例であるpCMV−iNOStrとpCMV−iNOS−Fを示す図。
【図10】例4の結果を示す図。
【発明を実施するための形態】
【0013】
1態様に従う、環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物は、細胞に送達され、細胞の環境に応じてフリーラジカルを発生させる。従って、フリーラジカルの産生の有無またはフリーラジカルの産生量を指標に、転写制御配列の活性化の有無を判定し、それに基づいて、当該レポーター遺伝子構築物が導入された細胞の環境や細胞の状態を予測することが可能である。
【0014】
ここでいう「環境」とは、当該レポーター遺伝子構築物の送達が意図される細胞における種々の状態、例えば、細胞の病的状態、例えば、癌化した状態、および有害物質に暴露された状態、または低酸素環境、低温環境または高温環境に曝された状態などを示す。
【0015】
「環境に依存して活性化される」とは、意図される細胞が、意図された環境に存在する場合に活性化されることをいう。
【0016】
「転写制御配列」とは、当該配列の下流に位置する遺伝子の転写を制御する配列であればよく、例えば、特定遺伝子のエンハンサーおよび/またはプロモーター(以下「エンハンサー/プロモーター」と記す)であってよい。「特定遺伝子」とは、環境に依存して活性化される遺伝子であればよい。
【0017】
「機能的に結合される」とは、意図される機能が維持された状態または意図される機能が発揮できる状態で結合されることをいう。
【0018】
「フリーラジカルを発生させるタンパク質」とは、環境に依存して活性化される転写制御配列の活性化を受けて、一酸化窒素(NO・)、スーパーオキシド(O2−・)およびヒドロキシラジカル(OH・)などのフリーラジカルを産生するタンパク質であればよく、例えば、基質に作用してフリーラジカルを産生する酵素などであってよい。
【0019】
「フリーラジカルを発生させるタンパク質をコードするレポーター遺伝子」とは、前記タンパク質をコードする遺伝子、または前記タンパク質をコードする配列を含む遺伝子、または前記タンパク質のフリーラジカルを産生することが可能な一部分を含む遺伝子、フリーラジカルを産生することが可能な範囲で置換、欠失および/または付加などの変異が含まれる前記タンパク質をコードする遺伝子であってよい。
【0020】
当該レポーター遺伝子構築物は、意図される細胞に送達され、目的とする環境においてレポーター遺伝子を発現することが可能であればよい。当該レポーター遺伝子構築物は、それ自身公知の何れかの手段により細胞内に導入されればよい。例えば、カチオン脂質を用いる方法(リポフェクション)、エレクトロポーレーション、超音波、磁気またはパーティクル・ガンなどにより物理化学的手法により導入されてもよく、それ自身がアデノウイルスなどのウイルスベクターおよびプラスミドベクターとして構築されてもよく、それ自身がカチオン性脂質、塩基性ポリマー、合成ポリペプチドおよび炭酸アパタイトなどのイオンコンプレックス型キャリアなどのキャリア型に構築されてもよい。
【0021】
1態様において、当該レポーター遺伝子構築物は、プロモーター活性を検出するベクターであってもよい。この場合、特定遺伝子のエンハンサー/プロモーターと、フリーラジカルを発生させるタンパク質をコードする遺伝子と、ポリ(A)付加シグナルを連結したDNAを含んでよい。特定遺伝子のエンハンサー/プロモーターは、特定遺伝子のエンハンサーと、任意のプロモーターで構成されていてもよい。本態様においけるエンハンサーとは、基質により活性化された転写因子が結合するゲノム上の特異的な塩基配列であり、転写因子との結合によって下流遺伝子の転写を活性化する機能を持つ塩基配列である。プロモーターとは、RNAポリメラーゼの結合配列を含む、遺伝子の転写開始に不可欠な塩基配列である。
【0022】
[転写制御配列]
転写制御配列は、例えば、エンハンサーおよび/またはプロモーターであってよい。環境に依存して活性化される転写制御配列は、特定遺伝子のエンハンサー/プロモーターであってもよい。ここでいう「特定遺伝子」は、環境に依存して活性化される遺伝子であればよく、測定対象とする細胞の特定の状態において特異的に活性化されるエンハンサー/プロモーターであればよい。測定対象とする細胞の状態としては、癌化した細胞の状態や、有害物質に暴露された細胞の状態や、低酸素環境や低温環境、或いは高温環境に晒された細胞の状態などが挙げられる。例えば、特定の疾患の状態において細胞において活性化される遺伝子、即ち、疾患関連遺伝子のエンハンサーおよび/またはプロモーターであってもよい。例えば、疾患関連遺伝子のエンハンサーおよび/またはプロモーターの例は、癌化した細胞の状態で活性化するエンハンサー/プロモーターであり、例えば、myc遺伝子、fos遺伝子、ras遺伝子のエンハンサー/プロモーターなどが挙げられる。また、有害物質に暴露された細胞の状態で活性化するエンハンサー/プロモーターには、チトクロム1A1遺伝子などの薬剤代謝関連酵素遺伝子群のエンハンサー/プロモーターなどが挙げられる。これらの遺伝子のエンハンサー/プロモーターは、エンハンサー配列のみを分離し、該エンハンサーを任意のプロモーターと連結して用いることも可能である。任意のプロモーターとしては、例えば、サイトメガロウイルス(CMV)の最小プロモーター, シミアンウイルス40(SV40)の初期プロモーター、ヘルペス・シンプレックス・ウイルスのチミジンキナーゼ・プロモーターなどを使用することができる。ただし、本態様の実施において使用可能な任意のプロモーターは、これに限定されるものではなく、プロモーターとしての機能を損なわない限りにおいては、遺伝子配列を改変したものを用いてもよい。
【0023】
例えば、前記転写制御配列が、サイトメガロウイルス・イミディエート・プロモーター、シミアンウイルス40・初期プロモーターおよびヘルペス・シンプレックス・ウイルス・チミジンキナーゼからなる群より選択されたプロモーター配列であり、環境に依存して活性化される遺伝子のエンハンサーの挿入部位を前記プロモーター配列の上流に更に具備するレポーター遺伝子構築物であってもよい。その場合、エンハンサーの挿入部位に特定遺伝子のエンハンサー、例えば、疾患関連遺伝子のエンハンサーを更に組込んで使用されればよい。
【0024】
[レポーター遺伝子]
レポーター遺伝子として使用されるフリーラジカルを発生させるタンパク質遺伝子の例としては、L−アルギニンから一酸化窒素(NO・)を合成する一酸化窒素合成酵素(NOS,NO Synthase)遺伝子群、ヒポキサンチンからキサンチンへの酸化の過程でスーパーオキシド(O2−・)を発生させるキサンチンオキシダーゼ(XO, Xanthine Oxidase)遺伝子などが挙げられる。ただし、これらの遺伝子に限定されるわけではなく、フリーラジカルを発生する活性を持つタンパク質の遺伝子であれば、他の遺伝子を使用してもよい。
【0025】
NOS遺伝子を使用する例を挙げると、哺乳動物には、一般的に3種類のNOS遺伝子、すなわち、iNOS(inducible NOS)、nNOS(neural NOS)、eNOS(endothelial NOS)が存在する。これらのNOS遺伝子はいずれも、本態様において使用することが可能である。これらのNOS遺伝子のうち、nNOSとeNOSは細胞内で構成的に発現しており、その酵素活性(NO・合成の活性)が細胞内のカルシウム濃度で制御される。本態様において、nNOSとeNOSの野生型遺伝子を使用することは可能であるが、より好ましくは、細胞内カルシウム濃度の制御を受けない変異を導入したnNOSとeNOSの変異型遺伝子を使用することが望ましい。これに対して、iNOSは、炎症性サイトカイン(TNF−αやIL−1βやIFN−γなど)により転写レベルで誘導され、その酵素活性は細胞内カルシウムの制御を受けない。したがって、iNOSの場合は、野生型遺伝子を好ましく使用することができるが、本態様におけるiNOS遺伝子の使用は、野生型遺伝子の使用に限定されるわけではない。例えば、フリーラジカルを発生する能力を向上させたiNOSの変異型遺伝子を用いてもよい。例えばNO・合成活性の向上した変異型iNOSや構成的に酵素活性化したiNOSを使用してもよい。本態様における3種類のNOS遺伝子の由来は、哺乳動物であればよい。また、NOS遺伝子の分類の1つとして構成的に存在するcNOS(constitutive NOS)もあるが、cNOSも本態様において使用されてもよい。
【0026】
[転写終結遺伝子]
当該レポーター遺伝子構築物は、レポーター遺伝子の下流に更に転写終結遺伝子を含んでもよい。転写終結遺伝子は、その上流の遺伝子の転写を終結する遺伝子であればよく、例えば、ポリ(A)付加シグナルであってよい。
【0027】
ポリ(A)付加シグナルは、哺乳動物の遺伝子の転写終結に機能するものであればよい。例としては、SV40ウイルスの後期ポリ(A)付加シグナルや、牛成長ホルモン遺伝子のポリ(A)付加シグナルなどが挙げられる。ただし、本態様の実施において使用可能なポリ(A)付加シグナルは、これに限定されるものではなく、ポリ(A)付加シグナルとしての機能を損なわない限りにおいては、遺伝子配列を改変したものを用いてもよい。
【0028】
[ラジカル産生ベクターの作製]
以下、本態様の1つであるベクターの1例について説明する。このベクターは、フリーラジカルを発生させる遺伝子にiNOS遺伝子に用いたベクターの1例である。
【0029】
マウスのiNOS遺伝子の塩基配列を配列番号1に示す。iNOS遺伝子の由来は、哺乳動物に由来するものであればよく、マウス由来のiNOS遺伝子限定されるものではない。例えば、ヒト、サル、ラットなどのiNOS遺伝子であってもよい。また、iNOS遺伝子は、その酵素活性(NO・合成活性)を失わない限りにおいては、配列番号1の塩基配列と完全に一致している必要はない。iNOS遺伝子は、既知の遺伝子工学手法によって取得すればよい。例えば、塩基配列に特異的なプライマーセットによるPCRで増幅して取得してもよい。または全塩基配列を人工的に合成してもよい。また既にベクターに組込まれたものを利用してもよい。
【0030】
本態様で使用するiNOS遺伝子は、変異型遺伝子であってもよい。iNOS変異型遺伝子の塩基配列を配列番号2と3に示す。該変異型遺伝子は、カルボキシ末端の21アミノ酸が欠失したiNOSタンパク質、及び、カルボキシ末端に31アミノ酸が付加されたiNOSタンパク質をそれぞれコードする。配列番号2と3に示した変異遺伝子は、マウス由来であるが、これに限定されるわけではなく、哺乳動物、例えばヒト、サル、ラットに由来する遺伝子であればよく、変異箇所も遺伝子の由来に応じた対応箇所に変異を導入してあればよい。このようなiNOSの変異型遺伝子は、既知の遺伝子工学手法によって取得することができる。例えば、変異を導入した特異的なプライマーセットによるPCRで増幅することが可能である。または変異遺伝子の全塩基配列を人工的に合成してもよい。
【0031】
上述のiNOS遺伝子の5’上流に、特定遺伝子のエンハンサー/プロモーターを、3’下流にポリ(A)付加シグナルを連結することによって、ベクターが作製される。図1に示したpSV40−NOS2が、iNOS遺伝子を組み込んだベクターの1例である。この例では、任意のプロモーターにSV40初期プロモーターを、ポリ(A)付加シグナルにSV40後期ポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。このようなベクターは、iNOS遺伝子を市販のベクターに組込むことによって作製してもよい。このベクターのプロモーター上流に、特定遺伝子のエンハンサーを組み込むことにより、本態様における細胞の状態を測定するベクターを作製することができる。
【0032】
図2に示したpXRE−SV40−NOS2が、上記ベクターのプロモーター上流にエンハンサーを組み込んだベクターの1例である。この例では、エンハンサーとして、チトクロム1A1遺伝子の発癌物質に応答するエンハンサーを組み込んでいる。エンハンサーの塩基配列を配列番号4に示す。このようなエンハンサーは、既知の遺伝子工学手法によって取得することができる。例えば、塩基配列に特異的なプライマーセットによるPCRで増幅して取得することができる。取得したエンハンサーは、既知の遺伝子工学手法によって、ベクターに組み込めばよい。
【0033】
図9に示したpCMV−iNOStrが、カルボキシ末端の21アミノ酸が欠失させた変異型iNOS遺伝子(配列番号2)を組み込んだベクターの1例である。この例では、任意のプロモーターにCMVプロモーターを、ポリ(A)付加シグナルに牛成長ホルモン遺伝子のポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。このようなベクターは、既知の遺伝子工学手法、例えば、PCRなどにより、遺伝子のコードを改変した変異型のiNOS遺伝子を作製して、市販のベクターに組込むことによって作製してもよい。
【0034】
図9に示したpCMV−iNOS−Fが、カルボキシ末端に31アミノ酸を付加した変異型iNOS遺伝子(配列番号3)を組み込んだベクターの1例である。この例では、任意のプロモーターにCMVプロモーターを、ポリ(A)付加シグナルに牛成長ホルモン遺伝子のポリ(A)付加シグナルを使用している。プロモーターとポリ(A)付加シグナルは、これに限定されるものではない。該変異型遺伝子は、カルボキシ末端にV5−ポリヒスチジン・タグ配列を含む31アミノ酸配列を付加している。このようなベクターは、既知の遺伝子工学手法、例えば、PCRなどにより、遺伝子のコードを改変した変異型iNOS遺伝子を作製して、市販のベクターに予め組み込まれたV5−ポリヒスチジン・タグ配列との融合遺伝子となるように作製してもよい。該変異型遺伝子を組み込む市販のベクターとしては、例えば、pcDNA4/V5−Hisベクターなどが挙げられる。この例では、カルボキシ末端にV5−ポリヒスチジン・タグ配列を含む31アミノ酸配列を付加した変異型iNOS遺伝子を挙げたが、変異型iNOS遺伝子がコードする変異型iNOSのNO・合成活性が向上する限りにおいては、カルボキシ末端に付加する配列は、V5−ポリヒスチジン・タグ配列でなくともよく、また付加するアミノ酸配列の長さも31アミノ酸に限定されるわけではない。
【0035】
[転写制御配列の活性に基づく産生フリーラジカル検出による細胞状態の測定]
本態様においてベクターを使用して、細胞の状態をフリーラジカル発生により測定する。
【0036】
以下に、本態様の1例として、iNOS遺伝子を組み込んだベクターを使用し、フリーラジカルとして一酸化窒素を発生させて細胞の状態を測定する方法について説明する。まず、ベクターを測定対象の細胞に導入して任意の期間にわたり培養する。このとき、測定対象の細胞は、ヒトやサルやマウスやラットなどの哺乳動物の細胞を選択することが望ましい。
【0037】
ベクターを宿主細胞に導入する方法は、既知の細胞工学手法を用いればよい。このような方法としては、例えば、生化学的な方法として、カチオン脂質を用いる方法(リポフェクション)、塩化カルシウムを用いる方法などが挙げられる。例えば、物理化学的な方法として、電気穿孔法などが挙げられる。
【0038】
このようにベクターを宿主細胞に導入した後、細胞を任意の期間にわたり培養する。この培養期間中に測定対象の細胞に対して、必要に応じて所望の細胞の状態を誘発する環境刺激、例えば、化学物質、低酸素ストレスおよび/または温度ストレスなどを与えればよい。これにより、細胞に与えた環境刺激に応じて、刺激に対応して活性化したエンハンサー/プロモーターが、iNOS遺伝子の転写・翻訳を促進し、iNOSタンパク質が合成される。iNOSタンパク質は、細胞内のL-アルギニンから一酸化窒素(NO・)を合成する。この一酸化窒素の合成量を測定することにより、細胞の状態を測定することができる。
【0039】
例えば、一酸化窒素の合成されたことが測定された場合、または合成量が増加した場合に、当該細胞に導入されたエンハンサー/プロモーターが活性化されたことが分かる。即ち、この細胞の状態または環境が、当該エンハンサー/プロモーターが活性化される状態または環境であると判定される。従って、当該エンハンサー/プロモーターが活性化される状態または環境が細胞の癌化であれば、当該細胞が癌化している、または癌化している可能性が高いことが予測できる。或いは、当該エンハンサー/プロモーターが活性化される状態または環境が、低酸素環境であれば、フリーラジカルの産生または産生の大きさにより当該細胞が低酸素環境にあると判定される。
【0040】
一酸化窒素の測定方法としては、電子スピン共鳴装置による方法や一酸化窒素特異的な蛍光プローブを使用する方法がある。電子スピン共鳴装置による方法では、一酸化窒素を直接測定してもよいし、特異的なスピントラップ剤で一酸化窒素をトラップしてから、これを測定してもよい。一酸化窒素のスピントラップ剤としては、例えば、N−メチルグルカミンジチオカルバメート(MGD)やジエチルジチオカルバメート(DETC)やN−ジチオカルボキシルサルコシン(DTCS)やカルボキシPTIOが挙げられる。これらのスピントラップ剤を細胞に暴露した後に、電子スピン共鳴装置で測定することにより、細胞で発生した一酸化窒素を定量的に測定することができる。一酸化窒素特異的な蛍光プローブとしては、例えば、ジアミノフルオロセイン(DAF2)やこの誘導体が挙げられる。このような蛍光プローブを細胞に暴露した後に、蛍光測定装置で測定することにより、細胞で発生した一酸化窒素を定量的に測定することができる。
【0041】
[組織中の転写制御配列活性を産生フリーラジカルにより検出するシステム]
本態様のベクターを用いることにより、組織中において特定遺伝子の転写制御配列が活性化した細胞を検出することも可能である。以下に、本態様の1例として、iNOS遺伝子を組み込んだベクターを使用し、フリーラジカルとして一酸化窒素を発生させて細胞の状態を測定する方法について説明する。まず、pSV40−NOS2ベクターのSV40プロモーターの上流に目的とするプロモーターを組み込んだベクターと、スピントラップ剤、カチオン脂質を混合して、脂質膜小胞内にベクターとスピントラップ剤を封入する。このとき、一酸化窒素のスピントラップ剤としては、例えば、N−メチルグルカミンジチオカルバメートやジエチルジチオカルバメートやN−ジチオカルボキシルサルコシンやカルボキシPTIOが挙げられる。ベクターとスピントラップ剤を内包する脂質膜小胞は、組織への直接の塗布または血中への拡散により、確率的に組織と接触し細胞膜と融合することで、内容物を細胞内へ運搬する。これらの工程は、電子スピン共鳴装置(ESR)の外で行われてもよいが、ベクターとスピントラップ剤の生体への導入工程の後、ESR装置で検出できる体勢をとることが望ましい。
【0042】
次に任意の時間放置することで、目的とするプロモーターが活性化する細胞においては、ベクターが転写活性化され、iNOSタンパク質の発現が誘導される。iNOSタンパク質は、細胞内のL−アルギニンから一酸化窒素を合成するため、目的とするプロモーターの活性化の度合いに応じて、一酸化窒素が産生される。産生した一酸化窒素は細胞内にベクターと共に導入されたスピントラップ剤でトラップされる。任意の時間の後、信号源から任意の周波数のマイクロ波を発振し、スピントラップ剤に特異的なスピンシグナルを検出する。同時に、シグナル取得部位の位置情報を取得することにより、スピンシグナル検出部位を同定することができる。図8にその工程を示した。
【0043】
図8を参照して説明する。まず、対象となる組織に当該レポーター遺伝子構築物とラジカルスピントラップ剤を用意する。これらをカチオン性脂質と混合して脂質膜小胞内に封入する。次に、得られた脂質膜小胞内を生体内組織に接触させ、細胞内へ確率的に導入する。導入された当該レポーター遺伝子構築物におけるレポーター遺伝子が発現し、フリーラジカルが発生するために必要な長さの時間インキュベーションする。対象となる組織に対してマイクロ波を発振させ、スピントラップ剤についてラジカル特異的なスペクトルを検出する。組織においてスペクトルの検出された位置情報を検出する。検出されたスペクトルについての情報と検出位置情報から組織におけるラジカル産生部位を同定する。これにより、組織において当該転写制御配列活性が活性化される環境にある細胞を検出することが可能である。
【0044】
当該レポーター遺伝子からのフリーラジカルは、例えば、電子スピン共鳴測定装置により測定することが可能である。電子スピン共鳴測定装置における測定は、検出しようとする細胞を含む細胞群、組織および/または組織切片などについてインビトロでの検出、並びに生体に含まれる細胞および/または組織についてインビボでの検出が可能である。
【0045】
[電子スピン共鳴測定装置]
実施形態の磁気共鳴測定装置は、検出対象に関する核磁気共鳴(NMR)および/または電子スピン共鳴(ESR)などの磁気共鳴を利用して被測定物を検査または測定する装置である。
【0046】
図4に示すように、実施形態の磁気共鳴測定装置の原理は、マイクロ波信号を生ずるように構成された発信器(20)と、それに接続され、前記発信器からの信号を被測定物である検査試料に対して送るように構成された送信器(21)と、前記検査試料(22)を挟み前記送信器と対向する位置に配置され、前記検査試料からの信号を受けるように構成された受信器(23)と、それに接続された帯域幅BW(MHz)の狭帯域フィルタ(24)と、それに接続され、受信器からの信号を増幅し、予め設定された情報に前記増幅された信号を処理するように構成された受信回路(25)と、前記検査試料(22)に対して磁場を印加するように構成された磁場発生器(26)とを具備する。
【0047】
発信器(20)は、マイクロ波信号を出す信号源と、信号源からの信号を増幅する増幅器と、増幅された信号を検査試料に送る送信器を含んでよい。送信器(11)は、検査試料に対して指向性のあるそれ自身公知の何れかの送信器であればよく、例えば、、送信アンテナである。
【0048】
磁場発生器(26)は、検体試料に対して磁場を与えることが可能な磁場発生器であればよく、例えば、一般的にNMR装置およびESR装置に使用される何れかの磁場発生器であってよい。
【0049】
受信器(23)は、検査試料を得て送られる信号を受けることが可能なそれ自身公知の何れかの受信器であればよく、例えば、受信アンテナである。
【0050】
狭帯域フィルタ(24)は、受信器(23)からの信号から所望の周波数の信号を分離するための手段である。
【0051】
狭帯域フィルタの実施形態として、マイクロストリップラインを用いた超伝導フィルタのレイアウト例を図5に示す。マイクロストリップラインを用いたくし型共振器(303)7個のフィルタであり、A−A’の断面構造を図6に示す。マイクロストリップラインは誘電体基板(304)の片面に信号導体(301)、もう一面がグランド導体(306)からなる一般的な高周波用の導波路であり、くし型共振器(303)の長さが共振周波数を決めており、フィルタとしての通過する周波数帯の中心周波数を決めている。また、入力線路(301)や出力線路(302)とくし型共振器(303)の距離やくし型共振器(303)間の距離を最適にすることにより帯域幅が決定できる。このようなフィルタは、超伝導フィルタ信号導体とグランド導体に超伝導体を用いてよい。
【0052】
超伝導体としてはNb3Sn、MgB2、イットリウム系高温超伝導体(YBa2Cu3O7−x)、ビスマス系高温超伝導体(Bi2Sr2CaCu2O8+x、Bi2Sr2Ca2Cu3O10+x)をはじめ各種材料を利用できる。
【0053】
従来の疾患早期においては、対象となる組織でプロモーター活性が変化している前疾患化状態にある細胞の数は少数である。従って、体外診断を行うために採取した細胞中に当該細胞の含まれる確率は高いとはいえず、インビボにおいて、プロモーター活性を検出することが求められている。現在行われているインビボにおけるプロモーター活性のイメージング技術には、ルシフェラーゼの発光を超高感度CCDを用いて検出する方法や、GFPなどの蛍光を蛍光分子トモグラフィによって検出する方法がある。しかしながら、これらの方法はいずれも光学的な検出である。そのため、体内の深部(概ね2cm以上)における発光および/または蛍光は減衰してしまう。そのため、厚さが概ね2cm以内の組織中の活性を検出する小動物用の検出方法として適用されるにすぎない。
【0054】
本様態の如く、フリーラジカルを指標とすれば光学的手法に限定されず、検出が可能である。非光学的法を適用すれば、従来どおり生体などのサンプル浅部のみならず深部においてもプロモーターおよび/またはエンハンサーなどの転写制御配列の活性化の有無または活性化の程度を測定は可能である。それにより目的とする疾患、例えば、癌化を早期に発見することが可能になる。また、本態様のレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせて測定することにより、サンプル深部におけるプロモーターおよび/またはエンハンサーなどの転写制御配列の活性化の有無を非侵襲性に検出することが可能である。本態様に従うレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせによる検出方法であれば、より正確なより早期の疾患の診断が可能となる。
【0055】
また、例えば、早期癌化細胞を検出する場合、当該細胞を検出するのと同時に、レポーター遺伝子構築物から産生されたフリーラジカルにより疾患細胞を傷害することも可能である。細胞障害性は、レポーター遺伝子構築物の細胞への貯留時間およびそこに含まれるレポーター遺伝子の種類、放出されるラジカル種および量を任意に選択することにより変更することが可能である。
【0056】
また、同様に、細胞群、組織または生体において特定の環境または状態を有する細胞を検出することが可能である。ラジカルをレポーターとすることにより、測定対象に対して非侵襲的に検出が可能であり、例えば、インビボ、インビトロおよびエクスビボなど種々の検出を有利に行うことが可能である。
【0057】
[アッセイキット]
上述の態様に従う電子スピン共鳴測定装置と、当該レポーター遺伝子構築物とを利用して転写制御配列の活性化の有無または活性化の程度を測定する方法において使用するためのアッセイキットも提供される。
【0058】
そのようなアッセイキットは、上述の何れかの当該レポーター遺伝子構築物と、そこに含まれるレポーター遺伝子に対応するスピントラップ剤とを含めばよい。例えば、レポーター遺伝子が何れかのNOSである場合、スピントラップ剤は、一酸化窒素をトラップするための薬剤であればよく、例えば、N−メチルグルカミンジチオカルバメート、ジエチルジチオカルバメート、N−ジチオカルボキシルサルコシンおよびカルボキシPTIOからなる群より少なくとも1選択されるスピントラップ剤であってよい。また、電子スピン共鳴測定装置では、複数の狭帯域フィルタと受信回路とを含む構成とすることにより、異なるラジカル種について同時に測定することも可能である。当該アッセイキットは、複数種類のレポーター遺伝子を夫々に含むレポーター遺伝子構築物と、それらの各レポーター遺伝子により産生されるラジカル種に対応するスピントラップ剤を含んでもよい。更に、当該アッセイキットは、レポーター遺伝子構築物とスピントラップ剤を封入し脂質膜小胞を得るための脂質を更に含んでもよい。そのような脂質は、例えば、カチオン性脂質、塩基性ポリマー、合成ポリペプチドおよび炭酸アパタイトなどのイオンコンプレックス型キャリアであってよい。また更に、当該アッセイキットは、取り扱い説明書および/または脂質膜小胞を調製するための容器を含んでもよい。
【0059】
このようなアッセイキットは、簡便および/または迅速に目的とする方法を行う上で有効である。
【0060】
[例]
例1 iNOSベクターの作製
レポーター遺伝子として、一酸化窒素合成酵素2(iNOS)遺伝子を用いたiNOSベクターを作製した。シミアンウイルス40(SV40)初期プロモーター:ホタルのルシフェラーゼ遺伝子::SV40ポリA付加シグナルで構成される発現カセットを持つPGV−P2ベクター(東洋ビーネット)を制限酵素Hin dIIIで消化し、5’突出末端をE.coli DNAポリメラーゼのKlenow fragmentで平滑端化した。さらに制限酵素Xba Iで消化し、ルシフェラーゼ遺伝子を取り除いたPGV−P2のベクター断片を調整した。このベクター断片に、マウスのiNOS遺伝子を組み込んだ。マウスiNOS遺伝子のcDNA配列が組み込まれたpSPORT6ベクター(pNOS2)をライフテクノロジーズより入手し、これを制限酵素Sma IとXba Iで消化してiNOS遺伝子のcDNA断片を得た。このcDNA断片を、先に調整したPGV−P2のベクター断片にT4リガーゼで連結してiNOSベクター:pSV40−NOS2を作製した(図1)。
【0061】
例2 iNOSベクターによる発癌性に応答した一酸化窒素(NO・)の検出
発癌物質に応答するエンハンサー領域をiNOSベクター:pSV40−NOS2に組み込んだ。チトクロム1A1遺伝子の発癌物質(ヘンゾピレン)応答エンハンサー領域(配列番号4)を、マウスのゲノムからPCRで増幅した。増幅したエンハンサー領域の5’末端をT4ポリヌクレオチドキナーゼでリン酸化した後、制限酵素Sma Iで消化しアルカリホスファターゼで5’末端を脱リン酸化したpSV40−NOS2にT4リガーゼで連結してpXRE−SV40−NOS2を作製した(図2)。このベクターを用いて、発癌物質によるエンハンサー領域の活性化と、iNOSによる一酸化窒素(NO・)の合成量の相関を調べた。
【0062】
マウスの神経芽細胞腫Neuro2a(アメリカン・タイプ・セル・カルチャー)を8.0x104細胞/ウェルの密度で24ウェル・プレートに播種し、10%牛胎児血清(FCS)を加えたDMEM/F12等比混合培地(DF1:1培地)を用いて、37℃、5%CO2雰囲気下で一晩培養した。Opti−MEM培地50μLにリポフェクタミン2000(ライフテクノロジーズ)2.0μLを加えて室温に5分間インキュベートした。この溶液と、0.8μgのpXRE−SV40−NOS2を加えたOpti−MEM培地50μLとを混合して室温に20分間インキュベートして一晩培養したNeuro2aに加え、37℃、5%CO2雰囲気下で培養した。24時間後、Neuro2aの培地を取り除き、ジメチルスルホキシド(DMSO)、或いはベンゾピレン(BaP)を1.0μM含むDF1:1培地(10%FCS)を加え、37℃、5%CO2雰囲気下で培養した。24時間後、培地を取り除き、DF1:1培地(w/o FCS)で2回洗浄した後、一酸化窒素(NO・)検出用の蛍光プローブであるジアミノフルオロセイン−2,2酢酸(DAF2−DA、積水メディカル)を10μM含むDF1:1培地(w/o FCS)を加えて37℃にインキュベートした。2時間後、細胞をリン酸緩衝液(PBS)で2回洗浄し、倒立型蛍光顕微鏡でDAF−2DAと一酸化窒素(NO・)の反応生成物(DAF−2T、励起波長:495nm、蛍光波長:515nm)による蛍光を観察した。図3(a)にはジメチルスルホキシド(DMSO)を添加したときの結果を、図3(b)にはベンゾピレン(Bap)を添加したときの結果を示す。
【0063】
図3に示したとおり、ベンゾピレン暴露細胞において、一酸化窒素(NO・)合成量の増加による蛍光の誘導が観察された。ベンゾピレンによるエンハンサー領域の活性化とiNOSによる一酸化窒素(NO・)発生量増加の相関が示された。
【0064】
例3 変異型iNOSベクターの作製
pNOS2を制限酵素Sal I/Eco RVで切断し、iNOS遺伝子の5’−非翻訳領域とコード領域を含む遺伝子断片を切り出した。この断片を制限酵素Sal I/Eco RVで切断したpBluescriptII SK(−)ベクターに組込み、pNOS2−RVを作製した。次に、pNOS2を鋳型に、変異プライマーを用いたPCRにより、iNOS遺伝子3’−末端側を改変したDNA断片を増幅した。変異は、リバースプライマーに導入し、フォワードプライマーは同一のものを用いた。以下に、フォワードプライマーと、2種類の変異を導入したリバースプライマーの塩基配列を示した。
【0065】
フォワードプライマー:5’−GGCAGAGATTGGAGGCCTTGTGT(配列番号5)
リバースプライマー1: 5’−AGGTCTAGATTCAACCGAAGATATCTTCAT (配列番号6、iNOStr)
リバースプライマー2: 5’−CTCTGTCTAGACCGAGCCTCGTGGCTTTGGGC(配列番号7、iNOS−F)
iNOStrは、野生型iNOSのカルボキシ末端(C−末端)から21アミノ酸残基を欠失させるため、リバースプライマーに野生型iNOSの1125番目の終止コドンをグリシンに置換する変異を導入した。iNOS−Fは、野生型iNOSにV5−ポリヒスチジン・タグ配列が付加されるように、リバースプライマーに野生型iNOSの終止コドンを除去する変異を導入した。プライマーには、増幅断片のクローニングを容易にするため、制限酵素の認識配列を付加した(Stu I、或いはXba Iの認識配列)。
【0066】
上記プライマーを用いたPCRで増幅したDNA断片をStu IとXba Iで切断し、これを同様にStu IとXba Iで切断したpNOS2−RVに組込んで、2種類の変異型iNOS遺伝子を作製した(piNOStr、piNOS−F)。
【0067】
最後に、piNOStrとpiNOS−Fを、Kpn IとXba Iで切断して変異iNOS遺伝子を切り出し、これを同様にKpn IとXba Iで切断したpcDNA4/V5−His B(ライフテクノロジーズ)に組込んで、変異型iNOSベクター:pCMV−iNOStrとpCMV−iNOS−Fを作製した。図9Aおよび図9Bにその概要を示す。図9Bは図9Aの続く図面である(図9Aおよび図9B)。図9Aの最下段の矢印とその右側の記載は、図9Bの最上段の矢印とその右側の記載と同一の「消化(digestion)」処理について示すものである。図9Aと図9Bの記載内容の連続性をより分かり易く記載するためのものである。
【0068】
例4 変異型iNOSベクターによる一酸化窒素(NO・)の検出
マウスの神経芽細胞腫Neuro2a(アメリカン・タイプ・セル・カルチャー)を8.0x104細胞/ウェルの密度で24ウェル・プレートに播種し、10%牛胎児血清(FCS)を加えたDMEM/F12等比混合培地(DF1:1培地)を用いて、37℃、5%CO2雰囲気下で一晩培養した。Opti−MEM培地50μLにリポフェクタミン2000(ライフテクノロジーズ)2.0μLを加えて室温に5分間インキュベートした。この溶液と、0.8μgの野生型または変異型iNOSベクター(pCMV−iNOStr、pCMV−iNOS−F、pNOS2)を加えたOpti−MEM培地50μLとを混合して室温に20分間インキュベートして一晩培養したNeuro2aに加え、37℃、5%CO2雰囲気下で培養した。24時間後、Neuro2aの培地を取り除き、DF1:1培地(w/o FCS)で2回洗浄した後、一酸化窒素(NO・)検出用の蛍光プローブであるジアミノフルオロセイン−2,2酢酸(DAF2−DA、積水メディカル)を10μM含むDF1:1培地(w/o FCS)を加えて37℃にインキュベートした。2時間後、細胞をリン酸緩衝液(PBS)で2回洗浄し、倒立型蛍光顕微鏡でDAF−2DAと一酸化窒素(NO・)の反応生成物(DAF−2T、励起波長:495nm、蛍光波長:515nm)による蛍光を観察した。図10の(a)は、野生型iNOS導入細胞についての結果である。図10(b)および図10(c)は変異型iNOS導入細胞についての結果であり、図10(b)はpCMV−iNOStr導入細胞、図10(c)はpCMV−iNOS−F導入細胞についての結果である。
【0069】
図10に示したとおり、変異型iNOS導入細胞(pCMV−iNOStr導入細胞とpCMV−iNOS−F導入細胞)において、一酸化窒素(NO・)合成量の増加による蛍光の増加が観察された。変異型iNOSが、野生型iNOSよりも高い一酸化窒素(NO・)発生量能を有することが示された。
【0070】
例5 アッセイキット
レポーター遺伝子としてNOS遺伝子を含むレポーター遺伝子構築物と、N−メチルグルカミンジチオカルバメート(MGD)と、カチオン性脂質と、脂質膜小胞を調製するための容器と、取り扱い説明書とを含むアッセイキットを組み合わせ、樹脂製包材に梱包してアッセイキットとする。
【0071】
例6 電子スピン共鳴測定装置の例
図7は、当該レポーター遺伝子構築物を用いて細胞検出を行うための電子スピン共鳴測定装置の1例を示す概略ブロック図である。
【0072】
実施形態の電子スピン共鳴測定装置は、発信器として、マイクロ波を生ずるように構成された発信回路と、生じたマイクロ波を増幅する増幅器を含む送信信号発生器(201)を含む。送信信号発生器(201)から出た信号を稼動可能な送信アンテナ(203)から被測定物(205)に印加する。印加に先駆けて、当該レポーター遺伝子構築物とラジカルスピントラップ剤をカチオン性脂質と混合して膜粒子内に封入して脂質膜小胞を準備する。この脂質膜小胞を被測定物(205)の測定領域に添加し、脂質膜小胞内のレポーター遺伝子構築物を当該領域の細胞に導入する。導入された当該レポーター遺伝子構築物におけるレポーター遺伝子が発現し、フリーラジカルが発生するために必要な長さの時間インキュベーションする。その後、被測定物(205)に印加する。
【0073】
またこのとき、被測定物(205)は、磁場発生器(204)から生じた磁場内に位置される。磁場発生器(204)は、磁場変調器(202)により制御され、磁場を変調可能である。印加された磁場内の被測定物(205)からの信号は、受信アンテナ(206)により受信される。このとき、送信アンテナ(203)の位置情報が、送信アンテナ位置の検出手段である位置情報検出器としての画像入力部(213)から得られ、その位置情報は、制御部(210)に送られる。得られた位置情報に基づいた制御による制御部(210)による制御により、可動可能な受信部(230)が移動する。即ち、制御部(210)による制御により、受信部(230)を支持する受信部移動装置(212)が移動し、それにより受信部(230)が位置を移動し、磁場内で送信アンテナ(203)からの信号を印加された被測定物(205)からの信号を受ける。受信部(230)は、受信アンテナ(206)と、それに接続された狭帯域フィルタ(207)と、それに接続された低雑音増幅器(208)と、それに接続された検波部(209)を具備する。受信アンテナ(206)により受信された信号は、狭帯域フィルタ(207)により分波され、得られた分波された信号は低雑音増幅器(208)により増幅され、検波部(209)に送られる。検波部(209)は、ミキサおよびローカル信号源などによる周波数変換器と、信号処理回路とを含む。検波部(209)では、送られた信号について周波数変換器が周波数変換した後、信号の大きさと、画像入力部(213)から得られた位置情報および画像などの情報並びに予め記憶されたプログラムおよび/またはテーブルなどの情報に基づいて、当該周波数変換された信号を、信号処理回路により処理し、表示部(211)に情報を表示する。
【0074】
このような実施形態の電子スピン共鳴測定装置では、送信アンテナ(203)と受信アンテナ(206)の受信位置から被測定物(205)の測定断面位置を変更しての評価することが可能となる。このときに各測定断面位置で、磁場変調器(202)により磁場発生器(204)を制御し、磁場を変調して評価を行うことも可能である。磁場変調器(202)の制御は、予め記憶されたプログラムおよび/またはテーブルなどの情報に基づいて制御部(210)により行われてもよく、更に制御部に接続された入力部(図示せず)から、オペレータにより入力された情報に基づいて制御されてもよい。制御部はコンピュータであってもよい。
【0075】
検波部(209)は、ミキサおよびローカル信号源などによる周波数変換器と、例えば、コンピュータなどの信号処理回路とを含む。当該信号処理回路は、当該磁気共鳴測定装置を構成する他の構成要素、例えば、検波部(209)および/または制御部(210)などと一体化されて具備されてもよく、他の構成要素からは別の構成要素として互いに信号を送受信可能な状態で接続されて具備されてもよい。信号処理回路は、例えば、コンピュータであってよい。
【0076】
表示部(211)への情報の表示は、画像入力装置(213)からの画像と、測定された磁気共鳴信号に基づく評価情報が組み合わされた形式で表示部(211)に表示されてもよい。
【0077】
送信アンテナは、オペレータが手に持って、任意の位置に動かしてもよく、可動可能な支持体に固定して、オペレータの手動により、または制御部の制御により任意の位置に動かしてもよい。
【0078】
2次元のスライス画像や3次元のイメージング画像を作成する場合には一般的なMRI等の装置と同様の方法が利用可能である。例えば、静磁場とは別に、距離に比例した強度を持つ磁場(即ち、傾斜磁場)をかけ、傾斜磁場によって電子スピンの位相や周波数が変化する情報を得ればよい。実際に観測するのは個々の信号の合成されたものであるから、得られた信号を解析する際に二次元ないし三次元のフーリエ変換を行うことで個々の位置の信号(即ち、各位置における電子スピンに比例する)に分解し、画像情報を得ればよい。得られた画像情報を元にESR評価情報の被測定物の表面情報を画像入力装置の実画像に合わせたり、別に取得したMRIやX線CTなどの情報に重ねて表示したりすることが可能である。これにより、より多くの情報を提供することが可能となる。そのような機能を当該磁気共鳴測定装置に付与する場合には、必要に応じてそれ自身公知の構成要素を当該磁気共鳴測定装置の構成要素に追加すればよい。
【0079】
上述した例では、画像情報を元に送信アンテナ位置を特定する例を示したが、送信アンテナ自身にジャイロを内蔵させて基準位置からの変位データを取得する方法など、それ自身公知の何れか他の送信アンテナの位置検出方法も利用することが可能である。
【0080】
従来、電子スピン共鳴法は、非光学的検出として、体内の微弱な電子スピンシグナルを検出することが可能であるが、この電子スピン共鳴法によって、特定プロモーター活性を検出する方法についてはこれまで報告はない。
【0081】
本態様の電子スピン共鳴測定装置と上述した当該レポーター遺伝子構築物とを組み合わせることにより、目的とする疾患、例えば、癌化を早期に発見することが可能になり、生体深部における疾患をも非侵襲性に検出することが可能である。例えば、慢性炎症により正常幹細胞から癌性幹細胞に変化した場合における遺伝子転写環境の変化も生体において検出することが可能になる。従って、本態様に従うレポーター遺伝子構築物と電子スピン共鳴測定装置を組み合わせによる検出方法により、より正確なより早期の疾患の診断が可能となる。
【0082】
以上のような本態様により、組織中の特定プロモーターを検出し、疾患の早期診断等の用途に利用可能である。また、プロモーター活性に応じたラジカル産生に基づいて、特定のプロモーター活性をラジカル産生量と置換することによって電子スピン共鳴により検出する方法および装置が提供される。これらの方法および装置も本出願の範囲内に含まれる。
【符号の説明】
【0083】
20 発信器、21 送信器、22 検査試料、23 受信器、24 バンドパスフィルタ、25 受信回路、26 磁場発生器、201 送信信号発生器、202 磁場変調器、203 送信アンテナ、204 磁場発生器、205 被測定物、206 受信アンテナ、207 狭帯域フィルタ、208 低雑音増幅器、209 検波部、210 制御部、211 表示部、212 受信部移動器、213 画像入力部、303 くし型共振器、304 誘電体基板、305 信号導体、306 グランド導体
【特許請求の範囲】
【請求項1】
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物。
【請求項2】
前記タンパク質がフリーラジカル産生酵素である請求項1に記載のレポーター遺伝子構築物。
【請求項3】
前記タンパク質が、iNOS、nNOS、eNOSおよびキサンチノキシダーゼからなる群より選択される請求項2に記載のレポーター遺伝子構築物。
【請求項4】
前記転写制御配列が、疾患関連遺伝子のエンハンサーおよび/またはプロモーターである請求項1〜3の何れか1項に記載のレポーター遺伝子構築物。
【請求項5】
前記転写制御配列が、myc遺伝子、fos遺伝子およびras遺伝子からなる群より選択される請求項4に記載のレポーター遺伝子構築物。
【請求項6】
前記転写制御配列が、サイトメガロウイルスイミディエートプロモーター、シミアンウイルス40アーリープロモーターおよびヒルペスシンプレックスウイルスチミジンキナーゼからなる群より選択されたプロモーター配列であり、環境に依存して活性化される遺伝子のエンハンサーの挿入部位を前記プロモーター配列の上流に更に具備する請求項1〜3の何れか1項に記載のレポーター遺伝子構築物。
【請求項7】
前記エンハンサーが疾患関連遺伝子のエンハンサーである請求項6に記載のレポーター遺伝子構築物。
【請求項8】
前記エンハンサーが、myc遺伝子、fos遺伝子およびras遺伝子からなる群より選択される遺伝子のエンハンサーである請求項7に記載のレポーター遺伝子構築物。
【請求項9】
前記レポーター遺伝子の下流に更に転写終結遺伝子を含む請求項1〜8の何れか1項に記載のレポーター遺伝子構築物。
【請求項10】
インビトロにおいて細胞の環境を測定する方法であって、
(1)請求項1〜9の何れか1項に記載のレポーター遺伝子構築物を細胞に導入することと、
(2)前記細胞から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて前記細胞の環境を判定することと
を具備する方法。
【請求項11】
インビトロにおいて、細胞を検出する方法であって、
(1)請求項1〜9の何れか1項に記載のレポーター遺伝子構築物を細胞群に導入することと、
(2)前記細胞群から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて、フリーラジカルを生じた細胞を検出することと
を具備する方法。
【請求項12】
前記(2)の検出が、スピントラップ剤の存在下で電気スピン共鳴スペクトルを検出することにより行われる請求項10または11に記載の方法。
【請求項13】
請求項12に記載の方法を行うためのアッセイキットであって、
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含み、細胞内で発現可能なレポーター遺伝子構築物と、
スピントラップ剤と、
を含むアッセイキット。
【請求項14】
請求項13に記載のアッセイキットであって、前記フリーラジカルがNO・であり、前記レポーター遺伝子が、iNOS、nNOS、eNOSおよびキサンチノキシダーゼからなる群より選択されるタンパク質をコードする遺伝子であり、前記スピントラップ剤が、N−メチルグルカミンジチオカルバメート、ジエチルジチオカルバメート、N−ジチオカルボキシルサルコシンおよびカルボキシPTIOからなる群より選択されるアッセイキット。
【請求項1】
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含むレポーター遺伝子構築物。
【請求項2】
前記タンパク質がフリーラジカル産生酵素である請求項1に記載のレポーター遺伝子構築物。
【請求項3】
前記タンパク質が、iNOS、nNOS、eNOSおよびキサンチノキシダーゼからなる群より選択される請求項2に記載のレポーター遺伝子構築物。
【請求項4】
前記転写制御配列が、疾患関連遺伝子のエンハンサーおよび/またはプロモーターである請求項1〜3の何れか1項に記載のレポーター遺伝子構築物。
【請求項5】
前記転写制御配列が、myc遺伝子、fos遺伝子およびras遺伝子からなる群より選択される請求項4に記載のレポーター遺伝子構築物。
【請求項6】
前記転写制御配列が、サイトメガロウイルスイミディエートプロモーター、シミアンウイルス40アーリープロモーターおよびヒルペスシンプレックスウイルスチミジンキナーゼからなる群より選択されたプロモーター配列であり、環境に依存して活性化される遺伝子のエンハンサーの挿入部位を前記プロモーター配列の上流に更に具備する請求項1〜3の何れか1項に記載のレポーター遺伝子構築物。
【請求項7】
前記エンハンサーが疾患関連遺伝子のエンハンサーである請求項6に記載のレポーター遺伝子構築物。
【請求項8】
前記エンハンサーが、myc遺伝子、fos遺伝子およびras遺伝子からなる群より選択される遺伝子のエンハンサーである請求項7に記載のレポーター遺伝子構築物。
【請求項9】
前記レポーター遺伝子の下流に更に転写終結遺伝子を含む請求項1〜8の何れか1項に記載のレポーター遺伝子構築物。
【請求項10】
インビトロにおいて細胞の環境を測定する方法であって、
(1)請求項1〜9の何れか1項に記載のレポーター遺伝子構築物を細胞に導入することと、
(2)前記細胞から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて前記細胞の環境を判定することと
を具備する方法。
【請求項11】
インビトロにおいて、細胞を検出する方法であって、
(1)請求項1〜9の何れか1項に記載のレポーター遺伝子構築物を細胞群に導入することと、
(2)前記細胞群から生じたフリーラジカルを検出することと、
(3)前記検出の結果に基づいて、フリーラジカルを生じた細胞を検出することと
を具備する方法。
【請求項12】
前記(2)の検出が、スピントラップ剤の存在下で電気スピン共鳴スペクトルを検出することにより行われる請求項10または11に記載の方法。
【請求項13】
請求項12に記載の方法を行うためのアッセイキットであって、
環境に依存して活性化される転写制御配列と、その下流に機能的に結合され、前記転写制御配列の活性化によってフリーラジカルを発生させるタンパク質をコードするレポーター遺伝子とを含み、細胞内で発現可能なレポーター遺伝子構築物と、
スピントラップ剤と、
を含むアッセイキット。
【請求項14】
請求項13に記載のアッセイキットであって、前記フリーラジカルがNO・であり、前記レポーター遺伝子が、iNOS、nNOS、eNOSおよびキサンチノキシダーゼからなる群より選択されるタンパク質をコードする遺伝子であり、前記スピントラップ剤が、N−メチルグルカミンジチオカルバメート、ジエチルジチオカルバメート、N−ジチオカルボキシルサルコシンおよびカルボキシPTIOからなる群より選択されるアッセイキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9A】


【図9B】


【図10】


【公開番号】特開2012−65612(P2012−65612A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2010−214480(P2010−214480)
【出願日】平成22年9月24日(2010.9.24)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成22年9月24日(2010.9.24)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

