レーザ外科装置及びその使用方法
【課題】レーザは作用期間を短期間に維持して作用面内の局在化を行うという事実にもかかわらず、特に皮膚外被内の浸透の深さに関しては、治療の制御を保証していない。したがって、機能不全な瘢痕の形成及びレーザビームの健康な皮膚領域への浸透等の欠点を除去する。
【解決手段】生体組織を蒸発させるレーザ外科装置10は、手術用レーザアセンブリ22、24、26、28、30、32、34と、検出装置48と、制御ユニット14とからなる。手術用レーザアセンブリは、水のピーク吸収波長に相当する所定波長を有する手術用ビームを生成する。検出装置は、制御信号を生成するために、手術される生体組織から反射される信号を受信してチェックすることによって、手術される生体組織の状態を検出するようになっている。制御ユニットは、制御信号に基づいて手術用ビームの特性を制御するので、生体組織の蒸発の深さは、15〜20ミクロンを越えない。
【解決手段】生体組織を蒸発させるレーザ外科装置10は、手術用レーザアセンブリ22、24、26、28、30、32、34と、検出装置48と、制御ユニット14とからなる。手術用レーザアセンブリは、水のピーク吸収波長に相当する所定波長を有する手術用ビームを生成する。検出装置は、制御信号を生成するために、手術される生体組織から反射される信号を受信してチェックすることによって、手術される生体組織の状態を検出するようになっている。制御ユニットは、制御信号に基づいて手術用ビームの特性を制御するので、生体組織の蒸発の深さは、15〜20ミクロンを越えない。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、医療用レーザに関し、特に、外科用レーザ装置と皮膚科におけるその使用方法に関する。
【背景技術】
【0002】
様々なレーザが、先天性及び後天的な皮膚の異常及び病気を矯正するために、現代の皮膚科において使用されている。この分野におけるレーザの広範囲の急増の理由の一つは、その性質が医学的な需要をサポートする、すなわち患者を傷つけないからである。
【0003】
薬療法は、主に皮膚科における治療として最も広く使用されてきた。何となれば、薬療法は、容易に利用でき、簡単且つ無痛であるからである。しかし、相当数の疾患の治療における効率の低さと同じように、薬過敏症、副作用、一般のアレルギ反応によって、この治療は、妥当なものではなくなっている。
【0004】
皮膚科の異常及び病気のより効率的な治療に対する需要によって、外科的な処置はこの分野においてかなり一般的になった。皮膚疾患の治療の外科的な方法に関して、医者は、大抵、以下の処置、すなわち、移植の前の切開、超音波及びクライオセラピィの使用、放射をイオン化する磁場の印加、電気凝固法、プラズマ電流の使用等に頼らざるを得ない。これらの外科的方法は、以下に示す多くの欠点及び有害な副作用にもかかわらず使われている。かかる欠点及び有害な副作用は、治療の破壊的な性質、慢性化する治療プロセス、色素沈着低下の高い危険性、萎縮の可能性、皮膚組織の破壊、瘢痕の形成、健康な領域を含む隣接の皮膚領域への損傷を含む。外科医が、皮膚外被の所定の深さで、一定且つ短期間の作用時間のローカルな治療方法を用いるとき、これらの問題はしばし軽減される。これは、レーザが最近多くの皮膚科医によって選択される機器になった理由の1つである。
【0005】
現在、レーザ照射の異なる波長を有するレーザが、皮膚科において使われている。かかるレーザは、例えば、エキシマレーザ、ルビーレーザ、アルゴンレーザ、アレクサンドライトレーザ、ガーネットレーザ、調節自在半導体レーザ等である。これらの装置は、可視光線と同じスペクトル(0.4〜0.7μm)とUV範囲(0.18〜0.40μm)との波長を有するレーザビームを生成する。たとえば、赤外線レーザは、一組のCO2レーザ(波長が10.6μm)と、ネオジムレーザの変形(波長が1.06μm)等を含む。これらのレーザは、キャンデラレーザ社(Candela Laser Corporation)により製造され、「医療レーザ」タシケント(1989)に説明されている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
これらのレーザは作用期間を短期間に維持して作用面内の局在化を行うという事実にもかかわらず、特に皮膚外被内の浸透の深さに関しては、治療の制御を保証していない。したがって、これらのレーザの使用は、機能不全な(hypotrophic)瘢痕の形成及びレーザビームの健康な皮膚領域への浸透等の上記欠点は除去されていない。
【0007】
水の層によって、ある波長の光照射が水を透過できないことは、一般的に良く知られたことである。スペクトルのこの領域は、「不透過性の窓」として知られ、以下の波長範囲、すなわち1.25〜1.40μm,1.7〜2.1μm,2.5〜3.1μm,5.5〜7.5μmである。これらの範囲では、光照射は、水と、最高90パーセントの水からなる生体組織とによって、強く吸収される。
【0008】
かかる吸収は、水の急速な加熱と、治療される生体組織の蒸発とにつながる。これらの波長で、レーザビームは、重要な性質、すなわち、実質的に水からなる生体組織にレーザ照射が深く浸透できないという性質を持っている。この結果、散乱レーザビームは、15〜20μmの深さを超えない範囲のみの生体組織を伝搬して、隣接の組織を破壊しない。レーザのかかる動作モードは、特定レベルの電力密度及びエネルギ、パルスの所定のレート及び継続時間だけで実行され、さらに、外科処置の間にこれらの全ての特性の瞬間的な安定性が得られる時だけ実行される。
【0009】
かかる周知の装置の一つは、波長2.94μmのレーザ照射を行うアルミニウム・イットリウム・エルビウム・ガーネットレーザである。このレーザの口腔学的な使用についての最初のレポートは、1989年に現れた。しかし、1−2Jのエネルギパルス、2.94μmの波長、1Hzのパルスレートなどのその特性によって、医者は、皮膚科において外科装置としてこのレーザを使用することができる。かかる使用の最初のレポートは、1991年にドイツ及びスロヴェニアにおいて公知になった。
【0010】
図1は、かかる装置は、電力装置、冷却装置、レーザ共振器、関節接続のミラー光ガイド装置からなることを示す構成図である。関節接続のミラー光ガイドにおけるレーザビームの複数回の反射に関して、装置の効率は、とても低く、2.94μmの波長で60パーセントを越えない。これによって、レーザ照射のエネルギ入力を2.5−3.0Jのレベルに、電力装置の動作電力を300Wに維持することが必要になる。当然、かかる高電力レーザは、非常に効率の良い冷却装置を持つ必要がある。したがって、特別な水冷却装置が、従来の装置には設けられている。この点から、装置の重量は、全体の寸法が0.5m3に対して70kgであった。したがって、レーザビーム特性の不安定性と同様に重い重量及び大なる寸法は、皮膚科におけるレーザの使用をかなり制限していた。
【0011】
水冷却装置は、従来の高電力装置において、20±10℃の範囲内に能動素子の温度を保つために必要であった。この温度範囲を越えるときに、熱レンズ(thermolens)効果が能動素子に現れ、これによって、かなりのレーザビームの散乱と、治療された組織の焦点面におけるエネルギ損失とが生じていた。
【0012】
これらの問題を解決する1つの方法は、関節接続のミラー光ガイドの無い、さらに電力をあまり必要としないより効率的なレーザシステムの形成である。これによって、水冷却装置の空冷に対応した物への置き換えが可能になる。かかる変化は、重量とレーザアセンブリ全体の寸法との減少につながる。
【0013】
このように、所定深さの皮膚浸透を行うとともにその制御ができ、手術領域近傍の健康な組織領域を傷つけない、皮膚科において利用可能な効率の良い携帯レーザ外科装置に対してかなりの需要が存在する。
【課題を解決するための手段】
【0014】
本発明の一概念は、生体組織を蒸発せしめるレーザ外科装置を提供する。装置は、手術用レーザアセンブリ、検出装置および制御ユニットからなる。手術用レーザアセンブリは、水のピーク吸収波長に相当する所定波長を有する手術用ビームを生成する。検出装置は、手術される生体組織から反射される放射信号を受診しチェックすることによって手術される生体組織の状態を検出して、制御信号を生成するようになっている。制御ユニットは、制御信号に基づいて手術用ビームの特性を制御して調節する。その結果、生体組織が蒸発する深さは、15−20ミクロンを越えない。装置は、電力ユニットと、手術される生体組織に手術用ビームを集束せしめるフォーカシング装置と、手術用ビームを手術される生体組織に向けるためのガイド光ビームを生成する光ガイドユニットと、手術用レーザアセンブリの少なくとも一部を冷却する冷却ユニットとを含む。吸入装置は、手術される生体組織の領域から崩れた組織生成物の除去を行う。
【0015】
本発明の更なる概念が、手術用ビームを発する手術用レーザ素子と、それを励起する励起装置とから少なくともなる手術用レーザアセンブリを提供する。ハンドピースは、オペレータの手に好都合に配置されるようになっている。ハンドピースは、内外に部品を有し、少なくとも、手術用レーザアセンブリの一部およびフォーカシング装置は、ハンドピースの内部部品内に配置されている。少なくとも、冷却ユニットと検出装置と制御ユニットとの一部も、ハンドピースの内部部品内に配置されている。
【0016】
本発明の別の概念は、手術用レーザアセンブリの一部がハウジング内に配置されて、冷却ユニットがハンドピースの内部に長手方向に延在する気流を生成するファンである装置を提供する。
【0017】
本発明の更に別の概念は、励起装置がハンドピースの外側に配置されて、複数の光ファイバによって手術用レーザアセンブリに接続している装置を提供する。
【0018】
本発明の更なる概念は、作業部及び補部からなる手術用レーザ素子を提供する。作業部はハンドピース内に配置され、補助部および励起装置はハンドピースの外側に配置されている。手術用レーザ素子の主要部分および補助部分は、複数の光ファイバからなる光ガイドによって接続されている。
【0019】
本発明の更に別の概念は、手術用レーザ素子により発せられる手術用ビームの波長が、1.25‐1.40μm、1.7‐2.1μm、2.5−3.1μm、5.5‐7.5μmからなるグループから選択される装置を提供する。手術用レーザ素子のレーザ媒体は、Y3AL5O12:Nd;Gd3Ga5O12:Cr、Ce、Nd;MgF2:Co;BaYb2F8:Er;LiYF4:Er:Tm、Ho;Y3Sc2Al3O12:Cr、Er;(Y,Er)3Al5O12;HF(化学)、CO(ガス)からなるグループから選択される。
【0020】
あるいは、生体組織を外科的に蒸発せしめる方法を提供する。この方法は、水のピーク吸収波長に相当する所定波長を有する手術用レーザビームを生成し、組織から反射される放射信号を受信してチェックすることにより手術される生体組織の状態を検出して制御信号を生成する行程からなる。方法の更なる行程は、制御信号に基づいて手術用ビームの特性を制御し調節することであり、その結果、生体組織が蒸発する深さは、15‐20μmを越えない。
【0021】
本発明の他の効果および特徴を、代表的な実施例に関して記載するものであり、この目的は本発明を説明するものであって制限するものではなく、さらに、図面に示す。
【発明を実施するための形態】
【0022】
本発明の実施例を図面に基づいて説明するが、図示した実施例は一例であり、本発明の原理の適用を表す多くの可能性のある2、3の実施例のみを示しただけである。更に、従属の請求の範囲に定義されるように、本発明が属する分野の当業者に対して明らかな様々な変形例及び適用例は、本発明の請求の範囲に含まれるものである。
【0023】
「不透過性の窓」に相当する波長領域の光照射は、水及び生体組織によって非常に効率的に吸収されることは先に示した。本発明のレーザ外科装置の手術用ビームは、かかる全波長領域内で有効に機能する。レーザビームの患者の目標領域への印加の結果、上皮膚層の局部的な蒸発が、最大10−20ミクロンの深さで起こる。皮膚における照射スポットの直径は、約10mmであり、密度は5−50J/cm2の範囲内である。
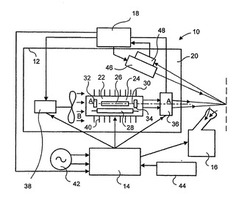
【0024】
図面を参照すると、図2に、レーザ手術を行う装置10を示す。装置10は、以下の主なユニット、すなわち、コンパクトな外科用レーザ機器、すなわちハンドピース12と、調節可能パラメータを有する高電圧パルスを生成する電源ユニット14と、手術用レーザビームの目標領域までの印加により壊れた皮膚生成物を吸入する吸入ユニット16と、制御ユニット18と、を含む。ハウジング20により形成されたハンドピースは、オペレータの手に都合良く保持されるようになっている。図2に、レーザ共振器22がハウジング20の内部に形成されていることが、最も良く示されている。手術用レーザアセンブリ24は、レーザ共振器の内部に配置され、能動レーザ素子すなわちロッド26と、励起装置28と、光共振器30と、からなる。手術用レーザ素子を励起するようになっている励起装置は、例えばフラッシュランプやダイオードレーザ等の従来の励起装置である。
【0025】
光共振器30は、反射能力が高く且つレーザ素子の後方に位置するミラー32と、可変集束レンズ36と対向するようにレーザ素子の前方に配置された半反射作業ミラー34と、を含む。光共振器のミラーは、レーザロッド26及び手術用レーザビームの長手方向の軸A−Aに対して同軸となるように配置されている。
【0026】
ハウジング20の内部に少なくとも一部が配置される集束レンズ36は、マイクロモータ(micromotor)または制御ユニット18からのコマンドによって操作される。集束レンズ36の所望の位置は、外科手術の前またはその間に、医療従事者によって手動で調節することもできる。光共振器30は、レーザビームをアライメントしたり増幅するように構成されるのに対し、集束レンズ36は、それを目標領域に向けるようになっている。励起装置28から手術用レーザ素子26までの光エネルギの供給を効率良く促進するために、レーザ共振器の内部は、反射率の高い材料によってカバーすることもできる。
【0027】
冷却装置38が、ハウジング20の内部でレーザ共振器22の後方に設けられている。冷却装置は、ガス状の冷却剤の軸方向の流れを生成する周知のタイプである。本発明の好ましい実施例において、冷却装置は、ハウジング20の内部において長手方向に延在する軸方向の空気流Bを生成するファン38である。冷却プロセスの効率を増やすために、レーザ共振器22の外部には、そこから外側に伸長する複数のリブ40が形成されている。したがって、ファンの起動時に、軸方向に流れる空気流Bは、温度を下げるリブ40を含むレーザ共振器22の外部を通過する。ハンドピース内を移動する空気流Bは、外科手術の結果として生じた壊れた皮膚生成物からのレンズの汚染を防止するために、ハウジングの開口(図示せず)を介して、集束レンズ36の外面側領域に向けられる。皮膚の手術領域に届くと即座に、空気流Bは、外科手術の場所から崩れた組織の生成物の除去を促進し、そして、医療従事者への不快な臭気の影響を低減せしめる。
【0028】
ハウジング20内の本発明の部品の長手方向の配置は、寸法の減少を助け、空冷剤の効率的な供給と、レーザ共振器とハンドピースの内部領域全体の温度の低下とを促進する。さらに、空冷システムの使用は、特に多数回のサーモサイクリング(thermocycling)の間及びその後に・レーザ共振器の温度及びその他の特性のより優れた安定性につながる。
【0029】
外科装置10は、標準電源42によって、またはバッテリ44により供給される。特に標準電源からバッテリユニットに電力を切替えるときの、ショックの危険を除去するために、電力インターロックスイッチを設けることもできる。
【0030】
電源ユニット14は、励起装置やフラッシュランプ28によって光パルスに変換される電気電圧パルスを生成する。レーザ共振器22において、かかる光パルスは、レーザロッド26に向けられた後、電圧パルスと比較して短い放射期間を有するレーザパルスに変換される。レーザ照射の波長は、外科装置によって利用されるレーザロッドまたは能動素子のタイプにより判別される。本発明の好ましい実施例において、Er:YAG(エルビウム)レーザが、外科装置の能動素子やレーザロッド26として使われる。この材料でできているレーザロッドは、水の「不透過性の窓」の波長に一致する電磁エネルギを発する。
このレーザの波長は2.94μmであり、水の最大吸収波長に非常に近い。尚、水の最大吸収波長は約3μmである。このように、手術用レーザビームのこの波長で、エネルギの大部分は、最大90パーセントの水からなる手術される生体組織によって吸収される。
【0031】
手術用レーザの能動素子において使われる材料に対して不可欠な条件は、照射波長がスペクトルの「不透過性の窓」領域に属していることである。したがって、本発明の能動素子のレーザ媒体は、このカテゴリの一部を形成する材料のグループから選択されるが、このグループに限定されるものではない。かかるグループは、Y3AL5O12:Nd(波長1.33μm)、Gd3Ga5O12:Cr,Ce,Nd(波長1.42μm)、MgF2:Co(波長1.75μm)、BaYb2F8:Er(波長2.0μm)、LiYF4:Er,Tm,Ho(波長2.06μm)、Y3Sc2Al3O12:Cr,Er(波長2.8μm)、(Y,Er)3Al5O12(波長2.94μm)、HF化学(波長2.6‐3.0μm)、CO気体(波長5.0−6.0μm)である。
【0032】
この手術用レーザビームの波長は、スペクトルの赤外線領域に属していて、外科のオペレータの肉眼には見えない。この点から、オペレータは、ハンドピースの最前部からの手術用レーザビームの放射を観察することができない。これによって、治療における安全性の重大な問題を提起する誤った外科処置を引き起こすことがある。この欠点を除去するために、本発明では、可視光であるガイド光ビームを連続して生成する光ガイドユニット46が設けられている。かかる光ガイドユニットは、He:Neレーザ、半導体レーザ、発光ダイオード、または適宜の可視放射源である。図2に示す本発明の実施例において、か
かる光ガイドユニット46は、非常に低電力のレーザビームを連続して発する半導体レーザである。Er:YAGレーザと異なり、半導体レーザは、スペクトルの可視光領域のビームを発する。ガイド光ビームは、手術用レーザビームが印加される前に、可視光スポットとして手術用レーザビームの焦点を示すようになっている。これは、手術用ビームがガイド光ビームスポットとして同じ領域に印加されることである。したがって、ガイド光ビームスポットが所望の位置に現れたあと、オペレータは、手術用レーザを始めることができる。このように、連続ガイド光レーザビームは、見えないパルス手術用ビームの目標設
定を容易にする照準機能を提供する。使用中に、ガイドレーザと同様に手術用レーザが起動すると、連続して、パルスビームが目標領域に供給される。
【0033】
手術用レーザは、ガイド光レーザの像に基づいて目標領域に容易に集束される。
【0034】
最終的に、外科手術の場所に蓄積される破壊された皮膚の生成物は、吸入ユニット16によって除去されて処理される。
【0035】
図2及び図3の実施例において、吸入ユニットは、ハンドピースから独立した装置として設計され、外科装置の電源ユニット14によって給電されている。それにもかかわらず、ハンドピースの一部として吸入ユニットを形成することも、検討されている。
【0036】
他の実施例において、冷却装置を、ハンドピースの外側に配置することもできる。たとえば、冷却装置は、冷却空気流が可撓性を有する配管や類似した装置を介してハンドピースの内部に供給されるように、電力ユニットと接続されている。
【0037】
図2に示す実施例の動作において、手術用レーザを励起するために、高電圧が電源ユニット14に現れて、フラッシュランプ28全体に印加される。レーザ共振器22において、フラッシュランプからの光エネルギの供給は、その高反射内面によって容易に行われる。フラッシュランプ28からのエネルギは、レーザロッド26の媒体によって吸収され、レーザ媒体内の分子が基底状態から励起状態に移動する。それらの分子が基底状態に戻るので、分子は特定の波長の光子を発する。光の一部は、レーザロッドから発せられる。光は、鏡32、34によってロッドに戻る。戻った光子は、励起状態のレーザ媒体の分子と反応して、それらの分子を基底状態に戻して、分子そのものが特定周波数の光子を発する。このように、発した光子は、分子に入射する光子と位相が同じになり、元の光子と同じ方向に向けられる。手術用レーザにおいて、ミラー32,34の間を移動する光子は、特定のパスに従い、故に、光子は、特定のモードにて共通の周波数及び位相で共振する。最終的に、ミラー32、34間の光は、その相当量が半反射ミラー34を通過して集束レンズ36によって患者の皮膚の目標領域に手術用ビームとして伝えられるようなレベルに達する。
【0038】
図3は、レーザ外科装置が2つの作業空洞部とともに形成される本発明の実施例を示す。補助空洞部17は、電源ユニット14と接続されている。この共振器は、フラッシュランプ28等の励起装置を含み、励起している光ファイバ装置19を介してメインレーザ共振器15に接続されている。図2に実施例と同様に、メインレーザ共振器15は、能動素子すなわちレーザロッド26と、2つのミラー32,34を有する光共振器30とを含む。作動中に、電源ユニット14に現れた高電圧は、光エネルギの衝撃を生成する補助空洞部17の励起装置28に印加される。これらの衝撃は、励起された光ファイバ装置19によって、メイン共振器15に配置された能動素子26に供給される。
【0039】
図3の実施例において、フラッシュランプ28に給電される高電圧パルスは、直接ハンドピースに伝えない。その代わりに、かかる高電圧パルスは、ハンドピース及びオペレータから離れて配置された補助空洞部17に供給される。これは、本発明の外科装置にかなりの安全性を提供する。何となれば、医療従事者に対する電気ショックの危険性の可能性を、効率良く小さくできるからである。さらに、励起装置やフラッシュランプ28がメイン共振器の外側に配置されるので、ハンドピースの重量はかなり軽減されて、外科医による装置の操作を容易にする。
【0040】
図2及び図3は、外科手術の間、手術される組織の状態が、その組織から反射される放射を検出するようになっている検出装置、すなわち検出器48によってモニタされることを、最も良く示している。検出器48の主な機能の一つは、患者の皮膚への手術用レーザビームの影響を制御することであり、特に手術用レーザビームの浸透の深さと表皮の蒸発の深さとを制御することである。あらゆる事例において、医者は、必要な効果を生成するために、レーザ照射の特定の特性を設定する。手術用レーザビームの浸透の所定の深さや皮膚の蒸発層の厚みが得られる場合、検出器48は、電力ユニット18に送る信号を生成
し、次に、電力ユニット18は、対応する信号を外科装置の電力ユニットや他のユニットに向けて生成する。手術用レーザのエネルギ密度や電力密度、他の特性の所定のレベルが得られるとき、類似した信号も生成される。これは、手術用レーザビームのより深い浸透や隣接する健康な皮膚組織を損傷する可能性を排除するために必要である。患者の皮膚から反射された光放射の強度は、病気の種類や程度、皮膚の色、患者の一般的な状態、治療される皮膚層の深さ等の要因に依存する。各患者に対して、光照射の初期レベルを考慮すると、強度のかかる値は、本発明のレーザ外科装置によって治療される皮膚領域の状態の特徴を表している。検出装置48は、多種多様な感光性素子、光導電セルやフォトダイオード、類似した装置を利用して作られている。感光性の素子を使用して検出器48を形成する場合、皮膚の目標領域から反射される光は、その陰極に向けられた感光性素子に電子流を生成して、制御ユニット18に転送する電流や制御信号を生成する。光導電セルが利用されるとき、検出器48の電気抵抗は、手術される組織から反射されて検出器48によって受信される光の強度レベルに依存して変化する。制御ユニット18への信号は、かかる抵抗に基づいている。
【0041】
図4は、本発明の他の実施例のレーザアセンブリの一部を示す。図4において、能動素子及び光共振器の一部のみが、ハンドピースに配置されたメイン作業空洞部21に置かれている。かかる装置を収容するために、補助空洞部23が設けられている。励起装置28及び能動素子の第1すなわち補助部25は、補助レーザ共振器23内に配置されている。能動素子の第1部25の末端部29は、反射率が高いミラー32と対向するが、その最も近い端部31は、光ガイド41の端部37に配置される。励起装置28から能動素子の第1部25までの光エネルギの供給を有効に促進するために、補助空洞部の内部は、反射特
性が高い材料から形成されている。能動素子の第2の、すなわち作業部27と光共振器の半反射ミラー34とは、メイン作業空洞部21に配置されている。能動素子の第2部27の末端部33とその第1部の最も近い端部31とは、光ファイバガイド41によって光学的に接続されている。能動素子の近傍に配置される光ガイドの両端部は、光共振器の一部として製造することができる。この点で、補助空洞部23に配置された光ガイドの端部37は、能動素子の第1部25から第2部33に向かうレーザ照射の通過を促進する特性を有するミラーとして形成されている。メイン共振器21から必要とされる手術用レーザビ
ーム動作を容易にするために、その内部に配置された光ガイドの端部39は、能動素子の第2部27の方向にのみ、照射の通過を可能とするミラーとして形成することができる。図3の前述の実施例のように、オペレータに、電気ショックの危険が無く且つ軽量化された機器が提供される。これは、特に外科手術が長引いた場合の本発明の重要な効果である。
【0042】
レーザ外科装置の更に簡略化した実施例を、図5及び図6に示す。図5に示すように、ヘアドライヤのハウジングに類似したハンドピース112は、手術用パルスレーザ122と、冷却ファン138と、光ガイド装置146とを含む。患者に向けられる軸方向の気流を形成するために、ファン138は、手術用レーザの後方に配置されている。光ガイド装置146の2つの発光ダイオード145,147は、手術用レーザと集束レンズ136との間のハウジング内にインストールされている。発光ダイオードは、集束レンズ136の焦点面内での光ガイドビーム121,123の像の間の距離が、この面内の手術用レーザ
122の手術用ビーム127のスポットの直径と等しくなるように配置されている。したがって、手術用ビームスポットの目標領域は、光ガイドビームの可視の像を見ることによって識別することができる。この手術用ビームスポットの寸法は、かかる可視の像の間の距離を変えることによって調節される。電源ユニット114は、レーザ、ファン、光ガイド装置のみならず、ハウジングの外側に配置される吸入ユニット116にも給電する。安全性のために、全ての給電ケーブルは、陶製の金属ホースによって被覆することができる。手術用レーザ122のパルスレート及びパルスエネルギーは、電源ユニット114のコ
ントロールパネルからコマンドを生成することによって手動で設定される。前述の実施例と同様に、吸入ユニット116は、外科手術の間に生じる皮膚の崩れた粒子の断片を除去する。集束レンズ136は、クォーツガラスで作製することができる。
【0043】
図6のレーザ外科装置は、図5の装置と類似している。しかし、図6において、励起装置135は、ハンドピース112の外側に配置され、光エネルギの衝撃は、光ガイド137によって手術用レーザ122に供給される。この点において、図6の機器は、図3の実施例と同様の方法で動作する。能動レーザ素子すなわちロッドの一部がハンドピース(図4を参照のこと)の外側に配置される図6の変形例を考慮することもできる。
【0044】
図5及び図6に示す実施例において、集束レンズ136は、所定距離を手動で動かす。かかる移動の間、発光ダイオード145,147により生成される像の位置は、焦点面内での手術用レーザスポットのサイズを判別し、自動的に変わる。
【0045】
レンズ136が、手術用ビーム軸A−Aに対してほぼ垂直な方向に移動する場合、一連のレーザビーム像が、焦点面内に得られる。例えば、図11は、標準に対するこの状態を示し、図12はシリンドリカルレンズに対する状態を示す。
【0046】
ビームの軸と平行な方向に集束レンズが移動するとき、より複雑なイメージパターン、すなわち環状パターン(図13を参照のこと)や、螺旋パターン(図14を参照のこと)を得ることが可能である。手術のタイプに応じた集束レンズの置換は、本発明において可能である。多くの場合、最適のレンズは、手術用レーザビームの軸に沿って円滑に移動する光学部品を有するものであり、故に、光学部品を所定の中間位置に固定することができる。この点に関して、図7は、かかる3つの中間位置を有する集束レンズ137を示す。
【0047】
フォーカス領域における手術用レーザスポットのサイズは、制御ユニット18(図2を参照のこと)からの信号に対してマイクロ装置によって調整される。これは、オペレータや、または所定のプログラムによって手動で行われる。このように、手術用レーザビームの手術用レーザスポットのサイズは、レーザスポットの不規則性が許容されるサイズまで、集束レンズの焦点面において調節される。
【0048】
図8に示す集束レンズは、長方形のストリップとなる手術用ビームを生成する。これは、半円筒レンズ237を使用することによって得られる。このストリップの形において必要とされる変化は、所定の形態でレンズ237を回転させて案内することにより得られる。
【0049】
図9に示す集束レンズ236の実施例によって、本発明は、集束手術用レーザビームの移動の軌跡を環状に生成することができる。これは、集束レンズ236を、手術用レーザビームの軸A−Aから所定距離だけシフトさせた軸B−Bを中心に回転させることによって得られる。
【0050】
図10の実施例について、図10は、目標領域への手術用レーザビームを正確に集束せしめるための補助の集束レンズを示す。このため、レンズ236、239及びミラー245、247を有するレーザアセンブリ222を所定の状態に堅実に固定することは、賢明である。可視のガイド光は、見えない手術用レーザビームと予めアライメントすべきである。この場合、手術の対象である患者の身体の少なくとも一部を静止状態に維持することが望ましい。特別の装置を、この作業を行うために設けることもできる。
【0051】
本発明の外科装置は、水の「不透過性の窓」に対応する波長の全スペクトル内のレーザ照射を利用する。5−10J/cm2の手術用ビームスポットのレーザ照射密度且つ3−10mmの手術用レーザビームスポットの直径で、本発明の手術用レーザビームの表皮への浸透の深さは、10−20ミクロンを越えない。これは、約0.001秒の非常に短い継続時間を有する衝撃が印加されたときに起こる。組織を脱水した後、手術用レーザビームのスポットは、患者の皮膚の上層の局部的な蒸発のみを生じる。これは、手術領域を囲んでいる表皮の外面上健康な領域と同様に、深さ方向を傷つけずに生じる。組織の手術領
域は、皮膚の表層を手術用レーザビームのスポットを移動せしめることによって増加する。生体組織への手術用レーザビームの浸透の深さは、電磁衝撃の周波数を変えることによって操作することができる。30−60秒の継続時間を有する1回の作業(session)の間、約50−100の衝撃が供給される。
【0052】
本発明のレーザ外科装置を使用して、散乱赤外線レーザ放射によって患部を感染させないようにすることができる。このタイプの放射の密度は、通常の健康な皮膚に損傷を生じさせない。しかし、かかる放射は、疾病によって傷つけられた皮膚領域のブドウ状球菌のコロニーを除去する。
【0053】
レーザ外科装置の光学系によって、ユーザは、ガンの腫瘍の切除を含むレーザ切開及びレーザ光凝固術に先行する外科手術を行うことができる。本発明も、組織の1つの層の1回の蒸発によって、良性腫瘍の除去を容易にしている。この作業は、病気による影響を受けた皮膚の各部に、所定のスポット領域を有する複数のレーザ衝撃を印加することよって実行される。「血露(blood dew)」が皮膚の上に現れるまで、この治療は継続され、薬療法に移る。
【0054】
例えば顔のしわを治療する赤外線放射による皮膚の治療を実行するために、本発明のレーザ外科装置を、前もって設定された散乱放射のスキャニングシステムと組み合わせて使用することができる。この治療を利用するために、前もって設定されたプログラムによるビーム走査の状態を固定することは、好都合である(手術用ビームのスポットの直径は所定の方法で変えられ、ビームのエネルギ密度は可変または一定である。図15を参照のこと)。レーザビームがスロットの形を取る場合(図16を参照のこと)、同一の状態を提供できる。
【0055】
本発明の集束レーザ照射は、例えば、フルンケルや膿疱の切開や除去、その結果としての切開領域への薬の導入等の局部的な外科手術を処置するために利用できる。
【0056】
以下の実施例は、本発明をより完全に理解するために提示される。本発明の原理及び実行を示す特定の技術、条件、材料、結果は、例示であって、本発明の請求の範囲を制限するものとして解釈すべきでない。
【0057】
実施例1
Er:YAGレーザは、励起装置としてフラッシュランプを有するレーザ外科装置の能動素子として使用される。Er:YAG能動素予は、2つの平らな共振ミラーの間に配置される。レイジングが、波長2.94μm、パルス幅250±50μ秒、最大1Hzのパルスレート、最大2Jのパルスエネルギーで発生する。
【0058】
手術用レーザビームの形状は、集束装置により調節される。Er:YAGレーザビームは赤外線のスペクトル領域に属しているので、オペレータの肉眼では見えない。患者の皮膚における手術用レーザビームのレーザスポットの位置及び寸法は、スペクトルの可視領域のビームを発するガイド半導体レーザにより生成される2つのガイド光ビームの補助により示される。各ガイド光レーザビームの最大直径は、約2.0mmである。患者の皮膚に投影された2つのガイド光レーザビームの間の距離は、同一対象物でのEr:YAGレーザのスポット径に相当する。このように、患者の皮膚でのEr:YAGレーザビームの
位置及び直径は、ガイド光半導体レーザにより発せられる2つのガイド光レーザビームの位置により測定される。Er:YAGレーザのエネルギ密度は、1.0−10J/cm2の範囲で調整可能である。治療の間、ポンピングエネルギのレベルが同一であることを考慮すると、Er:YAGレーザビームの寸法が小さくなると、そのエネルギ密度は高くなる。患者の皮膚でのEr:YAGレーザビームのスポットの集束寸法が最小になると、直ちに、組織の局部的な蒸発が、最大1.5mmの深さで生じる。Er:YAGレーザビームのエネルギ密度が約50J/cm2であるときに、表皮から目で確認できる蒸発が起きる。
【0059】
48人の患者の皮膚病の治療は、50J/cm2の最大エネルギ密度を有するEr:YAGレーザによって表皮の表層蒸発を使用することにより行われる。そのうち、15人が尖キャンディロマス(pointed candylomas)を患い、8人がコロイド状の瘢痕を有し、8人が手及び足に疣を有し、10人が尖過角化症を患い、7人が入墨を有する。病気や皮膚の傷のタイプに応じて、治療は、各々が3〜20パルスからなる6〜10セッションを処置することにより実行される。
【0060】
これらのセッションの間、Er:YAGレーザビームのスポット径は、3〜5mmである。凝固の制御は、「血露」の症状が現れるまで実行される。患者の皮膚へのレーザビームのかかる印加の結果、周辺の血液の内容物の変化が検出されず、また、現れた病気の時間をあけた再発が無い。
【0061】
実施例2
実施例1とは異なり、実施例2のレーザ装置では、2つの作業空洞部が設けられている。第1空洞部において、電気パルスは光パルスに変換される。かかる光ポンピングパルスは、第2空洞部の光学光ガイドを介して入力される。そこで、光パルスはレーザビームに変換される。第1空洞部は、患者及び医療従事者から離れた電源ユニットに配置されている。第2空洞部は、外科装置のハンドピース内に位置する。この実施例では、他の作業空洞部は、第1空洞部が励起装置と手術用レーザロッドの一部とを含み、レーザロッドの主要部分が第2空洞部に配置されるように、形成されている。空洞部も、光学光ファイバガ
イドによって相互に接続されている。第2空洞部に入力されるレーザパルスは、光学光ガイドの損失を最小にするようなポンピング波長である。第2空洞部にて生成されるレーザパルスは、例えば2.94μmの必要な波長で動作するレーザ照射ビームに変換される。
【図面の簡単な説明】
【0062】
【図1】従来技術レーザ装置を示す。
【図2】本発明のレーザ外科装置の1実施例を示す。
【図3】レーザ外科装置のもう一つの実施例を示す。
【図4】レーザ外科装置の更なる実施例の一部を示す。
【図5】レーザ外科装置の簡単な実施例を示す。
【図6】レーザ外科装置のもう一つの簡単な実施例を示す。
【図7】フォーカシング装置のレンズの他の位置を示す。
【図8】円筒形集束レンズを有するレーザ外科装置を示す。
【図9】シフトされた軸を中心に可動な集束レンズを有するレーザ外科装置を示す。
【図10】レーザ外科装置へのアクセサリレンズの取り付けを示す。
【図11】レーザビーム像の異なるパターンを示す。
【図12】レーザビーム像の異なるパターンを示す。
【図13】レーザビーム像の更なるパターンを示す。
【図14】レーザビーム像の更なるパターンを示す。
【図15】前もって設定されたプログラムでのビームスキャンの状態を示す。
【図16】レーザビームの形がスロットになるときのビームスキャンの状態を示す。
【技術分野】
【0001】
本発明は、医療用レーザに関し、特に、外科用レーザ装置と皮膚科におけるその使用方法に関する。
【背景技術】
【0002】
様々なレーザが、先天性及び後天的な皮膚の異常及び病気を矯正するために、現代の皮膚科において使用されている。この分野におけるレーザの広範囲の急増の理由の一つは、その性質が医学的な需要をサポートする、すなわち患者を傷つけないからである。
【0003】
薬療法は、主に皮膚科における治療として最も広く使用されてきた。何となれば、薬療法は、容易に利用でき、簡単且つ無痛であるからである。しかし、相当数の疾患の治療における効率の低さと同じように、薬過敏症、副作用、一般のアレルギ反応によって、この治療は、妥当なものではなくなっている。
【0004】
皮膚科の異常及び病気のより効率的な治療に対する需要によって、外科的な処置はこの分野においてかなり一般的になった。皮膚疾患の治療の外科的な方法に関して、医者は、大抵、以下の処置、すなわち、移植の前の切開、超音波及びクライオセラピィの使用、放射をイオン化する磁場の印加、電気凝固法、プラズマ電流の使用等に頼らざるを得ない。これらの外科的方法は、以下に示す多くの欠点及び有害な副作用にもかかわらず使われている。かかる欠点及び有害な副作用は、治療の破壊的な性質、慢性化する治療プロセス、色素沈着低下の高い危険性、萎縮の可能性、皮膚組織の破壊、瘢痕の形成、健康な領域を含む隣接の皮膚領域への損傷を含む。外科医が、皮膚外被の所定の深さで、一定且つ短期間の作用時間のローカルな治療方法を用いるとき、これらの問題はしばし軽減される。これは、レーザが最近多くの皮膚科医によって選択される機器になった理由の1つである。
【0005】
現在、レーザ照射の異なる波長を有するレーザが、皮膚科において使われている。かかるレーザは、例えば、エキシマレーザ、ルビーレーザ、アルゴンレーザ、アレクサンドライトレーザ、ガーネットレーザ、調節自在半導体レーザ等である。これらの装置は、可視光線と同じスペクトル(0.4〜0.7μm)とUV範囲(0.18〜0.40μm)との波長を有するレーザビームを生成する。たとえば、赤外線レーザは、一組のCO2レーザ(波長が10.6μm)と、ネオジムレーザの変形(波長が1.06μm)等を含む。これらのレーザは、キャンデラレーザ社(Candela Laser Corporation)により製造され、「医療レーザ」タシケント(1989)に説明されている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
これらのレーザは作用期間を短期間に維持して作用面内の局在化を行うという事実にもかかわらず、特に皮膚外被内の浸透の深さに関しては、治療の制御を保証していない。したがって、これらのレーザの使用は、機能不全な(hypotrophic)瘢痕の形成及びレーザビームの健康な皮膚領域への浸透等の上記欠点は除去されていない。
【0007】
水の層によって、ある波長の光照射が水を透過できないことは、一般的に良く知られたことである。スペクトルのこの領域は、「不透過性の窓」として知られ、以下の波長範囲、すなわち1.25〜1.40μm,1.7〜2.1μm,2.5〜3.1μm,5.5〜7.5μmである。これらの範囲では、光照射は、水と、最高90パーセントの水からなる生体組織とによって、強く吸収される。
【0008】
かかる吸収は、水の急速な加熱と、治療される生体組織の蒸発とにつながる。これらの波長で、レーザビームは、重要な性質、すなわち、実質的に水からなる生体組織にレーザ照射が深く浸透できないという性質を持っている。この結果、散乱レーザビームは、15〜20μmの深さを超えない範囲のみの生体組織を伝搬して、隣接の組織を破壊しない。レーザのかかる動作モードは、特定レベルの電力密度及びエネルギ、パルスの所定のレート及び継続時間だけで実行され、さらに、外科処置の間にこれらの全ての特性の瞬間的な安定性が得られる時だけ実行される。
【0009】
かかる周知の装置の一つは、波長2.94μmのレーザ照射を行うアルミニウム・イットリウム・エルビウム・ガーネットレーザである。このレーザの口腔学的な使用についての最初のレポートは、1989年に現れた。しかし、1−2Jのエネルギパルス、2.94μmの波長、1Hzのパルスレートなどのその特性によって、医者は、皮膚科において外科装置としてこのレーザを使用することができる。かかる使用の最初のレポートは、1991年にドイツ及びスロヴェニアにおいて公知になった。
【0010】
図1は、かかる装置は、電力装置、冷却装置、レーザ共振器、関節接続のミラー光ガイド装置からなることを示す構成図である。関節接続のミラー光ガイドにおけるレーザビームの複数回の反射に関して、装置の効率は、とても低く、2.94μmの波長で60パーセントを越えない。これによって、レーザ照射のエネルギ入力を2.5−3.0Jのレベルに、電力装置の動作電力を300Wに維持することが必要になる。当然、かかる高電力レーザは、非常に効率の良い冷却装置を持つ必要がある。したがって、特別な水冷却装置が、従来の装置には設けられている。この点から、装置の重量は、全体の寸法が0.5m3に対して70kgであった。したがって、レーザビーム特性の不安定性と同様に重い重量及び大なる寸法は、皮膚科におけるレーザの使用をかなり制限していた。
【0011】
水冷却装置は、従来の高電力装置において、20±10℃の範囲内に能動素子の温度を保つために必要であった。この温度範囲を越えるときに、熱レンズ(thermolens)効果が能動素子に現れ、これによって、かなりのレーザビームの散乱と、治療された組織の焦点面におけるエネルギ損失とが生じていた。
【0012】
これらの問題を解決する1つの方法は、関節接続のミラー光ガイドの無い、さらに電力をあまり必要としないより効率的なレーザシステムの形成である。これによって、水冷却装置の空冷に対応した物への置き換えが可能になる。かかる変化は、重量とレーザアセンブリ全体の寸法との減少につながる。
【0013】
このように、所定深さの皮膚浸透を行うとともにその制御ができ、手術領域近傍の健康な組織領域を傷つけない、皮膚科において利用可能な効率の良い携帯レーザ外科装置に対してかなりの需要が存在する。
【課題を解決するための手段】
【0014】
本発明の一概念は、生体組織を蒸発せしめるレーザ外科装置を提供する。装置は、手術用レーザアセンブリ、検出装置および制御ユニットからなる。手術用レーザアセンブリは、水のピーク吸収波長に相当する所定波長を有する手術用ビームを生成する。検出装置は、手術される生体組織から反射される放射信号を受診しチェックすることによって手術される生体組織の状態を検出して、制御信号を生成するようになっている。制御ユニットは、制御信号に基づいて手術用ビームの特性を制御して調節する。その結果、生体組織が蒸発する深さは、15−20ミクロンを越えない。装置は、電力ユニットと、手術される生体組織に手術用ビームを集束せしめるフォーカシング装置と、手術用ビームを手術される生体組織に向けるためのガイド光ビームを生成する光ガイドユニットと、手術用レーザアセンブリの少なくとも一部を冷却する冷却ユニットとを含む。吸入装置は、手術される生体組織の領域から崩れた組織生成物の除去を行う。
【0015】
本発明の更なる概念が、手術用ビームを発する手術用レーザ素子と、それを励起する励起装置とから少なくともなる手術用レーザアセンブリを提供する。ハンドピースは、オペレータの手に好都合に配置されるようになっている。ハンドピースは、内外に部品を有し、少なくとも、手術用レーザアセンブリの一部およびフォーカシング装置は、ハンドピースの内部部品内に配置されている。少なくとも、冷却ユニットと検出装置と制御ユニットとの一部も、ハンドピースの内部部品内に配置されている。
【0016】
本発明の別の概念は、手術用レーザアセンブリの一部がハウジング内に配置されて、冷却ユニットがハンドピースの内部に長手方向に延在する気流を生成するファンである装置を提供する。
【0017】
本発明の更に別の概念は、励起装置がハンドピースの外側に配置されて、複数の光ファイバによって手術用レーザアセンブリに接続している装置を提供する。
【0018】
本発明の更なる概念は、作業部及び補部からなる手術用レーザ素子を提供する。作業部はハンドピース内に配置され、補助部および励起装置はハンドピースの外側に配置されている。手術用レーザ素子の主要部分および補助部分は、複数の光ファイバからなる光ガイドによって接続されている。
【0019】
本発明の更に別の概念は、手術用レーザ素子により発せられる手術用ビームの波長が、1.25‐1.40μm、1.7‐2.1μm、2.5−3.1μm、5.5‐7.5μmからなるグループから選択される装置を提供する。手術用レーザ素子のレーザ媒体は、Y3AL5O12:Nd;Gd3Ga5O12:Cr、Ce、Nd;MgF2:Co;BaYb2F8:Er;LiYF4:Er:Tm、Ho;Y3Sc2Al3O12:Cr、Er;(Y,Er)3Al5O12;HF(化学)、CO(ガス)からなるグループから選択される。
【0020】
あるいは、生体組織を外科的に蒸発せしめる方法を提供する。この方法は、水のピーク吸収波長に相当する所定波長を有する手術用レーザビームを生成し、組織から反射される放射信号を受信してチェックすることにより手術される生体組織の状態を検出して制御信号を生成する行程からなる。方法の更なる行程は、制御信号に基づいて手術用ビームの特性を制御し調節することであり、その結果、生体組織が蒸発する深さは、15‐20μmを越えない。
【0021】
本発明の他の効果および特徴を、代表的な実施例に関して記載するものであり、この目的は本発明を説明するものであって制限するものではなく、さらに、図面に示す。
【発明を実施するための形態】
【0022】
本発明の実施例を図面に基づいて説明するが、図示した実施例は一例であり、本発明の原理の適用を表す多くの可能性のある2、3の実施例のみを示しただけである。更に、従属の請求の範囲に定義されるように、本発明が属する分野の当業者に対して明らかな様々な変形例及び適用例は、本発明の請求の範囲に含まれるものである。
【0023】
「不透過性の窓」に相当する波長領域の光照射は、水及び生体組織によって非常に効率的に吸収されることは先に示した。本発明のレーザ外科装置の手術用ビームは、かかる全波長領域内で有効に機能する。レーザビームの患者の目標領域への印加の結果、上皮膚層の局部的な蒸発が、最大10−20ミクロンの深さで起こる。皮膚における照射スポットの直径は、約10mmであり、密度は5−50J/cm2の範囲内である。
【0024】
図面を参照すると、図2に、レーザ手術を行う装置10を示す。装置10は、以下の主なユニット、すなわち、コンパクトな外科用レーザ機器、すなわちハンドピース12と、調節可能パラメータを有する高電圧パルスを生成する電源ユニット14と、手術用レーザビームの目標領域までの印加により壊れた皮膚生成物を吸入する吸入ユニット16と、制御ユニット18と、を含む。ハウジング20により形成されたハンドピースは、オペレータの手に都合良く保持されるようになっている。図2に、レーザ共振器22がハウジング20の内部に形成されていることが、最も良く示されている。手術用レーザアセンブリ24は、レーザ共振器の内部に配置され、能動レーザ素子すなわちロッド26と、励起装置28と、光共振器30と、からなる。手術用レーザ素子を励起するようになっている励起装置は、例えばフラッシュランプやダイオードレーザ等の従来の励起装置である。
【0025】
光共振器30は、反射能力が高く且つレーザ素子の後方に位置するミラー32と、可変集束レンズ36と対向するようにレーザ素子の前方に配置された半反射作業ミラー34と、を含む。光共振器のミラーは、レーザロッド26及び手術用レーザビームの長手方向の軸A−Aに対して同軸となるように配置されている。
【0026】
ハウジング20の内部に少なくとも一部が配置される集束レンズ36は、マイクロモータ(micromotor)または制御ユニット18からのコマンドによって操作される。集束レンズ36の所望の位置は、外科手術の前またはその間に、医療従事者によって手動で調節することもできる。光共振器30は、レーザビームをアライメントしたり増幅するように構成されるのに対し、集束レンズ36は、それを目標領域に向けるようになっている。励起装置28から手術用レーザ素子26までの光エネルギの供給を効率良く促進するために、レーザ共振器の内部は、反射率の高い材料によってカバーすることもできる。
【0027】
冷却装置38が、ハウジング20の内部でレーザ共振器22の後方に設けられている。冷却装置は、ガス状の冷却剤の軸方向の流れを生成する周知のタイプである。本発明の好ましい実施例において、冷却装置は、ハウジング20の内部において長手方向に延在する軸方向の空気流Bを生成するファン38である。冷却プロセスの効率を増やすために、レーザ共振器22の外部には、そこから外側に伸長する複数のリブ40が形成されている。したがって、ファンの起動時に、軸方向に流れる空気流Bは、温度を下げるリブ40を含むレーザ共振器22の外部を通過する。ハンドピース内を移動する空気流Bは、外科手術の結果として生じた壊れた皮膚生成物からのレンズの汚染を防止するために、ハウジングの開口(図示せず)を介して、集束レンズ36の外面側領域に向けられる。皮膚の手術領域に届くと即座に、空気流Bは、外科手術の場所から崩れた組織の生成物の除去を促進し、そして、医療従事者への不快な臭気の影響を低減せしめる。
【0028】
ハウジング20内の本発明の部品の長手方向の配置は、寸法の減少を助け、空冷剤の効率的な供給と、レーザ共振器とハンドピースの内部領域全体の温度の低下とを促進する。さらに、空冷システムの使用は、特に多数回のサーモサイクリング(thermocycling)の間及びその後に・レーザ共振器の温度及びその他の特性のより優れた安定性につながる。
【0029】
外科装置10は、標準電源42によって、またはバッテリ44により供給される。特に標準電源からバッテリユニットに電力を切替えるときの、ショックの危険を除去するために、電力インターロックスイッチを設けることもできる。
【0030】
電源ユニット14は、励起装置やフラッシュランプ28によって光パルスに変換される電気電圧パルスを生成する。レーザ共振器22において、かかる光パルスは、レーザロッド26に向けられた後、電圧パルスと比較して短い放射期間を有するレーザパルスに変換される。レーザ照射の波長は、外科装置によって利用されるレーザロッドまたは能動素子のタイプにより判別される。本発明の好ましい実施例において、Er:YAG(エルビウム)レーザが、外科装置の能動素子やレーザロッド26として使われる。この材料でできているレーザロッドは、水の「不透過性の窓」の波長に一致する電磁エネルギを発する。
このレーザの波長は2.94μmであり、水の最大吸収波長に非常に近い。尚、水の最大吸収波長は約3μmである。このように、手術用レーザビームのこの波長で、エネルギの大部分は、最大90パーセントの水からなる手術される生体組織によって吸収される。
【0031】
手術用レーザの能動素子において使われる材料に対して不可欠な条件は、照射波長がスペクトルの「不透過性の窓」領域に属していることである。したがって、本発明の能動素子のレーザ媒体は、このカテゴリの一部を形成する材料のグループから選択されるが、このグループに限定されるものではない。かかるグループは、Y3AL5O12:Nd(波長1.33μm)、Gd3Ga5O12:Cr,Ce,Nd(波長1.42μm)、MgF2:Co(波長1.75μm)、BaYb2F8:Er(波長2.0μm)、LiYF4:Er,Tm,Ho(波長2.06μm)、Y3Sc2Al3O12:Cr,Er(波長2.8μm)、(Y,Er)3Al5O12(波長2.94μm)、HF化学(波長2.6‐3.0μm)、CO気体(波長5.0−6.0μm)である。
【0032】
この手術用レーザビームの波長は、スペクトルの赤外線領域に属していて、外科のオペレータの肉眼には見えない。この点から、オペレータは、ハンドピースの最前部からの手術用レーザビームの放射を観察することができない。これによって、治療における安全性の重大な問題を提起する誤った外科処置を引き起こすことがある。この欠点を除去するために、本発明では、可視光であるガイド光ビームを連続して生成する光ガイドユニット46が設けられている。かかる光ガイドユニットは、He:Neレーザ、半導体レーザ、発光ダイオード、または適宜の可視放射源である。図2に示す本発明の実施例において、か
かる光ガイドユニット46は、非常に低電力のレーザビームを連続して発する半導体レーザである。Er:YAGレーザと異なり、半導体レーザは、スペクトルの可視光領域のビームを発する。ガイド光ビームは、手術用レーザビームが印加される前に、可視光スポットとして手術用レーザビームの焦点を示すようになっている。これは、手術用ビームがガイド光ビームスポットとして同じ領域に印加されることである。したがって、ガイド光ビームスポットが所望の位置に現れたあと、オペレータは、手術用レーザを始めることができる。このように、連続ガイド光レーザビームは、見えないパルス手術用ビームの目標設
定を容易にする照準機能を提供する。使用中に、ガイドレーザと同様に手術用レーザが起動すると、連続して、パルスビームが目標領域に供給される。
【0033】
手術用レーザは、ガイド光レーザの像に基づいて目標領域に容易に集束される。
【0034】
最終的に、外科手術の場所に蓄積される破壊された皮膚の生成物は、吸入ユニット16によって除去されて処理される。
【0035】
図2及び図3の実施例において、吸入ユニットは、ハンドピースから独立した装置として設計され、外科装置の電源ユニット14によって給電されている。それにもかかわらず、ハンドピースの一部として吸入ユニットを形成することも、検討されている。
【0036】
他の実施例において、冷却装置を、ハンドピースの外側に配置することもできる。たとえば、冷却装置は、冷却空気流が可撓性を有する配管や類似した装置を介してハンドピースの内部に供給されるように、電力ユニットと接続されている。
【0037】
図2に示す実施例の動作において、手術用レーザを励起するために、高電圧が電源ユニット14に現れて、フラッシュランプ28全体に印加される。レーザ共振器22において、フラッシュランプからの光エネルギの供給は、その高反射内面によって容易に行われる。フラッシュランプ28からのエネルギは、レーザロッド26の媒体によって吸収され、レーザ媒体内の分子が基底状態から励起状態に移動する。それらの分子が基底状態に戻るので、分子は特定の波長の光子を発する。光の一部は、レーザロッドから発せられる。光は、鏡32、34によってロッドに戻る。戻った光子は、励起状態のレーザ媒体の分子と反応して、それらの分子を基底状態に戻して、分子そのものが特定周波数の光子を発する。このように、発した光子は、分子に入射する光子と位相が同じになり、元の光子と同じ方向に向けられる。手術用レーザにおいて、ミラー32,34の間を移動する光子は、特定のパスに従い、故に、光子は、特定のモードにて共通の周波数及び位相で共振する。最終的に、ミラー32、34間の光は、その相当量が半反射ミラー34を通過して集束レンズ36によって患者の皮膚の目標領域に手術用ビームとして伝えられるようなレベルに達する。
【0038】
図3は、レーザ外科装置が2つの作業空洞部とともに形成される本発明の実施例を示す。補助空洞部17は、電源ユニット14と接続されている。この共振器は、フラッシュランプ28等の励起装置を含み、励起している光ファイバ装置19を介してメインレーザ共振器15に接続されている。図2に実施例と同様に、メインレーザ共振器15は、能動素子すなわちレーザロッド26と、2つのミラー32,34を有する光共振器30とを含む。作動中に、電源ユニット14に現れた高電圧は、光エネルギの衝撃を生成する補助空洞部17の励起装置28に印加される。これらの衝撃は、励起された光ファイバ装置19によって、メイン共振器15に配置された能動素子26に供給される。
【0039】
図3の実施例において、フラッシュランプ28に給電される高電圧パルスは、直接ハンドピースに伝えない。その代わりに、かかる高電圧パルスは、ハンドピース及びオペレータから離れて配置された補助空洞部17に供給される。これは、本発明の外科装置にかなりの安全性を提供する。何となれば、医療従事者に対する電気ショックの危険性の可能性を、効率良く小さくできるからである。さらに、励起装置やフラッシュランプ28がメイン共振器の外側に配置されるので、ハンドピースの重量はかなり軽減されて、外科医による装置の操作を容易にする。
【0040】
図2及び図3は、外科手術の間、手術される組織の状態が、その組織から反射される放射を検出するようになっている検出装置、すなわち検出器48によってモニタされることを、最も良く示している。検出器48の主な機能の一つは、患者の皮膚への手術用レーザビームの影響を制御することであり、特に手術用レーザビームの浸透の深さと表皮の蒸発の深さとを制御することである。あらゆる事例において、医者は、必要な効果を生成するために、レーザ照射の特定の特性を設定する。手術用レーザビームの浸透の所定の深さや皮膚の蒸発層の厚みが得られる場合、検出器48は、電力ユニット18に送る信号を生成
し、次に、電力ユニット18は、対応する信号を外科装置の電力ユニットや他のユニットに向けて生成する。手術用レーザのエネルギ密度や電力密度、他の特性の所定のレベルが得られるとき、類似した信号も生成される。これは、手術用レーザビームのより深い浸透や隣接する健康な皮膚組織を損傷する可能性を排除するために必要である。患者の皮膚から反射された光放射の強度は、病気の種類や程度、皮膚の色、患者の一般的な状態、治療される皮膚層の深さ等の要因に依存する。各患者に対して、光照射の初期レベルを考慮すると、強度のかかる値は、本発明のレーザ外科装置によって治療される皮膚領域の状態の特徴を表している。検出装置48は、多種多様な感光性素子、光導電セルやフォトダイオード、類似した装置を利用して作られている。感光性の素子を使用して検出器48を形成する場合、皮膚の目標領域から反射される光は、その陰極に向けられた感光性素子に電子流を生成して、制御ユニット18に転送する電流や制御信号を生成する。光導電セルが利用されるとき、検出器48の電気抵抗は、手術される組織から反射されて検出器48によって受信される光の強度レベルに依存して変化する。制御ユニット18への信号は、かかる抵抗に基づいている。
【0041】
図4は、本発明の他の実施例のレーザアセンブリの一部を示す。図4において、能動素子及び光共振器の一部のみが、ハンドピースに配置されたメイン作業空洞部21に置かれている。かかる装置を収容するために、補助空洞部23が設けられている。励起装置28及び能動素子の第1すなわち補助部25は、補助レーザ共振器23内に配置されている。能動素子の第1部25の末端部29は、反射率が高いミラー32と対向するが、その最も近い端部31は、光ガイド41の端部37に配置される。励起装置28から能動素子の第1部25までの光エネルギの供給を有効に促進するために、補助空洞部の内部は、反射特
性が高い材料から形成されている。能動素子の第2の、すなわち作業部27と光共振器の半反射ミラー34とは、メイン作業空洞部21に配置されている。能動素子の第2部27の末端部33とその第1部の最も近い端部31とは、光ファイバガイド41によって光学的に接続されている。能動素子の近傍に配置される光ガイドの両端部は、光共振器の一部として製造することができる。この点で、補助空洞部23に配置された光ガイドの端部37は、能動素子の第1部25から第2部33に向かうレーザ照射の通過を促進する特性を有するミラーとして形成されている。メイン共振器21から必要とされる手術用レーザビ
ーム動作を容易にするために、その内部に配置された光ガイドの端部39は、能動素子の第2部27の方向にのみ、照射の通過を可能とするミラーとして形成することができる。図3の前述の実施例のように、オペレータに、電気ショックの危険が無く且つ軽量化された機器が提供される。これは、特に外科手術が長引いた場合の本発明の重要な効果である。
【0042】
レーザ外科装置の更に簡略化した実施例を、図5及び図6に示す。図5に示すように、ヘアドライヤのハウジングに類似したハンドピース112は、手術用パルスレーザ122と、冷却ファン138と、光ガイド装置146とを含む。患者に向けられる軸方向の気流を形成するために、ファン138は、手術用レーザの後方に配置されている。光ガイド装置146の2つの発光ダイオード145,147は、手術用レーザと集束レンズ136との間のハウジング内にインストールされている。発光ダイオードは、集束レンズ136の焦点面内での光ガイドビーム121,123の像の間の距離が、この面内の手術用レーザ
122の手術用ビーム127のスポットの直径と等しくなるように配置されている。したがって、手術用ビームスポットの目標領域は、光ガイドビームの可視の像を見ることによって識別することができる。この手術用ビームスポットの寸法は、かかる可視の像の間の距離を変えることによって調節される。電源ユニット114は、レーザ、ファン、光ガイド装置のみならず、ハウジングの外側に配置される吸入ユニット116にも給電する。安全性のために、全ての給電ケーブルは、陶製の金属ホースによって被覆することができる。手術用レーザ122のパルスレート及びパルスエネルギーは、電源ユニット114のコ
ントロールパネルからコマンドを生成することによって手動で設定される。前述の実施例と同様に、吸入ユニット116は、外科手術の間に生じる皮膚の崩れた粒子の断片を除去する。集束レンズ136は、クォーツガラスで作製することができる。
【0043】
図6のレーザ外科装置は、図5の装置と類似している。しかし、図6において、励起装置135は、ハンドピース112の外側に配置され、光エネルギの衝撃は、光ガイド137によって手術用レーザ122に供給される。この点において、図6の機器は、図3の実施例と同様の方法で動作する。能動レーザ素子すなわちロッドの一部がハンドピース(図4を参照のこと)の外側に配置される図6の変形例を考慮することもできる。
【0044】
図5及び図6に示す実施例において、集束レンズ136は、所定距離を手動で動かす。かかる移動の間、発光ダイオード145,147により生成される像の位置は、焦点面内での手術用レーザスポットのサイズを判別し、自動的に変わる。
【0045】
レンズ136が、手術用ビーム軸A−Aに対してほぼ垂直な方向に移動する場合、一連のレーザビーム像が、焦点面内に得られる。例えば、図11は、標準に対するこの状態を示し、図12はシリンドリカルレンズに対する状態を示す。
【0046】
ビームの軸と平行な方向に集束レンズが移動するとき、より複雑なイメージパターン、すなわち環状パターン(図13を参照のこと)や、螺旋パターン(図14を参照のこと)を得ることが可能である。手術のタイプに応じた集束レンズの置換は、本発明において可能である。多くの場合、最適のレンズは、手術用レーザビームの軸に沿って円滑に移動する光学部品を有するものであり、故に、光学部品を所定の中間位置に固定することができる。この点に関して、図7は、かかる3つの中間位置を有する集束レンズ137を示す。
【0047】
フォーカス領域における手術用レーザスポットのサイズは、制御ユニット18(図2を参照のこと)からの信号に対してマイクロ装置によって調整される。これは、オペレータや、または所定のプログラムによって手動で行われる。このように、手術用レーザビームの手術用レーザスポットのサイズは、レーザスポットの不規則性が許容されるサイズまで、集束レンズの焦点面において調節される。
【0048】
図8に示す集束レンズは、長方形のストリップとなる手術用ビームを生成する。これは、半円筒レンズ237を使用することによって得られる。このストリップの形において必要とされる変化は、所定の形態でレンズ237を回転させて案内することにより得られる。
【0049】
図9に示す集束レンズ236の実施例によって、本発明は、集束手術用レーザビームの移動の軌跡を環状に生成することができる。これは、集束レンズ236を、手術用レーザビームの軸A−Aから所定距離だけシフトさせた軸B−Bを中心に回転させることによって得られる。
【0050】
図10の実施例について、図10は、目標領域への手術用レーザビームを正確に集束せしめるための補助の集束レンズを示す。このため、レンズ236、239及びミラー245、247を有するレーザアセンブリ222を所定の状態に堅実に固定することは、賢明である。可視のガイド光は、見えない手術用レーザビームと予めアライメントすべきである。この場合、手術の対象である患者の身体の少なくとも一部を静止状態に維持することが望ましい。特別の装置を、この作業を行うために設けることもできる。
【0051】
本発明の外科装置は、水の「不透過性の窓」に対応する波長の全スペクトル内のレーザ照射を利用する。5−10J/cm2の手術用ビームスポットのレーザ照射密度且つ3−10mmの手術用レーザビームスポットの直径で、本発明の手術用レーザビームの表皮への浸透の深さは、10−20ミクロンを越えない。これは、約0.001秒の非常に短い継続時間を有する衝撃が印加されたときに起こる。組織を脱水した後、手術用レーザビームのスポットは、患者の皮膚の上層の局部的な蒸発のみを生じる。これは、手術領域を囲んでいる表皮の外面上健康な領域と同様に、深さ方向を傷つけずに生じる。組織の手術領
域は、皮膚の表層を手術用レーザビームのスポットを移動せしめることによって増加する。生体組織への手術用レーザビームの浸透の深さは、電磁衝撃の周波数を変えることによって操作することができる。30−60秒の継続時間を有する1回の作業(session)の間、約50−100の衝撃が供給される。
【0052】
本発明のレーザ外科装置を使用して、散乱赤外線レーザ放射によって患部を感染させないようにすることができる。このタイプの放射の密度は、通常の健康な皮膚に損傷を生じさせない。しかし、かかる放射は、疾病によって傷つけられた皮膚領域のブドウ状球菌のコロニーを除去する。
【0053】
レーザ外科装置の光学系によって、ユーザは、ガンの腫瘍の切除を含むレーザ切開及びレーザ光凝固術に先行する外科手術を行うことができる。本発明も、組織の1つの層の1回の蒸発によって、良性腫瘍の除去を容易にしている。この作業は、病気による影響を受けた皮膚の各部に、所定のスポット領域を有する複数のレーザ衝撃を印加することよって実行される。「血露(blood dew)」が皮膚の上に現れるまで、この治療は継続され、薬療法に移る。
【0054】
例えば顔のしわを治療する赤外線放射による皮膚の治療を実行するために、本発明のレーザ外科装置を、前もって設定された散乱放射のスキャニングシステムと組み合わせて使用することができる。この治療を利用するために、前もって設定されたプログラムによるビーム走査の状態を固定することは、好都合である(手術用ビームのスポットの直径は所定の方法で変えられ、ビームのエネルギ密度は可変または一定である。図15を参照のこと)。レーザビームがスロットの形を取る場合(図16を参照のこと)、同一の状態を提供できる。
【0055】
本発明の集束レーザ照射は、例えば、フルンケルや膿疱の切開や除去、その結果としての切開領域への薬の導入等の局部的な外科手術を処置するために利用できる。
【0056】
以下の実施例は、本発明をより完全に理解するために提示される。本発明の原理及び実行を示す特定の技術、条件、材料、結果は、例示であって、本発明の請求の範囲を制限するものとして解釈すべきでない。
【0057】
実施例1
Er:YAGレーザは、励起装置としてフラッシュランプを有するレーザ外科装置の能動素子として使用される。Er:YAG能動素予は、2つの平らな共振ミラーの間に配置される。レイジングが、波長2.94μm、パルス幅250±50μ秒、最大1Hzのパルスレート、最大2Jのパルスエネルギーで発生する。
【0058】
手術用レーザビームの形状は、集束装置により調節される。Er:YAGレーザビームは赤外線のスペクトル領域に属しているので、オペレータの肉眼では見えない。患者の皮膚における手術用レーザビームのレーザスポットの位置及び寸法は、スペクトルの可視領域のビームを発するガイド半導体レーザにより生成される2つのガイド光ビームの補助により示される。各ガイド光レーザビームの最大直径は、約2.0mmである。患者の皮膚に投影された2つのガイド光レーザビームの間の距離は、同一対象物でのEr:YAGレーザのスポット径に相当する。このように、患者の皮膚でのEr:YAGレーザビームの
位置及び直径は、ガイド光半導体レーザにより発せられる2つのガイド光レーザビームの位置により測定される。Er:YAGレーザのエネルギ密度は、1.0−10J/cm2の範囲で調整可能である。治療の間、ポンピングエネルギのレベルが同一であることを考慮すると、Er:YAGレーザビームの寸法が小さくなると、そのエネルギ密度は高くなる。患者の皮膚でのEr:YAGレーザビームのスポットの集束寸法が最小になると、直ちに、組織の局部的な蒸発が、最大1.5mmの深さで生じる。Er:YAGレーザビームのエネルギ密度が約50J/cm2であるときに、表皮から目で確認できる蒸発が起きる。
【0059】
48人の患者の皮膚病の治療は、50J/cm2の最大エネルギ密度を有するEr:YAGレーザによって表皮の表層蒸発を使用することにより行われる。そのうち、15人が尖キャンディロマス(pointed candylomas)を患い、8人がコロイド状の瘢痕を有し、8人が手及び足に疣を有し、10人が尖過角化症を患い、7人が入墨を有する。病気や皮膚の傷のタイプに応じて、治療は、各々が3〜20パルスからなる6〜10セッションを処置することにより実行される。
【0060】
これらのセッションの間、Er:YAGレーザビームのスポット径は、3〜5mmである。凝固の制御は、「血露」の症状が現れるまで実行される。患者の皮膚へのレーザビームのかかる印加の結果、周辺の血液の内容物の変化が検出されず、また、現れた病気の時間をあけた再発が無い。
【0061】
実施例2
実施例1とは異なり、実施例2のレーザ装置では、2つの作業空洞部が設けられている。第1空洞部において、電気パルスは光パルスに変換される。かかる光ポンピングパルスは、第2空洞部の光学光ガイドを介して入力される。そこで、光パルスはレーザビームに変換される。第1空洞部は、患者及び医療従事者から離れた電源ユニットに配置されている。第2空洞部は、外科装置のハンドピース内に位置する。この実施例では、他の作業空洞部は、第1空洞部が励起装置と手術用レーザロッドの一部とを含み、レーザロッドの主要部分が第2空洞部に配置されるように、形成されている。空洞部も、光学光ファイバガ
イドによって相互に接続されている。第2空洞部に入力されるレーザパルスは、光学光ガイドの損失を最小にするようなポンピング波長である。第2空洞部にて生成されるレーザパルスは、例えば2.94μmの必要な波長で動作するレーザ照射ビームに変換される。
【図面の簡単な説明】
【0062】
【図1】従来技術レーザ装置を示す。
【図2】本発明のレーザ外科装置の1実施例を示す。
【図3】レーザ外科装置のもう一つの実施例を示す。
【図4】レーザ外科装置の更なる実施例の一部を示す。
【図5】レーザ外科装置の簡単な実施例を示す。
【図6】レーザ外科装置のもう一つの簡単な実施例を示す。
【図7】フォーカシング装置のレンズの他の位置を示す。
【図8】円筒形集束レンズを有するレーザ外科装置を示す。
【図9】シフトされた軸を中心に可動な集束レンズを有するレーザ外科装置を示す。
【図10】レーザ外科装置へのアクセサリレンズの取り付けを示す。
【図11】レーザビーム像の異なるパターンを示す。
【図12】レーザビーム像の異なるパターンを示す。
【図13】レーザビーム像の更なるパターンを示す。
【図14】レーザビーム像の更なるパターンを示す。
【図15】前もって設定されたプログラムでのビームスキャンの状態を示す。
【図16】レーザビームの形がスロットになるときのビームスキャンの状態を示す。
【特許請求の範囲】
【請求項1】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、検出装置を含み、
前記検出装置は、前記被手術生体組織で反射された信号を受信しチェックすることによって前記被手術生体組織の状態を検出し、前記手術用ビームの特性を調整するための制御信号を生成し、
前記ハウジングが、オペレータの手に適合したハンドピースの一部を形成し、前記冷却装置の少なくとも一部が前記ハンドピースの内部に配置されていることを特徴とする皮膚疾患用レーザ外科装置。
【請求項2】
前記検出装置は、光学素子、光導電セル、及びフォトダイオードからなるグループから選択されることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項3】
前記検出装置は、前記ハンドピースの内部に少なくとも一部が位置することを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項4】
前記検出装置は、病気の種類や程度、皮膚の色、治療される皮膚層の深さに基づいて患者の皮膚から反射される光放射を識別できることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項5】
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置を更に含むことを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項6】
前記励起装置は、作業部及び補助部からなり、前記作業部は前記ハンドピース内に位置し、前記励起装置の前記補助部は前記ハンドピース外に位置し、前記励起装置の前記作業部と前記補助部とは少なくとも1本のファイバからなる光ガイドによって接続されていることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項7】
前記手術用レーザビームの波長は、スペクトルの赤外線領域に属していることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項8】
前記手術用ビームは、皮膚の損傷の消毒のために利用される散乱赤外線レーザ放射の形式であることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項9】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、前記ガス状冷却流は、前記手術用レーザ素子の長手軸に沿って方向付けられていて、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置を含み、
前記ハウジングが、オペレータの手に適合したハンドピースの一部を形成し、前記冷却装置の少なくとも一部及び前記吸入装置の少なくとも一部が前記ハンドピースの内部に配置されていることを特徴とする皮膚疾患用レーザ外科装置。
【請求項10】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、前記ガス状冷却流は、前記手術用レーザ素子の長手軸に沿って方向付けられていて、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置と、
少なくとも一部が前記ハンドピースの内側部分に位置し前記被手術生体組織に前記手術用ビームを照射するための2つの光ガイドビームを生成する光ガイドユニットと、
を含み、
前記光ガイドユニットは、前記光ガイドビームの像の間の距離が、この面内の前記手術用ビームのスポットの直径と等しくなるよう配置されていて、これにより手術用ビームスポットの目標領域が、光ガイドビームの可視の像を見ることにより識別できるようにすることを特徴とする皮膚疾患用レーザ外科装置。
【請求項1】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、検出装置を含み、
前記検出装置は、前記被手術生体組織で反射された信号を受信しチェックすることによって前記被手術生体組織の状態を検出し、前記手術用ビームの特性を調整するための制御信号を生成し、
前記ハウジングが、オペレータの手に適合したハンドピースの一部を形成し、前記冷却装置の少なくとも一部が前記ハンドピースの内部に配置されていることを特徴とする皮膚疾患用レーザ外科装置。
【請求項2】
前記検出装置は、光学素子、光導電セル、及びフォトダイオードからなるグループから選択されることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項3】
前記検出装置は、前記ハンドピースの内部に少なくとも一部が位置することを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項4】
前記検出装置は、病気の種類や程度、皮膚の色、治療される皮膚層の深さに基づいて患者の皮膚から反射される光放射を識別できることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項5】
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置を更に含むことを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項6】
前記励起装置は、作業部及び補助部からなり、前記作業部は前記ハンドピース内に位置し、前記励起装置の前記補助部は前記ハンドピース外に位置し、前記励起装置の前記作業部と前記補助部とは少なくとも1本のファイバからなる光ガイドによって接続されていることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項7】
前記手術用レーザビームの波長は、スペクトルの赤外線領域に属していることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項8】
前記手術用ビームは、皮膚の損傷の消毒のために利用される散乱赤外線レーザ放射の形式であることを特徴とする請求項1記載の皮膚疾患用レーザ外科装置。
【請求項9】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、前記ガス状冷却流は、前記手術用レーザ素子の長手軸に沿って方向付けられていて、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置を含み、
前記ハウジングが、オペレータの手に適合したハンドピースの一部を形成し、前記冷却装置の少なくとも一部及び前記吸入装置の少なくとも一部が前記ハンドピースの内部に配置されていることを特徴とする皮膚疾患用レーザ外科装置。
【請求項10】
皮膚疾患用レーザ外科装置であって、
内部領域及び外部領域を有するハウジングと、
前記内部領域内に延伸するレーザ共振器と、
を含み、
前記レーザ共振器は、少なくとも外側部分を有していて手術用ビームを生成する手術用レーザ素子と前記手術用レーザ素子を励起する励起装置とを有し、
前記皮膚疾患用レーザ外科装置は更に、
前記ハウジングの前記内部領域内でガス状冷却流を形成する冷却装置を含み、前記ガス状冷却流は、前記手術用レーザ素子の長手軸に沿って方向付けられていて、
前記手術用レーザ素子は、全体として前記ガス状冷却流の中に位置し、
前記皮膚疾患用レーザ外科装置は更に、
前記被手術生体組織の領域から前記手術の間に生じる破壊された組織生成物を除去する吸入装置と、
少なくとも一部が前記ハンドピースの内側部分に位置し前記被手術生体組織に前記手術用ビームを照射するための2つの光ガイドビームを生成する光ガイドユニットと、
を含み、
前記光ガイドユニットは、前記光ガイドビームの像の間の距離が、この面内の前記手術用ビームのスポットの直径と等しくなるよう配置されていて、これにより手術用ビームスポットの目標領域が、光ガイドビームの可視の像を見ることにより識別できるようにすることを特徴とする皮膚疾患用レーザ外科装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【公開番号】特開2011−104390(P2011−104390A)
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願番号】特願2011−6357(P2011−6357)
【出願日】平成23年1月14日(2011.1.14)
【分割の表示】特願2007−96736(P2007−96736)の分割
【原出願日】平成8年3月5日(1996.3.5)
【出願人】(503173065)イノテック ユーエスエイ インコーポレイテッド (2)
【Fターム(参考)】
【公開日】平成23年6月2日(2011.6.2)
【国際特許分類】
【出願日】平成23年1月14日(2011.1.14)
【分割の表示】特願2007−96736(P2007−96736)の分割
【原出願日】平成8年3月5日(1996.3.5)
【出願人】(503173065)イノテック ユーエスエイ インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

