レーザ治療装置
【課題】レーザ治療装置の施術の安全性の向上や術者の負担を軽減する。
【解決手段】レーザ治療装置11は、治療用プローブ24、観察用プローブ23、画像処理部67、病変消失判定部69、CPU68を備える。治療用プローブ24は、血管内に挿入される挿入部16に設けられ、挿入部16の外周と対向する血管に向けてレーザを照射して、血管に含まれる病変を消失させる。観察用プローブ23は、治療用プローブ24とともに挿入部16に設けられており、血管を走査して血管の断層画像72を得るための信号を検出する。画像処理部67は、観察用プローブ23によって検出された信号に基づいて断層画像72を生成する。CPU68は、病変消失判定部69の判定結果に応じて、治療用プローブ24を制御する。
【解決手段】レーザ治療装置11は、治療用プローブ24、観察用プローブ23、画像処理部67、病変消失判定部69、CPU68を備える。治療用プローブ24は、血管内に挿入される挿入部16に設けられ、挿入部16の外周と対向する血管に向けてレーザを照射して、血管に含まれる病変を消失させる。観察用プローブ23は、治療用プローブ24とともに挿入部16に設けられており、血管を走査して血管の断層画像72を得るための信号を検出する。画像処理部67は、観察用プローブ23によって検出された信号に基づいて断層画像72を生成する。CPU68は、病変消失判定部69の判定結果に応じて、治療用プローブ24を制御する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、レーザを照射して治療対象部位の治療を行うレーザ治療装置に関するものであり、さらに詳しくは、治療対象部位の断層画像をモニタリングしながら治療を行うレーザ治療装置に関する。
【背景技術】
【0002】
狭心症や心筋梗塞は、冠状動脈の狭窄、塞栓によって引き起こされることが知られている。冠状動脈の狭窄や塞栓の多くは、コレステロール等の脂質を主成分とするプラークが血管壁に付着したり、血管壁内部で増殖することによって引き起こされる。
【0003】
狭心症や心筋梗塞の治療方法としては、経皮的カテーテルインターベンション(PCI)が知られている。経皮的カテーテルインターベンションは、冠状動脈内にカテーテルを挿入しながら狭窄部や塞栓部(以下、治療対象部位という)を治療する治療方法であり、例えば、狭窄部へのベアメタルステントや薬剤溶出ステントの留置や、バルーンカテーテルによる治療対象部位の拡張等が行われる。また、完全塞栓やステント留置後の再狭窄の対応としては、レーザ血管形成術が施される。
【0004】
レーザ血管形成術は、プラークにレーザを照射することによってプラークを除去する施術法である。レーザ血管形成術では、アルゴンレーザやCO2@レーザ等の熱的なレーザが用いられるが、熱的なレーザでは病変の周辺にある正常組織に対しても熱的損傷が生じることが知られている。このため、近年では、紫外エキシマレーザ等の非熱的レーザによってレーザ血管形成術を行うレーザ治療装置が知られている(特許文献1,2)。
【0005】
また、特許文献3,4には、冠状動脈内に挿入される挿入部の先端に、治療用のレーザとOCT(Optical Coherence Tomography)のプローブユニットを一体的に設ける技術が記載されている。両者を組み合わせることで、治療対象部位をリアルタイムにモニタしながらレーザ血管形成術を行うことが可能になる。また、従来の血管形成術においては、X線による透視増を撮影して、これを治療対象部位の観察に利用していたが、OCTを用いることにより、X線画像よりも鮮明な断層画像を得ることが可能になる。さらに、X線による被爆量を軽減する効果もある。
【特許文献1】米国特許第5093877号明細書
【特許文献2】欧州特許出願公開第03555200号明細書
【特許文献3】特開2005−230549号公報
【特許文献4】特表2001−515382
【発明の開示】
【発明が解決しようとする課題】
【0006】
レーザ血管形成術においては、治療対象部位は非常に小さく、しかも血管壁の厚みも薄いため、術者はレーザ照射と画像確認を頻繁に繰り返しながら、レーザの照射位置の確認やレーザの出力制御を行う等、慎重に施術を進める必要がある。このように、レーザ血管形成術では、高度かつ繊細な技術が求められるため、術者への負担が大きい。こうしたことから、施術の安全性の向上や、術者への負担を軽減する対策が要望されている。
【0007】
しかしながら、特許文献1,2には、単に治療用のレーザとOCTを組み合わせることが記載されているのみであり、両者を連携させる具体的な制御内容は開示されていない。
【0008】
本発明は、上述のような背景に鑑みてなされたものであり、施術の安全性の向上や術者の負担を軽減することを目的とする。
【課題を解決するための手段】
【0009】
本発明のレーザ治療装置は、体腔内に挿入される挿入部に設けられ、治療対象部位に含まれる病変に向けてレーザを照射して、前記病変を消失させる治療用プローブと、前記治療用プローブとともに前記挿入部に設けられており、前記治療対象部位内を走査して前記治療対象部位の断層画像を得るための信号を検出する観察用プローブと、前記観察用プローブによって検出された信号に基づいて断層画像を生成する断層画像生成手段と、前記断層画像を解析して前記病変の消失状況を判定する判定手段と、前記判定手段の判定結果に応じて、前記治療用プローブを制御する制御手段と、を備えたことを特徴とする。
【0010】
また、前記判定手段は、前記断層画像が更新される毎に判定を行うことが好ましい。
【0011】
また、前記断層画像を表示する表示手段を含むコンソールを備えていることが好ましい。
【0012】
また、前記制御手段は、前記レーザの照射のオンオフ、照射位置、単位時間当たりの照射量、波長の切り替えの少なくとも1つを含む照射条件を制御することが好ましい。
【0013】
また、前記制御手段は、前記治療用プローブを自動的に制御する自動制御モードを有しており、前記自動制御モードにおいて、前記病変が消失するまで前記レーザ照射手段によるレーザの照射を継続し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射を停止することが好ましい。
【0014】
また、前記制御手段は、前記治療用プローブに対する術者の操作をアシストするアシストモードを有しており、前記アシストモードにおいて、前記病変が消失するまで前記治療用プローブに対するレーザの照射操作を許容し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射操作を禁止することが好ましい。
【0015】
また、前記判定手段は、前記断層画像を解析して前記病変を識別することにより、前記病変が消失したか否かを判定することが好ましい。
【0016】
また、前記病変を識別するための基準となる参照値を取得する参照値取得手段を備えていることが好ましい。
【0017】
また、前記断層画像内の治療範囲の指定を受け付ける受付手段を備えることが好ましい。
【0018】
また、前記判定手段は、指定された前記治療範囲内において前記病変が消失したか否かを判定することが好ましい。
【0019】
また、前記判定手段による判定結果を警告する警告手段を備えることが好ましい。
【0020】
また、前記治療用プローブは、波長が5.75μmのレーザを照射することを特徴とするが好ましい。
【0021】
また、前記治療用プローブは、1100nm以上1800nm以下の範囲に含まれる波長のレーザを照射することを特徴とするが好ましい。
【0022】
また、前記治療用プローブの光源は、半導体レーザまたは自由電子レーザのいずれかであることが好ましい。
【0023】
また、前記治療用プローブは、193nm、248nm、308nm、351nmのうち、少なくとも1つの波長のレーザを照射することが好ましい。
【0024】
また、前記治療用プローブは、異なる複数の波長のレーザを照射可能なことを特徴とするが好ましい。
【0025】
また、前記観察用プローブは、光の干渉を利用して断層画像を得るプローブであることが好ましい。
【発明の効果】
【0026】
本発明によれば、施術の安全性の向上や術者の負担を軽減することができる。
【発明を実施するための最良の形態】
【0027】
図1に示すように、レーザ治療装置11は、冠状動脈等の血管12(治療対象部位)内に挿入する挿入部16が備えられている。レーザ治療装置11は、挿入部16を通して血管12の断層画像をリアルタイムに観察しながら病変17にレーザを照射して、血管12の狭窄や塞栓等、血管12の患部を治療する。
【0028】
挿入部16は、カテーテル21とプローブユニット22から構成される。カテーテル21は、透明で可撓性に富んだ材料からなり、挿入部16の最も外郭に位置し、内部にはプローブユニット22が挿入される。挿入部16は、可撓性を有しており、血管12に挿入されると、血管12の湾曲形状に応じて自在に湾曲する。
【0029】
プローブユニット22は、チューブ22a、観察用プローブ23、治療用プローブ24等が一体となって構成されている。このため、プローブユニット22がカテーテル21に沿って湾曲されたり、カテーテル21内を掃引されたりするときには、チューブ22a、観察用プローブ23、治療用プローブ24は一体となって湾曲、掃引される。
【0030】
チューブ22aは、カテーテル21と同様に、透明で可撓性に富んだ材料からなり、カテーテル21の湾曲に応じて自在に湾曲する。また、チューブ22aは、軸Aに沿ってカテーテル21内を自在に移動するように設けられており、レーザ治療装置11が血管12の断層画像を取得する際や、血管12の病変17を治療する際にカテーテル21内を掃引される。なお、軸Aは、挿入部16の挿入軸であるとともに、血管12の管軸と平行になっている。
【0031】
観察用プローブ23は、いわゆるOCT用のプローブであり、断層画像を取得するための低コヒーレンス光を血管12の内壁に向けて照射し、血管12からの反射光を制御装置37(後述)に導く。
【0032】
観察用プローブ23は、反射光学部材26と導光部27とからなる。導光部27は、光ファイバやGRINレンズ等から構成され、プローブユニット22の湾曲に応じて自在に湾曲する。また、低コヒーレンス光を反射光学部材26へ導き、血管12からの反射光を制御装置37へと導く。反射光学部材26は、例えばプリズムであり、導光部27の先端に設けられている。反射光学部材26は、導光部27から入射される低コヒーレンス光を反射面26aで軸Aに対して垂直な方向に屈曲し、血管12へ向けて低コヒーレンス光を照射する。また、血管12からの反射光が反射光学部材26に入射すると、反射面26aで軸Aに沿った方向へと屈曲され、導光部27へと導かれる。
【0033】
また、観察用プローブ23は、軸Aと平行な中心軸周りに矢印で示すように、所定方向に回転するように設けられている。観察用プローブ23は、回転しながら低コヒーレンス光を照射することにより血管12の内壁面の全周を走査し、その走査位置における断層画像を得るための反射光(断層画像を得るための信号)を受信する。また、観察用プローブ23は、チューブ22aがカテーテル21内で掃引されることによって、軸A方向に移動し、血管12の管道に沿った走査を行う。観察用プローブ23は、この走査により、軸A方向における走査位置が異なる複数枚の断層画像を得る。
【0034】
治療用プローブ24は、血管12に向けて治療用のレーザを照射し、病変17を分解または蒸散させることにより消失させる。治療用プローブ24は、反射光学部材28と導光部29を1セットのレーザ照射部31として、複数セットのレーザ照射部31から構成される。これらのレーザ照射部31は、観察用プローブ23の導光部27の周囲を囲むように配置されており、治療用プローブ24はこれらのレーザ照射部31のうち、ひとつのレーザ照射部31から病変17に向けてレーザを照射する。
【0035】
導光部29は、観察用プローブ23の導光部27と同様に光ファイバやGRINレンズ等から構成され、チューブ22aの湾曲に応じて自在に湾曲するとともに、レーザを反射光学部材28へ導く。反射光学部材28は、反射光学部材26と同様のプリズムであり、導光部29の先端に設けられており、導光部29から導かれるレーザを反射面28aで屈曲して血管12へと照射する。反射光学部材28は、観察用プローブ23の反射光学部材26の光路に重ならないように、観察用プローブ23の反射光学部材26よりも軸A方向において基端側に設けられている。このように、各反射光学部材26,28の位置が軸A方向においてずれているので、反射光学部材26と反射光学部材28のそれぞれの反射面26a、28aの傾斜角を変えることにより、低コヒーレンス光とレーザの照射位置が軸A方向において同一になるようにしている。
【0036】
なお、図1において、治療用プローブ24は、図示の便宜上、8個のレーザ照射部31からなるが、治療用プローブ24は、血管12の任意の位置にレーザを照射できる程度に、多数のレーザ照射部31から構成される。
【0037】
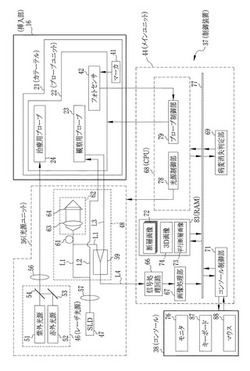
図2に示すように、レーザ治療装置11は、制御装置37やコンソール38等を備えている。挿入部16の各部は、制御装置37等と基端部分39で接続されている。
【0038】
観察用プローブ23は、制御装置37から低コヒーレンス光が入力され、血管12からの反射光を制御装置37に入力する。また、観察用プローブ23の軸A回りの回転は、制御装置37によって制御される。
【0039】
治療用プローブ24には、制御装置37から治療用のレーザが入力される。治療用プローブ24に入力されるレーザは、病変17の種類や、病変17を蒸散させるか分解するかといった治療様態等に応じて、適切な波長が選択される。また、治療用プローブ24に入力されるレーザの強度は、病変17の大きさや深さに応じて調節される。こうしたレーザの調節は、例えば、術者がコンソール38を用いて制御装置37に対して適切な波長や強度の操作指示を入力することによって行われる。また、後述するように、レーザ治療装置11が自動(あるいは半自動)で制御される動作モードで使用されるときには、制御装置37によって自動的に最適値が設定される。
【0040】
挿入部16の基端部分39には、マーカー41と、マーカー41を検知するフォトセンサ42が設けられている。マーカー41は、カテーテル21に設けられ、円環状の模様が軸Aに沿った方向に一定の間隔で並んだ縞模様となっている。マーカー41は、プローブユニット22がカテーテル21内を移動するときにフォトセンサ42によって検知される。フォトセンサ42からの信号は制御装置37に入力され、後述するようにカテーテル21内でのプローブユニット22の軸A方向の位置制御に用いられる。
【0041】
図3に示すように、制御装置37は、光源ユニット43、メインユニット44等から構成される。光源ユニット43は、レーザ光源46、スーパールミネッセントダイオード(SLD)47、ファイバ結合光学系48等から構成される。
【0042】
レーザ光源46は、治療用プローブ24にレーザを入力する光源であり、紫外光源51と赤外光源52の2種類の光源を備えている。紫外光源51は、XeClを用いたエキシマレーザであり、波長308nmの紫外線レーザをパルス出力する。波長308nmの紫外線レーザは、光音響プロセス及び光化学プロセスによりプラークを分解する。このため、紫外光源51は、正常組織に熱的損傷を与えずにプラークを選択的に分解する場合に用いられる。
【0043】
また、赤外光源52は、量子カスケードレーザであり、波長5.75μmの赤外線レーザをパルス出力する。波長5.75μmの赤外線レーザは、コレステロールエステルのエステル結合に選択的に吸収され、エステル結合を分解する。このため、赤外光源52は、コレステロールエステルを主成分とする脂質プラークを分解させるときに用いられる。また、波長5.75μmの赤外線レーザは適度なエネルギーで照射すれば、上述のように脂質プラークを選択的に分解するが、さらに高エネルギーで照射することにより脂質プラークを含めた周辺組織を蒸散させる。このため、プラークを蒸散させる治療を行うときは、赤外光源52が高エネルギーで出力される。このような赤外光源52の出力は、後述する光源制御部78によって調節される。
【0044】
また、レーザ光源46は、紫外光源51や赤外光源52の光路に、赤外線を反射する反射鏡53や、赤外線を反射し、赤外線を透過する半透鏡54が設けられている。これにより、赤外光源52からの赤外線レーザと紫外光源51からの紫外線レーザとが同じ光路で出力されるようになっている。そして、レーザ光源46から出力されるレーザは、レンズ56によって光ファイバに集光して入射され、治療用プローブ24に出力される。
【0045】
SLD47は、低コヒーレンス光源であり、中心波長800nmでコヒーレンス長が20μmの低コヒーレンス光を出力する。SLD47から出力される低コヒーレンス光は、レンズ57によって光ファイバに集光して入射され、ファイバ結合光学系48に入射する。
【0046】
ファイバ結合光学系48は、ファイバカプラ59、ピエゾ素子61、光路遅延部62等から構成される。SLD47から入力される低コヒーレンス光は、参照光L1と信号光L2に分岐される。参照光L1は光路遅延部62に入射される。信号光L2は、観察用プローブ23から血管12に入射される。そして、信号光L2は、血管12で反射されて、血管12の断層画像を得るための信号光L3となり、ファイバ結合光学系48に入力される。信号光L3には、信号光L2が血管12の壁面内の様々な深さで反射された光が混じり合っている。
【0047】
ピエゾ素子61は、参照光L1が光路遅延部62に至る光路上に設けられ、信号光L3対して僅かな周波数差が生じるように参照光L1を変調する。また、光路遅延部62は、レンズ63と、レンズ63の光軸に沿って平行に移動自在に設けられたプリズム64とから構成される。光路遅延部62に入射した参照光L1は、レンズ63によって平行光に変換されてプリズム64に入射する。そして、プリズム64で反射されると、レンズ63によって集光されて、入射時の光路と同じ光ファイバに戻される。このとき、プリズム64がレンズ63の光軸に沿って移動されると、参照光L1の光路長が変化する。こうして参照光L1の周波数と光路長が調節されることにより、参照光L1と干渉する信号光L3の光路長が調節される。このため、プリズム64の移動によって、断層画像の信号が得られる血管12の壁内方向の長さ(深さ)が変化する。
【0048】
こうして周波数と光路長が調節された参照光L1は、ファイバカプラ59で信号光L3とともにファイバカプラ59へ入力される。ファイバカプラ59は、参照光L1と信号光L3を干渉させた干渉光L4を信号処理回路66(後述)に入力する。
【0049】
メインユニット44は、信号処理回路66、画像処理部67、CPU68、病変消失判定部69、コンソール制御部71等から構成される。
【0050】
信号処理回路66は、光検出器、ヘテロダイン検出回路等から構成され、ファイバカプラ59入力される干渉光L4の強度を電気信号に変換する。信号処理回路66は、プリズム64の移動や観察用プローブ23の回転とともに、連続的に入力される干渉光L4から断層画像を得るための信号を検出し、これを画像処理部67に出力する。
【0051】
画像処理部67は、信号処理回路66から順次入力される信号から、図4に示すように、血管12の断層画像72を生成する。これにより、レーザ治療装置11は、血管12の断層画像72を取得する。ここで取得される断層画像72は、血管12の管軸方向に垂直な断面の画像であり、カテーテル21内におけるプローブユニット22の掃引にともなって、血管12の様々な位置での断層画像72が取得される。また、画像処理部67は、1回のプローブユニット22の掃引で生成される複数の断層画像72から、血管12の管軸方向に平行な方向の断層画像(以下、平行断層画像という)73や、血管12の立体的な画像74(以下、3D画像という)を生成する。こうして画像処理部67で生成された断層画像72、平行断層画像73、3D画像74は、RAM83に記憶される。また、断層画像72、平行断層画像73、3D画像74(以下、これらをまとめて観察画像という)は必要に応じてモニタ76に表示される。また、断層画像72及び平行断層画像73には、組織の相違が輝度の相違として表れるので、輝度の分布から血管12の内膜、中膜、外膜といった正常組織の様子や、プラーク等の病変の様子が観察される。
【0052】
CPU68(制御手段,警告手段)は、システムバス77を介して、画像処理部67、病変消失判定部69、コンソール制御部71等と接続されており、これらの動作を制御する。また、CPU68は、後述する病変消失判定部69による判定結果等に基づいて、レーザ治療装置11が適切に操作されているかを監視し、レーザ治療装置11に対して不適切な操作がなされたときには、操作が適切でない旨の警告や適切な操作を行わせるためのガイダンスをモニタ76に表示させる。CPU68は、光源制御部78、プローブ制御部79を備える。
【0053】
光源制御部78は、光源ユニット43に接続されており、レーザ光源46やSLD47のオンオフの切り替えや、光源ユニット43から出力するレーザの波長や照射エネルギー等の照射条件の切り替え,調節等を行う。例えば、光源制御部78は、紫外光源51と赤外光源52の一方を選択的に駆動させることにより、レーザ光源46から出力するレーザの波長を切り替える。また、光源制御部78は、プラークを分解するか、蒸散させるかといった治療様態や、病変17の厚み等に応じて、レーザ光源46から出力させるレーザの単位時間当たりの照射量を調節する。こうしたレーザの照射エネルギーの調節は、紫外光源51や赤外光源52のパルス周波数、パルス幅、デューティー比の何れかを変更することによって行われる。さらに、光源制御部78は、SLD47のオンオフ制御や、プリズム64の掃引速度等、プリズム64の動作制御を行う。
【0054】
光源制御部78は、術者によってレーザの照射条件が設定されて、レーザの照射操作が行われると、後述する病変消失判定部69の判定結果に基づいて、術者の設定したレーザの照射条件が適切であるか否かを判定する。この判定の結果、レーザの照射条件が適切でないときには、コンソール制御部71を介してモニタ76に警告を表示させるとともに、レーザ光源46をオフにし、強制的にレーザの照射を中止させる。
【0055】
プローブ制御部79は、プローブユニット22の各部と接続されており、これらの動作を制御する。プローブ制御部79は、設定等により定められた取得レートで血管12の断層画像72が取得されるように、観察用プローブ23の回転動作を制御する。また、プローブ制御部79は、プローブユニット22をカテーテル21内で移動させる駆動系と接続されており、レーザ治療装置11によってプローブユニット22の掃引が自動で制御されるときには、プローブユニット22のカテーテル21内での移動を制御する。このとき、フォトセンサ42からの信号に基づいて、プローブユニット22を駆動させる駆動系(図示しない)のドリフトやバックラッシュを補償し、カテーテル21に対するプローブユニット22の位置を正確に制御する。
【0056】
また、プローブ制御部79は、術者によってプローブユニット22の掃引が手動で制御されるときには、プローブユニット22のカテーテル21内での位置を監視する。このとき、プローブユニット22が所定位置よりも奥に挿入されてカテーテル21を損傷したり、カテーテル21から引き抜かれて挿入部16が損傷することがないように、プローブユニット22の軸A方向の移動範囲を所定範囲内に規制する。そして、プローブユニット22がこの所定範囲から外れようとしたときには、コンソール制御部71を介してモニタ76に警告を表示させるとともに、プローブユニット22の移動を強制的に中止させる。
【0057】
病変消失判定部69は、画像処理部67によって生成された断層画像72等の観察画像をRAM83から読み出して、断層画像72の輝度の分布を解析することにより、断層画像72内の病変17を識別する。これにより、病変の有無や、病変の厚み、角度範囲(断層画像72においては中心角で規定される病変17の大きさ)といった病変の大きさを判定する。また、レーザの照射後に、新たに取得された断層画像27について、病変消失判定部69が病変の有無を判定することにより、レーザの照射によって病変17が消失したか否か(消失状況)が判定される。病変消失判定部69による判定結果は、RAM83に一時的に記憶され、CPU68によってレーザ治療装置11の動作制御に用いられる。
【0058】
コンソール制御部71は、コンソール38(参照値取得手段、受付手段)を制御する。コンソール38は、観察画像や操作メニュー等を表示するモニタ76(表示手段)や、キーボード87やマウス88といった入力装置からなる。例えば、コンソール制御部71は、レーザ治療装置11が断層画像72を取得すると同時に、RAM83から断層画像72を読み出してビデオ信号に変換し、リアルタイムにモニタ76に表示する。
【0059】
また、コンソール制御部71は、モニタ76に観察画像を表示するときに、表示された観察画像を見ながらレーザ治療装置11を操作するためのメニューや、治療範囲を指定するツールを観察画像にあわせて表示する。例えば、断層画像72等の複数の観察画像をモニタ76に表示するときに、断層画像72と、平行断層画像73や3D断層画像74との対応を示す基準線を表示し、レーザを照射するときには、断層画像72内に照射方向を示す矢印等を表示する。また、モニタ76に表示されるメニューやツール(GUIによる操作ツール)は、キーボード87やマウス88からの入力に基づいて操作される。
【0060】
RAM83は、断層画像72や各種設定値を記憶するメモリである。RAM83には、観察画像の他に、病変が比較的大きなときに照射するレーザの照射エネルギー値(以下、標準値という)や、病変消失判定部69が判定する病変17の径方向の大きさ(厚さ)と比較される閾値、術者によって指定される病変17の輝度値等、種々の設定やデータ等が記憶される。
【0061】
上述のように構成されるレーザ治療装置11は、マニュアルモード、アシストモード、オートモード(自動制御モード)の3種の動作モードが切り替え自在となっており、治療の様態や断層画像の観察の様態等に応じて任意に選択して使用される。
【0062】
マニュアルモードは、レーザ治療装置11の操作を術者が全て手動で行う動作モードである。マニュアルモードでは、治療時のプローブユニット22の掃引、治療範囲の指定や、レーザの波長,照射エネルギー等の各種照射条件の設定は、断層画像72を観察しながら術者が行う。
【0063】
アシストモードは、術者がレーザ治療装置11を操作しながらも、煩雑な操作や設定の一部をレーザ治療装置11が自動的に行ったり、レーザ治療装置11が不適切に操作されたときに警告やガイダンスを表示して術者に適切な操作を促したりすることで、術者をアシストする動作モードである。
【0064】
オートモードは、挿入部16を血管内12に挿入した後の操作を、術者の開始操作を契機に全て自動で行う動作モードである。例えば、術者がコンソール38から、断層画像取得の開始操作をすると、プローブユニット22を自動的に掃引して、断層画像72を取得する。また、治療範囲を指定した後に、治療の開始操作をすると、指定した治療範囲内で病変17を自動的に認識して、病変17にレーザを照射し、治療を行う。
【0065】
[第1実施形態]
以下では、レーザ治療装置11をアシストモードで使用し、レーザを照射しながら、リアルタイムに病変17の消失状況を判定し、判定結果に応じてレーザのオンオフを制御する例を、第1実施形態として説明する。まず、血管12内に挿入部16が挿入されると、プローブユニット22を掃引し、観察用プローブ23からの信号に基づいて、血管12の断層画像72が取得される(ステップS1)。
【0066】
このとき取得される断層画像72は、図4に示すように、モニタ76にリアルタイムに表示される。同時に、取得された複数の断層画像72から、平行断層画像73や3D画像74が生成され、設定に応じて平行断層画像73(図4A)か3D画像74(図4B)の何れかが、断層画像72と同時にモニタ76に表示される。また、平行断層画像73と3D画像74の表示は、コンソール38の操作によって切り替え可能である。
【0067】
また、図4(A)に示すように、断層画像72や平行断層画像73には、相互の位置関係を示す基準線91a,91bが表示される。基準線91aは自在に回転または移動するようになっており、マウス88により操作されるカーソル97によってドラッグして基準線91a,91bを移動させると、基準線91a,91bの位置に応じた断層画像72,平行断層画像73が表示される。例えば、断層画像72内に表示された基準線91aを回転させると、回転後の基準線91aの断面の平行断層画像73に変わる。同様に、平行断層画像72内で基準線91bを左右に移動させると、移動後の基準線91bの位置に対応する断層画像72が表示される。
【0068】
さらに、平行断層画像73内には、1組の範囲指定線92a,92bが表示される。病変17の治療を行うときには、範囲指定線92a,92bをそれぞれカーソル97で移動させることで、範囲指定線92a,92bの間の領域を血管12の管軸方向の治療範囲に指定する。ここで指定する管軸方向の治療範囲は、病変17を含むように指定される。こうして指定された管軸方向の治療範囲内で、プローブユニット22がカテーテル21内を移動して、病変の消失状況の判定や、観察画像の取得、治療等が行われる。
【0069】
断層画像72とともに3D画像74を表示する場合には、図4(B)に示すように、3D画像74内には基準線91aの方向で血管12を切断した立体的な血管12が表示される。このとき3D画像74内には、断層画像72に対応する位置を示す基準線91cが表示される。平行断層画像73の場合と同様に、基準線91cを移動させれば、断層画像72は、移動後の基準線91cにおける断層画像72に更新される。また、断層画像72で基準線91aを回転させれば、3D画像74における血管12の切断方向が変化する。このとき、新たに表示される3D画像74は、血管12の内面が観察できるように、適宜回転して表示される。なお、3D画像74は、血管12の立体的な様子が表示されるので、平行断層画像73では基準線91a,91bを調節しなければ観察することができなかった病変17や血管12の分岐12a等が比較的容易に観察される。
【0070】
また、断層画像72内には、レーザの照射方向を示す矢印96が表示される。レーザを照射するときには、矢印96を回転させることにより、病変17に向けて正しくレーザが照射されるように、レーザの照射方向が定められる。
【0071】
血管12の断層画像72が取得されると、術者は、モニタ76で断層画像72等を観察しながら病変17の有無や容体を把握する。そして、レーザの照射によって病変17が消失してゆく状況を断層画像72でリアルタイムに確認しながら治療が行われる。
【0072】
図5(A)のフローチャートに示すように、まず、観察画像を取得し(ステップS1)、病変17を観察できる断層画像72aを表示させる。カーソル97で病変17をクリックする操作により、病変17の輝度値が指定される。コンソール38は、この指定を受けてCPU68に入力する(ステップS2)。この輝度値は、病変消失判定部69が画像解析により病変17を識別するための参照値である。これにより、レーザ治療装置11は、断層画像72aから、入力された輝度値の部分が病変17であることを認識する。
【0073】
そして、術者は、平行断層画像73(または3D画像74)を確認しながら、血管12の管軸方向における病変17の大きさ(長さ)と略等しくなるように、範囲指定線92a,92bで病変17を囲む。この操作によって、管軸方向の治療範囲が指定され、その指定情報がコンソール38を通じてCPU68に入力される(ステップS3)。こうして管軸方向の治療範囲が指定されることで、プローブユニット22の移動範囲が治療範囲内に限定される。これにより、指定した管軸方向の治療範囲内に限って、レーザの照射が許容されるようになる。そして、管軸方向の治療範囲の指定が完了すると、プローブユニット22は、指定した治療範囲の一端の治療開始位置に移動される。この間も観察用プローブ23は動作を続けるので、最新の断層画像72がモニタ76に表示される。
【0074】
プローブユニット22が治療開始位置に移動されると、治療開始位置での断層画像72bを観察しながら、病変17の大きさ等に応じて、治療に使用するレーザの波長、照射エネルギーといったレーザの照射条件が設定される(ステップ4)。この治療開始位置での断層画像72bが表示される。同時に、レーザの照射方向を示す矢印96が断層画像72b内に表示され、この矢印96を病変17に向けて回転させることで、矢印96の方向にレーザの照射方向が指定される。
【0075】
こうした照射条件の設定が完了すると、レーザの照射を開始する操作が行われる(ステップS5)。このとき、レーザ治療装置11は、指定された病変17の輝度値の画素が最新の断層画像72bにあるか否かを比較し、病変17があるか否か(消失状況)を判定する(ステップS6)。断層画像72bのように、断層画像72b内に病変17があるときには、レーザ治療装置11はレーザの照射操作を許容し、レーザの照射操作にしたがってレーザをオンに制御し、指定された照射条件で病変17にレーザを照射する(ステップS7)。そして、レーザの照射直後に更新された断層画像72cについて、指定された病変17の輝度値の画素があるか否かを判別することによって、病変17の消失状況を判定する(ステップS8)。このとき、レーザの照射方向に病変17が残されていれば、断層画像72dのように病変が全て消失するまで、レーザの照射条件の設定から上述の手順が繰り返される。
【0076】
一方、レーザを照射する操作が行われたときに、指定したレーザの照射方向に病変17がない場合には、レーザ治療装置11は、レーザの照射操作を無効として、強制的にレーザをオフに操作し、新たなレーザの照射操作を禁止し(ステップ9)、警告を表示する(ステップ10)。
【0077】
ここで表示される警告は、図6に示すように、モニタ76に警告ウィンドウ110を表示して行われる。警告ウィンドウ110では、病変17が消失し、既に病変17がないことや、レーザの照射を中止したことを術者に警告する。
【0078】
上述のように、レーザ治療装置11は、レーザの照射操作が行われたときやレーザの照射直後に、最新の断層画像72からリアルタイムに病変17の消失状況を判定し、この判定の結果に基づいて、レーザのオンオフを制御する。このため、レーザの誤射を防ぐことができ、安全な治療を行うことができる。
【0079】
[第2実施形態]
以下では、病変17の消失状況に基づいて、レーザの照射エネルギーを制御する例を、第2実施形態として説明する。まず、第1実施形態と同様にして、観察画像を取得し、病変17の輝度値の入力や血管12の管軸方向の治療範囲の指定、レーザの照射条件の設定を行う(ステップS1〜S4)。そして、レーザの照射操作を行うと、レーザ照射装置11は、最新の断層画像72内に入力された病変17の輝度値があるか否かを比較し、病変17の消失状況を判定する(ステップS5〜S6)。
【0080】
判定の結果、最新の断層画像72内に病変17がある場合には、病変消失判定部69は、指定されたレーザの照射方向について、病変17の厚さを判定し、CPU68に入力する。CPU68は、病変17の厚さの判定結果を受けて、これを予め定められた閾値と比較する。そして、病変17の厚さが閾値よりも大きく、病変17が比較的厚い場合には、レーザの照射エネルギーを標準値に設定してレーザを照射する。レーザの照射エネルギーの標準値は、前述のように、選択したレーザで比較的厚みの大きい病変17を治療するときに適した照射エネルギーであり、光源毎に予め定められている。
【0081】
一方、判定した病変17の厚さが、閾値以下の値であるときには、CPU68(光源制御部78)は、指定された照射エネルギーではなく、病変17の厚さに応じて、標準値よりも小さな照射エネルギーとなるようにレーザ光源46を調節してから(ステップ13)、レーザ光を照射させる(ステップ14)。このとき、CPU68は、レーザの照射エネルギーを、病変17の厚さが厚いほど標準値に近く調節し、病変17が薄いほど小さな値となるように調節する。
【0082】
このように、病変17の厚さに応じた照射エネルギーに調節してレーザを照射すると、第1実施形態と同様に、レーザ照射直後の最新の断層画像72を取得し、病変17の消失状況を判定する(ステップS8)。この結果、病変17が消失していなければ、病変17が消失するまで、上述の手順による治療がレーザの照射条件の設定から繰り返し行われる。一方、病変17が消失し、最新の断層画像72から病変17が認識されなかったときには、レーザを照射させない。
【0083】
こうして、病変17の消失状況を判定し、この判定結果のうち、病変17の厚さに応じてレーザの照射エネルギーを制御すると、病変17が小さく、病変17が薄い場合に、過剰な照射エネルギーでレーザを照射してしまうことを防止することができる。特に、レーザ治療装置11で観察することができる血管12の径方向の長さ(断層の深さ)には限界があり、病変17が大きく厚みがあるばあいには、断層画像72で病変17の輪郭をすべて観察することができないが(図5B参照)、上述のように照射エネルギーを調節することで、厚みのある病変17の場合にも、治療を安全に行うことができる。
【0084】
なお、上述の第2実施形態では、病変17の消失状況を判定し、この判定結果のうち、病変17の厚さに応じてレーザの照射エネルギーを制御する例を説明したが、これに限らず、病変17の消失状況の判定に応じて、レーザの照射位置やレーザの波長を切り替えるようにしても良い。例えば、病変17の消失状況の判定からレーザの照射位置の制御を行う場合に、病変消失の判定結果から、病変消失判定部69は、軸Aを中心として病変17のある角度範囲を認識し、病変17のある角度範囲の情報をCPU68に入力する。CPU68は、レーザの照射方向を入力された角度範囲内におさまるように、レーザの照射方向を自動的に調節する。また、病変17の消失状況に応じてレーザの波長を切り替えるときには、上述の第2実施形態と同様に、病変消失判定部69は、病変17の厚さを認識し、病変17の厚さの情報をCPU68に入力する。CMPU68は入力された病変17の厚さと、前述の閾値とを比較し、病変17の厚さが厚いときには、赤外光源52を用いて高エネルギーの赤外線レーザを用いる。一方、レーザの照射によって病変17が薄くなった場合には、紫外光源51を用いて紫外線レーザを治療に用いる。
【0085】
[第3実施形態]
上述の第1,第2実施形態では、病変17の消失状況の判定を行う治療範囲を、血管12の管軸方向で指定する例を説明したが、これに限らず、治療範囲として、血管12の管軸を中心とした範囲を指定するようにしても良い。以下では、断層画像72を観察しながら、断層画像72内で血管12の管軸に垂直な面内で治療範囲を指定する例を第3実施形態として説明する。
【0086】
まず、前述の第1実施形態や第2実施形態と同様にして、観察画像を取得して、病変17の輝度値の入力し、病変17の輝度値を入力する(ステップS1〜S2)。そして、平行断層画像73(または3D画像74)を確認しながら、血管12の管軸方向における病変17の長さと略等しくなるように、範囲指定線92a,92bで病変17を囲まれると、範囲指定線92a,92bの間の領域が管軸方向の治療範囲として指定される(ステップS3)。これと同時に、コンソール制御部71は、図8に示すように、表示している断層画像72に、血管12の管軸に対して垂直な方向の範囲を指定する円形の範囲指定線92cを表示させる。ここで表示される範囲指定線92cは、カーソル97でドラックすることで、円形のまま、血管12の管軸を中心に径が変化される。また、コンソール制御部71は、範囲指定線92cの径が変化したときに、範囲指定線92c内の範囲を、血管12の管軸に垂直な方向の治療範囲としてCPU68に入力する。これにより、血管12の管軸方向の治療範囲だけでなく、血管12の管軸に垂直な面内の治療範囲が指定される(ステップS14)。
【0087】
その後、図9に示すように、レーザの照射条件を設定した後に、レーザの照射操作が行われる(ステップS4〜S5)。このとき、病変消失判定部69は、断層画像72の全体ではなく、範囲指定線92cで指定された治療範囲内で病変17の消失状況を判定し、判定結果をCPU68に入力する(ステップS15)。CPU68はこの判定結果を受けると、範囲指定線92cで指定された治療範囲内に病変17があるときには、レーザの照射操作を許容し、レーザを照射させる(ステップ7)。また、レーザの照射後に、最新の断層画像72を用いて、範囲指定線92cで指定された治療範囲内で病変17の消失状況を判定する(ステップ16)。そして、病変17が治療範囲内にある場合には、レーザの照射条件設定から上述の手順を繰り返して治療が行われる。一方、病変17の消失状況の判定の結果、範囲指定線92cで指定された治療範囲内に病変17がないときには、レーザの照射操作を無効とし、また、強制的にレーザをオフに操作し、新たなレーザの照射操作を禁止し、警告を表示する(ステップ10)。
【0088】
こうして、血管12の管軸に垂直な断層画像72の面内で指定された治療範囲内で病変17の消失状況を判定し、この判定結果に応じてレーザのオンオフ制御を行うことで、治療後の血管12の厚さを保障することができ、より安全な治療を行うことができる。このレーザ治療装置11の様態は、赤外線レーザを高出力で用い、病変17を蒸散させるときに特に好適に用いることができる。
【0089】
なお、上述の第3実施形態では、断層画像72内で血管12の管軸に垂直な面内の治療範囲を指定するときに、血管12の管軸を中心として径だけが変化自在となっている円形の範囲指定線92cを用いるが、これに限らない。例えば、図10に示すように、中心位置や形状を自在に調節することができる範囲指定線92dを表示させる。そして、カーソル97で範囲指定線92dを移動,変形させ、できる限り病変17を囲み、範囲指定線92dの内部を、血管12の管軸に垂直な面内の治療範囲に指定しても良い。また、このように、病変17を断層画像72内で囲んで治療範囲を指定し、かつ、病変17を蒸散させる治療を行うときには、病変17を輝度値で識別するのではなく、治療範囲内を全て病変17と認識するようにしても良い。この場合、病変17か正常組織かにかかわらず治療範囲内に組織があるか否かで病変17の消失状況を判定し、レーザのオンオフ等を切り替えるように制御しても良い。
【0090】
また、上述の第3実施形態では、断層画像72内で血管12の管軸に垂直な面内の治療範囲を指定するが、これに限らず、断層画像72内で血管12の管軸を中心とした角度方向の範囲を治療範囲と指定するようにしても良い。このような角度範囲で治療範囲を指定するときには、断層画像72に、例えば、血管12の管軸を中心とした2本の直線を範囲指定線として表示し、これらの範囲指定線の間の角度を治療範囲とする。そして、この角度方向の治療範囲内で病変17の消失状況を判定し、判定結果から、角度方向の治療範囲内に病変17があるときに、レーザの照射を許容する。このように角度範囲で治療範囲を指定すると、矢印96によるレーザの照射角度の設定が不適切なときに、レーザが病変17のない位置に誤射されることを防ぐことができる。
【0091】
以上のように、レーザ治療装置11は、病変17にレーザを照射しながらリアルタイムに病変17の消失状況を判定し、この判定結果に基づいて、レーザのオンオフ、照射方向、照射エネルギーを随時制御するので、レーザの誤照射や過剰照射により正常組織を無用に損失することなく安全な治療を行うことができる。また、レーザ治療装置11では、上述のようにレーザの制御が補助されるので、術者の操作負担が軽減される。
【0092】
また、レーザ治療装置11は、断層画像72から直接に病変17の輝度値を指定するから、実際に治療する血管12の正常組織と同じ血管12の病変17の相違を直接的に指定することになるため、病変17を高精度に識別することができる。
【0093】
なお、上述の第1〜第3実施形態では、病変17の消失状況の判定結果に応じて、レーザの種々の照射条件を個々に制御する例を説明したが、上述の第1〜第3実施形態や、これらの一部を組み合わせて、病変17の消失状況の判定結果に応じて、レーザの照射条件を制御することが好ましい。
【0094】
なお、上述の第1〜第3実施形態では、レーザ治療装置11をアシストモードで使用する例を説明したが、レーザ治療装置11をオートモードで使用する場合にも同様の制御を行うことが好ましい。例えば、図11に示すように、オートモードの場合には、病変17の消失状況の判定結果に基づいて、レーザのオンオフを切り替える。オートモードでは、病変17の消失状況の判定結果から、病変17がある場合にはレーザを照射し続ける(ステップS17)。一方、判定結果から、病変17が消失した場合には、その時点でレーザの照射を停止する(ステップS17)。
【0095】
なお、上述の第1〜第3実施形態では、病変17の消失状況の判定を行う治療範囲の指定を、平行断層画像73や断層画像72に表示した範囲指定線によって行う例を説明したが、これに限らず、治療範囲の指定を3D画像74で行うようにしても良い。例えば、3D画像74の病変17をクリックすることで、クリックした箇所周辺の凹凸形状や輝度分布から、病変17を囲む範囲指定線92eが表示されるようにし、この範囲指定線92eの内部の領域が治療範囲に指定されるようにしても良い。
【0096】
なお、上述の第1〜第3実施形態では、治療用プローブ24は、複数のレーザ照射部31を備えているが、これに限らず、図13に示すように、1つのレーザ照射部122をプローブユニット23とともに回転するように設けることで、このレーザ照射部122を治療用プローブ121として用いても良い。
【0097】
なお、上述の第1〜第3実施形態では、レーザ治療装置11は、コンソール38として、モニタ76、キーボード87、マウス88を備えている例を説明したが、これに限らず、これらの表示装置,入力装置の替わりに、表示と入力を兼ねたタッチパネルディスプレイをコンソールとしても良い。
【0098】
なお、上述の第1〜第3実施形態では、病変消失判定部69による各種判定(病変17の位置、大きさ、消失状況等)は、断層画像72が更新される毎に行われるが、これに限らず、病変消失判定部69による各種判定のタイミングは、断層画像72の更新にかかわらず、所定の時間間隔で行うようにしても良い。
【0099】
なお、上述の第1〜第3実施形態では、病変17の有無や大きさ、消失を判定するときに、術者がコンソール38の操作によって病変17の輝度値を指定するが、これに限らず、病変17の輝度値や正常組織との輝度差等の値が定められているときには、その値を予め記憶しておいても良いし、キーボード87等で数値を入力しても良く、通信ネットワークを介して取得するようにしても良い。
【0100】
なお、上述の第1〜第3実施形態では、レーザ光源46として、エキシマレーザ(紫外光源51)と、量子カスケードレーザ(赤外光源52)を備える例を説明したが、他の周知のレーザを備えるようにしても良い。例えば、紫外光源51としては、波長308nmのXeClエキシマレーザに限らず、波長193nmのArFエキシマレーザ、波長248nmのKrFエキシマレーザ、波長351nmのXeFエキシマレーザ等を紫外光源51として好適に用いることができ、これらのうち少なくとも1つが備えられていることが好ましい。また、赤外光源52としては、波長5.75μmの量子カスケードレーザを用いる例を示したが、波長5.75μmの赤外線レーザを出力することができる自由電子レーザや他の周知の半導体レーザを赤外光源52として好適に用いることができる。
【0101】
さらに、上述の第1〜第3実施形態では、赤外光源52として波長5.75μmの量子カスケードレーザを用いる例を示したが、実施形態の赤外光源52を含めて、脂質プラークを選択的に分解することのできる赤外光源52を少なくとも1つ備えていることが好ましい。波長5.75μm以外の波長では、脂質プラークを選択的に分解することができる波長帯のレーザとして、波長1100nm以上波長1800nm以下の範囲に含まれる波長を出力するレーザを赤外光源52として備えることが好ましい。また、波長1200nm以上波長1250nm以下のレーザか、波長1680nm以上波長1800nm以下のレーザのうち少なくとも1つを備えていることが特に好ましい。なお、上述のような多くの波長帯のレーザ光源が切り替え自在に設けられていることが特に好ましいが、出力するレーザの波長が変更可能となっており、上述の波長帯のレーザを自在に出力できるレーザ光源であれば、複数のレーザ光源を切り替え自在に設ける必要はなく、1つのレーザ光源を備えていれば良い。
【0102】
なお、上述の第1〜第3実施形態では、観察用プローブ23が光の干渉を利用して断層画像を得るOCTプローブユニットである例を説明したが、これに限らず、観察用プローブ23は超音波を利用して断層画像を得る超音波プローブユニットであっても良い。観察用プローブ23がいわゆるタイムドメインのOCTプローブユニットである例を説明したが、観察用プローブ23は、周波数ドメインのOCT(OFDI)のプローブであっても良く、また、他の周知機構のOCTプローブであっても良い。
【0103】
なお、上述の第1〜第3実施形態では、血管12の治療を例に説明したが、これに限らず、レーザ治療装置11は血管12以外の体腔内を経皮的に治療するときにも好適に用いることができる。
【図面の簡単な説明】
【0104】
【図1】レーザ治療装置の挿入部の外観を模式的に示す斜視図である。
【図2】挿入部の断面とレーザ治療装置の概略的な構成を示す説明図である。
【図3】レーザ治療装置の電気的構成及び光学的構成を示すブロック図である。
【図4】観察画像がモニタに表示される様子を示す模式図である。
【図5】アシストモードで治療する場合のフローチャートと、各ステップにおける観察画像の様子を示す説明図である。
【図6】警告を表示する様子を示す模式図である。
【図7】病変の消失状況に応じて、レーザの照射エネルギーを制御する場合のフローチャートである。
【図8】断層画像内で治療範囲を指定する様子を示す説明図である。
【図9】第2実施形態の流れを示すフローチャートである。
【図10】断層画像内で治療範囲を指定する様子を示す説明図である。
【図11】オートモードにおいて、病変の消失状況に応じてレーザのオンオフを制御する流れを示すフローチャートである。
【図12】3D画像で治療範囲を指定する様子を示す模式図である。
【図13】治療用プローブの変形例を模式的に示す斜視図である。
【符号の説明】
【0105】
11 レーザ治療装置
12 血管
16 挿入部
17 照射位置
17 病変
21 カテーテル
22 プローブユニット
22a チューブ
23 観察用プローブ
24 治療用プローブ
A 軸
26,28 反射光学部材
27,29 導光部
26a,28a 反射面
31 レーザ照射部
37 制御装置
38 コンソール
39 基端部分
41 マーカー
42 フォトセンサ
43 光源ユニット
44 メインユニット
46 レーザ光源
47 SLD
48 ファイバ結合光学系
51 紫外光源
52 赤外光源
53 反射鏡
54 半透鏡
56,57 レンズ
59 ファイバカプラ
61 ピエゾ素子
62 光路遅延部
63 レンズ
64 プリズム
L1 参照光
L2,L3 信号光
L4 干渉光
66 信号処理回路
67 画像処理部
68 CPU
69 病変消失判定部
71 コンソール制御部
72,72a〜72d 断層画像
73 平行断層画像
74 3D画像
76 モニタ
77 システムバス
78 光源制御部
79 プローブ制御部
83 RAM
86 病変
87 キーボード
88 マウス
91a〜91c 基準線
92a〜92e 範囲指定線
96 矢印(レーザの照射方向)
97 カーソル
101 治療範囲
110 警告ウィンドウ
121 治療用プローブ
122 レーザ照射部
【技術分野】
【0001】
本発明は、レーザを照射して治療対象部位の治療を行うレーザ治療装置に関するものであり、さらに詳しくは、治療対象部位の断層画像をモニタリングしながら治療を行うレーザ治療装置に関する。
【背景技術】
【0002】
狭心症や心筋梗塞は、冠状動脈の狭窄、塞栓によって引き起こされることが知られている。冠状動脈の狭窄や塞栓の多くは、コレステロール等の脂質を主成分とするプラークが血管壁に付着したり、血管壁内部で増殖することによって引き起こされる。
【0003】
狭心症や心筋梗塞の治療方法としては、経皮的カテーテルインターベンション(PCI)が知られている。経皮的カテーテルインターベンションは、冠状動脈内にカテーテルを挿入しながら狭窄部や塞栓部(以下、治療対象部位という)を治療する治療方法であり、例えば、狭窄部へのベアメタルステントや薬剤溶出ステントの留置や、バルーンカテーテルによる治療対象部位の拡張等が行われる。また、完全塞栓やステント留置後の再狭窄の対応としては、レーザ血管形成術が施される。
【0004】
レーザ血管形成術は、プラークにレーザを照射することによってプラークを除去する施術法である。レーザ血管形成術では、アルゴンレーザやCO2@レーザ等の熱的なレーザが用いられるが、熱的なレーザでは病変の周辺にある正常組織に対しても熱的損傷が生じることが知られている。このため、近年では、紫外エキシマレーザ等の非熱的レーザによってレーザ血管形成術を行うレーザ治療装置が知られている(特許文献1,2)。
【0005】
また、特許文献3,4には、冠状動脈内に挿入される挿入部の先端に、治療用のレーザとOCT(Optical Coherence Tomography)のプローブユニットを一体的に設ける技術が記載されている。両者を組み合わせることで、治療対象部位をリアルタイムにモニタしながらレーザ血管形成術を行うことが可能になる。また、従来の血管形成術においては、X線による透視増を撮影して、これを治療対象部位の観察に利用していたが、OCTを用いることにより、X線画像よりも鮮明な断層画像を得ることが可能になる。さらに、X線による被爆量を軽減する効果もある。
【特許文献1】米国特許第5093877号明細書
【特許文献2】欧州特許出願公開第03555200号明細書
【特許文献3】特開2005−230549号公報
【特許文献4】特表2001−515382
【発明の開示】
【発明が解決しようとする課題】
【0006】
レーザ血管形成術においては、治療対象部位は非常に小さく、しかも血管壁の厚みも薄いため、術者はレーザ照射と画像確認を頻繁に繰り返しながら、レーザの照射位置の確認やレーザの出力制御を行う等、慎重に施術を進める必要がある。このように、レーザ血管形成術では、高度かつ繊細な技術が求められるため、術者への負担が大きい。こうしたことから、施術の安全性の向上や、術者への負担を軽減する対策が要望されている。
【0007】
しかしながら、特許文献1,2には、単に治療用のレーザとOCTを組み合わせることが記載されているのみであり、両者を連携させる具体的な制御内容は開示されていない。
【0008】
本発明は、上述のような背景に鑑みてなされたものであり、施術の安全性の向上や術者の負担を軽減することを目的とする。
【課題を解決するための手段】
【0009】
本発明のレーザ治療装置は、体腔内に挿入される挿入部に設けられ、治療対象部位に含まれる病変に向けてレーザを照射して、前記病変を消失させる治療用プローブと、前記治療用プローブとともに前記挿入部に設けられており、前記治療対象部位内を走査して前記治療対象部位の断層画像を得るための信号を検出する観察用プローブと、前記観察用プローブによって検出された信号に基づいて断層画像を生成する断層画像生成手段と、前記断層画像を解析して前記病変の消失状況を判定する判定手段と、前記判定手段の判定結果に応じて、前記治療用プローブを制御する制御手段と、を備えたことを特徴とする。
【0010】
また、前記判定手段は、前記断層画像が更新される毎に判定を行うことが好ましい。
【0011】
また、前記断層画像を表示する表示手段を含むコンソールを備えていることが好ましい。
【0012】
また、前記制御手段は、前記レーザの照射のオンオフ、照射位置、単位時間当たりの照射量、波長の切り替えの少なくとも1つを含む照射条件を制御することが好ましい。
【0013】
また、前記制御手段は、前記治療用プローブを自動的に制御する自動制御モードを有しており、前記自動制御モードにおいて、前記病変が消失するまで前記レーザ照射手段によるレーザの照射を継続し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射を停止することが好ましい。
【0014】
また、前記制御手段は、前記治療用プローブに対する術者の操作をアシストするアシストモードを有しており、前記アシストモードにおいて、前記病変が消失するまで前記治療用プローブに対するレーザの照射操作を許容し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射操作を禁止することが好ましい。
【0015】
また、前記判定手段は、前記断層画像を解析して前記病変を識別することにより、前記病変が消失したか否かを判定することが好ましい。
【0016】
また、前記病変を識別するための基準となる参照値を取得する参照値取得手段を備えていることが好ましい。
【0017】
また、前記断層画像内の治療範囲の指定を受け付ける受付手段を備えることが好ましい。
【0018】
また、前記判定手段は、指定された前記治療範囲内において前記病変が消失したか否かを判定することが好ましい。
【0019】
また、前記判定手段による判定結果を警告する警告手段を備えることが好ましい。
【0020】
また、前記治療用プローブは、波長が5.75μmのレーザを照射することを特徴とするが好ましい。
【0021】
また、前記治療用プローブは、1100nm以上1800nm以下の範囲に含まれる波長のレーザを照射することを特徴とするが好ましい。
【0022】
また、前記治療用プローブの光源は、半導体レーザまたは自由電子レーザのいずれかであることが好ましい。
【0023】
また、前記治療用プローブは、193nm、248nm、308nm、351nmのうち、少なくとも1つの波長のレーザを照射することが好ましい。
【0024】
また、前記治療用プローブは、異なる複数の波長のレーザを照射可能なことを特徴とするが好ましい。
【0025】
また、前記観察用プローブは、光の干渉を利用して断層画像を得るプローブであることが好ましい。
【発明の効果】
【0026】
本発明によれば、施術の安全性の向上や術者の負担を軽減することができる。
【発明を実施するための最良の形態】
【0027】
図1に示すように、レーザ治療装置11は、冠状動脈等の血管12(治療対象部位)内に挿入する挿入部16が備えられている。レーザ治療装置11は、挿入部16を通して血管12の断層画像をリアルタイムに観察しながら病変17にレーザを照射して、血管12の狭窄や塞栓等、血管12の患部を治療する。
【0028】
挿入部16は、カテーテル21とプローブユニット22から構成される。カテーテル21は、透明で可撓性に富んだ材料からなり、挿入部16の最も外郭に位置し、内部にはプローブユニット22が挿入される。挿入部16は、可撓性を有しており、血管12に挿入されると、血管12の湾曲形状に応じて自在に湾曲する。
【0029】
プローブユニット22は、チューブ22a、観察用プローブ23、治療用プローブ24等が一体となって構成されている。このため、プローブユニット22がカテーテル21に沿って湾曲されたり、カテーテル21内を掃引されたりするときには、チューブ22a、観察用プローブ23、治療用プローブ24は一体となって湾曲、掃引される。
【0030】
チューブ22aは、カテーテル21と同様に、透明で可撓性に富んだ材料からなり、カテーテル21の湾曲に応じて自在に湾曲する。また、チューブ22aは、軸Aに沿ってカテーテル21内を自在に移動するように設けられており、レーザ治療装置11が血管12の断層画像を取得する際や、血管12の病変17を治療する際にカテーテル21内を掃引される。なお、軸Aは、挿入部16の挿入軸であるとともに、血管12の管軸と平行になっている。
【0031】
観察用プローブ23は、いわゆるOCT用のプローブであり、断層画像を取得するための低コヒーレンス光を血管12の内壁に向けて照射し、血管12からの反射光を制御装置37(後述)に導く。
【0032】
観察用プローブ23は、反射光学部材26と導光部27とからなる。導光部27は、光ファイバやGRINレンズ等から構成され、プローブユニット22の湾曲に応じて自在に湾曲する。また、低コヒーレンス光を反射光学部材26へ導き、血管12からの反射光を制御装置37へと導く。反射光学部材26は、例えばプリズムであり、導光部27の先端に設けられている。反射光学部材26は、導光部27から入射される低コヒーレンス光を反射面26aで軸Aに対して垂直な方向に屈曲し、血管12へ向けて低コヒーレンス光を照射する。また、血管12からの反射光が反射光学部材26に入射すると、反射面26aで軸Aに沿った方向へと屈曲され、導光部27へと導かれる。
【0033】
また、観察用プローブ23は、軸Aと平行な中心軸周りに矢印で示すように、所定方向に回転するように設けられている。観察用プローブ23は、回転しながら低コヒーレンス光を照射することにより血管12の内壁面の全周を走査し、その走査位置における断層画像を得るための反射光(断層画像を得るための信号)を受信する。また、観察用プローブ23は、チューブ22aがカテーテル21内で掃引されることによって、軸A方向に移動し、血管12の管道に沿った走査を行う。観察用プローブ23は、この走査により、軸A方向における走査位置が異なる複数枚の断層画像を得る。
【0034】
治療用プローブ24は、血管12に向けて治療用のレーザを照射し、病変17を分解または蒸散させることにより消失させる。治療用プローブ24は、反射光学部材28と導光部29を1セットのレーザ照射部31として、複数セットのレーザ照射部31から構成される。これらのレーザ照射部31は、観察用プローブ23の導光部27の周囲を囲むように配置されており、治療用プローブ24はこれらのレーザ照射部31のうち、ひとつのレーザ照射部31から病変17に向けてレーザを照射する。
【0035】
導光部29は、観察用プローブ23の導光部27と同様に光ファイバやGRINレンズ等から構成され、チューブ22aの湾曲に応じて自在に湾曲するとともに、レーザを反射光学部材28へ導く。反射光学部材28は、反射光学部材26と同様のプリズムであり、導光部29の先端に設けられており、導光部29から導かれるレーザを反射面28aで屈曲して血管12へと照射する。反射光学部材28は、観察用プローブ23の反射光学部材26の光路に重ならないように、観察用プローブ23の反射光学部材26よりも軸A方向において基端側に設けられている。このように、各反射光学部材26,28の位置が軸A方向においてずれているので、反射光学部材26と反射光学部材28のそれぞれの反射面26a、28aの傾斜角を変えることにより、低コヒーレンス光とレーザの照射位置が軸A方向において同一になるようにしている。
【0036】
なお、図1において、治療用プローブ24は、図示の便宜上、8個のレーザ照射部31からなるが、治療用プローブ24は、血管12の任意の位置にレーザを照射できる程度に、多数のレーザ照射部31から構成される。
【0037】
図2に示すように、レーザ治療装置11は、制御装置37やコンソール38等を備えている。挿入部16の各部は、制御装置37等と基端部分39で接続されている。
【0038】
観察用プローブ23は、制御装置37から低コヒーレンス光が入力され、血管12からの反射光を制御装置37に入力する。また、観察用プローブ23の軸A回りの回転は、制御装置37によって制御される。
【0039】
治療用プローブ24には、制御装置37から治療用のレーザが入力される。治療用プローブ24に入力されるレーザは、病変17の種類や、病変17を蒸散させるか分解するかといった治療様態等に応じて、適切な波長が選択される。また、治療用プローブ24に入力されるレーザの強度は、病変17の大きさや深さに応じて調節される。こうしたレーザの調節は、例えば、術者がコンソール38を用いて制御装置37に対して適切な波長や強度の操作指示を入力することによって行われる。また、後述するように、レーザ治療装置11が自動(あるいは半自動)で制御される動作モードで使用されるときには、制御装置37によって自動的に最適値が設定される。
【0040】
挿入部16の基端部分39には、マーカー41と、マーカー41を検知するフォトセンサ42が設けられている。マーカー41は、カテーテル21に設けられ、円環状の模様が軸Aに沿った方向に一定の間隔で並んだ縞模様となっている。マーカー41は、プローブユニット22がカテーテル21内を移動するときにフォトセンサ42によって検知される。フォトセンサ42からの信号は制御装置37に入力され、後述するようにカテーテル21内でのプローブユニット22の軸A方向の位置制御に用いられる。
【0041】
図3に示すように、制御装置37は、光源ユニット43、メインユニット44等から構成される。光源ユニット43は、レーザ光源46、スーパールミネッセントダイオード(SLD)47、ファイバ結合光学系48等から構成される。
【0042】
レーザ光源46は、治療用プローブ24にレーザを入力する光源であり、紫外光源51と赤外光源52の2種類の光源を備えている。紫外光源51は、XeClを用いたエキシマレーザであり、波長308nmの紫外線レーザをパルス出力する。波長308nmの紫外線レーザは、光音響プロセス及び光化学プロセスによりプラークを分解する。このため、紫外光源51は、正常組織に熱的損傷を与えずにプラークを選択的に分解する場合に用いられる。
【0043】
また、赤外光源52は、量子カスケードレーザであり、波長5.75μmの赤外線レーザをパルス出力する。波長5.75μmの赤外線レーザは、コレステロールエステルのエステル結合に選択的に吸収され、エステル結合を分解する。このため、赤外光源52は、コレステロールエステルを主成分とする脂質プラークを分解させるときに用いられる。また、波長5.75μmの赤外線レーザは適度なエネルギーで照射すれば、上述のように脂質プラークを選択的に分解するが、さらに高エネルギーで照射することにより脂質プラークを含めた周辺組織を蒸散させる。このため、プラークを蒸散させる治療を行うときは、赤外光源52が高エネルギーで出力される。このような赤外光源52の出力は、後述する光源制御部78によって調節される。
【0044】
また、レーザ光源46は、紫外光源51や赤外光源52の光路に、赤外線を反射する反射鏡53や、赤外線を反射し、赤外線を透過する半透鏡54が設けられている。これにより、赤外光源52からの赤外線レーザと紫外光源51からの紫外線レーザとが同じ光路で出力されるようになっている。そして、レーザ光源46から出力されるレーザは、レンズ56によって光ファイバに集光して入射され、治療用プローブ24に出力される。
【0045】
SLD47は、低コヒーレンス光源であり、中心波長800nmでコヒーレンス長が20μmの低コヒーレンス光を出力する。SLD47から出力される低コヒーレンス光は、レンズ57によって光ファイバに集光して入射され、ファイバ結合光学系48に入射する。
【0046】
ファイバ結合光学系48は、ファイバカプラ59、ピエゾ素子61、光路遅延部62等から構成される。SLD47から入力される低コヒーレンス光は、参照光L1と信号光L2に分岐される。参照光L1は光路遅延部62に入射される。信号光L2は、観察用プローブ23から血管12に入射される。そして、信号光L2は、血管12で反射されて、血管12の断層画像を得るための信号光L3となり、ファイバ結合光学系48に入力される。信号光L3には、信号光L2が血管12の壁面内の様々な深さで反射された光が混じり合っている。
【0047】
ピエゾ素子61は、参照光L1が光路遅延部62に至る光路上に設けられ、信号光L3対して僅かな周波数差が生じるように参照光L1を変調する。また、光路遅延部62は、レンズ63と、レンズ63の光軸に沿って平行に移動自在に設けられたプリズム64とから構成される。光路遅延部62に入射した参照光L1は、レンズ63によって平行光に変換されてプリズム64に入射する。そして、プリズム64で反射されると、レンズ63によって集光されて、入射時の光路と同じ光ファイバに戻される。このとき、プリズム64がレンズ63の光軸に沿って移動されると、参照光L1の光路長が変化する。こうして参照光L1の周波数と光路長が調節されることにより、参照光L1と干渉する信号光L3の光路長が調節される。このため、プリズム64の移動によって、断層画像の信号が得られる血管12の壁内方向の長さ(深さ)が変化する。
【0048】
こうして周波数と光路長が調節された参照光L1は、ファイバカプラ59で信号光L3とともにファイバカプラ59へ入力される。ファイバカプラ59は、参照光L1と信号光L3を干渉させた干渉光L4を信号処理回路66(後述)に入力する。
【0049】
メインユニット44は、信号処理回路66、画像処理部67、CPU68、病変消失判定部69、コンソール制御部71等から構成される。
【0050】
信号処理回路66は、光検出器、ヘテロダイン検出回路等から構成され、ファイバカプラ59入力される干渉光L4の強度を電気信号に変換する。信号処理回路66は、プリズム64の移動や観察用プローブ23の回転とともに、連続的に入力される干渉光L4から断層画像を得るための信号を検出し、これを画像処理部67に出力する。
【0051】
画像処理部67は、信号処理回路66から順次入力される信号から、図4に示すように、血管12の断層画像72を生成する。これにより、レーザ治療装置11は、血管12の断層画像72を取得する。ここで取得される断層画像72は、血管12の管軸方向に垂直な断面の画像であり、カテーテル21内におけるプローブユニット22の掃引にともなって、血管12の様々な位置での断層画像72が取得される。また、画像処理部67は、1回のプローブユニット22の掃引で生成される複数の断層画像72から、血管12の管軸方向に平行な方向の断層画像(以下、平行断層画像という)73や、血管12の立体的な画像74(以下、3D画像という)を生成する。こうして画像処理部67で生成された断層画像72、平行断層画像73、3D画像74は、RAM83に記憶される。また、断層画像72、平行断層画像73、3D画像74(以下、これらをまとめて観察画像という)は必要に応じてモニタ76に表示される。また、断層画像72及び平行断層画像73には、組織の相違が輝度の相違として表れるので、輝度の分布から血管12の内膜、中膜、外膜といった正常組織の様子や、プラーク等の病変の様子が観察される。
【0052】
CPU68(制御手段,警告手段)は、システムバス77を介して、画像処理部67、病変消失判定部69、コンソール制御部71等と接続されており、これらの動作を制御する。また、CPU68は、後述する病変消失判定部69による判定結果等に基づいて、レーザ治療装置11が適切に操作されているかを監視し、レーザ治療装置11に対して不適切な操作がなされたときには、操作が適切でない旨の警告や適切な操作を行わせるためのガイダンスをモニタ76に表示させる。CPU68は、光源制御部78、プローブ制御部79を備える。
【0053】
光源制御部78は、光源ユニット43に接続されており、レーザ光源46やSLD47のオンオフの切り替えや、光源ユニット43から出力するレーザの波長や照射エネルギー等の照射条件の切り替え,調節等を行う。例えば、光源制御部78は、紫外光源51と赤外光源52の一方を選択的に駆動させることにより、レーザ光源46から出力するレーザの波長を切り替える。また、光源制御部78は、プラークを分解するか、蒸散させるかといった治療様態や、病変17の厚み等に応じて、レーザ光源46から出力させるレーザの単位時間当たりの照射量を調節する。こうしたレーザの照射エネルギーの調節は、紫外光源51や赤外光源52のパルス周波数、パルス幅、デューティー比の何れかを変更することによって行われる。さらに、光源制御部78は、SLD47のオンオフ制御や、プリズム64の掃引速度等、プリズム64の動作制御を行う。
【0054】
光源制御部78は、術者によってレーザの照射条件が設定されて、レーザの照射操作が行われると、後述する病変消失判定部69の判定結果に基づいて、術者の設定したレーザの照射条件が適切であるか否かを判定する。この判定の結果、レーザの照射条件が適切でないときには、コンソール制御部71を介してモニタ76に警告を表示させるとともに、レーザ光源46をオフにし、強制的にレーザの照射を中止させる。
【0055】
プローブ制御部79は、プローブユニット22の各部と接続されており、これらの動作を制御する。プローブ制御部79は、設定等により定められた取得レートで血管12の断層画像72が取得されるように、観察用プローブ23の回転動作を制御する。また、プローブ制御部79は、プローブユニット22をカテーテル21内で移動させる駆動系と接続されており、レーザ治療装置11によってプローブユニット22の掃引が自動で制御されるときには、プローブユニット22のカテーテル21内での移動を制御する。このとき、フォトセンサ42からの信号に基づいて、プローブユニット22を駆動させる駆動系(図示しない)のドリフトやバックラッシュを補償し、カテーテル21に対するプローブユニット22の位置を正確に制御する。
【0056】
また、プローブ制御部79は、術者によってプローブユニット22の掃引が手動で制御されるときには、プローブユニット22のカテーテル21内での位置を監視する。このとき、プローブユニット22が所定位置よりも奥に挿入されてカテーテル21を損傷したり、カテーテル21から引き抜かれて挿入部16が損傷することがないように、プローブユニット22の軸A方向の移動範囲を所定範囲内に規制する。そして、プローブユニット22がこの所定範囲から外れようとしたときには、コンソール制御部71を介してモニタ76に警告を表示させるとともに、プローブユニット22の移動を強制的に中止させる。
【0057】
病変消失判定部69は、画像処理部67によって生成された断層画像72等の観察画像をRAM83から読み出して、断層画像72の輝度の分布を解析することにより、断層画像72内の病変17を識別する。これにより、病変の有無や、病変の厚み、角度範囲(断層画像72においては中心角で規定される病変17の大きさ)といった病変の大きさを判定する。また、レーザの照射後に、新たに取得された断層画像27について、病変消失判定部69が病変の有無を判定することにより、レーザの照射によって病変17が消失したか否か(消失状況)が判定される。病変消失判定部69による判定結果は、RAM83に一時的に記憶され、CPU68によってレーザ治療装置11の動作制御に用いられる。
【0058】
コンソール制御部71は、コンソール38(参照値取得手段、受付手段)を制御する。コンソール38は、観察画像や操作メニュー等を表示するモニタ76(表示手段)や、キーボード87やマウス88といった入力装置からなる。例えば、コンソール制御部71は、レーザ治療装置11が断層画像72を取得すると同時に、RAM83から断層画像72を読み出してビデオ信号に変換し、リアルタイムにモニタ76に表示する。
【0059】
また、コンソール制御部71は、モニタ76に観察画像を表示するときに、表示された観察画像を見ながらレーザ治療装置11を操作するためのメニューや、治療範囲を指定するツールを観察画像にあわせて表示する。例えば、断層画像72等の複数の観察画像をモニタ76に表示するときに、断層画像72と、平行断層画像73や3D断層画像74との対応を示す基準線を表示し、レーザを照射するときには、断層画像72内に照射方向を示す矢印等を表示する。また、モニタ76に表示されるメニューやツール(GUIによる操作ツール)は、キーボード87やマウス88からの入力に基づいて操作される。
【0060】
RAM83は、断層画像72や各種設定値を記憶するメモリである。RAM83には、観察画像の他に、病変が比較的大きなときに照射するレーザの照射エネルギー値(以下、標準値という)や、病変消失判定部69が判定する病変17の径方向の大きさ(厚さ)と比較される閾値、術者によって指定される病変17の輝度値等、種々の設定やデータ等が記憶される。
【0061】
上述のように構成されるレーザ治療装置11は、マニュアルモード、アシストモード、オートモード(自動制御モード)の3種の動作モードが切り替え自在となっており、治療の様態や断層画像の観察の様態等に応じて任意に選択して使用される。
【0062】
マニュアルモードは、レーザ治療装置11の操作を術者が全て手動で行う動作モードである。マニュアルモードでは、治療時のプローブユニット22の掃引、治療範囲の指定や、レーザの波長,照射エネルギー等の各種照射条件の設定は、断層画像72を観察しながら術者が行う。
【0063】
アシストモードは、術者がレーザ治療装置11を操作しながらも、煩雑な操作や設定の一部をレーザ治療装置11が自動的に行ったり、レーザ治療装置11が不適切に操作されたときに警告やガイダンスを表示して術者に適切な操作を促したりすることで、術者をアシストする動作モードである。
【0064】
オートモードは、挿入部16を血管内12に挿入した後の操作を、術者の開始操作を契機に全て自動で行う動作モードである。例えば、術者がコンソール38から、断層画像取得の開始操作をすると、プローブユニット22を自動的に掃引して、断層画像72を取得する。また、治療範囲を指定した後に、治療の開始操作をすると、指定した治療範囲内で病変17を自動的に認識して、病変17にレーザを照射し、治療を行う。
【0065】
[第1実施形態]
以下では、レーザ治療装置11をアシストモードで使用し、レーザを照射しながら、リアルタイムに病変17の消失状況を判定し、判定結果に応じてレーザのオンオフを制御する例を、第1実施形態として説明する。まず、血管12内に挿入部16が挿入されると、プローブユニット22を掃引し、観察用プローブ23からの信号に基づいて、血管12の断層画像72が取得される(ステップS1)。
【0066】
このとき取得される断層画像72は、図4に示すように、モニタ76にリアルタイムに表示される。同時に、取得された複数の断層画像72から、平行断層画像73や3D画像74が生成され、設定に応じて平行断層画像73(図4A)か3D画像74(図4B)の何れかが、断層画像72と同時にモニタ76に表示される。また、平行断層画像73と3D画像74の表示は、コンソール38の操作によって切り替え可能である。
【0067】
また、図4(A)に示すように、断層画像72や平行断層画像73には、相互の位置関係を示す基準線91a,91bが表示される。基準線91aは自在に回転または移動するようになっており、マウス88により操作されるカーソル97によってドラッグして基準線91a,91bを移動させると、基準線91a,91bの位置に応じた断層画像72,平行断層画像73が表示される。例えば、断層画像72内に表示された基準線91aを回転させると、回転後の基準線91aの断面の平行断層画像73に変わる。同様に、平行断層画像72内で基準線91bを左右に移動させると、移動後の基準線91bの位置に対応する断層画像72が表示される。
【0068】
さらに、平行断層画像73内には、1組の範囲指定線92a,92bが表示される。病変17の治療を行うときには、範囲指定線92a,92bをそれぞれカーソル97で移動させることで、範囲指定線92a,92bの間の領域を血管12の管軸方向の治療範囲に指定する。ここで指定する管軸方向の治療範囲は、病変17を含むように指定される。こうして指定された管軸方向の治療範囲内で、プローブユニット22がカテーテル21内を移動して、病変の消失状況の判定や、観察画像の取得、治療等が行われる。
【0069】
断層画像72とともに3D画像74を表示する場合には、図4(B)に示すように、3D画像74内には基準線91aの方向で血管12を切断した立体的な血管12が表示される。このとき3D画像74内には、断層画像72に対応する位置を示す基準線91cが表示される。平行断層画像73の場合と同様に、基準線91cを移動させれば、断層画像72は、移動後の基準線91cにおける断層画像72に更新される。また、断層画像72で基準線91aを回転させれば、3D画像74における血管12の切断方向が変化する。このとき、新たに表示される3D画像74は、血管12の内面が観察できるように、適宜回転して表示される。なお、3D画像74は、血管12の立体的な様子が表示されるので、平行断層画像73では基準線91a,91bを調節しなければ観察することができなかった病変17や血管12の分岐12a等が比較的容易に観察される。
【0070】
また、断層画像72内には、レーザの照射方向を示す矢印96が表示される。レーザを照射するときには、矢印96を回転させることにより、病変17に向けて正しくレーザが照射されるように、レーザの照射方向が定められる。
【0071】
血管12の断層画像72が取得されると、術者は、モニタ76で断層画像72等を観察しながら病変17の有無や容体を把握する。そして、レーザの照射によって病変17が消失してゆく状況を断層画像72でリアルタイムに確認しながら治療が行われる。
【0072】
図5(A)のフローチャートに示すように、まず、観察画像を取得し(ステップS1)、病変17を観察できる断層画像72aを表示させる。カーソル97で病変17をクリックする操作により、病変17の輝度値が指定される。コンソール38は、この指定を受けてCPU68に入力する(ステップS2)。この輝度値は、病変消失判定部69が画像解析により病変17を識別するための参照値である。これにより、レーザ治療装置11は、断層画像72aから、入力された輝度値の部分が病変17であることを認識する。
【0073】
そして、術者は、平行断層画像73(または3D画像74)を確認しながら、血管12の管軸方向における病変17の大きさ(長さ)と略等しくなるように、範囲指定線92a,92bで病変17を囲む。この操作によって、管軸方向の治療範囲が指定され、その指定情報がコンソール38を通じてCPU68に入力される(ステップS3)。こうして管軸方向の治療範囲が指定されることで、プローブユニット22の移動範囲が治療範囲内に限定される。これにより、指定した管軸方向の治療範囲内に限って、レーザの照射が許容されるようになる。そして、管軸方向の治療範囲の指定が完了すると、プローブユニット22は、指定した治療範囲の一端の治療開始位置に移動される。この間も観察用プローブ23は動作を続けるので、最新の断層画像72がモニタ76に表示される。
【0074】
プローブユニット22が治療開始位置に移動されると、治療開始位置での断層画像72bを観察しながら、病変17の大きさ等に応じて、治療に使用するレーザの波長、照射エネルギーといったレーザの照射条件が設定される(ステップ4)。この治療開始位置での断層画像72bが表示される。同時に、レーザの照射方向を示す矢印96が断層画像72b内に表示され、この矢印96を病変17に向けて回転させることで、矢印96の方向にレーザの照射方向が指定される。
【0075】
こうした照射条件の設定が完了すると、レーザの照射を開始する操作が行われる(ステップS5)。このとき、レーザ治療装置11は、指定された病変17の輝度値の画素が最新の断層画像72bにあるか否かを比較し、病変17があるか否か(消失状況)を判定する(ステップS6)。断層画像72bのように、断層画像72b内に病変17があるときには、レーザ治療装置11はレーザの照射操作を許容し、レーザの照射操作にしたがってレーザをオンに制御し、指定された照射条件で病変17にレーザを照射する(ステップS7)。そして、レーザの照射直後に更新された断層画像72cについて、指定された病変17の輝度値の画素があるか否かを判別することによって、病変17の消失状況を判定する(ステップS8)。このとき、レーザの照射方向に病変17が残されていれば、断層画像72dのように病変が全て消失するまで、レーザの照射条件の設定から上述の手順が繰り返される。
【0076】
一方、レーザを照射する操作が行われたときに、指定したレーザの照射方向に病変17がない場合には、レーザ治療装置11は、レーザの照射操作を無効として、強制的にレーザをオフに操作し、新たなレーザの照射操作を禁止し(ステップ9)、警告を表示する(ステップ10)。
【0077】
ここで表示される警告は、図6に示すように、モニタ76に警告ウィンドウ110を表示して行われる。警告ウィンドウ110では、病変17が消失し、既に病変17がないことや、レーザの照射を中止したことを術者に警告する。
【0078】
上述のように、レーザ治療装置11は、レーザの照射操作が行われたときやレーザの照射直後に、最新の断層画像72からリアルタイムに病変17の消失状況を判定し、この判定の結果に基づいて、レーザのオンオフを制御する。このため、レーザの誤射を防ぐことができ、安全な治療を行うことができる。
【0079】
[第2実施形態]
以下では、病変17の消失状況に基づいて、レーザの照射エネルギーを制御する例を、第2実施形態として説明する。まず、第1実施形態と同様にして、観察画像を取得し、病変17の輝度値の入力や血管12の管軸方向の治療範囲の指定、レーザの照射条件の設定を行う(ステップS1〜S4)。そして、レーザの照射操作を行うと、レーザ照射装置11は、最新の断層画像72内に入力された病変17の輝度値があるか否かを比較し、病変17の消失状況を判定する(ステップS5〜S6)。
【0080】
判定の結果、最新の断層画像72内に病変17がある場合には、病変消失判定部69は、指定されたレーザの照射方向について、病変17の厚さを判定し、CPU68に入力する。CPU68は、病変17の厚さの判定結果を受けて、これを予め定められた閾値と比較する。そして、病変17の厚さが閾値よりも大きく、病変17が比較的厚い場合には、レーザの照射エネルギーを標準値に設定してレーザを照射する。レーザの照射エネルギーの標準値は、前述のように、選択したレーザで比較的厚みの大きい病変17を治療するときに適した照射エネルギーであり、光源毎に予め定められている。
【0081】
一方、判定した病変17の厚さが、閾値以下の値であるときには、CPU68(光源制御部78)は、指定された照射エネルギーではなく、病変17の厚さに応じて、標準値よりも小さな照射エネルギーとなるようにレーザ光源46を調節してから(ステップ13)、レーザ光を照射させる(ステップ14)。このとき、CPU68は、レーザの照射エネルギーを、病変17の厚さが厚いほど標準値に近く調節し、病変17が薄いほど小さな値となるように調節する。
【0082】
このように、病変17の厚さに応じた照射エネルギーに調節してレーザを照射すると、第1実施形態と同様に、レーザ照射直後の最新の断層画像72を取得し、病変17の消失状況を判定する(ステップS8)。この結果、病変17が消失していなければ、病変17が消失するまで、上述の手順による治療がレーザの照射条件の設定から繰り返し行われる。一方、病変17が消失し、最新の断層画像72から病変17が認識されなかったときには、レーザを照射させない。
【0083】
こうして、病変17の消失状況を判定し、この判定結果のうち、病変17の厚さに応じてレーザの照射エネルギーを制御すると、病変17が小さく、病変17が薄い場合に、過剰な照射エネルギーでレーザを照射してしまうことを防止することができる。特に、レーザ治療装置11で観察することができる血管12の径方向の長さ(断層の深さ)には限界があり、病変17が大きく厚みがあるばあいには、断層画像72で病変17の輪郭をすべて観察することができないが(図5B参照)、上述のように照射エネルギーを調節することで、厚みのある病変17の場合にも、治療を安全に行うことができる。
【0084】
なお、上述の第2実施形態では、病変17の消失状況を判定し、この判定結果のうち、病変17の厚さに応じてレーザの照射エネルギーを制御する例を説明したが、これに限らず、病変17の消失状況の判定に応じて、レーザの照射位置やレーザの波長を切り替えるようにしても良い。例えば、病変17の消失状況の判定からレーザの照射位置の制御を行う場合に、病変消失の判定結果から、病変消失判定部69は、軸Aを中心として病変17のある角度範囲を認識し、病変17のある角度範囲の情報をCPU68に入力する。CPU68は、レーザの照射方向を入力された角度範囲内におさまるように、レーザの照射方向を自動的に調節する。また、病変17の消失状況に応じてレーザの波長を切り替えるときには、上述の第2実施形態と同様に、病変消失判定部69は、病変17の厚さを認識し、病変17の厚さの情報をCPU68に入力する。CMPU68は入力された病変17の厚さと、前述の閾値とを比較し、病変17の厚さが厚いときには、赤外光源52を用いて高エネルギーの赤外線レーザを用いる。一方、レーザの照射によって病変17が薄くなった場合には、紫外光源51を用いて紫外線レーザを治療に用いる。
【0085】
[第3実施形態]
上述の第1,第2実施形態では、病変17の消失状況の判定を行う治療範囲を、血管12の管軸方向で指定する例を説明したが、これに限らず、治療範囲として、血管12の管軸を中心とした範囲を指定するようにしても良い。以下では、断層画像72を観察しながら、断層画像72内で血管12の管軸に垂直な面内で治療範囲を指定する例を第3実施形態として説明する。
【0086】
まず、前述の第1実施形態や第2実施形態と同様にして、観察画像を取得して、病変17の輝度値の入力し、病変17の輝度値を入力する(ステップS1〜S2)。そして、平行断層画像73(または3D画像74)を確認しながら、血管12の管軸方向における病変17の長さと略等しくなるように、範囲指定線92a,92bで病変17を囲まれると、範囲指定線92a,92bの間の領域が管軸方向の治療範囲として指定される(ステップS3)。これと同時に、コンソール制御部71は、図8に示すように、表示している断層画像72に、血管12の管軸に対して垂直な方向の範囲を指定する円形の範囲指定線92cを表示させる。ここで表示される範囲指定線92cは、カーソル97でドラックすることで、円形のまま、血管12の管軸を中心に径が変化される。また、コンソール制御部71は、範囲指定線92cの径が変化したときに、範囲指定線92c内の範囲を、血管12の管軸に垂直な方向の治療範囲としてCPU68に入力する。これにより、血管12の管軸方向の治療範囲だけでなく、血管12の管軸に垂直な面内の治療範囲が指定される(ステップS14)。
【0087】
その後、図9に示すように、レーザの照射条件を設定した後に、レーザの照射操作が行われる(ステップS4〜S5)。このとき、病変消失判定部69は、断層画像72の全体ではなく、範囲指定線92cで指定された治療範囲内で病変17の消失状況を判定し、判定結果をCPU68に入力する(ステップS15)。CPU68はこの判定結果を受けると、範囲指定線92cで指定された治療範囲内に病変17があるときには、レーザの照射操作を許容し、レーザを照射させる(ステップ7)。また、レーザの照射後に、最新の断層画像72を用いて、範囲指定線92cで指定された治療範囲内で病変17の消失状況を判定する(ステップ16)。そして、病変17が治療範囲内にある場合には、レーザの照射条件設定から上述の手順を繰り返して治療が行われる。一方、病変17の消失状況の判定の結果、範囲指定線92cで指定された治療範囲内に病変17がないときには、レーザの照射操作を無効とし、また、強制的にレーザをオフに操作し、新たなレーザの照射操作を禁止し、警告を表示する(ステップ10)。
【0088】
こうして、血管12の管軸に垂直な断層画像72の面内で指定された治療範囲内で病変17の消失状況を判定し、この判定結果に応じてレーザのオンオフ制御を行うことで、治療後の血管12の厚さを保障することができ、より安全な治療を行うことができる。このレーザ治療装置11の様態は、赤外線レーザを高出力で用い、病変17を蒸散させるときに特に好適に用いることができる。
【0089】
なお、上述の第3実施形態では、断層画像72内で血管12の管軸に垂直な面内の治療範囲を指定するときに、血管12の管軸を中心として径だけが変化自在となっている円形の範囲指定線92cを用いるが、これに限らない。例えば、図10に示すように、中心位置や形状を自在に調節することができる範囲指定線92dを表示させる。そして、カーソル97で範囲指定線92dを移動,変形させ、できる限り病変17を囲み、範囲指定線92dの内部を、血管12の管軸に垂直な面内の治療範囲に指定しても良い。また、このように、病変17を断層画像72内で囲んで治療範囲を指定し、かつ、病変17を蒸散させる治療を行うときには、病変17を輝度値で識別するのではなく、治療範囲内を全て病変17と認識するようにしても良い。この場合、病変17か正常組織かにかかわらず治療範囲内に組織があるか否かで病変17の消失状況を判定し、レーザのオンオフ等を切り替えるように制御しても良い。
【0090】
また、上述の第3実施形態では、断層画像72内で血管12の管軸に垂直な面内の治療範囲を指定するが、これに限らず、断層画像72内で血管12の管軸を中心とした角度方向の範囲を治療範囲と指定するようにしても良い。このような角度範囲で治療範囲を指定するときには、断層画像72に、例えば、血管12の管軸を中心とした2本の直線を範囲指定線として表示し、これらの範囲指定線の間の角度を治療範囲とする。そして、この角度方向の治療範囲内で病変17の消失状況を判定し、判定結果から、角度方向の治療範囲内に病変17があるときに、レーザの照射を許容する。このように角度範囲で治療範囲を指定すると、矢印96によるレーザの照射角度の設定が不適切なときに、レーザが病変17のない位置に誤射されることを防ぐことができる。
【0091】
以上のように、レーザ治療装置11は、病変17にレーザを照射しながらリアルタイムに病変17の消失状況を判定し、この判定結果に基づいて、レーザのオンオフ、照射方向、照射エネルギーを随時制御するので、レーザの誤照射や過剰照射により正常組織を無用に損失することなく安全な治療を行うことができる。また、レーザ治療装置11では、上述のようにレーザの制御が補助されるので、術者の操作負担が軽減される。
【0092】
また、レーザ治療装置11は、断層画像72から直接に病変17の輝度値を指定するから、実際に治療する血管12の正常組織と同じ血管12の病変17の相違を直接的に指定することになるため、病変17を高精度に識別することができる。
【0093】
なお、上述の第1〜第3実施形態では、病変17の消失状況の判定結果に応じて、レーザの種々の照射条件を個々に制御する例を説明したが、上述の第1〜第3実施形態や、これらの一部を組み合わせて、病変17の消失状況の判定結果に応じて、レーザの照射条件を制御することが好ましい。
【0094】
なお、上述の第1〜第3実施形態では、レーザ治療装置11をアシストモードで使用する例を説明したが、レーザ治療装置11をオートモードで使用する場合にも同様の制御を行うことが好ましい。例えば、図11に示すように、オートモードの場合には、病変17の消失状況の判定結果に基づいて、レーザのオンオフを切り替える。オートモードでは、病変17の消失状況の判定結果から、病変17がある場合にはレーザを照射し続ける(ステップS17)。一方、判定結果から、病変17が消失した場合には、その時点でレーザの照射を停止する(ステップS17)。
【0095】
なお、上述の第1〜第3実施形態では、病変17の消失状況の判定を行う治療範囲の指定を、平行断層画像73や断層画像72に表示した範囲指定線によって行う例を説明したが、これに限らず、治療範囲の指定を3D画像74で行うようにしても良い。例えば、3D画像74の病変17をクリックすることで、クリックした箇所周辺の凹凸形状や輝度分布から、病変17を囲む範囲指定線92eが表示されるようにし、この範囲指定線92eの内部の領域が治療範囲に指定されるようにしても良い。
【0096】
なお、上述の第1〜第3実施形態では、治療用プローブ24は、複数のレーザ照射部31を備えているが、これに限らず、図13に示すように、1つのレーザ照射部122をプローブユニット23とともに回転するように設けることで、このレーザ照射部122を治療用プローブ121として用いても良い。
【0097】
なお、上述の第1〜第3実施形態では、レーザ治療装置11は、コンソール38として、モニタ76、キーボード87、マウス88を備えている例を説明したが、これに限らず、これらの表示装置,入力装置の替わりに、表示と入力を兼ねたタッチパネルディスプレイをコンソールとしても良い。
【0098】
なお、上述の第1〜第3実施形態では、病変消失判定部69による各種判定(病変17の位置、大きさ、消失状況等)は、断層画像72が更新される毎に行われるが、これに限らず、病変消失判定部69による各種判定のタイミングは、断層画像72の更新にかかわらず、所定の時間間隔で行うようにしても良い。
【0099】
なお、上述の第1〜第3実施形態では、病変17の有無や大きさ、消失を判定するときに、術者がコンソール38の操作によって病変17の輝度値を指定するが、これに限らず、病変17の輝度値や正常組織との輝度差等の値が定められているときには、その値を予め記憶しておいても良いし、キーボード87等で数値を入力しても良く、通信ネットワークを介して取得するようにしても良い。
【0100】
なお、上述の第1〜第3実施形態では、レーザ光源46として、エキシマレーザ(紫外光源51)と、量子カスケードレーザ(赤外光源52)を備える例を説明したが、他の周知のレーザを備えるようにしても良い。例えば、紫外光源51としては、波長308nmのXeClエキシマレーザに限らず、波長193nmのArFエキシマレーザ、波長248nmのKrFエキシマレーザ、波長351nmのXeFエキシマレーザ等を紫外光源51として好適に用いることができ、これらのうち少なくとも1つが備えられていることが好ましい。また、赤外光源52としては、波長5.75μmの量子カスケードレーザを用いる例を示したが、波長5.75μmの赤外線レーザを出力することができる自由電子レーザや他の周知の半導体レーザを赤外光源52として好適に用いることができる。
【0101】
さらに、上述の第1〜第3実施形態では、赤外光源52として波長5.75μmの量子カスケードレーザを用いる例を示したが、実施形態の赤外光源52を含めて、脂質プラークを選択的に分解することのできる赤外光源52を少なくとも1つ備えていることが好ましい。波長5.75μm以外の波長では、脂質プラークを選択的に分解することができる波長帯のレーザとして、波長1100nm以上波長1800nm以下の範囲に含まれる波長を出力するレーザを赤外光源52として備えることが好ましい。また、波長1200nm以上波長1250nm以下のレーザか、波長1680nm以上波長1800nm以下のレーザのうち少なくとも1つを備えていることが特に好ましい。なお、上述のような多くの波長帯のレーザ光源が切り替え自在に設けられていることが特に好ましいが、出力するレーザの波長が変更可能となっており、上述の波長帯のレーザを自在に出力できるレーザ光源であれば、複数のレーザ光源を切り替え自在に設ける必要はなく、1つのレーザ光源を備えていれば良い。
【0102】
なお、上述の第1〜第3実施形態では、観察用プローブ23が光の干渉を利用して断層画像を得るOCTプローブユニットである例を説明したが、これに限らず、観察用プローブ23は超音波を利用して断層画像を得る超音波プローブユニットであっても良い。観察用プローブ23がいわゆるタイムドメインのOCTプローブユニットである例を説明したが、観察用プローブ23は、周波数ドメインのOCT(OFDI)のプローブであっても良く、また、他の周知機構のOCTプローブであっても良い。
【0103】
なお、上述の第1〜第3実施形態では、血管12の治療を例に説明したが、これに限らず、レーザ治療装置11は血管12以外の体腔内を経皮的に治療するときにも好適に用いることができる。
【図面の簡単な説明】
【0104】
【図1】レーザ治療装置の挿入部の外観を模式的に示す斜視図である。
【図2】挿入部の断面とレーザ治療装置の概略的な構成を示す説明図である。
【図3】レーザ治療装置の電気的構成及び光学的構成を示すブロック図である。
【図4】観察画像がモニタに表示される様子を示す模式図である。
【図5】アシストモードで治療する場合のフローチャートと、各ステップにおける観察画像の様子を示す説明図である。
【図6】警告を表示する様子を示す模式図である。
【図7】病変の消失状況に応じて、レーザの照射エネルギーを制御する場合のフローチャートである。
【図8】断層画像内で治療範囲を指定する様子を示す説明図である。
【図9】第2実施形態の流れを示すフローチャートである。
【図10】断層画像内で治療範囲を指定する様子を示す説明図である。
【図11】オートモードにおいて、病変の消失状況に応じてレーザのオンオフを制御する流れを示すフローチャートである。
【図12】3D画像で治療範囲を指定する様子を示す模式図である。
【図13】治療用プローブの変形例を模式的に示す斜視図である。
【符号の説明】
【0105】
11 レーザ治療装置
12 血管
16 挿入部
17 照射位置
17 病変
21 カテーテル
22 プローブユニット
22a チューブ
23 観察用プローブ
24 治療用プローブ
A 軸
26,28 反射光学部材
27,29 導光部
26a,28a 反射面
31 レーザ照射部
37 制御装置
38 コンソール
39 基端部分
41 マーカー
42 フォトセンサ
43 光源ユニット
44 メインユニット
46 レーザ光源
47 SLD
48 ファイバ結合光学系
51 紫外光源
52 赤外光源
53 反射鏡
54 半透鏡
56,57 レンズ
59 ファイバカプラ
61 ピエゾ素子
62 光路遅延部
63 レンズ
64 プリズム
L1 参照光
L2,L3 信号光
L4 干渉光
66 信号処理回路
67 画像処理部
68 CPU
69 病変消失判定部
71 コンソール制御部
72,72a〜72d 断層画像
73 平行断層画像
74 3D画像
76 モニタ
77 システムバス
78 光源制御部
79 プローブ制御部
83 RAM
86 病変
87 キーボード
88 マウス
91a〜91c 基準線
92a〜92e 範囲指定線
96 矢印(レーザの照射方向)
97 カーソル
101 治療範囲
110 警告ウィンドウ
121 治療用プローブ
122 レーザ照射部
【特許請求の範囲】
【請求項1】
体腔内に挿入される挿入部に設けられ、治療対象部位に含まれる病変に向けてレーザを照射して、前記病変を消失させる治療用プローブと、
前記治療用プローブとともに前記挿入部に設けられており、前記治療対象部位内を走査して前記治療対象部位の断層画像を得るための信号を検出する観察用プローブと、
前記観察用プローブによって検出された信号に基づいて断層画像を生成する断層画像生成手段と、
前記断層画像を解析して前記病変の消失状況を判定する判定手段と、
前記判定手段の判定結果に応じて、前記治療用プローブを制御する制御手段と、
を備えたことを特徴とするレーザ治療装置。
【請求項2】
前記判定手段は、前記断層画像が更新される毎に判定を行うことを特徴とする請求項1記載のレーザ治療装置。
【請求項3】
前記断層画像を表示する表示手段を含むコンソールを備えていることを特徴とする請求項1または2記載のレーザ治療装置。
【請求項4】
前記制御手段は、前記レーザの照射のオンオフ、照射位置、単位時間当たりの照射量、波長の切り替えの少なくとも1つを含む照射条件を制御することを特徴とする請求項1ないし3いずれかに記載のレーザ治療装置。
【請求項5】
前記制御手段は、前記治療用プローブを自動的に制御する自動制御モードを有しており、
前記自動制御モードにおいて、前記病変が消失するまで前記レーザ照射手段によるレーザの照射を継続し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射を停止することを特徴とする請求項1ないし4いずれかに記載のレーザ治療装置。
【請求項6】
前記制御手段は、前記治療用プローブに対する術者の操作をアシストするアシストモードを有しており、
前記アシストモードにおいて、前記病変が消失するまで前記治療用プローブに対するレーザの照射操作を許容し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射操作を禁止することを特徴とする請求項1ないし5いずれかに記載のレーザ治療装置。
【請求項7】
前記判定手段は、前記断層画像を解析して前記病変を識別することにより、前記病変が消失したか否かを判定することを特徴とする請求項1ないし6いずれかに記載のレーザ治療装置。
【請求項8】
前記病変を識別するための基準となる参照値を取得する参照値取得手段を備えていることを特徴とする請求項7記載のレーザ治療装置。
【請求項9】
前記断層画像内の治療範囲の指定を受け付ける受付手段を備えることを特徴とする請求項1ないし8いずれかに記載のレーザ治療装置。
【請求項10】
前記判定手段は、指定された前記治療範囲内において前記病変が消失したか否かを判定することを特徴とする請求項9記載のレーザ治療装置。
【請求項11】
前記判定手段による判定結果を警告する警告手段を備えることを特徴とする請求項1ないし10いずれかに記載のレーザ治療装置。
【請求項12】
前記治療用プローブは、波長が5.75μmのレーザを照射することを特徴とする請求項1ないし11いずれかに記載のレーザ治療装置。
【請求項13】
前記治療用プローブは、1100nm以上1800nm以下の範囲に含まれる波長のレーザを照射することを特徴とする請求項1ないし12いずれかに記載のレーザ治療装置。
【請求項14】
前記治療用プローブの光源は、半導体レーザまたは自由電子レーザのいずれかであることを特徴とする請求項12または13のいずれかに記載のレーザ治療装置。
【請求項15】
前記治療用プローブは、193nm、248nm、308nm、351nmのうち、少なくとも1つの波長のレーザを照射することを特徴とする請求項1ないし13いずれかに記載のレーザ治療装置。
【請求項16】
前記治療用プローブは、異なる複数の波長のレーザを照射可能なことを特徴とする請求項1ないし15いずれかに記載のレーザ治療装置。
【請求項17】
前記観察用プローブは、光の干渉を利用して断層画像を得るプローブであることを特徴とする請求項1ないし16いずれかに記載のレーザ治療装置。
【請求項1】
体腔内に挿入される挿入部に設けられ、治療対象部位に含まれる病変に向けてレーザを照射して、前記病変を消失させる治療用プローブと、
前記治療用プローブとともに前記挿入部に設けられており、前記治療対象部位内を走査して前記治療対象部位の断層画像を得るための信号を検出する観察用プローブと、
前記観察用プローブによって検出された信号に基づいて断層画像を生成する断層画像生成手段と、
前記断層画像を解析して前記病変の消失状況を判定する判定手段と、
前記判定手段の判定結果に応じて、前記治療用プローブを制御する制御手段と、
を備えたことを特徴とするレーザ治療装置。
【請求項2】
前記判定手段は、前記断層画像が更新される毎に判定を行うことを特徴とする請求項1記載のレーザ治療装置。
【請求項3】
前記断層画像を表示する表示手段を含むコンソールを備えていることを特徴とする請求項1または2記載のレーザ治療装置。
【請求項4】
前記制御手段は、前記レーザの照射のオンオフ、照射位置、単位時間当たりの照射量、波長の切り替えの少なくとも1つを含む照射条件を制御することを特徴とする請求項1ないし3いずれかに記載のレーザ治療装置。
【請求項5】
前記制御手段は、前記治療用プローブを自動的に制御する自動制御モードを有しており、
前記自動制御モードにおいて、前記病変が消失するまで前記レーザ照射手段によるレーザの照射を継続し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射を停止することを特徴とする請求項1ないし4いずれかに記載のレーザ治療装置。
【請求項6】
前記制御手段は、前記治療用プローブに対する術者の操作をアシストするアシストモードを有しており、
前記アシストモードにおいて、前記病変が消失するまで前記治療用プローブに対するレーザの照射操作を許容し、前記判定手段によって前記病変が消失したと判定された場合には、前記レーザの照射操作を禁止することを特徴とする請求項1ないし5いずれかに記載のレーザ治療装置。
【請求項7】
前記判定手段は、前記断層画像を解析して前記病変を識別することにより、前記病変が消失したか否かを判定することを特徴とする請求項1ないし6いずれかに記載のレーザ治療装置。
【請求項8】
前記病変を識別するための基準となる参照値を取得する参照値取得手段を備えていることを特徴とする請求項7記載のレーザ治療装置。
【請求項9】
前記断層画像内の治療範囲の指定を受け付ける受付手段を備えることを特徴とする請求項1ないし8いずれかに記載のレーザ治療装置。
【請求項10】
前記判定手段は、指定された前記治療範囲内において前記病変が消失したか否かを判定することを特徴とする請求項9記載のレーザ治療装置。
【請求項11】
前記判定手段による判定結果を警告する警告手段を備えることを特徴とする請求項1ないし10いずれかに記載のレーザ治療装置。
【請求項12】
前記治療用プローブは、波長が5.75μmのレーザを照射することを特徴とする請求項1ないし11いずれかに記載のレーザ治療装置。
【請求項13】
前記治療用プローブは、1100nm以上1800nm以下の範囲に含まれる波長のレーザを照射することを特徴とする請求項1ないし12いずれかに記載のレーザ治療装置。
【請求項14】
前記治療用プローブの光源は、半導体レーザまたは自由電子レーザのいずれかであることを特徴とする請求項12または13のいずれかに記載のレーザ治療装置。
【請求項15】
前記治療用プローブは、193nm、248nm、308nm、351nmのうち、少なくとも1つの波長のレーザを照射することを特徴とする請求項1ないし13いずれかに記載のレーザ治療装置。
【請求項16】
前記治療用プローブは、異なる複数の波長のレーザを照射可能なことを特徴とする請求項1ないし15いずれかに記載のレーザ治療装置。
【請求項17】
前記観察用プローブは、光の干渉を利用して断層画像を得るプローブであることを特徴とする請求項1ないし16いずれかに記載のレーザ治療装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2010−42182(P2010−42182A)
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願番号】特願2008−209526(P2008−209526)
【出願日】平成20年8月18日(2008.8.18)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願日】平成20年8月18日(2008.8.18)
【出願人】(306037311)富士フイルム株式会社 (25,513)
【Fターム(参考)】
[ Back to top ]

