ワクチン組成物及びその使用方法
イン・ビボでのワクチン接種及び抗体(例えば、モノクローナル抗体)産生のための1又は2以上の抗原の効果的な送達のために、及び、PAPC(プロフェッショナル抗原提示細胞)又はMHCクラスII陽性細胞(例えば、腫瘍細胞)へのペプチド、タンパク質、siRNA、RNA又はDNAの効果的な送達のために、ナノ粒子に基づくワクチン、組成物、キット、及び、方法が使用される。例えば、抗原は、被験体(例として哺乳類)において、関心遺伝子の発現、及び、発現タンパク質への強く特異的な免疫反応の誘導に結び付くDNAであってもよい。また、抗原は、プロセシングされ提示される免疫原性ペプチド又はポリペプチドであってもよい。一つの態様において、ここで記載されるように、イン・ビボでの抗原送達のためのナノ粒子を利用する方法は、少なくとも一つの抗原又はTヘルパーエピトープ(例えばPADRE)コンジュゲート荷電性デンドリマー(例えばPADRE誘導化デンドリマー)にコンジュゲートする少なくとも一つの抗原性ペプチド又はポリペプチドをエンコードするDNAから組成されるワクチンの注入を含む。もし陰性に荷電していなければプラスミドは化学的にPADREデンドリマーに連結する一方、陰性に荷電したプラスミドは自然に陽性に荷電したPADRE誘導化デンドリマーに結合する。代わりに、陰荷電性デンドリマーが使用されてもよい。ここに記載された組成物、キット、ワクチン及び方法は予防的及び処置的応用の両方、即ち、生体における病気又は疾患の処置と同様に、生体における病気又は疾患の開始を防止する予防薬として使用可能である。ここに記載されたワクチンは、いかなる感染性病原又はがんに対する免疫反応を備えるために使用可能である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般的に化学及び免疫学の分野に関する。より具体的には、本発明は、被験体で免疫応答を誘導するためのワクチン、組成物及び方法に関する。
【背景技術】
【0002】
関連出願
本出願は、2009年4月1日に出願された米国仮特許出願第61/165,732号の優先権を主張する。出願人は、本明細書でこの特許出願の優先権を主張し、全体の内容が引用により本明細書に取り込まれる。
【0003】
背景
ワクチンの使用による微生物感染及び発病過程の予防は、最も効果的で理想的な病気との闘いのための一つの手段と考えられている。感染又は発病に先立って、宿主動物の免疫応答を刺激する方法で、抗原、又は、免疫原が生体に導入される。しかしながら、伝統的なワクチン戦略は、多数の病原体又はがんに対する防御の備えに効果的ではなかった。伝統的ワクチン戦略によって、100以上の病原体に対してわずかに約20の有効なワクチンが作製されたに過ぎない。高い細胞障害性Tリンパ球(CTL)反応を誘導するワクチンの中で一部は、弱い免疫原性により、低い目標反応割合、免疫回避メカニズム、及び、ディセプティブ・インプリンティング(偽装刷り込み)をしばしば示す。現在のワクチン送達の方法は、強い“危険信号”を誘発せず、負の制御として作用する阻害反応を開始し、ノンプロフェッショナルな抗原提示細胞(APC)へ抗原を送達するため、防御的免疫応答誘導との観点では、低い成功割合である。例えば、高いCTL反応を備える場合であっても、現在のがんワクチンは、低い目標反応割合(2.6%)しか示さない。これらは、弱い免疫原性及び免疫回避メカニズムを含む多数の不利益を伴う。さらに、(樹状細胞に基づく、及び、G−vaxに基づく)最も有望ながんワクチンは、極めて高価であり、これらのワクチンの調製(例えば、患者毎の個別化、及び、GMP基準での製造)が含まれる。
【0004】
遺伝子ワクチン又は遺伝子免疫は、抗原作製のための哺乳類宿主への遺伝子材料接種関与の、がんワクチンを含むワクチンへの可能なアプローチとして考えられる。送達された関心抗原をエンコードする哺乳類発現ベクターは、イン・ビボでの発現と、それに続く抗原特異的反応に結び付く。その上、関心タンパク質の発現可能な場において、遺伝子は細胞膜を通過できず細胞の核に到達できない陰荷電性ポリマーである。遺伝子ワクチンは、自然なエピトープの完全なスペクトルの発生と、イン・ビトロで発現された組換えタンパク質の投与と比較してイン・ビボでのタンパク質の自然な配位構造の達成と、抗体と細胞性免疫の誘導と、及び、抗原作製のためのコスト的で一般的なワクチン投与ステップの除外とを含む多数の利点を与える。しかしながら、遺伝子ワクチンは、自己抗原の寛容破壊と、イン・ビボでの細胞及び核への低い核酸送達と、特定のタイプの細胞に対する特異性の欠如と、及び、弱い免疫応答と、多くの欠点を伴う。
【0005】
同様に、他の型のワクチンは欠点を伴う。例えば、遺伝子のウイルス送達は、ウイルスベクターに対する強い免疫応答に結びつき、安全性上の問題を伴う。抗原として使用するための微生物からの蛋白精製とペプチド製造は、高価で時間を要する。
【発明の概要】
【発明が解決しようとする課題】
【0006】
現在、副作用がないか又は弱く、コスト的に効率的な抗原提示細胞(APC)を標的とするワクチンはない。そこで、プロフェッショナル抗原提示細胞(APC)を標的とし、安全でコスト効果的で、使用が容易で、強く特異的な細胞性及び抗体反応を引き出すワクチンについて大きな需要がある。
【課題を解決するための手段】
【0007】
概要
本明細書記載の発明は、抗原に対して強力で特異的な免疫応答をもたらす前記抗原か、該抗原をエンコードする核酸かをイン・ビボでプロフェッショナルAPC(PAPC)に送達するためのナノ粒子を利用した組成物、キット及び方法と、プラットフォームとである。また、本明細書記載の発明は、siRNAをPAPCに送達するためと、核酸、ペプチド又はタンパク質を細胞(例えば、MHCクラスIIを発現する腫瘍細胞)に送達するためとのナノ粒子を利用した組成物、キット及び方法と、プラットフォームとである。現在のワクチン戦略の主要な利益は、ワクチン戦略が制御性T細胞を含む抑制性細胞を誘導することである。抗原をPAPCに標的送達することが、抑制因子機構の活性化、特に、制御性T細胞の活性化を低減又は阻害することが知られている。前記組成物、キット及び方法は、MHC標的で免疫原性のペプチド(例えば、PADRE、HA)を、特定の細胞に核酸、ペプチド又はポリペプチドを標的送達のための運搬体としての荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマー(例えば、PAMAMその他のデンドリマー)と組み合わせて使用することを含み、遺伝子又はタンパク質のワクチン接種のための新規ナノ粒子を利用した方法をもたらす。本明細書記載の典型的なワクチンは、Tヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)と、少なくとも1つのポリペプチド抗原か、該少なくとも1つの抗原をエンコードする核酸かと、任意のポリI−CとのようなMHC標的で免疫原性のペプチドにコンジュゲートした荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマー(例えば、PAMAMその他のデンドリマー)を含む。本明細書記載の前記陽荷電性多分枝ポリマーデンドリマーは、DNA、RNAその他のものを含む陰荷電性生体分子に効率的に結合する。Tヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)にコンジュゲートした荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマーは、PAPCに特定の抗原を送達するために増大された有効性を有するワクチンを提供する。本明細書記載の実験では、MHCクラスII分子に結合するPADREを介してPAPCを標的にするためにPADREを第1番目に使用することが示される。本明細書記載の実験は、前記MHCクラスIIに結合することが期待されるユニークな特徴の異なる標的ペプチド2つを効率的に使用することを記載する。したがって、本明細書記載の前記ワクチン、方法及び組成物は、全てのMHCクラスII結合ペプチドを含む。本明細書記載の前記ワクチン、キット及び組成物は、イン・ビボでのPAPCへの特異的かつ効率的なトランスフェクションと、自家PAPCの成熟、つまり強力で特異的な免疫応答をしばしばもたらす生来の普遍的なヘルパーT活性とを提供する。
【0008】
デンドリマーは理想的なDNA送達候補であり、前記デンドリマーは、サイズ及び形状(積荷−空間)にわたる構造的な制御を提供し、生体適合性(無毒性で非免疫原性)であり、重要なスキャフォールド特性を有し、特異的な標的原子団のためのよく定義された表面を調節可能な官能基を有し、細胞接着と、細胞質又は核へのエンドサイト−シス及び送達とのための能力を有し、許容可能な生体分解性(体内で安全に分解するための能力)を有し、簡単で都合の良い製造性(臨床グレード)の合成と関係付けられる。本明細書記載の実験では、前記DNA、siRNA、ペプチド又はポリペプチドにコンジュゲートした陽荷電性多分枝ポリマーデンドリマーは、ヒト及びマウスの両方で抗原提示細胞(APC)を標的にし、ヘルパーT細胞を活性化するペプチド(例えば、PADRE又はインフルエンザHA)を含む。前記PADREペプチドは主要な機能2つを有する。前記PADREペプチドはPAPC上に存在する前記MHCクラスIIに結合するようにPAPCにDNAを送り届け、前記PADREペプチドは、細胞傷害性T細胞の発生と、抗体応答に必要とされるクラススイッチとを促進するヘルパーT細胞を刺激する。この新規ナノ構築物は、遺伝子及びペプチドの送達及びワクチン接種のためのユニークな特徴を有する。また、本明細書記載の実験は、PADREにコンジュゲートした陽荷電性多分枝ポリマーデンドリマー(PAMAMデンドリマー)が、治療上の設定で50%までC57BLマウスで確立され、高い侵襲性のB16/LU8メラノーマ腫瘍の成長を遅延し、サイズを減少させること、及び、B16/OVAの予防上の設定で腫瘍の100%根絶を示すこと、ワクチン接種ために用いられる遺伝子産物に対する強力な免疫応答を誘導すること、マウス及びヒトの抗原提示細胞(APC)の両方で2倍又は3倍までのトランスフェクション効率を示すこと、GFPをエンコードするプラスミドを、流入領域リンパ節に由来するイン・ビボで送達すること、及び、ヒトB細胞、T細胞及びマウスのマクロファージにsiRNAを効率的に送達することを示す。
【0009】
本明細書記載の組成物及びワクチンは、組成物及びワクチンが、MHCクラスII陽性細胞、PAPCの全て又はほとんど全てを標的とするとき、ワクチン接種のために目的に合わせた理想的なプラットフォームである。T細胞の活性化の抑制又は促進をする(CD80、CD86、B7−H1、B7−H4、B7−DC、CD137、OX40、Foxp3及びこれらの推定の共刺激性受容体を含むが、これらに限定されない)共阻害性で共刺激性の非常に重要な分子を発現する。これらの経路に含まれる分子の発現の標的化操作は、がん、感染性疾患のための免疫療法/ワクチン接種、又は、中毒症又は不妊症のためか、被験体において疾患を誘導する薬剤を中和するためかと、自己免疫の管理のためとのワクチン接種のような他の新規ワクチンアプローチのために用いることが可能である。本明細書に記載されているようなワクチンを抗原提示細胞(APC)に標的送達することが、非常により強力な免疫応答を生じ、抑制因子/フィードバック機構を減少し、ワクチン投与量を少なくすることで毒性を防止することによって、従来のワクチン接種戦略に関係する感作に解決策を提供する。
【0010】
したがって、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つの抗原をエンコードする核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記少なくとも1つの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記ワクチンでは、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることが可能である。本実施態様は、薬学的に許容可能な担体及び/又は油中水型エマルジョンを含むことが可能である。1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ(PADRE)、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープである。また、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることが可能である。前記核酸は発現ベクターであることが可能であり、前記少なくとも1つの抗原は、がん抗原か、感染性病原体由来の抗原かであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。
【0011】
また、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記少なくとも1つのペプチド又はポリペプチドの抗原との組み合わせが前記少なくとも1つのペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。1つの実施態様では、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしている。前記ワクチンは、第2の荷電性多分枝ポリマーデンドリマーをさらに含むことが可能であって、前記第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドはプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることが可能である。前記ワクチンは、薬学的に許容可能な担体及び/又は油中水型エマルジョンをさらに含むことが可能である。前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPan−DRエピトープであることが可能である。もう1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAである。前記ペプチド又はポリペプチドの抗原は、がん抗原か、感染性病原体由来の抗原かであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。
【0012】
さらに、本明細書記載の発明は、抗原を哺乳類に送達し、該哺乳類で前記抗原に対するモノクローナル抗体の産生を誘導する方法である。前記方法は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記組成物はMHCクラスIIで仲介されるヘルパーT細胞の活性化を誘導するために有効量の組成物であり、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド若しくはポリペプチドの抗原か、該少なくとも1つの抗原をエンコードする核酸かとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸か、又は、前記少なくとも1つのペプチド若しくはポリペプチドの抗原との組み合わせが、前記少なくとも1つのペプチド若しくはポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸か、又は、少なくとも1つのペプチド若しくはポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記組成物を前記哺乳類に投与することが、前記少なくとも1つのペプチド又はポリペプチドの抗原に対するモノクローナル抗体の産生をもたらす。ある実施態様では、前記哺乳類はがんを有し、前記少なくとも1つのペプチド又はポリペプチドの抗原はがん抗原であり、前記組成物は前記がんに対するワクチンである。典型的に、前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じない。もう1つの実施態様では、前記哺乳類は感染性疾患を有し、前記少なくとも1つのペプチド又はポリペプチドの抗原は感染性病原体由来であり、前記組成物は典型的に前記哺乳類で局所的な有害応答を全く生じない前記感染性病原体に対するワクチンである。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、ポリイノシン−ポリシチジン酸に結合されること、及び/又は、薬学的に許容可能な担体、及び/又は、油中水型エマルジョンを含むことが可能である。
【0013】
本方法の1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはPADREエピトープ、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープである。また、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートされることが可能である。前記組成物は第2の荷電性多分枝ポリマーデンドリマーをさらに含むことが可能であり、該第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが、前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。
【0014】
抗体を産生し、採取するための1つの実施態様では、前記哺乳類は、げっ歯類又はウサギであることが可能であり、前記モノクローナル抗体は前記哺乳類から採取される。本実施態様では、前記モノクローナル抗体は、前記哺乳類から前記抗体を採取するステップと、前記抗体のタイターを測定するステップと、前記哺乳類から脾臓を摘出するステップと、ミエローマとの融合を実行するステップとによって調製される。前記抗体はヒト化されることが可能である。
【0015】
さらに、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物であって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドはPADREであることが可能であり、前記siRNAは、例えば、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられるであることが可能である。
【0016】
その上さらに、本明細書記載の発明は、siRNAをプロフェッショナル抗原提示細胞に送達する方法であって、該方法は、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートする少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を提供するステップと、哺乳類の被験体に前記組成物を投与するステップとを含み、前記組成物を提供するステップでは、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記投与するステップでは、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとをコンジュゲートしている前記少なくとも1つの荷電性多分枝ポリマーデンドリマーが前記プロフェッショナル抗原提示細胞に結合し、前記siRNAが前記プロフェッショナル抗原提示細胞に入る条件下で前記組成物を投与する。前記荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能であり、前記siRNAは、例えば、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられるであることが可能である。1つの実施態様では、前記siRNAは、前記プロフェッショナル抗原提示細胞でCTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1の発現を妨げる。
【0017】
その上さらに、本明細書記載の発明は、哺乳類において、MHCクラスII腫瘍細胞(リンパ腫又はリンパ腫の一部分)の増殖を抑制するか、MHCクラスII腫瘍細胞のアポトーシスを誘導するかの方法である。本方法は、少なくとも1つのTヘルパーペプチドをコンジュゲートし、タンパク質をエンコードする核酸によって結合した少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーにおいて、前記少なくとも1つのTヘルパーペプチドが前記MHCクラスII腫瘍細胞に特異的に結合し、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸又は該核酸によってエンコードされるタンパク質との組み合わせが、前記MHCクラスII腫瘍細胞の増殖の抑制か、前記MHCクラスII腫瘍細胞のアポトーシスの誘導かをするように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、結合される。前記陽荷電性多分枝ポリマーデンドリマーは、例えばPAMAMデンドリマーであることが可能であり、少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。しかし、適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能である。
【0018】
本明細書に記載されているような核酸を細胞に送達するための方法は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を細胞に接触させるステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーエピトープと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーエピトープが前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーエピトープと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーエピトープと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。本方法では、前記ペプチド又はタンパク質は前記細胞内で典型的に発現される。適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能であるが、前記陽荷電性多分枝ポリマーデンドリマーは、例えばPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。
【0019】
本明細書に記載されているような核酸を細胞に送達するための組成物は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含み、該少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドは前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。しかし、適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能である。
【0020】
他に定義されなければ、本明細書において使用される全ての技術用語は、本発明が属する技術分野の当業者の一般的な理解と同一の意味を有する。
【0021】
本明細書において、「核酸」又は「核酸分子」は、RNA(リボ核酸)及びDNA(デオキシリボ核酸)のような2以上のヌクレオチドの鎖、及び化学的に改変されたヌクレオチドを意味する。「精製された」核酸分子は、核酸が天然に存在する細胞又は生命体の他の核酸配列から実質的に分離された核酸分子である (例えば、30、40、50、60、70、80、90、95、96、97、98、99、100%夾雑物を含まない)。前記用語は、例えば、ベクターに組み込まれた組換え核酸分子、プラスミド、ウイルス、又は原核生物若しくは真核生物のゲノム(全遺伝情報)を含む。精製された核酸の例は、cDNA、ゲノム核酸断片、ポリメラーゼ連鎖反応(PCR)で製造される核酸、ゲノム核酸の制限酵素処理で形成される核酸、組換え核酸、化学的に合成される核酸分子を含む。「組換え」核酸分子は、例えば、化学合成によって、又は、分離された核酸セグメントの遺伝子工学技術による操作によって、分離した別の2つの配列セグメントの人工的組み合わせで製造される核酸分子である。
【0022】
ペプチド、オリゴペプチド、又はタンパク質のアミノ酸残基の引用において、「アミノ酸(置換)基」、「アミノ酸」、及び「(置換)基」の用語は相互代替的に使用され、本明細書において、アミノ酸又は少なくとも一つの他のアミノ酸若しくはアミノ酸様化合物にアミド結合又はアミド様結合で共有結合したアミノ酸様化合物を意味する。
【0023】
本明細書において、「タンパク質」及び「ポリペプチド」は、例えば、長さ、及び、糖鎖付加やリン酸化のような翻訳後の修飾にかかわらず、アミノ酸のいかなるペプチド連結鎖を意味する同義語として使用される。
【0024】
核酸分子、ポリペプチド、又は感染性病原体の引用において、「自然の(native)」は自然に存在する(例えば、野生型)核酸、ポリペプチド、又は感染性病原体である。
【0025】
本明細書において「抗原」又は「免疫原」は抗体によって特異的に認識され、結合する分子を意味する。
【0026】
エピトープ(例えば、Tヘルパーエピトープ)の引用においては、生物活性によって適当なMHC分子へ結合し、CTL(細胞障害性Tリンパ球)反応の刺激に対して有用なペプチドの場合に標的抗原又は抗原様分子に対するTヘルパー反応及びCTL反応を誘導する能力を意味する。
【0027】
「特異的結合」及び「特異的に結合する」の用語は、酵素/基質、受容体/アゴニスト、抗体/抗原等の対となる種の間で起こり、共有的若しくは非共有的相互作用、又は、共有的若しくは非共有的相互作用の組み合わせで介在される結合である。2つの種の相互作用が非共有結合複合体を作る場合、発生する結合は、典型的に、静電気的、水素結合、又は疎水結合の結果である。従って、「特異的結合」は、抗体/抗原、酵素/基質相互作用の特徴を有する結合複合体を作る2者間相互作用存在の一対の種の間で起こる。特に、特異的結合は、一対の中の1つのメンバーが特定の種と結合し、相応のメンバーが属する化合物ファミリーの中の他のいかなる種とも結合しないことによって特徴化される。
【0028】
本明細書において、「Pan−DRエピトープ」、「Pan−HLA−DR結合エピトープ」、「PADRE」及び「PADREペプチド」は、最も一般的な12のDRアレル(DR1、2w2b、2w2a、3、4w4、4w14、5、7、52a、52b、52c及び53)中の少なくとも約7つのDRアレルと高親和性で結合できる約4及び約20の間の置換基のペプチドを意味する。「高親和性」は本明細書において200nm未満のIC50%での結合と定義される。例えば、高親和結合は、3100nM未満のIC50%での結合を含む。クラスIIMHCとの結合に対して、1000nmの結合親和性閾値は典型的であり、100nm未満の結合親和性は一般的に高親和結合と一般的に考えられる。PADREペプチドの構築と使用は、米国特許5736142号公報に詳細に記載され、本明細書に引用として取り込まれる。
【0029】
「Tヘルパーペプチド」は本明細書においてTヘルパー細胞のT細胞受容体によって認識されるペプチドである。例えば、本明細書記載のPADREペプチドはTヘルパーペプチドである。
【0030】
本明細書で使用される用語「デンドリマー」は、荷電(例えば、陽荷電、陰荷電)し、高分枝の、概して球形のポリマー高分子である。陽荷電性高分枝のポリマーデンドリマーの例として、PAMAMデンドリマーがある。「PAMAMデンドリマー」及び「ポリアミドアミンデンドリマー」の用語によって、分枝点に3級アミンが存在し、構造的な層の間の結合がアミド置換基によって作られるデンドリマーの型を意味する。
【0031】
「PAMAMデンドリマー」及び「ポリアミドアミンデンドリマー」の用語によって、分枝点に3級アミンが存在し、構造的な層の間の結合がアミド置換基によって作られるデンドリマーの型を意味する。PAMAMデンドリマーはその表面に多数の陽荷電を示す。
【0032】
用語「誘導体化デンドリマー」は、その表面に1以上の置換基を有するデンドリマーを意味する。
【0033】
「PADRE誘導体化デンドリマー」又は「PADREデンドリマー」は、荷電(例えば陽荷電)性高分枝ポリマーデンドリマー(例えば、PAMAMデンドリマー)表面の置換基にPADREペプチドが共有結合したナノ構築物である。
【0034】
用語「コンジュゲートされた(conjugated)」は、1分子又は化学物質の物理的又は化学的に他の分子又は化学物質への結合又は接着を意味する。コンジュゲートの例は、共有的連結及び静電気的な複合体形成を含む。用語「複合体形成した」、「との複合体」、及び、「コンジュゲートされた」は本明細書において相互代替的に使用される。
【0035】
本明細書において、語句「配列相同性」は、サブユニットの一致を最大化するように整列した、即ち、ギャップと挿入を考慮し、2つの配列(例えば、核酸配列、アミノ酸配列)の相同位置の同定サブユニットのパーセンテージを意味する。「配列相同性」は、配列分析ソフトウェア(例えば、カリフォルニア州サンディエゴ、Accelrysの配列分析ソフトウェア)によって測定できる。
【0036】
語句「単離した」又は「生物学的に純粋な」は、自然な状態において一般的に付随する構成要素が実質的にない物質である。
【0037】
本明細書において、「ナノ粒子」は、ナノメーターで計測される大きさの微視的な粒子を意味する。例えば、ナノ粒子は、概ね総直径2−500nmの範囲のPADREデンドリマーコンジュゲート体、又は、核酸若しくはアミノ酸物質といくつかのPADREデンドリマーコンジュゲート体とを組み合わせた粒子である。
【0038】
用語「抗体」は、ポリクローナル抗体、モノクローナル抗体(mAb)、キメラ抗体、ヒト化抗体、抗体に対する抗イディオタイプ(anti−Id)抗体を含み、該抗体は、溶解又は結合形態で、公知の技術、例えば、これに限定されない酵素的開裂、ペプチド合成、又は組換え技術によって提供される当該抗体の断片、領域、及び誘導体と同様に標識可能なものを意味する。
【0039】
本明細書において、用語「アジュバント」は、体液性及び/又は細胞性免疫応答を亢進するように調製するいかなる物質を意味する。
【0040】
本明細書において、用語「表示された(displayed)」又は「表面に暴露された」は同義語と考え、ナノ粒子(例えばPADREデンドリマー)のような構造の外表面に存在する(例えば、免疫サイト認識に到達可能な抗原又は他の分子である)抗原又は他の分子である。
【0041】
用語「多価の」は、1以上の複製又は抗原の型又は分子がナノ粒子上に表示されることを意味する。
【0042】
本明細書において、「ワクチン」は予防的及び治療的なワクチンの全てを包含する。ワクチン組成物は、本明細書において、イン・ビボで生物学的に互換的な形態での被験体への投与に適する。本発明における「イン・ビボでの生物学的に互換的な投与に適した形態」の表現は、治療効果が毒性作用を上廻る投与物質の形態を意味する。当該化合物はいずれの動物(例えばヒト)に投与されても良い。本発明のある実施態様において、哺乳類(例えば、げっ歯類又はウサギ)に特定の抗原に対するモノクローナル抗体を製造するためにワクチンが投与される。
【0043】
「免疫応答」の語句によって、抗原又は複数の抗原に対する抗体、及び/又は、免疫細胞介在応答の誘導が意味される。免疫応答の誘導は、抗原投与生体の免疫原性の体質、化学組成、及び、抗原の構造、並びに、抗原投与の方法及び期間を含む多くの要因に依存する。免疫応答は多くの様相を有し、その一部は免疫システムの細胞(例えば、Bリンパ球、Tリンパ球、マクロファージ、及び、プラズマ細胞)によって示される。免疫システムの細胞は、抗原若しくは免疫系の他の細胞との相互作用、サイトカインの放出及びこれらのサイトカインとの反応性を通して関与しても良い。免疫応答は一般的に、体液性及び細胞性の2つの主要なカテゴリーに分けられる。体液性免疫応答の構成要因として、抗原に特異的な抗体の産生を含む。細胞介在の要因としては抗原に対して遅発型過剰感受性で細胞障害性エフェクター細胞の産生を含む。
【0044】
語句「治療的有効量」及び「有効的な投与量」は、治療的(臨床的)に望ましい結果を生むために十分な量を意味し、結果の正確な性質は、処置される障害の性質に依存して変動する。例えば、処置される障害はがんであり、その結果は、がん性腫瘍を含むがん細胞の排除が可能である。本発明における、組成物及びワクチンは1日当たり1回以上から1週間投与当たり1回以上の投与が可能である。当業者は、これに限定されない病気又は障害の重篤性、過去の処置、全体的な健康及び/又は被験体の年齢、罹患疾患を含む被験体への効果的な処置に必要な投与量及びタイミングに影響する要因を理解するであろう。さらに、本発明の組成物又はワクチンの治療的に有効な量での処置は、1回の処置又は連続処置を含む場合がある。
【0045】
本明細書において、用語「処置」は、本発明における又は本発明の方法によって同定される、治療剤の患者への投与若しくは適用、又は、病気、病気の症状を持つ、若しくは病気の素因を持つ患者から単離された組織若しくは細胞系列への、治療剤の、病気、病気の症状、病気の素因を、治す、癒す、緩和する、和らげる、変化する、救う、改善する、好転する若しくは作用する目的での、適用若しくは投与と定義される。
【0046】
用語「患者」、「披験体」、「個体」は、本明細書において相互代替的に使用され、ヒト患者が望ましい処置を受ける哺乳類披験体を意味する。ある事例においては、本発明の方法は、非ヒト霊長類と同様に、マウス、ラット、及びハムスターに限定されないげっ歯類を含み、動物実験、獣医学的応用、動物疾患モデルの展開での使用を認める。
【0047】
本発明と同様の又は同等のワクチン、組成物、キット及び方法は、本発明の実施又は試験として使用できるが、好適なワクチン、組成物、キット及び方法は以下に記載される。本明細書記載の全ての出版物、特許出願、及び、特許は、引用によって全体として本明細書に取り込まれる。矛盾する場合は、本明細書が定義を含めて調整する。以下に議論する特定の実施態様は例証するためのものであり、限定を意図するものではない。
【図面の簡単な説明】
【0048】
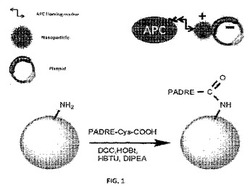
【図1】プラスミドと混合、又は、標的APC(抗原提示細胞)に対するペプチド若しくはポリペプチド抗原と連結したPADRE−デンドリマーの概要図である。
【図2】イン・ビトロでの、赤色蛍光色素でタグ付けした短い核酸配列とPADRE−デンドリマーとの複合体の送達を示すヒトB細胞の解析の一連のドット・プロット・サイトメトリーの分析図である。
【図3】イン・ビボにおけるPADRE−デンドリマーのDNA送達を表す写真である。
【図4】GFP又はOVAをエンコードするプラスミド皮下投与で免疫されたC57BLマウスの血清での、ELISA(左図)又はFLISA(右図)で評価された腫瘍に対する効果を示すグラフである。
【図5】B16メラノーマ細胞(上段)又はTSA(下段)が移植されたマウスにおけるPADRE−デンドリマーの腫瘍に対する治療効果を示すグラフである。
【図6】ヒトB細胞(上段図)とヒト末梢単核球細胞(PBMC)(下段図)にいて、デンドリマー−PADREとGFPプラスミド(5μg)との複合体を共培養したGFP発現のフロー・サイトメトリーヒストグラムである。
【図7】イン・ビトロでのタンパク質、アルブミン−FITCのPDD(PADRE−誘導体化デンドリマー)によるヒトB細胞への送達を示す一連のフロー・サイトメトリー・ドット・プロットである。右側の写真はPDD/アルブミン−FITC複合体添加後1時間のB細胞によるアルブミン取り込みの蛍光写真である。
【図8】リンパ節でのイン・ビボDC(樹状細胞)標的を示す一連のフロー・サイトメトリー・ドット・プロットである。左図は、実験操作の時間概念図を表し、右図は、PDD/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節に対するフロー・サイトメトリー・ドット・プロットを表す。
【図9】DRHA(デンドリマーHA)、異なったTヘルパーエピトープで修飾されたデンドリマーのDC(樹状細胞)へのGFPトランスフェクションの促進を表すグラフを示す。
【図10】赤色(Alexa Fuor)標識dsRNAオリゴマーとの複合PADRE−デンドリマーでトランスフェクトされたヒトB細胞の顕微鏡写真である。
【図11】赤色(Alexa Fuor)標識dsRNAオリゴマーとデンドリマー複合体(左図)、及び、赤色(Alexa Fuor)標識dsRNAオリゴマーとPADRE−デンドリマーとの複合体でトランスフェクトされた(右図)、ヒヒ末梢血単核球(PBMC)の顕微鏡写真である。
【図12】プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)の顕微鏡写真を表す。
【図13】PADRE−デンドリマーのプラスミド(DRP−ovaプラスミド)複合体のワクチン接種とイン・ビボ電気穿孔法(EP−ovaプラスミド)との比較を表すグラフである。
【図14】PDD/プラスミド−PCARD抗原の2つで免疫したマウスの高タイター抗体反応誘発を示すイン−セル・ウエスタン・アッセイのマルチウェルプレートの写真である(左図:抗原をエンコードするプラスミドをトランスフェクトしたcos−7細胞、右図:対照プラスミドをトランスフェクトしたcos−7細胞)。
【図15】PDD/プラスミドの2つで免疫されたマウスの高タイター抗体反応誘導を表すイン−セル・ウエスタン・アッセイのマルチウェルプレートのグラフと写真である。
【図16】PDD/プラスミド−VgPCRで1回免疫し、更にPDD/プラスミド−VgPCRで2回免疫することにより抗体反応を誘導した免疫マウスの血清イン−セル・ウエスタン・アッセイのマルチウェルプレートの写真である。
【図17】G5デンドリマー、コンジュゲート体、及び、ペプチドのUV−可視スペクトルを表すグラフである。
【図18】PADRE−デンドリマー/OVA プラスミドの予防的ワクチン接種のB16/OVA腫瘍に対する効果を示すグラフである。
【0049】
図1は、プラスミドと混合、又は、標的APC(抗原提示細胞)に対するペプチド若しくはポリペプチド抗原と連結したPADRE−デンドリマーを示す一対の概要図である。図1は、本明細書に記載されたPADRE−デンドリマーがいかなる関心抗原又はいかなる関心抗原をエンコードする核酸を取り込むことが可能なプラットフォームを提供することを表す。本明細書におけるPADRE−デンドリマーは、プロフェッショナル抗原提示細胞によって取り込まれるようにデザインされた生来の免疫力の活性化剤である。
【0050】
図2は、イン・ビトロでの、赤色蛍光色素でタグ付けした短い核酸配列とPADRE−デンドリマーとの複合体の送達を示すヒトB細胞の解析についての一連のドット・プロット・サイトメトリー画像である。該核酸は、哺乳類細胞へのsiRNAオリゴヌクレオチド送達最適化の評価促進のためのRNAi解析での使用のためにデザインされた赤色蛍光標識dsRNAである。細胞は、PADRE−デンドリマー/多ヌクレオチド複合体又は対照と共に、培地を除去し、新鮮な培地を添加し、4時間共培養された。画像は、精製ヒトB細胞へのAlexa Fuor標識dsRNAオリゴマーの送達を示す。第4カラムの最下段の画像は、約9.2%の細胞でのオリゴ送達を示す。
【0051】
図3は、イン・ビボにおけるPADRE−デンドリマーのDNA送達を表す一連の写真である。PADRE−デンドリマー/GFP(緑色蛍光タンパク質)−プラスミド複合体が皮膚(全5μgプラスミド)及び角膜(1μg/角膜)に注入された。麻酔されたマウスの肝臓のステレオ蛍光顕微鏡画像が撮影された。左の画像は皮膚でのGFP発現が、右の画像は角膜でのGFP発現を示す。
【0052】
図4は、確立された腫瘍の処置を示すグラフである。C57BLマウスが、GFP(1回)又はOVA(2回)をエンコードするプラスミドの皮下投与で免疫された。3匹の血清が採取され、ELISA(左図)又はFLISA(右図)が実施された。
【0053】
図5は、確立された腫瘍のPADRE−デンドリマー治療についての一対のグラフを示す。B16メラノーマ細胞(上段)又はTSA(下段)が移植されたマウスが、腫瘍移植後2日目又は3日目にワクチン接種され、1週間後に追加免疫された。
【0054】
図6は、ヒト末梢単核球細胞(PBMC)(下段図)、ヒトB細胞(上段図)のデンドリマー−PADREとGFPプラスミド(5μg)との複合体を共培養したGFP発現の一連のフロー・サイトメトリーヒストグラムである。デンドリマー/GFP複合体が対照(左ヒストグラム)として使用された。
【0055】
図7は、イン・ビトロでのタンパク質、アルブミン−FITCのPDD(PADRE−誘導体化デンドリマー)によるヒトB細胞への送達を示す一連のフロー・サイトメトリー・ドット・プロットである。左画像は、精製ヒトB細胞へのPDD/アルブミン−FITC送達を表す。ヒト精製B細胞が採取され、PDD/アルブミン−FITCと共培養された。左ヒストグラムはヒトB細胞に添加後のPDD/アルブミン−FITC送達を示す。上段のヒストグラムはB細胞単独を、中段のヒストグラムはデンドリマー/アルブミン−FITC複合体を、下段のヒストグラムはヒトB細胞添加PDD/アルブミン−FITC複合体の結果を表す。右写真はPDD/アルブミン−FITC複合体添加後1時間のB細胞によるアルブミン取り込みの蛍光写真の画像である。
【0056】
図8は、リンパ節でのイン・ビボDC(樹状細胞)標的を示す一連のフロー・サイトメトリー・ドット・プロットである。左画像は、注入、リンパ節摘出、及び解析の時間概念図を表し、右画像図は、PDD/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節細胞から得られるナイーブのリンパ節に対するデータ解析の一対のフロー・サイトメトリー・ドット・プロットを表す。これらの画像は、リンパ節近接の注入部位のマウスDC及びB細胞のイン・ビボPADRE−デンドリマーの効果を表す。リンパ細胞はCD11c(DCマーカー)、MHCクラスII及びCD20(B細胞マーカー)で染色した。右上段のヒストグラムは、デンドリマー/GFP−プラスミド注入がDCの約6%にGFPを発現する結果を、下段ドットプロットは明確にPDD/GFP−プラスミド注入がDC>70%でGFPを発現する結果を示す。
【0057】
図9は、DRHA(デンドリマーHA)、異なったTヘルパーエピトープで修飾されたデンドリマーを表す一対のグラフを示し、イン・ビボ標的リンパ節がDRHAによりDC(樹状細胞)へのGFPトランスフェクションを促進することを表す。本実験は、Balb/cマウスがIad制限HAペプチドコンジュゲートデンドリマーと連動して使用される点が相違するが、図8と同様である。DRHA/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節、及び、ナイーブなリンパ節が、DRHA/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入後5日目に摘出された。チャートは、DCに対してCD11c(DCマーカー)で染色後のリンパ節細胞から得られたデータのフロー・サイトメトリー解析結果を表す。上段の図は、既に示した処置マウスの流入領域リンパ節に認められるGFP陽性DC数を表す。下段の図は、DC中のGFP蛍光強度の平均を表す。これらの結果は、DRHAがイン・ビボでトランスフェクトされたDC数を増加するだけではなく、細胞に入るプラスミド分子の数の増加を明確に示す。
【0058】
図10は、赤色(Alexa Fuor)標識dsRNAオリゴマーオリゴとの複合PADRE−デンドリマーでトランスフェクトされたヒトB細胞の顕微鏡写真である。
【0059】
図11は、赤色(Alexa Fuor)標識dsRNAオリゴマーとのデンドリマー複合体でトランスフェクトされた(左図)、及び、赤色(Alexa Fuor)標識dsRNAオリゴマーとのPADRE−デンドリマー複合体でトランスフェクトされた(右図)、ヒヒ末梢血単核球(PBMC)の一対の顕微鏡写真である。蛍光顕微鏡写真は、PDD/dsRNA−Alexa Fuor又は対照複合体をヒヒ末梢血単核球に対して添加後2時間に撮影された。画像は、サル末梢血単核球へのPDDを介した多ヌクレオチドの標的送達の高い効果を表す。
【0060】
図12は、プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)の一対の顕微鏡写真を表す。プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)。蛍光写真画像は、ヒヒPBMCにPDD/GFP−プラスミド又は対照複合体を添加後1日に撮影された。本画像は、プラスミドの標的送達の高い効果とPDDを介したプラスミドによってエンコードされた遺伝子発現を表す。
【0061】
図13は、PADRE−デンドリマーのプラスミド(DRP−ovaプラスミド)複合体のDNAワクチン単回接種がプラスミドのイン・ビボ電気穿孔法(EP−ovaプラスミド)に優ることを表す結果のグラフである。
【0062】
図14は、PDD/プラスミド−PCARD抗原の2つで免疫したマウスの高タイター抗体反応誘発を示す免疫マウス血清を使用するイン−セル・ウエスタン・アッセイのマルチウェルプレートの一対の写真である。マルチウェルプレートは、抗原をエンコードするプラスミドをトランスフェクトしたcos−7細胞(左図)及び対照プラスミドをトランスフェクトしたcos−7細胞(右図)を含んでいる。
【0063】
図15は、PDD/プラスミドの2つで免疫したマウスの高タイター抗体反応誘導を表す免疫マウス血清を使用するイン−セル・ウエスタン・アッセイのマルチウェルプレートのグラフと一連の写真である。PADRE−デンドリマーのGFP又はovaをエンコードするプラスミド複合体で1回免疫した、又は、PADRE-デンドリマーのCCR5、vgPCR、CathL、若しくはp2をエンコードするプラスミドとの複合体で2回免疫したイン−セル・ウエスタン・FLISAの結果を表す。
【0064】
図16は、PDD/プラスミド−VgPCRで1回免疫し、更にPDD/プラスミド−VgPCRで2回免疫することにより抗体反応を誘導した免疫マウスの血清を使用したマウス、イン−セル・ウエスタン・アッセイのマルチウェルプレートの一対の写真である。これらの結果は、PDD/プラスミド−VgPCRでの単回免疫が、追加免疫で高められる抗体反応に結びつくことを示す。
【0065】
図17は、G5デンドリマー、コンジュゲート体、及び、ペプチドのUV−可視スペクトルを表すグラフである。
【0066】
図18は、本明細書で(PADRE−デンドリマー/OVA プラスミド)と記載されるワクチン接種の予防的な設定でB16/OVA腫瘍の撲滅を示すグラフである。
【発明を実施するための形態】
【0067】
詳細な説明
本明細書に、イン・ビボでのワクチン接種及び抗体(例えば、モノクローナル抗体)製造のための1又は2以上の抗原の効果的な送達を目的に、及び、PAPC(プロフェッショナル抗原提示細胞)又はMHCクラスII陽性細胞(例えば、腫瘍細胞)へのペプチドか、タンパク質か、siRNAか、RNA又はDNAかの効果的な送達を目的に、ナノ粒子に基づくワクチンと、組成物と、キットと、及び、方法とが記載されている。典型的なワクチン又は組成物において、荷電(例えば陽荷電)性高分枝ポリマーデンドリマーは、MHC標的で、Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHAのようなエピトープ)のような免疫原性ペプチドにコンジュゲートされ、披験体における特定の抗原に対する免疫応答を誘導するための少なくとも1つの分子にコンジュゲート又は結合される。前記分子は、細菌性、真菌性、原生動物、若しくはウイルス起源のタンパク質若しくはペプチド、又は、これらの抗原、炭化水素、若しくはペプチド様炭化水素由来のフラグメントであっても良い。該分子は、自己免疫疾患処置のための自己抗原を含んでも良い。さらに、抗原性分子は、少なくとも1つの抗原をエンコードする哺乳類のプラスミドを含む1以上の核酸であっても良い。例えば、抗原は、披験体(例えば哺乳類)において、1以上の免疫原性ペプチドを発現して、該発現タンパク質に対する強く特異的な免疫応答の誘導に結びつく1以上の核酸であっても良い。別の例として、抗原は、プロセシングされて提示される免疫原性のペプチド又はポリペプチドであっても良い。荷電(例えば、陽荷電)性高分枝ポリマーデンドリマーは2以上の異なる抗原にコンジュゲートされることが可能であり、同様に、各々異なる抗原をエンコードする2以上の核酸とコンジュゲートすることが可能である。本明細書において、ワクチン又は他の組成物は、一つの型の抗原をコンジュゲートした複数の荷電(例えば、陽荷電)性高分枝ポリマーデンドリマー(例えば、特定の抗原の5つの複製をコンジュゲートした5つのデンドリマー)、又は、異なる抗原の複数にコンジュゲートされた荷電(例えば、陽荷電)性高分枝ポリマーデンドリマー(例えば、5つの異なる抗原に対する5つのデンドリマー)を含むことができる。該デンドリマーは、デンドリマー(陽性)と抗原(陰性)との反対の電荷に基づき、抗原(核酸又はタンパク質)との複合体(コンジュゲート)を作る。又は、コンジュゲートは共有的な化学結合の場合がある。
【0068】
1つの実施態様として、本明細書に記載されるように、イン・ビボで抗原を送達するためのナノ粒子に基づく方法は、Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHA等のようなエピトープ)のようなMHC標的又は免疫原性ペプチドとコンジュゲートし、荷電(例えば陽荷電)性高分枝ポリマーデンドリマー(例えば、PADRE−誘導体化デンドリマー(PDD))に対して、結合する抗原、又は、コンジュゲートするポリペプチド又は抗原性ペプチド若しくはポリペプチドをエンコードするDNAプラスミドによって組成されるワクチンの注入を含む。陰性に荷電したプラスミドは、自然に、陽性に荷電したPADRE−デントリマーに結合する、一方、ペプチド又はポリペプチド抗原は、もし陰性に荷電していないならば、化学的にPADRE−デンドリマーに連結される。別の実施態様において、デンドリマーは、陽荷電性のタンパク質及びペプチドと結合するために陰性に荷電している。表面に暴露された抗原又は抗原をエンコードする核酸は、いかなる好適な公知の手段によって、デンドリマーにコンジュゲートされても良い。コンジュゲート方法は、自然のイオン的、非イオン的、静電気的結合又は共有結合のどれであっても良い化学的な複合体形成を含む。本明細書において、Tヘルパーエピトープにコンジュゲートされたデンドリマーは、多価であることが可能であり、抗原の1以上の複製若しくは型、又は核酸を表面に提示できる。多価の、又は、凝集した抗原(又は抗原をエンコードする核酸)の存在は、披験体の免疫応答を高める。抗原又は核酸の型の1以上の複製は、2以上の分離したリンカー若しくはスペーサー、又は共通のリンカー若しくはスペーサーを介してデンドリマーに接着できる。本明細書の組成物、キット及びワクチンは予防的及び処置的の両方の適応を有する。即ち、披験体の病気又は疾患の発症を防止する予防薬として使用できる。いかなる感染病原体又はがんに対する免疫応答を備えるために、本明細書記載のワクチンが使用可能である。
【0069】
本明細書において、治療剤は単核球、特にB細胞を標的として使用でき、同時発生慢性リンパ球性白血病及び多発性骨髄腫に使用できる。本明細書において、ナノ粒子(例えば、PADRE−誘導体化デンドリマー)と治療剤(医薬品)との組み合わせが複数の形態、例えば、治療剤とナノ粒子の混合物で使用できる。本明細書に記載するナノ粒子の組み合わせ(例えば、PADRE-誘導体化デンドリマー)及び治療剤(例えば、医薬)は、例えば、治療剤とナノ粒子との混合物、複合体形成のための静電的結合、治療剤のナノ粒子への化学的コンジュゲート等、いくつかの形態で使用しても良い。治療薬の例として、毒素、iRNA、siRNA、マイクロRNA、(例えば、腫瘍抑制遺伝子、自殺遺伝子(例えば、TK)、又は、腫瘍の増殖及び/又は生存を遮断又は変化させるいかなる遺伝子をエンコードする)プラスミド、タキソール(登録商標)(パクリタキセル)(Bristol−Myers Squibb)、抗体、メルファラン、プレドニゾン、サリドマイド(MPT)、ベルケード(登録商標)(ボルテゾミブ)(Millenium Pharmaceuticals)、レナリドミド、及び、デキサメタゾン、又は、これらの組み合わせを含むが、これに限定されない。
【0070】
同様に、本明細書記載の組成物及び方法は、単球、樹状細胞、T細胞又はB細胞を含む免疫細胞に治療薬が到達する(送達される)自己免疫疾患の治療に使用されても良い。本明細書記載の組成物は、陰荷電性で本明細書に記載のナノ粒子との複合体を生成するポリI.C.(しかし、これに限定されない)のようなアジュバントとともに使用されても良い。
【0071】
下記の好ましい実施態様は、これらの組成物, ワクチン、キット及び方法の適用を表す。それにもかかわらず、これらの実施態様の記載から下記の記載に基づいて発明の他の側面が作られ、及び/又は、実践する場合がある。
【0072】
生物学的方法
ここで、従来の分子生物学的技術を含む方法を記載する。このような技術はSambrookら著「分子クローニング:研究室マニュアル 第三版、1−3巻」(Cold Spring Habor Laboratory Press、Cold Spring Harbor N.Y.、2001)、及び、Ausubelら著「分子生物学の現在のプロトコール」(Greene Publishing and Wiley−Interscience、N.Y.1992年(定期出版物))のような方法論の文献や専門書に詳細に記載され公知である。免疫学的技術は、Frederick W.Alt著「免疫学の進歩、第93巻」(Academic Press,Burlington、MA、2007)、Gary C Howard 及びMatthew R.Kaser編集「抗体の作製と使用 実践的ハンドブック」(CRC Press、Boca Raton、Fl、ロンドン、英国)、Gabriel Virella著「医学免疫学 第6版」(Informa Healthcare Press、ロンドン、英国、2007年)、及び、Harlow and Lane著「抗体、研究室マニュアル」(Cold Spring Habor Laboratory Press、Cold Spring Harbor N.Y.、1988)のような文献や専門書に詳細に記載され公知である。遺伝子導入、及び遺伝子治療の従来の方法は本発明に適用されても良い。例えば、T.Blackenstein「遺伝子治療:原理と応用」(Springer Verlag 1999)、及びP.D.Robbins著「遺伝子治療プロトコール(分子医学の方法)」(Humana Press 1997年)を参照のこと。ワクチン製造の方法とワクチン投与は、例えば、Andrew Robinson、Martin P.Cranage 及びMichael J.Hudson著「ワクチン・プロトコール(分子医学の方法)第2版」(Humana Press、Totowa、NJ、2003年)、Manmohan Singh著「ワクチン、アジュバント及び送達システム 第1版」(Wiley−Interscience、Hoboken、NJ、2007年)、Arvin A.M.及びGreenberg H.B.著、Viology、344:240-249、2006年、R.Morenweiser著、Gene Therapy suppl.1: S103−S110, 2005年のような文献に詳細に記載され公知である。PAMAMデンドリマーと同様にワクチンの構築と使用は、例えば、Arashkiaら、Virus Genes40 (1):44−52, 2010年; Veldersら、J.Immunol.、166:5366-5373, 2001年; 及び、S.Chauhan、N.K.Jain、P.V.Diwan(2009年)「マウスにおけるPAMAMデンドリマーの前臨床及び行動毒プロフィール」(Proceedings of the Royal Society A、数学、物理学、工学科学(オンライン出版日2009年12月3日)に記載されている。
【0073】
核酸、ペプチド、ポリペプチドとのコンジュゲート体 デンドリマーの合成
デンドリマーは濃密なDNAの骨格(schaffold)として作用し、完全に陽荷電したデンドリマーは陰荷電性のDNA又はRNAとの強い電気的相互作用の発生に対して好ましい。例えば、デンドリマー/Tヘルパーエピトープ/DNA複合生成物は、調整可能なN/P比率(アミンに対するリン酸、又は、荷電比率)に依存する正味の荷電を有する。本明細書において、少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞(PAPC)に特異的に結合するように、少なくとも一つのTヘルパーペプチド、及び、抗原、核酸又はsiRNAがデンドリマーの外表面にコンジュゲートされていることを特徴とし、該Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHAのようなエピトープ)及び、抗原、抗原をエンコードする核酸又はsiRNAをコンジュゲートするデンドリマーが記載される。一つの実施態様において、デンドリマーは、少なくとも1つ(例えば、2、3、4、5個等)のPADREペプチド、及び、ペプチド又はポリペプチド抗原にコンジュゲートされている。本実施態様において、デンドリマーは、典型的には、複数のペプチド又はポリペプチド抗原とコンジュゲート又は結合している。いくつかの抗原(例えば、複数の同一抗原)とのコンジュゲート又は結合は、抗原がハプテン関連の大きさの問題により効果的な免疫応答を誘導できない小さい抗原(特に、小ペプチド又は糖質)の場合に、特に有用である。本明細書に記載のデンドリマー/Tヘルパーエピトープ/核酸コンジュゲート体が抗原の多くの複製を含むことは、抗原の免疫原性を向上できる。もう一つの実施態様において、デンドリマーは、PADREペプチドとコンジュゲートし、抗原をエンコードする核酸と結合する。さらにもう一つの実施態様において、デンドリマーは、PADREペプチドとコンジュゲートし、関心遺伝子に対するsiRNAを結合する。これらの実施態様において、いかなる有用な方法によってデンドリマーが調製され、Tヘルパーペプチド(例えば、PADREペプチド及びインフルエンザHAのようなエピトープ)をコンジュゲート、及び、核酸(例えば、DNA及びsiRNA)と結合できる。デンドリマーを製造し、使用する方法は、例えば、引用文献として両方が本明細書に取り込まれるZhang J−Tら、Macromol.Biosci.2004、4、575-578、並びに、米国特許4216171号公報及び5795582号公報の文献に記載され周知である。D.A.Tomalia、A.M.Naylor,及び、W.A.Goddard III「星型デンドリマー:サイズ、形、表面科学、トポロジー、及び、柔軟性の原子から大分子までの分子レベルの調節」Angew. Chem.Int.Ed.Engl. 29 (1990年)、 138-175を参照のこと。本明細書記載の実験において、PAMAM−デンドリマーが使用された。しかしながら、いかなる適正な陽荷電性高分枝ポリマーデンドリマーを使用できる。付加的な陽荷電性高分枝ポリマーデンドリマーは、ポリ(プロピレンイミン)(PPI)デンドリマー又はより一般的に表面に1級アミノ基を有する他のいかなるデンドリマーを含む。
【0074】
本明細書に記載されているPADRE−デンドリマー (PADRE誘導体化デンドリマー)は、適正な方法によって調製される。例えば、米国特許5736142号公報を参照のこと。米国特許5736142号公報に記載されたPADREペプチドを製造するために、Jadetzkyらが最初に記載した戦略(EMBO J 9:1797−1083、1990年)、即ち、13置換基のポリアミンに挿入されるMHCに結合するために重要な側鎖を含むアンカー置換基が使用された。PADREペプチドは、例えば、米国特許5736142号公報に記載された方法に従って調製可能、又は購入可能(例えば、Anaspec Inc.Fremnt、CA)である。相対的に小さいサイズのため、PADREペプチドは溶液又は固体支持体上で従来法に従って合成可能である。種々の自動合成装置が商業的に利用可能であり、公知のプロトコールに従って使用可能である。それに代わって、組換えDNA技術が、Tヘルパーエピトープをエンコードする配列の発現ベクターへの挿入、変換、又は、適切な宿主細胞へのトランスフェクト、発現のための適性条件下での培養のために使用されても良い。これらの操作は、本明細書に引用文献として取り込まれるSambrookらの文献(上記)に記載され、公知技術である。本明細書に記載のように、PADREペプチドは、N−及びC−末端置換基への改変を含んでも良い。当業者によって良く理解されているように、N−及びC−末端は、例えば、結合、安定性、生物学的利用性、連結容易性のような物理的又は化学的性質を変更するために改変されても良い。本明細書に記載されるようにPADREペプチドは、希望とする特性、例えば、非改変ペプチドの実質的な全生物活性を維持しつつ、改良された薬理学的特性を与えるために、いかなる数の方法で改変されても良い。
【0075】
本明細書に記載の実験において、PADRE−デンドリマーコンジュゲート体は、PADREペプチドの−COOH末端とデンドリマーのアミノ基の一つとの単純なアミド結合によって製造された。PADREペプチド(Ac−D−Ala−Lys−Cha−Val−Ala−Ala−Trp−Thr−Leu−Lys−Ala−Ala−D−Ala−Ahx−Cys−OH)(SEQ ID NO:1、Ac=アセチル基; D−Ala=D−アラニン; Cha=シクロヘキシルアラニン; Ahx=アミノヘキサン酸)は、Anaspec社(Fremont、CA)より、アミノ末端の保護と反応回避のためにアセチル誘導体を購入した。購入されたペプチドは95%以上の純度であった。アミド結合反応はDMF溶液中で標準的な条件で行われた(図1、下段概要図参照)。大半のアミノ基を遊離状態に保ちデンドリマーの大きな陽荷電性生成のためにデンドリマー1個当たり2−3個のペプチドの結合を求め、各々のデンドリマー表面へ結合するPADREエピトープの数を調節するために、反応では2:1のペプチド/デンドリマー比が使用された。典型的な実施態様において、本明細書で記載されている複数のPADRE−デンドリマーコンジュゲート体は、0、1、2、3個等が結合したPADRE(又は他のペプチド)を含むデンドリマーが頒布されるであろう。相対的母集団は、ポワッソン分布に従うものと記載される。PADRE、aKXVAAWTLKAAa(SEQ ID NO: 2)は、もっとも普及した16の中の15のHLA−DR分子(Kawashimaら、Human Immunology 59: 1−14(1998); Alexanderら、Immunity1: 751−761(1994))に対して高い又は中等の親和性(IC50<1000nM)で結合する。しかしながら、大半のヒトでMHCクラスIIに結合しCD4ヘルパーT細胞を活性化可能な他のペプチドがデンドリマーを標識するために使用されても良い。ペプチドの例として、これに限定されないが、テタヌス毒素(IT)ペプチド830-843; Panina−Bordignonら(Eur.J.Immunology19: 2237-2242(1989))に記載された普遍的エピトープ; 及び、大半のヒト、及び、多くのマウスのMHCクラスIIと反応する下記ペプチドを含む。
【0076】
aKFVAAWTLKAAa (SEQ ID NO:3)、aKYVAAWTLKAAa (SEQ ID NO:4)、aKFVAAYTLKAAa (SEQ ID NO:5)、aKXVAAYTLKAAa (SEQ ID NO:6)、aKYVAAYTLKAAa (SEQ ID NO:7)、aKFVAAHTLKAAa (SEQ ID NO:8)、aKXVAAHTLKAAa (SEQ ID NO:9)、aKYVAAHTLKAAa (SEQ ID NO:10)、aKFVAANTLKAAa (SEQ ID NO:11)、aKXVAANTLKAAa (SEQ ID NO:12)、aKYVAANTLKAAa (SEQ ID NO:13)、AKXVAAWTLKAAA (SEQ ID NO:2)、AKFVAAWTLKAAA (SEQ ID NO:14)、AKYVAAWTLKAAA (SEQ ID NO:15)、AKFVAAYTLKAAA (SEQ ID NO:16)、AKXVAAYTLKAAA(SEQ ID NO:17)、AKYVAAYTLKAAA (SEQ ID NO:18)、AKFVAAHTLKAAA (SEQ ID NO:19)、AKXVAAHTLKAAA (SEQ ID NO:20)、AKYVAAHTLKAAA (SEQ ID NO:21)、AKFVAANTLKAAA (SEQ ID NO:22)、AKXVAANTLKAAA (SEQ ID NO:23)、及びAKYVAANTLKAAA (SEQ ID NO:24)(a=D−アラニン、=シクロヘキシルアラニン)。他の使用可能なエピトープのもう一つの例は、マウスBalb/c MHCクラスII IaDに結合するHAペプチド配列SFERFEIFPKE(SEQ ID NO:25)(プロウイルスPR8ウイルスHA由来)である。
【0077】
製造物を少なくとも24時間純水に対して透析することにより精製し、真空下乾燥した。集めた製造物は、透明な油状であり、1H−NMR(核磁気共鳴分析法)、UV−Vis及びMALDI−TOF質量分析法で、その特性を分析した。PADRE−デンドリマーコンジュゲート体のNMRスペクトルは、デントリマープロトンに一致する大きなピークと、ペプチドプロトンについての小さなピークの集合を示した。PADRE−デンドリマーコンジュゲート体のMALDI−TOF質量分析スペクトルは、デンドリマー単独で観察されるピークよりも約3000 m/z高いピークを示した。その超過分の質量は、約2個のペプチドエピトープに一致する。コンジュゲート体のUV−Visスペクトルは、トリプトファンの吸収波長領域に明確な吸収を示す。
【0078】
PADRE−デンドリマーコンジュゲート体とのプラスミドDNAの複合化は、生理的pHのPBS緩衝水溶液中で、2つの成分を混合することにより行われた。N/P(アミン対リン酸)比の典型的な値は、10:1である。DNAの完全な複合化を分析するためにゲル電気泳動法が使用される。生理的pH値においてアミノ基(−NH2)は水素化され、デントリマーの高い陽荷電性を与え、陰荷電性のDNA又はRNAの細胞への送達に特に適している。水溶液において、陽荷電性のデンドリマーと陰荷電性の核酸は、比較的容易に細胞膜を透過及び通過可能な凝縮物又はナノ粒子を生じさせる。
【0079】
PADRE以外のTヘルパーエピトープとコンジュゲートするデンドリマーは、上記のPADRE−誘導体化デンドリマーと同様の方法で典型的に調製される。例えば、ペプチドの酸末端は、活性化試薬としてのカルボジイミドを使用するアミド化の一つによって、公知の合成方法によってデンドリマー表面上のアミノ基と共有結合することができる。もう一つの例として、アミン終末デンドリマーへのこれらペプチドの結合は、2つの合成経路によって実施できる。ペプチドエピトープのアミノ末端はアセチル化によって保護される。第一の経路は、標準的なアミド化化学による結合達成のために、システイン基のカルボン酸を使用する。第二の経路は、システインのチオール基(もしペプチドに存在する場合、それ以外は付加されても良い)の利点によって、マレイミドの前処理によりデンドリマー表面に結合するアルケン基と結合する。両経路は、エピトープ結合デンドリマーの機能化を与える。数個(several)までのペプチドエピトープ(例えば、2、3、4、5、6個等)/デンドリマーは、DNA送達剤としての標的性を高め、ワクチン化の目的に対しての特性を改善するだろう。しかしながら、生理的pH値での水素化によるデンドリマーの大きな陽荷電性の獲得のために多くの未反応アミノ置換基の放置は重要である。本明細書に記載のように、デンドリマーは、いかなるTヘルパーエピトープともコンジュゲート可能である。付加的なTヘルパーエピトープの一つの例は、インフルエンザHAである。
【0080】
一般的に、ジェネレーション−5(G5)のデンドリマーが、本明細書における組成物、キット及び方法に使用される。しかしながら、他のデンドリマー(表1参照)が使用可能である。
【表1】

【0081】
荷電されたポリマー担体ワクチン及び組成物
本明細書に記載のワクチンは、少なくとも1つのMHC標的及び免疫原性ペプチドと、及び、少なくとも1つの核酸か又は少なくとも1つのペプチド若しくはポリペプチド抗原が、荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の外部表面にコンジュゲートされ、前記MHC標的及び前記免疫原性ペプチド(例えば、Tヘルパーエピトープ)が特異的にPAPCに結合するように、Tヘルパーペプチド(例えば、PADREペプチド及びインフルエンザHAのようなエピトープ)のようなMHC標的で免疫原性のペプチド、及び、少なくとも1つのペプチド若しくはポリペプチド抗原か、又は少なくとも1つの抗原をエンコードする少なくとも1つの核酸かを、コンジュゲート又は結合したデンドリマーのような、少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体を含む。前記少なくとも1つのTヘルパーペプチドと、少なくとも1つのデンドリマーと及び少なくとも1つのペプチド若しくはポリペプチド抗原か又は前記少なくとも1つの抗原をエンコードする少なくとも1つの核酸の組み合わせは、ヘルパーT細胞の活性化を仲介するMHCクラスIIの誘導を含む、少なくとも1つの抗原に対する免疫応答を誘導することができる。さらに、ワクチンは油中水型乳剤を含む場合がある。ワクチンを前記哺乳類に投与することは、抗原に対するモノクローナル抗体の産生をもたらす。デンドリマー上か又はデンドリマー内に示された本明細書に記載されている抗原(Antigen)又は抗原類(antigens)は、さまざまな病原体の状態によって惹起された疾患に対する免疫応答を誘導する。1つの実施態様では、前記抗原は病原性細菌、真菌、又はウイルス性生物、レンサ球菌種、カンジダ種、ブルセラ種、サルモネラ種、シゲラ種、シュードモナス種、ボルデテラ種、クロストリジウム種、ノーウォークウイルス、炭疽菌、結核菌、ヒト免疫不全ウイルス(HIV)、クラミジア種、ヒトパピローマウイルス、インフルエンザウイルス、パラミクソウイルス種、ヘルペスウイルス、サイトメガロウイルス、水痘・帯状疱疹ウイルス、EBウイルス、肝炎ウイルス、マラリア原虫種、トリコモナス種、性感染症病原体、ウイルス性脳炎病原体、原虫疾患病原体、真菌疾患病原体、細菌疾患病原体、がん細胞、又はこれらの混合物に由来する場合があるがこれらに限られない。
【0082】
前記少なくとも1つのデンドリマーはさらにポリイノシンポリシチジン酸(Poly(I:C))へコンジュゲートされることができ、前記ワクチン又は組成物はさらに薬学的に許容可能な担体を含むことができる。1つの実施態様では、例えば、配列番号1のアミノ酸配列を各々有する2つのPan−DRエピトープのように、前記少なくとも1つのTヘルパーエピトープがPan−DRエピトープである。もう1つの実施態様では、前記TヘルパーエピトープはインフルエンザHAである。前記Tヘルパーエピトープは、しかし、CD4+Tヘルパー細胞の活性化をする又はTヘルパー細胞の活性化に寄与するいずれかのエピトープであることができる。CD4+Tヘルパー細胞のTヘルパーエピトープ活性化はCD8T細胞の増殖及び刺激と、B細胞による抗体産生とが必要とされ、その両方が感染性病原体又はがんに対する防御免疫応答の誘導に必要不可欠である。前記デンドリマーが抗原をエンコードする核酸にコンジュゲートされるある実施態様では、前記核酸は一般的に発現ベクターである。前記発現ベクターは、前記抗原をエンコードする遺伝子と、クローニング部位と、ポリアデニル化配列と、選択可能なマーカーと及び細菌の複製開始点とに操作可能に連結された真核細胞プロモーターを含むのが典型的である。一般的に、前記抗原は、がん抗原か又は感染性病原体からの抗原かが典型的である。前記少なくとも1つのデンドリマーは一般的にG5デンドリマーである。同様に、前記デンドリマーがペプチド又はポリペプチド抗原にコンジュゲートされる実施態様では、前記抗原は、一般的にがん抗原か又は感染性病原体からの抗原かであり、前記少なくとも1つのデンドリマーはG5デンドリマーである。いくつかの実施態様では、アジュバントが前記ワクチン又は組成物に取り込まれる場合がある。
【0083】
デンドリマーはDNA(及びDNA、RNA、siRNA、microRNA、RNAi等を含むその他の核酸)を細胞内へ送るのに有効な担体である。しかし、ワクチン送達プラットフォームとして、デンドリマーは従来複数の理由のため欠陥があった。最初に、デンドリマーはアジュバント活性を欠如している;これらは自然免疫の有効な刺激を欠如しており、これらは「危険信号」を生成しない。また、デンドリマーは弱いAPCの標的しか提供せず、一般的に、これらは弱い獲得免疫の刺激しか提供しない。特に低い免疫原性又は「自己」抗原若しくは免疫系が寛容を獲得した「自己」抗原と高い相同性を有する抗原を扱う際に、PAPCを特異的に標的にし、「危険信号」を誘導し、注入部位にプロフェッショナル単核球を動員し、かつ、安全な強いアジュバント入りワクチン送達システムが非常に所望される。弱い抗原又は低い免疫原性を有するそれらは、無及び低レベルの特異的な免疫応答か、抗体応答か、又は細胞に仲介される免疫応答かをもたらす。本明細書に記載される前記ワクチンプラットフォームは、DNA又はペプチド又はポリペプチド抗原と複合体化された(コンジュゲートされた)生分解性ナノ粒子である。前記プラットフォームは、そのMHCクラスIIリガンドを介してPAPCを標的にし、結合し、及び高陽荷電性外膜により前記細胞膜を透過し、大量産生のためのスケールアップが安全かつ容易であり、及び分子上の修飾性により強力なアジュバントとして作用する。典型的な実施態様では、前記少なくとも1つのデンドリマーは、多分枝ポリマー高分子であり、その増強された可溶性のため理想的な添加剤であるG5 PAMAMデンドリマーである。G5は、特に、細胞内への前記DNAの送達に理想的である。本明細書に記載される典型的なワクチンは、前記注入部位への単核球の動員をもたらす一過性危険信号を誘導する油中水型乳剤を含む。DNAを取り上げ、これらの細胞は、所属リンパ節に移動し、抗原を提示するであろう。前記MHCクラスII分子の側面(flank)に結合する、例えば、PADREのような普遍的なTヘルパーアゴニストの包含は、PAPCへのデンドリマー複合体とヘルパーT細胞のオプソニン化をもたらす。この変化は不活性及び弱いデンドリマーを前記発現した関心抗原の強い免疫エンハンサーに変える。またアジュバント活性と持効性効果の両方を有する疎水性担体、すなわち、油性乳剤(例えば、Montanide ISA 720)を含むことは、抗原の遅延性放出をもたらす。Poly(I:C)を含むことは、さらに関心抗原に対する免疫応答の誘導を増大する。Poly(I:C)は正味の陰荷電を有するため、それは都合よくデンドリマーに結合し、免疫応答の強さを増大するアジュバントである。これらの特徴は強い「危険信号」として作用し、注入部位へさらに単核球(APCを含む)を動員する。併せて、これらの特徴は自然免疫を刺激し、有効な免疫応答の誘導のために必要とされる炎症誘発性サイトカイン環境の増大された発現をもたらす。
【0084】
ワクチンの1つの実施態様では、前記TヘルパーペプチドはPADREエピトープであり、及び前記デンドリマーはPADREで誘導体化されている。PADREは前記MHCクラスIIの大部分と結合する人工的に設計されたペプチドであり、そして、デンドリマー(例えば、PADREで誘導体化されたデンドリマー)とコンジュゲートされたPADREペプチドは、結果として生じる複合体又は高レベルのMHCクラスIIを発現するPAPCのためのリガンドのコンジュゲート体を作製する。この複合体は、従って、MHCクラスII又はPAPCを発現する細胞に高い親和性を有する普遍的に標的付けられたワクチン送達システムになる。PADREもまたTヘルパー細胞を活性化し、炎症誘発性サイトカインの環境をもたらし、そして、前記注入部位へその他の免疫細胞を動員する。デンドリマー、PADREを組み合わせることで、さらに「危険信号」を誘導することによる前記抗原の取り込みが増大する。PADREで誘導体化されたデンドリマーは現在既知のワクチンに対し複数の利点を提供する。最初に、G5デンドリマーは、結合し細胞膜非常に効果的に入り、前記タンパク質の強い発現をもたらす高荷電生分解性分子である。第二に、PADREは、多くのマウス及びヒトMHCクラスII分子と結合する普遍的なTヘルパーエピトープである。それは合成の非天然Tヘルパーエピトープ[AKchxAVAAWTLKAAA(配列番号:26)(chxA=シクロヘキシルアラニン)]である。前記デンドリマーの表面に融合する際に、PADREは主に全てのPAPCを含むMHCクラスIIを有する細胞を結合し、活性化するであろう。複数のPADREエピトープ(例えば、2、3、4、5個等)が各デンドリマーに不着することができる。前記付着は、その免疫原性性質が生じる前記ペプチド結合する性質を維持する適切なスペーサーとともになされる。リンカー又はスペーサー分子は、本明細書に記載される前記デンドリマーコンジュゲート体と抗原又はその他の分子をコンジュゲートするのに用いられる場合がある。スペーサーは、AAA、KK、GS、GSGGGGS(配列番号:27)、RS、又はAAYを含むアミノ酸の組み合わせのいずれかの場合がある。本明細書で用いられるところの、「リンカー」又は「スペーサー」という用語は前記デンドリマーと例えば前記MHCクラスIIリガンドか、CD4+Tヘルパーエピトープか、ポリペプチドか、又は前記デンドリマー(例えば、PADRE−デンドリマー)及び前記表面に曝露された分子にコンジュゲートされるか又は結合されるかの治療剤のような前記表面に曝露された分子との間に挿入する化学官能基を意味する。好ましくは、リンカーが1つの末端で前記表面分子に、及びそれらのその他の末端で前記ナノ粒子(例えば、PADRE−デンドリマー)にコンジュゲートされる。連結は同種又は異種2官能基剤、すなわち、SPDP、DSS、SIABのいずれかに、行われる場合がある。連結方法はde Jonghらの国際出願DK00/00531(WO01/22995)号公報で開示されており、各内容は引用により全体として本明細書に取り込まれる。
【0085】
第三に、前記ワクチンもまた油中水型乳剤を含む実施態様において、前記油中水型乳剤は前記注入部位への前記単核球の動員をもたらす一過性の「危険信号」を誘導する。DNAを拾うこれらの細胞は、領域リンパ節に移動し、抗原を提示するであろう。さらに、免疫応答誘導をさらに増大するために、合成2本鎖RNA(dsRNA)、poly(I:C)は前記デンドリマー(例えば、PADRE−デンドリマー)に結合する場合がある。PoIy(I:C)は、正味の陰荷電を有し、従って、デンドリマーへ都合よく結合され得るトル様受容体3(TLR−3)作動薬である。Poly(I:C)は、アジュバントであり、その正味の陰荷電により、前記デンドリマーへ結合し、前記免疫応答の強さを増大するであろう。Poly(I:C)のデンドリマーへの結合は、それが前記注入の頻度と及び注入間のインターバルを減らすため、前記モノクローナル抗体の産生(以下に記載される)において、特に有用である。
【0086】
本明細書に記載されている抗原をエンコードする核酸分子は、RNA(例えば、mRNAか、microRNAか、siRNAか、shRNAか又は合成化学的に改変されたRNA)の形態か又はDNA(例えば、cDNAと、ゲノムDNAと、及び合成DNA)の形態である場合がある。前記DNAは2本鎖か又は1本鎖かである場合があり、1本鎖の場合、コード(センス)鎖か又は非コード(アンチセンス)鎖である場合がある。1つの実施態様では、核酸は、不死化されたか、又は原発腫瘍の細胞株から、単離又は増幅されたRNA分子であることができる。
【0087】
上記に記載されているように、1つの実施態様では、免疫応答の誘導のためのワクチンは、前記結果として生じる複合体が前記抗原に対する免疫応答を誘導するコンジュゲートされた少なくとも1つのTヘルパーエピトープ、及び、抗原をエンコードする核酸を有する少なくとも1つのデンドリマーを含む。これらの組成物及び方法は、例えば、ウイルスベクターか又はイン・ビボ電気穿孔法の使用を必要とするその他の遺伝子免疫法と比較して、非常に安全で、簡単で、速い。液性又は細胞免疫応答の誘導のための前記DNAの使用は、複数の利点を有する。最初に、DNAの使用は、天然にプロセシングされたエピトープの完全なスペクトルを提供する。また、Tヘルパーエピトープ及び抗原をエンコードする核酸にコンジュゲートされたデンドリマーは、全ヒトMHC(AKA、HLA)の95%を超えるAPCを標的とする普遍的なワクチンの送達を提供し、精製が課題のタンパク質の精製の必要性を除去する。かかるタンパク質は、多タンパク質複合体の一部であることができ、膜タンパク質であることが可能であり、不正確に折りたたまれており、不溶性であることができる。本明細書に記載されている、前記デンドリマーコンジュゲート体は、タンパク質のグリコシル化又は翻訳後修飾を必要とせず、それらはタンパク質構造又は折りたたみの干渉にタグ付けし、劇的なコスト及び時間の節約を提供する。PADRE−デンドリマーが、マウス、ヒヒ及びヒトからのPBMCへ核酸を標的づけし送達するという事実は、このプラットフォームをマウスから非ヒト霊長類、及びヒトへの急速なトランスレーショナルリサーチの理想的な候補にする。
【0088】
また上記に記載されたように、もう1つの実施態様では、免疫応答の誘導のためのワクチンは、油中水型乳剤及び、前記少なくとも1つのTヘルパーエピトープと及び前記ペプチド若しくはポリペプチド抗原とが前記デンドリマーの外部表面にコンジュゲートされ、前記ペプチド若しくはポリペプチド抗原に対する免疫原性を誘導することができる少なくとも1つのTヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)及びペプチド若しくはポリペプチド抗原にそれとコンジュゲートされた少なくとも1つのデンドリマーを含む。弱い抗原性を有するペプチド又はポリペプチドが、本明細書に記載されているTヘルパーエピトープ/デンドリマー複合体にコンジュゲートされた(複合体化された)ときに、強い免疫応答を誘導する。正味の陰荷電を有するポリペプチド及びペプチドは、例えば、共有結合によるコンジュゲートの必要なくPADRE−デンドリマーと複合化する場合がある。例えば、PADRE−デンドリマーのような油中水型乳剤は、さらにアジュバント活性及び持効性の効果をもたらす。
【0089】
上述のように、本明細書に記載されている前記組成物及びワクチンは、予防上及び治療上の用途の両方を有する; これらは、被験体における疾患又は症状の発症を防ぐための予防として用いられこともでき、疾患又は症状を有する被験体を治療するために用いられる場合もある。本明細書に記載のワクチンは、感染性病原体又はがんのいずれかに対する免疫応答を備え付けるために用いられることもできる。感染性病原体の例は、例えば、インフルエンザ、HIV、デングウイルス、ロタウイルス、HPV、HBV、HCV、CMV、HSV、HZV、及びEBVのようなウイルスを含み、熱帯マラリア原虫、四日熱マラリア原虫、卵形マラリア原虫、三日熱マラリア原虫及びサルマラリア原虫といったマラリア原因病原体を含む病原性病原体;大形リーシュマニア、熱帯リーシュマニア、エチオピアリーシュマニア、メキシコリーシュマニア、ドノバンリーシュマニア、幼児リーシュマニアシノニムシャーガスリーシュマニア(L.infantumsyn.L.chagas)といったリーシュマニア原因病原体を含む病原性病原体;炭疽菌、百日咳菌、肺炎球菌、及び髄膜炎菌含む病原性細菌などを含むがこれらに限られない。本明細書に記載されている実験において、PADRE−デンドリマーは、マウスにおける確立したメラノーマ腫瘍を根絶させた。しかし、本明細書に記載されているTヘルパーエピトープ及び抗原又は抗原をエンコードする核酸にコンジュゲートされた前記デンドリマーは、いかなるがんに対する特定の免疫応答を備え付けるために用いられる場合がある。追加のがんの例は、HPV誘導子宮頸がん(例えば、抗原(TAA)に関連したE7/E7腫瘍又はこれらの抗原をエンコードするプラスミドが、本明細書に記載されている前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化することができる)、ヒトメラノーマ(例えば、TRP−I、TRP−2、gp−100、MAGE−I、MAGE−3及び/又はp53は、TAAとして用いられ、本明細書に記載されている前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化できる)、及び前立腺がん(例えば、TSAは、TAAとして用いられ、本明細書に記載される前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化される場合がある)を含む。同様に、肺腫瘍、乳房腫瘍、及び白血病について、いずれか適切なTAAが用いることが可能であり、多くが記載されている。かかるTAAの多くは、さまざまながん(例えば、CEA、MUC−1、Her2、CD20)の間で共通である。かかる抗原をエンコードするTAA又はプラスミドの混合物は、本明細書に記載されている普遍的な、多重使用がんワクチンを作製するために用いられる場合がある。本明細書に記載されている1つのワクチンの例において、CD4エピトープ/デンドリマー(例えば、PADRE−デンドリマー)は、1種類より多い抗原又は1種類より多い前記抗原をエンコードするプラスミドと複合体化される場合がある。代替的に、1つの抗原か又は1つの抗原をエンコードする1つのプラスミドと各々複合体化された複数のワクチンは、さまざまな病原体又はさまざまながんの1つのワクチンとして混合され用いられる場合がある。
【0090】
哺乳類への抗原送達方法及び免疫応答誘導
哺乳類(例えば、ヒト)へ抗原を送達する方法と、及び前記哺乳類における免疫応答の誘導のための前記抗原に対するモノクローナル抗体の産生を誘導する方法とが本明細書に記載されている。典型的な方法は、少なくとも1つのMHC標的ペプチドかつ免疫原性のペプチド(例えば、Tヘルパーエピトープ)がPAPCに特異的に結合するように、前記少なくとも1つのTヘルパーペプチド及び前記少なくとも1つの核酸、又は少なくとも1つのペプチド抗原若しくはポリペプチド抗原が、前記少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の前記外部表面へコンジュゲートされることを特徴とし、MHC標的ペプチド及び免疫原性ペプチド(例えば、TヘルパーペプチドPADREペプチド又はインフルエンザHA等)及び少なくとも1つのペプチド若しくはポリペプチド抗原又は前記少なくとも1つの抗原をエンコードする少なくとも1つの核酸をコンジュゲートした少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)を含む組成物の前記哺乳類への投与のステップを含み、前記少なくとも1つのMHC標的ペプチド及び免疫原性ペプチド(例えば、Tヘルパーエピトープ)、少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えばデンドリマー)、及び前記少なくとも1つの核酸又は少なくとも1つのペプチド若しくはポリペプチド抗原の組み合わせが、前記抗原に対する免疫応答を誘導することができる。前記方法において、前記組成物は、MHCクラスIIを介するヘルパーT細胞の活性化を誘導するために有効な量で投与され、モノクローナル抗体の産生、及び前記哺乳類の前記抗原に対する免疫応答をもたらす。組成物は、さらに油中水型乳剤を含む場合がある。前記少なくとも1つのデンドリマーは、さらに、典型的には、Poly(I:C)にコンジュゲートされ、前記組成物はさらに典型的に薬学的に許容可能な担体を含む。前記少なくとも1つのTヘルパーエピトープは、例えば、前記配列番号:1のアミノ酸配列を各々有する2つのPan−DRエピトープのような、Pan−DRエピトープが可能である。代替的に、前記少なくとも1つのTヘルパーエピトープは、例えば、インフルエンザHAのような、Pan−DRエピトープ(PADREエピトープ)以外が可能である。一般的に、前記少なくとも1つのデンドリマーは、G5デンドリマーである。
【0091】
1つの実施態様では、前記哺乳類はがん抗原を有し、前記抗原はがんであり、抗原及び前記組成物は前記がんに対するワクチンである。もう1つの実施態様では、前記哺乳類は感染性疾患を有し、前記抗原は感染性病原体からの抗原であり、前記組成物は、前記感染性病原体に対するワクチンである。かかる実施態様において、前記組成物の投与は、一般的に、前記哺乳類において局所的な副作用をもたらさない。前記組成物(例えば、ワクチン)を前記哺乳類の外側で処方することと、及び、例えば、前記哺乳類におけるがん抗原又は感染性病原体からの抗原のような抗原に対する免疫応答を刺激するために十分な量で、前記哺乳類に前記組成物を投与することとによって、かかる方法は一般的に行われる。本明細書に記載されている前記組成物、ワクチン及び方法は、例えば、哺乳類(例えば、ヒト、げっ歯類、イヌ、ネコ、ヤギ、ヒツジ、ウシ、ウマ等)のような動物の適切ないかなる被験体に利用することができる。がん又は感染性疾患に苦しんでいるか、又はがん又は感染性疾患の発症の危険にさらされているヒトの患者が典型的な被験体である。
【0092】
siRNAをPAPCに送達するための組成物及び方法
またsiRNAをPAPCに送達するための組成物及び方法が本明細書に記載されている。典型的な実施態様において、siRNAをPAPCに送達するため組成物は、少なくとも1つのMHC標的ペプチドと、免疫原性ペプチド(例えば、Tヘルパーペプチド)と、及びsiRNAがコンジュゲートされた少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)を含む。前記少なくとも1つのMHC標的ペプチドと、及び免疫原性ペプチド(例えば、Tヘルパーエピトープ)と、及び前記siRNAとは、前記少なくとも1つのTヘルパーエピトープがPAPCへ特異的に結合するように、前記少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の前記外部表面にコンジュゲートされる。前記siRNAは、関心遺伝子のいずれか(例えば、FoxP3、CD−28、CTLA−4)に(特異的に)向けることができる。前記組成物は、さらに油中水型乳剤を含むことが可能である。
【0093】
siRNAをPAPCに送達する典型的な方法は、前記少なくとも1つのTヘルパーペプチドがPAPCに特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、及び前記少なくとも1つのsiRNAとが、前記デンドリマーの前記外部表面にコンジュゲートされることを特徴とする、少なくとも1つのTヘルパーペプチド、及び少なくとも1つのsiRNAとをコンジュゲートした少なくとも1つのデンドリマーを含む組成物を提供し; 前記少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートした少なくとも1つのデンドリマーがPAPCに結合し、前記siRNAが前記PAPCに入り前記PAPC内で発現する条件で、哺乳類被験体へ前記組成物を投与するステップを含む。前記組成物は、さらに油中水型乳剤を含むことができる。前記方法において、前記siRNAは、前記関心遺伝子の発現を抑制するために、いかなる(特異的な)関心遺伝子(例えば、FoxP3)に対して向かわせることができる。1つの例において、FoxP3に対して向けられたsiRNAは、免疫応答を抑制し、免疫応答の負の制御として作用する細胞である、制御性T細胞の誘導をもたらす分子である、FoxP3の発現を抑制するために用いられる。この実施態様は、制御性T細胞が免疫療法及び介入を抑制している場合に、がん治療のための特定の使用を見出すことができる。制御性T細胞は、MHCクラスIIを発現し、PADRE−デンドリマー又はその他のCD4エピトープ−デンドリマーを介して標的化することができる。その他の例は、T細胞上の、T細胞へ抑制性シグナルを伝達するCTLA−4である。CTLA−4に特異的なsiRNAがPADRE−デンドリマーと複合体化するようなある実施態様では、前記複合体は、CD4T細胞を含むMHCクラスII発現細胞を標的化し、前記CTLA−4発現を抑制する。前記CTLA−4の発現が低いほど、前記病原体又はがんに対する免疫応答が高くなり、PAPCの中へ送達された際は、(病原体、がんに対する免疫応答を増大するために、又は、宿主がワクチン接種される場合に)免疫応答を抑制するか,又は、例えば乾癬のような自己免疫疾患の治療のためのB7.1、LFA−3、ICAM−I(T細胞活性化に必要なシグナル2誘導因子)を含む免疫応答を増大する分子の発現を防止又は低下する。
【0094】
典型的な実施態様において、本明細書に記載される組成物は、共抑制及び共刺激分子及びそれらの仮想共刺激受容体(例えば、FoxP3、CD28CTLA−4)に特異的なsiRNAを含む。配列−特異的siRNAは、標的核酸分子に結合し、その発現を抑制する。siRNAは、異常細胞、異常細胞増殖、及び感染性疾患病原体により惹起される腫瘍を含む腫瘍の治療に有効である。siRNAの送達のための組成物及びその治療方法が提供される。
【0095】
リボザイム、siRNA及びアンチセンス分子を構築し使用する方法は、当業者に知られている(例えば、Isaka Y.、Curr Opin Mol Ther vol.9: 132−136,2007;Sioud M.and Iversen P.O.、Curr Drug Targets vol.6:647−653,2005;Mouldy Sioud著、Ribozymes and siRNA Protocols (Methods in Molecular Biology)、2nd ed.、2004,Humana Press、New York、New York)。「アンチセンス」核酸は、例えば、2本鎖cDNA分子のコード鎖と相補的、又はmRNA配列と相補的であるように、タンパク質をエンコードする「センス」核酸と相補的であるヌクレオチド配列を含むことができる。前記アンチセンス核酸は、関心遺伝子の全てのコード鎖か、又はその一部のみと相補的であることができる。もう1つの実施態様では、前記アンチセンス核酸分子は、関心遺伝子をエンコードするヌクレオチド配列(例えば、5’及び3’非翻訳領域)のコード鎖の「非コード領域」をアンチセンスする。アンチセンス剤は、例えば、約8ないし約80の核酸塩基(すなわち約8ないし約80のヌクレオチド)、例えば、約8ないし約50の核酸塩基、又は約12ないし約30の核酸塩基を含むことができる。アンチセンス化合物は、標的核酸にハイブリダイズしてその発現を調節するリボザイム、外部誘導配列(EGS)オリゴヌクレオチド(オリゴザイム)、及びその他の短い触媒性RNAまたは触媒性オリゴヌクレオチドを含む。アンチセンス化合物は、前記標的遺伝子(すなわち、関心遺伝子)における配列と相補的である少なくとも8個の連続した核酸塩基の伸長を含むことができる。オリゴヌクレオチドは、特異的にハイブリダイゼーション可能であるその標的核酸配列と100%相補的である必要はない。オリゴヌクレオチドは、前記標的への前記オリゴヌクレオチドの結合が、標的分子の正常機能を阻害し利用性喪失をもたらし、そして、例えば、イン・ビボアッセイか、又は治療的処置の場合における生理的条件と、アッセイが行われる場合の条件下でのイン・ビトロアッセイのような、特異的結合が所望される条件で、標的でない配列に対する前記オリゴヌクレオチドの非特異的な結合を回避するのに十分な相補性の程度の場合に、特異的にハイブリダイゼーション可能である。
【0096】
RNA干渉(RNAi)は2本鎖RNA(dsRNA、また、低分子干渉RNAはsiRNAとして本明細書に言及され、又は2本鎖低分子干渉性RNAはds siRNAとして本明細書に言及される)が動物および植物細胞において相同的なmRNAの配列特異的分解を誘導する非常に有効なプロセスである(Hutvagner and Zamore、Curr.Opin.Genet.Dev.、12:225−232(2002);Sharp、Genes Dev.、15:485−490(2001))。哺乳動物細胞において、RNAiは、低分子干渉RNA(siRNA)の二重鎖(Chiuetal、MoI.細胞、10:549−561(2002); Elbashirら、Nature,411:494−498(2001))、又はRNAポリメラーゼIIIプロモーターを有するDNAの鋳型を用いてイン・ビボで発現するマイクロRNA(miRNA)、機能的小ヘアピンRNA(shRNA)、若しくはその他のdsRNA(Zengら、Mol.Cell、9:1327−1333(2002); Paddisonら、Genes Dev.、16:948−958(2002); Lee et al.、Nature Biotechnol.、20:500−505(2002);Paulら、Nature Biotechnol.、20:505−508(2002);Tuschl T.、Nature Biotechnol.、20:440−448(2002);Yuら、Proc.Natl.Acad.Sci.USA、99(9):6047−6052(2002);McManusら,RNA、8:842−850(2002);Suiら、Proc.Natl.Acad.Sci.USA、99(6):5515−5520(2002))によって引き起こすことができる。
【0097】
前記dsRNA分子は、各鎖に例えば16、17、18、19、20、21、22、23、24、25、26、27、28、29、または30ヌクレオチドなど約16乃至30の長さを典型的に含み、前記鎖の1つがmRNAにおける標的領域に対して実質的に同一、例えば少なくとも80%(またはそれを超える、例えば85%、90%、95%、または100%)同一であって、例えば3、2、1または0のミスマッチヌクレオチドを有し、もう片方の鎖は第1の鎖と同一又は実質的に同一である。各鎖もまた、例えば、dTdTdTのような1、2、3、4個、又はそれ以上のオーバーハングヌクレオチド1個又は2個以上のオーバーハング(すなわち、非相補的)ヌクレオチドを有する場合がある。
【0098】
前記dsRNA分子は化学的に合成でき、又はDNAの鋳型からイン・ビトロで転写でき、又は例えば、shRNAからイン・ビボで転写できる。前記dsRNA分子は、当業者に知られている方法のいずれかを用いて設計できる;多数のアルゴリズムが当業者に知られており、例えば、Tuschlら、Genes Dev 13 (24):3191−7(1999)を参照のこと、及び多くはインターネット上で利用可能である。
【0099】
陰性対照siRNAは、典型的には、選択されたsiRNAと同一ヌクレオチド組成を有するが、適切なゲノムに意味のある相補配列を有さない。かかる陰性対照は、選択されたsiRNAのヌクレオチド配列をランダムにスクランブルすることにより設計することができる;相同性検索は、前記陰性対照が、適切なゲノムにおいて、他の遺伝子のいずれに対しても相同性を欠失していることを確認するために行うことができる。さらに、陰性対照siRNAは、配列に1個又は2個以上の塩基ミスマッチを導入することによって設計することができる。いくつかの実施態様では、siRNAは、ヌクレアーゼへの耐性を前記siRNAに作るために、修飾ヌクレオチド(例えば、2F−RNA)を用いて生成できる。
【0100】
抗体作製のための方法及びキット
治療又は予防を目的として被験体へ投与することができる抗体を作製するための組成物と、キットと、及び方法とが、本明細書に記載される。細胞内へのDNA送達の現在の方法は非効率的であり、複雑であり、及び免疫応答をほとんど誘導しない。しかしながら、本明細書に記載される前記組成物及び方法は、関心抗原の急速及び高い発現を示す強い抗体応答をもたらす。本明細書に記載されるデンドリマー/Tヘルパーペプチドコンジュゲート体(例えば、PADRE−デンドリマー)は、抗体を作製する方法において、ペプチド又はポリペプチド又は核酸(例えば、DNA)と複合体化(コンジュゲート体化)可能である。Poly(I:C)のデンドリマーへの結合は、頻度及び注入インターバルを減らすため、前記モノクローナル抗体の産生に特に有用である。以下に記載される実験において、DNAとの複合体化PADRE−デンドリマーの単回注入後、強い液性応答と同様に角膜及び皮膚へのGFPの送達及び発現が示された。現在の薬剤の50%は精製が最も難しい膜タンパク質標的を標的にしている。本明細書に記載される組成物、キット、及び方法は、それらを精製することなく、かかる難精製タンパク質を標的にするための手段を提供する。
【0101】
ポリクローナル抗体は、免疫された動物の血清に含まれる不均一な抗体分子の集団である。本明細書に記載される組成物、キット、及び方法を用いて生成することができる抗体は、従って、ポリクローナル抗体、さらに、モノクローナル抗体、一本鎖抗体、Fab断片、F(ab’)2断片、及びFab発現ライブラリを用いて生成された分子を含む。特定の抗原に対する抗体の均一な集団であるモノクローナル抗体は、本明細書に記載されるデンドリマー/Tヘルパーエピトープコンジュゲート体及び標準ハイブリドーマ技術を用いて調製することができる(例えば、Kohlerら、Nature 256: 495,1975; Kohlerら、Eur.J.Immunol. 6:511、1976; Kohlerら、Eur.J.Immunol. 6:292、1976; Hammerlingら、「Monoclonal Antibodies and T Cell Hybridomas」、 Elsevier、N.Y.、1981; Ausubelら、上記を参照のこと)。特に、例えばKohlerら、Nature 256:495、1975、及び米国特許4376110号公報; ヒトB細胞ハイブリドーマ技術(Kosborら、Immunology Today 4:72、1983; Coleら、Proc.Natl.Acad.Sci.USA 80:2026、1983),及びEBVハイブリドーマ技術(Coleら、 「Monoclonal Antibodies and Cancer Therapy」、Alan R.Liss、Inc.、pp.77−96、1983)などで記載される培養継続細胞株による抗体分子産生を提供する技術のいずれかによって、モノクローナル抗体を得ることができる。かかる抗体は、IgG、IgM、IgE、IgA、IgDのいずれか、及びそのサブクラスのいずれかを含む免疫グロブリンクラスである。本明細書に記載されるmAbを産生するハイブリドーマは、イン・ビトロ又はイン・ビボで培養される場合がある。イン・ビボでのmAbの高タイター生成能力に対して、本明細書に記載されている組成物、キット、及び方法は、mAb産生で特に有用である。
【0102】
抗原又はタンパク質をエンコードする核酸(例えば、プラスミドDNA又はmRNA)は、i)単調で及び/又は高価な及び/又は適時のタンパク質精製ステップの除去、ii)従来のタンパク質精製から生じるタンパク質非天然型の感作を打ち消す宿主の細胞機構によるイン・ビボでのタンパク質の天然型の発現、及びii)タンパク質又は抗原の自然/天然型を標的とする治療用モノクローナル抗体作製のための理想的な方法、の利点を提供するため、デンドリマー/Tヘルパーペプチド(例えば、PADRE−デンドリマー)が、タンパク質又は抗原をエンコードする核酸と複合化(コンジュゲート化、又は結合)する本明細書記載の組成物、キット、及び方法は、タンパク質又は抗原の精製の必要性を否定する。
【0103】
特定の抗原に対するヒト抗体は、例えばマウスのような動物においてヒト抗体を産生するための公知の技術の適用によって作製できる。例えば、Fishwild、D.M.ら、Nature Biotechnology 14 (1996):845−851; Heijnen、I.ら、Journal of Clinical Investigation 97(1996):331−338; Lonberg N.ら、Nature 368(1994):856−859; Morrison S.L.、Nature 368(1994):812−813; Neuberger M.、Nature Biotechnology 14(1996):826; 及び米国特許第5545806; 5569825; 5877397; 5939598; 6075181; 6091001; 6114598; 及び6130314号公報を参照のこと。例えば米国特許第5530101、5585089、5693761、及び5693762号公報に記載されているように、特定の抗原に対するヒト型又はヒト化抗体は、公知の方法の適用により非ヒト抗体から作製可能である。
【0104】
一度生成されると、ポリクローナル又はモノクローナル抗体は、例えば、Ausubelらによって上記に記載されているように標準的な方法又はその他の適切な方法によるウエスタンブロット、免疫沈降分析によって特定の抗原認識についてテスト可能である。抗血清は、一連の注入により産生可能であり、少なくとも3回の追加免疫注入を含む一連の注入が好ましい。
【0105】
特定のエピトープを認識し、及び特定のエピトープと結合する抗体断片が、公知技術により生成可能である。例えば、かかる断片は、前記抗体分子のペプシン消化により生成可能なF(ab’)2断片、及びF(ab’)2断片のジスルフィド架橋の還元により生成可能なFab断片を含むがこれらに限られない。代替的に、急速な及び容易な所望の特異性を有するモノクローナルFab断片の同定を可能にするための、Fab発現ライブラリが構築可能である(Huseら、Science 246:1275、1989)。
【0106】
哺乳類へ抗原を送達し、哺乳類で抗体取得を目的とする抗原に対するモノクローナル抗体産生を誘導する典型的な方法は、少なくとも一つのTヘルパーペプチドが特異的にPAPCに結合し、少なくとも一つのTヘルパーペプチド、少なくとも一つのデンドリマー、及び、核酸又はペプチド若しくはポリペプチド抗原が抗原に対する免疫応答を誘導可能であるように、少なくとも一つのTヘルパーペプチド及び核酸又はペプチド若しくはポリペプチド抗原が少なくとも一つのデンドリマーの外部表面にコンジュゲート化されることを特徴とし、少なくとも一つのTヘルパーペプチド及びペプチド若しくはポリペプヂド抗原又は抗原をエンコードする核酸をコンジュゲートした少なくとも一つのデンドリマーを含む組成物の投与を含む。本方法において、前記組成物は、MHCクラスIIを介するヘルパーT細胞活性化の誘導に有効な量で投与され、前記抗原に対するモノクローナル抗体の産生をもたらす。マウスにおける抗体産生の方法において、上記に記載されているように、前記マウスは、抗原で免疫後、1匹又は2匹以上のマウスから抗体が採取され、高タイターについてスクリーニングされる。高タイターのマウスが選択され、このマウスから脾臓が摘出される。そして骨髄腫との融合が行われ、最もよく結合するクローンについてのスクリーニングが行われる。
【0107】
また本明細書に記載されているキットは、タンパク質精製の必要性を除去する抗原への抗体(例えば、モノクローナル抗体)を作製するためのものである。典型的なキットは、本明細書に記載されている複数のデンドリマー/Tヘルパーペプチド複合体(コンジュゲート体)(例えば、PADRE誘導体化デンドリマー、インフルエンザHAコンジュゲートデンドリマー等)と、及び典型的にpHが7.4の生理緩衝液とを含む容器を含む。緩衝液又は培地の1つの例において、該緩衝液又は培地は、HEPES及び重炭酸ナトリウムで緩衝され、並びに、ヒポキサンチン、チミジン、ピルビン酸ナトリウム、L−グルタミン、及び10%未満のウシ血清アルブミン又は、エンドトキシンレベルが1.0EU/ml未満である、塩化カルシウム100mg/lを有するインスリン及び/又はトランスフェリンを含む個体血清タンパク質で補充されたイーグル最小必須培地を含む。本実施態様において、前記キットの使用者は、100−200μg/mlの前記緩衝液で、1つの抗原をエンコードする少なくとも1つの核酸(例えば、DNAプラスミド)を希釈し、穏やかに震とうしながら、前記組成物(Tヘルパー−デンドリマー)を前記希釈されたプラスミドDNAに加える。典型的な実施態様において、TプラスミドDNA中のヘルパー−デンドリマーの割合は10:1で使用され(N:P)、概ねDNAプラスミド1(重量)に対して組成物が7(重量)である。1つの実施態様では、以下の条件が続く。室温で10分間インキュベーション後、前記プラスミド−DNA/組成物10−20μgを含む前記混合物100μlが、マウスに皮下注射される。14日後の同様の追加免疫、モノクローナル抗体についての、一次スクリーニング、融合及び最終スクリーニングの標準的な方法が続く。核酸に加えて、本明細書に記載されている前記組成物及びキットは、タンパク質又は抗原とコンジュゲートされる場合がある。かかる実施態様において、タンパク質中の前記組成物についての10:1の同一割合が、典型的に前記複合体形成をもたらす。本明細書に記載されているキットに含まれる取扱説明書は、適切な割合、緩衝液の作製、及び最適化並びに必要な際のトラブルシューティングのプロトコールを記載する。本明細書に記載されている、PADRE−デンドリマーコンジュゲート体を有するプラスミドDNA又はタンパク質/抗原の複合体化は、一般的に、PBSを含む生理緩衝液の生理学的pHで緩衝された水溶液中の2つの成分を混合することによってなされる。典型的なN/P(アミン対リン酸)比は10:1である。ゲル電気泳動又はその他の適切なアッセイは、前記PADRE−デンドリマーへの前記DNAの完全な複合体化を示すために使用可能である。
【0108】
本明細書で記載されているキットは、関心抗原をエンコードするベクター又はプラスミドのいずれかとともに用いられることができる。本明細書に記載されている、前記デンドリマー/Tヘルパーエピトープ複合体(コンジュゲート体)の使用前準備のための説明資料が一般的に含まれる。前記説明資料は典型的に書面の又は印刷された資料であることを含むが、それらはこれに限定されない。かかる説明書を保存することができる及びエンドユーザーへそれらを伝えることができる媒体のいずれもが、ここでの前記キット及び方法に包含される。かかる媒体は電子記録媒体(例えば、磁気ディスク、テープ、カートリッジ、チップ)、光学媒体(例えば、CDROM)等を含むが、これらに限られない。かかる媒体は、かかる説明資料を提供するインターネットサイトへのアドレスを含む場合がある。
【0109】
細胞へ核酸を送達するための組成物及び方法
本明細書に記載されている実験において、GFPをエンコードする遺伝子の送達は、MHCクラスII細胞(MHCクラスIIを発現する細胞)へ特異的に送達され、前記遺伝子の発現が観察された。従って、本明細書に記載されている前記組成物及び方法は、いかなる遺伝子治療応用での使用を見出しても良い。細胞を核酸へ送達するための組成物は、典型的に、少なくとも1つのTヘルパーペプチド、及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸をコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含み、前記少なくとも1つのTヘルパーペプチドが前記細胞へ特異的に結合し、少なくとも一つのTヘルパーペプチド、少なくとも一つの陽荷電性高分枝ポリマーデンドリマー、及び、核酸が細胞に取り込まれるように、前記少なくとも1つのTヘルパーペプチド及び前記核酸が、少なくとも1つの前記陽荷電性多分枝高分子デンドリマーの外部表面へコンジュゲートされることを特徴とする。細胞へ核酸を送達する方法は、典型的に、少なくとも1つのTヘルパーペプチド及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸にコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含む組成物を細胞に接触させることを含み、前記組成物は、少なくとも1つのTヘルパーペプチド、及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸をコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含み、少なくとも1つのTヘルパーペプチドが前記細胞へ特異的に結合して、前記核酸の組み合わせが前記細胞によって内部に取り込まれるように、前記少なくとも1つのTヘルパーペプチド及び前記核酸が前記少なくとも1つの陽荷電性多分枝高分子デンドリマーの前記外部表面へコンジュゲートされることを特徴とする。典型的な実施態様において、前記ペプチド又はタンパク質は前記細胞内に発現する。
【0110】
組成物の投与
本明細書に記載されている前記ワクチン及び組成物は、哺乳類(例えば、イヌ、ネコ、ブタ、ウマ、げっ歯類、非ヒト霊長類、ヒト)へいかなる適切な処方で投与されても良い。例えば、siRNAへコンジュゲートされたPADRE−デンドリマーを含む組成物又は、核酸、又はペプチド若しくはポリペプチド抗原へ複合体化されたPADRE−デンドリマーを含むワクチンが、例えば薬学的に許容可能な担体又は生理食塩水又は緩衝塩類溶液のような希釈剤中で処方されても良い。適切な担体及び希釈剤は、投与の様式及び経路と、標準的な薬務とにもとづいて選択することが可能である。典型的な薬学的に許容可能な担体及び希釈剤と、医薬品の処方とは、レミントンの薬学と、この分野の標準的な教科書と、UPS/NFとで知ることができる。別の物質が、前記組成物を安定化及び/又は保護するために組成物に添加される場合がある。
【0111】
本明細書に記載されている前記組成物及びワクチンは、いずれかの従来技術により哺乳類へ投与されても良い。かかる投与は、典型的に、非経口(例えば、静脈内、皮下、腫瘍内、筋肉内、腹腔内、又は髄腔内注入)だろう。前記組成物は、直接的に標的部位に投与される場合もある。前記組成物は、単回ボーラス投与か、複数回注射か、持続投与(例えば、腹膜透析、ポンプ注入による静注)かで投与されても良い。非経口投与のために、前記組成物は、パイロジェンを含まない殺菌された剤形で処方されることが好ましい。治療用途において、本明細書に記載されている前記組成物及びワクチンは、既にがんで苦しんでいる、又は前記関心病原体(例えば、ウイルス)に感染した個体に投与される。予防用途において、本明細書に記載されている前記組成物及びワクチンは、がん又は感染性疾患(すなわち、関心病原体に感染している(例えば、ウイルス))の発症の危険にさらされている(例えば、遺伝的に罹患しやすい、又は環境的に曝露された)個体に投与される。
【0112】
治療用途において、本明細書に記載されている前記組成物及びワクチンは、既にがんで苦しんでいる、又は前記関心病原体(例えば、ウイルス)に感染した個体に投与される。予防用途において、本明細書に記載されている前記組成物及びワクチンは、がん又は感染性疾患(すなわち、関心病原体に感染している(例えば、ウイルス))の発症の危険にさらされている(例えば、遺伝的に罹患しやすい、又は環境的に曝露された)個体に投与される。
【0113】
有効な用量
本明細書に記載の前記ワクチン及び組成物は哺乳類(例えば、イヌ、ネコ、ブタ、ウマ、げっ歯類、非ヒト霊長類、ヒト)へ有効な量、つまり、処置された哺乳類において望ましい結果(例えば、哺乳類におけるがんの予防又は除去、感染性疾患等に対する防御)を提供できる量で投与されるのが好ましい。かかる治療的有効量は以下で記載されるように決定可能である。
【0114】
本明細書に記載のワクチン及び組成物の毒性及び治療有効性用量は、LD50(集団の50%に対する至死用量)を決定するために細胞培養又は実験動物のいずれかを用いる標準的な薬学的手順で決定可能である。毒性効果と治療効果の間の用量比は、治療指数であり、LD50/ED50比として表すことができる。高い治療指数を示す組成物が好ましい。また、毒性の副作用を示す組成物が用いられる場合があるが、かかる副作用のダメージの可能性を最小化する送達システムの設計に注意を払うべきである。好ましい組成物の投与量は、ほとんど又は全く毒性がないED50を含む範囲内であることが好ましい。投与量は、用いる剤形及び利用する投与経路に依存して、この範囲内で変わる場合がある。
【0115】
本明細書に記載されている組成物及びワクチンの治療学的有効量は、最初の免疫(治療又は予防投与)において、70kgの患者(例えば、0.14μgから357μgのプラスミドDNA又はタンパク質及び0.86μgから2142.85μgの前記Tヘルパー−デンドリマー)に対して、前記抗原をエンコードする核酸にコンジュゲートされるか又は結合されるかのTヘルパーエピトープ/デンドリマーの複合体が一般的に1μgから約25,000μgまでの(例えば、1、100、500、2000、2500、10,000、15,000、25,000μg)範囲であり、そして、前記患者の血液中の特定のCTL活性及び/又は抗体応答を測定による前記患者の応答及び状態に依存して、週から月単位の追加免疫計画に従って、約1μgから約2,500μgの前記複合体(ワクチン)の追加免疫がなされる。1つの実施態様では、133倍以上多い用量のデンドリマーの15日間投与が、毒性なく哺乳類に投与される場合がある(Abhay Singh Chauhanら、2009 Proc.R.Soc.A,466,pp1535−1550.2009を参照のこと)。
【0116】
現在がん又は感染性疾患に苦しんでいる及び/又はがん又は感染性疾患と診断された被験体の治療のために、投与は、疾患の最初の兆候の時か、又は腫瘍の検出又は外科的摘出時か、又は急性感染の場合には診断後すぐに開始することが好ましい。これは、少なくとも症状が実質的に弱められるまで、及びその後一時期の間、追加免疫がなされる。慢性感染症において、負荷用量とそれに続く追加免疫が必要とされる場合がある。予防使用のために、個体ががんへの素因に気付いたらすぐに、又は感染性疾患への曝露の予想の前に投与を開始しても良い。
【0117】
医学及び獣医学の当業者に周知であるように、いずれかの被験体への投与量は、前記被験体の大きさ、身体表面領域、年齢、投与される特定の組成物、時間及び投与経路、健康所見、及びその他の同時に投与される薬剤を含む因子の多くに依存する。例えばPAMAMのようなデンドリマーは臨床試験と同様に前臨床試験でテストされた。最近、FDAは「ファーストトラック」をVivaGel(登録商標)(Starpharma、Melbourne、Australia)に付与し、既に第3相臨床試験にある。角膜におけるデンドリマーの治療使用は公知であり、デンドリマーは角膜遺伝子送達に用いられている。角膜の用途におけるデンドリマーの使用例は、角膜の新血管形成の治療、光線力学療法、及び角膜等価物としての再生医学を含む。Poly(I:C)は、ヒトに40年以上の間、「天然の」インターフェロンの誘導因子として投与されてきた。複数の最近の臨床試験は、安全性及び増強した免疫原性のために異なった用量及び投与経路が試されてきた;一般的な安全性及び増強した免疫原性は繰り返し報告され、確立されている。
【0118】
実施例
本発明は、以下の特定の実施例によってさらに例示される。前記実施例は例示のみのために提供され、何等、本発明の技術的範囲を限定するように解釈されるべきではない。
【実施例1】
【0119】
確立されたメラノーマ腫瘍の遺伝子ワクチン接種療法のためのアジュバント/標的ナノ粒子を利用したプラットフォーム
裸のDNAを用いる遺伝子ワクチン接種は、抗原を作製するために天然型で用いられる。しかし、イン・ビボでのトランスフェクション効率が低いこと、有効な送達がないこと、及び、従来の因子ワクチン接種アプローチの特異性が低いことが、抗原の効率を非常に制限する。これらの制限を克服するために、1)イン・ビボでPAPCの特異的で効率的なトランスフェクションを可能にし、2)自家PAPCの成熟、つまり強力な免疫応答をもたらす「危険信号」を提供し、3)発生した免疫応答をさらに高めるヘルパーT細胞を活性化する、抗腫瘍DNAワクチン接種のための新規で柔軟なプラットフォームが開発され、本明細書に記載される。
【0120】
本明細書記載の新規のデンドリマーを利用するナノ粒子が、2つの反応物、ジェネレーション5のアミノ末端型PAMAMデンドリマーと、標的/免疫増強ペプチド、すなわち普遍的なTヘルパーエピトープ(PADRE)とのコンジュゲートによって典型的に調製される。以下に記載のデータは、i)C57BLマウスで確立され、高い侵襲性のB16/LU8メラノーマ腫瘍を50%の腫瘍サイズに減少する目的の抗腫瘍効果を達成し、ワクチン接種で用いられた前記遺伝子の生産物に対する強力な免疫応答を誘導し、2倍ないし3倍まで、マウス及びヒトの両方の抗原提示細胞(APC)でトランスフェクション効率を増大するための本プラットフォームを示した。さらに、PADREデンドリマーにコンジュゲートしたGFPをエンコードするプラスミドを用いるイン・ビボ実験は、GFPが流入領域リンパ節で産生されることを示した。
【0121】
材料及び方法
PADRE誘導体化PAMAMデンドリマーが、以下の改変とともに上述のように製造された。前記PADREデンドリマー/DNA又はsiRNAの複合体は、適切なN/P比で10分間室温でインキュベーションすることによって製造された。かかる複合体は、イン・ビトロ研究のために初代のPMBC又は脾臓細胞に添加されたか、又はワクチン接種の目的のために皮下に注射された。図1は、ジェネレーション5のPAMAMデンドリマー(へのコンジュゲート)のPADRE修飾を示す。
【0122】
複数の核酸を結合するための高い陽荷電性表面を維持するために、1つのデンドリマー分子は、その表面にコンジュゲートした2つのPADREペプチドを典型的に有するため、それが正味の陽荷電性を保持するであろう。PADREを前記デンドリマーに付加することは、抗原提示細胞(APC)の特異的な標的化と、強力なCD4支援とをもたらす。前記PADRE誘導体化PAMAMデンドリマーは、抗原をエンコードするプラスミドの送り届けだけでなく、自然及び適応免疫を刺激し、「危険信号」として作用する。
【0123】
エンドトキシン無しのMaxiPrep試薬が、(PCDNA3.1中のpEGFP−C1、pMAX、GFP、TRP−2、P2、PCARD及びOVAを含む)さまざまなプラスミドを作製するために用いられた。蛍光色素免疫吸着アッセイ(FLISA)と、免疫蛍光アッセイ(IFA)とが標準的な方法によって実行された。簡潔には、トランスフェクションされたcos−7細胞は、(96ウェルプレートでウェル1つあたり0.02×106個)播種され、細胞は固定され、透過処理された。上昇した液性応答を測定するために、希釈された血清は前記ウェルに添加され、第2番目のIRDye 800CWでタグ化された抗マウスIgGが抗体応答を測定するために用いられた。
【0124】
前記デンドリマー/DNAの複合体を調製するために、エンドトキシン無しのPBS中に調製されたDNA1μg/μLが、さまざまな割合でデンドリマー又はデンドリマー−PADREと複合体形成された。室温で10分間インキュベーション後、前記複合体は、細胞培養物に添加されるか、又は皮下、皮内又は角膜間質腔(corneal stroma cavity)に注射された。
【0125】
B16−LU8メラノーマ腫瘍を有するマウス、5群の雌性C57BLマウスにワクチン接種のために、B16−F10細胞(0.02×106個)が皮下に移植された。異なる群が、i)非処理か、ii)PCDNA3.1(対照ベクター)単独か、iii)デンドリマー単独で複合体形成されたTRP−2か、iv)PADRE−デンドリマーで複合体形成されたTRP−2かを腫瘍移植後2日目及び10日目に受けた。腫瘍測定は1週間に2回実行された。
【0126】
結果
調製されたPADRE−デンドリマーが特徴付けられた。ペプチド−デンドリマーコンジュゲート体は、前記ペプチドの−COOH末端と前記デンドリマーのアミノ基との間で単純にアミドカップリングすることによって作製された。2:1のペプチド/デンドリマーの感作割合が反応で用いられ、前記デンドリマーの大きな陽電荷を作るための多くの遊離のアミノ基を保持するために、デンドリマー1個あたりペプチド数個のみを付着する。産物は、純水に対する透析によって少なくとも24時間精製され、その後真空で乾燥された。回収された産物、精油は、1H NMR、UV−Vis及びMALDI−TOF質量分析によって特徴付けられた。NMRは、前記デンドリマーの陽電子に対応する大きなピークと、ペプチドの陽電子についての一連の小さなピークとを示す。前記PADRE−デンドリマーコンジュゲート体のMALDI−TOF質量分析は、m/z比で前記デンドリマーについて観察されたピークよりも高い約3,000ユニットのピークを示す。過剰な質量は約2個のペプチドエピトープに対応する(図17)。
【0127】
データは2つのPADREの平均が各デンドリマーに存在すると証明した(図17)。複数の核酸を自家APCにイン・ビトロ送達することが示された。ヒトの初代の末梢単核球細胞をイン・ビトロで送達/トランスフェクションすることは、1:5及び1:10の感作比で最もよく達成された。図2は、PADRE−デンドリマー(にコンジュゲートした)と複合体形成した、Alexa Fluorでタグ化されたsiRNAがB細胞と4時間インキュベーションされた際の純化されたヒトB細胞にPADRE−デンドリマーを介するsiRNA送達(〜%86)を示す。細胞はCD19/FITCで染色され、赤色チャンネル(PE)はsiRNA /Alexa Fluor.manを有する細胞を示す。
【0128】
図3に関して、PADRE−デンドリマーのイン・ビボのDNA送達が示された。GFP又はTRP−2をエンコードするプラスミドは単独で注射されるか、又はPADRE−デンドリマー又はデンドリマー(即ち、PADREと複合体形成されていないデンドリマー)と複合体形成された。画像は、注射後24時間及び16時間の皮膚(左)及び角膜(右)でのGFPの発現を示す。GFPの効率的な発現が、PADRE−デンドリマー複合体の注射後24時間及び16時間の皮膚及び角膜の両方で示された。イン・ビボでリンパ節の標的化が実証された。PADRE−デンドリマー/GFP−プラスミド複合体(全5μgのプラスミド)が皮下に注射された後8日目、隣接のリンパ節が除去され、GFP−DNA単独で注射されたマウスのリンパ節と比較された。蛍光顕微鏡画像が、免疫後8日目に網目状のリンパ節(meshed lymph nodes)で撮られた。注射部位に隣接する前記リンパ節での抗原の発現が見られたが、対照リンパ節での抗原の発現は見られなかった。
【0129】
イン・ビボでリンパ節の標的化が実証された。PADRE−デンドリマー/GFP−プラスミド複合体(全5μgのプラスミド)が皮下に注射された後8日目、隣接のリンパ節が摘出され、GFP−DNA単独で注射されたマウスのリンパ節と比較された。蛍光顕微鏡画像が、免疫後8日目に網目状のリンパ節(meshed lymph nodes)で撮られた。注射部位に隣接する前記リンパ節での抗原の発現が見られたが、対照リンパ節での抗原の発現は見られなかった。
【0130】
図4に示されるように、特異的な免疫応答がPADRE−デンドリマー/プラスミド複合体を投与した後に上昇された。強い液性応答が、プラスミド/PADRE−デンドリマーの複合体での1回(GFP)又は2回(OVA)の免疫で観察された。
【0131】
図5に示されるデータは、確立された腫瘍のPADRE−デンドリマー療法を示す。B16メラノーマは、侵襲性のマウス腫瘍モデルであることが知られる。B16メラノーマ細胞(上)又はTSA(下)を移植されたマウスが、腫瘍移植後2又は3日目にワクチン接種され、1週間後に追加免疫が続いて行われた。PADRE−デンドリマーを投与することが、特に、PADRE結合に対して高い親和性を有するC57BL(Iab)で防御免疫応答をもたらしたことを追跡腫瘍測定が明確に実証した。またC57BLはヘルパーT細胞の誘導を介してPADREに強く応答した。
【0132】
図5に関して、結果は、高い侵襲性で確立されたB16/LU8腫瘍の腫瘍サイズを50%減少する目的の抗腫瘍効果を示した。この侵襲性モデルは、他の全てが失敗してもプラットフォームの能力を示すために意図的に選択された。腫瘍成長の遅延と、腫瘍サイズの減少とは前例のないことである。さらに、腫瘍移植後22日目、腫瘍又は触診可能な腫瘍が全ての対照群と顕著に異なる試験群(即ち、本明細書に記載されているようなワクチンを受け取っている動物)で全く検出されなかった。本ワクチン接種(ワクチン投与)で用いられたDNA量は、通常用いられる量(20μg及び全2回の免疫)と比較して非常に少なかった。図5では、下段の図は、PADREが適切に結合していないBalb/cマウスを用いる陰性対照であり、Balb/c TSA腫瘍モデルでの類似の実験では全く有効性を示さない。これは、MHCクラスIIを介する送達システムの特異性を明らかに示す。
【0133】
これらのデータは、本明細書記載の標的用アジュバントナノ粒子プラットフォームが、遺伝子送達と、エンコードされた抗原の強力な発現と、抗原提示と、防御免疫応答の誘導とをもたらすことを明らかに実証する。したがって、本明細書記載のPADRE−デンドリマーのナノ粒子は、i)タンパク質なしの(モノクローナル)抗体の製造と、ii)悪性腫瘍と、虚偽のインプリンティングを有する感染性疾患との免疫学的治療/予防と、iii)免疫を利用した治療介入の多くのためのsiRNA送達とのための新規で強力なアジュバント/標的用送達ツール及びプラットフォームである。
【実施例2】
【0134】
イン・ビトロでの標的送達及びトランスフェクションの効率
図6に関して、イン・ビトロでのPBMCの標的送達は77%のB細胞トランスフェクション効率をもたらす。健康な提供者由来のヒトPBMCが入手された。PBMCは、10%ウシ胎仔血清を含むRPMI培地1mLあたり6百万個の細胞で培養された。GFPをエンコードするプラスミド5μgは、生理緩衝液、PBS100μLで希釈され、PBS50μL中のPADRE−デンドリマー5μgは、振とうながらDNAに添加された。室温で10分間インキュベーション後、GFPプラスミド及びPADRE−デンドリマーの混合物/複合体が、その後、PBMCに添加された。37°C/5%CO2インキュベーターでインキュベーション24時間後、PBMCはCD19 PEで染色され、細胞はフローサイトメトリーで解析された。GFPの発現が全PBMCの43%で観察された一方、B細胞にゲートされたとき、B細胞の77%がGFPを発現した。対照群、デンドリマーとGFPプラスミドの同じの割合をインキュベーションしたPBMCは、総PBMC又はB細胞に対して約11%と7%のGFPの発現を示した。培地のみでのPBMCと比較するとき、主要な生存率変化は全く観察されなかった。これは、さまざまな実験の代表例である。これらの実験は、i)PBMCと、特に、MHCクラスIIを発現している細胞(B細胞)とへのGFPプラスミド送達、及び、ii)PBMCと、特に、B細胞とによるGFPの発現を実証する。
【実施例3】
【0135】
イン・ビボでマウス樹状細胞(DC)と、イン・ビトロでヒトB細胞とへのペプチド/タンパク質の送達
PDD/アルブミン−FITCは純化されたヒトB細胞に送達された(図7)。図8に関して、この図は、PADRE−デンドリマーの標的化の、イン・ビボでのマウス樹状細胞(DC)の効率と、注射及びリンパ節解析の時系列とを示す。この実験の結果は、i)(図7)PADRE−デンドリマーと混合されたタンパク質、アルブミン−FITCは2時間未満でヒトB細胞中に送達され、ii)(図8)皮下注射後5日目、デンドリマーにコンジュゲートしたエピトープ、PADREは、リンパ節のB細胞と樹状細胞(DC)とにイン・ビボで送達され(前記PADRE−デンドリマーは、リンパ節/B細胞/樹状細胞(DC)への複合体の送達を可視化するためにGFP−プラスミドに複合体形成された。)、iii)(図9)皮下注射後5日目、デンドリマーにコンジュゲートしたエピトープ、インフルエンザのHAヘルパーエピトープはリンパ節の樹状細胞(DC)にイン・ビボで送達される(前記PADRE−デンドリマーは、リンパ節の樹状細胞(DC)への複合体の送達を可視化するためにGFP−プラスミドに複合体形成された。)ことを示す。これらのデータは、さまざまな実験で、GFPプラスミドと複合体形成されたPADRE−デンドリマー又はHA−デンドリマーそれぞれの皮下注射後3日目に摘出されたリンパ節のいくつかでの代表例である。これらの結果は、FITCのFITC可視化を介して、リンパ節細胞のB細胞及び樹状細胞(DC)を含む抗原提示細胞(APC)へのFITCコンジュゲートタンパク質の送達と、デンドリマーにコンジュゲートしたPADRE及びHAヘルパーのエピトープの2つのペプチドの送達との例を証明し、該2つのペプチドでは、GFPプラスミドが複合体(GFPをエンコードするプラスミドを伴うペプチド連結デンドリマー複合体)の可視化と解析を促進するために前記ペプチド−デンドリマーと複合体形成された。樹状細胞(DC)の特異的なイン・ビトロ及びイン・ビボのトランスフェクションは、ナノ粒子(PADRE−デンドリマー/GFPをエンコードするプラスミド)、対、対照の注射後5日目の隣接のリンパ節で標的化及び増幅する樹状細胞(DC)のイン・ビボのフローサイトメトリーデータによって示された(GFPの発現78%、対、〜7%)。PADRE誘導体化デンドリマー(PDD)は、抗原提示細胞(APC)上に発現したMHCクラスIIに結合する高い親和性を有するPADREのオプソニン効果の補助によって送達を増大する。同様に、HA−デンドリマー(DRHA)/GFP−プラスミドは、皮下に注射されたとき、隣接のリンパ節にイン・ビボで送達される(図9)。マウスで特筆すべきことは、PADREがIAb(C57BLマウス)の前記MHCクラスIIに結合する一方(図8)、選択されたHAエピトープがIAd(Balb/cマウス)のMHCクラスIIに結合する(図9)ことである。異なる2つのエピトープを用いて、異なる2つのマウスの系統において、類似の結果となるイン・ビボ送達を実行できることが示された。ヒトPBMC(図6)、純化されたヒトB細胞(図6)及びC57BLマウスの脾臓細胞でPADRE−デンドリマー/GFP−プラスミドによってGFPの発現をもたらす抗原提示細胞(APC)標的送達と、ヒトB細胞(図10)及びサルPMBC(図11)へのPADRE−デンドリマー/dsRNAの送達とは、本明細書記載の組成物によるPAPCへのペプチド送達の追加のイン・ビトロの証拠である。ユニークな特徴は前記MHCクラスIIに結合する異なる2つの標的ペプチドの使用が、本明細書記載の実験で示されたように働くため、本明細書記載のワクチン、方法及び組成物は、全てのMHCクラスII結合ペプチドを包含する。また、図9に関して、インフルエンザHAヘルパーエピトープにコンジュゲートしたデンドリマー(HDD)が調製された。HDDはbalb/cマウスで用いられる場合がある。マウスに注射されたとき、HDDは、隣接のリンパ節で樹状細胞(DC)を標的とする。
【実施例4】
【0136】
ヒトB細胞及び非ヒト霊長類PBMCへのsiRNAのPADRE−デンドリマー送達及び非ヒト霊長類PBMCへのプラスミドのPADRE−デンドリマー送達
図10に関して、dssiRNAに複合体形成されたPADRE−デンドリマー(対照siRNA)は、イン・ビトロの標的送達を示した。0.1μgのdsRNAは100μLのPBS中に希釈され、20μL中の0.7μgのPADRE−デンドリマーが、振とうしながらAlexa Fluorでタグ化されたdsRNAに添加された。室温で10分間インキュベーション後の複合体が、24ウェルのプレート中の(10%ウシ胎仔血清含有RPMI中の)100万個の純化されたB細胞に添加された。37°C/5%CO2インキュベーターでインキュベーション約1時間後、細胞は洗浄され、ウェルに(新鮮な10%ウシ胎仔血清含有RPMI1mL中に)戻され、赤色チャンネルの蛍光顕微鏡下で解析された。明視野及び赤色チャンネル下での細胞の重ね合わせ画像は、ヒトB細胞によるAlexa Fluorでタグ化されたdsRNAの取り込みを実証する(図10)。細胞がCD19(B細胞マーカー)で染色され、フローサイトメトリーによって解析されたとき(図2)、細胞は37°C/5%CO2インキュベーターで一晩インキュベーションされた。図2に示されるように、対照のデンドリマー/dsRNA−Alexa Fluorの約6%に対して、B細胞の80%よりも多くが、(RNAにタグ化された)Alexa Fluorに陽性である。これらの結果は、PADRE−デンドリマーによるPAPCへの核酸の強力な送達を明らかに実証する。
【0137】
ヒヒ(papio hamadryas)由来の1つの試料と、カニクイザル(macaca fascicularis)由来の異なる2つの試料とのPBMCがテストされた。図11に示される蛍光顕微鏡画像は、siRNA/Alexa Fluorで複合体形成されたPADRE−デンドリマー又はデンドリマーそれぞれの添加後2時間に撮られた代表例である。同様に、GFP−プラスミドで複合体形成されたPADRE−デンドリマー又はデンドリマーは前記PBMCに添加され、インキュベーション後24時間で解析された(図12)。結果は、PADRE−デンドリマーは核酸をサルのPBMCに2時間未満で送達する一方、デンドリマーは穏やかな送達のみを示すことを示す。これらの結果は、PADRE−デンドリマーは非ヒト霊長類で作用することを強く示唆する。
【実施例5】
【0138】
PADRE−デンドリマーのナノ粒子及びIN−CELL−ART(商標)プラットフォームの組成物
本明細書記載のPADRE−デンドリマーは、全ての細胞へのIN−CELL−ARTの非特異的な送達とは反対のPAPCの特異的な標的化を提供する。前記IN−CELL−ART(商標)プラットフォームは、抗原提示細胞(APC)に結合するために非特異的な生来のアジュバント活性又はいずれかのリガンドを用いる電気穿孔法を介してDNAを細胞に送達する704ポリマーを含む。従来、イン・ビボの電気穿孔法は、最も良いウイルス遺伝子を使用しない免疫方法として知られる。本明細書記載のPADRE−デンドリマーは、前記IN−CELL−ART(商標)のプラットフォームによって提供されないヘルパーT細胞の誘導を提供する。上記の実験では、前記PADRE−デンドリマーは治療上の腫瘍モデルで有効であることが示された一方、IN−CELL−ARTのものはイン・ビボ腫瘍モデルで有効であることが示されなかった。本明細書記載の前記実験では、強力な対照として、PADRE−デンドリマーはイン・ビボ電気穿孔法と比較された(図13)。反対に、IN−CELL−ARTは裸のDNAとの比較のみを示した。本明細書記載の前記PADRE−デンドリマーの単回免疫が、液性応答を上昇するためのイン・ビボ電気穿孔法と比較された。本実験を実行するために、PADRE−デンドリマーは、室温で5μgの前記プラスミドと混合され、10分後、混合物はマウスに皮下注射された。OVAをエンコードするプラスミドにコンジュゲートしたPADRE−デンドリマーで免疫されたマウスと、対照マウスとは、単回のワクチン接種28日後にOVAを発現する50k B16F10で感作された。イン・ビトロでの電気穿孔法を介してプラスミドを受け取っているマウスでは40%であり、DNAのみを受け取った対照群では0%であったが、プラスミドにコンジュゲートしたPADRE−デンドリマーを受け取ったマウス全てが腫瘍移植後25日目で保護(Protect)された。図13に示されるように、結果は、PADRE−デンドリマー/プラスミド(DRP−ova)での単回のDNAワクチン接種は、抗ova抗体の液性応答を誘導するためのプラスミド(EP−ova)のイン・ビボ電気穿孔法(EP)の送達よりも優れていることを示す。
【実施例6】
【0139】
マウスで強い液性応答を誘導するPADRE−デンドリマー
図14−16に示されるように、プラスミドと複合体形成されたPADRE−デンドリマーはマウスで強い液性応答をもたらす。
【実施例7】
【0140】
PADRE−デンドリマー/OVAプラスミドワクチンによる予防上の設定でのB16/OVAの根絶
ケージあたり5匹の群の雌6週齢のC57BLマウスが、i)免疫なし、ii)Derma Vax電気穿孔装置を用いる「イン・ビボ電気穿孔法」を介する20μgのOVA−プラスミドの2回の免疫か、iii)PADRE−デンドリマー/OVA−プラスミドの2回の免疫(各20μg)かを受けた。免疫は2週間の間隔で実行された。免疫後10日目、全てのマウスは、右側腹部にPBS100μL中のB16/OVA腫瘍細胞50,000個の皮下注射(移植)を受けた。腫瘍の測定は1週間に2回実施され、毎週のデータはプロットされ、図18に示される。PADRE−デンドリマー/20μgのOVA−プラスミドでの2回のワクチン接種は、免疫されたマウス全てでB16/OVA腫瘍の完全な根絶をもたらす一方、非処理では100%、及び、「イン・ビボ電気穿孔法」を介してワクチン接種されたマウスの60%が腫瘍を持ったままであった。体重の15%よりも大きな腫瘍を有する、腫瘍を持ったマウスの全ては屠殺された。
【0141】
その他の実施態様
いずれかの改良が、前記組成物、キット及び方法ステップの一部又は全部で行われる場合がある。本明細書で引用される刊行物、特許出願及び特許を含む参考文献の全ては、引用により本明細書に取り込まれる。本明細書で提供される例又は例示的な用語(例えば、「のような」)のいずれか及び全てを用いることは、本発明を例示することを意図し、他に要求がない場合には、本発明の技術的範囲を限定することを示すものではない。例えば、本明細書記載の実験は、B16メラノーマの根絶と、GFP、OVA、PCARD、CCR5、vgPCR、muPAR、CathL又はp2の抗原への強い液性応答の誘導とを含むけれども、本明細書記載のワクチン、組成物及び方法は、がんの追加のタイプを予防又は根絶するステップ、及び、免疫応答、つまり興味のある抗原(例えば、感染性病原体由来の抗原)いずれかに対する免疫を誘導するステップを含む、他の治療上及び予防上の適用の多くで使用することを発見することが可能である。もう1つの例では、本明細書記載の前記ワクチン、組成物及び方法は、抗原ではないタンパク質又はペプチドを細胞に送達するために用いられることが可能である。この例は、ペプチド又はタンパク質を細胞に送達するための典型的な組成物は、少なくとも1つのTヘルパーペプチド及び少なくとも1つのペプチド又はタンパク質をコンジュゲートした少なくとも1つの荷電性多分枝ポリマーデンドリマーを含み、前記少なくとも1つのTヘルパーペプチドが前記細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はタンパク質とは、少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。本発明又は好ましい実施態様の性質又は利益に関する本明細書の説明のいずれも限定することを意図せず、添付された請求項は、かかる説明によって制限されるとみなされるべきではない。より一般的には、明細書中の用語は、本発明の実行に必須とされるものと同じく、請求項に記載されていない構成要素のいずれかを示すものと解釈されるべきではない。本発明は、準拠法によって許されているように、本明細書に添付された請求項に記載の対象の改変及び均等物の全てを含む。さらに、本明細書で他に示されるか、又は明らかに文脈と矛盾したりしない場合には、全ての変形における上記構成要素のいずれの組合せも本発明に含まれる。
【技術分野】
【0001】
本発明は、一般的に化学及び免疫学の分野に関する。より具体的には、本発明は、被験体で免疫応答を誘導するためのワクチン、組成物及び方法に関する。
【背景技術】
【0002】
関連出願
本出願は、2009年4月1日に出願された米国仮特許出願第61/165,732号の優先権を主張する。出願人は、本明細書でこの特許出願の優先権を主張し、全体の内容が引用により本明細書に取り込まれる。
【0003】
背景
ワクチンの使用による微生物感染及び発病過程の予防は、最も効果的で理想的な病気との闘いのための一つの手段と考えられている。感染又は発病に先立って、宿主動物の免疫応答を刺激する方法で、抗原、又は、免疫原が生体に導入される。しかしながら、伝統的なワクチン戦略は、多数の病原体又はがんに対する防御の備えに効果的ではなかった。伝統的ワクチン戦略によって、100以上の病原体に対してわずかに約20の有効なワクチンが作製されたに過ぎない。高い細胞障害性Tリンパ球(CTL)反応を誘導するワクチンの中で一部は、弱い免疫原性により、低い目標反応割合、免疫回避メカニズム、及び、ディセプティブ・インプリンティング(偽装刷り込み)をしばしば示す。現在のワクチン送達の方法は、強い“危険信号”を誘発せず、負の制御として作用する阻害反応を開始し、ノンプロフェッショナルな抗原提示細胞(APC)へ抗原を送達するため、防御的免疫応答誘導との観点では、低い成功割合である。例えば、高いCTL反応を備える場合であっても、現在のがんワクチンは、低い目標反応割合(2.6%)しか示さない。これらは、弱い免疫原性及び免疫回避メカニズムを含む多数の不利益を伴う。さらに、(樹状細胞に基づく、及び、G−vaxに基づく)最も有望ながんワクチンは、極めて高価であり、これらのワクチンの調製(例えば、患者毎の個別化、及び、GMP基準での製造)が含まれる。
【0004】
遺伝子ワクチン又は遺伝子免疫は、抗原作製のための哺乳類宿主への遺伝子材料接種関与の、がんワクチンを含むワクチンへの可能なアプローチとして考えられる。送達された関心抗原をエンコードする哺乳類発現ベクターは、イン・ビボでの発現と、それに続く抗原特異的反応に結び付く。その上、関心タンパク質の発現可能な場において、遺伝子は細胞膜を通過できず細胞の核に到達できない陰荷電性ポリマーである。遺伝子ワクチンは、自然なエピトープの完全なスペクトルの発生と、イン・ビトロで発現された組換えタンパク質の投与と比較してイン・ビボでのタンパク質の自然な配位構造の達成と、抗体と細胞性免疫の誘導と、及び、抗原作製のためのコスト的で一般的なワクチン投与ステップの除外とを含む多数の利点を与える。しかしながら、遺伝子ワクチンは、自己抗原の寛容破壊と、イン・ビボでの細胞及び核への低い核酸送達と、特定のタイプの細胞に対する特異性の欠如と、及び、弱い免疫応答と、多くの欠点を伴う。
【0005】
同様に、他の型のワクチンは欠点を伴う。例えば、遺伝子のウイルス送達は、ウイルスベクターに対する強い免疫応答に結びつき、安全性上の問題を伴う。抗原として使用するための微生物からの蛋白精製とペプチド製造は、高価で時間を要する。
【発明の概要】
【発明が解決しようとする課題】
【0006】
現在、副作用がないか又は弱く、コスト的に効率的な抗原提示細胞(APC)を標的とするワクチンはない。そこで、プロフェッショナル抗原提示細胞(APC)を標的とし、安全でコスト効果的で、使用が容易で、強く特異的な細胞性及び抗体反応を引き出すワクチンについて大きな需要がある。
【課題を解決するための手段】
【0007】
概要
本明細書記載の発明は、抗原に対して強力で特異的な免疫応答をもたらす前記抗原か、該抗原をエンコードする核酸かをイン・ビボでプロフェッショナルAPC(PAPC)に送達するためのナノ粒子を利用した組成物、キット及び方法と、プラットフォームとである。また、本明細書記載の発明は、siRNAをPAPCに送達するためと、核酸、ペプチド又はタンパク質を細胞(例えば、MHCクラスIIを発現する腫瘍細胞)に送達するためとのナノ粒子を利用した組成物、キット及び方法と、プラットフォームとである。現在のワクチン戦略の主要な利益は、ワクチン戦略が制御性T細胞を含む抑制性細胞を誘導することである。抗原をPAPCに標的送達することが、抑制因子機構の活性化、特に、制御性T細胞の活性化を低減又は阻害することが知られている。前記組成物、キット及び方法は、MHC標的で免疫原性のペプチド(例えば、PADRE、HA)を、特定の細胞に核酸、ペプチド又はポリペプチドを標的送達のための運搬体としての荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマー(例えば、PAMAMその他のデンドリマー)と組み合わせて使用することを含み、遺伝子又はタンパク質のワクチン接種のための新規ナノ粒子を利用した方法をもたらす。本明細書記載の典型的なワクチンは、Tヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)と、少なくとも1つのポリペプチド抗原か、該少なくとも1つの抗原をエンコードする核酸かと、任意のポリI−CとのようなMHC標的で免疫原性のペプチドにコンジュゲートした荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマー(例えば、PAMAMその他のデンドリマー)を含む。本明細書記載の前記陽荷電性多分枝ポリマーデンドリマーは、DNA、RNAその他のものを含む陰荷電性生体分子に効率的に結合する。Tヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)にコンジュゲートした荷電性(例えば、陽荷電性)多分枝ポリマーデンドリマーは、PAPCに特定の抗原を送達するために増大された有効性を有するワクチンを提供する。本明細書記載の実験では、MHCクラスII分子に結合するPADREを介してPAPCを標的にするためにPADREを第1番目に使用することが示される。本明細書記載の実験は、前記MHCクラスIIに結合することが期待されるユニークな特徴の異なる標的ペプチド2つを効率的に使用することを記載する。したがって、本明細書記載の前記ワクチン、方法及び組成物は、全てのMHCクラスII結合ペプチドを含む。本明細書記載の前記ワクチン、キット及び組成物は、イン・ビボでのPAPCへの特異的かつ効率的なトランスフェクションと、自家PAPCの成熟、つまり強力で特異的な免疫応答をしばしばもたらす生来の普遍的なヘルパーT活性とを提供する。
【0008】
デンドリマーは理想的なDNA送達候補であり、前記デンドリマーは、サイズ及び形状(積荷−空間)にわたる構造的な制御を提供し、生体適合性(無毒性で非免疫原性)であり、重要なスキャフォールド特性を有し、特異的な標的原子団のためのよく定義された表面を調節可能な官能基を有し、細胞接着と、細胞質又は核へのエンドサイト−シス及び送達とのための能力を有し、許容可能な生体分解性(体内で安全に分解するための能力)を有し、簡単で都合の良い製造性(臨床グレード)の合成と関係付けられる。本明細書記載の実験では、前記DNA、siRNA、ペプチド又はポリペプチドにコンジュゲートした陽荷電性多分枝ポリマーデンドリマーは、ヒト及びマウスの両方で抗原提示細胞(APC)を標的にし、ヘルパーT細胞を活性化するペプチド(例えば、PADRE又はインフルエンザHA)を含む。前記PADREペプチドは主要な機能2つを有する。前記PADREペプチドはPAPC上に存在する前記MHCクラスIIに結合するようにPAPCにDNAを送り届け、前記PADREペプチドは、細胞傷害性T細胞の発生と、抗体応答に必要とされるクラススイッチとを促進するヘルパーT細胞を刺激する。この新規ナノ構築物は、遺伝子及びペプチドの送達及びワクチン接種のためのユニークな特徴を有する。また、本明細書記載の実験は、PADREにコンジュゲートした陽荷電性多分枝ポリマーデンドリマー(PAMAMデンドリマー)が、治療上の設定で50%までC57BLマウスで確立され、高い侵襲性のB16/LU8メラノーマ腫瘍の成長を遅延し、サイズを減少させること、及び、B16/OVAの予防上の設定で腫瘍の100%根絶を示すこと、ワクチン接種ために用いられる遺伝子産物に対する強力な免疫応答を誘導すること、マウス及びヒトの抗原提示細胞(APC)の両方で2倍又は3倍までのトランスフェクション効率を示すこと、GFPをエンコードするプラスミドを、流入領域リンパ節に由来するイン・ビボで送達すること、及び、ヒトB細胞、T細胞及びマウスのマクロファージにsiRNAを効率的に送達することを示す。
【0009】
本明細書記載の組成物及びワクチンは、組成物及びワクチンが、MHCクラスII陽性細胞、PAPCの全て又はほとんど全てを標的とするとき、ワクチン接種のために目的に合わせた理想的なプラットフォームである。T細胞の活性化の抑制又は促進をする(CD80、CD86、B7−H1、B7−H4、B7−DC、CD137、OX40、Foxp3及びこれらの推定の共刺激性受容体を含むが、これらに限定されない)共阻害性で共刺激性の非常に重要な分子を発現する。これらの経路に含まれる分子の発現の標的化操作は、がん、感染性疾患のための免疫療法/ワクチン接種、又は、中毒症又は不妊症のためか、被験体において疾患を誘導する薬剤を中和するためかと、自己免疫の管理のためとのワクチン接種のような他の新規ワクチンアプローチのために用いることが可能である。本明細書に記載されているようなワクチンを抗原提示細胞(APC)に標的送達することが、非常により強力な免疫応答を生じ、抑制因子/フィードバック機構を減少し、ワクチン投与量を少なくすることで毒性を防止することによって、従来のワクチン接種戦略に関係する感作に解決策を提供する。
【0010】
したがって、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つの抗原をエンコードする核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記少なくとも1つの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記ワクチンでは、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることが可能である。本実施態様は、薬学的に許容可能な担体及び/又は油中水型エマルジョンを含むことが可能である。1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ(PADRE)、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープである。また、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることが可能である。前記核酸は発現ベクターであることが可能であり、前記少なくとも1つの抗原は、がん抗原か、感染性病原体由来の抗原かであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。
【0011】
また、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記少なくとも1つのペプチド又はポリペプチドの抗原との組み合わせが前記少なくとも1つのペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。1つの実施態様では、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしている。前記ワクチンは、第2の荷電性多分枝ポリマーデンドリマーをさらに含むことが可能であって、前記第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドはプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることが可能である。前記ワクチンは、薬学的に許容可能な担体及び/又は油中水型エマルジョンをさらに含むことが可能である。前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPan−DRエピトープであることが可能である。もう1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAである。前記ペプチド又はポリペプチドの抗原は、がん抗原か、感染性病原体由来の抗原かであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。
【0012】
さらに、本明細書記載の発明は、抗原を哺乳類に送達し、該哺乳類で前記抗原に対するモノクローナル抗体の産生を誘導する方法である。前記方法は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記組成物はMHCクラスIIで仲介されるヘルパーT細胞の活性化を誘導するために有効量の組成物であり、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド若しくはポリペプチドの抗原か、該少なくとも1つの抗原をエンコードする核酸かとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸か、又は、前記少なくとも1つのペプチド若しくはポリペプチドの抗原との組み合わせが、前記少なくとも1つのペプチド若しくはポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸か、又は、少なくとも1つのペプチド若しくはポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記組成物を前記哺乳類に投与することが、前記少なくとも1つのペプチド又はポリペプチドの抗原に対するモノクローナル抗体の産生をもたらす。ある実施態様では、前記哺乳類はがんを有し、前記少なくとも1つのペプチド又はポリペプチドの抗原はがん抗原であり、前記組成物は前記がんに対するワクチンである。典型的に、前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じない。もう1つの実施態様では、前記哺乳類は感染性疾患を有し、前記少なくとも1つのペプチド又はポリペプチドの抗原は感染性病原体由来であり、前記組成物は典型的に前記哺乳類で局所的な有害応答を全く生じない前記感染性病原体に対するワクチンである。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、ポリイノシン−ポリシチジン酸に結合されること、及び/又は、薬学的に許容可能な担体、及び/又は、油中水型エマルジョンを含むことが可能である。
【0013】
本方法の1つの実施態様では、前記少なくとも1つのTヘルパーペプチドはPADREエピトープ、例えば、それぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープである。また、前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能である。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートされることが可能である。前記組成物は第2の荷電性多分枝ポリマーデンドリマーをさらに含むことが可能であり、該第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが、前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。
【0014】
抗体を産生し、採取するための1つの実施態様では、前記哺乳類は、げっ歯類又はウサギであることが可能であり、前記モノクローナル抗体は前記哺乳類から採取される。本実施態様では、前記モノクローナル抗体は、前記哺乳類から前記抗体を採取するステップと、前記抗体のタイターを測定するステップと、前記哺乳類から脾臓を摘出するステップと、ミエローマとの融合を実行するステップとによって調製される。前記抗体はヒト化されることが可能である。
【0015】
さらに、本明細書記載の発明は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物であって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドはPADREであることが可能であり、前記siRNAは、例えば、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられるであることが可能である。
【0016】
その上さらに、本明細書記載の発明は、siRNAをプロフェッショナル抗原提示細胞に送達する方法であって、該方法は、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートする少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を提供するステップと、哺乳類の被験体に前記組成物を投与するステップとを含み、前記組成物を提供するステップでは、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記投与するステップでは、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとをコンジュゲートしている前記少なくとも1つの荷電性多分枝ポリマーデンドリマーが前記プロフェッショナル抗原提示細胞に結合し、前記siRNAが前記プロフェッショナル抗原提示細胞に入る条件下で前記組成物を投与する。前記荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能であり、前記siRNAは、例えば、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられるであることが可能である。1つの実施態様では、前記siRNAは、前記プロフェッショナル抗原提示細胞でCTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1の発現を妨げる。
【0017】
その上さらに、本明細書記載の発明は、哺乳類において、MHCクラスII腫瘍細胞(リンパ腫又はリンパ腫の一部分)の増殖を抑制するか、MHCクラスII腫瘍細胞のアポトーシスを誘導するかの方法である。本方法は、少なくとも1つのTヘルパーペプチドをコンジュゲートし、タンパク質をエンコードする核酸によって結合した少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーにおいて、前記少なくとも1つのTヘルパーペプチドが前記MHCクラスII腫瘍細胞に特異的に結合し、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸又は該核酸によってエンコードされるタンパク質との組み合わせが、前記MHCクラスII腫瘍細胞の増殖の抑制か、前記MHCクラスII腫瘍細胞のアポトーシスの誘導かをするように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、結合される。前記陽荷電性多分枝ポリマーデンドリマーは、例えばPAMAMデンドリマーであることが可能であり、少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。しかし、適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能である。
【0018】
本明細書に記載されているような核酸を細胞に送達するための方法は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を細胞に接触させるステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーエピトープと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーエピトープが前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーエピトープと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーエピトープと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。本方法では、前記ペプチド又はタンパク質は前記細胞内で典型的に発現される。適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能であるが、前記陽荷電性多分枝ポリマーデンドリマーは、例えばPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。
【0019】
本明細書に記載されているような核酸を細胞に送達するための組成物は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含み、該少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドは前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることが可能であり、前記少なくとも1つのTヘルパーペプチドは、例えばPADREであることが可能である。しかし、適切な陽荷電性多分枝ポリマーデンドリマー及びTヘルパーペプチドのいずれかが用いられることが可能である。
【0020】
他に定義されなければ、本明細書において使用される全ての技術用語は、本発明が属する技術分野の当業者の一般的な理解と同一の意味を有する。
【0021】
本明細書において、「核酸」又は「核酸分子」は、RNA(リボ核酸)及びDNA(デオキシリボ核酸)のような2以上のヌクレオチドの鎖、及び化学的に改変されたヌクレオチドを意味する。「精製された」核酸分子は、核酸が天然に存在する細胞又は生命体の他の核酸配列から実質的に分離された核酸分子である (例えば、30、40、50、60、70、80、90、95、96、97、98、99、100%夾雑物を含まない)。前記用語は、例えば、ベクターに組み込まれた組換え核酸分子、プラスミド、ウイルス、又は原核生物若しくは真核生物のゲノム(全遺伝情報)を含む。精製された核酸の例は、cDNA、ゲノム核酸断片、ポリメラーゼ連鎖反応(PCR)で製造される核酸、ゲノム核酸の制限酵素処理で形成される核酸、組換え核酸、化学的に合成される核酸分子を含む。「組換え」核酸分子は、例えば、化学合成によって、又は、分離された核酸セグメントの遺伝子工学技術による操作によって、分離した別の2つの配列セグメントの人工的組み合わせで製造される核酸分子である。
【0022】
ペプチド、オリゴペプチド、又はタンパク質のアミノ酸残基の引用において、「アミノ酸(置換)基」、「アミノ酸」、及び「(置換)基」の用語は相互代替的に使用され、本明細書において、アミノ酸又は少なくとも一つの他のアミノ酸若しくはアミノ酸様化合物にアミド結合又はアミド様結合で共有結合したアミノ酸様化合物を意味する。
【0023】
本明細書において、「タンパク質」及び「ポリペプチド」は、例えば、長さ、及び、糖鎖付加やリン酸化のような翻訳後の修飾にかかわらず、アミノ酸のいかなるペプチド連結鎖を意味する同義語として使用される。
【0024】
核酸分子、ポリペプチド、又は感染性病原体の引用において、「自然の(native)」は自然に存在する(例えば、野生型)核酸、ポリペプチド、又は感染性病原体である。
【0025】
本明細書において「抗原」又は「免疫原」は抗体によって特異的に認識され、結合する分子を意味する。
【0026】
エピトープ(例えば、Tヘルパーエピトープ)の引用においては、生物活性によって適当なMHC分子へ結合し、CTL(細胞障害性Tリンパ球)反応の刺激に対して有用なペプチドの場合に標的抗原又は抗原様分子に対するTヘルパー反応及びCTL反応を誘導する能力を意味する。
【0027】
「特異的結合」及び「特異的に結合する」の用語は、酵素/基質、受容体/アゴニスト、抗体/抗原等の対となる種の間で起こり、共有的若しくは非共有的相互作用、又は、共有的若しくは非共有的相互作用の組み合わせで介在される結合である。2つの種の相互作用が非共有結合複合体を作る場合、発生する結合は、典型的に、静電気的、水素結合、又は疎水結合の結果である。従って、「特異的結合」は、抗体/抗原、酵素/基質相互作用の特徴を有する結合複合体を作る2者間相互作用存在の一対の種の間で起こる。特に、特異的結合は、一対の中の1つのメンバーが特定の種と結合し、相応のメンバーが属する化合物ファミリーの中の他のいかなる種とも結合しないことによって特徴化される。
【0028】
本明細書において、「Pan−DRエピトープ」、「Pan−HLA−DR結合エピトープ」、「PADRE」及び「PADREペプチド」は、最も一般的な12のDRアレル(DR1、2w2b、2w2a、3、4w4、4w14、5、7、52a、52b、52c及び53)中の少なくとも約7つのDRアレルと高親和性で結合できる約4及び約20の間の置換基のペプチドを意味する。「高親和性」は本明細書において200nm未満のIC50%での結合と定義される。例えば、高親和結合は、3100nM未満のIC50%での結合を含む。クラスIIMHCとの結合に対して、1000nmの結合親和性閾値は典型的であり、100nm未満の結合親和性は一般的に高親和結合と一般的に考えられる。PADREペプチドの構築と使用は、米国特許5736142号公報に詳細に記載され、本明細書に引用として取り込まれる。
【0029】
「Tヘルパーペプチド」は本明細書においてTヘルパー細胞のT細胞受容体によって認識されるペプチドである。例えば、本明細書記載のPADREペプチドはTヘルパーペプチドである。
【0030】
本明細書で使用される用語「デンドリマー」は、荷電(例えば、陽荷電、陰荷電)し、高分枝の、概して球形のポリマー高分子である。陽荷電性高分枝のポリマーデンドリマーの例として、PAMAMデンドリマーがある。「PAMAMデンドリマー」及び「ポリアミドアミンデンドリマー」の用語によって、分枝点に3級アミンが存在し、構造的な層の間の結合がアミド置換基によって作られるデンドリマーの型を意味する。
【0031】
「PAMAMデンドリマー」及び「ポリアミドアミンデンドリマー」の用語によって、分枝点に3級アミンが存在し、構造的な層の間の結合がアミド置換基によって作られるデンドリマーの型を意味する。PAMAMデンドリマーはその表面に多数の陽荷電を示す。
【0032】
用語「誘導体化デンドリマー」は、その表面に1以上の置換基を有するデンドリマーを意味する。
【0033】
「PADRE誘導体化デンドリマー」又は「PADREデンドリマー」は、荷電(例えば陽荷電)性高分枝ポリマーデンドリマー(例えば、PAMAMデンドリマー)表面の置換基にPADREペプチドが共有結合したナノ構築物である。
【0034】
用語「コンジュゲートされた(conjugated)」は、1分子又は化学物質の物理的又は化学的に他の分子又は化学物質への結合又は接着を意味する。コンジュゲートの例は、共有的連結及び静電気的な複合体形成を含む。用語「複合体形成した」、「との複合体」、及び、「コンジュゲートされた」は本明細書において相互代替的に使用される。
【0035】
本明細書において、語句「配列相同性」は、サブユニットの一致を最大化するように整列した、即ち、ギャップと挿入を考慮し、2つの配列(例えば、核酸配列、アミノ酸配列)の相同位置の同定サブユニットのパーセンテージを意味する。「配列相同性」は、配列分析ソフトウェア(例えば、カリフォルニア州サンディエゴ、Accelrysの配列分析ソフトウェア)によって測定できる。
【0036】
語句「単離した」又は「生物学的に純粋な」は、自然な状態において一般的に付随する構成要素が実質的にない物質である。
【0037】
本明細書において、「ナノ粒子」は、ナノメーターで計測される大きさの微視的な粒子を意味する。例えば、ナノ粒子は、概ね総直径2−500nmの範囲のPADREデンドリマーコンジュゲート体、又は、核酸若しくはアミノ酸物質といくつかのPADREデンドリマーコンジュゲート体とを組み合わせた粒子である。
【0038】
用語「抗体」は、ポリクローナル抗体、モノクローナル抗体(mAb)、キメラ抗体、ヒト化抗体、抗体に対する抗イディオタイプ(anti−Id)抗体を含み、該抗体は、溶解又は結合形態で、公知の技術、例えば、これに限定されない酵素的開裂、ペプチド合成、又は組換え技術によって提供される当該抗体の断片、領域、及び誘導体と同様に標識可能なものを意味する。
【0039】
本明細書において、用語「アジュバント」は、体液性及び/又は細胞性免疫応答を亢進するように調製するいかなる物質を意味する。
【0040】
本明細書において、用語「表示された(displayed)」又は「表面に暴露された」は同義語と考え、ナノ粒子(例えばPADREデンドリマー)のような構造の外表面に存在する(例えば、免疫サイト認識に到達可能な抗原又は他の分子である)抗原又は他の分子である。
【0041】
用語「多価の」は、1以上の複製又は抗原の型又は分子がナノ粒子上に表示されることを意味する。
【0042】
本明細書において、「ワクチン」は予防的及び治療的なワクチンの全てを包含する。ワクチン組成物は、本明細書において、イン・ビボで生物学的に互換的な形態での被験体への投与に適する。本発明における「イン・ビボでの生物学的に互換的な投与に適した形態」の表現は、治療効果が毒性作用を上廻る投与物質の形態を意味する。当該化合物はいずれの動物(例えばヒト)に投与されても良い。本発明のある実施態様において、哺乳類(例えば、げっ歯類又はウサギ)に特定の抗原に対するモノクローナル抗体を製造するためにワクチンが投与される。
【0043】
「免疫応答」の語句によって、抗原又は複数の抗原に対する抗体、及び/又は、免疫細胞介在応答の誘導が意味される。免疫応答の誘導は、抗原投与生体の免疫原性の体質、化学組成、及び、抗原の構造、並びに、抗原投与の方法及び期間を含む多くの要因に依存する。免疫応答は多くの様相を有し、その一部は免疫システムの細胞(例えば、Bリンパ球、Tリンパ球、マクロファージ、及び、プラズマ細胞)によって示される。免疫システムの細胞は、抗原若しくは免疫系の他の細胞との相互作用、サイトカインの放出及びこれらのサイトカインとの反応性を通して関与しても良い。免疫応答は一般的に、体液性及び細胞性の2つの主要なカテゴリーに分けられる。体液性免疫応答の構成要因として、抗原に特異的な抗体の産生を含む。細胞介在の要因としては抗原に対して遅発型過剰感受性で細胞障害性エフェクター細胞の産生を含む。
【0044】
語句「治療的有効量」及び「有効的な投与量」は、治療的(臨床的)に望ましい結果を生むために十分な量を意味し、結果の正確な性質は、処置される障害の性質に依存して変動する。例えば、処置される障害はがんであり、その結果は、がん性腫瘍を含むがん細胞の排除が可能である。本発明における、組成物及びワクチンは1日当たり1回以上から1週間投与当たり1回以上の投与が可能である。当業者は、これに限定されない病気又は障害の重篤性、過去の処置、全体的な健康及び/又は被験体の年齢、罹患疾患を含む被験体への効果的な処置に必要な投与量及びタイミングに影響する要因を理解するであろう。さらに、本発明の組成物又はワクチンの治療的に有効な量での処置は、1回の処置又は連続処置を含む場合がある。
【0045】
本明細書において、用語「処置」は、本発明における又は本発明の方法によって同定される、治療剤の患者への投与若しくは適用、又は、病気、病気の症状を持つ、若しくは病気の素因を持つ患者から単離された組織若しくは細胞系列への、治療剤の、病気、病気の症状、病気の素因を、治す、癒す、緩和する、和らげる、変化する、救う、改善する、好転する若しくは作用する目的での、適用若しくは投与と定義される。
【0046】
用語「患者」、「披験体」、「個体」は、本明細書において相互代替的に使用され、ヒト患者が望ましい処置を受ける哺乳類披験体を意味する。ある事例においては、本発明の方法は、非ヒト霊長類と同様に、マウス、ラット、及びハムスターに限定されないげっ歯類を含み、動物実験、獣医学的応用、動物疾患モデルの展開での使用を認める。
【0047】
本発明と同様の又は同等のワクチン、組成物、キット及び方法は、本発明の実施又は試験として使用できるが、好適なワクチン、組成物、キット及び方法は以下に記載される。本明細書記載の全ての出版物、特許出願、及び、特許は、引用によって全体として本明細書に取り込まれる。矛盾する場合は、本明細書が定義を含めて調整する。以下に議論する特定の実施態様は例証するためのものであり、限定を意図するものではない。
【図面の簡単な説明】
【0048】
【図1】プラスミドと混合、又は、標的APC(抗原提示細胞)に対するペプチド若しくはポリペプチド抗原と連結したPADRE−デンドリマーの概要図である。
【図2】イン・ビトロでの、赤色蛍光色素でタグ付けした短い核酸配列とPADRE−デンドリマーとの複合体の送達を示すヒトB細胞の解析の一連のドット・プロット・サイトメトリーの分析図である。
【図3】イン・ビボにおけるPADRE−デンドリマーのDNA送達を表す写真である。
【図4】GFP又はOVAをエンコードするプラスミド皮下投与で免疫されたC57BLマウスの血清での、ELISA(左図)又はFLISA(右図)で評価された腫瘍に対する効果を示すグラフである。
【図5】B16メラノーマ細胞(上段)又はTSA(下段)が移植されたマウスにおけるPADRE−デンドリマーの腫瘍に対する治療効果を示すグラフである。
【図6】ヒトB細胞(上段図)とヒト末梢単核球細胞(PBMC)(下段図)にいて、デンドリマー−PADREとGFPプラスミド(5μg)との複合体を共培養したGFP発現のフロー・サイトメトリーヒストグラムである。
【図7】イン・ビトロでのタンパク質、アルブミン−FITCのPDD(PADRE−誘導体化デンドリマー)によるヒトB細胞への送達を示す一連のフロー・サイトメトリー・ドット・プロットである。右側の写真はPDD/アルブミン−FITC複合体添加後1時間のB細胞によるアルブミン取り込みの蛍光写真である。
【図8】リンパ節でのイン・ビボDC(樹状細胞)標的を示す一連のフロー・サイトメトリー・ドット・プロットである。左図は、実験操作の時間概念図を表し、右図は、PDD/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節に対するフロー・サイトメトリー・ドット・プロットを表す。
【図9】DRHA(デンドリマーHA)、異なったTヘルパーエピトープで修飾されたデンドリマーのDC(樹状細胞)へのGFPトランスフェクションの促進を表すグラフを示す。
【図10】赤色(Alexa Fuor)標識dsRNAオリゴマーとの複合PADRE−デンドリマーでトランスフェクトされたヒトB細胞の顕微鏡写真である。
【図11】赤色(Alexa Fuor)標識dsRNAオリゴマーとデンドリマー複合体(左図)、及び、赤色(Alexa Fuor)標識dsRNAオリゴマーとPADRE−デンドリマーとの複合体でトランスフェクトされた(右図)、ヒヒ末梢血単核球(PBMC)の顕微鏡写真である。
【図12】プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)の顕微鏡写真を表す。
【図13】PADRE−デンドリマーのプラスミド(DRP−ovaプラスミド)複合体のワクチン接種とイン・ビボ電気穿孔法(EP−ovaプラスミド)との比較を表すグラフである。
【図14】PDD/プラスミド−PCARD抗原の2つで免疫したマウスの高タイター抗体反応誘発を示すイン−セル・ウエスタン・アッセイのマルチウェルプレートの写真である(左図:抗原をエンコードするプラスミドをトランスフェクトしたcos−7細胞、右図:対照プラスミドをトランスフェクトしたcos−7細胞)。
【図15】PDD/プラスミドの2つで免疫されたマウスの高タイター抗体反応誘導を表すイン−セル・ウエスタン・アッセイのマルチウェルプレートのグラフと写真である。
【図16】PDD/プラスミド−VgPCRで1回免疫し、更にPDD/プラスミド−VgPCRで2回免疫することにより抗体反応を誘導した免疫マウスの血清イン−セル・ウエスタン・アッセイのマルチウェルプレートの写真である。
【図17】G5デンドリマー、コンジュゲート体、及び、ペプチドのUV−可視スペクトルを表すグラフである。
【図18】PADRE−デンドリマー/OVA プラスミドの予防的ワクチン接種のB16/OVA腫瘍に対する効果を示すグラフである。
【0049】
図1は、プラスミドと混合、又は、標的APC(抗原提示細胞)に対するペプチド若しくはポリペプチド抗原と連結したPADRE−デンドリマーを示す一対の概要図である。図1は、本明細書に記載されたPADRE−デンドリマーがいかなる関心抗原又はいかなる関心抗原をエンコードする核酸を取り込むことが可能なプラットフォームを提供することを表す。本明細書におけるPADRE−デンドリマーは、プロフェッショナル抗原提示細胞によって取り込まれるようにデザインされた生来の免疫力の活性化剤である。
【0050】
図2は、イン・ビトロでの、赤色蛍光色素でタグ付けした短い核酸配列とPADRE−デンドリマーとの複合体の送達を示すヒトB細胞の解析についての一連のドット・プロット・サイトメトリー画像である。該核酸は、哺乳類細胞へのsiRNAオリゴヌクレオチド送達最適化の評価促進のためのRNAi解析での使用のためにデザインされた赤色蛍光標識dsRNAである。細胞は、PADRE−デンドリマー/多ヌクレオチド複合体又は対照と共に、培地を除去し、新鮮な培地を添加し、4時間共培養された。画像は、精製ヒトB細胞へのAlexa Fuor標識dsRNAオリゴマーの送達を示す。第4カラムの最下段の画像は、約9.2%の細胞でのオリゴ送達を示す。
【0051】
図3は、イン・ビボにおけるPADRE−デンドリマーのDNA送達を表す一連の写真である。PADRE−デンドリマー/GFP(緑色蛍光タンパク質)−プラスミド複合体が皮膚(全5μgプラスミド)及び角膜(1μg/角膜)に注入された。麻酔されたマウスの肝臓のステレオ蛍光顕微鏡画像が撮影された。左の画像は皮膚でのGFP発現が、右の画像は角膜でのGFP発現を示す。
【0052】
図4は、確立された腫瘍の処置を示すグラフである。C57BLマウスが、GFP(1回)又はOVA(2回)をエンコードするプラスミドの皮下投与で免疫された。3匹の血清が採取され、ELISA(左図)又はFLISA(右図)が実施された。
【0053】
図5は、確立された腫瘍のPADRE−デンドリマー治療についての一対のグラフを示す。B16メラノーマ細胞(上段)又はTSA(下段)が移植されたマウスが、腫瘍移植後2日目又は3日目にワクチン接種され、1週間後に追加免疫された。
【0054】
図6は、ヒト末梢単核球細胞(PBMC)(下段図)、ヒトB細胞(上段図)のデンドリマー−PADREとGFPプラスミド(5μg)との複合体を共培養したGFP発現の一連のフロー・サイトメトリーヒストグラムである。デンドリマー/GFP複合体が対照(左ヒストグラム)として使用された。
【0055】
図7は、イン・ビトロでのタンパク質、アルブミン−FITCのPDD(PADRE−誘導体化デンドリマー)によるヒトB細胞への送達を示す一連のフロー・サイトメトリー・ドット・プロットである。左画像は、精製ヒトB細胞へのPDD/アルブミン−FITC送達を表す。ヒト精製B細胞が採取され、PDD/アルブミン−FITCと共培養された。左ヒストグラムはヒトB細胞に添加後のPDD/アルブミン−FITC送達を示す。上段のヒストグラムはB細胞単独を、中段のヒストグラムはデンドリマー/アルブミン−FITC複合体を、下段のヒストグラムはヒトB細胞添加PDD/アルブミン−FITC複合体の結果を表す。右写真はPDD/アルブミン−FITC複合体添加後1時間のB細胞によるアルブミン取り込みの蛍光写真の画像である。
【0056】
図8は、リンパ節でのイン・ビボDC(樹状細胞)標的を示す一連のフロー・サイトメトリー・ドット・プロットである。左画像は、注入、リンパ節摘出、及び解析の時間概念図を表し、右画像図は、PDD/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節細胞から得られるナイーブのリンパ節に対するデータ解析の一対のフロー・サイトメトリー・ドット・プロットを表す。これらの画像は、リンパ節近接の注入部位のマウスDC及びB細胞のイン・ビボPADRE−デンドリマーの効果を表す。リンパ細胞はCD11c(DCマーカー)、MHCクラスII及びCD20(B細胞マーカー)で染色した。右上段のヒストグラムは、デンドリマー/GFP−プラスミド注入がDCの約6%にGFPを発現する結果を、下段ドットプロットは明確にPDD/GFP−プラスミド注入がDC>70%でGFPを発現する結果を示す。
【0057】
図9は、DRHA(デンドリマーHA)、異なったTヘルパーエピトープで修飾されたデンドリマーを表す一対のグラフを示し、イン・ビボ標的リンパ節がDRHAによりDC(樹状細胞)へのGFPトランスフェクションを促進することを表す。本実験は、Balb/cマウスがIad制限HAペプチドコンジュゲートデンドリマーと連動して使用される点が相違するが、図8と同様である。DRHA/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入部位に接するリンパ節、及び、ナイーブなリンパ節が、DRHA/GFP−プラスミド又はデンドリマー/GFP−プラスミド注入後5日目に摘出された。チャートは、DCに対してCD11c(DCマーカー)で染色後のリンパ節細胞から得られたデータのフロー・サイトメトリー解析結果を表す。上段の図は、既に示した処置マウスの流入領域リンパ節に認められるGFP陽性DC数を表す。下段の図は、DC中のGFP蛍光強度の平均を表す。これらの結果は、DRHAがイン・ビボでトランスフェクトされたDC数を増加するだけではなく、細胞に入るプラスミド分子の数の増加を明確に示す。
【0058】
図10は、赤色(Alexa Fuor)標識dsRNAオリゴマーオリゴとの複合PADRE−デンドリマーでトランスフェクトされたヒトB細胞の顕微鏡写真である。
【0059】
図11は、赤色(Alexa Fuor)標識dsRNAオリゴマーとのデンドリマー複合体でトランスフェクトされた(左図)、及び、赤色(Alexa Fuor)標識dsRNAオリゴマーとのPADRE−デンドリマー複合体でトランスフェクトされた(右図)、ヒヒ末梢血単核球(PBMC)の一対の顕微鏡写真である。蛍光顕微鏡写真は、PDD/dsRNA−Alexa Fuor又は対照複合体をヒヒ末梢血単核球に対して添加後2時間に撮影された。画像は、サル末梢血単核球へのPDDを介した多ヌクレオチドの標的送達の高い効果を表す。
【0060】
図12は、プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)の一対の顕微鏡写真を表す。プラスミドをエンコードするデンドリマー−GFP複合体をトランスフェクトしたヒヒ末梢血単核球(左図)、及び、PADRE−デンドリマー−GFP複合体をトランスフェクトした細胞(右図)。蛍光写真画像は、ヒヒPBMCにPDD/GFP−プラスミド又は対照複合体を添加後1日に撮影された。本画像は、プラスミドの標的送達の高い効果とPDDを介したプラスミドによってエンコードされた遺伝子発現を表す。
【0061】
図13は、PADRE−デンドリマーのプラスミド(DRP−ovaプラスミド)複合体のDNAワクチン単回接種がプラスミドのイン・ビボ電気穿孔法(EP−ovaプラスミド)に優ることを表す結果のグラフである。
【0062】
図14は、PDD/プラスミド−PCARD抗原の2つで免疫したマウスの高タイター抗体反応誘発を示す免疫マウス血清を使用するイン−セル・ウエスタン・アッセイのマルチウェルプレートの一対の写真である。マルチウェルプレートは、抗原をエンコードするプラスミドをトランスフェクトしたcos−7細胞(左図)及び対照プラスミドをトランスフェクトしたcos−7細胞(右図)を含んでいる。
【0063】
図15は、PDD/プラスミドの2つで免疫したマウスの高タイター抗体反応誘導を表す免疫マウス血清を使用するイン−セル・ウエスタン・アッセイのマルチウェルプレートのグラフと一連の写真である。PADRE−デンドリマーのGFP又はovaをエンコードするプラスミド複合体で1回免疫した、又は、PADRE-デンドリマーのCCR5、vgPCR、CathL、若しくはp2をエンコードするプラスミドとの複合体で2回免疫したイン−セル・ウエスタン・FLISAの結果を表す。
【0064】
図16は、PDD/プラスミド−VgPCRで1回免疫し、更にPDD/プラスミド−VgPCRで2回免疫することにより抗体反応を誘導した免疫マウスの血清を使用したマウス、イン−セル・ウエスタン・アッセイのマルチウェルプレートの一対の写真である。これらの結果は、PDD/プラスミド−VgPCRでの単回免疫が、追加免疫で高められる抗体反応に結びつくことを示す。
【0065】
図17は、G5デンドリマー、コンジュゲート体、及び、ペプチドのUV−可視スペクトルを表すグラフである。
【0066】
図18は、本明細書で(PADRE−デンドリマー/OVA プラスミド)と記載されるワクチン接種の予防的な設定でB16/OVA腫瘍の撲滅を示すグラフである。
【発明を実施するための形態】
【0067】
詳細な説明
本明細書に、イン・ビボでのワクチン接種及び抗体(例えば、モノクローナル抗体)製造のための1又は2以上の抗原の効果的な送達を目的に、及び、PAPC(プロフェッショナル抗原提示細胞)又はMHCクラスII陽性細胞(例えば、腫瘍細胞)へのペプチドか、タンパク質か、siRNAか、RNA又はDNAかの効果的な送達を目的に、ナノ粒子に基づくワクチンと、組成物と、キットと、及び、方法とが記載されている。典型的なワクチン又は組成物において、荷電(例えば陽荷電)性高分枝ポリマーデンドリマーは、MHC標的で、Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHAのようなエピトープ)のような免疫原性ペプチドにコンジュゲートされ、披験体における特定の抗原に対する免疫応答を誘導するための少なくとも1つの分子にコンジュゲート又は結合される。前記分子は、細菌性、真菌性、原生動物、若しくはウイルス起源のタンパク質若しくはペプチド、又は、これらの抗原、炭化水素、若しくはペプチド様炭化水素由来のフラグメントであっても良い。該分子は、自己免疫疾患処置のための自己抗原を含んでも良い。さらに、抗原性分子は、少なくとも1つの抗原をエンコードする哺乳類のプラスミドを含む1以上の核酸であっても良い。例えば、抗原は、披験体(例えば哺乳類)において、1以上の免疫原性ペプチドを発現して、該発現タンパク質に対する強く特異的な免疫応答の誘導に結びつく1以上の核酸であっても良い。別の例として、抗原は、プロセシングされて提示される免疫原性のペプチド又はポリペプチドであっても良い。荷電(例えば、陽荷電)性高分枝ポリマーデンドリマーは2以上の異なる抗原にコンジュゲートされることが可能であり、同様に、各々異なる抗原をエンコードする2以上の核酸とコンジュゲートすることが可能である。本明細書において、ワクチン又は他の組成物は、一つの型の抗原をコンジュゲートした複数の荷電(例えば、陽荷電)性高分枝ポリマーデンドリマー(例えば、特定の抗原の5つの複製をコンジュゲートした5つのデンドリマー)、又は、異なる抗原の複数にコンジュゲートされた荷電(例えば、陽荷電)性高分枝ポリマーデンドリマー(例えば、5つの異なる抗原に対する5つのデンドリマー)を含むことができる。該デンドリマーは、デンドリマー(陽性)と抗原(陰性)との反対の電荷に基づき、抗原(核酸又はタンパク質)との複合体(コンジュゲート)を作る。又は、コンジュゲートは共有的な化学結合の場合がある。
【0068】
1つの実施態様として、本明細書に記載されるように、イン・ビボで抗原を送達するためのナノ粒子に基づく方法は、Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHA等のようなエピトープ)のようなMHC標的又は免疫原性ペプチドとコンジュゲートし、荷電(例えば陽荷電)性高分枝ポリマーデンドリマー(例えば、PADRE−誘導体化デンドリマー(PDD))に対して、結合する抗原、又は、コンジュゲートするポリペプチド又は抗原性ペプチド若しくはポリペプチドをエンコードするDNAプラスミドによって組成されるワクチンの注入を含む。陰性に荷電したプラスミドは、自然に、陽性に荷電したPADRE−デントリマーに結合する、一方、ペプチド又はポリペプチド抗原は、もし陰性に荷電していないならば、化学的にPADRE−デンドリマーに連結される。別の実施態様において、デンドリマーは、陽荷電性のタンパク質及びペプチドと結合するために陰性に荷電している。表面に暴露された抗原又は抗原をエンコードする核酸は、いかなる好適な公知の手段によって、デンドリマーにコンジュゲートされても良い。コンジュゲート方法は、自然のイオン的、非イオン的、静電気的結合又は共有結合のどれであっても良い化学的な複合体形成を含む。本明細書において、Tヘルパーエピトープにコンジュゲートされたデンドリマーは、多価であることが可能であり、抗原の1以上の複製若しくは型、又は核酸を表面に提示できる。多価の、又は、凝集した抗原(又は抗原をエンコードする核酸)の存在は、披験体の免疫応答を高める。抗原又は核酸の型の1以上の複製は、2以上の分離したリンカー若しくはスペーサー、又は共通のリンカー若しくはスペーサーを介してデンドリマーに接着できる。本明細書の組成物、キット及びワクチンは予防的及び処置的の両方の適応を有する。即ち、披験体の病気又は疾患の発症を防止する予防薬として使用できる。いかなる感染病原体又はがんに対する免疫応答を備えるために、本明細書記載のワクチンが使用可能である。
【0069】
本明細書において、治療剤は単核球、特にB細胞を標的として使用でき、同時発生慢性リンパ球性白血病及び多発性骨髄腫に使用できる。本明細書において、ナノ粒子(例えば、PADRE−誘導体化デンドリマー)と治療剤(医薬品)との組み合わせが複数の形態、例えば、治療剤とナノ粒子の混合物で使用できる。本明細書に記載するナノ粒子の組み合わせ(例えば、PADRE-誘導体化デンドリマー)及び治療剤(例えば、医薬)は、例えば、治療剤とナノ粒子との混合物、複合体形成のための静電的結合、治療剤のナノ粒子への化学的コンジュゲート等、いくつかの形態で使用しても良い。治療薬の例として、毒素、iRNA、siRNA、マイクロRNA、(例えば、腫瘍抑制遺伝子、自殺遺伝子(例えば、TK)、又は、腫瘍の増殖及び/又は生存を遮断又は変化させるいかなる遺伝子をエンコードする)プラスミド、タキソール(登録商標)(パクリタキセル)(Bristol−Myers Squibb)、抗体、メルファラン、プレドニゾン、サリドマイド(MPT)、ベルケード(登録商標)(ボルテゾミブ)(Millenium Pharmaceuticals)、レナリドミド、及び、デキサメタゾン、又は、これらの組み合わせを含むが、これに限定されない。
【0070】
同様に、本明細書記載の組成物及び方法は、単球、樹状細胞、T細胞又はB細胞を含む免疫細胞に治療薬が到達する(送達される)自己免疫疾患の治療に使用されても良い。本明細書記載の組成物は、陰荷電性で本明細書に記載のナノ粒子との複合体を生成するポリI.C.(しかし、これに限定されない)のようなアジュバントとともに使用されても良い。
【0071】
下記の好ましい実施態様は、これらの組成物, ワクチン、キット及び方法の適用を表す。それにもかかわらず、これらの実施態様の記載から下記の記載に基づいて発明の他の側面が作られ、及び/又は、実践する場合がある。
【0072】
生物学的方法
ここで、従来の分子生物学的技術を含む方法を記載する。このような技術はSambrookら著「分子クローニング:研究室マニュアル 第三版、1−3巻」(Cold Spring Habor Laboratory Press、Cold Spring Harbor N.Y.、2001)、及び、Ausubelら著「分子生物学の現在のプロトコール」(Greene Publishing and Wiley−Interscience、N.Y.1992年(定期出版物))のような方法論の文献や専門書に詳細に記載され公知である。免疫学的技術は、Frederick W.Alt著「免疫学の進歩、第93巻」(Academic Press,Burlington、MA、2007)、Gary C Howard 及びMatthew R.Kaser編集「抗体の作製と使用 実践的ハンドブック」(CRC Press、Boca Raton、Fl、ロンドン、英国)、Gabriel Virella著「医学免疫学 第6版」(Informa Healthcare Press、ロンドン、英国、2007年)、及び、Harlow and Lane著「抗体、研究室マニュアル」(Cold Spring Habor Laboratory Press、Cold Spring Harbor N.Y.、1988)のような文献や専門書に詳細に記載され公知である。遺伝子導入、及び遺伝子治療の従来の方法は本発明に適用されても良い。例えば、T.Blackenstein「遺伝子治療:原理と応用」(Springer Verlag 1999)、及びP.D.Robbins著「遺伝子治療プロトコール(分子医学の方法)」(Humana Press 1997年)を参照のこと。ワクチン製造の方法とワクチン投与は、例えば、Andrew Robinson、Martin P.Cranage 及びMichael J.Hudson著「ワクチン・プロトコール(分子医学の方法)第2版」(Humana Press、Totowa、NJ、2003年)、Manmohan Singh著「ワクチン、アジュバント及び送達システム 第1版」(Wiley−Interscience、Hoboken、NJ、2007年)、Arvin A.M.及びGreenberg H.B.著、Viology、344:240-249、2006年、R.Morenweiser著、Gene Therapy suppl.1: S103−S110, 2005年のような文献に詳細に記載され公知である。PAMAMデンドリマーと同様にワクチンの構築と使用は、例えば、Arashkiaら、Virus Genes40 (1):44−52, 2010年; Veldersら、J.Immunol.、166:5366-5373, 2001年; 及び、S.Chauhan、N.K.Jain、P.V.Diwan(2009年)「マウスにおけるPAMAMデンドリマーの前臨床及び行動毒プロフィール」(Proceedings of the Royal Society A、数学、物理学、工学科学(オンライン出版日2009年12月3日)に記載されている。
【0073】
核酸、ペプチド、ポリペプチドとのコンジュゲート体 デンドリマーの合成
デンドリマーは濃密なDNAの骨格(schaffold)として作用し、完全に陽荷電したデンドリマーは陰荷電性のDNA又はRNAとの強い電気的相互作用の発生に対して好ましい。例えば、デンドリマー/Tヘルパーエピトープ/DNA複合生成物は、調整可能なN/P比率(アミンに対するリン酸、又は、荷電比率)に依存する正味の荷電を有する。本明細書において、少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞(PAPC)に特異的に結合するように、少なくとも一つのTヘルパーペプチド、及び、抗原、核酸又はsiRNAがデンドリマーの外表面にコンジュゲートされていることを特徴とし、該Tヘルパーペプチド(例えば、PADREペプチド又はインフルエンザHAのようなエピトープ)及び、抗原、抗原をエンコードする核酸又はsiRNAをコンジュゲートするデンドリマーが記載される。一つの実施態様において、デンドリマーは、少なくとも1つ(例えば、2、3、4、5個等)のPADREペプチド、及び、ペプチド又はポリペプチド抗原にコンジュゲートされている。本実施態様において、デンドリマーは、典型的には、複数のペプチド又はポリペプチド抗原とコンジュゲート又は結合している。いくつかの抗原(例えば、複数の同一抗原)とのコンジュゲート又は結合は、抗原がハプテン関連の大きさの問題により効果的な免疫応答を誘導できない小さい抗原(特に、小ペプチド又は糖質)の場合に、特に有用である。本明細書に記載のデンドリマー/Tヘルパーエピトープ/核酸コンジュゲート体が抗原の多くの複製を含むことは、抗原の免疫原性を向上できる。もう一つの実施態様において、デンドリマーは、PADREペプチドとコンジュゲートし、抗原をエンコードする核酸と結合する。さらにもう一つの実施態様において、デンドリマーは、PADREペプチドとコンジュゲートし、関心遺伝子に対するsiRNAを結合する。これらの実施態様において、いかなる有用な方法によってデンドリマーが調製され、Tヘルパーペプチド(例えば、PADREペプチド及びインフルエンザHAのようなエピトープ)をコンジュゲート、及び、核酸(例えば、DNA及びsiRNA)と結合できる。デンドリマーを製造し、使用する方法は、例えば、引用文献として両方が本明細書に取り込まれるZhang J−Tら、Macromol.Biosci.2004、4、575-578、並びに、米国特許4216171号公報及び5795582号公報の文献に記載され周知である。D.A.Tomalia、A.M.Naylor,及び、W.A.Goddard III「星型デンドリマー:サイズ、形、表面科学、トポロジー、及び、柔軟性の原子から大分子までの分子レベルの調節」Angew. Chem.Int.Ed.Engl. 29 (1990年)、 138-175を参照のこと。本明細書記載の実験において、PAMAM−デンドリマーが使用された。しかしながら、いかなる適正な陽荷電性高分枝ポリマーデンドリマーを使用できる。付加的な陽荷電性高分枝ポリマーデンドリマーは、ポリ(プロピレンイミン)(PPI)デンドリマー又はより一般的に表面に1級アミノ基を有する他のいかなるデンドリマーを含む。
【0074】
本明細書に記載されているPADRE−デンドリマー (PADRE誘導体化デンドリマー)は、適正な方法によって調製される。例えば、米国特許5736142号公報を参照のこと。米国特許5736142号公報に記載されたPADREペプチドを製造するために、Jadetzkyらが最初に記載した戦略(EMBO J 9:1797−1083、1990年)、即ち、13置換基のポリアミンに挿入されるMHCに結合するために重要な側鎖を含むアンカー置換基が使用された。PADREペプチドは、例えば、米国特許5736142号公報に記載された方法に従って調製可能、又は購入可能(例えば、Anaspec Inc.Fremnt、CA)である。相対的に小さいサイズのため、PADREペプチドは溶液又は固体支持体上で従来法に従って合成可能である。種々の自動合成装置が商業的に利用可能であり、公知のプロトコールに従って使用可能である。それに代わって、組換えDNA技術が、Tヘルパーエピトープをエンコードする配列の発現ベクターへの挿入、変換、又は、適切な宿主細胞へのトランスフェクト、発現のための適性条件下での培養のために使用されても良い。これらの操作は、本明細書に引用文献として取り込まれるSambrookらの文献(上記)に記載され、公知技術である。本明細書に記載のように、PADREペプチドは、N−及びC−末端置換基への改変を含んでも良い。当業者によって良く理解されているように、N−及びC−末端は、例えば、結合、安定性、生物学的利用性、連結容易性のような物理的又は化学的性質を変更するために改変されても良い。本明細書に記載されるようにPADREペプチドは、希望とする特性、例えば、非改変ペプチドの実質的な全生物活性を維持しつつ、改良された薬理学的特性を与えるために、いかなる数の方法で改変されても良い。
【0075】
本明細書に記載の実験において、PADRE−デンドリマーコンジュゲート体は、PADREペプチドの−COOH末端とデンドリマーのアミノ基の一つとの単純なアミド結合によって製造された。PADREペプチド(Ac−D−Ala−Lys−Cha−Val−Ala−Ala−Trp−Thr−Leu−Lys−Ala−Ala−D−Ala−Ahx−Cys−OH)(SEQ ID NO:1、Ac=アセチル基; D−Ala=D−アラニン; Cha=シクロヘキシルアラニン; Ahx=アミノヘキサン酸)は、Anaspec社(Fremont、CA)より、アミノ末端の保護と反応回避のためにアセチル誘導体を購入した。購入されたペプチドは95%以上の純度であった。アミド結合反応はDMF溶液中で標準的な条件で行われた(図1、下段概要図参照)。大半のアミノ基を遊離状態に保ちデンドリマーの大きな陽荷電性生成のためにデンドリマー1個当たり2−3個のペプチドの結合を求め、各々のデンドリマー表面へ結合するPADREエピトープの数を調節するために、反応では2:1のペプチド/デンドリマー比が使用された。典型的な実施態様において、本明細書で記載されている複数のPADRE−デンドリマーコンジュゲート体は、0、1、2、3個等が結合したPADRE(又は他のペプチド)を含むデンドリマーが頒布されるであろう。相対的母集団は、ポワッソン分布に従うものと記載される。PADRE、aKXVAAWTLKAAa(SEQ ID NO: 2)は、もっとも普及した16の中の15のHLA−DR分子(Kawashimaら、Human Immunology 59: 1−14(1998); Alexanderら、Immunity1: 751−761(1994))に対して高い又は中等の親和性(IC50<1000nM)で結合する。しかしながら、大半のヒトでMHCクラスIIに結合しCD4ヘルパーT細胞を活性化可能な他のペプチドがデンドリマーを標識するために使用されても良い。ペプチドの例として、これに限定されないが、テタヌス毒素(IT)ペプチド830-843; Panina−Bordignonら(Eur.J.Immunology19: 2237-2242(1989))に記載された普遍的エピトープ; 及び、大半のヒト、及び、多くのマウスのMHCクラスIIと反応する下記ペプチドを含む。
【0076】
aKFVAAWTLKAAa (SEQ ID NO:3)、aKYVAAWTLKAAa (SEQ ID NO:4)、aKFVAAYTLKAAa (SEQ ID NO:5)、aKXVAAYTLKAAa (SEQ ID NO:6)、aKYVAAYTLKAAa (SEQ ID NO:7)、aKFVAAHTLKAAa (SEQ ID NO:8)、aKXVAAHTLKAAa (SEQ ID NO:9)、aKYVAAHTLKAAa (SEQ ID NO:10)、aKFVAANTLKAAa (SEQ ID NO:11)、aKXVAANTLKAAa (SEQ ID NO:12)、aKYVAANTLKAAa (SEQ ID NO:13)、AKXVAAWTLKAAA (SEQ ID NO:2)、AKFVAAWTLKAAA (SEQ ID NO:14)、AKYVAAWTLKAAA (SEQ ID NO:15)、AKFVAAYTLKAAA (SEQ ID NO:16)、AKXVAAYTLKAAA(SEQ ID NO:17)、AKYVAAYTLKAAA (SEQ ID NO:18)、AKFVAAHTLKAAA (SEQ ID NO:19)、AKXVAAHTLKAAA (SEQ ID NO:20)、AKYVAAHTLKAAA (SEQ ID NO:21)、AKFVAANTLKAAA (SEQ ID NO:22)、AKXVAANTLKAAA (SEQ ID NO:23)、及びAKYVAANTLKAAA (SEQ ID NO:24)(a=D−アラニン、=シクロヘキシルアラニン)。他の使用可能なエピトープのもう一つの例は、マウスBalb/c MHCクラスII IaDに結合するHAペプチド配列SFERFEIFPKE(SEQ ID NO:25)(プロウイルスPR8ウイルスHA由来)である。
【0077】
製造物を少なくとも24時間純水に対して透析することにより精製し、真空下乾燥した。集めた製造物は、透明な油状であり、1H−NMR(核磁気共鳴分析法)、UV−Vis及びMALDI−TOF質量分析法で、その特性を分析した。PADRE−デンドリマーコンジュゲート体のNMRスペクトルは、デントリマープロトンに一致する大きなピークと、ペプチドプロトンについての小さなピークの集合を示した。PADRE−デンドリマーコンジュゲート体のMALDI−TOF質量分析スペクトルは、デンドリマー単独で観察されるピークよりも約3000 m/z高いピークを示した。その超過分の質量は、約2個のペプチドエピトープに一致する。コンジュゲート体のUV−Visスペクトルは、トリプトファンの吸収波長領域に明確な吸収を示す。
【0078】
PADRE−デンドリマーコンジュゲート体とのプラスミドDNAの複合化は、生理的pHのPBS緩衝水溶液中で、2つの成分を混合することにより行われた。N/P(アミン対リン酸)比の典型的な値は、10:1である。DNAの完全な複合化を分析するためにゲル電気泳動法が使用される。生理的pH値においてアミノ基(−NH2)は水素化され、デントリマーの高い陽荷電性を与え、陰荷電性のDNA又はRNAの細胞への送達に特に適している。水溶液において、陽荷電性のデンドリマーと陰荷電性の核酸は、比較的容易に細胞膜を透過及び通過可能な凝縮物又はナノ粒子を生じさせる。
【0079】
PADRE以外のTヘルパーエピトープとコンジュゲートするデンドリマーは、上記のPADRE−誘導体化デンドリマーと同様の方法で典型的に調製される。例えば、ペプチドの酸末端は、活性化試薬としてのカルボジイミドを使用するアミド化の一つによって、公知の合成方法によってデンドリマー表面上のアミノ基と共有結合することができる。もう一つの例として、アミン終末デンドリマーへのこれらペプチドの結合は、2つの合成経路によって実施できる。ペプチドエピトープのアミノ末端はアセチル化によって保護される。第一の経路は、標準的なアミド化化学による結合達成のために、システイン基のカルボン酸を使用する。第二の経路は、システインのチオール基(もしペプチドに存在する場合、それ以外は付加されても良い)の利点によって、マレイミドの前処理によりデンドリマー表面に結合するアルケン基と結合する。両経路は、エピトープ結合デンドリマーの機能化を与える。数個(several)までのペプチドエピトープ(例えば、2、3、4、5、6個等)/デンドリマーは、DNA送達剤としての標的性を高め、ワクチン化の目的に対しての特性を改善するだろう。しかしながら、生理的pH値での水素化によるデンドリマーの大きな陽荷電性の獲得のために多くの未反応アミノ置換基の放置は重要である。本明細書に記載のように、デンドリマーは、いかなるTヘルパーエピトープともコンジュゲート可能である。付加的なTヘルパーエピトープの一つの例は、インフルエンザHAである。
【0080】
一般的に、ジェネレーション−5(G5)のデンドリマーが、本明細書における組成物、キット及び方法に使用される。しかしながら、他のデンドリマー(表1参照)が使用可能である。
【表1】

【0081】
荷電されたポリマー担体ワクチン及び組成物
本明細書に記載のワクチンは、少なくとも1つのMHC標的及び免疫原性ペプチドと、及び、少なくとも1つの核酸か又は少なくとも1つのペプチド若しくはポリペプチド抗原が、荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の外部表面にコンジュゲートされ、前記MHC標的及び前記免疫原性ペプチド(例えば、Tヘルパーエピトープ)が特異的にPAPCに結合するように、Tヘルパーペプチド(例えば、PADREペプチド及びインフルエンザHAのようなエピトープ)のようなMHC標的で免疫原性のペプチド、及び、少なくとも1つのペプチド若しくはポリペプチド抗原か、又は少なくとも1つの抗原をエンコードする少なくとも1つの核酸かを、コンジュゲート又は結合したデンドリマーのような、少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体を含む。前記少なくとも1つのTヘルパーペプチドと、少なくとも1つのデンドリマーと及び少なくとも1つのペプチド若しくはポリペプチド抗原か又は前記少なくとも1つの抗原をエンコードする少なくとも1つの核酸の組み合わせは、ヘルパーT細胞の活性化を仲介するMHCクラスIIの誘導を含む、少なくとも1つの抗原に対する免疫応答を誘導することができる。さらに、ワクチンは油中水型乳剤を含む場合がある。ワクチンを前記哺乳類に投与することは、抗原に対するモノクローナル抗体の産生をもたらす。デンドリマー上か又はデンドリマー内に示された本明細書に記載されている抗原(Antigen)又は抗原類(antigens)は、さまざまな病原体の状態によって惹起された疾患に対する免疫応答を誘導する。1つの実施態様では、前記抗原は病原性細菌、真菌、又はウイルス性生物、レンサ球菌種、カンジダ種、ブルセラ種、サルモネラ種、シゲラ種、シュードモナス種、ボルデテラ種、クロストリジウム種、ノーウォークウイルス、炭疽菌、結核菌、ヒト免疫不全ウイルス(HIV)、クラミジア種、ヒトパピローマウイルス、インフルエンザウイルス、パラミクソウイルス種、ヘルペスウイルス、サイトメガロウイルス、水痘・帯状疱疹ウイルス、EBウイルス、肝炎ウイルス、マラリア原虫種、トリコモナス種、性感染症病原体、ウイルス性脳炎病原体、原虫疾患病原体、真菌疾患病原体、細菌疾患病原体、がん細胞、又はこれらの混合物に由来する場合があるがこれらに限られない。
【0082】
前記少なくとも1つのデンドリマーはさらにポリイノシンポリシチジン酸(Poly(I:C))へコンジュゲートされることができ、前記ワクチン又は組成物はさらに薬学的に許容可能な担体を含むことができる。1つの実施態様では、例えば、配列番号1のアミノ酸配列を各々有する2つのPan−DRエピトープのように、前記少なくとも1つのTヘルパーエピトープがPan−DRエピトープである。もう1つの実施態様では、前記TヘルパーエピトープはインフルエンザHAである。前記Tヘルパーエピトープは、しかし、CD4+Tヘルパー細胞の活性化をする又はTヘルパー細胞の活性化に寄与するいずれかのエピトープであることができる。CD4+Tヘルパー細胞のTヘルパーエピトープ活性化はCD8T細胞の増殖及び刺激と、B細胞による抗体産生とが必要とされ、その両方が感染性病原体又はがんに対する防御免疫応答の誘導に必要不可欠である。前記デンドリマーが抗原をエンコードする核酸にコンジュゲートされるある実施態様では、前記核酸は一般的に発現ベクターである。前記発現ベクターは、前記抗原をエンコードする遺伝子と、クローニング部位と、ポリアデニル化配列と、選択可能なマーカーと及び細菌の複製開始点とに操作可能に連結された真核細胞プロモーターを含むのが典型的である。一般的に、前記抗原は、がん抗原か又は感染性病原体からの抗原かが典型的である。前記少なくとも1つのデンドリマーは一般的にG5デンドリマーである。同様に、前記デンドリマーがペプチド又はポリペプチド抗原にコンジュゲートされる実施態様では、前記抗原は、一般的にがん抗原か又は感染性病原体からの抗原かであり、前記少なくとも1つのデンドリマーはG5デンドリマーである。いくつかの実施態様では、アジュバントが前記ワクチン又は組成物に取り込まれる場合がある。
【0083】
デンドリマーはDNA(及びDNA、RNA、siRNA、microRNA、RNAi等を含むその他の核酸)を細胞内へ送るのに有効な担体である。しかし、ワクチン送達プラットフォームとして、デンドリマーは従来複数の理由のため欠陥があった。最初に、デンドリマーはアジュバント活性を欠如している;これらは自然免疫の有効な刺激を欠如しており、これらは「危険信号」を生成しない。また、デンドリマーは弱いAPCの標的しか提供せず、一般的に、これらは弱い獲得免疫の刺激しか提供しない。特に低い免疫原性又は「自己」抗原若しくは免疫系が寛容を獲得した「自己」抗原と高い相同性を有する抗原を扱う際に、PAPCを特異的に標的にし、「危険信号」を誘導し、注入部位にプロフェッショナル単核球を動員し、かつ、安全な強いアジュバント入りワクチン送達システムが非常に所望される。弱い抗原又は低い免疫原性を有するそれらは、無及び低レベルの特異的な免疫応答か、抗体応答か、又は細胞に仲介される免疫応答かをもたらす。本明細書に記載される前記ワクチンプラットフォームは、DNA又はペプチド又はポリペプチド抗原と複合体化された(コンジュゲートされた)生分解性ナノ粒子である。前記プラットフォームは、そのMHCクラスIIリガンドを介してPAPCを標的にし、結合し、及び高陽荷電性外膜により前記細胞膜を透過し、大量産生のためのスケールアップが安全かつ容易であり、及び分子上の修飾性により強力なアジュバントとして作用する。典型的な実施態様では、前記少なくとも1つのデンドリマーは、多分枝ポリマー高分子であり、その増強された可溶性のため理想的な添加剤であるG5 PAMAMデンドリマーである。G5は、特に、細胞内への前記DNAの送達に理想的である。本明細書に記載される典型的なワクチンは、前記注入部位への単核球の動員をもたらす一過性危険信号を誘導する油中水型乳剤を含む。DNAを取り上げ、これらの細胞は、所属リンパ節に移動し、抗原を提示するであろう。前記MHCクラスII分子の側面(flank)に結合する、例えば、PADREのような普遍的なTヘルパーアゴニストの包含は、PAPCへのデンドリマー複合体とヘルパーT細胞のオプソニン化をもたらす。この変化は不活性及び弱いデンドリマーを前記発現した関心抗原の強い免疫エンハンサーに変える。またアジュバント活性と持効性効果の両方を有する疎水性担体、すなわち、油性乳剤(例えば、Montanide ISA 720)を含むことは、抗原の遅延性放出をもたらす。Poly(I:C)を含むことは、さらに関心抗原に対する免疫応答の誘導を増大する。Poly(I:C)は正味の陰荷電を有するため、それは都合よくデンドリマーに結合し、免疫応答の強さを増大するアジュバントである。これらの特徴は強い「危険信号」として作用し、注入部位へさらに単核球(APCを含む)を動員する。併せて、これらの特徴は自然免疫を刺激し、有効な免疫応答の誘導のために必要とされる炎症誘発性サイトカイン環境の増大された発現をもたらす。
【0084】
ワクチンの1つの実施態様では、前記TヘルパーペプチドはPADREエピトープであり、及び前記デンドリマーはPADREで誘導体化されている。PADREは前記MHCクラスIIの大部分と結合する人工的に設計されたペプチドであり、そして、デンドリマー(例えば、PADREで誘導体化されたデンドリマー)とコンジュゲートされたPADREペプチドは、結果として生じる複合体又は高レベルのMHCクラスIIを発現するPAPCのためのリガンドのコンジュゲート体を作製する。この複合体は、従って、MHCクラスII又はPAPCを発現する細胞に高い親和性を有する普遍的に標的付けられたワクチン送達システムになる。PADREもまたTヘルパー細胞を活性化し、炎症誘発性サイトカインの環境をもたらし、そして、前記注入部位へその他の免疫細胞を動員する。デンドリマー、PADREを組み合わせることで、さらに「危険信号」を誘導することによる前記抗原の取り込みが増大する。PADREで誘導体化されたデンドリマーは現在既知のワクチンに対し複数の利点を提供する。最初に、G5デンドリマーは、結合し細胞膜非常に効果的に入り、前記タンパク質の強い発現をもたらす高荷電生分解性分子である。第二に、PADREは、多くのマウス及びヒトMHCクラスII分子と結合する普遍的なTヘルパーエピトープである。それは合成の非天然Tヘルパーエピトープ[AKchxAVAAWTLKAAA(配列番号:26)(chxA=シクロヘキシルアラニン)]である。前記デンドリマーの表面に融合する際に、PADREは主に全てのPAPCを含むMHCクラスIIを有する細胞を結合し、活性化するであろう。複数のPADREエピトープ(例えば、2、3、4、5個等)が各デンドリマーに不着することができる。前記付着は、その免疫原性性質が生じる前記ペプチド結合する性質を維持する適切なスペーサーとともになされる。リンカー又はスペーサー分子は、本明細書に記載される前記デンドリマーコンジュゲート体と抗原又はその他の分子をコンジュゲートするのに用いられる場合がある。スペーサーは、AAA、KK、GS、GSGGGGS(配列番号:27)、RS、又はAAYを含むアミノ酸の組み合わせのいずれかの場合がある。本明細書で用いられるところの、「リンカー」又は「スペーサー」という用語は前記デンドリマーと例えば前記MHCクラスIIリガンドか、CD4+Tヘルパーエピトープか、ポリペプチドか、又は前記デンドリマー(例えば、PADRE−デンドリマー)及び前記表面に曝露された分子にコンジュゲートされるか又は結合されるかの治療剤のような前記表面に曝露された分子との間に挿入する化学官能基を意味する。好ましくは、リンカーが1つの末端で前記表面分子に、及びそれらのその他の末端で前記ナノ粒子(例えば、PADRE−デンドリマー)にコンジュゲートされる。連結は同種又は異種2官能基剤、すなわち、SPDP、DSS、SIABのいずれかに、行われる場合がある。連結方法はde Jonghらの国際出願DK00/00531(WO01/22995)号公報で開示されており、各内容は引用により全体として本明細書に取り込まれる。
【0085】
第三に、前記ワクチンもまた油中水型乳剤を含む実施態様において、前記油中水型乳剤は前記注入部位への前記単核球の動員をもたらす一過性の「危険信号」を誘導する。DNAを拾うこれらの細胞は、領域リンパ節に移動し、抗原を提示するであろう。さらに、免疫応答誘導をさらに増大するために、合成2本鎖RNA(dsRNA)、poly(I:C)は前記デンドリマー(例えば、PADRE−デンドリマー)に結合する場合がある。PoIy(I:C)は、正味の陰荷電を有し、従って、デンドリマーへ都合よく結合され得るトル様受容体3(TLR−3)作動薬である。Poly(I:C)は、アジュバントであり、その正味の陰荷電により、前記デンドリマーへ結合し、前記免疫応答の強さを増大するであろう。Poly(I:C)のデンドリマーへの結合は、それが前記注入の頻度と及び注入間のインターバルを減らすため、前記モノクローナル抗体の産生(以下に記載される)において、特に有用である。
【0086】
本明細書に記載されている抗原をエンコードする核酸分子は、RNA(例えば、mRNAか、microRNAか、siRNAか、shRNAか又は合成化学的に改変されたRNA)の形態か又はDNA(例えば、cDNAと、ゲノムDNAと、及び合成DNA)の形態である場合がある。前記DNAは2本鎖か又は1本鎖かである場合があり、1本鎖の場合、コード(センス)鎖か又は非コード(アンチセンス)鎖である場合がある。1つの実施態様では、核酸は、不死化されたか、又は原発腫瘍の細胞株から、単離又は増幅されたRNA分子であることができる。
【0087】
上記に記載されているように、1つの実施態様では、免疫応答の誘導のためのワクチンは、前記結果として生じる複合体が前記抗原に対する免疫応答を誘導するコンジュゲートされた少なくとも1つのTヘルパーエピトープ、及び、抗原をエンコードする核酸を有する少なくとも1つのデンドリマーを含む。これらの組成物及び方法は、例えば、ウイルスベクターか又はイン・ビボ電気穿孔法の使用を必要とするその他の遺伝子免疫法と比較して、非常に安全で、簡単で、速い。液性又は細胞免疫応答の誘導のための前記DNAの使用は、複数の利点を有する。最初に、DNAの使用は、天然にプロセシングされたエピトープの完全なスペクトルを提供する。また、Tヘルパーエピトープ及び抗原をエンコードする核酸にコンジュゲートされたデンドリマーは、全ヒトMHC(AKA、HLA)の95%を超えるAPCを標的とする普遍的なワクチンの送達を提供し、精製が課題のタンパク質の精製の必要性を除去する。かかるタンパク質は、多タンパク質複合体の一部であることができ、膜タンパク質であることが可能であり、不正確に折りたたまれており、不溶性であることができる。本明細書に記載されている、前記デンドリマーコンジュゲート体は、タンパク質のグリコシル化又は翻訳後修飾を必要とせず、それらはタンパク質構造又は折りたたみの干渉にタグ付けし、劇的なコスト及び時間の節約を提供する。PADRE−デンドリマーが、マウス、ヒヒ及びヒトからのPBMCへ核酸を標的づけし送達するという事実は、このプラットフォームをマウスから非ヒト霊長類、及びヒトへの急速なトランスレーショナルリサーチの理想的な候補にする。
【0088】
また上記に記載されたように、もう1つの実施態様では、免疫応答の誘導のためのワクチンは、油中水型乳剤及び、前記少なくとも1つのTヘルパーエピトープと及び前記ペプチド若しくはポリペプチド抗原とが前記デンドリマーの外部表面にコンジュゲートされ、前記ペプチド若しくはポリペプチド抗原に対する免疫原性を誘導することができる少なくとも1つのTヘルパーペプチド(例えば、前記PADREペプチド又はインフルエンザHAのようなエピトープ)及びペプチド若しくはポリペプチド抗原にそれとコンジュゲートされた少なくとも1つのデンドリマーを含む。弱い抗原性を有するペプチド又はポリペプチドが、本明細書に記載されているTヘルパーエピトープ/デンドリマー複合体にコンジュゲートされた(複合体化された)ときに、強い免疫応答を誘導する。正味の陰荷電を有するポリペプチド及びペプチドは、例えば、共有結合によるコンジュゲートの必要なくPADRE−デンドリマーと複合化する場合がある。例えば、PADRE−デンドリマーのような油中水型乳剤は、さらにアジュバント活性及び持効性の効果をもたらす。
【0089】
上述のように、本明細書に記載されている前記組成物及びワクチンは、予防上及び治療上の用途の両方を有する; これらは、被験体における疾患又は症状の発症を防ぐための予防として用いられこともでき、疾患又は症状を有する被験体を治療するために用いられる場合もある。本明細書に記載のワクチンは、感染性病原体又はがんのいずれかに対する免疫応答を備え付けるために用いられることもできる。感染性病原体の例は、例えば、インフルエンザ、HIV、デングウイルス、ロタウイルス、HPV、HBV、HCV、CMV、HSV、HZV、及びEBVのようなウイルスを含み、熱帯マラリア原虫、四日熱マラリア原虫、卵形マラリア原虫、三日熱マラリア原虫及びサルマラリア原虫といったマラリア原因病原体を含む病原性病原体;大形リーシュマニア、熱帯リーシュマニア、エチオピアリーシュマニア、メキシコリーシュマニア、ドノバンリーシュマニア、幼児リーシュマニアシノニムシャーガスリーシュマニア(L.infantumsyn.L.chagas)といったリーシュマニア原因病原体を含む病原性病原体;炭疽菌、百日咳菌、肺炎球菌、及び髄膜炎菌含む病原性細菌などを含むがこれらに限られない。本明細書に記載されている実験において、PADRE−デンドリマーは、マウスにおける確立したメラノーマ腫瘍を根絶させた。しかし、本明細書に記載されているTヘルパーエピトープ及び抗原又は抗原をエンコードする核酸にコンジュゲートされた前記デンドリマーは、いかなるがんに対する特定の免疫応答を備え付けるために用いられる場合がある。追加のがんの例は、HPV誘導子宮頸がん(例えば、抗原(TAA)に関連したE7/E7腫瘍又はこれらの抗原をエンコードするプラスミドが、本明細書に記載されている前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化することができる)、ヒトメラノーマ(例えば、TRP−I、TRP−2、gp−100、MAGE−I、MAGE−3及び/又はp53は、TAAとして用いられ、本明細書に記載されている前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化できる)、及び前立腺がん(例えば、TSAは、TAAとして用いられ、本明細書に記載される前記Tヘルパーエピトープ/デンドリマー(例えばPADRE−デンドリマー)と複合体化される場合がある)を含む。同様に、肺腫瘍、乳房腫瘍、及び白血病について、いずれか適切なTAAが用いることが可能であり、多くが記載されている。かかるTAAの多くは、さまざまながん(例えば、CEA、MUC−1、Her2、CD20)の間で共通である。かかる抗原をエンコードするTAA又はプラスミドの混合物は、本明細書に記載されている普遍的な、多重使用がんワクチンを作製するために用いられる場合がある。本明細書に記載されている1つのワクチンの例において、CD4エピトープ/デンドリマー(例えば、PADRE−デンドリマー)は、1種類より多い抗原又は1種類より多い前記抗原をエンコードするプラスミドと複合体化される場合がある。代替的に、1つの抗原か又は1つの抗原をエンコードする1つのプラスミドと各々複合体化された複数のワクチンは、さまざまな病原体又はさまざまながんの1つのワクチンとして混合され用いられる場合がある。
【0090】
哺乳類への抗原送達方法及び免疫応答誘導
哺乳類(例えば、ヒト)へ抗原を送達する方法と、及び前記哺乳類における免疫応答の誘導のための前記抗原に対するモノクローナル抗体の産生を誘導する方法とが本明細書に記載されている。典型的な方法は、少なくとも1つのMHC標的ペプチドかつ免疫原性のペプチド(例えば、Tヘルパーエピトープ)がPAPCに特異的に結合するように、前記少なくとも1つのTヘルパーペプチド及び前記少なくとも1つの核酸、又は少なくとも1つのペプチド抗原若しくはポリペプチド抗原が、前記少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の前記外部表面へコンジュゲートされることを特徴とし、MHC標的ペプチド及び免疫原性ペプチド(例えば、TヘルパーペプチドPADREペプチド又はインフルエンザHA等)及び少なくとも1つのペプチド若しくはポリペプチド抗原又は前記少なくとも1つの抗原をエンコードする少なくとも1つの核酸をコンジュゲートした少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)を含む組成物の前記哺乳類への投与のステップを含み、前記少なくとも1つのMHC標的ペプチド及び免疫原性ペプチド(例えば、Tヘルパーエピトープ)、少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えばデンドリマー)、及び前記少なくとも1つの核酸又は少なくとも1つのペプチド若しくはポリペプチド抗原の組み合わせが、前記抗原に対する免疫応答を誘導することができる。前記方法において、前記組成物は、MHCクラスIIを介するヘルパーT細胞の活性化を誘導するために有効な量で投与され、モノクローナル抗体の産生、及び前記哺乳類の前記抗原に対する免疫応答をもたらす。組成物は、さらに油中水型乳剤を含む場合がある。前記少なくとも1つのデンドリマーは、さらに、典型的には、Poly(I:C)にコンジュゲートされ、前記組成物はさらに典型的に薬学的に許容可能な担体を含む。前記少なくとも1つのTヘルパーエピトープは、例えば、前記配列番号:1のアミノ酸配列を各々有する2つのPan−DRエピトープのような、Pan−DRエピトープが可能である。代替的に、前記少なくとも1つのTヘルパーエピトープは、例えば、インフルエンザHAのような、Pan−DRエピトープ(PADREエピトープ)以外が可能である。一般的に、前記少なくとも1つのデンドリマーは、G5デンドリマーである。
【0091】
1つの実施態様では、前記哺乳類はがん抗原を有し、前記抗原はがんであり、抗原及び前記組成物は前記がんに対するワクチンである。もう1つの実施態様では、前記哺乳類は感染性疾患を有し、前記抗原は感染性病原体からの抗原であり、前記組成物は、前記感染性病原体に対するワクチンである。かかる実施態様において、前記組成物の投与は、一般的に、前記哺乳類において局所的な副作用をもたらさない。前記組成物(例えば、ワクチン)を前記哺乳類の外側で処方することと、及び、例えば、前記哺乳類におけるがん抗原又は感染性病原体からの抗原のような抗原に対する免疫応答を刺激するために十分な量で、前記哺乳類に前記組成物を投与することとによって、かかる方法は一般的に行われる。本明細書に記載されている前記組成物、ワクチン及び方法は、例えば、哺乳類(例えば、ヒト、げっ歯類、イヌ、ネコ、ヤギ、ヒツジ、ウシ、ウマ等)のような動物の適切ないかなる被験体に利用することができる。がん又は感染性疾患に苦しんでいるか、又はがん又は感染性疾患の発症の危険にさらされているヒトの患者が典型的な被験体である。
【0092】
siRNAをPAPCに送達するための組成物及び方法
またsiRNAをPAPCに送達するための組成物及び方法が本明細書に記載されている。典型的な実施態様において、siRNAをPAPCに送達するため組成物は、少なくとも1つのMHC標的ペプチドと、免疫原性ペプチド(例えば、Tヘルパーペプチド)と、及びsiRNAがコンジュゲートされた少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)を含む。前記少なくとも1つのMHC標的ペプチドと、及び免疫原性ペプチド(例えば、Tヘルパーエピトープ)と、及び前記siRNAとは、前記少なくとも1つのTヘルパーエピトープがPAPCへ特異的に結合するように、前記少なくとも1つの荷電性(例えば、陽荷電性)ポリマー担体(例えば、デンドリマー)の前記外部表面にコンジュゲートされる。前記siRNAは、関心遺伝子のいずれか(例えば、FoxP3、CD−28、CTLA−4)に(特異的に)向けることができる。前記組成物は、さらに油中水型乳剤を含むことが可能である。
【0093】
siRNAをPAPCに送達する典型的な方法は、前記少なくとも1つのTヘルパーペプチドがPAPCに特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、及び前記少なくとも1つのsiRNAとが、前記デンドリマーの前記外部表面にコンジュゲートされることを特徴とする、少なくとも1つのTヘルパーペプチド、及び少なくとも1つのsiRNAとをコンジュゲートした少なくとも1つのデンドリマーを含む組成物を提供し; 前記少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートした少なくとも1つのデンドリマーがPAPCに結合し、前記siRNAが前記PAPCに入り前記PAPC内で発現する条件で、哺乳類被験体へ前記組成物を投与するステップを含む。前記組成物は、さらに油中水型乳剤を含むことができる。前記方法において、前記siRNAは、前記関心遺伝子の発現を抑制するために、いかなる(特異的な)関心遺伝子(例えば、FoxP3)に対して向かわせることができる。1つの例において、FoxP3に対して向けられたsiRNAは、免疫応答を抑制し、免疫応答の負の制御として作用する細胞である、制御性T細胞の誘導をもたらす分子である、FoxP3の発現を抑制するために用いられる。この実施態様は、制御性T細胞が免疫療法及び介入を抑制している場合に、がん治療のための特定の使用を見出すことができる。制御性T細胞は、MHCクラスIIを発現し、PADRE−デンドリマー又はその他のCD4エピトープ−デンドリマーを介して標的化することができる。その他の例は、T細胞上の、T細胞へ抑制性シグナルを伝達するCTLA−4である。CTLA−4に特異的なsiRNAがPADRE−デンドリマーと複合体化するようなある実施態様では、前記複合体は、CD4T細胞を含むMHCクラスII発現細胞を標的化し、前記CTLA−4発現を抑制する。前記CTLA−4の発現が低いほど、前記病原体又はがんに対する免疫応答が高くなり、PAPCの中へ送達された際は、(病原体、がんに対する免疫応答を増大するために、又は、宿主がワクチン接種される場合に)免疫応答を抑制するか,又は、例えば乾癬のような自己免疫疾患の治療のためのB7.1、LFA−3、ICAM−I(T細胞活性化に必要なシグナル2誘導因子)を含む免疫応答を増大する分子の発現を防止又は低下する。
【0094】
典型的な実施態様において、本明細書に記載される組成物は、共抑制及び共刺激分子及びそれらの仮想共刺激受容体(例えば、FoxP3、CD28CTLA−4)に特異的なsiRNAを含む。配列−特異的siRNAは、標的核酸分子に結合し、その発現を抑制する。siRNAは、異常細胞、異常細胞増殖、及び感染性疾患病原体により惹起される腫瘍を含む腫瘍の治療に有効である。siRNAの送達のための組成物及びその治療方法が提供される。
【0095】
リボザイム、siRNA及びアンチセンス分子を構築し使用する方法は、当業者に知られている(例えば、Isaka Y.、Curr Opin Mol Ther vol.9: 132−136,2007;Sioud M.and Iversen P.O.、Curr Drug Targets vol.6:647−653,2005;Mouldy Sioud著、Ribozymes and siRNA Protocols (Methods in Molecular Biology)、2nd ed.、2004,Humana Press、New York、New York)。「アンチセンス」核酸は、例えば、2本鎖cDNA分子のコード鎖と相補的、又はmRNA配列と相補的であるように、タンパク質をエンコードする「センス」核酸と相補的であるヌクレオチド配列を含むことができる。前記アンチセンス核酸は、関心遺伝子の全てのコード鎖か、又はその一部のみと相補的であることができる。もう1つの実施態様では、前記アンチセンス核酸分子は、関心遺伝子をエンコードするヌクレオチド配列(例えば、5’及び3’非翻訳領域)のコード鎖の「非コード領域」をアンチセンスする。アンチセンス剤は、例えば、約8ないし約80の核酸塩基(すなわち約8ないし約80のヌクレオチド)、例えば、約8ないし約50の核酸塩基、又は約12ないし約30の核酸塩基を含むことができる。アンチセンス化合物は、標的核酸にハイブリダイズしてその発現を調節するリボザイム、外部誘導配列(EGS)オリゴヌクレオチド(オリゴザイム)、及びその他の短い触媒性RNAまたは触媒性オリゴヌクレオチドを含む。アンチセンス化合物は、前記標的遺伝子(すなわち、関心遺伝子)における配列と相補的である少なくとも8個の連続した核酸塩基の伸長を含むことができる。オリゴヌクレオチドは、特異的にハイブリダイゼーション可能であるその標的核酸配列と100%相補的である必要はない。オリゴヌクレオチドは、前記標的への前記オリゴヌクレオチドの結合が、標的分子の正常機能を阻害し利用性喪失をもたらし、そして、例えば、イン・ビボアッセイか、又は治療的処置の場合における生理的条件と、アッセイが行われる場合の条件下でのイン・ビトロアッセイのような、特異的結合が所望される条件で、標的でない配列に対する前記オリゴヌクレオチドの非特異的な結合を回避するのに十分な相補性の程度の場合に、特異的にハイブリダイゼーション可能である。
【0096】
RNA干渉(RNAi)は2本鎖RNA(dsRNA、また、低分子干渉RNAはsiRNAとして本明細書に言及され、又は2本鎖低分子干渉性RNAはds siRNAとして本明細書に言及される)が動物および植物細胞において相同的なmRNAの配列特異的分解を誘導する非常に有効なプロセスである(Hutvagner and Zamore、Curr.Opin.Genet.Dev.、12:225−232(2002);Sharp、Genes Dev.、15:485−490(2001))。哺乳動物細胞において、RNAiは、低分子干渉RNA(siRNA)の二重鎖(Chiuetal、MoI.細胞、10:549−561(2002); Elbashirら、Nature,411:494−498(2001))、又はRNAポリメラーゼIIIプロモーターを有するDNAの鋳型を用いてイン・ビボで発現するマイクロRNA(miRNA)、機能的小ヘアピンRNA(shRNA)、若しくはその他のdsRNA(Zengら、Mol.Cell、9:1327−1333(2002); Paddisonら、Genes Dev.、16:948−958(2002); Lee et al.、Nature Biotechnol.、20:500−505(2002);Paulら、Nature Biotechnol.、20:505−508(2002);Tuschl T.、Nature Biotechnol.、20:440−448(2002);Yuら、Proc.Natl.Acad.Sci.USA、99(9):6047−6052(2002);McManusら,RNA、8:842−850(2002);Suiら、Proc.Natl.Acad.Sci.USA、99(6):5515−5520(2002))によって引き起こすことができる。
【0097】
前記dsRNA分子は、各鎖に例えば16、17、18、19、20、21、22、23、24、25、26、27、28、29、または30ヌクレオチドなど約16乃至30の長さを典型的に含み、前記鎖の1つがmRNAにおける標的領域に対して実質的に同一、例えば少なくとも80%(またはそれを超える、例えば85%、90%、95%、または100%)同一であって、例えば3、2、1または0のミスマッチヌクレオチドを有し、もう片方の鎖は第1の鎖と同一又は実質的に同一である。各鎖もまた、例えば、dTdTdTのような1、2、3、4個、又はそれ以上のオーバーハングヌクレオチド1個又は2個以上のオーバーハング(すなわち、非相補的)ヌクレオチドを有する場合がある。
【0098】
前記dsRNA分子は化学的に合成でき、又はDNAの鋳型からイン・ビトロで転写でき、又は例えば、shRNAからイン・ビボで転写できる。前記dsRNA分子は、当業者に知られている方法のいずれかを用いて設計できる;多数のアルゴリズムが当業者に知られており、例えば、Tuschlら、Genes Dev 13 (24):3191−7(1999)を参照のこと、及び多くはインターネット上で利用可能である。
【0099】
陰性対照siRNAは、典型的には、選択されたsiRNAと同一ヌクレオチド組成を有するが、適切なゲノムに意味のある相補配列を有さない。かかる陰性対照は、選択されたsiRNAのヌクレオチド配列をランダムにスクランブルすることにより設計することができる;相同性検索は、前記陰性対照が、適切なゲノムにおいて、他の遺伝子のいずれに対しても相同性を欠失していることを確認するために行うことができる。さらに、陰性対照siRNAは、配列に1個又は2個以上の塩基ミスマッチを導入することによって設計することができる。いくつかの実施態様では、siRNAは、ヌクレアーゼへの耐性を前記siRNAに作るために、修飾ヌクレオチド(例えば、2F−RNA)を用いて生成できる。
【0100】
抗体作製のための方法及びキット
治療又は予防を目的として被験体へ投与することができる抗体を作製するための組成物と、キットと、及び方法とが、本明細書に記載される。細胞内へのDNA送達の現在の方法は非効率的であり、複雑であり、及び免疫応答をほとんど誘導しない。しかしながら、本明細書に記載される前記組成物及び方法は、関心抗原の急速及び高い発現を示す強い抗体応答をもたらす。本明細書に記載されるデンドリマー/Tヘルパーペプチドコンジュゲート体(例えば、PADRE−デンドリマー)は、抗体を作製する方法において、ペプチド又はポリペプチド又は核酸(例えば、DNA)と複合体化(コンジュゲート体化)可能である。Poly(I:C)のデンドリマーへの結合は、頻度及び注入インターバルを減らすため、前記モノクローナル抗体の産生に特に有用である。以下に記載される実験において、DNAとの複合体化PADRE−デンドリマーの単回注入後、強い液性応答と同様に角膜及び皮膚へのGFPの送達及び発現が示された。現在の薬剤の50%は精製が最も難しい膜タンパク質標的を標的にしている。本明細書に記載される組成物、キット、及び方法は、それらを精製することなく、かかる難精製タンパク質を標的にするための手段を提供する。
【0101】
ポリクローナル抗体は、免疫された動物の血清に含まれる不均一な抗体分子の集団である。本明細書に記載される組成物、キット、及び方法を用いて生成することができる抗体は、従って、ポリクローナル抗体、さらに、モノクローナル抗体、一本鎖抗体、Fab断片、F(ab’)2断片、及びFab発現ライブラリを用いて生成された分子を含む。特定の抗原に対する抗体の均一な集団であるモノクローナル抗体は、本明細書に記載されるデンドリマー/Tヘルパーエピトープコンジュゲート体及び標準ハイブリドーマ技術を用いて調製することができる(例えば、Kohlerら、Nature 256: 495,1975; Kohlerら、Eur.J.Immunol. 6:511、1976; Kohlerら、Eur.J.Immunol. 6:292、1976; Hammerlingら、「Monoclonal Antibodies and T Cell Hybridomas」、 Elsevier、N.Y.、1981; Ausubelら、上記を参照のこと)。特に、例えばKohlerら、Nature 256:495、1975、及び米国特許4376110号公報; ヒトB細胞ハイブリドーマ技術(Kosborら、Immunology Today 4:72、1983; Coleら、Proc.Natl.Acad.Sci.USA 80:2026、1983),及びEBVハイブリドーマ技術(Coleら、 「Monoclonal Antibodies and Cancer Therapy」、Alan R.Liss、Inc.、pp.77−96、1983)などで記載される培養継続細胞株による抗体分子産生を提供する技術のいずれかによって、モノクローナル抗体を得ることができる。かかる抗体は、IgG、IgM、IgE、IgA、IgDのいずれか、及びそのサブクラスのいずれかを含む免疫グロブリンクラスである。本明細書に記載されるmAbを産生するハイブリドーマは、イン・ビトロ又はイン・ビボで培養される場合がある。イン・ビボでのmAbの高タイター生成能力に対して、本明細書に記載されている組成物、キット、及び方法は、mAb産生で特に有用である。
【0102】
抗原又はタンパク質をエンコードする核酸(例えば、プラスミドDNA又はmRNA)は、i)単調で及び/又は高価な及び/又は適時のタンパク質精製ステップの除去、ii)従来のタンパク質精製から生じるタンパク質非天然型の感作を打ち消す宿主の細胞機構によるイン・ビボでのタンパク質の天然型の発現、及びii)タンパク質又は抗原の自然/天然型を標的とする治療用モノクローナル抗体作製のための理想的な方法、の利点を提供するため、デンドリマー/Tヘルパーペプチド(例えば、PADRE−デンドリマー)が、タンパク質又は抗原をエンコードする核酸と複合化(コンジュゲート化、又は結合)する本明細書記載の組成物、キット、及び方法は、タンパク質又は抗原の精製の必要性を否定する。
【0103】
特定の抗原に対するヒト抗体は、例えばマウスのような動物においてヒト抗体を産生するための公知の技術の適用によって作製できる。例えば、Fishwild、D.M.ら、Nature Biotechnology 14 (1996):845−851; Heijnen、I.ら、Journal of Clinical Investigation 97(1996):331−338; Lonberg N.ら、Nature 368(1994):856−859; Morrison S.L.、Nature 368(1994):812−813; Neuberger M.、Nature Biotechnology 14(1996):826; 及び米国特許第5545806; 5569825; 5877397; 5939598; 6075181; 6091001; 6114598; 及び6130314号公報を参照のこと。例えば米国特許第5530101、5585089、5693761、及び5693762号公報に記載されているように、特定の抗原に対するヒト型又はヒト化抗体は、公知の方法の適用により非ヒト抗体から作製可能である。
【0104】
一度生成されると、ポリクローナル又はモノクローナル抗体は、例えば、Ausubelらによって上記に記載されているように標準的な方法又はその他の適切な方法によるウエスタンブロット、免疫沈降分析によって特定の抗原認識についてテスト可能である。抗血清は、一連の注入により産生可能であり、少なくとも3回の追加免疫注入を含む一連の注入が好ましい。
【0105】
特定のエピトープを認識し、及び特定のエピトープと結合する抗体断片が、公知技術により生成可能である。例えば、かかる断片は、前記抗体分子のペプシン消化により生成可能なF(ab’)2断片、及びF(ab’)2断片のジスルフィド架橋の還元により生成可能なFab断片を含むがこれらに限られない。代替的に、急速な及び容易な所望の特異性を有するモノクローナルFab断片の同定を可能にするための、Fab発現ライブラリが構築可能である(Huseら、Science 246:1275、1989)。
【0106】
哺乳類へ抗原を送達し、哺乳類で抗体取得を目的とする抗原に対するモノクローナル抗体産生を誘導する典型的な方法は、少なくとも一つのTヘルパーペプチドが特異的にPAPCに結合し、少なくとも一つのTヘルパーペプチド、少なくとも一つのデンドリマー、及び、核酸又はペプチド若しくはポリペプチド抗原が抗原に対する免疫応答を誘導可能であるように、少なくとも一つのTヘルパーペプチド及び核酸又はペプチド若しくはポリペプチド抗原が少なくとも一つのデンドリマーの外部表面にコンジュゲート化されることを特徴とし、少なくとも一つのTヘルパーペプチド及びペプチド若しくはポリペプヂド抗原又は抗原をエンコードする核酸をコンジュゲートした少なくとも一つのデンドリマーを含む組成物の投与を含む。本方法において、前記組成物は、MHCクラスIIを介するヘルパーT細胞活性化の誘導に有効な量で投与され、前記抗原に対するモノクローナル抗体の産生をもたらす。マウスにおける抗体産生の方法において、上記に記載されているように、前記マウスは、抗原で免疫後、1匹又は2匹以上のマウスから抗体が採取され、高タイターについてスクリーニングされる。高タイターのマウスが選択され、このマウスから脾臓が摘出される。そして骨髄腫との融合が行われ、最もよく結合するクローンについてのスクリーニングが行われる。
【0107】
また本明細書に記載されているキットは、タンパク質精製の必要性を除去する抗原への抗体(例えば、モノクローナル抗体)を作製するためのものである。典型的なキットは、本明細書に記載されている複数のデンドリマー/Tヘルパーペプチド複合体(コンジュゲート体)(例えば、PADRE誘導体化デンドリマー、インフルエンザHAコンジュゲートデンドリマー等)と、及び典型的にpHが7.4の生理緩衝液とを含む容器を含む。緩衝液又は培地の1つの例において、該緩衝液又は培地は、HEPES及び重炭酸ナトリウムで緩衝され、並びに、ヒポキサンチン、チミジン、ピルビン酸ナトリウム、L−グルタミン、及び10%未満のウシ血清アルブミン又は、エンドトキシンレベルが1.0EU/ml未満である、塩化カルシウム100mg/lを有するインスリン及び/又はトランスフェリンを含む個体血清タンパク質で補充されたイーグル最小必須培地を含む。本実施態様において、前記キットの使用者は、100−200μg/mlの前記緩衝液で、1つの抗原をエンコードする少なくとも1つの核酸(例えば、DNAプラスミド)を希釈し、穏やかに震とうしながら、前記組成物(Tヘルパー−デンドリマー)を前記希釈されたプラスミドDNAに加える。典型的な実施態様において、TプラスミドDNA中のヘルパー−デンドリマーの割合は10:1で使用され(N:P)、概ねDNAプラスミド1(重量)に対して組成物が7(重量)である。1つの実施態様では、以下の条件が続く。室温で10分間インキュベーション後、前記プラスミド−DNA/組成物10−20μgを含む前記混合物100μlが、マウスに皮下注射される。14日後の同様の追加免疫、モノクローナル抗体についての、一次スクリーニング、融合及び最終スクリーニングの標準的な方法が続く。核酸に加えて、本明細書に記載されている前記組成物及びキットは、タンパク質又は抗原とコンジュゲートされる場合がある。かかる実施態様において、タンパク質中の前記組成物についての10:1の同一割合が、典型的に前記複合体形成をもたらす。本明細書に記載されているキットに含まれる取扱説明書は、適切な割合、緩衝液の作製、及び最適化並びに必要な際のトラブルシューティングのプロトコールを記載する。本明細書に記載されている、PADRE−デンドリマーコンジュゲート体を有するプラスミドDNA又はタンパク質/抗原の複合体化は、一般的に、PBSを含む生理緩衝液の生理学的pHで緩衝された水溶液中の2つの成分を混合することによってなされる。典型的なN/P(アミン対リン酸)比は10:1である。ゲル電気泳動又はその他の適切なアッセイは、前記PADRE−デンドリマーへの前記DNAの完全な複合体化を示すために使用可能である。
【0108】
本明細書で記載されているキットは、関心抗原をエンコードするベクター又はプラスミドのいずれかとともに用いられることができる。本明細書に記載されている、前記デンドリマー/Tヘルパーエピトープ複合体(コンジュゲート体)の使用前準備のための説明資料が一般的に含まれる。前記説明資料は典型的に書面の又は印刷された資料であることを含むが、それらはこれに限定されない。かかる説明書を保存することができる及びエンドユーザーへそれらを伝えることができる媒体のいずれもが、ここでの前記キット及び方法に包含される。かかる媒体は電子記録媒体(例えば、磁気ディスク、テープ、カートリッジ、チップ)、光学媒体(例えば、CDROM)等を含むが、これらに限られない。かかる媒体は、かかる説明資料を提供するインターネットサイトへのアドレスを含む場合がある。
【0109】
細胞へ核酸を送達するための組成物及び方法
本明細書に記載されている実験において、GFPをエンコードする遺伝子の送達は、MHCクラスII細胞(MHCクラスIIを発現する細胞)へ特異的に送達され、前記遺伝子の発現が観察された。従って、本明細書に記載されている前記組成物及び方法は、いかなる遺伝子治療応用での使用を見出しても良い。細胞を核酸へ送達するための組成物は、典型的に、少なくとも1つのTヘルパーペプチド、及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸をコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含み、前記少なくとも1つのTヘルパーペプチドが前記細胞へ特異的に結合し、少なくとも一つのTヘルパーペプチド、少なくとも一つの陽荷電性高分枝ポリマーデンドリマー、及び、核酸が細胞に取り込まれるように、前記少なくとも1つのTヘルパーペプチド及び前記核酸が、少なくとも1つの前記陽荷電性多分枝高分子デンドリマーの外部表面へコンジュゲートされることを特徴とする。細胞へ核酸を送達する方法は、典型的に、少なくとも1つのTヘルパーペプチド及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸にコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含む組成物を細胞に接触させることを含み、前記組成物は、少なくとも1つのTヘルパーペプチド、及びペプチド又はタンパク質をエンコードする少なくとも1つの核酸をコンジュゲートさせた少なくとも1つの陽荷電性多分枝高分子デンドリマーを含み、少なくとも1つのTヘルパーペプチドが前記細胞へ特異的に結合して、前記核酸の組み合わせが前記細胞によって内部に取り込まれるように、前記少なくとも1つのTヘルパーペプチド及び前記核酸が前記少なくとも1つの陽荷電性多分枝高分子デンドリマーの前記外部表面へコンジュゲートされることを特徴とする。典型的な実施態様において、前記ペプチド又はタンパク質は前記細胞内に発現する。
【0110】
組成物の投与
本明細書に記載されている前記ワクチン及び組成物は、哺乳類(例えば、イヌ、ネコ、ブタ、ウマ、げっ歯類、非ヒト霊長類、ヒト)へいかなる適切な処方で投与されても良い。例えば、siRNAへコンジュゲートされたPADRE−デンドリマーを含む組成物又は、核酸、又はペプチド若しくはポリペプチド抗原へ複合体化されたPADRE−デンドリマーを含むワクチンが、例えば薬学的に許容可能な担体又は生理食塩水又は緩衝塩類溶液のような希釈剤中で処方されても良い。適切な担体及び希釈剤は、投与の様式及び経路と、標準的な薬務とにもとづいて選択することが可能である。典型的な薬学的に許容可能な担体及び希釈剤と、医薬品の処方とは、レミントンの薬学と、この分野の標準的な教科書と、UPS/NFとで知ることができる。別の物質が、前記組成物を安定化及び/又は保護するために組成物に添加される場合がある。
【0111】
本明細書に記載されている前記組成物及びワクチンは、いずれかの従来技術により哺乳類へ投与されても良い。かかる投与は、典型的に、非経口(例えば、静脈内、皮下、腫瘍内、筋肉内、腹腔内、又は髄腔内注入)だろう。前記組成物は、直接的に標的部位に投与される場合もある。前記組成物は、単回ボーラス投与か、複数回注射か、持続投与(例えば、腹膜透析、ポンプ注入による静注)かで投与されても良い。非経口投与のために、前記組成物は、パイロジェンを含まない殺菌された剤形で処方されることが好ましい。治療用途において、本明細書に記載されている前記組成物及びワクチンは、既にがんで苦しんでいる、又は前記関心病原体(例えば、ウイルス)に感染した個体に投与される。予防用途において、本明細書に記載されている前記組成物及びワクチンは、がん又は感染性疾患(すなわち、関心病原体に感染している(例えば、ウイルス))の発症の危険にさらされている(例えば、遺伝的に罹患しやすい、又は環境的に曝露された)個体に投与される。
【0112】
治療用途において、本明細書に記載されている前記組成物及びワクチンは、既にがんで苦しんでいる、又は前記関心病原体(例えば、ウイルス)に感染した個体に投与される。予防用途において、本明細書に記載されている前記組成物及びワクチンは、がん又は感染性疾患(すなわち、関心病原体に感染している(例えば、ウイルス))の発症の危険にさらされている(例えば、遺伝的に罹患しやすい、又は環境的に曝露された)個体に投与される。
【0113】
有効な用量
本明細書に記載の前記ワクチン及び組成物は哺乳類(例えば、イヌ、ネコ、ブタ、ウマ、げっ歯類、非ヒト霊長類、ヒト)へ有効な量、つまり、処置された哺乳類において望ましい結果(例えば、哺乳類におけるがんの予防又は除去、感染性疾患等に対する防御)を提供できる量で投与されるのが好ましい。かかる治療的有効量は以下で記載されるように決定可能である。
【0114】
本明細書に記載のワクチン及び組成物の毒性及び治療有効性用量は、LD50(集団の50%に対する至死用量)を決定するために細胞培養又は実験動物のいずれかを用いる標準的な薬学的手順で決定可能である。毒性効果と治療効果の間の用量比は、治療指数であり、LD50/ED50比として表すことができる。高い治療指数を示す組成物が好ましい。また、毒性の副作用を示す組成物が用いられる場合があるが、かかる副作用のダメージの可能性を最小化する送達システムの設計に注意を払うべきである。好ましい組成物の投与量は、ほとんど又は全く毒性がないED50を含む範囲内であることが好ましい。投与量は、用いる剤形及び利用する投与経路に依存して、この範囲内で変わる場合がある。
【0115】
本明細書に記載されている組成物及びワクチンの治療学的有効量は、最初の免疫(治療又は予防投与)において、70kgの患者(例えば、0.14μgから357μgのプラスミドDNA又はタンパク質及び0.86μgから2142.85μgの前記Tヘルパー−デンドリマー)に対して、前記抗原をエンコードする核酸にコンジュゲートされるか又は結合されるかのTヘルパーエピトープ/デンドリマーの複合体が一般的に1μgから約25,000μgまでの(例えば、1、100、500、2000、2500、10,000、15,000、25,000μg)範囲であり、そして、前記患者の血液中の特定のCTL活性及び/又は抗体応答を測定による前記患者の応答及び状態に依存して、週から月単位の追加免疫計画に従って、約1μgから約2,500μgの前記複合体(ワクチン)の追加免疫がなされる。1つの実施態様では、133倍以上多い用量のデンドリマーの15日間投与が、毒性なく哺乳類に投与される場合がある(Abhay Singh Chauhanら、2009 Proc.R.Soc.A,466,pp1535−1550.2009を参照のこと)。
【0116】
現在がん又は感染性疾患に苦しんでいる及び/又はがん又は感染性疾患と診断された被験体の治療のために、投与は、疾患の最初の兆候の時か、又は腫瘍の検出又は外科的摘出時か、又は急性感染の場合には診断後すぐに開始することが好ましい。これは、少なくとも症状が実質的に弱められるまで、及びその後一時期の間、追加免疫がなされる。慢性感染症において、負荷用量とそれに続く追加免疫が必要とされる場合がある。予防使用のために、個体ががんへの素因に気付いたらすぐに、又は感染性疾患への曝露の予想の前に投与を開始しても良い。
【0117】
医学及び獣医学の当業者に周知であるように、いずれかの被験体への投与量は、前記被験体の大きさ、身体表面領域、年齢、投与される特定の組成物、時間及び投与経路、健康所見、及びその他の同時に投与される薬剤を含む因子の多くに依存する。例えばPAMAMのようなデンドリマーは臨床試験と同様に前臨床試験でテストされた。最近、FDAは「ファーストトラック」をVivaGel(登録商標)(Starpharma、Melbourne、Australia)に付与し、既に第3相臨床試験にある。角膜におけるデンドリマーの治療使用は公知であり、デンドリマーは角膜遺伝子送達に用いられている。角膜の用途におけるデンドリマーの使用例は、角膜の新血管形成の治療、光線力学療法、及び角膜等価物としての再生医学を含む。Poly(I:C)は、ヒトに40年以上の間、「天然の」インターフェロンの誘導因子として投与されてきた。複数の最近の臨床試験は、安全性及び増強した免疫原性のために異なった用量及び投与経路が試されてきた;一般的な安全性及び増強した免疫原性は繰り返し報告され、確立されている。
【0118】
実施例
本発明は、以下の特定の実施例によってさらに例示される。前記実施例は例示のみのために提供され、何等、本発明の技術的範囲を限定するように解釈されるべきではない。
【実施例1】
【0119】
確立されたメラノーマ腫瘍の遺伝子ワクチン接種療法のためのアジュバント/標的ナノ粒子を利用したプラットフォーム
裸のDNAを用いる遺伝子ワクチン接種は、抗原を作製するために天然型で用いられる。しかし、イン・ビボでのトランスフェクション効率が低いこと、有効な送達がないこと、及び、従来の因子ワクチン接種アプローチの特異性が低いことが、抗原の効率を非常に制限する。これらの制限を克服するために、1)イン・ビボでPAPCの特異的で効率的なトランスフェクションを可能にし、2)自家PAPCの成熟、つまり強力な免疫応答をもたらす「危険信号」を提供し、3)発生した免疫応答をさらに高めるヘルパーT細胞を活性化する、抗腫瘍DNAワクチン接種のための新規で柔軟なプラットフォームが開発され、本明細書に記載される。
【0120】
本明細書記載の新規のデンドリマーを利用するナノ粒子が、2つの反応物、ジェネレーション5のアミノ末端型PAMAMデンドリマーと、標的/免疫増強ペプチド、すなわち普遍的なTヘルパーエピトープ(PADRE)とのコンジュゲートによって典型的に調製される。以下に記載のデータは、i)C57BLマウスで確立され、高い侵襲性のB16/LU8メラノーマ腫瘍を50%の腫瘍サイズに減少する目的の抗腫瘍効果を達成し、ワクチン接種で用いられた前記遺伝子の生産物に対する強力な免疫応答を誘導し、2倍ないし3倍まで、マウス及びヒトの両方の抗原提示細胞(APC)でトランスフェクション効率を増大するための本プラットフォームを示した。さらに、PADREデンドリマーにコンジュゲートしたGFPをエンコードするプラスミドを用いるイン・ビボ実験は、GFPが流入領域リンパ節で産生されることを示した。
【0121】
材料及び方法
PADRE誘導体化PAMAMデンドリマーが、以下の改変とともに上述のように製造された。前記PADREデンドリマー/DNA又はsiRNAの複合体は、適切なN/P比で10分間室温でインキュベーションすることによって製造された。かかる複合体は、イン・ビトロ研究のために初代のPMBC又は脾臓細胞に添加されたか、又はワクチン接種の目的のために皮下に注射された。図1は、ジェネレーション5のPAMAMデンドリマー(へのコンジュゲート)のPADRE修飾を示す。
【0122】
複数の核酸を結合するための高い陽荷電性表面を維持するために、1つのデンドリマー分子は、その表面にコンジュゲートした2つのPADREペプチドを典型的に有するため、それが正味の陽荷電性を保持するであろう。PADREを前記デンドリマーに付加することは、抗原提示細胞(APC)の特異的な標的化と、強力なCD4支援とをもたらす。前記PADRE誘導体化PAMAMデンドリマーは、抗原をエンコードするプラスミドの送り届けだけでなく、自然及び適応免疫を刺激し、「危険信号」として作用する。
【0123】
エンドトキシン無しのMaxiPrep試薬が、(PCDNA3.1中のpEGFP−C1、pMAX、GFP、TRP−2、P2、PCARD及びOVAを含む)さまざまなプラスミドを作製するために用いられた。蛍光色素免疫吸着アッセイ(FLISA)と、免疫蛍光アッセイ(IFA)とが標準的な方法によって実行された。簡潔には、トランスフェクションされたcos−7細胞は、(96ウェルプレートでウェル1つあたり0.02×106個)播種され、細胞は固定され、透過処理された。上昇した液性応答を測定するために、希釈された血清は前記ウェルに添加され、第2番目のIRDye 800CWでタグ化された抗マウスIgGが抗体応答を測定するために用いられた。
【0124】
前記デンドリマー/DNAの複合体を調製するために、エンドトキシン無しのPBS中に調製されたDNA1μg/μLが、さまざまな割合でデンドリマー又はデンドリマー−PADREと複合体形成された。室温で10分間インキュベーション後、前記複合体は、細胞培養物に添加されるか、又は皮下、皮内又は角膜間質腔(corneal stroma cavity)に注射された。
【0125】
B16−LU8メラノーマ腫瘍を有するマウス、5群の雌性C57BLマウスにワクチン接種のために、B16−F10細胞(0.02×106個)が皮下に移植された。異なる群が、i)非処理か、ii)PCDNA3.1(対照ベクター)単独か、iii)デンドリマー単独で複合体形成されたTRP−2か、iv)PADRE−デンドリマーで複合体形成されたTRP−2かを腫瘍移植後2日目及び10日目に受けた。腫瘍測定は1週間に2回実行された。
【0126】
結果
調製されたPADRE−デンドリマーが特徴付けられた。ペプチド−デンドリマーコンジュゲート体は、前記ペプチドの−COOH末端と前記デンドリマーのアミノ基との間で単純にアミドカップリングすることによって作製された。2:1のペプチド/デンドリマーの感作割合が反応で用いられ、前記デンドリマーの大きな陽電荷を作るための多くの遊離のアミノ基を保持するために、デンドリマー1個あたりペプチド数個のみを付着する。産物は、純水に対する透析によって少なくとも24時間精製され、その後真空で乾燥された。回収された産物、精油は、1H NMR、UV−Vis及びMALDI−TOF質量分析によって特徴付けられた。NMRは、前記デンドリマーの陽電子に対応する大きなピークと、ペプチドの陽電子についての一連の小さなピークとを示す。前記PADRE−デンドリマーコンジュゲート体のMALDI−TOF質量分析は、m/z比で前記デンドリマーについて観察されたピークよりも高い約3,000ユニットのピークを示す。過剰な質量は約2個のペプチドエピトープに対応する(図17)。
【0127】
データは2つのPADREの平均が各デンドリマーに存在すると証明した(図17)。複数の核酸を自家APCにイン・ビトロ送達することが示された。ヒトの初代の末梢単核球細胞をイン・ビトロで送達/トランスフェクションすることは、1:5及び1:10の感作比で最もよく達成された。図2は、PADRE−デンドリマー(にコンジュゲートした)と複合体形成した、Alexa Fluorでタグ化されたsiRNAがB細胞と4時間インキュベーションされた際の純化されたヒトB細胞にPADRE−デンドリマーを介するsiRNA送達(〜%86)を示す。細胞はCD19/FITCで染色され、赤色チャンネル(PE)はsiRNA /Alexa Fluor.manを有する細胞を示す。
【0128】
図3に関して、PADRE−デンドリマーのイン・ビボのDNA送達が示された。GFP又はTRP−2をエンコードするプラスミドは単独で注射されるか、又はPADRE−デンドリマー又はデンドリマー(即ち、PADREと複合体形成されていないデンドリマー)と複合体形成された。画像は、注射後24時間及び16時間の皮膚(左)及び角膜(右)でのGFPの発現を示す。GFPの効率的な発現が、PADRE−デンドリマー複合体の注射後24時間及び16時間の皮膚及び角膜の両方で示された。イン・ビボでリンパ節の標的化が実証された。PADRE−デンドリマー/GFP−プラスミド複合体(全5μgのプラスミド)が皮下に注射された後8日目、隣接のリンパ節が除去され、GFP−DNA単独で注射されたマウスのリンパ節と比較された。蛍光顕微鏡画像が、免疫後8日目に網目状のリンパ節(meshed lymph nodes)で撮られた。注射部位に隣接する前記リンパ節での抗原の発現が見られたが、対照リンパ節での抗原の発現は見られなかった。
【0129】
イン・ビボでリンパ節の標的化が実証された。PADRE−デンドリマー/GFP−プラスミド複合体(全5μgのプラスミド)が皮下に注射された後8日目、隣接のリンパ節が摘出され、GFP−DNA単独で注射されたマウスのリンパ節と比較された。蛍光顕微鏡画像が、免疫後8日目に網目状のリンパ節(meshed lymph nodes)で撮られた。注射部位に隣接する前記リンパ節での抗原の発現が見られたが、対照リンパ節での抗原の発現は見られなかった。
【0130】
図4に示されるように、特異的な免疫応答がPADRE−デンドリマー/プラスミド複合体を投与した後に上昇された。強い液性応答が、プラスミド/PADRE−デンドリマーの複合体での1回(GFP)又は2回(OVA)の免疫で観察された。
【0131】
図5に示されるデータは、確立された腫瘍のPADRE−デンドリマー療法を示す。B16メラノーマは、侵襲性のマウス腫瘍モデルであることが知られる。B16メラノーマ細胞(上)又はTSA(下)を移植されたマウスが、腫瘍移植後2又は3日目にワクチン接種され、1週間後に追加免疫が続いて行われた。PADRE−デンドリマーを投与することが、特に、PADRE結合に対して高い親和性を有するC57BL(Iab)で防御免疫応答をもたらしたことを追跡腫瘍測定が明確に実証した。またC57BLはヘルパーT細胞の誘導を介してPADREに強く応答した。
【0132】
図5に関して、結果は、高い侵襲性で確立されたB16/LU8腫瘍の腫瘍サイズを50%減少する目的の抗腫瘍効果を示した。この侵襲性モデルは、他の全てが失敗してもプラットフォームの能力を示すために意図的に選択された。腫瘍成長の遅延と、腫瘍サイズの減少とは前例のないことである。さらに、腫瘍移植後22日目、腫瘍又は触診可能な腫瘍が全ての対照群と顕著に異なる試験群(即ち、本明細書に記載されているようなワクチンを受け取っている動物)で全く検出されなかった。本ワクチン接種(ワクチン投与)で用いられたDNA量は、通常用いられる量(20μg及び全2回の免疫)と比較して非常に少なかった。図5では、下段の図は、PADREが適切に結合していないBalb/cマウスを用いる陰性対照であり、Balb/c TSA腫瘍モデルでの類似の実験では全く有効性を示さない。これは、MHCクラスIIを介する送達システムの特異性を明らかに示す。
【0133】
これらのデータは、本明細書記載の標的用アジュバントナノ粒子プラットフォームが、遺伝子送達と、エンコードされた抗原の強力な発現と、抗原提示と、防御免疫応答の誘導とをもたらすことを明らかに実証する。したがって、本明細書記載のPADRE−デンドリマーのナノ粒子は、i)タンパク質なしの(モノクローナル)抗体の製造と、ii)悪性腫瘍と、虚偽のインプリンティングを有する感染性疾患との免疫学的治療/予防と、iii)免疫を利用した治療介入の多くのためのsiRNA送達とのための新規で強力なアジュバント/標的用送達ツール及びプラットフォームである。
【実施例2】
【0134】
イン・ビトロでの標的送達及びトランスフェクションの効率
図6に関して、イン・ビトロでのPBMCの標的送達は77%のB細胞トランスフェクション効率をもたらす。健康な提供者由来のヒトPBMCが入手された。PBMCは、10%ウシ胎仔血清を含むRPMI培地1mLあたり6百万個の細胞で培養された。GFPをエンコードするプラスミド5μgは、生理緩衝液、PBS100μLで希釈され、PBS50μL中のPADRE−デンドリマー5μgは、振とうながらDNAに添加された。室温で10分間インキュベーション後、GFPプラスミド及びPADRE−デンドリマーの混合物/複合体が、その後、PBMCに添加された。37°C/5%CO2インキュベーターでインキュベーション24時間後、PBMCはCD19 PEで染色され、細胞はフローサイトメトリーで解析された。GFPの発現が全PBMCの43%で観察された一方、B細胞にゲートされたとき、B細胞の77%がGFPを発現した。対照群、デンドリマーとGFPプラスミドの同じの割合をインキュベーションしたPBMCは、総PBMC又はB細胞に対して約11%と7%のGFPの発現を示した。培地のみでのPBMCと比較するとき、主要な生存率変化は全く観察されなかった。これは、さまざまな実験の代表例である。これらの実験は、i)PBMCと、特に、MHCクラスIIを発現している細胞(B細胞)とへのGFPプラスミド送達、及び、ii)PBMCと、特に、B細胞とによるGFPの発現を実証する。
【実施例3】
【0135】
イン・ビボでマウス樹状細胞(DC)と、イン・ビトロでヒトB細胞とへのペプチド/タンパク質の送達
PDD/アルブミン−FITCは純化されたヒトB細胞に送達された(図7)。図8に関して、この図は、PADRE−デンドリマーの標的化の、イン・ビボでのマウス樹状細胞(DC)の効率と、注射及びリンパ節解析の時系列とを示す。この実験の結果は、i)(図7)PADRE−デンドリマーと混合されたタンパク質、アルブミン−FITCは2時間未満でヒトB細胞中に送達され、ii)(図8)皮下注射後5日目、デンドリマーにコンジュゲートしたエピトープ、PADREは、リンパ節のB細胞と樹状細胞(DC)とにイン・ビボで送達され(前記PADRE−デンドリマーは、リンパ節/B細胞/樹状細胞(DC)への複合体の送達を可視化するためにGFP−プラスミドに複合体形成された。)、iii)(図9)皮下注射後5日目、デンドリマーにコンジュゲートしたエピトープ、インフルエンザのHAヘルパーエピトープはリンパ節の樹状細胞(DC)にイン・ビボで送達される(前記PADRE−デンドリマーは、リンパ節の樹状細胞(DC)への複合体の送達を可視化するためにGFP−プラスミドに複合体形成された。)ことを示す。これらのデータは、さまざまな実験で、GFPプラスミドと複合体形成されたPADRE−デンドリマー又はHA−デンドリマーそれぞれの皮下注射後3日目に摘出されたリンパ節のいくつかでの代表例である。これらの結果は、FITCのFITC可視化を介して、リンパ節細胞のB細胞及び樹状細胞(DC)を含む抗原提示細胞(APC)へのFITCコンジュゲートタンパク質の送達と、デンドリマーにコンジュゲートしたPADRE及びHAヘルパーのエピトープの2つのペプチドの送達との例を証明し、該2つのペプチドでは、GFPプラスミドが複合体(GFPをエンコードするプラスミドを伴うペプチド連結デンドリマー複合体)の可視化と解析を促進するために前記ペプチド−デンドリマーと複合体形成された。樹状細胞(DC)の特異的なイン・ビトロ及びイン・ビボのトランスフェクションは、ナノ粒子(PADRE−デンドリマー/GFPをエンコードするプラスミド)、対、対照の注射後5日目の隣接のリンパ節で標的化及び増幅する樹状細胞(DC)のイン・ビボのフローサイトメトリーデータによって示された(GFPの発現78%、対、〜7%)。PADRE誘導体化デンドリマー(PDD)は、抗原提示細胞(APC)上に発現したMHCクラスIIに結合する高い親和性を有するPADREのオプソニン効果の補助によって送達を増大する。同様に、HA−デンドリマー(DRHA)/GFP−プラスミドは、皮下に注射されたとき、隣接のリンパ節にイン・ビボで送達される(図9)。マウスで特筆すべきことは、PADREがIAb(C57BLマウス)の前記MHCクラスIIに結合する一方(図8)、選択されたHAエピトープがIAd(Balb/cマウス)のMHCクラスIIに結合する(図9)ことである。異なる2つのエピトープを用いて、異なる2つのマウスの系統において、類似の結果となるイン・ビボ送達を実行できることが示された。ヒトPBMC(図6)、純化されたヒトB細胞(図6)及びC57BLマウスの脾臓細胞でPADRE−デンドリマー/GFP−プラスミドによってGFPの発現をもたらす抗原提示細胞(APC)標的送達と、ヒトB細胞(図10)及びサルPMBC(図11)へのPADRE−デンドリマー/dsRNAの送達とは、本明細書記載の組成物によるPAPCへのペプチド送達の追加のイン・ビトロの証拠である。ユニークな特徴は前記MHCクラスIIに結合する異なる2つの標的ペプチドの使用が、本明細書記載の実験で示されたように働くため、本明細書記載のワクチン、方法及び組成物は、全てのMHCクラスII結合ペプチドを包含する。また、図9に関して、インフルエンザHAヘルパーエピトープにコンジュゲートしたデンドリマー(HDD)が調製された。HDDはbalb/cマウスで用いられる場合がある。マウスに注射されたとき、HDDは、隣接のリンパ節で樹状細胞(DC)を標的とする。
【実施例4】
【0136】
ヒトB細胞及び非ヒト霊長類PBMCへのsiRNAのPADRE−デンドリマー送達及び非ヒト霊長類PBMCへのプラスミドのPADRE−デンドリマー送達
図10に関して、dssiRNAに複合体形成されたPADRE−デンドリマー(対照siRNA)は、イン・ビトロの標的送達を示した。0.1μgのdsRNAは100μLのPBS中に希釈され、20μL中の0.7μgのPADRE−デンドリマーが、振とうしながらAlexa Fluorでタグ化されたdsRNAに添加された。室温で10分間インキュベーション後の複合体が、24ウェルのプレート中の(10%ウシ胎仔血清含有RPMI中の)100万個の純化されたB細胞に添加された。37°C/5%CO2インキュベーターでインキュベーション約1時間後、細胞は洗浄され、ウェルに(新鮮な10%ウシ胎仔血清含有RPMI1mL中に)戻され、赤色チャンネルの蛍光顕微鏡下で解析された。明視野及び赤色チャンネル下での細胞の重ね合わせ画像は、ヒトB細胞によるAlexa Fluorでタグ化されたdsRNAの取り込みを実証する(図10)。細胞がCD19(B細胞マーカー)で染色され、フローサイトメトリーによって解析されたとき(図2)、細胞は37°C/5%CO2インキュベーターで一晩インキュベーションされた。図2に示されるように、対照のデンドリマー/dsRNA−Alexa Fluorの約6%に対して、B細胞の80%よりも多くが、(RNAにタグ化された)Alexa Fluorに陽性である。これらの結果は、PADRE−デンドリマーによるPAPCへの核酸の強力な送達を明らかに実証する。
【0137】
ヒヒ(papio hamadryas)由来の1つの試料と、カニクイザル(macaca fascicularis)由来の異なる2つの試料とのPBMCがテストされた。図11に示される蛍光顕微鏡画像は、siRNA/Alexa Fluorで複合体形成されたPADRE−デンドリマー又はデンドリマーそれぞれの添加後2時間に撮られた代表例である。同様に、GFP−プラスミドで複合体形成されたPADRE−デンドリマー又はデンドリマーは前記PBMCに添加され、インキュベーション後24時間で解析された(図12)。結果は、PADRE−デンドリマーは核酸をサルのPBMCに2時間未満で送達する一方、デンドリマーは穏やかな送達のみを示すことを示す。これらの結果は、PADRE−デンドリマーは非ヒト霊長類で作用することを強く示唆する。
【実施例5】
【0138】
PADRE−デンドリマーのナノ粒子及びIN−CELL−ART(商標)プラットフォームの組成物
本明細書記載のPADRE−デンドリマーは、全ての細胞へのIN−CELL−ARTの非特異的な送達とは反対のPAPCの特異的な標的化を提供する。前記IN−CELL−ART(商標)プラットフォームは、抗原提示細胞(APC)に結合するために非特異的な生来のアジュバント活性又はいずれかのリガンドを用いる電気穿孔法を介してDNAを細胞に送達する704ポリマーを含む。従来、イン・ビボの電気穿孔法は、最も良いウイルス遺伝子を使用しない免疫方法として知られる。本明細書記載のPADRE−デンドリマーは、前記IN−CELL−ART(商標)のプラットフォームによって提供されないヘルパーT細胞の誘導を提供する。上記の実験では、前記PADRE−デンドリマーは治療上の腫瘍モデルで有効であることが示された一方、IN−CELL−ARTのものはイン・ビボ腫瘍モデルで有効であることが示されなかった。本明細書記載の前記実験では、強力な対照として、PADRE−デンドリマーはイン・ビボ電気穿孔法と比較された(図13)。反対に、IN−CELL−ARTは裸のDNAとの比較のみを示した。本明細書記載の前記PADRE−デンドリマーの単回免疫が、液性応答を上昇するためのイン・ビボ電気穿孔法と比較された。本実験を実行するために、PADRE−デンドリマーは、室温で5μgの前記プラスミドと混合され、10分後、混合物はマウスに皮下注射された。OVAをエンコードするプラスミドにコンジュゲートしたPADRE−デンドリマーで免疫されたマウスと、対照マウスとは、単回のワクチン接種28日後にOVAを発現する50k B16F10で感作された。イン・ビトロでの電気穿孔法を介してプラスミドを受け取っているマウスでは40%であり、DNAのみを受け取った対照群では0%であったが、プラスミドにコンジュゲートしたPADRE−デンドリマーを受け取ったマウス全てが腫瘍移植後25日目で保護(Protect)された。図13に示されるように、結果は、PADRE−デンドリマー/プラスミド(DRP−ova)での単回のDNAワクチン接種は、抗ova抗体の液性応答を誘導するためのプラスミド(EP−ova)のイン・ビボ電気穿孔法(EP)の送達よりも優れていることを示す。
【実施例6】
【0139】
マウスで強い液性応答を誘導するPADRE−デンドリマー
図14−16に示されるように、プラスミドと複合体形成されたPADRE−デンドリマーはマウスで強い液性応答をもたらす。
【実施例7】
【0140】
PADRE−デンドリマー/OVAプラスミドワクチンによる予防上の設定でのB16/OVAの根絶
ケージあたり5匹の群の雌6週齢のC57BLマウスが、i)免疫なし、ii)Derma Vax電気穿孔装置を用いる「イン・ビボ電気穿孔法」を介する20μgのOVA−プラスミドの2回の免疫か、iii)PADRE−デンドリマー/OVA−プラスミドの2回の免疫(各20μg)かを受けた。免疫は2週間の間隔で実行された。免疫後10日目、全てのマウスは、右側腹部にPBS100μL中のB16/OVA腫瘍細胞50,000個の皮下注射(移植)を受けた。腫瘍の測定は1週間に2回実施され、毎週のデータはプロットされ、図18に示される。PADRE−デンドリマー/20μgのOVA−プラスミドでの2回のワクチン接種は、免疫されたマウス全てでB16/OVA腫瘍の完全な根絶をもたらす一方、非処理では100%、及び、「イン・ビボ電気穿孔法」を介してワクチン接種されたマウスの60%が腫瘍を持ったままであった。体重の15%よりも大きな腫瘍を有する、腫瘍を持ったマウスの全ては屠殺された。
【0141】
その他の実施態様
いずれかの改良が、前記組成物、キット及び方法ステップの一部又は全部で行われる場合がある。本明細書で引用される刊行物、特許出願及び特許を含む参考文献の全ては、引用により本明細書に取り込まれる。本明細書で提供される例又は例示的な用語(例えば、「のような」)のいずれか及び全てを用いることは、本発明を例示することを意図し、他に要求がない場合には、本発明の技術的範囲を限定することを示すものではない。例えば、本明細書記載の実験は、B16メラノーマの根絶と、GFP、OVA、PCARD、CCR5、vgPCR、muPAR、CathL又はp2の抗原への強い液性応答の誘導とを含むけれども、本明細書記載のワクチン、組成物及び方法は、がんの追加のタイプを予防又は根絶するステップ、及び、免疫応答、つまり興味のある抗原(例えば、感染性病原体由来の抗原)いずれかに対する免疫を誘導するステップを含む、他の治療上及び予防上の適用の多くで使用することを発見することが可能である。もう1つの例では、本明細書記載の前記ワクチン、組成物及び方法は、抗原ではないタンパク質又はペプチドを細胞に送達するために用いられることが可能である。この例は、ペプチド又はタンパク質を細胞に送達するための典型的な組成物は、少なくとも1つのTヘルパーペプチド及び少なくとも1つのペプチド又はタンパク質をコンジュゲートした少なくとも1つの荷電性多分枝ポリマーデンドリマーを含み、前記少なくとも1つのTヘルパーペプチドが前記細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はタンパク質とは、少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされる。本発明又は好ましい実施態様の性質又は利益に関する本明細書の説明のいずれも限定することを意図せず、添付された請求項は、かかる説明によって制限されるとみなされるべきではない。より一般的には、明細書中の用語は、本発明の実行に必須とされるものと同じく、請求項に記載されていない構成要素のいずれかを示すものと解釈されるべきではない。本発明は、準拠法によって許されているように、本明細書に添付された請求項に記載の対象の改変及び均等物の全てを含む。さらに、本明細書で他に示されるか、又は明らかに文脈と矛盾したりしない場合には、全ての変形における上記構成要素のいずれの組合せも本発明に含まれる。
【特許請求の範囲】
【請求項1】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つの抗原をエンコードする核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記少なくとも1つの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、ワクチン。
【請求項2】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項1に記載のワクチン。
【請求項3】
薬学的に許容可能な担体及び油中水型エマルジョンをさらに含むことを特徴とする、請求項1に記載のワクチン。
【請求項4】
前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ(PADRE)であることを特徴とする、請求項1に記載のワクチン。
【請求項5】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープであることを特徴とする、請求項4に記載のワクチン。
【請求項6】
前記核酸は発現ベクターであり、前記少なくとも1つの抗原は、がん抗原か、感染性病原体由来の抗原かであることを特徴とする、請求項1に記載のワクチン。
【請求項7】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項1に記載のワクチン。
【請求項8】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項1に記載のワクチン。
【請求項9】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記少なくとも1つのペプチド又はポリペプチドの抗原との組み合わせが前記少なくとも1つのペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、ワクチン。
【請求項10】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしていることを特徴とする、請求項9に記載のワクチン。
【請求項11】
前記第2の荷電性多分枝ポリマーデンドリマーをさらに含むワクチンであって、前記第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、請求項9に記載のワクチン。
【請求項12】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項9に記載のワクチン。
【請求項13】
薬学的に許容可能な担体をさらに含むことを特徴とする、請求項9に記載のワクチン。
【請求項14】
油中水型エマルジョンをさらに含むことを特徴とする、請求項9に記載のワクチン。
【請求項15】
前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープであることを特徴とする、請求項9に記載のワクチン。
【請求項16】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPan−DRエピトープであることを特徴とする、請求項15に記載のワクチン。
【請求項17】
前記ペプチド又はポリペプチドの抗原は、がん抗原か、感染性病原体由来の抗原かであることを特徴とする、請求項9に記載のワクチン。
【請求項18】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項9に記載のワクチン。
【請求項19】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項9に記載のワクチン。
【請求項20】
抗原を哺乳類に送達し、該哺乳類で前記抗原に対するモノクローナル抗体の産生を誘導する方法であって、該方法は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記組成物はMHCクラスIIで仲介されるヘルパーT細胞の活性化を誘導するために有効量の組成物であり、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド若しくはポリペプチドの抗原か、該少なくとも1つの抗原をエンコードする核酸かとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸か、又は、前記少なくとも1つのペプチド若しくはポリペプチドの抗原かとの組み合わせが、前記少なくとも1つのペプチド若しくはポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸か、又は、少なくとも1つのペプチド若しくはポリペプチドの抗原かとが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記組成物を前記哺乳類に投与することが、前記少なくとも1つのペプチド又はポリペプチドの抗原に対するモノクローナル抗体の産生をもたらすことを特徴とする、方法。
【請求項21】
前記哺乳類はがんを有し、前記少なくとも1つのペプチド又はポリペプチドの抗原はがん抗原であり、前記組成物は前記がんに対するワクチンであることを特徴とする、請求項20に記載の方法。
【請求項22】
前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じないことを特徴とする、請求項21に記載の方法。
【請求項23】
前記哺乳類は感染性疾患を有し、前記少なくとも1つのペプチド又はポリペプチドの抗原は感染性病原体由来であり、前記組成物は前記感染性病原体に対するワクチンであることを特徴とする、請求項20に記載の方法。
【請求項24】
前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じないことを特徴とする、請求項23に記載の方法。
【請求項25】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項20に記載の方法。
【請求項26】
前記組成物は薬学的に許容可能な担体をさらに含むことを特徴とする、請求項20に記載の方法。
【請求項27】
前記組成物は油中水型エマルジョンをさらに含むことを特徴とする、請求項20に記載の方法。
【請求項28】
前記少なくとも1つのTヘルパーペプチドはPADREエピトープであることを特徴とする、請求項20に記載の方法。
【請求項29】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープであることを特徴とする、請求項28に記載の方法。
【請求項30】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項20に記載の方法。
【請求項31】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項20に記載の方法。
【請求項32】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしていることを特徴とする、請求項20に記載の方法。
【請求項33】
前記組成物は第2の荷電性多分枝ポリマーデンドリマーをさらに含み、該第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、請求項21に記載の方法。
【請求項34】
前記哺乳類は、げっ歯類又はウサギであり、前記モノクローナル抗体は前記哺乳類から採取されることを特徴とする、請求項20に記載の方法。
【請求項35】
前記モノクローナル抗体は、前記哺乳類から前記抗体を採取するステップと、前記抗体のタイターを測定するステップと、前記哺乳類から脾臓を摘出するステップと、ミエローマとの融合を実行するステップとによって調製されることを特徴とする、請求項34に記載の方法。
【請求項36】
前記抗体はヒト化されることを特徴とする、請求項35に記載の方法。
【請求項37】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物であって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、組成物。
【請求項38】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであり、前記siRNAは、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられることを特徴とする、請求項37に記載の組成物。
【請求項39】
siRNAをプロフェッショナル抗原提示細胞に送達する方法であって、該方法は、
(a)少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートする少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を提供するステップと、
(b)哺乳類の被験体に前記組成物を投与するステップとを含み、
前記組成物を提供するステップでは、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、
前記投与するステップでは、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとをコンジュゲートしている前記少なくとも1つの荷電性多分枝ポリマーデンドリマーが前記プロフェッショナル抗原提示細胞に結合し、前記siRNAが前記プロフェッショナル抗原提示細胞に入る条件下で前記組成物を投与することを特徴とする、方法。
【請求項40】
前記荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項39に記載の方法。
【請求項41】
前記siRNAは、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられることを特徴とする、請求項39に記載の方法。
【請求項42】
前記siRNAは、前記プロフェッショナル抗原提示細胞でCTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1の発現を妨げることを特徴とする、請求項40に記載の方法。
【請求項43】
哺乳類において、MHCクラスII腫瘍細胞の増殖を抑制するか、MHCクラスII腫瘍細胞のアポトーシスを誘導するかの方法であって、該方法は、少なくとも1つのTヘルパーペプチドをコンジュゲートし、タンパク質をエンコードする核酸によって結合した少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーにおいて、前記少なくとも1つのTヘルパーペプチドが前記MHCクラスII腫瘍細胞に特異的に結合し、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸又は該核酸によってエンコードされるタンパク質との組み合わせが、前記MHCクラスII腫瘍細胞の増殖の抑制か、前記MHCクラスII腫瘍細胞のアポトーシスの誘導かをするように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、結合されることを特徴とする、方法。
【請求項44】
前記MHCクラスII腫瘍細胞は、リンパ腫又はリンパ腫の一部分であることを特徴とする、請求項43に記載の方法。
【請求項45】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項43に記載の方法。
【請求項46】
核酸を細胞に送達するための方法であって、該方法は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を細胞に接触させるステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーエピトープと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーエピトープが前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーエピトープと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーエピトープと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、方法。
【請求項47】
前記ペプチド又はタンパク質は前記細胞内で発現されることを特徴とする、請求項46に記載の方法。
【請求項48】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項46に記載の方法。
【請求項49】
核酸を細胞に送達するための組成物であって、該組成物は少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含み、該少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドは前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、組成物。
【請求項50】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項46に記載の組成物。
【請求項1】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つの抗原をエンコードする核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記少なくとも1つの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、ワクチン。
【請求項2】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項1に記載のワクチン。
【請求項3】
薬学的に許容可能な担体及び油中水型エマルジョンをさらに含むことを特徴とする、請求項1に記載のワクチン。
【請求項4】
前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープ(PADRE)であることを特徴とする、請求項1に記載のワクチン。
【請求項5】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープであることを特徴とする、請求項4に記載のワクチン。
【請求項6】
前記核酸は発現ベクターであり、前記少なくとも1つの抗原は、がん抗原か、感染性病原体由来の抗原かであることを特徴とする、請求項1に記載のワクチン。
【請求項7】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項1に記載のワクチン。
【請求項8】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項1に記載のワクチン。
【請求項9】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含むワクチンであって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記少なくとも1つのペプチド又はポリペプチドの抗原との組み合わせが前記少なくとも1つのペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのペプチド又はポリペプチドの抗原とが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、ワクチン。
【請求項10】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしていることを特徴とする、請求項9に記載のワクチン。
【請求項11】
前記第2の荷電性多分枝ポリマーデンドリマーをさらに含むワクチンであって、前記第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、請求項9に記載のワクチン。
【請求項12】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項9に記載のワクチン。
【請求項13】
薬学的に許容可能な担体をさらに含むことを特徴とする、請求項9に記載のワクチン。
【請求項14】
油中水型エマルジョンをさらに含むことを特徴とする、請求項9に記載のワクチン。
【請求項15】
前記少なくとも1つのTヘルパーペプチドはPan−DRエピトープであることを特徴とする、請求項9に記載のワクチン。
【請求項16】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPan−DRエピトープであることを特徴とする、請求項15に記載のワクチン。
【請求項17】
前記ペプチド又はポリペプチドの抗原は、がん抗原か、感染性病原体由来の抗原かであることを特徴とする、請求項9に記載のワクチン。
【請求項18】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項9に記載のワクチン。
【請求項19】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項9に記載のワクチン。
【請求項20】
抗原を哺乳類に送達し、該哺乳類で前記抗原に対するモノクローナル抗体の産生を誘導する方法であって、該方法は、少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記組成物はMHCクラスIIで仲介されるヘルパーT細胞の活性化を誘導するために有効量の組成物であり、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド若しくはポリペプチドの抗原か、該少なくとも1つの抗原をエンコードする核酸かとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーと、前記核酸か、又は、前記少なくとも1つのペプチド若しくはポリペプチドの抗原かとの組み合わせが、前記少なくとも1つのペプチド若しくはポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸か、又は、少なくとも1つのペプチド若しくはポリペプチドの抗原かとが前記少なくとも1つの荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、前記組成物を前記哺乳類に投与することが、前記少なくとも1つのペプチド又はポリペプチドの抗原に対するモノクローナル抗体の産生をもたらすことを特徴とする、方法。
【請求項21】
前記哺乳類はがんを有し、前記少なくとも1つのペプチド又はポリペプチドの抗原はがん抗原であり、前記組成物は前記がんに対するワクチンであることを特徴とする、請求項20に記載の方法。
【請求項22】
前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じないことを特徴とする、請求項21に記載の方法。
【請求項23】
前記哺乳類は感染性疾患を有し、前記少なくとも1つのペプチド又はポリペプチドの抗原は感染性病原体由来であり、前記組成物は前記感染性病原体に対するワクチンであることを特徴とする、請求項20に記載の方法。
【請求項24】
前記組成物を投与することは前記哺乳類で局所的な有害応答を全く生じないことを特徴とする、請求項23に記載の方法。
【請求項25】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはポリイノシン−ポリシチジン酸に結合されることを特徴とする、請求項20に記載の方法。
【請求項26】
前記組成物は薬学的に許容可能な担体をさらに含むことを特徴とする、請求項20に記載の方法。
【請求項27】
前記組成物は油中水型エマルジョンをさらに含むことを特徴とする、請求項20に記載の方法。
【請求項28】
前記少なくとも1つのTヘルパーペプチドはPADREエピトープであることを特徴とする、請求項20に記載の方法。
【請求項29】
前記少なくとも1つのTヘルパーペプチドはそれぞれ配列番号1のアミノ酸配列を有する2つのPADREエピトープであることを特徴とする、請求項28に記載の方法。
【請求項30】
前記少なくとも1つのTヘルパーペプチドはインフルエンザHAであることを特徴とする、請求項20に記載の方法。
【請求項31】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであることを特徴とする、請求項20に記載の方法。
【請求項32】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、前記少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原をさらにコンジュゲートしていることを特徴とする、請求項20に記載の方法。
【請求項33】
前記組成物は第2の荷電性多分枝ポリマーデンドリマーをさらに含み、該第2の荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのペプチド又はポリペプチドの抗原と異なる第2のペプチド又はポリペプチドの抗原とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記第2の荷電性多分枝ポリマーデンドリマーと、前記第2のペプチド又はポリペプチドの抗原との組み合わせが、前記第2のペプチド又はポリペプチドの抗原に対する免疫応答を誘導できるように、前記少なくとも1つのTヘルパーペプチドと、前記第2のペプチド又はポリペプチドの抗原とが前記第2の荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、請求項21に記載の方法。
【請求項34】
前記哺乳類は、げっ歯類又はウサギであり、前記モノクローナル抗体は前記哺乳類から採取されることを特徴とする、請求項20に記載の方法。
【請求項35】
前記モノクローナル抗体は、前記哺乳類から前記抗体を採取するステップと、前記抗体のタイターを測定するステップと、前記哺乳類から脾臓を摘出するステップと、ミエローマとの融合を実行するステップとによって調製されることを特徴とする、請求項34に記載の方法。
【請求項36】
前記抗体はヒト化されることを特徴とする、請求項35に記載の方法。
【請求項37】
少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物であって、前記少なくとも1つの荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、組成物。
【請求項38】
前記少なくとも1つの荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであり、前記siRNAは、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられることを特徴とする、請求項37に記載の組成物。
【請求項39】
siRNAをプロフェッショナル抗原提示細胞に送達する方法であって、該方法は、
(a)少なくとも1つのTヘルパーペプチドと、少なくとも1つのsiRNAとをコンジュゲートする少なくとも1つの荷電性多分枝ポリマーデンドリマーを含む組成物を提供するステップと、
(b)哺乳類の被験体に前記組成物を投与するステップとを含み、
前記組成物を提供するステップでは、前記少なくとも1つのTヘルパーペプチドがプロフェッショナル抗原提示細胞に特異的に結合するように、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとが前記荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、
前記投与するステップでは、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つのsiRNAとをコンジュゲートしている前記少なくとも1つの荷電性多分枝ポリマーデンドリマーが前記プロフェッショナル抗原提示細胞に結合し、前記siRNAが前記プロフェッショナル抗原提示細胞に入る条件下で前記組成物を投与することを特徴とする、方法。
【請求項40】
前記荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項39に記載の方法。
【請求項41】
前記siRNAは、CTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1に対して向けられることを特徴とする、請求項39に記載の方法。
【請求項42】
前記siRNAは、前記プロフェッショナル抗原提示細胞でCTLA−4、Foxp3、CD28、IDO又はアルギナーゼ1の発現を妨げることを特徴とする、請求項40に記載の方法。
【請求項43】
哺乳類において、MHCクラスII腫瘍細胞の増殖を抑制するか、MHCクラスII腫瘍細胞のアポトーシスを誘導するかの方法であって、該方法は、少なくとも1つのTヘルパーペプチドをコンジュゲートし、タンパク質をエンコードする核酸によって結合した少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を前記哺乳類に投与するステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーにおいて、前記少なくとも1つのTヘルパーペプチドが前記MHCクラスII腫瘍細胞に特異的に結合し、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸又は該核酸によってエンコードされるタンパク質との組み合わせが、前記MHCクラスII腫瘍細胞の増殖の抑制か、前記MHCクラスII腫瘍細胞のアポトーシスの誘導かをするように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされ、結合されることを特徴とする、方法。
【請求項44】
前記MHCクラスII腫瘍細胞は、リンパ腫又はリンパ腫の一部分であることを特徴とする、請求項43に記載の方法。
【請求項45】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項43に記載の方法。
【請求項46】
核酸を細胞に送達するための方法であって、該方法は、少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含む組成物を細胞に接触させるステップを含み、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーエピトープと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーエピトープが前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーエピトープと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーエピトープと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、方法。
【請求項47】
前記ペプチド又はタンパク質は前記細胞内で発現されることを特徴とする、請求項46に記載の方法。
【請求項48】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項46に記載の方法。
【請求項49】
核酸を細胞に送達するための組成物であって、該組成物は少なくとも1つの陽荷電性多分枝ポリマーデンドリマーを含み、該少なくとも1つの陽荷電性多分枝ポリマーデンドリマーは、少なくとも1つのTヘルパーペプチドと、ペプチド又はタンパク質をエンコードする少なくとも1つの核酸とをコンジュゲートし、前記少なくとも1つのTヘルパーペプチドは前記細胞に特異的に結合して、前記少なくとも1つのTヘルパーペプチドと、前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーと、前記核酸との組み合わせが前記細胞によって吸収されるように、前記少なくとも1つのTヘルパーペプチドと、前記核酸とが前記少なくとも1つの陽荷電性多分枝ポリマーデンドリマーの外表面にコンジュゲートされることを特徴とする、組成物。
【請求項50】
前記陽荷電性多分枝ポリマーデンドリマーはPAMAMデンドリマーであり、前記少なくとも1つのTヘルパーペプチドはPADREであることを特徴とする、請求項46に記載の組成物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【公表番号】特表2012−522802(P2012−522802A)
【公表日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願番号】特願2012−503723(P2012−503723)
【出願日】平成22年4月1日(2010.4.1)
【国際出願番号】PCT/US2010/029694
【国際公開番号】WO2010/115046
【国際公開日】平成22年10月7日(2010.10.7)
【出願人】(306036668)ユニバーシティ オブ マイアミ (10)
【Fターム(参考)】
【公表日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願日】平成22年4月1日(2010.4.1)
【国際出願番号】PCT/US2010/029694
【国際公開番号】WO2010/115046
【国際公開日】平成22年10月7日(2010.10.7)
【出願人】(306036668)ユニバーシティ オブ マイアミ (10)
【Fターム(参考)】
[ Back to top ]

