ワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法
【課題】光合成により二酸化炭素を炭素源として微細藻ユーグレナを好気的に培養した後、窒素飢餓状態でさらに培養することで細胞当たりのパラミロン蓄積量を増加させ、その後嫌気状態に置くことで、ワックスエステル高含有ユーグレナを生産することが可能なワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法を提供することにある。
【解決手段】ワックスエステル高含有ユーグレナの生産方法に関する。
微細藻ユーグレナを好気的に培養する第1の工程と、該培地を窒素飢餓状態にてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成る。
【解決手段】ワックスエステル高含有ユーグレナの生産方法に関する。
微細藻ユーグレナを好気的に培養する第1の工程と、該培地を窒素飢餓状態にてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、バイオ燃料の原料となるワックスエステルを高含有する微細藻ユーグレナを低エネルギー・低コストで生産することが可能なワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法に関する。
【背景技術】
【0002】
地球温暖化問題がクローズアップされる昨今において、温室効果ガスの一つである二酸化炭素ガスの排出量を抑制することや、二酸化炭素を固定することにより大気中の二酸化炭素濃度を低減することは、大きな課題となっている。
このような状況下、固定化された二酸化炭素を含有する化石燃料をエネルギーとして使用することは、固定した二酸化炭素を再度大気中へ放出することにつながり、環境問題となっている。また化石燃料は有限な資源であるため、枯渇の問題もある。
上記のような問題を解決するために、化石燃料以外の燃料源が必要とされており、高等植物や藻類を原料としたバイオ燃料の開発に対する期待が高まっている。
【0003】
バイオ燃料原料の候補となる高等植物としては、大豆、トウモロコシ、パームなどが知られているが、可食性作物を原料とする場合、食糧不足への懸念から問題になっている。一方、ジャトロファ、カメリナなどの非食性植物からの生産も進められているが、単位面積当りの生産量が低いことが問題となっている。
【0004】
一方、池や沼に広く生息する光合成微生物や原生動物は、植物と同様の光合成能を持ち、水と二酸化炭素から炭水化物や脂質を生合成し、細胞内に数十質量%蓄積する。その生産量は、植物に比べて高く、単位面積当たりで、これらの生産量が高いと言われるパームの10倍以上あることが知られている。
【0005】
ところで、光合成微生物の一種である微細藻ユーグレナは鞭毛虫の一群で、運動性のある藻類として有名なミドリムシを含む。大部分のユーグレナは、葉緑体を持っており、光合成を行って独立栄養生活を行うが、捕食性のものや吸収栄養性のものもある。ユーグレナ(Euglena)は、動物学と植物学の双方に分類される属である。
【0006】
動物学では、原生動物門(Protozoa)の鞭毛虫綱(Mastigophorea)、植物鞭毛虫亜綱(Phytomastigophorea)に属する目の中にミドリムシ目(Euglenida)があり、これは三つの亜目、Euglenoidina、Peranemoidina、Petalomonadoidinaよりなる。
Euglenoidinaには、属としてEuglena、Trachelemonas、Strombonas、Phacus、Lepocinelis、Astasia、Colaciumが含まれる。植物学では、ミドリムシ植物門(Euglenophyta)があり、その下にミドリムシ藻類綱(Euglenophyceae)、ミドリムシ目(Euglenales)があって、この目に含まれる属としてはEuglenaの他、動物分類表と同様である。
【0007】
ユーグレナは炭水化物としてパラミロン(Paramylon)を細胞内に蓄積する。パラミロンは、約700個のグルコースが、β―1,3−結合により重合した高分子体の粒子である。
【0008】
ユーグレナは嫌気状態に置かれると、貯蔵多糖であるパラミロンを分解して脂肪酸と脂肪アルコールからなるワックスエステルを最終産物とするワックスエステル発酵を行う。
【0009】
非特許文献1には、ユーグレナを光照射下で培養した後、窒素源のない培地に置換した実験区では1細胞当たりのパラミロン蓄積量が増加するが、窒素源を添加した培地に置換した実験区では1細胞当たりのパラミロン含有量が低下することが記載されている。
特許文献1には、ユーグレナを好気的に培養し、その後嫌気条件下に置くことで貯蔵多糖パラミロンを発酵させてロウ・エステル(ワックスエステル)に変換させることが記載されている。
【0010】
特許文献2には、微細藻ユーグレナを好気的に培養し、不飽和脂肪酸を添加した後、嫌気条件下に置くことで貯蔵多糖パラミロンを発酵させてワックスエステルに変換させることで、良質の潤滑油として用いられるマッコウ鯨油の代替原料となる不飽和ワックスエステルを生産する方法が記載されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特公平3−65948号公報
【特許文献2】特公平5−27384号公報
【非特許文献】
【0012】
【非特許文献1】Sumida et al., Ammonia- and Linght-InducedDegradation of Paramylum in Euglena gracilis. Plant Cell Physiol. 28(8). P1587-1592 (1987)
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、非特許文献1では、パラミロンの分解制御についてのみ記載されており、ワックスエステル発酵との組み合わせは示唆されていない。
【0014】
また、特許文献1には、好気的培養の方法として、炭素源としてグルコース等の有機物を添加するか、通常の光合成条件下で培養する等の一般的な方法しか開示されていない。
バイオ燃料の製造において、グルコース等の炭素源を用いる培養法はコストに合わず、二酸化炭素の固定にもつながらない。
【0015】
また、特許文献2に開示された技術は、不飽和ワックスエステルを高収量で得ることを目的としているが、バイオ燃料の原料としては飽和ワックスエステルである方が望ましい。
【0016】
本発明の目的は、上記各問題点を解決することにあり、光合成により二酸化炭素を炭素源として微細藻ユーグレナを好気的に培養した後、窒素飢餓状態でさらに培養することで細胞当たりのパラミロン蓄積量を増加させ、その後嫌気状態に置くことで、ワックスエステル高含有ユーグレナを生産することが可能なワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法を提供することにある。
【課題を解決するための手段】
【0017】
上記課題は、本発明に係るワックスエステル高含有ユーグレナの生産方法によれば、微細藻ユーグレナを好気的に培養する第1の工程と、前記微細藻ユーグレナが培養されている培地を窒素飢餓状態としてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成ることにより解決される。
【0018】
このように、好気的に培養→窒素飢餓状態においてさらに培養→細胞を嫌気状態下に保持という一連の工程を実行することにより、ワックスエステルの含有量が高いユーグレナを効率的に生産することができる。
つまり、工程2の窒素飢餓状態における培養により、ユーグレナに炭水化物を十分に蓄積させることができる。
このため、工程3にて、工程2で培養した細胞を嫌気状態に置くことにより、工程2で十分に蓄積された炭水化物をワックスエステルに変換させることとなるため、結果的に工程3におけるワックスエステル蓄積量は飛躍的に増加することとなる。
換言すれば、これら工程1→工程2→工程3を組み合わせることにより、ワックスエステルの蓄積量が飛躍的に増加するという有利な効果を生じることとなる。
また、窒素飢餓状態で培養したユーグレナの細胞は嫌気処理直後でも培養時と同じ緑色を呈し、死滅する細胞はほとんどなく、細胞の大きさも嫌気処理前と変化しない。
つまり、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べてユーグレナの細胞の生存率が大幅に改善するという有利な効果も生じる。
【0019】
また、このとき、前記窒素飢餓状態は、前記培地を窒素欠乏培地に置換することにより創出すると、効率良く窒素飢餓状態が創出できるため好適である。
このように、好気的に培養→窒素欠乏培地に置換してさらに培養→細胞を嫌気状態下に保持という一連の工程を実行することにより、ワックスエステルの含有量が高いユーグレナを効率的に生産することができる。
【0020】
具体的には、前記第1の工程においては、前記微細藻ユーグレナを、窒素源を含まない培地で好気的に培養を開始するとともに、流加量を適宜調節して窒素源を加えて継続的かつ好気的に培養を行い、細胞濃度が一定に達したところで窒素源の流加を停止し、前記第2の工程においては、窒素飢餓状態に置いてさらに培養を行うと好適である。
更に、具体的には、前記第1の工程においては、二酸化炭素ガスを通気することにより、二酸化炭素源と混入している酸素源が付与されるものであり、前記二酸化炭素ガスは、発電所から排出されるものであるとより好適である。
【0021】
このように構成されることによって、培養をメスアップして工業化することが可能となり、大量生産を行うことができる。
更に、排ガスとして取得できる二酸化炭素ガスを有効に活用することができるため、コスト面で有利であるとともに、環境面においても非常に有用な技術となる。
なお、工程2の窒素飢餓状態は、工程1で窒素源の流加を停止しているため、ユーグレナが窒素源を全て資化してしまう結果創出される。
【0022】
また、前記第3の工程においては、不活性ガス通気、静置処理、遠心分離による濃縮から選択される少なくとも一つの方法により嫌気処理を行うと好適である。
これは、一種の方法を選択しても良いし、複数の方法を組み合わせてもよい。
【0023】
また、上記課題は、本発明に係るワックスエステル製造方法によれば、請求項1乃至請求項5いずれかに一項に記載のワックスエステル高含有ユーグレナの生産方法により生産されたワックスエステル高含有ユーグレナを使用し、有機溶媒で油分画を抽出して抽出液を得、該抽出液を濃縮してワックス成分を得る工程、前記ワックス成分からワックスエステルをカラムにより分離して第1の精製を行う工程、を実施することにより解決される。
【0024】
このように、本発明においては、培養されたユーグレナより、簡易にワックスエステル成分を精製することができる。
このユーグレナは、上記請求項1乃至請求項6に記載の方法により、ワックスエステルを高含有した状態で簡易かつ大量に培養することができる。
よって、本発明によれば、大量に培養されたユーグレナを利用して、良質でクリーンな燃料を安定的に供給することが可能となる。
【0025】
具体的には、前記濃縮は、50度±10℃の範囲で実施すると好適である。
この温度より低いと、ワックス成分の粘性により突沸し、濃縮器であるエバポレータ内にワックス成分が噴出する可能性を否定できない。
【0026】
更に具体的には、前記第1の精製を行う工程により得られた前記ワックスエステルを加水分解し第2の精製を行う工程を次工程として実施すると好適である。
このように構成されていると、第1の精製において粗生成されたものを、第2の精製により更に精製を重ねることができ、より良質な燃料を提供することができる。
つまり、第1の精製を行う工程後、第2の精製において加水分解を行うことによって、炭素鎖が短くなり、揮発性が増して、燃料としての価値が上がる。
【0027】
また、前記第1の精製を行う工程において、前記カラムに適用する溶出溶媒としてヘキサン若しくは、エーテルを10容量%以下混合したヘキサンとエーテルの混合溶媒を使用すると好適である。
このように構成されていると、効率よくクロロフィルを分離することができるとともに、他の色素も有効に排除することができるため好適である。
よって、より良質な燃料を提供することができる。
【0028】
なお、上記ワックスエステル製造方法によりユーグレナから製造されたワックスエステルは、良質なバイオ燃料となり、これらは大量に安定的に提供することができる。
また、これはクリーンなエネルギーであり、環境問題等の改善に大きく寄与するものである。
【0029】
以上のように、前記課題を解決するため、本発明に係るワックスエステル製造方法は、ユーグレナを好気的に培養する培養工程と、培養工程の後、窒素飢餓状態でさらに培養することにより炭水化物を蓄積させる培養工程と、培養した細胞を嫌気状態に置くことにより炭水化物をワックスエステルに変換させる嫌気発酵工程とを含むことを最大の特徴としている。
【発明の効果】
【0030】
本発明によれば、光合成によって固定化した二酸化炭素から油脂含有量の多いバイオマス原料を安価に提供することができる。
また、本発明によってバイオ燃料を製造すればエネルギー自給率の向上にもつながる。
【図面の簡単な説明】
【0031】
【図1】本発明の第1の実施形態に係るワックスエステル高含有ユーグレナの生産方法を示す工程図である。
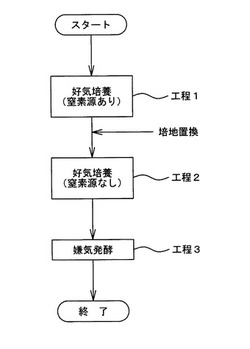
【図2】本発明の第2の実施形態に係るワックスエステル高含有ユーグレナの生産方法を示すフローチャートである。
【図3】本発明の一実施形態に係るワックスエステルの製造方法を示す工程図である。
【発明を実施するための形態】
【0032】
以下、本発明の一実施形態を図面に基づいて説明する。
なお、以下に説明する構成は本発明を限定するものでなく、本発明の趣旨の範囲内で種々改変することができるものとする。
本実施形態は、好気的条件下でユーグレナを培養し、その後窒素飢餓状態でさらに培養した後、嫌気状態に置くことでワックスエステルを高含有させたユーグレナの生産方法に関する。
【0033】
(第1の実施形態)
図1により、本発明に係るワックスエステル高含有ユーグレナの生産方法の第1の実施形態について説明する。
本生産方法は、ユーグレナを窒素源添加した培地で好気的に培養する工程1(第1の工程に相当)と、窒素源を含まない培地に置換して好気的に培養する工程2(第2の工程に相当)と、嫌気処理を行い、炭水化物をワックスエステルに発酵させる工程3(第3の工程に相当)とを含んでいる。
【0034】
まず、工程1におけるユーグレナの培養は、二酸化炭素源として大気を培地に通気することにより行うこともできるが、培養効率を上げるため、二酸化炭素ガスを培地に通気する方が好ましい。
つまり、大気や二酸化炭素ガスには酸素も含まれているため、これによって好気的に培養を行うものである。
二酸化炭素ガスの通気は、例えば、工場や発電所等から排出される燃焼排ガスを利用することにより行うことができる。このとき、集塵機、脱硝装置、脱硫装置等により燃焼排ガス中の塵埃、NOxおよびSOxを取り除いておくのが好ましい。また、攪拌は通気によるエアリフト方式や、攪拌ハネを用いる方法等、一般的な技術を用いることができる。
【0035】
光は蛍光灯等の人工光を照射することにより行うこともできるが、より低エネルギー・低コストに培養するために太陽光のみで培養を行うことが望ましい。
また、培地の水温は、29±1℃に制御するのが好ましい。
ただし、水温制御にエネルギーを投入しないように温度制御は行わないか、水温制御を行うにしても、ユーグレナが死滅するような高温にならないよう冷却を行うことや、冬季や夜間に水温が低下しすぎないように暖める等の最小限の制御を行うと好適である。
【0036】
ユーグレナの培地組成は、例えば、改変Cramer-Myers培地((NH4)2HPO4 1.0g/L、KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH3.5))を用いることができる。なお、(NH4)2HPO4は、(NH4)2SO4やNH3aqに変換することも可能である。
なお、培地組成がこれに限定されるものでないことは言うまでもない。
【0037】
培地のpHは、2〜7.5の範囲内であればよいが、3.5又は5.5に調整するのが好ましい。特に、4.5以下の酸性とすることで、動物性プランクトンや細菌等のコンタミネーションを有効に抑制することができる。
【0038】
次いで、工程2では、窒素源を含まない培地に置換して、さらに培養を行う。
工程2における窒素源を含まない培地組成は、例えば、Resting培地、1%マンニトール、0.2% MgCl2・6H2O、0.14% KH2PO4を用いることができる。
なお、培地組成は窒素源が含まれていない限り、これに限定されるものでないことは言うまでもない。
【0039】
次いで、工程3では、培養したユーグレナの嫌気処理を行う。
嫌気処理は、通常、培養後の培地に窒素ガス等の不活性ガスを通気することにより行う。また、嫌気処理は培地を静置することによっても行うことができる。培地を攪拌せずに静置すると細胞が沈降し、高密度になることによって結果的に酸素不足となるためである。遠心分離により高密度状態を作り出すことで嫌気処理を行ってもよい。
このときのpHは、極端に低い、又は高い値でなければよく、光照射の有無はワックスエステル発酵には影響がない。保持温度はユーグレナが死滅するような高温、培地が凍結するような低温でなければ良い。通常、6時間〜72時間でワックスエステル発酵は終わる。
【0040】
なお、工程2の窒素飢餓状態における培養により、ユーグレナに炭水化物を十分に蓄積させることができる。
このため、工程3にて、工程2で培養した細胞を嫌気状態に置くことにより、工程2で十分に蓄積された炭水化物をワックスエステルに変換させることとなるため、結果的に工程3におけるワックスエステル蓄積量は飛躍的に増加することとなる。
【0041】
換言すれば、これら工程1→工程2→工程3を組み合わせることにより、ワックスエステルの蓄積量が飛躍的に増加するという、各工程単独では得られない有利な効果を生じることとなる。
【0042】
また、下記実施例にて詳述するが、窒素飢餓状態で培養したユーグレナの細胞は嫌気処理直後でも培養時と同じ緑色を呈し、死滅する細胞はほとんどなく、細胞の大きさも嫌気処理前と変化しない。
つまり、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べてユーグレナの細胞の生存率が大幅に改善するという有利な効果も生じる。
以上より、これら工程1→工程2→工程3を組み合わせることによって、従来と比して飛躍的多量のワックスエステルを含有した細胞活性の高いユーグレナを得ることができる。
【0043】
(第2の実施形態)
図2により、本発明に係るワックスエステル高含有ユーグレナの生産方法の第2の実施形態について説明する。
なお、培地組成、培養条件等は、第1の実施例と同様であるため、同様の説明は省略し、相違点のみ説明する。
【0044】
工程1における好気培養工程は、第1の実施形態の工程1における改変Cramer-Myers培地から窒素源を抜いたものを使用する。
つまり、スタート段階では、窒素源を含まない培地で好気的にユーグレナの培養を開始する。
工程1においては、まず、ステップS1において、ユーグレナを接種した培地に窒素源を流加する。
【0045】
そして、ステップS2により好気培養を行う。
次いで、ステップS3において、窒素源添加を終了してよいか否かを判定する。
ステップ3において、窒素源添加を終了しないと判定されれば(ステップS3:No)、処理は、ステップS1に戻り窒素源を流加する。
また、ステップ3において、窒素源添加を終了してよいと判定されれば(ステップS3:Yes)、処理は、ステップS4に進み、窒素源添加を終了する。
つまり、工程1においては、窒素源を徐々に流加し、窒素源を含む好気培養を行うこととなる。
この窒素源の流加量等は、天候、気温等の条件に依存し、これらの条件を勘案することにより適宜調整される。
なお、窒素源添加を終了する目安としては、本実施形態においては、上記条件等も勘案しながら、例えば、細胞濃度が一定に達した時期等が選択される。
【0046】
次いで、工程2(ステップS5)において、継続して好気培養を必要期間行う。
このとき、初期の段階では窒素源が残留しているが、時間が経つにつれ窒素源はユーグレナにより資化され、窒素源飢餓状態となる。
このため、所謂工程2の「好気培養工程 窒素源なし」という培養工程が成立する。
次いで、ステップS6にて、工程3の嫌気発酵工程が実施されるが、この工程は、第1の実施形態と同様である。
【0047】
なお、窒素源を添加する方法としては、窒素源を培養開始時に一度に投入する方法も考えられる。
この場合は、初期の段階では窒素源が残留しているが、時間が経つにつれ窒素源はユーグレナにより資化され、窒素源飢餓状態となる。
このため、窒素飢餓状態での好気培養、すなわち、「好気培養工程 窒素源なし」という培養工程が成立することとなる。
【0048】
上記第2の実施形態に係るワックスエステル高含有ユーグレナの生産方法は、工業化ラインにスケールアップした際に有効である。
つまり、連続運転により培養を行うことが可能となり、培地置換のための遠心分離作業等が不要となる。
よって、培養に必要なエネルギー使用量を減少させて、ワックスエステル高含有ユーグレナの大量生産に有効に適用される。
【0049】
次いで、図3を参照し、本実施形態に係るユーグレナからのワックスエステル製造方法の工程を説明する。
まず、工程1でユーグレナを培養する。これは、上記第1の実施形態又は第2の実施形態に係る生産工程に係る培養である。
【0050】
次いで、工程2でワックスエステルを抽出する。
その後、工程2で得られた成分を工程3で第1の精製にかけ、次いで、工程4で第2の精製にかけ、ワックスエステルを得る。
第1の精製では、有機溶媒によりユーグレナからワックスエステルを抽出し、第2の精製では、カラムによりワックスエステルの分離精製を行う。
このようにして精製されたワックスエステルはこれを含有するバイオ燃料として有効に利用することができる。
【実施例】
【0051】
(ワックスエステル高含有ユーグレナの生産方法について)
以下に、本発明に係るワックスエステル高含有ユーグレナについて、一実施例を示して具体的に説明する。
【0052】
この実施例では、Euglena graclilis Z株を用いた。
培地は改変Cramer-Myers培地((NH4)2HPO4 1.0g/L、KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH5.5))をオートクレーブ滅菌することにより調整した。
【0053】
(工程1:好気培養)
調製した培地880mlを1L容量の振とうフラスコに入れた後、初期濃度が約0.05g/Lになるようにユーグレナの種藻体を接種し、29℃に設定した人工気象器(サンヨー社製、GROWTH CABINET)内で9日間振とう培養した。光照射強度は約100μmol/(m2・s)とし、光照射時間は24時間連続とした。フラスコには、通気濃度10%の二酸化炭素ガスを供給した。
【0054】
(工程2:窒素欠乏培養)
9日間培養した後、培養液を2つに分け、窒素源を含まない培地、窒素源を含む培地それぞれに置換した。
具体的には、880mlの培養液から420mlずつの培養液をとり分け、それぞれ遠心分離して上清を捨てた後、一方の沈殿には窒素源を抜いた改変Cramer-Myers培地(以下、窒素源欠乏培地) KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH5.5))を420ml、もう一方の沈殿には新たなCM培地(窒素源含む)を420ml加えて沈殿を懸濁した。
窒素源欠乏培地に置換した培養液をサンプル1、新たなCM培地に置換した培養液をサンプル2とする。
【0055】
培地交換をした後、サンプル1とサンプル2共に、29℃に設定した人工気象器内で48時間さらに振とう培養した。光照射強度は約100μmol/(m2・s)とし、光照射時間は24時間連続とした。フラスコには、通気濃度10%の二酸化炭素ガスを供給した。
【0056】
(工程3:嫌気処理)
培地置換培養をした後、サンプル1とサンプル2の乾燥重量を測定し(表1A)、29℃に設定した人工気象器内で遮光してフラスコを密栓し、静置することにより細胞を嫌気状態に置いた。
【0057】
培養液中におけるユーグレナ細胞の乾燥重量の測定方法は以下の通りである。
105℃で30分間、乾燥機内であらかじめ乾燥し、重量を測定した約1μmの孔径をもつガラスろ紙GS−25(ADVANTEC社製)で培養液1mlをろ過した。次にガラスろ紙を105℃に設定した乾燥機に入れて1時間乾燥させた。その後、真空デシケータ内で減圧しながら20分間脱湿・冷却後、精密天秤にて重量測定した。ろ過前後のろ紙の重量の差を、1ml当たりの乾燥重量とした。
【0058】
48時間嫌気処理を行った後、両サンプルを回収した。回収した400mlの培養液を、遠心分離機(コクサン社製、H−103FN)を用いて5分間、3,000rpm、常温で遠心分離した後、上清を捨て、沈殿した藻体を回収した。回収した藻体は冷凍した後、凍結乾燥した。
【0059】
(脂質の抽出)
50ml容量のナスフラスコを真空デシケータ内で1時間程度乾燥させ、ナスフラスコ自体の重量を測定した。凍結乾燥したユーグレナ粉末をスパーテルなどで破砕し、その粉末を50ml容量の三角フラスコに測りとった。このとき、サンプル1の重量は0.693g、サンプル2の重量は0.480gであった(表1B)。
次に、各サンプルに20mlのヘキサンを加えて懸濁した。粉末のダマをさらに破砕するため、30秒間超音波破砕した。自然沈降後の上清をパスツールピペットにて50ml容量の蓋付ガラス製遠心管に移し、10分間、3,000rpmにて遠心分離し、上清はろ紙(Advantec社、NO.2)を介してろ過した。
抽出操作は、溶媒をかえながら計9回繰り返した。
つまり、ヘキサンを用いて上記の抽出操作を3回繰り返した後、有機溶媒をアセトンにかえて同様に3回抽出操作を行い、最後にヘキサンとアセトンを1:1で混合した溶媒を用いて3回抽出操作を行った。
その後、ロータリーエバポレータ(東京理化器械社製、ROTARY VACCUUMEVAPORATOR)を用いて、ろ液入りのナスフラスコを40〜50℃で湯浴し、ヘキサン・アセトンを蒸発させた。少量のヘキサンを用いて、ナスフラスコ内を洗いこみながら、秤量済みのナスフラスコに移した。この操作を4回繰り返した後、上記と同様にヘキサンを蒸発させた。
ナスフラスコにアルミホイルでフタをし、真空デシケータに入れて残りのヘキサンを蒸発させながら、30分〜1時間程度、乾燥させた。
ユーグレナ粉末から脂質を抽出した後のナスフラスコの重量を測定し、最初に測定したナスフラスコ自体の重量を差し引いて、脂質重量を算出した(表1C)。
なお、本抽出方法によって抽出される脂質は、そのほとんどがワックスエステルで構成されている。
【0060】
本実験の結果、最終的な粗脂質の抽出量は窒素欠乏培地で培養したサンプル1が0.188g、窒素源を含むCM培地で培養したサンプル2が0.157gであり、窒素欠乏培地で培養した方が粗脂質の終了は0.031g多かった(表1C)。
【0061】
また、嫌気処理前の乾燥重量に対する粗脂質の含有率は、窒素欠乏培地で培養したサンプル1は23%、窒素を含むCM培地で培養したサンプル2は16%であり、窒素欠乏培地で培養した方が脂質含有率も7%高かった(表1C/A)。
【0062】
さらに、サンプル1は嫌気処理の前後で約0.120g細胞重量が減少していたが、サンプル2では0.507gも細胞数が減少していた(表1B)。嫌気処理直後のサンプル2の培養液は茶色く変色しており、顕微鏡観察したところ、死滅した細胞が多く、生きている細胞も大きさは小さくなっていた。一方、サンプル1は嫌気処理直後でも培養時と同じ緑色を呈し、顕微鏡観察したところ、死滅した細胞はほとんどなく、細胞の大きさも嫌気処理前と変わらなかった。以上の結果から、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べて細胞の生存率が大幅に改善することがわかった。
結果を、表1にまとめる。
【0063】
【表1】

【0064】
以上より、窒素飢餓状態に置いた実験区では、窒素源を含む培地で培養した実験区に比べて最終的な脂質の収量が増加した上、嫌気処理前後の細胞の生存率も著しく改善することがわかった。
【0065】
(ワックスエステルの分離精製について)
次いで、ユーグレナからワックスエステルを抽出して精製する手順の一実施例について説明する。
本実施形態においては、粉末化したユーグレナを使用して、ユーグレナ体内に貯蔵されていたワックスエステルを抽出して精製した(工程2)。
(材料)
ユーグレナ粉末 10kg
ヘキサン 60L
エーテル 1L
Wakogel C-300 300g
【0066】
1.抽出及びろ過
(1)ユーグレナ1kgを秤量し、2.5Lヘキサンに縣濁した
(2)ブレンダーにて激しく撹拌した
30秒×3回
(3)10分間室温で放置し、ユーグレナ粉末を自然沈殿させた
(4)上澄液をろ紙にて吸引ろ過した
(5)沈殿物をブフナーロートに移し、沈殿物に付着した油成分を搾った
(6)(4)の炉液及び(5)の回収液をナスフラスコに移し、ロータリーエバポレーターで濃縮した(濃縮条件:温度50℃±10℃、減圧度100mmHg〜150mmHg)この濃縮液を以下、「濃縮サンプル」と記す。
【0067】
2.分離精製(工程3)
(1)ガラスカラム(100φ)にヘキサンで縣濁したWakogel C-300を30センチ程度充填(約300g充填)した
(2)1カラムボリュームのヘキサンを流してカラムを平衡化した
(3)約500g程度の濃縮サンプルをカラムにアプライした
(4)溶出溶媒にて、カラムに保持された濃縮サンプルからワックス成分を分離した溶出溶媒は、
a.ヘキサン:エーテル=100: 0(以下、「溶出溶媒a」と記す)
b.ヘキサン:エーテル= 95: 5(以下、「溶出溶媒b」と記す)
c.ヘキサン:エーテル= 90:10(以下、「溶出溶媒c」と記す)
の3種類を使用した
(5)分離したワックス成分を酸加水分解を行うことにより第2の精製を行った(工程4)。
【0068】
結果
上記方法により実施したワックスエステルの抽出結果を示す。
(1)ユーグレナ10Kgから、約3L程度のワックス成分が抽出された。
最終的な回収率より、一度のヘキサン抽出で、ワックス成分はほぼ全て回収できると考えられる。
(2)ろ過を行う際には、ろ過性が良好ではないため、ろ紙上にセライトを撒いてろ過を行った。
(3)濃縮を行う際には、30℃前後程度で濃縮を行うと、揮発熱によって濃縮液が冷えて表面からワックス成分の粘性が高まり、突沸によってエバポレーター内に噴出する。これを回避するために、50℃前後程度で濃縮を行うと、ワックス成分の粘性が低下し、突沸によってエバポレーター内に噴出することを回避できた。
(4)1カラムボリュームのヘキサンを流してカラムを平衡化した後、約500g程度の濃縮サンプルをカラムにアプライしたが、280g程度は保持されず、そのまま溶出した。そのため、溶出溶媒aを2カラムボリューム流し、保持されていない成分を溶出して濃縮した。
(5)次に、溶出溶媒bを3カラムボリューム分流して溶出及び濃縮を行ったところ、ワックス成分は、黄色の色素とともに溶出されることがわかった。
(6)次に、完全にワックス成分を溶出するために、溶出溶媒cを3カラムボリューム分流して溶出及び溶出を行った。
この際、約240g(300mL)程度のワックス成分が回収できた。
なお、クロロフィル成分は分離できたが、いくつかの色素は非常に低濃度ながらも残存していた。
【0069】
考察
上記の結果より、ワックス成分を240g程度保持するために必要であったカラム容量は、約2L(約1kg)で、溶出に要した溶媒の量は、9カラムボリューム(約18L)であった。
ワックス成分が2.5kgであった場合、必要なカラム容量は、約24L(約12kg)であり、溶出に要する溶媒の容量は約200L程度であることがわかる。
【0070】
以上のように、分離後、加水分解を行うことによって、ワックスエステルの炭素鎖が短くなり、揮発性が増して、燃料としての価値が上がる。
そして、このワックスエステルをバイオ燃料として有効に使用することができる。
ユーグレナは、健康食品等にも使用されているとおり、簡易に手に入る微生物であるとともに、大量に培養することが可能である。
このような微生物であるユーグレナより良質なワックスエステルを回収することにより、クリーンなエネルギーを安定的に供給することができる。
なお、本例においては、有機溶媒での抽出を実行したが、抽出方法はこれに限られることはなく、例えば、水での分離、二酸化炭素流体を用いた方法、圧搾等の物理的方法も用いることができる。
【技術分野】
【0001】
本発明は、バイオ燃料の原料となるワックスエステルを高含有する微細藻ユーグレナを低エネルギー・低コストで生産することが可能なワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法に関する。
【背景技術】
【0002】
地球温暖化問題がクローズアップされる昨今において、温室効果ガスの一つである二酸化炭素ガスの排出量を抑制することや、二酸化炭素を固定することにより大気中の二酸化炭素濃度を低減することは、大きな課題となっている。
このような状況下、固定化された二酸化炭素を含有する化石燃料をエネルギーとして使用することは、固定した二酸化炭素を再度大気中へ放出することにつながり、環境問題となっている。また化石燃料は有限な資源であるため、枯渇の問題もある。
上記のような問題を解決するために、化石燃料以外の燃料源が必要とされており、高等植物や藻類を原料としたバイオ燃料の開発に対する期待が高まっている。
【0003】
バイオ燃料原料の候補となる高等植物としては、大豆、トウモロコシ、パームなどが知られているが、可食性作物を原料とする場合、食糧不足への懸念から問題になっている。一方、ジャトロファ、カメリナなどの非食性植物からの生産も進められているが、単位面積当りの生産量が低いことが問題となっている。
【0004】
一方、池や沼に広く生息する光合成微生物や原生動物は、植物と同様の光合成能を持ち、水と二酸化炭素から炭水化物や脂質を生合成し、細胞内に数十質量%蓄積する。その生産量は、植物に比べて高く、単位面積当たりで、これらの生産量が高いと言われるパームの10倍以上あることが知られている。
【0005】
ところで、光合成微生物の一種である微細藻ユーグレナは鞭毛虫の一群で、運動性のある藻類として有名なミドリムシを含む。大部分のユーグレナは、葉緑体を持っており、光合成を行って独立栄養生活を行うが、捕食性のものや吸収栄養性のものもある。ユーグレナ(Euglena)は、動物学と植物学の双方に分類される属である。
【0006】
動物学では、原生動物門(Protozoa)の鞭毛虫綱(Mastigophorea)、植物鞭毛虫亜綱(Phytomastigophorea)に属する目の中にミドリムシ目(Euglenida)があり、これは三つの亜目、Euglenoidina、Peranemoidina、Petalomonadoidinaよりなる。
Euglenoidinaには、属としてEuglena、Trachelemonas、Strombonas、Phacus、Lepocinelis、Astasia、Colaciumが含まれる。植物学では、ミドリムシ植物門(Euglenophyta)があり、その下にミドリムシ藻類綱(Euglenophyceae)、ミドリムシ目(Euglenales)があって、この目に含まれる属としてはEuglenaの他、動物分類表と同様である。
【0007】
ユーグレナは炭水化物としてパラミロン(Paramylon)を細胞内に蓄積する。パラミロンは、約700個のグルコースが、β―1,3−結合により重合した高分子体の粒子である。
【0008】
ユーグレナは嫌気状態に置かれると、貯蔵多糖であるパラミロンを分解して脂肪酸と脂肪アルコールからなるワックスエステルを最終産物とするワックスエステル発酵を行う。
【0009】
非特許文献1には、ユーグレナを光照射下で培養した後、窒素源のない培地に置換した実験区では1細胞当たりのパラミロン蓄積量が増加するが、窒素源を添加した培地に置換した実験区では1細胞当たりのパラミロン含有量が低下することが記載されている。
特許文献1には、ユーグレナを好気的に培養し、その後嫌気条件下に置くことで貯蔵多糖パラミロンを発酵させてロウ・エステル(ワックスエステル)に変換させることが記載されている。
【0010】
特許文献2には、微細藻ユーグレナを好気的に培養し、不飽和脂肪酸を添加した後、嫌気条件下に置くことで貯蔵多糖パラミロンを発酵させてワックスエステルに変換させることで、良質の潤滑油として用いられるマッコウ鯨油の代替原料となる不飽和ワックスエステルを生産する方法が記載されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特公平3−65948号公報
【特許文献2】特公平5−27384号公報
【非特許文献】
【0012】
【非特許文献1】Sumida et al., Ammonia- and Linght-InducedDegradation of Paramylum in Euglena gracilis. Plant Cell Physiol. 28(8). P1587-1592 (1987)
【発明の概要】
【発明が解決しようとする課題】
【0013】
しかしながら、非特許文献1では、パラミロンの分解制御についてのみ記載されており、ワックスエステル発酵との組み合わせは示唆されていない。
【0014】
また、特許文献1には、好気的培養の方法として、炭素源としてグルコース等の有機物を添加するか、通常の光合成条件下で培養する等の一般的な方法しか開示されていない。
バイオ燃料の製造において、グルコース等の炭素源を用いる培養法はコストに合わず、二酸化炭素の固定にもつながらない。
【0015】
また、特許文献2に開示された技術は、不飽和ワックスエステルを高収量で得ることを目的としているが、バイオ燃料の原料としては飽和ワックスエステルである方が望ましい。
【0016】
本発明の目的は、上記各問題点を解決することにあり、光合成により二酸化炭素を炭素源として微細藻ユーグレナを好気的に培養した後、窒素飢餓状態でさらに培養することで細胞当たりのパラミロン蓄積量を増加させ、その後嫌気状態に置くことで、ワックスエステル高含有ユーグレナを生産することが可能なワックスエステル高含有ユーグレナの生産方法及びワックスエステル製造方法を提供することにある。
【課題を解決するための手段】
【0017】
上記課題は、本発明に係るワックスエステル高含有ユーグレナの生産方法によれば、微細藻ユーグレナを好気的に培養する第1の工程と、前記微細藻ユーグレナが培養されている培地を窒素飢餓状態としてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成ることにより解決される。
【0018】
このように、好気的に培養→窒素飢餓状態においてさらに培養→細胞を嫌気状態下に保持という一連の工程を実行することにより、ワックスエステルの含有量が高いユーグレナを効率的に生産することができる。
つまり、工程2の窒素飢餓状態における培養により、ユーグレナに炭水化物を十分に蓄積させることができる。
このため、工程3にて、工程2で培養した細胞を嫌気状態に置くことにより、工程2で十分に蓄積された炭水化物をワックスエステルに変換させることとなるため、結果的に工程3におけるワックスエステル蓄積量は飛躍的に増加することとなる。
換言すれば、これら工程1→工程2→工程3を組み合わせることにより、ワックスエステルの蓄積量が飛躍的に増加するという有利な効果を生じることとなる。
また、窒素飢餓状態で培養したユーグレナの細胞は嫌気処理直後でも培養時と同じ緑色を呈し、死滅する細胞はほとんどなく、細胞の大きさも嫌気処理前と変化しない。
つまり、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べてユーグレナの細胞の生存率が大幅に改善するという有利な効果も生じる。
【0019】
また、このとき、前記窒素飢餓状態は、前記培地を窒素欠乏培地に置換することにより創出すると、効率良く窒素飢餓状態が創出できるため好適である。
このように、好気的に培養→窒素欠乏培地に置換してさらに培養→細胞を嫌気状態下に保持という一連の工程を実行することにより、ワックスエステルの含有量が高いユーグレナを効率的に生産することができる。
【0020】
具体的には、前記第1の工程においては、前記微細藻ユーグレナを、窒素源を含まない培地で好気的に培養を開始するとともに、流加量を適宜調節して窒素源を加えて継続的かつ好気的に培養を行い、細胞濃度が一定に達したところで窒素源の流加を停止し、前記第2の工程においては、窒素飢餓状態に置いてさらに培養を行うと好適である。
更に、具体的には、前記第1の工程においては、二酸化炭素ガスを通気することにより、二酸化炭素源と混入している酸素源が付与されるものであり、前記二酸化炭素ガスは、発電所から排出されるものであるとより好適である。
【0021】
このように構成されることによって、培養をメスアップして工業化することが可能となり、大量生産を行うことができる。
更に、排ガスとして取得できる二酸化炭素ガスを有効に活用することができるため、コスト面で有利であるとともに、環境面においても非常に有用な技術となる。
なお、工程2の窒素飢餓状態は、工程1で窒素源の流加を停止しているため、ユーグレナが窒素源を全て資化してしまう結果創出される。
【0022】
また、前記第3の工程においては、不活性ガス通気、静置処理、遠心分離による濃縮から選択される少なくとも一つの方法により嫌気処理を行うと好適である。
これは、一種の方法を選択しても良いし、複数の方法を組み合わせてもよい。
【0023】
また、上記課題は、本発明に係るワックスエステル製造方法によれば、請求項1乃至請求項5いずれかに一項に記載のワックスエステル高含有ユーグレナの生産方法により生産されたワックスエステル高含有ユーグレナを使用し、有機溶媒で油分画を抽出して抽出液を得、該抽出液を濃縮してワックス成分を得る工程、前記ワックス成分からワックスエステルをカラムにより分離して第1の精製を行う工程、を実施することにより解決される。
【0024】
このように、本発明においては、培養されたユーグレナより、簡易にワックスエステル成分を精製することができる。
このユーグレナは、上記請求項1乃至請求項6に記載の方法により、ワックスエステルを高含有した状態で簡易かつ大量に培養することができる。
よって、本発明によれば、大量に培養されたユーグレナを利用して、良質でクリーンな燃料を安定的に供給することが可能となる。
【0025】
具体的には、前記濃縮は、50度±10℃の範囲で実施すると好適である。
この温度より低いと、ワックス成分の粘性により突沸し、濃縮器であるエバポレータ内にワックス成分が噴出する可能性を否定できない。
【0026】
更に具体的には、前記第1の精製を行う工程により得られた前記ワックスエステルを加水分解し第2の精製を行う工程を次工程として実施すると好適である。
このように構成されていると、第1の精製において粗生成されたものを、第2の精製により更に精製を重ねることができ、より良質な燃料を提供することができる。
つまり、第1の精製を行う工程後、第2の精製において加水分解を行うことによって、炭素鎖が短くなり、揮発性が増して、燃料としての価値が上がる。
【0027】
また、前記第1の精製を行う工程において、前記カラムに適用する溶出溶媒としてヘキサン若しくは、エーテルを10容量%以下混合したヘキサンとエーテルの混合溶媒を使用すると好適である。
このように構成されていると、効率よくクロロフィルを分離することができるとともに、他の色素も有効に排除することができるため好適である。
よって、より良質な燃料を提供することができる。
【0028】
なお、上記ワックスエステル製造方法によりユーグレナから製造されたワックスエステルは、良質なバイオ燃料となり、これらは大量に安定的に提供することができる。
また、これはクリーンなエネルギーであり、環境問題等の改善に大きく寄与するものである。
【0029】
以上のように、前記課題を解決するため、本発明に係るワックスエステル製造方法は、ユーグレナを好気的に培養する培養工程と、培養工程の後、窒素飢餓状態でさらに培養することにより炭水化物を蓄積させる培養工程と、培養した細胞を嫌気状態に置くことにより炭水化物をワックスエステルに変換させる嫌気発酵工程とを含むことを最大の特徴としている。
【発明の効果】
【0030】
本発明によれば、光合成によって固定化した二酸化炭素から油脂含有量の多いバイオマス原料を安価に提供することができる。
また、本発明によってバイオ燃料を製造すればエネルギー自給率の向上にもつながる。
【図面の簡単な説明】
【0031】
【図1】本発明の第1の実施形態に係るワックスエステル高含有ユーグレナの生産方法を示す工程図である。
【図2】本発明の第2の実施形態に係るワックスエステル高含有ユーグレナの生産方法を示すフローチャートである。
【図3】本発明の一実施形態に係るワックスエステルの製造方法を示す工程図である。
【発明を実施するための形態】
【0032】
以下、本発明の一実施形態を図面に基づいて説明する。
なお、以下に説明する構成は本発明を限定するものでなく、本発明の趣旨の範囲内で種々改変することができるものとする。
本実施形態は、好気的条件下でユーグレナを培養し、その後窒素飢餓状態でさらに培養した後、嫌気状態に置くことでワックスエステルを高含有させたユーグレナの生産方法に関する。
【0033】
(第1の実施形態)
図1により、本発明に係るワックスエステル高含有ユーグレナの生産方法の第1の実施形態について説明する。
本生産方法は、ユーグレナを窒素源添加した培地で好気的に培養する工程1(第1の工程に相当)と、窒素源を含まない培地に置換して好気的に培養する工程2(第2の工程に相当)と、嫌気処理を行い、炭水化物をワックスエステルに発酵させる工程3(第3の工程に相当)とを含んでいる。
【0034】
まず、工程1におけるユーグレナの培養は、二酸化炭素源として大気を培地に通気することにより行うこともできるが、培養効率を上げるため、二酸化炭素ガスを培地に通気する方が好ましい。
つまり、大気や二酸化炭素ガスには酸素も含まれているため、これによって好気的に培養を行うものである。
二酸化炭素ガスの通気は、例えば、工場や発電所等から排出される燃焼排ガスを利用することにより行うことができる。このとき、集塵機、脱硝装置、脱硫装置等により燃焼排ガス中の塵埃、NOxおよびSOxを取り除いておくのが好ましい。また、攪拌は通気によるエアリフト方式や、攪拌ハネを用いる方法等、一般的な技術を用いることができる。
【0035】
光は蛍光灯等の人工光を照射することにより行うこともできるが、より低エネルギー・低コストに培養するために太陽光のみで培養を行うことが望ましい。
また、培地の水温は、29±1℃に制御するのが好ましい。
ただし、水温制御にエネルギーを投入しないように温度制御は行わないか、水温制御を行うにしても、ユーグレナが死滅するような高温にならないよう冷却を行うことや、冬季や夜間に水温が低下しすぎないように暖める等の最小限の制御を行うと好適である。
【0036】
ユーグレナの培地組成は、例えば、改変Cramer-Myers培地((NH4)2HPO4 1.0g/L、KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH3.5))を用いることができる。なお、(NH4)2HPO4は、(NH4)2SO4やNH3aqに変換することも可能である。
なお、培地組成がこれに限定されるものでないことは言うまでもない。
【0037】
培地のpHは、2〜7.5の範囲内であればよいが、3.5又は5.5に調整するのが好ましい。特に、4.5以下の酸性とすることで、動物性プランクトンや細菌等のコンタミネーションを有効に抑制することができる。
【0038】
次いで、工程2では、窒素源を含まない培地に置換して、さらに培養を行う。
工程2における窒素源を含まない培地組成は、例えば、Resting培地、1%マンニトール、0.2% MgCl2・6H2O、0.14% KH2PO4を用いることができる。
なお、培地組成は窒素源が含まれていない限り、これに限定されるものでないことは言うまでもない。
【0039】
次いで、工程3では、培養したユーグレナの嫌気処理を行う。
嫌気処理は、通常、培養後の培地に窒素ガス等の不活性ガスを通気することにより行う。また、嫌気処理は培地を静置することによっても行うことができる。培地を攪拌せずに静置すると細胞が沈降し、高密度になることによって結果的に酸素不足となるためである。遠心分離により高密度状態を作り出すことで嫌気処理を行ってもよい。
このときのpHは、極端に低い、又は高い値でなければよく、光照射の有無はワックスエステル発酵には影響がない。保持温度はユーグレナが死滅するような高温、培地が凍結するような低温でなければ良い。通常、6時間〜72時間でワックスエステル発酵は終わる。
【0040】
なお、工程2の窒素飢餓状態における培養により、ユーグレナに炭水化物を十分に蓄積させることができる。
このため、工程3にて、工程2で培養した細胞を嫌気状態に置くことにより、工程2で十分に蓄積された炭水化物をワックスエステルに変換させることとなるため、結果的に工程3におけるワックスエステル蓄積量は飛躍的に増加することとなる。
【0041】
換言すれば、これら工程1→工程2→工程3を組み合わせることにより、ワックスエステルの蓄積量が飛躍的に増加するという、各工程単独では得られない有利な効果を生じることとなる。
【0042】
また、下記実施例にて詳述するが、窒素飢餓状態で培養したユーグレナの細胞は嫌気処理直後でも培養時と同じ緑色を呈し、死滅する細胞はほとんどなく、細胞の大きさも嫌気処理前と変化しない。
つまり、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べてユーグレナの細胞の生存率が大幅に改善するという有利な効果も生じる。
以上より、これら工程1→工程2→工程3を組み合わせることによって、従来と比して飛躍的多量のワックスエステルを含有した細胞活性の高いユーグレナを得ることができる。
【0043】
(第2の実施形態)
図2により、本発明に係るワックスエステル高含有ユーグレナの生産方法の第2の実施形態について説明する。
なお、培地組成、培養条件等は、第1の実施例と同様であるため、同様の説明は省略し、相違点のみ説明する。
【0044】
工程1における好気培養工程は、第1の実施形態の工程1における改変Cramer-Myers培地から窒素源を抜いたものを使用する。
つまり、スタート段階では、窒素源を含まない培地で好気的にユーグレナの培養を開始する。
工程1においては、まず、ステップS1において、ユーグレナを接種した培地に窒素源を流加する。
【0045】
そして、ステップS2により好気培養を行う。
次いで、ステップS3において、窒素源添加を終了してよいか否かを判定する。
ステップ3において、窒素源添加を終了しないと判定されれば(ステップS3:No)、処理は、ステップS1に戻り窒素源を流加する。
また、ステップ3において、窒素源添加を終了してよいと判定されれば(ステップS3:Yes)、処理は、ステップS4に進み、窒素源添加を終了する。
つまり、工程1においては、窒素源を徐々に流加し、窒素源を含む好気培養を行うこととなる。
この窒素源の流加量等は、天候、気温等の条件に依存し、これらの条件を勘案することにより適宜調整される。
なお、窒素源添加を終了する目安としては、本実施形態においては、上記条件等も勘案しながら、例えば、細胞濃度が一定に達した時期等が選択される。
【0046】
次いで、工程2(ステップS5)において、継続して好気培養を必要期間行う。
このとき、初期の段階では窒素源が残留しているが、時間が経つにつれ窒素源はユーグレナにより資化され、窒素源飢餓状態となる。
このため、所謂工程2の「好気培養工程 窒素源なし」という培養工程が成立する。
次いで、ステップS6にて、工程3の嫌気発酵工程が実施されるが、この工程は、第1の実施形態と同様である。
【0047】
なお、窒素源を添加する方法としては、窒素源を培養開始時に一度に投入する方法も考えられる。
この場合は、初期の段階では窒素源が残留しているが、時間が経つにつれ窒素源はユーグレナにより資化され、窒素源飢餓状態となる。
このため、窒素飢餓状態での好気培養、すなわち、「好気培養工程 窒素源なし」という培養工程が成立することとなる。
【0048】
上記第2の実施形態に係るワックスエステル高含有ユーグレナの生産方法は、工業化ラインにスケールアップした際に有効である。
つまり、連続運転により培養を行うことが可能となり、培地置換のための遠心分離作業等が不要となる。
よって、培養に必要なエネルギー使用量を減少させて、ワックスエステル高含有ユーグレナの大量生産に有効に適用される。
【0049】
次いで、図3を参照し、本実施形態に係るユーグレナからのワックスエステル製造方法の工程を説明する。
まず、工程1でユーグレナを培養する。これは、上記第1の実施形態又は第2の実施形態に係る生産工程に係る培養である。
【0050】
次いで、工程2でワックスエステルを抽出する。
その後、工程2で得られた成分を工程3で第1の精製にかけ、次いで、工程4で第2の精製にかけ、ワックスエステルを得る。
第1の精製では、有機溶媒によりユーグレナからワックスエステルを抽出し、第2の精製では、カラムによりワックスエステルの分離精製を行う。
このようにして精製されたワックスエステルはこれを含有するバイオ燃料として有効に利用することができる。
【実施例】
【0051】
(ワックスエステル高含有ユーグレナの生産方法について)
以下に、本発明に係るワックスエステル高含有ユーグレナについて、一実施例を示して具体的に説明する。
【0052】
この実施例では、Euglena graclilis Z株を用いた。
培地は改変Cramer-Myers培地((NH4)2HPO4 1.0g/L、KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH5.5))をオートクレーブ滅菌することにより調整した。
【0053】
(工程1:好気培養)
調製した培地880mlを1L容量の振とうフラスコに入れた後、初期濃度が約0.05g/Lになるようにユーグレナの種藻体を接種し、29℃に設定した人工気象器(サンヨー社製、GROWTH CABINET)内で9日間振とう培養した。光照射強度は約100μmol/(m2・s)とし、光照射時間は24時間連続とした。フラスコには、通気濃度10%の二酸化炭素ガスを供給した。
【0054】
(工程2:窒素欠乏培養)
9日間培養した後、培養液を2つに分け、窒素源を含まない培地、窒素源を含む培地それぞれに置換した。
具体的には、880mlの培養液から420mlずつの培養液をとり分け、それぞれ遠心分離して上清を捨てた後、一方の沈殿には窒素源を抜いた改変Cramer-Myers培地(以下、窒素源欠乏培地) KH2PO4 1.0g/L、MgSO4・7H2O 0.2g/L、CaCl2・2H2O 0.02g/L、EDTA・2Na 0.05g/L、Fe2(SO2)3・7H2O 3mg/L、MnCl2・4H2O 1.8mg/L、CoSO4・7H2O 1.5mg/L、ZnSO4・7H2O 0.4mg/L、Na2MoO4・2H2O 0.2mg/L、CuSO4・5H2O 0.02g/L、チアミン塩酸塩(ビタミンB1) 0.1mg/L、シアノコバラミン(ビタミンB12)、(pH5.5))を420ml、もう一方の沈殿には新たなCM培地(窒素源含む)を420ml加えて沈殿を懸濁した。
窒素源欠乏培地に置換した培養液をサンプル1、新たなCM培地に置換した培養液をサンプル2とする。
【0055】
培地交換をした後、サンプル1とサンプル2共に、29℃に設定した人工気象器内で48時間さらに振とう培養した。光照射強度は約100μmol/(m2・s)とし、光照射時間は24時間連続とした。フラスコには、通気濃度10%の二酸化炭素ガスを供給した。
【0056】
(工程3:嫌気処理)
培地置換培養をした後、サンプル1とサンプル2の乾燥重量を測定し(表1A)、29℃に設定した人工気象器内で遮光してフラスコを密栓し、静置することにより細胞を嫌気状態に置いた。
【0057】
培養液中におけるユーグレナ細胞の乾燥重量の測定方法は以下の通りである。
105℃で30分間、乾燥機内であらかじめ乾燥し、重量を測定した約1μmの孔径をもつガラスろ紙GS−25(ADVANTEC社製)で培養液1mlをろ過した。次にガラスろ紙を105℃に設定した乾燥機に入れて1時間乾燥させた。その後、真空デシケータ内で減圧しながら20分間脱湿・冷却後、精密天秤にて重量測定した。ろ過前後のろ紙の重量の差を、1ml当たりの乾燥重量とした。
【0058】
48時間嫌気処理を行った後、両サンプルを回収した。回収した400mlの培養液を、遠心分離機(コクサン社製、H−103FN)を用いて5分間、3,000rpm、常温で遠心分離した後、上清を捨て、沈殿した藻体を回収した。回収した藻体は冷凍した後、凍結乾燥した。
【0059】
(脂質の抽出)
50ml容量のナスフラスコを真空デシケータ内で1時間程度乾燥させ、ナスフラスコ自体の重量を測定した。凍結乾燥したユーグレナ粉末をスパーテルなどで破砕し、その粉末を50ml容量の三角フラスコに測りとった。このとき、サンプル1の重量は0.693g、サンプル2の重量は0.480gであった(表1B)。
次に、各サンプルに20mlのヘキサンを加えて懸濁した。粉末のダマをさらに破砕するため、30秒間超音波破砕した。自然沈降後の上清をパスツールピペットにて50ml容量の蓋付ガラス製遠心管に移し、10分間、3,000rpmにて遠心分離し、上清はろ紙(Advantec社、NO.2)を介してろ過した。
抽出操作は、溶媒をかえながら計9回繰り返した。
つまり、ヘキサンを用いて上記の抽出操作を3回繰り返した後、有機溶媒をアセトンにかえて同様に3回抽出操作を行い、最後にヘキサンとアセトンを1:1で混合した溶媒を用いて3回抽出操作を行った。
その後、ロータリーエバポレータ(東京理化器械社製、ROTARY VACCUUMEVAPORATOR)を用いて、ろ液入りのナスフラスコを40〜50℃で湯浴し、ヘキサン・アセトンを蒸発させた。少量のヘキサンを用いて、ナスフラスコ内を洗いこみながら、秤量済みのナスフラスコに移した。この操作を4回繰り返した後、上記と同様にヘキサンを蒸発させた。
ナスフラスコにアルミホイルでフタをし、真空デシケータに入れて残りのヘキサンを蒸発させながら、30分〜1時間程度、乾燥させた。
ユーグレナ粉末から脂質を抽出した後のナスフラスコの重量を測定し、最初に測定したナスフラスコ自体の重量を差し引いて、脂質重量を算出した(表1C)。
なお、本抽出方法によって抽出される脂質は、そのほとんどがワックスエステルで構成されている。
【0060】
本実験の結果、最終的な粗脂質の抽出量は窒素欠乏培地で培養したサンプル1が0.188g、窒素源を含むCM培地で培養したサンプル2が0.157gであり、窒素欠乏培地で培養した方が粗脂質の終了は0.031g多かった(表1C)。
【0061】
また、嫌気処理前の乾燥重量に対する粗脂質の含有率は、窒素欠乏培地で培養したサンプル1は23%、窒素を含むCM培地で培養したサンプル2は16%であり、窒素欠乏培地で培養した方が脂質含有率も7%高かった(表1C/A)。
【0062】
さらに、サンプル1は嫌気処理の前後で約0.120g細胞重量が減少していたが、サンプル2では0.507gも細胞数が減少していた(表1B)。嫌気処理直後のサンプル2の培養液は茶色く変色しており、顕微鏡観察したところ、死滅した細胞が多く、生きている細胞も大きさは小さくなっていた。一方、サンプル1は嫌気処理直後でも培養時と同じ緑色を呈し、顕微鏡観察したところ、死滅した細胞はほとんどなく、細胞の大きさも嫌気処理前と変わらなかった。以上の結果から、窒素源を含まない培地で嫌気処理を行うと、窒素源を含む培地に比べて細胞の生存率が大幅に改善することがわかった。
結果を、表1にまとめる。
【0063】
【表1】

【0064】
以上より、窒素飢餓状態に置いた実験区では、窒素源を含む培地で培養した実験区に比べて最終的な脂質の収量が増加した上、嫌気処理前後の細胞の生存率も著しく改善することがわかった。
【0065】
(ワックスエステルの分離精製について)
次いで、ユーグレナからワックスエステルを抽出して精製する手順の一実施例について説明する。
本実施形態においては、粉末化したユーグレナを使用して、ユーグレナ体内に貯蔵されていたワックスエステルを抽出して精製した(工程2)。
(材料)
ユーグレナ粉末 10kg
ヘキサン 60L
エーテル 1L
Wakogel C-300 300g
【0066】
1.抽出及びろ過
(1)ユーグレナ1kgを秤量し、2.5Lヘキサンに縣濁した
(2)ブレンダーにて激しく撹拌した
30秒×3回
(3)10分間室温で放置し、ユーグレナ粉末を自然沈殿させた
(4)上澄液をろ紙にて吸引ろ過した
(5)沈殿物をブフナーロートに移し、沈殿物に付着した油成分を搾った
(6)(4)の炉液及び(5)の回収液をナスフラスコに移し、ロータリーエバポレーターで濃縮した(濃縮条件:温度50℃±10℃、減圧度100mmHg〜150mmHg)この濃縮液を以下、「濃縮サンプル」と記す。
【0067】
2.分離精製(工程3)
(1)ガラスカラム(100φ)にヘキサンで縣濁したWakogel C-300を30センチ程度充填(約300g充填)した
(2)1カラムボリュームのヘキサンを流してカラムを平衡化した
(3)約500g程度の濃縮サンプルをカラムにアプライした
(4)溶出溶媒にて、カラムに保持された濃縮サンプルからワックス成分を分離した溶出溶媒は、
a.ヘキサン:エーテル=100: 0(以下、「溶出溶媒a」と記す)
b.ヘキサン:エーテル= 95: 5(以下、「溶出溶媒b」と記す)
c.ヘキサン:エーテル= 90:10(以下、「溶出溶媒c」と記す)
の3種類を使用した
(5)分離したワックス成分を酸加水分解を行うことにより第2の精製を行った(工程4)。
【0068】
結果
上記方法により実施したワックスエステルの抽出結果を示す。
(1)ユーグレナ10Kgから、約3L程度のワックス成分が抽出された。
最終的な回収率より、一度のヘキサン抽出で、ワックス成分はほぼ全て回収できると考えられる。
(2)ろ過を行う際には、ろ過性が良好ではないため、ろ紙上にセライトを撒いてろ過を行った。
(3)濃縮を行う際には、30℃前後程度で濃縮を行うと、揮発熱によって濃縮液が冷えて表面からワックス成分の粘性が高まり、突沸によってエバポレーター内に噴出する。これを回避するために、50℃前後程度で濃縮を行うと、ワックス成分の粘性が低下し、突沸によってエバポレーター内に噴出することを回避できた。
(4)1カラムボリュームのヘキサンを流してカラムを平衡化した後、約500g程度の濃縮サンプルをカラムにアプライしたが、280g程度は保持されず、そのまま溶出した。そのため、溶出溶媒aを2カラムボリューム流し、保持されていない成分を溶出して濃縮した。
(5)次に、溶出溶媒bを3カラムボリューム分流して溶出及び濃縮を行ったところ、ワックス成分は、黄色の色素とともに溶出されることがわかった。
(6)次に、完全にワックス成分を溶出するために、溶出溶媒cを3カラムボリューム分流して溶出及び溶出を行った。
この際、約240g(300mL)程度のワックス成分が回収できた。
なお、クロロフィル成分は分離できたが、いくつかの色素は非常に低濃度ながらも残存していた。
【0069】
考察
上記の結果より、ワックス成分を240g程度保持するために必要であったカラム容量は、約2L(約1kg)で、溶出に要した溶媒の量は、9カラムボリューム(約18L)であった。
ワックス成分が2.5kgであった場合、必要なカラム容量は、約24L(約12kg)であり、溶出に要する溶媒の容量は約200L程度であることがわかる。
【0070】
以上のように、分離後、加水分解を行うことによって、ワックスエステルの炭素鎖が短くなり、揮発性が増して、燃料としての価値が上がる。
そして、このワックスエステルをバイオ燃料として有効に使用することができる。
ユーグレナは、健康食品等にも使用されているとおり、簡易に手に入る微生物であるとともに、大量に培養することが可能である。
このような微生物であるユーグレナより良質なワックスエステルを回収することにより、クリーンなエネルギーを安定的に供給することができる。
なお、本例においては、有機溶媒での抽出を実行したが、抽出方法はこれに限られることはなく、例えば、水での分離、二酸化炭素流体を用いた方法、圧搾等の物理的方法も用いることができる。
【特許請求の範囲】
【請求項1】
微細藻ユーグレナを好気的に培養する第1の工程と、前記微細藻ユーグレナが培養されている培地を窒素飢餓状態としてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成るワックスエステル高含有ユーグレナの生産方法。
【請求項2】
前記窒素飢餓状態は、前記培地を窒素欠乏培地に置換することにより創出することを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項3】
前記第1の工程においては、前記微細藻ユーグレナを、窒素源を含まない培地で好気的に培養を開始するとともに、流加量を適宜調節して窒素源を加えて継続的かつ好気的に培養を行い、細胞濃度が一定に達したところで窒素源の流加を停止し、
前記第2の工程においては、窒素飢餓状態に置いてさらに培養を行うことを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項4】
前記第1の工程においては、二酸化炭素ガスを通気することにより、二酸化炭素源と混入している酸素源が付与されることを特徴とする請求項1又は請求項3に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項5】
前記二酸化炭素ガスは、発電所から排出されるものであることを特徴とする請求項4に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項6】
前記第3の工程においては、不活性ガス通気、静置処理、遠心分離による濃縮から選択される少なくとも一つの方法により嫌気処理を行うことを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項7】
請求項1乃至請求項6いずれかに一項に記載のワックスエステル高含有ユーグレナの生産方法により生産されたワックスエステル高含有ユーグレナを使用し、
有機溶媒で油分画を抽出して抽出液を得、該抽出液を濃縮してワックス成分を得る工程、
前記ワックス成分からワックスエステルをカラムにより分離して第1の精製を行う工程、
を実施することを特徴とするワックスエステル製造方法。
【請求項8】
前記濃縮は、50度±10℃の範囲で実施することを特徴とする請求項7に記載のワックスエステル製造方法。
【請求項9】
前記第1の精製を行う工程により得られた前記ワックスエステルを加水分解し第2の精製を行う工程を次工程として実施することを特徴とする請求項7に記載のワックスエステル製造方法。
【請求項10】
前記第1の精製を行う工程において、前記カラムに適用する溶出溶媒としてヘキサン若しくは、エーテルを10容量%以下混合したヘキサンとエーテルの混合溶媒を使用したことを特徴とする請求項7に記載のワックスエステル製造方法。
【請求項1】
微細藻ユーグレナを好気的に培養する第1の工程と、前記微細藻ユーグレナが培養されている培地を窒素飢餓状態としてさらに培養する第2の工程と、細胞を嫌気状態下に保持する第3の工程とから成るワックスエステル高含有ユーグレナの生産方法。
【請求項2】
前記窒素飢餓状態は、前記培地を窒素欠乏培地に置換することにより創出することを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項3】
前記第1の工程においては、前記微細藻ユーグレナを、窒素源を含まない培地で好気的に培養を開始するとともに、流加量を適宜調節して窒素源を加えて継続的かつ好気的に培養を行い、細胞濃度が一定に達したところで窒素源の流加を停止し、
前記第2の工程においては、窒素飢餓状態に置いてさらに培養を行うことを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項4】
前記第1の工程においては、二酸化炭素ガスを通気することにより、二酸化炭素源と混入している酸素源が付与されることを特徴とする請求項1又は請求項3に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項5】
前記二酸化炭素ガスは、発電所から排出されるものであることを特徴とする請求項4に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項6】
前記第3の工程においては、不活性ガス通気、静置処理、遠心分離による濃縮から選択される少なくとも一つの方法により嫌気処理を行うことを特徴とする請求項1に記載のワックスエステル高含有ユーグレナの生産方法。
【請求項7】
請求項1乃至請求項6いずれかに一項に記載のワックスエステル高含有ユーグレナの生産方法により生産されたワックスエステル高含有ユーグレナを使用し、
有機溶媒で油分画を抽出して抽出液を得、該抽出液を濃縮してワックス成分を得る工程、
前記ワックス成分からワックスエステルをカラムにより分離して第1の精製を行う工程、
を実施することを特徴とするワックスエステル製造方法。
【請求項8】
前記濃縮は、50度±10℃の範囲で実施することを特徴とする請求項7に記載のワックスエステル製造方法。
【請求項9】
前記第1の精製を行う工程により得られた前記ワックスエステルを加水分解し第2の精製を行う工程を次工程として実施することを特徴とする請求項7に記載のワックスエステル製造方法。
【請求項10】
前記第1の精製を行う工程において、前記カラムに適用する溶出溶媒としてヘキサン若しくは、エーテルを10容量%以下混合したヘキサンとエーテルの混合溶媒を使用したことを特徴とする請求項7に記載のワックスエステル製造方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−23977(P2012−23977A)
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願番号】特願2010−163370(P2010−163370)
【出願日】平成22年7月20日(2010.7.20)
【出願人】(506141225)株式会社ユーグレナ (12)
【Fターム(参考)】
【公開日】平成24年2月9日(2012.2.9)
【国際特許分類】
【出願日】平成22年7月20日(2010.7.20)
【出願人】(506141225)株式会社ユーグレナ (12)
【Fターム(参考)】
[ Back to top ]

