一分子型プローブ及びその利用
【課題】発光輝度が高く、容易に設計可能な一分子型プローブを提供する。
【解決手段】本発明に係る融合タンパク質は、標的物質を検出するプローブとして使用されるものであり、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものである。
【解決手段】本発明に係る融合タンパク質は、標的物質を検出するプローブとして使用されるものであり、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、被験試料中の標的物質を検出する融合タンパク質及びその利用に関し、より具体的には、被験試料中の標的物質を検出する一分子型プローブとして用いられる融合タンパク質及びその利用に関するものである。
【背景技術】
【0002】
タンパク質の変形、タンパク質分子間の結合などに基づく生命現象として、例えば、ホルモン刺激により構造変化を経て活性化状態となり、二量体となる核受容体(NR:nuclear receptor)が挙げられる。そして、二量体化した核受容体は、核内に移行し、核内の核受容体応答配列(NRE:nuclear receptor response element)に結合して、転写活性を引き起こす(非特許文献1)。
【0003】
また、細胞は、細胞外部からの成長ホルモン(growth factor)刺激に対して、特異的な受容体(growth factor receptor)を介して応答し、一連のタンパク質リン酸化の媒介によって細胞内部に信号を伝達する(非特許文献2)。さらに、細胞は、細胞内部のコレステロール濃度の変化をモニタリングするシステムを有している。その一例として、細胞は、コレステロール濃度を調節するタンパク質(SREBP−2:Sterol-response element binding protein-2)を保有している。細胞内のコレステロール濃度が一定以下に低下した場合、細胞はそれを感知し、SREBP−2が分割される。そして、2分割されたSREBP−2の断片の一部が二量体化して核内移行し、核内でステロール応答配列(SRE:Sterol-response element)に結合することによって、一連のコレステロール調節因子を発現させる(非特許文献3)。
【0004】
この様な細胞内分子現象は、生体が生命活動の恒常性を維持しつつ、外部の環境変化に素早く応答するための機構である。これらの信号伝達を担うタンパク質は、細胞が外部刺激に素早く反応し、対処する上で極めて重要な役割を果たしている。
【0005】
細胞内分子現象を測定するためのいくつかの方法が開示されている。例えば、タンパク質―タンパク質間相互作用、タンパク質の立体構造の変化、タンパク質のリン酸化等を測定する手法が知られている。タンパク質―タンパク質間の相互作用を検出する方法として、FRET(fluorescence resonance energy transfer)法及びBRET(bioluminescence resonance energy transfer)法が広く使用されている(非特許文献4及び5)。
【0006】
また、本発明者らは以前に、一分子型及び二分子型生物発光プローブを提案している(非特許文献6及び7ならびに特許文献1〜3)。これらの生物発光プローブは、発光酵素を2分割し、それらの間に1つ又は2つのタンパク質を挿入した形態の生物発光可視化プローブである。一分子型生物発光プローブの一例として、ガウシア(Gaussia)由来の発光酵素を2分割し、カルシウム認識タンパク質であるカルモジュリン(CaM:calmodulin)をその間に挿入したものが挙げられる。この一分子型生物発光プローブを真核細胞に導入した場合、Ca2+の濃度に依存した生物発光の変化を観察できる(非特許文献8及び特許文献3)。
【0007】
さらに、本発明者らは以前に、円順列置換した発光酵素用いた生物発光プローブを提案している(非特許文献9)。この生物発光プローブにおいて、発光酵素の本来のN末端とC末端とを連結する一方で、酵素の酵素活性部位を切断して人工的なN末端とC末端とを作ることによって円順列置換されている。そして、人工的に作製したこれらの末端のそれぞれにタンパク質を連結する。このように分子設計することによって、発光酵素の酵素活性部位は2分割され、分割された酵素活性部位がそれぞれ分子の中心から外側に配置される。従って、酵素活性部位間の衝突確率を顕著に抑えることができる。結果として、シグナル−ノイズ比(S/N比:signal-to-noise ratio)を格段に改善することができる。
【0008】
また、本発明者らは以前に、男性ホルモン受容体(AR:androgen receptor)の核内移行を指標とした、生物発光イメージングプローブを提案している(非特許文献1)。このプローブでは、発光酵素を2分割する一方で、タンパク質組み継ぎ反応を起こすタンパク質(DnaE)も2分割する。そして、2分割したそれぞれの一方の断片をARに連結して通常は細胞質に局在させておき、その残りの断片を核内に局在させておく。ARは、ステロイドホルモン依存的に核内に移行し、ARに連結された断片は、核内に局在している残りの断片と相互作用する。これにより回復した生物発光強度を測定することによって、タンパク質間相互作用を検出する。
【0009】
さらに他の細胞内分子現象を測定する方法として、特許文献4には、ホタルルシフェラーゼに1つのタンパク質を挿入したプローブを用いて、外部刺激により低下する発光量を測定する方法が記載されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2008/084869号パンフレット
【特許文献2】特開2009−34059号公報(2009年2月19日公開)
【特許文献3】米国特許出願公開第2009/0176239号公報(2009年7月9日公開)
【特許文献4】国際公開第2005/038029号パンフレット(2005年4月28日)
【非特許文献】
【0011】
【非特許文献1】Kim, S. B.; Ozawa, T.; Watanabe, S.; Umezawa, Y. Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 11542-11547.
【非特許文献2】Kaihara, A.; Umezawa, Y. Chemistry, An Asian Journal 2008, 3, 38-45.
【非特許文献3】Kim, S. B.; Takao, R.; Ozawa, T.; Umezawa, Y. Analytical Chemistry 2005, 77, 6928-6934.
【非特許文献4】Awais, M.; Sato, M.; Lee, X. F.; Umezawa, Y. Angew. Chem. Int. Ed. 2006, 45, 2707-2712.
【非特許文献5】Hoshino, H.; Nakajima, Y.; Ohmiya, Y. Nat. Methods 2007, 4, 637-639.
【非特許文献6】Kim, S. B.; Otani, Y.; Umezawa, Y.; Tao, H. Anal. Chem. 2007, 79, 4820-4826.
【非特許文献7】Kim, S. B.; Awais, M.; Sato, M.; Umezawa, Y.; Tao, H. Anal. Chem. 2007, 79, 1874-1880.
【非特許文献8】Kim, S. B.; Sato, M.; Tao, H. Anal. Chem. 2009, 81, 67-74.
【非特許文献9】Kim, S. B.; Sato, M.; Tao, H. Bioconjugate Chemistry 2008, 19, 2480-2486.
【非特許文献10】Hodges, Y. K.; Tung, L.; Yan, X. D.; Graham, J. D.; Horwitz, K. B.; Horwitz, L. D. Circulation 2000, 101, 1792-1798.
【非特許文献11】Loening, A. M.; Wu, A. M.; Gambhir, S.S. Nat. Methods 2007, 4, 641-643.
【発明の概要】
【発明が解決しようとする課題】
【0012】
上述した、発光酵素を含有する発光プローブを用いた検出方法は、従来のタンパク質間相互作用検出用のFRETにおける、自己蛍光によるバックグラウンド蛍光が高いこと、外部光源が必要となること、蛍光測定のために大型の蛍光顕微鏡を必要とすること、分析できる細胞数が限られており、得られる結果が定量的というよりもむしろ定性的となること等の問題を解決し得るものである。
【0013】
そのため、このような発光プローブによる検出精度のさらなる向上が要求されており、特に、十分な検出精度を得るために、より安定性が高い発光プローブが求められている。また、発光プローブの開発費用等を抑え、広く使用するために、設計が容易であることが求められている。
【0014】
そこで、本発明の目的は、発光強度が高く、設計が容易な新規のプローブを提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記課題を解決するために鋭意検討を行い、以下の点に深く考慮することにより本発明を完成させた。
【0016】
まず、発光酵素が本来持つ酵素活性を侵害しないことに考慮し、発光酵素の全長をそのまま利用することを見出した。そして、発光酵素の構造上の変形による酵素活性度の変化を指標とすることによって、高い発光強度のままでの測定が可能であり、発光プローブの構造をより単純化して設計上の試行錯誤を容易に回避できることを見出した。
【0017】
本発明に係る融合タンパク質は、上記課題を解決するために、標的物質を検出する融合タンパク質であって、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものであることを特徴としている。また、本発明に係る融合タンパク質において、前記酵素は略球形状であることが好ましい。
【0018】
また、本発明に係る融合タンパク質において、前記酵素は発光酵素であり、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、発光量を増加させるものであることが好ましい。また、本発明に係る融合タンパク質において、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することが好ましい。また、本発明に係る融合タンパク質において、前記発光酵素は、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、クリックビートルルシフェラーゼ、及びホタルルシフェラーゼからなる群より選択されることが好ましい。
【0019】
さらに、本発明に係る融合タンパク質において、前記一次結合タンパク質は、核内受容体、サイトカイン受容体、タンパク質キナーゼ、セカンドメッセンジャー認識タンパク質、及び転写因子からなる群より選択されることが好ましい。また、本発明に係る融合タンパク質において、前記一次結合タンパク質がエストロゲン受容体のリガンド結合ドメインであり、前記二次結合タンパク質がSrcタンパク質のSH2ドメインであり、前記発光酵素がウミシイタケルシフェラーゼであることが好ましい。
【0020】
また、本発明に係る融合タンパク質は、前記一次結合タンパク質と前記酵素とを連結する第1リンカーと、前記二次結合タンパク質と前記酵素とを連結する第2リンカーとをさらに備え、前記第1リンカー及び前記第2リンカーはそれぞれ、5アミノ酸以下のアミノ酸配列からなることが好ましい。さらに、本発明に係る融合タンパク質において、前記第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、前記第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることが好ましい。
【0021】
さらに、本発明に係る融合タンパク質は、配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列からなる、融合タンパク質;あるいは配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列の1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質であることを特徴としている。
【0022】
本発明に係るポリヌクレオチドは、上記いずれかの融合タンパク質をコードする、ポリヌクレオチドであることを特徴としている。また、本発明に係るポリヌクレオチドは、配列番号4〜6及び15〜16のいずれかに示される塩基配列からなる、ポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;あるいは配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチドであることを特徴としている。
【0023】
本発明に係るベクターは、上記いずれかのポリヌクレオチドを含んでいることを特徴としている。本発明に係る形質転換体は、上記いずれかのポリヌクレオチド、又は上記ベクターを含んでいることを特徴としている。
【0024】
本発明に係る標的物質を検出する方法は、被験試料中の標的物質を検出する方法であって、前記被験試料と、上記いずれかの融合タンパク質とを接触させる工程を包含することを特徴としている。本発明に係る標的物質を検出するためのキットは、上記いずれかの融合タンパク質を備えていることを特徴としている。
【0025】
本発明に係るプローブの生産方法は、上記いずれかのポリヌクレオチド又は上記ベクターを用いて細胞を形質転換する工程を包含することを特徴としている。本発明に係るプローブの生産キットは、上記いずれかのポリヌクレオチド又はベクターを備えていることを特徴としている。
【発明の効果】
【0026】
本発明に係る融合タンパク質によれば、活性型の酵素又はその前駆体を用いることによって、設計が容易であり、かつ発光強度が高く、種々のタンパク質間相互作用の可視化検出をより高精度に行うことができる。
【図面の簡単な説明】
【0027】
【図1】本発明に係る発光プローブの一例を用いたリガンド認識メカニズムを模式的に示す図である。
【図2】ウミシイタケルシフェラーゼ(RLuc8)の結晶構造を示す図である。
【図3】ホタルルシフェラーゼ(FLuc)の結晶構造を示す図である。
【図4】RLuc8の酵素活性部位における各アミノ酸と基質との間の相互作用を示す図であり、酵素末端から近いアミノ酸を破線によって囲んで示す。
【図5】本発明に係る発光プローブを用いたリガンド認識メカニズムを示す模式図である。
【図6】本発明に係る発光プローブを作製するためのDNAコンストラクト構成の一例を示す図である。
【図7】RLuc8を挿入した発光プローブ(ERS)を発現した形質転換体における発光スペクトルを示すグラフである。
【図8】ERS、EGS(GLucを挿入した発光プローブ)、ECS(CBLucを挿入した発光プローブ)、EFS(FLucを挿入した発光プローブ)をそれぞれ発現した形質転換体における発光強度の割合を示すグラフである。
【図9】発光酵素の種々の基質の化学構造を示す図であり、重要なサイドチェーンにあたる部位を破線によって囲んで示す。
【図10】種々の基質共存下における発光スペクトルを示すグラフである。
【図11】種々の基質共存下における発光スペクトルのピーク強度の割合を示すグラフである。
【図12】RLuc8を発現する形質転換体、及びERSを発現する形質転換体における発光スペクトルを示すグラフである。
【図13】ERSを発現する形質転換体におけるリガンド応答曲線を示す図である。
【図14】ERS、EmRS(ER LBDのリン酸化部位が変異した発光プローブ)、ER+RS(RLuc8とER LBDとが連結されたプローブ(ER)及びRLuc8とSH2ドメインとが連結されたプローブ(RS))を発現する形質転換体における相対発光強度を示すグラフである。
【図15】ER又はRSを発現させるためのDNAコンストラクト構成を示す図である。
【図16】ER及びRSの構造を模式的に示す図である。
【図17】種々のリガンドの化学構造を示す図である。
【図18】ERSを発現する形質転換体における、種々のリガンドに応答した発光強度を示すグラフである。
【図19】本発明に係る発光プローブ(EERS)を作製するための構成の一例を示す図である。
【図20】EYFP及びRLuc8を挿入した発光プローブ(pEERS)を発現した形質転換体における発光スペクトルを示すグラフである。
【図21】本発明に係る発光プローブであり、その内部での発光共鳴エネルギー移動を起こす発光プローブ(EERS)のリガンド認識メカニズムを模式的に示す図である。
【発明を実施するための形態】
【0028】
〔1.融合タンパク質及びポリヌクレオチド〕
本発明に係る融合タンパク質は、一分子型生物発光プローブとして用いられ、標的物質を検出する融合タンパク質であって、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質である。
【0029】
後述するように、本発明に係る融合タンパク質に含まれる活性型の酵素又はその前駆体の代表的な例として、活性型の発光酵素又はその前駆体が挙げられる。したがって、以下では、例として、本発明に係る融合タンパク質における酵素を発光酵素として説明し、本発明に係る融合タンパク質を発光プローブと称することもあるが、本発明はこれに限定されず、他の酵素であっても同様に説明され得る。
【0030】
本明細書において、「発光プローブ」は、「生物発光プローブ」又は「プローブ」と交換可能に使用され、標的に特異的な標的物質によって引き起こされる様々な分子現象を、生きた細胞又は生体において、生物発光として可視化イメージングすることが可能なプローブである。また、「一分子型発光プローブ」とは、上述した可視化イメージングするために用いられる全構成要素を単一融合分子内に含むプローブである。例えば、上述した(i)一次結合タンパク質、(ii)活性型酵素又はその前駆体、(iii)二次結合タンパク質を、基本構成要素として含む融合タンパク質が含まれ得る。
【0031】
本発明の融合タンパク質は、一次結合タンパク質と二次結合タンパク質との間に活性型酵素又はその前駆体が挿入されていればどのような順番でもよいが、一次結合タンパク質、活性型酵素又はその前駆体、二次結合タンパク質の順に直鎖状に連結された形態であることが好ましく、アミノ末端から一次結合タンパク質、活性型酵素又はその前駆体、二次結合タンパク質の順に直鎖状に連結された形態であることがより好ましい。
【0032】
また、本発明の融合タンパク質は、前記酵素が発光酵素であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、発光量を増加させるものであることが好ましい。さらに、本発明の融合タンパク質は、一次結合タンパク質と二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することが好ましい。この構成であれば、発光共鳴エネルギー移動を起こすことができる。
【0033】
ここで、「一次結合タンパク質」は、その標的物質の結合部位に標的物質が結合するタンパク質が意図され、「標的物質結合タンパク質」と称することもある。後述するように、本発明によって検出する標的物質をリガンドと称する場合には、標的物質結合タンパク質を、「リガンド結合タンパク質」と称することもある。
【0034】
一次結合タンパク質は、例えば、標的物質が結合することによって立体構造が変化し、後述する二次結合タンパク質の分子認識部位と結合することができるタンパク質であり得る。このような一次結合タンパク質としては、例えば、ホルモン、化学物質又は信号伝達タンパク質をリガンドとする核内受容体(NR)、サイトカイン受容体、あるいは各種タンパク質キナーゼが用いられる。一次結合タンパク質は、対象とする標的物質によって適宜選択される。
【0035】
本明細書中における「標的物質」は、本発明に係る発光プローブの検出の対象となる物質であり、生細胞膜上又は生細胞内の特定タンパク質と特異的に結合してその機能を変化させうる物質を意味しており、「リガンド」と称することもある。例えば、核リセプターに対してはステロイド又は合成化学物質をさし、サイトカイン受容体に対しては各種サイトカインをさし、インシュリン受容体のような細胞膜上受容体に対してはインシュリンを含む刺激物質をさす。
【0036】
本発明によって検出するリガンドとしては、リガンド結合タンパク質に結合するものであれば特に限定されず、細胞外から細胞内に取り込まれる細胞外リガンドであってもよく、細胞外からの刺激により細胞内で産生される細胞内リガンドであってもよい。例えば、受容体タンパク質(例えば核内受容体、Gタンパク質結合型受容体等)に対するアゴニスト又はアンタゴニストであり得る。また、細胞内の情報伝達に関与する分子に特異的に結合するサイトカイン、ケモカイン、インシュリン等の信号伝達タンパク質、細胞内セカンドメッセンジャー、脂質セカンドメッセンジャー、リン酸化アミノ酸残基、Gタンパク質結合型受容体リガンド等であり得る。
【0037】
例えば、リガンドとして細胞内セカンドメッセンジャー、脂質セカンドメッセンジャー等を対象とする場合には、リガンド結合タンパク質として、各セカンドメッセンジャーの結合タンパク質(セカンドメッセンジャー認識タンパク質)を使用することができる。セカンドメッセンジャーとは、ホルモン、神経伝達物質等の細胞外情報伝達物質が細胞膜に存在する受容体と結合することによって、細胞内で新たに生成される別種の細胞内情報伝達物質を意図している。このセカンドメッセンジャーとして、例えば、cGMP、cAMP、PIP、PIP2、PIP3、イノシトール3リン酸(IP3:inositol triphosphate)、IP4、Ca2+、ジアシルグリセロール(diacylglycerol)、アラキドン酸(arachidonic acid)等が挙げられる。例えば、セカンドメッセンジャーのCa2+に対しては、リガンド結合タンパク質としてカルモジュリン(CaM)を用いることができる。
【0038】
また、例えば、リガンドとして核内受容体に特異的なリガンドを対象とする場合には、リガンド結合タンパク質として、核内受容体の公知の結合ドメイン(LBD:ligand binding domain)を使用することができる。さらに、リン酸化アミノ酸残基又はGタンパク質結合型受容体リガンドを対象とする場合には、リガンド結合タンパク質として、それぞれリン酸化アミノ酸結合ドメイン又はGタンパク質結合型受容体を使用することができる。核内受容体リガンド結合ドメインとしては、エストロゲンをリガンドとするエストロゲン受容体(ER)、グルココルチコイド受容体(GR)、アンドロゲン受容体(AR)又はプロゲステロン受容体(PR)のリガンド結合ドメインが好適に用いられる。
【0039】
例えば、エストロゲン受容体のLBDは、全長ヒトエストロゲン受容体の配列情報(GenBank/P03372)に基づき、そのLBD領域(アミノ酸番号305〜550)を、遺伝子工学的に又はPCR合成によって調製したものを使用することができる。また、例えばアンドロゲン受容体のLBDは、全長ヒトアンドロゲン受容体の配列情報(GenBank/AF162704)に基づき、そのLBD領域(アミノ酸番号672〜910)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。また、例えばグルココルチコイド受容体のLBDは、全長ヒトグルココルチコイド受容体の配列情報(GenBank/1201277A)に基づき、そのLBD領域(アミノ酸番号527〜777)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。また、同様にプロゲステロン受容体のLBDについても、全長ヒトプロゲステロン受容体の配列情報(GenBank/P06401)に基づき、そのLBD領域(アミノ酸番号677−933)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。
【0040】
本明細書において「二次結合タンパク質」は、上述したリガンド結合タンパク質にリガンドが結合したことを認識する分子認識部位を有するタンパク質が意図され、「認識タンパク質」と称することもある。認識タンパク質には、例えば、リガンドの結合により立体構造が変化したリガンド結合タンパク質に結合するタンパク質等が包含される。
【0041】
例えばリガンド結合タンパク質としてカルモジュリンを用いた場合、認識タンパク質として、ミオシン軽鎖キナーゼ(miosin light chain kinase)由来のペプチドであるM13ペプチドが好適に用いられる。また、M13以外にもカルモジュリンに対して結合できるタンパク質として、アデニリルシクラーゼ、カルモジュリンキナーゼIIのようなCaM依存性タンパク質キナーゼ類を挙げることができる。このようなタンパク質の一部分をM13の代わりに用いることができる。
【0042】
また、例えばリガンド結合タンパク質として、アンドロゲン受容体、エストロゲン受容体等の核内受容体を用いた場合、認識タンパク質として共転写因子(coactivator)由来のLXXLLモチーフ(配列番号12)、ARのN末側(AR NTD)由来のFQNLFモチーフ、FXXLFモチーフ、WXXLFモチーフ等が用いられ得る。好ましくは、共転写因子の一種であるRip140(GenBank/NP003480)、又はSrc−1a(steroid receptor coactivator 1 isoform 1;GenBank/NP003734)のLXXLLモチーフ(約15アミノ酸)が用いられる。
【0043】
さらに、リン酸化アミノ酸残基を認識できるドメインである、各種キナーゼタンパク質のSH2ドメインを、認識タンパク質として用いてもよい。例えば、発癌制御タンパク質であるSrcタンパク質(proto-oncogene tyrosine-protein kinase Src;GenBank/NP938033)のリン酸化認識ドメイン(SH2ドメイン;アミノ酸番号150〜248)、細胞増殖、発癌等に関連する増殖因子レセプター結合タンパク質Grb2(growth factor receptor-binding protein2)のSH2ドメイン等を用いることができる。また、リガンド結合タンパク質としてGタンパク質結合型受容体を用いた場合、認識タンパク質としてGタンパク質等を好適に用いることができる。
【0044】
本発明におけるリガンド結合タンパク質及び認識タンパク質の組み合わせとしては、条件依存的に結合する2つのタンパク質であってもよい。例えばFRBとBRAD、ER LBDとLXXLLモチーフ、AR LBDとFQNLFモチーフ、CaMとM13、核内受容体とそのコアクチベーター、リン酸化タンパク質とそのリン酸化認識タンパク質、核受容体間のホモ又はヘテロ結合(二量化)を行う2つのタンパク質等のペアを用いることができる。
【0045】
本明細書中において「活性型の酵素又はその前駆体」は、その酵素活性部位に基質を結合し得る、活性化状態の酵素又はその前駆体であることが意図され、酵素の全長配列を含むものであることが意図される。なお、「酵素の全長配列」とは、少なくとも酵素活性部位を含む領域を、欠失、分割等せずにそのまま全て含むものであり、本来の酵素活性を保持しているものであればよい。例えば、欠失させても酵素活性には影響を及ぼさないN末側又はC末側の一部分等が欠失しているものについても、「酵素の全長配列」に含まれる。
【0046】
ここで、酵素の前駆体とは、不活性なものであるが、何らかの修飾を受けることによって、活性化し、活性型の酵素となるものを意図しており、活性型の酵素と同一の配列からなるものである。例えば、リン酸化により不活性状態から活性化する酵素を使用する場合、前駆体の状態で発光プローブに挿入し、リガンドの検出時にリン酸化することによって活性化して、活性型の酵素として使用することができる。以下で、本発明において使用する「酵素の全長」又は単に「酵素」について記載する場合、活性型の酵素又はその前駆体を意図している。
【0047】
本発明において使用する酵素は、そのN末側とC末側とにそれぞれつながれているリガンド結合タンパク質と認識タンパク質とが互いに相互作用することによって、外部からの分子テンションが加わり、その構造的な変形が生じることによって、発光プローブからの酵素活性度が変化する酵素であり得る。このような酵素の代表的なものとして、発光酵素(LE:lighting enzyme)が挙げられる。
【0048】
また、本発明において使用する酵素は、リガンド結合タンパク質と認識タンパク質との間に、蛍光タンパク質と連結されて挿入されていてもよい。この場合の酵素とは、発光酵素であることが好ましい。また、蛍光タンパク質は、発光共鳴エネルギー移動(BRET)の受け皿となり得るものであることが好ましい。すなわち、蛍光タンパク質は、発光酵素の活性によって発生した発光エネルギーを吸収できるものであることが好ましい。これにより、発光共鳴を誘導する(発光共鳴エネルギー移動を起こす)ことが可能になる。
【0049】
本発明において使用する発光酵素と蛍光タンパク質との組み合わせは、リガンド結合タンパク質と認識タンパク質との間に挿入されることによって、発光酵素と蛍光タンパク質との発光共鳴エネルギー移動の一部に影響を受けるものであることが望ましい。また、発光酵素と蛍光タンパク質との組み合わせは、リガンド結合タンパク質と認識タンパク質とが互いに相互作用することによって、外部からの分子テンションが加わり、それらの内部構造的な変形が生じることにより発光酵素と蛍光タンパク質との発光共鳴エネルギー移動が影響を受けるものであって、これによって、発光プローブからの酵素活性度が変化する発光酵素と蛍光タンパク質との組み合わせであり得る。
【0050】
なお、蛍光タンパク質は、酵素のN末側に連結されていてもよいし、酵素のC末側に連結されていてもよい。
【0051】
本明細書中において「分子テンション」とは、上述した酵素(酵素分子)、又は酵素と蛍光タンパク質との組み合わせにN末端とC末端とから加わる力(緊張)であり、好ましくは酵素分子、又は酵素と蛍光タンパク質との組み合わせに構造的な変形を生じさせるような力である。
【0052】
本明細書中において「構造的な変形」とは、上述したような酵素分子、又は酵素と蛍光タンパク質との組み合わせに外部から加わる分子テンションによって、酵素分子、又は酵素と蛍光タンパク質との組み合わせの分子が捩れる等の構造上の変化であることを意図しており、構造が大きく変形するようなものでなくてもよく、その変形により発光プローブからの酵素活性度が増加するような変形であればよい。
【0053】
本発明に係る発光プローブの各構成要素であるリガンド結合タンパク質、酵素の全長あるいは酵素の全長及び蛍光タンパク質、ならびに認識タンパク質は、直鎖状の融合分子となるように、それぞれ直接に、又は最適なリンカーペプチドを介して連結される。リンカーペプチドを介して連結する場合、リンカーペプチド配列の種類及び長さを変えることで、各構成要素間の距離を適宜調整することが可能である。
【0054】
このようなリンカーペプチドとしては、本発明に係る発光プローブを一本鎖の融合タンパク質として発現するための連結ペプチドであることが好ましい。リンカーペプチドとしては、サイドチェーンのない、柔軟なアミノ酸(例えば、グリシン(G:Glysine)など)を介してもよい。リンカーペプチドの長さは短いことが好ましく、例えば5アミノ酸以下の短いアミノ酸配列であることが好ましい。このように、各要素間のリンカーペプチドの長さを最短に抑えることによって、リガンド応答性の良いプローブを設計できる。また、リガンド結合タンパク質と、酵素又は当該酵素と組み合わされて挿入される蛍光タンパク質と、を連結する第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、認識タンパク質と、酵素又は当該酵素と組み合わされて挿入される蛍光タンパク質と、を連結する第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることが好ましく、これにより、リガンド結合タンパク質と認識タンパク質との相互作用による生じる分子テンションを効率よく酵素に伝達し、確実に酵素に構造的な変形を生じさせることができる。
【0055】
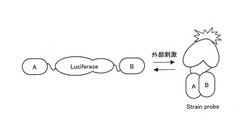
ここで、本発明に係る発光プローブの一例を用いたリガンド認識メカニズムを模式的に図1に示す。本発明に係る発光プローブの一例は、図1に示すように、例えばリガンド結合タンパク質(A)と認識タンパク質(B)との間に、発光酵素であるルシフェラーゼ(Luciferase)の全長が挿入されている。なお、全長とは、酵素活性に関与しない一部が欠損されているものであってもよい。そして、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素に一定の構造的な変形(ストレイン)を引き起こし、この変形によって発光プローブからの酵素活性度が増加する。
【0056】
また、本発明に係る発光プローブの他の例を用いたリガンド認識メカニズムを模式的に図21に示す。本発明に係る発光プローブの他の例は、図21に示すように、例えばリガンド結合タンパク質(A)と認識タンパク質(B)との間に、発光酵素であるルシフェラーゼ(RLuc8)の全長と、強化黄色蛍光タンパク質(EYFP:Enhanced Yellow Fluorescence Protein)とが挿入されている。EYFPは、RLuc8のN末側に連結されている。リガンドがない条件では、リガンド結合タンパク質と認識タンパク質とが相互作用せず、EYFPとRLuc8との間の生物発光共鳴エネルギー移動(bioluminescence resonance energy transfer;BRET)は弱く、発光強度は弱い。一方、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素及び蛍光タンパク質に一定の構造的な変形(ストレイン)を引き起こし、発光酵素と蛍光タンパク質との間の生物発光共鳴エネルギー移動が影響を受けることによって、発光プローブからの酵素活性度が増加する。
【0057】
酵素活性度の増加は、リガンドの濃度、性質等に依存するため、この酵素活性度の増加、すなわち発光強度の増加を指標として、リガンドの性質、量等を測定することができる。以上のような原理でリガンドを検出するため、本発明に係る発光プローブを「ストレインプローブ(Strain probe)」と称することもある。
【0058】
このように、発光プローブに挿入される発光酵素は、全長の発光酵素の両側に連結されたタンパク質同士の相互作用によって分子テンションが加わり、分子の構造的な変形(分子変形)が生じ、発光プローブからの酵素活性度を増加させるものであればよく、その種類、発光特性、分子量等は、特に限定されない。例えば、ウミシイタケルシフェラーゼ(RLuc8:Renilla luciferase 8)、ガウシアルシフェラーゼ(GLuc:Gaussia luciferase)、ビートル(昆虫)ルシフェラーゼの一種であるクリックビートルルシフェラーゼ(CBLuc:click beetle luciferase)、ホタルルシフェラーゼ(FLuc:firefly luciferase)、RLuc、MpLuc1(Metridia pacifica luciferase 1)、MpLuc2(Metridia pacifica luciferase 2)、MLuc(Metridia longa luciferase)、OLuc(Oplophorus)、RWLuc(Rail-road worm luciferase)等を含む海洋生物、昆虫、バクテリア由来のルシフェラーゼを、特に制限なく使用できる。これらの発光酵素のなかでも、RLuc8、GLuc、CBLuc、FLuc等を好適に用いることができる。
【0059】
これらの発光酵素は、アミノ酸配列や遺伝子(DNA)の塩基配列が公知であり(例えば、FLucはGenBank/AB062786等、CBLucはGenBank/AY258592.1等、GLucはGenBank/AY015993等)、これらの配列情報に基づいて公知の方法によりDNAを取得することができる。
【0060】
ここで、RLuc8とFLucとの構造を比較する。図2は、RLuc8の結晶構造を示す図であり、図3は、ホタルルシフェラーゼ(FLuc)の結晶構造を示す図である。なお、図2において、NはN末端を示し、CはC末端を示す。また、酵素活性部位を矢印部位(a)で示す。図2に示すように、RLuc8は、略球形状の1つのユニットからなり、堅い分子構造を有している。一方、図3に示すように、FLucは、2つのドメインによって構成されており、N末側ドメインとC末側ドメインとは柔軟性の高い親水性アミノ酸によって繋がっている。これらの構造の違いから、酵素を単独でリガンド結合タンパク質と認識タンパク質との間に挿入する場合には、FLucのような2ドメイン構造よりも、RLuc8のような構造を有する酵素の方が、分子末端からの分子テンションが酵素本体に効率よく伝わり、構造的な変形が起こりやすいため好ましい。
【0061】
次に、RLuc8の酵素活性部位について考察する。図4は、RLuc8の酵素活性部位における各アミノ酸と基質との間の相互作用(結合)を示す図である(非特許文献11)。なお、図4において、破線によって囲まれたアミノ酸は、酵素末端から近いアミノ酸である。RLuc8の酵素活性部位を構成するアミノ酸のうち、H285、F286、及びF261等は、C末端(Q311)から近いため、特にC末端にかかる外部からの分子テンションにより直接影響を受けやすい。したがって、RLuc8は、外部からの分子テンションが酵素活性部位に効率よく伝わるため、変形により酵素活性が変化しやすい構造となっている。
【0062】
このように、本発明に係る発光プローブに用いる酵素としては、酵素を単独でリガンド結合タンパク質と認識タンパク質との間に挿入する場合には、RLuc8のような、略球形状の1つのドメインからなり、酵素活性部位が末端に近いなど、変形しやすく、かつ変形により酵素活性が変化しやすいものが好ましい。
【0063】
なお、本明細書中において「酵素が略球形状である」とは、酵素分子の立体構造が全体として略球形状をしていることを意味する。したがって、例えば酵素分子が2つのドメインによって構成されていても、酵素分子が全体として略球形状であれば、その酵素は略球形状である。なお、「略球形状」とは、完全な球形状との差異が比較的小さい形状であって、酵素分子の中心から酵素分子の表面上の任意の点までの距離が略一定である形状であればよい。
【0064】
また、発光プローブに発光酵素と蛍光タンパク質とを組み合わせて挿入する場合には、発光酵素としては、上述したものを特に制限なく使用できる。発光酵素と組み合わされる蛍光タンパク質としては、当該発光酵素の活性によって発生した発光エネルギーを効率よく吸収できるものが望ましい。例えば、蛍光タンパク質は、その吸収スペクトルの全部又は一部が、発光酵素の発光スペクトルの全部又は一部と重なるものであることが望ましい。蛍光タンパク質としては、上述したEYFPの他に、Venus、mOrange,Kaede,Dronpa等が挙げられる。
【0065】
本発明に係る発光プローブとしては、リガンド結合タンパク質として、エストロゲン(女性ホルモン)受容体(ER:estrogen receptor)のリガンド結合ドメイン(LBD:ligand-binding domain)を用い、認識タンパク質としてキナーゼSrcのリン酸化認識ドメイン(Src SH2)を用い、発光酵素の全長としてRLuc8を用いた発光プローブ(ERS)であることが好ましい。ER LBDは、17β−エストラジオール(estradiol)(E2)等のエストロゲン(estrogen)、エストロゲンアンタゴニスト(OHT; 4-hydroxytamoxifen)等のリガンドに応答するものである。この発光プローブは、ER LBDをリン酸化するリガンドを検出するために用いることができる。
【0066】
このように、最適な発光酵素を選択することによって、発光プローブの構造的変化による分子テンションが効率よく発光酵素に伝達され、さらに発光プローブの構造を単純化することができる。そして、発光プローブをこのように構成することによって、従来の酵素分割型に比べて発光プローブから格段に高い発光強度を維持しつつ、リガンド結合タンパク質と認識タンパク質との相互作用による発光量を顕著に増加させることができる。例えば、後述する実施例において示すように、発光プローブの発光酵素としてRLuc8を用いた場合には、リガンド結合タンパク質と認識タンパク質との相互作用によって、これらが相互作用していないときに対して発光量を650%まで増加させることができる(図10のfcpを参照)。このように、本発明に係る発光プローブは、分子テンションによる酵素の変形、それに伴う酵素活性度の増加が生じるものであることが好ましい。
【0067】
このように構成された発光プローブを用いたリガンド認識メカニズムを示す模式図を図5に示す。図5に示すように、ER LBDは、OHT等のリガンドによる刺激に応じて構造変化(活性化)する。この構造変化の結果、ER LBDにおけるY537がリン酸化されると、SrcのSH2ドメインがこのリン酸化部位を認識し、分子内相互作用によりER LBDとSH2ドメインとが結合する。ER LBD−SH2ドメイン間の結合は、RLuc8の構造的な変形を引き起こし、発光プローブの酵素活性度を増加させる。この酵素活性度の増加は、リガンドの濃度等に依存する。そのため、発光プローブからの発光強度の変化を指標に、リガンドの量を測定することができる。
【0068】
また、例えばアンドロゲン受容体に対するリガンドを検出するためには、リガンド結合タンパク質としてAR LBDを用い、認識タンパク質としてLXXLLモチーフを用いることができる。
【0069】
本発明に係る発光プローブにおいては、リガンド結合タンパク質にリガンドが結合したことを、同じ分子内の認識タンパク質が認識した場合に、酵素に構造的な変形が生じることによって、発光プローブの酵素活性度、すなわち発光量が、リガンド結合タンパク質にリガンドが結合する前の状態における発光プローブからの発光量よりも増える。すなわち、リガンドが結合する前と後とで、発光プローブからの発光量が異なるものであればよく、その発光量の変化の要因としては、変形による酵素の量子収率(Quantum yield)の向上、酵素の変形による発光プローブの代謝回転率(Turn-over rate)の向上(安定性の向上)等が挙げられる。しかしながら、本発明に係る発光プローブによるリガンドの検出においては、発光プローブからの発光量の変化の要因に関わらず、発光プローブからの発光量の増加を指標とすればよいことは言うまでもない。
【0070】
本発明に係る発光プローブは、各構成要素のポリペプチドを化学合成法等で得た後に、それぞれを連結して得てもよいが、各構成要素のポリペプチドをコードするポリヌクレオチドを直鎖状に連結したポリヌクレオチド、すなわちキメラDNAが挿入されたベクターを用いて細胞を形質転換し、形質転換した細胞内に発現させることによっても得られる。
【0071】
ここで、キメラDNAとは、由来の異なるいくつかのDNA断片が人工的に直鎖状に連結されたものであり、いくつかのポリペプチドを構成要素とする融合タンパク質を発現することのできるDNAである。
【0072】
本明細書中において、「生細胞」とは、生物における細胞(原核細胞、酵母細胞、昆虫細胞、ヒトを含めた哺乳動物細胞等)のみならず、その本来の機能を維持した状態の培養細胞(原核細胞及び真核細胞)、生物個体内に移植、感染した細胞などを含み、特に実験動物、例えばマウス等の細胞である。また、生物の個体そのものをも含む概念である。
【0073】
本明細書中において、融合タンパク質とは、由来の異なるいくつかのタンパク質又はポリペプチドが人工的に連結されたものであり得る。
【0074】
本明細書中において、「ポリペプチド」は、「ペプチド」又は「タンパク質」と交換可能に使用される。本発明に係るポリペプチドはまた、化学合成されても、天然供給源より単離されてもよい。用語「単離された」ポリペプチドまたはタンパク質は、その天然の環境から取り出されたポリペプチド又はタンパク質が意図される。例えば、宿主細胞中で発現され産生された組換えポリペプチド及びタンパク質は、任意の適切な技術によって実質的に精製されている天然の、又は組換えのポリペプチド及びタンパク質と同様に、単離されていると考えられる。
【0075】
本発明に係る発光プローブにおいて、各構成要素のポリペプチドは、天然の精製産物、化学合成手順の産物、及び原核生物宿主または真核生物宿主(例えば、細菌細胞、酵母細胞、高等植物細胞、昆虫細胞、及び哺乳動物細胞を含む)から組換え技術によって産生された産物を含む。
【0076】
また、本発明に係る発光プローブ及び各構成要素のポリペプチドは、付加的なペプチドを含むものであってもよい。付加的なペプチドとしては、例えば、Hisタグ(配列番号7)、Mycタグ(配列番号9)、Flagタグ(配列番号8)等のエピトープ標識ペプチドが挙げられる。本発明に係る融合タンパク質は、好ましい形態に改変され、組換え発現され得る。例えば、本発明に係る融合タンパク質は、N末端又はC末端に特定のアミノ酸、特に荷電性アミノ酸の領域等を付加することによって、宿主細胞内、精製、精製に引き続く操作、及び保存等における安定性、持続性等を改善することができる。
【0077】
一実施形態において、本発明に係る発光プローブは、配列番号1〜3及び13〜14のいずれかに示されるアミノ酸配列からなる融合タンパク質又はその変異体であることが好ましい。ここで、当該変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号1〜3及び13〜14のいずれかに示されるアミノ酸配列において、1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなる融合タンパク質であることが好ましい。
【0078】
本明細書中においてポリペプチドまたはタンパク質に関して用いられる場合、用語「変異体」は、本来のアミノ酸の少なくとも1つ以上がポイント変異、挿入、逆転、反復、欠損、タイプ置換されたポリペプチド又はタンパク質であって、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させるポリペプチドまたはタンパク質が意図される。
【0079】
このような変異体としては、欠失、挿入、逆転、反復、タイプ置換(例えば、親水性残基の別の残基への置換、しかし通常は強い親水性の残基を強い疎水性の残基には置換しない)、及びポイント変異などを含む変異体が挙げられる。アミノ酸の置換には、例えば、ポリペプチドにおける中性アミノ酸を別の中性アミノ酸に置換する場合等が含まれる。
【0080】
ポリペプチドのアミノ酸配列中のいくつかのアミノ酸が、このポリペプチドの構造又は機能に有意に影響することなく容易に改変され得ることは、当該分野において周知である。さらに、人為的に改変させるだけではなく、天然のタンパク質において、当該タンパク質の構造又は機能を有意に変化させない変異体が存在することもまた周知である。
【0081】
当業者は、周知技術を使用してポリペプチドのアミノ酸配列において1又は数個のアミノ酸を容易に変異させることができる。例えば、公知の点変異導入法に従えば、ポリペプチドをコードするポリヌクレオチドの任意の塩基を変異させることができる。また、ポリペプチドをコードするポリヌクレオチドの任意の部位に対応するプライマーを設計して欠失変異体又は付加変異体を作製することができる。さらに、本明細書中に記載される方法を用いれば、作製した変異体が所望の活性を有するか否かを容易に決定し得る。
【0082】
変異体としては、好ましくは保存性もしくは非保存性アミノ酸置換、欠失、又は添加等の変異を有する変異体である。変異体が有する変異としては、好ましくは、サイレント置換、添加、及び欠失であり、特に好ましくは、保存性置換である。これらは、本発明に係る発光プローブの発光活性を変化させない。
【0083】
代表的に保存性置換と見られるのは、脂肪族アミノ酸Ala、Val、Leu、及びIleの中での1アミノ酸の別のアミノ酸への置換;ヒドロキシル残基Ser及びThrの交換、酸性残基Asp及びGluの交換、アミド残基Asn及びGlnの間の置換、塩基性残基Lys及びArgの交換、ならびに芳香族残基Phe及びTyrの間の置換である。
【0084】
他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなるポリヌクレオチドによってコードされることが好ましい。
【0085】
他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされることが好ましい。
【0086】
ハイブリダイゼーションは、Sambrookら、Molecular Cloning,A Laboratory Manual,2d Ed.,Cold Spring Harbor Laboratory(1989)に記載されている方法のような周知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり(ハイブリダイズし難くなる)、より相同なポリヌクレオチドを取得することができる。適切なハイブリダイゼーション温度は、塩基配列やその塩基配列の長さによって異なり、例えば、アミノ酸6個をコードする18塩基からなるDNAフラグメントをプローブとして用いる場合、50℃以下の温度が好ましい。
【0087】
本明細書中で使用される場合、用語「ストリンジェントな(ハイブリダイゼーション)条件」は、ハイブリダイゼーション溶液(50%ホルムアミド、5×SSC(150mMのNaCl、15mMのクエン酸三ナトリウム)、50mMのリン酸ナトリウム(pH7.6)、5×デンハート液、10%硫酸デキストラン、及び20μg/mlの変性剪断サケ精子DNAを含む)中にて42℃で一晩インキュベーションした後、約65℃にて0.1×SSC中でフィルターを洗浄することが意図される。ポリヌクレオチドの「一部」にハイブリダイズするポリヌクレオチドによって、参照のポリヌクレオチドの少なくとも約15ヌクレオチド(nt)、そしてより好ましくは少なくとも約20nt、さらにより好ましくは少なくとも約30nt、そしてさらにより好ましくは約30ntより長いポリヌクレオチドにハイブリダイズするポリヌクレオチド(DNA又はRNAのいずれか)が意図される。
【0088】
また、他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一、より好ましくは少なくとも80%同一、さらに好ましくは少なくとも85%、90%、92%、95%、96%、97%、98%又は99%同一である塩基配列からなるポリヌクレオチドによってコードされることが好ましい。
【0089】
DNA塩基配列の66%以上が同一であれば、全く同様の活性を持つ融合タンパク質を作製できる根拠としては、サイレント変異を考えられる。遺伝子暗記票によれば、例えば、アミノ酸のバリン(Valine)をコードする遺伝子は、GUU、GUC、GUA、GUGのいずれでもよい。従って、最大33%の遺伝子塩基が違っても全く同一の融合タンパク質プローブを作製できることから、数字の66%が同一塩基配列か否かを判定する上で妥当な意味を持つ。
【0090】
また、機能が解明されている多くのタンパク質は、自然変異体またはアイソフォームを持つ。本実施例にあげたERでさえ、自然界にはERαとERβとが存在しており、女性ホルモンに対して同様のセンシング能をもつことが知られている(非特許文献10)。ところが、そのアミノ酸間の相同性はわずか30%(N-末側領域;NTD)、53%(リガンド結合領域;LBD)に過ぎない点を考慮すべきである。
【0091】
さらに、本実施例において用いたERと同じ核受容体であるグルココルチコイド(GR)では、GRαA、GRβA、GRα2、GRβ2、GRAα、GRAβ、GR−P、GR−βBなどのイソフォームが存在し、それぞれ同じGR類として生体内で機能している(Swiss−Prot P04150)点を考慮しなければならない。
【0092】
例えば、「本発明に係る融合タンパク質をコードするポリヌクレオチドの参照(QUERY)塩基配列に少なくとも66%同一の塩基配列からなるポリヌクレオチド」である対象塩基配列は、当該参照塩基配列の100ヌクレオチチド(塩基)あたり33個までの不一致(mismatch)を含み得るが、参照塩基配列と同じ表現型(アミノ酸配列)のタンパク質をコードする配列である。参照塩基配列に少なくとも66%同一の塩基配列からなるポリヌクレオチドとは、例えば参照配列における塩基の33%までが、欠失されていてもよく、又は別の塩基で置換されていてもよい。また、参照塩基配列における全塩基の33%までにあたる数の塩基が、参照塩基配列に挿入されていてもよい。対象塩基配列における、参照塩基配列とは不一致な塩基は、対象塩基配列の5’もしくは3’末端位置、又はそれ以外の塩基配列中において、個々に、又は1以上の隣接した群において分散されていてよく、また、対象塩基配列中のどこにあってもよい。
【0093】
本発明はまた、本発明に係る発光プローブをコードするポリヌクレオチドを提供する。本発明に係るポリヌクレオチドは、生細胞内外において、本発明に係る発光プローブを発現可能なポリヌクレオチドである。本発明に係るポリヌクレオチドは、例えば、リガンド結合タンパク質、発光酵素の全長、及び認識タンパク質が直鎖状に配列した融合タンパク質となるように、それぞれをコードするcDNAを直鎖状に連結して作製されたキメラDNAである。
【0094】
本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」又は「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語「塩基配列」は、「核酸配列」又は「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A、G、C及びTと省略される)もしくはリボヌクレオチド(C、A、G及びU)の配列として示される。また、「配列番号4に示される塩基配列を含むポリヌクレオチド又はそのフラグメント」とは、配列番号4の各デオキシヌクレオチドA、G、C及び/又はTによって示される配列を含むポリヌクレオチド又はその断片部分が意図される。
【0095】
本発明に係るポリヌクレオチドは、RNA(例えば、mRNA)の形態、又はDNAの形態(例えば、cDNA又はゲノムDNA)で存在し得る。DNAは、二本鎖又は一本鎖であり得る。一本鎖DNA又はRNAは、コード鎖(センス鎖としても知られる)であり得るか、又は、非コード鎖(アンチセンス鎖としても知られる)であり得る。
【0096】
一実施形態において、本発明に係るポリヌクレオチドは、配列番号4〜6及び15〜16のいずれかに示される塩基配列からなるポリヌクレオチド又はその変異体であることが好ましい。
【0097】
一実施形態において、本発明に係るポリヌクレオチドの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質をコードし、かつ以下のポリヌクレオチドのいずれかであることが好ましい:配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなるポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズするポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一、より好ましくは少なくとも80%同一、さらに好ましくは少なくとも85%、90%、92%、95%、96%、97%、98%または99%同一である塩基配列からなるポリヌクレオチド。
【0098】
本発明に係るポリヌクレオチドは、非翻訳領域(UTR)の配列又はベクター配列(発現用ベクター配列を含む)などの配列を含むものであってもよい。
【0099】
本発明に係るポリヌクレオチドを取得するための供給源としては、特に限定されないが、生物材料(例えば、ヒトまたはマウスなどの諸器官)であることが好ましい。本明細書中で使用される場合、用語「生物材料」は、生物学的サンプル(生物体から得られた組織サンプル又は細胞サンプル)が意図される。
【0100】
本発明に係るポリヌクレオチドは、例えば、発現用ベクター等にサブクローンして、発光プローブを発現させるためのベクター(プラスミド)を作製し、これを細胞内に導入することによって、当該ポリヌクレオチドがコードする発光プローブを細胞内に発現させることができる。なお、本発明に係るポリヌクレオチドは、融合タンパク質をコードする領域の上流に、細胞内において発光プローブを発現させるためのプロモーター配列等が組み込まれたものであってもよい。
【0101】
本発明に係る融合タンパク質又はポリヌクレオチドは、本明細書中にさらに記載されるように、細胞内外における分子の可視化イメージングのための発光プローブとして使用され得る。より具体的には、本発明に係る融合タンパク質は一本鎖の融合ポリペプチドとして構成され、リガンド結合タンパク質にリガンドが結合すると、その立体構造が変化し、リガンド結合タンパク質が認識タンパク質によって認識される。その結果、リガンド結合タンパク質と認識タンパク質とが相互作用すると、これによってリガンド結合タンパク質と認識タンパク質との間に位置する全長の発光酵素、又は連結された全長の発光酵素及び蛍光タンパク質、が変形し、発光量を増加させる。このように、本発明に係る融合タンパク質によれば、発光量の変化に基づいて、細胞内外における分子の動き、信号伝達等を可視化検出することができる。
【0102】
したがって、本発明に係る融合タンパク質を用いれば、標的特異的なリガンドの生理活性、濃度等を高精度に検出することが可能であり、例えば発癌物質のような生体内危険因子のスクリーニング、薬学分野における新薬候補物質のスクリーニング、抗癌剤の薬理作用の定量評価(新薬の開発)、環境汚染・毒性物質の判定、診断用のキット、新型万能細胞(iPS)における分化・生理作用の測定などに有用である。
【0103】
つまり、本発明の目的は、発光プローブ及びこれをコードするポリヌクレオチドを提供することにあるのであって、本明細書中に具体的に記載した融合タンパク質作製方法及びポリヌクレオチド作製方法等に存するのではない。従って、上記各方法以外によって取得される発光プローブ及びこれをコードするポリヌクレオチドも本発明の技術的範囲に属することに留意しなければならない。
【0104】
〔2.ベクター〕
本発明はまた、本発明に係る融合タンパク質を生物又は細胞内で発現させるベクターを提供する。本発明に係るベクターを用いれば、本発明に係る融合タンパク質をコードするポリヌクレオチドを生物又は細胞に導入し、当該生物又は細胞内において本発明に係る融合タンパク質を発現させることができる。
【0105】
本発明に係るベクターは、上述した本発明に係るポリヌクレオチドを含んでいることを特徴としている。本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものであれば、特に限定されない。例えば、本発明に係るポリヌクレオチドのcDNAが挿入された組換え発現ベクター等が挙げられる。組換え発現ベクターの作製方法としては、プラスミド、ファージ又はコスミド等を用いる方法が挙げられるが特に限定されない。
【0106】
発現用ベクターの具体的な種類は特に限定されず、発現に用いる宿主中で発現可能なベクター等が適宜選択され得る。例えば、公知の真核又は原核細胞用のベクター等を使用することができる。また、ある臓器に特異的に宿る既知のベクターを使うことによって、特定臓器に選択的に本発明に係る融合タンパク質を発現させることもできる。
【0107】
また、本発明に係るベクターは、本発明に係るポリヌクレオチドの発現を制御するために(例えば、生物個体における特定組織での発現)、公知の組織特異的プロモーター配列を組み込むようにしてもよい。また、特定のリガンド、刺激物等の有無によって、本発明に係るポリヌクレオチドの発現を制御するために、公知の特定刺激特異的プロモーター配列を組み込むようにしてもよい。
【0108】
また、本発明に係るベクターは、本発明に係るポリヌクレオチドを、例えばpMXなどのレトロウイルスベクターにつなげたものであってもよい。これを高力価のウイルス産生能を有するパッケイジング細胞PLATEに導入することによって、動物に感染するレトロウイルスの作成が可能である。このウイルスを動物の各臓器に感染させることによって、各臓器内におけるセカンドメッセンジャー特性のリアルタイムイメージングができる。
【0109】
すなわち、本発明に係るベクターは、確実に本発明に係るポリヌクレオチドによりコードされる融合タンパク質を発現させるために、適宜プロモーター配列を選択し、これと本発明に係るポリヌクレオチドとを各種プラスミド等に組み込んだものであってもよい。
【0110】
本発明に係るベクターは、例えばマイクロインジェクション法、エレクトロポーレーション法、脂質試薬によるトランスフェクション法(例えばTransIT、Mirus社製)等の公知の方法により宿主内に導入することができる。上記の宿主は、特に限定されるものではなく、従来公知の各種細胞、生物個体等を好適に用いることができる。
【0111】
なお、目的とする本発明に係る融合タンパク質が常に合成される場合に限定されず、IPTGを添加することにより、合成が誘導されるものであってもよい。また、ベクターには、合成されるタンパク質のN末端又はC末端にヒスチジンタグ、HAタグ(配列番号10)、Mycタグ、Flag等のタグ配列を付加する配列を含むものであってもよい。
【0112】
また、本発明に係るベクターは、例えば、融合タンパク質を発現させる目的ではなく、融合タンパク質をコードする配列の上流に発現制御をし得る制御配列を繋げることによって、融合タンパク質の発現の有無を指標としてさらなる生物分析のために利用することができる。
【0113】
本発明に係るベクターは、少なくとも1つの選択マーカーを含むことが好ましい。このようなマーカーとしては、真核生物細胞培養については、ジヒドロ葉酸レダクターゼ、又はネオマイシン、ゼオシン、ジェネティシン、ブラストシジンS、ハイグロマイシンB等の薬剤耐性遺伝子が挙げられる。また、大腸菌及び他の細菌における培養については、カナマイシン、ゼオシン、アクチノマイシンD、セフォタキシム、ストレプトマイシン、カルベニシリン、ピューロマイシン、テトラサイクリン又はアンピシリン等の薬剤耐性遺伝子が挙げられる。上記選択マーカーを用いれば、本発明に係るポリヌクレオチドが宿主に導入されたか否か、さらには宿主中で確実に発現しているか否かを確認することができる。
【0114】
本発明に係るベクターを用いれば、生物又は細胞に導入することにより、当該生物又は細胞中に本発明に係る融合タンパク質を発現させることができる。また、本発明に係るベクターを導入した細胞から融合タンパク質を抽出して、精製し又は未精製のままで(非細胞系)、診断キットのセンサー成分として使用できる。例えば、生体試料内の各種生理物質の一例としてステロイドホルモン又は化学物質を測定することによって、各リガンドの生理活性を迅速に測定することができる。
【0115】
さらに、本発明に係るベクターを無細胞タンパク質合成系に用いれば、本発明に係る融合タンパク質を合成することができる。
【0116】
なお、本発明に係るベクターは、少なくとも、本発明に係る融合タンパク質をコードするポリヌクレオチドを含んでいればよい。すなわち、発現用ベクター以外のベクターも本発明の技術的範囲に含まれる点に留意すべきである。
【0117】
〔3.形質転換体〕
本発明はまた、本発明に係る融合タンパク質を発現させ得る形質転換体を提供する。本発明に係る形質転換体は、本発明に係るポリヌクレオチド、及び当該ポリヌクレオチドを含むベクターを含んでいることを特徴としている。本明細書中において、「形質転換体」は、細胞、組織又は器官だけでなく、生物個体をも含むことが意図される。本発明に係る形質転換体は、本発明に係るポリヌクレオチド、及び当該ポリヌクレオチドを含むベクターを含んでいる限り、特に限定されるものではない。
【0118】
本発明に係る形質転換体は、本発明に係るポリヌクレオチド、又は当該ポリヌクレオチドを含む組換えベクターを、本発明に係る融合タンパク質が発現され得るように生物又は細胞中に導入することによって得られる。なお、組換えベクターを導入する宿主生物及び細胞としては、特に限定されないが、例えばCOS−7、MCF−7、HeLa、CHOのような真核培養細胞、体細胞由来の新型万能細胞(iPS)、原核細胞、植物細胞、高等動物等を用いることができる。
【0119】
本発明に係るポリヌクレオチド、又は当該ポリヌクレオチドを含むベクターを宿主に導入する方法、すなわち形質転換方法は特に限定されるものではなく、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等の従来公知の方法を好適に用いることができる。また、本発明に係る形質転換体は、本発明に係るポリヌクレオチドが宿主のゲノムに組み込まれていない状態で一過性に発現する、一過性形質転換体であってもよく、本発明に係るポリヌクレオチドが宿主のゲノムに組み込まれ安定的に発現し続ける、安定形質転換体であってもよい。
【0120】
本発明に係る形質転換体を用いれば、本発明に係る融合タンパク質を発現させることができるため、本発明に係る形質転換体をリガンドで刺激し、当該形質転換体からの発光量の変化を測定することによって、リガンドの性質、濃度、活性の程度等を評価することができる。
【0121】
〔4.標的物質検出方法及びキット〕
本発明は、さらに、被験試料中の標的物質を検出する標的物質検出方法及びキットを提供する。標的物質をリガンドと称する場合、標的物質検出方法及びキットを、リガンド検出方法及びキットと称する。本発明に係る標的物質検出方法は、被験試料と、本発明に係る融合タンパク質とを共存させる工程を包含することを特徴としている。本方法においては、被験試料と接触させる融合タンパク質に含まれる酵素の基質を、適宜接触させてもよい。これにより、本発明に係る融合タンパク質からの発光量を指標に、被験試料中の標的物質を検出する。本明細書中において、「被験試料」は、リガンドそのものであってもよく、リガンドを含む生体試料等であってもよい。また、被験試料は、本発明に係る融合タンパク質が発現した細胞において二次的に生産された細胞内物質であることもできる。
【0122】
上記工程において、被験試料の存在下及び非存在下において、本発明に係る融合タンパク質からの発光量が増加した場合、当該被験試料中において、本発明に係る融合タンパク質のリガンド結合タンパク質に結合するリガンドを検出することができる。本発明に係るリガンド検出方法によれば、後述する実施例に示すように、リガンドの性質、リガンドの活性の程度、リガンドの濃度等を分析することが可能である。
【0123】
本発明に係る標的物質検出方法によれば、既知のアゴニストに対する未知のアンタゴニストを検出することもできる。例えば、本発明に係る融合タンパク質に候補物質を含む被験試料を接触させ、ついで既知のアゴニストを接触させて、本発明に係る融合タンパク質からの発光量を測定する。被験試料中の候補物質がアンタゴニスト作用を有するものであれば、一次結合タンパク質のアゴニスト結合部位は候補物質によって占有されているので、その後に導入されたアゴニストは一次結合タンパク質に結合することはできない。
【0124】
このとき、アンタゴニストの結合によっては立体構造が増加しない一次結合タンパク質を用いていれば、アンタゴニストの結合により融合タンパク質からの発光量は増加しないため、アゴニスト単独で導入した場合に比して発光量は低い。一方、アゴニストの結合によっては立体構造が変化しない一次結合タンパク質を用いていれば、同様に既知のアンタゴニストを用いて、未知のアゴニストを検出することもできる。
【0125】
本発明に係る標的物質検出方法においては、典型的には、本発明に係る融合タンパク質をコードするポリヌクレオチドを含む発現ベクターを用いて形質転換した生細胞と、被験試料とを接触させて刺激し、刺激前後における本発明に係る融合タンパク質からの発光量の増加を測定する。本発明に係る融合タンパク質と被験試料とを接触させる方法は、特に限定されないが、例えば本発明に係る融合タンパク質が発現した生細胞の培養培地に被験試料を添加し、エンドサイトーシス作用によって被験試料を細胞内に取り込ませて接触させてもよい。また、被験試料が細胞内物質の場合には、本発明に係る融合タンパク質を当該細胞内において発現させることによって、接触させてもよい。また、生細胞がない状態であっても、例えば培地中に分泌した本発明に係る融合タンパク質を含む培養液、又は精製した本発明に係る融合タンパク質を用いれば、各発光酵素の基質を同時に存在させて、in vitroでの測定も可能である。
【0126】
本発明に係る標的物質検出方法において、生細胞中に発現させた発光プローブを用いる場合、以下の方法を適用できるが、この方法に限定されない。
(i)本発明に係る発光プローブをコードするポリヌクレオチドを有するプラスミドを、24穴プレート上の生細胞に導入し、さらに16時間培養する。
(ii)上記細胞を被験試料で20分間刺激する。
(iii)基質共存下で、上記細胞における発光量の変化を発光度計で測定する。
【0127】
本発明に係る標的物質検出方法において、本発明に係る発光プローブを用いた非細胞系実験(in vitro)を行った場合、以下の方法を適用できるが、この方法に限定されない。
(i)公知の方法により精製した発光プローブを、直径1.2センチの十字架型紙片の末端に垂らして乾燥させる。
(ii)上記十字架型紙片のもう一方の末端に刺激物質(リガンド)を含む基質溶液を点滴し、即時に発光Scanner(例えば、RAS−3000;FujiFilm)で発光量の変化を測定する。
【0128】
本発明に係る標的物質を検出するための標的物質検出キットは、本発明に係る融合タンパク質を備えていることを特徴としている。また、本キットは、本発明に係る融合タンパク質に含まれる発光酵素の基質を、さらに備えていてもよい。
【0129】
ここで、本キットが備える本発明に係る融合タンパク質は、真核細胞内及び原核細胞内において大量発現させた後に精製することが可能である。例えば哺乳動物細胞を用いた場合、従来公知の適切なシグナル配列(例えば、MGVKVLFALICIAVAEA等)を繋いで培地中に大量に分泌させることによって、精製工程なしでも分析に用いることが可能な、大量の融合タンパク質含有培養上清が得られる。また、さらに精製用のタグ(例えば、His Tag)をつけることで、容易に融合タンパク質を大量精製することができる。
【0130】
このようにして得られた融合タンパク質を備えたキットと同様に、本発明に係る融合タンパク質を発現している形質転換体を備えたキットも、被験試料中の標的物質の検出に用いられ得る。また、例えば精製した発光プローブを備える紙ストリップと、発光酵素の基質とを組み合わせたキットは、発光プローブを発現している形質転換体を備えたキットと同様に、外部刺激及びそれによる二次現象であるセカンドメッセンジャーの定性定量分析が可能なキット構成とすることができる。また、本発明に係るポリヌクレオチドと当該ポリヌクレオチドにより形質転換される細胞とを備えたキット、及び本発明に係るベクターと当該ベクターにより形質転換される細胞とを備えたキットも、同様に被験試料中の標的物質の検出に用いられ得る。
【0131】
〔5.プローブ生産方法及びキット〕
本発明は、さらに、本発明に係るプローブの生産方法及びキットを提供する。本発明に係るプローブの生産方法は、本発明に係るポリヌクレオチド又は本発明に係るベクターを用いて細胞を形質転換する工程を包含することを特徴としている。本方法においては、本発明に係るポリヌクレオチド又は本発明に係るベクターを用いて細胞を形質転換し、本発明に係るプローブを細胞中に発現させることによって、本発明に係るプローブを生産する。細胞中に発現させたプローブは、公知の方法により細胞中から回収し、精製することができる。
【0132】
具体的には、本発明に係るポリヌクレオチド又はベクターを用いて細胞を形質転換し、培養した後、培養物等から慣用的な手法(例えば、濾過、遠心分離、細胞の破砕、ゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー等)に従って、本発明に係るプローブを回収、精製することができる。また、細胞中で発現させたポリヌクレオチドに精製用のタグが付加されている場合には、より容易に回収することができる。
【0133】
本発明に係るプローブの生産キットは、本発明に係るポリヌクレオチド又は本発明に係るベクターを備えていることを特徴としている。また、本キットは、本発明に係るポリヌクレオチド又は本発明に係るベクターにより形質転換される細胞を、さらに供えていてもよい。さらに、本発明に係る融合タンパク質に含まれる酵素の基質を備えていてもよい。また、本発明に係るプローブの生産キットは、本発明に係る融合タンパク質をコードするポリヌクレオチドを備えていてもよい。
【0134】
本発明では、従来の方法における問題点を克服すべく、酵素の全長を用いる、新規の一分子型プローブとして用いられる融合タンパク質を提供する。例えば、酵素として発光酵素を用いる、新規な生物発光による可視化手段を提供する。また、本発明の手法は、生物発光酵素を用いる基礎原理をも提供している。
【0135】
本発明は、酵素にかかる分子の捩れ現象を指標としたユニークな生物分析法を用いるものである。本発明は、酵素の全長を用いるので、酵素として発光酵素を用いた場合には、高輝度の生物発光イメージングが可能である。また、本発明に係る融合タンパク質は、分解、ミスフォールディングなどが起こりにくいので安定性が高い。また、1つの分子内タンパク質間相互作用を指標とするため、非細胞系における生物分析にも適用できる。従って、本発明に係る融合タンパク質は、高精度で安定性の高い分析手段を提供するものであり、かつ、細胞・非細胞系ともに適用できる、簡便な手法を提供するものである。本発明における分析原理は、新薬候補物質のスクリーニング、毒性物質及び環境汚染物質の評価などに広く適用できる。
【0136】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【0137】
なお、本明細書における用語は、基本的にはIUPAC−IUB Commission on Biochemical Nomenclatureによるものであり、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。また発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学および分子生物学的技術はJ. Sambrook, E. F. Fritsch & T. Maniatis, "Molecular Cloning: A Laboratory Manual (2nd edition)", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989); D. M. Glover et al. ed., "DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995); Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995;日本生化学会編、「続生化学実験講座1、遺伝子研究法II」、東京化学同人 (1986); 日本生化学会編、「新生化学実験講座2、核酸III(組換えDNA技術)」、東京化学同人 (1992);R. Wu ed., "Methods in Enzymology", Vol. 68 (Recombinant DNA), Academic Press, New York (1980); R. Wu et al. ed., "Methods in Enzymology", Vol. 100 (Recombinant DNA, Part B) & 101 (Recombinant DNA, Part C), Academic Press, New York (1983); R. Wu et al. ed., "Methods in Enzymology", Vol. 153 (Recombinant DNA, Part D), 154 (Recombinant DNA, Part E) & 155 (Recombinant DNA, Part F), Academic Press, New York (1987) などの参考文献に記載の方法、上記文献に引用された文献に記載の方法、またはこれらと実質的に同一の方法、もしくはその改変法により行うことができる。また、本発明で使用する各種タンパク質、ペプチド、あるいはそれらをコードするDNAについては、既存のデータベース(URL:http://www.ncbi.nlm.nih.gov/等)から入手することができる。
【実施例】
【0138】
〔実施例1:発光酵素を挿入したストレインプローブの設計〕
まず、RLuc8(1−234アミノ酸)、GLuc(17−185アミノ酸)、CBLuc(1−515アミノ酸)、及びFLuc(1−550アミノ酸)をそれぞれコードするcDNAに対して、そのN末側にER LBDのcDNAを連結し、そのC末側にSrcのSH2ドメインのcDNAを連結して、これらのcDNAを直鎖状に連結したキメラDNAコンストラクトを作製した(配列番号4〜6、15)。作製したコンストラクトを、pcDNA 3.1(+)(Invitrogen社)にサブクローンした。
【0139】
図6は、ストレインプローブを作製するためのプラスミド構成の一例を示す図である。なお、図6には、RLuc8を挿入したストレインプローブ(ERSプローブ)を発現させるためのプラスミド(pERS)のみのDNAコンストラクト構成を示すが、GLucを挿入したストレインプローブ(EGSプローブ)を発現させるプラスミド(pEGS)、CBLucを挿入したストレインプローブ(ECSプローブ)を発現させるプラスミド(pECS)又はFLucを挿入したストレインプローブ(EFSプローブ)を発現させるプラスミド(pEFS)についてもこれと同様に構成した。
【0140】
次に、これらのプラスミドをCOS−7細胞(ATCC)に形質転換した。具体的には、COS−7細胞を、10%ステロイドフリーウシ胎児血清(FBS)及び1%ペニシリン−ストレプトマイシン(P/S)を添加したDulbecco改変イーグル培地(DMEM;Sigma製)を含む24ウエルプレートにおいて、cellインキュベータ(Sanyo製)中で、37℃、5%CO2存在下で培養した。導入試薬としてTransIT−LT1(Mirus製)を用いて、COS−7細胞に、pERS、pEGS、pECS及びpEFS(各ウエル当り0.2μg)を一過性形質転換した。形質転換した細胞を、5%CO2存在下で16時間インキュベートした。
【0141】
得られた形質転換体を用いて、リガンドとして用いた4−ヒドロキシタモキシフェン(OHT)の存在下・非存在下それぞれにおける発光強度を観察した。
【0142】
まず、作製したpERS、pEGS、pECS又はpEFSが導入されたCOS−7細胞を、OHT 10−6M(終濃度)存在下又は非存在下で20分間刺激した後、基質としてセレンテラジン又はD−ルシフェリン(D−luciferin)を用いて発光強度を測定した。
【0143】
発光強度の測定を以下のとおり行った。pERSが導入されたCOS−7細胞について、刺激後の細胞を、基質を含む200μLの細胞溶解バッファに溶解し、全溶解物を石英セル(45×12.5×7.5mm)に移した。分光光度計(FP−750;Jasco社)を用いて、400nmから700nmの範囲の発光を測定した(n=2)。また、pERS、pEGS、pECS又はpEFSが導入されたCOS−7細胞について、発光度計(Minilumat LB9506)を用いて発光強度を測定した。結果を図7及び8に示す。
【0144】
図7は、pERSが導入された形質転換体における発光スペクトルを示すグラフである。図7に示すように、RLuc8を挿入したERSプローブにおいて、OHT刺激依存的に発光強度が大幅に増加することが示された。また、発光スペクトルは、475nm近傍において最高値を示した。
【0145】
また、図8は、各ストレインプローブをそれぞれ発現する形質転換体の、バックグラウンド(−OHT)を1としたときの発光強度の割合を示すグラフである。図8に示すように、それぞれのストレインプローブにおいて、OHT刺激依存的に発光強度が増加することが示された。このように、OHT刺激によってストレインプローブからの発光強度が大きくなったという結果から、外部刺激を受けることによって、ストレインプローブ自身の代謝回転率が改善される、又はストレインプローブの量子収率が改善されることが示唆された。
【0146】
また、図8に示すように、RLuc8を挿入したERSプローブにおいて、他の発光酵素を挿入したストレインプローブと比較して特に発光強度が大きく増加した。この結果から、外部刺激によるストレインプローブの発光量の変化が、挿入した発光酵素の分子構造に強く依存することが示唆された。すなわち、挿入した発光酵素が、外部からの分子テンションが加わることにより酵素活性部位の構造が変形しやすい分子構造であるか否かが、ストレインプローブの発光量の変化に影響を及ぼすことが示唆された。上述したように、RLuc8は、略球形状であるため、外部からの分子テンションが酵素活性部位に効率よく伝わり、その構造が変形しやすい(ストレインがかかりやすい)構造となっている。したがって、他の発光酵素と比較して、外部刺激による発光強度の増加量が多い結果が得られたと言える。また、GLucは、他の発光酵素に比べて分子量(18―185アミノ酸;18kD)が非常に小さいため、外部からの分子テンションが酵素本体に伝わりにくく、その活性部位の構造が変形しにくいため、RLuc8と比較して外部刺激による発光強度の増加量が少ない結果となったと言える。
【0147】
また、ERSプローブを発現する形質転換体からの発光強度は、非常に高かった。これは、ERSプローブが、RLuc8の全長をそのまま含んでいるためであると言える。
【0148】
このように、本発明に係るストレインプローブを用いれば、様々なタンパク質―タンパク質間の相互作用を高感度、かつ高い発光強度で測定できることが示された。
【0149】
〔実施例2:ストレインプローブの基質選択性〕
次に、ERSプローブにおける発光酵素RLuc8の基質選択性について調べた。COS−7細胞を12穴プレートにおいて十分に培養した後、脂質試薬を用いてpERSをCOS−7細胞に導入し、さらに16時間培養した。その後、この細胞を溶媒又はOHT10−6M(終濃度)により20分間刺激し、種々の基質の共存下又は非存在下(バックグラウンド)における発光強度を実施例1と同様に、分光光度計(FP−750;Jasco社)を用いて測定した。基質として、図9に示すセレンテラジン(coelenterazine)(coele)、セレンテラジンcp(cp)、セレンテラジンhcp(hcp)、セレンテラジンfcp(fcp)、セレンテラジンip(ip)、及びセレンテラジン400A(400A)を用いた。なお、図9において、重要なサイドチェーンにあたる部位を破線によって囲んで示した。結果を図10及び11に示す。
【0150】
図10は、種々の基質共存下における、pERSを導入したCOS7細胞の発光スペクトルを示すグラフである。また、図11は、種々の基質共存下におけるpERSを導入したCOS7細胞の、バックグラウンドを1としたときの発光スペクトルのピーク強度の割合を示すグラフである。図10及び図11に示すように、いずれの基質を用いた場合であっても発光強度はOHT依存的に増加したが、基質の種類によって、その増加率が異なっていた。発光強度は、セレンテラジンを用いた場合が最も高かった(図示せず)。一方、バックグラウンドに対するシグナル比率は、セレンテラジンfcpを用いた場合が最も大きかった。
【0151】
この結果から、実験の目的に応じて基質を使い分けることができることが示唆された。また、各セレンテラジンのサイドチェーンを比較することによって、本発明のストレインプローブの基質における^重要なサイドチェーンを同定し得ることが示唆された。
【0152】
また、RLuc8を単独で用いた場合、又はERSを用いた場合の発光強度を、同様の方法を用いて測定した。RLuc8の全長をコードするcDNAのみをpcDNA 3.1(+)(Invitrogen社)にサブクローンしてプラスミドを構築し、当該プラスミドをCOS−7細胞に形質転換することによって、RLuc8を単独で発現した形質転換体を得た。結果を図12に示す。
【0153】
図12は、RLuc8を単独で発現した形質転換体、又はERSを発現した形質転換体における発光スペクトルを示すグラフである。図12に示すように、セレンテラジンfcp共存下において、RLuc8を単独で発現した形質転換体においては、OHT依存的な発光スペクトルの変化が見られなかったが、ERSを発現した形質転換体では、OHT依存的な発光スペクトルの変化が見られた。
【0154】
〔実施例3:ERSのリガンド依存性、検出限界及びリガンド選択性〕
まず、ERSのリガンド依存性及び検出限界について調べた。12穴プレートにおいて培養したCOS−7細胞に、pERSを導入(トランスフェクト)した後、さらに16時間培養した。その後、この細胞を種々の濃度のOHT又はテストステロン(T:testosterone)により20分間刺激し、次いでライセート試薬を15分間導入することによってライセートを作製した。作製したライセートについて、基質としてセレンテラジンの共存下において、発光強度の変化を発光度計(Minilumat LB9506)を用いて測定した。結果を図13に示す。
【0155】
図13は、ERSを発現した形質転換体におけるリガンド応答曲線を示す図である。図13に示すように、ERSを発現した形質転換体における発光強度は、濃度約10−10のOHT刺激によって増加しはじめ、濃度10−7近傍において最高値に達した。一方、テストステロンの刺激に対しては、発光強度の増加による応答は見られなかった。これにより、ERSは、OHTに特異的に応答することが示された。
【0156】
次に、ERSに及ぼすER LBDのリン酸化の影響、及び発光強度の変化に及ぼすERSの一分子型構造変化の影響を調べた。ER LBDのリン酸化部位であるY537に変異を導入した、EmRSプローブを発現するプラスミドを構築し、これをCOS−7細胞に導入した形質転換体を得た。また、図15に示すように、RLuc8のN末側にER LBDのみをつなげたプローブ(ERプローブ)を発現させるためのDNAコンストラクト構成を有するプラスミド(pER)、RLuc8のC末側にSH2ドメインのみをつなげたプローブ(RSプローブ)を発現させるためのDNAコンストラクト構成を有するプラスミド(pRS)をそれぞれ構築した。そして、構築したpER及びpRSを同時にCOS−7細胞に導入した形質転換体(ER+RS)を得た。
【0157】
得られた形質転換体をOHT又は0.l%DMSO(コントロール)によって刺激し、その発光強度を上記と同様の方法により測定し、比較した。結果を図14に示す。図14は、ERS、EmRS、並びにER及びRSをそれぞれ発現した形質転換体の、コントロールを1としたときの相対発光強度を示すグラフである。
【0158】
図14に示すように、ERSを発現した形質転換体は、OHT刺激に対して、コントロールと比較して約3倍の発光強度を示した。一方、EmRSを発現した形質転換体は、OHT刺激に対する発光強度の増加は、コントロールと比較して約1.7倍であった。これにより、リン酸化部位を変異したEmRSにおいては、外部刺激によるER LBDとSH2ドメインとの相互作用が生じにくく、外部刺激に依存した発光量の変化が見られにくいことが示唆された。
【0159】
また、ER及びRSを共発現する形質転換体(ER+RS)においては、OHT刺激に対して発光強度の増加が認められなかった。ここで、図16に、ER及びRSの構造を模式的に示す。図5に示すERSとを比較して、図16に示すER及びRSが共発現する形質転換体(ER+RS)においては、OHTの刺激によりSH2ドメインとER LBDとが相互作用したとしても、RLuc8に外部からの分子テンションが加わらない。したがって、RLuc8に変形、すなわち捩れが生じないので、その酵素活性部位が変形せず、発光強度が増加しなかった。
【0160】
次に、ERSにおけるリガンド選択性を調べた。図17に示す、OHT、E2(17β−エストラディオール)、及びパーシャルアゴニスト(partial agonist)であるゲニステイン(Genistein)、ならびにデヒドロテストステロン(DHT:5α-dihydrotestosterone)、テストステロン(T)、及びコルチゾール(cortisol)を、リガンドとして用いた。濃度10−6Mの各リガンドを用いて、ERSを発現した形質転換体を刺激した後、上記と同様の方法により発光強度を測定し、リガンドの代わりに溶媒を用いた場合(vehicle)の発光強度と比較した。結果を図18に示す。
【0161】
図18は、ERSを発現した形質転換体の、種々のリガンド応答による発光強度を示すグラフである。ERSを発現した形質転換体は、OHT及びE2に対してほぼ同等の発光強度の増加を示した。また、ゲニステインに対して、OHT及びE2よりは低いが、発光強度の増加を示した。一方、DHT、テストステロン、及びコルチゾールに対しては、発光強度の増加を示さなかった。
【0162】
この結果から、ERSが女性ホルモン受容体に特異的なリガンド感受性を有することが示された。また、ERSがリガンドに対して感度よく応答できることが示された。
【0163】
〔実施例4:発光酵素と蛍光タンパク質とを組み合わせて挿入したストレインプローブの設計〕
まず、蛍光タンパク質EYFPをコードするcDNAを、RLuc8(1−234アミノ酸)をコードするcDNAのN末側に連結した。連結したcDNAに対して、そのN末側にさらにER LBDのcDNAを連結し、そのC末側にSrc SH2ドメインのcDNAを連結して、このcDNAを直鎖状に連結したキメラDNAコンストラクトを作製した(配列番号16)。作製したコンストラクトを、pcDNA 3.1(+)(Invitrogen社)にサブクローンした。
【0164】
図19は、ストレインプローブを作製するためのプラスミド構成の一例を示す図である。図19には、EYFPのC末側にRLuc8を連結したものを挿入したストレインプローブ(EERSプローブ)を発現させるためのプラスミド(pEERS)のDNAコンストラクト構成を示す。
【0165】
次に、実施例1に示した方法と同様の方法を用いて、このプラスミドをCOS−7細胞(ATCC)に形質転換し、得られた形質転換体を用いて、OHTの存在下・非存在下それぞれにおける発光強度を測定した。結果を図20に示す。
【0166】
図20は、pEERSが導入された形質転換体における発光スペクトルを示すグラフである。図20に示すように、EYFP及びRLuc8を挿入したEERSプローブにおいて、OHT刺激依存的に発光強度が増加することが示された。
【0167】
この結果から、以下のことが示された。図21に示すように、リガンド(OHT)がない条件では、リガンド結合タンパク質(ER LBD)と認識タンパク質(Src SH2)とが相互作用せず、EYFPとRLuc8との間の生物発光共鳴エネルギー移動が弱いため、発光強度は弱かった。一方、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素(RLuc8)及び蛍光タンパク質(EYFP)に一定の構造的な変形(ストレイン)を引き起こし、発光酵素と蛍光タンパク質との間の生物発光共鳴エネルギー移動が影響を受けることによって、発光プローブからの酵素活性度、すなわち発光総量が増加した。すなわち、EERSプローブは、その内部において発光共鳴エネルギー移動を起こすものであることが示された。
【0168】
したがって、本発明に係る発光プローブは、リガンド結合タンパク質と認識タンパク質との間に、酵素を含む2つのタンパク質分子を挿入した場合においても、リガンド依存的な酵素活性度の変化が起こり得ることが示された。
【産業上の利用可能性】
【0169】
本発明に係る融合タンパク質は、発光強度が高く、設計が容易であるので、バイオ産業、医薬品産業、食品産業等の広範な分野に応用することができる。特に、診断医療分野、ナノバイオ分野、薬理作用評価分野、環境分析分野等において、好適に利用可能である。
【技術分野】
【0001】
本発明は、被験試料中の標的物質を検出する融合タンパク質及びその利用に関し、より具体的には、被験試料中の標的物質を検出する一分子型プローブとして用いられる融合タンパク質及びその利用に関するものである。
【背景技術】
【0002】
タンパク質の変形、タンパク質分子間の結合などに基づく生命現象として、例えば、ホルモン刺激により構造変化を経て活性化状態となり、二量体となる核受容体(NR:nuclear receptor)が挙げられる。そして、二量体化した核受容体は、核内に移行し、核内の核受容体応答配列(NRE:nuclear receptor response element)に結合して、転写活性を引き起こす(非特許文献1)。
【0003】
また、細胞は、細胞外部からの成長ホルモン(growth factor)刺激に対して、特異的な受容体(growth factor receptor)を介して応答し、一連のタンパク質リン酸化の媒介によって細胞内部に信号を伝達する(非特許文献2)。さらに、細胞は、細胞内部のコレステロール濃度の変化をモニタリングするシステムを有している。その一例として、細胞は、コレステロール濃度を調節するタンパク質(SREBP−2:Sterol-response element binding protein-2)を保有している。細胞内のコレステロール濃度が一定以下に低下した場合、細胞はそれを感知し、SREBP−2が分割される。そして、2分割されたSREBP−2の断片の一部が二量体化して核内移行し、核内でステロール応答配列(SRE:Sterol-response element)に結合することによって、一連のコレステロール調節因子を発現させる(非特許文献3)。
【0004】
この様な細胞内分子現象は、生体が生命活動の恒常性を維持しつつ、外部の環境変化に素早く応答するための機構である。これらの信号伝達を担うタンパク質は、細胞が外部刺激に素早く反応し、対処する上で極めて重要な役割を果たしている。
【0005】
細胞内分子現象を測定するためのいくつかの方法が開示されている。例えば、タンパク質―タンパク質間相互作用、タンパク質の立体構造の変化、タンパク質のリン酸化等を測定する手法が知られている。タンパク質―タンパク質間の相互作用を検出する方法として、FRET(fluorescence resonance energy transfer)法及びBRET(bioluminescence resonance energy transfer)法が広く使用されている(非特許文献4及び5)。
【0006】
また、本発明者らは以前に、一分子型及び二分子型生物発光プローブを提案している(非特許文献6及び7ならびに特許文献1〜3)。これらの生物発光プローブは、発光酵素を2分割し、それらの間に1つ又は2つのタンパク質を挿入した形態の生物発光可視化プローブである。一分子型生物発光プローブの一例として、ガウシア(Gaussia)由来の発光酵素を2分割し、カルシウム認識タンパク質であるカルモジュリン(CaM:calmodulin)をその間に挿入したものが挙げられる。この一分子型生物発光プローブを真核細胞に導入した場合、Ca2+の濃度に依存した生物発光の変化を観察できる(非特許文献8及び特許文献3)。
【0007】
さらに、本発明者らは以前に、円順列置換した発光酵素用いた生物発光プローブを提案している(非特許文献9)。この生物発光プローブにおいて、発光酵素の本来のN末端とC末端とを連結する一方で、酵素の酵素活性部位を切断して人工的なN末端とC末端とを作ることによって円順列置換されている。そして、人工的に作製したこれらの末端のそれぞれにタンパク質を連結する。このように分子設計することによって、発光酵素の酵素活性部位は2分割され、分割された酵素活性部位がそれぞれ分子の中心から外側に配置される。従って、酵素活性部位間の衝突確率を顕著に抑えることができる。結果として、シグナル−ノイズ比(S/N比:signal-to-noise ratio)を格段に改善することができる。
【0008】
また、本発明者らは以前に、男性ホルモン受容体(AR:androgen receptor)の核内移行を指標とした、生物発光イメージングプローブを提案している(非特許文献1)。このプローブでは、発光酵素を2分割する一方で、タンパク質組み継ぎ反応を起こすタンパク質(DnaE)も2分割する。そして、2分割したそれぞれの一方の断片をARに連結して通常は細胞質に局在させておき、その残りの断片を核内に局在させておく。ARは、ステロイドホルモン依存的に核内に移行し、ARに連結された断片は、核内に局在している残りの断片と相互作用する。これにより回復した生物発光強度を測定することによって、タンパク質間相互作用を検出する。
【0009】
さらに他の細胞内分子現象を測定する方法として、特許文献4には、ホタルルシフェラーゼに1つのタンパク質を挿入したプローブを用いて、外部刺激により低下する発光量を測定する方法が記載されている。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】国際公開第2008/084869号パンフレット
【特許文献2】特開2009−34059号公報(2009年2月19日公開)
【特許文献3】米国特許出願公開第2009/0176239号公報(2009年7月9日公開)
【特許文献4】国際公開第2005/038029号パンフレット(2005年4月28日)
【非特許文献】
【0011】
【非特許文献1】Kim, S. B.; Ozawa, T.; Watanabe, S.; Umezawa, Y. Proc. Natl. Acad. Sci. U. S. A. 2004, 101, 11542-11547.
【非特許文献2】Kaihara, A.; Umezawa, Y. Chemistry, An Asian Journal 2008, 3, 38-45.
【非特許文献3】Kim, S. B.; Takao, R.; Ozawa, T.; Umezawa, Y. Analytical Chemistry 2005, 77, 6928-6934.
【非特許文献4】Awais, M.; Sato, M.; Lee, X. F.; Umezawa, Y. Angew. Chem. Int. Ed. 2006, 45, 2707-2712.
【非特許文献5】Hoshino, H.; Nakajima, Y.; Ohmiya, Y. Nat. Methods 2007, 4, 637-639.
【非特許文献6】Kim, S. B.; Otani, Y.; Umezawa, Y.; Tao, H. Anal. Chem. 2007, 79, 4820-4826.
【非特許文献7】Kim, S. B.; Awais, M.; Sato, M.; Umezawa, Y.; Tao, H. Anal. Chem. 2007, 79, 1874-1880.
【非特許文献8】Kim, S. B.; Sato, M.; Tao, H. Anal. Chem. 2009, 81, 67-74.
【非特許文献9】Kim, S. B.; Sato, M.; Tao, H. Bioconjugate Chemistry 2008, 19, 2480-2486.
【非特許文献10】Hodges, Y. K.; Tung, L.; Yan, X. D.; Graham, J. D.; Horwitz, K. B.; Horwitz, L. D. Circulation 2000, 101, 1792-1798.
【非特許文献11】Loening, A. M.; Wu, A. M.; Gambhir, S.S. Nat. Methods 2007, 4, 641-643.
【発明の概要】
【発明が解決しようとする課題】
【0012】
上述した、発光酵素を含有する発光プローブを用いた検出方法は、従来のタンパク質間相互作用検出用のFRETにおける、自己蛍光によるバックグラウンド蛍光が高いこと、外部光源が必要となること、蛍光測定のために大型の蛍光顕微鏡を必要とすること、分析できる細胞数が限られており、得られる結果が定量的というよりもむしろ定性的となること等の問題を解決し得るものである。
【0013】
そのため、このような発光プローブによる検出精度のさらなる向上が要求されており、特に、十分な検出精度を得るために、より安定性が高い発光プローブが求められている。また、発光プローブの開発費用等を抑え、広く使用するために、設計が容易であることが求められている。
【0014】
そこで、本発明の目的は、発光強度が高く、設計が容易な新規のプローブを提供することにある。
【課題を解決するための手段】
【0015】
本発明者らは、上記課題を解決するために鋭意検討を行い、以下の点に深く考慮することにより本発明を完成させた。
【0016】
まず、発光酵素が本来持つ酵素活性を侵害しないことに考慮し、発光酵素の全長をそのまま利用することを見出した。そして、発光酵素の構造上の変形による酵素活性度の変化を指標とすることによって、高い発光強度のままでの測定が可能であり、発光プローブの構造をより単純化して設計上の試行錯誤を容易に回避できることを見出した。
【0017】
本発明に係る融合タンパク質は、上記課題を解決するために、標的物質を検出する融合タンパク質であって、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものであることを特徴としている。また、本発明に係る融合タンパク質において、前記酵素は略球形状であることが好ましい。
【0018】
また、本発明に係る融合タンパク質において、前記酵素は発光酵素であり、前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、発光量を増加させるものであることが好ましい。また、本発明に係る融合タンパク質において、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することが好ましい。また、本発明に係る融合タンパク質において、前記発光酵素は、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、クリックビートルルシフェラーゼ、及びホタルルシフェラーゼからなる群より選択されることが好ましい。
【0019】
さらに、本発明に係る融合タンパク質において、前記一次結合タンパク質は、核内受容体、サイトカイン受容体、タンパク質キナーゼ、セカンドメッセンジャー認識タンパク質、及び転写因子からなる群より選択されることが好ましい。また、本発明に係る融合タンパク質において、前記一次結合タンパク質がエストロゲン受容体のリガンド結合ドメインであり、前記二次結合タンパク質がSrcタンパク質のSH2ドメインであり、前記発光酵素がウミシイタケルシフェラーゼであることが好ましい。
【0020】
また、本発明に係る融合タンパク質は、前記一次結合タンパク質と前記酵素とを連結する第1リンカーと、前記二次結合タンパク質と前記酵素とを連結する第2リンカーとをさらに備え、前記第1リンカー及び前記第2リンカーはそれぞれ、5アミノ酸以下のアミノ酸配列からなることが好ましい。さらに、本発明に係る融合タンパク質において、前記第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、前記第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることが好ましい。
【0021】
さらに、本発明に係る融合タンパク質は、配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列からなる、融合タンパク質;あるいは配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列の1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質であることを特徴としている。
【0022】
本発明に係るポリヌクレオチドは、上記いずれかの融合タンパク質をコードする、ポリヌクレオチドであることを特徴としている。また、本発明に係るポリヌクレオチドは、配列番号4〜6及び15〜16のいずれかに示される塩基配列からなる、ポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;あるいは配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチドであることを特徴としている。
【0023】
本発明に係るベクターは、上記いずれかのポリヌクレオチドを含んでいることを特徴としている。本発明に係る形質転換体は、上記いずれかのポリヌクレオチド、又は上記ベクターを含んでいることを特徴としている。
【0024】
本発明に係る標的物質を検出する方法は、被験試料中の標的物質を検出する方法であって、前記被験試料と、上記いずれかの融合タンパク質とを接触させる工程を包含することを特徴としている。本発明に係る標的物質を検出するためのキットは、上記いずれかの融合タンパク質を備えていることを特徴としている。
【0025】
本発明に係るプローブの生産方法は、上記いずれかのポリヌクレオチド又は上記ベクターを用いて細胞を形質転換する工程を包含することを特徴としている。本発明に係るプローブの生産キットは、上記いずれかのポリヌクレオチド又はベクターを備えていることを特徴としている。
【発明の効果】
【0026】
本発明に係る融合タンパク質によれば、活性型の酵素又はその前駆体を用いることによって、設計が容易であり、かつ発光強度が高く、種々のタンパク質間相互作用の可視化検出をより高精度に行うことができる。
【図面の簡単な説明】
【0027】
【図1】本発明に係る発光プローブの一例を用いたリガンド認識メカニズムを模式的に示す図である。
【図2】ウミシイタケルシフェラーゼ(RLuc8)の結晶構造を示す図である。
【図3】ホタルルシフェラーゼ(FLuc)の結晶構造を示す図である。
【図4】RLuc8の酵素活性部位における各アミノ酸と基質との間の相互作用を示す図であり、酵素末端から近いアミノ酸を破線によって囲んで示す。
【図5】本発明に係る発光プローブを用いたリガンド認識メカニズムを示す模式図である。
【図6】本発明に係る発光プローブを作製するためのDNAコンストラクト構成の一例を示す図である。
【図7】RLuc8を挿入した発光プローブ(ERS)を発現した形質転換体における発光スペクトルを示すグラフである。
【図8】ERS、EGS(GLucを挿入した発光プローブ)、ECS(CBLucを挿入した発光プローブ)、EFS(FLucを挿入した発光プローブ)をそれぞれ発現した形質転換体における発光強度の割合を示すグラフである。
【図9】発光酵素の種々の基質の化学構造を示す図であり、重要なサイドチェーンにあたる部位を破線によって囲んで示す。
【図10】種々の基質共存下における発光スペクトルを示すグラフである。
【図11】種々の基質共存下における発光スペクトルのピーク強度の割合を示すグラフである。
【図12】RLuc8を発現する形質転換体、及びERSを発現する形質転換体における発光スペクトルを示すグラフである。
【図13】ERSを発現する形質転換体におけるリガンド応答曲線を示す図である。
【図14】ERS、EmRS(ER LBDのリン酸化部位が変異した発光プローブ)、ER+RS(RLuc8とER LBDとが連結されたプローブ(ER)及びRLuc8とSH2ドメインとが連結されたプローブ(RS))を発現する形質転換体における相対発光強度を示すグラフである。
【図15】ER又はRSを発現させるためのDNAコンストラクト構成を示す図である。
【図16】ER及びRSの構造を模式的に示す図である。
【図17】種々のリガンドの化学構造を示す図である。
【図18】ERSを発現する形質転換体における、種々のリガンドに応答した発光強度を示すグラフである。
【図19】本発明に係る発光プローブ(EERS)を作製するための構成の一例を示す図である。
【図20】EYFP及びRLuc8を挿入した発光プローブ(pEERS)を発現した形質転換体における発光スペクトルを示すグラフである。
【図21】本発明に係る発光プローブであり、その内部での発光共鳴エネルギー移動を起こす発光プローブ(EERS)のリガンド認識メカニズムを模式的に示す図である。
【発明を実施するための形態】
【0028】
〔1.融合タンパク質及びポリヌクレオチド〕
本発明に係る融合タンパク質は、一分子型生物発光プローブとして用いられ、標的物質を検出する融合タンパク質であって、前記標的物質が結合する結合部位を有する一次結合タンパク質と、前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、前記一次結合タンパク質に標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質である。
【0029】
後述するように、本発明に係る融合タンパク質に含まれる活性型の酵素又はその前駆体の代表的な例として、活性型の発光酵素又はその前駆体が挙げられる。したがって、以下では、例として、本発明に係る融合タンパク質における酵素を発光酵素として説明し、本発明に係る融合タンパク質を発光プローブと称することもあるが、本発明はこれに限定されず、他の酵素であっても同様に説明され得る。
【0030】
本明細書において、「発光プローブ」は、「生物発光プローブ」又は「プローブ」と交換可能に使用され、標的に特異的な標的物質によって引き起こされる様々な分子現象を、生きた細胞又は生体において、生物発光として可視化イメージングすることが可能なプローブである。また、「一分子型発光プローブ」とは、上述した可視化イメージングするために用いられる全構成要素を単一融合分子内に含むプローブである。例えば、上述した(i)一次結合タンパク質、(ii)活性型酵素又はその前駆体、(iii)二次結合タンパク質を、基本構成要素として含む融合タンパク質が含まれ得る。
【0031】
本発明の融合タンパク質は、一次結合タンパク質と二次結合タンパク質との間に活性型酵素又はその前駆体が挿入されていればどのような順番でもよいが、一次結合タンパク質、活性型酵素又はその前駆体、二次結合タンパク質の順に直鎖状に連結された形態であることが好ましく、アミノ末端から一次結合タンパク質、活性型酵素又はその前駆体、二次結合タンパク質の順に直鎖状に連結された形態であることがより好ましい。
【0032】
また、本発明の融合タンパク質は、前記酵素が発光酵素であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、発光量を増加させるものであることが好ましい。さらに、本発明の融合タンパク質は、一次結合タンパク質と二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することが好ましい。この構成であれば、発光共鳴エネルギー移動を起こすことができる。
【0033】
ここで、「一次結合タンパク質」は、その標的物質の結合部位に標的物質が結合するタンパク質が意図され、「標的物質結合タンパク質」と称することもある。後述するように、本発明によって検出する標的物質をリガンドと称する場合には、標的物質結合タンパク質を、「リガンド結合タンパク質」と称することもある。
【0034】
一次結合タンパク質は、例えば、標的物質が結合することによって立体構造が変化し、後述する二次結合タンパク質の分子認識部位と結合することができるタンパク質であり得る。このような一次結合タンパク質としては、例えば、ホルモン、化学物質又は信号伝達タンパク質をリガンドとする核内受容体(NR)、サイトカイン受容体、あるいは各種タンパク質キナーゼが用いられる。一次結合タンパク質は、対象とする標的物質によって適宜選択される。
【0035】
本明細書中における「標的物質」は、本発明に係る発光プローブの検出の対象となる物質であり、生細胞膜上又は生細胞内の特定タンパク質と特異的に結合してその機能を変化させうる物質を意味しており、「リガンド」と称することもある。例えば、核リセプターに対してはステロイド又は合成化学物質をさし、サイトカイン受容体に対しては各種サイトカインをさし、インシュリン受容体のような細胞膜上受容体に対してはインシュリンを含む刺激物質をさす。
【0036】
本発明によって検出するリガンドとしては、リガンド結合タンパク質に結合するものであれば特に限定されず、細胞外から細胞内に取り込まれる細胞外リガンドであってもよく、細胞外からの刺激により細胞内で産生される細胞内リガンドであってもよい。例えば、受容体タンパク質(例えば核内受容体、Gタンパク質結合型受容体等)に対するアゴニスト又はアンタゴニストであり得る。また、細胞内の情報伝達に関与する分子に特異的に結合するサイトカイン、ケモカイン、インシュリン等の信号伝達タンパク質、細胞内セカンドメッセンジャー、脂質セカンドメッセンジャー、リン酸化アミノ酸残基、Gタンパク質結合型受容体リガンド等であり得る。
【0037】
例えば、リガンドとして細胞内セカンドメッセンジャー、脂質セカンドメッセンジャー等を対象とする場合には、リガンド結合タンパク質として、各セカンドメッセンジャーの結合タンパク質(セカンドメッセンジャー認識タンパク質)を使用することができる。セカンドメッセンジャーとは、ホルモン、神経伝達物質等の細胞外情報伝達物質が細胞膜に存在する受容体と結合することによって、細胞内で新たに生成される別種の細胞内情報伝達物質を意図している。このセカンドメッセンジャーとして、例えば、cGMP、cAMP、PIP、PIP2、PIP3、イノシトール3リン酸(IP3:inositol triphosphate)、IP4、Ca2+、ジアシルグリセロール(diacylglycerol)、アラキドン酸(arachidonic acid)等が挙げられる。例えば、セカンドメッセンジャーのCa2+に対しては、リガンド結合タンパク質としてカルモジュリン(CaM)を用いることができる。
【0038】
また、例えば、リガンドとして核内受容体に特異的なリガンドを対象とする場合には、リガンド結合タンパク質として、核内受容体の公知の結合ドメイン(LBD:ligand binding domain)を使用することができる。さらに、リン酸化アミノ酸残基又はGタンパク質結合型受容体リガンドを対象とする場合には、リガンド結合タンパク質として、それぞれリン酸化アミノ酸結合ドメイン又はGタンパク質結合型受容体を使用することができる。核内受容体リガンド結合ドメインとしては、エストロゲンをリガンドとするエストロゲン受容体(ER)、グルココルチコイド受容体(GR)、アンドロゲン受容体(AR)又はプロゲステロン受容体(PR)のリガンド結合ドメインが好適に用いられる。
【0039】
例えば、エストロゲン受容体のLBDは、全長ヒトエストロゲン受容体の配列情報(GenBank/P03372)に基づき、そのLBD領域(アミノ酸番号305〜550)を、遺伝子工学的に又はPCR合成によって調製したものを使用することができる。また、例えばアンドロゲン受容体のLBDは、全長ヒトアンドロゲン受容体の配列情報(GenBank/AF162704)に基づき、そのLBD領域(アミノ酸番号672〜910)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。また、例えばグルココルチコイド受容体のLBDは、全長ヒトグルココルチコイド受容体の配列情報(GenBank/1201277A)に基づき、そのLBD領域(アミノ酸番号527〜777)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。また、同様にプロゲステロン受容体のLBDについても、全長ヒトプロゲステロン受容体の配列情報(GenBank/P06401)に基づき、そのLBD領域(アミノ酸番号677−933)を、遺伝子工学的又はPCR合成によって調製したものを使用することができる。
【0040】
本明細書において「二次結合タンパク質」は、上述したリガンド結合タンパク質にリガンドが結合したことを認識する分子認識部位を有するタンパク質が意図され、「認識タンパク質」と称することもある。認識タンパク質には、例えば、リガンドの結合により立体構造が変化したリガンド結合タンパク質に結合するタンパク質等が包含される。
【0041】
例えばリガンド結合タンパク質としてカルモジュリンを用いた場合、認識タンパク質として、ミオシン軽鎖キナーゼ(miosin light chain kinase)由来のペプチドであるM13ペプチドが好適に用いられる。また、M13以外にもカルモジュリンに対して結合できるタンパク質として、アデニリルシクラーゼ、カルモジュリンキナーゼIIのようなCaM依存性タンパク質キナーゼ類を挙げることができる。このようなタンパク質の一部分をM13の代わりに用いることができる。
【0042】
また、例えばリガンド結合タンパク質として、アンドロゲン受容体、エストロゲン受容体等の核内受容体を用いた場合、認識タンパク質として共転写因子(coactivator)由来のLXXLLモチーフ(配列番号12)、ARのN末側(AR NTD)由来のFQNLFモチーフ、FXXLFモチーフ、WXXLFモチーフ等が用いられ得る。好ましくは、共転写因子の一種であるRip140(GenBank/NP003480)、又はSrc−1a(steroid receptor coactivator 1 isoform 1;GenBank/NP003734)のLXXLLモチーフ(約15アミノ酸)が用いられる。
【0043】
さらに、リン酸化アミノ酸残基を認識できるドメインである、各種キナーゼタンパク質のSH2ドメインを、認識タンパク質として用いてもよい。例えば、発癌制御タンパク質であるSrcタンパク質(proto-oncogene tyrosine-protein kinase Src;GenBank/NP938033)のリン酸化認識ドメイン(SH2ドメイン;アミノ酸番号150〜248)、細胞増殖、発癌等に関連する増殖因子レセプター結合タンパク質Grb2(growth factor receptor-binding protein2)のSH2ドメイン等を用いることができる。また、リガンド結合タンパク質としてGタンパク質結合型受容体を用いた場合、認識タンパク質としてGタンパク質等を好適に用いることができる。
【0044】
本発明におけるリガンド結合タンパク質及び認識タンパク質の組み合わせとしては、条件依存的に結合する2つのタンパク質であってもよい。例えばFRBとBRAD、ER LBDとLXXLLモチーフ、AR LBDとFQNLFモチーフ、CaMとM13、核内受容体とそのコアクチベーター、リン酸化タンパク質とそのリン酸化認識タンパク質、核受容体間のホモ又はヘテロ結合(二量化)を行う2つのタンパク質等のペアを用いることができる。
【0045】
本明細書中において「活性型の酵素又はその前駆体」は、その酵素活性部位に基質を結合し得る、活性化状態の酵素又はその前駆体であることが意図され、酵素の全長配列を含むものであることが意図される。なお、「酵素の全長配列」とは、少なくとも酵素活性部位を含む領域を、欠失、分割等せずにそのまま全て含むものであり、本来の酵素活性を保持しているものであればよい。例えば、欠失させても酵素活性には影響を及ぼさないN末側又はC末側の一部分等が欠失しているものについても、「酵素の全長配列」に含まれる。
【0046】
ここで、酵素の前駆体とは、不活性なものであるが、何らかの修飾を受けることによって、活性化し、活性型の酵素となるものを意図しており、活性型の酵素と同一の配列からなるものである。例えば、リン酸化により不活性状態から活性化する酵素を使用する場合、前駆体の状態で発光プローブに挿入し、リガンドの検出時にリン酸化することによって活性化して、活性型の酵素として使用することができる。以下で、本発明において使用する「酵素の全長」又は単に「酵素」について記載する場合、活性型の酵素又はその前駆体を意図している。
【0047】
本発明において使用する酵素は、そのN末側とC末側とにそれぞれつながれているリガンド結合タンパク質と認識タンパク質とが互いに相互作用することによって、外部からの分子テンションが加わり、その構造的な変形が生じることによって、発光プローブからの酵素活性度が変化する酵素であり得る。このような酵素の代表的なものとして、発光酵素(LE:lighting enzyme)が挙げられる。
【0048】
また、本発明において使用する酵素は、リガンド結合タンパク質と認識タンパク質との間に、蛍光タンパク質と連結されて挿入されていてもよい。この場合の酵素とは、発光酵素であることが好ましい。また、蛍光タンパク質は、発光共鳴エネルギー移動(BRET)の受け皿となり得るものであることが好ましい。すなわち、蛍光タンパク質は、発光酵素の活性によって発生した発光エネルギーを吸収できるものであることが好ましい。これにより、発光共鳴を誘導する(発光共鳴エネルギー移動を起こす)ことが可能になる。
【0049】
本発明において使用する発光酵素と蛍光タンパク質との組み合わせは、リガンド結合タンパク質と認識タンパク質との間に挿入されることによって、発光酵素と蛍光タンパク質との発光共鳴エネルギー移動の一部に影響を受けるものであることが望ましい。また、発光酵素と蛍光タンパク質との組み合わせは、リガンド結合タンパク質と認識タンパク質とが互いに相互作用することによって、外部からの分子テンションが加わり、それらの内部構造的な変形が生じることにより発光酵素と蛍光タンパク質との発光共鳴エネルギー移動が影響を受けるものであって、これによって、発光プローブからの酵素活性度が変化する発光酵素と蛍光タンパク質との組み合わせであり得る。
【0050】
なお、蛍光タンパク質は、酵素のN末側に連結されていてもよいし、酵素のC末側に連結されていてもよい。
【0051】
本明細書中において「分子テンション」とは、上述した酵素(酵素分子)、又は酵素と蛍光タンパク質との組み合わせにN末端とC末端とから加わる力(緊張)であり、好ましくは酵素分子、又は酵素と蛍光タンパク質との組み合わせに構造的な変形を生じさせるような力である。
【0052】
本明細書中において「構造的な変形」とは、上述したような酵素分子、又は酵素と蛍光タンパク質との組み合わせに外部から加わる分子テンションによって、酵素分子、又は酵素と蛍光タンパク質との組み合わせの分子が捩れる等の構造上の変化であることを意図しており、構造が大きく変形するようなものでなくてもよく、その変形により発光プローブからの酵素活性度が増加するような変形であればよい。
【0053】
本発明に係る発光プローブの各構成要素であるリガンド結合タンパク質、酵素の全長あるいは酵素の全長及び蛍光タンパク質、ならびに認識タンパク質は、直鎖状の融合分子となるように、それぞれ直接に、又は最適なリンカーペプチドを介して連結される。リンカーペプチドを介して連結する場合、リンカーペプチド配列の種類及び長さを変えることで、各構成要素間の距離を適宜調整することが可能である。
【0054】
このようなリンカーペプチドとしては、本発明に係る発光プローブを一本鎖の融合タンパク質として発現するための連結ペプチドであることが好ましい。リンカーペプチドとしては、サイドチェーンのない、柔軟なアミノ酸(例えば、グリシン(G:Glysine)など)を介してもよい。リンカーペプチドの長さは短いことが好ましく、例えば5アミノ酸以下の短いアミノ酸配列であることが好ましい。このように、各要素間のリンカーペプチドの長さを最短に抑えることによって、リガンド応答性の良いプローブを設計できる。また、リガンド結合タンパク質と、酵素又は当該酵素と組み合わされて挿入される蛍光タンパク質と、を連結する第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、認識タンパク質と、酵素又は当該酵素と組み合わされて挿入される蛍光タンパク質と、を連結する第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることが好ましく、これにより、リガンド結合タンパク質と認識タンパク質との相互作用による生じる分子テンションを効率よく酵素に伝達し、確実に酵素に構造的な変形を生じさせることができる。
【0055】
ここで、本発明に係る発光プローブの一例を用いたリガンド認識メカニズムを模式的に図1に示す。本発明に係る発光プローブの一例は、図1に示すように、例えばリガンド結合タンパク質(A)と認識タンパク質(B)との間に、発光酵素であるルシフェラーゼ(Luciferase)の全長が挿入されている。なお、全長とは、酵素活性に関与しない一部が欠損されているものであってもよい。そして、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素に一定の構造的な変形(ストレイン)を引き起こし、この変形によって発光プローブからの酵素活性度が増加する。
【0056】
また、本発明に係る発光プローブの他の例を用いたリガンド認識メカニズムを模式的に図21に示す。本発明に係る発光プローブの他の例は、図21に示すように、例えばリガンド結合タンパク質(A)と認識タンパク質(B)との間に、発光酵素であるルシフェラーゼ(RLuc8)の全長と、強化黄色蛍光タンパク質(EYFP:Enhanced Yellow Fluorescence Protein)とが挿入されている。EYFPは、RLuc8のN末側に連結されている。リガンドがない条件では、リガンド結合タンパク質と認識タンパク質とが相互作用せず、EYFPとRLuc8との間の生物発光共鳴エネルギー移動(bioluminescence resonance energy transfer;BRET)は弱く、発光強度は弱い。一方、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素及び蛍光タンパク質に一定の構造的な変形(ストレイン)を引き起こし、発光酵素と蛍光タンパク質との間の生物発光共鳴エネルギー移動が影響を受けることによって、発光プローブからの酵素活性度が増加する。
【0057】
酵素活性度の増加は、リガンドの濃度、性質等に依存するため、この酵素活性度の増加、すなわち発光強度の増加を指標として、リガンドの性質、量等を測定することができる。以上のような原理でリガンドを検出するため、本発明に係る発光プローブを「ストレインプローブ(Strain probe)」と称することもある。
【0058】
このように、発光プローブに挿入される発光酵素は、全長の発光酵素の両側に連結されたタンパク質同士の相互作用によって分子テンションが加わり、分子の構造的な変形(分子変形)が生じ、発光プローブからの酵素活性度を増加させるものであればよく、その種類、発光特性、分子量等は、特に限定されない。例えば、ウミシイタケルシフェラーゼ(RLuc8:Renilla luciferase 8)、ガウシアルシフェラーゼ(GLuc:Gaussia luciferase)、ビートル(昆虫)ルシフェラーゼの一種であるクリックビートルルシフェラーゼ(CBLuc:click beetle luciferase)、ホタルルシフェラーゼ(FLuc:firefly luciferase)、RLuc、MpLuc1(Metridia pacifica luciferase 1)、MpLuc2(Metridia pacifica luciferase 2)、MLuc(Metridia longa luciferase)、OLuc(Oplophorus)、RWLuc(Rail-road worm luciferase)等を含む海洋生物、昆虫、バクテリア由来のルシフェラーゼを、特に制限なく使用できる。これらの発光酵素のなかでも、RLuc8、GLuc、CBLuc、FLuc等を好適に用いることができる。
【0059】
これらの発光酵素は、アミノ酸配列や遺伝子(DNA)の塩基配列が公知であり(例えば、FLucはGenBank/AB062786等、CBLucはGenBank/AY258592.1等、GLucはGenBank/AY015993等)、これらの配列情報に基づいて公知の方法によりDNAを取得することができる。
【0060】
ここで、RLuc8とFLucとの構造を比較する。図2は、RLuc8の結晶構造を示す図であり、図3は、ホタルルシフェラーゼ(FLuc)の結晶構造を示す図である。なお、図2において、NはN末端を示し、CはC末端を示す。また、酵素活性部位を矢印部位(a)で示す。図2に示すように、RLuc8は、略球形状の1つのユニットからなり、堅い分子構造を有している。一方、図3に示すように、FLucは、2つのドメインによって構成されており、N末側ドメインとC末側ドメインとは柔軟性の高い親水性アミノ酸によって繋がっている。これらの構造の違いから、酵素を単独でリガンド結合タンパク質と認識タンパク質との間に挿入する場合には、FLucのような2ドメイン構造よりも、RLuc8のような構造を有する酵素の方が、分子末端からの分子テンションが酵素本体に効率よく伝わり、構造的な変形が起こりやすいため好ましい。
【0061】
次に、RLuc8の酵素活性部位について考察する。図4は、RLuc8の酵素活性部位における各アミノ酸と基質との間の相互作用(結合)を示す図である(非特許文献11)。なお、図4において、破線によって囲まれたアミノ酸は、酵素末端から近いアミノ酸である。RLuc8の酵素活性部位を構成するアミノ酸のうち、H285、F286、及びF261等は、C末端(Q311)から近いため、特にC末端にかかる外部からの分子テンションにより直接影響を受けやすい。したがって、RLuc8は、外部からの分子テンションが酵素活性部位に効率よく伝わるため、変形により酵素活性が変化しやすい構造となっている。
【0062】
このように、本発明に係る発光プローブに用いる酵素としては、酵素を単独でリガンド結合タンパク質と認識タンパク質との間に挿入する場合には、RLuc8のような、略球形状の1つのドメインからなり、酵素活性部位が末端に近いなど、変形しやすく、かつ変形により酵素活性が変化しやすいものが好ましい。
【0063】
なお、本明細書中において「酵素が略球形状である」とは、酵素分子の立体構造が全体として略球形状をしていることを意味する。したがって、例えば酵素分子が2つのドメインによって構成されていても、酵素分子が全体として略球形状であれば、その酵素は略球形状である。なお、「略球形状」とは、完全な球形状との差異が比較的小さい形状であって、酵素分子の中心から酵素分子の表面上の任意の点までの距離が略一定である形状であればよい。
【0064】
また、発光プローブに発光酵素と蛍光タンパク質とを組み合わせて挿入する場合には、発光酵素としては、上述したものを特に制限なく使用できる。発光酵素と組み合わされる蛍光タンパク質としては、当該発光酵素の活性によって発生した発光エネルギーを効率よく吸収できるものが望ましい。例えば、蛍光タンパク質は、その吸収スペクトルの全部又は一部が、発光酵素の発光スペクトルの全部又は一部と重なるものであることが望ましい。蛍光タンパク質としては、上述したEYFPの他に、Venus、mOrange,Kaede,Dronpa等が挙げられる。
【0065】
本発明に係る発光プローブとしては、リガンド結合タンパク質として、エストロゲン(女性ホルモン)受容体(ER:estrogen receptor)のリガンド結合ドメイン(LBD:ligand-binding domain)を用い、認識タンパク質としてキナーゼSrcのリン酸化認識ドメイン(Src SH2)を用い、発光酵素の全長としてRLuc8を用いた発光プローブ(ERS)であることが好ましい。ER LBDは、17β−エストラジオール(estradiol)(E2)等のエストロゲン(estrogen)、エストロゲンアンタゴニスト(OHT; 4-hydroxytamoxifen)等のリガンドに応答するものである。この発光プローブは、ER LBDをリン酸化するリガンドを検出するために用いることができる。
【0066】
このように、最適な発光酵素を選択することによって、発光プローブの構造的変化による分子テンションが効率よく発光酵素に伝達され、さらに発光プローブの構造を単純化することができる。そして、発光プローブをこのように構成することによって、従来の酵素分割型に比べて発光プローブから格段に高い発光強度を維持しつつ、リガンド結合タンパク質と認識タンパク質との相互作用による発光量を顕著に増加させることができる。例えば、後述する実施例において示すように、発光プローブの発光酵素としてRLuc8を用いた場合には、リガンド結合タンパク質と認識タンパク質との相互作用によって、これらが相互作用していないときに対して発光量を650%まで増加させることができる(図10のfcpを参照)。このように、本発明に係る発光プローブは、分子テンションによる酵素の変形、それに伴う酵素活性度の増加が生じるものであることが好ましい。
【0067】
このように構成された発光プローブを用いたリガンド認識メカニズムを示す模式図を図5に示す。図5に示すように、ER LBDは、OHT等のリガンドによる刺激に応じて構造変化(活性化)する。この構造変化の結果、ER LBDにおけるY537がリン酸化されると、SrcのSH2ドメインがこのリン酸化部位を認識し、分子内相互作用によりER LBDとSH2ドメインとが結合する。ER LBD−SH2ドメイン間の結合は、RLuc8の構造的な変形を引き起こし、発光プローブの酵素活性度を増加させる。この酵素活性度の増加は、リガンドの濃度等に依存する。そのため、発光プローブからの発光強度の変化を指標に、リガンドの量を測定することができる。
【0068】
また、例えばアンドロゲン受容体に対するリガンドを検出するためには、リガンド結合タンパク質としてAR LBDを用い、認識タンパク質としてLXXLLモチーフを用いることができる。
【0069】
本発明に係る発光プローブにおいては、リガンド結合タンパク質にリガンドが結合したことを、同じ分子内の認識タンパク質が認識した場合に、酵素に構造的な変形が生じることによって、発光プローブの酵素活性度、すなわち発光量が、リガンド結合タンパク質にリガンドが結合する前の状態における発光プローブからの発光量よりも増える。すなわち、リガンドが結合する前と後とで、発光プローブからの発光量が異なるものであればよく、その発光量の変化の要因としては、変形による酵素の量子収率(Quantum yield)の向上、酵素の変形による発光プローブの代謝回転率(Turn-over rate)の向上(安定性の向上)等が挙げられる。しかしながら、本発明に係る発光プローブによるリガンドの検出においては、発光プローブからの発光量の変化の要因に関わらず、発光プローブからの発光量の増加を指標とすればよいことは言うまでもない。
【0070】
本発明に係る発光プローブは、各構成要素のポリペプチドを化学合成法等で得た後に、それぞれを連結して得てもよいが、各構成要素のポリペプチドをコードするポリヌクレオチドを直鎖状に連結したポリヌクレオチド、すなわちキメラDNAが挿入されたベクターを用いて細胞を形質転換し、形質転換した細胞内に発現させることによっても得られる。
【0071】
ここで、キメラDNAとは、由来の異なるいくつかのDNA断片が人工的に直鎖状に連結されたものであり、いくつかのポリペプチドを構成要素とする融合タンパク質を発現することのできるDNAである。
【0072】
本明細書中において、「生細胞」とは、生物における細胞(原核細胞、酵母細胞、昆虫細胞、ヒトを含めた哺乳動物細胞等)のみならず、その本来の機能を維持した状態の培養細胞(原核細胞及び真核細胞)、生物個体内に移植、感染した細胞などを含み、特に実験動物、例えばマウス等の細胞である。また、生物の個体そのものをも含む概念である。
【0073】
本明細書中において、融合タンパク質とは、由来の異なるいくつかのタンパク質又はポリペプチドが人工的に連結されたものであり得る。
【0074】
本明細書中において、「ポリペプチド」は、「ペプチド」又は「タンパク質」と交換可能に使用される。本発明に係るポリペプチドはまた、化学合成されても、天然供給源より単離されてもよい。用語「単離された」ポリペプチドまたはタンパク質は、その天然の環境から取り出されたポリペプチド又はタンパク質が意図される。例えば、宿主細胞中で発現され産生された組換えポリペプチド及びタンパク質は、任意の適切な技術によって実質的に精製されている天然の、又は組換えのポリペプチド及びタンパク質と同様に、単離されていると考えられる。
【0075】
本発明に係る発光プローブにおいて、各構成要素のポリペプチドは、天然の精製産物、化学合成手順の産物、及び原核生物宿主または真核生物宿主(例えば、細菌細胞、酵母細胞、高等植物細胞、昆虫細胞、及び哺乳動物細胞を含む)から組換え技術によって産生された産物を含む。
【0076】
また、本発明に係る発光プローブ及び各構成要素のポリペプチドは、付加的なペプチドを含むものであってもよい。付加的なペプチドとしては、例えば、Hisタグ(配列番号7)、Mycタグ(配列番号9)、Flagタグ(配列番号8)等のエピトープ標識ペプチドが挙げられる。本発明に係る融合タンパク質は、好ましい形態に改変され、組換え発現され得る。例えば、本発明に係る融合タンパク質は、N末端又はC末端に特定のアミノ酸、特に荷電性アミノ酸の領域等を付加することによって、宿主細胞内、精製、精製に引き続く操作、及び保存等における安定性、持続性等を改善することができる。
【0077】
一実施形態において、本発明に係る発光プローブは、配列番号1〜3及び13〜14のいずれかに示されるアミノ酸配列からなる融合タンパク質又はその変異体であることが好ましい。ここで、当該変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号1〜3及び13〜14のいずれかに示されるアミノ酸配列において、1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなる融合タンパク質であることが好ましい。
【0078】
本明細書中においてポリペプチドまたはタンパク質に関して用いられる場合、用語「変異体」は、本来のアミノ酸の少なくとも1つ以上がポイント変異、挿入、逆転、反復、欠損、タイプ置換されたポリペプチド又はタンパク質であって、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させるポリペプチドまたはタンパク質が意図される。
【0079】
このような変異体としては、欠失、挿入、逆転、反復、タイプ置換(例えば、親水性残基の別の残基への置換、しかし通常は強い親水性の残基を強い疎水性の残基には置換しない)、及びポイント変異などを含む変異体が挙げられる。アミノ酸の置換には、例えば、ポリペプチドにおける中性アミノ酸を別の中性アミノ酸に置換する場合等が含まれる。
【0080】
ポリペプチドのアミノ酸配列中のいくつかのアミノ酸が、このポリペプチドの構造又は機能に有意に影響することなく容易に改変され得ることは、当該分野において周知である。さらに、人為的に改変させるだけではなく、天然のタンパク質において、当該タンパク質の構造又は機能を有意に変化させない変異体が存在することもまた周知である。
【0081】
当業者は、周知技術を使用してポリペプチドのアミノ酸配列において1又は数個のアミノ酸を容易に変異させることができる。例えば、公知の点変異導入法に従えば、ポリペプチドをコードするポリヌクレオチドの任意の塩基を変異させることができる。また、ポリペプチドをコードするポリヌクレオチドの任意の部位に対応するプライマーを設計して欠失変異体又は付加変異体を作製することができる。さらに、本明細書中に記載される方法を用いれば、作製した変異体が所望の活性を有するか否かを容易に決定し得る。
【0082】
変異体としては、好ましくは保存性もしくは非保存性アミノ酸置換、欠失、又は添加等の変異を有する変異体である。変異体が有する変異としては、好ましくは、サイレント置換、添加、及び欠失であり、特に好ましくは、保存性置換である。これらは、本発明に係る発光プローブの発光活性を変化させない。
【0083】
代表的に保存性置換と見られるのは、脂肪族アミノ酸Ala、Val、Leu、及びIleの中での1アミノ酸の別のアミノ酸への置換;ヒドロキシル残基Ser及びThrの交換、酸性残基Asp及びGluの交換、アミド残基Asn及びGlnの間の置換、塩基性残基Lys及びArgの交換、ならびに芳香族残基Phe及びTyrの間の置換である。
【0084】
他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなるポリヌクレオチドによってコードされることが好ましい。
【0085】
他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズするポリヌクレオチドによってコードされることが好ましい。
【0086】
ハイブリダイゼーションは、Sambrookら、Molecular Cloning,A Laboratory Manual,2d Ed.,Cold Spring Harbor Laboratory(1989)に記載されている方法のような周知の方法で行うことができる。通常、温度が高いほど、塩濃度が低いほどストリンジェンシーは高くなり(ハイブリダイズし難くなる)、より相同なポリヌクレオチドを取得することができる。適切なハイブリダイゼーション温度は、塩基配列やその塩基配列の長さによって異なり、例えば、アミノ酸6個をコードする18塩基からなるDNAフラグメントをプローブとして用いる場合、50℃以下の温度が好ましい。
【0087】
本明細書中で使用される場合、用語「ストリンジェントな(ハイブリダイゼーション)条件」は、ハイブリダイゼーション溶液(50%ホルムアミド、5×SSC(150mMのNaCl、15mMのクエン酸三ナトリウム)、50mMのリン酸ナトリウム(pH7.6)、5×デンハート液、10%硫酸デキストラン、及び20μg/mlの変性剪断サケ精子DNAを含む)中にて42℃で一晩インキュベーションした後、約65℃にて0.1×SSC中でフィルターを洗浄することが意図される。ポリヌクレオチドの「一部」にハイブリダイズするポリヌクレオチドによって、参照のポリヌクレオチドの少なくとも約15ヌクレオチド(nt)、そしてより好ましくは少なくとも約20nt、さらにより好ましくは少なくとも約30nt、そしてさらにより好ましくは約30ntより長いポリヌクレオチドにハイブリダイズするポリヌクレオチド(DNA又はRNAのいずれか)が意図される。
【0088】
また、他の実施形態において、本発明に係る発光プローブの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質であって、配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一、より好ましくは少なくとも80%同一、さらに好ましくは少なくとも85%、90%、92%、95%、96%、97%、98%又は99%同一である塩基配列からなるポリヌクレオチドによってコードされることが好ましい。
【0089】
DNA塩基配列の66%以上が同一であれば、全く同様の活性を持つ融合タンパク質を作製できる根拠としては、サイレント変異を考えられる。遺伝子暗記票によれば、例えば、アミノ酸のバリン(Valine)をコードする遺伝子は、GUU、GUC、GUA、GUGのいずれでもよい。従って、最大33%の遺伝子塩基が違っても全く同一の融合タンパク質プローブを作製できることから、数字の66%が同一塩基配列か否かを判定する上で妥当な意味を持つ。
【0090】
また、機能が解明されている多くのタンパク質は、自然変異体またはアイソフォームを持つ。本実施例にあげたERでさえ、自然界にはERαとERβとが存在しており、女性ホルモンに対して同様のセンシング能をもつことが知られている(非特許文献10)。ところが、そのアミノ酸間の相同性はわずか30%(N-末側領域;NTD)、53%(リガンド結合領域;LBD)に過ぎない点を考慮すべきである。
【0091】
さらに、本実施例において用いたERと同じ核受容体であるグルココルチコイド(GR)では、GRαA、GRβA、GRα2、GRβ2、GRAα、GRAβ、GR−P、GR−βBなどのイソフォームが存在し、それぞれ同じGR類として生体内で機能している(Swiss−Prot P04150)点を考慮しなければならない。
【0092】
例えば、「本発明に係る融合タンパク質をコードするポリヌクレオチドの参照(QUERY)塩基配列に少なくとも66%同一の塩基配列からなるポリヌクレオチド」である対象塩基配列は、当該参照塩基配列の100ヌクレオチチド(塩基)あたり33個までの不一致(mismatch)を含み得るが、参照塩基配列と同じ表現型(アミノ酸配列)のタンパク質をコードする配列である。参照塩基配列に少なくとも66%同一の塩基配列からなるポリヌクレオチドとは、例えば参照配列における塩基の33%までが、欠失されていてもよく、又は別の塩基で置換されていてもよい。また、参照塩基配列における全塩基の33%までにあたる数の塩基が、参照塩基配列に挿入されていてもよい。対象塩基配列における、参照塩基配列とは不一致な塩基は、対象塩基配列の5’もしくは3’末端位置、又はそれ以外の塩基配列中において、個々に、又は1以上の隣接した群において分散されていてよく、また、対象塩基配列中のどこにあってもよい。
【0093】
本発明はまた、本発明に係る発光プローブをコードするポリヌクレオチドを提供する。本発明に係るポリヌクレオチドは、生細胞内外において、本発明に係る発光プローブを発現可能なポリヌクレオチドである。本発明に係るポリヌクレオチドは、例えば、リガンド結合タンパク質、発光酵素の全長、及び認識タンパク質が直鎖状に配列した融合タンパク質となるように、それぞれをコードするcDNAを直鎖状に連結して作製されたキメラDNAである。
【0094】
本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」又は「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語「塩基配列」は、「核酸配列」又は「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A、G、C及びTと省略される)もしくはリボヌクレオチド(C、A、G及びU)の配列として示される。また、「配列番号4に示される塩基配列を含むポリヌクレオチド又はそのフラグメント」とは、配列番号4の各デオキシヌクレオチドA、G、C及び/又はTによって示される配列を含むポリヌクレオチド又はその断片部分が意図される。
【0095】
本発明に係るポリヌクレオチドは、RNA(例えば、mRNA)の形態、又はDNAの形態(例えば、cDNA又はゲノムDNA)で存在し得る。DNAは、二本鎖又は一本鎖であり得る。一本鎖DNA又はRNAは、コード鎖(センス鎖としても知られる)であり得るか、又は、非コード鎖(アンチセンス鎖としても知られる)であり得る。
【0096】
一実施形態において、本発明に係るポリヌクレオチドは、配列番号4〜6及び15〜16のいずれかに示される塩基配列からなるポリヌクレオチド又はその変異体であることが好ましい。
【0097】
一実施形態において、本発明に係るポリヌクレオチドの変異体は、リガンド結合タンパク質にリガンドが結合したことを認識タンパク質が認識した場合に、発光量を増加させる融合タンパク質をコードし、かつ以下のポリヌクレオチドのいずれかであることが好ましい:配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなるポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズするポリヌクレオチド;配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一、より好ましくは少なくとも80%同一、さらに好ましくは少なくとも85%、90%、92%、95%、96%、97%、98%または99%同一である塩基配列からなるポリヌクレオチド。
【0098】
本発明に係るポリヌクレオチドは、非翻訳領域(UTR)の配列又はベクター配列(発現用ベクター配列を含む)などの配列を含むものであってもよい。
【0099】
本発明に係るポリヌクレオチドを取得するための供給源としては、特に限定されないが、生物材料(例えば、ヒトまたはマウスなどの諸器官)であることが好ましい。本明細書中で使用される場合、用語「生物材料」は、生物学的サンプル(生物体から得られた組織サンプル又は細胞サンプル)が意図される。
【0100】
本発明に係るポリヌクレオチドは、例えば、発現用ベクター等にサブクローンして、発光プローブを発現させるためのベクター(プラスミド)を作製し、これを細胞内に導入することによって、当該ポリヌクレオチドがコードする発光プローブを細胞内に発現させることができる。なお、本発明に係るポリヌクレオチドは、融合タンパク質をコードする領域の上流に、細胞内において発光プローブを発現させるためのプロモーター配列等が組み込まれたものであってもよい。
【0101】
本発明に係る融合タンパク質又はポリヌクレオチドは、本明細書中にさらに記載されるように、細胞内外における分子の可視化イメージングのための発光プローブとして使用され得る。より具体的には、本発明に係る融合タンパク質は一本鎖の融合ポリペプチドとして構成され、リガンド結合タンパク質にリガンドが結合すると、その立体構造が変化し、リガンド結合タンパク質が認識タンパク質によって認識される。その結果、リガンド結合タンパク質と認識タンパク質とが相互作用すると、これによってリガンド結合タンパク質と認識タンパク質との間に位置する全長の発光酵素、又は連結された全長の発光酵素及び蛍光タンパク質、が変形し、発光量を増加させる。このように、本発明に係る融合タンパク質によれば、発光量の変化に基づいて、細胞内外における分子の動き、信号伝達等を可視化検出することができる。
【0102】
したがって、本発明に係る融合タンパク質を用いれば、標的特異的なリガンドの生理活性、濃度等を高精度に検出することが可能であり、例えば発癌物質のような生体内危険因子のスクリーニング、薬学分野における新薬候補物質のスクリーニング、抗癌剤の薬理作用の定量評価(新薬の開発)、環境汚染・毒性物質の判定、診断用のキット、新型万能細胞(iPS)における分化・生理作用の測定などに有用である。
【0103】
つまり、本発明の目的は、発光プローブ及びこれをコードするポリヌクレオチドを提供することにあるのであって、本明細書中に具体的に記載した融合タンパク質作製方法及びポリヌクレオチド作製方法等に存するのではない。従って、上記各方法以外によって取得される発光プローブ及びこれをコードするポリヌクレオチドも本発明の技術的範囲に属することに留意しなければならない。
【0104】
〔2.ベクター〕
本発明はまた、本発明に係る融合タンパク質を生物又は細胞内で発現させるベクターを提供する。本発明に係るベクターを用いれば、本発明に係る融合タンパク質をコードするポリヌクレオチドを生物又は細胞に導入し、当該生物又は細胞内において本発明に係る融合タンパク質を発現させることができる。
【0105】
本発明に係るベクターは、上述した本発明に係るポリヌクレオチドを含んでいることを特徴としている。本発明に係るベクターは、本発明に係るポリヌクレオチドを含むものであれば、特に限定されない。例えば、本発明に係るポリヌクレオチドのcDNAが挿入された組換え発現ベクター等が挙げられる。組換え発現ベクターの作製方法としては、プラスミド、ファージ又はコスミド等を用いる方法が挙げられるが特に限定されない。
【0106】
発現用ベクターの具体的な種類は特に限定されず、発現に用いる宿主中で発現可能なベクター等が適宜選択され得る。例えば、公知の真核又は原核細胞用のベクター等を使用することができる。また、ある臓器に特異的に宿る既知のベクターを使うことによって、特定臓器に選択的に本発明に係る融合タンパク質を発現させることもできる。
【0107】
また、本発明に係るベクターは、本発明に係るポリヌクレオチドの発現を制御するために(例えば、生物個体における特定組織での発現)、公知の組織特異的プロモーター配列を組み込むようにしてもよい。また、特定のリガンド、刺激物等の有無によって、本発明に係るポリヌクレオチドの発現を制御するために、公知の特定刺激特異的プロモーター配列を組み込むようにしてもよい。
【0108】
また、本発明に係るベクターは、本発明に係るポリヌクレオチドを、例えばpMXなどのレトロウイルスベクターにつなげたものであってもよい。これを高力価のウイルス産生能を有するパッケイジング細胞PLATEに導入することによって、動物に感染するレトロウイルスの作成が可能である。このウイルスを動物の各臓器に感染させることによって、各臓器内におけるセカンドメッセンジャー特性のリアルタイムイメージングができる。
【0109】
すなわち、本発明に係るベクターは、確実に本発明に係るポリヌクレオチドによりコードされる融合タンパク質を発現させるために、適宜プロモーター配列を選択し、これと本発明に係るポリヌクレオチドとを各種プラスミド等に組み込んだものであってもよい。
【0110】
本発明に係るベクターは、例えばマイクロインジェクション法、エレクトロポーレーション法、脂質試薬によるトランスフェクション法(例えばTransIT、Mirus社製)等の公知の方法により宿主内に導入することができる。上記の宿主は、特に限定されるものではなく、従来公知の各種細胞、生物個体等を好適に用いることができる。
【0111】
なお、目的とする本発明に係る融合タンパク質が常に合成される場合に限定されず、IPTGを添加することにより、合成が誘導されるものであってもよい。また、ベクターには、合成されるタンパク質のN末端又はC末端にヒスチジンタグ、HAタグ(配列番号10)、Mycタグ、Flag等のタグ配列を付加する配列を含むものであってもよい。
【0112】
また、本発明に係るベクターは、例えば、融合タンパク質を発現させる目的ではなく、融合タンパク質をコードする配列の上流に発現制御をし得る制御配列を繋げることによって、融合タンパク質の発現の有無を指標としてさらなる生物分析のために利用することができる。
【0113】
本発明に係るベクターは、少なくとも1つの選択マーカーを含むことが好ましい。このようなマーカーとしては、真核生物細胞培養については、ジヒドロ葉酸レダクターゼ、又はネオマイシン、ゼオシン、ジェネティシン、ブラストシジンS、ハイグロマイシンB等の薬剤耐性遺伝子が挙げられる。また、大腸菌及び他の細菌における培養については、カナマイシン、ゼオシン、アクチノマイシンD、セフォタキシム、ストレプトマイシン、カルベニシリン、ピューロマイシン、テトラサイクリン又はアンピシリン等の薬剤耐性遺伝子が挙げられる。上記選択マーカーを用いれば、本発明に係るポリヌクレオチドが宿主に導入されたか否か、さらには宿主中で確実に発現しているか否かを確認することができる。
【0114】
本発明に係るベクターを用いれば、生物又は細胞に導入することにより、当該生物又は細胞中に本発明に係る融合タンパク質を発現させることができる。また、本発明に係るベクターを導入した細胞から融合タンパク質を抽出して、精製し又は未精製のままで(非細胞系)、診断キットのセンサー成分として使用できる。例えば、生体試料内の各種生理物質の一例としてステロイドホルモン又は化学物質を測定することによって、各リガンドの生理活性を迅速に測定することができる。
【0115】
さらに、本発明に係るベクターを無細胞タンパク質合成系に用いれば、本発明に係る融合タンパク質を合成することができる。
【0116】
なお、本発明に係るベクターは、少なくとも、本発明に係る融合タンパク質をコードするポリヌクレオチドを含んでいればよい。すなわち、発現用ベクター以外のベクターも本発明の技術的範囲に含まれる点に留意すべきである。
【0117】
〔3.形質転換体〕
本発明はまた、本発明に係る融合タンパク質を発現させ得る形質転換体を提供する。本発明に係る形質転換体は、本発明に係るポリヌクレオチド、及び当該ポリヌクレオチドを含むベクターを含んでいることを特徴としている。本明細書中において、「形質転換体」は、細胞、組織又は器官だけでなく、生物個体をも含むことが意図される。本発明に係る形質転換体は、本発明に係るポリヌクレオチド、及び当該ポリヌクレオチドを含むベクターを含んでいる限り、特に限定されるものではない。
【0118】
本発明に係る形質転換体は、本発明に係るポリヌクレオチド、又は当該ポリヌクレオチドを含む組換えベクターを、本発明に係る融合タンパク質が発現され得るように生物又は細胞中に導入することによって得られる。なお、組換えベクターを導入する宿主生物及び細胞としては、特に限定されないが、例えばCOS−7、MCF−7、HeLa、CHOのような真核培養細胞、体細胞由来の新型万能細胞(iPS)、原核細胞、植物細胞、高等動物等を用いることができる。
【0119】
本発明に係るポリヌクレオチド、又は当該ポリヌクレオチドを含むベクターを宿主に導入する方法、すなわち形質転換方法は特に限定されるものではなく、電気穿孔法、リン酸カルシウム法、リポソーム法、DEAEデキストラン法等の従来公知の方法を好適に用いることができる。また、本発明に係る形質転換体は、本発明に係るポリヌクレオチドが宿主のゲノムに組み込まれていない状態で一過性に発現する、一過性形質転換体であってもよく、本発明に係るポリヌクレオチドが宿主のゲノムに組み込まれ安定的に発現し続ける、安定形質転換体であってもよい。
【0120】
本発明に係る形質転換体を用いれば、本発明に係る融合タンパク質を発現させることができるため、本発明に係る形質転換体をリガンドで刺激し、当該形質転換体からの発光量の変化を測定することによって、リガンドの性質、濃度、活性の程度等を評価することができる。
【0121】
〔4.標的物質検出方法及びキット〕
本発明は、さらに、被験試料中の標的物質を検出する標的物質検出方法及びキットを提供する。標的物質をリガンドと称する場合、標的物質検出方法及びキットを、リガンド検出方法及びキットと称する。本発明に係る標的物質検出方法は、被験試料と、本発明に係る融合タンパク質とを共存させる工程を包含することを特徴としている。本方法においては、被験試料と接触させる融合タンパク質に含まれる酵素の基質を、適宜接触させてもよい。これにより、本発明に係る融合タンパク質からの発光量を指標に、被験試料中の標的物質を検出する。本明細書中において、「被験試料」は、リガンドそのものであってもよく、リガンドを含む生体試料等であってもよい。また、被験試料は、本発明に係る融合タンパク質が発現した細胞において二次的に生産された細胞内物質であることもできる。
【0122】
上記工程において、被験試料の存在下及び非存在下において、本発明に係る融合タンパク質からの発光量が増加した場合、当該被験試料中において、本発明に係る融合タンパク質のリガンド結合タンパク質に結合するリガンドを検出することができる。本発明に係るリガンド検出方法によれば、後述する実施例に示すように、リガンドの性質、リガンドの活性の程度、リガンドの濃度等を分析することが可能である。
【0123】
本発明に係る標的物質検出方法によれば、既知のアゴニストに対する未知のアンタゴニストを検出することもできる。例えば、本発明に係る融合タンパク質に候補物質を含む被験試料を接触させ、ついで既知のアゴニストを接触させて、本発明に係る融合タンパク質からの発光量を測定する。被験試料中の候補物質がアンタゴニスト作用を有するものであれば、一次結合タンパク質のアゴニスト結合部位は候補物質によって占有されているので、その後に導入されたアゴニストは一次結合タンパク質に結合することはできない。
【0124】
このとき、アンタゴニストの結合によっては立体構造が増加しない一次結合タンパク質を用いていれば、アンタゴニストの結合により融合タンパク質からの発光量は増加しないため、アゴニスト単独で導入した場合に比して発光量は低い。一方、アゴニストの結合によっては立体構造が変化しない一次結合タンパク質を用いていれば、同様に既知のアンタゴニストを用いて、未知のアゴニストを検出することもできる。
【0125】
本発明に係る標的物質検出方法においては、典型的には、本発明に係る融合タンパク質をコードするポリヌクレオチドを含む発現ベクターを用いて形質転換した生細胞と、被験試料とを接触させて刺激し、刺激前後における本発明に係る融合タンパク質からの発光量の増加を測定する。本発明に係る融合タンパク質と被験試料とを接触させる方法は、特に限定されないが、例えば本発明に係る融合タンパク質が発現した生細胞の培養培地に被験試料を添加し、エンドサイトーシス作用によって被験試料を細胞内に取り込ませて接触させてもよい。また、被験試料が細胞内物質の場合には、本発明に係る融合タンパク質を当該細胞内において発現させることによって、接触させてもよい。また、生細胞がない状態であっても、例えば培地中に分泌した本発明に係る融合タンパク質を含む培養液、又は精製した本発明に係る融合タンパク質を用いれば、各発光酵素の基質を同時に存在させて、in vitroでの測定も可能である。
【0126】
本発明に係る標的物質検出方法において、生細胞中に発現させた発光プローブを用いる場合、以下の方法を適用できるが、この方法に限定されない。
(i)本発明に係る発光プローブをコードするポリヌクレオチドを有するプラスミドを、24穴プレート上の生細胞に導入し、さらに16時間培養する。
(ii)上記細胞を被験試料で20分間刺激する。
(iii)基質共存下で、上記細胞における発光量の変化を発光度計で測定する。
【0127】
本発明に係る標的物質検出方法において、本発明に係る発光プローブを用いた非細胞系実験(in vitro)を行った場合、以下の方法を適用できるが、この方法に限定されない。
(i)公知の方法により精製した発光プローブを、直径1.2センチの十字架型紙片の末端に垂らして乾燥させる。
(ii)上記十字架型紙片のもう一方の末端に刺激物質(リガンド)を含む基質溶液を点滴し、即時に発光Scanner(例えば、RAS−3000;FujiFilm)で発光量の変化を測定する。
【0128】
本発明に係る標的物質を検出するための標的物質検出キットは、本発明に係る融合タンパク質を備えていることを特徴としている。また、本キットは、本発明に係る融合タンパク質に含まれる発光酵素の基質を、さらに備えていてもよい。
【0129】
ここで、本キットが備える本発明に係る融合タンパク質は、真核細胞内及び原核細胞内において大量発現させた後に精製することが可能である。例えば哺乳動物細胞を用いた場合、従来公知の適切なシグナル配列(例えば、MGVKVLFALICIAVAEA等)を繋いで培地中に大量に分泌させることによって、精製工程なしでも分析に用いることが可能な、大量の融合タンパク質含有培養上清が得られる。また、さらに精製用のタグ(例えば、His Tag)をつけることで、容易に融合タンパク質を大量精製することができる。
【0130】
このようにして得られた融合タンパク質を備えたキットと同様に、本発明に係る融合タンパク質を発現している形質転換体を備えたキットも、被験試料中の標的物質の検出に用いられ得る。また、例えば精製した発光プローブを備える紙ストリップと、発光酵素の基質とを組み合わせたキットは、発光プローブを発現している形質転換体を備えたキットと同様に、外部刺激及びそれによる二次現象であるセカンドメッセンジャーの定性定量分析が可能なキット構成とすることができる。また、本発明に係るポリヌクレオチドと当該ポリヌクレオチドにより形質転換される細胞とを備えたキット、及び本発明に係るベクターと当該ベクターにより形質転換される細胞とを備えたキットも、同様に被験試料中の標的物質の検出に用いられ得る。
【0131】
〔5.プローブ生産方法及びキット〕
本発明は、さらに、本発明に係るプローブの生産方法及びキットを提供する。本発明に係るプローブの生産方法は、本発明に係るポリヌクレオチド又は本発明に係るベクターを用いて細胞を形質転換する工程を包含することを特徴としている。本方法においては、本発明に係るポリヌクレオチド又は本発明に係るベクターを用いて細胞を形質転換し、本発明に係るプローブを細胞中に発現させることによって、本発明に係るプローブを生産する。細胞中に発現させたプローブは、公知の方法により細胞中から回収し、精製することができる。
【0132】
具体的には、本発明に係るポリヌクレオチド又はベクターを用いて細胞を形質転換し、培養した後、培養物等から慣用的な手法(例えば、濾過、遠心分離、細胞の破砕、ゲル濾過クロマトグラフィー、イオン交換クロマトグラフィー等)に従って、本発明に係るプローブを回収、精製することができる。また、細胞中で発現させたポリヌクレオチドに精製用のタグが付加されている場合には、より容易に回収することができる。
【0133】
本発明に係るプローブの生産キットは、本発明に係るポリヌクレオチド又は本発明に係るベクターを備えていることを特徴としている。また、本キットは、本発明に係るポリヌクレオチド又は本発明に係るベクターにより形質転換される細胞を、さらに供えていてもよい。さらに、本発明に係る融合タンパク質に含まれる酵素の基質を備えていてもよい。また、本発明に係るプローブの生産キットは、本発明に係る融合タンパク質をコードするポリヌクレオチドを備えていてもよい。
【0134】
本発明では、従来の方法における問題点を克服すべく、酵素の全長を用いる、新規の一分子型プローブとして用いられる融合タンパク質を提供する。例えば、酵素として発光酵素を用いる、新規な生物発光による可視化手段を提供する。また、本発明の手法は、生物発光酵素を用いる基礎原理をも提供している。
【0135】
本発明は、酵素にかかる分子の捩れ現象を指標としたユニークな生物分析法を用いるものである。本発明は、酵素の全長を用いるので、酵素として発光酵素を用いた場合には、高輝度の生物発光イメージングが可能である。また、本発明に係る融合タンパク質は、分解、ミスフォールディングなどが起こりにくいので安定性が高い。また、1つの分子内タンパク質間相互作用を指標とするため、非細胞系における生物分析にも適用できる。従って、本発明に係る融合タンパク質は、高精度で安定性の高い分析手段を提供するものであり、かつ、細胞・非細胞系ともに適用できる、簡便な手法を提供するものである。本発明における分析原理は、新薬候補物質のスクリーニング、毒性物質及び環境汚染物質の評価などに広く適用できる。
【0136】
本発明は上述した各実施形態に限定されるものではなく、請求項に示した範囲で種々の変更が可能であり、異なる実施形態にそれぞれ開示された技術的手段を適宜組み合わせて得られる実施形態についても本発明の技術的範囲に含まれる。
【0137】
なお、本明細書における用語は、基本的にはIUPAC−IUB Commission on Biochemical Nomenclatureによるものであり、あるいは当該分野において慣用的に使用される用語の意味に基づくものである。また発明を実施するために使用する様々な技術は、特にその出典を明示した技術を除いては、公知の文献等に基づいて当業者であれば容易かつ確実に実施可能である。例えば、遺伝子工学および分子生物学的技術はJ. Sambrook, E. F. Fritsch & T. Maniatis, "Molecular Cloning: A Laboratory Manual (2nd edition)", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1989); D. M. Glover et al. ed., "DNA Cloning", 2nd ed., Vol. 1 to 4, (The Practical Approach Series), IRL Press, Oxford University Press (1995); Ausubel, F. M. et al., Current Protocols in Molecular Biology, John Wiley & Sons, New York, N.Y, 1995;日本生化学会編、「続生化学実験講座1、遺伝子研究法II」、東京化学同人 (1986); 日本生化学会編、「新生化学実験講座2、核酸III(組換えDNA技術)」、東京化学同人 (1992);R. Wu ed., "Methods in Enzymology", Vol. 68 (Recombinant DNA), Academic Press, New York (1980); R. Wu et al. ed., "Methods in Enzymology", Vol. 100 (Recombinant DNA, Part B) & 101 (Recombinant DNA, Part C), Academic Press, New York (1983); R. Wu et al. ed., "Methods in Enzymology", Vol. 153 (Recombinant DNA, Part D), 154 (Recombinant DNA, Part E) & 155 (Recombinant DNA, Part F), Academic Press, New York (1987) などの参考文献に記載の方法、上記文献に引用された文献に記載の方法、またはこれらと実質的に同一の方法、もしくはその改変法により行うことができる。また、本発明で使用する各種タンパク質、ペプチド、あるいはそれらをコードするDNAについては、既存のデータベース(URL:http://www.ncbi.nlm.nih.gov/等)から入手することができる。
【実施例】
【0138】
〔実施例1:発光酵素を挿入したストレインプローブの設計〕
まず、RLuc8(1−234アミノ酸)、GLuc(17−185アミノ酸)、CBLuc(1−515アミノ酸)、及びFLuc(1−550アミノ酸)をそれぞれコードするcDNAに対して、そのN末側にER LBDのcDNAを連結し、そのC末側にSrcのSH2ドメインのcDNAを連結して、これらのcDNAを直鎖状に連結したキメラDNAコンストラクトを作製した(配列番号4〜6、15)。作製したコンストラクトを、pcDNA 3.1(+)(Invitrogen社)にサブクローンした。
【0139】
図6は、ストレインプローブを作製するためのプラスミド構成の一例を示す図である。なお、図6には、RLuc8を挿入したストレインプローブ(ERSプローブ)を発現させるためのプラスミド(pERS)のみのDNAコンストラクト構成を示すが、GLucを挿入したストレインプローブ(EGSプローブ)を発現させるプラスミド(pEGS)、CBLucを挿入したストレインプローブ(ECSプローブ)を発現させるプラスミド(pECS)又はFLucを挿入したストレインプローブ(EFSプローブ)を発現させるプラスミド(pEFS)についてもこれと同様に構成した。
【0140】
次に、これらのプラスミドをCOS−7細胞(ATCC)に形質転換した。具体的には、COS−7細胞を、10%ステロイドフリーウシ胎児血清(FBS)及び1%ペニシリン−ストレプトマイシン(P/S)を添加したDulbecco改変イーグル培地(DMEM;Sigma製)を含む24ウエルプレートにおいて、cellインキュベータ(Sanyo製)中で、37℃、5%CO2存在下で培養した。導入試薬としてTransIT−LT1(Mirus製)を用いて、COS−7細胞に、pERS、pEGS、pECS及びpEFS(各ウエル当り0.2μg)を一過性形質転換した。形質転換した細胞を、5%CO2存在下で16時間インキュベートした。
【0141】
得られた形質転換体を用いて、リガンドとして用いた4−ヒドロキシタモキシフェン(OHT)の存在下・非存在下それぞれにおける発光強度を観察した。
【0142】
まず、作製したpERS、pEGS、pECS又はpEFSが導入されたCOS−7細胞を、OHT 10−6M(終濃度)存在下又は非存在下で20分間刺激した後、基質としてセレンテラジン又はD−ルシフェリン(D−luciferin)を用いて発光強度を測定した。
【0143】
発光強度の測定を以下のとおり行った。pERSが導入されたCOS−7細胞について、刺激後の細胞を、基質を含む200μLの細胞溶解バッファに溶解し、全溶解物を石英セル(45×12.5×7.5mm)に移した。分光光度計(FP−750;Jasco社)を用いて、400nmから700nmの範囲の発光を測定した(n=2)。また、pERS、pEGS、pECS又はpEFSが導入されたCOS−7細胞について、発光度計(Minilumat LB9506)を用いて発光強度を測定した。結果を図7及び8に示す。
【0144】
図7は、pERSが導入された形質転換体における発光スペクトルを示すグラフである。図7に示すように、RLuc8を挿入したERSプローブにおいて、OHT刺激依存的に発光強度が大幅に増加することが示された。また、発光スペクトルは、475nm近傍において最高値を示した。
【0145】
また、図8は、各ストレインプローブをそれぞれ発現する形質転換体の、バックグラウンド(−OHT)を1としたときの発光強度の割合を示すグラフである。図8に示すように、それぞれのストレインプローブにおいて、OHT刺激依存的に発光強度が増加することが示された。このように、OHT刺激によってストレインプローブからの発光強度が大きくなったという結果から、外部刺激を受けることによって、ストレインプローブ自身の代謝回転率が改善される、又はストレインプローブの量子収率が改善されることが示唆された。
【0146】
また、図8に示すように、RLuc8を挿入したERSプローブにおいて、他の発光酵素を挿入したストレインプローブと比較して特に発光強度が大きく増加した。この結果から、外部刺激によるストレインプローブの発光量の変化が、挿入した発光酵素の分子構造に強く依存することが示唆された。すなわち、挿入した発光酵素が、外部からの分子テンションが加わることにより酵素活性部位の構造が変形しやすい分子構造であるか否かが、ストレインプローブの発光量の変化に影響を及ぼすことが示唆された。上述したように、RLuc8は、略球形状であるため、外部からの分子テンションが酵素活性部位に効率よく伝わり、その構造が変形しやすい(ストレインがかかりやすい)構造となっている。したがって、他の発光酵素と比較して、外部刺激による発光強度の増加量が多い結果が得られたと言える。また、GLucは、他の発光酵素に比べて分子量(18―185アミノ酸;18kD)が非常に小さいため、外部からの分子テンションが酵素本体に伝わりにくく、その活性部位の構造が変形しにくいため、RLuc8と比較して外部刺激による発光強度の増加量が少ない結果となったと言える。
【0147】
また、ERSプローブを発現する形質転換体からの発光強度は、非常に高かった。これは、ERSプローブが、RLuc8の全長をそのまま含んでいるためであると言える。
【0148】
このように、本発明に係るストレインプローブを用いれば、様々なタンパク質―タンパク質間の相互作用を高感度、かつ高い発光強度で測定できることが示された。
【0149】
〔実施例2:ストレインプローブの基質選択性〕
次に、ERSプローブにおける発光酵素RLuc8の基質選択性について調べた。COS−7細胞を12穴プレートにおいて十分に培養した後、脂質試薬を用いてpERSをCOS−7細胞に導入し、さらに16時間培養した。その後、この細胞を溶媒又はOHT10−6M(終濃度)により20分間刺激し、種々の基質の共存下又は非存在下(バックグラウンド)における発光強度を実施例1と同様に、分光光度計(FP−750;Jasco社)を用いて測定した。基質として、図9に示すセレンテラジン(coelenterazine)(coele)、セレンテラジンcp(cp)、セレンテラジンhcp(hcp)、セレンテラジンfcp(fcp)、セレンテラジンip(ip)、及びセレンテラジン400A(400A)を用いた。なお、図9において、重要なサイドチェーンにあたる部位を破線によって囲んで示した。結果を図10及び11に示す。
【0150】
図10は、種々の基質共存下における、pERSを導入したCOS7細胞の発光スペクトルを示すグラフである。また、図11は、種々の基質共存下におけるpERSを導入したCOS7細胞の、バックグラウンドを1としたときの発光スペクトルのピーク強度の割合を示すグラフである。図10及び図11に示すように、いずれの基質を用いた場合であっても発光強度はOHT依存的に増加したが、基質の種類によって、その増加率が異なっていた。発光強度は、セレンテラジンを用いた場合が最も高かった(図示せず)。一方、バックグラウンドに対するシグナル比率は、セレンテラジンfcpを用いた場合が最も大きかった。
【0151】
この結果から、実験の目的に応じて基質を使い分けることができることが示唆された。また、各セレンテラジンのサイドチェーンを比較することによって、本発明のストレインプローブの基質における^重要なサイドチェーンを同定し得ることが示唆された。
【0152】
また、RLuc8を単独で用いた場合、又はERSを用いた場合の発光強度を、同様の方法を用いて測定した。RLuc8の全長をコードするcDNAのみをpcDNA 3.1(+)(Invitrogen社)にサブクローンしてプラスミドを構築し、当該プラスミドをCOS−7細胞に形質転換することによって、RLuc8を単独で発現した形質転換体を得た。結果を図12に示す。
【0153】
図12は、RLuc8を単独で発現した形質転換体、又はERSを発現した形質転換体における発光スペクトルを示すグラフである。図12に示すように、セレンテラジンfcp共存下において、RLuc8を単独で発現した形質転換体においては、OHT依存的な発光スペクトルの変化が見られなかったが、ERSを発現した形質転換体では、OHT依存的な発光スペクトルの変化が見られた。
【0154】
〔実施例3:ERSのリガンド依存性、検出限界及びリガンド選択性〕
まず、ERSのリガンド依存性及び検出限界について調べた。12穴プレートにおいて培養したCOS−7細胞に、pERSを導入(トランスフェクト)した後、さらに16時間培養した。その後、この細胞を種々の濃度のOHT又はテストステロン(T:testosterone)により20分間刺激し、次いでライセート試薬を15分間導入することによってライセートを作製した。作製したライセートについて、基質としてセレンテラジンの共存下において、発光強度の変化を発光度計(Minilumat LB9506)を用いて測定した。結果を図13に示す。
【0155】
図13は、ERSを発現した形質転換体におけるリガンド応答曲線を示す図である。図13に示すように、ERSを発現した形質転換体における発光強度は、濃度約10−10のOHT刺激によって増加しはじめ、濃度10−7近傍において最高値に達した。一方、テストステロンの刺激に対しては、発光強度の増加による応答は見られなかった。これにより、ERSは、OHTに特異的に応答することが示された。
【0156】
次に、ERSに及ぼすER LBDのリン酸化の影響、及び発光強度の変化に及ぼすERSの一分子型構造変化の影響を調べた。ER LBDのリン酸化部位であるY537に変異を導入した、EmRSプローブを発現するプラスミドを構築し、これをCOS−7細胞に導入した形質転換体を得た。また、図15に示すように、RLuc8のN末側にER LBDのみをつなげたプローブ(ERプローブ)を発現させるためのDNAコンストラクト構成を有するプラスミド(pER)、RLuc8のC末側にSH2ドメインのみをつなげたプローブ(RSプローブ)を発現させるためのDNAコンストラクト構成を有するプラスミド(pRS)をそれぞれ構築した。そして、構築したpER及びpRSを同時にCOS−7細胞に導入した形質転換体(ER+RS)を得た。
【0157】
得られた形質転換体をOHT又は0.l%DMSO(コントロール)によって刺激し、その発光強度を上記と同様の方法により測定し、比較した。結果を図14に示す。図14は、ERS、EmRS、並びにER及びRSをそれぞれ発現した形質転換体の、コントロールを1としたときの相対発光強度を示すグラフである。
【0158】
図14に示すように、ERSを発現した形質転換体は、OHT刺激に対して、コントロールと比較して約3倍の発光強度を示した。一方、EmRSを発現した形質転換体は、OHT刺激に対する発光強度の増加は、コントロールと比較して約1.7倍であった。これにより、リン酸化部位を変異したEmRSにおいては、外部刺激によるER LBDとSH2ドメインとの相互作用が生じにくく、外部刺激に依存した発光量の変化が見られにくいことが示唆された。
【0159】
また、ER及びRSを共発現する形質転換体(ER+RS)においては、OHT刺激に対して発光強度の増加が認められなかった。ここで、図16に、ER及びRSの構造を模式的に示す。図5に示すERSとを比較して、図16に示すER及びRSが共発現する形質転換体(ER+RS)においては、OHTの刺激によりSH2ドメインとER LBDとが相互作用したとしても、RLuc8に外部からの分子テンションが加わらない。したがって、RLuc8に変形、すなわち捩れが生じないので、その酵素活性部位が変形せず、発光強度が増加しなかった。
【0160】
次に、ERSにおけるリガンド選択性を調べた。図17に示す、OHT、E2(17β−エストラディオール)、及びパーシャルアゴニスト(partial agonist)であるゲニステイン(Genistein)、ならびにデヒドロテストステロン(DHT:5α-dihydrotestosterone)、テストステロン(T)、及びコルチゾール(cortisol)を、リガンドとして用いた。濃度10−6Mの各リガンドを用いて、ERSを発現した形質転換体を刺激した後、上記と同様の方法により発光強度を測定し、リガンドの代わりに溶媒を用いた場合(vehicle)の発光強度と比較した。結果を図18に示す。
【0161】
図18は、ERSを発現した形質転換体の、種々のリガンド応答による発光強度を示すグラフである。ERSを発現した形質転換体は、OHT及びE2に対してほぼ同等の発光強度の増加を示した。また、ゲニステインに対して、OHT及びE2よりは低いが、発光強度の増加を示した。一方、DHT、テストステロン、及びコルチゾールに対しては、発光強度の増加を示さなかった。
【0162】
この結果から、ERSが女性ホルモン受容体に特異的なリガンド感受性を有することが示された。また、ERSがリガンドに対して感度よく応答できることが示された。
【0163】
〔実施例4:発光酵素と蛍光タンパク質とを組み合わせて挿入したストレインプローブの設計〕
まず、蛍光タンパク質EYFPをコードするcDNAを、RLuc8(1−234アミノ酸)をコードするcDNAのN末側に連結した。連結したcDNAに対して、そのN末側にさらにER LBDのcDNAを連結し、そのC末側にSrc SH2ドメインのcDNAを連結して、このcDNAを直鎖状に連結したキメラDNAコンストラクトを作製した(配列番号16)。作製したコンストラクトを、pcDNA 3.1(+)(Invitrogen社)にサブクローンした。
【0164】
図19は、ストレインプローブを作製するためのプラスミド構成の一例を示す図である。図19には、EYFPのC末側にRLuc8を連結したものを挿入したストレインプローブ(EERSプローブ)を発現させるためのプラスミド(pEERS)のDNAコンストラクト構成を示す。
【0165】
次に、実施例1に示した方法と同様の方法を用いて、このプラスミドをCOS−7細胞(ATCC)に形質転換し、得られた形質転換体を用いて、OHTの存在下・非存在下それぞれにおける発光強度を測定した。結果を図20に示す。
【0166】
図20は、pEERSが導入された形質転換体における発光スペクトルを示すグラフである。図20に示すように、EYFP及びRLuc8を挿入したEERSプローブにおいて、OHT刺激依存的に発光強度が増加することが示された。
【0167】
この結果から、以下のことが示された。図21に示すように、リガンド(OHT)がない条件では、リガンド結合タンパク質(ER LBD)と認識タンパク質(Src SH2)とが相互作用せず、EYFPとRLuc8との間の生物発光共鳴エネルギー移動が弱いため、発光強度は弱かった。一方、リガンドにより刺激されると、リガンドがリガンド結合タンパク質に結合し、この結合を認識タンパク質が認識することにより、リガンド結合タンパク質と認識タンパク質とが相互作用する。リガンド結合タンパク質と認識タンパク質との相互作用は、必然的にその間に存在する発光酵素(RLuc8)及び蛍光タンパク質(EYFP)に一定の構造的な変形(ストレイン)を引き起こし、発光酵素と蛍光タンパク質との間の生物発光共鳴エネルギー移動が影響を受けることによって、発光プローブからの酵素活性度、すなわち発光総量が増加した。すなわち、EERSプローブは、その内部において発光共鳴エネルギー移動を起こすものであることが示された。
【0168】
したがって、本発明に係る発光プローブは、リガンド結合タンパク質と認識タンパク質との間に、酵素を含む2つのタンパク質分子を挿入した場合においても、リガンド依存的な酵素活性度の変化が起こり得ることが示された。
【産業上の利用可能性】
【0169】
本発明に係る融合タンパク質は、発光強度が高く、設計が容易であるので、バイオ産業、医薬品産業、食品産業等の広範な分野に応用することができる。特に、診断医療分野、ナノバイオ分野、薬理作用評価分野、環境分析分野等において、好適に利用可能である。
【特許請求の範囲】
【請求項1】
標的物質を検出する融合タンパク質であって、
前記標的物質が結合する結合部位を有する一次結合タンパク質と、
前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、
前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、
前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものであることを特徴とする融合タンパク質。
【請求項2】
前記酵素は略球形状であることを特徴とする請求項1に記載の融合タンパク質。
【請求項3】
前記酵素は発光酵素であり、
前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、発光量を増加させるものであることを特徴とする請求項1または2に記載の融合タンパク質。
【請求項4】
前記一次結合タンパク質と前記二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することを特徴とする請求項3に記載の融合タンパク質。
【請求項5】
前記発光酵素は、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、クリックビートルルシフェラーゼ、及びホタルルシフェラーゼからなる群より選択されることを特徴とする請求項3または4に記載の融合タンパク質。
【請求項6】
前記一次結合タンパク質は、核内受容体、サイトカイン受容体、タンパク質キナーゼ、セカンドメッセンジャー認識タンパク質、及び転写因子からなる群より選択されることを特徴とする請求項1〜5のいずれか1項に記載の融合タンパク質。
【請求項7】
前記一次結合タンパク質がエストロゲン受容体のリガンド結合ドメインであり、前記二次結合タンパク質がSrcタンパク質のSH2ドメインであり、前記発光酵素がウミシイタケルシフェラーゼであることを特徴とする請求項3または4に記載の融合タンパク質。
【請求項8】
前記一次結合タンパク質と前記酵素とを連結する第1リンカーと、前記二次結合タンパク質と前記酵素とを連結する第2リンカーとをさらに備え、
前記第1リンカー及び前記第2リンカーはそれぞれ、5アミノ酸以下のアミノ酸配列からなることを特徴とする請求項1〜7のいずれか1項に記載の融合タンパク質。
【請求項9】
前記第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、前記第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることを特徴とする請求項8に記載の融合タンパク質。
【請求項10】
配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列からなる、融合タンパク質;あるいは
配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列の1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する、融合タンパク質。
【請求項11】
請求項1〜10のいずれか1項に記載の融合タンパク質をコードする、ポリヌクレオチド。
【請求項12】
配列番号4〜6及び15〜16のいずれかに示される塩基配列からなる、ポリヌクレオチド;
配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;
配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;あるいは
配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド。
【請求項13】
請求項11又は12に記載のポリヌクレオチドを含んでいることを特徴とするベクター。
【請求項14】
請求項11又は12に記載のポリヌクレオチドを含んでいることを特徴とする形質転換体。
【請求項15】
請求項13に記載のベクターを含んでいることを特徴とする形質転換体。
【請求項16】
被験試料中の標的物質を検出する方法であって、
前記被験試料と、請求項1〜10のいずれか1項に記載の融合タンパク質とを接触させる工程を包含することを特徴とする方法。
【請求項17】
請求項1〜10のいずれか1項に記載の融合タンパク質を備えていることを特徴とする被験試料中の標的物質を検出するためのキット。
【請求項18】
請求項11又は12に記載のポリヌクレオチドを用いて細胞を形質転換する工程を包含することを特徴とするプローブの生産方法。
【請求項19】
請求項11又は12に記載のポリヌクレオチドを備えていることを特徴とするプローブの生産キット。
【請求項20】
請求項13に記載のベクターを用いて細胞を形質転換する工程を包含することを特徴とするプローブの生産方法。
【請求項21】
請求項13に記載のベクターを備えていることを特徴とするプローブの生産キット。
【請求項1】
標的物質を検出する融合タンパク質であって、
前記標的物質が結合する結合部位を有する一次結合タンパク質と、
前記一次結合タンパク質に前記標的物質が結合したことを認識する二次結合タンパク質と、
前記一次結合タンパク質と前記二次結合タンパク質との間に位置する、活性型の酵素又はその前駆体とを有し、
前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、酵素活性度を増加するものであることを特徴とする融合タンパク質。
【請求項2】
前記酵素は略球形状であることを特徴とする請求項1に記載の融合タンパク質。
【請求項3】
前記酵素は発光酵素であり、
前記一次結合タンパク質に前記標的物質が結合したことを前記二次結合タンパク質が認識した場合に、発光量を増加させるものであることを特徴とする請求項1または2に記載の融合タンパク質。
【請求項4】
前記一次結合タンパク質と前記二次結合タンパク質との間に位置する蛍光タンパク質をさらに有することを特徴とする請求項3に記載の融合タンパク質。
【請求項5】
前記発光酵素は、ウミシイタケルシフェラーゼ、ガウシアルシフェラーゼ、クリックビートルルシフェラーゼ、及びホタルルシフェラーゼからなる群より選択されることを特徴とする請求項3または4に記載の融合タンパク質。
【請求項6】
前記一次結合タンパク質は、核内受容体、サイトカイン受容体、タンパク質キナーゼ、セカンドメッセンジャー認識タンパク質、及び転写因子からなる群より選択されることを特徴とする請求項1〜5のいずれか1項に記載の融合タンパク質。
【請求項7】
前記一次結合タンパク質がエストロゲン受容体のリガンド結合ドメインであり、前記二次結合タンパク質がSrcタンパク質のSH2ドメインであり、前記発光酵素がウミシイタケルシフェラーゼであることを特徴とする請求項3または4に記載の融合タンパク質。
【請求項8】
前記一次結合タンパク質と前記酵素とを連結する第1リンカーと、前記二次結合タンパク質と前記酵素とを連結する第2リンカーとをさらに備え、
前記第1リンカー及び前記第2リンカーはそれぞれ、5アミノ酸以下のアミノ酸配列からなることを特徴とする請求項1〜7のいずれか1項に記載の融合タンパク質。
【請求項9】
前記第1リンカーは、Gly−Serで表されるアミノ酸配列からなり、前記第2リンカーは、Gly−Thrで表されるアミノ酸配列からなることを特徴とする請求項8に記載の融合タンパク質。
【請求項10】
配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列からなる、融合タンパク質;あるいは
配列番号1〜3及び13〜14のいずれか1つに示されるアミノ酸配列の1又は数個のアミノ酸が欠失、置換又は付加されたアミノ酸配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する、融合タンパク質。
【請求項11】
請求項1〜10のいずれか1項に記載の融合タンパク質をコードする、ポリヌクレオチド。
【請求項12】
配列番号4〜6及び15〜16のいずれかに示される塩基配列からなる、ポリヌクレオチド;
配列番号4〜6及び15〜16のいずれかに示される塩基配列の1個又は数個の塩基配列が欠失、置換又は付加された塩基配列からなり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;
配列番号4〜6及び15〜16のいずれかに示される塩基配列と相補的な塩基配列からなるポリヌクレオチドとストリンジェントな条件下でハイブリダイズし、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド;あるいは
配列番号4〜6及び15〜16のいずれかに示される塩基配列と少なくとも66%同一であり、一次結合タンパク質に標的物質が結合したことを二次結合タンパク質が認識した場合に、酵素活性度を増加する融合タンパク質をコードする塩基配列からなる、ポリヌクレオチド。
【請求項13】
請求項11又は12に記載のポリヌクレオチドを含んでいることを特徴とするベクター。
【請求項14】
請求項11又は12に記載のポリヌクレオチドを含んでいることを特徴とする形質転換体。
【請求項15】
請求項13に記載のベクターを含んでいることを特徴とする形質転換体。
【請求項16】
被験試料中の標的物質を検出する方法であって、
前記被験試料と、請求項1〜10のいずれか1項に記載の融合タンパク質とを接触させる工程を包含することを特徴とする方法。
【請求項17】
請求項1〜10のいずれか1項に記載の融合タンパク質を備えていることを特徴とする被験試料中の標的物質を検出するためのキット。
【請求項18】
請求項11又は12に記載のポリヌクレオチドを用いて細胞を形質転換する工程を包含することを特徴とするプローブの生産方法。
【請求項19】
請求項11又は12に記載のポリヌクレオチドを備えていることを特徴とするプローブの生産キット。
【請求項20】
請求項13に記載のベクターを用いて細胞を形質転換する工程を包含することを特徴とするプローブの生産方法。
【請求項21】
請求項13に記載のベクターを備えていることを特徴とするプローブの生産キット。
【図1】


【図4】


【図5】


【図6】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図2】


【図3】


【図7】


【図10】




【図4】


【図5】


【図6】


【図8】


【図9】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図2】


【図3】


【図7】


【図10】


【公開番号】特開2011−67190(P2011−67190A)
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願番号】特願2010−18759(P2010−18759)
【出願日】平成22年1月29日(2010.1.29)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願日】平成22年1月29日(2010.1.29)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

