一時的な管腔内ステント、並びにそれを作製及び使用する方法
【課題】X線不透過性を有し、生分解性で増強された機械的強度を有するポリマーステントを作製する方法及び使用、又は身体の管腔中で使用するための分解の制御を提供する。
【解決手段】ステント100は、1)従来の金属製のステントと同様の機械的機能を有するポリマーからなり、2)拡張可能で、種々の必要性を満たすようにカスタマイズできる拡張比を有し、3)体温にて配置することができ、低い膨張圧(3atm)を有し、4)一時的な、完全生分解性のインプラントであり、5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有し、6)局所への薬物又は遺伝子の送達装置であり、7)局所放射線療法の装置であり、8)種々の機械的支持、急性の薬物放出、長期の薬物放出等を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【解決手段】ステント100は、1)従来の金属製のステントと同様の機械的機能を有するポリマーからなり、2)拡張可能で、種々の必要性を満たすようにカスタマイズできる拡張比を有し、3)体温にて配置することができ、低い膨張圧(3atm)を有し、4)一時的な、完全生分解性のインプラントであり、5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有し、6)局所への薬物又は遺伝子の送達装置であり、7)局所放射線療法の装置であり、8)種々の機械的支持、急性の薬物放出、長期の薬物放出等を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、X線不透過性を有する生分解性のポリマーステント並びにそのようなステントを作製する方法及びその使用に関する。
【背景技術】
【0002】
ステントは、内部補綴インプラントであり、一般的に、形状は管状であり、典型的には、身体構造内の管腔中に挿入して、管腔に機械的な支持を提供し、前記管腔の内部に流路を維持又は再度確立するために拡張可能である、開放型又は格子状の管状構造を有する。ステントは、大動脈、頚動脈、又は1つ若しくは複数の冠状動脈等の血管中で使用して、例えば、動脈の封鎖又は動脈瘤を治療することで知られている。さらに、ステントは、血管以外の身体の管腔又は経路の開存性を維持する場合にも使用されることで知られている。これらは、胆道ステント、尿道ステント及びその他を包含する。例として、血管内ステントを、血管形成術の間に血管内に挿入することができ、これは、血管形成術によって衰弱又は損傷してしまった血管の早期の崩壊を阻止するように設計されている。血管内ステントの挿入により、血管の負の再構築が低減し、一方、損傷した血管壁の治癒が数カ月かけて進行することが示されている。
【0003】
治癒の過程の間に、血管形成術によって生じた炎症及びステントの埋込みによる損傷が、しばしば、ステントの内部における平滑筋細胞の増殖及び再成長を引き起こし、その結果、流路を部分的に閉鎖し、それによって、血管形成術/ステント挿入の手順の有益な効果を、低下させ又は排除する。この過程は、再狭窄と呼ばれる。また、生体適合性材料を使用してステントを形成した場合であっても、ステント表面の血栓形成性により、血餅が新しく埋め込まれたステントの内部に形成する場合もある。血管形成術の手順自体の間又はその直後には、強力な抗血小板薬を血液循環中に注入する現行方式により、大きな血餅は形成し得ないが、何らかの血栓症が、ステント表面上に少なくとも顕微鏡レベルでは常に存在し、この血栓症が、ステント表面上に生体適合性のマトリックスを確立することによって、再狭窄の早期の段階において顕著な役割を担うと考えられている。このマトリックス上には続いて、平滑筋細胞が、移入及び増殖することができる。
【0004】
ステントの性質は、持続性であっても、又は一時的であってもよい。生分解性材料から作製される一時的なステントは、特に、第2のステントを最初のステントを留置した部位において若しくはその付近に挿入することが望ましい再発性の血管狭小化の場合、又は前立腺手術後の尿道の閉塞等の身体の管腔の閉塞を引き起こす恐れがある手術後の腫脹の影響を弱めるためにステントが一時的にしか必要でない場合には好都合な場合がある。
【0005】
生体吸収性/生分解性/生体内分解性のステントは、典型的には、生体適合性であり、生物学的手段によって分解される合成ポリマーで作製される。また、ポリマー材料の外側表面が又はその全体積にまで及んで多孔性である生分解性のステントも知られている。例えば、本出願と所有者が共通である特許文献1は、そのようなステントを開示し、参照によって本明細書に明確に組み込まれている。
【0006】
また、API(活性医薬成分)を含有するステントも知られており、これらは、一般に、血栓症又は再狭窄を低減させる又は排除することを意図する。そのようなAPIは、しばしば、耐久性又は生分解性のいずれかであるポリマーマトリックス中に分散又は溶解させ、これを、少なくとも一部のフィラメントの表面上に、被覆として適用する。埋込み後、APIは、ポリマーマトリックスから、好ましくは、周囲組織中に拡散する。
【0007】
平滑筋細胞の増殖を阻害する、したがって、再狭窄を阻害することが具体的に主張されている多様な薬剤が、血管内ステントからの放出のために提案されている。免疫抑制剤であるラパマイシン(シロリムス)は、平滑筋細胞及び内皮細胞の両方の成長を抑制することが報告され、ステント上のポリマー被覆から送達した場合、再狭窄に対して有効性を有することが示されている。(例えば、特許文献2及び特許文献3を参照)。また、特許文献4及び特許文献5も、大環状トリエン免疫抑制化合物であるエベロリムス及び関連化合物を記載し、これは、再狭窄を治療するために提案されている。特許文献6は、キナゾリノン誘導体の使用を記載し;特許文献7及び特許文献8は、パクリタキセル(タキソール)の使用を記載する。特許文献9は、ヘパリン及びラパマイシンの両方の使用を記載する。抗炎症性を有すると考えられる、膜安定化剤であるトラニラストは、特許文献10に開示されている。特許文献11に記載されるように、ポリマーと治療用物質との混合物は、ステント表面上に被覆することができ、次いで、これに、ポリマーの第2の層を被覆する。第1の層は、治療用物質と混合したポリマーを含有することができ、第2の層は、ヘパリンと混合したポリマーを含有することができる。特許文献12中、Shulzeらは、再狭窄を阻害するためのステントを開示し、これは、ステント本体、並びにポリ(D,L−ラクチド)ポリマー及び免疫抑制化合物を含有する生分解性の、薬物を放出する被覆を含む。この免疫抑制化合物は、血管の損傷部位において、時間と共に溶出する。特許文献13は、血管内ステントからのラパマイシン又はその類似体の局所送達を開示し、これは、ステント本体中の小さな微小孔又は経路から直接送達されるか、ステント上に又はステントの支柱より寸法が小さい溝若しくは経路の上に適用したポリマー被覆中に混合して又は結合させて送達されるかのいずれかである。また、特許文献14も、治療用薬物を含有及び溶出させるための多孔性のめっき層の使用を参照する。
【0008】
非金属製のポリマーに基づいたステントは、X線透過性であるために、可視化するのが困難である。ステントの最適な留置には、心臓病専門医がステントをin vivoにおいて追跡することを可能にするリアルタイムの可視化が必要であることから、非金属製のポリマーに基づいたステントのX線不透過性を向上させる必要性がある。ヨウ素化された造影剤が、静脈内X線撮影用染料の一般的な型であり、これは、X線撮影手順の間の血管構造の可視性を増強するヨウ素を含有する。
【0009】
現在のステントの幾何学的形状は、多種多様である。ポリマー管状ステントのブランクは、一般に、射出成型又は押出し成型され、次いで、所望の幾何学的形状又は透かし細工に、打ち抜かれたり、機械加工されたり、又はレーザー切断されたりする。別法として、金属製又はポリマー1枚又は複数枚の薄板を回転させることによって、管状の金属製又はポリマーステントのブランクを形成してもよい。ステントはまた、押出し成型し、組みひも様の構造に織り込まれた、ポリマーフィラメントからなってもよい(特許文献15を参照)。網状又は透かし細工様のステント本体を達成するためには、ステントは、一般に、ジグザグ又は正弦曲線の構造を有することが多く、概して長手方向に通例走る連結要素又は「連結部」によって相互に接続されている、半径方向に拡張可能な管状の要素又は「バンド」を含む。
【0010】
Steinke(特許文献16)は、ロッキングステントを開示し、これは、分解性であり得る。このステントは、金属製又はプラスチック製の1枚又は複数枚の平坦な薄板から形成され、滑り及びロッキングの半径方向の要素又は支柱を担持する。これらの半径方向の要素は、半径方向の要素の一方向性の滑りを可能にする歯止め機構を担持してよい。
【0011】
特許文献17(Killion)は、ステントを所望の直径において選択的にロックする一体に形成されたロッキングアームを有する連続的な円周の管状ステントを開示する。
【0012】
特許文献18(Stenzel)は、複数の相互に接続した細胞を含むステントを開示し、それらの細胞うちの少なくとも1つが、相互にロックすることができる第1及び第2のロッキング部材を有するロッキング可能な細胞である。また、ピン状のロッキング部材を有する、複数の相互に接続したバンドを含むステントも開示され、これらのバンドは、ハサミ状のロッキング部材を有する隣接するバンドに向かって延出する。
【0013】
特許文献19(McGuinness)は、らせん形の立体構造を維持するために、一方の縁部に沿う溝及び他方の縁部に沿うピンを有する、材料の条片を含むステントを開示する。ロッキング機構は開示されていない。
【0014】
特許文献20(Fleming)は、閉鎖型及び開放型の立体構造を有する格子を含むステントを開示する。この格子は、閉鎖型から開放型の立体構造に移行しながら、相互にかみ合うフープ又は支柱からなり、これらのフープは、支柱上の歯の手段によって相互にかみ合う。
【0015】
特許文献21(Jadhav)は、ポリマーのブレンドで作製された生体適合性且つ生分解性のステントを開示する。
【0016】
特許文献22(Khosravi)は、重なってかみ合う縁部を有する円柱状の薄板を含む歯止めステントを開示する。このステントは、生分解性であり得、薬物を放出することもできる。
【0017】
特許文献23及び特許文献24は、骨の修復のための、緩衝化され、再吸収性である、内部固定化のためのポリマー装置を開示する。
【0018】
特許文献25は、ステントの適用に耐え得る合成ポリマーを作製する方法を開示する。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】PCT公開第WO99/07308号
【特許文献2】米国特許第5,288,711号
【特許文献3】米国特許第6,153,252号
【特許文献4】PCT公開第WO97/35575号
【特許文献5】PCT公開第WO2003/090684号
【特許文献6】米国特許第6,159,488号
【特許文献7】米国特許第6,171,609号
【特許文献8】米国特許第5,716,981号
【特許文献9】米国特許第5,288,711号
【特許文献10】米国特許第5,733,327号
【特許文献11】米国特許第6,231,600号
【特許文献12】米国特許第6,939,376号
【特許文献13】米国特許第6,808,536号
【特許文献14】米国特許第6,904,658号
【特許文献15】米国特許第6,368,346号
【特許文献16】米国特許第6,623,521号
【特許文献17】米国特許第6,022,371号
【特許文献18】米国特許第6,540,777号
【特許文献19】米国特許第6,156,062号
【特許文献20】米国特許出願第2004/0249442A1号
【特許文献21】米国特許第6,368,346号
【特許文献22】米国特許第5,441,515号
【特許文献23】米国特許第5,817,328号
【特許文献24】米国特許第6,419,945号
【特許文献25】米国特許第6,932,930号
【発明の概要】
【発明が解決しようとする課題】
【0020】
伝統的な金属製のステントとは異なり、生分解性のステントは、複数のAPIの多量の充填が可能であり、一時的なインプラントである。しかし、生分解性のステントは、通例、不十分な機械的強度及び/又は弾性ポリマーの望ましくない物理的/機械的な反跳に悩まされる。さらに、そのようなステントの分解時間は、制御されておらず、主に、使用するポリマー樹脂の分子量に依存する。本ステント及び方法は、ポリマーの分解速度を調整し、且つ/又は生分解性のステントの作製のために使用するポリマー管又は繊維の機械的強度を増強するための手段を提供する。
【課題を解決するための手段】
【0021】
本ステントは、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;且つ(8)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0022】
代替の実施形態は、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;(8)浸漬被覆及び引き抜きの工程によって形成することにより増強された機械的強度を有する;(9)ポリマーの融解温度未満且つポリマーのガラス転移温度の直ぐ上の低い温度において形成される;且つ(10)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0023】
代替の実施形態は、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;(8)可視性を向上させるための一時的なヨウ素化された造影剤を包含することができる;且つ(9)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0024】
1つの態様では、ステントは、一時的なインプラントである。この一時的なインプラントは、血管壁に対するストレスを減少させ、この場合、特に、若年の患者及び糖尿病患者等の脆弱な患者に対しては、それに続く介入を必要としない。
【0025】
別の態様では、ステントは、ステント本体中に組み込まれた及び/又はポリマー表面上に被覆された治療剤の送達が可能である。
【0026】
本ステントのさらなる態様では、ポリマーの組成、ポリマーの分子量、繊維コードの直径及び処理条件を選択し、それによって、分解速度、薬物放出速度及び機械的支持の期間を制御することによって、適用を変化させること及びステントの分解を制御することが可能である。
【0027】
本ステントの追加の態様では、ステントを介入の手順の間に可視化して追跡することを可能にするX線不透過性が改善されている。
【0028】
本発明のこれら及びその他の態様並びに利点が、好ましい実施形態の以下の詳細な説明を、付随する図面と共に検討することによって、当業者には明らかになるであろう。図面中、複数の図にわたり、同一の番号により、対応する部品を指す。
【図面の簡単な説明】
【0029】
【図1】拡張した繊維製のステントの三次元構造の斜視図である。
【図2】図1の繊維製のステントを側面から眺めた場合の斜視図である。
【図3】図1の繊維製のステントの横断面の側面図である。
【図4】図1の繊維製のステントを拡大した横断面図である。
【図5】管状のステントを製造するための工程の進め方を示す図である。
【図6】山の谷に対向する円周の制限機構を有する拡張した管状のステントの三次元構造の斜視図である。
【図7】図6の管状のステントの側面図である。
【図8】図6の管状のステントを拡大して示す平面図である。
【図9】バルーンカテーテル上に巻き付けた管状のステントの走査像である。
【図10】拡張された状態にある管状のステントの走査像である。
【図11】軸方向にロックする設計を有するステントの平面図である。
【図12】圧縮伸展を比較する棒グラフである。純粋なPLLA製の管(■)及びリン酸塩を含有するPLLA製の管(□)を水にあらかじめ浸漬0カ月及び5カ月後に、圧縮伸展させた(cm(N))場合の平均荷重を測定した。
【図13】PLLA製のステント(#1)、PLLA中の26wt%イオヘキソールで形成したステント(#2)、PLLA中の50wt%イオヘキソールで形成したステント(#3)、及びイオヘキソールで被覆したPLLA製のステント(#4)、並びにガイドカテーテルのX線画像である。
【図14】PLLA製のステント(#1及び#4)、イオヘキソール及びBA9−PLLAで被覆したステントの水への浸漬2分後(#2)及び水への浸漬30秒後(#3)、並びにガイドカテーテルのX線画像である。
【発明を実施するための形態】
【0030】
I.定義
以下の用語は、別段の指定がない限り、本明細書において示す定義を有する。
【0031】
「再狭窄を阻止する」とは、血管の「過剰な」損傷後に観察される再狭窄の程度を低減させることを意味し、これは、ステント留置後の選択された時点、例えば、1〜6カ月における、平均パーセントで示す血管の狭窄の低減によって測定する。
【0032】
「X線を透過させない」は、電磁放射線の通過を阻止する材料を指し、当該材料は、X線下でX線透視によって可視化される。
【0033】
II.ステント
A.材料
本ステントは、1つ又は複数のポリマー又はコポリマーで形成する。実施形態において、且つ以下にさらに記載するように、ステント本体を、フィラメントによって連結された複数の管状部材で形成する。ステント本体は、これらに限定されないが、生体再吸収性、生体吸収性又は生体内分解性をはじめとする、生分解性であり得る生体適合性のポリマーで形成することができる。多様な天然、合成及び生合成のポリマーが、生分解性である。一般に、化学的な連結、とりわけ、酸無水物、エステル又はアミドの結合等を含有するポリマー骨格は、生分解性である(www.sigmaaldrich.com)。分解の機構は、一般に、これらの結合の加水分解又は酵素的切断によるものであり、その結果、ポリマー骨格の分割が生じる。ポリマーの生体内分解は、一般に、少なくとも部分的に水不溶性のポリマーの少なくとも部分的に水溶性のポリマーへの変換によって生じる。ポリマーを治療剤と混合すると、薬物の周囲のポリマーが分解されるにつれて、薬物が放出される。
【0034】
いくつかの実施形態では、ステントは、生分解性のポリマーで形成する。生分解の速度は、これらに限定されないが、結晶化度、材料の分子量、及び(1つ又は複数の)分解部位におけるpH変化を軽減し、加水分解を、溶解経路を介して加速させる生体適合性の緩衝剤の使用をはじめとする、多くの要因によって制御することができる。いくつかの実施形態では、ポリマーステントは、1つ又は複数の治療剤を放出し、これらは、所望の順序及び所望の速度で放出され得る。
【0035】
生分解性材料の使用によって、ステントの組織中での分解及び再吸収並びに/又は細胞による吸収が可能となる。以下に記載するように、そのような材料は、これらに限定されないが、直鎖脂肪族ポリエステル及びグリコリドファミリーのポリマーを包含する。本発明のステントの実施形態のために企図するその他の材料は、生体適合性のポリマー、すなわち、ポリエチレン、ポリエステル及びポリプロピレンのファミリーからの型のもの等、並びに直鎖脂肪族ポリエステルファミリーからのポリマー等のプラスチックを包含する。例示的なポリマーとして、これらに限定されないが、ポリ(乳酸)、ポリ(グリコール酸)若しくはポリカプロラクトン及びそれらの関連のコポリマー、ポリオルトエステル、ポリ酸無水物、ポリジオキサノン及びポリヒドロキシブチレート等の分解性のポリマー、又はそれらの組合せが挙げられる。
【0036】
代表的な生体適合性、吸収性のポリマーとして、ポリ(乳酸)(PLA)、ポリ(L−乳酸)、ポリ(D,L−乳酸)、ポリグリコール酸(PGA)、ポリ(D−乳酸−co−グリコール酸)、ポリ(L−乳酸−co−グリコール酸)、ポリ(D,L−乳酸−co−グリコール酸)、ポリ(ε−カプロラクトン)、ポリ(バレロラクトン)、ポリ(ヒドロキシブチレート)、ポリジオキサノン、ポリ(ヒドロキシルブチレート)、ポリ(ヒドロバレレート)等が挙げられ、コポリマー、具体的には、ポリグラクチン(乳酸とグリコール酸とのコポリマー(PGA−PLA))、ポリグリコネート(トリメチレンカルゴネートとグリコリドとのコポリマー)、ポリグリコール酸とε−カプロラクトンとのコポリマー、ポリ(乳酸)とε−カプロラクトンとのコポリマー、ポリ(乳酸)−ポリ(エチレングリコール)のブロックコポリマー及びポリ(エチレンオキシド)−ポリ(ブチレンテレフタレート)、ポリ(乳酸−co−トリメチレンカーボネート)、ポリ(ε−カプロラクトンコポリマー)、ポリ(L−乳酸コポリマー)等も包含される。生分解性のステントは、単一のポリマー又はコポリマーから作製することができることが理解されるであろう(例えば、米国特許第5,670,161号に記載のL−ラクチドとε−カプロラクトンとのコポリマー、又は米国特許第5,085,629号に記載のL−ラクチドとグリコリドとε−カプロラクトンとのターポリマー)。生分解性のステントはまた、ブレンドされたホモポリマー、具体的には、上記のコポリマーに類似する組成を有するブレンドをはじめとする、米国特許第6,368,346号に記載のものからも形成することができる。ホモポリマー、ブレンドされたポリマー及びコポリマーは、加水分解性の分解に対する様々な感受性をはじめとする、異なる特徴を有することができ、したがって、より迅速又はより緩慢な吸収が望まれる状況下では好ましい場合がある。
【0037】
ポリマーステントの別の際立った利点は、それらが、MRI画像診断に、より適合するという点である。これは、これらのポリマーが、強磁性材料ではないことによる。この特性のおかげで、ポリマーが画像診断の過程の間にシグナルの喪失を引き起こす可能性が低下し、血管の管腔の可視性が維持される。さらに、それに続く解析を、非侵襲的に実施することもできる。
【0038】
ステントは、米国特許第6,368,356号の開示に従って、ステント形成の前に、無毒性のX線を透過させないマーカー、例えば、硫酸バリウム又は三酸化ビスマス等をポリマー中にさらに包含して、ステントのX線不透過性を向上させることができる。好ましい実施形態では、ステントは、約1ミリグラム(+/−20%)の分子の重量及び約0.5から5ミクロンの厚さを有する、無毒性、水溶性のヨウ素化された造影剤の1つ又は複数のX線を透過させない層で被覆される。実施形態では、X線を透過させない被覆は、薄く、生体吸収により一時的なものである。好ましくは、ヨウ素化された造影剤は、身体組織によるより迅速な吸収のために水溶性である。典型的には、造影剤はまた、低い重量モル浸透圧濃度も有して、浸透圧、化学毒性、過敏症及びその他の潜在的に有害な副作用を低下させる。造影剤を組み合せて、同一の層又は別の層中に使用してよいことが理解されるであろう。1つ又は複数の造影剤をステントのポリマー中に包含してよいこと、及び1つ又は複数の異なる又は同一の造影剤をステント上に被覆してよいこともさらに理解されるであろう。別法として、造影剤は、疎水性であってもよい。疎水性の造影剤は、分解又は排泄のより緩慢な速度を必要とする適用例において利用することができる。例が、Kitaguchiに対する米国特許第7008614号に開示されている。
【0039】
以前のステントは、X線不透過性をもたらすために重金属製の被覆を包含している。しかし、これらの被覆は、生分解性のステントが組織によって吸収されても、消失することはない。本X線を透過させない被覆は、持続的で且つ有害な材料をヒトの身体中に導入することのない、一時的なX線不透過性を有する生分解性のステントを生み出す。実施形態では、約2〜3分後には、X線を透過させない材料は、組織中にほとんど又は全く残留しない。
【0040】
生分解性のステントにX線不透過性をもたらすために使用することができる造影剤は、これらに限定されないが、イオパミドール、イオヘキソール、イオプロミド及びイオジキサノールを包含する。これらの薬剤の分子構造は、患者に対する快適性及び心臓病専門医が必要とする可視性の両方をもたらす。一般に、化学構造は、溶解性を増加させ、血液又はその他の血管の構成要素との結合を減少させる親水性領域で隠された疎水性領域からなる。好ましい造影剤は、イオヘキソールである。
【0041】
選択されたX線を透過させない化合物は、ポリマー被覆の内部に包含して、ステント構造の内部に含浸させて、ステントとさらなる被覆との間に挟んで、又はこれらの技法のいずれかを組み合せて、ポリマーステント上に直接被覆することができる。好ましくは、選択されたX線を透過させない化合物は、(1つ又は複数の)生分解性のポリマーの内部に組み込まれる。
【0042】
造影剤が、ステント上に被覆される場合には、造影剤は、実施例3に記載するような、メタノールに基づいた溶媒等の溶媒中の溶液として調製することができる。次いで、溶液を、ステントに、吹き付け等のいずれかの適切な方法を用いて適用する。溶媒を蒸発させると、X線を透過させない材料の薄い被膜が、ステントの少なくとも一部の上に残留する。好ましい実施形態では、ステントの反管腔側の表面が完全に覆われる。得られたステント は、典型的な可視化の技法下ではX線を透過させない。図13(#4)に示すように、イオヘキソールで被覆されたステントは、画像診断で可視化された。
【0043】
ステントの実施形態はまた、(1つ又は複数の)X線を透過させない化合物を、生分解性のポリマーと組み合せる工程も場合によっては包含する。造影剤の層を、吹き付けによる被覆、浸漬被覆、同時押出し成型、圧縮成型、電気めっき、塗装、プラズマ蒸着、スパッタリング、蒸発、イオン注入又は流動床の使用によって適用することができる。好ましい実施形態では、ステントのポリマー骨格に、造影剤を含浸させ、続いて、薬物をその上に上記の工程のうちの1つを使用して適用する。実施例5に記載するように、造影剤を、ポリマーを有する溶液中に、所望の最終の重量まで懸濁させる。図13(#2及び#3)に示すように、含浸させたステントのX線不透過性は、造影剤の重量パーセントの増加と共に増加することが明らかである。代替の実施形態では、反管腔側の表面上において、一時的なヨウ素化された造影剤を、ステントの骨格上の薬物と、薄いポリマー(PLLA又はその他の生分解性のポリマー)との間に挟む。実施例4に記載する例示的な方法では、ポリマーステントを、最初に、造影剤で被覆する。続いて、ステントを、治療剤又はポリマー被覆中の治療剤で被覆する。
【0044】
例示的な実施形態では、ヨウ素化された造影剤の1つの型であるイオヘキソールを、X線を透過させない材料として使用する。実施例5に示すように、イオヘキソールを、ポリ(L−乳酸)(PLLA)製のポリマー中に組み込んだり、ステント上に被覆したりした。これらのステントは、水に対して32秒間及び2分間暴露した後、X線を透過させない状態を維持した。
【0045】
B.活性医薬成分
また、本発明のステントを使用して、1つ又は複数のAPIを送達することもできる。これらの薬剤は、宿主細胞応答に対して所望の効果を有するために、ステントから、所望の順番で且つ制御可能な時期に放出させることができる。種々の型のAPIを、0.1wt%から55wt%までの所望の重量パーセントで、ポリマーの溶液と混合することができる。本ステントは、ポリマーの押出し成型の方法の場合には必要となる極端な熱を用いることなく製造され、したがって、温度感受性のいずれの治療剤についても熱による不活性化の可能性を減少させる。実施形態では、生分解性のポリマーを、多様なAPI又は治療剤のうちの1つ又は複数と混合する。その他の実施形態では、APIは、繊維表面上又は中空繊維の管腔中に単独で堆積させるか、APIを組み合せてステントのポリマー中に混合することができる。X線の透視に関して不透過性の薬剤を、繊維を紡糸する又はステントを組み立てる時に添加することによって、導入した管腔ステントの状況を、従来のX線透視装置を用いて観察できることが理解されるであろう。本ステントと共に用いるのに有用な治療剤の非限定的な例として、抗再狭窄薬、抗増殖薬、免疫抑制化合物、抗血栓形成薬、抗線維性/線維素溶解性の化合物、及び細胞傷害性化合物が挙げられる。好ましい実施形態では、薬剤は、抗再狭窄薬、ラパマイシン(シロリムス)、エベロリムス、パクリタキセル、ゾタロリムス、Biolimus A9(登録商標)、ピメクロリムス及びタクロリムス等の抗増殖薬、ヘパリン/エノキサパリン/低分子量ヘパリン、ヒルジン/ビバリルジン/レピルジン/組換えヒルジン、アプロチニン、クロピドグレル、プラスグレル、アルガトロバン等の抗血栓形成/抗凝固薬、トラニラスト、コルヒチン、ストレプトキナーゼ、二鎖ウロキナーゼ型(tcu−プラスミノーゲン活性化因子、ウロキナーゼ)、組織型プラスミノーゲン活性化因子PA(t−PA)及び一本鎖ウロキナーゼ型PA(scu−プラスミノーゲン活性化因子)等の抗線維性又は線維素溶解性の薬物である。ポリマーが生分解性である場合には、拡散過程による薬物の放出に加えて、APIはまたポリマーが分解又は再吸収される際にも放出され、周囲の組織環境にとって薬剤をより容易に利用可能となすことができる。生分解性のポリマーを、薬物送達の被覆として使用する場合には、例えば、米国特許第6,099,562号、第5,873,904号、第5,342,348号、第5,707,385号、第5,824,048号、第5,527,337号、第5,306,286号及び第6,013,853号に開示されているように、多孔性が、組織の内殖を援助し、ポリマーの分解をより予測可能にし、且つ/又は薬物放出の速度を調節若しくは増強することが、多岐にわたり開示されている。
【0046】
C.機械的強度
本ステントは、ステント、したがって患者に対する構造的な利益を有するのみならず、より少ないポリマー材料を用いたステントの製造もまた可能にする。これは、コスト及び患者の異物に対する暴露の減少の利点をもたらす。増強された機械的強度は、高度に方向付けられたポリマー分子によってもたらされる。
【0047】
以下にさらに記載し、図5に描写するように、管状のステントは、増強された機械的強度を有するポリマーステントを作製するための工程によって形成することができる。この工程は、回転乾燥240及び引き抜き260のステップを包含し、これらのステップはそれぞれ、管のポリマー鎖を半径及び軸の方向に方向付ける。さらに、この工程に関与するステップは、ステントを形成するために通常使用される熱による押出し成型の技術には必要である極度の熱を必要としない。中等度の製造温度は、特に、温度感受性のAPIを生分解性の管状のステント200を介して送達しようとする場合には、利点をもたらす。例えば、ポリマーステントを製造するために通常使用される熱による押出し成型は、ポリマーの融解温度(Tm)超の温度で実施する必要があり、これは、ポリ−L−乳酸のポリマーの場合には、約173℃である。それに対して、本発明の引き抜き260の工程は、ガラス転移温度(Tg)とTmとの間、又はポリ−L−乳酸の場合には、約55℃から60℃で実施され、引き抜き260のステップに先行する製造のステップは、室温で実施される。
【0048】
繊維製のステントの繊維もまた、この工程によって形成することができることが理解されるであろう。別の実施形態では、繊維製のステントの機械的強度は、以下にさらに記載するように繊維の立体構造によって、且つ/又は製造工程によって増強することができる。
【0049】
D.緩衝剤
本発明のステントは、さらに、ステントの再吸収の速度を制御できるように製造することもできる。1つの実施形態では、これは、緩衝剤の塩を添加して、ステントの再吸収の速度を変化させることによって達成される。この実施形態では、ポリマー、したがって、ステントの分解を調整するために、これらに限定されないが、リン酸緩衝剤の塩、クエン酸緩衝剤の塩又はNaCl緩衝剤をはじめとする、1つ又は複数の緩衝剤を、ポリマー溶液中に単独で又は1つ若しくは複数のAPIと併せて充填することができる。理論に限定されることなく、ステントが流体と接触すると、ポリマー中に組み込まれた緩衝剤が、ステントから急速に拡散し、したがって、顕微鏡レベルの孔又は経路を生み出すと考えられている。次いで、水分子が、それらの孔又は経路を通ってステントに浸透することができる。例えば、PLLA製のポリマーの分解は、加水分解によって推進され、水分の含有量の影響を受ける。長い分子の鎖が、乳酸を形成する、多くの単一の分子に分解し、次いで、付近の細胞が乳酸を吸収すると、ポリマーの再吸収が生じる。したがって、ポリマー溶液中に充填した緩衝剤粉末の量を制御することによって、緩衝剤の塩の拡散速度及びステントの再吸収速度が制御可能となる。
【0050】
緩衝剤の塩の濃度は、一般に、ステントの約0.01%から15%までのwt%;好ましくは、0.01%から10%のwt%;より好ましくは、2%から8%のwt%である。実施例1に記載するように、ポリマーステントを、6重量%のリン酸塩と共にPLLAで形成した。図12を参照すると、6wt%でリン酸塩の緩衝剤を有するPLLA製の管状ステントは、緩衝剤を有さないPLLA製の管状ステントと比較して、5カ月において測定した場合、相当により迅速な分解を生じた。
【0051】
E.ステントの幾何学的形状
1.繊維製のステント
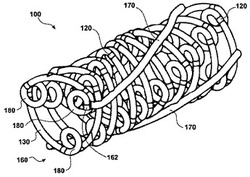
図1は、本発明により1本又は複数本のポリマー繊維から構築した繊維製のステント100を示す。好ましくは、繊維製のステントは、生分解性のポリマー撚り糸、繊維又はコードを「編み込む」ことによって生産した管状部材からなる管腔ステントである。そのような繊維製のステントは、好ましくは、送達カテーテルの遠位末端の付近にあるバルーン形成部分の上に取り付けられた管腔用ステントを含む、管腔用ステントの配置装置から配置される。
【0052】
好ましい実施形態では、繊維は、組織が分解及び再吸収することができる「生分解性の繊維」である。繊維は、中空でなくても、中空であっても、又は中空でないと中空との組合せであってもよい。好ましくは、繊維は、身体への挿入後約1から60カ月以内に、より好ましくは、約3から15カ月後に、さらにより好ましくは、約6から12カ月後に分解する。生分解性の繊維は、上記に記載した生分解性の材料で形成することができる。好ましい実施形態では、ポリマー繊維を、PLLAで形成する。非限定的な実施形態では、これらの繊維は、一般に、直径が約5から約1,000μmのフィラメントの糸である。好ましくは、フィラメントの糸は、これらの繊維からなるステントが、円柱状の形状を容易に維持することができるように十分に固くなるような大きさを有する。単一フィラメントの糸が、本明細書における使用のためには、特に好ましい。好ましい生分解性のポリマーの平均分子量は、約10,000から約800,000DAまでの間である。生分解性のポリマーの選択は、種々の大きさを有する血管の管腔を支持するのに必要な全体的な半径方向の強度に依存し得ることが理解されるであろう。ポリマー繊維は、いずれの適切な手段で形成してもよい。1つの実施形態では、ポリマー繊維を、当技術分野で既知の熱による押出し成型によって形成する。別の実施形態では、繊維を、上記に記載し、図5に図解する方法によって形成する。
【0053】
ステントのポリマー繊維のうちの少なくともいくつかは、上記に記載した1つ又は複数のAPIと混合することができることが理解されるであろう。ポリマー繊維のうちの少なくともいくつかは、1つ又は複数のAPIで被覆することができることもさらに理解されるであろう。
【0054】
いくつかの実施形態では、ステントの作製のために使用するポリマー繊維に、ウコン等の非ステロイド性の抗炎症剤を、単独で又はさらなる(1つ若しくは複数の)APIと組み合せて充填する。ウコンを充填した繊維は、ステントの埋込み部位における炎症を、炎症性細胞の接着を減少させることによって顕著に低減する。含浸させた又は被覆したAPIは、あらかじめ決定した期間にわたり制御して送達される用量に調製することができる。
【0055】
さらに、生分解性のポリマー繊維から生成した繊維製のステントは、あらかじめ決定した期間後には、それが導入されていた部位から完全に分解するという事実を生かすことによって、制癌剤又は抗血栓剤を、病変部位へのこれらの薬剤の高濃度投与のために、繊維中に混合する又は繊維に結合させることができる。
【0056】
本発明の繊維製のステントは、介入の手順の後に、血管の管腔に対して適切な機械的支持を提供する。さらに、繊維製のステントは、制御可能な期間にわたって吸収されることにより、血管壁の慢性的な機械的混乱を回避する。ステントが加水分解され、繊維が内皮化すると、血管壁に対する残余のストレスは排除される。繊維製のステントのAPIは、加水分解の間に制御された様式で放出され、有効濃度が、標的の病変において維持される。
【0057】
繊維製のステントは、バルーンを取り付けたカテーテルによって、血管形成術の部位内へ導入し、そこに留置し、バルーンを拡張すること又は当技術分野で既知のいずれかのその他の方法によって配置することができる。繊維製のステントは、留置後、数週間から数カ月間、通常約2カ月間から約2年間、その形状を保持し、数カ月後、通常約6〜12カ月後に加水分解することができる。ステントは、2年等の長い期間にわたり加水分解することができることが理解されるであろう。
【0058】
繊維製のステントを使用する方法は、構造的な支持、及び場合によっては、身体の管腔の内側への薬物の局所投与を提供することを意図する。1つの実施形態では、この方法は、局在化する血管損傷を被っている又は血管閉塞のリスクを有する患者の再狭窄のリスク及び/又は程度を最小化するように設計される。典型的には、血管損傷は、部分的に閉塞した、冠状又は末梢の血管の動脈等の血管を開く血管形成術の手順の間に生じる。血管形成術の手順においては、バルーンカテーテルを、閉塞部位に留置し、遠位のバルーンを、1回又は複数回膨張及び収縮させて、閉塞した血管を強制的に開かせる。この血管の拡張、特に、プラークを取り除くことができる血管壁における表面の外傷が関与する場合には、しばしば、十分な量の局在化する損傷が生じるので、血管が、時間をかけて、炎症、正の再構築に至る平滑筋細胞の増殖、及び再閉塞によって応答する。当然のことながら、再狭窄として知られる、この過程の発生又は重症度は、血管形成術の手順によって生じた血管の伸展及び損傷の程度に関係があることが多い。特に、過剰な伸展が35%以上の場合には、再狭窄が、高い頻度で発生し、しばしば、相当な重症度、すなわち、血管の閉塞を伴うこともある。
【0059】
繊維製のステントは、典型的には、収縮した状態で、典型的には、カテーテルの遠位末端において、カテーテルの管腔の内側に置かれる、又は遠位末端のバルーン上で収縮した状態で置かれるのいずれかである。次いで、遠位のカテーテルの末端が、損傷部位又は潜在的な閉塞の部位まで導かれ、カテーテルから、例えば、トリップワイヤーを使用することによって放出されて、ステントを当該部位内に放出し、ステントは、血管壁に接触するまで、それ自体で拡張するか、バルーン上のステントであれば、バルーンの膨張によって拡張されて、実質的に、当該ステントは当該部位において組織の壁の中に埋め込まれる。
【0060】
図1〜4は、例示的な繊維製のステントを示す。ここで、図1を参照すると、繊維製のステント100は、ぐるぐる巻かれた繊維材料を含む。上記に記載したように、繊維材料は、ポリマー繊維又は複数のポリマー繊維からなる層である。好ましくは、ポリマーは、PLLAを含む。PLLAが生分解性であることから、繊維製のステントを構築するためのPLLAの使用は好都合である。繊維製のステントの分解機構は、一般に、エステル結合における加水分解によるものである。分解は、いくつかの要因、具体的には、ポリマーの分子量及び利用する緩衝剤の型に依存して、約3カ月から約3年の期間にわたり生じ得る。また、PLLAは、ステントの埋込み部位における組織の局所治療のために、薬物又はその他の治療剤を含浸させる及び/又はそれらで被覆することができることからも、好都合である。その他の生分解性のポリマーも、PLLAについて記載したような利点を有することが理解されるであろう。
【0061】
繊維材料を、ぐるぐる巻きにして、少なくとも1つの大きな中心ローブ160を形成し、この中心ローブは、複数の周辺ローブ180を、大きな中心ローブ160及び周辺ローブ180間に配置した接続セグメント130の内部にさらに含む。好ましい実施形態では、複数の周辺ローブは、1つの中心ローブ当たり、少なくとも3つの周辺ローブを含む。代替の立体構造では、周辺ローブ180は、大きな中心ローブ160の反管腔側上に配置することができる(図示せず)。恣意的なバンド120が、周辺ローブ180のそれぞれの推定上の始点及び終点を画定する。大きな中心ローブ160は、繊維製のステント100の上位構造を形成する。少なくとも3つの長手方向ロッド170を、大きな中心ローブ160の反管腔側表面上に、好ましくは、粘性のPLLA−クロロホルム溶液を使用して結合させる。長手方向ロッド170は、大きな中心ローブ160及び周辺ローブ180と同一の材料からなってよい。図1に示す実施形態では、ステントは、9個の中心ローブ160を含み、この中心ローブ160は、接続バンド130によって連結している3つの周辺ローブ180で形成される。周辺ローブを、中心ローブの管腔側上に配置する。ステントは、繊維製のステントの反管腔側表面上に配置した、少なくとも1つの長手方向又は補強用のロッド170をさらに含む。好ましくは、2つ以上の長手方向ロッドを、繊維製のステントの反管腔側表面上に配置する。より好ましくは、3つ以上の長手方向ロッドを、繊維製のステントの反管腔側表面上に配置する。長手方向は、中心ローブのうちの1つ又は複数に、ステントに沿った複数の点において結合させることができる。図に示すように、中心ローブは、ほぼ同一の大きさであり、間隔を置いて連続して配列させて、ステントの長手方向の軸を画定する。各中心ローブは、先端162及び終端(図示せず)を有する。最初及び最後の中心ローブ以外は、各中心ローブの終端は、次に連続する中心ローブの先端に接続している。ステントは、連続した繊維で形成することができ、各中心ローブの終端が、次に連続する中心ローブの先端に連続してつながることが理解されるであろう。図にさらに示すように、周辺ローブは、中心ローブの円周の周りで、規則的又は実質的に規則的に隔たってよい。別の実施形態では、周辺ローブは、中心ローブの円周の周りで、不規則的に隔たってよい(図示せず)。複数の周辺ローブは、中心ローブの先端に続く、先端に存在する周辺ローブ、及び中心ローブの終端に先行する、終端に存在する周辺ローブをさらに包含する。1つ又は複数の追加の周辺ローブが、先端に存在する周辺ローブと、終端に存在する周辺ローブとの間にさらに位置してもよい。好ましくは、先端に存在する周辺ローブは、中心ローブの先端に隣接し、終端に存在する周辺ローブは、中心ローブの終端に隣接する。
【0062】
図2〜4は、代替の実施形態の多層型の繊維製のステント110を図解し、大きな中心ローブ161、周辺ローブ181、及び長手方向ロッド171が、複数層の繊維材料を含んでよい。例えば、大きな中心ローブ161及び周辺ローブ181は、二層繊維材料又は三層以上の材料から形成することができ、少なくとも3つの長手方向ロッド171のそれぞれは、追加の剛性のために、三層繊維材料から形成することができる。さらに、多層型の繊維製のステント110は、埋込み後の放出のためのAPIの保管が可能である中空の管腔150を有してよい。
【0063】
また、一例として、好ましい実施形態の長さは、18mmであり、最初の直径は、1.9mmである。この実施形態では、バルーン拡張後の最終的な直径は、好ましくは、約3.25mmである。好ましくは、ステントの長さは、約8mmから約30mmまでである。いくつかの実施形態では、ステントの長さは、最長約60mmである。典型的な冠状動脈の直径は、約2mmから約4mmまでであり、冠状動脈ステントの拡張された直径は、一般に、適切な寸法を有する。その他の身体の管腔は、最大約1cmの直径を有し、これらの管腔のためのステントは、適切な拡張された直径を有することができることが理解されるであろう。繊維製のステント110の長さは、大きな中心ローブ161及び周辺ローブ181の数を増加させることによって増加させることができる。周辺ローブ181及び大きな中心ローブ181の直径を調整して、ステントの最終的な直径を設定することができる。例えば、市販の冠状動脈ステントは、2〜5mmの範囲の最終的な拡張された直径を有する。ステントは、管腔及び/又は適用に適した大きさを有することができることが理解されるであろう。
【0064】
本発明を実行するには、ステントを、ステントの中心ローブが畳まれた、小さな直径の状態である、収縮した状態とする。ステントは、典型的には、カテーテルの遠位末端において、カテーテルの管腔の内側にある、又は遠位末端のバルーン上で収縮した状態にあるのいずれかである。次いで、遠位のカテーテルの末端が、損傷部位又は潜在的な閉塞の部位まで導かれ、カテーテルから、例えば、トリップワイヤーを使用することによって放出されて、ステントを当該部位内に放出し、ステントは、血管壁に接触するまで、それ自体で拡張するか、バルーン上のステントであれば、バルーンの膨張によって拡張されて、実質的に、当該ステントは当該部位において組織の壁の中に埋め込まれる。
【0065】
ステントは、当該部位に配置されると、活性化合物を、細胞中に放出し始めて、当該の血管部位を内張りする細胞の増殖を阻害する。
【0066】
2.管状のステント
別の実施形態では、ステントは、生分解性のポリマー管状ステントである。典型的には、ステントを、図5に図解する工程によって、円柱状の薄板状に形成する。図柄は、約310nm未満の波長を有するエキシマレーザー技術を使用して、管からレーザー切断する280ことができる。
【0067】
生分解性のポリマー管を、心棒210上に、一層ずつ築く。典型的には、心棒は、Teflon(登録商標)製の心棒又はTeflon(登録商標)で被覆した金属製の心棒である。ステントの形状を支持するその他の心棒又は構造も使用できることが理解されるであろう。生分解性のポリマーの溶液220を、生分解性のポリマー樹脂を、(これらに限定されないが)クロロホルム又はジオキサン等の適切な溶媒中に溶解することによって作製する。溶液の粘度は、一般に、約1から約2000センチポアズ;好ましくは、約10から約500センチポアズである。
【0068】
リン酸緩衝剤又はクエン酸緩衝剤の塩等の緩衝剤を、ポリマー溶液中に単独で又は1つ若しくは複数のAPIと併せて充填することができる。これらに限定されないが、リンゲル液及び乳酸をはじめとする、その他の生体適合性の緩衝剤の塩も、医療技術の当業者であれば、容易に思い当たる。
【0069】
管状のステントを、心棒を生分解性のポリマー溶液中にポリマー被覆が所望の厚さになるまで1回又は複数回浸漬被覆する230ことによって形成する。浸漬230被覆のスピードは、一般に、約1ミリメートル/分から約10メートル/分までの範囲に及ぶ。典型的なスピードの範囲は、1メートル/分から5メートル/分までである。次いで、被覆した心棒を、乾燥させる240。好ましくは、被覆した心棒を、層流フード中で、心棒の長手方向の軸の周りに回転させて乾燥し240、溶媒を蒸発させて、薄いポリマーの層を残留させる。回転乾燥240のスピードは、約1から約100,000rpmであってよく、典型的な範囲は、約100から約4000rpmである。回転乾燥240のステップは、ポリマー管の半径方向の強度を、円周方向に増強する。乾燥ステップ240における回転の方向は、一方向で繰り返してもよいし、又は方向を、例えば、時計回り方向から反時計回り方向へ交互に変化させてもよい。次いで、このポリマーの層を、溶媒研磨し250、1回又は複数回乾燥させ240、後に薄く且つ平滑なポリマー管を残留させる(図示せず)。好ましくは、溶媒研磨250は、純粋な溶媒を使用し、これは、ポリマー溶液220を調製するために使用した溶媒と同一であっても、又はそれとは異なってもよい。典型的な溶媒は、クロロホルムである。浸漬230被覆、回転乾燥240、及び溶媒研磨250を包含する全サイクルは、好ましくは、室温又は室温付近(10℃から30℃まで)において実施する。しかし、約−20℃から80℃までの温度範囲が可能であることが理解されるであろう。管の厚さを所望の厚さ、例えば、0.0875ミリメートルから1.25ミリメートルに達するまで増加させるために、浸漬、乾燥及び研磨のサイクルを繰り返すのが好ましい。1つの実施形態では、サイクルを、少なくとも約46層のポリマーを重ねるまで繰り返して、完全な管を形成する。上記に記載したように、種々のサイクルは、同等のポリマー溶液220を用いて実施する必要はない。ポリマー、緩衝剤及び/又はAPIは、その性質及び濃度を、上記で説明したように、逐次的な浸漬230被覆を用いて、層毎に変化させることができる。
【0070】
ポリマー管は、引き抜き260及び焼きなまし270の工程によって機械的によりさらに強化することができる。引き抜き260の処理においては、管を、引き抜き用のダイスを通して引き出す(図示せず)と、管の外径の厚さが減少し、一方、内径は一定に留まる。この引き抜き260の工程は、ポリマーの分子を長手方向の軸に沿って整列させることによって、管の軸方向の強度を増強する。引き抜き260の工程は、ポリマーのガラス転移温度Tg超且つポリマーの融解温度Tm未満の温度において実施する。例えば、ポリL−乳酸の場合の引き抜きの温度は、約55℃から60℃である。次いで、引き抜いた管が引き抜き用のダイスから出たら、引き抜いた管の表面上に空気を吹き付けることによって、引き抜いた管を焼きなます270。引き抜き260及び焼きなまし270は、所望の管の外径を達成するまで繰り返すことができる。
【0071】
引き抜き260のステップにおいて引き下げた面積比が、強化の効果に影響を及ばすことが理解されるであろう。引き下げた面積比は、約1.01から約20.00、好ましくは、3.5から6.0であってよい。引き下げた面積比は、以下のように計算する:
Xは、引き抜き前の、ポリマーで被覆した心棒の直径であり、
Yは、心棒の直径であり;
Zは、引き抜き後の、ポリマーで被覆した心棒の直径である。
【化1】

【0072】
引き抜き260に続いて、管を、典型的には、純粋な不活性ガスを用いて焼きなます270。適切な不活性ガスは、これらに限定されないが、窒素、アルゴン、ネオン、ヘリウム又はその他の希ガスを包含する。また、焼きなまし270によっても、機械的強度がポリマーの結晶化度を増加させることによって向上し、さらに、加水分解のための水の接近も調節される。
【0073】
この方法によって形成した管状のステントは、従来の熱により押出し成型した管状のステントと比較して、顕著に増強された機械的強度を有した。破損時の最大荷重は、壁の厚さ0.007’’を有する熱により押出し成型したポリ(L−乳酸)(PLLA)の管の場合、46.33±1.66NTであった。本方法によって作製した同一の仕様の管は、153.13±1.66NTの最大荷重を有した。
【0074】
一般に、管状のステントの強度は、加水分解を開始すると低下する。例えば、PLLAは、加水分解速度が速まると弱まる。実施例1に記載する圧縮伸展比較試験において、リン酸塩を含有するPLLA及び純粋なPLLA製の試料を、最初に水に5カ月間浸漬し、半径方向の強度について試験した。図12は、分解させたリン酸塩を含有するPLLA製の管は、分解させた純粋なPLLA製の管よりも49.8%弱かったことを示している。図12は、リン酸塩含有PLLA製の管は、半径方向の強度の喪失を加速させる、より迅速な加水分解を受けることを示している。
【0075】
代替の実施形態では、増強された機械的強度を有するポリマー管状ステントを作製する方法は、浸漬被覆の工程230を繰り返すステップと、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度においてポリマー管を引き抜く260ステップと、ポリマー管を焼きなます270ステップと、エキシマレーザーでポリマー管から所望の図柄のステントを切断し、拡張した場合の円周の制限を形成するための最終的な切断280のステップとを包含する。
【0076】
図8に示すように、本発明のポリマー管状ステント300は、正弦曲線形の支柱バンド320及び円周制限バンド330を含む。隣接したバンドは、固定された軸方向の連結部340又は柔軟性のある軸方向の連結部350のいずれかによって接続されている。図9に示すように、2つの隣接した半径方向に拡張可能な円周制限バンド330は、それらのそれぞれの谷において、柔軟性のある軸方向の連結部350により連結されて一体になっている。正弦曲線形の支柱バンド320は、円周制限バンド330に、それらのそれぞれの山において、固定された軸方向の連結部340を介して連結されている。正弦曲線形の支柱バンドは、少なくとも1つのピークと谷とをステントの円周の周りに有する実質的に正弦波形を有する構造を含む。好ましくは、正弦曲線形の支柱バンドは、2つ以上のピークと谷とをステントの円周の周りに包含する。ポリマー管状ステント300が拡張されていない状態から拡張された状態まで拡張する間に、半径方向に拡張可能な円周制限バンド330は、外側に真直ぐに伸びて、半径方向の増加を補整する。図10に示すように、半径方向に拡張可能な円周制限バンド330は、外側に真直ぐに伸びて、血管の管腔に接触する完全なフープを形成する。半径方向に拡張可能な円周制限バンド330が、外側に真直ぐに伸びると、拡張された状態のポリマー管状ステント300をロックする。本発明のポリマー管状ステント300は、1つの円周当たりわずか4つのピークを有してよく、したがって、各バンド330の結び目340の半径を増加させること、又は12個以上もの数のピークによって、より大きな血管の管腔に適応する。バンド330上のピーク340の数を調整して、特に、配置の間における機械的ストレス及びバンド内の緊張のレベルを低減させることができる。
【0077】
別の実施形態では、ステントは、1つ又は複数の半径方向に拡張可能な管状の要素を含む1つ又は複数の強度モジュールを含む。好ましくは、半径方向に拡張可能な管状の要素は、少なくとも1つの山のピークと山の谷との実質的に正弦波形を有する構造を含む。1つの実施形態では拡張可能な管状の要素は、4つ以下の山のピークを有する。強度モジュールは、(1つ又は複数の)強度モジュールに柔軟性を添加する、1つ又は複数の軸方向の連結要素によって相互に接続されている。強度モジュールは、拡張可能な管状の要素の山の谷に対向する、少なくとも2つの円周制限バンドをさらに有する。実施形態では、円周制限バンドの長さが、ステントを拡張した場合のステントの大きさを画定する。この実施形態では、各円周制限バンドの長さは、拡張可能な管状の要素の長さより短い。
【0078】
代替の実施形態は、図11に示す弾性のポリマーで作製したバイオロック型のポリマーステント400を含む。ポリマーステント400は、長い固定された連結部450、短い固定された連結部451及びばね製のコネクタ452によって相互に接続されている、1つ又は複数の半径方向に拡張可能なバンド405、406で作り上げた管状の構造で作り上げられ、それによってポリマーステント400が、拡張されていな直径から少なくとも1つの拡張された直径まで半径方向に拡張可能であり、軸方向のペグ410等の第1のロッキング部材及び軸方向の受器420等の第2のロッキング部材で作り上げられたロッキング機構を有する。軸方向のペグ410は、バンド406の谷430から突出し、バンド405の谷440に結合している軸方向の受器420に対向する。ステントが、その拡張されていない状態から拡張された状態まで拡張すると、軸方向のペグ410が、軸方向の受器420に接触し、係合して、ステントをその拡張された直径にロックする。ポリマーステント400が拡張されていない直径の状態である場合には、ロッキング機構は係号せず、管状構造が拡張された直径の状態である場合には、ロッキング機構は係号する。ばね製のコネクタ452は、軸方向のペグ410と軸方向の受器420との対間に配置されて、半径方向の柔軟性を増加させる。
【0079】
ポリマーステント400が、複数の拡張された直径にロック可能である実施形態もあれば、ロッキングが可逆的である実施形態もある。1つの実施形態では、軸方向のペグは、軸方向の受器の内部にはまるような寸法を有する歯又はとげを包含する。軸方向の受器は、軸方向のペグのとげを収容し、軸方向のペグを適所に保持するための1つ又は複数の位置を有する形状をさらに有してもよい。この様式の場合、ステントを、拡張させ、1つ又は複数の位置においてロックすることができる。ステントを、最初は、第1の位置にロックし、次いで、第2又はいずれかの数の位置(複数の位置)にさらに拡張させることができることが理解されるであろう。したがって、ステントを、さらに拡張させ、軸方向のペグと軸方向の受器とをロックすることによって適所にロックすることができる。ポリマーステント400は、力の共有の増加により、半径方向の強度を増加させている。半径方向の力は、ステントの支柱の円周方向の強度のみによるのではなく、ロッキング機構中の軸方向のペグ410と軸方向の受器420との接触面において共有されてもいる。
【0080】
管状のステントはまた、ポリマー管及びその結果としてステントの再吸収速度を制御するための機構も包含することができる。緩衝剤の粉末を、ポリマー溶液中に組み込むことができ、次いで、これを、管状のステントを形成するために使用する。これらの緩衝剤は、流体に接触すると、管状のステントから急速に拡散し、それによって、顕微鏡レベルの孔を生み出す。次いで、水分子が、これらの孔を通って管状のステントに浸透することができる。PLLA製のポリマーの分解は、加水分解によって推進され、水分の含有量の影響を受ける。長い分子の鎖が、乳酸を形成する、多くの単一の分子に分解し、次いで、付近の細胞が乳酸を吸収すると、ポリマーの再吸収が生じる。したがって、ポリマー溶液中に充填した緩衝剤粉末の量を制御することによって、緩衝剤の塩の拡散速度及び管状のステントの再吸収速度が制御可能となる。
【0081】
管状のステントの実施形態はまた、管の合成時に、複数のAPI又は異なる濃度の単一のAPIを層状にして、ポリマー管に充填するための工程も場合によっては包含する。さらに、異なるAPIをステントの異なる層の内部に提供することが好ましい場合もある。例えば、免疫抑制剤又は抗再狭窄剤をステントの外側又は側面の1つ又は複数の層中に、抗炎症剤をステントの挟まれた1つ又は複数の層中に、且つ抗血栓形成剤をステントの中央(内部)の1つ又は複数の層に提供することができる。これは、(ステントになる)ポリマー管の種々の層を浸漬被覆によって積み重ねる際に、ポリマー中の薬物の内容を変化させることによって達成される。API、緩衝剤及びポリマーの順番を調整することによって、放出の動態の時期及び期間を加減することができる。さらに、上記で言及したように、ポリマー管状のステントのための製造工程は、中等度の温度において実施され、これにより、熱により押出し成型するポリマーを用いて可能となる範囲よりもはるかに広い範囲のAPIの使用が可能になる。
【0082】
本発明を、具体的な実施形態及び適用例に関して説明してきたが、種々の変更形態及び改変形態を、本発明から逸脱することなく作製することができることが理解されるであろう。以下の実施例によって、本明細書におけるステントの発明を作製及び使用する種々の態様を例証する。これらには、本発明の範囲を制限する意図はない。
【実施例】
【0083】
材料及び方法
イオヘキソールは、Amersham(製品番号:0407−1414−80)から購入した。
メタノールは、EMD(製品番号:MX0488)から購入した。
ホスファチジルコリンは、Sigma−Aldrich(PN P3556、20mg)から購入した。
【0084】
X線画像を、OEC Model 9600 ESP C−ARM 60Hzを用いて、MAG2の倍率設定で撮影した。
【0085】
(実施例1)
生分解性のポリマー管の調製
生分解性のポリマー管を、心棒上に、CCl3H(クロロホルム)中の12%のwt%のPLLAの生分解性のポリマー溶液中に浸漬することによって一層ずつ積み重ねた。心棒は、PLLA溶液中に、約0.1メートル/秒の速度で46回浸漬した。
【0086】
次いで、被覆した心棒を、流層フード中で、長手方向の軸の周りに回転させて乾燥し、溶媒を蒸発させて、薄いポリマーの層を残留させた。乾燥のステップにおいて、回転を繰り返した。得られたポリマー管は、約0.2mmの厚さを有し、リン酸塩緩衝剤は、6重量%であった。次いで、このポリマーの層を、クロロホルム又はポリマーを溶解及び乾燥させた純粋な溶媒を用いて溶媒研磨すると、後に薄く且つ平滑なポリマー管が残留した。
【0087】
管状のステントの外径の厚さを、管状のステントを引き抜き用のダイスを通して引き出すことによって減少させ、一方、ステントの内径は一定に留めた。
【0088】
引き抜きに続いて、管を、純粋な不活性窒素を用いて焼きなました。
【0089】
圧縮時における平均荷重を、水中への浸漬の前及び5カ月後に測定した。これは、Instron(Norwood、マサチューセッツ州)の力の送達/測定のシステム上で実施する半径方向の力の試験によって測定した。緩衝剤を有するステント及び緩衝剤を有しないステントについての圧縮時の平均荷重を試験した結果を、図12に示す。
【0090】
(実施例2)
ステントの図柄及び作製
ステントのパターンを、CADソフトウエアを使用して設計した。平面設計図及び未切断の生分解性のポリマー管をレーザー切断のためにレーザー作業所に送った。Resonetics(Nashua、ニューハンプシャー州)、及びSpectralytics(Dassel、ミネソタ州)等のいくつかのレーザー切断施設が、一般向けに利用可能である。ステントの図柄を、生分解性のポリマー管状ステントから、310nm未満の波長を有するエキシマレーザーを用いて切断した。
【0091】
当業者であれば、開示した実施形態又はその変形形態中の考案のステントは、従来のステントを上回る機械的及び治療上の利点を提供することを理解するであろう。さらに、熟練した開業医には、本発明の上記の説明を検討すれば、好都合な治療が自ずと明らかになるであろう。考案のステントが生分解性のポリマーからなるという性質のおかげで、同一の血管部位を、必要であれば、その後の時点で再度治療することができ、これには、患者の成長の間の段階的な手順が包含される。同様に、大きさが変化する組織の継続的な治療も、開示したステントを用いて促進することができる。また、考案のステントは、診断の目的で又は隣接した組織の治療的処置のために、健常な組織の部位に埋め込むことができることにも注目されたい。
【0092】
(実施例3)
ヨウ素化された造影剤を用いたX線を透過させないステント
長さ0.8〜1.2cmのPLLAのポリマー製ステントを使用し、この場合、PLLA製の繊維の直径は、0.01905cmであり、繊維の長さは、15〜22cmであった。イオヘキソールを、メタノール中に溶解させ、350mg/mLの濃度を得た。次いで、純粋なイオヘキソール溶液を、PLLA製のステントの上層上に吹き付け、約0.01’’の被覆の厚さを得た。全てのステント試料上の測定した用量は、1000μm/ステントであった。メタノールを蒸発させると、ステントの反管腔側表面が、イオヘキソールにより完全に覆われていた。被覆したステントのX線不透過性を、30秒間水に暴露させた後にc−arm下で観察した結果を、図13(#4)に示す。また、純粋なPLLAで形成した対照のステントのX線不透過性も試験した(#1)。
【0093】
(実施例4)
X線不透過性を生み出すために、ヨウ素化された造影剤による被覆の上にBA9−PLLA被覆用溶液を有するステント
PLLA製の繊維の直径が、0.01905cmであり、繊維の長さが、15〜22cmである、長さ0.8〜1.2cmのPLLAのポリマー製ステントを、イオヘキソールを用いて被覆した。ステントの特徴を、表1に示す。
【表1】

【0094】
最初に、イオヘキソールを、メタノール中に溶解させ、350mg/mLの濃度を得た。次いで、純粋なイオヘキソール溶液を、PLLA製のステントの上に吹き付け被覆した。全てのステント試料上の測定した用量は、1000μm/ステントであった。BAS−PLLA被覆用溶液をイオヘキソールの被覆の上に吹き付けて、反管腔側表面を完全に覆った。次いで、被覆したステントを、水中に30秒間又は2分間浸漬した後に観察した。
【表2】

【0095】
水に30秒間、2分間暴露した場合の被覆したステント、及び純粋なPLLAで形成した2つの対照のステントのX線不透過性を試験し、図14に示す。
【0096】
(実施例5)
X線不透過性を生み出すために、ステントにヨウ素化された造影剤を含浸させる
ステントのPLLA製の骨格に、造影剤を含浸させた。イオヘキソールの細かい粉末を、PLLA−クロロホルム溶液中に懸濁させ、イオヘキソールの26又は50重量パーセントの最終重量を得た。ステントのX線不透過性を、30秒間水に暴露させた後にc−arm下で観察した結果を、図13(#2及び#3)に示す。また、純粋なPLLAで形成した対照のステントのX線不透過性も試験した(#1)。図に示すように、X線不透過性は、イオヘキソールの重量パーセントの増加と共に増加した。
【0097】
好ましい実施形態を説明及び図解してきたが、付随する特許請求の範囲によって定義する本発明の精神及び範囲から逸脱することなく、種々の変更形態、置換形態及び代替形態を作製することができることを理解されたい。
【0098】
(実施例6)
疎水性のイオヘキソールによる被覆
A.ホスファチジルコリン−イオヘキソールのリポソームの調製
ホスファチジルコリン(PC,Sigma−Aldrichから入手可能、製品番号:P3556、20mg)を、長く伸びた首を有する50mlの丸底フラスコ中で10mLのクロロホルム中に溶解させ、次いで、クロロホルムを、回転式蒸発装置によって減圧下で除去する。次いで、系を、窒素を用いてパージし、PCをクロロホルム中に再度溶解させて、溶媒相を形成する。
【0099】
次いで、水相(1mLの蒸留水中の50mgのイオヘキソール)を添加し、系を、窒素下に引き続き保ち、得られた二相系を、浴型の超音波処理器(Bransonic Ultrasonic Cleaner、1510R−MTH)中で、混合液が、超音波処理後少なくとも30分間は分離しない清澄な一相性の分散系又は均一な乳白色の分散系のいずれかになるまで短時(2〜5分)間超音波処理する。超音波処理の温度は、20〜25℃である。次いで、混合液を回転式蒸発装置上に置き、減圧(水による吸引)下、20〜25℃、約200rpmで回転させて、クロロホルムを除去する。
【0100】
クロロホルムを蒸発させる間に、この系は、通常泡立つ。大部分の溶媒が除去されると、材料は、最初に粘性のゲルを形成し、続いて(5〜10分以内に)水性の懸濁液になる。この時点で、(必ずしも必要とは限らないが)過剰の水を加えてよく、懸濁液を、20℃で15分さらに蒸発させて、微量の溶媒を除去する。次いで、調製物を、遠心分離して、被包されていないイオヘキソール及び残余のクロロホルムを除去する。最後に、PC−イオヘキソールのリポソームを、450℃で少なくとも30分間維持して、水を完全に除去する。1mgのPC当たり1.7〜2.5mgのイオヘキソールとなると推定される。
【0101】
B.生分解性のステント上へのPC−イオヘキソールの拭き付け被覆
PC−イオヘキソールのリポソーム(10mg)を、(3mlの)エチレンアセテート中に懸濁し、30分間超音波処理する。次いで、この溶液を、ステント上に拭き付け被覆する。拭き付け被覆の工程を、最終的な被覆重量が1つのステント当たり1.5mgに達するまで続ける。次いで、ステントを、48時間真空乾燥して、エチレンアセテートを除去する。
【0102】
参考文献: 「逆相蒸発法(Reverse phase evaporation method)」、Henzeら、「コンピュータ断層撮影による、限局性の肝臓疾患の可視化の改善のためのX線を透過させないリポソーム(Radio−opaque liposomes for the improved visualization of focal liver disease by computerized tomography)」、Comput Med Imaging Graph. 1989 Nov−Dec;13(6):455−62.
【技術分野】
【0001】
本出願は、X線不透過性を有する生分解性のポリマーステント並びにそのようなステントを作製する方法及びその使用に関する。
【背景技術】
【0002】
ステントは、内部補綴インプラントであり、一般的に、形状は管状であり、典型的には、身体構造内の管腔中に挿入して、管腔に機械的な支持を提供し、前記管腔の内部に流路を維持又は再度確立するために拡張可能である、開放型又は格子状の管状構造を有する。ステントは、大動脈、頚動脈、又は1つ若しくは複数の冠状動脈等の血管中で使用して、例えば、動脈の封鎖又は動脈瘤を治療することで知られている。さらに、ステントは、血管以外の身体の管腔又は経路の開存性を維持する場合にも使用されることで知られている。これらは、胆道ステント、尿道ステント及びその他を包含する。例として、血管内ステントを、血管形成術の間に血管内に挿入することができ、これは、血管形成術によって衰弱又は損傷してしまった血管の早期の崩壊を阻止するように設計されている。血管内ステントの挿入により、血管の負の再構築が低減し、一方、損傷した血管壁の治癒が数カ月かけて進行することが示されている。
【0003】
治癒の過程の間に、血管形成術によって生じた炎症及びステントの埋込みによる損傷が、しばしば、ステントの内部における平滑筋細胞の増殖及び再成長を引き起こし、その結果、流路を部分的に閉鎖し、それによって、血管形成術/ステント挿入の手順の有益な効果を、低下させ又は排除する。この過程は、再狭窄と呼ばれる。また、生体適合性材料を使用してステントを形成した場合であっても、ステント表面の血栓形成性により、血餅が新しく埋め込まれたステントの内部に形成する場合もある。血管形成術の手順自体の間又はその直後には、強力な抗血小板薬を血液循環中に注入する現行方式により、大きな血餅は形成し得ないが、何らかの血栓症が、ステント表面上に少なくとも顕微鏡レベルでは常に存在し、この血栓症が、ステント表面上に生体適合性のマトリックスを確立することによって、再狭窄の早期の段階において顕著な役割を担うと考えられている。このマトリックス上には続いて、平滑筋細胞が、移入及び増殖することができる。
【0004】
ステントの性質は、持続性であっても、又は一時的であってもよい。生分解性材料から作製される一時的なステントは、特に、第2のステントを最初のステントを留置した部位において若しくはその付近に挿入することが望ましい再発性の血管狭小化の場合、又は前立腺手術後の尿道の閉塞等の身体の管腔の閉塞を引き起こす恐れがある手術後の腫脹の影響を弱めるためにステントが一時的にしか必要でない場合には好都合な場合がある。
【0005】
生体吸収性/生分解性/生体内分解性のステントは、典型的には、生体適合性であり、生物学的手段によって分解される合成ポリマーで作製される。また、ポリマー材料の外側表面が又はその全体積にまで及んで多孔性である生分解性のステントも知られている。例えば、本出願と所有者が共通である特許文献1は、そのようなステントを開示し、参照によって本明細書に明確に組み込まれている。
【0006】
また、API(活性医薬成分)を含有するステントも知られており、これらは、一般に、血栓症又は再狭窄を低減させる又は排除することを意図する。そのようなAPIは、しばしば、耐久性又は生分解性のいずれかであるポリマーマトリックス中に分散又は溶解させ、これを、少なくとも一部のフィラメントの表面上に、被覆として適用する。埋込み後、APIは、ポリマーマトリックスから、好ましくは、周囲組織中に拡散する。
【0007】
平滑筋細胞の増殖を阻害する、したがって、再狭窄を阻害することが具体的に主張されている多様な薬剤が、血管内ステントからの放出のために提案されている。免疫抑制剤であるラパマイシン(シロリムス)は、平滑筋細胞及び内皮細胞の両方の成長を抑制することが報告され、ステント上のポリマー被覆から送達した場合、再狭窄に対して有効性を有することが示されている。(例えば、特許文献2及び特許文献3を参照)。また、特許文献4及び特許文献5も、大環状トリエン免疫抑制化合物であるエベロリムス及び関連化合物を記載し、これは、再狭窄を治療するために提案されている。特許文献6は、キナゾリノン誘導体の使用を記載し;特許文献7及び特許文献8は、パクリタキセル(タキソール)の使用を記載する。特許文献9は、ヘパリン及びラパマイシンの両方の使用を記載する。抗炎症性を有すると考えられる、膜安定化剤であるトラニラストは、特許文献10に開示されている。特許文献11に記載されるように、ポリマーと治療用物質との混合物は、ステント表面上に被覆することができ、次いで、これに、ポリマーの第2の層を被覆する。第1の層は、治療用物質と混合したポリマーを含有することができ、第2の層は、ヘパリンと混合したポリマーを含有することができる。特許文献12中、Shulzeらは、再狭窄を阻害するためのステントを開示し、これは、ステント本体、並びにポリ(D,L−ラクチド)ポリマー及び免疫抑制化合物を含有する生分解性の、薬物を放出する被覆を含む。この免疫抑制化合物は、血管の損傷部位において、時間と共に溶出する。特許文献13は、血管内ステントからのラパマイシン又はその類似体の局所送達を開示し、これは、ステント本体中の小さな微小孔又は経路から直接送達されるか、ステント上に又はステントの支柱より寸法が小さい溝若しくは経路の上に適用したポリマー被覆中に混合して又は結合させて送達されるかのいずれかである。また、特許文献14も、治療用薬物を含有及び溶出させるための多孔性のめっき層の使用を参照する。
【0008】
非金属製のポリマーに基づいたステントは、X線透過性であるために、可視化するのが困難である。ステントの最適な留置には、心臓病専門医がステントをin vivoにおいて追跡することを可能にするリアルタイムの可視化が必要であることから、非金属製のポリマーに基づいたステントのX線不透過性を向上させる必要性がある。ヨウ素化された造影剤が、静脈内X線撮影用染料の一般的な型であり、これは、X線撮影手順の間の血管構造の可視性を増強するヨウ素を含有する。
【0009】
現在のステントの幾何学的形状は、多種多様である。ポリマー管状ステントのブランクは、一般に、射出成型又は押出し成型され、次いで、所望の幾何学的形状又は透かし細工に、打ち抜かれたり、機械加工されたり、又はレーザー切断されたりする。別法として、金属製又はポリマー1枚又は複数枚の薄板を回転させることによって、管状の金属製又はポリマーステントのブランクを形成してもよい。ステントはまた、押出し成型し、組みひも様の構造に織り込まれた、ポリマーフィラメントからなってもよい(特許文献15を参照)。網状又は透かし細工様のステント本体を達成するためには、ステントは、一般に、ジグザグ又は正弦曲線の構造を有することが多く、概して長手方向に通例走る連結要素又は「連結部」によって相互に接続されている、半径方向に拡張可能な管状の要素又は「バンド」を含む。
【0010】
Steinke(特許文献16)は、ロッキングステントを開示し、これは、分解性であり得る。このステントは、金属製又はプラスチック製の1枚又は複数枚の平坦な薄板から形成され、滑り及びロッキングの半径方向の要素又は支柱を担持する。これらの半径方向の要素は、半径方向の要素の一方向性の滑りを可能にする歯止め機構を担持してよい。
【0011】
特許文献17(Killion)は、ステントを所望の直径において選択的にロックする一体に形成されたロッキングアームを有する連続的な円周の管状ステントを開示する。
【0012】
特許文献18(Stenzel)は、複数の相互に接続した細胞を含むステントを開示し、それらの細胞うちの少なくとも1つが、相互にロックすることができる第1及び第2のロッキング部材を有するロッキング可能な細胞である。また、ピン状のロッキング部材を有する、複数の相互に接続したバンドを含むステントも開示され、これらのバンドは、ハサミ状のロッキング部材を有する隣接するバンドに向かって延出する。
【0013】
特許文献19(McGuinness)は、らせん形の立体構造を維持するために、一方の縁部に沿う溝及び他方の縁部に沿うピンを有する、材料の条片を含むステントを開示する。ロッキング機構は開示されていない。
【0014】
特許文献20(Fleming)は、閉鎖型及び開放型の立体構造を有する格子を含むステントを開示する。この格子は、閉鎖型から開放型の立体構造に移行しながら、相互にかみ合うフープ又は支柱からなり、これらのフープは、支柱上の歯の手段によって相互にかみ合う。
【0015】
特許文献21(Jadhav)は、ポリマーのブレンドで作製された生体適合性且つ生分解性のステントを開示する。
【0016】
特許文献22(Khosravi)は、重なってかみ合う縁部を有する円柱状の薄板を含む歯止めステントを開示する。このステントは、生分解性であり得、薬物を放出することもできる。
【0017】
特許文献23及び特許文献24は、骨の修復のための、緩衝化され、再吸収性である、内部固定化のためのポリマー装置を開示する。
【0018】
特許文献25は、ステントの適用に耐え得る合成ポリマーを作製する方法を開示する。
【先行技術文献】
【特許文献】
【0019】
【特許文献1】PCT公開第WO99/07308号
【特許文献2】米国特許第5,288,711号
【特許文献3】米国特許第6,153,252号
【特許文献4】PCT公開第WO97/35575号
【特許文献5】PCT公開第WO2003/090684号
【特許文献6】米国特許第6,159,488号
【特許文献7】米国特許第6,171,609号
【特許文献8】米国特許第5,716,981号
【特許文献9】米国特許第5,288,711号
【特許文献10】米国特許第5,733,327号
【特許文献11】米国特許第6,231,600号
【特許文献12】米国特許第6,939,376号
【特許文献13】米国特許第6,808,536号
【特許文献14】米国特許第6,904,658号
【特許文献15】米国特許第6,368,346号
【特許文献16】米国特許第6,623,521号
【特許文献17】米国特許第6,022,371号
【特許文献18】米国特許第6,540,777号
【特許文献19】米国特許第6,156,062号
【特許文献20】米国特許出願第2004/0249442A1号
【特許文献21】米国特許第6,368,346号
【特許文献22】米国特許第5,441,515号
【特許文献23】米国特許第5,817,328号
【特許文献24】米国特許第6,419,945号
【特許文献25】米国特許第6,932,930号
【発明の概要】
【発明が解決しようとする課題】
【0020】
伝統的な金属製のステントとは異なり、生分解性のステントは、複数のAPIの多量の充填が可能であり、一時的なインプラントである。しかし、生分解性のステントは、通例、不十分な機械的強度及び/又は弾性ポリマーの望ましくない物理的/機械的な反跳に悩まされる。さらに、そのようなステントの分解時間は、制御されておらず、主に、使用するポリマー樹脂の分子量に依存する。本ステント及び方法は、ポリマーの分解速度を調整し、且つ/又は生分解性のステントの作製のために使用するポリマー管又は繊維の機械的強度を増強するための手段を提供する。
【課題を解決するための手段】
【0021】
本ステントは、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;且つ(8)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0022】
代替の実施形態は、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;(8)浸漬被覆及び引き抜きの工程によって形成することにより増強された機械的強度を有する;(9)ポリマーの融解温度未満且つポリマーのガラス転移温度の直ぐ上の低い温度において形成される;且つ(10)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0023】
代替の実施形態は、好ましくは、以下の特色の少なくとも1つを有する:(1)従来の金属製のステントと同様の機械的機能を有する、全体がポリマーからなる構造を有する;(2)拡張可能であり、種々の必要性を満たすようにカスタマイズできる拡張比を有する;(3)体温において配置することができ、低い膨張圧(3atm)を有する;(4)一時的な、完全生分解性のインプラントである;(5)加水分解を加速させる生体適合性緩衝剤により調節された分解速度を有する;(6)局所への薬物又は遺伝子の送達装置であり得る;(7)局所放射線療法の装置であり得る;(8)可視性を向上させるための一時的なヨウ素化された造影剤を包含することができる;且つ(9)種々の機能(機械的支持、急性の薬物放出、長期の薬物放出等)を有する繊維を包含することができ、単一のステントを用い、ステントを埋め込む単一の手順を使用して、複数の機能を包含する多様な治療の選択肢を可能にする。
【0024】
1つの態様では、ステントは、一時的なインプラントである。この一時的なインプラントは、血管壁に対するストレスを減少させ、この場合、特に、若年の患者及び糖尿病患者等の脆弱な患者に対しては、それに続く介入を必要としない。
【0025】
別の態様では、ステントは、ステント本体中に組み込まれた及び/又はポリマー表面上に被覆された治療剤の送達が可能である。
【0026】
本ステントのさらなる態様では、ポリマーの組成、ポリマーの分子量、繊維コードの直径及び処理条件を選択し、それによって、分解速度、薬物放出速度及び機械的支持の期間を制御することによって、適用を変化させること及びステントの分解を制御することが可能である。
【0027】
本ステントの追加の態様では、ステントを介入の手順の間に可視化して追跡することを可能にするX線不透過性が改善されている。
【0028】
本発明のこれら及びその他の態様並びに利点が、好ましい実施形態の以下の詳細な説明を、付随する図面と共に検討することによって、当業者には明らかになるであろう。図面中、複数の図にわたり、同一の番号により、対応する部品を指す。
【図面の簡単な説明】
【0029】
【図1】拡張した繊維製のステントの三次元構造の斜視図である。
【図2】図1の繊維製のステントを側面から眺めた場合の斜視図である。
【図3】図1の繊維製のステントの横断面の側面図である。
【図4】図1の繊維製のステントを拡大した横断面図である。
【図5】管状のステントを製造するための工程の進め方を示す図である。
【図6】山の谷に対向する円周の制限機構を有する拡張した管状のステントの三次元構造の斜視図である。
【図7】図6の管状のステントの側面図である。
【図8】図6の管状のステントを拡大して示す平面図である。
【図9】バルーンカテーテル上に巻き付けた管状のステントの走査像である。
【図10】拡張された状態にある管状のステントの走査像である。
【図11】軸方向にロックする設計を有するステントの平面図である。
【図12】圧縮伸展を比較する棒グラフである。純粋なPLLA製の管(■)及びリン酸塩を含有するPLLA製の管(□)を水にあらかじめ浸漬0カ月及び5カ月後に、圧縮伸展させた(cm(N))場合の平均荷重を測定した。
【図13】PLLA製のステント(#1)、PLLA中の26wt%イオヘキソールで形成したステント(#2)、PLLA中の50wt%イオヘキソールで形成したステント(#3)、及びイオヘキソールで被覆したPLLA製のステント(#4)、並びにガイドカテーテルのX線画像である。
【図14】PLLA製のステント(#1及び#4)、イオヘキソール及びBA9−PLLAで被覆したステントの水への浸漬2分後(#2)及び水への浸漬30秒後(#3)、並びにガイドカテーテルのX線画像である。
【発明を実施するための形態】
【0030】
I.定義
以下の用語は、別段の指定がない限り、本明細書において示す定義を有する。
【0031】
「再狭窄を阻止する」とは、血管の「過剰な」損傷後に観察される再狭窄の程度を低減させることを意味し、これは、ステント留置後の選択された時点、例えば、1〜6カ月における、平均パーセントで示す血管の狭窄の低減によって測定する。
【0032】
「X線を透過させない」は、電磁放射線の通過を阻止する材料を指し、当該材料は、X線下でX線透視によって可視化される。
【0033】
II.ステント
A.材料
本ステントは、1つ又は複数のポリマー又はコポリマーで形成する。実施形態において、且つ以下にさらに記載するように、ステント本体を、フィラメントによって連結された複数の管状部材で形成する。ステント本体は、これらに限定されないが、生体再吸収性、生体吸収性又は生体内分解性をはじめとする、生分解性であり得る生体適合性のポリマーで形成することができる。多様な天然、合成及び生合成のポリマーが、生分解性である。一般に、化学的な連結、とりわけ、酸無水物、エステル又はアミドの結合等を含有するポリマー骨格は、生分解性である(www.sigmaaldrich.com)。分解の機構は、一般に、これらの結合の加水分解又は酵素的切断によるものであり、その結果、ポリマー骨格の分割が生じる。ポリマーの生体内分解は、一般に、少なくとも部分的に水不溶性のポリマーの少なくとも部分的に水溶性のポリマーへの変換によって生じる。ポリマーを治療剤と混合すると、薬物の周囲のポリマーが分解されるにつれて、薬物が放出される。
【0034】
いくつかの実施形態では、ステントは、生分解性のポリマーで形成する。生分解の速度は、これらに限定されないが、結晶化度、材料の分子量、及び(1つ又は複数の)分解部位におけるpH変化を軽減し、加水分解を、溶解経路を介して加速させる生体適合性の緩衝剤の使用をはじめとする、多くの要因によって制御することができる。いくつかの実施形態では、ポリマーステントは、1つ又は複数の治療剤を放出し、これらは、所望の順序及び所望の速度で放出され得る。
【0035】
生分解性材料の使用によって、ステントの組織中での分解及び再吸収並びに/又は細胞による吸収が可能となる。以下に記載するように、そのような材料は、これらに限定されないが、直鎖脂肪族ポリエステル及びグリコリドファミリーのポリマーを包含する。本発明のステントの実施形態のために企図するその他の材料は、生体適合性のポリマー、すなわち、ポリエチレン、ポリエステル及びポリプロピレンのファミリーからの型のもの等、並びに直鎖脂肪族ポリエステルファミリーからのポリマー等のプラスチックを包含する。例示的なポリマーとして、これらに限定されないが、ポリ(乳酸)、ポリ(グリコール酸)若しくはポリカプロラクトン及びそれらの関連のコポリマー、ポリオルトエステル、ポリ酸無水物、ポリジオキサノン及びポリヒドロキシブチレート等の分解性のポリマー、又はそれらの組合せが挙げられる。
【0036】
代表的な生体適合性、吸収性のポリマーとして、ポリ(乳酸)(PLA)、ポリ(L−乳酸)、ポリ(D,L−乳酸)、ポリグリコール酸(PGA)、ポリ(D−乳酸−co−グリコール酸)、ポリ(L−乳酸−co−グリコール酸)、ポリ(D,L−乳酸−co−グリコール酸)、ポリ(ε−カプロラクトン)、ポリ(バレロラクトン)、ポリ(ヒドロキシブチレート)、ポリジオキサノン、ポリ(ヒドロキシルブチレート)、ポリ(ヒドロバレレート)等が挙げられ、コポリマー、具体的には、ポリグラクチン(乳酸とグリコール酸とのコポリマー(PGA−PLA))、ポリグリコネート(トリメチレンカルゴネートとグリコリドとのコポリマー)、ポリグリコール酸とε−カプロラクトンとのコポリマー、ポリ(乳酸)とε−カプロラクトンとのコポリマー、ポリ(乳酸)−ポリ(エチレングリコール)のブロックコポリマー及びポリ(エチレンオキシド)−ポリ(ブチレンテレフタレート)、ポリ(乳酸−co−トリメチレンカーボネート)、ポリ(ε−カプロラクトンコポリマー)、ポリ(L−乳酸コポリマー)等も包含される。生分解性のステントは、単一のポリマー又はコポリマーから作製することができることが理解されるであろう(例えば、米国特許第5,670,161号に記載のL−ラクチドとε−カプロラクトンとのコポリマー、又は米国特許第5,085,629号に記載のL−ラクチドとグリコリドとε−カプロラクトンとのターポリマー)。生分解性のステントはまた、ブレンドされたホモポリマー、具体的には、上記のコポリマーに類似する組成を有するブレンドをはじめとする、米国特許第6,368,346号に記載のものからも形成することができる。ホモポリマー、ブレンドされたポリマー及びコポリマーは、加水分解性の分解に対する様々な感受性をはじめとする、異なる特徴を有することができ、したがって、より迅速又はより緩慢な吸収が望まれる状況下では好ましい場合がある。
【0037】
ポリマーステントの別の際立った利点は、それらが、MRI画像診断に、より適合するという点である。これは、これらのポリマーが、強磁性材料ではないことによる。この特性のおかげで、ポリマーが画像診断の過程の間にシグナルの喪失を引き起こす可能性が低下し、血管の管腔の可視性が維持される。さらに、それに続く解析を、非侵襲的に実施することもできる。
【0038】
ステントは、米国特許第6,368,356号の開示に従って、ステント形成の前に、無毒性のX線を透過させないマーカー、例えば、硫酸バリウム又は三酸化ビスマス等をポリマー中にさらに包含して、ステントのX線不透過性を向上させることができる。好ましい実施形態では、ステントは、約1ミリグラム(+/−20%)の分子の重量及び約0.5から5ミクロンの厚さを有する、無毒性、水溶性のヨウ素化された造影剤の1つ又は複数のX線を透過させない層で被覆される。実施形態では、X線を透過させない被覆は、薄く、生体吸収により一時的なものである。好ましくは、ヨウ素化された造影剤は、身体組織によるより迅速な吸収のために水溶性である。典型的には、造影剤はまた、低い重量モル浸透圧濃度も有して、浸透圧、化学毒性、過敏症及びその他の潜在的に有害な副作用を低下させる。造影剤を組み合せて、同一の層又は別の層中に使用してよいことが理解されるであろう。1つ又は複数の造影剤をステントのポリマー中に包含してよいこと、及び1つ又は複数の異なる又は同一の造影剤をステント上に被覆してよいこともさらに理解されるであろう。別法として、造影剤は、疎水性であってもよい。疎水性の造影剤は、分解又は排泄のより緩慢な速度を必要とする適用例において利用することができる。例が、Kitaguchiに対する米国特許第7008614号に開示されている。
【0039】
以前のステントは、X線不透過性をもたらすために重金属製の被覆を包含している。しかし、これらの被覆は、生分解性のステントが組織によって吸収されても、消失することはない。本X線を透過させない被覆は、持続的で且つ有害な材料をヒトの身体中に導入することのない、一時的なX線不透過性を有する生分解性のステントを生み出す。実施形態では、約2〜3分後には、X線を透過させない材料は、組織中にほとんど又は全く残留しない。
【0040】
生分解性のステントにX線不透過性をもたらすために使用することができる造影剤は、これらに限定されないが、イオパミドール、イオヘキソール、イオプロミド及びイオジキサノールを包含する。これらの薬剤の分子構造は、患者に対する快適性及び心臓病専門医が必要とする可視性の両方をもたらす。一般に、化学構造は、溶解性を増加させ、血液又はその他の血管の構成要素との結合を減少させる親水性領域で隠された疎水性領域からなる。好ましい造影剤は、イオヘキソールである。
【0041】
選択されたX線を透過させない化合物は、ポリマー被覆の内部に包含して、ステント構造の内部に含浸させて、ステントとさらなる被覆との間に挟んで、又はこれらの技法のいずれかを組み合せて、ポリマーステント上に直接被覆することができる。好ましくは、選択されたX線を透過させない化合物は、(1つ又は複数の)生分解性のポリマーの内部に組み込まれる。
【0042】
造影剤が、ステント上に被覆される場合には、造影剤は、実施例3に記載するような、メタノールに基づいた溶媒等の溶媒中の溶液として調製することができる。次いで、溶液を、ステントに、吹き付け等のいずれかの適切な方法を用いて適用する。溶媒を蒸発させると、X線を透過させない材料の薄い被膜が、ステントの少なくとも一部の上に残留する。好ましい実施形態では、ステントの反管腔側の表面が完全に覆われる。得られたステント は、典型的な可視化の技法下ではX線を透過させない。図13(#4)に示すように、イオヘキソールで被覆されたステントは、画像診断で可視化された。
【0043】
ステントの実施形態はまた、(1つ又は複数の)X線を透過させない化合物を、生分解性のポリマーと組み合せる工程も場合によっては包含する。造影剤の層を、吹き付けによる被覆、浸漬被覆、同時押出し成型、圧縮成型、電気めっき、塗装、プラズマ蒸着、スパッタリング、蒸発、イオン注入又は流動床の使用によって適用することができる。好ましい実施形態では、ステントのポリマー骨格に、造影剤を含浸させ、続いて、薬物をその上に上記の工程のうちの1つを使用して適用する。実施例5に記載するように、造影剤を、ポリマーを有する溶液中に、所望の最終の重量まで懸濁させる。図13(#2及び#3)に示すように、含浸させたステントのX線不透過性は、造影剤の重量パーセントの増加と共に増加することが明らかである。代替の実施形態では、反管腔側の表面上において、一時的なヨウ素化された造影剤を、ステントの骨格上の薬物と、薄いポリマー(PLLA又はその他の生分解性のポリマー)との間に挟む。実施例4に記載する例示的な方法では、ポリマーステントを、最初に、造影剤で被覆する。続いて、ステントを、治療剤又はポリマー被覆中の治療剤で被覆する。
【0044】
例示的な実施形態では、ヨウ素化された造影剤の1つの型であるイオヘキソールを、X線を透過させない材料として使用する。実施例5に示すように、イオヘキソールを、ポリ(L−乳酸)(PLLA)製のポリマー中に組み込んだり、ステント上に被覆したりした。これらのステントは、水に対して32秒間及び2分間暴露した後、X線を透過させない状態を維持した。
【0045】
B.活性医薬成分
また、本発明のステントを使用して、1つ又は複数のAPIを送達することもできる。これらの薬剤は、宿主細胞応答に対して所望の効果を有するために、ステントから、所望の順番で且つ制御可能な時期に放出させることができる。種々の型のAPIを、0.1wt%から55wt%までの所望の重量パーセントで、ポリマーの溶液と混合することができる。本ステントは、ポリマーの押出し成型の方法の場合には必要となる極端な熱を用いることなく製造され、したがって、温度感受性のいずれの治療剤についても熱による不活性化の可能性を減少させる。実施形態では、生分解性のポリマーを、多様なAPI又は治療剤のうちの1つ又は複数と混合する。その他の実施形態では、APIは、繊維表面上又は中空繊維の管腔中に単独で堆積させるか、APIを組み合せてステントのポリマー中に混合することができる。X線の透視に関して不透過性の薬剤を、繊維を紡糸する又はステントを組み立てる時に添加することによって、導入した管腔ステントの状況を、従来のX線透視装置を用いて観察できることが理解されるであろう。本ステントと共に用いるのに有用な治療剤の非限定的な例として、抗再狭窄薬、抗増殖薬、免疫抑制化合物、抗血栓形成薬、抗線維性/線維素溶解性の化合物、及び細胞傷害性化合物が挙げられる。好ましい実施形態では、薬剤は、抗再狭窄薬、ラパマイシン(シロリムス)、エベロリムス、パクリタキセル、ゾタロリムス、Biolimus A9(登録商標)、ピメクロリムス及びタクロリムス等の抗増殖薬、ヘパリン/エノキサパリン/低分子量ヘパリン、ヒルジン/ビバリルジン/レピルジン/組換えヒルジン、アプロチニン、クロピドグレル、プラスグレル、アルガトロバン等の抗血栓形成/抗凝固薬、トラニラスト、コルヒチン、ストレプトキナーゼ、二鎖ウロキナーゼ型(tcu−プラスミノーゲン活性化因子、ウロキナーゼ)、組織型プラスミノーゲン活性化因子PA(t−PA)及び一本鎖ウロキナーゼ型PA(scu−プラスミノーゲン活性化因子)等の抗線維性又は線維素溶解性の薬物である。ポリマーが生分解性である場合には、拡散過程による薬物の放出に加えて、APIはまたポリマーが分解又は再吸収される際にも放出され、周囲の組織環境にとって薬剤をより容易に利用可能となすことができる。生分解性のポリマーを、薬物送達の被覆として使用する場合には、例えば、米国特許第6,099,562号、第5,873,904号、第5,342,348号、第5,707,385号、第5,824,048号、第5,527,337号、第5,306,286号及び第6,013,853号に開示されているように、多孔性が、組織の内殖を援助し、ポリマーの分解をより予測可能にし、且つ/又は薬物放出の速度を調節若しくは増強することが、多岐にわたり開示されている。
【0046】
C.機械的強度
本ステントは、ステント、したがって患者に対する構造的な利益を有するのみならず、より少ないポリマー材料を用いたステントの製造もまた可能にする。これは、コスト及び患者の異物に対する暴露の減少の利点をもたらす。増強された機械的強度は、高度に方向付けられたポリマー分子によってもたらされる。
【0047】
以下にさらに記載し、図5に描写するように、管状のステントは、増強された機械的強度を有するポリマーステントを作製するための工程によって形成することができる。この工程は、回転乾燥240及び引き抜き260のステップを包含し、これらのステップはそれぞれ、管のポリマー鎖を半径及び軸の方向に方向付ける。さらに、この工程に関与するステップは、ステントを形成するために通常使用される熱による押出し成型の技術には必要である極度の熱を必要としない。中等度の製造温度は、特に、温度感受性のAPIを生分解性の管状のステント200を介して送達しようとする場合には、利点をもたらす。例えば、ポリマーステントを製造するために通常使用される熱による押出し成型は、ポリマーの融解温度(Tm)超の温度で実施する必要があり、これは、ポリ−L−乳酸のポリマーの場合には、約173℃である。それに対して、本発明の引き抜き260の工程は、ガラス転移温度(Tg)とTmとの間、又はポリ−L−乳酸の場合には、約55℃から60℃で実施され、引き抜き260のステップに先行する製造のステップは、室温で実施される。
【0048】
繊維製のステントの繊維もまた、この工程によって形成することができることが理解されるであろう。別の実施形態では、繊維製のステントの機械的強度は、以下にさらに記載するように繊維の立体構造によって、且つ/又は製造工程によって増強することができる。
【0049】
D.緩衝剤
本発明のステントは、さらに、ステントの再吸収の速度を制御できるように製造することもできる。1つの実施形態では、これは、緩衝剤の塩を添加して、ステントの再吸収の速度を変化させることによって達成される。この実施形態では、ポリマー、したがって、ステントの分解を調整するために、これらに限定されないが、リン酸緩衝剤の塩、クエン酸緩衝剤の塩又はNaCl緩衝剤をはじめとする、1つ又は複数の緩衝剤を、ポリマー溶液中に単独で又は1つ若しくは複数のAPIと併せて充填することができる。理論に限定されることなく、ステントが流体と接触すると、ポリマー中に組み込まれた緩衝剤が、ステントから急速に拡散し、したがって、顕微鏡レベルの孔又は経路を生み出すと考えられている。次いで、水分子が、それらの孔又は経路を通ってステントに浸透することができる。例えば、PLLA製のポリマーの分解は、加水分解によって推進され、水分の含有量の影響を受ける。長い分子の鎖が、乳酸を形成する、多くの単一の分子に分解し、次いで、付近の細胞が乳酸を吸収すると、ポリマーの再吸収が生じる。したがって、ポリマー溶液中に充填した緩衝剤粉末の量を制御することによって、緩衝剤の塩の拡散速度及びステントの再吸収速度が制御可能となる。
【0050】
緩衝剤の塩の濃度は、一般に、ステントの約0.01%から15%までのwt%;好ましくは、0.01%から10%のwt%;より好ましくは、2%から8%のwt%である。実施例1に記載するように、ポリマーステントを、6重量%のリン酸塩と共にPLLAで形成した。図12を参照すると、6wt%でリン酸塩の緩衝剤を有するPLLA製の管状ステントは、緩衝剤を有さないPLLA製の管状ステントと比較して、5カ月において測定した場合、相当により迅速な分解を生じた。
【0051】
E.ステントの幾何学的形状
1.繊維製のステント
図1は、本発明により1本又は複数本のポリマー繊維から構築した繊維製のステント100を示す。好ましくは、繊維製のステントは、生分解性のポリマー撚り糸、繊維又はコードを「編み込む」ことによって生産した管状部材からなる管腔ステントである。そのような繊維製のステントは、好ましくは、送達カテーテルの遠位末端の付近にあるバルーン形成部分の上に取り付けられた管腔用ステントを含む、管腔用ステントの配置装置から配置される。
【0052】
好ましい実施形態では、繊維は、組織が分解及び再吸収することができる「生分解性の繊維」である。繊維は、中空でなくても、中空であっても、又は中空でないと中空との組合せであってもよい。好ましくは、繊維は、身体への挿入後約1から60カ月以内に、より好ましくは、約3から15カ月後に、さらにより好ましくは、約6から12カ月後に分解する。生分解性の繊維は、上記に記載した生分解性の材料で形成することができる。好ましい実施形態では、ポリマー繊維を、PLLAで形成する。非限定的な実施形態では、これらの繊維は、一般に、直径が約5から約1,000μmのフィラメントの糸である。好ましくは、フィラメントの糸は、これらの繊維からなるステントが、円柱状の形状を容易に維持することができるように十分に固くなるような大きさを有する。単一フィラメントの糸が、本明細書における使用のためには、特に好ましい。好ましい生分解性のポリマーの平均分子量は、約10,000から約800,000DAまでの間である。生分解性のポリマーの選択は、種々の大きさを有する血管の管腔を支持するのに必要な全体的な半径方向の強度に依存し得ることが理解されるであろう。ポリマー繊維は、いずれの適切な手段で形成してもよい。1つの実施形態では、ポリマー繊維を、当技術分野で既知の熱による押出し成型によって形成する。別の実施形態では、繊維を、上記に記載し、図5に図解する方法によって形成する。
【0053】
ステントのポリマー繊維のうちの少なくともいくつかは、上記に記載した1つ又は複数のAPIと混合することができることが理解されるであろう。ポリマー繊維のうちの少なくともいくつかは、1つ又は複数のAPIで被覆することができることもさらに理解されるであろう。
【0054】
いくつかの実施形態では、ステントの作製のために使用するポリマー繊維に、ウコン等の非ステロイド性の抗炎症剤を、単独で又はさらなる(1つ若しくは複数の)APIと組み合せて充填する。ウコンを充填した繊維は、ステントの埋込み部位における炎症を、炎症性細胞の接着を減少させることによって顕著に低減する。含浸させた又は被覆したAPIは、あらかじめ決定した期間にわたり制御して送達される用量に調製することができる。
【0055】
さらに、生分解性のポリマー繊維から生成した繊維製のステントは、あらかじめ決定した期間後には、それが導入されていた部位から完全に分解するという事実を生かすことによって、制癌剤又は抗血栓剤を、病変部位へのこれらの薬剤の高濃度投与のために、繊維中に混合する又は繊維に結合させることができる。
【0056】
本発明の繊維製のステントは、介入の手順の後に、血管の管腔に対して適切な機械的支持を提供する。さらに、繊維製のステントは、制御可能な期間にわたって吸収されることにより、血管壁の慢性的な機械的混乱を回避する。ステントが加水分解され、繊維が内皮化すると、血管壁に対する残余のストレスは排除される。繊維製のステントのAPIは、加水分解の間に制御された様式で放出され、有効濃度が、標的の病変において維持される。
【0057】
繊維製のステントは、バルーンを取り付けたカテーテルによって、血管形成術の部位内へ導入し、そこに留置し、バルーンを拡張すること又は当技術分野で既知のいずれかのその他の方法によって配置することができる。繊維製のステントは、留置後、数週間から数カ月間、通常約2カ月間から約2年間、その形状を保持し、数カ月後、通常約6〜12カ月後に加水分解することができる。ステントは、2年等の長い期間にわたり加水分解することができることが理解されるであろう。
【0058】
繊維製のステントを使用する方法は、構造的な支持、及び場合によっては、身体の管腔の内側への薬物の局所投与を提供することを意図する。1つの実施形態では、この方法は、局在化する血管損傷を被っている又は血管閉塞のリスクを有する患者の再狭窄のリスク及び/又は程度を最小化するように設計される。典型的には、血管損傷は、部分的に閉塞した、冠状又は末梢の血管の動脈等の血管を開く血管形成術の手順の間に生じる。血管形成術の手順においては、バルーンカテーテルを、閉塞部位に留置し、遠位のバルーンを、1回又は複数回膨張及び収縮させて、閉塞した血管を強制的に開かせる。この血管の拡張、特に、プラークを取り除くことができる血管壁における表面の外傷が関与する場合には、しばしば、十分な量の局在化する損傷が生じるので、血管が、時間をかけて、炎症、正の再構築に至る平滑筋細胞の増殖、及び再閉塞によって応答する。当然のことながら、再狭窄として知られる、この過程の発生又は重症度は、血管形成術の手順によって生じた血管の伸展及び損傷の程度に関係があることが多い。特に、過剰な伸展が35%以上の場合には、再狭窄が、高い頻度で発生し、しばしば、相当な重症度、すなわち、血管の閉塞を伴うこともある。
【0059】
繊維製のステントは、典型的には、収縮した状態で、典型的には、カテーテルの遠位末端において、カテーテルの管腔の内側に置かれる、又は遠位末端のバルーン上で収縮した状態で置かれるのいずれかである。次いで、遠位のカテーテルの末端が、損傷部位又は潜在的な閉塞の部位まで導かれ、カテーテルから、例えば、トリップワイヤーを使用することによって放出されて、ステントを当該部位内に放出し、ステントは、血管壁に接触するまで、それ自体で拡張するか、バルーン上のステントであれば、バルーンの膨張によって拡張されて、実質的に、当該ステントは当該部位において組織の壁の中に埋め込まれる。
【0060】
図1〜4は、例示的な繊維製のステントを示す。ここで、図1を参照すると、繊維製のステント100は、ぐるぐる巻かれた繊維材料を含む。上記に記載したように、繊維材料は、ポリマー繊維又は複数のポリマー繊維からなる層である。好ましくは、ポリマーは、PLLAを含む。PLLAが生分解性であることから、繊維製のステントを構築するためのPLLAの使用は好都合である。繊維製のステントの分解機構は、一般に、エステル結合における加水分解によるものである。分解は、いくつかの要因、具体的には、ポリマーの分子量及び利用する緩衝剤の型に依存して、約3カ月から約3年の期間にわたり生じ得る。また、PLLAは、ステントの埋込み部位における組織の局所治療のために、薬物又はその他の治療剤を含浸させる及び/又はそれらで被覆することができることからも、好都合である。その他の生分解性のポリマーも、PLLAについて記載したような利点を有することが理解されるであろう。
【0061】
繊維材料を、ぐるぐる巻きにして、少なくとも1つの大きな中心ローブ160を形成し、この中心ローブは、複数の周辺ローブ180を、大きな中心ローブ160及び周辺ローブ180間に配置した接続セグメント130の内部にさらに含む。好ましい実施形態では、複数の周辺ローブは、1つの中心ローブ当たり、少なくとも3つの周辺ローブを含む。代替の立体構造では、周辺ローブ180は、大きな中心ローブ160の反管腔側上に配置することができる(図示せず)。恣意的なバンド120が、周辺ローブ180のそれぞれの推定上の始点及び終点を画定する。大きな中心ローブ160は、繊維製のステント100の上位構造を形成する。少なくとも3つの長手方向ロッド170を、大きな中心ローブ160の反管腔側表面上に、好ましくは、粘性のPLLA−クロロホルム溶液を使用して結合させる。長手方向ロッド170は、大きな中心ローブ160及び周辺ローブ180と同一の材料からなってよい。図1に示す実施形態では、ステントは、9個の中心ローブ160を含み、この中心ローブ160は、接続バンド130によって連結している3つの周辺ローブ180で形成される。周辺ローブを、中心ローブの管腔側上に配置する。ステントは、繊維製のステントの反管腔側表面上に配置した、少なくとも1つの長手方向又は補強用のロッド170をさらに含む。好ましくは、2つ以上の長手方向ロッドを、繊維製のステントの反管腔側表面上に配置する。より好ましくは、3つ以上の長手方向ロッドを、繊維製のステントの反管腔側表面上に配置する。長手方向は、中心ローブのうちの1つ又は複数に、ステントに沿った複数の点において結合させることができる。図に示すように、中心ローブは、ほぼ同一の大きさであり、間隔を置いて連続して配列させて、ステントの長手方向の軸を画定する。各中心ローブは、先端162及び終端(図示せず)を有する。最初及び最後の中心ローブ以外は、各中心ローブの終端は、次に連続する中心ローブの先端に接続している。ステントは、連続した繊維で形成することができ、各中心ローブの終端が、次に連続する中心ローブの先端に連続してつながることが理解されるであろう。図にさらに示すように、周辺ローブは、中心ローブの円周の周りで、規則的又は実質的に規則的に隔たってよい。別の実施形態では、周辺ローブは、中心ローブの円周の周りで、不規則的に隔たってよい(図示せず)。複数の周辺ローブは、中心ローブの先端に続く、先端に存在する周辺ローブ、及び中心ローブの終端に先行する、終端に存在する周辺ローブをさらに包含する。1つ又は複数の追加の周辺ローブが、先端に存在する周辺ローブと、終端に存在する周辺ローブとの間にさらに位置してもよい。好ましくは、先端に存在する周辺ローブは、中心ローブの先端に隣接し、終端に存在する周辺ローブは、中心ローブの終端に隣接する。
【0062】
図2〜4は、代替の実施形態の多層型の繊維製のステント110を図解し、大きな中心ローブ161、周辺ローブ181、及び長手方向ロッド171が、複数層の繊維材料を含んでよい。例えば、大きな中心ローブ161及び周辺ローブ181は、二層繊維材料又は三層以上の材料から形成することができ、少なくとも3つの長手方向ロッド171のそれぞれは、追加の剛性のために、三層繊維材料から形成することができる。さらに、多層型の繊維製のステント110は、埋込み後の放出のためのAPIの保管が可能である中空の管腔150を有してよい。
【0063】
また、一例として、好ましい実施形態の長さは、18mmであり、最初の直径は、1.9mmである。この実施形態では、バルーン拡張後の最終的な直径は、好ましくは、約3.25mmである。好ましくは、ステントの長さは、約8mmから約30mmまでである。いくつかの実施形態では、ステントの長さは、最長約60mmである。典型的な冠状動脈の直径は、約2mmから約4mmまでであり、冠状動脈ステントの拡張された直径は、一般に、適切な寸法を有する。その他の身体の管腔は、最大約1cmの直径を有し、これらの管腔のためのステントは、適切な拡張された直径を有することができることが理解されるであろう。繊維製のステント110の長さは、大きな中心ローブ161及び周辺ローブ181の数を増加させることによって増加させることができる。周辺ローブ181及び大きな中心ローブ181の直径を調整して、ステントの最終的な直径を設定することができる。例えば、市販の冠状動脈ステントは、2〜5mmの範囲の最終的な拡張された直径を有する。ステントは、管腔及び/又は適用に適した大きさを有することができることが理解されるであろう。
【0064】
本発明を実行するには、ステントを、ステントの中心ローブが畳まれた、小さな直径の状態である、収縮した状態とする。ステントは、典型的には、カテーテルの遠位末端において、カテーテルの管腔の内側にある、又は遠位末端のバルーン上で収縮した状態にあるのいずれかである。次いで、遠位のカテーテルの末端が、損傷部位又は潜在的な閉塞の部位まで導かれ、カテーテルから、例えば、トリップワイヤーを使用することによって放出されて、ステントを当該部位内に放出し、ステントは、血管壁に接触するまで、それ自体で拡張するか、バルーン上のステントであれば、バルーンの膨張によって拡張されて、実質的に、当該ステントは当該部位において組織の壁の中に埋め込まれる。
【0065】
ステントは、当該部位に配置されると、活性化合物を、細胞中に放出し始めて、当該の血管部位を内張りする細胞の増殖を阻害する。
【0066】
2.管状のステント
別の実施形態では、ステントは、生分解性のポリマー管状ステントである。典型的には、ステントを、図5に図解する工程によって、円柱状の薄板状に形成する。図柄は、約310nm未満の波長を有するエキシマレーザー技術を使用して、管からレーザー切断する280ことができる。
【0067】
生分解性のポリマー管を、心棒210上に、一層ずつ築く。典型的には、心棒は、Teflon(登録商標)製の心棒又はTeflon(登録商標)で被覆した金属製の心棒である。ステントの形状を支持するその他の心棒又は構造も使用できることが理解されるであろう。生分解性のポリマーの溶液220を、生分解性のポリマー樹脂を、(これらに限定されないが)クロロホルム又はジオキサン等の適切な溶媒中に溶解することによって作製する。溶液の粘度は、一般に、約1から約2000センチポアズ;好ましくは、約10から約500センチポアズである。
【0068】
リン酸緩衝剤又はクエン酸緩衝剤の塩等の緩衝剤を、ポリマー溶液中に単独で又は1つ若しくは複数のAPIと併せて充填することができる。これらに限定されないが、リンゲル液及び乳酸をはじめとする、その他の生体適合性の緩衝剤の塩も、医療技術の当業者であれば、容易に思い当たる。
【0069】
管状のステントを、心棒を生分解性のポリマー溶液中にポリマー被覆が所望の厚さになるまで1回又は複数回浸漬被覆する230ことによって形成する。浸漬230被覆のスピードは、一般に、約1ミリメートル/分から約10メートル/分までの範囲に及ぶ。典型的なスピードの範囲は、1メートル/分から5メートル/分までである。次いで、被覆した心棒を、乾燥させる240。好ましくは、被覆した心棒を、層流フード中で、心棒の長手方向の軸の周りに回転させて乾燥し240、溶媒を蒸発させて、薄いポリマーの層を残留させる。回転乾燥240のスピードは、約1から約100,000rpmであってよく、典型的な範囲は、約100から約4000rpmである。回転乾燥240のステップは、ポリマー管の半径方向の強度を、円周方向に増強する。乾燥ステップ240における回転の方向は、一方向で繰り返してもよいし、又は方向を、例えば、時計回り方向から反時計回り方向へ交互に変化させてもよい。次いで、このポリマーの層を、溶媒研磨し250、1回又は複数回乾燥させ240、後に薄く且つ平滑なポリマー管を残留させる(図示せず)。好ましくは、溶媒研磨250は、純粋な溶媒を使用し、これは、ポリマー溶液220を調製するために使用した溶媒と同一であっても、又はそれとは異なってもよい。典型的な溶媒は、クロロホルムである。浸漬230被覆、回転乾燥240、及び溶媒研磨250を包含する全サイクルは、好ましくは、室温又は室温付近(10℃から30℃まで)において実施する。しかし、約−20℃から80℃までの温度範囲が可能であることが理解されるであろう。管の厚さを所望の厚さ、例えば、0.0875ミリメートルから1.25ミリメートルに達するまで増加させるために、浸漬、乾燥及び研磨のサイクルを繰り返すのが好ましい。1つの実施形態では、サイクルを、少なくとも約46層のポリマーを重ねるまで繰り返して、完全な管を形成する。上記に記載したように、種々のサイクルは、同等のポリマー溶液220を用いて実施する必要はない。ポリマー、緩衝剤及び/又はAPIは、その性質及び濃度を、上記で説明したように、逐次的な浸漬230被覆を用いて、層毎に変化させることができる。
【0070】
ポリマー管は、引き抜き260及び焼きなまし270の工程によって機械的によりさらに強化することができる。引き抜き260の処理においては、管を、引き抜き用のダイスを通して引き出す(図示せず)と、管の外径の厚さが減少し、一方、内径は一定に留まる。この引き抜き260の工程は、ポリマーの分子を長手方向の軸に沿って整列させることによって、管の軸方向の強度を増強する。引き抜き260の工程は、ポリマーのガラス転移温度Tg超且つポリマーの融解温度Tm未満の温度において実施する。例えば、ポリL−乳酸の場合の引き抜きの温度は、約55℃から60℃である。次いで、引き抜いた管が引き抜き用のダイスから出たら、引き抜いた管の表面上に空気を吹き付けることによって、引き抜いた管を焼きなます270。引き抜き260及び焼きなまし270は、所望の管の外径を達成するまで繰り返すことができる。
【0071】
引き抜き260のステップにおいて引き下げた面積比が、強化の効果に影響を及ばすことが理解されるであろう。引き下げた面積比は、約1.01から約20.00、好ましくは、3.5から6.0であってよい。引き下げた面積比は、以下のように計算する:
Xは、引き抜き前の、ポリマーで被覆した心棒の直径であり、
Yは、心棒の直径であり;
Zは、引き抜き後の、ポリマーで被覆した心棒の直径である。
【化1】

【0072】
引き抜き260に続いて、管を、典型的には、純粋な不活性ガスを用いて焼きなます270。適切な不活性ガスは、これらに限定されないが、窒素、アルゴン、ネオン、ヘリウム又はその他の希ガスを包含する。また、焼きなまし270によっても、機械的強度がポリマーの結晶化度を増加させることによって向上し、さらに、加水分解のための水の接近も調節される。
【0073】
この方法によって形成した管状のステントは、従来の熱により押出し成型した管状のステントと比較して、顕著に増強された機械的強度を有した。破損時の最大荷重は、壁の厚さ0.007’’を有する熱により押出し成型したポリ(L−乳酸)(PLLA)の管の場合、46.33±1.66NTであった。本方法によって作製した同一の仕様の管は、153.13±1.66NTの最大荷重を有した。
【0074】
一般に、管状のステントの強度は、加水分解を開始すると低下する。例えば、PLLAは、加水分解速度が速まると弱まる。実施例1に記載する圧縮伸展比較試験において、リン酸塩を含有するPLLA及び純粋なPLLA製の試料を、最初に水に5カ月間浸漬し、半径方向の強度について試験した。図12は、分解させたリン酸塩を含有するPLLA製の管は、分解させた純粋なPLLA製の管よりも49.8%弱かったことを示している。図12は、リン酸塩含有PLLA製の管は、半径方向の強度の喪失を加速させる、より迅速な加水分解を受けることを示している。
【0075】
代替の実施形態では、増強された機械的強度を有するポリマー管状ステントを作製する方法は、浸漬被覆の工程230を繰り返すステップと、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度においてポリマー管を引き抜く260ステップと、ポリマー管を焼きなます270ステップと、エキシマレーザーでポリマー管から所望の図柄のステントを切断し、拡張した場合の円周の制限を形成するための最終的な切断280のステップとを包含する。
【0076】
図8に示すように、本発明のポリマー管状ステント300は、正弦曲線形の支柱バンド320及び円周制限バンド330を含む。隣接したバンドは、固定された軸方向の連結部340又は柔軟性のある軸方向の連結部350のいずれかによって接続されている。図9に示すように、2つの隣接した半径方向に拡張可能な円周制限バンド330は、それらのそれぞれの谷において、柔軟性のある軸方向の連結部350により連結されて一体になっている。正弦曲線形の支柱バンド320は、円周制限バンド330に、それらのそれぞれの山において、固定された軸方向の連結部340を介して連結されている。正弦曲線形の支柱バンドは、少なくとも1つのピークと谷とをステントの円周の周りに有する実質的に正弦波形を有する構造を含む。好ましくは、正弦曲線形の支柱バンドは、2つ以上のピークと谷とをステントの円周の周りに包含する。ポリマー管状ステント300が拡張されていない状態から拡張された状態まで拡張する間に、半径方向に拡張可能な円周制限バンド330は、外側に真直ぐに伸びて、半径方向の増加を補整する。図10に示すように、半径方向に拡張可能な円周制限バンド330は、外側に真直ぐに伸びて、血管の管腔に接触する完全なフープを形成する。半径方向に拡張可能な円周制限バンド330が、外側に真直ぐに伸びると、拡張された状態のポリマー管状ステント300をロックする。本発明のポリマー管状ステント300は、1つの円周当たりわずか4つのピークを有してよく、したがって、各バンド330の結び目340の半径を増加させること、又は12個以上もの数のピークによって、より大きな血管の管腔に適応する。バンド330上のピーク340の数を調整して、特に、配置の間における機械的ストレス及びバンド内の緊張のレベルを低減させることができる。
【0077】
別の実施形態では、ステントは、1つ又は複数の半径方向に拡張可能な管状の要素を含む1つ又は複数の強度モジュールを含む。好ましくは、半径方向に拡張可能な管状の要素は、少なくとも1つの山のピークと山の谷との実質的に正弦波形を有する構造を含む。1つの実施形態では拡張可能な管状の要素は、4つ以下の山のピークを有する。強度モジュールは、(1つ又は複数の)強度モジュールに柔軟性を添加する、1つ又は複数の軸方向の連結要素によって相互に接続されている。強度モジュールは、拡張可能な管状の要素の山の谷に対向する、少なくとも2つの円周制限バンドをさらに有する。実施形態では、円周制限バンドの長さが、ステントを拡張した場合のステントの大きさを画定する。この実施形態では、各円周制限バンドの長さは、拡張可能な管状の要素の長さより短い。
【0078】
代替の実施形態は、図11に示す弾性のポリマーで作製したバイオロック型のポリマーステント400を含む。ポリマーステント400は、長い固定された連結部450、短い固定された連結部451及びばね製のコネクタ452によって相互に接続されている、1つ又は複数の半径方向に拡張可能なバンド405、406で作り上げた管状の構造で作り上げられ、それによってポリマーステント400が、拡張されていな直径から少なくとも1つの拡張された直径まで半径方向に拡張可能であり、軸方向のペグ410等の第1のロッキング部材及び軸方向の受器420等の第2のロッキング部材で作り上げられたロッキング機構を有する。軸方向のペグ410は、バンド406の谷430から突出し、バンド405の谷440に結合している軸方向の受器420に対向する。ステントが、その拡張されていない状態から拡張された状態まで拡張すると、軸方向のペグ410が、軸方向の受器420に接触し、係合して、ステントをその拡張された直径にロックする。ポリマーステント400が拡張されていない直径の状態である場合には、ロッキング機構は係号せず、管状構造が拡張された直径の状態である場合には、ロッキング機構は係号する。ばね製のコネクタ452は、軸方向のペグ410と軸方向の受器420との対間に配置されて、半径方向の柔軟性を増加させる。
【0079】
ポリマーステント400が、複数の拡張された直径にロック可能である実施形態もあれば、ロッキングが可逆的である実施形態もある。1つの実施形態では、軸方向のペグは、軸方向の受器の内部にはまるような寸法を有する歯又はとげを包含する。軸方向の受器は、軸方向のペグのとげを収容し、軸方向のペグを適所に保持するための1つ又は複数の位置を有する形状をさらに有してもよい。この様式の場合、ステントを、拡張させ、1つ又は複数の位置においてロックすることができる。ステントを、最初は、第1の位置にロックし、次いで、第2又はいずれかの数の位置(複数の位置)にさらに拡張させることができることが理解されるであろう。したがって、ステントを、さらに拡張させ、軸方向のペグと軸方向の受器とをロックすることによって適所にロックすることができる。ポリマーステント400は、力の共有の増加により、半径方向の強度を増加させている。半径方向の力は、ステントの支柱の円周方向の強度のみによるのではなく、ロッキング機構中の軸方向のペグ410と軸方向の受器420との接触面において共有されてもいる。
【0080】
管状のステントはまた、ポリマー管及びその結果としてステントの再吸収速度を制御するための機構も包含することができる。緩衝剤の粉末を、ポリマー溶液中に組み込むことができ、次いで、これを、管状のステントを形成するために使用する。これらの緩衝剤は、流体に接触すると、管状のステントから急速に拡散し、それによって、顕微鏡レベルの孔を生み出す。次いで、水分子が、これらの孔を通って管状のステントに浸透することができる。PLLA製のポリマーの分解は、加水分解によって推進され、水分の含有量の影響を受ける。長い分子の鎖が、乳酸を形成する、多くの単一の分子に分解し、次いで、付近の細胞が乳酸を吸収すると、ポリマーの再吸収が生じる。したがって、ポリマー溶液中に充填した緩衝剤粉末の量を制御することによって、緩衝剤の塩の拡散速度及び管状のステントの再吸収速度が制御可能となる。
【0081】
管状のステントの実施形態はまた、管の合成時に、複数のAPI又は異なる濃度の単一のAPIを層状にして、ポリマー管に充填するための工程も場合によっては包含する。さらに、異なるAPIをステントの異なる層の内部に提供することが好ましい場合もある。例えば、免疫抑制剤又は抗再狭窄剤をステントの外側又は側面の1つ又は複数の層中に、抗炎症剤をステントの挟まれた1つ又は複数の層中に、且つ抗血栓形成剤をステントの中央(内部)の1つ又は複数の層に提供することができる。これは、(ステントになる)ポリマー管の種々の層を浸漬被覆によって積み重ねる際に、ポリマー中の薬物の内容を変化させることによって達成される。API、緩衝剤及びポリマーの順番を調整することによって、放出の動態の時期及び期間を加減することができる。さらに、上記で言及したように、ポリマー管状のステントのための製造工程は、中等度の温度において実施され、これにより、熱により押出し成型するポリマーを用いて可能となる範囲よりもはるかに広い範囲のAPIの使用が可能になる。
【0082】
本発明を、具体的な実施形態及び適用例に関して説明してきたが、種々の変更形態及び改変形態を、本発明から逸脱することなく作製することができることが理解されるであろう。以下の実施例によって、本明細書におけるステントの発明を作製及び使用する種々の態様を例証する。これらには、本発明の範囲を制限する意図はない。
【実施例】
【0083】
材料及び方法
イオヘキソールは、Amersham(製品番号:0407−1414−80)から購入した。
メタノールは、EMD(製品番号:MX0488)から購入した。
ホスファチジルコリンは、Sigma−Aldrich(PN P3556、20mg)から購入した。
【0084】
X線画像を、OEC Model 9600 ESP C−ARM 60Hzを用いて、MAG2の倍率設定で撮影した。
【0085】
(実施例1)
生分解性のポリマー管の調製
生分解性のポリマー管を、心棒上に、CCl3H(クロロホルム)中の12%のwt%のPLLAの生分解性のポリマー溶液中に浸漬することによって一層ずつ積み重ねた。心棒は、PLLA溶液中に、約0.1メートル/秒の速度で46回浸漬した。
【0086】
次いで、被覆した心棒を、流層フード中で、長手方向の軸の周りに回転させて乾燥し、溶媒を蒸発させて、薄いポリマーの層を残留させた。乾燥のステップにおいて、回転を繰り返した。得られたポリマー管は、約0.2mmの厚さを有し、リン酸塩緩衝剤は、6重量%であった。次いで、このポリマーの層を、クロロホルム又はポリマーを溶解及び乾燥させた純粋な溶媒を用いて溶媒研磨すると、後に薄く且つ平滑なポリマー管が残留した。
【0087】
管状のステントの外径の厚さを、管状のステントを引き抜き用のダイスを通して引き出すことによって減少させ、一方、ステントの内径は一定に留めた。
【0088】
引き抜きに続いて、管を、純粋な不活性窒素を用いて焼きなました。
【0089】
圧縮時における平均荷重を、水中への浸漬の前及び5カ月後に測定した。これは、Instron(Norwood、マサチューセッツ州)の力の送達/測定のシステム上で実施する半径方向の力の試験によって測定した。緩衝剤を有するステント及び緩衝剤を有しないステントについての圧縮時の平均荷重を試験した結果を、図12に示す。
【0090】
(実施例2)
ステントの図柄及び作製
ステントのパターンを、CADソフトウエアを使用して設計した。平面設計図及び未切断の生分解性のポリマー管をレーザー切断のためにレーザー作業所に送った。Resonetics(Nashua、ニューハンプシャー州)、及びSpectralytics(Dassel、ミネソタ州)等のいくつかのレーザー切断施設が、一般向けに利用可能である。ステントの図柄を、生分解性のポリマー管状ステントから、310nm未満の波長を有するエキシマレーザーを用いて切断した。
【0091】
当業者であれば、開示した実施形態又はその変形形態中の考案のステントは、従来のステントを上回る機械的及び治療上の利点を提供することを理解するであろう。さらに、熟練した開業医には、本発明の上記の説明を検討すれば、好都合な治療が自ずと明らかになるであろう。考案のステントが生分解性のポリマーからなるという性質のおかげで、同一の血管部位を、必要であれば、その後の時点で再度治療することができ、これには、患者の成長の間の段階的な手順が包含される。同様に、大きさが変化する組織の継続的な治療も、開示したステントを用いて促進することができる。また、考案のステントは、診断の目的で又は隣接した組織の治療的処置のために、健常な組織の部位に埋め込むことができることにも注目されたい。
【0092】
(実施例3)
ヨウ素化された造影剤を用いたX線を透過させないステント
長さ0.8〜1.2cmのPLLAのポリマー製ステントを使用し、この場合、PLLA製の繊維の直径は、0.01905cmであり、繊維の長さは、15〜22cmであった。イオヘキソールを、メタノール中に溶解させ、350mg/mLの濃度を得た。次いで、純粋なイオヘキソール溶液を、PLLA製のステントの上層上に吹き付け、約0.01’’の被覆の厚さを得た。全てのステント試料上の測定した用量は、1000μm/ステントであった。メタノールを蒸発させると、ステントの反管腔側表面が、イオヘキソールにより完全に覆われていた。被覆したステントのX線不透過性を、30秒間水に暴露させた後にc−arm下で観察した結果を、図13(#4)に示す。また、純粋なPLLAで形成した対照のステントのX線不透過性も試験した(#1)。
【0093】
(実施例4)
X線不透過性を生み出すために、ヨウ素化された造影剤による被覆の上にBA9−PLLA被覆用溶液を有するステント
PLLA製の繊維の直径が、0.01905cmであり、繊維の長さが、15〜22cmである、長さ0.8〜1.2cmのPLLAのポリマー製ステントを、イオヘキソールを用いて被覆した。ステントの特徴を、表1に示す。
【表1】

【0094】
最初に、イオヘキソールを、メタノール中に溶解させ、350mg/mLの濃度を得た。次いで、純粋なイオヘキソール溶液を、PLLA製のステントの上に吹き付け被覆した。全てのステント試料上の測定した用量は、1000μm/ステントであった。BAS−PLLA被覆用溶液をイオヘキソールの被覆の上に吹き付けて、反管腔側表面を完全に覆った。次いで、被覆したステントを、水中に30秒間又は2分間浸漬した後に観察した。
【表2】

【0095】
水に30秒間、2分間暴露した場合の被覆したステント、及び純粋なPLLAで形成した2つの対照のステントのX線不透過性を試験し、図14に示す。
【0096】
(実施例5)
X線不透過性を生み出すために、ステントにヨウ素化された造影剤を含浸させる
ステントのPLLA製の骨格に、造影剤を含浸させた。イオヘキソールの細かい粉末を、PLLA−クロロホルム溶液中に懸濁させ、イオヘキソールの26又は50重量パーセントの最終重量を得た。ステントのX線不透過性を、30秒間水に暴露させた後にc−arm下で観察した結果を、図13(#2及び#3)に示す。また、純粋なPLLAで形成した対照のステントのX線不透過性も試験した(#1)。図に示すように、X線不透過性は、イオヘキソールの重量パーセントの増加と共に増加した。
【0097】
好ましい実施形態を説明及び図解してきたが、付随する特許請求の範囲によって定義する本発明の精神及び範囲から逸脱することなく、種々の変更形態、置換形態及び代替形態を作製することができることを理解されたい。
【0098】
(実施例6)
疎水性のイオヘキソールによる被覆
A.ホスファチジルコリン−イオヘキソールのリポソームの調製
ホスファチジルコリン(PC,Sigma−Aldrichから入手可能、製品番号:P3556、20mg)を、長く伸びた首を有する50mlの丸底フラスコ中で10mLのクロロホルム中に溶解させ、次いで、クロロホルムを、回転式蒸発装置によって減圧下で除去する。次いで、系を、窒素を用いてパージし、PCをクロロホルム中に再度溶解させて、溶媒相を形成する。
【0099】
次いで、水相(1mLの蒸留水中の50mgのイオヘキソール)を添加し、系を、窒素下に引き続き保ち、得られた二相系を、浴型の超音波処理器(Bransonic Ultrasonic Cleaner、1510R−MTH)中で、混合液が、超音波処理後少なくとも30分間は分離しない清澄な一相性の分散系又は均一な乳白色の分散系のいずれかになるまで短時(2〜5分)間超音波処理する。超音波処理の温度は、20〜25℃である。次いで、混合液を回転式蒸発装置上に置き、減圧(水による吸引)下、20〜25℃、約200rpmで回転させて、クロロホルムを除去する。
【0100】
クロロホルムを蒸発させる間に、この系は、通常泡立つ。大部分の溶媒が除去されると、材料は、最初に粘性のゲルを形成し、続いて(5〜10分以内に)水性の懸濁液になる。この時点で、(必ずしも必要とは限らないが)過剰の水を加えてよく、懸濁液を、20℃で15分さらに蒸発させて、微量の溶媒を除去する。次いで、調製物を、遠心分離して、被包されていないイオヘキソール及び残余のクロロホルムを除去する。最後に、PC−イオヘキソールのリポソームを、450℃で少なくとも30分間維持して、水を完全に除去する。1mgのPC当たり1.7〜2.5mgのイオヘキソールとなると推定される。
【0101】
B.生分解性のステント上へのPC−イオヘキソールの拭き付け被覆
PC−イオヘキソールのリポソーム(10mg)を、(3mlの)エチレンアセテート中に懸濁し、30分間超音波処理する。次いで、この溶液を、ステント上に拭き付け被覆する。拭き付け被覆の工程を、最終的な被覆重量が1つのステント当たり1.5mgに達するまで続ける。次いで、ステントを、48時間真空乾燥して、エチレンアセテートを除去する。
【0102】
参考文献: 「逆相蒸発法(Reverse phase evaporation method)」、Henzeら、「コンピュータ断層撮影による、限局性の肝臓疾患の可視化の改善のためのX線を透過させないリポソーム(Radio−opaque liposomes for the improved visualization of focal liver disease by computerized tomography)」、Comput Med Imaging Graph. 1989 Nov−Dec;13(6):455−62.
【特許請求の範囲】
【請求項1】
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップと、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップと、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップと、
(d)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップ
から作られる、生体適合性ポリマーを包含する管状ステント。
【請求項2】
歯又はとげの手段によってかみ合う第1及び第2のロッキング部材を有する、請求項1に記載のステント。
【請求項3】
生分解性、生体吸収性及び生体内分解性のポリマーからなる群から選択されたポリマーで形成される、請求項1に記載のステント。
【請求項4】
ポリマー中に組み込まれ、ポリマーから放出される少なくとも1つの医薬品をさらに包含する、請求項1に記載のステント。
【請求項5】
前記ヨウ素化された造影剤が、被覆として、少なくとも反管腔側に適用される、請求項1に記載のステント。
【請求項6】
拡張可能な管状要素の山の谷に対向する、少なくとも2つの円周制限バンドを有する強度モジュールをさらに含み、
該拡張可能な管状要素が、4つ以下の山のピークを有し、
円周制限バンドの長さが、配置時のステントの大きさを画定し、各円周制限バンドの長さが、拡張可能な管状要素の長さより短い、
請求項1に記載のステント。
【請求項7】
前記ポリマー管をレーザー切断することによって生み出される、請求項1に記載のステント。
【請求項8】
前記ポリマーがヨウ素化された造影剤を含む、請求項1に記載のステント。
【請求項9】
増強された機械的強度を有するポリマーステントを作製する方法であって、
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップと、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップと、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップと、
(d)a〜cのステップを、ポリマー管が所望の厚さに達するまで繰り返すステップと、
(e)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、
該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップと、
(f)ポリマー管を、不活性ガスを用いて焼きなますステップと、
(g)ポリマー管を、心棒から取り外すステップと、
(h)該ポリマー管中に図柄を生み出すステップと
を含む、上記方法。
【請求項10】
前記図柄が前記ポリマー管をレーザー切断することによって生み出される、請求項9に記載の方法。
【請求項11】
1つ又は複数の生体適合性のポリマーを含む溶液が、1つ又は複数の活性医薬成分も含む、請求項9に記載の方法。
【請求項12】
1つ又は複数の生体適合性のポリマーを含む前記溶液が、少なくとも2つの溶液を含み、前記繰り返すステップが、繰り返す毎に心棒を異なる溶液中に浸漬被覆するステップを含む、請求項9に記載の方法。
【請求項13】
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップ、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップ、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップ、
(d)a〜cのステップを、ポリマー管が所望の厚さに達するまで繰り返すステップ、
(e)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、
該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップ、
(f)ポリマー管を、不活性ガスを用いて焼きなますステップ、
(g)ポリマー管を、心棒から取り外すステップ、及び
(h)該ポリマー管中に図柄を生み出すステップにより作られる、
増強された機械的強度を有するポリマーステント。
【請求項14】
ポリマーで形成されかつヨウ素化された造影剤を包含する管状構造を有する、請求項13に記載のポリマーステントであって、
該構造が、1つ又は複数の半径方向に拡張可能な管状要素を含む、1つ又は複数の強度モジュールを含み、
該強度モジュールが、ステントの柔軟性のために、1つ又は複数の軸方向の連結要素によって相互に接続されており、
該管状構造が、少なくともある拡張されていない直径とある拡張された直径との間で半径方向に拡張可能であり;且つ
強度モジュールのうちの少なくとも1つが、第1及び第2のロッキング部材を含むロッキング機構を有し、
該第1のロッキング部材が、管状要素の谷において固定して結合されており、
該第2のロッキング部材が、管状要素の谷において固定して結合されており、
該第1及び第2のロッキング部材が、半径方向に拡張可能な管状要素上で相互に対向して位置し、
それによって、該管状構造が拡張されていない直径にある場合には、該第1及び第2のロッキング部材は、相互にかみ合わず、該管状構造が該拡張された直径にある場合には、前記第1及び第2のロッキング部材は、相互にかみ合い、
該管状構造が、該拡張されていない直径と、2つ以上の個別の拡張された直径との間で半径方向に拡張可能であり、該2つ以上の拡張された直径のうちのいずれかにおいてロック可能である、
上記ポリマーステント。
【請求項15】
生分解性、生体吸収性及び生体内分解性のポリマーからなる群から選択されたポリマーで形成される、請求項13に記載のポリマーステント。
【請求項16】
ポリマー中に組み込まれ、ポリマーから放出される少なくとも1つの医薬品をさらに包含する、請求項13に記載のポリマーステント。
【請求項17】
前記ヨウ素化された造影剤が、被覆として、少なくとも反管腔側に適用される、請求項13に記載のポリマーステント。
【請求項18】
前記ポリマーが脂肪族ポリエステルポリマーである、請求項13に記載のポリマーステント。
【請求項19】
前記脂肪族ポリエステルポリマーがポリ−L−乳酸である、請求項18に記載のポリマーステント。
【請求項20】
拡張可能な管状要素の山の谷に対向する、少なくとも2つの円周制限バンドを有する強度モジュールをさらに含み、
該拡張可能な管状要素が、4つ以下の山のピークを有し、円周制限バンドの長さが、配置時のステントの大きさを画定し、各円周制限バンドの長さが、拡張可能な管状要素の長さより短い、
請求項13に記載のステント。
【請求項21】
前記ポリマー管をレーザー切断することによって生み出される、請求項13に記載のステント。
【請求項1】
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップと、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップと、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップと、
(d)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップ
から作られる、生体適合性ポリマーを包含する管状ステント。
【請求項2】
歯又はとげの手段によってかみ合う第1及び第2のロッキング部材を有する、請求項1に記載のステント。
【請求項3】
生分解性、生体吸収性及び生体内分解性のポリマーからなる群から選択されたポリマーで形成される、請求項1に記載のステント。
【請求項4】
ポリマー中に組み込まれ、ポリマーから放出される少なくとも1つの医薬品をさらに包含する、請求項1に記載のステント。
【請求項5】
前記ヨウ素化された造影剤が、被覆として、少なくとも反管腔側に適用される、請求項1に記載のステント。
【請求項6】
拡張可能な管状要素の山の谷に対向する、少なくとも2つの円周制限バンドを有する強度モジュールをさらに含み、
該拡張可能な管状要素が、4つ以下の山のピークを有し、
円周制限バンドの長さが、配置時のステントの大きさを画定し、各円周制限バンドの長さが、拡張可能な管状要素の長さより短い、
請求項1に記載のステント。
【請求項7】
前記ポリマー管をレーザー切断することによって生み出される、請求項1に記載のステント。
【請求項8】
前記ポリマーがヨウ素化された造影剤を含む、請求項1に記載のステント。
【請求項9】
増強された機械的強度を有するポリマーステントを作製する方法であって、
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップと、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップと、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップと、
(d)a〜cのステップを、ポリマー管が所望の厚さに達するまで繰り返すステップと、
(e)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、
該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップと、
(f)ポリマー管を、不活性ガスを用いて焼きなますステップと、
(g)ポリマー管を、心棒から取り外すステップと、
(h)該ポリマー管中に図柄を生み出すステップと
を含む、上記方法。
【請求項10】
前記図柄が前記ポリマー管をレーザー切断することによって生み出される、請求項9に記載の方法。
【請求項11】
1つ又は複数の生体適合性のポリマーを含む溶液が、1つ又は複数の活性医薬成分も含む、請求項9に記載の方法。
【請求項12】
1つ又は複数の生体適合性のポリマーを含む前記溶液が、少なくとも2つの溶液を含み、前記繰り返すステップが、繰り返す毎に心棒を異なる溶液中に浸漬被覆するステップを含む、請求項9に記載の方法。
【請求項13】
(a)心棒を、1つ又は複数の生体適合性のポリマーを含む溶液を用いて浸漬被覆して、ポリマー管を形成するステップであって、ポリマーのうちの少なくとも1つが、ヨウ素化された造影剤を包含するステップ、
(b)ポリマー管を、その長手方向の軸の周りに回転させて乾燥するステップ、
(c)ポリマー管を、溶媒研磨及び真空乾燥するステップ、
(d)a〜cのステップを、ポリマー管が所望の厚さに達するまで繰り返すステップ、
(e)ポリマー管を担持する心棒を、直径が減少する1つ又は複数の引き抜き用のダイスを通して引き出すことによって、ポリマー管を引き抜くステップであって、
該引き抜くステップが、ポリマーのガラス転移温度超且つポリマーの融解温度未満の温度において実施されるステップ、
(f)ポリマー管を、不活性ガスを用いて焼きなますステップ、
(g)ポリマー管を、心棒から取り外すステップ、及び
(h)該ポリマー管中に図柄を生み出すステップにより作られる、
増強された機械的強度を有するポリマーステント。
【請求項14】
ポリマーで形成されかつヨウ素化された造影剤を包含する管状構造を有する、請求項13に記載のポリマーステントであって、
該構造が、1つ又は複数の半径方向に拡張可能な管状要素を含む、1つ又は複数の強度モジュールを含み、
該強度モジュールが、ステントの柔軟性のために、1つ又は複数の軸方向の連結要素によって相互に接続されており、
該管状構造が、少なくともある拡張されていない直径とある拡張された直径との間で半径方向に拡張可能であり;且つ
強度モジュールのうちの少なくとも1つが、第1及び第2のロッキング部材を含むロッキング機構を有し、
該第1のロッキング部材が、管状要素の谷において固定して結合されており、
該第2のロッキング部材が、管状要素の谷において固定して結合されており、
該第1及び第2のロッキング部材が、半径方向に拡張可能な管状要素上で相互に対向して位置し、
それによって、該管状構造が拡張されていない直径にある場合には、該第1及び第2のロッキング部材は、相互にかみ合わず、該管状構造が該拡張された直径にある場合には、前記第1及び第2のロッキング部材は、相互にかみ合い、
該管状構造が、該拡張されていない直径と、2つ以上の個別の拡張された直径との間で半径方向に拡張可能であり、該2つ以上の拡張された直径のうちのいずれかにおいてロック可能である、
上記ポリマーステント。
【請求項15】
生分解性、生体吸収性及び生体内分解性のポリマーからなる群から選択されたポリマーで形成される、請求項13に記載のポリマーステント。
【請求項16】
ポリマー中に組み込まれ、ポリマーから放出される少なくとも1つの医薬品をさらに包含する、請求項13に記載のポリマーステント。
【請求項17】
前記ヨウ素化された造影剤が、被覆として、少なくとも反管腔側に適用される、請求項13に記載のポリマーステント。
【請求項18】
前記ポリマーが脂肪族ポリエステルポリマーである、請求項13に記載のポリマーステント。
【請求項19】
前記脂肪族ポリエステルポリマーがポリ−L−乳酸である、請求項18に記載のポリマーステント。
【請求項20】
拡張可能な管状要素の山の谷に対向する、少なくとも2つの円周制限バンドを有する強度モジュールをさらに含み、
該拡張可能な管状要素が、4つ以下の山のピークを有し、円周制限バンドの長さが、配置時のステントの大きさを画定し、各円周制限バンドの長さが、拡張可能な管状要素の長さより短い、
請求項13に記載のステント。
【請求項21】
前記ポリマー管をレーザー切断することによって生み出される、請求項13に記載のステント。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2012−120850(P2012−120850A)
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願番号】特願2012−1802(P2012−1802)
【出願日】平成24年1月10日(2012.1.10)
【分割の表示】特願2009−534642(P2009−534642)の分割
【原出願日】平成19年10月24日(2007.10.24)
【出願人】(504395257)バイオセンサーズ インターナショナル グループ、リミテッド (16)
【Fターム(参考)】
【公開日】平成24年6月28日(2012.6.28)
【国際特許分類】
【出願日】平成24年1月10日(2012.1.10)
【分割の表示】特願2009−534642(P2009−534642)の分割
【原出願日】平成19年10月24日(2007.10.24)
【出願人】(504395257)バイオセンサーズ インターナショナル グループ、リミテッド (16)
【Fターム(参考)】
[ Back to top ]

