三次元培養色素沈着皮膚モデル、その製造方法および三次元培養色素沈着皮膚モデルを用いたメラニンの局在・排出・代謝・分解の評価方法
【課題】 新規の三次元培養色素沈着皮膚モデル、その製造方法および三次元培養色素沈着皮膚モデルを用いたメラニンの局在・排出・代謝・分解の評価方法を提供する。
【解決手段】 メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することにより三次元培養色素沈着皮膚モデルを作製する。この製造方法により得られた三次元培養色素沈着皮膚モデルを用いて、メラニンの局在・排出・代謝・分解を評価することができる。また、色素沈着のモデルと美白剤の効果を評価することができる。本発明のキットは、このような三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたものである。
【解決手段】 メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することにより三次元培養色素沈着皮膚モデルを作製する。この製造方法により得られた三次元培養色素沈着皮膚モデルを用いて、メラニンの局在・排出・代謝・分解を評価することができる。また、色素沈着のモデルと美白剤の効果を評価することができる。本発明のキットは、このような三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたものである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、新規の三次元培養色素沈着皮膚モデルとその製造方法、及びその三次元培養色素沈着皮膚モデルを用いたメラニンの局在・排出・代謝・分解の評価方法、及び色素沈着のモデルと美白剤の評価方法に関する。
【背景技術】
【0002】
皮膚のメラニンは、表皮基底層にある色素細胞(メラノサイト)内のメラノソームと呼ばれる小器官において生成され、生成したメラニンは周囲の角化細胞(ケラチノサイト)に取り込まれる。取り込まれたメラニンは角化細胞の代謝(ターンオーバー)とともに角層まで移行し約40日かけて生体外に排出される。皮膚のしみ・そばかすなどの色素沈着は、ホルモンの異常や紫外線曝露、局所の炎症によりメラノサイトでメラニンが過剰に形成されることや、メラニン顆粒が表皮基底層の角化細胞内に沈着することが原因と考えられる。メラニンの生成の程度を評価する方法としては、培養したメラノサイトやメラノーマ細胞を用いて、それらが生成するメラニンの量を評価する方法がある。しかし、表皮基底層の角化細胞に沈着したメラニン顆粒の代謝・排出を評価するモデルやメラニン顆粒が沈着するメカニズムを研究する三次元培養皮膚モデルは存在しなかった。
【0003】
メラニンは、メラノサイト内のメラノソームで生成され、メラノサイトの樹枝状突起の先端まで運ばれる。角化細胞がメラノサイトの樹枝状突起の先端を貪食することにより角化細胞内にメラノソームが取り込まれる。取り込まれたメラノソームはライソファゴソームに取り込まれ、メラノソーム複合体として存在するようになる。メラノサイトのメラノソームや角化細胞内のメラノソーム複合体の代謝を調べる方法としては、表皮にメラノサイトを有する動物を用いて組織学的に調べることができるが、動物愛護の精神から、培養系での評価法の開発が望まれていた。
【0004】
動物実験代替法の一つとしてヒトの培養皮膚モデルが報告されている(非特許文献1)。
【0005】
市販されているものとしては、エピダーム(Epiderm )(クラボウ,日本)、ラボサイトEPIモデル(LabCyte EPI-MODEL) (J−TEC、日本)、テストスキンLSE(Test Skin LSE),テストスキンLSEハイ(Test Skin LSE high)(東洋紡,日本)、スキンエシック(SkinEthic )(スキンエシックラボラトリーズ(SkinEthic Laboratories)社,フランス) 、エピスキン(Episkin )(エピスキン(Episkin)SNC社,フランス)等を挙げることができる。これらの培養皮膚モデルは、メンブランやコラーゲンゲル、皮膚線維芽細胞含有コラーゲンゲル、デエピダーミストダーミス(de-epidermised dermis)(DED)等の支持体上に角化細胞を播種して、浸漬培養、気相・液体培養することで、実際の皮膚と同様の表皮各層(基底層、有棘層、顆粒層、角層)からなる表皮が形成される。また、これらの皮膚モデルの培養は、主に正常な表皮や角層が形成されることを主眼に研究開発されたもので、経皮投与実験による皮膚透過性試験や皮膚刺激性試験に用いられている。また、基底膜構成成分や角化細胞の遺伝子発現がより実際の皮膚に近くなるような皮膚モデルの研究も行われている。さらに、メラノサイトを含む培養皮膚モデルも開発されてきた(非特許文献2)。これはコラーゲンコート(collagen-coated)した24ウェルプレートサイズセルカルチャーインサート(24-well plate size cell culture inserts )(例えば、ミリセルCM(Millicell)あるいはヌンクポリカーボネイトセルカルチャーインサート(Nunc polycarbonate cell culture inserts))を用いており、それにメラノサイトと角化細胞を1:10で播種して、角化細胞を8〜12層に重層化したモデルである。基本培地はダルベッコ変法イーグル培地(Dulbecco's Modified Eagle's Medium )(DMEM)で、増殖因子/ホルモン(Growth factors/hormones)として上皮細胞増殖因子(Epidermal growth factor )(マウス)、インスリン(insulin)、ヒドロコルチゾン(hydrocortisone)、表皮分化のためのほかの適切な刺激因子(other proprietary stimulators of epidermal differentiation)が用いられている。また、その他に皮膚線維芽細胞含有コラーゲンゲルを支持体に用いた、メラノサイトを用いたヒト全層皮膚モデル再構成(Reconstituted Human Full-Thickness Skin Model with Melanocytes )(スキンエシックモデルエピスキン(スキンエシックラボラトリーズ(SkinEthic Laboratories),フランス)やデエピダーミストダーミス(De-epidermised dermis )(DEC)を支持体に用いた色素性モデルエピスキン(Pigmented Model Episkin )(エピスキン(Episkin)SNC社,フランス)が市販されてきた。
【非特許文献1】Rosdy M., Clauss L.C.: Terminal epidermal differentiation of human keratinocytes grown in chemically defined medium on inert filter substrates at the air-liquid interface. J. Invest. Dermatol. 95: 409-414, 1990
【非特許文献2】MelanoDerm MatTek, USA, MEL-300, 312, クラボウ
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、これらの皮膚モデルではメラノサイトが生成したメラニン顆粒は角化細胞に十分に移行しないので、メラニン顆粒が表皮基底層の角化細胞内に沈着するモデルとしては利用できない。即ち、色素沈着した生体皮膚の部位では角化細胞、特に基底層に、より大きなメラニン顆粒がメラノソーム複合体として存在している(図7、図8)が、この状態を再現する皮膚モデルは存在していないのが現状である(図9)。
【0007】
ここで、図7は、電子顕微鏡による正常皮膚と老人性色素斑組織の観察例を示す。倫理委員会で承認された計画書とインフォームドコンセントに従い、健常男性7名の背部より老人性色素斑皮膚とその近傍の正常皮膚を生検した。正常皮膚の表皮基底層の角化細胞内では、メラノソームは単独又は数個の複合体として存在していたが、老人性色素斑の基底層の角化細胞内では、大きなメラノソーム複合体として存在していた。老人性色素斑では、メラノサイト内のメラノソームの大きさに比べて角化細胞内のメラノソーム複合体が異常に大きくなっていた。また、有棘層にも大きなメラノソーム複合体が見られた。
【0008】
そして、図8は、正常皮膚と老人性色素斑組織のメラノソーム複合体の数と大きさの比較を示す。7名の正常皮膚と老人性色素斑皮膚について、表皮基底層の一個あたりの角化細胞内にあるメラノソーム複合体の数と大きさ(面積)を電子顕微鏡写真より解析した。計測は、トレース紙に写した像をウィンルーフ(WinRoof)(解析ソフト)を用いて行った。老人性色素斑の表皮基底層の角化細胞では、正常部位の角化細胞に比べて、細胞一個あたりのメラノソーム複合体の数と大きさが増加していることがわかった。特に、数の増加に比べて大きさが著しく増加していることがわかった。*P<0.05,+<0.10 t−検定(t-test)による。
【0009】
図9は、ヒト正常メラノサイトとヒト正常角化細胞の三次元培養モデルの凍結組織切片像(10μm)を示す。基底層にあるメラノサイトが黒く見えた。
【課題を解決するための手段】
【0010】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞の単層培養については文献等で報告されているが、メラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞の三次元培養した皮膚モデルは知られていない。
【0011】
そこで、本発明者らは、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種して、三次元培養することにより、色素沈着皮膚モデルを作製した。これは、メラニンの局在・排出・代謝・分解の評価方法や色素沈着のモデル、美白剤の評価に応用できることを見出し、本発明を完成するに至った。
【0012】
即ち、本発明の請求項1記載の三次元培養色素沈着皮膚モデルの製造方法は、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有させた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することを特徴とする。
【0013】
そして、本発明の請求項2記載の三次元培養色素沈着皮膚モデルの製造方法は、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養することを特徴とする。
【0014】
そして、本発明の請求項3記載の三次元培養色素沈着皮膚モデルの製造方法は、正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地で三次元培養することを特徴とする。
【0015】
そして、本発明の請求項4記載の三次元培養色素沈着皮膚モデルは、請求項1〜3のいずれかに記載の三次元培養色素沈着皮膚モデルの製造方法により得られたことを特徴とする。
【0016】
そして、本発明の請求項5記載のメラニンの局在・排出・代謝・分解の評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いてメラニンの局在および/または排出および/または代謝および/または分解を評価することを特徴とする。
【0017】
そして、本発明の請求項6記載の色素沈着モデルの評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することを特徴とする。
【0018】
そして、本発明の請求項7記載の美白剤の評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することを特徴とする。
【0019】
また、本発明の請求項8記載の三次元培養色素沈着皮膚モデル作製用キットは、請求項4記載の三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたことを特徴とする。
【発明の効果】
【0020】
本発明によれば、本発明の三次元培養色素沈着皮膚モデルを用いて、メラニンの局在・排出・代謝・分解を評価することができる。また、色素沈着のモデルやメラニンの局在・排出・代謝・分解に作用する美白剤の効果を評価することができる。
【発明を実施するための最良の形態】
【0021】
以下に、本発明の最良の実施形態について説明する。
【0022】
本発明の三次元培養色素沈着皮膚モデルの製造方法は、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することにより、細胞を重層化させ、三次元培養色素沈着皮膚モデルを作製するものである。
【0023】
そして、その製造方法は、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養してもよい。
【0024】
また、正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地で三次元培養してもよい。
【0025】
また、支持体上に角化細胞および/または不死化角化細胞および/または表皮細胞を播種して培養した後にメラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地で培養することによって得られる培養皮膚を、更に、メラニン、メラノソーム、蛍光ビーズを含まない培地で培養することによって三次元培養することにより、細胞を重層化させ、三次元培養色素沈着皮膚モデルを作製してもよい。
【0026】
培養皮膚モデルは、一般に、メンブラン、コラーゲンゲル、皮膚線維芽細胞含有コラーゲンゲル、DED等からなる支持体上に表皮細胞(表皮角化細胞、色素細胞)を播種し、必要により浸漬培養、気相・液体培養を組み合わせて作製される。市販されているものとして、エピダーム(Epiderm )(クラボウ,日本)、ラボサイトEPIモデル(LabCyte EPI-MODEL )(J-TEC,日本)、テストスキンLSE(Test Skin LSE)、テストスキンLSEハイ(Test Skin LSE high)、(東洋紡、日本)、スキンエシック(SkinEthic )(スキンエシックラボラトリーズ(SkinEthic Laboratories)社,フランス)、エピスキン(Episkin )(エピスキン(Episkin)SNC社,フランス)等を挙げることができる。支持体としては、播種した表皮細胞が接着又は固定され、その上で増殖するものであれば特に限定されるものではなく、支持体を基盤として三次元に細胞が培養される。
【0027】
本発明における支持体としては、メンブラン、コラーゲンゲル、線維芽細胞含有コラーゲンゲル、基底膜構成成分、プレート、オプティセル(OptiCell )(バイオクリスタル(Biocrystal)社,アメリカ)、DED等のいずれも用いることができる。メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加して角化細胞を6〜48時間培養して、角化細胞内にこれらを取り込ませ、支持体に再度播種しなおすか、あるいは支持体に播種した角化細胞に取り込ませ、培地を交換して通常の方法で培養皮膚モデルを作製する。
【0028】
上記のキットを用いて、0日から2日培養時にメラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加する前処理を施すことで、色素沈着皮膚モデルを作製してもよい。
【0029】
ここで、正常角化細胞としては、ヒトや動物の正常角化細胞を用いることができ、また、不死化角化細胞としては、HaCaTやPAM212等を用いることができる。また用いる細胞としては、ヒトに限らず、マウス、ラット、ブタ等の表皮細胞でも良い。
【0030】
本発明に用いるメラニンは、ヒト毛髪メラニン、合成メラニン(シグマアルドリッチ(Sigma Aldrich)等)、イカメラニン、動物体毛メラニン等を用いることができる。また、メラノソームは培養ヒトメラノサイト、培養メラノーマ細胞(マウスB16メラノーマ、4A5、ヒト等)から抽出したメラノソーム粗抽出分画や精製品を用いることができる。蛍光ビーズは0.02μm〜4μmまでのカルボン酸修飾マイクロスフェア(Carboxylate-modified microspheres)、硫酸マイクロスフェア(Sulfate microspheres)、硫酸アルデヒドマイクロスフェア(Aldehyde-sulfate microspheres)、アミン修飾マイクロスフェア(Amine-modified microspheres)(モレキュラープローブ(Molecular Probe)社,アメリカ)を用いることができるが、これらに限定されるものではない。直径はメラノソームと同程度の大きさの0.1μm程度の大きさが好ましい。
【0031】
これらは、水や培地等に適宜溶解し、培地に添加する。添加量は、一概には規定できないがメラニンとメラノソームは405nmの吸光度0.2を培地に1/1,000〜1/10倍量添加、または1μg/mLから1,000μg/mL程度の濃度、蛍光ビーズは1×108個〜1×1012個/mLとすることが望ましい。
【0032】
そして、本発明の三次元培養色素沈着皮膚モデルは、上記のような製造方法により得られたものである。
【0033】
そして、本発明のメラニンの局在・排出・代謝・分解の評価方法によれば、上記のような製造方法により得られた三次元培養色素沈着皮膚モデルを用いてメラニンの局在や排出、代謝、分解等を評価することができる。
【0034】
そして、本発明の色素沈着モデルの評価方法は、上記のような製造方法により得られた三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することができる。
【0035】
そして、本発明の美白剤の評価方法は、上記のような三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することができる。
【0036】
また、本発明の三次元培養色素沈着皮膚モデル作製用キットは、上記のような三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたものである。
【0037】
以下に具体例を挙げて詳細に説明するが、本発明の技術的範囲はこれらの具体例により何ら制限されるものではない。
【実施例1】
【0038】
(三次元培養色素沈着皮膚モデルの作製)
1.1 メラノソームの調製
マウスB16メラノーマ培養細胞を10%ウシ血清およびテオフィリン(0.09mg/mL)を含むイーグルMEM培地でCO2インキュベーター(95%空気,5%二酸化炭素)内、37℃の条件下で培養し増殖させた。細胞をトリプシン溶液で剥がし、ウシ血清(10%)を含むイーグルMEM培地を加え、1,100rpmで遠心して細胞を集めた。
【0039】
細胞をホモジネートバッファ(250mM スクロース(Sucrose)、10mMトリス(Tris)、10mM KCl)中でガラスホモジナイザーを用いて氷上で30回ほどホモジネートした。さらにシリンジ(26G)を通し、15mLの遠心チューブへ入れて、700rpm、5分遠心した。その上清をエッペンドルフチューブへ入れて、メラノソームとした。
【0040】
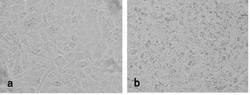
1.2 角化細胞へのメラノソームの取り込み
ディシュ(100x20mm)にヒト正常角化細胞を300,000個になるように播種し、5mLの培地で1日間培養後、メラノソームを含む培地で6時間培養した(図1)。結果を図4に示した。図1(a)の培養角化細胞に対し、図1(b)のメラノソームを取り込ませた培養角化細胞では、取り込んだメラノソームがメラノソーム複合体となって位相差顕微鏡下で見えるようになった。
【0041】
1.3 メラノソームを取り込ませた角化細胞の三次元培養
細胞をトリプシン溶液で剥がし、ウシ血清(10%)を含む培地を加え、1,100rpmで遠心して細胞を集め、カルチャーインサートに播種した。37℃のCO2インキュベーターで3日間空気曝露培養して色素沈着皮膚モデルを作製した。培養3日後に色素沈着皮膚モデルの凍結組織切片を作製して光学顕微鏡で観察した(図2)。
【0042】
比較例として、メラノサイトと角化細胞を播種して作製した三次元モデルの凍結組織切片を作製して光学顕微鏡で観察した(図3)。さらに、これらの凍結組織切片を作成し、画像を比較した(図4)。
【0043】
結果を図2〜図4に示した。図2は、メラノソームを取り込ませたヒト正常角化細胞の三次元培養色素沈着皮膚モデルを示す。画像は、位相差顕微鏡でカルチャープレートの上にすりガラス置いて取り込んだ。角化細胞に取り込まれたメラノソームが核周囲にメラノソーム複合体として集積して、黒く見えるようになった。図3は、ヒト正常メラノサイトとヒト正常角化細胞の三次元培養皮膚モデルを示す。画像は、位相差顕微鏡でカルチャープレートの上にすりガラス置いて取り込んだ。メラノサイトは黒く見えたが、角化細胞は黒く見えなかった。そして、図4は、(a)培養色素沈着皮膚モデル(実施例)と(b)メラノサイト含有皮膚モデル(比較例)の凍結組織切片像(10μm)を示す。(a)培養色素沈着皮膚モデルについては、角化細胞が黒く見えた。(b)メラノサイト含有皮膚モデルについては、基底層にあるメラノサイトが黒く見えた。
【0044】
比較例に示したように、通常の培養皮膚モデルでは、角化細胞でメラニン顆粒(メラノソーム複合体)がほとんど見られず、メラノサイトが主に黒く観察された。一方、実施例1に示したように、メラノソームを角化細胞に取り込ませた後に三次元構築して培養すると、基底層の角化細胞内に多くのメラニン顆粒(メラノソーム複合体)が黒く認められるようになり、色素沈着した皮膚の組織像に類似してモデルを作製することができた。また、凍結組織切片の画像もこの知見を支持した(図4)。
【0045】
以上の結果より、本発明により作製した培養皮膚モデルは、色素沈着皮膚モデルとして有用であると考えられた。
【実施例2】
【0046】
(色素沈着培養皮膚モデルの作製)
2.1 蛍光ビーズの調製
蛍光ビーズは0.1μmのカルボン酸修飾マイクロスフェア(Carboxylate-modified microshperes )(モレキュラープローブ(Molecular Probe)社,アメリカ)を購入して用いた。培地に添加する前に、超音波振動を3分かけてビーズを均一化した。
【0047】
2.2 角化細胞への蛍光ビーズの取り込み
ディシュ(100x20mm)にヒト正常角化細胞を300,000個になるように播種し、5mLの培地で1日間培養後、1×1010個/mLの蛍光ビーズを含む培地で6時間培養した(図5)。結果を図5に示した。図5は、蛍光ビーズを取り込ませた単層培養角化細胞を共焦点レーザースキャン顕微鏡で観察した画像である。赤は蛍光ビーズ(0.1μm)、青は核を表す。単層培養した角化細胞では核の周囲に基質面(支持体、右図では下側)と平行にビーズが集積した。
【0048】
2.3 蛍光ビーズを取り込ませた角化細胞の三次元培養
培地を取り除き、リン酸塩緩衝液で3回洗浄して、37℃のCO2インキュベーターで3日間培養して色素沈着皮膚モデルを作製した。培養3日後に色素沈着皮膚モデル皮膚を共焦点レーザースキャン顕微鏡(LSMパスカル(LSM5Pascal),カールツワィス( Carl Zeiss),ドイツ)で観察した(図6)。図6は、培養角化細胞に蛍光ビーズを取り込ませ三次元培養したときの共焦点レーザースキャン顕微鏡画像である。赤は蛍光ビーズ(0.1μm)、青は核を表す。三次元培養した角化細胞では基質面(支持体、図では下側)と反対側にビーズが集積するものもみられた。
【図面の簡単な説明】
【0049】
【図1】(a)培養角化細胞及び(b)メラノソームを取り込ませた培養角化細胞の位相差顕微鏡写真である。
【図2】メラノソームを取り込ませたヒト正常角化細胞の三次元培養色素沈着皮膚モデルの位相差顕微鏡写真である。
【図3】ヒト正常メラノサイトとヒト正常角化細胞の三次元培養皮膚モデルの位相差顕微鏡写真である。
【図4】(a)培養色素沈着皮膚モデル(実施例)及び(b)メラノサイト含有皮膚モデル(比較例)の凍結組織切片像(10μm)を示す写真である。
【図5】蛍光ビーズを取り込ませた単層培養角化細胞の共焦点レーザースキャン顕微鏡写真である。
【図6】培養角化細胞に蛍光ビーズを取り込ませ三次元培養したときの共焦点レーザースキャン顕微鏡写真である。
【図7】正常皮膚と老人性色素斑組織の電子顕微鏡写真である。
【図8】正常皮膚と老人性色素斑組織のメラノソーム複合体の数と大きさの比較を示すグラフである。
【図9】ヒト正常メラノサイトとヒト正常角化細胞の三次元培養モデルの凍結組織切片像(10μm)を示す写真である。
【技術分野】
【0001】
本発明は、新規の三次元培養色素沈着皮膚モデルとその製造方法、及びその三次元培養色素沈着皮膚モデルを用いたメラニンの局在・排出・代謝・分解の評価方法、及び色素沈着のモデルと美白剤の評価方法に関する。
【背景技術】
【0002】
皮膚のメラニンは、表皮基底層にある色素細胞(メラノサイト)内のメラノソームと呼ばれる小器官において生成され、生成したメラニンは周囲の角化細胞(ケラチノサイト)に取り込まれる。取り込まれたメラニンは角化細胞の代謝(ターンオーバー)とともに角層まで移行し約40日かけて生体外に排出される。皮膚のしみ・そばかすなどの色素沈着は、ホルモンの異常や紫外線曝露、局所の炎症によりメラノサイトでメラニンが過剰に形成されることや、メラニン顆粒が表皮基底層の角化細胞内に沈着することが原因と考えられる。メラニンの生成の程度を評価する方法としては、培養したメラノサイトやメラノーマ細胞を用いて、それらが生成するメラニンの量を評価する方法がある。しかし、表皮基底層の角化細胞に沈着したメラニン顆粒の代謝・排出を評価するモデルやメラニン顆粒が沈着するメカニズムを研究する三次元培養皮膚モデルは存在しなかった。
【0003】
メラニンは、メラノサイト内のメラノソームで生成され、メラノサイトの樹枝状突起の先端まで運ばれる。角化細胞がメラノサイトの樹枝状突起の先端を貪食することにより角化細胞内にメラノソームが取り込まれる。取り込まれたメラノソームはライソファゴソームに取り込まれ、メラノソーム複合体として存在するようになる。メラノサイトのメラノソームや角化細胞内のメラノソーム複合体の代謝を調べる方法としては、表皮にメラノサイトを有する動物を用いて組織学的に調べることができるが、動物愛護の精神から、培養系での評価法の開発が望まれていた。
【0004】
動物実験代替法の一つとしてヒトの培養皮膚モデルが報告されている(非特許文献1)。
【0005】
市販されているものとしては、エピダーム(Epiderm )(クラボウ,日本)、ラボサイトEPIモデル(LabCyte EPI-MODEL) (J−TEC、日本)、テストスキンLSE(Test Skin LSE),テストスキンLSEハイ(Test Skin LSE high)(東洋紡,日本)、スキンエシック(SkinEthic )(スキンエシックラボラトリーズ(SkinEthic Laboratories)社,フランス) 、エピスキン(Episkin )(エピスキン(Episkin)SNC社,フランス)等を挙げることができる。これらの培養皮膚モデルは、メンブランやコラーゲンゲル、皮膚線維芽細胞含有コラーゲンゲル、デエピダーミストダーミス(de-epidermised dermis)(DED)等の支持体上に角化細胞を播種して、浸漬培養、気相・液体培養することで、実際の皮膚と同様の表皮各層(基底層、有棘層、顆粒層、角層)からなる表皮が形成される。また、これらの皮膚モデルの培養は、主に正常な表皮や角層が形成されることを主眼に研究開発されたもので、経皮投与実験による皮膚透過性試験や皮膚刺激性試験に用いられている。また、基底膜構成成分や角化細胞の遺伝子発現がより実際の皮膚に近くなるような皮膚モデルの研究も行われている。さらに、メラノサイトを含む培養皮膚モデルも開発されてきた(非特許文献2)。これはコラーゲンコート(collagen-coated)した24ウェルプレートサイズセルカルチャーインサート(24-well plate size cell culture inserts )(例えば、ミリセルCM(Millicell)あるいはヌンクポリカーボネイトセルカルチャーインサート(Nunc polycarbonate cell culture inserts))を用いており、それにメラノサイトと角化細胞を1:10で播種して、角化細胞を8〜12層に重層化したモデルである。基本培地はダルベッコ変法イーグル培地(Dulbecco's Modified Eagle's Medium )(DMEM)で、増殖因子/ホルモン(Growth factors/hormones)として上皮細胞増殖因子(Epidermal growth factor )(マウス)、インスリン(insulin)、ヒドロコルチゾン(hydrocortisone)、表皮分化のためのほかの適切な刺激因子(other proprietary stimulators of epidermal differentiation)が用いられている。また、その他に皮膚線維芽細胞含有コラーゲンゲルを支持体に用いた、メラノサイトを用いたヒト全層皮膚モデル再構成(Reconstituted Human Full-Thickness Skin Model with Melanocytes )(スキンエシックモデルエピスキン(スキンエシックラボラトリーズ(SkinEthic Laboratories),フランス)やデエピダーミストダーミス(De-epidermised dermis )(DEC)を支持体に用いた色素性モデルエピスキン(Pigmented Model Episkin )(エピスキン(Episkin)SNC社,フランス)が市販されてきた。
【非特許文献1】Rosdy M., Clauss L.C.: Terminal epidermal differentiation of human keratinocytes grown in chemically defined medium on inert filter substrates at the air-liquid interface. J. Invest. Dermatol. 95: 409-414, 1990
【非特許文献2】MelanoDerm MatTek, USA, MEL-300, 312, クラボウ
【発明の開示】
【発明が解決しようとする課題】
【0006】
しかしながら、これらの皮膚モデルではメラノサイトが生成したメラニン顆粒は角化細胞に十分に移行しないので、メラニン顆粒が表皮基底層の角化細胞内に沈着するモデルとしては利用できない。即ち、色素沈着した生体皮膚の部位では角化細胞、特に基底層に、より大きなメラニン顆粒がメラノソーム複合体として存在している(図7、図8)が、この状態を再現する皮膚モデルは存在していないのが現状である(図9)。
【0007】
ここで、図7は、電子顕微鏡による正常皮膚と老人性色素斑組織の観察例を示す。倫理委員会で承認された計画書とインフォームドコンセントに従い、健常男性7名の背部より老人性色素斑皮膚とその近傍の正常皮膚を生検した。正常皮膚の表皮基底層の角化細胞内では、メラノソームは単独又は数個の複合体として存在していたが、老人性色素斑の基底層の角化細胞内では、大きなメラノソーム複合体として存在していた。老人性色素斑では、メラノサイト内のメラノソームの大きさに比べて角化細胞内のメラノソーム複合体が異常に大きくなっていた。また、有棘層にも大きなメラノソーム複合体が見られた。
【0008】
そして、図8は、正常皮膚と老人性色素斑組織のメラノソーム複合体の数と大きさの比較を示す。7名の正常皮膚と老人性色素斑皮膚について、表皮基底層の一個あたりの角化細胞内にあるメラノソーム複合体の数と大きさ(面積)を電子顕微鏡写真より解析した。計測は、トレース紙に写した像をウィンルーフ(WinRoof)(解析ソフト)を用いて行った。老人性色素斑の表皮基底層の角化細胞では、正常部位の角化細胞に比べて、細胞一個あたりのメラノソーム複合体の数と大きさが増加していることがわかった。特に、数の増加に比べて大きさが著しく増加していることがわかった。*P<0.05,+<0.10 t−検定(t-test)による。
【0009】
図9は、ヒト正常メラノサイトとヒト正常角化細胞の三次元培養モデルの凍結組織切片像(10μm)を示す。基底層にあるメラノサイトが黒く見えた。
【課題を解決するための手段】
【0010】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞の単層培養については文献等で報告されているが、メラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞の三次元培養した皮膚モデルは知られていない。
【0011】
そこで、本発明者らは、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを取り込ませた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種して、三次元培養することにより、色素沈着皮膚モデルを作製した。これは、メラニンの局在・排出・代謝・分解の評価方法や色素沈着のモデル、美白剤の評価に応用できることを見出し、本発明を完成するに至った。
【0012】
即ち、本発明の請求項1記載の三次元培養色素沈着皮膚モデルの製造方法は、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有させた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することを特徴とする。
【0013】
そして、本発明の請求項2記載の三次元培養色素沈着皮膚モデルの製造方法は、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養することを特徴とする。
【0014】
そして、本発明の請求項3記載の三次元培養色素沈着皮膚モデルの製造方法は、正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地で三次元培養することを特徴とする。
【0015】
そして、本発明の請求項4記載の三次元培養色素沈着皮膚モデルは、請求項1〜3のいずれかに記載の三次元培養色素沈着皮膚モデルの製造方法により得られたことを特徴とする。
【0016】
そして、本発明の請求項5記載のメラニンの局在・排出・代謝・分解の評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いてメラニンの局在および/または排出および/または代謝および/または分解を評価することを特徴とする。
【0017】
そして、本発明の請求項6記載の色素沈着モデルの評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することを特徴とする。
【0018】
そして、本発明の請求項7記載の美白剤の評価方法は、請求項4記載の三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することを特徴とする。
【0019】
また、本発明の請求項8記載の三次元培養色素沈着皮膚モデル作製用キットは、請求項4記載の三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたことを特徴とする。
【発明の効果】
【0020】
本発明によれば、本発明の三次元培養色素沈着皮膚モデルを用いて、メラニンの局在・排出・代謝・分解を評価することができる。また、色素沈着のモデルやメラニンの局在・排出・代謝・分解に作用する美白剤の効果を評価することができる。
【発明を実施するための最良の形態】
【0021】
以下に、本発明の最良の実施形態について説明する。
【0022】
本発明の三次元培養色素沈着皮膚モデルの製造方法は、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することにより、細胞を重層化させ、三次元培養色素沈着皮膚モデルを作製するものである。
【0023】
そして、その製造方法は、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養してもよい。
【0024】
また、正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地で三次元培養してもよい。
【0025】
また、支持体上に角化細胞および/または不死化角化細胞および/または表皮細胞を播種して培養した後にメラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加した培地で培養することによって得られる培養皮膚を、更に、メラニン、メラノソーム、蛍光ビーズを含まない培地で培養することによって三次元培養することにより、細胞を重層化させ、三次元培養色素沈着皮膚モデルを作製してもよい。
【0026】
培養皮膚モデルは、一般に、メンブラン、コラーゲンゲル、皮膚線維芽細胞含有コラーゲンゲル、DED等からなる支持体上に表皮細胞(表皮角化細胞、色素細胞)を播種し、必要により浸漬培養、気相・液体培養を組み合わせて作製される。市販されているものとして、エピダーム(Epiderm )(クラボウ,日本)、ラボサイトEPIモデル(LabCyte EPI-MODEL )(J-TEC,日本)、テストスキンLSE(Test Skin LSE)、テストスキンLSEハイ(Test Skin LSE high)、(東洋紡、日本)、スキンエシック(SkinEthic )(スキンエシックラボラトリーズ(SkinEthic Laboratories)社,フランス)、エピスキン(Episkin )(エピスキン(Episkin)SNC社,フランス)等を挙げることができる。支持体としては、播種した表皮細胞が接着又は固定され、その上で増殖するものであれば特に限定されるものではなく、支持体を基盤として三次元に細胞が培養される。
【0027】
本発明における支持体としては、メンブラン、コラーゲンゲル、線維芽細胞含有コラーゲンゲル、基底膜構成成分、プレート、オプティセル(OptiCell )(バイオクリスタル(Biocrystal)社,アメリカ)、DED等のいずれも用いることができる。メラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加して角化細胞を6〜48時間培養して、角化細胞内にこれらを取り込ませ、支持体に再度播種しなおすか、あるいは支持体に播種した角化細胞に取り込ませ、培地を交換して通常の方法で培養皮膚モデルを作製する。
【0028】
上記のキットを用いて、0日から2日培養時にメラニン、メラノソーム、蛍光ビーズからなる群より少なくとも一種以上を添加する前処理を施すことで、色素沈着皮膚モデルを作製してもよい。
【0029】
ここで、正常角化細胞としては、ヒトや動物の正常角化細胞を用いることができ、また、不死化角化細胞としては、HaCaTやPAM212等を用いることができる。また用いる細胞としては、ヒトに限らず、マウス、ラット、ブタ等の表皮細胞でも良い。
【0030】
本発明に用いるメラニンは、ヒト毛髪メラニン、合成メラニン(シグマアルドリッチ(Sigma Aldrich)等)、イカメラニン、動物体毛メラニン等を用いることができる。また、メラノソームは培養ヒトメラノサイト、培養メラノーマ細胞(マウスB16メラノーマ、4A5、ヒト等)から抽出したメラノソーム粗抽出分画や精製品を用いることができる。蛍光ビーズは0.02μm〜4μmまでのカルボン酸修飾マイクロスフェア(Carboxylate-modified microspheres)、硫酸マイクロスフェア(Sulfate microspheres)、硫酸アルデヒドマイクロスフェア(Aldehyde-sulfate microspheres)、アミン修飾マイクロスフェア(Amine-modified microspheres)(モレキュラープローブ(Molecular Probe)社,アメリカ)を用いることができるが、これらに限定されるものではない。直径はメラノソームと同程度の大きさの0.1μm程度の大きさが好ましい。
【0031】
これらは、水や培地等に適宜溶解し、培地に添加する。添加量は、一概には規定できないがメラニンとメラノソームは405nmの吸光度0.2を培地に1/1,000〜1/10倍量添加、または1μg/mLから1,000μg/mL程度の濃度、蛍光ビーズは1×108個〜1×1012個/mLとすることが望ましい。
【0032】
そして、本発明の三次元培養色素沈着皮膚モデルは、上記のような製造方法により得られたものである。
【0033】
そして、本発明のメラニンの局在・排出・代謝・分解の評価方法によれば、上記のような製造方法により得られた三次元培養色素沈着皮膚モデルを用いてメラニンの局在や排出、代謝、分解等を評価することができる。
【0034】
そして、本発明の色素沈着モデルの評価方法は、上記のような製造方法により得られた三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することができる。
【0035】
そして、本発明の美白剤の評価方法は、上記のような三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することができる。
【0036】
また、本発明の三次元培養色素沈着皮膚モデル作製用キットは、上記のような三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたものである。
【0037】
以下に具体例を挙げて詳細に説明するが、本発明の技術的範囲はこれらの具体例により何ら制限されるものではない。
【実施例1】
【0038】
(三次元培養色素沈着皮膚モデルの作製)
1.1 メラノソームの調製
マウスB16メラノーマ培養細胞を10%ウシ血清およびテオフィリン(0.09mg/mL)を含むイーグルMEM培地でCO2インキュベーター(95%空気,5%二酸化炭素)内、37℃の条件下で培養し増殖させた。細胞をトリプシン溶液で剥がし、ウシ血清(10%)を含むイーグルMEM培地を加え、1,100rpmで遠心して細胞を集めた。
【0039】
細胞をホモジネートバッファ(250mM スクロース(Sucrose)、10mMトリス(Tris)、10mM KCl)中でガラスホモジナイザーを用いて氷上で30回ほどホモジネートした。さらにシリンジ(26G)を通し、15mLの遠心チューブへ入れて、700rpm、5分遠心した。その上清をエッペンドルフチューブへ入れて、メラノソームとした。
【0040】
1.2 角化細胞へのメラノソームの取り込み
ディシュ(100x20mm)にヒト正常角化細胞を300,000個になるように播種し、5mLの培地で1日間培養後、メラノソームを含む培地で6時間培養した(図1)。結果を図4に示した。図1(a)の培養角化細胞に対し、図1(b)のメラノソームを取り込ませた培養角化細胞では、取り込んだメラノソームがメラノソーム複合体となって位相差顕微鏡下で見えるようになった。
【0041】
1.3 メラノソームを取り込ませた角化細胞の三次元培養
細胞をトリプシン溶液で剥がし、ウシ血清(10%)を含む培地を加え、1,100rpmで遠心して細胞を集め、カルチャーインサートに播種した。37℃のCO2インキュベーターで3日間空気曝露培養して色素沈着皮膚モデルを作製した。培養3日後に色素沈着皮膚モデルの凍結組織切片を作製して光学顕微鏡で観察した(図2)。
【0042】
比較例として、メラノサイトと角化細胞を播種して作製した三次元モデルの凍結組織切片を作製して光学顕微鏡で観察した(図3)。さらに、これらの凍結組織切片を作成し、画像を比較した(図4)。
【0043】
結果を図2〜図4に示した。図2は、メラノソームを取り込ませたヒト正常角化細胞の三次元培養色素沈着皮膚モデルを示す。画像は、位相差顕微鏡でカルチャープレートの上にすりガラス置いて取り込んだ。角化細胞に取り込まれたメラノソームが核周囲にメラノソーム複合体として集積して、黒く見えるようになった。図3は、ヒト正常メラノサイトとヒト正常角化細胞の三次元培養皮膚モデルを示す。画像は、位相差顕微鏡でカルチャープレートの上にすりガラス置いて取り込んだ。メラノサイトは黒く見えたが、角化細胞は黒く見えなかった。そして、図4は、(a)培養色素沈着皮膚モデル(実施例)と(b)メラノサイト含有皮膚モデル(比較例)の凍結組織切片像(10μm)を示す。(a)培養色素沈着皮膚モデルについては、角化細胞が黒く見えた。(b)メラノサイト含有皮膚モデルについては、基底層にあるメラノサイトが黒く見えた。
【0044】
比較例に示したように、通常の培養皮膚モデルでは、角化細胞でメラニン顆粒(メラノソーム複合体)がほとんど見られず、メラノサイトが主に黒く観察された。一方、実施例1に示したように、メラノソームを角化細胞に取り込ませた後に三次元構築して培養すると、基底層の角化細胞内に多くのメラニン顆粒(メラノソーム複合体)が黒く認められるようになり、色素沈着した皮膚の組織像に類似してモデルを作製することができた。また、凍結組織切片の画像もこの知見を支持した(図4)。
【0045】
以上の結果より、本発明により作製した培養皮膚モデルは、色素沈着皮膚モデルとして有用であると考えられた。
【実施例2】
【0046】
(色素沈着培養皮膚モデルの作製)
2.1 蛍光ビーズの調製
蛍光ビーズは0.1μmのカルボン酸修飾マイクロスフェア(Carboxylate-modified microshperes )(モレキュラープローブ(Molecular Probe)社,アメリカ)を購入して用いた。培地に添加する前に、超音波振動を3分かけてビーズを均一化した。
【0047】
2.2 角化細胞への蛍光ビーズの取り込み
ディシュ(100x20mm)にヒト正常角化細胞を300,000個になるように播種し、5mLの培地で1日間培養後、1×1010個/mLの蛍光ビーズを含む培地で6時間培養した(図5)。結果を図5に示した。図5は、蛍光ビーズを取り込ませた単層培養角化細胞を共焦点レーザースキャン顕微鏡で観察した画像である。赤は蛍光ビーズ(0.1μm)、青は核を表す。単層培養した角化細胞では核の周囲に基質面(支持体、右図では下側)と平行にビーズが集積した。
【0048】
2.3 蛍光ビーズを取り込ませた角化細胞の三次元培養
培地を取り除き、リン酸塩緩衝液で3回洗浄して、37℃のCO2インキュベーターで3日間培養して色素沈着皮膚モデルを作製した。培養3日後に色素沈着皮膚モデル皮膚を共焦点レーザースキャン顕微鏡(LSMパスカル(LSM5Pascal),カールツワィス( Carl Zeiss),ドイツ)で観察した(図6)。図6は、培養角化細胞に蛍光ビーズを取り込ませ三次元培養したときの共焦点レーザースキャン顕微鏡画像である。赤は蛍光ビーズ(0.1μm)、青は核を表す。三次元培養した角化細胞では基質面(支持体、図では下側)と反対側にビーズが集積するものもみられた。
【図面の簡単な説明】
【0049】
【図1】(a)培養角化細胞及び(b)メラノソームを取り込ませた培養角化細胞の位相差顕微鏡写真である。
【図2】メラノソームを取り込ませたヒト正常角化細胞の三次元培養色素沈着皮膚モデルの位相差顕微鏡写真である。
【図3】ヒト正常メラノサイトとヒト正常角化細胞の三次元培養皮膚モデルの位相差顕微鏡写真である。
【図4】(a)培養色素沈着皮膚モデル(実施例)及び(b)メラノサイト含有皮膚モデル(比較例)の凍結組織切片像(10μm)を示す写真である。
【図5】蛍光ビーズを取り込ませた単層培養角化細胞の共焦点レーザースキャン顕微鏡写真である。
【図6】培養角化細胞に蛍光ビーズを取り込ませ三次元培養したときの共焦点レーザースキャン顕微鏡写真である。
【図7】正常皮膚と老人性色素斑組織の電子顕微鏡写真である。
【図8】正常皮膚と老人性色素斑組織のメラノソーム複合体の数と大きさの比較を示すグラフである。
【図9】ヒト正常メラノサイトとヒト正常角化細胞の三次元培養モデルの凍結組織切片像(10μm)を示す写真である。
【特許請求の範囲】
【請求項1】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有させた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項2】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項3】
正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地で三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項4】
請求項1〜3のいずれかに記載の三次元培養色素沈着皮膚モデルの製造方法により得られたことを特徴とする三次元培養色素沈着皮膚モデル。
【請求項5】
請求項4記載の三次元培養色素沈着皮膚モデルを用いてメラニンの局在および/または排出および/または代謝および/または分解を評価することを特徴とするメラニンの局在・排出・代謝・分解の評価方法。
【請求項6】
請求項4記載の三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することを特徴とする色素沈着モデルの評価方法。
【請求項7】
請求項4記載の三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することを特徴とする美白剤の評価方法。
【請求項8】
請求項4記載の三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたことを特徴とする三次元培養色素沈着皮膚モデル作製用キット。
【請求項1】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有させた正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種し、三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項2】
メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地に正常角化細胞および/または不死化角化細胞および/または表皮細胞を播種、培養し、培養した該細胞を支持体に播種し、三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項3】
正常角化細胞および/または不死化角化細胞および/または表皮細胞を支持体上に播種し、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地で三次元培養することを特徴とする三次元培養色素沈着皮膚モデルの製造方法。
【請求項4】
請求項1〜3のいずれかに記載の三次元培養色素沈着皮膚モデルの製造方法により得られたことを特徴とする三次元培養色素沈着皮膚モデル。
【請求項5】
請求項4記載の三次元培養色素沈着皮膚モデルを用いてメラニンの局在および/または排出および/または代謝および/または分解を評価することを特徴とするメラニンの局在・排出・代謝・分解の評価方法。
【請求項6】
請求項4記載の三次元培養色素沈着皮膚モデルを用いて色素沈着のモデルを評価することを特徴とする色素沈着モデルの評価方法。
【請求項7】
請求項4記載の三次元培養色素沈着皮膚モデルを用いて美白剤の効果を評価することを特徴とする美白剤の評価方法。
【請求項8】
請求項4記載の三次元培養色素沈着皮膚モデルを作製するために、メラニンおよび/またはメラノソームおよび/または蛍光ビーズを含有する培地を備えたことを特徴とする三次元培養色素沈着皮膚モデル作製用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2008−237045(P2008−237045A)
【公開日】平成20年10月9日(2008.10.9)
【国際特許分類】
【出願番号】特願2007−79012(P2007−79012)
【出願日】平成19年3月26日(2007.3.26)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
【公開日】平成20年10月9日(2008.10.9)
【国際特許分類】
【出願日】平成19年3月26日(2007.3.26)
【出願人】(000001959)株式会社資生堂 (1,748)
【Fターム(参考)】
[ Back to top ]

