三次元DNAネットワーク
【課題】三次元DNAネットワークを構築する。
【解決手段】2枚の基板間にDNAをDNA固定化因子で不溶化したDNAの分散液をしみ込ませる(S1〜S3)。さらに基板間にネットワーク連結手構成因子の溶液をしみ込ませ、その状態で所定時間放置する(S4〜S5)。これによって、三次元DNAネットワークを構築させる。
【解決手段】2枚の基板間にDNAをDNA固定化因子で不溶化したDNAの分散液をしみ込ませる(S1〜S3)。さらに基板間にネットワーク連結手構成因子の溶液をしみ込ませ、その状態で所定時間放置する(S4〜S5)。これによって、三次元DNAネットワークを構築させる。
【発明の詳細な説明】
【技術分野】
【0001】
DNAから構成される三次元状に広がったネットワークに関する。
【背景技術】
【0002】
染色体は、デオキシリボ核酸(DNA)とタンパク質でできており、DNAが遺伝子の本体であるといわれている。そこで、遺伝子工学などにおいてDNAについて、広範な研究がなされている。
【0003】
ここで、DNAは、その化学的、物理的な性質としても、特別なものを有しており、その性質を各種の装置に利用することも考えられている。例えば、DNAを基板上に固定し、このDNAの電気的な性質や、特定物質の吸着機能を利用することなどが考えられている。
【0004】
非特許文献1では、poly(dA-dT):poly(dA-dT)を水溶液に溶解する。この溶液を基板(マイカ、HOPG)上に滴下し、空気を吹き付けて乾燥させ、これによって基板上に二次元状に広がったDNAのネットワークが形成している。
【0005】
また、非特許文献2では、DNAとMgCl2を混合した溶液をSiO2基板上に作用させ、二次元ネットワークを形成している。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】T.Kanno, H.Tanaka, N.Miyoshi and T.Kawai : Jpn.J.Appl.Phys., 39, (2000), L269-L270
【非特許文献2】S.Tanaka, L.T.Cai, H.Tabata and T.Kawai : Jpn.J.Appl.Phys., 40(2001), 4217-4220
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記従来例では、二次元に広がるDNAネットワークが形成され、このネットワークを利用して各種の利用が考えられる。
【0008】
本発明は、三次元に広がるDNAネットワークにより、より広範な機能を達成しようとするものである。
【課題を解決するための手段】
【0009】
本発明は、DNAと、DNA固定化因子を溶液中において混合して、DNAを不溶化し、この不溶化されたDNAを含む溶液を2枚の基板間に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0010】
また、本発明は、DNAと、DNA固定化因子とを溶液中において混合して、DNAを不溶化し、この不溶化されたDNAを含む溶液を1枚の基板上に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0011】
また、前記DNA固定化因子は、溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることが好適である。
【0012】
また、前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることが好適である。
【0013】
また、本発明は、DNAを含む溶液を、DNAを不溶化する表面を有する基板に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0014】
また、前記基板の表面は、吸着する特性を有することが好適である。
【0015】
また、前記基板の表面は、疎水性または正電荷表面であることが好適である。
【0016】
また、前記ネットワーク連結点構成因子は、DNAを凝縮する性質を持つ因子であることが好適である。
【0017】
また、前記ネットワーク連結点構成因子は、ヒストンタンパク質であることが好適である。
【0018】
また、前記DNAとして、特定のタンパク質を吸着する配列を繰り返したDNAを採用することが好適である。
【0019】
また、前記DNAは、λDNAであることが好適である。
【0020】
また、前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことが好適である。
【0021】
また、前記不溶化されたDNAを含む溶液を2枚の基板間または1枚の基板上に支持させた後に、ネットワーク連結点構成因子となる物質を添加することが好適である。
【0022】
また、前記ネットワーク連結点構成因子となる物質の添加量を変更することで、ネットワークの網目の大きさを制御することが好適である。
【0023】
また、前記基板として単結晶材料や配向性表面を持つ材料を用いることにより、その表面の特性に基づいて構築されることが好適である。
【0024】
また、2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することで、基板間に構築されるDNAネットワークのネットワーク長を制御することが好適である。
【0025】
また、前記ネットワーク連結点と、紐状のDNAに色素をインターカレートすることが好適である。
【0026】
また、本発明に係る三次元DNAネットワークは、三次元的に広がりもって点在するネットワーク連結点構成因子と、このネットワーク連結点構成因子を連結点として、三次元的に広がるひも状のDNAと、を含むことを特徴とする。
【0027】
また、前記ネットワークの紐状のDNAは、引き延ばされた状態になっていることが好適である。
【発明の効果】
【0028】
このように、本発明によれば、三次元空間に広がりを持つDNAネットワークを構築することができる。
【0029】
従って、二次元的なDNAネットワークに比べ、他の物質との接触を容易に行うことができ、例えば特定物質吸着や、効率のよいDNAチップとして利用することができる。
【0030】
また、本発明に係る三次元DNAネットワークは、比較的容易な方法で構築が行える。
【0031】
また、DNAネットワークが、DNA紐の部分が引き延ばされた状態になっていることで、塩基対の方向とインターカレートさせた色素の方向が揃っている。この性質を利用して色素の励起光の変更面を制御することにより、三次元光スイッチング素子に利用することができる。
【図面の簡単な説明】
【0032】
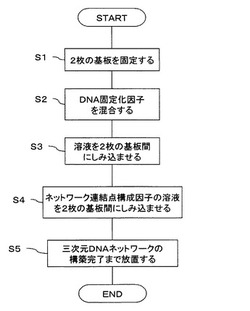
【図1】実施形態に係る三次元DNAネットワークの構築方法の手順を示す図である。
【図2】三次元DNAネットワークを観察するための装置の構成を示すである。
【図3】実施例1の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【図4】DNAの紐と連結点を示す図である。
【図5】三次元DNAネットワークの各領域における偏光角依存性を示す図である。
【図6】ネットワーク連結点構成因子の濃度を増加した場合の画像を示す図である。
【図7】実施例2の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【図8】実施例3の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【発明を実施するための形態】
【0033】
以下、本発明の実施形態について説明する。
【0034】
「概要」
本実施形態では、DNAから構成される三次元上に広がったネットワークを構築する。特に、DNAと、DNA固定化因子と、ネットワーク連結点構成因子の3要素を混合し、これを基板間において保持して、自己組織化により三次元DNAネットワークを構築させる。
【0035】
具体的には、図1に示すように、
(S1)2枚の基板を間隔をあけて向かい合わせに固定する
(S2)DNAにDNA固定化因子を混合して、DNAを不溶化する
(S3)不溶化したDNAの分散液を基板間にしみ込ませる
(S4)ネットワーク連結点構成因子の溶液を基板間にしみ込ませる
(S5)自己組織化による、三次元DNAネットワークの構築完了まで放置する
という、5つの工程からなっている。
【0036】
「具体的説明」
上述のS1〜S5の手順について、以下に詳細に述べる。
【0037】
(S1)2枚の基板を間隔をあけて向かい合わせに固定する
例えば、顕微鏡のカバーガラスを2枚の基板として利用する。この場合、2枚のカバーガラスをスペーサを挟み込んで重ねる。スペーサとしては、ガラス片などが利用できる。また、単にカバーガラスを重ねておき、その間に侵入させる溶液の量で2枚のカバーガラスの間隔を調整して固定することもできる。
【0038】
なお、基板はカバーガラスに限らず、安定した物質であればどのようなものでもよい。透明なものを利用することが観察などの観点から好ましいが、構築されたDNAネットワークの利用から考えれば不透明なものでもよく、各種のセラミックなども利用可能である。また、表面は、平坦で、一定の間隔を維持できることが好適である。
【0039】
(S2)DNAにDNA固定化因子を混合しDNAを不溶化する
DNAを溶解した水溶液に対しDNA固定化因子を混合することで溶液内においてDNAを不溶化する。例えば、DNA固定化因子として多価陽イオンを含む電解質の溶液を加え、DNAを不溶化する。多価陽イオンを含む電解質としては、塩化カルシウムがあげられるが、これに限らず、各種の金属塩などが利用可能である。
【0040】
また、この段階で、予め色素を添加して、DNAに色素をインターカレートしておくと、色素で染色された三次元DNAネットワークを構築することができ、構築の検証などが容易に行える。
【0041】
(S3)DNAを不溶化した水溶液を基板間に侵入させる
DNAを不溶化した水溶液をピペットを用いて、基板(カバーガラス)間の間隙に供給し、その表面張力を利用してしみ込ませ、ここに保持させる。
【0042】
(S4)ネットワーク連結点構成因子の溶液を基板間に保持された水溶液に加える
基板間に不溶化したDNAの分散液が保持されている状態において、その基板間の水溶液にさらにネットワーク連結点構成因子の溶液を追加する。ネットワーク連結点構成因子としては、ヒストンタンパク質が採用される。このヒストンタンパク質としては、染色体にあるのと同様の、ヒストンH2A、H2B、H3、H4の4つ種類のタンパク質の結合した球状の構造物などが好適であるが、他のタンパク質でもDNAがからみつきやすい性状を持ち、DNAの連結点になりうる性質を有すれば採用することができる。
【0043】
ここで、ネットワーク連結点構成因子の濃度を変更することにより、ネットワークの構造を制御することができる。例えば、ネットワーク連結点構成因子の濃度を高めるとネットワーク連結点の数が多くなるため、構築されるネットワークの網目が小さくなる。すなわち、三次元上に点在するネットワーク連結点構成因子間の距離が小さくなる。
【0044】
なお、DNAを不溶化した水溶液にネットワーク連結点構成因子を添加混合した後、基板間にしみ込ませてもよい。しかし、DNAを不溶化したDNAの分散液を基板間にしみ込ませた後、基板間にネットワーク連結点構成因子をしみ込ませた方が、三次元DNAネットワークを基板間に確実に構築できる。
【0045】
(S5)自己組織化による三次元DNAネットワークが完了するまで放置する
S4において、ネットワーク連結点構成因子の溶液が添加された後、例えば、室温で数10分間そのまま大気中で放置する。これによって、両基板表面で、二次元DNAネットワークが構築されると同時に基板と垂直方向のネットワークも構築され、これが基板表面の二次元ネットワークと連結され、三次元DNAネットワークが構築される。
【0046】
ここで、基板として単結晶材料や配向性表面を持つ材料を用いること、その表面の特性に構築される三次元DNAネットワークの構造が影響される。そこで、基板として、所望の表面特性を有するものを選択することで、構築される三次元DNAネットワークの構造を制御することができる。
【0047】
このような基板は、DNA固定化因子として作用することができ、このような基板を用いた場合には、上述したようなDNA固定化因子の添加混合を省略することもできる。
【0048】
また、2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することできる。そして、この基板間間隔を制御することによって、基板間に構築されるDNAネットワークのネットワーク長を制御することができる。
【0049】
例えば、基板間を広めにするなどによって、前記ネットワークの紐状のDNAは、引き延ばされた状態になる。
【0050】
特に、本実施形態では、ネットワークの紐状のDNAを、引き延ばされた状態にしている。このように、DNAネットワークが、DNA紐の部分が引き延ばされた状態になっていることで、塩基対の方向とインターカレートさせた色素の方向が揃っている。この性質を利用して色素の励起光の変更面を制御することにより、DNAネットワークを三次元光スイッチング素子などに利用することができる。
【0051】
また、ネットワーク連結点と、紐状のDNAに色素をインターカレートしていることで、所望の光学特性を付与することができる。
【0052】
図2には、上述のようにして、構築される三次元DNAネットワークをチェックする装置の構成が示してある。
【0053】
レーザ光源からの所定波長のレーザ光は、1/2波長板(λ/2plate)または偏光解消板(depolarizer)を介し、入射側の対物レンズ(Objective lens)に入力される。ここで、1/2波長板は、入射光の直線偏光の偏光角を制御するものであって、この1/2波長板をレーザ光の入射方向に直交する面内で回転させることで、入射光の偏光角を任意に制御する。また、偏光解消板は、偏光した入射光を非偏光にするものであって、三次元DNAネットワークを観察するときに使用する。なお、レーザ光の波長は、DNAにインターカレートする色素を励起するのに好ましいものが選択される。例えば、色素としてCyanine DyeであるTOTO-1(商標)を用いた場合には、励起光として514nm程度が採用される。また、色素として、ethidinium bromideやSyber Green Iを用いる場合には、300,520nmや、290、380、495nmの励起光をそれぞれ採用する。
【0054】
対物レンズは、入射光をフォーカッシングするもので、その対物レンズからの射出光は、2枚のカバーガラス(Cover glass)間の所定の部位に照射される。なお、カバーガラスを移動することで、入射光の位置を調整する。
【0055】
カバーガラス間には、上述のようにして得られる三次元DNAネットワークが形成されており、この三次元DNAネットワークの任意の場所に、任意の偏光角を持つ入射光がフォーカッシングされて照射される。
【0056】
ここで、DNAには、上述のように色素をインターカレートしてあるため、照射光によって蛍光(fluorescence)が生じ、この蛍光は、検出側の対物レンズ(Objective lens)により、所定の平行光に直され、ダイクロイックミラー(Dichroic mirror)、フィルタ(Filter)を介し、色素によって決定される所定波長の蛍光(TOTO-1(商標)の場合の蛍光は、533nm程度)のみを取り出し、これがCCDカメラ(CCD)へ供給される。このように、この装置では、カバーガラス間の試料の蛍光顕微鏡による画像をCCDカメラによって得ることができる。
【0057】
そして、カバーガラスを二次元移動することによって、DNAネットワークにおける測定位置を二次元的に移動することができ、対物レンズの焦点位置によって、深さ方向の位置を調整でき、これによって三次元DNAネットワークの任意の位置の観察が行える。また、1/2波長板の回転によって、照射光の偏光角を調整することができる。
【0058】
また、三次元DNAネットワークを構成(構築)する場として基板間以外に、基板上に構成することもできる。この場合、基板は三次元DNAネットワークの足場を提供し、この上部に三次元ネットワークが構成される。
【0059】
手順は、次の通りである。
【0060】
(1)DNAとDNA固定化因子を混合し、DNAを不溶化する。
例えば、多価陽イオンを含む電解質を加え、DNAを不溶化する。また、この段階で、予めDNAに色素をインターカレートしておくと、色素で染色された三次元DNAネットワークを構築することもできる。
【0061】
(2)この基板上のDNAを不溶化したDNAの分散液を基板上に滴下する。
基板上にピペットを用いて、(1)の溶液を滴下する。
【0062】
(3)基板上の溶液に、ネットワーク連結点構成因子を含む溶液をさらに滴下する。
ネットワーク連結点構成因子としては、例えばヒストンタンパク質がある。このヒストンタンパク質の溶液を、(2)と同様に基板上に滴下する。このとき、ネットワーク連結点構成因子の濃度を変えることにより、ネットワークの構造を制御することができる。例えば、ネットワーク連結点因子の濃度を高めるとネットワーク連結点の数が多くなるため、構築されるネットワークの網目が小さくなる。
【0063】
(4)自己組織化による三次元DNAネットワークの構築が完了するまで放置する。
数十分間放置する。このとき、基板表面上で二次元DNAネットワークが構築されると同時に基板と垂直方向のネットワークも構築される。
【0064】
このような手順によっても、上述の基板間の場合と同様に、三次元DNAネットワークを構成することができる。
【0065】
・実施例1
「三次元DNAネットワークの作製」
DNAとして、λDNA、DNA固定因子として塩化カルシウムCaCl2、ネットワーク連結点構成因子としてヒストンタンパク質を用いて三次元DNAネットワークをガラス基板間に構築した。
【0066】
まず、色素(TOTO-1(商標):Molecular Probes, Inc.)をインターカレートした濃度8.3nMのλDNAの溶液(TOTO-1:塩基=1:6, 3mM Tris-HCl (pH8.0), 0.1mM EDTAのバッファー)に多価陽イオンCaCl2を含む電解質を濃度が17mMになるように加えλDNAを不溶化した。これを蛍光顕微鏡用の2枚のカバーガラス(ガラス基板)を重ねた隙間にしみ込ませた。次に、3×10-6Mのヒストンタンパク質を含む溶液をカバーガラスの隙間にしみ込ませ、さらに自己組織化による三次元DNAネットワーク構築のため室温で30分間放置した。
【0067】
「観察結果」
このようにして得た試料について、偏光解消板を用いて観察した結果を図3に示す。この例では、2枚のカバーガラス(Cover slip)間の間隔を102.5μmとして、カバーガラス間で複数の異なった深度で画像を得ている。すなわち、図における下側のガラス基板(位置(f):0μm)に対物レンズの焦点をあわせ、ガラス基板上に二次元DNAネットワークが構成されていることを確認した。次に、対物レンズの位置をもう上側ガラス基板の方向に徐々に移動させることで、位置(e):下から20.5μm、位置(d):下から41.0μm、位置(c):下から61.5μm、(b):下から82.0μmでの画像を得、DNAの紐が三次元に伸びていることが確認された。そして、図における上側のガラス基板(位置(a):102.5μm)に対物レンズの焦点をあわせ、上側ガラス基板上にも二次元DNAネットワークが構成されていることを確認した。これによって、一対のガラス基板上にそれぞれ形成されている二次元DNAネットワーク間がDNAの紐で連結されて、三次元DNAネットワークが形成されていることが確認された。
【0068】
ここで、図における明るいスポット上の点がネットワークの連結点であり、この連結点同士をDNAが結んでいることが分かる。すなわち、図4に示すように、DNAの紐(DNA bundle)が球状のヒストンタンパク質の連結点に絡まり、DNAとヒストンタンパク質の複合体(Complexes of DNA and histone)を構成しながら、三次元的に広がっている。
【0069】
「三次元DNAネットワークの構造解析」
次に、入射光(励起光)の偏光面の角度(偏光角)を変えながら、カバーガラス間に構築されたTOTO-1色素をインターカレートした三次元DNAネットワークにおけるカバーガラス表面部分の蛍光強度像を二次元検出器(CCDカメラ)で記録した。なお、偏光角の調整は、λ/2波長板を回転させることによって行った。
【0070】
図5の上に得られた蛍光像を示す。四角で囲んだ領域A〜Dの蛍光強度の励起光偏光面角度(偏光角)依存性を、図5の下に示す。領域A〜Cは、二次元DNAネットワークの紐の部分、領域Dは、ネットワーク連結点の部分である。領域A〜Cでは、偏光角依存性があるが、領域Dでは、偏光角依存性が消失していることが分かる。領域A〜Cの偏光角依存性を高分子化学的な方法で解析したところ、DNAの塩基の向きが分子レベルで揃っていることが分かった。領域Dの連結点は、ヒストンタンパク質にλDNAが結合して、λDNAが糸巻きのようにヒストンタンパク質の回りに巻き付いた構造になり、λDNAの塩基の方向がバラバラになって偏光角依存性が消失したものと考えられる。
【0071】
「三次元DNAネットワークの構造制御」
ネットワーク連結点構成因子であるヒストンタンパク質の濃度を変えることにより、ネットワークの構造を制御した。具体的には、ヒストンタンパク質の濃度を上述の実施例1で用いた濃度の5倍に高めると、ネットワーク連結点の数が大きくなり、ネットワークの網目を小さくすることができた。この場合のガラス基板上のネットワークの蛍光像を図6に示す。
【0072】
従って、ネットワーク連結点構成因子の濃度を変更することで三次元DNAネットワークの構成を制御することできる。
【0073】
・実施例2
この実施例2では、DNAとしてλDNAを、DNA固定化因子として塩化マグネシウムMgCl2を、ネットワーク連結点構成因子としてヒストンタンパク質を用い、3次元DNAネットワークをガラス基板間で構成した。
【0074】
CaCl2を使用した場合と同様な手順でMgCl2を用いて3次元DNAネットワークを基板間に構築し、これを蛍光顕微鏡により観察した(図6参照)。まず、1枚のガラス基板上に対物レンズの焦点を合わせ、基板上に2次元DNAネットワークが構成されていることを確認した(図6(a)参照)。対物レンズの位置をもう一枚のガラス基板の方向に徐々に移動させると、ガラス基板に対して垂直にDNAの紐が構成され(図6(b)参照)、もう一方のガラス基板上に構築された2次元DNAネットワーク(図6(c)参照)までつながっていることを確認した(3次元DNAネットワーク)。明るいスポット状の点がネットワークの連結点で、その連結点同士をDNAが結んでいる(図6点線が連結点を結ぶDNAであり、像が鮮明ではないのでアイガイドをつけた)。
【0075】
・実施例3
この実施例3では、DNAとしてλDNAを、DNA固定化因子として塩化カルシウムCaCl2を、ネットワーク連結点因子としてヒストンタンパク質を用い、3次元DNAネットワークをガラス基板上で構成した。
【0076】
まず、TOTO−1色素をインターカレートしたλDNAの溶液(TOTO−1:塩基=1:6)に多価陽イオンCaCl2を含む電解質を加えλDNAを不溶化した。これを蛍光顕微鏡用のカバーガラス上にスポットした。次に、ヒストンタンパク質を含む溶液をDNAの溶液をスポットした位置に上から滴下し、さらに自己組織化による3次元DNAネットワーク構築のため30分間放置した。これを蛍光顕微鏡により観察した(図7参照)。まず、1枚のガラス基板上に対物レンズの焦点を合わせ、基板上に2次元DNAネットワークが構築されていることを確認した(図7(a)参照)。対物レンズの位置を上部に徐々に移動させると、ガラス基板に対して垂直にDNAの紐が構成されていることを確認した(図7(b)〜(e)参照)(3次元DNAネットワーク)。明るいスポット状の点がネットワークの連結点で、その連結点同士をDNAが結んでいる(図7(a)参照。連結点を結ぶDNAの像が鮮明ではないのでアイガイドとして点線を付けた)。
【0077】
「三次元DNAネットワークの利用」
上述のようにして得られる三次元DNAネットワークは、各種分野において利用が可能であるが、そのうちのいくつかを下に示す。
【0078】
(i)電子デバイス:光スイッチングへの応用(電気伝導性の利用)
DNAは、塩基対の面がDNAの軸に垂直になっており、それぞれの塩基対は隣りの塩基対とπ電子を重なり合わせている。この重なり合ったπ電子軌道を介してDNAの軸方向の電子輸送が可能であり、DNAは半導体程度の電気伝導性を持つ。さらに、DNAに色素分子をインターカレートした場合、その色素を可視光などで電子励起するとDNAの電気伝導性が高まるという報告がある。
【0079】
本実施形態の三次元DNAネットワークでは、上述したように、ネットワークの連結点から伸びるDNA紐の塩基対がDNA紐の伸びる方向と垂直に揃っている。DNAに色素をインターカレートし、偏光励起光を照射してある特定の方向に伸びたDNA紐にインターカレートした色素のみを電子励起することで、そのDNA紐の電気伝導性を高めることができる。この原理を利用して光スイッチングや電子輸送の制御がDNAネットワーク上で可能になる。また、電子供与性、受容性化学種をそのネットワークにドープすることにより、その電気導電性を制御することもできる。
【0080】
(ii)環境材料:遺伝子に作用する環境因子捕捉(DNAの吸着特性の利用)
遺伝子に作用する環境因子捕捉器として、DNAと脂質を混合し膜状に成形したDNAフィルム、または二次元DNAネットワークを用いる方法が考案されている。これは、遺伝子に作用する環境因子がDNAに吸着、インターカレートするものが多いことを利用したものである。ここで、フィルムも二次元DNAネットワークのいずれもDNAが支持体に吸着した状態になっており、環境因子のDNA分子への接近が困難となり捕捉効率が悪くなるという欠点を有する。
【0081】
一方、本実施形態に係る三次元DNAネットワークでは、基板表面に固定されているDNAの他に、基板間の空間に固定されているものがある。そして、この基板間のDNAには、環境因子の接近が容易である。従って、本実施形態に係る三次元DNAネットワークを利用して環境因子の捕捉効率を高めることができる。
【0082】
(iii)医療用生体分子材料:DNAチップ(DNAの相補鎖とのハイブリダイゼーションの利用)
DNAチップとは、一群の遺伝子をガラス基板上にスポットしたものを指す。別の細胞、例えば発ガン細胞から用意した蛍光ラベルされた一群のDNAをこのDNAチップにハイブリダイゼーションさせる。特定のDNAは決まった場所にスポットされたDNAにハイブリダイゼーションするするため、スポット全体の蛍光パターンを正常細胞のそれと比較することにより、発ガン細胞に特有に発現している遺伝子を特定できる。
【0083】
上述の環境材料の項で述べたことと同様に、基板に吸着したDNAに対して相補鎖のハイブリダイゼーションの効率が低下するという問題があり、現在のDNAチップ産業において、DNAの基板への固定法の開発が大きなテーマになっている。これを解決する手段として、DNAの一端を基板に固定し、残りの部分は溶液中に浮遊されておく方向も提案されている。
【0084】
本実施形態の三次元DNAネットワークでは、基板間の空間にDNAが固定されている。このため、相補鎖のハイブリダイゼーション効率が高まり、DNAチップの新しい製造法として利用できる。
【0085】
(iv)工学材料:機能性材料の三次元空間への集積(DNA上の反応の配列特異性の利用)
まず、ある配列を持ったDNAに機能性材料、例えば触媒活性を有する金属微粒子やタンパク質などを連結させる。得られた機能性材料付きDNAを三次元DNAネットワーク上の特定配列部分にハイブリダイゼーションさせ、機能性材料を設計通りの位置に三次元的に集積することが可能である。DNA上の反応の配列特異性の利用して機能性材料を三次元空間に集積することができる。
【0086】
「その他の使用の態様について」
(i)基板間に三次元DNAネットワークを構築した場合において、三次元DNAネットワークを構築した基板間に流路を形成する。この流路に反応液を流すことにより、三次元DNAネットワークに作用させる。例えば、環境因子捕捉においては、環境因子を含む溶液、DNAチップにおいては、蛍光標識した一群のDNAを含む溶液、機能性材料の三次元空間への配置においては、機能性材料付きDNAを含む溶液を流路に流す。
【0087】
(ii)また、基板上面に三次元DNAネットワークを構築した場合には、(i)における各反応液を上部から滴下して直接三次元DNAネットワーク作用させることができる。
【0088】
「他のDNA固定因子、ネットワーク連結点構成因子について」
(i)DNA固定化因子としては、溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子が利用できる。具体的には、多価陽イオンがあり、例えばCaCl2、MgCl2、ポリアミンなどが利用できる。
【0089】
(ii)また、DNAは、基板表面に二次元的に広がって固定化され、これの基板表面もDNA固定化因子といえる。そこで、上述したようなDNA固定化因子を省略し、基板表面をDNA吸着特性を有するものすることができる。このような方法によっても、基板上にDNAが吸着固定化され、これをベースとして三次元DNAネットワークが構築される。この場合も、1枚の基板上に三次元DNAネットワークを構築してもよいし、2枚の基板間に三次元DNAネットワークを構築してもよい。このような基板表面としては、DNA吸着特性を有するものが好適であり、例えば疎水化表面(シランコーティング、雲母表面、マイカ、HOPG、SiO2など)、正電荷表面(ポリ−L−リジンなど)がある。なお、このようなDNA固定化因子として機能する基板を上述のようなDNA固定化因子を添加混合した後の溶液に適用してもよい。
【0090】
(iii)ネットワーク連結点構成因子としては、DNAに配列特異的または配列非特異的に結合または吸着し、さらに凝縮する性質を持つものが採用される。このようなものとして、DNA結合タンパク質があり、例えばヒストン、t4 gene 32 proteinなどが利用される。
【0091】
(iv)ネットワーク連結点構成因子の中で、DNAに配列非特異的に結合または吸着し、さらに凝縮する性質を持つものとして、金属微粒子がある。この金属微粒子としては、界面活性剤が被覆されていない金微粒子、白金微粒子などがあげられる。
【0092】
「λDNA以外のDNAについて」
(i)使用するDNAとしては、数ミクロン以上の長さを有するDNA(1本鎖でも2本鎖でもよい)が望ましい。λDNA以外には、例えば、M13mp8 single strand DNA(1本鎖)、バクテリオファージ T4GT7 DNA(2本鎖)などがあげられる。
【0093】
(ii)遺伝子に作用する環境因子捕捉に関して、例えば、発ガン作用を有するタンパク質などの捕捉では、そのタンパク質が配列特異的に吸着することが知られている場合、その配列を多数繰り返したDNAを、例えばλDNAの中に組み込んで三次元ネットワークに構築する。すなわち、吸着対象タンパク質を特異的に吸着する配列を繰り返すDNAを組み込んで三次元DNAネットワークを構築することが好適である。
【0094】
(iii)遺伝子に作用する環境因子捕捉に関して、例えば、発ガン作用を有するタンパク質などの捕捉では、そのタンパク質が配列特異的に吸着することが知られている場合、その配列を多数繰り返したDNAを、例えばλDNAの中に組み込んでスポット状に三次元ネットワークを構築する。DNAライブラリーの中の多種類のDNAに対してこのスポットを多数構築する。
【0095】
(iv)機能性材料の三次元空間への集積に関して
機能性材料を順序や空間配置を設計した位置に集積する場合には、1つの配列を持ってDNAに1つの機能性材料を対応させて結合させ、機能性材料の順序や空間配列に対応した塩基配列をもつDNAの三次元ネットワークを構成する。
【0096】
「インターカレートする色素について」
DNAなどにインターカレートする色素としては、TOTO-1以外に、
YOYO-1, YOYO-3, TOTO-3,yo-1,T0-1,YO-3,TO-3,SYBR GreenI, SYBR GreenII, POPO-1, POPO-3, BOBO-1, BOBO-3
などが使用することができる。
【技術分野】
【0001】
DNAから構成される三次元状に広がったネットワークに関する。
【背景技術】
【0002】
染色体は、デオキシリボ核酸(DNA)とタンパク質でできており、DNAが遺伝子の本体であるといわれている。そこで、遺伝子工学などにおいてDNAについて、広範な研究がなされている。
【0003】
ここで、DNAは、その化学的、物理的な性質としても、特別なものを有しており、その性質を各種の装置に利用することも考えられている。例えば、DNAを基板上に固定し、このDNAの電気的な性質や、特定物質の吸着機能を利用することなどが考えられている。
【0004】
非特許文献1では、poly(dA-dT):poly(dA-dT)を水溶液に溶解する。この溶液を基板(マイカ、HOPG)上に滴下し、空気を吹き付けて乾燥させ、これによって基板上に二次元状に広がったDNAのネットワークが形成している。
【0005】
また、非特許文献2では、DNAとMgCl2を混合した溶液をSiO2基板上に作用させ、二次元ネットワークを形成している。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】T.Kanno, H.Tanaka, N.Miyoshi and T.Kawai : Jpn.J.Appl.Phys., 39, (2000), L269-L270
【非特許文献2】S.Tanaka, L.T.Cai, H.Tabata and T.Kawai : Jpn.J.Appl.Phys., 40(2001), 4217-4220
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記従来例では、二次元に広がるDNAネットワークが形成され、このネットワークを利用して各種の利用が考えられる。
【0008】
本発明は、三次元に広がるDNAネットワークにより、より広範な機能を達成しようとするものである。
【課題を解決するための手段】
【0009】
本発明は、DNAと、DNA固定化因子を溶液中において混合して、DNAを不溶化し、この不溶化されたDNAを含む溶液を2枚の基板間に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0010】
また、本発明は、DNAと、DNA固定化因子とを溶液中において混合して、DNAを不溶化し、この不溶化されたDNAを含む溶液を1枚の基板上に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0011】
また、前記DNA固定化因子は、溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることが好適である。
【0012】
また、前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることが好適である。
【0013】
また、本発明は、DNAを含む溶液を、DNAを不溶化する表面を有する基板に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、ことを特徴とする。
【0014】
また、前記基板の表面は、吸着する特性を有することが好適である。
【0015】
また、前記基板の表面は、疎水性または正電荷表面であることが好適である。
【0016】
また、前記ネットワーク連結点構成因子は、DNAを凝縮する性質を持つ因子であることが好適である。
【0017】
また、前記ネットワーク連結点構成因子は、ヒストンタンパク質であることが好適である。
【0018】
また、前記DNAとして、特定のタンパク質を吸着する配列を繰り返したDNAを採用することが好適である。
【0019】
また、前記DNAは、λDNAであることが好適である。
【0020】
また、前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことが好適である。
【0021】
また、前記不溶化されたDNAを含む溶液を2枚の基板間または1枚の基板上に支持させた後に、ネットワーク連結点構成因子となる物質を添加することが好適である。
【0022】
また、前記ネットワーク連結点構成因子となる物質の添加量を変更することで、ネットワークの網目の大きさを制御することが好適である。
【0023】
また、前記基板として単結晶材料や配向性表面を持つ材料を用いることにより、その表面の特性に基づいて構築されることが好適である。
【0024】
また、2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することで、基板間に構築されるDNAネットワークのネットワーク長を制御することが好適である。
【0025】
また、前記ネットワーク連結点と、紐状のDNAに色素をインターカレートすることが好適である。
【0026】
また、本発明に係る三次元DNAネットワークは、三次元的に広がりもって点在するネットワーク連結点構成因子と、このネットワーク連結点構成因子を連結点として、三次元的に広がるひも状のDNAと、を含むことを特徴とする。
【0027】
また、前記ネットワークの紐状のDNAは、引き延ばされた状態になっていることが好適である。
【発明の効果】
【0028】
このように、本発明によれば、三次元空間に広がりを持つDNAネットワークを構築することができる。
【0029】
従って、二次元的なDNAネットワークに比べ、他の物質との接触を容易に行うことができ、例えば特定物質吸着や、効率のよいDNAチップとして利用することができる。
【0030】
また、本発明に係る三次元DNAネットワークは、比較的容易な方法で構築が行える。
【0031】
また、DNAネットワークが、DNA紐の部分が引き延ばされた状態になっていることで、塩基対の方向とインターカレートさせた色素の方向が揃っている。この性質を利用して色素の励起光の変更面を制御することにより、三次元光スイッチング素子に利用することができる。
【図面の簡単な説明】
【0032】
【図1】実施形態に係る三次元DNAネットワークの構築方法の手順を示す図である。
【図2】三次元DNAネットワークを観察するための装置の構成を示すである。
【図3】実施例1の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【図4】DNAの紐と連結点を示す図である。
【図5】三次元DNAネットワークの各領域における偏光角依存性を示す図である。
【図6】ネットワーク連結点構成因子の濃度を増加した場合の画像を示す図である。
【図7】実施例2の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【図8】実施例3の三次元DNAネットワークの厚み方向の各位置の画像を示す図である。
【発明を実施するための形態】
【0033】
以下、本発明の実施形態について説明する。
【0034】
「概要」
本実施形態では、DNAから構成される三次元上に広がったネットワークを構築する。特に、DNAと、DNA固定化因子と、ネットワーク連結点構成因子の3要素を混合し、これを基板間において保持して、自己組織化により三次元DNAネットワークを構築させる。
【0035】
具体的には、図1に示すように、
(S1)2枚の基板を間隔をあけて向かい合わせに固定する
(S2)DNAにDNA固定化因子を混合して、DNAを不溶化する
(S3)不溶化したDNAの分散液を基板間にしみ込ませる
(S4)ネットワーク連結点構成因子の溶液を基板間にしみ込ませる
(S5)自己組織化による、三次元DNAネットワークの構築完了まで放置する
という、5つの工程からなっている。
【0036】
「具体的説明」
上述のS1〜S5の手順について、以下に詳細に述べる。
【0037】
(S1)2枚の基板を間隔をあけて向かい合わせに固定する
例えば、顕微鏡のカバーガラスを2枚の基板として利用する。この場合、2枚のカバーガラスをスペーサを挟み込んで重ねる。スペーサとしては、ガラス片などが利用できる。また、単にカバーガラスを重ねておき、その間に侵入させる溶液の量で2枚のカバーガラスの間隔を調整して固定することもできる。
【0038】
なお、基板はカバーガラスに限らず、安定した物質であればどのようなものでもよい。透明なものを利用することが観察などの観点から好ましいが、構築されたDNAネットワークの利用から考えれば不透明なものでもよく、各種のセラミックなども利用可能である。また、表面は、平坦で、一定の間隔を維持できることが好適である。
【0039】
(S2)DNAにDNA固定化因子を混合しDNAを不溶化する
DNAを溶解した水溶液に対しDNA固定化因子を混合することで溶液内においてDNAを不溶化する。例えば、DNA固定化因子として多価陽イオンを含む電解質の溶液を加え、DNAを不溶化する。多価陽イオンを含む電解質としては、塩化カルシウムがあげられるが、これに限らず、各種の金属塩などが利用可能である。
【0040】
また、この段階で、予め色素を添加して、DNAに色素をインターカレートしておくと、色素で染色された三次元DNAネットワークを構築することができ、構築の検証などが容易に行える。
【0041】
(S3)DNAを不溶化した水溶液を基板間に侵入させる
DNAを不溶化した水溶液をピペットを用いて、基板(カバーガラス)間の間隙に供給し、その表面張力を利用してしみ込ませ、ここに保持させる。
【0042】
(S4)ネットワーク連結点構成因子の溶液を基板間に保持された水溶液に加える
基板間に不溶化したDNAの分散液が保持されている状態において、その基板間の水溶液にさらにネットワーク連結点構成因子の溶液を追加する。ネットワーク連結点構成因子としては、ヒストンタンパク質が採用される。このヒストンタンパク質としては、染色体にあるのと同様の、ヒストンH2A、H2B、H3、H4の4つ種類のタンパク質の結合した球状の構造物などが好適であるが、他のタンパク質でもDNAがからみつきやすい性状を持ち、DNAの連結点になりうる性質を有すれば採用することができる。
【0043】
ここで、ネットワーク連結点構成因子の濃度を変更することにより、ネットワークの構造を制御することができる。例えば、ネットワーク連結点構成因子の濃度を高めるとネットワーク連結点の数が多くなるため、構築されるネットワークの網目が小さくなる。すなわち、三次元上に点在するネットワーク連結点構成因子間の距離が小さくなる。
【0044】
なお、DNAを不溶化した水溶液にネットワーク連結点構成因子を添加混合した後、基板間にしみ込ませてもよい。しかし、DNAを不溶化したDNAの分散液を基板間にしみ込ませた後、基板間にネットワーク連結点構成因子をしみ込ませた方が、三次元DNAネットワークを基板間に確実に構築できる。
【0045】
(S5)自己組織化による三次元DNAネットワークが完了するまで放置する
S4において、ネットワーク連結点構成因子の溶液が添加された後、例えば、室温で数10分間そのまま大気中で放置する。これによって、両基板表面で、二次元DNAネットワークが構築されると同時に基板と垂直方向のネットワークも構築され、これが基板表面の二次元ネットワークと連結され、三次元DNAネットワークが構築される。
【0046】
ここで、基板として単結晶材料や配向性表面を持つ材料を用いること、その表面の特性に構築される三次元DNAネットワークの構造が影響される。そこで、基板として、所望の表面特性を有するものを選択することで、構築される三次元DNAネットワークの構造を制御することができる。
【0047】
このような基板は、DNA固定化因子として作用することができ、このような基板を用いた場合には、上述したようなDNA固定化因子の添加混合を省略することもできる。
【0048】
また、2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することできる。そして、この基板間間隔を制御することによって、基板間に構築されるDNAネットワークのネットワーク長を制御することができる。
【0049】
例えば、基板間を広めにするなどによって、前記ネットワークの紐状のDNAは、引き延ばされた状態になる。
【0050】
特に、本実施形態では、ネットワークの紐状のDNAを、引き延ばされた状態にしている。このように、DNAネットワークが、DNA紐の部分が引き延ばされた状態になっていることで、塩基対の方向とインターカレートさせた色素の方向が揃っている。この性質を利用して色素の励起光の変更面を制御することにより、DNAネットワークを三次元光スイッチング素子などに利用することができる。
【0051】
また、ネットワーク連結点と、紐状のDNAに色素をインターカレートしていることで、所望の光学特性を付与することができる。
【0052】
図2には、上述のようにして、構築される三次元DNAネットワークをチェックする装置の構成が示してある。
【0053】
レーザ光源からの所定波長のレーザ光は、1/2波長板(λ/2plate)または偏光解消板(depolarizer)を介し、入射側の対物レンズ(Objective lens)に入力される。ここで、1/2波長板は、入射光の直線偏光の偏光角を制御するものであって、この1/2波長板をレーザ光の入射方向に直交する面内で回転させることで、入射光の偏光角を任意に制御する。また、偏光解消板は、偏光した入射光を非偏光にするものであって、三次元DNAネットワークを観察するときに使用する。なお、レーザ光の波長は、DNAにインターカレートする色素を励起するのに好ましいものが選択される。例えば、色素としてCyanine DyeであるTOTO-1(商標)を用いた場合には、励起光として514nm程度が採用される。また、色素として、ethidinium bromideやSyber Green Iを用いる場合には、300,520nmや、290、380、495nmの励起光をそれぞれ採用する。
【0054】
対物レンズは、入射光をフォーカッシングするもので、その対物レンズからの射出光は、2枚のカバーガラス(Cover glass)間の所定の部位に照射される。なお、カバーガラスを移動することで、入射光の位置を調整する。
【0055】
カバーガラス間には、上述のようにして得られる三次元DNAネットワークが形成されており、この三次元DNAネットワークの任意の場所に、任意の偏光角を持つ入射光がフォーカッシングされて照射される。
【0056】
ここで、DNAには、上述のように色素をインターカレートしてあるため、照射光によって蛍光(fluorescence)が生じ、この蛍光は、検出側の対物レンズ(Objective lens)により、所定の平行光に直され、ダイクロイックミラー(Dichroic mirror)、フィルタ(Filter)を介し、色素によって決定される所定波長の蛍光(TOTO-1(商標)の場合の蛍光は、533nm程度)のみを取り出し、これがCCDカメラ(CCD)へ供給される。このように、この装置では、カバーガラス間の試料の蛍光顕微鏡による画像をCCDカメラによって得ることができる。
【0057】
そして、カバーガラスを二次元移動することによって、DNAネットワークにおける測定位置を二次元的に移動することができ、対物レンズの焦点位置によって、深さ方向の位置を調整でき、これによって三次元DNAネットワークの任意の位置の観察が行える。また、1/2波長板の回転によって、照射光の偏光角を調整することができる。
【0058】
また、三次元DNAネットワークを構成(構築)する場として基板間以外に、基板上に構成することもできる。この場合、基板は三次元DNAネットワークの足場を提供し、この上部に三次元ネットワークが構成される。
【0059】
手順は、次の通りである。
【0060】
(1)DNAとDNA固定化因子を混合し、DNAを不溶化する。
例えば、多価陽イオンを含む電解質を加え、DNAを不溶化する。また、この段階で、予めDNAに色素をインターカレートしておくと、色素で染色された三次元DNAネットワークを構築することもできる。
【0061】
(2)この基板上のDNAを不溶化したDNAの分散液を基板上に滴下する。
基板上にピペットを用いて、(1)の溶液を滴下する。
【0062】
(3)基板上の溶液に、ネットワーク連結点構成因子を含む溶液をさらに滴下する。
ネットワーク連結点構成因子としては、例えばヒストンタンパク質がある。このヒストンタンパク質の溶液を、(2)と同様に基板上に滴下する。このとき、ネットワーク連結点構成因子の濃度を変えることにより、ネットワークの構造を制御することができる。例えば、ネットワーク連結点因子の濃度を高めるとネットワーク連結点の数が多くなるため、構築されるネットワークの網目が小さくなる。
【0063】
(4)自己組織化による三次元DNAネットワークの構築が完了するまで放置する。
数十分間放置する。このとき、基板表面上で二次元DNAネットワークが構築されると同時に基板と垂直方向のネットワークも構築される。
【0064】
このような手順によっても、上述の基板間の場合と同様に、三次元DNAネットワークを構成することができる。
【0065】
・実施例1
「三次元DNAネットワークの作製」
DNAとして、λDNA、DNA固定因子として塩化カルシウムCaCl2、ネットワーク連結点構成因子としてヒストンタンパク質を用いて三次元DNAネットワークをガラス基板間に構築した。
【0066】
まず、色素(TOTO-1(商標):Molecular Probes, Inc.)をインターカレートした濃度8.3nMのλDNAの溶液(TOTO-1:塩基=1:6, 3mM Tris-HCl (pH8.0), 0.1mM EDTAのバッファー)に多価陽イオンCaCl2を含む電解質を濃度が17mMになるように加えλDNAを不溶化した。これを蛍光顕微鏡用の2枚のカバーガラス(ガラス基板)を重ねた隙間にしみ込ませた。次に、3×10-6Mのヒストンタンパク質を含む溶液をカバーガラスの隙間にしみ込ませ、さらに自己組織化による三次元DNAネットワーク構築のため室温で30分間放置した。
【0067】
「観察結果」
このようにして得た試料について、偏光解消板を用いて観察した結果を図3に示す。この例では、2枚のカバーガラス(Cover slip)間の間隔を102.5μmとして、カバーガラス間で複数の異なった深度で画像を得ている。すなわち、図における下側のガラス基板(位置(f):0μm)に対物レンズの焦点をあわせ、ガラス基板上に二次元DNAネットワークが構成されていることを確認した。次に、対物レンズの位置をもう上側ガラス基板の方向に徐々に移動させることで、位置(e):下から20.5μm、位置(d):下から41.0μm、位置(c):下から61.5μm、(b):下から82.0μmでの画像を得、DNAの紐が三次元に伸びていることが確認された。そして、図における上側のガラス基板(位置(a):102.5μm)に対物レンズの焦点をあわせ、上側ガラス基板上にも二次元DNAネットワークが構成されていることを確認した。これによって、一対のガラス基板上にそれぞれ形成されている二次元DNAネットワーク間がDNAの紐で連結されて、三次元DNAネットワークが形成されていることが確認された。
【0068】
ここで、図における明るいスポット上の点がネットワークの連結点であり、この連結点同士をDNAが結んでいることが分かる。すなわち、図4に示すように、DNAの紐(DNA bundle)が球状のヒストンタンパク質の連結点に絡まり、DNAとヒストンタンパク質の複合体(Complexes of DNA and histone)を構成しながら、三次元的に広がっている。
【0069】
「三次元DNAネットワークの構造解析」
次に、入射光(励起光)の偏光面の角度(偏光角)を変えながら、カバーガラス間に構築されたTOTO-1色素をインターカレートした三次元DNAネットワークにおけるカバーガラス表面部分の蛍光強度像を二次元検出器(CCDカメラ)で記録した。なお、偏光角の調整は、λ/2波長板を回転させることによって行った。
【0070】
図5の上に得られた蛍光像を示す。四角で囲んだ領域A〜Dの蛍光強度の励起光偏光面角度(偏光角)依存性を、図5の下に示す。領域A〜Cは、二次元DNAネットワークの紐の部分、領域Dは、ネットワーク連結点の部分である。領域A〜Cでは、偏光角依存性があるが、領域Dでは、偏光角依存性が消失していることが分かる。領域A〜Cの偏光角依存性を高分子化学的な方法で解析したところ、DNAの塩基の向きが分子レベルで揃っていることが分かった。領域Dの連結点は、ヒストンタンパク質にλDNAが結合して、λDNAが糸巻きのようにヒストンタンパク質の回りに巻き付いた構造になり、λDNAの塩基の方向がバラバラになって偏光角依存性が消失したものと考えられる。
【0071】
「三次元DNAネットワークの構造制御」
ネットワーク連結点構成因子であるヒストンタンパク質の濃度を変えることにより、ネットワークの構造を制御した。具体的には、ヒストンタンパク質の濃度を上述の実施例1で用いた濃度の5倍に高めると、ネットワーク連結点の数が大きくなり、ネットワークの網目を小さくすることができた。この場合のガラス基板上のネットワークの蛍光像を図6に示す。
【0072】
従って、ネットワーク連結点構成因子の濃度を変更することで三次元DNAネットワークの構成を制御することできる。
【0073】
・実施例2
この実施例2では、DNAとしてλDNAを、DNA固定化因子として塩化マグネシウムMgCl2を、ネットワーク連結点構成因子としてヒストンタンパク質を用い、3次元DNAネットワークをガラス基板間で構成した。
【0074】
CaCl2を使用した場合と同様な手順でMgCl2を用いて3次元DNAネットワークを基板間に構築し、これを蛍光顕微鏡により観察した(図6参照)。まず、1枚のガラス基板上に対物レンズの焦点を合わせ、基板上に2次元DNAネットワークが構成されていることを確認した(図6(a)参照)。対物レンズの位置をもう一枚のガラス基板の方向に徐々に移動させると、ガラス基板に対して垂直にDNAの紐が構成され(図6(b)参照)、もう一方のガラス基板上に構築された2次元DNAネットワーク(図6(c)参照)までつながっていることを確認した(3次元DNAネットワーク)。明るいスポット状の点がネットワークの連結点で、その連結点同士をDNAが結んでいる(図6点線が連結点を結ぶDNAであり、像が鮮明ではないのでアイガイドをつけた)。
【0075】
・実施例3
この実施例3では、DNAとしてλDNAを、DNA固定化因子として塩化カルシウムCaCl2を、ネットワーク連結点因子としてヒストンタンパク質を用い、3次元DNAネットワークをガラス基板上で構成した。
【0076】
まず、TOTO−1色素をインターカレートしたλDNAの溶液(TOTO−1:塩基=1:6)に多価陽イオンCaCl2を含む電解質を加えλDNAを不溶化した。これを蛍光顕微鏡用のカバーガラス上にスポットした。次に、ヒストンタンパク質を含む溶液をDNAの溶液をスポットした位置に上から滴下し、さらに自己組織化による3次元DNAネットワーク構築のため30分間放置した。これを蛍光顕微鏡により観察した(図7参照)。まず、1枚のガラス基板上に対物レンズの焦点を合わせ、基板上に2次元DNAネットワークが構築されていることを確認した(図7(a)参照)。対物レンズの位置を上部に徐々に移動させると、ガラス基板に対して垂直にDNAの紐が構成されていることを確認した(図7(b)〜(e)参照)(3次元DNAネットワーク)。明るいスポット状の点がネットワークの連結点で、その連結点同士をDNAが結んでいる(図7(a)参照。連結点を結ぶDNAの像が鮮明ではないのでアイガイドとして点線を付けた)。
【0077】
「三次元DNAネットワークの利用」
上述のようにして得られる三次元DNAネットワークは、各種分野において利用が可能であるが、そのうちのいくつかを下に示す。
【0078】
(i)電子デバイス:光スイッチングへの応用(電気伝導性の利用)
DNAは、塩基対の面がDNAの軸に垂直になっており、それぞれの塩基対は隣りの塩基対とπ電子を重なり合わせている。この重なり合ったπ電子軌道を介してDNAの軸方向の電子輸送が可能であり、DNAは半導体程度の電気伝導性を持つ。さらに、DNAに色素分子をインターカレートした場合、その色素を可視光などで電子励起するとDNAの電気伝導性が高まるという報告がある。
【0079】
本実施形態の三次元DNAネットワークでは、上述したように、ネットワークの連結点から伸びるDNA紐の塩基対がDNA紐の伸びる方向と垂直に揃っている。DNAに色素をインターカレートし、偏光励起光を照射してある特定の方向に伸びたDNA紐にインターカレートした色素のみを電子励起することで、そのDNA紐の電気伝導性を高めることができる。この原理を利用して光スイッチングや電子輸送の制御がDNAネットワーク上で可能になる。また、電子供与性、受容性化学種をそのネットワークにドープすることにより、その電気導電性を制御することもできる。
【0080】
(ii)環境材料:遺伝子に作用する環境因子捕捉(DNAの吸着特性の利用)
遺伝子に作用する環境因子捕捉器として、DNAと脂質を混合し膜状に成形したDNAフィルム、または二次元DNAネットワークを用いる方法が考案されている。これは、遺伝子に作用する環境因子がDNAに吸着、インターカレートするものが多いことを利用したものである。ここで、フィルムも二次元DNAネットワークのいずれもDNAが支持体に吸着した状態になっており、環境因子のDNA分子への接近が困難となり捕捉効率が悪くなるという欠点を有する。
【0081】
一方、本実施形態に係る三次元DNAネットワークでは、基板表面に固定されているDNAの他に、基板間の空間に固定されているものがある。そして、この基板間のDNAには、環境因子の接近が容易である。従って、本実施形態に係る三次元DNAネットワークを利用して環境因子の捕捉効率を高めることができる。
【0082】
(iii)医療用生体分子材料:DNAチップ(DNAの相補鎖とのハイブリダイゼーションの利用)
DNAチップとは、一群の遺伝子をガラス基板上にスポットしたものを指す。別の細胞、例えば発ガン細胞から用意した蛍光ラベルされた一群のDNAをこのDNAチップにハイブリダイゼーションさせる。特定のDNAは決まった場所にスポットされたDNAにハイブリダイゼーションするするため、スポット全体の蛍光パターンを正常細胞のそれと比較することにより、発ガン細胞に特有に発現している遺伝子を特定できる。
【0083】
上述の環境材料の項で述べたことと同様に、基板に吸着したDNAに対して相補鎖のハイブリダイゼーションの効率が低下するという問題があり、現在のDNAチップ産業において、DNAの基板への固定法の開発が大きなテーマになっている。これを解決する手段として、DNAの一端を基板に固定し、残りの部分は溶液中に浮遊されておく方向も提案されている。
【0084】
本実施形態の三次元DNAネットワークでは、基板間の空間にDNAが固定されている。このため、相補鎖のハイブリダイゼーション効率が高まり、DNAチップの新しい製造法として利用できる。
【0085】
(iv)工学材料:機能性材料の三次元空間への集積(DNA上の反応の配列特異性の利用)
まず、ある配列を持ったDNAに機能性材料、例えば触媒活性を有する金属微粒子やタンパク質などを連結させる。得られた機能性材料付きDNAを三次元DNAネットワーク上の特定配列部分にハイブリダイゼーションさせ、機能性材料を設計通りの位置に三次元的に集積することが可能である。DNA上の反応の配列特異性の利用して機能性材料を三次元空間に集積することができる。
【0086】
「その他の使用の態様について」
(i)基板間に三次元DNAネットワークを構築した場合において、三次元DNAネットワークを構築した基板間に流路を形成する。この流路に反応液を流すことにより、三次元DNAネットワークに作用させる。例えば、環境因子捕捉においては、環境因子を含む溶液、DNAチップにおいては、蛍光標識した一群のDNAを含む溶液、機能性材料の三次元空間への配置においては、機能性材料付きDNAを含む溶液を流路に流す。
【0087】
(ii)また、基板上面に三次元DNAネットワークを構築した場合には、(i)における各反応液を上部から滴下して直接三次元DNAネットワーク作用させることができる。
【0088】
「他のDNA固定因子、ネットワーク連結点構成因子について」
(i)DNA固定化因子としては、溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子が利用できる。具体的には、多価陽イオンがあり、例えばCaCl2、MgCl2、ポリアミンなどが利用できる。
【0089】
(ii)また、DNAは、基板表面に二次元的に広がって固定化され、これの基板表面もDNA固定化因子といえる。そこで、上述したようなDNA固定化因子を省略し、基板表面をDNA吸着特性を有するものすることができる。このような方法によっても、基板上にDNAが吸着固定化され、これをベースとして三次元DNAネットワークが構築される。この場合も、1枚の基板上に三次元DNAネットワークを構築してもよいし、2枚の基板間に三次元DNAネットワークを構築してもよい。このような基板表面としては、DNA吸着特性を有するものが好適であり、例えば疎水化表面(シランコーティング、雲母表面、マイカ、HOPG、SiO2など)、正電荷表面(ポリ−L−リジンなど)がある。なお、このようなDNA固定化因子として機能する基板を上述のようなDNA固定化因子を添加混合した後の溶液に適用してもよい。
【0090】
(iii)ネットワーク連結点構成因子としては、DNAに配列特異的または配列非特異的に結合または吸着し、さらに凝縮する性質を持つものが採用される。このようなものとして、DNA結合タンパク質があり、例えばヒストン、t4 gene 32 proteinなどが利用される。
【0091】
(iv)ネットワーク連結点構成因子の中で、DNAに配列非特異的に結合または吸着し、さらに凝縮する性質を持つものとして、金属微粒子がある。この金属微粒子としては、界面活性剤が被覆されていない金微粒子、白金微粒子などがあげられる。
【0092】
「λDNA以外のDNAについて」
(i)使用するDNAとしては、数ミクロン以上の長さを有するDNA(1本鎖でも2本鎖でもよい)が望ましい。λDNA以外には、例えば、M13mp8 single strand DNA(1本鎖)、バクテリオファージ T4GT7 DNA(2本鎖)などがあげられる。
【0093】
(ii)遺伝子に作用する環境因子捕捉に関して、例えば、発ガン作用を有するタンパク質などの捕捉では、そのタンパク質が配列特異的に吸着することが知られている場合、その配列を多数繰り返したDNAを、例えばλDNAの中に組み込んで三次元ネットワークに構築する。すなわち、吸着対象タンパク質を特異的に吸着する配列を繰り返すDNAを組み込んで三次元DNAネットワークを構築することが好適である。
【0094】
(iii)遺伝子に作用する環境因子捕捉に関して、例えば、発ガン作用を有するタンパク質などの捕捉では、そのタンパク質が配列特異的に吸着することが知られている場合、その配列を多数繰り返したDNAを、例えばλDNAの中に組み込んでスポット状に三次元ネットワークを構築する。DNAライブラリーの中の多種類のDNAに対してこのスポットを多数構築する。
【0095】
(iv)機能性材料の三次元空間への集積に関して
機能性材料を順序や空間配置を設計した位置に集積する場合には、1つの配列を持ってDNAに1つの機能性材料を対応させて結合させ、機能性材料の順序や空間配列に対応した塩基配列をもつDNAの三次元ネットワークを構成する。
【0096】
「インターカレートする色素について」
DNAなどにインターカレートする色素としては、TOTO-1以外に、
YOYO-1, YOYO-3, TOTO-3,yo-1,T0-1,YO-3,TO-3,SYBR GreenI, SYBR GreenII, POPO-1, POPO-3, BOBO-1, BOBO-3
などが使用することができる。
【特許請求の範囲】
【請求項1】
DNAと、DNA固定化因子を溶液中において混合して、DNAを不溶化し、
この不溶化されたDNAを含む溶液を2枚の基板間に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項2】
DNAと、DNA固定化因子とを溶液中において混合して、DNAを不溶化し、
この不溶化されたDNAを含む溶液を1枚の基板上に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項3】
請求項1または2に記載の方法において、
前記DNA固定化因子は、
溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることを特徴とする三次元DNAネットワークの構築方法。
【請求項4】
請求項3に記載の方法において、
前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることを特徴とする三次元DNAネットワークの構築方法。
【請求項5】
DNAを含む溶液を、DNAを不溶化する表面を有する基板に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項6】
請求項5に記載の方法において、
前記基板の表面は、吸着する特性を有することを特徴とすることを特徴とする三次元DNAネットワークの構築方法。
【請求項7】
請求項6に記載の方法において、
前記基板の表面は、疎水性または正電荷表面であることを特徴とする三次元DNAネットワークの構築方法。
【請求項8】
請求項1〜7のいずれか1つに記載の方法において、
前記ネットワーク連結点構成因子は、
DNAを凝縮する性質を持つ因子であることを特徴とする三次元DNAネットワークの構築方法。
【請求項9】
請求項8に記載の方法において、
前記ネットワーク連結点構成因子は、ヒストンタンパク質であることを特徴とする三次元DNAネットワークの構築方法。
【請求項10】
請求項1〜9のいずれか1つに記載の方法において、
前記DNAとして、特定のタンパク質を吸着する配列を繰り返したDNAを採用することを特徴とする三次元DNAネットワークの構築方法。
【請求項11】
請求項1〜10のいずれか1つに記載の方法において、
前記DNAは、λDNAであることを特徴とする三次元DNAネットワークの構築方法。
【請求項12】
請求項1〜9に記載の方法において、
前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことを特徴とする三次元DNAネットワークの構築方法。
【請求項13】
請求項1〜12のいずれか1つに記載の方法において、
前記不溶化されたDNAを含む溶液を2枚の基板間または1枚の基板上に支持させた後に、ネットワーク連結点構成因子となる物質を添加することを特徴とする三次元DNAネットワークの構築方法。
【請求項14】
請求項1〜13のいずれか1つに記載の方法において、
前記ネットワーク連結点構成因子となる物質の添加量を変更することで、ネットワークの網目の大きさを制御することを特徴とする三次元DNAネットワークの構築方法。
【請求項15】
請求項1〜14のいずれか1つに記載の方法において、
前記基板として単結晶材料や配向性表面を持つ材料を用いることにより、その表面の特性に基づいて構築される三次元DNAネットワークの構造を制御することを特徴とするDNAネットワークの構築方法。
【請求項16】
請求項1または請求項1に従属する請求項3〜15のいずれか1つに記載の方法において、
2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することで、基板間に構築されるDNAネットワークのネットワーク長を制御することを特徴とするDNAネットワークの構築方法。
【請求項17】
請求項1〜16のいずれか1つに記載の方法において、
前記ネットワーク連結点と、紐状のDNAに色素をインターカレートすることを特徴とする三次元DNAネットワークの構築方法。
【請求項18】
三次元的に広がりもって点在するネットワーク連結点構成因子と、
このネットワーク連結点構成因子を連結点として、三次元的に広がる紐状のDNAと、
を含む、
三次元DNAネットワーク。
【請求項19】
請求項18記載の三次元DNAネットワークにおいて、
前記DNA固定化因子は、
溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることを特徴とする三次元DNAネットワーク。
【請求項20】
請求項19に記載の三次元DNAネットワークにおいて、
前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることを特徴とする三次元DNAネットワーク。
【請求項21】
請求項18〜20のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点構成因子は、
DNAを凝縮する性質を持つ因子であることを特徴とする三次元DNAネットワーク。
【請求項22】
請求項21に記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点構成因子は、ヒストンタンパク質であることを特徴とする三次元DNAネットワーク。
【請求項23】
請求項18〜22のいずれか1つに記載の三次元DNAネットワークにおいて、
前記DNAは、特定のタンパク質を吸着する配列を繰り返したDNAをであることを特徴とする三次元DNAネットワーク。
【請求項24】
請求項18〜23のいずれか1つに記載の三次元DNAネットワークにおいて、
前記DNAは、λDNAであることを特徴とする三次元DNAネットワーク。
【請求項25】
請求項18〜24のいずれか1つに記載の方法において、
前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことを特徴とする三次元DNAネットワーク。
【請求項26】
請求項18〜25のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワークの紐状のDNAは、引き延ばされた状態になっていることを特徴とする三次元DNAネットワーク。
【請求項27】
請求項18〜26のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点と、紐状のDNAに色素をインターカレートしていることを特徴とする三次元DNAネットワーク。
【請求項1】
DNAと、DNA固定化因子を溶液中において混合して、DNAを不溶化し、
この不溶化されたDNAを含む溶液を2枚の基板間に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項2】
DNAと、DNA固定化因子とを溶液中において混合して、DNAを不溶化し、
この不溶化されたDNAを含む溶液を1枚の基板上に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項3】
請求項1または2に記載の方法において、
前記DNA固定化因子は、
溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることを特徴とする三次元DNAネットワークの構築方法。
【請求項4】
請求項3に記載の方法において、
前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることを特徴とする三次元DNAネットワークの構築方法。
【請求項5】
DNAを含む溶液を、DNAを不溶化する表面を有する基板に支持させるとともに、溶液中にネットワーク連結点構成因子を添加し、
その状態に所定時間保持し、自己組織化させて、紐状のDNAが三次元に広がった三次元DNAネットワークを構築させる、
ことを特徴とする三次元DNAネットワークの構築方法。
【請求項6】
請求項5に記載の方法において、
前記基板の表面は、吸着する特性を有することを特徴とすることを特徴とする三次元DNAネットワークの構築方法。
【請求項7】
請求項6に記載の方法において、
前記基板の表面は、疎水性または正電荷表面であることを特徴とする三次元DNAネットワークの構築方法。
【請求項8】
請求項1〜7のいずれか1つに記載の方法において、
前記ネットワーク連結点構成因子は、
DNAを凝縮する性質を持つ因子であることを特徴とする三次元DNAネットワークの構築方法。
【請求項9】
請求項8に記載の方法において、
前記ネットワーク連結点構成因子は、ヒストンタンパク質であることを特徴とする三次元DNAネットワークの構築方法。
【請求項10】
請求項1〜9のいずれか1つに記載の方法において、
前記DNAとして、特定のタンパク質を吸着する配列を繰り返したDNAを採用することを特徴とする三次元DNAネットワークの構築方法。
【請求項11】
請求項1〜10のいずれか1つに記載の方法において、
前記DNAは、λDNAであることを特徴とする三次元DNAネットワークの構築方法。
【請求項12】
請求項1〜9に記載の方法において、
前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことを特徴とする三次元DNAネットワークの構築方法。
【請求項13】
請求項1〜12のいずれか1つに記載の方法において、
前記不溶化されたDNAを含む溶液を2枚の基板間または1枚の基板上に支持させた後に、ネットワーク連結点構成因子となる物質を添加することを特徴とする三次元DNAネットワークの構築方法。
【請求項14】
請求項1〜13のいずれか1つに記載の方法において、
前記ネットワーク連結点構成因子となる物質の添加量を変更することで、ネットワークの網目の大きさを制御することを特徴とする三次元DNAネットワークの構築方法。
【請求項15】
請求項1〜14のいずれか1つに記載の方法において、
前記基板として単結晶材料や配向性表面を持つ材料を用いることにより、その表面の特性に基づいて構築される三次元DNAネットワークの構造を制御することを特徴とするDNAネットワークの構築方法。
【請求項16】
請求項1または請求項1に従属する請求項3〜15のいずれか1つに記載の方法において、
2枚の基板間にスペーサを配置したり、溶液の表面張力と基板間に加える圧力のバランスを制御することにより基板間の間隔を制御することで、基板間に構築されるDNAネットワークのネットワーク長を制御することを特徴とするDNAネットワークの構築方法。
【請求項17】
請求項1〜16のいずれか1つに記載の方法において、
前記ネットワーク連結点と、紐状のDNAに色素をインターカレートすることを特徴とする三次元DNAネットワークの構築方法。
【請求項18】
三次元的に広がりもって点在するネットワーク連結点構成因子と、
このネットワーク連結点構成因子を連結点として、三次元的に広がる紐状のDNAと、
を含む、
三次元DNAネットワーク。
【請求項19】
請求項18記載の三次元DNAネットワークにおいて、
前記DNA固定化因子は、
溶液中で負に帯電したDNAを電気的に中性化し、DNAを不溶化する因子であることを特徴とする三次元DNAネットワーク。
【請求項20】
請求項19に記載の三次元DNAネットワークにおいて、
前記DNA固定化因子となる物資は、多価陽イオンを含む電解質であることを特徴とする三次元DNAネットワーク。
【請求項21】
請求項18〜20のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点構成因子は、
DNAを凝縮する性質を持つ因子であることを特徴とする三次元DNAネットワーク。
【請求項22】
請求項21に記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点構成因子は、ヒストンタンパク質であることを特徴とする三次元DNAネットワーク。
【請求項23】
請求項18〜22のいずれか1つに記載の三次元DNAネットワークにおいて、
前記DNAは、特定のタンパク質を吸着する配列を繰り返したDNAをであることを特徴とする三次元DNAネットワーク。
【請求項24】
請求項18〜23のいずれか1つに記載の三次元DNAネットワークにおいて、
前記DNAは、λDNAであることを特徴とする三次元DNAネットワーク。
【請求項25】
請求項18〜24のいずれか1つに記載の方法において、
前記DNAは、目的とする機能性材料の順序や空間配列に対応した塩基配列を持つことを特徴とする三次元DNAネットワーク。
【請求項26】
請求項18〜25のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワークの紐状のDNAは、引き延ばされた状態になっていることを特徴とする三次元DNAネットワーク。
【請求項27】
請求項18〜26のいずれか1つに記載の三次元DNAネットワークにおいて、
前記ネットワーク連結点と、紐状のDNAに色素をインターカレートしていることを特徴とする三次元DNAネットワーク。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2011−16222(P2011−16222A)
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願番号】特願2010−168406(P2010−168406)
【出願日】平成22年7月27日(2010.7.27)
【分割の表示】特願2004−43734(P2004−43734)の分割
【原出願日】平成16年2月19日(2004.2.19)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(598014814)株式会社コンポン研究所 (24)
【Fターム(参考)】
【公開日】平成23年1月27日(2011.1.27)
【国際特許分類】
【出願日】平成22年7月27日(2010.7.27)
【分割の表示】特願2004−43734(P2004−43734)の分割
【原出願日】平成16年2月19日(2004.2.19)
【出願人】(000003207)トヨタ自動車株式会社 (59,920)
【出願人】(598014814)株式会社コンポン研究所 (24)
【Fターム(参考)】
[ Back to top ]

