三置換ベンゾピラノンの使用
酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への三置換ベンゾピラノンの使用、新規な三置換ベンゾピラノンおよびその生理学的に許容できる塩、およびこれらの化合物を含有する植物抽出物、薬物、食品および製剤を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への三置換ベンゾピラノンの使用と、新規な三置換ベンゾピラノンおよび生理学的に許容できるその塩とに関する。さらに本発明は、植物抽出物、薬物、食品および製剤に関する。
【背景技術】
【0002】
遊離基とは、外部軌道内に不対電子を有する原子または分子である。生体内作用にとって最も重要な遊離基とは、還元によって異なる代謝産物を形成することができる酸素分子である。これらの代謝産物は、一般に「活性酸素種」(ROS)という総称で呼ばれている。ROSの例としては、超酸化物アニオン、ヒドロキシルラジカル、過酸化水素、過酸化物アニオン、一重項酸素、次亜塩素酸塩、窒素酸化物および過酸化亜硝酸が挙げられる。
ROSは、様々な生体内作用によって自然発生する。細胞を微生物、生体異物あるいは内在物質で刺激した後、スーパーオキシドラジカルおよび他のROSが、膜状NADPHオキシダーゼを活性化することによって酸素分子から発生する反応生成物として形成されるといういわゆる白血球の「呼吸バースト」は、特に重要である。呼吸バーストとは、初期の非特異免疫防御の最も重要な機構の一つであり、主に、侵入した感染体および腫瘍細胞を死滅させる役割を果たす。さらに、ROSは、不十分な共役反応に起因する電子の漏出によって主に発生する。これは、例えば、ミトコンドリア呼吸中の、虚血性状態におけるヒポキサンチンのキサンチンオキシダーゼ触媒酸化によるアラキドン酸からのプロスタグランジンおよびロイコトリエンの合成または生体異物のシトクロムP450媒介代謝の過程において生ずる。
【0003】
呼吸バーストが基本的に感染からの防御における望ましい反応であるのに対し、形成されるROSの増加およびROSの連続した形成は通常望ましくない。その理由は、酸化攻撃は侵入してくる微生物に限られておらず、しかも生体組織がそれらの毒性に曝されるからである。これは、とりわけ、自己免疫疾患の経過中におけるROSの形成の増加のごとき非感染性疾患、虚血の経過中における変性疾患、または医薬品の代謝に当てはまる。遊離基およびROSの好ましからざる効果は、それらと核酸(例えば、DNA鎖切断の誘発)、タンパク質(例えば、変性、酵素系の不活性化)、炭水化物(例えば、ヒアルロン酸の解重合)およびとりわけ脂質(例えば、脂質過酸化反応、粘膜の病変、炎症性プロスタグランジンおよびロイコトリエンの形成)との相互作用に基づく。
活性酸素種(ROS)が様々な病気の発症に関わっていることは約50年前に言明されていたが、今日、これらの分子が、様々な病気、例えば糖尿病I型およびII型、炎症性疾患(例えば、関節リウマチ、ぜんそく、潰瘍性大腸炎、乾癬)、細菌感染およびウイルス感染(例えば、インフルエンザ、エイズ、ウイルス性肝炎)、アテローム性動脈硬化性、虚血、神経系の病気(例えば、アルツハイマー病、パーキンソン病および他の神経変性病)、白内障、鎌状赤血球貧血および腫瘍の発症において重要な役割を果たしていること、および、これらの分子が老化プロセスにも関与していることは確かであると考えられている(非特許文献1〜3)。
【0004】
生物は、遊離基やROSの悪影響から防御するための様々な防御システムを備えている。前記防御システムとしては、ビタミン(例えば、ビタミンEおよびビタミンC)および他の低分子化合物(例えば、グルタチオン、尿酸)、抗酸化酵素(例えば、スーパオキシドジスムターゼ、カタラーゼおよびグルタチオンペルオキシダーゼ)並びに金属結合タンパク質(例えば、トランスフェリン、セルロプラスミン)が挙げられる。しかしながら、生体の抗酸化システムは、病的過程の初期段階において活発になることが多い。その理由は、単に、進行中の病的過程において形成されるROSの濃度の増大が内部防御機構の容量をはるかに上回ってしまうからである。
【0005】
従って、酸化的ストレスは、ROSの濃度と抗酸化防御システムの間の不均衡であると考えられる。従って、数多くの疾病に関してのROSの突出した重要性により、そのような病的状態の予防および治療に用いることができる抗酸化性を有する物質に多大な関心が寄せられている。
ROSは炎症反応にとってとりわけ重要であり、酸化的ストレスは炎症性エイコサノイド(例えば、プロスタグランジン、ロイコトリエン)およびサイトカイン(例えば、IL−1、TNF−α、IL−6)の合成の増加を伴うことが多い。従って、とりわけ、抗酸化性を示し尚且つこれらの炎症メディエータの形成を妨げる物質が求められている。
【非特許文献1】A. Bendich(1994) in: B. Frei(ed.) “Natural Antioxidants in Human Health and Disease”, Academic Press, San Diego, p. 447
【非特許文献2】E. Peterhans(1997) J. Nutr. 127, 962 S
【非特許文献3】D. V. Parke(1999) in: T. K. Basu et al. (ed.) “Antioxidants in Human Health”, CAB International, p. 1
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための化合物を提供することである。
【課題を解決するための手段】
【0007】
この目的は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への一般式I
【0008】
【化1】

【0009】
式中、残基R6、R7およびR8は、独立して、HまたはSO3Hまたはそれらの生理学的に許容できる塩を表す、
で表される化合物の使用によって達成される。
【発明を実施するための最良の形態】
【0010】
驚くべきことに、6,7,8−トリヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物II)は特に有利な薬理学的特性を示すことが分かった。強力な抗酸化作用に加えて、この化合物は、ロイコトリエンおよびプロスタグランジンの合成および炎症性サイトカインIL−1β、TNF−αおよびIL−6の合成も示す。従って、化合物IIは、酸化的ストレスを伴う病気、例えば糖尿病I型および/またはII型、アテローム性動脈硬化性および内皮機能不全、虚血、神経系の病気(例えば、アルツハイマー病、パーキンソン病および他の神経変性病)、白内障および腫瘍を治療または予防するのに基本的に好適である。しかしながら、化合物IIは、炎症成分を有する病気、例えば関節リウマチ、ぜんそく、潰瘍性大腸炎、クローン(Crohn)病、乾癬、神経皮膚炎、細菌やウィルスによる感染(例えば、インフルエンザ、エイズ、ウイルス性肝炎)および他の病原体(例えば、寄生虫、菌類およびプリオン)に対して特に有利である。化合物IIは、文献(O. Kayser and H. Kolodziej, Phytochemistry 39, 1181−1185(1995); S. Kumar, A. B. Ray, C. Konno, Y. Oshima and H. Hikino, Phytochemistry 27, 636−638(1988); K. P. Latte, O. Kayser, N. Tan, M. Kaloga and H. Kolodziej, Z. Naturforsch. 55c, 528−533(2000))にすでに記載されているが、化合物IIの薬理効果は未だ不明である。化合物IIは、ペラルゴニウムシドイデスにはわずか0.0004%しか含有されておらず(Kayserら、Latteら、上記参照)、ペラルゴニウムレニフォルメにはわずか0.02%しか含有されていない(Latteら、上記参照)。これより、化合物IIは、これらの低い濃度において、ペラルゴニウムシドイデスおよびレニフォルメの生物学的効率に多大な貢献はしていないと結論付けられる。
従って、本発明の主題は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への化合物IIの使用である。
【0011】
化合物IIは、一般式Iの硫酸エステルの形態で投与することも可能である。これは、化合物IIが経口投与時にそれらの化合物から放出されるからである。このため、一般式Iの化合物は、前述の病的状態の治療または予防にも好適である。一般式Iの好ましい化合物としては、6,7−ジヒドロキシ−8−スルホオキシ−2H−1−ベンゾピラン−2−オン(R6=R7=H; R8=SO3H)および7,8−ジヒドロキシ−6−スルホオキシ−2H−1−ベンゾピラン−2−オン(R7=R8=H; R6=SO3H)が挙げられる。6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(R6=R8=SO3H; R7=H; 化合物III)が特に好ましい。残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物は新規である。従って、これらの化合物、とりわけ化合物III、並びに酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防へのそれらの使用も本発明の一部である。
【0012】
【化2】

【0013】
一般式Iにおいて、残基R6、R7およびR8は、独立して、水素原子またはSO3H残基である。一般式Iの化合物並びに化合物IIおよびIIIは、それらの生理学的に許容できるアルカリ金属、アルカリ土類金属および他の塩、例えばカリウム塩、の形態をとることもできる。これらの塩も本発明の主題である。
【0014】
さらに、植物抽出物、とりわけ、残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物を1種以上含有するペラルゴニウム種からの植物抽出物も、本発明の一部を形成する。これにより、植物抽出物の乾燥物中の一般式Iの化合物の少なくとも1種の濃度が0.1%〜10%である植物抽出物が好ましく、前記濃度が0.5%〜5%である植物抽出物が特に好ましい。前記乾燥物は、Ph. Eur.(流体抽出物)に応じた乾燥残留物に相当する。この場合、例えば流体抽出物に直接分析を施すこともでき、乾燥残留物は計算によって求めることができる。
【0015】
化合物IIの調製は、例えば市販のフラキシンまたは残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物の加水分解および/またはエーテル開裂によって行うことができる。
【0016】
残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物の調製は、化合物IIを三酸化硫黄−トリメチルアミン錯体と反応させることによって、または化合物IIIの場合、好適な植物材料、例えばペラルゴニウムシドイデスの乾燥した根から単離することによって達成することができる。化合物6,7−ジヒドロキシ−8−スルホオキシ−2H−1−ベンゾピラン−2−オン(一般式I; R6=R7=H; R8=SO3H)および7,8−ジヒドロキシ−6−スルホオキシ−2H−1−ベンゾピラン−2−オン(一般式I; R7=R8=H; R6=SO3H)も、化合物IIIを部分加水分解することによって得ることができる。
【0017】
本発明による抽出物は、例えば水、メタノール、エタノール、アセトン等およびこれらの混合物のごとき溶媒を用いる公知の調製法によって、室温〜60℃の温度で、10分間〜24時間、ゆっくり〜激しく攪拌しながらまたは濾過によって、ペラルゴニウム植物またはその一部から、様々な組成で得ることができる。好ましい抽出溶媒は、水またはエタノールと水との混合物である。前記混合物中の水の割合は少なくとも50重量%であり、エタノール/水の比率は、10/90〜15/85(w/w)であることが特に好ましい。本発明による一般式Iの化合物をさらに濃縮するために、さらなる濃縮、例えば1−ブタノール/水またはエチルアセテート/水を用いた液液分配、イオン交換体、LH20、HP20および他の樹脂を用いた吸脱着またはRP18、シリカゲル等を用いたクロマトグラフ分離を行ってもよい。必要に応じて、それ自体公知の方法に従って、高温および/または低圧において溶媒を取り除くことによってまたは凍結乾燥によって、乾燥抽出物を得るためのさらなる処理を行ってもよい。European Pharmacopoeiaによれば、乾燥抽出物は、一般に、少なくとも95重量%の乾燥残留物を有する。
【0018】
本発明による一般式Iの化合物およびそれら化合物のうちの少なくとも1種を含有する抽出物は、粉末、顆粒、錠剤、糖衣錠あるいはカプセルの形態でまたは溶液として、好ましくは経口で投与することができる。
投与量としては、一般式Iの化合物の1種以上が1日当たり0.1〜250mg、好ましくは1日当たり0.3〜50mg投与される。
【0019】
錠剤を調製するには、一般式Iの化合物の少なくとも1種または対応する抽出物を、好適な生理学的に許容できるアジュバント、例えばラクトース、セルロース、二酸化ケイ素、クロスカルメロースおよびステアリン酸マグネシウムと混ぜ合わせ、プレスして錠剤にする。前記錠剤は、任意に、例えばヒドロキシメチルプロピルセルロース、ポリエチレングリコール、着色剤(例えば、酸化チタン、酸化鉄)およびタルクからなる好適なコーティングを施されていてもよい。
酸化的ストレスおよび/または炎症反応に関連する病的状態における化合物IIの効果は、下記実験によって立証される。
【実施例】
【0020】
抗酸化性
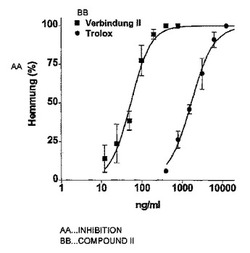
脂質の自動酸化は発光を伴う。この非常に弱い化学発光の測定は、過酸化物の定量化と酸化防止剤の効力の評価との両方に用いることができる。本研究では、オスのネズミ(NMRI; 20〜30g; Centre d’Elevage Janvier, Le Genest−Saint Isle, France)の脳組織を、脂質が豊富な組織として用いた。脳を摘出後、よく冷えたリン酸塩緩衝生理食塩溶液(PBS、pH=7.4)で洗浄し、髄膜および残った血を取り除いた。組織サンプルを、前記サンプルの体積(v/w)の4倍のPBSと均質化させ、1,000 × g および4℃で10分間遠心分離機にかけた。直ちに、上澄み液を同じ緩衝液で3倍に希釈し、氷の上で保存した。250μlの希釈済み上澄み液を試験管に移し、37℃において、6チャネル照度計(Multi−Biolumat LB 9505 C, Berthold, Bad Wildbad)で10分間培養した。2.5%DMSOを添加したPBSに25μlの化合物IIを添加した後、さらに10分間培養を続けた。その後、化学発光(CL)の強度を60分間にわたって測定した。自動酸化の抑制の比率を、同時に測定した溶媒対照(2.5%DMSOを添加したPBS)と比較して計算した。化合物IIは、53ng/mlの半最大抑制濃度において、脂質の自動酸化を優れた効力で抑制した(図1)。一方、抗酸化性の測定において基準物質としてしばしば用いられるTroloxは、1665ng/mlの半最大抑制濃度を示したに過ぎなかった。
図1は、脂質の自動酸化に対する化合物IIおよびTroloxの作用を示す。3つの独立した試験からの溶媒対照と比較した脂質過酸化の抑制の比率(平均値±SD)が示されている。
【0021】
炎症性サイトカインの合成の抑制
炎症性サイトカインIL−1β、TNF−αおよびIL−6の合成に対する化合物IIの作用を、活性化マウス腹腔マクロファージを用いて測定した。前記活性化マクロファージを得るために、0.5mlのPBS中の3x109個の死菌コリネバクテリアパルバムバクテリア(Changzhou Yanshen Co., Ltd., Changzhou, China)を、オスのNMRIマウス(Centre d’Elevage Janvier, Le Genest−Saint Isle, France)の腹腔内に注入した。6日後、腹腔を、カルシウムおよびマグネシウムを含有せず且つ10U/mlのヘパリンを添加した2.5mlのハンクス平衡塩類溶液(HBSS)で洗浄した。細胞を、10%のウシ胎仔血清が添加された完全RPMI培地に、1ml当たり2x106個の濃度で再懸濁させた。200μmの細胞懸濁液を、96ウェルマイクロタイタープレートの各ウェルに充填した。2時間の培養期間の後、非接着性細胞を取り除きし、残った細胞ローンを培養液(37℃)で2度洗浄した。マクロファージを化合物IIを用いて30分間予備培養させた後、1μg/mlの大腸菌のリポポリサッカライド(血清型0127:B8、Sigma、Deisenhofen)を添加することによって炎症性サイトカインの合成を誘発させた。24時間(37℃、空気中のCO2濃度:5%)培養させた後、凍結および解凍を3回繰り返すことによって細胞を溶解させ、細胞上澄み液を回収し、分析するまで−80℃で凍らせておいた。細胞上澄み液中のサイトカインの濃度の測定は、製造業者の手引きに従って市販の検査キット(Duosets IL−1β、TNF−αおよびIL−6、R&D、Wiesbaden)を用いて行った。すべての調査は3回行った。サイトカインの合成に対する化合物IIの作用を、同時に試験した溶媒対照(完全RPMI培地中の0.1%DMSO)と比較して評価した。下記表1から分かるように、100μg/mlの濃度における化合物IIは、3つの測定サイトカインすべての合成に対して著しい抑制効果を示したが、IL−6の製造に対する効果が最も高かった。
【0022】
【表1】

【0023】
ヒト全血におけるシクロオキシゲナーゼおよびリポキシゲナーゼ活性の抑制
ヘパリン化ヒト全血を検査に用いた。100μlの全血を、96ウェルマイクロタイタープレートの各ウェルに充填した。独立したプレートを用いて、シクロオキシゲナーゼ−1(COX1)およびリポキシゲナーゼ(LO)活性の測定およびシクロオキシゲナーゼ−2(COX2)の誘導を行った。
【0024】
DMSO(最終濃度:0.1%)を溶解促進剤として用い、1%の抗生物質/抗真菌剤溶液と2mMのL−グルタミン(Sigma,Deisenhofen)とで、化合物IIをDME培地(DMEM)中で希釈した。50μlの化合物IIを添加した後、試験対象を37℃で60分間培養させた。その後、50μlのカルシウムイオノフォアA23187(最終濃度:50μM)を添加することによって、エイコサノイド合成を促進させた。37℃でさらに30分間培養させた後、マイクロタイタープレートを4℃において5分間、1,500gで遠心分離機にかけた。血漿をピペットで取り、分析するまで−80℃で凍らせておいた。
【0025】
COX2活性を検証するために、血液サンプル(100μl/ウェル)を、まずアスピリン(DMEM中の50μl、最終濃度:12μg/ml)で、37℃において6時間予備処理することによって、COX1を不活性化させた。その後、化合物IIおよび溶媒(0.1%のDMSOを含有するDMEM)を、それぞれ25μlずつ添加した。さらに、COX2の発現を誘発するために、25μlの大腸菌のリポポリサッカライド(血清型0127:B8、最終濃度:10μg/ml)を添加した。37℃で18時間培養させた後、上記のようにして血漿を採取し、分析するまで−80℃で凍らせておいた。
【0026】
血漿サンプルについて、TXB2、PGE2およびシステニルロイコトリエン(システニル−LT)を、COX1活性、COX2活性およびLO活性についてのパラメータとして測定した。分析のために、市販のEIA検査キット(TXB2およびPGE2: Caymann/BL, Hamburg; システニルロイコトリエン: CAST−2000, Milenia, Bad Nauheim)を製造業者の手引きに従って用いた。その結果(表2参照)から、化合物IIはCOX2およびLOの活性を強力に抑制する効果を示すことが明らかとなった。一方、COX1の活性はほとんど影響を受けなかった。この効力範囲は非常に有利であるととらえられるべきである。なぜならば、化合物IIの治療的使用において、COX1抑制剤に特有である副作用、例えば消化管の合併症(浸食、潰瘍)または血小板の凝集の抑制に因る出血、を考慮する必要が無くなるからである。
【0027】
【表2】

【0028】
実施例1: 6,7,8−トリヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物II)の調製
20g(42.7mmol)の6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オンカリウム塩を480mlの約2Nの塩酸に投入し、40〜50℃で20時間攪拌した。冷却後、沈殿した粗生成物を濾別し、水で再結晶化させた(熱濾過)。得られた結晶化物を濾別および洗浄した後、100℃で真空乾燥させた。5.9g(71%)、融点:260℃で分解開始。1Hおよび13CNMRは、O.Kayser and H. Kolodziej (Phytochemistry 39, 1181−1185(1995))の指摘に適合している。
【0029】
実施例2: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オンカリウム塩(化合物IIIのカリウム塩)の単離および構造決定
15kgのペラルゴニウムシドイデスの根を、室温において、75lの水および40lの水で濾過した。得られた水性抽出物をそのおよそ1/3にまで濃縮した後、7kgの硫酸アンモニウムを添加し、そして2−ブタノン/エタノールの3/2混合物で数回抽出した。得られた有機相を混ぜ合わせ、蒸発によって濃縮した。
この残留物をHP20カラム(溶離液:水)でクロマトグラフ分析した。6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン成分を濃縮し、水酸化カリウム溶液を用いてpHを8に調節し、エタノールで1/1の割合で希釈した。得られた沈殿物を濾別し、水中に懸濁させた。水酸化カリウム溶液を用いてpHを10.7に調節し、エタノールで1/1の割合で希釈した。その結果として得られた沈殿物を熱湯に再溶解させた。得られた溶液を濾過し、エタノールで1/1の割合で希釈した。沈殿した結晶化物を濾別および洗浄した後、50℃で真空乾燥させた。27.6g(植物材料に対して0.14%、遊離酸として計算)。
融点:216℃で分解開始;C9H3K3O11S2(468.55) 実測値:C 23.08%、 H 0.70%、K 24.65%、S 13.9% − 計算値: C 23.07%、 H 0.65%、K 25.04%、O 37.56%、S 13.69%; 1HNMR(DMSO−d6):δ=7.62(d,J=9.1Hz、H−4)、7.03(s,H−5)、5.59(d,J=9.1Hz、H−3)、13CNMR(DMSO−d6):δ=162.9(C−7)、161.9(C−2)、147.7(C−8)、145.1(C−4)、142.2(C−6)、130.4(C−8a)、115.5(C−5)、102.4(C−3)、101.5(C−4a)。
【0030】
トリヒドロキシクマリン二硫酸カリウム塩の酸加水分解によって、6,7,8−トリヒドロキシクマリンが得られた(実施例1参照)。さらなる構造決定のため、下記反応順序に従って、化合物IIIを誘導体化させた。
【0031】
【化3】

【0032】
このために、トリヒドロキシクマリン二硫酸カリウム塩を、炭酸カリウムの存在下、60℃においてDMF中でヨウ化メチルと反応させて、対応する7−メチルエーテルを得た。濃塩酸で酸性化させた後、反応混合物を50℃で24時間攪拌し、酢酸エチルで抽出し、シリカゲル(溶離液:ヘプタン/酢酸エチル 7/3)でクロマトグラフ分析した。6,8−ジヒドロキシ−7−メトキシクマリンが得られた。これを、炭酸カリウムおよびヨウ化カリウムの存在下、室温においてDMF中で臭化ベンジルと反応させた。得られた混合物を濃縮し、残留物を水とTBMEとの間に分散させた。得られた有機相を濃縮し、シリカゲル(溶離液:トルエン/エタノール 95/5)でクロマトグラフ分析した。6,8−ジベンジルオキシ−7−メトキシクマリンが得られた。
【0033】
後者の化合物の置換パターンを、CDCl3中において、一次元および二次元NMR分光法によって求めた。H−5とCH2信号の1つとの間の明白なNOESY相関関係により、6位におけるベンジルオキシ残基の存在が明確に導き出される。さらに、OCH3信号は、メトキシ基が2つのベンジルオキシ残基の間、すなわち、7位に位置することを示す両方のCH2信号と相関関係がある。C−7とH−5並びにOCH3との間、並びにC−8とH−4並びに8−CH2との間のHMBC相関関係は、置換パターンがNOESYから派生していることを裏付けている。トリヒドロキシクマリジサルフェートのスルホキシ残基は6位と8位との間に結合していることは、調査した誘導体の調製手順およびその構造から明確に導き出すことができる。
【0034】
【化4】

【0035】
実施例3: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物III)を含有する植物抽出物
500gのペラルゴニウムシドイデスの根を、室温において、3kgの水で4時間抽出した。抽出された植物抽出物を濾別した後、上記条件下において2kgの水でもう1度抽出し、濾過した。得られたろ液を混ぜ合わせ、約35℃において濃縮し、そして凍結乾燥させた。化合物IIIの含有率が1.54%である乾燥抽出物が58.7g(11.7%)得られた。
【0036】
実施例4: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物III)を含有する植物抽出物
約1.25kgのペラルゴニウムシドイデスの根を、室温において、約12.5kgのエタノール/水 11/89(w/w)で抽出した。濾過後、得られたろ液を約45℃で濃縮し、そして凍結乾燥させた。化合物IIIの含有率が1.86%である乾燥抽出物が90.4g(7.2%)得られた。
【0037】
実施例5: 錠剤
求められる効力に依って5〜250mgの活性材料を含有する錠剤を調製するには、下記が必要とされる。
化合物II 200〜5,000g
セルロース粉末 2,000g
澱粉 1,200g
コロイドケイ酸 80g
ステアリン酸マグネシウム 20g
ラクトース 〜10,000g
活性材料は、任意に粉砕され、アジュバントと均質に混ぜ合わされ、そして慣用の方法で各々の重量が250mg、直径が9mmの錠剤にプレスされる。125mgを超える投与量については、各々の重量が500mg、直径が11mmの錠剤をプレスする。必要に応じて、錠剤にフィルムをコーティングする。
【図面の簡単な説明】
【0038】
【図1】脂質の自動酸化に対する化合物IIおよびTroloxの作用を示す。
【技術分野】
【0001】
本発明は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への三置換ベンゾピラノンの使用と、新規な三置換ベンゾピラノンおよび生理学的に許容できるその塩とに関する。さらに本発明は、植物抽出物、薬物、食品および製剤に関する。
【背景技術】
【0002】
遊離基とは、外部軌道内に不対電子を有する原子または分子である。生体内作用にとって最も重要な遊離基とは、還元によって異なる代謝産物を形成することができる酸素分子である。これらの代謝産物は、一般に「活性酸素種」(ROS)という総称で呼ばれている。ROSの例としては、超酸化物アニオン、ヒドロキシルラジカル、過酸化水素、過酸化物アニオン、一重項酸素、次亜塩素酸塩、窒素酸化物および過酸化亜硝酸が挙げられる。
ROSは、様々な生体内作用によって自然発生する。細胞を微生物、生体異物あるいは内在物質で刺激した後、スーパーオキシドラジカルおよび他のROSが、膜状NADPHオキシダーゼを活性化することによって酸素分子から発生する反応生成物として形成されるといういわゆる白血球の「呼吸バースト」は、特に重要である。呼吸バーストとは、初期の非特異免疫防御の最も重要な機構の一つであり、主に、侵入した感染体および腫瘍細胞を死滅させる役割を果たす。さらに、ROSは、不十分な共役反応に起因する電子の漏出によって主に発生する。これは、例えば、ミトコンドリア呼吸中の、虚血性状態におけるヒポキサンチンのキサンチンオキシダーゼ触媒酸化によるアラキドン酸からのプロスタグランジンおよびロイコトリエンの合成または生体異物のシトクロムP450媒介代謝の過程において生ずる。
【0003】
呼吸バーストが基本的に感染からの防御における望ましい反応であるのに対し、形成されるROSの増加およびROSの連続した形成は通常望ましくない。その理由は、酸化攻撃は侵入してくる微生物に限られておらず、しかも生体組織がそれらの毒性に曝されるからである。これは、とりわけ、自己免疫疾患の経過中におけるROSの形成の増加のごとき非感染性疾患、虚血の経過中における変性疾患、または医薬品の代謝に当てはまる。遊離基およびROSの好ましからざる効果は、それらと核酸(例えば、DNA鎖切断の誘発)、タンパク質(例えば、変性、酵素系の不活性化)、炭水化物(例えば、ヒアルロン酸の解重合)およびとりわけ脂質(例えば、脂質過酸化反応、粘膜の病変、炎症性プロスタグランジンおよびロイコトリエンの形成)との相互作用に基づく。
活性酸素種(ROS)が様々な病気の発症に関わっていることは約50年前に言明されていたが、今日、これらの分子が、様々な病気、例えば糖尿病I型およびII型、炎症性疾患(例えば、関節リウマチ、ぜんそく、潰瘍性大腸炎、乾癬)、細菌感染およびウイルス感染(例えば、インフルエンザ、エイズ、ウイルス性肝炎)、アテローム性動脈硬化性、虚血、神経系の病気(例えば、アルツハイマー病、パーキンソン病および他の神経変性病)、白内障、鎌状赤血球貧血および腫瘍の発症において重要な役割を果たしていること、および、これらの分子が老化プロセスにも関与していることは確かであると考えられている(非特許文献1〜3)。
【0004】
生物は、遊離基やROSの悪影響から防御するための様々な防御システムを備えている。前記防御システムとしては、ビタミン(例えば、ビタミンEおよびビタミンC)および他の低分子化合物(例えば、グルタチオン、尿酸)、抗酸化酵素(例えば、スーパオキシドジスムターゼ、カタラーゼおよびグルタチオンペルオキシダーゼ)並びに金属結合タンパク質(例えば、トランスフェリン、セルロプラスミン)が挙げられる。しかしながら、生体の抗酸化システムは、病的過程の初期段階において活発になることが多い。その理由は、単に、進行中の病的過程において形成されるROSの濃度の増大が内部防御機構の容量をはるかに上回ってしまうからである。
【0005】
従って、酸化的ストレスは、ROSの濃度と抗酸化防御システムの間の不均衡であると考えられる。従って、数多くの疾病に関してのROSの突出した重要性により、そのような病的状態の予防および治療に用いることができる抗酸化性を有する物質に多大な関心が寄せられている。
ROSは炎症反応にとってとりわけ重要であり、酸化的ストレスは炎症性エイコサノイド(例えば、プロスタグランジン、ロイコトリエン)およびサイトカイン(例えば、IL−1、TNF−α、IL−6)の合成の増加を伴うことが多い。従って、とりわけ、抗酸化性を示し尚且つこれらの炎症メディエータの形成を妨げる物質が求められている。
【非特許文献1】A. Bendich(1994) in: B. Frei(ed.) “Natural Antioxidants in Human Health and Disease”, Academic Press, San Diego, p. 447
【非特許文献2】E. Peterhans(1997) J. Nutr. 127, 962 S
【非特許文献3】D. V. Parke(1999) in: T. K. Basu et al. (ed.) “Antioxidants in Human Health”, CAB International, p. 1
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための化合物を提供することである。
【課題を解決するための手段】
【0007】
この目的は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への一般式I
【0008】
【化1】

【0009】
式中、残基R6、R7およびR8は、独立して、HまたはSO3Hまたはそれらの生理学的に許容できる塩を表す、
で表される化合物の使用によって達成される。
【発明を実施するための最良の形態】
【0010】
驚くべきことに、6,7,8−トリヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物II)は特に有利な薬理学的特性を示すことが分かった。強力な抗酸化作用に加えて、この化合物は、ロイコトリエンおよびプロスタグランジンの合成および炎症性サイトカインIL−1β、TNF−αおよびIL−6の合成も示す。従って、化合物IIは、酸化的ストレスを伴う病気、例えば糖尿病I型および/またはII型、アテローム性動脈硬化性および内皮機能不全、虚血、神経系の病気(例えば、アルツハイマー病、パーキンソン病および他の神経変性病)、白内障および腫瘍を治療または予防するのに基本的に好適である。しかしながら、化合物IIは、炎症成分を有する病気、例えば関節リウマチ、ぜんそく、潰瘍性大腸炎、クローン(Crohn)病、乾癬、神経皮膚炎、細菌やウィルスによる感染(例えば、インフルエンザ、エイズ、ウイルス性肝炎)および他の病原体(例えば、寄生虫、菌類およびプリオン)に対して特に有利である。化合物IIは、文献(O. Kayser and H. Kolodziej, Phytochemistry 39, 1181−1185(1995); S. Kumar, A. B. Ray, C. Konno, Y. Oshima and H. Hikino, Phytochemistry 27, 636−638(1988); K. P. Latte, O. Kayser, N. Tan, M. Kaloga and H. Kolodziej, Z. Naturforsch. 55c, 528−533(2000))にすでに記載されているが、化合物IIの薬理効果は未だ不明である。化合物IIは、ペラルゴニウムシドイデスにはわずか0.0004%しか含有されておらず(Kayserら、Latteら、上記参照)、ペラルゴニウムレニフォルメにはわずか0.02%しか含有されていない(Latteら、上記参照)。これより、化合物IIは、これらの低い濃度において、ペラルゴニウムシドイデスおよびレニフォルメの生物学的効率に多大な貢献はしていないと結論付けられる。
従って、本発明の主題は、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への化合物IIの使用である。
【0011】
化合物IIは、一般式Iの硫酸エステルの形態で投与することも可能である。これは、化合物IIが経口投与時にそれらの化合物から放出されるからである。このため、一般式Iの化合物は、前述の病的状態の治療または予防にも好適である。一般式Iの好ましい化合物としては、6,7−ジヒドロキシ−8−スルホオキシ−2H−1−ベンゾピラン−2−オン(R6=R7=H; R8=SO3H)および7,8−ジヒドロキシ−6−スルホオキシ−2H−1−ベンゾピラン−2−オン(R7=R8=H; R6=SO3H)が挙げられる。6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(R6=R8=SO3H; R7=H; 化合物III)が特に好ましい。残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物は新規である。従って、これらの化合物、とりわけ化合物III、並びに酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防へのそれらの使用も本発明の一部である。
【0012】
【化2】

【0013】
一般式Iにおいて、残基R6、R7およびR8は、独立して、水素原子またはSO3H残基である。一般式Iの化合物並びに化合物IIおよびIIIは、それらの生理学的に許容できるアルカリ金属、アルカリ土類金属および他の塩、例えばカリウム塩、の形態をとることもできる。これらの塩も本発明の主題である。
【0014】
さらに、植物抽出物、とりわけ、残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物を1種以上含有するペラルゴニウム種からの植物抽出物も、本発明の一部を形成する。これにより、植物抽出物の乾燥物中の一般式Iの化合物の少なくとも1種の濃度が0.1%〜10%である植物抽出物が好ましく、前記濃度が0.5%〜5%である植物抽出物が特に好ましい。前記乾燥物は、Ph. Eur.(流体抽出物)に応じた乾燥残留物に相当する。この場合、例えば流体抽出物に直接分析を施すこともでき、乾燥残留物は計算によって求めることができる。
【0015】
化合物IIの調製は、例えば市販のフラキシンまたは残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物の加水分解および/またはエーテル開裂によって行うことができる。
【0016】
残基R6、R7およびR8のうちの少なくとも1つがSO3H残基である一般式Iの化合物の調製は、化合物IIを三酸化硫黄−トリメチルアミン錯体と反応させることによって、または化合物IIIの場合、好適な植物材料、例えばペラルゴニウムシドイデスの乾燥した根から単離することによって達成することができる。化合物6,7−ジヒドロキシ−8−スルホオキシ−2H−1−ベンゾピラン−2−オン(一般式I; R6=R7=H; R8=SO3H)および7,8−ジヒドロキシ−6−スルホオキシ−2H−1−ベンゾピラン−2−オン(一般式I; R7=R8=H; R6=SO3H)も、化合物IIIを部分加水分解することによって得ることができる。
【0017】
本発明による抽出物は、例えば水、メタノール、エタノール、アセトン等およびこれらの混合物のごとき溶媒を用いる公知の調製法によって、室温〜60℃の温度で、10分間〜24時間、ゆっくり〜激しく攪拌しながらまたは濾過によって、ペラルゴニウム植物またはその一部から、様々な組成で得ることができる。好ましい抽出溶媒は、水またはエタノールと水との混合物である。前記混合物中の水の割合は少なくとも50重量%であり、エタノール/水の比率は、10/90〜15/85(w/w)であることが特に好ましい。本発明による一般式Iの化合物をさらに濃縮するために、さらなる濃縮、例えば1−ブタノール/水またはエチルアセテート/水を用いた液液分配、イオン交換体、LH20、HP20および他の樹脂を用いた吸脱着またはRP18、シリカゲル等を用いたクロマトグラフ分離を行ってもよい。必要に応じて、それ自体公知の方法に従って、高温および/または低圧において溶媒を取り除くことによってまたは凍結乾燥によって、乾燥抽出物を得るためのさらなる処理を行ってもよい。European Pharmacopoeiaによれば、乾燥抽出物は、一般に、少なくとも95重量%の乾燥残留物を有する。
【0018】
本発明による一般式Iの化合物およびそれら化合物のうちの少なくとも1種を含有する抽出物は、粉末、顆粒、錠剤、糖衣錠あるいはカプセルの形態でまたは溶液として、好ましくは経口で投与することができる。
投与量としては、一般式Iの化合物の1種以上が1日当たり0.1〜250mg、好ましくは1日当たり0.3〜50mg投与される。
【0019】
錠剤を調製するには、一般式Iの化合物の少なくとも1種または対応する抽出物を、好適な生理学的に許容できるアジュバント、例えばラクトース、セルロース、二酸化ケイ素、クロスカルメロースおよびステアリン酸マグネシウムと混ぜ合わせ、プレスして錠剤にする。前記錠剤は、任意に、例えばヒドロキシメチルプロピルセルロース、ポリエチレングリコール、着色剤(例えば、酸化チタン、酸化鉄)およびタルクからなる好適なコーティングを施されていてもよい。
酸化的ストレスおよび/または炎症反応に関連する病的状態における化合物IIの効果は、下記実験によって立証される。
【実施例】
【0020】
抗酸化性
脂質の自動酸化は発光を伴う。この非常に弱い化学発光の測定は、過酸化物の定量化と酸化防止剤の効力の評価との両方に用いることができる。本研究では、オスのネズミ(NMRI; 20〜30g; Centre d’Elevage Janvier, Le Genest−Saint Isle, France)の脳組織を、脂質が豊富な組織として用いた。脳を摘出後、よく冷えたリン酸塩緩衝生理食塩溶液(PBS、pH=7.4)で洗浄し、髄膜および残った血を取り除いた。組織サンプルを、前記サンプルの体積(v/w)の4倍のPBSと均質化させ、1,000 × g および4℃で10分間遠心分離機にかけた。直ちに、上澄み液を同じ緩衝液で3倍に希釈し、氷の上で保存した。250μlの希釈済み上澄み液を試験管に移し、37℃において、6チャネル照度計(Multi−Biolumat LB 9505 C, Berthold, Bad Wildbad)で10分間培養した。2.5%DMSOを添加したPBSに25μlの化合物IIを添加した後、さらに10分間培養を続けた。その後、化学発光(CL)の強度を60分間にわたって測定した。自動酸化の抑制の比率を、同時に測定した溶媒対照(2.5%DMSOを添加したPBS)と比較して計算した。化合物IIは、53ng/mlの半最大抑制濃度において、脂質の自動酸化を優れた効力で抑制した(図1)。一方、抗酸化性の測定において基準物質としてしばしば用いられるTroloxは、1665ng/mlの半最大抑制濃度を示したに過ぎなかった。
図1は、脂質の自動酸化に対する化合物IIおよびTroloxの作用を示す。3つの独立した試験からの溶媒対照と比較した脂質過酸化の抑制の比率(平均値±SD)が示されている。
【0021】
炎症性サイトカインの合成の抑制
炎症性サイトカインIL−1β、TNF−αおよびIL−6の合成に対する化合物IIの作用を、活性化マウス腹腔マクロファージを用いて測定した。前記活性化マクロファージを得るために、0.5mlのPBS中の3x109個の死菌コリネバクテリアパルバムバクテリア(Changzhou Yanshen Co., Ltd., Changzhou, China)を、オスのNMRIマウス(Centre d’Elevage Janvier, Le Genest−Saint Isle, France)の腹腔内に注入した。6日後、腹腔を、カルシウムおよびマグネシウムを含有せず且つ10U/mlのヘパリンを添加した2.5mlのハンクス平衡塩類溶液(HBSS)で洗浄した。細胞を、10%のウシ胎仔血清が添加された完全RPMI培地に、1ml当たり2x106個の濃度で再懸濁させた。200μmの細胞懸濁液を、96ウェルマイクロタイタープレートの各ウェルに充填した。2時間の培養期間の後、非接着性細胞を取り除きし、残った細胞ローンを培養液(37℃)で2度洗浄した。マクロファージを化合物IIを用いて30分間予備培養させた後、1μg/mlの大腸菌のリポポリサッカライド(血清型0127:B8、Sigma、Deisenhofen)を添加することによって炎症性サイトカインの合成を誘発させた。24時間(37℃、空気中のCO2濃度:5%)培養させた後、凍結および解凍を3回繰り返すことによって細胞を溶解させ、細胞上澄み液を回収し、分析するまで−80℃で凍らせておいた。細胞上澄み液中のサイトカインの濃度の測定は、製造業者の手引きに従って市販の検査キット(Duosets IL−1β、TNF−αおよびIL−6、R&D、Wiesbaden)を用いて行った。すべての調査は3回行った。サイトカインの合成に対する化合物IIの作用を、同時に試験した溶媒対照(完全RPMI培地中の0.1%DMSO)と比較して評価した。下記表1から分かるように、100μg/mlの濃度における化合物IIは、3つの測定サイトカインすべての合成に対して著しい抑制効果を示したが、IL−6の製造に対する効果が最も高かった。
【0022】
【表1】

【0023】
ヒト全血におけるシクロオキシゲナーゼおよびリポキシゲナーゼ活性の抑制
ヘパリン化ヒト全血を検査に用いた。100μlの全血を、96ウェルマイクロタイタープレートの各ウェルに充填した。独立したプレートを用いて、シクロオキシゲナーゼ−1(COX1)およびリポキシゲナーゼ(LO)活性の測定およびシクロオキシゲナーゼ−2(COX2)の誘導を行った。
【0024】
DMSO(最終濃度:0.1%)を溶解促進剤として用い、1%の抗生物質/抗真菌剤溶液と2mMのL−グルタミン(Sigma,Deisenhofen)とで、化合物IIをDME培地(DMEM)中で希釈した。50μlの化合物IIを添加した後、試験対象を37℃で60分間培養させた。その後、50μlのカルシウムイオノフォアA23187(最終濃度:50μM)を添加することによって、エイコサノイド合成を促進させた。37℃でさらに30分間培養させた後、マイクロタイタープレートを4℃において5分間、1,500gで遠心分離機にかけた。血漿をピペットで取り、分析するまで−80℃で凍らせておいた。
【0025】
COX2活性を検証するために、血液サンプル(100μl/ウェル)を、まずアスピリン(DMEM中の50μl、最終濃度:12μg/ml)で、37℃において6時間予備処理することによって、COX1を不活性化させた。その後、化合物IIおよび溶媒(0.1%のDMSOを含有するDMEM)を、それぞれ25μlずつ添加した。さらに、COX2の発現を誘発するために、25μlの大腸菌のリポポリサッカライド(血清型0127:B8、最終濃度:10μg/ml)を添加した。37℃で18時間培養させた後、上記のようにして血漿を採取し、分析するまで−80℃で凍らせておいた。
【0026】
血漿サンプルについて、TXB2、PGE2およびシステニルロイコトリエン(システニル−LT)を、COX1活性、COX2活性およびLO活性についてのパラメータとして測定した。分析のために、市販のEIA検査キット(TXB2およびPGE2: Caymann/BL, Hamburg; システニルロイコトリエン: CAST−2000, Milenia, Bad Nauheim)を製造業者の手引きに従って用いた。その結果(表2参照)から、化合物IIはCOX2およびLOの活性を強力に抑制する効果を示すことが明らかとなった。一方、COX1の活性はほとんど影響を受けなかった。この効力範囲は非常に有利であるととらえられるべきである。なぜならば、化合物IIの治療的使用において、COX1抑制剤に特有である副作用、例えば消化管の合併症(浸食、潰瘍)または血小板の凝集の抑制に因る出血、を考慮する必要が無くなるからである。
【0027】
【表2】

【0028】
実施例1: 6,7,8−トリヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物II)の調製
20g(42.7mmol)の6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オンカリウム塩を480mlの約2Nの塩酸に投入し、40〜50℃で20時間攪拌した。冷却後、沈殿した粗生成物を濾別し、水で再結晶化させた(熱濾過)。得られた結晶化物を濾別および洗浄した後、100℃で真空乾燥させた。5.9g(71%)、融点:260℃で分解開始。1Hおよび13CNMRは、O.Kayser and H. Kolodziej (Phytochemistry 39, 1181−1185(1995))の指摘に適合している。
【0029】
実施例2: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オンカリウム塩(化合物IIIのカリウム塩)の単離および構造決定
15kgのペラルゴニウムシドイデスの根を、室温において、75lの水および40lの水で濾過した。得られた水性抽出物をそのおよそ1/3にまで濃縮した後、7kgの硫酸アンモニウムを添加し、そして2−ブタノン/エタノールの3/2混合物で数回抽出した。得られた有機相を混ぜ合わせ、蒸発によって濃縮した。
この残留物をHP20カラム(溶離液:水)でクロマトグラフ分析した。6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン成分を濃縮し、水酸化カリウム溶液を用いてpHを8に調節し、エタノールで1/1の割合で希釈した。得られた沈殿物を濾別し、水中に懸濁させた。水酸化カリウム溶液を用いてpHを10.7に調節し、エタノールで1/1の割合で希釈した。その結果として得られた沈殿物を熱湯に再溶解させた。得られた溶液を濾過し、エタノールで1/1の割合で希釈した。沈殿した結晶化物を濾別および洗浄した後、50℃で真空乾燥させた。27.6g(植物材料に対して0.14%、遊離酸として計算)。
融点:216℃で分解開始;C9H3K3O11S2(468.55) 実測値:C 23.08%、 H 0.70%、K 24.65%、S 13.9% − 計算値: C 23.07%、 H 0.65%、K 25.04%、O 37.56%、S 13.69%; 1HNMR(DMSO−d6):δ=7.62(d,J=9.1Hz、H−4)、7.03(s,H−5)、5.59(d,J=9.1Hz、H−3)、13CNMR(DMSO−d6):δ=162.9(C−7)、161.9(C−2)、147.7(C−8)、145.1(C−4)、142.2(C−6)、130.4(C−8a)、115.5(C−5)、102.4(C−3)、101.5(C−4a)。
【0030】
トリヒドロキシクマリン二硫酸カリウム塩の酸加水分解によって、6,7,8−トリヒドロキシクマリンが得られた(実施例1参照)。さらなる構造決定のため、下記反応順序に従って、化合物IIIを誘導体化させた。
【0031】
【化3】

【0032】
このために、トリヒドロキシクマリン二硫酸カリウム塩を、炭酸カリウムの存在下、60℃においてDMF中でヨウ化メチルと反応させて、対応する7−メチルエーテルを得た。濃塩酸で酸性化させた後、反応混合物を50℃で24時間攪拌し、酢酸エチルで抽出し、シリカゲル(溶離液:ヘプタン/酢酸エチル 7/3)でクロマトグラフ分析した。6,8−ジヒドロキシ−7−メトキシクマリンが得られた。これを、炭酸カリウムおよびヨウ化カリウムの存在下、室温においてDMF中で臭化ベンジルと反応させた。得られた混合物を濃縮し、残留物を水とTBMEとの間に分散させた。得られた有機相を濃縮し、シリカゲル(溶離液:トルエン/エタノール 95/5)でクロマトグラフ分析した。6,8−ジベンジルオキシ−7−メトキシクマリンが得られた。
【0033】
後者の化合物の置換パターンを、CDCl3中において、一次元および二次元NMR分光法によって求めた。H−5とCH2信号の1つとの間の明白なNOESY相関関係により、6位におけるベンジルオキシ残基の存在が明確に導き出される。さらに、OCH3信号は、メトキシ基が2つのベンジルオキシ残基の間、すなわち、7位に位置することを示す両方のCH2信号と相関関係がある。C−7とH−5並びにOCH3との間、並びにC−8とH−4並びに8−CH2との間のHMBC相関関係は、置換パターンがNOESYから派生していることを裏付けている。トリヒドロキシクマリジサルフェートのスルホキシ残基は6位と8位との間に結合していることは、調査した誘導体の調製手順およびその構造から明確に導き出すことができる。
【0034】
【化4】

【0035】
実施例3: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物III)を含有する植物抽出物
500gのペラルゴニウムシドイデスの根を、室温において、3kgの水で4時間抽出した。抽出された植物抽出物を濾別した後、上記条件下において2kgの水でもう1度抽出し、濾過した。得られたろ液を混ぜ合わせ、約35℃において濃縮し、そして凍結乾燥させた。化合物IIIの含有率が1.54%である乾燥抽出物が58.7g(11.7%)得られた。
【0036】
実施例4: 6,8−ビス(スルホオキシ)−7−ヒドロキシ−2H−1−ベンゾピラン−2−オン(化合物III)を含有する植物抽出物
約1.25kgのペラルゴニウムシドイデスの根を、室温において、約12.5kgのエタノール/水 11/89(w/w)で抽出した。濾過後、得られたろ液を約45℃で濃縮し、そして凍結乾燥させた。化合物IIIの含有率が1.86%である乾燥抽出物が90.4g(7.2%)得られた。
【0037】
実施例5: 錠剤
求められる効力に依って5〜250mgの活性材料を含有する錠剤を調製するには、下記が必要とされる。
化合物II 200〜5,000g
セルロース粉末 2,000g
澱粉 1,200g
コロイドケイ酸 80g
ステアリン酸マグネシウム 20g
ラクトース 〜10,000g
活性材料は、任意に粉砕され、アジュバントと均質に混ぜ合わされ、そして慣用の方法で各々の重量が250mg、直径が9mmの錠剤にプレスされる。125mgを超える投与量については、各々の重量が500mg、直径が11mmの錠剤をプレスする。必要に応じて、錠剤にフィルムをコーティングする。
【図面の簡単な説明】
【0038】
【図1】脂質の自動酸化に対する化合物IIおよびTroloxの作用を示す。
【特許請求の範囲】
【請求項1】
酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への一般式I
【化1】

式中、残基R6、R7およびR8は、独立して、HまたはSO3Hまたはそれらの生理学的に許容できる塩を表す、
で表される化合物の使用。
【請求項2】
残基R6、R7およびR8が水素原子である、請求項1に記載の使用。
【請求項3】
残基R6およびR8がOSO3Hを表し、そして残基R7が水素を表す、請求項1に記載の使用。
【請求項4】
一般式Iの化合物の1種以上が植物抽出物に含有されている、請求項1〜3のいずれか1つに記載の使用。
【請求項5】
前記植物抽出物はペラルゴニウム種からの抽出物である、請求項4に記載の使用。
【請求項6】
前記植物抽出物はペラルゴニウムシドイデスからの抽出物である、請求項5に記載の使用。
【請求項7】
乾燥した前記植物抽出物中における一般式Iの化合物の少なくとも1種の濃度は、0.1%〜10%である、請求項4〜6のいずれか1つに記載の使用。
【請求項8】
乾燥した前記植物抽出物中における一般式Iの化合物の少なくとも1種の濃度は、0.5%〜5%である、請求項4〜6のいずれか1つに記載の使用。
【請求項9】
前記病的状態が、糖尿病I型および/またはII型、関節リウマチを含む炎症性疾患、ぜんそく、潰瘍性大腸炎、クローン(Crohn)病、乾癬、神経皮膚炎、細菌による感染、インフルエンザウイルス、エイズ、ウイルス性肝炎および寄生虫、菌類およびプリオンを含んでなる他の病原体、アテローム性動脈硬化性および内皮機能不全、虚血、アルツハイマー病、パーキンソン病および他の神経変性病を含んでなる神経系の病気または白内障および腫瘍からなる群から選択される、請求項1〜8のいずれか1つに記載の使用。
【請求項10】
一般式I
【化2】

式中、残基R6、R7およびR8は、独立して、HまたはOSO3Hまたはそれらの生理学的に許容できる塩を表す、ただしR6、R7およびR8が同時に水素であることはない、
で表される化合物。
【請求項11】
R6およびR8がSO3Hを表し、R7が水素を表す、または、
R6がSO3Hを表し、R7およびR8が水素を表す、または、
R8がSO3Hを表し、R6およびR7が水素を表す、請求項10に記載の化合物。
【請求項12】
請求項10または11に記載の化合物の1種以上を含有する植物抽出物。
【請求項13】
前記植物抽出物はペラルゴニウム種からの抽出物である、請求項12に記載の植物抽出物。
【請求項14】
前記植物抽出物はペラルゴニウムシドイデスからの抽出物である、請求項13に記載の植物抽出物。
【請求項15】
乾燥した前記植物抽出物中における請求項10または11に記載の化合物の少なくとも1種の濃度は、0.1%〜10%である、請求項12〜14のいずれか1つに記載の植物抽出物。
【請求項16】
乾燥した前記植物抽出物中における請求項10または11に記載の化合物の少なくとも1種の濃度は、0.5%〜5%である、請求項12に記載の植物抽出物。
【請求項17】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種を含有する、酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための薬物。
【請求項18】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種を含有する、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療を支援するためのまたは前記病的状態を予防するための食品。
【請求項19】
酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための薬物を製造するための、請求項1、2または3に記載の一般式Iの化合物の使用。
【請求項20】
酸化的ストレスおよび/または炎症反応に関連する病的状態の治療を支援するためのまたは前記病的状態を予防するための食品を製造するための、請求項1、2または3に記載の一般式Iの化合物の使用。
【請求項21】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種と、好適なアジュバントとを含んでなる経口投与用製剤。
【請求項22】
請求項12〜16のいずれか1つに記載の植物抽出液と、好適なアジュバントとを含んでなる経口投与用製剤。
【請求項1】
酸化的ストレスおよび/または炎症反応に関連する病的状態の治療または予防への一般式I
【化1】

式中、残基R6、R7およびR8は、独立して、HまたはSO3Hまたはそれらの生理学的に許容できる塩を表す、
で表される化合物の使用。
【請求項2】
残基R6、R7およびR8が水素原子である、請求項1に記載の使用。
【請求項3】
残基R6およびR8がOSO3Hを表し、そして残基R7が水素を表す、請求項1に記載の使用。
【請求項4】
一般式Iの化合物の1種以上が植物抽出物に含有されている、請求項1〜3のいずれか1つに記載の使用。
【請求項5】
前記植物抽出物はペラルゴニウム種からの抽出物である、請求項4に記載の使用。
【請求項6】
前記植物抽出物はペラルゴニウムシドイデスからの抽出物である、請求項5に記載の使用。
【請求項7】
乾燥した前記植物抽出物中における一般式Iの化合物の少なくとも1種の濃度は、0.1%〜10%である、請求項4〜6のいずれか1つに記載の使用。
【請求項8】
乾燥した前記植物抽出物中における一般式Iの化合物の少なくとも1種の濃度は、0.5%〜5%である、請求項4〜6のいずれか1つに記載の使用。
【請求項9】
前記病的状態が、糖尿病I型および/またはII型、関節リウマチを含む炎症性疾患、ぜんそく、潰瘍性大腸炎、クローン(Crohn)病、乾癬、神経皮膚炎、細菌による感染、インフルエンザウイルス、エイズ、ウイルス性肝炎および寄生虫、菌類およびプリオンを含んでなる他の病原体、アテローム性動脈硬化性および内皮機能不全、虚血、アルツハイマー病、パーキンソン病および他の神経変性病を含んでなる神経系の病気または白内障および腫瘍からなる群から選択される、請求項1〜8のいずれか1つに記載の使用。
【請求項10】
一般式I
【化2】

式中、残基R6、R7およびR8は、独立して、HまたはOSO3Hまたはそれらの生理学的に許容できる塩を表す、ただしR6、R7およびR8が同時に水素であることはない、
で表される化合物。
【請求項11】
R6およびR8がSO3Hを表し、R7が水素を表す、または、
R6がSO3Hを表し、R7およびR8が水素を表す、または、
R8がSO3Hを表し、R6およびR7が水素を表す、請求項10に記載の化合物。
【請求項12】
請求項10または11に記載の化合物の1種以上を含有する植物抽出物。
【請求項13】
前記植物抽出物はペラルゴニウム種からの抽出物である、請求項12に記載の植物抽出物。
【請求項14】
前記植物抽出物はペラルゴニウムシドイデスからの抽出物である、請求項13に記載の植物抽出物。
【請求項15】
乾燥した前記植物抽出物中における請求項10または11に記載の化合物の少なくとも1種の濃度は、0.1%〜10%である、請求項12〜14のいずれか1つに記載の植物抽出物。
【請求項16】
乾燥した前記植物抽出物中における請求項10または11に記載の化合物の少なくとも1種の濃度は、0.5%〜5%である、請求項12に記載の植物抽出物。
【請求項17】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種を含有する、酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための薬物。
【請求項18】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種を含有する、酸化的ストレスおよび/または炎症反応に関連する病的状態の治療を支援するためのまたは前記病的状態を予防するための食品。
【請求項19】
酸化的ストレスおよび/または炎症反応に関連する病的状態を治療または予防するための薬物を製造するための、請求項1、2または3に記載の一般式Iの化合物の使用。
【請求項20】
酸化的ストレスおよび/または炎症反応に関連する病的状態の治療を支援するためのまたは前記病的状態を予防するための食品を製造するための、請求項1、2または3に記載の一般式Iの化合物の使用。
【請求項21】
請求項1、2または3に記載の一般式Iの化合物の少なくとも1種と、好適なアジュバントとを含んでなる経口投与用製剤。
【請求項22】
請求項12〜16のいずれか1つに記載の植物抽出液と、好適なアジュバントとを含んでなる経口投与用製剤。
【図1】




【公表番号】特表2008−505064(P2008−505064A)
【公表日】平成20年2月21日(2008.2.21)
【国際特許分類】
【出願番号】特願2007−518536(P2007−518536)
【出願日】平成17年6月30日(2005.6.30)
【国際出願番号】PCT/EP2005/007051
【国際公開番号】WO2006/002918
【国際公開日】平成18年1月12日(2006.1.12)
【出願人】(500287282)ドクター.ヴィルマー シュワーベ ゲーエムベーハー ウント ツェーオー.カーゲー (7)
【Fターム(参考)】
【公表日】平成20年2月21日(2008.2.21)
【国際特許分類】
【出願日】平成17年6月30日(2005.6.30)
【国際出願番号】PCT/EP2005/007051
【国際公開番号】WO2006/002918
【国際公開日】平成18年1月12日(2006.1.12)
【出願人】(500287282)ドクター.ヴィルマー シュワーベ ゲーエムベーハー ウント ツェーオー.カーゲー (7)
【Fターム(参考)】
[ Back to top ]

