不均一凝固試験
【課題】凝固診断分野において、血液凝固因子の活性を測定するための不均質方法及び血液凝固因子の活性を阻害する抗凝固因子を測定する不均質方法を提供する。
【解決手段】(a)i)試料、ii)試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、iii)活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び、iv)切断可能な基質が結合された又はインキュベーション中に結合される固相を含有してなる反応混合物を準備してインキュベートし;(b)固相を分離し;そして、(c)固相に結合されている未切断基質の量を測定する。
【解決手段】(a)i)試料、ii)試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、iii)活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び、iv)切断可能な基質が結合された又はインキュベーション中に結合される固相を含有してなる反応混合物を準備してインキュベートし;(b)固相を分離し;そして、(c)固相に結合されている未切断基質の量を測定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、凝固診断分野のものであり、タンパク質分解性血液凝固因子の活性を測定するための方法及び血液凝固因子の活性を抑制する抗凝固剤を測定するための方法に関する。
【背景技術】
【0002】
凝固診断は、血液凝固カスケードの機能性を調べるためのいわゆるグローバル試験及び個々の血液凝固因子の活性を測定するためのいわゆる個別試験に区別される。グローバル試験についても個別試験についても、異なる試験フォーマットが知られている。試験フォーマットは、基本的に凝固試験及び発色試験に区別される。
【0003】
凝固試験においては、通常、血漿から成る被検患者試料が、凝固過程を開始させる凝固活性化剤と混合される。この凝固過程においてフィブリン凝塊が形成され、このフィブリン凝塊は、光度測定法により測定することができる。フィブリン形成速度は血液凝固カスケードの機能性の尺度である。凝固試験において個々の凝固因子の活性を測定するために、被検患者試料は、試験すべき血液凝固因子以外の血液凝固カスケードの全構成要素を供給する欠損血漿と付加的に混合される。
【0004】
発色試験では、通常、血漿から成る被検患者試料は、凝固活性化剤及び凝固因子用基質と混合される。大抵の血液凝固因子はセリンエンドペプチダーゼ、即ち、ペプチド結合を切断することのできるヒドロラーゼであるので、被測定血液凝固因子によって高度に特異的に切断されて検出可能なシグナル発生部分を有するペプチド基質が、主として使用される。好ましくは、光度測定法により測定される、切断可能な発色シグナル発生部分又は蛍光発光シグナル発生部分が使用される。特許文献1及び特許文献2には、多数の発色ペプチド基質、並びに、凝固診断試験、例えば凝固第IIa因子(トロンビン)及び第Xa因子を測定するための試験、におけるそれらの使用が述べられている。特許文献3には、第XIIa凝固因子を測定するための発色法が述べられている。
【0005】
特に発色試験は、患者試料中の、血液凝固因子の活性を抑制する、抗凝固剤を測定するために用いることができる。この目的のために、検査すべき患者試料は、活性化凝固因子及びこの凝固因子のための基質と混合される。試料中に存在する抗凝固剤が多ければ多いほど、活性化凝固因子は一層強く抑制され、切断される基質は少なくなる。
【0006】
これらの公知方法は、均質法である。均質試験方法には、試料が検出試薬と混合されて試験混合物とされ、例えば、分析物をそれ以外の試料構成要素から分離するための工程等の、追加的な分離工程なしに、この試験混合物中で検出反応が測定されるという利点がある。しかし、均質試験法には、全試験プロセス中、試料に固有の物質が存在し、その結果、この物質が検出反応に影響を及ぼし又は検出反応の測定を妨害することがあるという欠点も、存在する。患者試料は、例えば個別事例において、異常に高い濃度の一つ又は複数の固有の物質、即ち、内因性物質、を含有していることがあり、これらの物質は、許容可能な濃度を上まわるときには、光度測定検出法において障害となり、系統誤差を生じることがある。溶血性、黄疸性及び/又は高脂血性の血清試料又は血漿試料、異常に高い濃度のヘモグロビン、ビリルビン及び/又はトリグリセリド濃度を有する、いわゆるHIL試料、によって問題を生じることは、周知である。これら干渉物質の異常に高い濃度は、患者の病的状態又は不適切な試料取得若しくは試料保管によって引き起こされ得る。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】欧州特許出願公開第34122号明細書
【特許文献2】米国特許第4508644号明細書
【特許文献3】欧州特許出願公開第78764号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで本発明の課題は、試料中のタンパク質分解性凝固因子の活性を測定するための、試料固有の妨害物質の干渉を受け難い方法を提供することである。
【課題を解決するための手段】
【0009】
この課題は、本発明によれば、以下の工程:
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、
iii.活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程、
を備える方法によって解決される。
【0010】
固相に結合されている未切断基質の量は、測定すべきタンパク質分解性凝固因子の活性に逆比例している。
【0011】
反応混合物の準備は、常に、試料、好ましくは血液試料又は血漿試料、を、試料中の測定すべきタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤及び固相に接触させることを含んでなる。活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、様々な方法で反応混合物に供給することができる:
−固相に結合されていない切断可能な基質、例えば合成ペプチド又は精製タンパク質、が反応混合物に添加される個別の試薬に存在していてもよい。その場合、反応混合物は、インキュベーション中に切断可能な基質が結合される固相を含有してなる。
−切断可能な基質、例えば合成ペプチド又は精製タンパク質、が既に固相に結合されており、固相と一緒に固相の構成要素として、試料及びタンパク質分解性凝固因子の活性化のための薬剤に、接触させられる。
−切断可能な基質が、試料中に天然に含有された、活性化凝固因子のための天然基質であり、これにより試料材料の構成要素として試料と共に反応混合物に供給される。その場合、反応混合物は、インキュベーション中に切断可能な天然基質が結合される固相を含有してなる。
【0012】
活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、当業者には周知である。切断可能な基質は、合成的に、組換え的に若しくは生物工学的に製造された分子又は天然分子であってよく、活性化凝固因子の作用によって2つの切断生成物に分解される。切断可能な基質は、完全に又は部分的にペプチドで構成することができる。切断可能な基質は、好ましくは、少なくとも切断部位の領域にペプチド部分を含んでなる。切断可能な基質のペプチド部分は、好ましくは、3〜約150のアミノ酸残基から成る。
【0013】
別の実施態様において、切断可能な基質は、完全無欠のタンパク質又はタンパク質断片で構成することができる。切断可能な基質は、活性化凝固因子の天然基質であってもよい。切断可能な天然基質の一例は、第V因子であり、このものは、活性化タンパク質C、第Xa因子、第IIa因子(トロンビン)及びプラスミンのための切断部位を有する。他の一例は、フィブリノゲンであり、このものは、第IIa因子(トロンビン)のための切断部位を有する。なお他の一例は、第II因子(プロトロンビン)であり、このものは、第IIa因子(トロンビン)、第Xa因子及び、例えばエカリン又はテキスタリン等の、各種ヘビ毒のための切断部位を有する。
【0014】
本発明に係る方法の一実施態様において、活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、固相に結合されている。
【0015】
用語「結合」は、幅広く理解すべきであり、例えば共有結合及び非共有結合、直接的結合及び間接的結合、表面への吸着、窪み又は空洞への封入、等を包含する。共有結合の場合は、切断可能な基質が化学結合を介して固相に結合されている。非共有結合の例は、表面吸着、空洞への封入、又は2つの特異的結合相手の結合である。固相への直接的結合の他に、切断可能な基質は、別の特異的結合相手との特異的相互作用を介して、間接的に固相に結合することもできる。
【0016】
好ましい一実施態様においては、切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、前記固相が前記結合相手Bを有し、そして、前記基質が、結合相手A及びBの結合によって、前記固相に結合されている。
【0017】
本発明に係る方法の別の一実施態様において、活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、反応混合物のインキュベーション中に固相に結合される。この目的のために、切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、固相が結合相手Bを有し、基質が、反応混合物のインキュベーション中に結合相手A及びBの結合によって、固相に結合される。
【0018】
適切な結合対A/Bは、とりわけ、抗原/抗体の組み合わせであって、ここで、結合相手Aは、切断可能な基質の抗原性エピトープである。特に試料中に存在する天然基質が切断可能な基質として使用される場合、抗原性エピトープは、天然タンパク質又はタンパク質断片の天然の線状エピトープ又は立体構造エピトープであってよい。抗原性エピトープは、変性された切断可能な基質の非相同の(heterologous)線状エピトープ又は立体構造エピトープであってもよい。非相同の線状エピトープ又は立体構造エピトープの例は、特にペプチド又はタンパク質の標識化に使用される、FLAG−Tag又はHIS−Tag又はフルオレセイン−Tagである。固相に結合されている結合相手Bは、切断可能な基質が特異的に結合されるように選択されなければならない。好ましくは、結合相手Bは抗体又は抗体の抗原結合断片から成る。特別好ましい結合対A/Bは、FLAG−Tag/抗FLAG−Tag抗体、HIS−Tag/抗HIS−Tag抗体、及びフルオレセイン/抗フルオレセイン抗体である。
【0019】
本発明に係る方法の他の実施態様において、切断可能な基質は、第2の結合対X/Yの第2の結合相手Yと相互作用する、第2の結合対X/Yの第1の結合相手Xを有し、ここで、前記第2の結合相手Yは、シグナル発生系の一構成要素と会合している。未切断基質は、このようにして、検出することができる。結合相手Xは、もし基質が活性化タンパク質分解性凝固因子によって切断される場合には、固相に結合されている基質領域から分離された基質領域に配置されている。
【0020】
適切な結合対X/Yは、例えば抗原/抗体の組み合わせであり、ここで、結合相手Xは、切断可能な基質の抗原性エピトープである。特に試料中に存在する天然基質が切断可能な基質として使用される場合、抗原性エピトープは、天然タンパク質又はタンパク質断片の天然線状エピトープ又は立体構造エピトープであってよい。抗原性エピトープは、変性された切断可能な基質の非相同の線状エピトープ又は立体構造エピトープであってもよい。非相同の線状エピトープ又は立体構造エピトープの例は、特にペプチド又はタンパク質の標識化に使用される、FLAG−Tag又はHIS−Tag又はフルオレセイン−Tagである。他の適切な結合対X/Yは、例えば、ビオチン/アビジン及びビオチン/ストレプトアビジンである。
【0021】
第2の結合相手Yは、シグナル発生系の構成要素と会合している。
【0022】
「シグナル発生系」は、一つ又は複数の構成要素であってよく、ここで、少なくとも1つの構成要素は、検出可能な標識である。標識とは、それ自体シグナルを発生するかシグナルの発生を誘発できる、例えば、蛍光性物質、放射性物質、酵素又は化学発光物質等の、任意の分子を意味すると理解されるべきである。シグナルは、例えば、酵素活性、ルミネセンス、光吸収、光散乱、放射された電磁線若しくは放射線、又は化学反応により、検出し又は測定することができる。
【0023】
標識は、それ自体で、検出可能なシグナルを発生することができるので、他の構成要素は必要でない。多くの有機分子は、紫外光及び可視光を吸収し、これにより、これらの分子は、励起エネルギー状態に入ることができ、吸収されたエネルギーを、入射光の波長以外の波長を有する光の形で、放出する。更に別の標識は、例えば放射性同位体又は色素等の、検出可能なシグナルを直接的に生成することができる。
【0024】
更に別の標識はシグナル生成のために他の構成要素を必要とする。即ち、このような場合、シグナル発生系は、例えば、基質、補酵素、消光剤、促進剤、付加的酵素、酵素産物と反応する物質、触媒、活性化剤、補助因子、阻害剤、イオン等のようなシグナル発生に必要な全ての構成要素、を包含する。
【0025】
適切な標識は、例えば、セイヨウワサビペルオキシダーゼ、アルカリ性ホスファターゼ、グルコース−6−リン酸デヒドロゲナーゼ、アルコールデヒドロゲナーゼ、グルコースオキシダーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、ウレアーゼ及びアセチルコリンエステラーゼを始めとする酵素;色素;フルオレセインイソチオシアネート、ローダミン、フィコエリトリン、フィコシアニン、臭化エチジウム、5−ジメチルアミノナフタレン−1−塩化スルホニル及び希土類の蛍光性キレートを始めとする蛍光性物質;ルミノール、イソルミノール、アクリジニウム化合物、オレフィン、エノールエーテル、エナミン、アリールビニルエーテル、ジオキセン、アリールイミダゾール、ルシゲニン、ルシフェリン及びエクオリンを始めとする化学発光物質;エオシン、9,10−ジブロモアントラセン、メチレンブルー、ポルフィリン、フタロシアニン、クロロフィル、ローズベンガルを始めとする増感剤;補酵素;酵素基質;125I、131I、14C、3H、32P、33P、35S、51Cr、59Fe、57Co及び75Seを始めとする放射性同位体である。
【0026】
切断可能な基質が結合されているか又はインキュベーション中に結合される固相は、多孔質の及び/又は非多孔質の、一般に水に不溶な、材料から成る対象物を含んでなる。この対象物は、例えば、管、チューブ、マイクロタイタープレート、ビーズ、微粒子、棒、細片、濾紙又はクロマトグラフィー紙等の、多種多様な形状を有することができる。一般に、固相の表面は、親水性であるか又は親水性とすることができる。固相は、例えば、無機及び/又は有機材料、合成材料、天然産出材料及び/又は変性された天然産出材料等の、多種多様な材料で構成されていてよい。固相材料の例は、例えば、セルロース、ニトロセルロース、酢酸セルロース、ポリ塩化ビニル、ポリアクリルアミド、架橋デキストラン分子、アガロース、ポリスチレン、ポリエチレン、ポリプロピレン、ポリメタクリレート又はナイロン等のポリマー;セラミックス、ガラス、金属、特に金、銀等の貴金属;磁鉄鉱;これらの混合物又は組合せ;等である。
【0027】
例えば、試料構成要素が固相に非特異的に結合するのを抑制し又は防止するために、或いは、例えば、粒子状固相の懸濁安定性、貯蔵安定性、賦形安定性又は紫外光、微生物若しくはその他の破壊的に作用する薬剤に対する耐性に関して諸々の改善を達成するために、固相は、例えば、タンパク質、炭水化物、脂肪親和性物質、バイオポリマー、有機ポリマー又はこれらの混合物から成る、一又は複数の層から成るコーティングを有していてもよい。
【0028】
試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するために、試料は、通常、タンパク質分解性凝固因子を直接的又は間接的に活性化する薬剤と混合される。直接的活性化とは、別の凝固因子の存在に拘りなく、測定すべきタンパク質分解性凝固因子を直接的に活性化する薬剤が使用されることを、意味すると理解すべきである。間接的活性化とは、調べるべきタンパク質分解性凝固因子を活性化する血液凝固カスケードの一つ又は複数の血液凝固因子を活性化する薬剤が使用されることを、意味すると理解すべきである。薬剤の種類は、いかなる凝固因子を測定すべきなのか、凝固因子の活性を単独で測定すべきなのか、又は血液凝固カスケードの機能性若しくは血液凝固カスケード部分領域の機能性(外因性又は内因性経路)を凝固因子に基づいて測定すべきなのかに、依る。タンパク質分解性凝固因子の直接的又は間接的な活性化を可能とする物質及び様々な物質の特異的混合物は、当業者には周知であり、リン脂質、例えば負荷電リン脂質;リポタンパク質、例えばトロンボプラスチン;タンパク質、例えば組織因子、活性化セリンプロテアーゼ、例えば第IIa因子(トロンビン)、第VIIa因子、第IXa因子、第Xa因子、第XIa因子、第XIIa因子又は活性化タンパク質C;ヘビ毒、例えばPROTAC(登録商標)酵素、エカリン、テキスタリン、ノスカリン、バトロキソビン、トロンボシチン又はラッセルマムシ毒(RVV);接触活性化剤、例えばシリカ、カオリン、エラグ酸又はセライト;を包含する。薬剤を構成することのできる他の物質は、例えば、緩衝物質、塩、洗浄剤、イオン、特にカルシウムイオン、及びキレート剤である。
【0029】
「試料」とは、本発明の目的のために、検出すべきタンパク質分解性凝固因子を含有すると推定される材料を意味すると理解すべきである。用語「試料」は、特に、人間又は動物の体液、主として、血液及び血漿を含有してなる。
【0030】
試料、タンパク質分解性凝固因子を活性化するための薬剤、切断可能な基質、及び切断可能な基質が結合されているか又は結合される固相を含有する反応混合物を用意した後、凝固因子の十分な活性化、活性化凝固因子による基質の十分な切断、及び、場合によっては、切断可能な基質又は基質切断生成物の固相への十分な結合を保証するために、反応混合物は、一定時間、インキュベートされる。
【0031】
用語「十分」とは、本方法が、全体として、凝固因子活性の定量的な測定を可能とすることを意味すると理解すべきである。或る試験装置の最適なインキュベーション時間は、実験的に確かめることができる。
【0032】
好ましい一実施態様において、反応混合物に、更に、フィブリン凝集阻害剤を添加することができる。フィブリン凝集阻害剤とは、トロンビンの作用によって発生するフィブリンモノマーの合体(重合)を抑制し、それによって反応混合物内での凝塊形成を防止する物質、特に合成オリゴペプチド、を意味すると理解すべきである(例えばEP0456152B1参照)。
【0033】
反応混合物がインキュベートされたのち、固相、従って、これに結合された構成要素は、反応混合物の残りの構成要素から分離される。この分離は固相の種類に応じて様々な方法で、例えば遠心分離、濾過、磁気分離によって、又は反応混合物の液相の吸引によって、行なうことができる。固相の除去後、残留反応混合物を極力完全に固相から取り除くために、及び/又は後続の検出反応のために固相を準備するために、少なくとも1つの洗浄工程を実行することができる。この目的のため、固相は、洗浄液、好ましくは緩衝液、でインキュベートされ、引き続き洗浄液から再び分離される。
【0034】
固相に結合されている未切断基質の量の測定は、使用する検出系の種類に応じて様々な方法で、例えば未切断基質と特異的に相互作用して測定可能なシグナルを発生する物質を含有してなる試薬で固相をインキュベートすることによって、行なうことができる。固相に結合されている未切断基質の量の測定は、好ましくは、第2の結合対X/Yの結合相手Yを含有してなる検出試薬で固相をインキュベートすることによって、行われる。この場合、結合相手Yは、未切断基質の結合相手Xに特異的に結合する。結合相手Yは、シグナル発生構成要素と直接会合していてもよく、また、シグナル発生構成要素と会合させてもよい。
【0035】
シグナルの量又は強さは、固相に結合されている未切断基質の量に比例し、従って、タンパク質分解性凝固因子の活性に逆比例している。
【0036】
タンパク質分解性凝固因子を測定するための本発明に係る方法は、特に、タンパク質分解性凝固因子第II因子、第VII因子、第IX因子、第X因子、第XI因子、第XII因子又はタンパク質Cを測定するのに適している。
【0037】
本発明の他の目的は、試料内の抗凝固剤を定量的に測定するための、試料に固有の干渉物質の影響をより受けにくい、方法を提供することである。
【0038】
この目的は、本発明によれば、
以下の工程:
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.測定すべき抗凝固剤によって直接的又は間接的にその活性が影響を受ける、反応混合物に添加される個別の試薬中に存在する、一定量の活性化凝固因子、
iii.活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程;
を備える方法によって解決される。
【0039】
この方法では、一定量の既知の活性化凝固因子が反応混合物に添加される。いずれの活性化凝固因子が添加されるかは、いずれの抗凝固剤を測定すべきであるのかに依る。
【0040】
ヘパリン、即ち高分子量の未分画ヘパリン(HMWヘパリン)又は低分子量ヘパリン(LMWヘパリン)又はヘパリン類似物質の測定には、特に第IIa因子(トロンビン)又は第Xa因子の添加が適している。直接的トロンビン阻害剤、例えば、アルガトロバン、メラガトラン、キシメラガトラン、ビバリルジン、ダビガトラン又はヒルジン、の測定には、特に、第IIa因子(トロンビン)の添加が適している。直接的第Xa因子阻害剤、例えばリバロキサバン、の測定には特に、第Xa因子の添加が適している。
【0041】
試料中に存在している抗凝固剤が多ければ多いほど、添加された活性化凝固因子は一層強く抑制され、切断可能な基質の切断は一層少なくなる。従って、固相に結合されている未切断基質の量は、試料中の、測定すべき抗凝固剤の量又は活性に比例する。
【0042】
抗凝固剤を定量的に測定するための本発明に係る方法では、
−測定すべき抗凝固剤によってその活性が直接的又は間接的に影響を受ける一定量の活性化凝固因子が使用され、ここで、活性化凝固因子は、反応混合物に添加される個別の試薬中に存在しており、
−従って、反応混合物は、タンパク質分解性凝固因子を活性化するための薬剤を含有する必要がない、
点を別として、タンパク質分解性凝固因子を測定するための方法の実施についての上記説明は、抗凝固剤を定量的に測定するための本発明に係る方法にも当てはまる。
【図面の簡単な説明】
【0043】
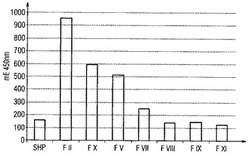
【図1】外因性凝固経路をInnovin(登録商標)(トロンボプラスチン試薬)によって活性化し、トロンビン活性を測定した試料の450nmにおける吸光度を示す。
【図2】様々なレフルダン(Refludan(登録商標))濃度を有する試料に、一定量のトロンビンを添加し、トロンビン活性を測定した試料の450nmにおける吸光度を示す。
【発明を実施するための形態】
【0044】
以下の実施例は、本発明を具体的に説明するのに役立つが、本発明を限定するものと理解すべきではない。
【0045】
図1は、外因性凝固経路をInnovin(登録商標)(トロンボプラスチン試薬)によって活性化し、トロンビン活性を測定した試料の450nmにおける吸光度を示す(実施例1参照)。試料は、全ての凝固因子を完全無欠に含有する標準ヒト血漿(SHP)、及び、外因性凝固経路の因子(第II因子、第V因子、第VII因子、第X因子)又は内因性凝固経路の因子(第VIII因子、第IX因子、第XI因子)が欠損した血漿である。活性化試料中のトロンビン量は、外因性凝固経路の因子の存在にやはり依存しているが、このトロンビン量に依存して、トロンビン感受性ペプチド基質が、切断される。試料中に存在するトロンビンが多ければ多いほど、切断されるトロンビン基質は一層多くなり、また、検出することのできる未切断トロンビン基質は一層少なくなる。かくして、測定される吸光度は、試料中のトロンビン活性、即ち、外因性凝固カスケードの活性、に逆比例している。従って、ここに示した実験において、外因性凝固経路の因子が欠損した全ての血漿(特に第II因子欠損血漿)が正常血漿(SHP)よりも高い吸光度を有するのに対して、外因性凝固経路に関与しない因子(第VIII因子、第IX因子、第XI因子)が欠損する血漿は、SHPとのシグナル差を有していない。従って、ここに示した試験によって、血漿における外因性凝固経路の因子の欠損を明確に検出することができた。
【0046】
図2は、様々なレフルダン(Refludan(登録商標))濃度を有する試料に、一定量のトロンビン(Thr.1 IU/ml、Thr.10 IU/ml)を添加し、トロンビン活性を測定した試料の450nmにおける吸光度を示す(実施例2参照)。試料中に存在する、直接的トロンビン阻害剤であるRefludan(登録商標)が多ければ多いほど、添加されたトロンビンは一層多く抑制され、切断されるトロンビン基質は一層少なくなり、検出することのできる未切断トロンビン基質は一層多くなる。かくして、測定される吸光度は、試料中のRefludan(登録商標)のトロンビン阻害活性に比例している。このとき、本方法の感度は、治療上低いRefludan(登録商標)濃度(1μg/ml以下)を有する試料について、比較的少量のトロンビン(1 IU/ml)を添加した場合に、特別良好である一方、治療上高いRefludan(登録商標)濃度(1〜5μg/ml)を有する試料について、比較的多量のトロンビン(10 IU/ml)を添加した場合に特別良好であることが明らかになった。
【0047】
実施例1:トロンビン活性の測定方法
先ず、マイクロタイタープレート(Nunc−Thermofisher、ロスキルデ、デンマーク)がモノクロナールFLAGエピトープ特異的抗体(MAK M2、Sigma Aldrich、ミュンヘン、ドイツ)でコーティングされた。引き続き、7つのアミノ酸残基、具体的には、ロイシン、バリン、プロリン、アルギニン、グリシン、フェニルアラニン及びグリシン、をこの配列で含有し、アミノ末端にFLAG−Tagエピトープを有しかつカルボキシ末端がビオチン化されている、トロンビン特異的ペプチド基質が、固相に結合されている抗FLAG抗体で、インキュベートされ、こうして固相に結合された。次いで、下記試薬が、各ウエルに下記順序で、添加された。
【0048】
25μlのフィブリン凝集阻害剤溶液(アミノ酸残基のグリシン、プロリン、アルギニン、プロリン及びアラニンをこの配列で有する合成オリゴペプチド6mg/ml);25μlの試料;及び、凝固活性化剤としての、25μlのInnovin(登録商標)(合成リン脂質を有する組換えヒト組織因子、シーメンス ヘルスケア ダイアグノスティックス、マールブルク、ドイツ)。
【0049】
試料として標準ヒト血漿(SHP)又は凝固因子(第II因子、第X因子、第V因子、第VII因子、第VIII因子、第IX因子、第XI因子)欠損血漿が使用された。
【0050】
反応混合物が完全混合され、37℃で15分間、インキュベートされた。反応混合物は、次に吸引され、ウエル毎に、それぞれ、250μlの洗浄緩衝液で3回洗浄された。固相に結合されている、未切断のトロンビン基質を検出するために、100μlのストレプトアビジン/ペルオキシダーゼ(POD)接合体溶液(0.33μg/ml、Sigma Aldrich)が各ウエルに添加され、20〜25℃で30分間、インキュベートされた。次に、接合体溶液は吸引され、ウエル毎に、それぞれ250μlの洗浄緩衝液で3回洗浄された。引き続き、0.5g/LのTMB(3,3’,5,5’−テトラメチルベンジジン−ジヒドロクロリド)と0.1g/Lの過酸化水素とを有する100μlの緩衝液が各ウエルに添加され、やはり20〜25℃で30分間、インキュベートされた。ペルオキシダーゼ反応を停止させるために、100μlの0.5N硫酸が各ウエルに添加され、450nmにおける吸光度と参照波長650nmにおける吸光度との差が、MTP光度計Sunrise(登録商標)(Tecan Trading AG、スイス)で測定された。
結果を図1に示す。
【0051】
実施例2:直接的トロンビン阻害剤Refludan(登録商標)の定量的測定方法
実施例1に述べたように、7つのアミノ酸残基を含有し、アミノ末端にFLAG−Tagエピトープを有し且つカルボキシ末端がビオチン化されたトロンビン特異的ペプチド基質が、抗FLAG抗体を介して固相(マイクロタイタープレート)に結合された。
【0052】
各ウエルに下記試薬が下記順序で添加された。
50μlのフィブリン凝集阻害剤溶液(アミノ酸残基のグリシン、プロリン、アルギニン、プロリン及びアラニンをこの配列で有する合成オリゴペプチド3mg/ml);
25μlの試料;
25μlのウシ−α−トロンビン溶液(4又は40IUウシ−α−トロンビン/ml、10KIE/mlアプロチニン、150mM/L NaCl、5mg/mlウシ血清アルブミン、10mg/mlマンニトール、5μg/mlヘキサジメトリンブロミド)。
【0053】
異なるトロンビン濃度に亘って、様々な治療範囲内で感度を保証することができる。
【0054】
試料として、標準ヒト血漿(SHP)又は正常ヒトクエン酸血漿試料が使用された。これらの試料は等分され、これらの等分標本に、それぞれ、0.0μg/ml、0.2μg/ml、1.0μg/ml、5μg/mlの濃度となるように、Refludan(登録商標)(レピルジン、組換えヒルジン、CSL Behring GmbH、マールブルク、ドイツ)が添加された。
【0055】
固相に結合されている、未切断トロンビン基質の検出は、実施例1に述べたように実行され、450nmにおける吸光度と参照波長650nmにおける吸光度との差が、MTP光度計Sunrise(登録商標)(Tecan Trading AG、スイス)で測定された。
結果を図2に示す。
【技術分野】
【0001】
本発明は、凝固診断分野のものであり、タンパク質分解性血液凝固因子の活性を測定するための方法及び血液凝固因子の活性を抑制する抗凝固剤を測定するための方法に関する。
【背景技術】
【0002】
凝固診断は、血液凝固カスケードの機能性を調べるためのいわゆるグローバル試験及び個々の血液凝固因子の活性を測定するためのいわゆる個別試験に区別される。グローバル試験についても個別試験についても、異なる試験フォーマットが知られている。試験フォーマットは、基本的に凝固試験及び発色試験に区別される。
【0003】
凝固試験においては、通常、血漿から成る被検患者試料が、凝固過程を開始させる凝固活性化剤と混合される。この凝固過程においてフィブリン凝塊が形成され、このフィブリン凝塊は、光度測定法により測定することができる。フィブリン形成速度は血液凝固カスケードの機能性の尺度である。凝固試験において個々の凝固因子の活性を測定するために、被検患者試料は、試験すべき血液凝固因子以外の血液凝固カスケードの全構成要素を供給する欠損血漿と付加的に混合される。
【0004】
発色試験では、通常、血漿から成る被検患者試料は、凝固活性化剤及び凝固因子用基質と混合される。大抵の血液凝固因子はセリンエンドペプチダーゼ、即ち、ペプチド結合を切断することのできるヒドロラーゼであるので、被測定血液凝固因子によって高度に特異的に切断されて検出可能なシグナル発生部分を有するペプチド基質が、主として使用される。好ましくは、光度測定法により測定される、切断可能な発色シグナル発生部分又は蛍光発光シグナル発生部分が使用される。特許文献1及び特許文献2には、多数の発色ペプチド基質、並びに、凝固診断試験、例えば凝固第IIa因子(トロンビン)及び第Xa因子を測定するための試験、におけるそれらの使用が述べられている。特許文献3には、第XIIa凝固因子を測定するための発色法が述べられている。
【0005】
特に発色試験は、患者試料中の、血液凝固因子の活性を抑制する、抗凝固剤を測定するために用いることができる。この目的のために、検査すべき患者試料は、活性化凝固因子及びこの凝固因子のための基質と混合される。試料中に存在する抗凝固剤が多ければ多いほど、活性化凝固因子は一層強く抑制され、切断される基質は少なくなる。
【0006】
これらの公知方法は、均質法である。均質試験方法には、試料が検出試薬と混合されて試験混合物とされ、例えば、分析物をそれ以外の試料構成要素から分離するための工程等の、追加的な分離工程なしに、この試験混合物中で検出反応が測定されるという利点がある。しかし、均質試験法には、全試験プロセス中、試料に固有の物質が存在し、その結果、この物質が検出反応に影響を及ぼし又は検出反応の測定を妨害することがあるという欠点も、存在する。患者試料は、例えば個別事例において、異常に高い濃度の一つ又は複数の固有の物質、即ち、内因性物質、を含有していることがあり、これらの物質は、許容可能な濃度を上まわるときには、光度測定検出法において障害となり、系統誤差を生じることがある。溶血性、黄疸性及び/又は高脂血性の血清試料又は血漿試料、異常に高い濃度のヘモグロビン、ビリルビン及び/又はトリグリセリド濃度を有する、いわゆるHIL試料、によって問題を生じることは、周知である。これら干渉物質の異常に高い濃度は、患者の病的状態又は不適切な試料取得若しくは試料保管によって引き起こされ得る。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】欧州特許出願公開第34122号明細書
【特許文献2】米国特許第4508644号明細書
【特許文献3】欧州特許出願公開第78764号明細書
【発明の概要】
【発明が解決しようとする課題】
【0008】
そこで本発明の課題は、試料中のタンパク質分解性凝固因子の活性を測定するための、試料固有の妨害物質の干渉を受け難い方法を提供することである。
【課題を解決するための手段】
【0009】
この課題は、本発明によれば、以下の工程:
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、
iii.活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程、
を備える方法によって解決される。
【0010】
固相に結合されている未切断基質の量は、測定すべきタンパク質分解性凝固因子の活性に逆比例している。
【0011】
反応混合物の準備は、常に、試料、好ましくは血液試料又は血漿試料、を、試料中の測定すべきタンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤及び固相に接触させることを含んでなる。活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、様々な方法で反応混合物に供給することができる:
−固相に結合されていない切断可能な基質、例えば合成ペプチド又は精製タンパク質、が反応混合物に添加される個別の試薬に存在していてもよい。その場合、反応混合物は、インキュベーション中に切断可能な基質が結合される固相を含有してなる。
−切断可能な基質、例えば合成ペプチド又は精製タンパク質、が既に固相に結合されており、固相と一緒に固相の構成要素として、試料及びタンパク質分解性凝固因子の活性化のための薬剤に、接触させられる。
−切断可能な基質が、試料中に天然に含有された、活性化凝固因子のための天然基質であり、これにより試料材料の構成要素として試料と共に反応混合物に供給される。その場合、反応混合物は、インキュベーション中に切断可能な天然基質が結合される固相を含有してなる。
【0012】
活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、当業者には周知である。切断可能な基質は、合成的に、組換え的に若しくは生物工学的に製造された分子又は天然分子であってよく、活性化凝固因子の作用によって2つの切断生成物に分解される。切断可能な基質は、完全に又は部分的にペプチドで構成することができる。切断可能な基質は、好ましくは、少なくとも切断部位の領域にペプチド部分を含んでなる。切断可能な基質のペプチド部分は、好ましくは、3〜約150のアミノ酸残基から成る。
【0013】
別の実施態様において、切断可能な基質は、完全無欠のタンパク質又はタンパク質断片で構成することができる。切断可能な基質は、活性化凝固因子の天然基質であってもよい。切断可能な天然基質の一例は、第V因子であり、このものは、活性化タンパク質C、第Xa因子、第IIa因子(トロンビン)及びプラスミンのための切断部位を有する。他の一例は、フィブリノゲンであり、このものは、第IIa因子(トロンビン)のための切断部位を有する。なお他の一例は、第II因子(プロトロンビン)であり、このものは、第IIa因子(トロンビン)、第Xa因子及び、例えばエカリン又はテキスタリン等の、各種ヘビ毒のための切断部位を有する。
【0014】
本発明に係る方法の一実施態様において、活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、固相に結合されている。
【0015】
用語「結合」は、幅広く理解すべきであり、例えば共有結合及び非共有結合、直接的結合及び間接的結合、表面への吸着、窪み又は空洞への封入、等を包含する。共有結合の場合は、切断可能な基質が化学結合を介して固相に結合されている。非共有結合の例は、表面吸着、空洞への封入、又は2つの特異的結合相手の結合である。固相への直接的結合の他に、切断可能な基質は、別の特異的結合相手との特異的相互作用を介して、間接的に固相に結合することもできる。
【0016】
好ましい一実施態様においては、切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、前記固相が前記結合相手Bを有し、そして、前記基質が、結合相手A及びBの結合によって、前記固相に結合されている。
【0017】
本発明に係る方法の別の一実施態様において、活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質は、反応混合物のインキュベーション中に固相に結合される。この目的のために、切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、固相が結合相手Bを有し、基質が、反応混合物のインキュベーション中に結合相手A及びBの結合によって、固相に結合される。
【0018】
適切な結合対A/Bは、とりわけ、抗原/抗体の組み合わせであって、ここで、結合相手Aは、切断可能な基質の抗原性エピトープである。特に試料中に存在する天然基質が切断可能な基質として使用される場合、抗原性エピトープは、天然タンパク質又はタンパク質断片の天然の線状エピトープ又は立体構造エピトープであってよい。抗原性エピトープは、変性された切断可能な基質の非相同の(heterologous)線状エピトープ又は立体構造エピトープであってもよい。非相同の線状エピトープ又は立体構造エピトープの例は、特にペプチド又はタンパク質の標識化に使用される、FLAG−Tag又はHIS−Tag又はフルオレセイン−Tagである。固相に結合されている結合相手Bは、切断可能な基質が特異的に結合されるように選択されなければならない。好ましくは、結合相手Bは抗体又は抗体の抗原結合断片から成る。特別好ましい結合対A/Bは、FLAG−Tag/抗FLAG−Tag抗体、HIS−Tag/抗HIS−Tag抗体、及びフルオレセイン/抗フルオレセイン抗体である。
【0019】
本発明に係る方法の他の実施態様において、切断可能な基質は、第2の結合対X/Yの第2の結合相手Yと相互作用する、第2の結合対X/Yの第1の結合相手Xを有し、ここで、前記第2の結合相手Yは、シグナル発生系の一構成要素と会合している。未切断基質は、このようにして、検出することができる。結合相手Xは、もし基質が活性化タンパク質分解性凝固因子によって切断される場合には、固相に結合されている基質領域から分離された基質領域に配置されている。
【0020】
適切な結合対X/Yは、例えば抗原/抗体の組み合わせであり、ここで、結合相手Xは、切断可能な基質の抗原性エピトープである。特に試料中に存在する天然基質が切断可能な基質として使用される場合、抗原性エピトープは、天然タンパク質又はタンパク質断片の天然線状エピトープ又は立体構造エピトープであってよい。抗原性エピトープは、変性された切断可能な基質の非相同の線状エピトープ又は立体構造エピトープであってもよい。非相同の線状エピトープ又は立体構造エピトープの例は、特にペプチド又はタンパク質の標識化に使用される、FLAG−Tag又はHIS−Tag又はフルオレセイン−Tagである。他の適切な結合対X/Yは、例えば、ビオチン/アビジン及びビオチン/ストレプトアビジンである。
【0021】
第2の結合相手Yは、シグナル発生系の構成要素と会合している。
【0022】
「シグナル発生系」は、一つ又は複数の構成要素であってよく、ここで、少なくとも1つの構成要素は、検出可能な標識である。標識とは、それ自体シグナルを発生するかシグナルの発生を誘発できる、例えば、蛍光性物質、放射性物質、酵素又は化学発光物質等の、任意の分子を意味すると理解されるべきである。シグナルは、例えば、酵素活性、ルミネセンス、光吸収、光散乱、放射された電磁線若しくは放射線、又は化学反応により、検出し又は測定することができる。
【0023】
標識は、それ自体で、検出可能なシグナルを発生することができるので、他の構成要素は必要でない。多くの有機分子は、紫外光及び可視光を吸収し、これにより、これらの分子は、励起エネルギー状態に入ることができ、吸収されたエネルギーを、入射光の波長以外の波長を有する光の形で、放出する。更に別の標識は、例えば放射性同位体又は色素等の、検出可能なシグナルを直接的に生成することができる。
【0024】
更に別の標識はシグナル生成のために他の構成要素を必要とする。即ち、このような場合、シグナル発生系は、例えば、基質、補酵素、消光剤、促進剤、付加的酵素、酵素産物と反応する物質、触媒、活性化剤、補助因子、阻害剤、イオン等のようなシグナル発生に必要な全ての構成要素、を包含する。
【0025】
適切な標識は、例えば、セイヨウワサビペルオキシダーゼ、アルカリ性ホスファターゼ、グルコース−6−リン酸デヒドロゲナーゼ、アルコールデヒドロゲナーゼ、グルコースオキシダーゼ、β−ガラクトシダーゼ、ルシフェラーゼ、ウレアーゼ及びアセチルコリンエステラーゼを始めとする酵素;色素;フルオレセインイソチオシアネート、ローダミン、フィコエリトリン、フィコシアニン、臭化エチジウム、5−ジメチルアミノナフタレン−1−塩化スルホニル及び希土類の蛍光性キレートを始めとする蛍光性物質;ルミノール、イソルミノール、アクリジニウム化合物、オレフィン、エノールエーテル、エナミン、アリールビニルエーテル、ジオキセン、アリールイミダゾール、ルシゲニン、ルシフェリン及びエクオリンを始めとする化学発光物質;エオシン、9,10−ジブロモアントラセン、メチレンブルー、ポルフィリン、フタロシアニン、クロロフィル、ローズベンガルを始めとする増感剤;補酵素;酵素基質;125I、131I、14C、3H、32P、33P、35S、51Cr、59Fe、57Co及び75Seを始めとする放射性同位体である。
【0026】
切断可能な基質が結合されているか又はインキュベーション中に結合される固相は、多孔質の及び/又は非多孔質の、一般に水に不溶な、材料から成る対象物を含んでなる。この対象物は、例えば、管、チューブ、マイクロタイタープレート、ビーズ、微粒子、棒、細片、濾紙又はクロマトグラフィー紙等の、多種多様な形状を有することができる。一般に、固相の表面は、親水性であるか又は親水性とすることができる。固相は、例えば、無機及び/又は有機材料、合成材料、天然産出材料及び/又は変性された天然産出材料等の、多種多様な材料で構成されていてよい。固相材料の例は、例えば、セルロース、ニトロセルロース、酢酸セルロース、ポリ塩化ビニル、ポリアクリルアミド、架橋デキストラン分子、アガロース、ポリスチレン、ポリエチレン、ポリプロピレン、ポリメタクリレート又はナイロン等のポリマー;セラミックス、ガラス、金属、特に金、銀等の貴金属;磁鉄鉱;これらの混合物又は組合せ;等である。
【0027】
例えば、試料構成要素が固相に非特異的に結合するのを抑制し又は防止するために、或いは、例えば、粒子状固相の懸濁安定性、貯蔵安定性、賦形安定性又は紫外光、微生物若しくはその他の破壊的に作用する薬剤に対する耐性に関して諸々の改善を達成するために、固相は、例えば、タンパク質、炭水化物、脂肪親和性物質、バイオポリマー、有機ポリマー又はこれらの混合物から成る、一又は複数の層から成るコーティングを有していてもよい。
【0028】
試料中のタンパク質分解性凝固因子を直接的又は間接的に活性化するために、試料は、通常、タンパク質分解性凝固因子を直接的又は間接的に活性化する薬剤と混合される。直接的活性化とは、別の凝固因子の存在に拘りなく、測定すべきタンパク質分解性凝固因子を直接的に活性化する薬剤が使用されることを、意味すると理解すべきである。間接的活性化とは、調べるべきタンパク質分解性凝固因子を活性化する血液凝固カスケードの一つ又は複数の血液凝固因子を活性化する薬剤が使用されることを、意味すると理解すべきである。薬剤の種類は、いかなる凝固因子を測定すべきなのか、凝固因子の活性を単独で測定すべきなのか、又は血液凝固カスケードの機能性若しくは血液凝固カスケード部分領域の機能性(外因性又は内因性経路)を凝固因子に基づいて測定すべきなのかに、依る。タンパク質分解性凝固因子の直接的又は間接的な活性化を可能とする物質及び様々な物質の特異的混合物は、当業者には周知であり、リン脂質、例えば負荷電リン脂質;リポタンパク質、例えばトロンボプラスチン;タンパク質、例えば組織因子、活性化セリンプロテアーゼ、例えば第IIa因子(トロンビン)、第VIIa因子、第IXa因子、第Xa因子、第XIa因子、第XIIa因子又は活性化タンパク質C;ヘビ毒、例えばPROTAC(登録商標)酵素、エカリン、テキスタリン、ノスカリン、バトロキソビン、トロンボシチン又はラッセルマムシ毒(RVV);接触活性化剤、例えばシリカ、カオリン、エラグ酸又はセライト;を包含する。薬剤を構成することのできる他の物質は、例えば、緩衝物質、塩、洗浄剤、イオン、特にカルシウムイオン、及びキレート剤である。
【0029】
「試料」とは、本発明の目的のために、検出すべきタンパク質分解性凝固因子を含有すると推定される材料を意味すると理解すべきである。用語「試料」は、特に、人間又は動物の体液、主として、血液及び血漿を含有してなる。
【0030】
試料、タンパク質分解性凝固因子を活性化するための薬剤、切断可能な基質、及び切断可能な基質が結合されているか又は結合される固相を含有する反応混合物を用意した後、凝固因子の十分な活性化、活性化凝固因子による基質の十分な切断、及び、場合によっては、切断可能な基質又は基質切断生成物の固相への十分な結合を保証するために、反応混合物は、一定時間、インキュベートされる。
【0031】
用語「十分」とは、本方法が、全体として、凝固因子活性の定量的な測定を可能とすることを意味すると理解すべきである。或る試験装置の最適なインキュベーション時間は、実験的に確かめることができる。
【0032】
好ましい一実施態様において、反応混合物に、更に、フィブリン凝集阻害剤を添加することができる。フィブリン凝集阻害剤とは、トロンビンの作用によって発生するフィブリンモノマーの合体(重合)を抑制し、それによって反応混合物内での凝塊形成を防止する物質、特に合成オリゴペプチド、を意味すると理解すべきである(例えばEP0456152B1参照)。
【0033】
反応混合物がインキュベートされたのち、固相、従って、これに結合された構成要素は、反応混合物の残りの構成要素から分離される。この分離は固相の種類に応じて様々な方法で、例えば遠心分離、濾過、磁気分離によって、又は反応混合物の液相の吸引によって、行なうことができる。固相の除去後、残留反応混合物を極力完全に固相から取り除くために、及び/又は後続の検出反応のために固相を準備するために、少なくとも1つの洗浄工程を実行することができる。この目的のため、固相は、洗浄液、好ましくは緩衝液、でインキュベートされ、引き続き洗浄液から再び分離される。
【0034】
固相に結合されている未切断基質の量の測定は、使用する検出系の種類に応じて様々な方法で、例えば未切断基質と特異的に相互作用して測定可能なシグナルを発生する物質を含有してなる試薬で固相をインキュベートすることによって、行なうことができる。固相に結合されている未切断基質の量の測定は、好ましくは、第2の結合対X/Yの結合相手Yを含有してなる検出試薬で固相をインキュベートすることによって、行われる。この場合、結合相手Yは、未切断基質の結合相手Xに特異的に結合する。結合相手Yは、シグナル発生構成要素と直接会合していてもよく、また、シグナル発生構成要素と会合させてもよい。
【0035】
シグナルの量又は強さは、固相に結合されている未切断基質の量に比例し、従って、タンパク質分解性凝固因子の活性に逆比例している。
【0036】
タンパク質分解性凝固因子を測定するための本発明に係る方法は、特に、タンパク質分解性凝固因子第II因子、第VII因子、第IX因子、第X因子、第XI因子、第XII因子又はタンパク質Cを測定するのに適している。
【0037】
本発明の他の目的は、試料内の抗凝固剤を定量的に測定するための、試料に固有の干渉物質の影響をより受けにくい、方法を提供することである。
【0038】
この目的は、本発明によれば、
以下の工程:
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.測定すべき抗凝固剤によって直接的又は間接的にその活性が影響を受ける、反応混合物に添加される個別の試薬中に存在する、一定量の活性化凝固因子、
iii.活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程;
を備える方法によって解決される。
【0039】
この方法では、一定量の既知の活性化凝固因子が反応混合物に添加される。いずれの活性化凝固因子が添加されるかは、いずれの抗凝固剤を測定すべきであるのかに依る。
【0040】
ヘパリン、即ち高分子量の未分画ヘパリン(HMWヘパリン)又は低分子量ヘパリン(LMWヘパリン)又はヘパリン類似物質の測定には、特に第IIa因子(トロンビン)又は第Xa因子の添加が適している。直接的トロンビン阻害剤、例えば、アルガトロバン、メラガトラン、キシメラガトラン、ビバリルジン、ダビガトラン又はヒルジン、の測定には、特に、第IIa因子(トロンビン)の添加が適している。直接的第Xa因子阻害剤、例えばリバロキサバン、の測定には特に、第Xa因子の添加が適している。
【0041】
試料中に存在している抗凝固剤が多ければ多いほど、添加された活性化凝固因子は一層強く抑制され、切断可能な基質の切断は一層少なくなる。従って、固相に結合されている未切断基質の量は、試料中の、測定すべき抗凝固剤の量又は活性に比例する。
【0042】
抗凝固剤を定量的に測定するための本発明に係る方法では、
−測定すべき抗凝固剤によってその活性が直接的又は間接的に影響を受ける一定量の活性化凝固因子が使用され、ここで、活性化凝固因子は、反応混合物に添加される個別の試薬中に存在しており、
−従って、反応混合物は、タンパク質分解性凝固因子を活性化するための薬剤を含有する必要がない、
点を別として、タンパク質分解性凝固因子を測定するための方法の実施についての上記説明は、抗凝固剤を定量的に測定するための本発明に係る方法にも当てはまる。
【図面の簡単な説明】
【0043】
【図1】外因性凝固経路をInnovin(登録商標)(トロンボプラスチン試薬)によって活性化し、トロンビン活性を測定した試料の450nmにおける吸光度を示す。
【図2】様々なレフルダン(Refludan(登録商標))濃度を有する試料に、一定量のトロンビンを添加し、トロンビン活性を測定した試料の450nmにおける吸光度を示す。
【発明を実施するための形態】
【0044】
以下の実施例は、本発明を具体的に説明するのに役立つが、本発明を限定するものと理解すべきではない。
【0045】
図1は、外因性凝固経路をInnovin(登録商標)(トロンボプラスチン試薬)によって活性化し、トロンビン活性を測定した試料の450nmにおける吸光度を示す(実施例1参照)。試料は、全ての凝固因子を完全無欠に含有する標準ヒト血漿(SHP)、及び、外因性凝固経路の因子(第II因子、第V因子、第VII因子、第X因子)又は内因性凝固経路の因子(第VIII因子、第IX因子、第XI因子)が欠損した血漿である。活性化試料中のトロンビン量は、外因性凝固経路の因子の存在にやはり依存しているが、このトロンビン量に依存して、トロンビン感受性ペプチド基質が、切断される。試料中に存在するトロンビンが多ければ多いほど、切断されるトロンビン基質は一層多くなり、また、検出することのできる未切断トロンビン基質は一層少なくなる。かくして、測定される吸光度は、試料中のトロンビン活性、即ち、外因性凝固カスケードの活性、に逆比例している。従って、ここに示した実験において、外因性凝固経路の因子が欠損した全ての血漿(特に第II因子欠損血漿)が正常血漿(SHP)よりも高い吸光度を有するのに対して、外因性凝固経路に関与しない因子(第VIII因子、第IX因子、第XI因子)が欠損する血漿は、SHPとのシグナル差を有していない。従って、ここに示した試験によって、血漿における外因性凝固経路の因子の欠損を明確に検出することができた。
【0046】
図2は、様々なレフルダン(Refludan(登録商標))濃度を有する試料に、一定量のトロンビン(Thr.1 IU/ml、Thr.10 IU/ml)を添加し、トロンビン活性を測定した試料の450nmにおける吸光度を示す(実施例2参照)。試料中に存在する、直接的トロンビン阻害剤であるRefludan(登録商標)が多ければ多いほど、添加されたトロンビンは一層多く抑制され、切断されるトロンビン基質は一層少なくなり、検出することのできる未切断トロンビン基質は一層多くなる。かくして、測定される吸光度は、試料中のRefludan(登録商標)のトロンビン阻害活性に比例している。このとき、本方法の感度は、治療上低いRefludan(登録商標)濃度(1μg/ml以下)を有する試料について、比較的少量のトロンビン(1 IU/ml)を添加した場合に、特別良好である一方、治療上高いRefludan(登録商標)濃度(1〜5μg/ml)を有する試料について、比較的多量のトロンビン(10 IU/ml)を添加した場合に特別良好であることが明らかになった。
【0047】
実施例1:トロンビン活性の測定方法
先ず、マイクロタイタープレート(Nunc−Thermofisher、ロスキルデ、デンマーク)がモノクロナールFLAGエピトープ特異的抗体(MAK M2、Sigma Aldrich、ミュンヘン、ドイツ)でコーティングされた。引き続き、7つのアミノ酸残基、具体的には、ロイシン、バリン、プロリン、アルギニン、グリシン、フェニルアラニン及びグリシン、をこの配列で含有し、アミノ末端にFLAG−Tagエピトープを有しかつカルボキシ末端がビオチン化されている、トロンビン特異的ペプチド基質が、固相に結合されている抗FLAG抗体で、インキュベートされ、こうして固相に結合された。次いで、下記試薬が、各ウエルに下記順序で、添加された。
【0048】
25μlのフィブリン凝集阻害剤溶液(アミノ酸残基のグリシン、プロリン、アルギニン、プロリン及びアラニンをこの配列で有する合成オリゴペプチド6mg/ml);25μlの試料;及び、凝固活性化剤としての、25μlのInnovin(登録商標)(合成リン脂質を有する組換えヒト組織因子、シーメンス ヘルスケア ダイアグノスティックス、マールブルク、ドイツ)。
【0049】
試料として標準ヒト血漿(SHP)又は凝固因子(第II因子、第X因子、第V因子、第VII因子、第VIII因子、第IX因子、第XI因子)欠損血漿が使用された。
【0050】
反応混合物が完全混合され、37℃で15分間、インキュベートされた。反応混合物は、次に吸引され、ウエル毎に、それぞれ、250μlの洗浄緩衝液で3回洗浄された。固相に結合されている、未切断のトロンビン基質を検出するために、100μlのストレプトアビジン/ペルオキシダーゼ(POD)接合体溶液(0.33μg/ml、Sigma Aldrich)が各ウエルに添加され、20〜25℃で30分間、インキュベートされた。次に、接合体溶液は吸引され、ウエル毎に、それぞれ250μlの洗浄緩衝液で3回洗浄された。引き続き、0.5g/LのTMB(3,3’,5,5’−テトラメチルベンジジン−ジヒドロクロリド)と0.1g/Lの過酸化水素とを有する100μlの緩衝液が各ウエルに添加され、やはり20〜25℃で30分間、インキュベートされた。ペルオキシダーゼ反応を停止させるために、100μlの0.5N硫酸が各ウエルに添加され、450nmにおける吸光度と参照波長650nmにおける吸光度との差が、MTP光度計Sunrise(登録商標)(Tecan Trading AG、スイス)で測定された。
結果を図1に示す。
【0051】
実施例2:直接的トロンビン阻害剤Refludan(登録商標)の定量的測定方法
実施例1に述べたように、7つのアミノ酸残基を含有し、アミノ末端にFLAG−Tagエピトープを有し且つカルボキシ末端がビオチン化されたトロンビン特異的ペプチド基質が、抗FLAG抗体を介して固相(マイクロタイタープレート)に結合された。
【0052】
各ウエルに下記試薬が下記順序で添加された。
50μlのフィブリン凝集阻害剤溶液(アミノ酸残基のグリシン、プロリン、アルギニン、プロリン及びアラニンをこの配列で有する合成オリゴペプチド3mg/ml);
25μlの試料;
25μlのウシ−α−トロンビン溶液(4又は40IUウシ−α−トロンビン/ml、10KIE/mlアプロチニン、150mM/L NaCl、5mg/mlウシ血清アルブミン、10mg/mlマンニトール、5μg/mlヘキサジメトリンブロミド)。
【0053】
異なるトロンビン濃度に亘って、様々な治療範囲内で感度を保証することができる。
【0054】
試料として、標準ヒト血漿(SHP)又は正常ヒトクエン酸血漿試料が使用された。これらの試料は等分され、これらの等分標本に、それぞれ、0.0μg/ml、0.2μg/ml、1.0μg/ml、5μg/mlの濃度となるように、Refludan(登録商標)(レピルジン、組換えヒルジン、CSL Behring GmbH、マールブルク、ドイツ)が添加された。
【0055】
固相に結合されている、未切断トロンビン基質の検出は、実施例1に述べたように実行され、450nmにおける吸光度と参照波長650nmにおける吸光度との差が、MTP光度計Sunrise(登録商標)(Tecan Trading AG、スイス)で測定された。
結果を図2に示す。
【特許請求の範囲】
【請求項1】
試料中のタンパク質分解性凝固因子の活性を測定するための方法であって、
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.前記試料中の前記タンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、
iii.前記活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.前記切断可能な基質が結合された又はインキュベーション中に結合される固相;
b.前記固相を分離する工程;並びに
c.前記固相に結合されている未切断基質の量を測定する工程、
を備える方法。
【請求項2】
前記切断可能な基質が、前記反応混合物に添加される個別の試薬内に、存在しており、前記反応混合物が、インキュベーション中に前記切断可能な基質が結合される固相を、有する請求項1記載の方法。
【請求項3】
前記切断可能な基質が3〜150のアミノ酸残基から成るペプチドを含んでなる請求項2記載の方法。
【請求項4】
前記切断可能な基質が前記活性化凝固因子及び前記試料の一構成要素のための天然基質であり、前記反応混合物がインキュベーション中に前記切断可能な基質が結合される固相を含有してなる、請求項1記載の方法。
【請求項5】
前記反応混合物が、前記切断可能な基質が共有結合している固相を、含有してなる請求項1記載の方法。
【請求項6】
前記切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、前記固相が前記第1の結合対A/Bの第2の結合相手Bを有し、前記切断可能な基質が前記結合相手A及びBの結合によって前記固相に結合されているか又はインキュベーション中に結合される、請求項1記載の方法。
【請求項7】
前記結合相手A及びBが、それらがFLAG−Tag/抗FLAG−Tag抗体、HIS−Tag/抗HIS−Tag抗体及びフルオレセイン/抗フルオレセイン抗体の群から選ばれる結合対A/Bを形成するように、選択されている請求項6記載の方法。
【請求項8】
前記切断可能な基質が第2の結合対X/Yの第1の結合相手Xを有し、前記第2の結合対X/Yの前記第2結合相手Yがシグナル発生系の一構成要素と会合している、請求項1から7のいずれか1つに記載の方法。
【請求項9】
前記結合相手X及びYが、それらがビオチン/アビジン及びビオチン/ストレプトアビジンの群から選ばれる結合対X/Yを形成するように、選択されている請求項8記載の方法。
【請求項10】
トロンボプラスチン、第IIa因子、第VIIa因子、第IXa因子、第Xa因子、第XIa因子、第XIIa因子、活性化タンパク質C、ヘビ毒、負荷電リン脂質、カルシウムイオン、組織因子、シリカ、カオリン、エラグ酸及びセライトからなる群から選ばれる薬剤が、タンパク質分解性凝固因子の直接的又は間接的活性化に使用される請求項1から9のいずれか1つに記載の方法。
【請求項11】
前記反応混合物にフィブリン凝集阻害剤が更に添加される請求項1から10のいずれか1つに記載の方法。
【請求項12】
第II因子、第VII因子、第IX因子、第X因子、第XI因子、第XII因子及びタンパク質Cから成る群から選ばれるタンパク質分解性凝固因子の活性を測定するための請求項1から11のいずれか1つに記載の方法。
【請求項13】
試料中の抗凝固剤を定量的に測定するための方法であって、
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.測定すべき抗凝固剤によって直接的又は間接的にその活性が影響を受ける、反応混合物に添加される個別の試薬中に存在する、一定量の活性化凝固因子、
iii.前記活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.前記切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.前記固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程、
を備える方法。
【請求項14】
LMWヘパリン、HMWヘパリン、ヘパリン類似物質、直接的トロンビン阻害剤及び直接的第Xa因子阻害剤から成る群から選ばれる抗凝固剤を定量的に測定するための請求項13記載の方法。
【請求項15】
前記反応混合物が、第IIa因子及び第Xa因子からなる群から選ばれる一定量の活性化凝固因子を、含有してなる請求項13記載の方法。
【請求項1】
試料中のタンパク質分解性凝固因子の活性を測定するための方法であって、
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.前記試料中の前記タンパク質分解性凝固因子を直接的又は間接的に活性化するための薬剤、
iii.前記活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.前記切断可能な基質が結合された又はインキュベーション中に結合される固相;
b.前記固相を分離する工程;並びに
c.前記固相に結合されている未切断基質の量を測定する工程、
を備える方法。
【請求項2】
前記切断可能な基質が、前記反応混合物に添加される個別の試薬内に、存在しており、前記反応混合物が、インキュベーション中に前記切断可能な基質が結合される固相を、有する請求項1記載の方法。
【請求項3】
前記切断可能な基質が3〜150のアミノ酸残基から成るペプチドを含んでなる請求項2記載の方法。
【請求項4】
前記切断可能な基質が前記活性化凝固因子及び前記試料の一構成要素のための天然基質であり、前記反応混合物がインキュベーション中に前記切断可能な基質が結合される固相を含有してなる、請求項1記載の方法。
【請求項5】
前記反応混合物が、前記切断可能な基質が共有結合している固相を、含有してなる請求項1記載の方法。
【請求項6】
前記切断可能な基質が第1の結合対A/Bの第1の結合相手Aを有し、前記固相が前記第1の結合対A/Bの第2の結合相手Bを有し、前記切断可能な基質が前記結合相手A及びBの結合によって前記固相に結合されているか又はインキュベーション中に結合される、請求項1記載の方法。
【請求項7】
前記結合相手A及びBが、それらがFLAG−Tag/抗FLAG−Tag抗体、HIS−Tag/抗HIS−Tag抗体及びフルオレセイン/抗フルオレセイン抗体の群から選ばれる結合対A/Bを形成するように、選択されている請求項6記載の方法。
【請求項8】
前記切断可能な基質が第2の結合対X/Yの第1の結合相手Xを有し、前記第2の結合対X/Yの前記第2結合相手Yがシグナル発生系の一構成要素と会合している、請求項1から7のいずれか1つに記載の方法。
【請求項9】
前記結合相手X及びYが、それらがビオチン/アビジン及びビオチン/ストレプトアビジンの群から選ばれる結合対X/Yを形成するように、選択されている請求項8記載の方法。
【請求項10】
トロンボプラスチン、第IIa因子、第VIIa因子、第IXa因子、第Xa因子、第XIa因子、第XIIa因子、活性化タンパク質C、ヘビ毒、負荷電リン脂質、カルシウムイオン、組織因子、シリカ、カオリン、エラグ酸及びセライトからなる群から選ばれる薬剤が、タンパク質分解性凝固因子の直接的又は間接的活性化に使用される請求項1から9のいずれか1つに記載の方法。
【請求項11】
前記反応混合物にフィブリン凝集阻害剤が更に添加される請求項1から10のいずれか1つに記載の方法。
【請求項12】
第II因子、第VII因子、第IX因子、第X因子、第XI因子、第XII因子及びタンパク質Cから成る群から選ばれるタンパク質分解性凝固因子の活性を測定するための請求項1から11のいずれか1つに記載の方法。
【請求項13】
試料中の抗凝固剤を定量的に測定するための方法であって、
a.下記のものを含有してなる反応混合物を準備してインキュベートする工程;
i.試料、
ii.測定すべき抗凝固剤によって直接的又は間接的にその活性が影響を受ける、反応混合物に添加される個別の試薬中に存在する、一定量の活性化凝固因子、
iii.前記活性化凝固因子のための少なくとも1つの切断部位を有する切断可能な基質、及び
iv.前記切断可能な基質が結合されているか又はインキュベーション中に結合される固相;
b.前記固相を分離する工程;並びに
c.固相に結合されている未切断基質の量を測定する工程、
を備える方法。
【請求項14】
LMWヘパリン、HMWヘパリン、ヘパリン類似物質、直接的トロンビン阻害剤及び直接的第Xa因子阻害剤から成る群から選ばれる抗凝固剤を定量的に測定するための請求項13記載の方法。
【請求項15】
前記反応混合物が、第IIa因子及び第Xa因子からなる群から選ばれる一定量の活性化凝固因子を、含有してなる請求項13記載の方法。
【図1】


【図2】




【図2】


【公開番号】特開2011−120584(P2011−120584A)
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願番号】特願2010−273486(P2010−273486)
【出願日】平成22年12月8日(2010.12.8)
【出願人】(398032751)シーメンス・ヘルスケア・ダイアグノスティックス・プロダクツ・ゲーエムベーハー (36)
【Fターム(参考)】
【公開日】平成23年6月23日(2011.6.23)
【国際特許分類】
【出願日】平成22年12月8日(2010.12.8)
【出願人】(398032751)シーメンス・ヘルスケア・ダイアグノスティックス・プロダクツ・ゲーエムベーハー (36)
【Fターム(参考)】
[ Back to top ]

