不整脈を放射線外科的に軽減するための心臓治療キット、システム、および方法
心臓の組織の放射線外科治療は、心臓のカテーテル挿入技法を使用し、心臓内もしくはその近傍に配置された、埋め込まれた基準を用いて不整脈を軽減し、かつ他の腫瘍性および非腫瘍性疾患を治療する。基準は、標的組織の診断および計画画像が取得された後に埋め込むことができる。基準の埋込みは、スケジュールされた放射線外科治療の日に行うことができる。計画後の基準の埋込みに適合させる技法は、埋め込まれた基準位置を、治療計画に登録することを含むことができ、また能動的な基準は、追跡精度を向上させながら、付随する撮像放射線への曝露を制限することができる。
【発明の詳細な説明】
【関連出願】
【0001】
(関連出願データの相互引用)
本出願は、2009年7月17日に出願された米国特許仮出願第61/271、177号の米国法典35巻第119条(e)における利益を主張するものであり、そのすべての開示を、全体として参照により本明細書に組み込む。
【技術分野】
【0002】
本発明は、一般に、患者の体の運動する組織に放射線外科治療を行うための改良されたキット、システム、および方法を提供する。例示的な実施形態は、心臓の不整脈を治療するのに十分な放射線量を心臓の標的部位に当てることができる。比較的速い速度で動く組織の治療を可能にすると共に、本発明の実施形態は、患者に長期間の外傷または不便さを不必要に与えることなく、かつ放射線外科治療計画に利用可能な時間を不必要に制約することなく、心臓部位の顕著な変形、または相対的な整復に適合することができる。
【0003】
頭部、背骨、腹部、および肺の腫瘍および他の標的は、放射線外科手術を用いて治療に成功してきた。放射線外科手術の間、電離放射線の一連のビームが、標的部位に収束するように患者の外側から送られることが多く、放射線ビームは、しばしば、様々な位置および方向から発射された100万電子ボルトのX線ビームを含む。ビームを、腫瘍の生態を変化させるために、中間組織を介して標的組織に向けて送ることができる。ビームの軌跡により、中間的な、また他の周囲組織の放射線への曝露を制限することができ、標的における累積した放射線量により腫瘍を治療することが可能になる。CyberKnife(商標)放射線外科手術システム(Accuray Inc.(アキュレイ社))、およびTrilogy(商標)放射線外科手術システム(Varian Medical Systems(バリアン・メディカル・システムズ))は、2つの知られた放射線外科治療システムである。
【0004】
最近の放射線外科手術システムは、標的組織の位置を検証し、かつ患者の小さな動きを調整するために、撮像を治療システムに組み込む。いくつかのシステムはまた、呼吸中に運動する組織を治療できる能力を有しており、こうすることにより、放射線外科手術から利益を受けることのできる患者の数を大幅に広げてきている。心房性細動および他の不整脈を治療するために、心臓の選択された領域に向けて放射線を送ることを含む、生理的な動きを受ける他の組織の放射線外科治療もまた提案されてきている。
【0005】
心房性細動中、心房は、その組織化されたポンプ送り動作を失う。健康な洞調律では、心房が収縮し、弁が開き、また血液が心室または下側の心腔を満たす。心室は、次いで、収縮して、各心拍の組織化されたサイクルを完了する。それに反して、心房性細動は、心房を横断して上側の心腔を震えさせる、または細動させる電気的エネルギーの嵐として特徴付けられる。心房性細動中は、各心拍で、血液を心房から心室へと十分に空にすることができない。適切な損傷パターン(lesion pattern)に基づき、電離放射線を心臓に向けて送ることにより得られた瘢痕組織が、電気信号の再循環を阻止し、それにより心房性細動を減少させる、またはなくすことができる。
【0006】
提案の心房性細動および他の不整脈の放射線外科治療は、心臓患者に対して外傷を大幅に減少させることによる利益を提供するが、既存の放射線外科治療技法に対する改良も、このような療法の可能性を完全に実現することを助けるはずである。例えば、呼吸中などに動く腫瘍は、標的とする腫瘍に隣接して高コントラストのマーカ構造を外科的に埋め込むことにより目標化することができる。マーカは基準として働き、システムは、立体X線撮像技法を用いて間欠的に基準の位置を特定する。埋め込まれた基準と共に、心臓組織の詳細な画像(コンピュータ断層撮影またはCTなど)が次いで取得され、癌性の腫瘍を切除するために、一連の交差する放射線ビームが慎重に計画される。残念ながら、心拍周期と関連するより速い心臓組織の動作を適切に追跡するのに十分なX線画像を取ることは、周囲の組織を過度の量の画像取得放射線に曝すことになりうる。実際には、知られた放射線外科手術システムは、埋め込まれた基準を追跡するのではなく、呼吸および他の患者の動きを決定するために、患者の皮膚上に取り付けられた発光ダイオード(LED)の基準アレイの動きを監視することができる。立体X線は、その場合、呼吸よりもかなり遅い速度で取得されうる。X線画像で呼吸周期の追跡を間欠的に確認し、かつ修正することだけにより、このようなシステムは、過度の撮像放射線を加えることなく、適切に、呼吸運動を追跡することができる。呼吸および/または心拍と共に動く組織の治療に対して、様々な代替形態が提案されてきており、またこれらの提案は、結果的に不整脈治療システムで使用するのに実行可能であることが示されているが、そのいずれも、広範囲に使用されていないようである。一方で、心臓の組織中、またはその近傍に埋め込まれた基準構造に依存することは、心臓の腫瘍性の、かつ/または非腫瘍性の疾患の放射線外科治療の一般的な受入れに対して、重大な、かつ予期しない課題を提示する可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記を考慮すると、特に、患者の外側から心臓の標的組織へと放射線を送ることにより、患者の運動する組織を治療するための改良されたデバイス、システム、および方法を提供することが望ましいはずである。理想的には、患者を付随的に撮像放射線に曝すことを大幅に増加させることなく、多くの患者にこれらの治療を利用できなくするほどシステム・コストを増加させることなく、不必要に治療の精度を低下させることなく、かつ/または心臓の拍動中に標的組織の比較的速い動きにもかかわらず、患者の健康な組織に対して不必要な付随的損傷を与えることなく、これらの改良が、既存の外科手術システムと互換性がある(またその変更により実施されうる)場合、それは特に利益があることになる。
【課題を解決するための手段】
【0008】
本発明は、一般に、患者の運動する組織を治療するための改良されたキット、システム、および方法を提供する。本発明の実施形態は、不整脈を軽減するために、これらの比較的速く動く組織を目標化するための既存の放射線外科手術システムの機能をしばしば高めて、心臓組織の改良された放射線外科治療を行うことができる。心臓組織の治療は、標的組織の位置を識別するための埋め込まれた位置代替物から利益をうることができ、その代替物は、任意選択で、心臓カテーテル挿入技法を用いて、心臓中にまたはその近傍に配置された基準マーカを含む。標準の放射線外科手法とは異なり、標的組織の治療計画画像が完了した後、これらの基準を配置することは大幅な利点がありうる。スケジュールされた放射線外科治療の日まで基準の埋込みを遅らせることにより、周囲組織を保存しながら、不整脈を軽減するための正確なビーム計画を開発することが可能になり、その計画は、通常、心臓における比較的精密な損傷パターンと、その損傷を導くための関連する一連の放射線ビームとを共に含む。多くの日数の間、埋め込まれた一時的な基準を有する心臓に対する障害を回避することにより、患者に対する総合的な外傷および不便さを減らすことができ、一方で、標的に向ける精度を高めるように、基準マーカを、心臓組織構造に対して望ましい位置に安全に配置することを可能にする。計画後に基準を埋め込むことに適合させる技法は、埋め込まれた基準位置を治療計画に登録することを含むことができる。能動的な基準を有する新規の心臓カテーテルおよび/または送出構造は、X線の必要性を制限する(かつそれにより付随的な撮像放射線への曝露を最小化する)ことができる。向上させた計画および追跡技法をまた使用することができ、本明細書で述べる放射線外科手術による心臓治療は、概して、既存の心臓外科治療システムの多くのコンポーネントと互換性がある。したがって、本明細書で述べる計画後に基準を埋め込む治療は、既存の治療手法とはいくつかの大きな変更を含みうるが、これらの技法は、既存の放射線外科治療システムに対して多大の投資および/または変更を必要とせずに、心臓の病状を治療するために、患者の外側から標的に向けた放射線の使用を大幅に拡大することを可能にする。代替的な実施形態は、基準を有する、または有しない代替物の埋込み後に計画画像が得られたとき、かつ/または計画が治療と同じ日に行われるとき、本明細書で述べる多くの態様を利用することができる。
【0009】
第1の態様では、本発明は、心臓を含む体を有する患者を治療するための放射線外科手術方法を提供する。心臓は、非腫瘍性の疾患を有している。本方法は、心臓から3次元の計画画像を取得するステップを含む。疾患を軽減するために、心臓の標的部位の電離放射線治療が、3次元の計画画像データを用いて計画される。治療が計画された後、体内に位置代替物が埋め込まれる。心臓の標的部位は、埋め込まれた代替物を参照して、体の外側から計画された放射線を標的部位に向けて送ることにより再建(remodel)される。
【0010】
代替の実施形態では、代替物の埋込みは、計画画像データのいくつかもしくはすべての取得の前に、かつ/または治療の計画のいくつかもしくはすべての前に実施することができる。いくつかの例示的な実施形態では、代替物を埋め込むステップ、標的部位を治療するステップ、および体から代替物を取り出すステップは、治療の日に行われる。心臓の計画画像データの取得、および治療の計画は、治療日の前の1つまたは複数の日に行われる。計画画像は、通常、治療日の複数日前に取得されることになり、それにより、少なくとも1日(しばしば、複数日、通常、少なくとも3日、少なくとも1週間、またはそれ以上)の間、医療の専門家および/または技術的にサポートする人員は、患者の非腫瘍性の疾患を軽減するために治療を計画することが可能になる。例えば、不整脈を治療する場合、適切な損傷パターンを、心臓の専門家(心臓病専門医、心臓外科医、電気生理学者、および/または同様の者など)の助けを借りて特定することができ、彼らは、不整脈を軽減するのに適した心臓中の標的部位を特定し、影響を受けやすい構造への付随的な損傷を回避するための放射線量勾配を識別し、かつ治療計画の他の詳細を特定するために、放射線外科手術の専門家(X線技師、放射線もしくは医療物理学者、および/または同様のものなど)と共に作業することができる。任意選択で、代替物、および同様のものを埋め込むために、心臓の標的部位を特定するための介入的心臓病専門医を含む他の医療専門家に相談することもできる。したがって、本明細書で述べる治療方法およびシステムの多くは、計画画像の取得と、放射線治療の開始との間のかなりの時間から利益を得ることになる。埋め込まれた撮像可能なマーカ、または他の代替物をこのような長い時間量の間、心臓中に残すことは不利益であり、また心臓は、計画画像データの取得と心臓の選択された部位の標的化との間に、患者の胸部内で大幅にシフトしている可能性があるので、代替物の計画後の埋込みは(これらの代替物に対する標的部位の位置の正確な特定と共に)、手技の利益および有効性を高めることができる。通常、治療の計画は、計画された放射線に基づいて心臓の推定される損傷を画定するステップを含み、理想的には、推定される損傷のグラフィカルな表示を、プロセスの一部として再検討することを可能にする。
【0011】
多くの実施形態では、代替物を埋め込むステップは、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップを含むことになる。代替物は、組織に結合され、したがって、代替物は、心拍で、かつ/または呼吸で誘起された運動を示すことができる。埋め込まれた代替物は、好ましくは、非共線性の1組の別個の基準マーカを備え、したがって、代替物と標的域との間の3次元オフセット方向を、基準マーカの画像から決定することができる。いくつかの実施形態では、代替物を埋め込むステップは、心臓の柔軟な、収縮性のある組織中に、細長い本体の螺旋構造をねじ込むステップを含むことができる。代替物を埋め込むステップはまた、組織が境界を成す管腔もしくは心腔で拡大可能な本体を拡大するステップも含むことができ、拡大可能な本体は、任意選択で、膨張可能なバルーン、一時的なステント状の構造、または同様のものなどを備え、それらは、周囲の組織と係合するように、冠状の血管内で、または拍動する心臓の心室内で、安全に、可逆的に拡大することができる。例示的な実施形態では、代替物を埋め込むステップは、能動的な3次元の位置指示器を組織に固定するステップを含むことができ、位置指示器は、埋め込まれた代替物の位置を、計画画像データに登録するために使用できる位置を示す信号を送信する。任意選択で、代替物の埋込み後に取られた画像は、登録を容易にすることができる。例えば、位置を示す信号が、代替物と体の外側に設けられた位置センサ(または送信器)との間のオフセットを示す場合、位置を示す信号を、心臓および位置センサを包含する埋込み後の画像データを用いて較正することができる。例示的な一実施形態では、位置を示す信号を較正するために使用される画像データは、計画後の較正画像データを含み、また較正位置感知信号は、カテーテル先端が心臓組織に係合している間に生成される。センサと体の間の位置関係は、較正画像データを取得する間、および位置感知信号を生成する間は維持される。より一般的には、位置指示器は、通常、超音波、または電磁式位置指示システム内で使用されるセンサまたは信号発生器を備える。標的部位を、間欠的な追跡検証画像の間における位置指示器からの位置を示す信号を用いて計画された放射線を送ることにより治療することができる。したがって、このような能動的な基準システムを使用する位置代替物は、X線を撮像する必要性を制限する(およびそれにより、付随的な撮像照射曝露を最小化する)ことができる。
【0012】
計画画像データは、代替物を埋め込むステップと、標的部位を治療するステップとの間で、登録データを取得することにより、埋め込まれた代替物に登録されうる。登録データは、しばしば、心臓および埋め込まれた代替物を包含する。登録データは、通常、第1の撮像モダリティを用いて取得された3次元の画像データを含む。計画画像データはまた、同じ撮像モダリティを用いて取得されうる。例えば、計画画像データは、コンピュータ断層撮影(CT)データを含むことができ、また登録画像データも同じCTシステム、または異なるCTシステムのいずれかで取得されたCTデータを含むことができる。登録および計画のために使用できる可能性のある他の撮像モダリティは、磁気共鳴撮像(MRI)、超音波(US)、陽電子放射断層撮影(PET)、単一陽電子放射型コンピュータ断層撮影(SPECT)、または同様のものを含む。他の実施形態では、登録データは、第1の撮像モダリティを用いて取得された3次元の画像データを含むことができるが、計画画像は、第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される。例えば、US撮像を、登録用に使用することができるが、計画はCT撮像を用いて行われる。
【0013】
いくつかの実施形態では、登録データは、3次元の画像データを含むことができる。心臓の表面は、計画画像データと登録画像データで共に、セグメント化されうる。登録を、次いで、セグメント化された表面を用いて行うことができる。血液中に入れた造影剤を用いて、画像データおよび/または登録データを取得するステップにより、心腔または血管の境界を成す血液/組織の界面の識別を容易に行うことができる。代替物の能動的な位置指示器は、登録を容易にすることができ、代替物はさらに、通常、埋め込まれた複数の別個の撮像可能なマーカを備え、したがって、通常、非共線性であるマーカは、3次元のオフセット方向を規定することができる。登録は、1つまたは複数の関連する心臓組織で規定される位置に、高コントラストの画像を有する基準マーカを埋め込むことにより容易に行うことができ、基準マーカは代替物として働く。例えば、カテーテルは、マーカを、冠状静脈口もしくはその近傍に、肺血管の間の分岐点の頂点もしくはその近傍に、または同様のものなどに埋め込むことができる。
【0014】
放射線治療源を埋め込まれた基準と位置合せするために、様々な手法を使用することができる。例えば、標的部位を容易に視認できない場合は特に、代替物の位置合せ画像データを取得することができる。代替物画像を、次いで、患者支持台を移動させることにより、所望の位置および方向へと移動させることができる。代替的な位置合せ手法は、放射線源を支持するロボットまたは同様のものに対する適切なオフセットを提供することを含むことができる。
【0015】
好ましくは、計画画像を取得する間、体からの心拍周期が監視される。時系列の3次元画像データセットを取得することができ、データセットは、心臓周期との心臓組織の動きを示すために、心拍周期の全体を通して分散させる。治療を計画するステップは、放射線の影響を受けやすい周囲組織を特定するステップと、周囲の組織を過度に照射することなく、標的部位に所望の放射線量を送るのに適した一連の放射線ビームを決定するステップとを含むことができる。標的部位を再建するステップは、体の心拍周期を監視するステップと、放射線を標的部位に送りながら、監視された心拍周期に応じて組織の動きの少なくとも一部を追跡するステップにより行うことができる。追跡するステップは、時系列のデータセットを使用することができる。
【0016】
代替物を埋め込むステップは、しばしば、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップと、代替物が心拍周期および呼吸周期と共に動くように、代替物を心臓に結合するステップとを含むことになる。代替物と標的部位の間の時間平均オフセットを、時系列の画像データセットを用いて決定することができる。標的部位を追跡するステップは、代替物の位置を決定するステップ、体の心拍周期を監視するステップ、および監視された心拍周期および呼吸周期、決定された代替物の位置、および時間平均オフセットを用いて、標的部位に放射線ビームを送るステップにより行うことができる。したがって、代替物と標的部位の間の心臓組織の変形を、必ずしもシステムが追跡する必要はない。
【0017】
例示的な実施形態では、時間平均オフセットは、心臓周期に対して、時系列の画像データセットから一連の3次元オフセットを特定するステップにより決定することができる。時間平均オフセットは、心臓周期の全体を通して適用することができるので、心拍周期中、代替物と標的部位の間の組織変形は追跡されない。時間平均オフセットは、時系列のデータセットの中から、画像データセットを選択することによりさらに決定することができる。選択されたデータセットは、測定された一連のオフセットの計算された平均に相当することが好ましい。選択されるオフセットは、必ずしも心臓周期の休止期に、または計算された時間平均オフセットそれ自体に相当する必要はない。他の実施形態では、特定された一連のオフセットの計算された時間平均を直接使用することができる。
【0018】
他の態様では、本発明は、心臓を含む患者の体を治療するための放射線外科手術システムを提供する。心臓は、非腫瘍性の疾患を有しており、システムは、心臓から3次元の計画画像データを取得するための画像取込みデバイスを備える。埋込み可能な位置代替物は、任意選択で、計画画像が取得された後に体内の心臓組織と結合可能である。放射線源が、体の外側から電離放射線の複数のビームを送出するために設けられる。プロセッサ・システムは、心臓の標的部位を特定するための入力を有する計画モジュールを含む。計画モジュールは、標的部位および計画画像データに応じて、放射線ビームの計画を生成する。プロセッサ・システムは、埋め込まれた代替物を参照して、放射線ビームを標的部位に向けて送るために放射線源と結合される。それにより、放射線ビームは心臓の標的部位を再建して疾患を緩和することができる。
【0019】
他の態様では、本発明は、患者の体を治療するために、放射線外科手術システムと使用するための治療キットを提供する。体は、非腫瘍性の疾患のある心臓を有する。放射線外科手術システムは、疾患を軽減するために、計画ごとに患者の体の外側から電離放射線の複数のビームを送出するための放射線源を有する。放射線外科手術システムはまた、放射線ビームを心臓の標的部位の動きと同期させるための複数の追跡入力を有する。キットは、患者の心臓周期信号を放射線外科手術システムの第1の追跡入力へと送出するために、患者に結合できる電極を備える。キットの細長い可撓性のある本体は、患者の血管を介して挿入可能な近位端および遠位端を有する。位置代替物を、心臓と動作可能な係合へと挿入可能であるように、可撓性のある本体の遠位端により支持することができ、したがって、代替物は心臓と共に適切に動いて、放射線外科手術システムの第2の追跡入力を生成することができる。任意選択で、遠位端は、心臓との動作可能な係合状態のまま留まり、したがって、遠位端は、治療中、心臓と共に動く。代替的には、代替物を、遠位端から回収可能に展開させることができ、また可撓性のある本体を、放射線ビームの照射中に除去することもできる。
【0020】
電極、可撓性のある本体、および代替物は、通常、パッケージ中に含まれることになり、パッケージは、しばしば、密閉してシールされ、またキットを使用するための説明書などを含む。キットのさらなるコンポーネントもまた、通常、パッケージに含まれることになる。
【0021】
放射線外科手術システムの第2の入力は、遠隔の撮像システムを含むことができる。代替物は、代替物と標的部位の間で3次元のオフセットを規定するために、展開されたとき、十分に非共線性構成を有する1組の受動的な、高コントラストの基準マーカを備えることができる。1組の基準は、実質的に直線的な挿入形状を有することができ、また代替物は、代替的に、能動的な超音波もしくは電磁式コンポーネントを備えることができる。能動的な代替物は、代替物(したがって、標的部位)の位置の追跡を容易にするための信号を第2の入力に供給する超音波または電磁式システム内に含まれうる。多くの実施形態では、細長い本体の遠位端を心臓の組織に取り付けるために、固定表面を設けることができる。固定表面は、半径方向に拡大可能な本体、真空シール本体、または螺旋の固定ねじにより規定されうる。
【0022】
治療キットの多くの実施形態は、体の呼吸運動の撮像を容易にするために、患者の体の露出した表面に取付け可能な体表面マーカを含むことができる。例えば、発光ダイオード(LED)を患者の胴部に取り付けることができる。LEDは、標準的な画像処理技法を用いて、呼吸を監視するために、標準のビデオカメラにより撮像することができる。
【0023】
多くの実施形態では、電極は、1組の心電図(EKG)電極中に含まれうる。患者の皮膚に、超音波撮像トランスデューサを取り付けるのに適した粘着性の貼布(patch)もまた、キットに含まれうる。代替物にアクセスし、埋め込むためのコンポーネントもまた含めることができる。例えば、放射線治療中に、患者の皮膚に取付け可能な近位端を有する導入シース、患者に挿入可能な遠位端、およびそれらの間の管腔を提供することができる。管腔は、細長い本体を密封状態で受け入れることができるが、通常、導入シースの弁部材が密封を行う。複数の代替物を支持するカテーテルを同時に配置できるように、さらなるポートまたはチャネルを設けることができる。例示的な実施形態では、キットはまた、心臓ガイドワイヤ、細長い本体の管腔を介して管腔もしくは心腔に送ることの可能な撮像造影剤、麻酔性の皮膚洗浄液、位置決め針、ガイドワイヤ、および/または同様のものなど、1つまたは複数のさらなるコンポーネントを含むことができる。
【0024】
他の態様では、本発明は、非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムを提供する。システムは、血管内から体内の心臓組織に回収可能に取り付けることのできる埋込み可能な位置代替物を備える。画像取込みデバイスは、心臓から、3次元の計画画像データを取得するように構成される。放射線源は、体外から電離放射線の複数のビームを送出し、また追跡システムは、代替物の位置に応じて位置データを生成する。プロセッサ・システムは、心臓の標的部位を特定するための入力を有する計画モジュールを含み、計画モジュールは、標的部位および計画画像データに応じて放射線ビームの計画を生成する。プロセッサ・システムは、追跡システムを放射線源と結合して、放射線ビームが心臓の標的部位を再建することにより疾患を軽減するように、埋め込まれた代替物を参照して放射線ビームを標的部位に向けて送る。
【図面の簡単な説明】
【0025】
【図1】本発明の実施形態で使用するための例示的なCyberKnife(商標)定位的放射線外科手術システムの図である。
【図2】心拍周期と呼吸周期の両方に関連する動きを示す、心臓の右心房の内側の下大静脈/三尖弁輪間峡部(cavotricuspid isthmus)の点の前方/後方の動きからの例示的なデータを示すグラフである。
【図3】放射線外科手術システムを用いて標的組織を治療するための方法を概略的に示す図である。
【図4】CTボリュームの時間シーケンスが取得される例示的な位相を示すEKG波形の図である。
【図5】治療システムのコンポーネントにより推定された心臓の損傷のグラフィカルな表示と共に、心臓の不整脈を治療するための標的部位に関する計画入力を含む、ユーザインターフェース表示の部分をグラフィカルに示す図である。
【図6A−6C】追跡代替物を提供するために、管腔および/または心腔中に展開されたカテーテルベースの基準を示す図である。
【図6D−6L】追跡代替物を提供するために管腔および/または心腔中に展開されたとき、カテーテルベースの管腔内固定構造、および/または非係留式の回収可能な管腔内固定構造、ならびにそれらの使用を含む、一時的に埋込み可能な代替物システムを示す図である。
【図7】標的部位および関連する一連の放射線ビームの計画後、基準が心臓に、または隣接する構造に埋め込まれる、心臓を治療するための放射線外科手術システムおよび方法を概略的に示す図である。
【図7A】標的部位および関連する一連の放射線ビームの計画前に、基準が心臓に、または隣接する構造に一時的に埋め込まれ、また治療後に取り出される、心臓を治療するための代替的な放射線外科手術システムおよび方法を概略的に示す図である。
【図8A−8F】運動している心臓組織を追跡するのを容易にするために、画像化が可能な、かつ/または能動的な基準を有する代替的なカテーテルベースの代替物システムを示す図である。
【図9A−9B】能動的な基準または同様のものを含む位置感知システムを較正するために、カテーテル先端をCTデータセットに登録するためのシステムおよび方法を概略的に示す図である。
【図9C】例示的な能動的カテーテル較正モジュールを概略的に示す機能ブロック図である。
【図10】埋め込まれたカテーテルベースの能動的かつ/または受動的な基準を治療計画に登録することを概略的に示す図である。
【図11】登録された治療計画および受動的な基準システムをグラフィカルに示す図である。
【図12】治療計画と治療システムの位置合せをグラフィカルに示す図である。
【図12A】能動的なカテーテル追跡モジュールの実施形態を概略的に示す機能ブロック図である。
【図13】治療計画に従って標的部位を治療するための方法を概略的に示す図である。
【図14a−14e】計算された平均の標的中心と共に、組織変形により生ずる可能性のある追跡代替物と標的組織の間の相対運動を概略的に示す図である。
【図15A−15B】固定されたオフセットが適用された場合(図15Aで)、およびオフセットが適用されない場合(図15B)、治療計画に対する動きの影響をグラフィカルに示す図である。
【図16】心臓の非腫瘍性の疾患の治療に関して、本明細書で述べたシステムおよび方法で使用するためのキットを概略的に示す図である。
【発明を実施するための形態】
【0026】
本発明は、概して、放射線外科手術システムを高い頻度で使用して組織を治療するための改良されたデバイス、システム、キット、および方法を提供する。本発明の実施形態は、心臓の組織など(心臓周期もしくは心拍周期と共に動く隣接する血管を含む)動きのある組織を治療するのに特によく適することができる。このような実施形態は、特に、呼吸周期と共に動く組織構造に関連するものなど、腫瘍を治療するために開発された構造および方法を利用することができる。心臓周期は、通常、呼吸周期よりもかなり速く、また心臓に対して有効な放射線外科手技を行うための全体的な治療時間か、かなり長くなりうる(通常、10分よりも長く、しばしば、30分を超え、多くの場合、2時間以上になる)。したがって、過度の撮像用放射線に曝すのを制限するために、蛍光透視法または同様のものを用いて、標的組織および隣接する組織の連続的な撮像を回避することは有利であることが多い。本発明の実施形態はまた、心臓の運動する組織中に長期間、基準を埋め込む何らかの必要性を回避することができ、それにより、患者に対する痛みおよび不快さを低減し、塞栓症の危険、血栓の蓄積、感染の危険などを最小化する。有利には、本発明は、計画画像データセット、および他の診断用測定値が得られた後、医師および他の医療の専門家に、適正な放射線外科の治療過程を計画するための適切な時間を与えることができる。
【0027】
本発明は、知られた放射線送出システムに含まれた、またはそれから派生した多くのコンポーネントを利用することができる。例示的な変更したCyberKnife(商標)の定位的放射線外科手術システム10が図1に示されている。放射線外科手術システム10は、ロボット・アーム14に取り付けられた軽量の直線加速器12を含む。画像ガイドシステム16は、ロボット・アーム14と標的部位の間の位置合せを向上させるために、立体診断X線源18および画像検出器20を含む。標的部位における組織は、高コントラスト画像を示さない可能性があるので、画像ガイドシステム16は、1つまたは複数の代替構造の位置を特定するために、画像処理技法を使用することができ、代替物は、通常、高コントラストの自然な組織構造(骨など)、または標的組織と相互に関係して動く人工的な、埋め込まれた基準マーカを含む。標的追跡はまた、特に呼吸に対応する胸壁の動きを特定するために、1つまたは複数の表面画像カメラ22を利用することができる。カメラ22は、患者の胸部上で視認可能な発光ダイオード(LED)、または他の高コントラストの基準マーカを監視することができる。患者支持台24は、患者(および治療部位)とロボット・アーム14との位置合せを行うのを容易にするように、位置合せアーム26により移動可能に支持されている。
【0028】
図2は、ブタの心臓の右心房の内側の下大静脈/三尖弁輪間峡部における点の前方/後方の動きをグラフィカルに示している。図で分かるように、動きには2つの成分が含まれている。すなわち、ゆっくりと変化する呼吸成分と、より速い心臓成分とである。本発明の実施形態は、これらの動き成分のいずれか、かつ/またはその両方に対処することができる。例えば、ロボット・アーム14は、全体の動きのうちの呼吸成分に対して、かつその心臓成分に対して共に補償するように、標的部位と同期して直線加速器12を動かすことができる。代替的には、ロボット・アームの同期運動は、少なくとも1つまたは複数の自由度における心臓成分を無視しながら、呼吸成分だけを追跡することができる。いくつかの実施形態では、心臓の動きで誘起されるエラーを低減する、またはなくすように、標的組織がロボットと十分に位置合せされている場合、ロボット・アーム14は、心拍周期のいくつかの部分への放射線ビームを制限するように直線加速器12にゲートを適用して、動きのうちの呼吸成分を追跡することができる。様々な自由度における様々な動き成分の重要性は変化する可能性があるので、動き成分追跡の異なる組合せ、動き成分の無視、および放射線ゲートを使用することができる。例示的な追跡手法は、2008年7月24日に公開された、Adler他の名前による米国特許出願公開第2008/0177280号でより詳細に述べられている(その開示全体を、参照により本明細書に組み込む)。
【0029】
次に図3を参照すると、比較的簡単な治療の流れ図40は、本発明の実施形態による放射線外科治療の前に、かつその間に使用されるステップを示すことができる。内部組織は、通常、コンピュータ断層撮影(CT)、磁気共鳴撮像(MRI)、超音波撮像、X線撮像、PET、SPECT、光干渉断層法、これらの組合せ、または他の撮像モダリティなど、遠隔の撮像モダリティを用いて、計画目的のため画像化42される。放射線再建のために実際に標的にされる組織構造は、標的組織の位置を特定するのに十分なコントラストの代替構造が画像データ中で視認可能である限り、必ずしも、画像中で視認される必要のないことに留意されたい。多くの実施形態で使用される計画画像は、時系列の3次元の組織ボリュームを含むことになり、その時系列は、通常、1つまたは複数の動き周期(心臓もしくは心拍周期、呼吸もしくは息をする周期、および/または同様のものなど)にわたっている。例示的な実施形態では、画像データは、容積測定または3次元的画像データを提供するために、心臓を介した一連のCTスライスを含む。時系列の3次元心臓画像は、心拍周期の全体を通して分散される時間で取得されることが好ましく、したがって、画像計画データは、心拍中の心臓組織の動きに関する情報を提供する時系列の3次元画像データセットを効果的に含む。図4は、典型的な心拍の心電図(EKG)波形を示しており、そこから、10個の位相が特定され、またそれに対して、10個の関連するCTボリュームが取得される。いくつかの実施形態では、標的組織は、10個のボリュームのそれぞれで概略的に示されうるが、あるいは標的の概要を、1つのCTボリュームで特定して、自動的に、他のCTボリュームに対しても追跡することができる。以下でより詳細に述べるように、他の代替形態は、時系列から3次元画像データセットの適切な1つを選択し、平均的な位置データセットを生成することなどを含む。そうではあるが、一連の3次元データセットの取得は、様々な市販のCTシステムのいずれかを用いて行うことができる。
【0030】
図3をさらに参照すると、画像ステップ42から取得された画像データに基づいて、計画44を標的部位における組織の治療のために作成することができる。計画は、通常、標的部位と、標的部位内で交差する一連の放射線ビームを含む。標的組織内の放射線量は、少なくとも望ましい再建効果を与えるのに十分なものである必要がある。通常、放射線量は、組織を切除し、心臓内の収縮性経路を抑制し、不整脈源性を抑制するなどを行うのに十分なものである。標的組織外の放射線量は、周囲の組織に過度の損傷を与えないようにするために、比較的急勾配で減少することが好ましく、指定された影響の受けやすい、かつ/または重要な組織構造における放射線量は、有害な副作用を回避するために、望ましい最大の閾値以下に維持されることが多い。
【0031】
図3および5を次に参照すると、例示的な治療計画モジュールおよびユーザインターフェースが、システム・ユーザに組織の表面を参照して、望ましい損傷パターンを入力することを可能にする。不整脈を抑制するように心臓の運動組織に治療を行うために、参照する心臓表面は、1つまたは複数の心腔および隣接する血管の血液/組織界面、または内側表面を含むことができる。代替的な実施形態は、参照表面として、心臓の外側表面を使用することができるが、表面は、計画画像取得ステップ42中に撮像造影剤を導入することにより、3次元の計画画像データからさらに容易に特定することができる。CTデータの各スライスにおける血液(付加された造影剤を含む)と心臓組織との間の境界は、心臓周期の位相と関連するボリューム・データセットの1つ、いくつか、またはすべてでセグメント化することができる。セグメント化された領域は、共に積み上げられ、または組み立てることができ、また平滑化技法を、スライスの境界間に適用することができる。こうすることにより、計画する医療の専門家は、心臓組織表面に対する一連の線または曲線として適切な損傷パターンを入力できるようにし、線は、所望の治療利益を与えるようにボリュームへと拡大される。代替的には、損傷パターンは、心腔のセグメント化された心外膜面と心内膜面との間の組織のボリュームを線で描くことにより画定することもできる。このような実施形態では、ユーザは、任意選択で、心筋壁面を参照して損傷を画定することもできる。心臓表面52に対する望ましい治療部位50の入力に関するさらなる詳細は、「Heart Tissue Surface Contour−Based Radiosurgical Treatment Planning」と題する米国特許出願第61/226,613号(整理番号021902−002100US)で提供されており、そのすべての開示を、参照により本明細書に組み込む。標的部位が特定された後、放射線の影響を受けやすい構造を特定することに対して、既存の放射線外科計画手法を実施することができる。同様に、既存の放射線外科手術の放射線ビーム計算モジュールを、得られる放射線分布を決定するために使用することもできる。
【0032】
望ましい損傷パターン(図5の左側で概略的に示されている)を入力すると共に、計画モジュールおよびユーザインターフェースは、好ましくは、心臓の表面に沿った実際の放射線照射量の推定を、好ましくは、推定された心臓表面の損傷54(図5の右側で概略的に示されている)の形で、出力することになる。推定された損傷54は、任意選択で、既存の放射線外科治療の計画装置から出力された放射線ビームおよび放射線量に基づき、壊死閾値を超えた放射線量を受ける心臓組織表面52の一部を表すことができる。代替的なパターンは、不整脈を抑制するように、治療的再建を行うために十分な放射線量を受けることになる組織の推定を表すこともできる。ユーザは、反復して計画治療モジュールに入力すること、およびモジュールから出力することに基づいて、計画を対話的に開発することができる。図5の心臓組織表面52上で示された推定損傷54の例示的な表示は、第1の(より低い)閾値を超え、第2の(より高い)閾値に満たない放射線量を受ける左心房の心内膜面の強調された(疑似カラー)領域を示している。代替的な表示は、結果的に組織に瘢痕を作り、壊死させ、切除するなどを行うのに十分な線量を受ける組織表面域を示すことができ、示された組織は、任意選択で、得られた組織状態に対応する色、または組織表面画像を用いて(例えば、通常、対応する健康な組織よりも白い瘢痕組織は、周囲の組織よりも白い色合いで示されるようになど)強調される。
【0033】
図3を(図1および図6A〜6Cと共に)再度参照すると、計画44の完了後、心臓の放射線外科治療46を、患者を患者支持台24上に配置すること、ロボット・アーム14で患者を位置合せすること、および直線加速器12からの計画された一連の放射線ビームを心臓の標的部位へと送ることにより開始することができる。しかし、上記で述べたように、心臓の標的部位は、画像ガイドシステム16により得られた画像中で、容易に特定できない可能性がある。心臓の軟組織の追跡を促進するために、心臓の標的部位と相互に関係して動く組織に、1つまたは複数の代替構造64を結合させるように、カテーテル60を血管62を介して前進させることが有利であることが多い。図6A〜6Cの実施形態では、カテーテル60は、2つのステント状構造68を備える遠位端66を有する。ステント状構造68は、周囲の管腔壁または心腔壁の組織表面に対して、基準64を支持するように、血管の管腔または心腔内で外傷を与えずに拡大することができる。ステント状構造68はまた、標的部位の放射線外科治療の後、半径方向に収縮し、近位方向に引き抜くことができる。図6A〜6Cで示されている例示的な方法は、一連の基準64が、左肺動脈LPA、右肺動脈RPA中に、また左右肺動脈の間の分岐の峡部もしくは隔壁部に隣接して、非共線性の構成で展開されている様子を示している。このような非共線性の構成は、基準の画像データに基づき、3次元オフセットを規定することを容易にするが、例示的なオフセットは、基準と標的部位(複数可)の間で延びており、図6Cで示すように、標的部位は、ここでは、左肺静脈LPV切除線、および右肺静脈RPV切除線で示されている。
【0034】
図3および7を次に参照すると、画像の取得42および治療の計画44に関連する時間は、総合すると、少なくとも1日のかなりの部分を示すはずである。放射線外科治療46それ自体も同様に、かなりの時間量を要するはずあり、基準の外科的埋込み70および取出しも72また、何らかの時間を要する。一般に、埋め込まれた構造を、必要以上の時間にわたって心臓組織中に、またはそれに隣接して残すことを回避するのが望ましいので、基準の埋込み70および基準の取出し72を放射線外科治療の日74に行い、画像42および計画44を、治療日の前に実施するのが利益のあることが多い。しかし、この計画後の基準の埋込み70の結果は、治療日の前に、基準画像および位置を計画画像データで利用できないことになる。この理由で、計画後の基準の埋込みは、標準の放射線外科治療の実務に反する可能性のあることに留意されたい。
【0035】
上記を考慮すると、例示的な治療法76は、概して、何らかの人工的な、または埋め込まれた追跡基準を使用することなく、CTデータ42の形で計画画像を取得することを含む。血液−心臓組織表面の識別を容易にするために、画像取得中に、通常、造影剤を使用することになり、また計画画像データは、好ましくは、時系列の3次元データセットを含み、各3次元データセットは、通常、心臓組織を介する一連のオフセット平面スキャンを含む。
【0036】
上記で述べたように、計画は、特殊化した心臓治療計画モジュール80と共に、汎用の放射線外科治療計画モジュール78を用いて行うことができる。汎用の計画モジュール78は、例えば、計画画像の平面CTスライスのいくつかにおけるアイソセンタの、または他の照射標的プロファイルを特定するために、腫瘍の治療中に使用されうる。放射線に影響されやすい周囲組織をさらに平面CTスキャンで特定することができ、この入力に基づき、汎用の治療計画モジュールは、一連の放射線ビームを生成し、かつ線量情報を、CTスキャンの平面に関連付けることができる。組織表面ベースの損傷パターンを用いて、心臓の非腫瘍性の疾患(不整脈など)の治療を容易にするために、心臓組織計画モジュール80は、汎用の計画モジュール78の機能とインターフェースをとる(またそれを利用する)ことができる。
【0037】
心臓組織計画モジュール80は、本明細書で述べる他のデータ処理モジュールと同様に、通常、コンピュータ処理ハードウェアおよび/またはソフトウェアを備え、ソフトウェアは、通常、本明細書で述べる関連する方法ステップの1つ、いくつか、またはすべてを実施するためのコンピュータ可読命令またはコードを使用する有形の媒体の形をしている。適切な有形の媒体は、ランダム・アクセス・メモリ(RAM)、読み出し専用メモリ(ROM)、揮発性メモリ、不揮発性メモリ、フラッシュメモリ、磁気記録媒体(ハードディスク、フロッピー(登録商標)ディスク、または同様のものなど)、光記録媒体(コンパクト・ディスク(CD)、デジタル・ビデオディスク(DVD)、読み出し専用のコンパクト・ディスク、メモリ・スティック、または同様のものなど)を含むことができる。本明細書で述べる様々なモジュールは、単一の汎用コンピュータの単一のプロセッサ・ボードで実施することができるが、あるいは任意の1つまたは複数のモジュールは、複数の所有権を有する、または市販のコンピュータ構造のいくつかの異なるプロセッサ・ボード上で動作することのできる任意の1つまたは複数のモジュールで実施することができ、コード、データ、および信号は、バス、ネットワーク(イーサネット(登録商標)、イントラネット、またはインターネットなど)を用いて、有形な記録媒体を介して、無線遠隔測定法を用いて、または同様のものなどにより、プロセッサ・ボード間で送信される。コードは、モノリシックのソフトウェア・プログラムとして記述されうるが、通常、広範囲なソフトウェア・アーキテクチャ、データ処理構成などのうちのいくつかで、異なる機能を処理する様々な別個のサブルーチンおよび/またはプログラムを含むことになる。そうではあるが、プログラムまたはハードウェアの機能性を、別個の機能モジュールへと分けることは、本発明の様々な態様の機能を理解する上で有益である。
【0038】
例示的な心臓組織計画モジュール80は、CyberKnife(商標)放射線外科手術システムのMultiplan(商標)計画モジュールとインターフェースをとる。平面CTスキャンに形状を入力するのではなく、心臓計画モジュール80のユーザインターフェースは、組織表面上に線および/または曲線を画定することができ、心臓組織計画モジュールは、CTスキャン平面上の関連する形状を特定する。心臓組織計画モジュールはまた、(概して、図5に関して述べたように)心臓計画モジュール80または放射線外科手術計画モジュール78のディスプレイ上に、心臓組織の推定される損傷をグラフィカルに表示する。こうすることにより、患者の治療を計画する1人または複数の医療の専門家が、損傷パターンが適切であり、かつ望ましい治療の利益を生成できることを検証できるようになる。例示的な心臓組織計画モジュール80はまた、患者および/または心臓と、放射線外科治療システム10との間の全体の位置合せ不良の影響を(関連する出力を医療の専門家(複数可)に送って)シミュレーションし、かつ/または推定された損傷位置および形状に対する追跡エラー(理想的には6個の自由度で)に関する出力を、計画する医療の専門家に送る。
【0039】
計画44が完了した後の暦日(calendar day)に、また好ましくは、治療日74に、患者は、追跡代替物または基準の外科的な埋込み70を受けることになる。いくつかの実施形態では、1つまたは複数の基準は、治療が開始される日に先立って埋め込むことができ、かつ/または治療は、1日を超えて行うことができる(基準は、任意選択で取り出され、新しい基準が治療の間に埋め込まれる)。好ましくは、基準は、血管を介して心臓の組織へとカテーテルの遠位端を前進させることにより埋め込まれ、細長い可撓性のあるカテーテル本体の遠位端は、基準が標的組織と相互に関係して動くように、高コントラストの基準セットを心臓組織に結合する。例示的な結合機構は、図6A〜6Cに関して上記で述べたように、(任意選択で、螺旋コイル、編組み、または同様のものを含む)半径方向に拡大可能なバルーンもしくはステント状構造を含む。これらの拡大可能な本体は、周囲のカテーテル・シースから(拡大可能な本体から近位方向にシースを引っ張ることによるなど)解放されたとき、半径方向に拡大するように偏らせることができる、あるいはバルーンの前方へと液(通常、食塩水などの液体、または空気などの気体)を導くことにより、拡大可能な本体の近位端と遠位端の間の長さを短縮することによりなど、拡大させることができる。拡大可能な本体は、通常、拡大可能な本体上でシースを前進させることにより、膨張液を空にすることにより、螺旋コイルの線条をシース中に引き込むことなどにより半径方向に収縮するように構成される。代替的な、広範囲の可逆的に拡大可能な構造がステント分野で知られており、その多くのものを修正して心腔の内側、または隣接する血管内で、代替物を心臓の組織に一時的に取り付けるために使用することができる。
【0040】
図7Aは、本明細書で述べる本発明の多くの態様を使用できる代替のワークフローを概略的に示している。代替の治療ワークフロー76’では、基準の埋込み70は、計画CT42または他の計画画像を取得する前に行うことができる。計画画像が取得された後、患者は、別の日に治療を行うために(治療計画44に1日の少なくともかなりの部分を使用できるように、なお、計画を立てるには、完了するのに複数日必要であることが多い)、帰宅することができる。係留された管腔内代替システム(その場合、基準は、細長いカテーテル本体により、管腔内のアクセス部位に係留されたままである)は、任意選択で、1日を超えて一時的に埋め込まれる可能性もありうる。代替的に、係留されない管腔内代替システムをそれに代えて使用することが利益のある可能性もある(その場合、一時的に埋め込まれ、解放される固定構造は、管腔内または心腔内で基準を支持するが、カテーテル本体が血管アクセス部位と代替システムとの間で延びることはない)。このような係留されない固定構造は、基準の取出し72中に、その後、カテーテルを結合し、管腔内で代替システムを再度捕捉し、回収することを容易にするように構成されることが好ましい。さらに、ワークフロー76’の代替の実施形態は、入院患者および/または同日治療手法を使用することもできる。例えば、基準の埋込み70、計画画像の取得42、治療計画44、治療システムと患者の位置合せ136、および治療46、さらに任意選択で取出し72は、1日のうちに完了するように調整することができ、患者は、治療期間中、病院または他の治療施設に留まることも多い。関連する代替の実施形態は、1日から2日、または3日を超えて(通常、1週間未満であるが)延びる可能性があるが、少なくとも取出し72(および任意選択で、治療それ自体)が、2日、3日、または1週間以内で行われ、しばしば、その間、患者は病院または他の治療場所に残ったままである。基準の取出し72はまた、手順の最後で通常行われる。
【0041】
図6Dおよび6Eを次に参照すると、例示的な係留されない代替システムを理解することができる。図6Dは、共に結合された2つの対向する螺旋ワイヤを備える一時的に埋込み可能な固定構造を示す。この例示的な係留されない固定構造は、カテーテル構造を用いて管腔内で展開され、回収することができ、またそれは、画像化中、計画中、および/または治療中に、1つまたは複数の基準を一時的に支持することができる。図6Dの固定構造は、米国カリフォルニア州メンローパークのCrux Biomedical Inc.による大静脈フィルタとして使用するために開発された(またはそれから導出され、あるいは変更された)構造を使用することができ、また固定コンポーネントおよびこの実施形態の使用は、ジョンソン他の名前で2008年6月19日に公開された、「Endoluminal Filter with Fixation」と題する米国特許出願公開第2008/0147111号(2008年1月4日に出願され特許出願第11/969、827号)を参照するとさらに理解することができ、その開示の全体を、参照により本明細書に組み込む。図6Dの構造を展開するために使用される方法およびカテーテル構造(ならびに再捕捉および回収のために使用される方法およびカテーテル)はまた、’111公開を参照することにより理解することができる。本明細書で述べられる放射線外科治療システムおよび方法と共に使用される図6Dおよび6Eで分かるように、1つまたは複数の高めたコントラストの受動的な基準を、2つの対向する外側の螺旋ワイヤ、またはその両端で共に結合された他の線条に(直接または間接的に)固定することができ、ワイヤの交差部および結合部が、それらの間のフレームを画定する。代替の実施形態は、外側の螺旋ワイヤに取り付けられた能動的な基準を使用することができ、能動的な基準は、任意選択で、係留部を有する、または電源を内蔵している。外側の螺旋ワイヤの間で延びる図6Dで示されたフィルタ線条要素を除去する、または除外することができるが、あるいはいくつかの実施形態では、一定の位置に残すこともできる。交差する螺旋ワイヤは、2つ、3つ、または複数のフレームを画定することができる(図6Eで示す)。
【0042】
図6Fおよび6Gを次に参照すると、図6Dおよび6Eの係留されない固定構造を有する代替システムを用いるための方法を理解することができる。図6Fでは、2個の2フレームの一時的管腔内固定構造が肺動脈中に埋め込まれて、心臓の運動する組織の追跡を容易にするように、非共線性の基準を支持する。肺動脈弁および右心室が、方向付けのために特定される。図6Gでは、左心房に隣接する左の上肺静脈LSPVおよび下肺静脈LIPVを囲み、かつ右の上肺静脈RSPVおよび下肺静脈RIPVを囲む標的部位は、冠状静脈洞CS内に一時的に埋め込まれた複数のループまたはフレームを有する代替システムの支援により、追跡することができる。展開する前に、係留されない代替システムは、送出および/またはガイド・カテーテルの内側に事前に搭載しておくことができる。ガイド・カテーテルの内側の細長い可撓性のある本体(任意選択で拡張器)は、冠状静脈洞、下大静脈(IVC)、上大静脈(SVC)、肺動脈、または他の望ましい血管などの血管の内側に留置されるように、代替システムを押すプランジャとして働く。一般の送出システムも使用することができる。治療が完了した後、スネアなどの回収カテーテルが、例えば、固定構造の近位端に設けられた突起もしくはフード上を把持することにより、留置された代替システムを再度捕捉し、回収することができる(図6Dを参照のこと)。固定構造は、任意選択で、Crux(商標)IVCフィルタ上に設けられたものと同様の、螺旋ワイヤの外側表面から半径方向に突き出たアンカーを有し、血管壁に良好に固定させることができる。肺動脈に基準システムを送出するために、Swan−Ganz(スワンガンツ)カテーテルと同様の流れ指向(flow−directed)バルーン・カテーテルを使用することができる。その後に続いて、ガイドワイヤを送出部位に挿入することができる。流れ指向バルーンが膨張して右または左の肺動脈を選択する間に、ガイドワイヤはまたねじられる可能性もある。次いで、Swan−Ganzは引き抜かれるがガイドワイヤは定位置にあり、代替システムの事前に搭載されたカテーテルが、ワイヤを介して標的部位へと進む。代替システムは標的部位で展開する。代替システムを後に残して、ガイドワイヤおよび送出カテーテルを引き抜くことができる。代替的には、流れ指向バルーンは、基準送出システムと一体化することができる。したがって、代替システムは係留される、かつ/または係留されない(留置される)。
【0043】
図6H〜6Lを次に参照すると、さらなる代替の固定構造が示されている。図6Hの実施形態では、螺旋のステント状固定構造が、血管壁に当接する基準を支持しており、血管内で固定構造は拡大されて、通常、螺旋の線条構造が関連するシース内から解放されている。図6Iの実施形態では、螺旋のステント状固定構造は、代替システムの遠位端の近傍に流れ指向バルーンおよび/または展開カテーテルを含み、血管内で下流へと展開カテーテルの前進をガイドしようとする。前と同様に、基準は周囲の血管の壁に当接することになり、また基準を、例えば、1cmごとになど、規則的な、または変化する距離で、固定構造の螺旋の長さに沿って分離することができる。図6Jの実施形態では、軸方向に一連の拡大可能なバスケット状の構造が、円周方向に一連の可撓性のある部材によりそれぞれ画定されている。プルワイヤは、患者の外から、ある長さのバスケット状構造を短縮させ、その場所でその直径を拡大することを可能にする。バスケットの遠位端における流れ指向バルーンは、カテーテルを下流方向へとガイドするのを助け、またプルワイヤに、またはバスケットの中心に沿ったままである他の構造に沿って基準を取り付けることにより、バスケットが拡大したとき、基準は、血管の中心に留まることができる。図6Kおよび6Kiは、血管に沿って下流方向に、展開カテーテルの遠位の前進をガイドするのを助けるための任意選択の流れ指向の遠位バルーンを備えた、一連のスポークおよびホイール・バルーン(任意選択で、カートホイール・バルーンと呼ばれる)を概略的に示している。基準をまた、1つまたは複数のバルーンの中心部に沿って取り付けることができる。図6Lは、編み組みされた管の中心に沿って配置された基準を支持するプルワイヤを備えた編組み管を含む代替の拡大可能な支持構造を概略的に示している。管の近位端に対してプルワイヤを引っ張ることにより管を短縮することは、管を半径方向に拡大する結果となるが、基準は、実質的に血管の中心に沿ったまま残ることになる。
【0044】
図8A〜8Cおよび8Eは、基準を展開し、かつ基準64を心臓組織Tに一時的に取り付けるためのさらに代替的なカテーテル構造を概略的に示している。カテーテル86、88、90、91は、カテーテルをその軸の周りで回転させることにより、組織Tの中へとねじ込むことのできる螺旋ねじ92を用いて、組織Tに基準64を取り付けるが、例示的な螺旋ねじは、螺旋の心臓ペースメーカ・リードと同様の構造である。基準64は、弾性的に、または可塑的に可撓性部材により支持されて、基準が、周囲のシースによる実質的に直線の構成から、組織Tと係合する非共線性に展開された構成へと拡大することを可能にする。基準64の非共線性に展開された構成は精度を向上させ、それにより、(図8Cのオフセット94により概略的に示される)3から6次元のオフセットが、基準の3次元または立体画像に対して決定されうる。標的組織は、治療中に基準からの3から6次元オフセット94を用いて特定されうるので、これは、追跡精度を向上させることができる。カテーテル91の弾性のある構造は、螺旋ねじの周囲で少なくとも部分的に、螺旋ねじと交差する組織と係合する円弧または投げ輪を形成するように偏倚される。図8Eは、代替的な基準展開カテーテル89を示しており、その場合、カテーテルの遠位端に設けられた展開可能なコーン89aが、カテーテルの近位端に結合された注射器89bなどの真空源を用いて、カテーテル内に真空を加えることにより、心臓内の組織表面Tに一時的に取り付けられうる。基準カテーテル89cは、次いで、展開カテーテルの近位端のポート89eを介して、遠位方向に基準カテーテルを進ませることにより、展開カテーテル89の遠位端に隣接して配置することができる。さらなる監視もしくは切除デバイスをまた、ポートを介して遠位方向に進めることができ、またコーンを展開することは、作動子89fを用いて、展開カテーテルの近位端から行うことができる。基準89dは、基準カテーテル89dの遠位端に、またはその近傍に取り付けることができる。
【0045】
本発明で使用するように適合されうる、さらに他の代替のカテーテルベースの基準構造は、図8Dで示されており、また「Device for Measuring Administered Dose in a Target」と題する米国特許出願第2008/0292054号でより詳細の述べられている(そのすべての開示を、参照により本明細書に組み込む)。その参考文献で述べられた例示的な実施形態は、前立腺ガンの治療を容易にするための尿道カテーテルを含むが、同様の構造を、図8A〜8C、8E、および図6A〜6Cに関して上記で述べた螺旋ねじ92、またはステント状構造68を含めることにより、変更することも可能である。いくつかの実施形態は、図8Dで示すカテーテル140の線量測定コンポーネントを含むことができるが、多くの他の実施形態は、線量測定機能を除外するはずである。例示的なカテーテル140に関して、その構造は、電気的なガイド142、および電気的なマーカ143を備えた細長い可撓性のあるカテーテル本体141を含む。マーカは、患者の中の標的域の位置と、患者の識別IDを決定するために使用される送信器Txを備える。インプラントはさらに、標的域に投与された線量を検出するために使用される線量センサ145と線量識別Dose/IDとを有する、組み合わされた線量および識別ユニット144を備える。
【0046】
組み合わされた線量および識別ユニット144は、電気的ガイド142に接続されるように構成されたコネクタ146を備え、線量識別Dose/IDと電気的マーカ143における患者のIDを比較することにより、正しいユニット144が接続されたことを保証することができる。カテーテル(およびカテーテルが取り付けられた組織)の動きが、カテーテルの送信器信号ベースの位置と、カテーテルの画像ベースの位置などとの間のオフセットを決定するので、送信器Txには、カテーテル140の位置を検証するために、組み合わされた線量および識別ユニット144を介して電力が供給されうる。組み合わされた線量および識別ユニット144は、ワイヤ148を介して外部に配置された集積回路147に接続され、また集積回路147は、線量変換と関連する機能を含むが、それは、米国特許出願公開第2008/0292054号でより完全に述べられている。適切な代替の能動的な基準は、しばしば、基準の位置を特定するために、(周囲組織またはそれを含まない埋め込まれた基準の画像を取得するいずれの撮像システムとも独立した)基準との電磁式、または超音波送信を利用する。適切な電磁式位置感知構造は、Biosensewebster(バイオセンス・ウェブスタ)から市販のCarto AcuNav(商標)カテーテルを含む様々な供給元から購入することができ、様々な3次元ガイド追跡構造は、米国バーモント州のAscension Technology Corporation(アセンション・テクノロジー社)から市販されており、超音波センサおよびシステムは、カナダのSonometrics Corporation(ソノメトリクス社)から市販されており、EnSite(商標)心臓マッピング・システムは、米国ミネソタ州セントポールのSt.Jude Medical(セント・ジュード・メディカル)から市販されており、以下同様である。これらの能動的な基準は、基準の位置、基準の動き、および同様のものなどを示す信号を送信し、かつ/または受信するが、この信号は、標的組織を追跡するための放射線外科治療システムのプロセッサへの入力として使用される。
【0047】
本明細書で述べる基準、固定構造、および/または代替システム(ならびに任意選択で、低い輪郭の挿入形状から、周囲の管腔壁に半径方向に係合する一時的に固定される形状へと半径方向に拡大する実施形態)は、以下の1つまたは複数の中に、またはそれに対して取り付けることができる。すなわち、冠状静脈洞、左肺動脈、右肺動脈、肺動脈幹、右心室流出路、下大静脈、上大静脈、肺静脈、左心室流出路、大動脈弓、上行大動脈、下行大動脈、および冠状動脈、ならびに心臓の他の組織構造中に、かつ/またはそれに対して取り付けることができる。代替システムの(任意選択で、ねじ込み式の取付けデバイス、および/または真空取付けを使用するものを含む)他の実施形態は、右心房、心房中壁、左心房、右心耳、左心耳、右心室、心室中隔、および左心室の壁に取り付けることができる。展開可能な、または固定された、基準を支持する環状リングを含むさらに他の代替の実施形態を使用することができ、それは、三尖弁輪、僧帽弁輪、肺動脈弁輪、および/または大動脈弁輪に適合することができる。
【0048】
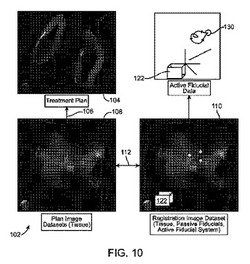
治療計画は、基準の埋込み前に開発されることが多いので、計画された標的に対する基準の位置が特定されると、標的組織の追跡は容易になる。治療計画を埋め込まれた受動的、かつ/または能動的基準に登録するためのプロセスは、図7、10、および11を参照して理解することができる。開始点として、治療計画104は、計画画像データ108との知られた位置関係106を有することが好ましい(これらの要素は、図10に概略的に示されている)。関係106は、上記で述べたように、計画画像データを用いて生成された画像に対する所望の損傷パターンを入力することにより達成することができる。治療計画104に対する基準64の位置を特定するために、登録画像データ110を、基準の埋込み70の後に取得することができる。登録画像データ110は、通常、心臓組織と、少なくともいくつかの埋め込まれた基準、特に、受動的な高コントラストの基準マーカ構造とを共に包含する3次元画像データを含むことになる。組織表面などの識別は、再度、血流中に造影剤を入れることにより容易に行うことができる。これは、心臓組織表面および心臓/血液界面をセグメント化することを容易にする。登録画像データ110および計画画像データ108から、心腔内および心臓の血管に隣接する組織/血液界面を用いて、計画画像データセットと、登録画像データセットとの間の関係112を特定することができる。例示的な関係112は、理想的には、変換マトリックス、オフセット、または同様のものなどを含む、マッピングもしくは変換を含むことができる。血管/組織界面を利用するのではなく、代替の画像/登録の関係112は、心腔の先端、弁輪平面、心門中心、および血管の方向付け、分岐位置、または同様のものなど、一連の別個の組織目印を特定することにより決定することができる。心臓組織は、心臓の外側の解剖学的目印に対して、計画画像データセット108の取得と、登録データセット110の取得との間でかなり動く可能性があること、および心臓および/またはそのコンポーネントの形状が(拍動周期の同様の位相であっても)変形する可能性のあることに留意されたい。したがって、本発明の実施形態は、計画/登録画像の関係112として、単純な固定された変換を使用することができるが、他の実施形態は、任意の様々な変形可能な登録技法を使用することもできる。
【0049】
計画/登録画像の関係112の特定を容易にするために、登録画像データセット110を、計画画像データセット108を取得するのに使用されたものと同じものである画像モダリティを用いて取得することができる。例えば、計画画像データセットは、CTデータを含み、登録画像データセット110もまたCTデータを含むことができる。代替的には、MRIデータが、計画画像データセット108のために使用された場合、基準の埋込み後、MRI取得を、登録画像データセット110に対して行うことができる。同様に、計画画像データセット108が、超音波データを含む場合、登録画像データセット110はまた、超音波データを含むことができる。そうではあるが、他の実施形態は、計画画像データセットの取得のために使用されたものとは異なる画像モダリティを、登録画像データセットを取得するために使用することができる。任意の広範囲な3次元画像データの融合、3次元の固定変換、および/または3次元の変形可能な変換技法を、異なる撮像モダリティの適用にもかかわらず使用することができる。
【0050】
例示的な実施形態では、登録画像データ110は、能動的な基準システムの少なくとも1つのコンポーネントを含むことができる。例えば、図9A、9B、および10は、カテーテル先端を、高い絶対的な精度で、(CTデータなどの)3次元の画像データセットに登録するための方法およびシステムを示している。標準の能動的なカテーテル・ナビゲーション・システムは、磁場の不均質性、または電気的インピーダンスの仮定に起因する幾何的歪みを受ける可能性がある。類似のエラーが、超音波または他のナビゲーション・システムでも提示されうる。これらの追跡技術は、例えば、冠状静脈洞内の撮像可能な電極などに関して、良好な相対位置測定を行うが、その絶対的精度は、体外からの放射線外科治療にとって望ましい程度に良好ではない可能性がある。
【0051】
図9Aおよび9Bは、能動的な基準カテーテルのナビゲーション・システムの送信器122を概略的に示しており、例示的な送信器は、立方体の形状をしている。能動的な基準は、位置基準の位置を感知するカテーテルの遠位端の近傍に配置されたセンサを備えることができる。能動的な基準の基準座標系は、立方体形状の送信器122のコーナに位置づけることができる。代替的なシステムは、この外部送信器を外部のセンサと置き換えることもでき、能動的な基準が関連する送信器を備える。そうではあるが、患者は、患者支持台124上に横たわることができ、患者支持台はまた、外部の能動的な基準センサ122もしくは送信器を支持することができる。いくつかの実施形態では、患者支持台124は、患者支持台に対する患者の動きを抑制するために、真空のバッグまたは他の構造を備えることができ、また患者支持台を(患者およびナビゲーション・システムのコンポーネントをそこに取り付けた状態で)移動可能にすることもできる。
【0052】
移動可能な患者支持台124、能動的な基準送信器122、および患者は、CTスキャナ126の治療台上に配置されるなどにより、撮像のために配置される。その結果、登録画像データセット(その画像128を図9Bで示す)は、送信器立方体122を含み、したがって、送信器立方体は、患者の組織および任意の他の埋め込まれた基準と共に、CTデータセット中で視認可能である。
【0053】
いくつかの実施形態では、患者支持台124および患者を、電気生理学検査室に移動して、プラットフォームまたは電気生理学テーブル上に配置することができ、患者支持台124の真空バッグが、送信器122に対する患者の動きを抑制する。能動的な基準位置センサを有するカテーテルが患者の中に導入されて、心臓組織へと進むことができ、能動的な基準ナビゲーション・システムに、能動的な基準から位置データを決定することを可能にする。CTデータセット中のセンサ122の位置が知られており、また能動的な基準ナビゲーション・システムの位置および方向もまた知られているので、能動的な基準マーカを、能動的な基準のナビゲーション・システムにより特定されたCT画像データセット位置に対して重畳することができる。したがって、能動的な基準130および組織、受動的な基準、ならびに治療計画104の間の関係もまた、特定されうる(図10を参照のこと)。能動的な基準位置情報を心臓の位相と相互に関係付けることにより、また心拍周期を通して、能動的な基準位置に対する標的部位の関係(計画画像データにおける時系列の3次元データセットから決定することができる)を知ることにより、能動的な基準のデータ信号は、標的部位の追跡を促進することができる。
【0054】
登録ステップ102の結果として、基準と治療計画の間の3次元位置オフセット(または1つまたは複数の変換マトリックス)を決定することができ、したがって、基準は、有効に治療計画132に登録される。
【0055】
図9Cを次に参照すると、例示的な較正モジュール200のブロック図は、患者組織を治療計画に登録するのを助けるための、かつ/または患者を放射線外科治療システムと位置合せするのを助けるための代替のシステムおよび手法を示している。較正は、例えば、患者が患者支持台24上に存在する前に、または患者を放射線外科手術システム10の患者支持台24上に乗せた後に、施療するのに先立って行うことができる。較正は、能動的な基準システムの座標系(Ascension Technology Corp.の3D追跡システムの追跡座標系など)と、放射線外科手術システム10の座標系(CyberKnife(商標)放射線外科手術ロボット座標系など)との間で、マッピング関数φを決定することができる。すなわち、
CKp=Φ(ASp) 式1
式中、CKpは、ロボット座標系における点であり、またASpは、能動的な基準追跡座標系における同じ点である。マッピング関数φは、例えば、能動的な基準を(通常、1つまたは複数の位置センサの形で)、一連の位置に、理想的には、関心のボリューム内の一連の格子点へと移動することにより、決定することができる。格子点および/または関心のボリュームは、計画された治療の、または直線加速器12(または他の放射線源)を支持するロボット14のアイソセンタに、またはその近傍に中心を置くことができる。例示的なCyberKnife放射線外科治療システムを用いる場合、治療のアイソセンタは、2つの天井に取り付けられた追跡カメラの軸が交差するCyberKnife室における点とすることができる。これはまた、CyberKnife座標系の原点として使用することもできる。その位置間、または格子点間の能動的な基準の動きは、運動プラットフォームΩロボット202(能動的な基準を近くの治療部位で機械的に動かすための別個のロボット・マニピュレータ)を用いて行うことができ、また能動的な基準の位置は、能動的な基準追跡システム204と、さらに画像追跡システム16(CyberKnife(商標)X線システムなど)との両方に基づいて、追跡モジュール206により感知され、かつ記録されうる。画像追跡ベースの位置と能動的な基準ベースの位置との間で最小二乗法を、較正モジュール206により使用して、最もよくマッチするマッピング関数φを見出すことができる。
【0056】
較正器208は、較正モジュール206のコンポーネントである。較正器208は、CHServerと呼ばれる、放射線外科手術システム上で動作するサーバ・アプリケーションと対話する。CHServerは、イーサネットを経由して通信することにより、較正器208にいくつかの要求をするように働く。較正器208はまた、能動的な基準運動プラットフォーム、Ωロボット202、および能動的な基準追跡システム204に対して共にUSBを介して接続される。較正器208は、
Ωロボットに、センサを指定された位置に移動するように命令する、
放射線外科手術システムの画像追跡システム16に、1対のX線を取得するように命令する、
現在位置に対する能動的な基準センサ座標を取り込む、
CHServerを介してX線をダウンロードする
ことができる。
ステップ1〜4は、すべての格子点、またはその他の形で望ましい位置で行われるまで繰り返される。すべての格子点からのデータが取り込まれた後、較正器208は、マッピング関数φを計算して、それをファイルに記憶することになる。
【0057】
図7、12、および1を次に参照すると、組織の標的部位と、ロボット14との位置合せ136は、概して、患者支持台24により患者を支持させることにより、また(画像ガイドシステム16の立体的X線画像で見られる)基準が所望の位置に配置されるように、関節動作をする患者支持台システム26を用いて患者支持台を移動させて、治療計画の標的部位が、直線加速器12からの計画された軌跡と位置合せされることにより行われることになる。したがって、基準が、実際には、治療計画が完了した後に埋め込まれたとしても、位置合せプロセスは、計画治療データに重畳された基準位置を参照して進めることができ、位置合せプロセスは、放射線外科治療を行う医療人員には理解されるように、計画前に基準が使用される場合に適用されるものと全く同様のものである。
【0058】
図7および13を次に参照すると、ロボットおよび直線加速器による標的組織の治療46および追跡を、概略的に理解することができる。位置合せされた治療計画152(図12を参照して上記で述べたように、ロボット14と適切に位置合せされた後、計画された軌跡および重畳された基準を含む)は、直線加速器12からの適切な軌跡および放射線ビームを規定する。知られた放射線外科治療と同様に、呼吸周期154に対して補償するためにオフセットが決定されるが、呼吸オフセットは、概して、患者の表面画像を用いて、また特に患者の皮膚156上に取り付けられた外部のLEDから特定される呼吸振幅から決定される。間欠的な立体X線データ158を、何らかの患者の動きなどに対する呼吸運動オフセットを変更し、補正するために使用することができる。
【0059】
心臓の動きオフセット160はまた、治療計画152に適用することができ、心臓周期のオフセットの位相は、患者に結合されたEKGセンサ162、または他の心臓周期の監視により特定される。能動的な基準164からのデータまたは信号はまた、心臓の動きの位相を特定するために、ならびに適切な心臓の動きオフセットを提供するために使用することができる。上記で説明したように、心臓周期全体を通しての心臓周期オフセットは、治療計画152に含まれる時系列の3次元データセットから特定することができる。代替的には、EKGセンサ信号162および/または能動的な基準信号164は、放射線ビームをゲートするために使用することができ、したがって、放射線ビームは、標的部位が計画152と十分に位置合せされる心臓周期のいくつかの部分で、心臓組織に向けて送られるだけである。標的部位に位置する組織の心臓周期の動きの何らかの部分は、例えば、無視することができ、基準と標的部位の間の組織の内部変形を、固定されたオフセットに有利なように無視し、十分に制限された振幅を有する1つまたは複数の方向における動きを無視する、または同様に行うことができることに留意されたい。そうではあるが、適切なオフセットが治療計画に適用された後、ロボットによる放射線ビームの標的化166を、次いで、適用することができる。
【0060】
図12Aを次に参照すると、図9Cのものに関係するコンポーネントおよび技法を用いた追跡モジュール210を次に理解することができる。ここでは簡便化のために、計画CTデータにおける位置合せ中心は、基準の重心に設けられると仮定する。そうであるとは限らないことも多いが、通常、計画データと基準中心の間のオフセットが含まれることになる。追跡モジュール210は、施療中、心臓追跡コンピュータHTS上で動作するソフトウェアを含む。位置合せモジュール206は、同様に、心臓追跡コンピュータHTS上で動作することができ、追跡モジュールおよび位置合せモジュールは、例示的な実施形態におけるパーソナル・コンピュータ(PC)で動作するコードを含む。追跡モジュール210は、USBを経由して、埋め込まれたカテーテル・システムのすべての能動的な基準センサ(Ascensionセンサなど)からの位置データ212を入力として受け取る。追跡モジュール210は、較正マップ214、φを、この能動的な基準データに適用して、放射線外科手術システムの座標系(CyberKnife(商標)座標など)における能動的な基準の位置を計算する。そこから、位置データは、3つの異なる経路、すなわち、位置合せ装置216、追跡装置218、および視覚化装置220へと流れる。
【0061】
位置合せ装置216は、能動的な基準からのデータを利用して、患者と放射線外科手術システムとの位置合せを変える。より具体的には、能動的な基準センサデータは、位置合せモジュール・ブロック[4]において、(放射線外科手術システム座標で指定された)計画CTデータからの基準座標との照合を行い、治療台補正を決定することができる。指定された期間にわたる平均の治療台補正が計算され、ユーザに表示することができる。ユーザは、次いで、これらの治療台補正を適用し、治療台補正が実時間でどのように変化するかを観察することができる。ブロック[5]は、移動平均として計算された、治療台補正をグラフィカルな形でユーザに表示することができる。
【0062】
追跡装置218は、入力される能動的な基準位置から標的位置を計算するように構成された追跡モジュール・ブロック[6]を含むことができる。位置合せの後、患者の位置合せ中心は、計画CT座標系で規定されるように、放射線外科治療システムのアイソセンタと一致する。動きが何もない場合、ブロック[6]の出力は、(0、0、0)でありうる。動きがある場合、ブロック[6]の出力は、最初の、または理想的な位置からの位置の変化でありうる。追跡モジュール・ブロック[7]は、標的の動きから心臓の動きを除去することができる。得られた「呼吸だけの」理想的な動きからの変化波形は、放射線外科治療システム・プロセッサの位置予測装置へと送ることができ、それは、標準のデータ経路ごとにこの情報を適用して、ロボットを駆動することができる。
【0063】
能動的な基準データは、視覚化装置220に送ることができ、それは、任意選択で、計画モジュールの表示モジュール・コンポーネントを用いて、CTデータ上に重畳された基準位置を表示することができる。こうすることにより、システム・ユーザに、能動的な基準の位置を、埋め込まれた後になど、視覚化できるようにする。さらに、視覚化装置は、能動的な位置センサを用いて測定された位置データを用いて、実時間で、ロボットにより放射された治療ビームを表示することができる。
【0064】
上記から理解できるように、患者の動きは、心臓疾患の放射線治療を複雑にする。患者の動きが追跡されない場合、標的を狙うことは、標的の時間平均位置にビームを送ることになりうる。代替物および標的が、固定されて共に結合されており、かつ代替物の追跡が正確に維持される場合、標的を狙うことが損なわれることはない。しかし、代替物が標的から偏っており、また標的および代替物が配置された組織が変形する場合、かつ代替物と標的の間の変形が追跡されない場合、単一の撮像位相を、代替物と標的の相対位置を計算するのに使用することができる。適切な撮像位相(3次元画像が取得される時系列の位相中からの)の選択は、標的化の精度に影響する可能性がある。例えば、標的に対する代替物のオフセットが心拍周期の全体を通した平均のオフセットに近くない位相に対して、相対位置の計算が行われた場合、平均の代替物位置に基づく標的化は、線量の送出が標的から偏る結果となりうる。
【0065】
追跡されない動きに適合するための比較的簡単な一手法は、標的を拡大して、標的部位の動きの(心拍周期および/または呼吸周期の全体を含む)すべての位相を通して標的部位の位置を含めるように、標的ボリュームの統合を使用することである。このような統合された標的は、標的部位の治療を保証することができるが、比較的高い放射線量を受ける合計の治療ボリュームが増加する可能性がある。放射線ビームが、標的組織と同期して動く、(Accuray Synchrony(商標)追跡システムで使用されるものと同様の)代替的な追随追跡(pursuit tracking)手法を、標的部位に線量を送るために使用することができる。これらの既存の手法は、放射線に影響されやすい周囲組織の動きを、あるいは標的部位に対する代替物の動きを考慮しないはずである。追跡されない動きへの放射線ビームをゲートすることも使用可能であるが、標的部位に対して十分な線量を与えるための合計時間を増加させることになりうる。
【0066】
例示的な代替の追跡されない治療手法では、組織を、追跡されない組織の動きにわたり統合された線量を受けるものとして解析することができる。ピーク線量は、線量勾配が動きの方向で変化している領域における線量分布に何らかの改変を行って、平均的な位置に送ることができる。線量勾配の変化の割合に対して比較的小さい動きに関しては、線量分布は、追跡されない動きにより、わずかに変更されるだけでありうる。その計画された解剖学的位置からのピーク線量の何らかのシフトにより、意図された線量と実際に組織に加えられた線量との間で、より顕著な変化が生ずる可能性がある。
【0067】
追跡されない動きの存在するこの例示的な標的化手法では、追跡代替物の画像化を使用して放射線ビームを送ることができる。追跡代替物の単一の画像だけが得られる場合、未追跡の動きから生じた標的化エラーが存在することになり、したがって、画像を間欠的に取得することにより、将来のビーム方向を決定するために、好ましくは、追跡代替物の位置を良好に突き止めるように平均化して、位置データを組み合わせることが可能になる。この手法により、標的部位に対する追跡代替物の平均位置に対してビームを送る結果となりうる。計画が、この同じ平均の相対的な位置決めに基づいて作成された場合、ピーク線量の位置は、計画された標的部位に対応すべきである。
【0068】
上記を考慮すると、また図14A〜14Eを参照して理解できるように、心臓運動および/または呼吸運動を通して、追跡代替物に対する標的の時間平均位置を解析することにより、未追跡の動きの存在する中で、標的化精度を向上させることができる。比較的簡単な一方法は、追跡代替物が、その平均相対位置に最も近くにある位相を選択することにより、計画中に、この時間平均相対位置を用いることである。計画中には、代替物の正確な位置は知られていない可能性もあるが、基準を埋め込むための標的位置に対応する心臓内の標的構造を特定することができ、したがって、代替物は、計画された平均オフセットに対して適切な位置に、またはその近傍に展開するように目標とすることができることに留意されたい。計画位相は、標的構造位置に対する標的代替物位置の平均位置に基づいて選択されうる。
【0069】
時系列の3次元計画データセットから選択されたどの別個の位相も、時間平均位置に正確に対応していないはずであることに留意されたい。この差のために何らかの標的化エラーが残る可能性がある。さらに、追跡代替物の平均位置は、追跡代替物に対する標的の平均的構成に対応していないはずである。多少正確である解決策は、代替物と標的の間の時間平均関係を考慮することである。図14A〜Dで示すように、この時間平均は、取り込まれた時系列における何らかの特定の位相に対応していない可能性がある。そうではあるが、計算された時間平均に最も近い位相を選択することが便利であり、かつ利益がありうる。
【0070】
図14A〜Dを見ると、追跡代替物(黒丸で示される)と標的(白丸で示される)の間の2次元の相対的な動きの例である。図14A〜Dは、周期的な心臓運動の4つの位相における基準フレームに対する標的および回路の位置を示している。代替物と標的は共に、基準フレームに対して動くが、標的はまた代替物に対しても動く。
【0071】
図14Eで、計算された平均の標的中心は、精度の利点を提供することができる。平均の標的中心と追跡代替物の間の関係は、必ずしも図14A〜Dの別個の画像のいずれとも一致しないが、その構成は、オブジェクト間の平均的な分離に対応している。
【0072】
多くの放射線外科手術システムでは、CTボリューム・セットが、デジタル再構成画像(DRR)を作成するために使用される。治療中、ガイド画像が、患者を位置合せするためにこれらのDRRと突合せが行われる。DRRは、時系列の特定の位相に対するどれか1つのデータセットから構成できるので便利である。したがって、標的それ自体は、DRR中で特定するのは多少困難でありうるが、それは、追跡代替物を使用するための動機付けを提供する。ビームを標的に向けるために使用されるオフセットは、それにもかかわらず、時間平均関係に最もよくマッチする選択された位相から生成されたDRRの平均の標的位置に基づくことができる。代替的に、標的とオフセットの相対的な位置は、DRRを利用することなく、計算された時間平均を使用することができ、したがって、CTボリュームにおける標的の標的位置は、特定のDRRに対応しないはずである。例えば、基準の座標がf(k、t)である場合、基準を連結する距離は、
d(k、m、t)=|f(k、t)−f(m−t)|である。基準間のこのような連結距離は、
【0073】
【数1】

となり、式中、Nは基準の数である。連結距離は、{d(k、m、t)}として表され、それはM次元ベクトルである。次いで、時間平均距離を、
【0074】
【数2】

として計算することができる。次いで、ベクトル距離を計算すると、
【0075】
【数3】

となる。次いで、最小のΔ(t)に対応する位相を選ぶ。
【0076】
図15Aおよび15Bを次に参照すると、治療計画上の未追跡の動きの影響が、グラフィカルに示されている。これらの図は、肺静脈を電気的に隔離することを意味する治療計画に対する、犬の右上肺静脈に取り付けられた基準の測定された動きの影響を示している。標的損傷は赤(右の標的損傷、RTL)、および緑(左の標的損傷、LTL)で示され、一方、放射線の影響を受けやすい周囲組織構造は、紫(右気管支)、オリーブ色(左気管支)、および青(食道)で示される。動きを考慮することなく計画された線量は緑の輪郭で示され、一方、動きの影響を考慮した後に計算された線量は、白の輪郭で示されている。図15Aは、基準と標的の間のオフセットが平均で0.5mmだけ異なる場合の位相を選択することにより生ずる計画オフセットに加えて、6mmのピーク・ツー・ピーク振幅の反復される未追跡の動きがある場合の線量の影響を示している。図15Bは、オフセットのない反復する未追跡の動きの影響だけを示している。オフセットの影響は、未追跡の反復する動きの影響よりもはるかに大きい。
【0077】
図16を次に参照すると、コンポーネントのキットは、本明細書で述べたシステムおよび方法を用いて放射線外科治療を容易にする。これらのかつ/または他のコンポーネントは、概して、同梱されたコンポーネントおよび/またはシステムを使用するための説明書172と共に、1つまたは複数の気密密封したパッケージ170に含まれうる。キットは、経皮カテーテルの心臓への挿入中に使用されるすべての使い捨て部品を含むようにするのが好ましい。カテーテル174は、一般に、近位端178と遠位端180の間で延びる細長い可撓性のある本体176を有する。シース182は、カテーテル本体176を受け入れる管腔を有することができ、シースは、任意選択で、挿入および位置決めするのに適した小さな輪郭形状に基準を制限し、またシースはさらに、任意選択で、上記で述べた螺旋状の、または半径方向に拡大可能な固定構造を包み込む。シースおよびカテーテルの近位のハブ184、186は、任意選択で、迅速な交換手法を用いて、シースを、カテーテル本体176を介して、近位方向に引き抜くことを可能にする。同様に、カテーテルは、ガイドワイヤ190を受け入れるための迅速な交換ガイドワイヤ管腔を有することができるが、あるいはカテーテルをオーバザワイヤ(over−the−wire)手法で使用するための貫通管腔を有することができる。さらに、カテーテルは、遠位端に流れ指向バルーンを有することができ、それは、肺動脈などの標的部位へと下流方向に、カテーテルの迅速な展開を容易にすることになる。カテーテルは、計画画像を取得する前に、また放射線治療の全体を通して挿入されうるが、カテーテルは、通常、画像取得および治療計画が完了した後の治療日に、展開することになる。
【0078】
上記で述べたように、カテーテルは、受動的代替物を提供するために、放射線外科治療中に容易に可視化できる高コントラストのマーカを含む受動的な基準を含むことができる。代替的には、カテーテル174は、カテーテルの位置を示すために、信号を、電子的に、超音波的に、電磁式に、放射能を用いてなど、送信または受信する能動的な基準を含むことができる(また標的の位置をそれにより示すことのできるカテーテルの位置と標的部位の位置との間の知られた関係を用いる)。受動的な基準は、例えば、金、プラチナ、イリジウム、および/またはタンタル、または同様のものなどを含む小さな金属構造を備えることができる。カテーテルはまた、治療中に受けた線量、血圧、および他の生物測定学的信号を測定するためのセンサを含むことができる。
【0079】
1つまたは複数の殺菌したパッケージ170内に含まれるいくつかの例示的なコンポーネントを再度見ると、キットは、ヨウ素または他の皮膚洗浄ローション192、1%ザイロカインの小びん、または同様のものを含むことができる。これらの材料は、皮膚の穿刺部位に、麻酔性の皮膚の膨疹を作成するために使用することができる。導入シース194は、血液の引抜き、複数の同時薬物の注入、および他の静脈内維持液の送りを可能にするために、少なくとも1つの、またはおそらく2つの側部ポートを含むことができる。例示的な導入シース194は、2つのカテーテルを同時に配置できるように、2つのポートまたはチャネルを有する。ゴムの隔壁を各ポートの入口に設けることができ、例示的な導入器は、静菌性のものとして使用するために、導入器のシースに沿って皮膚の穿刺部位へと前進できる銀を含む化合物で含浸された3mmの綿の管状のカフ(cuff)を有する。
【0080】
針196は、ガイドワイヤ190およびシース194と組み合わせて使用されたとき、カテーテル174の静脈カニューレ挿入および安全な位置決めを可能にする。1組のEKG電極198は、心拍リズムの追跡を可能にし、一方1組のLEDまたは金の基準は、呼吸を監視するために胸壁に取り付けることができる。導体が、カテーテル本体176に沿って延びて、心臓組織と係合させるための螺旋の固定リード、または他の導電性の遠位構造を、近位のハブ186の近位のコネクタと結合させることができる。こうすることにより、カテーテルの遠位端にある固定リードまたは他の導電性の構造を、単独で、または他のEKG電極に加えて、心拍を監視するための心臓信号電極として使用できるようにする。キット・パッケージ170はまた、患者マットレスを、理想的には、真空バッグ・マットレスなど、患者位置の変化を制限するように構成されたマットレスを含むことができ、真空バッグは、任意選択で、患者が患者支持台上で快適に配置された後、バッグの形状を再構成し、固定するための真空ポートを有する、かつ/または別個のペレットを含む。
【0081】
カテーテルベースの基準システムの使用時に、またはその展開中に、針196(20ゲージの位置決め針など)を、内部の頸静脈、鎖骨下もしくは上腕静脈を特定するために使用することができる。キット中に、またパッケージ170内にさらに含まれる14ゲージ針(図示せず)を次いで挿入することができ、挿入された針を介してワイヤ190を配置し、次いで、針が引き抜かれる。皮膚は、ワイヤ挿入部位で、おおよそ2mmで切開することができ、組織の溝を拡大するために、(任意選択で、挿入シース194の遠位端で)拡張器が使用される。カテーテル174の遠位端180を、次いで、針を介して挿入することができ、カテーテルの遠位端の位置は、X線または蛍光透視法のガイドを用いて確認される。カテーテル174の遠位端180の近くの固定構造を、カテーテル本体176からシース182を近位方向に引き抜くことにより露出することができ、また遠位端は、心臓の標的組織に取り付けられる。カテーテル174の近位のハブ186が、次いで、患者の皮膚に縫合され、またはその他の形で取り付けられうる。
【0082】
蛍光透視法または超音波ガイドを用いる代替の取付け手法は、図8Fに関して上記で述べたように、カテーテル174の遠位端180において、小さな輪郭形状から、大きな輪郭形状へとポリエチレン製コーンを展開することを含むことができる。コーンは、カテーテルの近位部分の側部のスイッチをスライドさせることにより展開することができる。任意選択で、10または20ccの注射器または同様のものを用いて、コーンの開放端に真空を加えることもできる。真空を維持するために、活栓を閉じることができ、また注射器は除去される。コーンを、心臓内表面への吸引により取り付けることが好ましい。
【0083】
任意選択で、検出、ペーシング、または切除電極を、カテーテル・ハブ186のポートを介して、または導入シース194を介して配置することができる。能動的な基準または代替物が使用される場合、ナビゲーション・システムとロボット制御システムとの間の通信を確認することができる。
【0084】
例示的な実施形態が、理解しやすくするために、かつ例としていくつかの細部で述べられてきたが、いくつかの変更、修正、および適合は、当業者には自明のものでありうる。したがって、本発明の範囲は、添付の特許請求の範囲によってのみ限定される。
【関連出願】
【0001】
(関連出願データの相互引用)
本出願は、2009年7月17日に出願された米国特許仮出願第61/271、177号の米国法典35巻第119条(e)における利益を主張するものであり、そのすべての開示を、全体として参照により本明細書に組み込む。
【技術分野】
【0002】
本発明は、一般に、患者の体の運動する組織に放射線外科治療を行うための改良されたキット、システム、および方法を提供する。例示的な実施形態は、心臓の不整脈を治療するのに十分な放射線量を心臓の標的部位に当てることができる。比較的速い速度で動く組織の治療を可能にすると共に、本発明の実施形態は、患者に長期間の外傷または不便さを不必要に与えることなく、かつ放射線外科治療計画に利用可能な時間を不必要に制約することなく、心臓部位の顕著な変形、または相対的な整復に適合することができる。
【0003】
頭部、背骨、腹部、および肺の腫瘍および他の標的は、放射線外科手術を用いて治療に成功してきた。放射線外科手術の間、電離放射線の一連のビームが、標的部位に収束するように患者の外側から送られることが多く、放射線ビームは、しばしば、様々な位置および方向から発射された100万電子ボルトのX線ビームを含む。ビームを、腫瘍の生態を変化させるために、中間組織を介して標的組織に向けて送ることができる。ビームの軌跡により、中間的な、また他の周囲組織の放射線への曝露を制限することができ、標的における累積した放射線量により腫瘍を治療することが可能になる。CyberKnife(商標)放射線外科手術システム(Accuray Inc.(アキュレイ社))、およびTrilogy(商標)放射線外科手術システム(Varian Medical Systems(バリアン・メディカル・システムズ))は、2つの知られた放射線外科治療システムである。
【0004】
最近の放射線外科手術システムは、標的組織の位置を検証し、かつ患者の小さな動きを調整するために、撮像を治療システムに組み込む。いくつかのシステムはまた、呼吸中に運動する組織を治療できる能力を有しており、こうすることにより、放射線外科手術から利益を受けることのできる患者の数を大幅に広げてきている。心房性細動および他の不整脈を治療するために、心臓の選択された領域に向けて放射線を送ることを含む、生理的な動きを受ける他の組織の放射線外科治療もまた提案されてきている。
【0005】
心房性細動中、心房は、その組織化されたポンプ送り動作を失う。健康な洞調律では、心房が収縮し、弁が開き、また血液が心室または下側の心腔を満たす。心室は、次いで、収縮して、各心拍の組織化されたサイクルを完了する。それに反して、心房性細動は、心房を横断して上側の心腔を震えさせる、または細動させる電気的エネルギーの嵐として特徴付けられる。心房性細動中は、各心拍で、血液を心房から心室へと十分に空にすることができない。適切な損傷パターン(lesion pattern)に基づき、電離放射線を心臓に向けて送ることにより得られた瘢痕組織が、電気信号の再循環を阻止し、それにより心房性細動を減少させる、またはなくすことができる。
【0006】
提案の心房性細動および他の不整脈の放射線外科治療は、心臓患者に対して外傷を大幅に減少させることによる利益を提供するが、既存の放射線外科治療技法に対する改良も、このような療法の可能性を完全に実現することを助けるはずである。例えば、呼吸中などに動く腫瘍は、標的とする腫瘍に隣接して高コントラストのマーカ構造を外科的に埋め込むことにより目標化することができる。マーカは基準として働き、システムは、立体X線撮像技法を用いて間欠的に基準の位置を特定する。埋め込まれた基準と共に、心臓組織の詳細な画像(コンピュータ断層撮影またはCTなど)が次いで取得され、癌性の腫瘍を切除するために、一連の交差する放射線ビームが慎重に計画される。残念ながら、心拍周期と関連するより速い心臓組織の動作を適切に追跡するのに十分なX線画像を取ることは、周囲の組織を過度の量の画像取得放射線に曝すことになりうる。実際には、知られた放射線外科手術システムは、埋め込まれた基準を追跡するのではなく、呼吸および他の患者の動きを決定するために、患者の皮膚上に取り付けられた発光ダイオード(LED)の基準アレイの動きを監視することができる。立体X線は、その場合、呼吸よりもかなり遅い速度で取得されうる。X線画像で呼吸周期の追跡を間欠的に確認し、かつ修正することだけにより、このようなシステムは、過度の撮像放射線を加えることなく、適切に、呼吸運動を追跡することができる。呼吸および/または心拍と共に動く組織の治療に対して、様々な代替形態が提案されてきており、またこれらの提案は、結果的に不整脈治療システムで使用するのに実行可能であることが示されているが、そのいずれも、広範囲に使用されていないようである。一方で、心臓の組織中、またはその近傍に埋め込まれた基準構造に依存することは、心臓の腫瘍性の、かつ/または非腫瘍性の疾患の放射線外科治療の一般的な受入れに対して、重大な、かつ予期しない課題を提示する可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0007】
上記を考慮すると、特に、患者の外側から心臓の標的組織へと放射線を送ることにより、患者の運動する組織を治療するための改良されたデバイス、システム、および方法を提供することが望ましいはずである。理想的には、患者を付随的に撮像放射線に曝すことを大幅に増加させることなく、多くの患者にこれらの治療を利用できなくするほどシステム・コストを増加させることなく、不必要に治療の精度を低下させることなく、かつ/または心臓の拍動中に標的組織の比較的速い動きにもかかわらず、患者の健康な組織に対して不必要な付随的損傷を与えることなく、これらの改良が、既存の外科手術システムと互換性がある(またその変更により実施されうる)場合、それは特に利益があることになる。
【課題を解決するための手段】
【0008】
本発明は、一般に、患者の運動する組織を治療するための改良されたキット、システム、および方法を提供する。本発明の実施形態は、不整脈を軽減するために、これらの比較的速く動く組織を目標化するための既存の放射線外科手術システムの機能をしばしば高めて、心臓組織の改良された放射線外科治療を行うことができる。心臓組織の治療は、標的組織の位置を識別するための埋め込まれた位置代替物から利益をうることができ、その代替物は、任意選択で、心臓カテーテル挿入技法を用いて、心臓中にまたはその近傍に配置された基準マーカを含む。標準の放射線外科手法とは異なり、標的組織の治療計画画像が完了した後、これらの基準を配置することは大幅な利点がありうる。スケジュールされた放射線外科治療の日まで基準の埋込みを遅らせることにより、周囲組織を保存しながら、不整脈を軽減するための正確なビーム計画を開発することが可能になり、その計画は、通常、心臓における比較的精密な損傷パターンと、その損傷を導くための関連する一連の放射線ビームとを共に含む。多くの日数の間、埋め込まれた一時的な基準を有する心臓に対する障害を回避することにより、患者に対する総合的な外傷および不便さを減らすことができ、一方で、標的に向ける精度を高めるように、基準マーカを、心臓組織構造に対して望ましい位置に安全に配置することを可能にする。計画後に基準を埋め込むことに適合させる技法は、埋め込まれた基準位置を治療計画に登録することを含むことができる。能動的な基準を有する新規の心臓カテーテルおよび/または送出構造は、X線の必要性を制限する(かつそれにより付随的な撮像放射線への曝露を最小化する)ことができる。向上させた計画および追跡技法をまた使用することができ、本明細書で述べる放射線外科手術による心臓治療は、概して、既存の心臓外科治療システムの多くのコンポーネントと互換性がある。したがって、本明細書で述べる計画後に基準を埋め込む治療は、既存の治療手法とはいくつかの大きな変更を含みうるが、これらの技法は、既存の放射線外科治療システムに対して多大の投資および/または変更を必要とせずに、心臓の病状を治療するために、患者の外側から標的に向けた放射線の使用を大幅に拡大することを可能にする。代替的な実施形態は、基準を有する、または有しない代替物の埋込み後に計画画像が得られたとき、かつ/または計画が治療と同じ日に行われるとき、本明細書で述べる多くの態様を利用することができる。
【0009】
第1の態様では、本発明は、心臓を含む体を有する患者を治療するための放射線外科手術方法を提供する。心臓は、非腫瘍性の疾患を有している。本方法は、心臓から3次元の計画画像を取得するステップを含む。疾患を軽減するために、心臓の標的部位の電離放射線治療が、3次元の計画画像データを用いて計画される。治療が計画された後、体内に位置代替物が埋め込まれる。心臓の標的部位は、埋め込まれた代替物を参照して、体の外側から計画された放射線を標的部位に向けて送ることにより再建(remodel)される。
【0010】
代替の実施形態では、代替物の埋込みは、計画画像データのいくつかもしくはすべての取得の前に、かつ/または治療の計画のいくつかもしくはすべての前に実施することができる。いくつかの例示的な実施形態では、代替物を埋め込むステップ、標的部位を治療するステップ、および体から代替物を取り出すステップは、治療の日に行われる。心臓の計画画像データの取得、および治療の計画は、治療日の前の1つまたは複数の日に行われる。計画画像は、通常、治療日の複数日前に取得されることになり、それにより、少なくとも1日(しばしば、複数日、通常、少なくとも3日、少なくとも1週間、またはそれ以上)の間、医療の専門家および/または技術的にサポートする人員は、患者の非腫瘍性の疾患を軽減するために治療を計画することが可能になる。例えば、不整脈を治療する場合、適切な損傷パターンを、心臓の専門家(心臓病専門医、心臓外科医、電気生理学者、および/または同様の者など)の助けを借りて特定することができ、彼らは、不整脈を軽減するのに適した心臓中の標的部位を特定し、影響を受けやすい構造への付随的な損傷を回避するための放射線量勾配を識別し、かつ治療計画の他の詳細を特定するために、放射線外科手術の専門家(X線技師、放射線もしくは医療物理学者、および/または同様のものなど)と共に作業することができる。任意選択で、代替物、および同様のものを埋め込むために、心臓の標的部位を特定するための介入的心臓病専門医を含む他の医療専門家に相談することもできる。したがって、本明細書で述べる治療方法およびシステムの多くは、計画画像の取得と、放射線治療の開始との間のかなりの時間から利益を得ることになる。埋め込まれた撮像可能なマーカ、または他の代替物をこのような長い時間量の間、心臓中に残すことは不利益であり、また心臓は、計画画像データの取得と心臓の選択された部位の標的化との間に、患者の胸部内で大幅にシフトしている可能性があるので、代替物の計画後の埋込みは(これらの代替物に対する標的部位の位置の正確な特定と共に)、手技の利益および有効性を高めることができる。通常、治療の計画は、計画された放射線に基づいて心臓の推定される損傷を画定するステップを含み、理想的には、推定される損傷のグラフィカルな表示を、プロセスの一部として再検討することを可能にする。
【0011】
多くの実施形態では、代替物を埋め込むステップは、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップを含むことになる。代替物は、組織に結合され、したがって、代替物は、心拍で、かつ/または呼吸で誘起された運動を示すことができる。埋め込まれた代替物は、好ましくは、非共線性の1組の別個の基準マーカを備え、したがって、代替物と標的域との間の3次元オフセット方向を、基準マーカの画像から決定することができる。いくつかの実施形態では、代替物を埋め込むステップは、心臓の柔軟な、収縮性のある組織中に、細長い本体の螺旋構造をねじ込むステップを含むことができる。代替物を埋め込むステップはまた、組織が境界を成す管腔もしくは心腔で拡大可能な本体を拡大するステップも含むことができ、拡大可能な本体は、任意選択で、膨張可能なバルーン、一時的なステント状の構造、または同様のものなどを備え、それらは、周囲の組織と係合するように、冠状の血管内で、または拍動する心臓の心室内で、安全に、可逆的に拡大することができる。例示的な実施形態では、代替物を埋め込むステップは、能動的な3次元の位置指示器を組織に固定するステップを含むことができ、位置指示器は、埋め込まれた代替物の位置を、計画画像データに登録するために使用できる位置を示す信号を送信する。任意選択で、代替物の埋込み後に取られた画像は、登録を容易にすることができる。例えば、位置を示す信号が、代替物と体の外側に設けられた位置センサ(または送信器)との間のオフセットを示す場合、位置を示す信号を、心臓および位置センサを包含する埋込み後の画像データを用いて較正することができる。例示的な一実施形態では、位置を示す信号を較正するために使用される画像データは、計画後の較正画像データを含み、また較正位置感知信号は、カテーテル先端が心臓組織に係合している間に生成される。センサと体の間の位置関係は、較正画像データを取得する間、および位置感知信号を生成する間は維持される。より一般的には、位置指示器は、通常、超音波、または電磁式位置指示システム内で使用されるセンサまたは信号発生器を備える。標的部位を、間欠的な追跡検証画像の間における位置指示器からの位置を示す信号を用いて計画された放射線を送ることにより治療することができる。したがって、このような能動的な基準システムを使用する位置代替物は、X線を撮像する必要性を制限する(およびそれにより、付随的な撮像照射曝露を最小化する)ことができる。
【0012】
計画画像データは、代替物を埋め込むステップと、標的部位を治療するステップとの間で、登録データを取得することにより、埋め込まれた代替物に登録されうる。登録データは、しばしば、心臓および埋め込まれた代替物を包含する。登録データは、通常、第1の撮像モダリティを用いて取得された3次元の画像データを含む。計画画像データはまた、同じ撮像モダリティを用いて取得されうる。例えば、計画画像データは、コンピュータ断層撮影(CT)データを含むことができ、また登録画像データも同じCTシステム、または異なるCTシステムのいずれかで取得されたCTデータを含むことができる。登録および計画のために使用できる可能性のある他の撮像モダリティは、磁気共鳴撮像(MRI)、超音波(US)、陽電子放射断層撮影(PET)、単一陽電子放射型コンピュータ断層撮影(SPECT)、または同様のものを含む。他の実施形態では、登録データは、第1の撮像モダリティを用いて取得された3次元の画像データを含むことができるが、計画画像は、第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される。例えば、US撮像を、登録用に使用することができるが、計画はCT撮像を用いて行われる。
【0013】
いくつかの実施形態では、登録データは、3次元の画像データを含むことができる。心臓の表面は、計画画像データと登録画像データで共に、セグメント化されうる。登録を、次いで、セグメント化された表面を用いて行うことができる。血液中に入れた造影剤を用いて、画像データおよび/または登録データを取得するステップにより、心腔または血管の境界を成す血液/組織の界面の識別を容易に行うことができる。代替物の能動的な位置指示器は、登録を容易にすることができ、代替物はさらに、通常、埋め込まれた複数の別個の撮像可能なマーカを備え、したがって、通常、非共線性であるマーカは、3次元のオフセット方向を規定することができる。登録は、1つまたは複数の関連する心臓組織で規定される位置に、高コントラストの画像を有する基準マーカを埋め込むことにより容易に行うことができ、基準マーカは代替物として働く。例えば、カテーテルは、マーカを、冠状静脈口もしくはその近傍に、肺血管の間の分岐点の頂点もしくはその近傍に、または同様のものなどに埋め込むことができる。
【0014】
放射線治療源を埋め込まれた基準と位置合せするために、様々な手法を使用することができる。例えば、標的部位を容易に視認できない場合は特に、代替物の位置合せ画像データを取得することができる。代替物画像を、次いで、患者支持台を移動させることにより、所望の位置および方向へと移動させることができる。代替的な位置合せ手法は、放射線源を支持するロボットまたは同様のものに対する適切なオフセットを提供することを含むことができる。
【0015】
好ましくは、計画画像を取得する間、体からの心拍周期が監視される。時系列の3次元画像データセットを取得することができ、データセットは、心臓周期との心臓組織の動きを示すために、心拍周期の全体を通して分散させる。治療を計画するステップは、放射線の影響を受けやすい周囲組織を特定するステップと、周囲の組織を過度に照射することなく、標的部位に所望の放射線量を送るのに適した一連の放射線ビームを決定するステップとを含むことができる。標的部位を再建するステップは、体の心拍周期を監視するステップと、放射線を標的部位に送りながら、監視された心拍周期に応じて組織の動きの少なくとも一部を追跡するステップにより行うことができる。追跡するステップは、時系列のデータセットを使用することができる。
【0016】
代替物を埋め込むステップは、しばしば、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップと、代替物が心拍周期および呼吸周期と共に動くように、代替物を心臓に結合するステップとを含むことになる。代替物と標的部位の間の時間平均オフセットを、時系列の画像データセットを用いて決定することができる。標的部位を追跡するステップは、代替物の位置を決定するステップ、体の心拍周期を監視するステップ、および監視された心拍周期および呼吸周期、決定された代替物の位置、および時間平均オフセットを用いて、標的部位に放射線ビームを送るステップにより行うことができる。したがって、代替物と標的部位の間の心臓組織の変形を、必ずしもシステムが追跡する必要はない。
【0017】
例示的な実施形態では、時間平均オフセットは、心臓周期に対して、時系列の画像データセットから一連の3次元オフセットを特定するステップにより決定することができる。時間平均オフセットは、心臓周期の全体を通して適用することができるので、心拍周期中、代替物と標的部位の間の組織変形は追跡されない。時間平均オフセットは、時系列のデータセットの中から、画像データセットを選択することによりさらに決定することができる。選択されたデータセットは、測定された一連のオフセットの計算された平均に相当することが好ましい。選択されるオフセットは、必ずしも心臓周期の休止期に、または計算された時間平均オフセットそれ自体に相当する必要はない。他の実施形態では、特定された一連のオフセットの計算された時間平均を直接使用することができる。
【0018】
他の態様では、本発明は、心臓を含む患者の体を治療するための放射線外科手術システムを提供する。心臓は、非腫瘍性の疾患を有しており、システムは、心臓から3次元の計画画像データを取得するための画像取込みデバイスを備える。埋込み可能な位置代替物は、任意選択で、計画画像が取得された後に体内の心臓組織と結合可能である。放射線源が、体の外側から電離放射線の複数のビームを送出するために設けられる。プロセッサ・システムは、心臓の標的部位を特定するための入力を有する計画モジュールを含む。計画モジュールは、標的部位および計画画像データに応じて、放射線ビームの計画を生成する。プロセッサ・システムは、埋め込まれた代替物を参照して、放射線ビームを標的部位に向けて送るために放射線源と結合される。それにより、放射線ビームは心臓の標的部位を再建して疾患を緩和することができる。
【0019】
他の態様では、本発明は、患者の体を治療するために、放射線外科手術システムと使用するための治療キットを提供する。体は、非腫瘍性の疾患のある心臓を有する。放射線外科手術システムは、疾患を軽減するために、計画ごとに患者の体の外側から電離放射線の複数のビームを送出するための放射線源を有する。放射線外科手術システムはまた、放射線ビームを心臓の標的部位の動きと同期させるための複数の追跡入力を有する。キットは、患者の心臓周期信号を放射線外科手術システムの第1の追跡入力へと送出するために、患者に結合できる電極を備える。キットの細長い可撓性のある本体は、患者の血管を介して挿入可能な近位端および遠位端を有する。位置代替物を、心臓と動作可能な係合へと挿入可能であるように、可撓性のある本体の遠位端により支持することができ、したがって、代替物は心臓と共に適切に動いて、放射線外科手術システムの第2の追跡入力を生成することができる。任意選択で、遠位端は、心臓との動作可能な係合状態のまま留まり、したがって、遠位端は、治療中、心臓と共に動く。代替的には、代替物を、遠位端から回収可能に展開させることができ、また可撓性のある本体を、放射線ビームの照射中に除去することもできる。
【0020】
電極、可撓性のある本体、および代替物は、通常、パッケージ中に含まれることになり、パッケージは、しばしば、密閉してシールされ、またキットを使用するための説明書などを含む。キットのさらなるコンポーネントもまた、通常、パッケージに含まれることになる。
【0021】
放射線外科手術システムの第2の入力は、遠隔の撮像システムを含むことができる。代替物は、代替物と標的部位の間で3次元のオフセットを規定するために、展開されたとき、十分に非共線性構成を有する1組の受動的な、高コントラストの基準マーカを備えることができる。1組の基準は、実質的に直線的な挿入形状を有することができ、また代替物は、代替的に、能動的な超音波もしくは電磁式コンポーネントを備えることができる。能動的な代替物は、代替物(したがって、標的部位)の位置の追跡を容易にするための信号を第2の入力に供給する超音波または電磁式システム内に含まれうる。多くの実施形態では、細長い本体の遠位端を心臓の組織に取り付けるために、固定表面を設けることができる。固定表面は、半径方向に拡大可能な本体、真空シール本体、または螺旋の固定ねじにより規定されうる。
【0022】
治療キットの多くの実施形態は、体の呼吸運動の撮像を容易にするために、患者の体の露出した表面に取付け可能な体表面マーカを含むことができる。例えば、発光ダイオード(LED)を患者の胴部に取り付けることができる。LEDは、標準的な画像処理技法を用いて、呼吸を監視するために、標準のビデオカメラにより撮像することができる。
【0023】
多くの実施形態では、電極は、1組の心電図(EKG)電極中に含まれうる。患者の皮膚に、超音波撮像トランスデューサを取り付けるのに適した粘着性の貼布(patch)もまた、キットに含まれうる。代替物にアクセスし、埋め込むためのコンポーネントもまた含めることができる。例えば、放射線治療中に、患者の皮膚に取付け可能な近位端を有する導入シース、患者に挿入可能な遠位端、およびそれらの間の管腔を提供することができる。管腔は、細長い本体を密封状態で受け入れることができるが、通常、導入シースの弁部材が密封を行う。複数の代替物を支持するカテーテルを同時に配置できるように、さらなるポートまたはチャネルを設けることができる。例示的な実施形態では、キットはまた、心臓ガイドワイヤ、細長い本体の管腔を介して管腔もしくは心腔に送ることの可能な撮像造影剤、麻酔性の皮膚洗浄液、位置決め針、ガイドワイヤ、および/または同様のものなど、1つまたは複数のさらなるコンポーネントを含むことができる。
【0024】
他の態様では、本発明は、非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムを提供する。システムは、血管内から体内の心臓組織に回収可能に取り付けることのできる埋込み可能な位置代替物を備える。画像取込みデバイスは、心臓から、3次元の計画画像データを取得するように構成される。放射線源は、体外から電離放射線の複数のビームを送出し、また追跡システムは、代替物の位置に応じて位置データを生成する。プロセッサ・システムは、心臓の標的部位を特定するための入力を有する計画モジュールを含み、計画モジュールは、標的部位および計画画像データに応じて放射線ビームの計画を生成する。プロセッサ・システムは、追跡システムを放射線源と結合して、放射線ビームが心臓の標的部位を再建することにより疾患を軽減するように、埋め込まれた代替物を参照して放射線ビームを標的部位に向けて送る。
【図面の簡単な説明】
【0025】
【図1】本発明の実施形態で使用するための例示的なCyberKnife(商標)定位的放射線外科手術システムの図である。
【図2】心拍周期と呼吸周期の両方に関連する動きを示す、心臓の右心房の内側の下大静脈/三尖弁輪間峡部(cavotricuspid isthmus)の点の前方/後方の動きからの例示的なデータを示すグラフである。
【図3】放射線外科手術システムを用いて標的組織を治療するための方法を概略的に示す図である。
【図4】CTボリュームの時間シーケンスが取得される例示的な位相を示すEKG波形の図である。
【図5】治療システムのコンポーネントにより推定された心臓の損傷のグラフィカルな表示と共に、心臓の不整脈を治療するための標的部位に関する計画入力を含む、ユーザインターフェース表示の部分をグラフィカルに示す図である。
【図6A−6C】追跡代替物を提供するために、管腔および/または心腔中に展開されたカテーテルベースの基準を示す図である。
【図6D−6L】追跡代替物を提供するために管腔および/または心腔中に展開されたとき、カテーテルベースの管腔内固定構造、および/または非係留式の回収可能な管腔内固定構造、ならびにそれらの使用を含む、一時的に埋込み可能な代替物システムを示す図である。
【図7】標的部位および関連する一連の放射線ビームの計画後、基準が心臓に、または隣接する構造に埋め込まれる、心臓を治療するための放射線外科手術システムおよび方法を概略的に示す図である。
【図7A】標的部位および関連する一連の放射線ビームの計画前に、基準が心臓に、または隣接する構造に一時的に埋め込まれ、また治療後に取り出される、心臓を治療するための代替的な放射線外科手術システムおよび方法を概略的に示す図である。
【図8A−8F】運動している心臓組織を追跡するのを容易にするために、画像化が可能な、かつ/または能動的な基準を有する代替的なカテーテルベースの代替物システムを示す図である。
【図9A−9B】能動的な基準または同様のものを含む位置感知システムを較正するために、カテーテル先端をCTデータセットに登録するためのシステムおよび方法を概略的に示す図である。
【図9C】例示的な能動的カテーテル較正モジュールを概略的に示す機能ブロック図である。
【図10】埋め込まれたカテーテルベースの能動的かつ/または受動的な基準を治療計画に登録することを概略的に示す図である。
【図11】登録された治療計画および受動的な基準システムをグラフィカルに示す図である。
【図12】治療計画と治療システムの位置合せをグラフィカルに示す図である。
【図12A】能動的なカテーテル追跡モジュールの実施形態を概略的に示す機能ブロック図である。
【図13】治療計画に従って標的部位を治療するための方法を概略的に示す図である。
【図14a−14e】計算された平均の標的中心と共に、組織変形により生ずる可能性のある追跡代替物と標的組織の間の相対運動を概略的に示す図である。
【図15A−15B】固定されたオフセットが適用された場合(図15Aで)、およびオフセットが適用されない場合(図15B)、治療計画に対する動きの影響をグラフィカルに示す図である。
【図16】心臓の非腫瘍性の疾患の治療に関して、本明細書で述べたシステムおよび方法で使用するためのキットを概略的に示す図である。
【発明を実施するための形態】
【0026】
本発明は、概して、放射線外科手術システムを高い頻度で使用して組織を治療するための改良されたデバイス、システム、キット、および方法を提供する。本発明の実施形態は、心臓の組織など(心臓周期もしくは心拍周期と共に動く隣接する血管を含む)動きのある組織を治療するのに特によく適することができる。このような実施形態は、特に、呼吸周期と共に動く組織構造に関連するものなど、腫瘍を治療するために開発された構造および方法を利用することができる。心臓周期は、通常、呼吸周期よりもかなり速く、また心臓に対して有効な放射線外科手技を行うための全体的な治療時間か、かなり長くなりうる(通常、10分よりも長く、しばしば、30分を超え、多くの場合、2時間以上になる)。したがって、過度の撮像用放射線に曝すのを制限するために、蛍光透視法または同様のものを用いて、標的組織および隣接する組織の連続的な撮像を回避することは有利であることが多い。本発明の実施形態はまた、心臓の運動する組織中に長期間、基準を埋め込む何らかの必要性を回避することができ、それにより、患者に対する痛みおよび不快さを低減し、塞栓症の危険、血栓の蓄積、感染の危険などを最小化する。有利には、本発明は、計画画像データセット、および他の診断用測定値が得られた後、医師および他の医療の専門家に、適正な放射線外科の治療過程を計画するための適切な時間を与えることができる。
【0027】
本発明は、知られた放射線送出システムに含まれた、またはそれから派生した多くのコンポーネントを利用することができる。例示的な変更したCyberKnife(商標)の定位的放射線外科手術システム10が図1に示されている。放射線外科手術システム10は、ロボット・アーム14に取り付けられた軽量の直線加速器12を含む。画像ガイドシステム16は、ロボット・アーム14と標的部位の間の位置合せを向上させるために、立体診断X線源18および画像検出器20を含む。標的部位における組織は、高コントラスト画像を示さない可能性があるので、画像ガイドシステム16は、1つまたは複数の代替構造の位置を特定するために、画像処理技法を使用することができ、代替物は、通常、高コントラストの自然な組織構造(骨など)、または標的組織と相互に関係して動く人工的な、埋め込まれた基準マーカを含む。標的追跡はまた、特に呼吸に対応する胸壁の動きを特定するために、1つまたは複数の表面画像カメラ22を利用することができる。カメラ22は、患者の胸部上で視認可能な発光ダイオード(LED)、または他の高コントラストの基準マーカを監視することができる。患者支持台24は、患者(および治療部位)とロボット・アーム14との位置合せを行うのを容易にするように、位置合せアーム26により移動可能に支持されている。
【0028】
図2は、ブタの心臓の右心房の内側の下大静脈/三尖弁輪間峡部における点の前方/後方の動きをグラフィカルに示している。図で分かるように、動きには2つの成分が含まれている。すなわち、ゆっくりと変化する呼吸成分と、より速い心臓成分とである。本発明の実施形態は、これらの動き成分のいずれか、かつ/またはその両方に対処することができる。例えば、ロボット・アーム14は、全体の動きのうちの呼吸成分に対して、かつその心臓成分に対して共に補償するように、標的部位と同期して直線加速器12を動かすことができる。代替的には、ロボット・アームの同期運動は、少なくとも1つまたは複数の自由度における心臓成分を無視しながら、呼吸成分だけを追跡することができる。いくつかの実施形態では、心臓の動きで誘起されるエラーを低減する、またはなくすように、標的組織がロボットと十分に位置合せされている場合、ロボット・アーム14は、心拍周期のいくつかの部分への放射線ビームを制限するように直線加速器12にゲートを適用して、動きのうちの呼吸成分を追跡することができる。様々な自由度における様々な動き成分の重要性は変化する可能性があるので、動き成分追跡の異なる組合せ、動き成分の無視、および放射線ゲートを使用することができる。例示的な追跡手法は、2008年7月24日に公開された、Adler他の名前による米国特許出願公開第2008/0177280号でより詳細に述べられている(その開示全体を、参照により本明細書に組み込む)。
【0029】
次に図3を参照すると、比較的簡単な治療の流れ図40は、本発明の実施形態による放射線外科治療の前に、かつその間に使用されるステップを示すことができる。内部組織は、通常、コンピュータ断層撮影(CT)、磁気共鳴撮像(MRI)、超音波撮像、X線撮像、PET、SPECT、光干渉断層法、これらの組合せ、または他の撮像モダリティなど、遠隔の撮像モダリティを用いて、計画目的のため画像化42される。放射線再建のために実際に標的にされる組織構造は、標的組織の位置を特定するのに十分なコントラストの代替構造が画像データ中で視認可能である限り、必ずしも、画像中で視認される必要のないことに留意されたい。多くの実施形態で使用される計画画像は、時系列の3次元の組織ボリュームを含むことになり、その時系列は、通常、1つまたは複数の動き周期(心臓もしくは心拍周期、呼吸もしくは息をする周期、および/または同様のものなど)にわたっている。例示的な実施形態では、画像データは、容積測定または3次元的画像データを提供するために、心臓を介した一連のCTスライスを含む。時系列の3次元心臓画像は、心拍周期の全体を通して分散される時間で取得されることが好ましく、したがって、画像計画データは、心拍中の心臓組織の動きに関する情報を提供する時系列の3次元画像データセットを効果的に含む。図4は、典型的な心拍の心電図(EKG)波形を示しており、そこから、10個の位相が特定され、またそれに対して、10個の関連するCTボリュームが取得される。いくつかの実施形態では、標的組織は、10個のボリュームのそれぞれで概略的に示されうるが、あるいは標的の概要を、1つのCTボリュームで特定して、自動的に、他のCTボリュームに対しても追跡することができる。以下でより詳細に述べるように、他の代替形態は、時系列から3次元画像データセットの適切な1つを選択し、平均的な位置データセットを生成することなどを含む。そうではあるが、一連の3次元データセットの取得は、様々な市販のCTシステムのいずれかを用いて行うことができる。
【0030】
図3をさらに参照すると、画像ステップ42から取得された画像データに基づいて、計画44を標的部位における組織の治療のために作成することができる。計画は、通常、標的部位と、標的部位内で交差する一連の放射線ビームを含む。標的組織内の放射線量は、少なくとも望ましい再建効果を与えるのに十分なものである必要がある。通常、放射線量は、組織を切除し、心臓内の収縮性経路を抑制し、不整脈源性を抑制するなどを行うのに十分なものである。標的組織外の放射線量は、周囲の組織に過度の損傷を与えないようにするために、比較的急勾配で減少することが好ましく、指定された影響の受けやすい、かつ/または重要な組織構造における放射線量は、有害な副作用を回避するために、望ましい最大の閾値以下に維持されることが多い。
【0031】
図3および5を次に参照すると、例示的な治療計画モジュールおよびユーザインターフェースが、システム・ユーザに組織の表面を参照して、望ましい損傷パターンを入力することを可能にする。不整脈を抑制するように心臓の運動組織に治療を行うために、参照する心臓表面は、1つまたは複数の心腔および隣接する血管の血液/組織界面、または内側表面を含むことができる。代替的な実施形態は、参照表面として、心臓の外側表面を使用することができるが、表面は、計画画像取得ステップ42中に撮像造影剤を導入することにより、3次元の計画画像データからさらに容易に特定することができる。CTデータの各スライスにおける血液(付加された造影剤を含む)と心臓組織との間の境界は、心臓周期の位相と関連するボリューム・データセットの1つ、いくつか、またはすべてでセグメント化することができる。セグメント化された領域は、共に積み上げられ、または組み立てることができ、また平滑化技法を、スライスの境界間に適用することができる。こうすることにより、計画する医療の専門家は、心臓組織表面に対する一連の線または曲線として適切な損傷パターンを入力できるようにし、線は、所望の治療利益を与えるようにボリュームへと拡大される。代替的には、損傷パターンは、心腔のセグメント化された心外膜面と心内膜面との間の組織のボリュームを線で描くことにより画定することもできる。このような実施形態では、ユーザは、任意選択で、心筋壁面を参照して損傷を画定することもできる。心臓表面52に対する望ましい治療部位50の入力に関するさらなる詳細は、「Heart Tissue Surface Contour−Based Radiosurgical Treatment Planning」と題する米国特許出願第61/226,613号(整理番号021902−002100US)で提供されており、そのすべての開示を、参照により本明細書に組み込む。標的部位が特定された後、放射線の影響を受けやすい構造を特定することに対して、既存の放射線外科計画手法を実施することができる。同様に、既存の放射線外科手術の放射線ビーム計算モジュールを、得られる放射線分布を決定するために使用することもできる。
【0032】
望ましい損傷パターン(図5の左側で概略的に示されている)を入力すると共に、計画モジュールおよびユーザインターフェースは、好ましくは、心臓の表面に沿った実際の放射線照射量の推定を、好ましくは、推定された心臓表面の損傷54(図5の右側で概略的に示されている)の形で、出力することになる。推定された損傷54は、任意選択で、既存の放射線外科治療の計画装置から出力された放射線ビームおよび放射線量に基づき、壊死閾値を超えた放射線量を受ける心臓組織表面52の一部を表すことができる。代替的なパターンは、不整脈を抑制するように、治療的再建を行うために十分な放射線量を受けることになる組織の推定を表すこともできる。ユーザは、反復して計画治療モジュールに入力すること、およびモジュールから出力することに基づいて、計画を対話的に開発することができる。図5の心臓組織表面52上で示された推定損傷54の例示的な表示は、第1の(より低い)閾値を超え、第2の(より高い)閾値に満たない放射線量を受ける左心房の心内膜面の強調された(疑似カラー)領域を示している。代替的な表示は、結果的に組織に瘢痕を作り、壊死させ、切除するなどを行うのに十分な線量を受ける組織表面域を示すことができ、示された組織は、任意選択で、得られた組織状態に対応する色、または組織表面画像を用いて(例えば、通常、対応する健康な組織よりも白い瘢痕組織は、周囲の組織よりも白い色合いで示されるようになど)強調される。
【0033】
図3を(図1および図6A〜6Cと共に)再度参照すると、計画44の完了後、心臓の放射線外科治療46を、患者を患者支持台24上に配置すること、ロボット・アーム14で患者を位置合せすること、および直線加速器12からの計画された一連の放射線ビームを心臓の標的部位へと送ることにより開始することができる。しかし、上記で述べたように、心臓の標的部位は、画像ガイドシステム16により得られた画像中で、容易に特定できない可能性がある。心臓の軟組織の追跡を促進するために、心臓の標的部位と相互に関係して動く組織に、1つまたは複数の代替構造64を結合させるように、カテーテル60を血管62を介して前進させることが有利であることが多い。図6A〜6Cの実施形態では、カテーテル60は、2つのステント状構造68を備える遠位端66を有する。ステント状構造68は、周囲の管腔壁または心腔壁の組織表面に対して、基準64を支持するように、血管の管腔または心腔内で外傷を与えずに拡大することができる。ステント状構造68はまた、標的部位の放射線外科治療の後、半径方向に収縮し、近位方向に引き抜くことができる。図6A〜6Cで示されている例示的な方法は、一連の基準64が、左肺動脈LPA、右肺動脈RPA中に、また左右肺動脈の間の分岐の峡部もしくは隔壁部に隣接して、非共線性の構成で展開されている様子を示している。このような非共線性の構成は、基準の画像データに基づき、3次元オフセットを規定することを容易にするが、例示的なオフセットは、基準と標的部位(複数可)の間で延びており、図6Cで示すように、標的部位は、ここでは、左肺静脈LPV切除線、および右肺静脈RPV切除線で示されている。
【0034】
図3および7を次に参照すると、画像の取得42および治療の計画44に関連する時間は、総合すると、少なくとも1日のかなりの部分を示すはずである。放射線外科治療46それ自体も同様に、かなりの時間量を要するはずあり、基準の外科的埋込み70および取出しも72また、何らかの時間を要する。一般に、埋め込まれた構造を、必要以上の時間にわたって心臓組織中に、またはそれに隣接して残すことを回避するのが望ましいので、基準の埋込み70および基準の取出し72を放射線外科治療の日74に行い、画像42および計画44を、治療日の前に実施するのが利益のあることが多い。しかし、この計画後の基準の埋込み70の結果は、治療日の前に、基準画像および位置を計画画像データで利用できないことになる。この理由で、計画後の基準の埋込みは、標準の放射線外科治療の実務に反する可能性のあることに留意されたい。
【0035】
上記を考慮すると、例示的な治療法76は、概して、何らかの人工的な、または埋め込まれた追跡基準を使用することなく、CTデータ42の形で計画画像を取得することを含む。血液−心臓組織表面の識別を容易にするために、画像取得中に、通常、造影剤を使用することになり、また計画画像データは、好ましくは、時系列の3次元データセットを含み、各3次元データセットは、通常、心臓組織を介する一連のオフセット平面スキャンを含む。
【0036】
上記で述べたように、計画は、特殊化した心臓治療計画モジュール80と共に、汎用の放射線外科治療計画モジュール78を用いて行うことができる。汎用の計画モジュール78は、例えば、計画画像の平面CTスライスのいくつかにおけるアイソセンタの、または他の照射標的プロファイルを特定するために、腫瘍の治療中に使用されうる。放射線に影響されやすい周囲組織をさらに平面CTスキャンで特定することができ、この入力に基づき、汎用の治療計画モジュールは、一連の放射線ビームを生成し、かつ線量情報を、CTスキャンの平面に関連付けることができる。組織表面ベースの損傷パターンを用いて、心臓の非腫瘍性の疾患(不整脈など)の治療を容易にするために、心臓組織計画モジュール80は、汎用の計画モジュール78の機能とインターフェースをとる(またそれを利用する)ことができる。
【0037】
心臓組織計画モジュール80は、本明細書で述べる他のデータ処理モジュールと同様に、通常、コンピュータ処理ハードウェアおよび/またはソフトウェアを備え、ソフトウェアは、通常、本明細書で述べる関連する方法ステップの1つ、いくつか、またはすべてを実施するためのコンピュータ可読命令またはコードを使用する有形の媒体の形をしている。適切な有形の媒体は、ランダム・アクセス・メモリ(RAM)、読み出し専用メモリ(ROM)、揮発性メモリ、不揮発性メモリ、フラッシュメモリ、磁気記録媒体(ハードディスク、フロッピー(登録商標)ディスク、または同様のものなど)、光記録媒体(コンパクト・ディスク(CD)、デジタル・ビデオディスク(DVD)、読み出し専用のコンパクト・ディスク、メモリ・スティック、または同様のものなど)を含むことができる。本明細書で述べる様々なモジュールは、単一の汎用コンピュータの単一のプロセッサ・ボードで実施することができるが、あるいは任意の1つまたは複数のモジュールは、複数の所有権を有する、または市販のコンピュータ構造のいくつかの異なるプロセッサ・ボード上で動作することのできる任意の1つまたは複数のモジュールで実施することができ、コード、データ、および信号は、バス、ネットワーク(イーサネット(登録商標)、イントラネット、またはインターネットなど)を用いて、有形な記録媒体を介して、無線遠隔測定法を用いて、または同様のものなどにより、プロセッサ・ボード間で送信される。コードは、モノリシックのソフトウェア・プログラムとして記述されうるが、通常、広範囲なソフトウェア・アーキテクチャ、データ処理構成などのうちのいくつかで、異なる機能を処理する様々な別個のサブルーチンおよび/またはプログラムを含むことになる。そうではあるが、プログラムまたはハードウェアの機能性を、別個の機能モジュールへと分けることは、本発明の様々な態様の機能を理解する上で有益である。
【0038】
例示的な心臓組織計画モジュール80は、CyberKnife(商標)放射線外科手術システムのMultiplan(商標)計画モジュールとインターフェースをとる。平面CTスキャンに形状を入力するのではなく、心臓計画モジュール80のユーザインターフェースは、組織表面上に線および/または曲線を画定することができ、心臓組織計画モジュールは、CTスキャン平面上の関連する形状を特定する。心臓組織計画モジュールはまた、(概して、図5に関して述べたように)心臓計画モジュール80または放射線外科手術計画モジュール78のディスプレイ上に、心臓組織の推定される損傷をグラフィカルに表示する。こうすることにより、患者の治療を計画する1人または複数の医療の専門家が、損傷パターンが適切であり、かつ望ましい治療の利益を生成できることを検証できるようになる。例示的な心臓組織計画モジュール80はまた、患者および/または心臓と、放射線外科治療システム10との間の全体の位置合せ不良の影響を(関連する出力を医療の専門家(複数可)に送って)シミュレーションし、かつ/または推定された損傷位置および形状に対する追跡エラー(理想的には6個の自由度で)に関する出力を、計画する医療の専門家に送る。
【0039】
計画44が完了した後の暦日(calendar day)に、また好ましくは、治療日74に、患者は、追跡代替物または基準の外科的な埋込み70を受けることになる。いくつかの実施形態では、1つまたは複数の基準は、治療が開始される日に先立って埋め込むことができ、かつ/または治療は、1日を超えて行うことができる(基準は、任意選択で取り出され、新しい基準が治療の間に埋め込まれる)。好ましくは、基準は、血管を介して心臓の組織へとカテーテルの遠位端を前進させることにより埋め込まれ、細長い可撓性のあるカテーテル本体の遠位端は、基準が標的組織と相互に関係して動くように、高コントラストの基準セットを心臓組織に結合する。例示的な結合機構は、図6A〜6Cに関して上記で述べたように、(任意選択で、螺旋コイル、編組み、または同様のものを含む)半径方向に拡大可能なバルーンもしくはステント状構造を含む。これらの拡大可能な本体は、周囲のカテーテル・シースから(拡大可能な本体から近位方向にシースを引っ張ることによるなど)解放されたとき、半径方向に拡大するように偏らせることができる、あるいはバルーンの前方へと液(通常、食塩水などの液体、または空気などの気体)を導くことにより、拡大可能な本体の近位端と遠位端の間の長さを短縮することによりなど、拡大させることができる。拡大可能な本体は、通常、拡大可能な本体上でシースを前進させることにより、膨張液を空にすることにより、螺旋コイルの線条をシース中に引き込むことなどにより半径方向に収縮するように構成される。代替的な、広範囲の可逆的に拡大可能な構造がステント分野で知られており、その多くのものを修正して心腔の内側、または隣接する血管内で、代替物を心臓の組織に一時的に取り付けるために使用することができる。
【0040】
図7Aは、本明細書で述べる本発明の多くの態様を使用できる代替のワークフローを概略的に示している。代替の治療ワークフロー76’では、基準の埋込み70は、計画CT42または他の計画画像を取得する前に行うことができる。計画画像が取得された後、患者は、別の日に治療を行うために(治療計画44に1日の少なくともかなりの部分を使用できるように、なお、計画を立てるには、完了するのに複数日必要であることが多い)、帰宅することができる。係留された管腔内代替システム(その場合、基準は、細長いカテーテル本体により、管腔内のアクセス部位に係留されたままである)は、任意選択で、1日を超えて一時的に埋め込まれる可能性もありうる。代替的に、係留されない管腔内代替システムをそれに代えて使用することが利益のある可能性もある(その場合、一時的に埋め込まれ、解放される固定構造は、管腔内または心腔内で基準を支持するが、カテーテル本体が血管アクセス部位と代替システムとの間で延びることはない)。このような係留されない固定構造は、基準の取出し72中に、その後、カテーテルを結合し、管腔内で代替システムを再度捕捉し、回収することを容易にするように構成されることが好ましい。さらに、ワークフロー76’の代替の実施形態は、入院患者および/または同日治療手法を使用することもできる。例えば、基準の埋込み70、計画画像の取得42、治療計画44、治療システムと患者の位置合せ136、および治療46、さらに任意選択で取出し72は、1日のうちに完了するように調整することができ、患者は、治療期間中、病院または他の治療施設に留まることも多い。関連する代替の実施形態は、1日から2日、または3日を超えて(通常、1週間未満であるが)延びる可能性があるが、少なくとも取出し72(および任意選択で、治療それ自体)が、2日、3日、または1週間以内で行われ、しばしば、その間、患者は病院または他の治療場所に残ったままである。基準の取出し72はまた、手順の最後で通常行われる。
【0041】
図6Dおよび6Eを次に参照すると、例示的な係留されない代替システムを理解することができる。図6Dは、共に結合された2つの対向する螺旋ワイヤを備える一時的に埋込み可能な固定構造を示す。この例示的な係留されない固定構造は、カテーテル構造を用いて管腔内で展開され、回収することができ、またそれは、画像化中、計画中、および/または治療中に、1つまたは複数の基準を一時的に支持することができる。図6Dの固定構造は、米国カリフォルニア州メンローパークのCrux Biomedical Inc.による大静脈フィルタとして使用するために開発された(またはそれから導出され、あるいは変更された)構造を使用することができ、また固定コンポーネントおよびこの実施形態の使用は、ジョンソン他の名前で2008年6月19日に公開された、「Endoluminal Filter with Fixation」と題する米国特許出願公開第2008/0147111号(2008年1月4日に出願され特許出願第11/969、827号)を参照するとさらに理解することができ、その開示の全体を、参照により本明細書に組み込む。図6Dの構造を展開するために使用される方法およびカテーテル構造(ならびに再捕捉および回収のために使用される方法およびカテーテル)はまた、’111公開を参照することにより理解することができる。本明細書で述べられる放射線外科治療システムおよび方法と共に使用される図6Dおよび6Eで分かるように、1つまたは複数の高めたコントラストの受動的な基準を、2つの対向する外側の螺旋ワイヤ、またはその両端で共に結合された他の線条に(直接または間接的に)固定することができ、ワイヤの交差部および結合部が、それらの間のフレームを画定する。代替の実施形態は、外側の螺旋ワイヤに取り付けられた能動的な基準を使用することができ、能動的な基準は、任意選択で、係留部を有する、または電源を内蔵している。外側の螺旋ワイヤの間で延びる図6Dで示されたフィルタ線条要素を除去する、または除外することができるが、あるいはいくつかの実施形態では、一定の位置に残すこともできる。交差する螺旋ワイヤは、2つ、3つ、または複数のフレームを画定することができる(図6Eで示す)。
【0042】
図6Fおよび6Gを次に参照すると、図6Dおよび6Eの係留されない固定構造を有する代替システムを用いるための方法を理解することができる。図6Fでは、2個の2フレームの一時的管腔内固定構造が肺動脈中に埋め込まれて、心臓の運動する組織の追跡を容易にするように、非共線性の基準を支持する。肺動脈弁および右心室が、方向付けのために特定される。図6Gでは、左心房に隣接する左の上肺静脈LSPVおよび下肺静脈LIPVを囲み、かつ右の上肺静脈RSPVおよび下肺静脈RIPVを囲む標的部位は、冠状静脈洞CS内に一時的に埋め込まれた複数のループまたはフレームを有する代替システムの支援により、追跡することができる。展開する前に、係留されない代替システムは、送出および/またはガイド・カテーテルの内側に事前に搭載しておくことができる。ガイド・カテーテルの内側の細長い可撓性のある本体(任意選択で拡張器)は、冠状静脈洞、下大静脈(IVC)、上大静脈(SVC)、肺動脈、または他の望ましい血管などの血管の内側に留置されるように、代替システムを押すプランジャとして働く。一般の送出システムも使用することができる。治療が完了した後、スネアなどの回収カテーテルが、例えば、固定構造の近位端に設けられた突起もしくはフード上を把持することにより、留置された代替システムを再度捕捉し、回収することができる(図6Dを参照のこと)。固定構造は、任意選択で、Crux(商標)IVCフィルタ上に設けられたものと同様の、螺旋ワイヤの外側表面から半径方向に突き出たアンカーを有し、血管壁に良好に固定させることができる。肺動脈に基準システムを送出するために、Swan−Ganz(スワンガンツ)カテーテルと同様の流れ指向(flow−directed)バルーン・カテーテルを使用することができる。その後に続いて、ガイドワイヤを送出部位に挿入することができる。流れ指向バルーンが膨張して右または左の肺動脈を選択する間に、ガイドワイヤはまたねじられる可能性もある。次いで、Swan−Ganzは引き抜かれるがガイドワイヤは定位置にあり、代替システムの事前に搭載されたカテーテルが、ワイヤを介して標的部位へと進む。代替システムは標的部位で展開する。代替システムを後に残して、ガイドワイヤおよび送出カテーテルを引き抜くことができる。代替的には、流れ指向バルーンは、基準送出システムと一体化することができる。したがって、代替システムは係留される、かつ/または係留されない(留置される)。
【0043】
図6H〜6Lを次に参照すると、さらなる代替の固定構造が示されている。図6Hの実施形態では、螺旋のステント状固定構造が、血管壁に当接する基準を支持しており、血管内で固定構造は拡大されて、通常、螺旋の線条構造が関連するシース内から解放されている。図6Iの実施形態では、螺旋のステント状固定構造は、代替システムの遠位端の近傍に流れ指向バルーンおよび/または展開カテーテルを含み、血管内で下流へと展開カテーテルの前進をガイドしようとする。前と同様に、基準は周囲の血管の壁に当接することになり、また基準を、例えば、1cmごとになど、規則的な、または変化する距離で、固定構造の螺旋の長さに沿って分離することができる。図6Jの実施形態では、軸方向に一連の拡大可能なバスケット状の構造が、円周方向に一連の可撓性のある部材によりそれぞれ画定されている。プルワイヤは、患者の外から、ある長さのバスケット状構造を短縮させ、その場所でその直径を拡大することを可能にする。バスケットの遠位端における流れ指向バルーンは、カテーテルを下流方向へとガイドするのを助け、またプルワイヤに、またはバスケットの中心に沿ったままである他の構造に沿って基準を取り付けることにより、バスケットが拡大したとき、基準は、血管の中心に留まることができる。図6Kおよび6Kiは、血管に沿って下流方向に、展開カテーテルの遠位の前進をガイドするのを助けるための任意選択の流れ指向の遠位バルーンを備えた、一連のスポークおよびホイール・バルーン(任意選択で、カートホイール・バルーンと呼ばれる)を概略的に示している。基準をまた、1つまたは複数のバルーンの中心部に沿って取り付けることができる。図6Lは、編み組みされた管の中心に沿って配置された基準を支持するプルワイヤを備えた編組み管を含む代替の拡大可能な支持構造を概略的に示している。管の近位端に対してプルワイヤを引っ張ることにより管を短縮することは、管を半径方向に拡大する結果となるが、基準は、実質的に血管の中心に沿ったまま残ることになる。
【0044】
図8A〜8Cおよび8Eは、基準を展開し、かつ基準64を心臓組織Tに一時的に取り付けるためのさらに代替的なカテーテル構造を概略的に示している。カテーテル86、88、90、91は、カテーテルをその軸の周りで回転させることにより、組織Tの中へとねじ込むことのできる螺旋ねじ92を用いて、組織Tに基準64を取り付けるが、例示的な螺旋ねじは、螺旋の心臓ペースメーカ・リードと同様の構造である。基準64は、弾性的に、または可塑的に可撓性部材により支持されて、基準が、周囲のシースによる実質的に直線の構成から、組織Tと係合する非共線性に展開された構成へと拡大することを可能にする。基準64の非共線性に展開された構成は精度を向上させ、それにより、(図8Cのオフセット94により概略的に示される)3から6次元のオフセットが、基準の3次元または立体画像に対して決定されうる。標的組織は、治療中に基準からの3から6次元オフセット94を用いて特定されうるので、これは、追跡精度を向上させることができる。カテーテル91の弾性のある構造は、螺旋ねじの周囲で少なくとも部分的に、螺旋ねじと交差する組織と係合する円弧または投げ輪を形成するように偏倚される。図8Eは、代替的な基準展開カテーテル89を示しており、その場合、カテーテルの遠位端に設けられた展開可能なコーン89aが、カテーテルの近位端に結合された注射器89bなどの真空源を用いて、カテーテル内に真空を加えることにより、心臓内の組織表面Tに一時的に取り付けられうる。基準カテーテル89cは、次いで、展開カテーテルの近位端のポート89eを介して、遠位方向に基準カテーテルを進ませることにより、展開カテーテル89の遠位端に隣接して配置することができる。さらなる監視もしくは切除デバイスをまた、ポートを介して遠位方向に進めることができ、またコーンを展開することは、作動子89fを用いて、展開カテーテルの近位端から行うことができる。基準89dは、基準カテーテル89dの遠位端に、またはその近傍に取り付けることができる。
【0045】
本発明で使用するように適合されうる、さらに他の代替のカテーテルベースの基準構造は、図8Dで示されており、また「Device for Measuring Administered Dose in a Target」と題する米国特許出願第2008/0292054号でより詳細の述べられている(そのすべての開示を、参照により本明細書に組み込む)。その参考文献で述べられた例示的な実施形態は、前立腺ガンの治療を容易にするための尿道カテーテルを含むが、同様の構造を、図8A〜8C、8E、および図6A〜6Cに関して上記で述べた螺旋ねじ92、またはステント状構造68を含めることにより、変更することも可能である。いくつかの実施形態は、図8Dで示すカテーテル140の線量測定コンポーネントを含むことができるが、多くの他の実施形態は、線量測定機能を除外するはずである。例示的なカテーテル140に関して、その構造は、電気的なガイド142、および電気的なマーカ143を備えた細長い可撓性のあるカテーテル本体141を含む。マーカは、患者の中の標的域の位置と、患者の識別IDを決定するために使用される送信器Txを備える。インプラントはさらに、標的域に投与された線量を検出するために使用される線量センサ145と線量識別Dose/IDとを有する、組み合わされた線量および識別ユニット144を備える。
【0046】
組み合わされた線量および識別ユニット144は、電気的ガイド142に接続されるように構成されたコネクタ146を備え、線量識別Dose/IDと電気的マーカ143における患者のIDを比較することにより、正しいユニット144が接続されたことを保証することができる。カテーテル(およびカテーテルが取り付けられた組織)の動きが、カテーテルの送信器信号ベースの位置と、カテーテルの画像ベースの位置などとの間のオフセットを決定するので、送信器Txには、カテーテル140の位置を検証するために、組み合わされた線量および識別ユニット144を介して電力が供給されうる。組み合わされた線量および識別ユニット144は、ワイヤ148を介して外部に配置された集積回路147に接続され、また集積回路147は、線量変換と関連する機能を含むが、それは、米国特許出願公開第2008/0292054号でより完全に述べられている。適切な代替の能動的な基準は、しばしば、基準の位置を特定するために、(周囲組織またはそれを含まない埋め込まれた基準の画像を取得するいずれの撮像システムとも独立した)基準との電磁式、または超音波送信を利用する。適切な電磁式位置感知構造は、Biosensewebster(バイオセンス・ウェブスタ)から市販のCarto AcuNav(商標)カテーテルを含む様々な供給元から購入することができ、様々な3次元ガイド追跡構造は、米国バーモント州のAscension Technology Corporation(アセンション・テクノロジー社)から市販されており、超音波センサおよびシステムは、カナダのSonometrics Corporation(ソノメトリクス社)から市販されており、EnSite(商標)心臓マッピング・システムは、米国ミネソタ州セントポールのSt.Jude Medical(セント・ジュード・メディカル)から市販されており、以下同様である。これらの能動的な基準は、基準の位置、基準の動き、および同様のものなどを示す信号を送信し、かつ/または受信するが、この信号は、標的組織を追跡するための放射線外科治療システムのプロセッサへの入力として使用される。
【0047】
本明細書で述べる基準、固定構造、および/または代替システム(ならびに任意選択で、低い輪郭の挿入形状から、周囲の管腔壁に半径方向に係合する一時的に固定される形状へと半径方向に拡大する実施形態)は、以下の1つまたは複数の中に、またはそれに対して取り付けることができる。すなわち、冠状静脈洞、左肺動脈、右肺動脈、肺動脈幹、右心室流出路、下大静脈、上大静脈、肺静脈、左心室流出路、大動脈弓、上行大動脈、下行大動脈、および冠状動脈、ならびに心臓の他の組織構造中に、かつ/またはそれに対して取り付けることができる。代替システムの(任意選択で、ねじ込み式の取付けデバイス、および/または真空取付けを使用するものを含む)他の実施形態は、右心房、心房中壁、左心房、右心耳、左心耳、右心室、心室中隔、および左心室の壁に取り付けることができる。展開可能な、または固定された、基準を支持する環状リングを含むさらに他の代替の実施形態を使用することができ、それは、三尖弁輪、僧帽弁輪、肺動脈弁輪、および/または大動脈弁輪に適合することができる。
【0048】
治療計画は、基準の埋込み前に開発されることが多いので、計画された標的に対する基準の位置が特定されると、標的組織の追跡は容易になる。治療計画を埋め込まれた受動的、かつ/または能動的基準に登録するためのプロセスは、図7、10、および11を参照して理解することができる。開始点として、治療計画104は、計画画像データ108との知られた位置関係106を有することが好ましい(これらの要素は、図10に概略的に示されている)。関係106は、上記で述べたように、計画画像データを用いて生成された画像に対する所望の損傷パターンを入力することにより達成することができる。治療計画104に対する基準64の位置を特定するために、登録画像データ110を、基準の埋込み70の後に取得することができる。登録画像データ110は、通常、心臓組織と、少なくともいくつかの埋め込まれた基準、特に、受動的な高コントラストの基準マーカ構造とを共に包含する3次元画像データを含むことになる。組織表面などの識別は、再度、血流中に造影剤を入れることにより容易に行うことができる。これは、心臓組織表面および心臓/血液界面をセグメント化することを容易にする。登録画像データ110および計画画像データ108から、心腔内および心臓の血管に隣接する組織/血液界面を用いて、計画画像データセットと、登録画像データセットとの間の関係112を特定することができる。例示的な関係112は、理想的には、変換マトリックス、オフセット、または同様のものなどを含む、マッピングもしくは変換を含むことができる。血管/組織界面を利用するのではなく、代替の画像/登録の関係112は、心腔の先端、弁輪平面、心門中心、および血管の方向付け、分岐位置、または同様のものなど、一連の別個の組織目印を特定することにより決定することができる。心臓組織は、心臓の外側の解剖学的目印に対して、計画画像データセット108の取得と、登録データセット110の取得との間でかなり動く可能性があること、および心臓および/またはそのコンポーネントの形状が(拍動周期の同様の位相であっても)変形する可能性のあることに留意されたい。したがって、本発明の実施形態は、計画/登録画像の関係112として、単純な固定された変換を使用することができるが、他の実施形態は、任意の様々な変形可能な登録技法を使用することもできる。
【0049】
計画/登録画像の関係112の特定を容易にするために、登録画像データセット110を、計画画像データセット108を取得するのに使用されたものと同じものである画像モダリティを用いて取得することができる。例えば、計画画像データセットは、CTデータを含み、登録画像データセット110もまたCTデータを含むことができる。代替的には、MRIデータが、計画画像データセット108のために使用された場合、基準の埋込み後、MRI取得を、登録画像データセット110に対して行うことができる。同様に、計画画像データセット108が、超音波データを含む場合、登録画像データセット110はまた、超音波データを含むことができる。そうではあるが、他の実施形態は、計画画像データセットの取得のために使用されたものとは異なる画像モダリティを、登録画像データセットを取得するために使用することができる。任意の広範囲な3次元画像データの融合、3次元の固定変換、および/または3次元の変形可能な変換技法を、異なる撮像モダリティの適用にもかかわらず使用することができる。
【0050】
例示的な実施形態では、登録画像データ110は、能動的な基準システムの少なくとも1つのコンポーネントを含むことができる。例えば、図9A、9B、および10は、カテーテル先端を、高い絶対的な精度で、(CTデータなどの)3次元の画像データセットに登録するための方法およびシステムを示している。標準の能動的なカテーテル・ナビゲーション・システムは、磁場の不均質性、または電気的インピーダンスの仮定に起因する幾何的歪みを受ける可能性がある。類似のエラーが、超音波または他のナビゲーション・システムでも提示されうる。これらの追跡技術は、例えば、冠状静脈洞内の撮像可能な電極などに関して、良好な相対位置測定を行うが、その絶対的精度は、体外からの放射線外科治療にとって望ましい程度に良好ではない可能性がある。
【0051】
図9Aおよび9Bは、能動的な基準カテーテルのナビゲーション・システムの送信器122を概略的に示しており、例示的な送信器は、立方体の形状をしている。能動的な基準は、位置基準の位置を感知するカテーテルの遠位端の近傍に配置されたセンサを備えることができる。能動的な基準の基準座標系は、立方体形状の送信器122のコーナに位置づけることができる。代替的なシステムは、この外部送信器を外部のセンサと置き換えることもでき、能動的な基準が関連する送信器を備える。そうではあるが、患者は、患者支持台124上に横たわることができ、患者支持台はまた、外部の能動的な基準センサ122もしくは送信器を支持することができる。いくつかの実施形態では、患者支持台124は、患者支持台に対する患者の動きを抑制するために、真空のバッグまたは他の構造を備えることができ、また患者支持台を(患者およびナビゲーション・システムのコンポーネントをそこに取り付けた状態で)移動可能にすることもできる。
【0052】
移動可能な患者支持台124、能動的な基準送信器122、および患者は、CTスキャナ126の治療台上に配置されるなどにより、撮像のために配置される。その結果、登録画像データセット(その画像128を図9Bで示す)は、送信器立方体122を含み、したがって、送信器立方体は、患者の組織および任意の他の埋め込まれた基準と共に、CTデータセット中で視認可能である。
【0053】
いくつかの実施形態では、患者支持台124および患者を、電気生理学検査室に移動して、プラットフォームまたは電気生理学テーブル上に配置することができ、患者支持台124の真空バッグが、送信器122に対する患者の動きを抑制する。能動的な基準位置センサを有するカテーテルが患者の中に導入されて、心臓組織へと進むことができ、能動的な基準ナビゲーション・システムに、能動的な基準から位置データを決定することを可能にする。CTデータセット中のセンサ122の位置が知られており、また能動的な基準ナビゲーション・システムの位置および方向もまた知られているので、能動的な基準マーカを、能動的な基準のナビゲーション・システムにより特定されたCT画像データセット位置に対して重畳することができる。したがって、能動的な基準130および組織、受動的な基準、ならびに治療計画104の間の関係もまた、特定されうる(図10を参照のこと)。能動的な基準位置情報を心臓の位相と相互に関係付けることにより、また心拍周期を通して、能動的な基準位置に対する標的部位の関係(計画画像データにおける時系列の3次元データセットから決定することができる)を知ることにより、能動的な基準のデータ信号は、標的部位の追跡を促進することができる。
【0054】
登録ステップ102の結果として、基準と治療計画の間の3次元位置オフセット(または1つまたは複数の変換マトリックス)を決定することができ、したがって、基準は、有効に治療計画132に登録される。
【0055】
図9Cを次に参照すると、例示的な較正モジュール200のブロック図は、患者組織を治療計画に登録するのを助けるための、かつ/または患者を放射線外科治療システムと位置合せするのを助けるための代替のシステムおよび手法を示している。較正は、例えば、患者が患者支持台24上に存在する前に、または患者を放射線外科手術システム10の患者支持台24上に乗せた後に、施療するのに先立って行うことができる。較正は、能動的な基準システムの座標系(Ascension Technology Corp.の3D追跡システムの追跡座標系など)と、放射線外科手術システム10の座標系(CyberKnife(商標)放射線外科手術ロボット座標系など)との間で、マッピング関数φを決定することができる。すなわち、
CKp=Φ(ASp) 式1
式中、CKpは、ロボット座標系における点であり、またASpは、能動的な基準追跡座標系における同じ点である。マッピング関数φは、例えば、能動的な基準を(通常、1つまたは複数の位置センサの形で)、一連の位置に、理想的には、関心のボリューム内の一連の格子点へと移動することにより、決定することができる。格子点および/または関心のボリュームは、計画された治療の、または直線加速器12(または他の放射線源)を支持するロボット14のアイソセンタに、またはその近傍に中心を置くことができる。例示的なCyberKnife放射線外科治療システムを用いる場合、治療のアイソセンタは、2つの天井に取り付けられた追跡カメラの軸が交差するCyberKnife室における点とすることができる。これはまた、CyberKnife座標系の原点として使用することもできる。その位置間、または格子点間の能動的な基準の動きは、運動プラットフォームΩロボット202(能動的な基準を近くの治療部位で機械的に動かすための別個のロボット・マニピュレータ)を用いて行うことができ、また能動的な基準の位置は、能動的な基準追跡システム204と、さらに画像追跡システム16(CyberKnife(商標)X線システムなど)との両方に基づいて、追跡モジュール206により感知され、かつ記録されうる。画像追跡ベースの位置と能動的な基準ベースの位置との間で最小二乗法を、較正モジュール206により使用して、最もよくマッチするマッピング関数φを見出すことができる。
【0056】
較正器208は、較正モジュール206のコンポーネントである。較正器208は、CHServerと呼ばれる、放射線外科手術システム上で動作するサーバ・アプリケーションと対話する。CHServerは、イーサネットを経由して通信することにより、較正器208にいくつかの要求をするように働く。較正器208はまた、能動的な基準運動プラットフォーム、Ωロボット202、および能動的な基準追跡システム204に対して共にUSBを介して接続される。較正器208は、
Ωロボットに、センサを指定された位置に移動するように命令する、
放射線外科手術システムの画像追跡システム16に、1対のX線を取得するように命令する、
現在位置に対する能動的な基準センサ座標を取り込む、
CHServerを介してX線をダウンロードする
ことができる。
ステップ1〜4は、すべての格子点、またはその他の形で望ましい位置で行われるまで繰り返される。すべての格子点からのデータが取り込まれた後、較正器208は、マッピング関数φを計算して、それをファイルに記憶することになる。
【0057】
図7、12、および1を次に参照すると、組織の標的部位と、ロボット14との位置合せ136は、概して、患者支持台24により患者を支持させることにより、また(画像ガイドシステム16の立体的X線画像で見られる)基準が所望の位置に配置されるように、関節動作をする患者支持台システム26を用いて患者支持台を移動させて、治療計画の標的部位が、直線加速器12からの計画された軌跡と位置合せされることにより行われることになる。したがって、基準が、実際には、治療計画が完了した後に埋め込まれたとしても、位置合せプロセスは、計画治療データに重畳された基準位置を参照して進めることができ、位置合せプロセスは、放射線外科治療を行う医療人員には理解されるように、計画前に基準が使用される場合に適用されるものと全く同様のものである。
【0058】
図7および13を次に参照すると、ロボットおよび直線加速器による標的組織の治療46および追跡を、概略的に理解することができる。位置合せされた治療計画152(図12を参照して上記で述べたように、ロボット14と適切に位置合せされた後、計画された軌跡および重畳された基準を含む)は、直線加速器12からの適切な軌跡および放射線ビームを規定する。知られた放射線外科治療と同様に、呼吸周期154に対して補償するためにオフセットが決定されるが、呼吸オフセットは、概して、患者の表面画像を用いて、また特に患者の皮膚156上に取り付けられた外部のLEDから特定される呼吸振幅から決定される。間欠的な立体X線データ158を、何らかの患者の動きなどに対する呼吸運動オフセットを変更し、補正するために使用することができる。
【0059】
心臓の動きオフセット160はまた、治療計画152に適用することができ、心臓周期のオフセットの位相は、患者に結合されたEKGセンサ162、または他の心臓周期の監視により特定される。能動的な基準164からのデータまたは信号はまた、心臓の動きの位相を特定するために、ならびに適切な心臓の動きオフセットを提供するために使用することができる。上記で説明したように、心臓周期全体を通しての心臓周期オフセットは、治療計画152に含まれる時系列の3次元データセットから特定することができる。代替的には、EKGセンサ信号162および/または能動的な基準信号164は、放射線ビームをゲートするために使用することができ、したがって、放射線ビームは、標的部位が計画152と十分に位置合せされる心臓周期のいくつかの部分で、心臓組織に向けて送られるだけである。標的部位に位置する組織の心臓周期の動きの何らかの部分は、例えば、無視することができ、基準と標的部位の間の組織の内部変形を、固定されたオフセットに有利なように無視し、十分に制限された振幅を有する1つまたは複数の方向における動きを無視する、または同様に行うことができることに留意されたい。そうではあるが、適切なオフセットが治療計画に適用された後、ロボットによる放射線ビームの標的化166を、次いで、適用することができる。
【0060】
図12Aを次に参照すると、図9Cのものに関係するコンポーネントおよび技法を用いた追跡モジュール210を次に理解することができる。ここでは簡便化のために、計画CTデータにおける位置合せ中心は、基準の重心に設けられると仮定する。そうであるとは限らないことも多いが、通常、計画データと基準中心の間のオフセットが含まれることになる。追跡モジュール210は、施療中、心臓追跡コンピュータHTS上で動作するソフトウェアを含む。位置合せモジュール206は、同様に、心臓追跡コンピュータHTS上で動作することができ、追跡モジュールおよび位置合せモジュールは、例示的な実施形態におけるパーソナル・コンピュータ(PC)で動作するコードを含む。追跡モジュール210は、USBを経由して、埋め込まれたカテーテル・システムのすべての能動的な基準センサ(Ascensionセンサなど)からの位置データ212を入力として受け取る。追跡モジュール210は、較正マップ214、φを、この能動的な基準データに適用して、放射線外科手術システムの座標系(CyberKnife(商標)座標など)における能動的な基準の位置を計算する。そこから、位置データは、3つの異なる経路、すなわち、位置合せ装置216、追跡装置218、および視覚化装置220へと流れる。
【0061】
位置合せ装置216は、能動的な基準からのデータを利用して、患者と放射線外科手術システムとの位置合せを変える。より具体的には、能動的な基準センサデータは、位置合せモジュール・ブロック[4]において、(放射線外科手術システム座標で指定された)計画CTデータからの基準座標との照合を行い、治療台補正を決定することができる。指定された期間にわたる平均の治療台補正が計算され、ユーザに表示することができる。ユーザは、次いで、これらの治療台補正を適用し、治療台補正が実時間でどのように変化するかを観察することができる。ブロック[5]は、移動平均として計算された、治療台補正をグラフィカルな形でユーザに表示することができる。
【0062】
追跡装置218は、入力される能動的な基準位置から標的位置を計算するように構成された追跡モジュール・ブロック[6]を含むことができる。位置合せの後、患者の位置合せ中心は、計画CT座標系で規定されるように、放射線外科治療システムのアイソセンタと一致する。動きが何もない場合、ブロック[6]の出力は、(0、0、0)でありうる。動きがある場合、ブロック[6]の出力は、最初の、または理想的な位置からの位置の変化でありうる。追跡モジュール・ブロック[7]は、標的の動きから心臓の動きを除去することができる。得られた「呼吸だけの」理想的な動きからの変化波形は、放射線外科治療システム・プロセッサの位置予測装置へと送ることができ、それは、標準のデータ経路ごとにこの情報を適用して、ロボットを駆動することができる。
【0063】
能動的な基準データは、視覚化装置220に送ることができ、それは、任意選択で、計画モジュールの表示モジュール・コンポーネントを用いて、CTデータ上に重畳された基準位置を表示することができる。こうすることにより、システム・ユーザに、能動的な基準の位置を、埋め込まれた後になど、視覚化できるようにする。さらに、視覚化装置は、能動的な位置センサを用いて測定された位置データを用いて、実時間で、ロボットにより放射された治療ビームを表示することができる。
【0064】
上記から理解できるように、患者の動きは、心臓疾患の放射線治療を複雑にする。患者の動きが追跡されない場合、標的を狙うことは、標的の時間平均位置にビームを送ることになりうる。代替物および標的が、固定されて共に結合されており、かつ代替物の追跡が正確に維持される場合、標的を狙うことが損なわれることはない。しかし、代替物が標的から偏っており、また標的および代替物が配置された組織が変形する場合、かつ代替物と標的の間の変形が追跡されない場合、単一の撮像位相を、代替物と標的の相対位置を計算するのに使用することができる。適切な撮像位相(3次元画像が取得される時系列の位相中からの)の選択は、標的化の精度に影響する可能性がある。例えば、標的に対する代替物のオフセットが心拍周期の全体を通した平均のオフセットに近くない位相に対して、相対位置の計算が行われた場合、平均の代替物位置に基づく標的化は、線量の送出が標的から偏る結果となりうる。
【0065】
追跡されない動きに適合するための比較的簡単な一手法は、標的を拡大して、標的部位の動きの(心拍周期および/または呼吸周期の全体を含む)すべての位相を通して標的部位の位置を含めるように、標的ボリュームの統合を使用することである。このような統合された標的は、標的部位の治療を保証することができるが、比較的高い放射線量を受ける合計の治療ボリュームが増加する可能性がある。放射線ビームが、標的組織と同期して動く、(Accuray Synchrony(商標)追跡システムで使用されるものと同様の)代替的な追随追跡(pursuit tracking)手法を、標的部位に線量を送るために使用することができる。これらの既存の手法は、放射線に影響されやすい周囲組織の動きを、あるいは標的部位に対する代替物の動きを考慮しないはずである。追跡されない動きへの放射線ビームをゲートすることも使用可能であるが、標的部位に対して十分な線量を与えるための合計時間を増加させることになりうる。
【0066】
例示的な代替の追跡されない治療手法では、組織を、追跡されない組織の動きにわたり統合された線量を受けるものとして解析することができる。ピーク線量は、線量勾配が動きの方向で変化している領域における線量分布に何らかの改変を行って、平均的な位置に送ることができる。線量勾配の変化の割合に対して比較的小さい動きに関しては、線量分布は、追跡されない動きにより、わずかに変更されるだけでありうる。その計画された解剖学的位置からのピーク線量の何らかのシフトにより、意図された線量と実際に組織に加えられた線量との間で、より顕著な変化が生ずる可能性がある。
【0067】
追跡されない動きの存在するこの例示的な標的化手法では、追跡代替物の画像化を使用して放射線ビームを送ることができる。追跡代替物の単一の画像だけが得られる場合、未追跡の動きから生じた標的化エラーが存在することになり、したがって、画像を間欠的に取得することにより、将来のビーム方向を決定するために、好ましくは、追跡代替物の位置を良好に突き止めるように平均化して、位置データを組み合わせることが可能になる。この手法により、標的部位に対する追跡代替物の平均位置に対してビームを送る結果となりうる。計画が、この同じ平均の相対的な位置決めに基づいて作成された場合、ピーク線量の位置は、計画された標的部位に対応すべきである。
【0068】
上記を考慮すると、また図14A〜14Eを参照して理解できるように、心臓運動および/または呼吸運動を通して、追跡代替物に対する標的の時間平均位置を解析することにより、未追跡の動きの存在する中で、標的化精度を向上させることができる。比較的簡単な一方法は、追跡代替物が、その平均相対位置に最も近くにある位相を選択することにより、計画中に、この時間平均相対位置を用いることである。計画中には、代替物の正確な位置は知られていない可能性もあるが、基準を埋め込むための標的位置に対応する心臓内の標的構造を特定することができ、したがって、代替物は、計画された平均オフセットに対して適切な位置に、またはその近傍に展開するように目標とすることができることに留意されたい。計画位相は、標的構造位置に対する標的代替物位置の平均位置に基づいて選択されうる。
【0069】
時系列の3次元計画データセットから選択されたどの別個の位相も、時間平均位置に正確に対応していないはずであることに留意されたい。この差のために何らかの標的化エラーが残る可能性がある。さらに、追跡代替物の平均位置は、追跡代替物に対する標的の平均的構成に対応していないはずである。多少正確である解決策は、代替物と標的の間の時間平均関係を考慮することである。図14A〜Dで示すように、この時間平均は、取り込まれた時系列における何らかの特定の位相に対応していない可能性がある。そうではあるが、計算された時間平均に最も近い位相を選択することが便利であり、かつ利益がありうる。
【0070】
図14A〜Dを見ると、追跡代替物(黒丸で示される)と標的(白丸で示される)の間の2次元の相対的な動きの例である。図14A〜Dは、周期的な心臓運動の4つの位相における基準フレームに対する標的および回路の位置を示している。代替物と標的は共に、基準フレームに対して動くが、標的はまた代替物に対しても動く。
【0071】
図14Eで、計算された平均の標的中心は、精度の利点を提供することができる。平均の標的中心と追跡代替物の間の関係は、必ずしも図14A〜Dの別個の画像のいずれとも一致しないが、その構成は、オブジェクト間の平均的な分離に対応している。
【0072】
多くの放射線外科手術システムでは、CTボリューム・セットが、デジタル再構成画像(DRR)を作成するために使用される。治療中、ガイド画像が、患者を位置合せするためにこれらのDRRと突合せが行われる。DRRは、時系列の特定の位相に対するどれか1つのデータセットから構成できるので便利である。したがって、標的それ自体は、DRR中で特定するのは多少困難でありうるが、それは、追跡代替物を使用するための動機付けを提供する。ビームを標的に向けるために使用されるオフセットは、それにもかかわらず、時間平均関係に最もよくマッチする選択された位相から生成されたDRRの平均の標的位置に基づくことができる。代替的に、標的とオフセットの相対的な位置は、DRRを利用することなく、計算された時間平均を使用することができ、したがって、CTボリュームにおける標的の標的位置は、特定のDRRに対応しないはずである。例えば、基準の座標がf(k、t)である場合、基準を連結する距離は、
d(k、m、t)=|f(k、t)−f(m−t)|である。基準間のこのような連結距離は、
【0073】
【数1】

となり、式中、Nは基準の数である。連結距離は、{d(k、m、t)}として表され、それはM次元ベクトルである。次いで、時間平均距離を、
【0074】
【数2】

として計算することができる。次いで、ベクトル距離を計算すると、
【0075】
【数3】

となる。次いで、最小のΔ(t)に対応する位相を選ぶ。
【0076】
図15Aおよび15Bを次に参照すると、治療計画上の未追跡の動きの影響が、グラフィカルに示されている。これらの図は、肺静脈を電気的に隔離することを意味する治療計画に対する、犬の右上肺静脈に取り付けられた基準の測定された動きの影響を示している。標的損傷は赤(右の標的損傷、RTL)、および緑(左の標的損傷、LTL)で示され、一方、放射線の影響を受けやすい周囲組織構造は、紫(右気管支)、オリーブ色(左気管支)、および青(食道)で示される。動きを考慮することなく計画された線量は緑の輪郭で示され、一方、動きの影響を考慮した後に計算された線量は、白の輪郭で示されている。図15Aは、基準と標的の間のオフセットが平均で0.5mmだけ異なる場合の位相を選択することにより生ずる計画オフセットに加えて、6mmのピーク・ツー・ピーク振幅の反復される未追跡の動きがある場合の線量の影響を示している。図15Bは、オフセットのない反復する未追跡の動きの影響だけを示している。オフセットの影響は、未追跡の反復する動きの影響よりもはるかに大きい。
【0077】
図16を次に参照すると、コンポーネントのキットは、本明細書で述べたシステムおよび方法を用いて放射線外科治療を容易にする。これらのかつ/または他のコンポーネントは、概して、同梱されたコンポーネントおよび/またはシステムを使用するための説明書172と共に、1つまたは複数の気密密封したパッケージ170に含まれうる。キットは、経皮カテーテルの心臓への挿入中に使用されるすべての使い捨て部品を含むようにするのが好ましい。カテーテル174は、一般に、近位端178と遠位端180の間で延びる細長い可撓性のある本体176を有する。シース182は、カテーテル本体176を受け入れる管腔を有することができ、シースは、任意選択で、挿入および位置決めするのに適した小さな輪郭形状に基準を制限し、またシースはさらに、任意選択で、上記で述べた螺旋状の、または半径方向に拡大可能な固定構造を包み込む。シースおよびカテーテルの近位のハブ184、186は、任意選択で、迅速な交換手法を用いて、シースを、カテーテル本体176を介して、近位方向に引き抜くことを可能にする。同様に、カテーテルは、ガイドワイヤ190を受け入れるための迅速な交換ガイドワイヤ管腔を有することができるが、あるいはカテーテルをオーバザワイヤ(over−the−wire)手法で使用するための貫通管腔を有することができる。さらに、カテーテルは、遠位端に流れ指向バルーンを有することができ、それは、肺動脈などの標的部位へと下流方向に、カテーテルの迅速な展開を容易にすることになる。カテーテルは、計画画像を取得する前に、また放射線治療の全体を通して挿入されうるが、カテーテルは、通常、画像取得および治療計画が完了した後の治療日に、展開することになる。
【0078】
上記で述べたように、カテーテルは、受動的代替物を提供するために、放射線外科治療中に容易に可視化できる高コントラストのマーカを含む受動的な基準を含むことができる。代替的には、カテーテル174は、カテーテルの位置を示すために、信号を、電子的に、超音波的に、電磁式に、放射能を用いてなど、送信または受信する能動的な基準を含むことができる(また標的の位置をそれにより示すことのできるカテーテルの位置と標的部位の位置との間の知られた関係を用いる)。受動的な基準は、例えば、金、プラチナ、イリジウム、および/またはタンタル、または同様のものなどを含む小さな金属構造を備えることができる。カテーテルはまた、治療中に受けた線量、血圧、および他の生物測定学的信号を測定するためのセンサを含むことができる。
【0079】
1つまたは複数の殺菌したパッケージ170内に含まれるいくつかの例示的なコンポーネントを再度見ると、キットは、ヨウ素または他の皮膚洗浄ローション192、1%ザイロカインの小びん、または同様のものを含むことができる。これらの材料は、皮膚の穿刺部位に、麻酔性の皮膚の膨疹を作成するために使用することができる。導入シース194は、血液の引抜き、複数の同時薬物の注入、および他の静脈内維持液の送りを可能にするために、少なくとも1つの、またはおそらく2つの側部ポートを含むことができる。例示的な導入シース194は、2つのカテーテルを同時に配置できるように、2つのポートまたはチャネルを有する。ゴムの隔壁を各ポートの入口に設けることができ、例示的な導入器は、静菌性のものとして使用するために、導入器のシースに沿って皮膚の穿刺部位へと前進できる銀を含む化合物で含浸された3mmの綿の管状のカフ(cuff)を有する。
【0080】
針196は、ガイドワイヤ190およびシース194と組み合わせて使用されたとき、カテーテル174の静脈カニューレ挿入および安全な位置決めを可能にする。1組のEKG電極198は、心拍リズムの追跡を可能にし、一方1組のLEDまたは金の基準は、呼吸を監視するために胸壁に取り付けることができる。導体が、カテーテル本体176に沿って延びて、心臓組織と係合させるための螺旋の固定リード、または他の導電性の遠位構造を、近位のハブ186の近位のコネクタと結合させることができる。こうすることにより、カテーテルの遠位端にある固定リードまたは他の導電性の構造を、単独で、または他のEKG電極に加えて、心拍を監視するための心臓信号電極として使用できるようにする。キット・パッケージ170はまた、患者マットレスを、理想的には、真空バッグ・マットレスなど、患者位置の変化を制限するように構成されたマットレスを含むことができ、真空バッグは、任意選択で、患者が患者支持台上で快適に配置された後、バッグの形状を再構成し、固定するための真空ポートを有する、かつ/または別個のペレットを含む。
【0081】
カテーテルベースの基準システムの使用時に、またはその展開中に、針196(20ゲージの位置決め針など)を、内部の頸静脈、鎖骨下もしくは上腕静脈を特定するために使用することができる。キット中に、またパッケージ170内にさらに含まれる14ゲージ針(図示せず)を次いで挿入することができ、挿入された針を介してワイヤ190を配置し、次いで、針が引き抜かれる。皮膚は、ワイヤ挿入部位で、おおよそ2mmで切開することができ、組織の溝を拡大するために、(任意選択で、挿入シース194の遠位端で)拡張器が使用される。カテーテル174の遠位端180を、次いで、針を介して挿入することができ、カテーテルの遠位端の位置は、X線または蛍光透視法のガイドを用いて確認される。カテーテル174の遠位端180の近くの固定構造を、カテーテル本体176からシース182を近位方向に引き抜くことにより露出することができ、また遠位端は、心臓の標的組織に取り付けられる。カテーテル174の近位のハブ186が、次いで、患者の皮膚に縫合され、またはその他の形で取り付けられうる。
【0082】
蛍光透視法または超音波ガイドを用いる代替の取付け手法は、図8Fに関して上記で述べたように、カテーテル174の遠位端180において、小さな輪郭形状から、大きな輪郭形状へとポリエチレン製コーンを展開することを含むことができる。コーンは、カテーテルの近位部分の側部のスイッチをスライドさせることにより展開することができる。任意選択で、10または20ccの注射器または同様のものを用いて、コーンの開放端に真空を加えることもできる。真空を維持するために、活栓を閉じることができ、また注射器は除去される。コーンを、心臓内表面への吸引により取り付けることが好ましい。
【0083】
任意選択で、検出、ペーシング、または切除電極を、カテーテル・ハブ186のポートを介して、または導入シース194を介して配置することができる。能動的な基準または代替物が使用される場合、ナビゲーション・システムとロボット制御システムとの間の通信を確認することができる。
【0084】
例示的な実施形態が、理解しやすくするために、かつ例としていくつかの細部で述べられてきたが、いくつかの変更、修正、および適合は、当業者には自明のものでありうる。したがって、本発明の範囲は、添付の特許請求の範囲によってのみ限定される。
【特許請求の範囲】
【請求項1】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術方法であって、
前記心臓から3次元の計画画像データを取得するステップと、
前記疾患を軽減するために、前記3次元の計画画像データを用いて、前記心臓の標的部位の電離放射線治療を計画するステップと、
前記治療を計画する前記ステップの後、前記体内に位置代替物を埋め込むステップと、
前記埋め込まれた代替物を参照して、前記体の外側から、前記標的部位に向けて前記計画された放射線を送ることにより、前記心臓の前記標的部位を再建するステップと
を含む方法。
【請求項2】
前記代替物を埋め込む前記ステップ、
前記標的部位を治療する前記ステップ、および
前記体から前記代替物を取り出すステップ
が治療日に行われ、また
前記心臓の前記計画画像を取得する前記ステップ、および
前記治療を計画する前記ステップ
が治療日の前に行われる、請求項1に記載の方法。
【請求項3】
前記治療を計画する前記ステップは、前記計画された放射線に基づいて、前記心臓の推定される損傷を決定するステップと、前記推定される損傷のグラフィカルな表示を再検討するステップとをさらに含む、請求項2に記載の方法。
【請求項4】
前記代替物を埋め込む前記ステップは、少なくとも1つの細長い可撓性のある本体を、血管を介して前進させるステップと、前記代替物が心拍で誘起された組織の動きを示すように、前記代替物を前記組織に結合するステップとを含む、請求項1に記載の方法。
【請求項5】
前記代替物は、前記代替物と前記標的域の間の3次元オフセット方向を、基準マーカの画像から決定できるように、非共線性の1組の別個の前記基準マーカを備える、請求項4に記載の方法。
【請求項6】
前記代替物を埋め込む前記ステップは、前記細長い本体の螺旋構造を前記組織の中にねじ込むステップを含む、請求項4に記載の方法。
【請求項7】
前記代替物を埋め込む前記ステップは、前記組織が境界を成す管腔または心腔内で本体を拡大するステップを含む、請求項4に記載の方法。
【請求項8】
前記代替物を埋め込む前記ステップは、能動的な3次元の位置指示器を前記組織に取り付けるステップを含む、請求項4に記載の方法。
【請求項9】
前記位置指示器からの位置を示す信号は、前記埋め込まれた代替物の位置を、前記計画画像データに登録するために使用される、請求項8に記載の方法。
【請求項10】
前記位置を示す信号は、前記代替物と体の外側の位置送信器との間のオフセットを示しており、また前記心臓および前記位置送信器を包含する画像データを用いて、前記位置を示す信号を較正するステップをさらに含む、請求項9に記載の方法。
【請求項11】
前記位置を示す信号を較正するために使用される前記画像データは、計画後の較正画像データを含んでおり、さらに、カテーテル先端が心臓組織に係合している間に較正位置感知信号を生成するステップを含み、前記送信器と前記体の間で確立された位置関係が、前記較正画像データの取得中および前記位置感知信号の生成中は維持される、請求項10に記載の方法。
【請求項12】
前記位置指示器は、超音波または電磁式位置指示システムで使用されるセンサまたは信号発生器を備える、請求項8に記載の方法。
【請求項13】
前記標的部位は、間欠的な追跡検証画像間の前記位置指示器からの位置を示す信号を用いて前記計画された放射線を送ることにより治療される、請求項12に記載の方法。
【請求項14】
前記代替物を埋め込む前記ステップと、前記標的部位を治療する前記ステップとの間で、登録データを取得することにより、前記計画画像データを前記埋め込まれた代替物に登録するステップをさらに含み、前記登録データは、前記心臓および前記埋め込まれた代替物を包含する、請求項1に記載の方法。
【請求項15】
前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データはまた、同じ撮像モダリティで取得される、請求項14に記載の方法。
【請求項16】
前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データは、前記第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される、請求項14に記載の方法。
【請求項17】
前記登録データは3次元画像データを含み、また前記計画画像データで前記心臓の表面をセグメント化するステップと、前記登録画像データで前記心臓の表面をセグメント化するステップと、前記計画画像データを、前記表面のセグメント化を用いて前記埋め込まれた代替物に登録するステップとをさらに含む、請求項14に記載の方法。
【請求項18】
前記計画画像データおよび前記登録データは、それぞれ、造影剤が、血液/組織の界面が境界を成す心腔または血管中に投入される間に取得され、また前記代替物は、前記血液/組織の界面を参照して登録される、請求項14に記載の方法。
【請求項19】
前記登録データは、前記代替物の能動的な位置指示器からの超音波または電磁式位置信号を含む、請求項14に記載の方法。
【請求項20】
前記代替物は、マーカが3次元のオフセット方向を規定するのに十分に非共線性であるように埋め込まれた複数の別個の画像化可能なマーカを含む、請求項14に記載の方法。
【請求項21】
前記体に隣接する高コントラストの組織構造に対する前記心臓の前記標的部位の位置は、前記計画画像が取得された後、前記標的部位が治療される前に大幅に動く、請求項1に記載の方法。
【請求項22】
1つまたは複数の関連する心臓組織で規定される位置に前記代替物の1つまたは複数の画像化可能な基準マーカを埋め込むことにより、かつ前記計画画像データで、前記1つまたは複数の心臓組織で規定される位置を特定することにより、前記埋め込まれた代替物の位置を、前記計画画像データに登録するステップをさらに含む、請求項1に記載の方法。
【請求項23】
前記代替物の位置合せ画像データを取得することにより、放射線治療源を前記埋め込まれた基準と位置合せするステップをさらに含み、また前記標的部位の前記組織は、前記位置合せのための前記位置合せ画像データ中で十分に認識可能ではない、請求項14に記載の方法。
【請求項24】
前記計画画像データを取得しながら、前記体から心拍周期を監視するステップと、前記心拍周期との心臓組織の動きを示すために、前記心拍周期の全体を通して分散させた時系列の3次元画像データセットを取得するステップとをさらに含み、
前記治療を計画する前記ステップは、
放射線の影響を受けやすい周囲組織を特定するステップと、
前記周囲の組織を過度に照射することなく、前記標的部位に所望の放射線量を送るのに適した一連の放射線ビームを決定するステップとを含み、
前記標的部位を再建する前記ステップは、
前記体の前記心拍周期を監視するステップと、
時系列のデータセットを用いて前記標的部位に前記放射線を送りながら、前記監視された心拍周期に応じて、前記組織の前記動きの少なくとも一部を追跡するステップと
により行われる、請求項1に記載の方法。
【請求項25】
前記代替物を埋め込む前記ステップは、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップと、前記代替物が前記心拍周期と共に動くように、前記代替物を前記心臓に結合するステップとを含んでおり、また前記時系列の画像データセットを用いて、前記代替物と前記標的部位の間の時間平均オフセットを決定するステップをさらに含み、前記標的部位を追跡する前記ステップは、
前記代替物の位置を決定するステップと、
前記体の前記心拍周期を監視するステップと、
前記監視された心拍周期、前記代替物の前記決定された位置、および前記時間平均オフセットを用いて、前記放射線ビームを前記標的部位に送るステップと
により行われる、請求項24に記載の方法。
【請求項26】
前記時間平均オフセットは、時系列の画像データセットから一連の3次元オフセットを特定することにより、前記心臓周期に対して決定され、また前記時間平均オフセットは、前記心臓周期の全体を通して適用され、したがって、前記心拍周期中に前記代替物と前記標的部位の間の組織変形は追跡されない、請求項25に記載の方法。
【請求項27】
前記時間平均オフセットは、前記測定された一連のオフセットの計算された平均に対応する時系列のデータセットの中から、画像データセットを選択するステップによりさらに決定され、したがって、前記選択されたオフセットは、必ずしも前記心臓周期の休止期に対応していない、請求項26に記載の方法。
【請求項28】
前記オフセットは、前記特定された一連のオフセットの計算された時間平均を含む、請求項26に記載の方法。
【請求項29】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムであって、
前記心臓から、3次元の計画画像データを取得するための画像取込みデバイスと、
前記体内で、前記心臓の組織と結合できる埋込み可能な位置代替物と、
前記体の外側から、電離放射線の複数のビームを送信するための放射線源と、
前記心臓の標的部位を特定するための入力を有する計画モジュールを備えるプロセッサ・システムであり、前記計画モジュールは、前記標的部位および前記計画画像データに応じて前記放射線ビームの計画を生成し、前記プロセッサ・システムは、前記放射線源と結合されて、前記放射線ビームが前記心臓の前記標的部位を再建することにより疾患を軽減するように、前記埋め込まれた代替物を参照して前記放射線ビームを前記標的部位に向けて送る、プロセッサ・システムと
を備えるシステム。
【請求項30】
前記心臓の計画画像を出力するように構成された前記計画モジュールのディスプレイをさらに備え、前記計画モジュールの前記入力は、前記心臓画像の3次元位置を指定し、前記心臓は3次元の心臓画像を含む、請求項29に記載のシステム。
【請求項31】
前記計画モジュールは、前記計画された放射線ビームに基づき、前記心臓画像上に前記心臓の推定された損傷をグラフィカルに重畳する、請求項30に記載のシステム。
【請求項32】
前記代替物は、使用中、前記体の外側で使い捨て可能な近位端と、前記代替物を支持し、かつ血管を介して挿入可能な遠位端と、前記代替物が心拍で誘起された前記組織の動きを示すように、組織に対して前記代替物を解放可能に結合するための組織取付け表面とを有する細長い可撓性のある本体により支持される、請求項29に記載のシステム。
【請求項33】
前記代替物は、前記代替物と前記標的域の間の3次元オフセット方向が、前記心臓画像中の基準マーカから決定することができるように、非共線構成を有する1組の別個の基準マーカを備える、請求項32に記載のシステム。
【請求項34】
前記取付け表面は、前記組織中にねじ込むように配置された螺旋構造を備える、請求項32に記載のシステム。
【請求項35】
前記取付け表面は、前記組織が境界を成す管腔または心腔へと挿入するための第1の構成と、前記組織に固定されて係合するための第2の拡大可能な構成とを有する拡大可能な本体上に配置される、請求項32に記載のシステム。
【請求項36】
前記代替物は、能動的な3次元の位置指示器を備える、請求項32に記載のシステム。
【請求項37】
前記プロセッサは、前記位置指示器からの位置を示す信号に応じて、前記埋め込まれた代替物の位置を、前記計画画像データに登録する、請求項32に記載のシステム。
【請求項38】
前記位置を示す信号は、前記代替物と、前記体の外側の位置センサもしくは送信器との間のオフセットを示し、前記プロセッサは、前記計画画像データに応じて、前記位置を示す信号を較正するように構成され、前記計画画像データは、前記センサまたは送信器を包含する、請求項37に記載のシステム。
【請求項39】
前記位置指示器は、前記プロセッサ・システムに結合された超音波または電磁式位置指示システム内に含まれるセンサもしくは信号発生器を備え、前記プロセッサ・システムは、前記位置を示す信号に応じて、前記放射線ビームを前記標的域に向けて送る、請求項32に記載のシステム。
【請求項40】
前記プロセッサ・システムは、検証画像システムからの間欠的な検証画像間の前記位置を示す信号を用いて前記計画された放射線を送り、かつ前記間欠的な検証画像を用いて、前記計画された放射線の送りを検証し、かつ改良するように、前記プロセッサ・システムに結合された追跡検証画像取得システムをさらに備える、請求項32に記載のシステム。
【請求項41】
前記プロセッサ・システムは、前記代替物を埋め込んだ後に取得された登録データに応じて、前記計画画像データを前記埋め込まれた代替物に登録するように構成され、前記登録データは、前記心臓および前記埋め込まれた代替物を包含する、請求項29に記載のシステム。
【請求項42】
前記登録データは、3次元画像データを含み、前記登録画像データおよび前記計画画像データは、同じ撮像モダリティを用いて取得される、請求項41に記載のシステム。
【請求項43】
登録画像取得システムをさらに備え、前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データは、前記第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される、請求項41に記載のシステム。
【請求項44】
登録データに三次元画像データを有し、形成されるプロセッサは、計画画像データにおいて心臓の表層を分割して、登録画像データにおいて心臓の表層を分割して、表層分割を用いている植設された代用物を有する計画画像データを登録する、請求項41に記載のシステム。
【請求項45】
対照が室または容器に配置される間、各々得られているイメージング・コントラスト、計画画像データおよび登録データから更に成ることは血液/組織インタフェース面によってよく似ていた。そこにおいて、プロセッサは血液/組織インタフェース面に関して代用物を登録するように構成される、請求項41に記載のシステム。
【請求項46】
登録データに、代用物の作動中の位置指示器からの超音波または電磁気のポジション信号が設けられている、請求項41に記載のシステム。
【請求項47】
代用物に、標識が登録データの三次元相殺された方位を定めるために十分に非同一直線上であるように、画像有能な標識が細長い可撓性血管内本体によって支持した複数の独立した装置が設けられている登録画像取得システムを有する、請求項41に記載のシステム。
【請求項48】
放射線治療ソースを植設された基準に合わせるのを容易にするためにプロセッサに連結する配列画像獲得装置から更に成っている請求項41のシステム。
【請求項49】
前記計画画像取込みデバイスおよび前記プロセッサと結合された計画画像心拍周期センサをさらに備え、前記計画画像データは、前記心拍周期との心臓組織の動きを示すために、前記心拍周期の全体を通して分散された時系列の3次元画像データセットを含んでおり、
前記プロセッサは、放射線に影響されやすい周囲組織を特定することにより、かつ過度に周囲組織を照射することなく、所望の放射線量を前記標的部位に送るのに適した一連の放射線ビームを決定することにより、前記治療を計画するように構成された計画モジュールを備え、
前記標的部位を再建しながら前記体の前記心拍周期を監視するために、前記プロセッサに結合された治療心拍周期センサと、前記体および前記放射線源の間の位置合せを変更するためのロボットとをさらに備えている、請求項29に記載のシステム。
【請求項50】
前記プロセッサは、前記放射線を前記標的部位に送りながら、前記監視された心拍周期に応じて、前記ロボットを用いて前記組織の前記動きの少なくとも一部を追跡することにより、前記放射線量を前記標的部位に送るように構成され、
前記代替物の埋込みは、前記代替物は前記心拍周期と共に動くように、前記代替物を前記心臓に結合するために、血管を介して挿入可能な少なくとも1つの細長い可撓性のある本体により支持され、前記プロセッサは、前記時系列の画像データセットを用いて、前記代替物と前記標的部位の間の時間平均オフセットを決定するように、かつ前記代替物の位置を決定することにより前記標的部位を追跡し、かつ前記心拍周期、前記代替物の前記決定された位置、および前記時間平均オフセットを用いて前記標的部位に前記放射線ビームを送るように構成されている、請求項49に記載のシステム。
【請求項51】
前記プロセッサは、前記時系列の画像データセットから、一連の3次元の画像オフセットを特定することにより、前記心臓周期に対する前記時間平均オフセットを決定し、また前記時間平均オフセットは、前記心臓周期の全体を通して適用され、したがって、前記心拍周期中に前記代替物と前記標的部位の間の組織変形は追跡されることのない、請求項50に記載のシステム。
【請求項52】
前記プロセッサは、前記測定された一連のオフセットの計算された平均に対応する時系列のデータセット中から画像データセットを選択することにより、前記時間平均オフセットを決定し、したがって、前記選択されたオフセットが必ずしも前記心臓周期の休止期に対応していない、請求項51に記載のシステム。
【請求項53】
平均が相殺した時間に、オフセットの確認された連続の算出時間平均が設けられている、請求項51に記載のシステム。
【請求項54】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムで使用するための治療キットであって、前記放射線外科手術システムは、前記疾患を軽減するために、計画ごとに前記患者の体の外側から電離放射線の複数のビームを送信するための放射線源を有しており、前記放射線外科手術システムは、前記心臓の標的部位の動きに前記放射線ビームを同期させるための複数の追跡入力を有しており、
前記患者の心臓周期信号を前記放射線外科手術システムの第1の追跡入力に送るために、前記患者に結合可能な電極と、
前記患者の血管を介して挿入可能な近位端および遠位端を有する細長い可撓性のある本体と、
前記代替物は、前記放射線外科手術システムの第2の追跡入力を生成するために、適切に前記心臓と共に動くように、前記心臓と動作可能な係合へと挿入可能とする前記可撓性のある本体の前記遠位端により支持される位置代替物と
を備える治療キット。
【請求項55】
電極、可撓体および代用物を含んでいるパッケージから更に成っている、請求項54の処理キット。
【請求項56】
遠隔画像処理システムを含んでいるラジオ外科的システムの第2の入力であり、三次元オフセットを代用物および目標地域との間に定めるために展開されるときに、代用物は十分に非同一直線上の構成を有する一組の受動的なハイコントラスト基準マーカから成る、請求項55に記載の処理キット。
【請求項57】
基準で設定されたものは、線形挿入構成を有する、請求項56に記載の処理キット。
【請求項58】
代用物に、超音波または電磁部品が超音波または電磁気のシステムの範囲内で含んだ能動態、超音波から成っている第2の入力または入力される電磁信号に拠点を置くポジションが設けられている、請求項55に記載の処理キット。
【請求項59】
末端を添付すること間の固定面本体を延長する心臓の組織であり、固定面は、放射状に拡張可能な本体、真空シールボディまたは螺旋形の固定ネジによって規定される、請求項55に記載の処理キット。
【請求項60】
本体の呼吸移動のイメージングを許容するために本体の露出表面に取り付け可能な体表標識から成る、請求項55に記載の処理キット。
【請求項61】
電極に一組の心電図電極が設けられている、請求項55に記載の処理キット。
【請求項62】
超音波イメージング・トランスデューサを患者の皮膜に添付することに適している接着パッチから更に成る、請求項55に記載の処理キット。
【請求項63】
放射ビーム、患者に挿入可能な末端、そして、その間にあるルーメン、密封して細長い本体を受けている内腔。の間、患者の皮膚に取り付け可能な近端部を有する案内管シースから成る、請求項55に記載の処理キット。
【請求項64】
噴門ガイドワイヤの一つ以上、ルーメンに対する細長い本体のルーメンによるイメージング・コントラスト配達可能なものまたは心臓、麻酔皮膚を洗っている溶液、ロケータ針またはガイドワイヤの室から更に成る、請求項55に記載の処理キット。
【請求項65】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムであって、
血管内から、前記体内の前記心臓の組織に回収可能に取り付けることのできる埋込み可能な位置代替物と、
前記心臓から3次元の計画画像データを取得するための画像取込みデバイスと、
前記体の外側から電離放射線の複数のビームを送るための放射線源と、
前記代替物の位置に応じて、位置データを生成するための追跡システムと、
前記心臓の標的部位を特定するための入力を有する計画モジュールを備えるプロセッサ・システムであり、前記計画モジュールは、前記標的部位および前記計画画像データに応じて前記放射線ビームの計画を生成し、前記プロセッサ・システムは、前記追跡システムを前記放射線源と結合して、前記放射線ビームが前記心臓の前記標的部位を再建することにより疾患を軽減するように、前記埋め込まれた代替物を参照して前記放射線ビームを前記標的部位に向けて送る、プロセッサ・システムと
を備えるシステム。
【請求項1】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術方法であって、
前記心臓から3次元の計画画像データを取得するステップと、
前記疾患を軽減するために、前記3次元の計画画像データを用いて、前記心臓の標的部位の電離放射線治療を計画するステップと、
前記治療を計画する前記ステップの後、前記体内に位置代替物を埋め込むステップと、
前記埋め込まれた代替物を参照して、前記体の外側から、前記標的部位に向けて前記計画された放射線を送ることにより、前記心臓の前記標的部位を再建するステップと
を含む方法。
【請求項2】
前記代替物を埋め込む前記ステップ、
前記標的部位を治療する前記ステップ、および
前記体から前記代替物を取り出すステップ
が治療日に行われ、また
前記心臓の前記計画画像を取得する前記ステップ、および
前記治療を計画する前記ステップ
が治療日の前に行われる、請求項1に記載の方法。
【請求項3】
前記治療を計画する前記ステップは、前記計画された放射線に基づいて、前記心臓の推定される損傷を決定するステップと、前記推定される損傷のグラフィカルな表示を再検討するステップとをさらに含む、請求項2に記載の方法。
【請求項4】
前記代替物を埋め込む前記ステップは、少なくとも1つの細長い可撓性のある本体を、血管を介して前進させるステップと、前記代替物が心拍で誘起された組織の動きを示すように、前記代替物を前記組織に結合するステップとを含む、請求項1に記載の方法。
【請求項5】
前記代替物は、前記代替物と前記標的域の間の3次元オフセット方向を、基準マーカの画像から決定できるように、非共線性の1組の別個の前記基準マーカを備える、請求項4に記載の方法。
【請求項6】
前記代替物を埋め込む前記ステップは、前記細長い本体の螺旋構造を前記組織の中にねじ込むステップを含む、請求項4に記載の方法。
【請求項7】
前記代替物を埋め込む前記ステップは、前記組織が境界を成す管腔または心腔内で本体を拡大するステップを含む、請求項4に記載の方法。
【請求項8】
前記代替物を埋め込む前記ステップは、能動的な3次元の位置指示器を前記組織に取り付けるステップを含む、請求項4に記載の方法。
【請求項9】
前記位置指示器からの位置を示す信号は、前記埋め込まれた代替物の位置を、前記計画画像データに登録するために使用される、請求項8に記載の方法。
【請求項10】
前記位置を示す信号は、前記代替物と体の外側の位置送信器との間のオフセットを示しており、また前記心臓および前記位置送信器を包含する画像データを用いて、前記位置を示す信号を較正するステップをさらに含む、請求項9に記載の方法。
【請求項11】
前記位置を示す信号を較正するために使用される前記画像データは、計画後の較正画像データを含んでおり、さらに、カテーテル先端が心臓組織に係合している間に較正位置感知信号を生成するステップを含み、前記送信器と前記体の間で確立された位置関係が、前記較正画像データの取得中および前記位置感知信号の生成中は維持される、請求項10に記載の方法。
【請求項12】
前記位置指示器は、超音波または電磁式位置指示システムで使用されるセンサまたは信号発生器を備える、請求項8に記載の方法。
【請求項13】
前記標的部位は、間欠的な追跡検証画像間の前記位置指示器からの位置を示す信号を用いて前記計画された放射線を送ることにより治療される、請求項12に記載の方法。
【請求項14】
前記代替物を埋め込む前記ステップと、前記標的部位を治療する前記ステップとの間で、登録データを取得することにより、前記計画画像データを前記埋め込まれた代替物に登録するステップをさらに含み、前記登録データは、前記心臓および前記埋め込まれた代替物を包含する、請求項1に記載の方法。
【請求項15】
前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データはまた、同じ撮像モダリティで取得される、請求項14に記載の方法。
【請求項16】
前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データは、前記第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される、請求項14に記載の方法。
【請求項17】
前記登録データは3次元画像データを含み、また前記計画画像データで前記心臓の表面をセグメント化するステップと、前記登録画像データで前記心臓の表面をセグメント化するステップと、前記計画画像データを、前記表面のセグメント化を用いて前記埋め込まれた代替物に登録するステップとをさらに含む、請求項14に記載の方法。
【請求項18】
前記計画画像データおよび前記登録データは、それぞれ、造影剤が、血液/組織の界面が境界を成す心腔または血管中に投入される間に取得され、また前記代替物は、前記血液/組織の界面を参照して登録される、請求項14に記載の方法。
【請求項19】
前記登録データは、前記代替物の能動的な位置指示器からの超音波または電磁式位置信号を含む、請求項14に記載の方法。
【請求項20】
前記代替物は、マーカが3次元のオフセット方向を規定するのに十分に非共線性であるように埋め込まれた複数の別個の画像化可能なマーカを含む、請求項14に記載の方法。
【請求項21】
前記体に隣接する高コントラストの組織構造に対する前記心臓の前記標的部位の位置は、前記計画画像が取得された後、前記標的部位が治療される前に大幅に動く、請求項1に記載の方法。
【請求項22】
1つまたは複数の関連する心臓組織で規定される位置に前記代替物の1つまたは複数の画像化可能な基準マーカを埋め込むことにより、かつ前記計画画像データで、前記1つまたは複数の心臓組織で規定される位置を特定することにより、前記埋め込まれた代替物の位置を、前記計画画像データに登録するステップをさらに含む、請求項1に記載の方法。
【請求項23】
前記代替物の位置合せ画像データを取得することにより、放射線治療源を前記埋め込まれた基準と位置合せするステップをさらに含み、また前記標的部位の前記組織は、前記位置合せのための前記位置合せ画像データ中で十分に認識可能ではない、請求項14に記載の方法。
【請求項24】
前記計画画像データを取得しながら、前記体から心拍周期を監視するステップと、前記心拍周期との心臓組織の動きを示すために、前記心拍周期の全体を通して分散させた時系列の3次元画像データセットを取得するステップとをさらに含み、
前記治療を計画する前記ステップは、
放射線の影響を受けやすい周囲組織を特定するステップと、
前記周囲の組織を過度に照射することなく、前記標的部位に所望の放射線量を送るのに適した一連の放射線ビームを決定するステップとを含み、
前記標的部位を再建する前記ステップは、
前記体の前記心拍周期を監視するステップと、
時系列のデータセットを用いて前記標的部位に前記放射線を送りながら、前記監視された心拍周期に応じて、前記組織の前記動きの少なくとも一部を追跡するステップと
により行われる、請求項1に記載の方法。
【請求項25】
前記代替物を埋め込む前記ステップは、少なくとも1つの細長い可撓性のある本体を血管を介して前進させるステップと、前記代替物が前記心拍周期と共に動くように、前記代替物を前記心臓に結合するステップとを含んでおり、また前記時系列の画像データセットを用いて、前記代替物と前記標的部位の間の時間平均オフセットを決定するステップをさらに含み、前記標的部位を追跡する前記ステップは、
前記代替物の位置を決定するステップと、
前記体の前記心拍周期を監視するステップと、
前記監視された心拍周期、前記代替物の前記決定された位置、および前記時間平均オフセットを用いて、前記放射線ビームを前記標的部位に送るステップと
により行われる、請求項24に記載の方法。
【請求項26】
前記時間平均オフセットは、時系列の画像データセットから一連の3次元オフセットを特定することにより、前記心臓周期に対して決定され、また前記時間平均オフセットは、前記心臓周期の全体を通して適用され、したがって、前記心拍周期中に前記代替物と前記標的部位の間の組織変形は追跡されない、請求項25に記載の方法。
【請求項27】
前記時間平均オフセットは、前記測定された一連のオフセットの計算された平均に対応する時系列のデータセットの中から、画像データセットを選択するステップによりさらに決定され、したがって、前記選択されたオフセットは、必ずしも前記心臓周期の休止期に対応していない、請求項26に記載の方法。
【請求項28】
前記オフセットは、前記特定された一連のオフセットの計算された時間平均を含む、請求項26に記載の方法。
【請求項29】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムであって、
前記心臓から、3次元の計画画像データを取得するための画像取込みデバイスと、
前記体内で、前記心臓の組織と結合できる埋込み可能な位置代替物と、
前記体の外側から、電離放射線の複数のビームを送信するための放射線源と、
前記心臓の標的部位を特定するための入力を有する計画モジュールを備えるプロセッサ・システムであり、前記計画モジュールは、前記標的部位および前記計画画像データに応じて前記放射線ビームの計画を生成し、前記プロセッサ・システムは、前記放射線源と結合されて、前記放射線ビームが前記心臓の前記標的部位を再建することにより疾患を軽減するように、前記埋め込まれた代替物を参照して前記放射線ビームを前記標的部位に向けて送る、プロセッサ・システムと
を備えるシステム。
【請求項30】
前記心臓の計画画像を出力するように構成された前記計画モジュールのディスプレイをさらに備え、前記計画モジュールの前記入力は、前記心臓画像の3次元位置を指定し、前記心臓は3次元の心臓画像を含む、請求項29に記載のシステム。
【請求項31】
前記計画モジュールは、前記計画された放射線ビームに基づき、前記心臓画像上に前記心臓の推定された損傷をグラフィカルに重畳する、請求項30に記載のシステム。
【請求項32】
前記代替物は、使用中、前記体の外側で使い捨て可能な近位端と、前記代替物を支持し、かつ血管を介して挿入可能な遠位端と、前記代替物が心拍で誘起された前記組織の動きを示すように、組織に対して前記代替物を解放可能に結合するための組織取付け表面とを有する細長い可撓性のある本体により支持される、請求項29に記載のシステム。
【請求項33】
前記代替物は、前記代替物と前記標的域の間の3次元オフセット方向が、前記心臓画像中の基準マーカから決定することができるように、非共線構成を有する1組の別個の基準マーカを備える、請求項32に記載のシステム。
【請求項34】
前記取付け表面は、前記組織中にねじ込むように配置された螺旋構造を備える、請求項32に記載のシステム。
【請求項35】
前記取付け表面は、前記組織が境界を成す管腔または心腔へと挿入するための第1の構成と、前記組織に固定されて係合するための第2の拡大可能な構成とを有する拡大可能な本体上に配置される、請求項32に記載のシステム。
【請求項36】
前記代替物は、能動的な3次元の位置指示器を備える、請求項32に記載のシステム。
【請求項37】
前記プロセッサは、前記位置指示器からの位置を示す信号に応じて、前記埋め込まれた代替物の位置を、前記計画画像データに登録する、請求項32に記載のシステム。
【請求項38】
前記位置を示す信号は、前記代替物と、前記体の外側の位置センサもしくは送信器との間のオフセットを示し、前記プロセッサは、前記計画画像データに応じて、前記位置を示す信号を較正するように構成され、前記計画画像データは、前記センサまたは送信器を包含する、請求項37に記載のシステム。
【請求項39】
前記位置指示器は、前記プロセッサ・システムに結合された超音波または電磁式位置指示システム内に含まれるセンサもしくは信号発生器を備え、前記プロセッサ・システムは、前記位置を示す信号に応じて、前記放射線ビームを前記標的域に向けて送る、請求項32に記載のシステム。
【請求項40】
前記プロセッサ・システムは、検証画像システムからの間欠的な検証画像間の前記位置を示す信号を用いて前記計画された放射線を送り、かつ前記間欠的な検証画像を用いて、前記計画された放射線の送りを検証し、かつ改良するように、前記プロセッサ・システムに結合された追跡検証画像取得システムをさらに備える、請求項32に記載のシステム。
【請求項41】
前記プロセッサ・システムは、前記代替物を埋め込んだ後に取得された登録データに応じて、前記計画画像データを前記埋め込まれた代替物に登録するように構成され、前記登録データは、前記心臓および前記埋め込まれた代替物を包含する、請求項29に記載のシステム。
【請求項42】
前記登録データは、3次元画像データを含み、前記登録画像データおよび前記計画画像データは、同じ撮像モダリティを用いて取得される、請求項41に記載のシステム。
【請求項43】
登録画像取得システムをさらに備え、前記登録データは、第1の撮像モダリティを用いて取得された3次元画像データを含み、前記計画画像データは、前記第1の撮像モダリティとは異なる第2の撮像モダリティを用いて取得される、請求項41に記載のシステム。
【請求項44】
登録データに三次元画像データを有し、形成されるプロセッサは、計画画像データにおいて心臓の表層を分割して、登録画像データにおいて心臓の表層を分割して、表層分割を用いている植設された代用物を有する計画画像データを登録する、請求項41に記載のシステム。
【請求項45】
対照が室または容器に配置される間、各々得られているイメージング・コントラスト、計画画像データおよび登録データから更に成ることは血液/組織インタフェース面によってよく似ていた。そこにおいて、プロセッサは血液/組織インタフェース面に関して代用物を登録するように構成される、請求項41に記載のシステム。
【請求項46】
登録データに、代用物の作動中の位置指示器からの超音波または電磁気のポジション信号が設けられている、請求項41に記載のシステム。
【請求項47】
代用物に、標識が登録データの三次元相殺された方位を定めるために十分に非同一直線上であるように、画像有能な標識が細長い可撓性血管内本体によって支持した複数の独立した装置が設けられている登録画像取得システムを有する、請求項41に記載のシステム。
【請求項48】
放射線治療ソースを植設された基準に合わせるのを容易にするためにプロセッサに連結する配列画像獲得装置から更に成っている請求項41のシステム。
【請求項49】
前記計画画像取込みデバイスおよび前記プロセッサと結合された計画画像心拍周期センサをさらに備え、前記計画画像データは、前記心拍周期との心臓組織の動きを示すために、前記心拍周期の全体を通して分散された時系列の3次元画像データセットを含んでおり、
前記プロセッサは、放射線に影響されやすい周囲組織を特定することにより、かつ過度に周囲組織を照射することなく、所望の放射線量を前記標的部位に送るのに適した一連の放射線ビームを決定することにより、前記治療を計画するように構成された計画モジュールを備え、
前記標的部位を再建しながら前記体の前記心拍周期を監視するために、前記プロセッサに結合された治療心拍周期センサと、前記体および前記放射線源の間の位置合せを変更するためのロボットとをさらに備えている、請求項29に記載のシステム。
【請求項50】
前記プロセッサは、前記放射線を前記標的部位に送りながら、前記監視された心拍周期に応じて、前記ロボットを用いて前記組織の前記動きの少なくとも一部を追跡することにより、前記放射線量を前記標的部位に送るように構成され、
前記代替物の埋込みは、前記代替物は前記心拍周期と共に動くように、前記代替物を前記心臓に結合するために、血管を介して挿入可能な少なくとも1つの細長い可撓性のある本体により支持され、前記プロセッサは、前記時系列の画像データセットを用いて、前記代替物と前記標的部位の間の時間平均オフセットを決定するように、かつ前記代替物の位置を決定することにより前記標的部位を追跡し、かつ前記心拍周期、前記代替物の前記決定された位置、および前記時間平均オフセットを用いて前記標的部位に前記放射線ビームを送るように構成されている、請求項49に記載のシステム。
【請求項51】
前記プロセッサは、前記時系列の画像データセットから、一連の3次元の画像オフセットを特定することにより、前記心臓周期に対する前記時間平均オフセットを決定し、また前記時間平均オフセットは、前記心臓周期の全体を通して適用され、したがって、前記心拍周期中に前記代替物と前記標的部位の間の組織変形は追跡されることのない、請求項50に記載のシステム。
【請求項52】
前記プロセッサは、前記測定された一連のオフセットの計算された平均に対応する時系列のデータセット中から画像データセットを選択することにより、前記時間平均オフセットを決定し、したがって、前記選択されたオフセットが必ずしも前記心臓周期の休止期に対応していない、請求項51に記載のシステム。
【請求項53】
平均が相殺した時間に、オフセットの確認された連続の算出時間平均が設けられている、請求項51に記載のシステム。
【請求項54】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムで使用するための治療キットであって、前記放射線外科手術システムは、前記疾患を軽減するために、計画ごとに前記患者の体の外側から電離放射線の複数のビームを送信するための放射線源を有しており、前記放射線外科手術システムは、前記心臓の標的部位の動きに前記放射線ビームを同期させるための複数の追跡入力を有しており、
前記患者の心臓周期信号を前記放射線外科手術システムの第1の追跡入力に送るために、前記患者に結合可能な電極と、
前記患者の血管を介して挿入可能な近位端および遠位端を有する細長い可撓性のある本体と、
前記代替物は、前記放射線外科手術システムの第2の追跡入力を生成するために、適切に前記心臓と共に動くように、前記心臓と動作可能な係合へと挿入可能とする前記可撓性のある本体の前記遠位端により支持される位置代替物と
を備える治療キット。
【請求項55】
電極、可撓体および代用物を含んでいるパッケージから更に成っている、請求項54の処理キット。
【請求項56】
遠隔画像処理システムを含んでいるラジオ外科的システムの第2の入力であり、三次元オフセットを代用物および目標地域との間に定めるために展開されるときに、代用物は十分に非同一直線上の構成を有する一組の受動的なハイコントラスト基準マーカから成る、請求項55に記載の処理キット。
【請求項57】
基準で設定されたものは、線形挿入構成を有する、請求項56に記載の処理キット。
【請求項58】
代用物に、超音波または電磁部品が超音波または電磁気のシステムの範囲内で含んだ能動態、超音波から成っている第2の入力または入力される電磁信号に拠点を置くポジションが設けられている、請求項55に記載の処理キット。
【請求項59】
末端を添付すること間の固定面本体を延長する心臓の組織であり、固定面は、放射状に拡張可能な本体、真空シールボディまたは螺旋形の固定ネジによって規定される、請求項55に記載の処理キット。
【請求項60】
本体の呼吸移動のイメージングを許容するために本体の露出表面に取り付け可能な体表標識から成る、請求項55に記載の処理キット。
【請求項61】
電極に一組の心電図電極が設けられている、請求項55に記載の処理キット。
【請求項62】
超音波イメージング・トランスデューサを患者の皮膜に添付することに適している接着パッチから更に成る、請求項55に記載の処理キット。
【請求項63】
放射ビーム、患者に挿入可能な末端、そして、その間にあるルーメン、密封して細長い本体を受けている内腔。の間、患者の皮膚に取り付け可能な近端部を有する案内管シースから成る、請求項55に記載の処理キット。
【請求項64】
噴門ガイドワイヤの一つ以上、ルーメンに対する細長い本体のルーメンによるイメージング・コントラスト配達可能なものまたは心臓、麻酔皮膚を洗っている溶液、ロケータ針またはガイドワイヤの室から更に成る、請求項55に記載の処理キット。
【請求項65】
非腫瘍性の疾患のある心臓を有する患者の体を治療するための放射線外科手術システムであって、
血管内から、前記体内の前記心臓の組織に回収可能に取り付けることのできる埋込み可能な位置代替物と、
前記心臓から3次元の計画画像データを取得するための画像取込みデバイスと、
前記体の外側から電離放射線の複数のビームを送るための放射線源と、
前記代替物の位置に応じて、位置データを生成するための追跡システムと、
前記心臓の標的部位を特定するための入力を有する計画モジュールを備えるプロセッサ・システムであり、前記計画モジュールは、前記標的部位および前記計画画像データに応じて前記放射線ビームの計画を生成し、前記プロセッサ・システムは、前記追跡システムを前記放射線源と結合して、前記放射線ビームが前記心臓の前記標的部位を再建することにより疾患を軽減するように、前記埋め込まれた代替物を参照して前記放射線ビームを前記標的部位に向けて送る、プロセッサ・システムと
を備えるシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6A】


【図6D】


【図6E】


【図6H】


【図6I】


【図6J】


【図6K】


【図6Ki】


【図6L】


【図7】


【図7A】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図9A】


【図9B】


【図9C】


【図12A】


【図13】


【図14a】


【図14b】


【図14c】


【図14d】


【図14e】


【図16】


【図6B】


【図6C】


【図6F】


【図6G】


【図10】


【図11】


【図12】


【図15A】


【図15B】




【図2】


【図3】


【図4】


【図5】


【図6A】


【図6D】


【図6E】


【図6H】


【図6I】


【図6J】


【図6K】


【図6Ki】


【図6L】


【図7】


【図7A】


【図8A】


【図8B】


【図8C】


【図8D】


【図8E】


【図8F】


【図9A】


【図9B】


【図9C】


【図12A】


【図13】


【図14a】


【図14b】


【図14c】


【図14d】


【図14e】


【図16】


【図6B】


【図6C】


【図6F】


【図6G】


【図10】


【図11】


【図12】


【図15A】


【図15B】


【公表番号】特表2012−533364(P2012−533364A)
【公表日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願番号】特願2012−520824(P2012−520824)
【出願日】平成22年7月16日(2010.7.16)
【国際出願番号】PCT/US2010/042344
【国際公開番号】WO2011/009087
【国際公開日】平成23年1月20日(2011.1.20)
【出願人】(512011336)サイバーハート, インコーポレイテッド (2)
【Fターム(参考)】
【公表日】平成24年12月27日(2012.12.27)
【国際特許分類】
【出願日】平成22年7月16日(2010.7.16)
【国際出願番号】PCT/US2010/042344
【国際公開番号】WO2011/009087
【国際公開日】平成23年1月20日(2011.1.20)
【出願人】(512011336)サイバーハート, インコーポレイテッド (2)
【Fターム(参考)】
[ Back to top ]

