不斉水素化のための触媒的プロセス
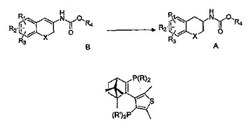
式Aの化合物のS又はR鏡像異性体の製造方法であって、該方法は、式Bの化合物をキラル遷移金属触媒及び水素源の存在下で不斉水素化させることを含み、式中XはCH2、酸素又はイオウであり;R1、R2及びR3は、同じであるか又は異なり、水素、ハロゲン、アルキル、アルキルオキシ、ヒドロキシ、ニトロ、アルキルカルボニルアミノ、アルキルアミノ、又はジアルキルアミノ基を表し;かつR4はアルキル又はアリールであり、該遷移金属触媒は、下記式を有するキラル配位子を含み、式中R及びR'のそれぞれは独立して、アルキル、アリール、アラルキル、アルケニル、アルキニル、アルコキシ、アリールオキシ、アルキルチオ、アリールチオ、単環式若しくは多環式の飽和した若しくは一部飽和した炭素環若しくは複素環からなる群から選択される非置換若しくは置換環状部位、又は芳香族環若しくはヘテロ芳香族環を表し、前記環は、原子4〜8個を含み、かつヘテロ原子0〜3個を含み:ここで用語アルキルは、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキル、アルキルオキシ、ハロゲン、又はニトロ基によって1以上置換された芳香族又はヘテロ芳香族基を意味し;及び用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する。
【化1】

【化1】

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、不斉水素化のための改善された触媒プロセスに関する。具体的には、本発明は、ドーパミン-β-ヒドロキシラーゼ(DβH)の末梢選択的阻害剤の合成に有用な中間体の製造方法であって、触媒的不斉水素化を含む該方法、並びに該水素化に使用するのに有利な配位子、及び該配位子を組込んでいる新規触媒に関する。
【背景技術】
【0002】
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩(下記式1の化合物)は、良く効き、無毒性で、かつ末梢選択的なDβHの阻害剤であり、特定の心血管障害の治療に使用することができる。化合物1は、その製造方法とともにWO2004/033447に開示されている。
【化1】

【0003】
WO2004/033447に開示される方法は、(R)-6,8-ジフルオロクロマン-3-イルアミン塩酸塩、[4-(tert-ブチルジメチルシラニルオキシ)-3-オキソブチル]カルバミン酸tert-ブチルエステル、及びチオシアン酸カリウムの反応を含む。(R)-6,8-ジフルオロクロマン-3-イルアミンの構造を、化合物2として下記に示す。
【化2】

【発明の概要】
【0004】
化合物1の合成において、(R)-6,8-ジフルオロクロマン-3-イルアミン(化合物2)は鍵となる中間体である。アミンが付加される炭素原子の立体化学は、化合物1の立体的配置を生じさせるので、化合物2は、できるだけ鏡像異性的に純粋な形態で存在していることが有利である。言い換えれば、望ましい鏡像異性体(例えば、R体)が優位となるのであり、望ましくない鏡像異性体(例えば、S体)は、ほとんど又は全く存在しない。したがって、上記化合物2として示したR-鏡像異性体が、できる限り高い鏡像体過剰率で生成されることが有利である。
【0005】
例えば、現在、式2の化合物の前駆体を製造するのに有利な方法が見出されている。該方法は、下記式を有するキラル配位子を含む遷移金属触媒を用いる、対応するエン-カルバマート(ene-carbamate)の触媒的不斉水素化を含む。
【化3】

【0006】
そのような配位子及びそれらの製造のための方法は、EP1595888A1に記載されている。また該方法は、ドーパミン-β-ヒドロキシラーゼの他の末梢選択的阻害剤の製造に有用な類似の前駆体の製造にも使用することができる。該触媒は、不斉水素化反応において高い活性及び選択性を示すので特に有利である。該水素化が酸添加物の存在下で行われる場合に、活性及び選択性のレベルが改善されることも示されている。更に、該触媒は、水素化が大規模で行われる場合に非常に効果的であることが示されており、これは該触媒を工業的使用に大いに適したものにする。より具体的には、80Ogの基質を用いて、99%を超える光学純度及び90%を超える収率で目的のキラル生成物を生成し得ることが見出されている。
【発明を実施するための形態】
【0007】
本発明の第1の態様により、式Aの化合物のS又はR鏡像異性体の製造方法を提供する。
【化4】

該方法は、式Bの化合物をキラル遷移金属触媒及び水素源の存在下で不斉水素化させることを含み、
【化5】

式中:XはCH2、酸素又はイオウであり;R1、R2及びR3は、同じであるか又は異なり、水素、ハロゲン、アルキル、アルキルオキシ、ヒドロキシ、ニトロ、アルキルカルボニルアミノ、アルキルアミノ、又はジアルキルアミノ基を表し;かつR4は、アルキル又はアリールであり、該遷移金属触媒は、下記式を有するキラル配位子を含み、
【化6】

式中R及びR'のそれぞれは独立して、アルキル、アリール、アラルキル、アルケニル、アルキニル、アルコキシ、アリールオキシ、アルキルチオ、アリールチオ、単環式若しくは多環式の飽和した若しくは一部飽和した炭素環若しくは複素環からなる群から選択される非置換若しくは置換環状部位、又は芳香族環若しくはヘテロ芳香族環を表し、前記環は、原子4〜8個を含み、かつ任意にヘテロ原子1〜3個を含み:ここで用語アルキルは、単独又は他の部位との組合せにかかわらず、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキルオキシ、ハロゲン、又はニトロ基によって置換された芳香族又はヘテロ芳香族基を意味し;及び用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する。該置換基は、置換されたそれら自身とすることができる。一実施態様において、用語アリールは、原子4〜8個を含み、かつ任意にヘテロ原子1〜3個を含む芳香環を意味することができる。好適には、アリールは、フェニル又はナフチルを意味する。化合物Bは、エン-カルバマートと呼ぶことができる。
【0008】
本発明の方法に使用されるキラル配位子は、商標名「CatASium(商標)T」で公知の一連の配位子からもたらされる。本明細書を通して、「CatASium(商標)T」シリーズの配位子への言及は、下記式を有するキラル配位子を意味する。
【化7】

【0009】
一実施態様において、水素源は水素ガスである。
一実施態様において、XはOである。別の実施態様において、R1、R2及びR3の少なくとも1つはハロゲン、好ましくはフッ素である。好ましくはR1、R2及びR3の2つはハロゲン、好ましくはフッ素であり、R1、R2及びR3のその他は水素である。好適には、化合物Aは下記式を有する。
【化8】

【0010】
一実施態様において、R4はC1〜C4アルキルである。任意に、R4はメチル(すなわち、メチル置換されたエン-カルバマート)、エチル(すなわち、エチル置換されたエン-カルバマート)又はtBu(すなわち、tBu置換されたエン-カルバマート)である。好ましくは、R4はメチルである。他の実施態様において、R4はベンジル(すなわち、ベンジル置換されたエン-カルバマート)である。
【0011】
好ましくは、触媒中の遷移金属は、ロジウム又はルテニウムである。最も好ましいのは、ルテニウムである。
ルテニウム触媒水素化検討から、CatASium(商標)Tシリーズをベースとした触媒の存在下で、メチル置換エン-カルバマートを使用して、完全な変換及び90%を超えて最大95%のe.eが得られることが明らかになっている。
【0012】
ロジウムベースの触媒を使用する不斉水素化も検討されている。特に、[Rh-(catASium(商標))(L)]X"カチオン錯体(式中L=シクロオクタジエン、及びX"=BF4)が検討されている。Rh-CatASium(登録商標)触媒水素化は、エン-カルバマート基質に対する中度から高度の活性、及び低度のエナンチオ選択性が明らかになった。
【0013】
好適には、該触媒は、式[(catASium(商標)T)Ru(アレーン)X']Y、[(catASium(商標)T)Ru(L)2]又は[(catASium(商標)T)Ru(L')2X'2]を有し、式中X'は一価負の単座配位子(singly-negative monodentate ligand)であり、Yは釣合せアニオン(balancing anion)であり、Lは一価負の配位性配位子(monovalent negative coordinating ligand)であり、及びL'は非イオン性単座配位子である。
【0014】
一実施態様において、X'は塩素である。別の実施態様において、Yは塩素である。X'及びYの両方を塩素とすることができる。別の実施態様において、アレーンはp-シメン又はベンゼンである。好ましくは、Lはacacである。好適には、L'はジメチルホルムアミド(dmf)である。配位子の他の選択肢を挙げると、アセチル、トリフルオロアセチル、テトラフルオロボラート、並びにモノ及びジアミンがある。
【0015】
あるいは、該触媒はRu(catASium(商標)T配位子)(acac)2、Ru(catASium(商標)T配位子)Br2、Ru(catASium(商標)T配位子)Cl2(Ar)(式中Arは、C6H6(すなわち、ベンゼン)又はp-シメンである。)、又はRu(catASium(商標)T配位子)Cl2(dmf)x(式中xは、好適には2、3又は4である。)である。Tシリーズからの配位子の適当な例を下記のスキーム1に示す。また、スキーム1のそれとは反対の立体化学を有する配位子も、本発明の不斉水素化に使用することができる。
【化9】

【0016】
化合物Iは商標名CatASium(商標)T1で公知である。化合物IIは商標名CatASium(商標)T2で公知である。化合物IIIは商標名CatASium(商標)T3で公知である。化合物IVは商標名CatASium(商標)T4で公知である。本明細書を通して、CatASium(商標)T1、T2、T3又はT4への言及は、それぞれ上に示した各構造を有する化合物I、II、III又はIVを意味する。
【0017】
好ましくは、該配位子はCatASium(商標)T3のR又はS鏡像異性体である。CatASium(商標)T3 は、化学名(1R)-3-ジフェニルホスフィノ-[4-ジ-(3,5-ジメチルフェニル)ホスフィノ-2,5-ジメチルチエニル-3)-1,7,7-トリメチルビシクロ[2.2.1]ヘプテン-2を有する。好適には、該配位子はCatASium(商標)T3のR鏡像異性体である。
【0018】
好ましくは、該活性遷移金属触媒は、水素化反応の前に事前形成(pre-form)される。あるいは、該活性遷移金属触媒は原位置(in situ)で形成される。すなわち、該触媒は水素化反応の前に単離されないが、反応ポット中でその前駆体配位子から形成される。該触媒は、前駆体化合物から事前形成されていてよい。例えば、Ru(catASium(商標)T配位子)(acac)2は、Ru(η-4-ヘキサジエン)(acac)2及びcatASium(商標)T配位子から製造されていてよい。Ru(catASium(商標)T配位子)Br2は、Ru(メチルアリル)2COD、catASium(商標)T配位子及びHBrから製造されていてよい。Ru(catASium(商標)T配位子)Cl2(C6H6)は、[Ru(C6H6)Cl2]2、catASium(商標)T配位子及びジクロロメタン/エタノールの1:1混合物から製造されていてよい。Ru(catASium(商標)T配位子)Cl2(p-シメン)は、[Ru(p-シメン)Cl2]2、catASium(商標)T配位子及びジクロロメタン/エタノールの1:1混合物から製造されていてよい。Ru(catASium(商標)T配位子)Cl2(dmf)xは、[Ru(C6H6)Cl2]2、catASium(商標)T配位子及びDMFから製造されていてよい。
【0019】
基質:触媒(S/C)比は、好ましくは100/1〜5000/1、より好ましくは250/1〜4000/1、更により好ましくは500/1〜2000/1である。更により好ましくは1000/1〜2000/1である。最も好ましくは、S/C比は2000/1である。
該水素化は、好ましくは40℃〜100℃の範囲の温度、より好ましくは40℃〜90℃の範囲の温度、更により好ましくは50℃〜90℃の範囲の温度、更により好ましくは60℃〜90℃の範囲の温度で行われ、最も好ましくは、該水素化は80℃の温度で行われる。
【0020】
該水素化は、好ましくは10バール〜70バールの範囲の圧力、より好ましくは10バール〜60バールの範囲の圧力、更により好ましくは20バール〜50バールの範囲の圧力、更により好ましくは20バール〜40バールの範囲の圧力で、及び更により好ましくは20バール〜30バールの範囲の圧力で行われる。最も好ましくは、該水素化は、20バール〜30バールの圧力で行われる。
【0021】
最も好ましい実施態様において、該水素化は酸の存在下で行われる。適当な酸を挙げると、HBF4、HCl、HBr、H2SO4、CF3SO3H、CH3COOH及びH3PO4がある。好ましくは、該酸は、エタン酸又はリン酸などの弱酸である。好適には、エタン酸は50%(v/v)〜20%(v/v)の範囲の濃度で存在する。リン酸は、10%(v/v)〜0.01%(v/v)、好ましくは5%(v/v)〜0.01%、より好ましくは1%(v/v)〜0.01%、更により好ましくは0.5%(v/v)〜0.05%の濃度で存在し得る。リン酸の最も好ましい濃度は、0.1%(v/v)である。
【0022】
一実施態様において、該酸は溶媒中に存在している。例えば、該酸溶媒は、ジエチルエーテル又は水である。典型的に、該酸溶媒の濃度は、80%(w/w)〜90%(w/w)、好ましくは85%(w/w)である。最も好ましいリン酸溶液は、水中に85%(w/w)である。
【0023】
好ましくは、該水素化は溶媒中で行われる。該溶媒は、置換又は非置換の直鎖又は分枝C1〜C6アルコール、アレーン又はそれらの混合物から選択することができる。適当な溶媒を挙げると、MeOH、EtOH、i-PrOH、1-PrOH、1-BuOH、2-BuOH、CF3CH2OH、ジクロロメタン(DCM)、ジクロロエタン(DCE)、テトラヒドロフラン(THF)、トルエン又はMeOHとDCMとの1:1混合物がある。好ましくは、該溶媒はMeOH又はDCMである。最も好ましくは、該溶媒はMeOHである。
好ましくは、該反応混合物は水素化プロセスを通して完全に混合される。
【0024】
更なる実施態様において、該方法は、式Aの化合物を実質的に結晶化することを更に含む。任意に、該結晶化はDCM/ヘキサン中で行われる。
一実施態様において、化合物AはS鏡像異性体の形態である。別の実施態様において、化合物AはR鏡像異性体の形態である。
例えば、化合物Bは、Tetrahedron:Asymmetry 10 (1999) 3467-3471に記載の方法によって製造することができる。
【0025】
より更なる実施態様において、該方法は、化合物AのR又はS鏡像異性体を、式Cの各R若しくはS鏡像異性体、又はその塩に変換することを更に含む。
【化10】

化合物Aは、-C(=O)-O-R4基をHで置換することを含む反応によって化合物Cに変換することができる。
【0026】
一実施態様において、化合物AのR又はS鏡像異性体は、加水分解によって式Cの各化合物のR又はS鏡像異性体に変換される。加水分解はメタノール中で40%水酸化カリウムを用いて行うことができ、続いて粗製アミンを単離し、L-酒石酸との塩としてアミンを結晶化する。
【0027】
本発明の別の態様において、式Eの化合物のR若しくはS鏡像異性体、又はその塩を形成する方法を提供する。
【化11】

該方法は、上記方法に従って式Cの化合物のR又はS鏡像異性体を形成すること、及び該式Cの化合物のR又はS鏡像異性体を、式Eの化合物のR又はS鏡像異性体に変換することを含む。一実施態様において、化合物Cを化合物Eの置換イミダゾール-2-チオン環のN(1)部位を構築するためのアミノ成分として用いることによって、化合物Cは化合物Eに変換される。一実施態様において、化合物Cのアミノ基は、5位の置換基が-(CH2)n-NHR12基(式中R12は、水素、アルキル又はアルキルアリール基を表す。)である5-置換イミダゾール-2-チオン基に変換される。
【0028】
より更なる実施態様において、該方法は、式Cの化合物のR又はS鏡像異性体を式Dの化合物と、実質的に不活性な溶媒中、有機酸の存在下で水溶性チオシアン酸塩とともに反応させて、中間体生成物E〜Hを生成すること、
【化12】

式中nは1、2又は3を表し;nが1又は2である場合、R12は水素、アルキル又はアルキルアリール基を表し、R11はヒドロキシル保護基を表し、かつR13はアミノ保護基を表し;nが3である場合、R11はヒドロキシル保護基を表すが、R12及びR13は互いに結合してフタルイミド基を表し;該水溶性チオシアン酸塩はアルカリ金属チオシアン酸塩又はテトラアルキルアンモニウムチオシアン酸塩であり、
【化13】

続いて、後続の中間生成物E〜Hの脱保護を行い、式Jの化合物の各R又はS鏡像異性体、又はその塩を生成することを更に含み、
【化14】

ここで用語アルキルは、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキルオキシ、ハロゲン、又はニトロ基によって置換されたフェニル又はナフチル基を意味し;用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する。
【0029】
一実施態様において、XはOである。別の実施態様において、nは2又は3である。一実施態様において、XはOであり、かつnは2である。あるいは、XはOであり、かつnは3である。更なる実施態様において、R1、R2及びR3の少なくとも1つはフッ素である。任意に、式Jの化合物は下記化合物である:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン又は
(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
【0030】
また、式Jの化合物は下記化合物の塩であってもよい:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン又は
(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
好ましくは、該塩は塩酸塩である。
【0031】
一実施態様において、式Jの化合物は、式1の化合物の各R又はS鏡像異性体である。
【化15】

【0032】
本発明の別の態様により、下記式を有するキラルcatASium(商標)Tシリーズ配位子を含む遷移金属錯体の使用を提供する。
【化16】

式中R及びR'は、式Bの化合物の不斉水素化における上記のものであり、
【化17】

ここで化合物Bは上記のものである。
【0033】
好ましくは、触媒はRu(catASium(商標)Tシリーズ配位子)(acac)2、Ru(catASium(商標)Tシリーズ配位子)Br2、Ru(catASium(商標)Tシリーズ配位子)Cl2(Ar)(式中Arは、C6H6 又はp-シメンである。)、又はRu(catASium(商標)Tシリーズ配位子)Cl2(dmf)x(式中xは、好適には2、3又は4である。)である。好ましくは、該触媒は、式Ru(catASium(商標)Tシリーズ配位子)(acac)2を有する。
【0034】
好ましくは、該catASium(商標)Tシリーズ配位子は、catASium(商標)T1、catASium(商標)T2、catASium(商標)T3、又はcatASium(商標)T4のR又はS鏡像異性体である。好ましくは、catASium T配位子はR鏡像異性体の形態である。最も好ましくは、該catASium(商標)Tシリーズ配位子は、catASium(商標)T3のR鏡像異性体である。最も好ましい触媒は、式Ru(catASium(商標)T3)(acac)2を有する。
一実施態様において、該触媒は事前形成される。
別の実施態様において、該水素化は酸の存在下で行われる。
【0035】
本発明の別の態様により、下記式のCatASium(登録商標)T配位子を含む事前形成された遷移金属触媒の製造方法を提供する。
【化18】

式中R及びR'は上記と同じ意味を有し、該方法は、DMF 中で[Ru(C6H6)Cl2]2の遷移金属前駆体化合物をCatASium(登録商標)T配位子と反応させること、及び該触媒を後続のプロセスで使用する前に、該遷移金属触媒を単離することを含む。該触媒は、Ru(catASium(商標)Tシリーズ配位子)Cl2(dmf)x(式中xは2、3又は4である。)とすることができる。
【0036】
本発明の別の態様により、下記式のCatASium(商標)T配位子を含む遷移金属触媒の製造方法を提供する。
【化19】

式中R及びR'は、上に規定したものと同じ意味を有する。該方法は、遷移金属前駆体化合物をcatASium(商標)T配位子と反応させることを含み、ここで該前駆体化合物は[Ru(C6H6)Cl2]2ではなく、かつ該溶媒はDMFではない。
【0037】
一実施態様において、遷移金属触媒は、後続のプロセスに使用される前に単離される。別の実施態様において、該遷移金属触媒は原位置で形成される。
一実施態様において、該触媒はRu(catASium(商標)Tシリーズ配位子)(acac)2、Ru(catASium(商標)Tシリーズ配位子)Br2、又はRu(catASium(商標)Tシリーズ配位子)Cl2(C6H6)である。
一実施態様において、該触媒はRu(catASium(商標)T配位子)(acac)2触媒であり、かつ該前駆体はRu(η4-ヘキサジエン)(acac)2である。
【0038】
一実施態様において、該触媒はRu(catASium(商標)T配位子)Br2であり、かつ該前駆体はRu(メチルアリル)2CODである。
一実施態様において、該触媒はRu(catASium(商標)Tシリーズ配位子)Cl2(C6H6)であり、該前駆体は[Ru(C6H6)Cl2]2であり、かつ該方法はジクロロメタン/エタノールの1:1混合物の存在下で行われる。
【0039】
一実施態様において、該触媒は、Ru(catASium(商標)Tシリーズ配位子)Cl2(p-シメン)、該前駆体は[Ru(p-シメン)Cl2]2であり、かつ該プロセスはジクロロメタン/エタノールの1:1混合物の存在下で行われる。
適当なcatASium(商標)Tシリーズ配位子を上記のスキーム1に示す。好ましいcatASium(商標)Tシリーズ配位子は、catASium(商標)T3のR又はS鏡像異性体であり、より好ましくはcatASium(商標)T3のR鏡像異性体である。
【0040】
本発明の別の態様により、該キラル遷移金属触媒が上記方法に従って製造される、上記方法に従って式Aの化合物のS又はR鏡像異性体を製造する方法を提供する。
一実施態様において、該キラル遷移金属触媒は、式Bの化合物と反応させる前に単離される。
一実施態様において、該キラル遷移金属触媒は原位置で形成される。言い換えると、該触媒は、式Bの化合物と反応させる前に単離されない。
【0041】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)(acac)2を提供する。一実施態様において、該Ru(catASium(商標)T配位子)(acac)2は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)(acac)2は上記方法に従って製造される。
【0042】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子) Br2を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Br2は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)Br2は上記方法に従って製造される。
【0043】
本発明の別の態様により、単離された状態のRu(catASium(商標)T配位子)Cl2(dmf)xを提供する。式中xは2、3又は4であり、かつ該catASium(商標)T配位子は、catASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(dmf)xは上記方法に従って製造される。
【0044】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)Cl2(C6H6)を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(C6H6)は単離されている。別の実施態様において、該Ru(catASium(商標)T配位子)Cl2(C6H6)は上記方法に従って製造される。
【0045】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)Cl2(p-シメン)を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(p-シメン)は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(p-シメン)は上記方法に従って製造される。
【0046】
本発明の別の態様により、上記の方法によって製造された(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩を提供する。
【実施例】
【0047】
ルテニウム-CatASium(商標)Tベース触媒(表1〜3及び5〜11)及びロジウム-CatASium(商標)Tベース触媒(表4)を用いて、プロキラルメチルエン-カルバマート1d(下記スキーム2に示す)のエナンチオ選択的水素化における触媒の効果の検討を行った。
【化20】

【0048】
(ルテニウム-CatASium(商標)T触媒作用)
ルテニウムベースの触媒反応を、リン酸の存在下及び非存在下で行った。
触媒活性Ru錯体は、基質の添加の前に下記のように事前形成される:DMF中、[Ru(C6H6)Cl2]2及び配位子からRu(配位子)Cl2(dmf)x;エタノール-ジクロロメタン1:1混合物中、[Ru(Ar)Cl2]2及び配位子から[Ru(配位子)(Ar)Cl]Cl(式中Arは、C6H6又はp-シメンである。);ジクロロメタン中、[Ru(η4-2,4-C6H10)(acac)2]及び配位子から[Ru(配位子)(acac)2];Ru(2-メチルアリル)2COD、配位子及びHBrから[RuBr2(配位子)]である。これらの事前形成の実験条件を下記に示す。
【0049】
(MPC1:Ru(配位子)Cl2(dmf)xの事前形成)
0.001mmolの各配位子及び0.0005mmolの[Ru(C6H6)Cl2]2を、アルゴン下で0.05mlのDMFに溶解させ、105℃で10分間温めた。次いで、それらを室温まで冷却した。
【0050】
(MPC2:Ru(配位子)Cl2(C6H6)の事前形成)
0.001mmolの各配位子及び0.0005mmolの[Ru(C6H6)Cl2]2を、アルゴン下で0.1mlのジクロロメタン/エタノール1:1混合物に溶解させ、50℃で1.5時間温めた。次いで、それらを室温まで冷却した。
【0051】
(MPC3:Ru(配位子)(acac)2の事前形成)
このルテニウム塩の合成は、Ziegler, M.L.らの文献、Organometallics 1991, 10, 3635-3642から得た。亜鉛の活性化は、Knochel, P.らの文献、「高官能化試薬の製造(Preparation of highly functionalised reagents)」有機銅試薬(Organocopper Reagents)、Oxford University Press, Oxford 1994, p.85に従い行った。
0.001mmolの各配位子及び0.001mmolのRu(η4-ヘキサジエン)(acac)2を、アルゴン下で0.1mlのジクロロメタンに溶解させ、室温で20〜30分間撹拌した。
【0052】
(MPC4:Ru(配位子)Br2の事前形成)
0.001mmolの各配位子及び0.001mmolのRu(メチルアリル)2CODを、アルゴン下で0.05mlのアセトンに溶解し、2当量のHBr(メタノールで希釈して水性の48%HBrから調製される溶液)を添加した。該混合物を室温で30分間撹拌した。
【0053】
(水素化条件)
MeOH中、60℃及び30バールのH2において、S/C比100で18時間、再現性実験を行った。より具体的には、MeOH中0.25Mの基質1dの溶液0.4mlを、事前形成したルテニウム錯体に添加し、任意に85%のH3PO450μlを添加した。
次いで、該反応混合物をオートクレーブに導入し、該オートクレーブを水素でパージした。他に示さない限り、30バールの水素を加圧し、かつ該反応を60℃で18時間温めた。
冷却及び圧力解放後、分析のために生混合物(0.1ml)の試料を採取した。該試料をMeOHで希釈し、幾らかのDeloxan(登録商標)を添加して該反応混合物から金属を除去し、該混合物を室温で10分間振盪し;濾紙で濾過した後に、該試料を0.5mlのメタノール及び0.5mlのiPrOHで希釈した。HPLC法を確立した:ChiralpakAD、MeOH/iPrOH 70/30;0.5ml/分;30℃である。
【0054】
(CatASium(商標)T2の事前形成)
上記の4種のルテニウム金属前駆体(MPC1、MPC2、MPC3及びMPC4)を用いて、リン酸の存在下及び非存在下でCatASium(商標)Tシリーズ配位子T2を試験した。一定量のリン酸(50μl)を添加した。各触媒について変換値(「Con」)及び鏡像体過剰率(「ee」)を2度確認した。
リン酸を伴わず及び伴い行った実験結果を、それぞれ表1及び表2に要約する。
【表1】

a変換(「Con」)及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
【表2】

a変換(「Con」)及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
b50μlのリン酸を使用した。これはおよそ10% v/vを意味する。
【0055】
(CatASium(商標)T1及びT3)
CatASium(登録商標)T2を使用して、高度の変換及び選択性を再現することができ、かつリン酸の存在が触媒性能に有益な効果を有し得ることが示されたことで、TシリーズのCatASium(登録商標)配位子T1及びT3を検討した。実験条件は上記(「水素化条件」の項)と同じであった。結果を下記表3に要約する。
【表3】

a変換は常に100%であった。R-鏡像異性体が得られた。eeの列には両確認実験の結果を示している。
Ru(η4-ヘキサジエン)(acac)2、並びにCatASium(商標)T1、T2及びT3配位子から事前形成した錯体は、H3PO4の存在下で使用した場合に、完全な変換、並びにそれぞれ94%のe.e、93%のe.e及び95%のe.eを与えた。
Ru(メチルアリル)2(COD)、並びにCatASium(商標)T1及びT3配位子から事前形成した錯体は、H3PO4の存在下で使用した場合に、完全な変換、及び90%を超えるe.e(T1で90〜91%のe.e及びT3で92〜93%のe.e)を与えた。
【0056】
(ロジウム-CatASium(商標)T触媒作用)
ジクロロメタン中、30℃、30バールのH2で、一般式[Rh(catASium(商標))(COD)]BF4の触媒を使用するエン-カルバマート1dの水素化は、低エナンチオ選択性となった(表4)。
【表4】

a変換及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
【0057】
(ルテニウム-CatASium(商標)T触媒作用最適化)
(溶媒/添加物/金属前駆体の最適化)
基質/触媒(S/C)比250/1を選択した。圧力及び温度は、前回の実験と同様に保持した。
他の反応パラメータは下記のように選択した:
・溶媒:MeOH及びiPrOH;
・添加物:強及び弱酸を試験した(5%のH3PO4、5%のH2SO4、5%のHBr、20%のAcOH);
・金属前駆体:Ru(η4-ヘキサジエン)(acac)2又はRu(メチルアリル)2CODを試験した。
実験手順は上記(「水素化条件」の項)と同じであった。基質を0.66Mの溶液(0.4ml)として対応する溶媒に導入した。該添加物は0.4mlの溶媒に希釈されるので、最終基質濃度はおよそ0.33Mであった。
【0058】
iPrOHを溶媒として使用する場合に、一般に、高度の変換を伴う全ての反応が主要生成物としてアルコールを示すことが見出された。iPrOHにおいて、ケトンへの加水分解及びその還元は、エン-カルバマートの水素化に対して優先的に起こる。加水分解が観察されなかったのは、ただ1つの実験だけであった。したがって、イソプロパノールは排除し、MeOHを使用した。しかし、低い酸濃度での溶媒としてのiPrOHの使用は、加水分解の抑制及び優先的なエン-カルバマートの水素化をもたらすかもしれない。
【表5】

表6に表5から得られた最良の結果を要約する(変換>96%;ee>90%)。
【表6】

a金属前駆体:MPC3;他に示す場合を除き、変換は100%であった。R-鏡像異性体が得られた。eeの列には両確認実験の結果を示している。
b変換:99%。
【0059】
(温度/圧力/添加物の濃度の最適化)
温度(50℃、60℃及び80℃)、圧力(20、30及び70バールの水素)、及び酸添加物の濃度をより望ましいS/C比(500/1)で変化させた。この点において、MPC3を用いて進めることを決定した(表6の全ての結果はMPC3を用いて得られた。)。
実験手順は上記のものと同じであった(「水素化条件」の項)。基質を0.66Mの溶液(0.8ml)として対応する溶媒に導入した。該添加物は0.8mlの対応する溶媒に希釈されるので、最終基質濃度はおよそ0.33Mであった。表に記載の圧力及び温度の値で、該反応を行った。
各実験から得られた最良の結果を配位子によって分類した:
・CatASium(商標)T1で得られた結果を表7に要約する;
・CatASium(商標)T2で得られた結果を表8に要約する;
・CatASium(商標)T3で得られた結果を表9に要約する。
【0060】
【表7】

・この配位子(T1)は、高温及び高圧で良好に作用する。
・酸の存在は、高度の変換を得るのを助ける。
・0.01%のH3PO4を使用する場合、該反応は80℃及び70バールでより良好に作用し;0.1%のH3PO4を使用する場合、該反応は30バールで高圧時と同様に良好に作用する。
【0061】
【表8】

この配位子の挙動は、CatASium(商標)T1に類似している:
・この配位子(T2)は、高温及び高圧で良好に作用する;
・酸の存在は、高度の変換を得るのを助ける;
・0.01%のH3PO4を使用する場合、該反応は80℃及び70バールでより良好に作用し;0.1%のH3PO4を使用する場合、該反応は30バールで高圧時と同様に良好に作用する。
【0062】
【表9】

この配位子は最良の反応性を示した:
・酸の存在は、高度の変換を得るのに好ましい。高温及び高圧で作用させることによって、酸を回避することができる;
・温度を上昇させることによって、20バールにおいてさえも良好な反応性が得られた。高温及び低圧において、100%の変換及び95%のeeには、わずか0.1%のH3PO4だけが必要である;
・最良の結果(変換における)は、高温及び高圧で得られる。しかし、鏡像体過剰率は数単位低い。高温及び高圧を用いることで、酸は不要である。
【0063】
(S/C最適化)
S/Cの最適化を最良の系(CatASium(商標)T3)で行った。異なるS/C(1000、2000、4000、5000)比を、0.1%のH3PO4の存在下、30バール及び80℃でCatASium(商標)T3を用いて試験した。S/C比を増大させるには2つの方法がある:
・一定の基質量を保ち(S/C 500の実験の場合と同じ値で濃度を一定に維持すること)、かつ触媒量を下げていくこと;
・一定の触媒量を保ち、かつ基質量を増加していくこと;である。
【0064】
両方の方法を試験した。該2つの実験は1%リン酸の存在下で行われた。
実験手順は、上記「水素化条件」の項と同様であった。
各試験用に基質を秤量し、対応する量のメタノールを加えた。該濃度を表10に要約し、結果を表11に要約する。該反応を初期圧力30バールの水素、及び80℃の温度で行った。
【表10】

【表11】

【表12】

変換の差は、反応混合物の撹拌が良好な変換を達成するのに役立ったことを示している。
【0065】
(エナンチオ純度の向上)
鏡像体過剰率は、粗製生成物の結晶化によって上昇させることができる。例えば、結晶化は、残渣が最小量の温ジクロロメタンに溶解している該粗製生成物から蒸発した任意の残留溶媒を含み得る。濾過後、生成物が結晶化を始めるまでゆっくりとヘキサンを添加する。室温で3時間及び4℃で15時間の結晶化の後、該結晶を濾過し、ヘキサンで洗浄した。
【0066】
(規模拡大実験)
大規模での触媒の有効性を調べるために、下記の反応を800g規模(15Lのオートクレーブ中)で行った。
【化21】

実験手順は下記であった:
触媒:EtOH/CH2Cl2中[Ru(p-シメン)Cl2]2 / CatASiumT3;
圧力:20バール;
温度:80℃;
S/C:2000;
濃度:0.7M;
添加物:0.1%のH3PO4;である。
【0067】
[Ru(p-シメン)Cl2]2及びCatASiumT3を、ジクロロメタン/EtOH(1:1)の混合物中、50℃で90分間撹拌し、次いで室温まで冷却した。アルゴン雰囲気下で15Lのオートクレーブに、基質、メタノール及び対応する添加物を加えた。その後、触媒を添加した。該反応を上記の条件で18時間水素化した。
Deloxan(登録商標)を該反応混合物に添加し、触媒を濾過により分離した。該溶媒の蒸発の間(6000mlのおよそ2000mlが蒸発)、沈殿物が形成された。およそ5000mlの蒸留物で蒸留を停止し、該沈殿物を濾過し、少量のメタノールで洗浄した。単離固形物(白色結晶)を40℃、真空下(180〜210ミリバール)で18時間乾燥した。濾液を蒸発乾固し、緑褐色の固形物を得た。
結果を表12に示す。
【表13】

1出発材料はHPLCで検出されなかった。
したがって、800gの基質及び2000:1の基質/触媒比を用いて、望ましいキラル生成物が99%を超える光学純度及び91%の収率で生成されたことが見出された。
本願発明は添付の特許請求の範囲の範囲内で変更し得ることが理解されるであろう。
【技術分野】
【0001】
本発明は、不斉水素化のための改善された触媒プロセスに関する。具体的には、本発明は、ドーパミン-β-ヒドロキシラーゼ(DβH)の末梢選択的阻害剤の合成に有用な中間体の製造方法であって、触媒的不斉水素化を含む該方法、並びに該水素化に使用するのに有利な配位子、及び該配位子を組込んでいる新規触媒に関する。
【背景技術】
【0002】
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩(下記式1の化合物)は、良く効き、無毒性で、かつ末梢選択的なDβHの阻害剤であり、特定の心血管障害の治療に使用することができる。化合物1は、その製造方法とともにWO2004/033447に開示されている。
【化1】

【0003】
WO2004/033447に開示される方法は、(R)-6,8-ジフルオロクロマン-3-イルアミン塩酸塩、[4-(tert-ブチルジメチルシラニルオキシ)-3-オキソブチル]カルバミン酸tert-ブチルエステル、及びチオシアン酸カリウムの反応を含む。(R)-6,8-ジフルオロクロマン-3-イルアミンの構造を、化合物2として下記に示す。
【化2】

【発明の概要】
【0004】
化合物1の合成において、(R)-6,8-ジフルオロクロマン-3-イルアミン(化合物2)は鍵となる中間体である。アミンが付加される炭素原子の立体化学は、化合物1の立体的配置を生じさせるので、化合物2は、できるだけ鏡像異性的に純粋な形態で存在していることが有利である。言い換えれば、望ましい鏡像異性体(例えば、R体)が優位となるのであり、望ましくない鏡像異性体(例えば、S体)は、ほとんど又は全く存在しない。したがって、上記化合物2として示したR-鏡像異性体が、できる限り高い鏡像体過剰率で生成されることが有利である。
【0005】
例えば、現在、式2の化合物の前駆体を製造するのに有利な方法が見出されている。該方法は、下記式を有するキラル配位子を含む遷移金属触媒を用いる、対応するエン-カルバマート(ene-carbamate)の触媒的不斉水素化を含む。
【化3】

【0006】
そのような配位子及びそれらの製造のための方法は、EP1595888A1に記載されている。また該方法は、ドーパミン-β-ヒドロキシラーゼの他の末梢選択的阻害剤の製造に有用な類似の前駆体の製造にも使用することができる。該触媒は、不斉水素化反応において高い活性及び選択性を示すので特に有利である。該水素化が酸添加物の存在下で行われる場合に、活性及び選択性のレベルが改善されることも示されている。更に、該触媒は、水素化が大規模で行われる場合に非常に効果的であることが示されており、これは該触媒を工業的使用に大いに適したものにする。より具体的には、80Ogの基質を用いて、99%を超える光学純度及び90%を超える収率で目的のキラル生成物を生成し得ることが見出されている。
【発明を実施するための形態】
【0007】
本発明の第1の態様により、式Aの化合物のS又はR鏡像異性体の製造方法を提供する。
【化4】

該方法は、式Bの化合物をキラル遷移金属触媒及び水素源の存在下で不斉水素化させることを含み、
【化5】

式中:XはCH2、酸素又はイオウであり;R1、R2及びR3は、同じであるか又は異なり、水素、ハロゲン、アルキル、アルキルオキシ、ヒドロキシ、ニトロ、アルキルカルボニルアミノ、アルキルアミノ、又はジアルキルアミノ基を表し;かつR4は、アルキル又はアリールであり、該遷移金属触媒は、下記式を有するキラル配位子を含み、
【化6】

式中R及びR'のそれぞれは独立して、アルキル、アリール、アラルキル、アルケニル、アルキニル、アルコキシ、アリールオキシ、アルキルチオ、アリールチオ、単環式若しくは多環式の飽和した若しくは一部飽和した炭素環若しくは複素環からなる群から選択される非置換若しくは置換環状部位、又は芳香族環若しくはヘテロ芳香族環を表し、前記環は、原子4〜8個を含み、かつ任意にヘテロ原子1〜3個を含み:ここで用語アルキルは、単独又は他の部位との組合せにかかわらず、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキルオキシ、ハロゲン、又はニトロ基によって置換された芳香族又はヘテロ芳香族基を意味し;及び用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する。該置換基は、置換されたそれら自身とすることができる。一実施態様において、用語アリールは、原子4〜8個を含み、かつ任意にヘテロ原子1〜3個を含む芳香環を意味することができる。好適には、アリールは、フェニル又はナフチルを意味する。化合物Bは、エン-カルバマートと呼ぶことができる。
【0008】
本発明の方法に使用されるキラル配位子は、商標名「CatASium(商標)T」で公知の一連の配位子からもたらされる。本明細書を通して、「CatASium(商標)T」シリーズの配位子への言及は、下記式を有するキラル配位子を意味する。
【化7】

【0009】
一実施態様において、水素源は水素ガスである。
一実施態様において、XはOである。別の実施態様において、R1、R2及びR3の少なくとも1つはハロゲン、好ましくはフッ素である。好ましくはR1、R2及びR3の2つはハロゲン、好ましくはフッ素であり、R1、R2及びR3のその他は水素である。好適には、化合物Aは下記式を有する。
【化8】

【0010】
一実施態様において、R4はC1〜C4アルキルである。任意に、R4はメチル(すなわち、メチル置換されたエン-カルバマート)、エチル(すなわち、エチル置換されたエン-カルバマート)又はtBu(すなわち、tBu置換されたエン-カルバマート)である。好ましくは、R4はメチルである。他の実施態様において、R4はベンジル(すなわち、ベンジル置換されたエン-カルバマート)である。
【0011】
好ましくは、触媒中の遷移金属は、ロジウム又はルテニウムである。最も好ましいのは、ルテニウムである。
ルテニウム触媒水素化検討から、CatASium(商標)Tシリーズをベースとした触媒の存在下で、メチル置換エン-カルバマートを使用して、完全な変換及び90%を超えて最大95%のe.eが得られることが明らかになっている。
【0012】
ロジウムベースの触媒を使用する不斉水素化も検討されている。特に、[Rh-(catASium(商標))(L)]X"カチオン錯体(式中L=シクロオクタジエン、及びX"=BF4)が検討されている。Rh-CatASium(登録商標)触媒水素化は、エン-カルバマート基質に対する中度から高度の活性、及び低度のエナンチオ選択性が明らかになった。
【0013】
好適には、該触媒は、式[(catASium(商標)T)Ru(アレーン)X']Y、[(catASium(商標)T)Ru(L)2]又は[(catASium(商標)T)Ru(L')2X'2]を有し、式中X'は一価負の単座配位子(singly-negative monodentate ligand)であり、Yは釣合せアニオン(balancing anion)であり、Lは一価負の配位性配位子(monovalent negative coordinating ligand)であり、及びL'は非イオン性単座配位子である。
【0014】
一実施態様において、X'は塩素である。別の実施態様において、Yは塩素である。X'及びYの両方を塩素とすることができる。別の実施態様において、アレーンはp-シメン又はベンゼンである。好ましくは、Lはacacである。好適には、L'はジメチルホルムアミド(dmf)である。配位子の他の選択肢を挙げると、アセチル、トリフルオロアセチル、テトラフルオロボラート、並びにモノ及びジアミンがある。
【0015】
あるいは、該触媒はRu(catASium(商標)T配位子)(acac)2、Ru(catASium(商標)T配位子)Br2、Ru(catASium(商標)T配位子)Cl2(Ar)(式中Arは、C6H6(すなわち、ベンゼン)又はp-シメンである。)、又はRu(catASium(商標)T配位子)Cl2(dmf)x(式中xは、好適には2、3又は4である。)である。Tシリーズからの配位子の適当な例を下記のスキーム1に示す。また、スキーム1のそれとは反対の立体化学を有する配位子も、本発明の不斉水素化に使用することができる。
【化9】

【0016】
化合物Iは商標名CatASium(商標)T1で公知である。化合物IIは商標名CatASium(商標)T2で公知である。化合物IIIは商標名CatASium(商標)T3で公知である。化合物IVは商標名CatASium(商標)T4で公知である。本明細書を通して、CatASium(商標)T1、T2、T3又はT4への言及は、それぞれ上に示した各構造を有する化合物I、II、III又はIVを意味する。
【0017】
好ましくは、該配位子はCatASium(商標)T3のR又はS鏡像異性体である。CatASium(商標)T3 は、化学名(1R)-3-ジフェニルホスフィノ-[4-ジ-(3,5-ジメチルフェニル)ホスフィノ-2,5-ジメチルチエニル-3)-1,7,7-トリメチルビシクロ[2.2.1]ヘプテン-2を有する。好適には、該配位子はCatASium(商標)T3のR鏡像異性体である。
【0018】
好ましくは、該活性遷移金属触媒は、水素化反応の前に事前形成(pre-form)される。あるいは、該活性遷移金属触媒は原位置(in situ)で形成される。すなわち、該触媒は水素化反応の前に単離されないが、反応ポット中でその前駆体配位子から形成される。該触媒は、前駆体化合物から事前形成されていてよい。例えば、Ru(catASium(商標)T配位子)(acac)2は、Ru(η-4-ヘキサジエン)(acac)2及びcatASium(商標)T配位子から製造されていてよい。Ru(catASium(商標)T配位子)Br2は、Ru(メチルアリル)2COD、catASium(商標)T配位子及びHBrから製造されていてよい。Ru(catASium(商標)T配位子)Cl2(C6H6)は、[Ru(C6H6)Cl2]2、catASium(商標)T配位子及びジクロロメタン/エタノールの1:1混合物から製造されていてよい。Ru(catASium(商標)T配位子)Cl2(p-シメン)は、[Ru(p-シメン)Cl2]2、catASium(商標)T配位子及びジクロロメタン/エタノールの1:1混合物から製造されていてよい。Ru(catASium(商標)T配位子)Cl2(dmf)xは、[Ru(C6H6)Cl2]2、catASium(商標)T配位子及びDMFから製造されていてよい。
【0019】
基質:触媒(S/C)比は、好ましくは100/1〜5000/1、より好ましくは250/1〜4000/1、更により好ましくは500/1〜2000/1である。更により好ましくは1000/1〜2000/1である。最も好ましくは、S/C比は2000/1である。
該水素化は、好ましくは40℃〜100℃の範囲の温度、より好ましくは40℃〜90℃の範囲の温度、更により好ましくは50℃〜90℃の範囲の温度、更により好ましくは60℃〜90℃の範囲の温度で行われ、最も好ましくは、該水素化は80℃の温度で行われる。
【0020】
該水素化は、好ましくは10バール〜70バールの範囲の圧力、より好ましくは10バール〜60バールの範囲の圧力、更により好ましくは20バール〜50バールの範囲の圧力、更により好ましくは20バール〜40バールの範囲の圧力で、及び更により好ましくは20バール〜30バールの範囲の圧力で行われる。最も好ましくは、該水素化は、20バール〜30バールの圧力で行われる。
【0021】
最も好ましい実施態様において、該水素化は酸の存在下で行われる。適当な酸を挙げると、HBF4、HCl、HBr、H2SO4、CF3SO3H、CH3COOH及びH3PO4がある。好ましくは、該酸は、エタン酸又はリン酸などの弱酸である。好適には、エタン酸は50%(v/v)〜20%(v/v)の範囲の濃度で存在する。リン酸は、10%(v/v)〜0.01%(v/v)、好ましくは5%(v/v)〜0.01%、より好ましくは1%(v/v)〜0.01%、更により好ましくは0.5%(v/v)〜0.05%の濃度で存在し得る。リン酸の最も好ましい濃度は、0.1%(v/v)である。
【0022】
一実施態様において、該酸は溶媒中に存在している。例えば、該酸溶媒は、ジエチルエーテル又は水である。典型的に、該酸溶媒の濃度は、80%(w/w)〜90%(w/w)、好ましくは85%(w/w)である。最も好ましいリン酸溶液は、水中に85%(w/w)である。
【0023】
好ましくは、該水素化は溶媒中で行われる。該溶媒は、置換又は非置換の直鎖又は分枝C1〜C6アルコール、アレーン又はそれらの混合物から選択することができる。適当な溶媒を挙げると、MeOH、EtOH、i-PrOH、1-PrOH、1-BuOH、2-BuOH、CF3CH2OH、ジクロロメタン(DCM)、ジクロロエタン(DCE)、テトラヒドロフラン(THF)、トルエン又はMeOHとDCMとの1:1混合物がある。好ましくは、該溶媒はMeOH又はDCMである。最も好ましくは、該溶媒はMeOHである。
好ましくは、該反応混合物は水素化プロセスを通して完全に混合される。
【0024】
更なる実施態様において、該方法は、式Aの化合物を実質的に結晶化することを更に含む。任意に、該結晶化はDCM/ヘキサン中で行われる。
一実施態様において、化合物AはS鏡像異性体の形態である。別の実施態様において、化合物AはR鏡像異性体の形態である。
例えば、化合物Bは、Tetrahedron:Asymmetry 10 (1999) 3467-3471に記載の方法によって製造することができる。
【0025】
より更なる実施態様において、該方法は、化合物AのR又はS鏡像異性体を、式Cの各R若しくはS鏡像異性体、又はその塩に変換することを更に含む。
【化10】

化合物Aは、-C(=O)-O-R4基をHで置換することを含む反応によって化合物Cに変換することができる。
【0026】
一実施態様において、化合物AのR又はS鏡像異性体は、加水分解によって式Cの各化合物のR又はS鏡像異性体に変換される。加水分解はメタノール中で40%水酸化カリウムを用いて行うことができ、続いて粗製アミンを単離し、L-酒石酸との塩としてアミンを結晶化する。
【0027】
本発明の別の態様において、式Eの化合物のR若しくはS鏡像異性体、又はその塩を形成する方法を提供する。
【化11】

該方法は、上記方法に従って式Cの化合物のR又はS鏡像異性体を形成すること、及び該式Cの化合物のR又はS鏡像異性体を、式Eの化合物のR又はS鏡像異性体に変換することを含む。一実施態様において、化合物Cを化合物Eの置換イミダゾール-2-チオン環のN(1)部位を構築するためのアミノ成分として用いることによって、化合物Cは化合物Eに変換される。一実施態様において、化合物Cのアミノ基は、5位の置換基が-(CH2)n-NHR12基(式中R12は、水素、アルキル又はアルキルアリール基を表す。)である5-置換イミダゾール-2-チオン基に変換される。
【0028】
より更なる実施態様において、該方法は、式Cの化合物のR又はS鏡像異性体を式Dの化合物と、実質的に不活性な溶媒中、有機酸の存在下で水溶性チオシアン酸塩とともに反応させて、中間体生成物E〜Hを生成すること、
【化12】

式中nは1、2又は3を表し;nが1又は2である場合、R12は水素、アルキル又はアルキルアリール基を表し、R11はヒドロキシル保護基を表し、かつR13はアミノ保護基を表し;nが3である場合、R11はヒドロキシル保護基を表すが、R12及びR13は互いに結合してフタルイミド基を表し;該水溶性チオシアン酸塩はアルカリ金属チオシアン酸塩又はテトラアルキルアンモニウムチオシアン酸塩であり、
【化13】

続いて、後続の中間生成物E〜Hの脱保護を行い、式Jの化合物の各R又はS鏡像異性体、又はその塩を生成することを更に含み、
【化14】

ここで用語アルキルは、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキルオキシ、ハロゲン、又はニトロ基によって置換されたフェニル又はナフチル基を意味し;用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する。
【0029】
一実施態様において、XはOである。別の実施態様において、nは2又は3である。一実施態様において、XはOであり、かつnは2である。あるいは、XはOであり、かつnは3である。更なる実施態様において、R1、R2及びR3の少なくとも1つはフッ素である。任意に、式Jの化合物は下記化合物である:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン又は
(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
【0030】
また、式Jの化合物は下記化合物の塩であってもよい:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン又は
(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
好ましくは、該塩は塩酸塩である。
【0031】
一実施態様において、式Jの化合物は、式1の化合物の各R又はS鏡像異性体である。
【化15】

【0032】
本発明の別の態様により、下記式を有するキラルcatASium(商標)Tシリーズ配位子を含む遷移金属錯体の使用を提供する。
【化16】

式中R及びR'は、式Bの化合物の不斉水素化における上記のものであり、
【化17】

ここで化合物Bは上記のものである。
【0033】
好ましくは、触媒はRu(catASium(商標)Tシリーズ配位子)(acac)2、Ru(catASium(商標)Tシリーズ配位子)Br2、Ru(catASium(商標)Tシリーズ配位子)Cl2(Ar)(式中Arは、C6H6 又はp-シメンである。)、又はRu(catASium(商標)Tシリーズ配位子)Cl2(dmf)x(式中xは、好適には2、3又は4である。)である。好ましくは、該触媒は、式Ru(catASium(商標)Tシリーズ配位子)(acac)2を有する。
【0034】
好ましくは、該catASium(商標)Tシリーズ配位子は、catASium(商標)T1、catASium(商標)T2、catASium(商標)T3、又はcatASium(商標)T4のR又はS鏡像異性体である。好ましくは、catASium T配位子はR鏡像異性体の形態である。最も好ましくは、該catASium(商標)Tシリーズ配位子は、catASium(商標)T3のR鏡像異性体である。最も好ましい触媒は、式Ru(catASium(商標)T3)(acac)2を有する。
一実施態様において、該触媒は事前形成される。
別の実施態様において、該水素化は酸の存在下で行われる。
【0035】
本発明の別の態様により、下記式のCatASium(登録商標)T配位子を含む事前形成された遷移金属触媒の製造方法を提供する。
【化18】

式中R及びR'は上記と同じ意味を有し、該方法は、DMF 中で[Ru(C6H6)Cl2]2の遷移金属前駆体化合物をCatASium(登録商標)T配位子と反応させること、及び該触媒を後続のプロセスで使用する前に、該遷移金属触媒を単離することを含む。該触媒は、Ru(catASium(商標)Tシリーズ配位子)Cl2(dmf)x(式中xは2、3又は4である。)とすることができる。
【0036】
本発明の別の態様により、下記式のCatASium(商標)T配位子を含む遷移金属触媒の製造方法を提供する。
【化19】

式中R及びR'は、上に規定したものと同じ意味を有する。該方法は、遷移金属前駆体化合物をcatASium(商標)T配位子と反応させることを含み、ここで該前駆体化合物は[Ru(C6H6)Cl2]2ではなく、かつ該溶媒はDMFではない。
【0037】
一実施態様において、遷移金属触媒は、後続のプロセスに使用される前に単離される。別の実施態様において、該遷移金属触媒は原位置で形成される。
一実施態様において、該触媒はRu(catASium(商標)Tシリーズ配位子)(acac)2、Ru(catASium(商標)Tシリーズ配位子)Br2、又はRu(catASium(商標)Tシリーズ配位子)Cl2(C6H6)である。
一実施態様において、該触媒はRu(catASium(商標)T配位子)(acac)2触媒であり、かつ該前駆体はRu(η4-ヘキサジエン)(acac)2である。
【0038】
一実施態様において、該触媒はRu(catASium(商標)T配位子)Br2であり、かつ該前駆体はRu(メチルアリル)2CODである。
一実施態様において、該触媒はRu(catASium(商標)Tシリーズ配位子)Cl2(C6H6)であり、該前駆体は[Ru(C6H6)Cl2]2であり、かつ該方法はジクロロメタン/エタノールの1:1混合物の存在下で行われる。
【0039】
一実施態様において、該触媒は、Ru(catASium(商標)Tシリーズ配位子)Cl2(p-シメン)、該前駆体は[Ru(p-シメン)Cl2]2であり、かつ該プロセスはジクロロメタン/エタノールの1:1混合物の存在下で行われる。
適当なcatASium(商標)Tシリーズ配位子を上記のスキーム1に示す。好ましいcatASium(商標)Tシリーズ配位子は、catASium(商標)T3のR又はS鏡像異性体であり、より好ましくはcatASium(商標)T3のR鏡像異性体である。
【0040】
本発明の別の態様により、該キラル遷移金属触媒が上記方法に従って製造される、上記方法に従って式Aの化合物のS又はR鏡像異性体を製造する方法を提供する。
一実施態様において、該キラル遷移金属触媒は、式Bの化合物と反応させる前に単離される。
一実施態様において、該キラル遷移金属触媒は原位置で形成される。言い換えると、該触媒は、式Bの化合物と反応させる前に単離されない。
【0041】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)(acac)2を提供する。一実施態様において、該Ru(catASium(商標)T配位子)(acac)2は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)(acac)2は上記方法に従って製造される。
【0042】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子) Br2を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Br2は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)Br2は上記方法に従って製造される。
【0043】
本発明の別の態様により、単離された状態のRu(catASium(商標)T配位子)Cl2(dmf)xを提供する。式中xは2、3又は4であり、かつ該catASium(商標)T配位子は、catASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(dmf)xは上記方法に従って製造される。
【0044】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)Cl2(C6H6)を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(C6H6)は単離されている。別の実施態様において、該Ru(catASium(商標)T配位子)Cl2(C6H6)は上記方法に従って製造される。
【0045】
本発明の別の態様により、catASium(商標)T配位子がcatASium(商標)T3のR又はS鏡像異性体、好ましくはcatASium(商標)T3のR鏡像異性体であり、上記方法に従って製造することができる、Ru(catASium(商標)T配位子)Cl2(p-シメン)を提供する。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(p-シメン)は単離されている。一実施態様において、該Ru(catASium(商標)T配位子)Cl2(p-シメン)は上記方法に従って製造される。
【0046】
本発明の別の態様により、上記の方法によって製造された(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩を提供する。
【実施例】
【0047】
ルテニウム-CatASium(商標)Tベース触媒(表1〜3及び5〜11)及びロジウム-CatASium(商標)Tベース触媒(表4)を用いて、プロキラルメチルエン-カルバマート1d(下記スキーム2に示す)のエナンチオ選択的水素化における触媒の効果の検討を行った。
【化20】

【0048】
(ルテニウム-CatASium(商標)T触媒作用)
ルテニウムベースの触媒反応を、リン酸の存在下及び非存在下で行った。
触媒活性Ru錯体は、基質の添加の前に下記のように事前形成される:DMF中、[Ru(C6H6)Cl2]2及び配位子からRu(配位子)Cl2(dmf)x;エタノール-ジクロロメタン1:1混合物中、[Ru(Ar)Cl2]2及び配位子から[Ru(配位子)(Ar)Cl]Cl(式中Arは、C6H6又はp-シメンである。);ジクロロメタン中、[Ru(η4-2,4-C6H10)(acac)2]及び配位子から[Ru(配位子)(acac)2];Ru(2-メチルアリル)2COD、配位子及びHBrから[RuBr2(配位子)]である。これらの事前形成の実験条件を下記に示す。
【0049】
(MPC1:Ru(配位子)Cl2(dmf)xの事前形成)
0.001mmolの各配位子及び0.0005mmolの[Ru(C6H6)Cl2]2を、アルゴン下で0.05mlのDMFに溶解させ、105℃で10分間温めた。次いで、それらを室温まで冷却した。
【0050】
(MPC2:Ru(配位子)Cl2(C6H6)の事前形成)
0.001mmolの各配位子及び0.0005mmolの[Ru(C6H6)Cl2]2を、アルゴン下で0.1mlのジクロロメタン/エタノール1:1混合物に溶解させ、50℃で1.5時間温めた。次いで、それらを室温まで冷却した。
【0051】
(MPC3:Ru(配位子)(acac)2の事前形成)
このルテニウム塩の合成は、Ziegler, M.L.らの文献、Organometallics 1991, 10, 3635-3642から得た。亜鉛の活性化は、Knochel, P.らの文献、「高官能化試薬の製造(Preparation of highly functionalised reagents)」有機銅試薬(Organocopper Reagents)、Oxford University Press, Oxford 1994, p.85に従い行った。
0.001mmolの各配位子及び0.001mmolのRu(η4-ヘキサジエン)(acac)2を、アルゴン下で0.1mlのジクロロメタンに溶解させ、室温で20〜30分間撹拌した。
【0052】
(MPC4:Ru(配位子)Br2の事前形成)
0.001mmolの各配位子及び0.001mmolのRu(メチルアリル)2CODを、アルゴン下で0.05mlのアセトンに溶解し、2当量のHBr(メタノールで希釈して水性の48%HBrから調製される溶液)を添加した。該混合物を室温で30分間撹拌した。
【0053】
(水素化条件)
MeOH中、60℃及び30バールのH2において、S/C比100で18時間、再現性実験を行った。より具体的には、MeOH中0.25Mの基質1dの溶液0.4mlを、事前形成したルテニウム錯体に添加し、任意に85%のH3PO450μlを添加した。
次いで、該反応混合物をオートクレーブに導入し、該オートクレーブを水素でパージした。他に示さない限り、30バールの水素を加圧し、かつ該反応を60℃で18時間温めた。
冷却及び圧力解放後、分析のために生混合物(0.1ml)の試料を採取した。該試料をMeOHで希釈し、幾らかのDeloxan(登録商標)を添加して該反応混合物から金属を除去し、該混合物を室温で10分間振盪し;濾紙で濾過した後に、該試料を0.5mlのメタノール及び0.5mlのiPrOHで希釈した。HPLC法を確立した:ChiralpakAD、MeOH/iPrOH 70/30;0.5ml/分;30℃である。
【0054】
(CatASium(商標)T2の事前形成)
上記の4種のルテニウム金属前駆体(MPC1、MPC2、MPC3及びMPC4)を用いて、リン酸の存在下及び非存在下でCatASium(商標)Tシリーズ配位子T2を試験した。一定量のリン酸(50μl)を添加した。各触媒について変換値(「Con」)及び鏡像体過剰率(「ee」)を2度確認した。
リン酸を伴わず及び伴い行った実験結果を、それぞれ表1及び表2に要約する。
【表1】

a変換(「Con」)及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
【表2】

a変換(「Con」)及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
b50μlのリン酸を使用した。これはおよそ10% v/vを意味する。
【0055】
(CatASium(商標)T1及びT3)
CatASium(登録商標)T2を使用して、高度の変換及び選択性を再現することができ、かつリン酸の存在が触媒性能に有益な効果を有し得ることが示されたことで、TシリーズのCatASium(登録商標)配位子T1及びT3を検討した。実験条件は上記(「水素化条件」の項)と同じであった。結果を下記表3に要約する。
【表3】

a変換は常に100%であった。R-鏡像異性体が得られた。eeの列には両確認実験の結果を示している。
Ru(η4-ヘキサジエン)(acac)2、並びにCatASium(商標)T1、T2及びT3配位子から事前形成した錯体は、H3PO4の存在下で使用した場合に、完全な変換、並びにそれぞれ94%のe.e、93%のe.e及び95%のe.eを与えた。
Ru(メチルアリル)2(COD)、並びにCatASium(商標)T1及びT3配位子から事前形成した錯体は、H3PO4の存在下で使用した場合に、完全な変換、及び90%を超えるe.e(T1で90〜91%のe.e及びT3で92〜93%のe.e)を与えた。
【0056】
(ロジウム-CatASium(商標)T触媒作用)
ジクロロメタン中、30℃、30バールのH2で、一般式[Rh(catASium(商標))(COD)]BF4の触媒を使用するエン-カルバマート1dの水素化は、低エナンチオ選択性となった(表4)。
【表4】

a変換及びeeは%で与えられる。それぞれにおいて、記入項目は2回確認の2つの値を記載する。
【0057】
(ルテニウム-CatASium(商標)T触媒作用最適化)
(溶媒/添加物/金属前駆体の最適化)
基質/触媒(S/C)比250/1を選択した。圧力及び温度は、前回の実験と同様に保持した。
他の反応パラメータは下記のように選択した:
・溶媒:MeOH及びiPrOH;
・添加物:強及び弱酸を試験した(5%のH3PO4、5%のH2SO4、5%のHBr、20%のAcOH);
・金属前駆体:Ru(η4-ヘキサジエン)(acac)2又はRu(メチルアリル)2CODを試験した。
実験手順は上記(「水素化条件」の項)と同じであった。基質を0.66Mの溶液(0.4ml)として対応する溶媒に導入した。該添加物は0.4mlの溶媒に希釈されるので、最終基質濃度はおよそ0.33Mであった。
【0058】
iPrOHを溶媒として使用する場合に、一般に、高度の変換を伴う全ての反応が主要生成物としてアルコールを示すことが見出された。iPrOHにおいて、ケトンへの加水分解及びその還元は、エン-カルバマートの水素化に対して優先的に起こる。加水分解が観察されなかったのは、ただ1つの実験だけであった。したがって、イソプロパノールは排除し、MeOHを使用した。しかし、低い酸濃度での溶媒としてのiPrOHの使用は、加水分解の抑制及び優先的なエン-カルバマートの水素化をもたらすかもしれない。
【表5】

表6に表5から得られた最良の結果を要約する(変換>96%;ee>90%)。
【表6】

a金属前駆体:MPC3;他に示す場合を除き、変換は100%であった。R-鏡像異性体が得られた。eeの列には両確認実験の結果を示している。
b変換:99%。
【0059】
(温度/圧力/添加物の濃度の最適化)
温度(50℃、60℃及び80℃)、圧力(20、30及び70バールの水素)、及び酸添加物の濃度をより望ましいS/C比(500/1)で変化させた。この点において、MPC3を用いて進めることを決定した(表6の全ての結果はMPC3を用いて得られた。)。
実験手順は上記のものと同じであった(「水素化条件」の項)。基質を0.66Mの溶液(0.8ml)として対応する溶媒に導入した。該添加物は0.8mlの対応する溶媒に希釈されるので、最終基質濃度はおよそ0.33Mであった。表に記載の圧力及び温度の値で、該反応を行った。
各実験から得られた最良の結果を配位子によって分類した:
・CatASium(商標)T1で得られた結果を表7に要約する;
・CatASium(商標)T2で得られた結果を表8に要約する;
・CatASium(商標)T3で得られた結果を表9に要約する。
【0060】
【表7】

・この配位子(T1)は、高温及び高圧で良好に作用する。
・酸の存在は、高度の変換を得るのを助ける。
・0.01%のH3PO4を使用する場合、該反応は80℃及び70バールでより良好に作用し;0.1%のH3PO4を使用する場合、該反応は30バールで高圧時と同様に良好に作用する。
【0061】
【表8】

この配位子の挙動は、CatASium(商標)T1に類似している:
・この配位子(T2)は、高温及び高圧で良好に作用する;
・酸の存在は、高度の変換を得るのを助ける;
・0.01%のH3PO4を使用する場合、該反応は80℃及び70バールでより良好に作用し;0.1%のH3PO4を使用する場合、該反応は30バールで高圧時と同様に良好に作用する。
【0062】
【表9】

この配位子は最良の反応性を示した:
・酸の存在は、高度の変換を得るのに好ましい。高温及び高圧で作用させることによって、酸を回避することができる;
・温度を上昇させることによって、20バールにおいてさえも良好な反応性が得られた。高温及び低圧において、100%の変換及び95%のeeには、わずか0.1%のH3PO4だけが必要である;
・最良の結果(変換における)は、高温及び高圧で得られる。しかし、鏡像体過剰率は数単位低い。高温及び高圧を用いることで、酸は不要である。
【0063】
(S/C最適化)
S/Cの最適化を最良の系(CatASium(商標)T3)で行った。異なるS/C(1000、2000、4000、5000)比を、0.1%のH3PO4の存在下、30バール及び80℃でCatASium(商標)T3を用いて試験した。S/C比を増大させるには2つの方法がある:
・一定の基質量を保ち(S/C 500の実験の場合と同じ値で濃度を一定に維持すること)、かつ触媒量を下げていくこと;
・一定の触媒量を保ち、かつ基質量を増加していくこと;である。
【0064】
両方の方法を試験した。該2つの実験は1%リン酸の存在下で行われた。
実験手順は、上記「水素化条件」の項と同様であった。
各試験用に基質を秤量し、対応する量のメタノールを加えた。該濃度を表10に要約し、結果を表11に要約する。該反応を初期圧力30バールの水素、及び80℃の温度で行った。
【表10】

【表11】

【表12】

変換の差は、反応混合物の撹拌が良好な変換を達成するのに役立ったことを示している。
【0065】
(エナンチオ純度の向上)
鏡像体過剰率は、粗製生成物の結晶化によって上昇させることができる。例えば、結晶化は、残渣が最小量の温ジクロロメタンに溶解している該粗製生成物から蒸発した任意の残留溶媒を含み得る。濾過後、生成物が結晶化を始めるまでゆっくりとヘキサンを添加する。室温で3時間及び4℃で15時間の結晶化の後、該結晶を濾過し、ヘキサンで洗浄した。
【0066】
(規模拡大実験)
大規模での触媒の有効性を調べるために、下記の反応を800g規模(15Lのオートクレーブ中)で行った。
【化21】

実験手順は下記であった:
触媒:EtOH/CH2Cl2中[Ru(p-シメン)Cl2]2 / CatASiumT3;
圧力:20バール;
温度:80℃;
S/C:2000;
濃度:0.7M;
添加物:0.1%のH3PO4;である。
【0067】
[Ru(p-シメン)Cl2]2及びCatASiumT3を、ジクロロメタン/EtOH(1:1)の混合物中、50℃で90分間撹拌し、次いで室温まで冷却した。アルゴン雰囲気下で15Lのオートクレーブに、基質、メタノール及び対応する添加物を加えた。その後、触媒を添加した。該反応を上記の条件で18時間水素化した。
Deloxan(登録商標)を該反応混合物に添加し、触媒を濾過により分離した。該溶媒の蒸発の間(6000mlのおよそ2000mlが蒸発)、沈殿物が形成された。およそ5000mlの蒸留物で蒸留を停止し、該沈殿物を濾過し、少量のメタノールで洗浄した。単離固形物(白色結晶)を40℃、真空下(180〜210ミリバール)で18時間乾燥した。濾液を蒸発乾固し、緑褐色の固形物を得た。
結果を表12に示す。
【表13】

1出発材料はHPLCで検出されなかった。
したがって、800gの基質及び2000:1の基質/触媒比を用いて、望ましいキラル生成物が99%を超える光学純度及び91%の収率で生成されたことが見出された。
本願発明は添付の特許請求の範囲の範囲内で変更し得ることが理解されるであろう。
【特許請求の範囲】
【請求項1】
式Aの化合物のS又はR鏡像異性体の製造方法であって、
【化1】

式Bの化合物をキラル遷移金属触媒及び水素源の存在下で不斉水素化させることを含み、
【化2】

式中:XはCH2、酸素又はイオウであり;R1、R2及びR3は、同じであるか又は異なり、水素、ハロゲン、アルキル、アルキルオキシ、ヒドロキシ、ニトロ、アルキルカルボニルアミノ、アルキルアミノ、又はジアルキルアミノ基を表し;かつR4は、アルキル又はアリールであり、該遷移金属触媒は、下記式を有するキラル配位子を含み、
【化3】

式中R及びR'のそれぞれは独立して、アルキル、アリール、アラルキル、アルケニル、アルキニル、アルコキシ、アリールオキシ、アルキルチオ、アリールチオ、単環式若しくは多環式の飽和した若しくは一部飽和した炭素環若しくは複素環からなる群から選択される非置換若しくは置換環状部位、又は芳香族環若しくはヘテロ芳香族環を表し、前記環は、原子4〜8個を含み、かつヘテロ原子0〜3個を含み:ここで用語アルキルは、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキル、アルキルオキシ、ハロゲン、又はニトロ基によって1以上置換された芳香族又はヘテロ芳香族基を意味し;及び用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する、前記製造方法。
【請求項2】
Xが、Oである、請求項1記載の方法。
【請求項3】
R1、R2及びR3の少なくとも1つが、フッ素である、請求項1又は2記載の方法。
【請求項4】
化合物Aが、下記式を有する、請求項1記載の方法:
【化4】

。
【請求項5】
R4が、C1〜C4アルキルである、請求項1〜4のいずれか一項記載の方法。
【請求項6】
R4が、メチル、エチル、又はtBuである、請求項1〜5のいずれか一項記載の方法。
【請求項7】
R4が、メチルである、請求項6記載の方法。
【請求項8】
R4が、ベンジルである、請求項1〜4のいずれか一項記載の方法。
【請求項9】
前記触媒が、式[(キラル配位子)Ru(アレーン)X']Y、[(キラル配位子)Ru(L)2]、又は[(キラル配位子)Ru(L')2X'2]を有し、式中X'は一価負の単座配位子であり、Yは釣合せアニオンであり、Lは一価負の配位性配位子であり、及びL'は非イオン性単座配位子である、請求項1〜8のいずれか一項記載の方法。
【請求項10】
X'及び/又はYが、塩素である、請求項9記載の方法。
【請求項11】
アレーンが、p-シメン又はベンゼンである、請求項9又は10記載の方法。
【請求項12】
Lが、acacである、請求項9、10又は11記載の方法。
【請求項13】
Lが、dmfである、請求項9、10又は11記載の方法。
【請求項14】
前記触媒が、Ru(キラル配位子)(acac)2である、請求項1〜8のいずれか一項記載の方法。
【請求項15】
前記Ru(キラル配位子)(acac)2触媒が、前記キラル配位子及びRu(η4-ヘキサジエン)(acac)2から事前形成される、請求項14記載の方法。
【請求項16】
前記触媒が、Ru(キラル配位子)Br2である、請求項1〜8のいずれか一項記載の方法。
【請求項17】
Ru(キラル配位子)Br2が、前記キラル配位子及びRu(メチルアリル)2CODから事前形成される、請求項16記載の方法。
【請求項18】
前記触媒が、Ru(キラル配位子)Cl2(dmf)xであり、式中xは2、3又は4である、請求項1〜8のいずれか一項記載の方法。
【請求項19】
前記Ru(キラル配位子)Cl2(dmf)xが、前記キラル配位子、[Ru(C6H6)Cl2]2及びDMFから事前形成される、請求項18記載の方法。
【請求項20】
前記触媒が、Ru(キラル配位子)Cl2(C6H6)である、請求項1〜8のいずれか一項記載の方法。
【請求項21】
前記Ru(キラル配位子)Cl2(C6H6)が、前記キラル配位子、[Ru(C6H6)Cl2]2、及びジクロロメタンとエタノールとの1:1混合物から事前形成される、請求項20記載の方法。
【請求項22】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項1〜21のいずれか一項記載の方法:
【化5】

。
【請求項23】
前記キラル配位子が、化合物IIIのR又はS鏡像異性体である、請求項22記載の方法。
【請求項24】
前記キラル配位子が、化合物IIIのR鏡像異性体である、請求項22記載の方法。
【請求項25】
前記水素化が、酸の存在下で行われる、請求項1〜24のいずれか一項記載の方法。
【請求項26】
前記酸が、CH3COOH又はH3PO4である、請求項25記載の方法。
【請求項27】
前記酸が、H3PO4である、請求項25又は26記載の方法。
【請求項28】
前記酸が、CH3COOHである、請求項25又は26記載の方法。
【請求項29】
前記水素化が、溶媒の存在下で行われる、請求項1〜28のいずれか一項記載の方法。
【請求項30】
前記溶媒が、置換又は非置換の直鎖又は分枝C1〜C6アルコール、アレーン、又はそれらの混合物から選択される、請求項29記載の方法。
【請求項31】
前記溶媒が、MeOH、EtOH、1-BuOH、2-BuOH、CF3CH2OH、DCM、DCE、THF、トルエン、又はMeOH、トルオールとDCMとの1:1混合物から選択される、請求項30記載の方法。
【請求項32】
前記溶媒が、MeOH又はDCMである、請求項31記載の方法。
【請求項33】
前記溶媒が、MeOHである、請求項32記載の方法。
【請求項34】
前記水素化が、40℃〜100℃の範囲の温度で行われる、請求項1〜33のいずれか一項記載の方法。
【請求項35】
前記水素化が、40℃〜90℃の範囲の温度で行われる、請求項34記載の方法。
【請求項36】
前記水素化が、50℃〜90℃の範囲の温度で行われる、請求項35記載の方法。
【請求項37】
前記水素化が、60℃〜90℃の範囲の温度で行われる、請求項36記載の方法。
【請求項38】
前記水素化が、80℃の温度で行われる、請求項34記載の方法。
【請求項39】
前記水素化が、10バール〜70バールの範囲の圧力で行われる、請求項1〜38のいずれか一項記載の方法。
【請求項40】
前記水素化が、10バール〜60バールの範囲の圧力で行われる、請求項39記載の方法。
【請求項41】
前記水素化が、20バール〜50バールの範囲の圧力で行われる、請求項40記載の方法。
【請求項42】
前記水素化が、20バール〜40バールの範囲の圧力で行われる、請求項41記載の方法。
【請求項43】
前記水素化が、20バール〜30バールの範囲の圧力で行われる、請求項42記載の方法。
【請求項44】
前記水素化が、30バールの圧力で行われる、請求項43記載の方法。
【請求項45】
基質:触媒(S/C)比が、100/1〜5000/1の範囲である、請求項1〜44のいずれか一項記載の方法。
【請求項46】
基質:触媒(S/C)比が、250/1〜4000/1の範囲である、請求項45記載の方法。
【請求項47】
基質:触媒(S/C)比が、500/1〜2000/1の範囲である、請求項46記載の方法。
【請求項48】
基質:触媒(S/C)比が、2000/1の範囲である、請求項47記載の方法。
【請求項49】
実質的に式Aの化合物を結晶化することを更に含む、請求項1〜48のいずれか一項記載の方法。
【請求項50】
前記結晶化が、DCM/ヘキサン中で行われる、請求項49記載の方法。
【請求項51】
化合物Aが、S鏡像異性体の形態である、請求項1〜50のいずれか一項記載の方法。
【請求項52】
化合物Aが、R鏡像異性体の形態である、請求項1〜50のいずれか一項記載の方法。
【請求項53】
式Cの化合物のR又はS鏡像異性体の製造方法であって、
【化6】

請求項1〜52のいずれか一項記載の方法によって式Aの化合物のR又はS鏡像異性体を形成すること、続いて、化合物AのR又はS鏡像異性体を式Cの化合物の各R又はS鏡像異性体に変換することを含む、前記製造方法。
【請求項54】
前記化合物Aが、-C(=O)-O-R4基をHと置換することを含む反応によって化合物Cに変換される、請求項53記載の方法。
【請求項55】
前記化合物AのR又はS鏡像異性体が、水素分解によって式Cの化合物の各R又はS鏡像異性体に変換される、請求項53又は54記載の方法。
【請求項56】
式Eの化合物のR若しくはS鏡像異性体又はその塩の製造方法であって、
【化7】

請求項53、54又は55のいずれか一項記載の方法によって式Cの化合物のR又はS鏡像異性体を形成すること、及び該式Cの化合物のR又はS鏡像異性体を式Eの化合物のR又はS鏡像異性体に変換することを含む、前記製造方法。
【請求項57】
化合物Cを化合物Eの置換イミダゾール-2-チオン環のN(1)部位を構築するためのアミノ成分として用いることによって、化合物Cが化合物Eに変換される、請求項56記載の方法。
【請求項58】
前記化合物Cのアミノ基が、5-置換イミダゾール-2-チオン基に変換され、ここで5位の置換基が-(CH2)n-NHR12基であり、式中R12は、水素、アルキル又はアルキルアリール基を表す、請求項56又は57記載の方法。
【請求項59】
前記式Cの化合物のR又はS鏡像異性体を式D2の化合物と、実質的に不活性な溶媒中、有機酸の存在下で水溶性のチオシアン酸塩とともに反応させること、
【化8】

(式中nは1、2又は3を表し;nが1又は2である場合、R12は水素、アルキル又はアルキルアリール基を表し、R11はヒドロキシル保護基を表し、かつR13はアミノ保護基を表し;nが3である場合、R11はヒドロキシル保護基を表すが、R12及びR13は互いに結合してフタルイミド基を表す。)続いて、後続の中間生成物F〜Iの脱保護を行うことを含む、請求項57又は58記載の方法:
【化9】

。
【請求項60】
Xが、Oである、請求項56〜59のいずれか一項記載の方法。
【請求項61】
nが、2又は3である、請求項56〜60のいずれか一項記載の方法。
【請求項62】
R1、R2及びR3の少なくとも1つが、フッ素である、請求項56〜61のいずれか一項記載の方法。
【請求項63】
化合物Eが、下記のもの又はその塩である、請求項56〜59のいずれか一項記載の方法:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン、又は(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
【請求項64】
化合物Eが、(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオンである、請求項63記載の方法。
【請求項65】
前記塩が、塩酸塩である、請求項63又は64記載の方法。
【請求項66】
化合物Eが、式Pの化合物の各R又はS鏡像異性体である、請求項56〜59のいずれか一項記載の方法:
【化10】

。
【請求項67】
式Bの化合物の不斉水素化におけるキラル遷移金属触媒の使用であって、
【化11】

該遷移金属触媒が、下記式を有するキラル配位子を含み、
【化12】

式中R、R'、X、R1、R2、R3及びR4は、請求項1〜8のいずれか一項に定義したものと同じ意味を有する、前記使用。
【請求項68】
前記触媒が、Ru(キラル配位子)(acac)2、Ru(キラル配位子)Br2、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)、又はRu(キラル配位子)Cl2(C6H6)である、請求項67記載の使用。
【請求項69】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項67又は68記載の使用:
【化13】

。
【請求項70】
前記キラル遷移金属触媒が、事前形成されている、請求項67記載の使用。
【請求項71】
前記水素化が、酸の存在下で行われる、請求項67〜70のいずれか一項記載の使用。
【請求項72】
請求項56〜59のいずれか一項記載の方法によって生成される、(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩。
【請求項73】
請求項1〜52のいずれか一項記載の式Aの化合物のS又はR鏡像異性体の製造方法であって、式中X、 R1、R2、R3及びR4は、請求項1、2、3又は4のいずれか一項に定義したものと同じ意味を有し、かつここで前記キラル遷移金属触媒が、下記式のキラル配位子を含む事前形成された触媒であり、
【化14】

式中R及びR'は、請求項1に定義したものと同じ意味を有し、前期触媒が、遷移金属前駆体化合物をキラル配位子と反応させること、及び該遷移金属触媒を単離することによって製造され、後に該触媒が後続のプロセスに使用される、前記製造方法。
【請求項74】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項73記載の方法:
【化15】

。
【請求項75】
前記キラル配位子が、化合物IIIのR又はS鏡像異性体である、請求項74記載の方法。
【請求項76】
前記キラル配位子が、化合物IIIのR鏡像異性体である、請求項75記載の方法。
【請求項77】
前記触媒が、Ru(キラル配位子)(acac)2、Ru(キラル配位子)Br2、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)、又はRu(キラル配位子)Cl2(Ar)(式中Arは、C6H6又はp-シメンである。)である、請求項73〜76のいずれか一項記載の方法。
【請求項78】
前記触媒が、Ru(キラル配位子)(acac)2触媒であり、かつ該前躯体がRu(η4-ヘキサジエン)(acac)2である、請求項77記載の方法。
【請求項79】
前記触媒が、Ru(キラル配位子)Br2であり、かつ該前躯体がRu(メチルアリル)2CODである、請求項77記載の方法。
【請求項80】
前記触媒が、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)であり、該前躯体が、[Ru(C6H6)Cl2]2であり、かつ該触媒の製造方法が、DMFの存在下で行われる、請求項77記載の方法。
【請求項81】
前記触媒が、Ru(キラル配位子)Cl2(Ar)であり、該前駆体が、[Ru(Ar)Cl2]2であり、かつ該製造方法が、ジクロロメタンとエタノールとの1:1混合物の存在下で行われ、式中Arは、C6H6又はp-シメンである、請求項77記載の方法。
【請求項82】
実施例を参照して、実質的に本明細書中に記載される方法。
【請求項83】
実施例を参照して、実質的に本明細書中に記載される使用。
【請求項1】
式Aの化合物のS又はR鏡像異性体の製造方法であって、
【化1】

式Bの化合物をキラル遷移金属触媒及び水素源の存在下で不斉水素化させることを含み、
【化2】

式中:XはCH2、酸素又はイオウであり;R1、R2及びR3は、同じであるか又は異なり、水素、ハロゲン、アルキル、アルキルオキシ、ヒドロキシ、ニトロ、アルキルカルボニルアミノ、アルキルアミノ、又はジアルキルアミノ基を表し;かつR4は、アルキル又はアリールであり、該遷移金属触媒は、下記式を有するキラル配位子を含み、
【化3】

式中R及びR'のそれぞれは独立して、アルキル、アリール、アラルキル、アルケニル、アルキニル、アルコキシ、アリールオキシ、アルキルチオ、アリールチオ、単環式若しくは多環式の飽和した若しくは一部飽和した炭素環若しくは複素環からなる群から選択される非置換若しくは置換環状部位、又は芳香族環若しくはヘテロ芳香族環を表し、前記環は、原子4〜8個を含み、かつヘテロ原子0〜3個を含み:ここで用語アルキルは、任意にアリール、アルコキシ、ハロゲン、アルコキシカルボニル、又はヒドロキシカルボニル基によって置換された炭素原子1〜6個を含む直鎖又は分枝の炭化水素鎖を意味し;用語アリールは、任意にアルキル、アルキルオキシ、ハロゲン、又はニトロ基によって1以上置換された芳香族又はヘテロ芳香族基を意味し;及び用語ハロゲンは、フッ素、塩素、臭素、又はヨウ素を意味する、前記製造方法。
【請求項2】
Xが、Oである、請求項1記載の方法。
【請求項3】
R1、R2及びR3の少なくとも1つが、フッ素である、請求項1又は2記載の方法。
【請求項4】
化合物Aが、下記式を有する、請求項1記載の方法:
【化4】

。
【請求項5】
R4が、C1〜C4アルキルである、請求項1〜4のいずれか一項記載の方法。
【請求項6】
R4が、メチル、エチル、又はtBuである、請求項1〜5のいずれか一項記載の方法。
【請求項7】
R4が、メチルである、請求項6記載の方法。
【請求項8】
R4が、ベンジルである、請求項1〜4のいずれか一項記載の方法。
【請求項9】
前記触媒が、式[(キラル配位子)Ru(アレーン)X']Y、[(キラル配位子)Ru(L)2]、又は[(キラル配位子)Ru(L')2X'2]を有し、式中X'は一価負の単座配位子であり、Yは釣合せアニオンであり、Lは一価負の配位性配位子であり、及びL'は非イオン性単座配位子である、請求項1〜8のいずれか一項記載の方法。
【請求項10】
X'及び/又はYが、塩素である、請求項9記載の方法。
【請求項11】
アレーンが、p-シメン又はベンゼンである、請求項9又は10記載の方法。
【請求項12】
Lが、acacである、請求項9、10又は11記載の方法。
【請求項13】
Lが、dmfである、請求項9、10又は11記載の方法。
【請求項14】
前記触媒が、Ru(キラル配位子)(acac)2である、請求項1〜8のいずれか一項記載の方法。
【請求項15】
前記Ru(キラル配位子)(acac)2触媒が、前記キラル配位子及びRu(η4-ヘキサジエン)(acac)2から事前形成される、請求項14記載の方法。
【請求項16】
前記触媒が、Ru(キラル配位子)Br2である、請求項1〜8のいずれか一項記載の方法。
【請求項17】
Ru(キラル配位子)Br2が、前記キラル配位子及びRu(メチルアリル)2CODから事前形成される、請求項16記載の方法。
【請求項18】
前記触媒が、Ru(キラル配位子)Cl2(dmf)xであり、式中xは2、3又は4である、請求項1〜8のいずれか一項記載の方法。
【請求項19】
前記Ru(キラル配位子)Cl2(dmf)xが、前記キラル配位子、[Ru(C6H6)Cl2]2及びDMFから事前形成される、請求項18記載の方法。
【請求項20】
前記触媒が、Ru(キラル配位子)Cl2(C6H6)である、請求項1〜8のいずれか一項記載の方法。
【請求項21】
前記Ru(キラル配位子)Cl2(C6H6)が、前記キラル配位子、[Ru(C6H6)Cl2]2、及びジクロロメタンとエタノールとの1:1混合物から事前形成される、請求項20記載の方法。
【請求項22】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項1〜21のいずれか一項記載の方法:
【化5】

。
【請求項23】
前記キラル配位子が、化合物IIIのR又はS鏡像異性体である、請求項22記載の方法。
【請求項24】
前記キラル配位子が、化合物IIIのR鏡像異性体である、請求項22記載の方法。
【請求項25】
前記水素化が、酸の存在下で行われる、請求項1〜24のいずれか一項記載の方法。
【請求項26】
前記酸が、CH3COOH又はH3PO4である、請求項25記載の方法。
【請求項27】
前記酸が、H3PO4である、請求項25又は26記載の方法。
【請求項28】
前記酸が、CH3COOHである、請求項25又は26記載の方法。
【請求項29】
前記水素化が、溶媒の存在下で行われる、請求項1〜28のいずれか一項記載の方法。
【請求項30】
前記溶媒が、置換又は非置換の直鎖又は分枝C1〜C6アルコール、アレーン、又はそれらの混合物から選択される、請求項29記載の方法。
【請求項31】
前記溶媒が、MeOH、EtOH、1-BuOH、2-BuOH、CF3CH2OH、DCM、DCE、THF、トルエン、又はMeOH、トルオールとDCMとの1:1混合物から選択される、請求項30記載の方法。
【請求項32】
前記溶媒が、MeOH又はDCMである、請求項31記載の方法。
【請求項33】
前記溶媒が、MeOHである、請求項32記載の方法。
【請求項34】
前記水素化が、40℃〜100℃の範囲の温度で行われる、請求項1〜33のいずれか一項記載の方法。
【請求項35】
前記水素化が、40℃〜90℃の範囲の温度で行われる、請求項34記載の方法。
【請求項36】
前記水素化が、50℃〜90℃の範囲の温度で行われる、請求項35記載の方法。
【請求項37】
前記水素化が、60℃〜90℃の範囲の温度で行われる、請求項36記載の方法。
【請求項38】
前記水素化が、80℃の温度で行われる、請求項34記載の方法。
【請求項39】
前記水素化が、10バール〜70バールの範囲の圧力で行われる、請求項1〜38のいずれか一項記載の方法。
【請求項40】
前記水素化が、10バール〜60バールの範囲の圧力で行われる、請求項39記載の方法。
【請求項41】
前記水素化が、20バール〜50バールの範囲の圧力で行われる、請求項40記載の方法。
【請求項42】
前記水素化が、20バール〜40バールの範囲の圧力で行われる、請求項41記載の方法。
【請求項43】
前記水素化が、20バール〜30バールの範囲の圧力で行われる、請求項42記載の方法。
【請求項44】
前記水素化が、30バールの圧力で行われる、請求項43記載の方法。
【請求項45】
基質:触媒(S/C)比が、100/1〜5000/1の範囲である、請求項1〜44のいずれか一項記載の方法。
【請求項46】
基質:触媒(S/C)比が、250/1〜4000/1の範囲である、請求項45記載の方法。
【請求項47】
基質:触媒(S/C)比が、500/1〜2000/1の範囲である、請求項46記載の方法。
【請求項48】
基質:触媒(S/C)比が、2000/1の範囲である、請求項47記載の方法。
【請求項49】
実質的に式Aの化合物を結晶化することを更に含む、請求項1〜48のいずれか一項記載の方法。
【請求項50】
前記結晶化が、DCM/ヘキサン中で行われる、請求項49記載の方法。
【請求項51】
化合物Aが、S鏡像異性体の形態である、請求項1〜50のいずれか一項記載の方法。
【請求項52】
化合物Aが、R鏡像異性体の形態である、請求項1〜50のいずれか一項記載の方法。
【請求項53】
式Cの化合物のR又はS鏡像異性体の製造方法であって、
【化6】

請求項1〜52のいずれか一項記載の方法によって式Aの化合物のR又はS鏡像異性体を形成すること、続いて、化合物AのR又はS鏡像異性体を式Cの化合物の各R又はS鏡像異性体に変換することを含む、前記製造方法。
【請求項54】
前記化合物Aが、-C(=O)-O-R4基をHと置換することを含む反応によって化合物Cに変換される、請求項53記載の方法。
【請求項55】
前記化合物AのR又はS鏡像異性体が、水素分解によって式Cの化合物の各R又はS鏡像異性体に変換される、請求項53又は54記載の方法。
【請求項56】
式Eの化合物のR若しくはS鏡像異性体又はその塩の製造方法であって、
【化7】

請求項53、54又は55のいずれか一項記載の方法によって式Cの化合物のR又はS鏡像異性体を形成すること、及び該式Cの化合物のR又はS鏡像異性体を式Eの化合物のR又はS鏡像異性体に変換することを含む、前記製造方法。
【請求項57】
化合物Cを化合物Eの置換イミダゾール-2-チオン環のN(1)部位を構築するためのアミノ成分として用いることによって、化合物Cが化合物Eに変換される、請求項56記載の方法。
【請求項58】
前記化合物Cのアミノ基が、5-置換イミダゾール-2-チオン基に変換され、ここで5位の置換基が-(CH2)n-NHR12基であり、式中R12は、水素、アルキル又はアルキルアリール基を表す、請求項56又は57記載の方法。
【請求項59】
前記式Cの化合物のR又はS鏡像異性体を式D2の化合物と、実質的に不活性な溶媒中、有機酸の存在下で水溶性のチオシアン酸塩とともに反応させること、
【化8】

(式中nは1、2又は3を表し;nが1又は2である場合、R12は水素、アルキル又はアルキルアリール基を表し、R11はヒドロキシル保護基を表し、かつR13はアミノ保護基を表し;nが3である場合、R11はヒドロキシル保護基を表すが、R12及びR13は互いに結合してフタルイミド基を表す。)続いて、後続の中間生成物F〜Iの脱保護を行うことを含む、請求項57又は58記載の方法:
【化9】

。
【請求項60】
Xが、Oである、請求項56〜59のいずれか一項記載の方法。
【請求項61】
nが、2又は3である、請求項56〜60のいずれか一項記載の方法。
【請求項62】
R1、R2及びR3の少なくとも1つが、フッ素である、請求項56〜61のいずれか一項記載の方法。
【請求項63】
化合物Eが、下記のもの又はその塩である、請求項56〜59のいずれか一項記載の方法:
(S)-5-(2-アミノエチル)-1-(1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(2-アミノエチル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-フルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,7-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6,7,8-トリフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-クロロ-8-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-メトキシ-8-クロロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(8-ニトロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-[6-(アセチルアミノ)クロマン-3-イル]-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-クロマン-3-イル-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-アミノエチル)-1-(6-ヒドロキシ-7-ベンジルクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-アミノメチル-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;
(R)-5-(3-アミノプロピル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(S)-5-(3-アミノプロピル)-1-(5,7-ジフルオロ-1,2,3,4-テトラヒドロナフタレン-2-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R,S)-5-(2-アミノエチル)-1-(6-ヒドロキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R,S)-5-(2-アミノエチル)-1-(6-メトキシチオクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-ベンジルアミノエチル)-1-(6-メトキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-5-(2-ベンジルアミノエチル)-1-(6-ヒドロキシクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-1-(6-ヒドロキシクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン;(R)-1-(6,8-ジフルオロクロマン-3-イル)-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオン、又は(R)-1-クロマン-3-イル-5-(2-メチルアミノエチル)-1,3-ジヒドロイミダゾール-2-チオンである。
【請求項64】
化合物Eが、(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオンである、請求項63記載の方法。
【請求項65】
前記塩が、塩酸塩である、請求項63又は64記載の方法。
【請求項66】
化合物Eが、式Pの化合物の各R又はS鏡像異性体である、請求項56〜59のいずれか一項記載の方法:
【化10】

。
【請求項67】
式Bの化合物の不斉水素化におけるキラル遷移金属触媒の使用であって、
【化11】

該遷移金属触媒が、下記式を有するキラル配位子を含み、
【化12】

式中R、R'、X、R1、R2、R3及びR4は、請求項1〜8のいずれか一項に定義したものと同じ意味を有する、前記使用。
【請求項68】
前記触媒が、Ru(キラル配位子)(acac)2、Ru(キラル配位子)Br2、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)、又はRu(キラル配位子)Cl2(C6H6)である、請求項67記載の使用。
【請求項69】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項67又は68記載の使用:
【化13】

。
【請求項70】
前記キラル遷移金属触媒が、事前形成されている、請求項67記載の使用。
【請求項71】
前記水素化が、酸の存在下で行われる、請求項67〜70のいずれか一項記載の使用。
【請求項72】
請求項56〜59のいずれか一項記載の方法によって生成される、(R)-5-(2-アミノエチル)-1-(6,8-ジフルオロクロマン-3-イル)-1,3-ジヒドロイミダゾール-2-チオン塩酸塩。
【請求項73】
請求項1〜52のいずれか一項記載の式Aの化合物のS又はR鏡像異性体の製造方法であって、式中X、 R1、R2、R3及びR4は、請求項1、2、3又は4のいずれか一項に定義したものと同じ意味を有し、かつここで前記キラル遷移金属触媒が、下記式のキラル配位子を含む事前形成された触媒であり、
【化14】

式中R及びR'は、請求項1に定義したものと同じ意味を有し、前期触媒が、遷移金属前駆体化合物をキラル配位子と反応させること、及び該遷移金属触媒を単離することによって製造され、後に該触媒が後続のプロセスに使用される、前記製造方法。
【請求項74】
前記キラル配位子が、下記構造の1つを有する化合物のR又はS鏡像異性体である、請求項73記載の方法:
【化15】

。
【請求項75】
前記キラル配位子が、化合物IIIのR又はS鏡像異性体である、請求項74記載の方法。
【請求項76】
前記キラル配位子が、化合物IIIのR鏡像異性体である、請求項75記載の方法。
【請求項77】
前記触媒が、Ru(キラル配位子)(acac)2、Ru(キラル配位子)Br2、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)、又はRu(キラル配位子)Cl2(Ar)(式中Arは、C6H6又はp-シメンである。)である、請求項73〜76のいずれか一項記載の方法。
【請求項78】
前記触媒が、Ru(キラル配位子)(acac)2触媒であり、かつ該前躯体がRu(η4-ヘキサジエン)(acac)2である、請求項77記載の方法。
【請求項79】
前記触媒が、Ru(キラル配位子)Br2であり、かつ該前躯体がRu(メチルアリル)2CODである、請求項77記載の方法。
【請求項80】
前記触媒が、Ru(キラル配位子)Cl2(dmf)x(式中xは、2、3又は4である。)であり、該前躯体が、[Ru(C6H6)Cl2]2であり、かつ該触媒の製造方法が、DMFの存在下で行われる、請求項77記載の方法。
【請求項81】
前記触媒が、Ru(キラル配位子)Cl2(Ar)であり、該前駆体が、[Ru(Ar)Cl2]2であり、かつ該製造方法が、ジクロロメタンとエタノールとの1:1混合物の存在下で行われ、式中Arは、C6H6又はp-シメンである、請求項77記載の方法。
【請求項82】
実施例を参照して、実質的に本明細書中に記載される方法。
【請求項83】
実施例を参照して、実質的に本明細書中に記載される使用。
【公表番号】特表2011−518771(P2011−518771A)
【公表日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願番号】特願2010−550630(P2010−550630)
【出願日】平成21年3月13日(2009.3.13)
【国際出願番号】PCT/PT2009/000012
【国際公開番号】WO2009/113891
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(596095518)バイアル−ポルテラ アンド シーエー,エス.エー. (25)
【Fターム(参考)】
【公表日】平成23年6月30日(2011.6.30)
【国際特許分類】
【出願日】平成21年3月13日(2009.3.13)
【国際出願番号】PCT/PT2009/000012
【国際公開番号】WO2009/113891
【国際公開日】平成21年9月17日(2009.9.17)
【出願人】(596095518)バイアル−ポルテラ アンド シーエー,エス.エー. (25)
【Fターム(参考)】
[ Back to top ]

