中枢神経移行性評価用プローブ、中枢神経移行性評価方法、及び、中枢神経移行性評価用プローブを用いたスクリーニング方法
【課題】本発明の目的は、中枢神経組織内外への物質移行性を光学的に評価することが可能な評価用プローブを提供することである。また、本発明の別の目的は、中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性評価方法を提供することである。また、本発明の別の目的は、中枢神経移行性評価用プローブを用いたスクリーニング方法を提供することにある。
【解決手段】一般式(1)で表される化合物を少なくとも1種を有効成分として含むことを特徴とする中枢神経移行性評価用プローブ。

【解決手段】一般式(1)で表される化合物を少なくとも1種を有効成分として含むことを特徴とする中枢神経移行性評価用プローブ。

【発明の詳細な説明】
【技術分野】
【0001】
本発明は、中枢神経組織内外への物質移行性を光学的に評価することが可能な評価用プローブ、中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性の評価方法、及び、中枢神経移行性評価用プローブを用いたスクリーニング方法に関する。
【背景技術】
【0002】
脊椎動物の脳や網膜などの中枢神経組織には関門機構(血液神経関門)が存在し、中枢神経組織への物質移行は制限されている。中枢神経組織における関門機構としては、血液脳関門(BBB)、血液脳脊髄液関門(BCSFB)、血液網膜関門(BRB)、などが知られている。これらの関門機構では、中枢神経組織の毛細血管内皮細胞が密着結合を形成することにより細胞間隙を介した物質の拡散が起こりにくくなっている。また、関門機構においてはトランスポーターが大きく関わっており、血液から脳への供給輸送に関わるトランスポーターの存在と、脳から血液への排出輸送に関わるトランスポーターの存在が明らかにされている。
【0003】
トランスポーターは全身の臓器・組織に分布しており、ATPの加水分解エネルギーを利用して輸送を行うABC (ATP binding cassette) ファミリーと、ATPのエネルギーを用いないで輸送を行うSLC (Solute carrier) ファミリーの二つに分けられ、ヒトにおいては現在までに48種類のABCトランスポーター遺伝子と319種類のSLCトランスポーター遺伝子が同定されている。トランスポーターには、薬剤を細胞内へ流入させる機能を担うものと、細胞内から細胞外へ排出する機能を担うものがある。
【0004】
トランスポーターによる物質輸送機能の評価や、トランスポーターの働きに影響を及ぼす阻害剤などの物質の作用を調べる、又は、スクリーニングをすることは、様々な病態の解明や創薬において重要である。
【0005】
例えば、トランスポーターの異常によって生ずる疾患は加齢とともに増加し、50歳以降の高齢化疾患関連遺伝子の約10%にトランスポーターが関連するとされる。トランスポーターが関連する病態は、トランスポーターの異常に起因する膜輸送障害によって惹起された病態と言えるため、トランスポーターはいわゆる生活習慣病の治療薬開発の標的分子となりうると考えられる。
【0006】
一方で、薬物送達においては、流入トランスポーターに認識される、あるいは、排出トランスポーターに認識されにくい薬物を開発することが戦略として考えられる。様々な組織で、特に細胞内から薬剤を排出するトランスポーターのうち、多くの抗がん剤などを輸送する多剤排出トランスポーターの存在が知られており、これががん細胞などに対して多くの薬剤が効かないこと(多剤耐性)の原因となっている。そこで、薬剤排出トランスポーターの機能を阻害することができれば、標的組織への薬物送達を可能にしたり、抗がん剤などの細胞内濃度を高めたりすることで、がん細胞の生育を阻害することができる。
【0007】
特許文献1では、標識された被験物質を細胞に接触させ、細胞内の標識物質を経時的に測定するスクリーニング方法が開示されている。本方法によれば、標識物質を検出することにより、被検物質のトランスポーターなどを介した輸送速度などを定量することができる。
【0008】
特許文献2では、多剤排出トランスポーターであるヒトmrp1遺伝子を導入した線虫に被検体を投与し、その耐性幼虫形成を検出することで、多剤耐性タンパク質MRP1阻害剤のスクリーニングを行う方法が開示されている。本方法を用いれば、多剤耐性タンパク質MRP1の阻害効果を持つ物質をスクリーニングすることができる。
【0009】
特許文献3には、ゼブラフィッシュを血液脳関門のスクリーニングに用いる技術が開示されている。近年小型硬骨魚類のゼブラフィッシュにも中枢神経組織における関門機構が存在することが明らかにされている。本文献では、P−糖タンパク(Pgp:P-glycoprotein)の阻害剤であるベラパミルに暴露したゼブラフィッシュ幼生の心膜内に蛍光色素であるローダミン123を注入し、脳における蛍光を定量することによってローダミン123の分布に対するPgpの阻害効果を評価する方法が開示されている。本方法は、ヒトとの相同性の高いゼブラフィッシュを用いているため、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した実験が可能である。
【0010】
ところで、特許文献4では、ゼブラフィッシュなどの生きた生物個体に暴露するだけで、中枢神経組織である網膜組織を染色可能な眼内組織用染色組成物が開示されている。この文献にはさらに、化学物質の眼内組織における効果、副作用、又は安全性をスクリーニングする方法が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2009−250652号公報
【特許文献2】特開2006−121981号公報
【特許文献3】特表2007−525665号公報
【特許文献4】特開2010−168369号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかし、特許文献1の方法では、細胞に接触させる被験物質を標識する必要があるため、多数の標的物質についてのスクリーニングを同時に行うことは難しかった。
【0013】
また、特許文献2の方法では、ターゲットとなるトランスポーターを予め遺伝子導入した線虫を用いるため、高等動物の血液神経関門や、生体内での代謝機構などの高度な生物学的メカニズムの影響が排除された実験系であり、得られる情報が限定的であった。特許文献3も同様に、排出トランスポーター機能の阻害により高度な生物学的メカニズムの影響が排除されることにより、得られる情報がある程度限定的となるおそれがある。
【0014】
さらに、特許文献3の方法では、トランスポーターの機能評価を行うためのプローブ(ローダミン123)を心膜内に注入する必要があり、このような侵襲性の高さがアーチファクトとなり、結果の再現性に影響を及ぼす可能性があった。
【0015】
これらの問題に鑑み、本発明の目的は、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価をできる技術を提供することにある。
【課題を解決するための手段】
【0016】
発明者らは、前記した課題を解決すべく鋭意検討の結果、下記一般式(1)で表される色素化合物は、生物試料に暴露するだけで生体内に移行し、中枢神経組織(脳神経組織、脊髄、及び、網膜)への物質移行/排出に関連するトランスポーターの基質となることを見出し、トランスポーターの機能評価、並びにトランスポーターの作用に影響を及ぼす化合物の評価及びスクリーニングを可能にする当該化合物を含む新規な中枢神経移行性評価用プローブを見出して、本発明に至った。
【0017】
また、本発明者らは、中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性評価方法、及び中枢神経移行性評価用プローブを用いたスクリーニング方法を開発し、本発明を完成するにいたった。
【0018】
すなわち、本発明の中枢神経移行性評価用プローブは、一般式(1)で表される化合物のうち少なくとも1種を有効成分として含むことを特徴とする。
【化1】

ここで、一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4が互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。
【化2】

一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。「*」は結合部位を示す。
【発明の効果】
【0019】
本発明の新規な中枢神経移行性評価用プローブの提供により、これまで困難であった生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した実験系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価が可能となり、簡便、且つ、再現性よく中枢神経組織(脳神経組織、脊髄、及び、網膜)への移行/排出に関連するトランスポーターの機能評価や、トランスポーターの作用に影響を及ぼす化合物の評価やスクリーニングが可能となる。更に、本発明の中枢神経移行性評価用プローブを用いた評価方法、及び、スクリーニング方法は、中枢神経系の関門機構の研究や中枢神経組織移行性薬剤の創薬のみならず、トランスポーターに影響を与える阻害剤などの化合物の評価やスクリーニングにも有効な新規なツールとなり得る。
【図面の簡単な説明】
【0020】
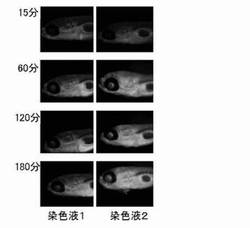
【図1】実施例1で観察された染色液1及び染色液2の経時的な中枢神経系組織の観察像を示す。
【図2】実施例1で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【図3】実施例2で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【図4】実施例3で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【発明を実施するための形態】
【0021】
以下、本発明の実施形態について説明する。なお、個々に開示する実施形態は、本発明の中枢神経移行性評価用プローブ、中枢神経移行性評価方法、及び中枢神経移行性評価用プローブを用いたスクリーニング方法を例示するものであり、本発明はこれらに限定されるものではない。
【0022】
(第一実施形態)
本発明の第一実施形態である中枢神経移行性評価用プローブは、一般式(1)で表される化合物のうち少なくとも1種を有効成分として含むことを特徴とする。
【化3】

ここで、一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4が互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。
【化4】

一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。「*」は結合部位を示す。
【0023】
前記一般式(1)中のR1におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、又は3−ヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0024】
前記一般式(1)中のR1におけるシクロアルキル基としては、特に限定されるものではないが、例えば、シクロヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0025】
前記一般式(1)中のR1におけるアラルキル基としては、特に限定されるものではないが、例えば、ベンジル基、フェネチル基等が挙げられる。
【0026】
前記一般式(1)中のR1におけるアルケニル基、置換アルケニル基若しくはシクロアルケニル基としては、特に限定されるものではないが、例えば、ビニル基、2,2−ジフェニルビニル基、3−ブテニル基、又はシクロヘキセニル基等が挙げられる。
【0027】
前記一般式(1)中のR1におけるアリール基若しくは置換アリール基としては、特に限定されるものではないが、例えば、フェニル基、4−ブロモフェニル基、4−メトキシフェニル基、4−チオメチルフェニル基、又は6−メトキシ−2−ナフチル基、又はナフチル基などが挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0028】
前記一般式(1)中のR1におけるヘテロ環基としては、特に限定されるものではないが、ピリジル基、ピラジル基、又はモルホリニル基等が挙げられる。
前記一般式(1)中のR1におけるアルカノイル基としては、特に限定されるものではないが、例えば、アセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ベンゾイル基、1−ナフトイル基、又は2−ナフトイル基等が挙げられる。
【0029】
前記一般式(1)中のR1としては、アルキル基、アラルキル基、又はアリール基が好ましく、特に、メチル基、エチル基、プロピル基、ベンジル基、フェニル基、4−ブロモフェニル基、4−メトキシフェニル基、4−チオメチルフェニル基、又は6−メトキシ−2−ナフチル基が中枢神経移行性評価をする点で好ましい。
【0030】
前記一般式(1)中のR2〜R5におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、シクロヘキシル基、又は3−ヘキサニル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。これらのうち、R2〜R5としては、水素原子又はメチル基が中枢神経移行性評価をする点で好ましい。
【0031】
前記一般式(1)中のR2〜R5におけるアリール基としては、特に限定されるものではないが、例えば、フェニル基又はナフチル基などが挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0032】
前記一般式(1)中のR2〜R5におけるアルコキシカルボニル基としては、特に限定されるものではないが、例えば、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、又はブトキシカルボニル基等が挙げられる。
【0033】
前記一般式(1)中のR2〜R5におけるアルカノイル基としては、特に限定されるものではないが、例えば、アセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ベンゾイル基、1−ナフトイル基、又は2−ナフトイル基等が挙げられる。
【0034】
R2とR4が互いに結合して形成する環としては、特に限定されるものではないが、例えば、シクロオクタン環、シクロヘプタン環、シクロヘキサン環、シクロペンタン環、若しくはシクロブタン環等の飽和脂肪族環、シクロペンテン環若しくはシクロヘキセン環等の部分飽和脂肪族環、又はベンゼン環等の芳香族環が挙げられる。これらの環は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。これらのうち、R2とR4が互いに結合して形成する環としては、シクロペンタン環又はベンゼン環が中枢神経移行性評価をする点で好ましい。
【0035】
前記一般式(1)中のR6におけるハロゲン原子としては、例えば、フッ素原子、塩素原子、臭素原子、又はヨウ素原子等が挙げられる。
【0036】
R6としては、水素原子又は臭素原子が好ましい。
【0037】
前記一般式(1)中のR7におけるアルコキシカルボニル基としては、特に限定されるものではないが、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基等が挙げられる。
【0038】
前記一般式(1)中のR7におけるカルボン酸の塩としては、特に限定されるものではないが、例えば、ナトリウム塩若しくはカリウム塩等のアルカリ金属塩;マグネシウム塩若しくはカルシウム塩等のようなアルカリ土類塩;アンモニウム塩、ピリジニウム塩、ピペリジニウム塩、若しくはトリエチルアンモニウム塩等のアミン塩;又はトリプトファン塩、リジン塩、ロイシン塩、フェニルアラニン塩、バリン塩、若しくはアルギニン塩等のアミノ酸塩が挙げられる。これらのうち、ナトリウム塩、カリウム塩、アンモニウム塩、ピリジニウム塩、又はピペリジニウム塩等が好ましい。
【0039】
前記一般式(1)中のR7としては、カルボン酸、カルボン酸エチル、カルボン酸ナトリウム、又はカルボン酸カリウムが中枢神経移行性評価をする点で好ましい。
【0040】
前記一般式(2)中のR9におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、又は3−ヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0041】
前記一般式(2)中のR9におけるアラルキル基としては、特に限定されるものではないが、例えば、ベンジル基、フェネチル基等が挙げられる。
【0042】
前記一般式(2)中のR9におけるアルケニル基、置換アルケニル基若しくはシクロアルケニル基としては、特に限定されるものではないが、例えば、ビニル基、2,2−ジフェニルビニル基、3−ブテニル基、又はシクロヘキセニル基等が挙げられる。
【0043】
前記一般式(2)中のR9におけるアリール基としては、特に限定されるものではないが、例えば、フェニル基又はナフチル基などが挙げられる。これらの基は、中枢神経移行性評価をする際に著しく阻害するものでなければ、さらに置換基を有していてもよい。
前記一般式(1)中のR8としては、硫黄原子が中枢神経移行性評価をする点で特に好ましい。
【0044】
前記一般式(1)中のnは0〜3の整数を表す。特に0又は1であることが、中枢神経移行性評価をする点で特に好ましい。
【0045】
前記一般式(1)中のmは1以上の整数を表す。mが1〜5の整数の時が好ましく、mが1又は2である時、中枢神経移行性評価をする点で特に好ましい。
【0046】
本発明者らの検討より、前記一般式(1)中のmの数がトランスポーターによる流入/排出の速度に影響することが確かめられており、トランスポーターに影響を及ぼす物質の評価を行う際には、トランスポーターに対する影響の強さによって、適宜選択することが好ましい。特に好ましい具体例として、例えば、mが1の化合物を含む中枢神経移行性評価用プローブは、トランスポーターに特に強く輸送されるため、トランスポーターに対する影響が強い物質の評価の際に用いる事が出来る。また、mが2の化合物を含む中枢神経移行性評価用プローブは、トランスポーターに比較的緩やかに輸送されるため、トランスポーターに対する影響が弱い物質の評価の際に用いる事が出来る。
【0047】
本発明にかかる一般式(1)で表される色素化合物は、市販されており入手可能であるが、公知の方法によって合成することも可能である。
【0048】
一般式(1)で表わされる色素化合物の好ましい具体例(化合物(1)から化合物(46))を次に示すが、本発明は以下のものに限定されるわけではない。
【化5】

【化6】

【0049】
(化合物について)
本発明の中枢神経移行性評価用プローブに含まれる一般式(1)で表される化合物としては、分子量が300以上1,000以下であるものが好ましく選択される。より好ましくは分子量が300以上650以下の化合物が選択される。また、本発明者らの検討より、前記一般式(1)中のR1の分子量が流入/排出の速度に影響することが確かめられており、一般的な評価においては、前記一般式(1)中のR1の分子量が1以上250以下であるものが好ましい。
【0050】
また、本発明の化合物は蛍光性を有する蛍光性化合物であることが好ましい。蛍光性の化合物であれば感度が高いため、低濃度でトランスポーターを標識して可視化することができ、必要とする化合物の量を相対的に減らすことができる。また、基質となるトランスポーターの種類や基質特異性ごとに蛍光スペクトルの異なる化合物等の組み合わせを選択すれば、複数のトランスポーターの機能を多重標識によって評価することが可能になり、一度の観察から得られる情報が増えるため、有用性が高い。このような、蛍光性化合物である本発明の化合物を用いれば、被験物質を標識する手間が省けるため、多数の標的物質についてのスクリーニングでも簡便に行うことができる。
【0051】
本発明の中枢神経移行性評価用プローブに含まれる化合物の濃度は特に限定されるものではないが、標的とする部位や使用される化合物によって適宜調節される。通常は0.001ng/mL以上100μg/mL以下の濃度で用いられ、より好ましくは0.001ng/mL以上10μg/mL以下、より好ましくは0.001ng/mL以上5μg/mL以下の濃度で用いられる。
【0052】
本発明の中枢神経移行性評価用プローブは、前記一般式(1)で表される化合物の少なくとも1種を適当な溶媒に溶解させて用いる。溶媒としては、生体に影響がなければ、特に限定されるものではないが、例えば、生体との親和性が高い水性の液体が好ましい。具体的には、水;生理食塩水;リン酸緩衝液(PBS)若しくはTris等の緩衝液;メタノール、エタノール、イソプロパノール、ブタノール、エチレングリコール、若しくはグリセリン等のアルコール系溶媒;N,N−ジメチルスルホキシド(以下、「DMSO」と略する)若しくはN,N−ジメチルホルムアミド(以下、「DMF」と略する)等の有機溶媒;D−MEM(Dulbecco's Modified Eagle Medium)若しくはHBSS(Hanks' Balanced Salt Solutions、ハンクス平衡塩)等の細胞培養用培地、又は乳酸リンゲル液等の輸液が挙げられる。これらの溶媒には、特に水が50%以上含まれていることが好ましい。また、これらの溶媒を2種以上混合して用いることもできる。これらの溶媒のうち、メタノール、エタノール、又はDMSOが特に好ましい。
【0053】
本発明の中枢神経移行性評価用プローブの作製方法は、特に限定されるものではないが、例えば、上記のような溶媒に溶解させた化合物の濃厚溶液を希釈して作成しても良い。化合物の水溶性が低い場合には、適当な溶媒に溶解させてから精製水に希釈させて用いることができる。
【0054】
本発明の中枢神経移行性評価用プローブには、生体に適した塩濃度やpH等を制御することが必要であれば添加剤を1種類又はそれ以上組み合わせて添加することができる。
本発明に用いられる添加剤としては、中枢神経系組織標識用組成物に影響がなければ特に限定されるものではないが、例えば、保湿剤、表面張力調整剤、増粘剤、塩化ナトリウムのような塩類、各種pH調整剤、pH緩衝剤、防腐剤、抗菌剤、甘味剤、又は香料等が挙げられる。
【0055】
pH調整剤としては、pHを5〜9に調整することが好ましく、特に限定されるものではないが、例えば、塩酸、酢酸、リン酸、クエン酸、リンゴ酸、水酸化ナトリウム、又は炭酸水素ナトリウム等が挙げられる。
【0056】
本発明の中枢神経移行性評価用プローブは放射性核種で標識されたプローブとして用いることも可能である。標識に用いる放射性核種の種類は、特に制限されるものではないが、使用の態様によって適宜選択することができる。具体的に、PETによる測定の場合は、例えば、11C、14C、13N、15O、18F、19F、62Cu、68Ga、又は78Br等の陽電子放出核種を用いることができる。好ましくは、11C、13N、15O、又は18F等であり、特に好ましくは、11C又は18F等である。また、SPECTによる測定の場合は、例えば、99mTc、111In、67Ga、201Tl、123I、又は133Xe等のγ線放射核種を用いることができる。好ましくは、99mTc又は123I等である。更に、ヒト以外の動物を測定する場合には、例えば、125Iのようなより半減期の長い放射線核種を用いることができる。GREIによる測定の場合は、例えば、131I、85Sr、又は65Zn等を用いることができる。
【0057】
放射性核種で標識した中枢神経系組織標識用組成物は、例えば、オートラジオグラフィー、陽電子(ポジトロン)放出核種を用いる放射断層撮影法(PET)、又は様々なガンマ線放出核種を用いる単一光子放射断層撮影法(SPECT)等によって画像化を行うことができる。また、フッ素原子核に由来するMR信号や13Cを利用した核磁気共鳴法(MRI)で検出してもよい。更に、次世代分子イメージング装置として複数分子同時イメージングが可能なコンプトンカメラ(GREI)等によって画像化することも可能である。また、例えば、液体シンチレーションカウンター、X線フィルム、又はイメージングプレート等を用いて中枢神経移行性評価用プローブの定量を行うことも可能である。
また、14C等の放射性同位元素で標識した中枢神経移行性評価用プローブは、加速器質量分析法(AMS)等によって、血液中(又は、尿中若しくは糞中)の濃度を測定して、標識化した物質の未変化体や代謝物の薬物動態学的情報(薬物血中濃度−時間曲線下面積(AUC)、血中濃度半減期(T1/2)、最高血中濃度(Cmax)、最高血中濃度到達時間(Tmax)、分布容積、初回通過効果、生物学的利用率、糞尿中排泄率等)を得ることが可能である。
【0058】
放射線核種は一般式(1)で表される化合物に含まれる形でも、結合する形でもよい。
【0059】
放射線核種の標識の方法は、特に限定されるものではなく、一般的に用いられている方法で良い。また、一般式(1)で表される化合物を構成する元素の少なくとも一部を放射性核種で置換する形でも良い。
【0060】
一般式(1)で表される化合物を放射性核種で標識した場合、1mMあたり、1〜100μCi程度の放射性を有することが好ましい。この時、用いる中枢神経移行性評価用プローブの投与量は、影響がなければ特に制限はされず、化合物の種類及び標識に用いた放射性核種の種類により適宜選択される。
【0061】
(対象)
本発明の中枢神経移行性評価用プローブを用い中枢神経組織内外への物質の流入・排出を評価することが可能な生物種としては、特に限定されるものではないが、例えば、脊椎動物としては、トラフグ、クサフグ、ミドリフグ、メダカ、若しくはゼブラフィッシュ等の硬骨魚類、アフリカツメガエル等の両生類、ニワトリ若しくはウズラ等の鳥類、ラット、マウス、若しくはハムスター等の小動物、ヤギ、ブタ、イヌ、ネコ、ウシ、若しくはウマ等の大動物、又は、サル、チンパンジー、若しくはヒト等の霊長類が挙げられる。特に、本発明によれば、これらの生物個体を用いて生きたままの状態で評価することができる。また、生物種としては、ヒトを除外してもよい。
【0062】
これらの生物試料の中でも、ゼブラフィッシュを用いることが好ましい。ゼブラフィッシュは、米国及び英国では、近年、既にマウス及びラットに続く第3のモデル動物として認知されており、人と比較して全ゲノム配列が80%の相同性を持ち、遺伝子数もほぼ同じであり、さらに主要臓器・組織の発生・構造も良く似ていることが解明されてきている。各パーツ(心臓、肝臓、腎臓、消化管等の臓器・器官)が受精卵から分化して形成されていく過程が透明な体を通して観察できるため、非侵襲的に生体内部の観察が可能なゼブラフィッシュをモデル動物としてスクリーニングに用いることは特に好ましい。ゼブラフィッシュは3dpf(days post fertilization、3日胚)でBBBの密着結合の主要な構成タンパク質であるClaudin−5及びZonula Occludens−1が発現する(Brain Research Bulltein 75 (2008) 619−628)。6−7dpfで主要な臓器が形成され、8dpfにはBBBの物質排出を担うP−糖タンパクも発現する。そのため、中枢神経組織の評価に好適に用いることができる。また、ゼブラフィッシュは1回の産卵で約200個以上の受精卵が得られるため同じ遺伝的背景持ったゼブラフィッシュが得られ、スクリーニングには好都合であるという利点がある。
【0063】
本発明の中枢神経移行性評価用プローブを用いて評価できる血液神経関門は、例えば、血液脳関門(BBB)、血液脳脊髄液関門(BCSFB)、血液網膜関門(BRB)等が挙げられる。これらのうち、血液脳関門及び血液脳脊髄液関門が好ましくは評価され、さらには血液脳関門が好ましくは評価される。これらの血液神経関門において、化合物の流入及び排出トランスポーターの働きを評価することができるが、特に排出トランスポーターの働きを好適に評価することができる。より好ましくは、ABCトランスポーターを評価することができる。
【0064】
本発明の中枢神経移行性評価用プローブは、プローブのみを投与した場合は、中枢神経組織への物質の移行性が見られても見られなくてもよい。プローブのみを投与することにより、中枢神経組織内外の物質の移行性を評価することができる。
【0065】
また、プローブのみを投与した場合に中枢神経組織への物質の移行性が見られない場合でも、トランスポーターの機能に影響を及ぼす化合物と同時に作用させることで、中枢神経組織への移行性が見られるようになることにより、中枢神経組織のトランスポーターに影響を及ぼす物質の評価を行うことができる。同様に、プローブのみを投与した場合でも中枢神経組織への移行性が見られる場合は、トランスポーターの機能に影響を及ぼす化合物と同時に作用させることで、中枢神経組織への移行性が見られなくなることや、中枢神経組織への移行速度が変化(上昇又は低下)することにより、トランスポーターに影響を及ぼす物質の評価を行うことができる。本発明においては、中枢神経組織への移行性が見られるようになること、逆に見られなくなること、及び中枢神経組織への移行速度が変化することをあわせて、中枢神経組織への移行性が変化すると表現する。本発明の化合物としては、中枢神経移行性評価用プローブのみを暴露した場合には中枢神経組織への移行性がない、あるいは非常に低いが、トランスポーターに影響を及ぼす物質と同時に暴露した場合に、中枢神経組織への移行性が変化するものが特に好ましく用いられる。
【0066】
本発明の中枢神経移行性評価用プローブは、生体内に侵襲的な手段で投与する必要がなく、生体への暴露、又は経口投与若しくは経粘膜投与などによって生体内に移行するため、生物試料を傷つけることなくトランスポーターの評価を行うことができる。すなわち、生きた生物個体に対して、中枢神経の近傍組織の切開や、中枢神経系組織又は中枢神経系組織に連絡する神経組織への針刺し等の外科的損傷、を与えることなく投与することができる。なお、本発明は、前記外科的損傷を伴う投与方法を排除していない。
【0067】
外科的損傷なく投与する方法としては特に限定されるものではないが、例えば、中枢神経移行性評価用プローブを生物個体の一部又は全体に暴露する方法、経口接触による方法、経肺(若しくは経鰓)接触による方法、経鼻接触による方法、経消化管接触による方法、経粘膜接触による方法、経体液接触による方法、舌下接触による方法、静脈又は動脈等の血管内接触による方法、腹腔内接触による方法、腹膣内、皮下、皮内、膀胱内、若しくは気管(気管支)内等への注入方法、又は噴霧若しくは塗布等の手段による生体内への接触による方法等が挙げられる。動物への投与の場合には、その投与形態、投与経路、投与量は対象となる動物の体重や状態によって適宜選択する。
【0068】
本発明の中枢神経移行性評価用プローブに含まれる化合物は、少なくとも一種類以上の中枢神経系組織に存在する関門機構を構成するトランスポーターの基質となることをその特徴とする。トランスポーターとしては、特に限定されるものではないが、ABCトランスポーター、SLCトランスポーター、グルコーストランスポーター、又はドーパミントランスポーターなどがあげられる。好ましくは、排出トランスポーターであり、より好ましくは、ABCトランスポーターであり、さらに好ましくは、Pgp、BCRP(BreastCancer Resistance Protein)、又はMRP(Multidrug resistance-associated Protein)1〜8の基質となるものである。
【0069】
本発明において、トランスポーターの基質となるとは、流入トランスポーターによって選択的に輸送されることができるか、又は流入トランスポーター阻害剤の存在下では輸送されることができないか、若しくはそのトランスポーターを介しての移行性が変化することを意味する。あるいは、本発明において、トランスポーターの基質となるとは、排出トランスポーターにより選択的に輸送されるか、排出トランスポーター阻害剤の非存在下ではそのトランスポーターにより輸送されるが阻害剤の存在下では輸送されないか、又は排出トランスポーター阻害剤の存在下でそのトランスポーターを介しての移行性が変化することを意味する。
【0070】
本発明の中枢神経移行性評価用プローブを用いれば、例えば、大脳(終脳)、大脳皮質、大脳基底核、中脳、小脳、間脳、後脳(外套)、橋、延髄、脊髄、視索、上丘(視蓋)、脳下垂体、視蓋脊髄(延髄)路、網様体、中隔核、扁桃体、内包、若しくは視神経などから構成される中枢神経系組織、視神経をはじめとする脳神経、これら組織の疾患状態組織、又は疾患による新生組織若しくは癌組織等について、トランスポーターの機能の評価を染色状態で行うことができる。また、生物種類、発生段階、又は発生異常若しくは疾病等によって前記と異なる中枢神経系組織が存在する場合は、それらの組織も含むことができる。本発明の中枢神経移行性評価用プローブは、視神経、視索、上丘(視蓋)、脳下垂体、視蓋脊髄(延髄)路、又は網様体の染色性によって特に好ましくトランスポーターの機能を評価することができる。
【0071】
前記の中枢神経系組織に含まれる細胞としては特に限定されるものではないが、神経細胞、オリゴデンドロサイト、シュワン細胞、プルキンエ細胞、アマクリン細胞、網膜神経節細胞、錐体細胞、星状細胞、顆粒細胞、若しくはグリア細胞、又はこれらの腫瘍細胞若しくはこれらの未分化状態の細胞(幹細胞)等が挙げられる。
【0072】
(評価方法)
本発明の第二の実施形態である中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性の評価方法は、蛍光化合物としての本発明の中枢神経移行性評価用プローブを生物試料に何れかの方法で投与した後、一定時間後に、励起波長の光を観察部位に照射し、発生するより長波長の蛍光を観測し画像を形成することを特徴とする。さらに、必要に応じて経時的に複数回の蛍光を観測してその変化を追跡することを特徴とする。このとき、第一の実施形態と同様に、プローブのみを投与してもよいし、プローブとトランスポーターの機能に影響を及ぼす化合物とを同時に投与した場合とプローブのみを投与した場合とを比較してもよい。
【0073】
本発明の評価方法は、in vivo、in vitro、又はex vivoのいずれで用いてもよい。
【0074】
本発明の評価方法は、中枢神経系組織に影響を与えなければ特に限定されるものではないが、生物試料の状態及び変化を画像として捉える方法である。例えば、中枢神経組織に可視光、近赤外光や赤外光を照射してカメラやCCD等で観察する可視光観察、近赤外光観察、赤外光観察、若しくはレーザー顕微鏡観察、蛍光内視鏡等のように生物試料に対して励起光光源から励起光を照射して発光している生物試料の蛍光を観察する蛍光観察、蛍光顕微鏡観察、蛍光内視鏡観察、共焦点蛍光顕微鏡観察、多光子励起蛍光顕微鏡観察、若しくは狭帯域光観察、共光干渉断層画像観察(OCT)、又は軟エックス線顕微鏡による観察等が挙げられる。
【0075】
本発明で用いられる励起するための波長は、特に限定されるものではないが、使用する前記一般式(1)で表される色素化合物によって異なり、本発明の前記一般式(1)で表される色素化合物が効率よく蛍光を発すれば特に限定されるものではない。通常、200〜1010nm、好ましくは400〜900nm、より好ましくは、480〜800nmである。近赤外領域の光を用いる場合は、通常600〜1000nmで、好ましくは、生体透過性に優れている680〜900nmの波長が用いられる。
【0076】
本発明で用いられる蛍光励起光源としては特に限定されるものではないが、各種レーザー光源を用いることができる。これらのレーザー光源としては、例えば、色素レーザー光源、半導体レーザー光源、イオンレーザー光源、ファイバーレーザー光源、ハロゲンランプ、キセノンランプ、又はタングステンランプ等が挙げられる。また、各種光学フィルターを用いて、好ましい励起波長を得たり、蛍光のみを検出したりすることができる。
【0077】
このように生物個体に励起光を照射することにより、中枢神経系組織の内部において発光させた状態で中枢神経系組織を撮像すれば発光部位を容易に検出することができる。また、可視光を照射して得られた明視野画像と励起光を照射して得られた蛍光画像を画像処理手段で組み合わせることで、より詳細に中枢神経系組織を観察することもできる。また、共焦点顕微鏡を用いれば、光学的な切片画像を取得することができるため、好ましい。さらに、多光子励起蛍光顕微鏡は、高い深部到達性と空間解像力を持つため、組織内部の観察に好ましく用いられる。
【0078】
(スクリーニング方法)
本発明の第三の実施形態であるスクリーニング方法は、中枢神経移行性評価用プローブを用いて、in vivoで中枢神経系組織に作用する化合物を検出することを特徴とする。本発明の中枢神経移行性評価用プローブは、生物個体、例えば、小型硬骨魚類であるゼブラフィッシュを用いて、生きたままの状態、いわゆるin vivoで中枢神経系組織への移行性を指標として用いることにより、スクリーニング対象化合物の中枢神経系組織移行性や薬理作用をスクリーニングすることが可能である。更に、生きた生物個体であるゼブラフィッシュ等を用いているため、スクリーニング対象化合物の安全性についても同時にスクリーニングすることが可能である。ただし、本発明はこれらに限定はされず、例えばin vitroやex vivoでスクリーニングを行ってもよい。
【0079】
「中枢神経系組織に作用する化合物を検出すること」とは、中枢神経組織内外の物質移行に影響する物質の候補となる被験物質(スクリーニング対象化合物)を当該中枢神経系組織へ作用させた際の、本発明の中枢神経移行性評価用プローブの標識性の変化を測ることによって、中枢神経系組織に作用する化合物の有無や特性を検出することをいう。具体的に、一例としては、スクリーニング対象化合物と本発明の中枢神経移行性評価用プローブとをゼブラフィッシュに接触させた場合と、本発明の中枢神経移行性評価用プローブのみをゼブラフィッシュに接触させた場合とを比較する。このようにして、スクリーニング対象化合物の存在が、中枢神経移行性評価用プローブによる中枢神経系組織の染色状態に及ぼす影響を観察することによってスクリーニングを行うことができる。
【0080】
スクリーニング対象化合物を接触させる方法としては、特に限定されるものではないが、スクリーニング対象化合物が水溶性の場合は、飼育水中にスクリーニング対象化合物を投与する方法、非水溶性の場合は、飼育水中にスクリーニング対象化合物を単独で分散させて投与する方法、若しくは微量の界面活性剤やDMSOと共に投与する方法、生物個体の餌に混ぜて経口投与する方法、又は注射等による非経口投与する方法が挙げられる。これらのうち、飼育水中にスクリーニング対象化合物を投与する方法が容易にできるため好ましい。
【0081】
1種類以上の本発明の中枢神経移行性評価用プローブを有効成分として利用し、スクリーニング対象化合物の中枢神経系組織における効果、副作用、又は安全性を生物個体を用いて生物に及ぼす影響のスクリーニングが可能である。標的部位、目的、検査手段等に応じて、使用する中枢神経移行性評価用プローブは随意に選択することができる。更に、中枢神経移行性評価用プローブの移行性に対する影響から、疾病の高精度な診断や治療法の開発等の応用展開が期待される。
【0082】
前記スクリーニング対象化合物とは、化学的に作用のある化合物の総称を意味し、特に限定されるものではないが、例えば、医薬品、有機化合物、治療剤、治験薬、農薬、化粧品、環境汚染物質、又は内分泌攪乱物質等が挙げられる。
【0083】
本発明のスクリーニング方法には、小型硬骨魚類を好ましく用いることができる。本発明のスクリーニング方法で用いられる小型硬骨魚類としては、特に限定されるものではないが、例えば、ゼブラフィッシュ、フグ、金魚、メダカ、又はジャイアント・レリオ等が挙げられる。小型硬骨魚類は、マウス及びラット等と比較して、生育のスピード面・コスト面で非常に優れているため好ましい。特に、ゼブラフィッシュはゲノムの解読がほぼ完了しており、また飼育及び繁殖が容易で流通価格も安く、受精後48〜72時間で主要臓器・組織の基本構造ができ上がるため、好ましい。
【0084】
ゼブラフィッシュとしては、スクリーニングの目的に応じ、野生型ゼブラフィッシュに限定されず、各種疾患系モデルのゼブラフィッシュを用いることができる。疾患系のモデルを用いた場合には、観察により新薬候補化合物の効果を見出し、疾患治療薬又は疾患予防薬のスクリーニングに応用することができる。
【実施例】
【0085】
以下に実施例を挙げて、本発明をより詳細に説明するが、これらの実施例は、本発明のより一層の深い理解のために示される具体例であって、本発明は、これらの具体例に何ら限定されるものではない。なお、特に表示していない限りは「%」は質量基準である。なお、使用した分析装置は、1H核磁気共鳴分光分析(ECA−400、日本電子(株)製)、LC/TOF MS(LC/MSD TOF、Agilent Technologies社製)、及びマルチスペクトロマイクロプレートリーダ(Varioskan Flash、サーモフィッシャーサイエンティフィック(株)製)である。
【0086】
本発明にかかる一般式(1)〜(46)で表される色素化合物は、市販されており入手可能であるが、公知の方法によって合成することも可能である。
【0087】
[化合物の合成例]
次に化合物の典型的な合成例1〜2を示す。
【0088】
<合成例1>
色素化合物(4)の合成
アルデヒド誘導体(1)3.0g(11.4mmol)の酢酸20mL溶液にロダニン−3−プロピオン酸2.2g(11.5mmol)、酢酸アンモニウム0.9gを添加して、還流下2時間攪拌させた。反応終了後、冷却させながら、ゆっくり水50mLを滴下して室温まで冷却した。析出した個体をろ過して、水100mLで2回洗浄し、更に、2−プロパノール50mLで洗浄して、目的物(4)3.1g(収率60.1%)を得た。
【化7】

【0089】
<合成例2>
色素化合物(8)の合成
アルデヒド誘導体(2)1.75g(10.0mmol)のトルエン20mL溶液に、ロダニン−3−プロピオン酸1.13g(10.0mmol)とピペリジン2.5g(30.0mmol)を添加して、還流下2.5時間攪拌させた。反応終了後、室温まで冷却させ、トルエン100mLで希釈した後、水100mLを添加し攪拌した。静置後、有機層を分液して無水硫酸ナトリウムで乾燥させた。ろ過した後、減圧下、トルエンを留去して、エタノールから再結晶して、目的物(8)1.6g(収率43.2%)を得た。
【化8】

【0090】
<他の色素化合物の合成例>
上記合成例1又は2に準じた方法で、下記表1に示す他の化合物を合成した。これらの化合物の構造は、前記した分析装置で確認した。
【0091】
<色素化合物の蛍光特性の測定>
色素化合物1〜46について5μMのDMSO溶液を調製し、日立ハイテク社製FL4500蛍光分光測定機で励起波長及び蛍光波長を測定した。
【0092】
【表1】

【0093】
[中枢神経移行性評価用プローブによる中枢神経組織への物質移行に影響する物質の評価]
(実施例1)
1mMの前記化合物(8)のDMSO溶液に蒸留水を加えて、前記化合物(8)の濃度が1μMである染色液1を得た。さらに、化合物8に加えて、MRP1、MRP2、MRP4などに対する阻害効果が知られているABCトランスポーター阻害剤のMK571が30μMとなるよう加えられた染色液2を得た。6穴マルチプレートの任意のウェル中に、4mLの染色液1とゼブラフィッシュ7日胚の稚魚を20匹入れ、染色を開始した。染色中のゼブラフィッシュを、15分後、1時間後、2時間後、3時間後にウェルから取り出し、スライドガラス上で3%メチルセルロースに埋没させて動きを制限し、実体蛍光顕微鏡(Leica社製 MZ16FA)を用いてゼブラフィッシュの側面から中枢神経組織の蛍光画像を取得し、各サンプルの蛍光強度を画像解析ソフトImage J(NIH)を用いて定量した。このとき取得した蛍光画像を図1に、定量した蛍光強度を図2にそれぞれ示す。また、共焦点顕微鏡(Zeiss社製 Pascal Exciter)を用いて脳神経組織及び網膜神経組織の観察を行った。
その結果、染色液1を暴露した稚魚は、血管の染色性のみ観察されたが、染色液2が暴露された稚魚は、経時的に脳神経組織及び、網膜神経組織の蛍光強度が上昇した。本実施例により、本発明の中枢神経移行性評価用プローブを用いることで、ABCトランスポーターに対する阻害効果を有する化合物の評価が可能であることが示された。
【0094】
(実施例2)
実施例1の染色液1で使用した化合物(8)を化合物(13)に変更して、染色液3を得た。また、染色液2の化合物(8)を化合物(13)に変更して、さらに、トランスポーター阻害剤としてMK571に代えて、有機アニオントランスポーター阻害剤であるDigoxinが30μMとなるように加えられた染色液4、又は、Breast Cancer Resistance Protein(BCRP)の阻害剤であるFumitremorginC(FTC)が10μMとなるように加えられた染色液5を得た。また、染色したゼブラフィッシュの洗浄液として、洗浄液1(蒸留水)、洗浄液2(蒸留水にDigoxinを30μM含む溶液)、洗浄液3(蒸留水にFTCを10μM含む溶液)を用意した。
【0095】
染色液1を染色液3に、染色液2を染色液4又は染色液5に変更した以外は実施例1と同じ操作でゼブラフィッシュ7日胚の稚魚を1時間染色した後、ゼブラフィッシュを表1の通りの洗浄液に移動し、洗浄を行った。洗浄直後(染色から60分)、洗浄1時間後(同120分)、及び、洗浄2時間後(同180分)にゼブラフィッシュをウェルから取り出し、実施例1と同様の操作で脳神経組織及び、ゼブラフィッシュ体側の血管の蛍光画像蛍光画像を取得し、中枢神経組織及び血管中の蛍光強度を評価した。表2に評価の結果(++:中枢神経系組織に強い蛍光が認められる、+:中枢神経系組織に弱い蛍光が認められる、−:蛍光がほとんど認められない)を示す。
【0096】
【表2】

【0097】
その結果、染色液3〜5を暴露した稚魚は60分の染色で何れも脳神経組織に蛍光が認められたが、染色液4及び染色液5の蛍光強度は染色液3の蛍光強度よりも高かった(表2)。次に、中枢神経組織からの物質輸送の影響をみるために、血管中の蛍光強度に対する脳神経組織の蛍光強度の比を求めた(図3)。その結果、トランスポーター阻害剤を含まない染色液3に暴露したゼブラフィッシュの相対蛍光強度は洗浄することによって経時的に低下しているのに対して、トランスポーター阻害剤を含む染色液4及び染色液5に暴露したゼブラフィッシュは相対蛍光強度の低下が著しく抑えられていることが分かった。
【0098】
本実施例により、本発明の中枢神経移行性評価用プローブを用いることで、有機アニオントランスポーター及び、BCRPに対する阻害効果を有する化合物の評価が可能であることが示された。
【0099】
(実施例3)
実施例1の染色液1で使用した化合物(8)を化合物(23)に変更して、化合物の濃度を2μMに調製した染色液6を得た。また染色液6に、トランスポーター阻害剤としてMK571とFTCをそれぞれ30μMとなるように併せて加えられた染色液7を得た。
6穴マルチプレートの任意のウェル中に、4mLの染色液1とゼブラフィッシュ7日胚の稚魚を20匹入れ、染色を開始した。染色中のゼブラフィッシュを、60分、180分、360分後にウェルから取り出し、実施例1と同様の操作で脳神経組織及び、ゼブラフィッシュ体側の血管の蛍光画像蛍光画像を取得し、中枢神経組織及び血管中の蛍光強度を評価した。
その結果、染色液6を暴露した稚魚は60分、180分、360分の染色で何れも脳神経組織に蛍光が認められなかったが、染色液7によって染色された稚魚の脳の蛍光強度は経時的に増加した(図4)。
なお、染色液6にトランスポーター阻害剤としてMK571又は、FTCをそれぞれ単独で30μMとなるように加えられた染色液では、稚魚の脳の蛍光強度の増加は見られなかった。この結果より、化合物(23)はMRPとBCRPの両方によって輸送されることが明らかとなった。また、このことは、化合物(23)がトランスポーターに強く輸送される特性を有しているため、MK571とFTCを併せて用いることによるトランスポーターに対する強力な阻害効果を評価する用途に化合物(23)が好適であることを示している。
【産業上の利用可能性】
【0100】
本発明により提供される、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価をできる技術は、トランスポーターの物質輸送の評価を簡便に行う上で、有用な材料となる。また、脳や網膜といった中枢神経系疾患に関連する創薬開発において、薬物が中枢神経系組織を送達される際の効率を上げることが重要な技術課題であるが、本発明を用いることで、中枢神経組織内外への物質移行の経時的な評価が可能になり、ハイスループットで高精度なスクリーニングを低コストで行うことができ、新しい疾患の診断法や治療法の開発、更には中枢神経研究を飛躍的に発展させ、産業上及び実用化の上でもきわめて有効な基盤技術となる。
【技術分野】
【0001】
本発明は、中枢神経組織内外への物質移行性を光学的に評価することが可能な評価用プローブ、中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性の評価方法、及び、中枢神経移行性評価用プローブを用いたスクリーニング方法に関する。
【背景技術】
【0002】
脊椎動物の脳や網膜などの中枢神経組織には関門機構(血液神経関門)が存在し、中枢神経組織への物質移行は制限されている。中枢神経組織における関門機構としては、血液脳関門(BBB)、血液脳脊髄液関門(BCSFB)、血液網膜関門(BRB)、などが知られている。これらの関門機構では、中枢神経組織の毛細血管内皮細胞が密着結合を形成することにより細胞間隙を介した物質の拡散が起こりにくくなっている。また、関門機構においてはトランスポーターが大きく関わっており、血液から脳への供給輸送に関わるトランスポーターの存在と、脳から血液への排出輸送に関わるトランスポーターの存在が明らかにされている。
【0003】
トランスポーターは全身の臓器・組織に分布しており、ATPの加水分解エネルギーを利用して輸送を行うABC (ATP binding cassette) ファミリーと、ATPのエネルギーを用いないで輸送を行うSLC (Solute carrier) ファミリーの二つに分けられ、ヒトにおいては現在までに48種類のABCトランスポーター遺伝子と319種類のSLCトランスポーター遺伝子が同定されている。トランスポーターには、薬剤を細胞内へ流入させる機能を担うものと、細胞内から細胞外へ排出する機能を担うものがある。
【0004】
トランスポーターによる物質輸送機能の評価や、トランスポーターの働きに影響を及ぼす阻害剤などの物質の作用を調べる、又は、スクリーニングをすることは、様々な病態の解明や創薬において重要である。
【0005】
例えば、トランスポーターの異常によって生ずる疾患は加齢とともに増加し、50歳以降の高齢化疾患関連遺伝子の約10%にトランスポーターが関連するとされる。トランスポーターが関連する病態は、トランスポーターの異常に起因する膜輸送障害によって惹起された病態と言えるため、トランスポーターはいわゆる生活習慣病の治療薬開発の標的分子となりうると考えられる。
【0006】
一方で、薬物送達においては、流入トランスポーターに認識される、あるいは、排出トランスポーターに認識されにくい薬物を開発することが戦略として考えられる。様々な組織で、特に細胞内から薬剤を排出するトランスポーターのうち、多くの抗がん剤などを輸送する多剤排出トランスポーターの存在が知られており、これががん細胞などに対して多くの薬剤が効かないこと(多剤耐性)の原因となっている。そこで、薬剤排出トランスポーターの機能を阻害することができれば、標的組織への薬物送達を可能にしたり、抗がん剤などの細胞内濃度を高めたりすることで、がん細胞の生育を阻害することができる。
【0007】
特許文献1では、標識された被験物質を細胞に接触させ、細胞内の標識物質を経時的に測定するスクリーニング方法が開示されている。本方法によれば、標識物質を検出することにより、被検物質のトランスポーターなどを介した輸送速度などを定量することができる。
【0008】
特許文献2では、多剤排出トランスポーターであるヒトmrp1遺伝子を導入した線虫に被検体を投与し、その耐性幼虫形成を検出することで、多剤耐性タンパク質MRP1阻害剤のスクリーニングを行う方法が開示されている。本方法を用いれば、多剤耐性タンパク質MRP1の阻害効果を持つ物質をスクリーニングすることができる。
【0009】
特許文献3には、ゼブラフィッシュを血液脳関門のスクリーニングに用いる技術が開示されている。近年小型硬骨魚類のゼブラフィッシュにも中枢神経組織における関門機構が存在することが明らかにされている。本文献では、P−糖タンパク(Pgp:P-glycoprotein)の阻害剤であるベラパミルに暴露したゼブラフィッシュ幼生の心膜内に蛍光色素であるローダミン123を注入し、脳における蛍光を定量することによってローダミン123の分布に対するPgpの阻害効果を評価する方法が開示されている。本方法は、ヒトとの相同性の高いゼブラフィッシュを用いているため、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した実験が可能である。
【0010】
ところで、特許文献4では、ゼブラフィッシュなどの生きた生物個体に暴露するだけで、中枢神経組織である網膜組織を染色可能な眼内組織用染色組成物が開示されている。この文献にはさらに、化学物質の眼内組織における効果、副作用、又は安全性をスクリーニングする方法が開示されている。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】特開2009−250652号公報
【特許文献2】特開2006−121981号公報
【特許文献3】特表2007−525665号公報
【特許文献4】特開2010−168369号公報
【発明の概要】
【発明が解決しようとする課題】
【0012】
しかし、特許文献1の方法では、細胞に接触させる被験物質を標識する必要があるため、多数の標的物質についてのスクリーニングを同時に行うことは難しかった。
【0013】
また、特許文献2の方法では、ターゲットとなるトランスポーターを予め遺伝子導入した線虫を用いるため、高等動物の血液神経関門や、生体内での代謝機構などの高度な生物学的メカニズムの影響が排除された実験系であり、得られる情報が限定的であった。特許文献3も同様に、排出トランスポーター機能の阻害により高度な生物学的メカニズムの影響が排除されることにより、得られる情報がある程度限定的となるおそれがある。
【0014】
さらに、特許文献3の方法では、トランスポーターの機能評価を行うためのプローブ(ローダミン123)を心膜内に注入する必要があり、このような侵襲性の高さがアーチファクトとなり、結果の再現性に影響を及ぼす可能性があった。
【0015】
これらの問題に鑑み、本発明の目的は、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価をできる技術を提供することにある。
【課題を解決するための手段】
【0016】
発明者らは、前記した課題を解決すべく鋭意検討の結果、下記一般式(1)で表される色素化合物は、生物試料に暴露するだけで生体内に移行し、中枢神経組織(脳神経組織、脊髄、及び、網膜)への物質移行/排出に関連するトランスポーターの基質となることを見出し、トランスポーターの機能評価、並びにトランスポーターの作用に影響を及ぼす化合物の評価及びスクリーニングを可能にする当該化合物を含む新規な中枢神経移行性評価用プローブを見出して、本発明に至った。
【0017】
また、本発明者らは、中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性評価方法、及び中枢神経移行性評価用プローブを用いたスクリーニング方法を開発し、本発明を完成するにいたった。
【0018】
すなわち、本発明の中枢神経移行性評価用プローブは、一般式(1)で表される化合物のうち少なくとも1種を有効成分として含むことを特徴とする。
【化1】

ここで、一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4が互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。
【化2】

一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。「*」は結合部位を示す。
【発明の効果】
【0019】
本発明の新規な中枢神経移行性評価用プローブの提供により、これまで困難であった生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した実験系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価が可能となり、簡便、且つ、再現性よく中枢神経組織(脳神経組織、脊髄、及び、網膜)への移行/排出に関連するトランスポーターの機能評価や、トランスポーターの作用に影響を及ぼす化合物の評価やスクリーニングが可能となる。更に、本発明の中枢神経移行性評価用プローブを用いた評価方法、及び、スクリーニング方法は、中枢神経系の関門機構の研究や中枢神経組織移行性薬剤の創薬のみならず、トランスポーターに影響を与える阻害剤などの化合物の評価やスクリーニングにも有効な新規なツールとなり得る。
【図面の簡単な説明】
【0020】
【図1】実施例1で観察された染色液1及び染色液2の経時的な中枢神経系組織の観察像を示す。
【図2】実施例1で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【図3】実施例2で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【図4】実施例3で観察された中枢神経系組織の蛍光強度を定量したグラフを示す。
【発明を実施するための形態】
【0021】
以下、本発明の実施形態について説明する。なお、個々に開示する実施形態は、本発明の中枢神経移行性評価用プローブ、中枢神経移行性評価方法、及び中枢神経移行性評価用プローブを用いたスクリーニング方法を例示するものであり、本発明はこれらに限定されるものではない。
【0022】
(第一実施形態)
本発明の第一実施形態である中枢神経移行性評価用プローブは、一般式(1)で表される化合物のうち少なくとも1種を有効成分として含むことを特徴とする。
【化3】

ここで、一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4が互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。
【化4】

一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。「*」は結合部位を示す。
【0023】
前記一般式(1)中のR1におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、又は3−ヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0024】
前記一般式(1)中のR1におけるシクロアルキル基としては、特に限定されるものではないが、例えば、シクロヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0025】
前記一般式(1)中のR1におけるアラルキル基としては、特に限定されるものではないが、例えば、ベンジル基、フェネチル基等が挙げられる。
【0026】
前記一般式(1)中のR1におけるアルケニル基、置換アルケニル基若しくはシクロアルケニル基としては、特に限定されるものではないが、例えば、ビニル基、2,2−ジフェニルビニル基、3−ブテニル基、又はシクロヘキセニル基等が挙げられる。
【0027】
前記一般式(1)中のR1におけるアリール基若しくは置換アリール基としては、特に限定されるものではないが、例えば、フェニル基、4−ブロモフェニル基、4−メトキシフェニル基、4−チオメチルフェニル基、又は6−メトキシ−2−ナフチル基、又はナフチル基などが挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0028】
前記一般式(1)中のR1におけるヘテロ環基としては、特に限定されるものではないが、ピリジル基、ピラジル基、又はモルホリニル基等が挙げられる。
前記一般式(1)中のR1におけるアルカノイル基としては、特に限定されるものではないが、例えば、アセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ベンゾイル基、1−ナフトイル基、又は2−ナフトイル基等が挙げられる。
【0029】
前記一般式(1)中のR1としては、アルキル基、アラルキル基、又はアリール基が好ましく、特に、メチル基、エチル基、プロピル基、ベンジル基、フェニル基、4−ブロモフェニル基、4−メトキシフェニル基、4−チオメチルフェニル基、又は6−メトキシ−2−ナフチル基が中枢神経移行性評価をする点で好ましい。
【0030】
前記一般式(1)中のR2〜R5におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、シクロヘキシル基、又は3−ヘキサニル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。これらのうち、R2〜R5としては、水素原子又はメチル基が中枢神経移行性評価をする点で好ましい。
【0031】
前記一般式(1)中のR2〜R5におけるアリール基としては、特に限定されるものではないが、例えば、フェニル基又はナフチル基などが挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0032】
前記一般式(1)中のR2〜R5におけるアルコキシカルボニル基としては、特に限定されるものではないが、例えば、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、又はブトキシカルボニル基等が挙げられる。
【0033】
前記一般式(1)中のR2〜R5におけるアルカノイル基としては、特に限定されるものではないが、例えば、アセチル基、プロピオニル基、ブチリル基、ペンタノイル基、ベンゾイル基、1−ナフトイル基、又は2−ナフトイル基等が挙げられる。
【0034】
R2とR4が互いに結合して形成する環としては、特に限定されるものではないが、例えば、シクロオクタン環、シクロヘプタン環、シクロヘキサン環、シクロペンタン環、若しくはシクロブタン環等の飽和脂肪族環、シクロペンテン環若しくはシクロヘキセン環等の部分飽和脂肪族環、又はベンゼン環等の芳香族環が挙げられる。これらの環は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。これらのうち、R2とR4が互いに結合して形成する環としては、シクロペンタン環又はベンゼン環が中枢神経移行性評価をする点で好ましい。
【0035】
前記一般式(1)中のR6におけるハロゲン原子としては、例えば、フッ素原子、塩素原子、臭素原子、又はヨウ素原子等が挙げられる。
【0036】
R6としては、水素原子又は臭素原子が好ましい。
【0037】
前記一般式(1)中のR7におけるアルコキシカルボニル基としては、特に限定されるものではないが、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基等が挙げられる。
【0038】
前記一般式(1)中のR7におけるカルボン酸の塩としては、特に限定されるものではないが、例えば、ナトリウム塩若しくはカリウム塩等のアルカリ金属塩;マグネシウム塩若しくはカルシウム塩等のようなアルカリ土類塩;アンモニウム塩、ピリジニウム塩、ピペリジニウム塩、若しくはトリエチルアンモニウム塩等のアミン塩;又はトリプトファン塩、リジン塩、ロイシン塩、フェニルアラニン塩、バリン塩、若しくはアルギニン塩等のアミノ酸塩が挙げられる。これらのうち、ナトリウム塩、カリウム塩、アンモニウム塩、ピリジニウム塩、又はピペリジニウム塩等が好ましい。
【0039】
前記一般式(1)中のR7としては、カルボン酸、カルボン酸エチル、カルボン酸ナトリウム、又はカルボン酸カリウムが中枢神経移行性評価をする点で好ましい。
【0040】
前記一般式(2)中のR9におけるアルキル基としては、特に限定されるものではないが、例えば、メチル基、エチル基、プロピル基、ブチル基、又は3−ヘキシル基等が挙げられる。これらの基は、色素化合物の保存安定性を著しく阻害するものでなければ、さらに置換基を有していてもよい。
【0041】
前記一般式(2)中のR9におけるアラルキル基としては、特に限定されるものではないが、例えば、ベンジル基、フェネチル基等が挙げられる。
【0042】
前記一般式(2)中のR9におけるアルケニル基、置換アルケニル基若しくはシクロアルケニル基としては、特に限定されるものではないが、例えば、ビニル基、2,2−ジフェニルビニル基、3−ブテニル基、又はシクロヘキセニル基等が挙げられる。
【0043】
前記一般式(2)中のR9におけるアリール基としては、特に限定されるものではないが、例えば、フェニル基又はナフチル基などが挙げられる。これらの基は、中枢神経移行性評価をする際に著しく阻害するものでなければ、さらに置換基を有していてもよい。
前記一般式(1)中のR8としては、硫黄原子が中枢神経移行性評価をする点で特に好ましい。
【0044】
前記一般式(1)中のnは0〜3の整数を表す。特に0又は1であることが、中枢神経移行性評価をする点で特に好ましい。
【0045】
前記一般式(1)中のmは1以上の整数を表す。mが1〜5の整数の時が好ましく、mが1又は2である時、中枢神経移行性評価をする点で特に好ましい。
【0046】
本発明者らの検討より、前記一般式(1)中のmの数がトランスポーターによる流入/排出の速度に影響することが確かめられており、トランスポーターに影響を及ぼす物質の評価を行う際には、トランスポーターに対する影響の強さによって、適宜選択することが好ましい。特に好ましい具体例として、例えば、mが1の化合物を含む中枢神経移行性評価用プローブは、トランスポーターに特に強く輸送されるため、トランスポーターに対する影響が強い物質の評価の際に用いる事が出来る。また、mが2の化合物を含む中枢神経移行性評価用プローブは、トランスポーターに比較的緩やかに輸送されるため、トランスポーターに対する影響が弱い物質の評価の際に用いる事が出来る。
【0047】
本発明にかかる一般式(1)で表される色素化合物は、市販されており入手可能であるが、公知の方法によって合成することも可能である。
【0048】
一般式(1)で表わされる色素化合物の好ましい具体例(化合物(1)から化合物(46))を次に示すが、本発明は以下のものに限定されるわけではない。
【化5】

【化6】

【0049】
(化合物について)
本発明の中枢神経移行性評価用プローブに含まれる一般式(1)で表される化合物としては、分子量が300以上1,000以下であるものが好ましく選択される。より好ましくは分子量が300以上650以下の化合物が選択される。また、本発明者らの検討より、前記一般式(1)中のR1の分子量が流入/排出の速度に影響することが確かめられており、一般的な評価においては、前記一般式(1)中のR1の分子量が1以上250以下であるものが好ましい。
【0050】
また、本発明の化合物は蛍光性を有する蛍光性化合物であることが好ましい。蛍光性の化合物であれば感度が高いため、低濃度でトランスポーターを標識して可視化することができ、必要とする化合物の量を相対的に減らすことができる。また、基質となるトランスポーターの種類や基質特異性ごとに蛍光スペクトルの異なる化合物等の組み合わせを選択すれば、複数のトランスポーターの機能を多重標識によって評価することが可能になり、一度の観察から得られる情報が増えるため、有用性が高い。このような、蛍光性化合物である本発明の化合物を用いれば、被験物質を標識する手間が省けるため、多数の標的物質についてのスクリーニングでも簡便に行うことができる。
【0051】
本発明の中枢神経移行性評価用プローブに含まれる化合物の濃度は特に限定されるものではないが、標的とする部位や使用される化合物によって適宜調節される。通常は0.001ng/mL以上100μg/mL以下の濃度で用いられ、より好ましくは0.001ng/mL以上10μg/mL以下、より好ましくは0.001ng/mL以上5μg/mL以下の濃度で用いられる。
【0052】
本発明の中枢神経移行性評価用プローブは、前記一般式(1)で表される化合物の少なくとも1種を適当な溶媒に溶解させて用いる。溶媒としては、生体に影響がなければ、特に限定されるものではないが、例えば、生体との親和性が高い水性の液体が好ましい。具体的には、水;生理食塩水;リン酸緩衝液(PBS)若しくはTris等の緩衝液;メタノール、エタノール、イソプロパノール、ブタノール、エチレングリコール、若しくはグリセリン等のアルコール系溶媒;N,N−ジメチルスルホキシド(以下、「DMSO」と略する)若しくはN,N−ジメチルホルムアミド(以下、「DMF」と略する)等の有機溶媒;D−MEM(Dulbecco's Modified Eagle Medium)若しくはHBSS(Hanks' Balanced Salt Solutions、ハンクス平衡塩)等の細胞培養用培地、又は乳酸リンゲル液等の輸液が挙げられる。これらの溶媒には、特に水が50%以上含まれていることが好ましい。また、これらの溶媒を2種以上混合して用いることもできる。これらの溶媒のうち、メタノール、エタノール、又はDMSOが特に好ましい。
【0053】
本発明の中枢神経移行性評価用プローブの作製方法は、特に限定されるものではないが、例えば、上記のような溶媒に溶解させた化合物の濃厚溶液を希釈して作成しても良い。化合物の水溶性が低い場合には、適当な溶媒に溶解させてから精製水に希釈させて用いることができる。
【0054】
本発明の中枢神経移行性評価用プローブには、生体に適した塩濃度やpH等を制御することが必要であれば添加剤を1種類又はそれ以上組み合わせて添加することができる。
本発明に用いられる添加剤としては、中枢神経系組織標識用組成物に影響がなければ特に限定されるものではないが、例えば、保湿剤、表面張力調整剤、増粘剤、塩化ナトリウムのような塩類、各種pH調整剤、pH緩衝剤、防腐剤、抗菌剤、甘味剤、又は香料等が挙げられる。
【0055】
pH調整剤としては、pHを5〜9に調整することが好ましく、特に限定されるものではないが、例えば、塩酸、酢酸、リン酸、クエン酸、リンゴ酸、水酸化ナトリウム、又は炭酸水素ナトリウム等が挙げられる。
【0056】
本発明の中枢神経移行性評価用プローブは放射性核種で標識されたプローブとして用いることも可能である。標識に用いる放射性核種の種類は、特に制限されるものではないが、使用の態様によって適宜選択することができる。具体的に、PETによる測定の場合は、例えば、11C、14C、13N、15O、18F、19F、62Cu、68Ga、又は78Br等の陽電子放出核種を用いることができる。好ましくは、11C、13N、15O、又は18F等であり、特に好ましくは、11C又は18F等である。また、SPECTによる測定の場合は、例えば、99mTc、111In、67Ga、201Tl、123I、又は133Xe等のγ線放射核種を用いることができる。好ましくは、99mTc又は123I等である。更に、ヒト以外の動物を測定する場合には、例えば、125Iのようなより半減期の長い放射線核種を用いることができる。GREIによる測定の場合は、例えば、131I、85Sr、又は65Zn等を用いることができる。
【0057】
放射性核種で標識した中枢神経系組織標識用組成物は、例えば、オートラジオグラフィー、陽電子(ポジトロン)放出核種を用いる放射断層撮影法(PET)、又は様々なガンマ線放出核種を用いる単一光子放射断層撮影法(SPECT)等によって画像化を行うことができる。また、フッ素原子核に由来するMR信号や13Cを利用した核磁気共鳴法(MRI)で検出してもよい。更に、次世代分子イメージング装置として複数分子同時イメージングが可能なコンプトンカメラ(GREI)等によって画像化することも可能である。また、例えば、液体シンチレーションカウンター、X線フィルム、又はイメージングプレート等を用いて中枢神経移行性評価用プローブの定量を行うことも可能である。
また、14C等の放射性同位元素で標識した中枢神経移行性評価用プローブは、加速器質量分析法(AMS)等によって、血液中(又は、尿中若しくは糞中)の濃度を測定して、標識化した物質の未変化体や代謝物の薬物動態学的情報(薬物血中濃度−時間曲線下面積(AUC)、血中濃度半減期(T1/2)、最高血中濃度(Cmax)、最高血中濃度到達時間(Tmax)、分布容積、初回通過効果、生物学的利用率、糞尿中排泄率等)を得ることが可能である。
【0058】
放射線核種は一般式(1)で表される化合物に含まれる形でも、結合する形でもよい。
【0059】
放射線核種の標識の方法は、特に限定されるものではなく、一般的に用いられている方法で良い。また、一般式(1)で表される化合物を構成する元素の少なくとも一部を放射性核種で置換する形でも良い。
【0060】
一般式(1)で表される化合物を放射性核種で標識した場合、1mMあたり、1〜100μCi程度の放射性を有することが好ましい。この時、用いる中枢神経移行性評価用プローブの投与量は、影響がなければ特に制限はされず、化合物の種類及び標識に用いた放射性核種の種類により適宜選択される。
【0061】
(対象)
本発明の中枢神経移行性評価用プローブを用い中枢神経組織内外への物質の流入・排出を評価することが可能な生物種としては、特に限定されるものではないが、例えば、脊椎動物としては、トラフグ、クサフグ、ミドリフグ、メダカ、若しくはゼブラフィッシュ等の硬骨魚類、アフリカツメガエル等の両生類、ニワトリ若しくはウズラ等の鳥類、ラット、マウス、若しくはハムスター等の小動物、ヤギ、ブタ、イヌ、ネコ、ウシ、若しくはウマ等の大動物、又は、サル、チンパンジー、若しくはヒト等の霊長類が挙げられる。特に、本発明によれば、これらの生物個体を用いて生きたままの状態で評価することができる。また、生物種としては、ヒトを除外してもよい。
【0062】
これらの生物試料の中でも、ゼブラフィッシュを用いることが好ましい。ゼブラフィッシュは、米国及び英国では、近年、既にマウス及びラットに続く第3のモデル動物として認知されており、人と比較して全ゲノム配列が80%の相同性を持ち、遺伝子数もほぼ同じであり、さらに主要臓器・組織の発生・構造も良く似ていることが解明されてきている。各パーツ(心臓、肝臓、腎臓、消化管等の臓器・器官)が受精卵から分化して形成されていく過程が透明な体を通して観察できるため、非侵襲的に生体内部の観察が可能なゼブラフィッシュをモデル動物としてスクリーニングに用いることは特に好ましい。ゼブラフィッシュは3dpf(days post fertilization、3日胚)でBBBの密着結合の主要な構成タンパク質であるClaudin−5及びZonula Occludens−1が発現する(Brain Research Bulltein 75 (2008) 619−628)。6−7dpfで主要な臓器が形成され、8dpfにはBBBの物質排出を担うP−糖タンパクも発現する。そのため、中枢神経組織の評価に好適に用いることができる。また、ゼブラフィッシュは1回の産卵で約200個以上の受精卵が得られるため同じ遺伝的背景持ったゼブラフィッシュが得られ、スクリーニングには好都合であるという利点がある。
【0063】
本発明の中枢神経移行性評価用プローブを用いて評価できる血液神経関門は、例えば、血液脳関門(BBB)、血液脳脊髄液関門(BCSFB)、血液網膜関門(BRB)等が挙げられる。これらのうち、血液脳関門及び血液脳脊髄液関門が好ましくは評価され、さらには血液脳関門が好ましくは評価される。これらの血液神経関門において、化合物の流入及び排出トランスポーターの働きを評価することができるが、特に排出トランスポーターの働きを好適に評価することができる。より好ましくは、ABCトランスポーターを評価することができる。
【0064】
本発明の中枢神経移行性評価用プローブは、プローブのみを投与した場合は、中枢神経組織への物質の移行性が見られても見られなくてもよい。プローブのみを投与することにより、中枢神経組織内外の物質の移行性を評価することができる。
【0065】
また、プローブのみを投与した場合に中枢神経組織への物質の移行性が見られない場合でも、トランスポーターの機能に影響を及ぼす化合物と同時に作用させることで、中枢神経組織への移行性が見られるようになることにより、中枢神経組織のトランスポーターに影響を及ぼす物質の評価を行うことができる。同様に、プローブのみを投与した場合でも中枢神経組織への移行性が見られる場合は、トランスポーターの機能に影響を及ぼす化合物と同時に作用させることで、中枢神経組織への移行性が見られなくなることや、中枢神経組織への移行速度が変化(上昇又は低下)することにより、トランスポーターに影響を及ぼす物質の評価を行うことができる。本発明においては、中枢神経組織への移行性が見られるようになること、逆に見られなくなること、及び中枢神経組織への移行速度が変化することをあわせて、中枢神経組織への移行性が変化すると表現する。本発明の化合物としては、中枢神経移行性評価用プローブのみを暴露した場合には中枢神経組織への移行性がない、あるいは非常に低いが、トランスポーターに影響を及ぼす物質と同時に暴露した場合に、中枢神経組織への移行性が変化するものが特に好ましく用いられる。
【0066】
本発明の中枢神経移行性評価用プローブは、生体内に侵襲的な手段で投与する必要がなく、生体への暴露、又は経口投与若しくは経粘膜投与などによって生体内に移行するため、生物試料を傷つけることなくトランスポーターの評価を行うことができる。すなわち、生きた生物個体に対して、中枢神経の近傍組織の切開や、中枢神経系組織又は中枢神経系組織に連絡する神経組織への針刺し等の外科的損傷、を与えることなく投与することができる。なお、本発明は、前記外科的損傷を伴う投与方法を排除していない。
【0067】
外科的損傷なく投与する方法としては特に限定されるものではないが、例えば、中枢神経移行性評価用プローブを生物個体の一部又は全体に暴露する方法、経口接触による方法、経肺(若しくは経鰓)接触による方法、経鼻接触による方法、経消化管接触による方法、経粘膜接触による方法、経体液接触による方法、舌下接触による方法、静脈又は動脈等の血管内接触による方法、腹腔内接触による方法、腹膣内、皮下、皮内、膀胱内、若しくは気管(気管支)内等への注入方法、又は噴霧若しくは塗布等の手段による生体内への接触による方法等が挙げられる。動物への投与の場合には、その投与形態、投与経路、投与量は対象となる動物の体重や状態によって適宜選択する。
【0068】
本発明の中枢神経移行性評価用プローブに含まれる化合物は、少なくとも一種類以上の中枢神経系組織に存在する関門機構を構成するトランスポーターの基質となることをその特徴とする。トランスポーターとしては、特に限定されるものではないが、ABCトランスポーター、SLCトランスポーター、グルコーストランスポーター、又はドーパミントランスポーターなどがあげられる。好ましくは、排出トランスポーターであり、より好ましくは、ABCトランスポーターであり、さらに好ましくは、Pgp、BCRP(BreastCancer Resistance Protein)、又はMRP(Multidrug resistance-associated Protein)1〜8の基質となるものである。
【0069】
本発明において、トランスポーターの基質となるとは、流入トランスポーターによって選択的に輸送されることができるか、又は流入トランスポーター阻害剤の存在下では輸送されることができないか、若しくはそのトランスポーターを介しての移行性が変化することを意味する。あるいは、本発明において、トランスポーターの基質となるとは、排出トランスポーターにより選択的に輸送されるか、排出トランスポーター阻害剤の非存在下ではそのトランスポーターにより輸送されるが阻害剤の存在下では輸送されないか、又は排出トランスポーター阻害剤の存在下でそのトランスポーターを介しての移行性が変化することを意味する。
【0070】
本発明の中枢神経移行性評価用プローブを用いれば、例えば、大脳(終脳)、大脳皮質、大脳基底核、中脳、小脳、間脳、後脳(外套)、橋、延髄、脊髄、視索、上丘(視蓋)、脳下垂体、視蓋脊髄(延髄)路、網様体、中隔核、扁桃体、内包、若しくは視神経などから構成される中枢神経系組織、視神経をはじめとする脳神経、これら組織の疾患状態組織、又は疾患による新生組織若しくは癌組織等について、トランスポーターの機能の評価を染色状態で行うことができる。また、生物種類、発生段階、又は発生異常若しくは疾病等によって前記と異なる中枢神経系組織が存在する場合は、それらの組織も含むことができる。本発明の中枢神経移行性評価用プローブは、視神経、視索、上丘(視蓋)、脳下垂体、視蓋脊髄(延髄)路、又は網様体の染色性によって特に好ましくトランスポーターの機能を評価することができる。
【0071】
前記の中枢神経系組織に含まれる細胞としては特に限定されるものではないが、神経細胞、オリゴデンドロサイト、シュワン細胞、プルキンエ細胞、アマクリン細胞、網膜神経節細胞、錐体細胞、星状細胞、顆粒細胞、若しくはグリア細胞、又はこれらの腫瘍細胞若しくはこれらの未分化状態の細胞(幹細胞)等が挙げられる。
【0072】
(評価方法)
本発明の第二の実施形態である中枢神経移行性評価用プローブを用いた中枢神経組織内外への物質移行性の評価方法は、蛍光化合物としての本発明の中枢神経移行性評価用プローブを生物試料に何れかの方法で投与した後、一定時間後に、励起波長の光を観察部位に照射し、発生するより長波長の蛍光を観測し画像を形成することを特徴とする。さらに、必要に応じて経時的に複数回の蛍光を観測してその変化を追跡することを特徴とする。このとき、第一の実施形態と同様に、プローブのみを投与してもよいし、プローブとトランスポーターの機能に影響を及ぼす化合物とを同時に投与した場合とプローブのみを投与した場合とを比較してもよい。
【0073】
本発明の評価方法は、in vivo、in vitro、又はex vivoのいずれで用いてもよい。
【0074】
本発明の評価方法は、中枢神経系組織に影響を与えなければ特に限定されるものではないが、生物試料の状態及び変化を画像として捉える方法である。例えば、中枢神経組織に可視光、近赤外光や赤外光を照射してカメラやCCD等で観察する可視光観察、近赤外光観察、赤外光観察、若しくはレーザー顕微鏡観察、蛍光内視鏡等のように生物試料に対して励起光光源から励起光を照射して発光している生物試料の蛍光を観察する蛍光観察、蛍光顕微鏡観察、蛍光内視鏡観察、共焦点蛍光顕微鏡観察、多光子励起蛍光顕微鏡観察、若しくは狭帯域光観察、共光干渉断層画像観察(OCT)、又は軟エックス線顕微鏡による観察等が挙げられる。
【0075】
本発明で用いられる励起するための波長は、特に限定されるものではないが、使用する前記一般式(1)で表される色素化合物によって異なり、本発明の前記一般式(1)で表される色素化合物が効率よく蛍光を発すれば特に限定されるものではない。通常、200〜1010nm、好ましくは400〜900nm、より好ましくは、480〜800nmである。近赤外領域の光を用いる場合は、通常600〜1000nmで、好ましくは、生体透過性に優れている680〜900nmの波長が用いられる。
【0076】
本発明で用いられる蛍光励起光源としては特に限定されるものではないが、各種レーザー光源を用いることができる。これらのレーザー光源としては、例えば、色素レーザー光源、半導体レーザー光源、イオンレーザー光源、ファイバーレーザー光源、ハロゲンランプ、キセノンランプ、又はタングステンランプ等が挙げられる。また、各種光学フィルターを用いて、好ましい励起波長を得たり、蛍光のみを検出したりすることができる。
【0077】
このように生物個体に励起光を照射することにより、中枢神経系組織の内部において発光させた状態で中枢神経系組織を撮像すれば発光部位を容易に検出することができる。また、可視光を照射して得られた明視野画像と励起光を照射して得られた蛍光画像を画像処理手段で組み合わせることで、より詳細に中枢神経系組織を観察することもできる。また、共焦点顕微鏡を用いれば、光学的な切片画像を取得することができるため、好ましい。さらに、多光子励起蛍光顕微鏡は、高い深部到達性と空間解像力を持つため、組織内部の観察に好ましく用いられる。
【0078】
(スクリーニング方法)
本発明の第三の実施形態であるスクリーニング方法は、中枢神経移行性評価用プローブを用いて、in vivoで中枢神経系組織に作用する化合物を検出することを特徴とする。本発明の中枢神経移行性評価用プローブは、生物個体、例えば、小型硬骨魚類であるゼブラフィッシュを用いて、生きたままの状態、いわゆるin vivoで中枢神経系組織への移行性を指標として用いることにより、スクリーニング対象化合物の中枢神経系組織移行性や薬理作用をスクリーニングすることが可能である。更に、生きた生物個体であるゼブラフィッシュ等を用いているため、スクリーニング対象化合物の安全性についても同時にスクリーニングすることが可能である。ただし、本発明はこれらに限定はされず、例えばin vitroやex vivoでスクリーニングを行ってもよい。
【0079】
「中枢神経系組織に作用する化合物を検出すること」とは、中枢神経組織内外の物質移行に影響する物質の候補となる被験物質(スクリーニング対象化合物)を当該中枢神経系組織へ作用させた際の、本発明の中枢神経移行性評価用プローブの標識性の変化を測ることによって、中枢神経系組織に作用する化合物の有無や特性を検出することをいう。具体的に、一例としては、スクリーニング対象化合物と本発明の中枢神経移行性評価用プローブとをゼブラフィッシュに接触させた場合と、本発明の中枢神経移行性評価用プローブのみをゼブラフィッシュに接触させた場合とを比較する。このようにして、スクリーニング対象化合物の存在が、中枢神経移行性評価用プローブによる中枢神経系組織の染色状態に及ぼす影響を観察することによってスクリーニングを行うことができる。
【0080】
スクリーニング対象化合物を接触させる方法としては、特に限定されるものではないが、スクリーニング対象化合物が水溶性の場合は、飼育水中にスクリーニング対象化合物を投与する方法、非水溶性の場合は、飼育水中にスクリーニング対象化合物を単独で分散させて投与する方法、若しくは微量の界面活性剤やDMSOと共に投与する方法、生物個体の餌に混ぜて経口投与する方法、又は注射等による非経口投与する方法が挙げられる。これらのうち、飼育水中にスクリーニング対象化合物を投与する方法が容易にできるため好ましい。
【0081】
1種類以上の本発明の中枢神経移行性評価用プローブを有効成分として利用し、スクリーニング対象化合物の中枢神経系組織における効果、副作用、又は安全性を生物個体を用いて生物に及ぼす影響のスクリーニングが可能である。標的部位、目的、検査手段等に応じて、使用する中枢神経移行性評価用プローブは随意に選択することができる。更に、中枢神経移行性評価用プローブの移行性に対する影響から、疾病の高精度な診断や治療法の開発等の応用展開が期待される。
【0082】
前記スクリーニング対象化合物とは、化学的に作用のある化合物の総称を意味し、特に限定されるものではないが、例えば、医薬品、有機化合物、治療剤、治験薬、農薬、化粧品、環境汚染物質、又は内分泌攪乱物質等が挙げられる。
【0083】
本発明のスクリーニング方法には、小型硬骨魚類を好ましく用いることができる。本発明のスクリーニング方法で用いられる小型硬骨魚類としては、特に限定されるものではないが、例えば、ゼブラフィッシュ、フグ、金魚、メダカ、又はジャイアント・レリオ等が挙げられる。小型硬骨魚類は、マウス及びラット等と比較して、生育のスピード面・コスト面で非常に優れているため好ましい。特に、ゼブラフィッシュはゲノムの解読がほぼ完了しており、また飼育及び繁殖が容易で流通価格も安く、受精後48〜72時間で主要臓器・組織の基本構造ができ上がるため、好ましい。
【0084】
ゼブラフィッシュとしては、スクリーニングの目的に応じ、野生型ゼブラフィッシュに限定されず、各種疾患系モデルのゼブラフィッシュを用いることができる。疾患系のモデルを用いた場合には、観察により新薬候補化合物の効果を見出し、疾患治療薬又は疾患予防薬のスクリーニングに応用することができる。
【実施例】
【0085】
以下に実施例を挙げて、本発明をより詳細に説明するが、これらの実施例は、本発明のより一層の深い理解のために示される具体例であって、本発明は、これらの具体例に何ら限定されるものではない。なお、特に表示していない限りは「%」は質量基準である。なお、使用した分析装置は、1H核磁気共鳴分光分析(ECA−400、日本電子(株)製)、LC/TOF MS(LC/MSD TOF、Agilent Technologies社製)、及びマルチスペクトロマイクロプレートリーダ(Varioskan Flash、サーモフィッシャーサイエンティフィック(株)製)である。
【0086】
本発明にかかる一般式(1)〜(46)で表される色素化合物は、市販されており入手可能であるが、公知の方法によって合成することも可能である。
【0087】
[化合物の合成例]
次に化合物の典型的な合成例1〜2を示す。
【0088】
<合成例1>
色素化合物(4)の合成
アルデヒド誘導体(1)3.0g(11.4mmol)の酢酸20mL溶液にロダニン−3−プロピオン酸2.2g(11.5mmol)、酢酸アンモニウム0.9gを添加して、還流下2時間攪拌させた。反応終了後、冷却させながら、ゆっくり水50mLを滴下して室温まで冷却した。析出した個体をろ過して、水100mLで2回洗浄し、更に、2−プロパノール50mLで洗浄して、目的物(4)3.1g(収率60.1%)を得た。
【化7】

【0089】
<合成例2>
色素化合物(8)の合成
アルデヒド誘導体(2)1.75g(10.0mmol)のトルエン20mL溶液に、ロダニン−3−プロピオン酸1.13g(10.0mmol)とピペリジン2.5g(30.0mmol)を添加して、還流下2.5時間攪拌させた。反応終了後、室温まで冷却させ、トルエン100mLで希釈した後、水100mLを添加し攪拌した。静置後、有機層を分液して無水硫酸ナトリウムで乾燥させた。ろ過した後、減圧下、トルエンを留去して、エタノールから再結晶して、目的物(8)1.6g(収率43.2%)を得た。
【化8】

【0090】
<他の色素化合物の合成例>
上記合成例1又は2に準じた方法で、下記表1に示す他の化合物を合成した。これらの化合物の構造は、前記した分析装置で確認した。
【0091】
<色素化合物の蛍光特性の測定>
色素化合物1〜46について5μMのDMSO溶液を調製し、日立ハイテク社製FL4500蛍光分光測定機で励起波長及び蛍光波長を測定した。
【0092】
【表1】

【0093】
[中枢神経移行性評価用プローブによる中枢神経組織への物質移行に影響する物質の評価]
(実施例1)
1mMの前記化合物(8)のDMSO溶液に蒸留水を加えて、前記化合物(8)の濃度が1μMである染色液1を得た。さらに、化合物8に加えて、MRP1、MRP2、MRP4などに対する阻害効果が知られているABCトランスポーター阻害剤のMK571が30μMとなるよう加えられた染色液2を得た。6穴マルチプレートの任意のウェル中に、4mLの染色液1とゼブラフィッシュ7日胚の稚魚を20匹入れ、染色を開始した。染色中のゼブラフィッシュを、15分後、1時間後、2時間後、3時間後にウェルから取り出し、スライドガラス上で3%メチルセルロースに埋没させて動きを制限し、実体蛍光顕微鏡(Leica社製 MZ16FA)を用いてゼブラフィッシュの側面から中枢神経組織の蛍光画像を取得し、各サンプルの蛍光強度を画像解析ソフトImage J(NIH)を用いて定量した。このとき取得した蛍光画像を図1に、定量した蛍光強度を図2にそれぞれ示す。また、共焦点顕微鏡(Zeiss社製 Pascal Exciter)を用いて脳神経組織及び網膜神経組織の観察を行った。
その結果、染色液1を暴露した稚魚は、血管の染色性のみ観察されたが、染色液2が暴露された稚魚は、経時的に脳神経組織及び、網膜神経組織の蛍光強度が上昇した。本実施例により、本発明の中枢神経移行性評価用プローブを用いることで、ABCトランスポーターに対する阻害効果を有する化合物の評価が可能であることが示された。
【0094】
(実施例2)
実施例1の染色液1で使用した化合物(8)を化合物(13)に変更して、染色液3を得た。また、染色液2の化合物(8)を化合物(13)に変更して、さらに、トランスポーター阻害剤としてMK571に代えて、有機アニオントランスポーター阻害剤であるDigoxinが30μMとなるように加えられた染色液4、又は、Breast Cancer Resistance Protein(BCRP)の阻害剤であるFumitremorginC(FTC)が10μMとなるように加えられた染色液5を得た。また、染色したゼブラフィッシュの洗浄液として、洗浄液1(蒸留水)、洗浄液2(蒸留水にDigoxinを30μM含む溶液)、洗浄液3(蒸留水にFTCを10μM含む溶液)を用意した。
【0095】
染色液1を染色液3に、染色液2を染色液4又は染色液5に変更した以外は実施例1と同じ操作でゼブラフィッシュ7日胚の稚魚を1時間染色した後、ゼブラフィッシュを表1の通りの洗浄液に移動し、洗浄を行った。洗浄直後(染色から60分)、洗浄1時間後(同120分)、及び、洗浄2時間後(同180分)にゼブラフィッシュをウェルから取り出し、実施例1と同様の操作で脳神経組織及び、ゼブラフィッシュ体側の血管の蛍光画像蛍光画像を取得し、中枢神経組織及び血管中の蛍光強度を評価した。表2に評価の結果(++:中枢神経系組織に強い蛍光が認められる、+:中枢神経系組織に弱い蛍光が認められる、−:蛍光がほとんど認められない)を示す。
【0096】
【表2】

【0097】
その結果、染色液3〜5を暴露した稚魚は60分の染色で何れも脳神経組織に蛍光が認められたが、染色液4及び染色液5の蛍光強度は染色液3の蛍光強度よりも高かった(表2)。次に、中枢神経組織からの物質輸送の影響をみるために、血管中の蛍光強度に対する脳神経組織の蛍光強度の比を求めた(図3)。その結果、トランスポーター阻害剤を含まない染色液3に暴露したゼブラフィッシュの相対蛍光強度は洗浄することによって経時的に低下しているのに対して、トランスポーター阻害剤を含む染色液4及び染色液5に暴露したゼブラフィッシュは相対蛍光強度の低下が著しく抑えられていることが分かった。
【0098】
本実施例により、本発明の中枢神経移行性評価用プローブを用いることで、有機アニオントランスポーター及び、BCRPに対する阻害効果を有する化合物の評価が可能であることが示された。
【0099】
(実施例3)
実施例1の染色液1で使用した化合物(8)を化合物(23)に変更して、化合物の濃度を2μMに調製した染色液6を得た。また染色液6に、トランスポーター阻害剤としてMK571とFTCをそれぞれ30μMとなるように併せて加えられた染色液7を得た。
6穴マルチプレートの任意のウェル中に、4mLの染色液1とゼブラフィッシュ7日胚の稚魚を20匹入れ、染色を開始した。染色中のゼブラフィッシュを、60分、180分、360分後にウェルから取り出し、実施例1と同様の操作で脳神経組織及び、ゼブラフィッシュ体側の血管の蛍光画像蛍光画像を取得し、中枢神経組織及び血管中の蛍光強度を評価した。
その結果、染色液6を暴露した稚魚は60分、180分、360分の染色で何れも脳神経組織に蛍光が認められなかったが、染色液7によって染色された稚魚の脳の蛍光強度は経時的に増加した(図4)。
なお、染色液6にトランスポーター阻害剤としてMK571又は、FTCをそれぞれ単独で30μMとなるように加えられた染色液では、稚魚の脳の蛍光強度の増加は見られなかった。この結果より、化合物(23)はMRPとBCRPの両方によって輸送されることが明らかとなった。また、このことは、化合物(23)がトランスポーターに強く輸送される特性を有しているため、MK571とFTCを併せて用いることによるトランスポーターに対する強力な阻害効果を評価する用途に化合物(23)が好適であることを示している。
【産業上の利用可能性】
【0100】
本発明により提供される、生体内での代謝機構などの高度な生物学的メカニズムの影響も加味した系で、侵襲性の低い方法によって簡便にトランスポーターによる物質輸送の評価をできる技術は、トランスポーターの物質輸送の評価を簡便に行う上で、有用な材料となる。また、脳や網膜といった中枢神経系疾患に関連する創薬開発において、薬物が中枢神経系組織を送達される際の効率を上げることが重要な技術課題であるが、本発明を用いることで、中枢神経組織内外への物質移行の経時的な評価が可能になり、ハイスループットで高精度なスクリーニングを低コストで行うことができ、新しい疾患の診断法や治療法の開発、更には中枢神経研究を飛躍的に発展させ、産業上及び実用化の上でもきわめて有効な基盤技術となる。
【特許請求の範囲】
【請求項1】
中枢神経系への流入/排出に関連するトランスポーターの機能を可視化するためのプローブであって、一般式(1)で表される化合物のうち少なくとも1種を含むことを特徴とする中枢神経移行性評価用プローブ。
【化1】

[一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4は互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。]
【化2】

[一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。を表す。「*」は結合部位を示す。]
【請求項2】
一般式(1)中、R8は硫黄原子である事を特徴とする請求項1に記載の中枢神経移行性評価用プローブ。
【請求項3】
前記一般式(1)中、mは1又は2であることを特徴とする請求項1又は2に記載の中枢神経移行性評価用プローブ。
【請求項4】
前記一般式(1)中、R1はアルキル基、アラルキル基、アリール基であることを特徴とする請求項1〜3のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項5】
前記一般式(1)中、nは0又は1であることを特徴とする請求項1〜4のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項6】
前記一般式(1)中、R2〜R5のいずれか又は全ては水素原子であることを特徴とする請求項1〜5のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項7】
前記一般式(1)はトランスポーターの基質となることを特徴とする請求項1〜6のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項8】
前記一般式(1)の化合物の分子量は、300以上650以下であることを特徴とする請求項1〜7のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項9】
前記一般式(1)中、R1の分子量は、1以上250以下であることを特徴とする請求項1〜8のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項10】
前記トランスポーターは血液脳関門、又は血液脳脊髄液関門に存在するトランスポーターであることを特徴とする、請求項1〜9のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項11】
前記トランスポーターに対する阻害剤の存在下では中枢神経組織への移行性が変化することを特徴とする、請求項1〜10のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項12】
前記トランスポーターはABCトランスポーター、又は有機アニオントランスポーターであることを特徴とする、請求項11に記載の中枢神経移行性評価用プローブ。
【請求項13】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する工程、及び、該生物試料の中枢神経組織内外への該プローブの移行を検出する工程を含むことを特徴とする、中枢神経組織内外の物質移行を評価する評価方法。
【請求項14】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する第1の工程、第1の工程とは独立に、一般式(1)の化合物を含む中枢神経移行性評価用プローブと共に被験物質を生物試料に投与する第2の工程、並びに第1の工程及び第2の工程のそれぞれにおける生物試料の中枢神経組織内外への該プローブの移行を検出し、比較する第3の工程を含むことを特徴とする、被験物質の中枢神経組織内外の物質移行に対する影響を評価する評価方法。
【請求項15】
前記トランスポーターはABCトランスポーター、又は、有機アニオントランスポーターであることを特徴とする、請求項14に記載の評価方法。
【請求項16】
前記プローブの移行を検出する工程は、生物試料に励起光を照射し、該中枢神経移行性評価用プローブに由来する蛍光を観察する工程を含むことを特徴とする請求項13〜15のいずれか1項に記載の評価方法。
【請求項17】
前記生物試料をin vivoで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項18】
前記生物試料をin vitroで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項19】
前記生物試料をex vivoで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項20】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを使用することを特徴とする、中枢神経組織内外の物質移行に影響する物質のスクリーニング方法。
【請求項21】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する第1の工程、第1の工程とは独立に、請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブと共に、中枢神経組織内外の物質移行に影響する物質の候補となる被験物質を生物試料に投与する第2の工程、並びに第1の工程及び第2の工程のそれぞれにおける生物試料の中枢神経組織内外への該プローブの移行を検出し、比較する第3の工程を含むことを特徴とする、中枢神経組織内外の物質移行に影響する物質のスクリーニング方法。
【請求項22】
前記トランスポーターはABCトランスポーター、又は有機アニオントランスポーターであることを特徴とする、請求項21に記載のスクリーニング方法。
【請求項23】
小型硬骨魚類を用いることを特徴とする、請求項20〜22のいずれか1項に記載のスクリーニング方法。
【請求項24】
前記小型硬骨魚類はゼブラフィッシュであることを特徴とする、請求項20〜23のいずれか1項に記載のスクリーニング方法。
【請求項1】
中枢神経系への流入/排出に関連するトランスポーターの機能を可視化するためのプローブであって、一般式(1)で表される化合物のうち少なくとも1種を含むことを特徴とする中枢神経移行性評価用プローブ。
【化1】

[一般式(1)中、R1は水素原子、アルキル基、アラルキル基、アルケニル基、置換アルケニル基若しくはシクロアルケニル基、シクロアルキル基、アリール基若しくは置換アリール基、ヘテロ環基、又はアルカノイル基を表す。R2〜R5は各々独立して水素原子、アルキル基、アリール基、カルボン酸基、アルコキシカルボニル基、又はアルカノイル基を表し、R2とR4は互いに結合して環を形成しても良い。R6は水素原子又はハロゲン原子を表す。R7は、アルコキシカルボニル基、カルボン酸又はその塩を表す。R8は、硫黄原子、又は、一般式(2)で表わされる環を表す。nは0〜3の整数を表し、mは1以上の整数を表す。]
【化2】

[一般式(2)中、R9はアルキル基、アラルキル基、アルケニル基、又はアリール基を表す。を表す。「*」は結合部位を示す。]
【請求項2】
一般式(1)中、R8は硫黄原子である事を特徴とする請求項1に記載の中枢神経移行性評価用プローブ。
【請求項3】
前記一般式(1)中、mは1又は2であることを特徴とする請求項1又は2に記載の中枢神経移行性評価用プローブ。
【請求項4】
前記一般式(1)中、R1はアルキル基、アラルキル基、アリール基であることを特徴とする請求項1〜3のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項5】
前記一般式(1)中、nは0又は1であることを特徴とする請求項1〜4のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項6】
前記一般式(1)中、R2〜R5のいずれか又は全ては水素原子であることを特徴とする請求項1〜5のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項7】
前記一般式(1)はトランスポーターの基質となることを特徴とする請求項1〜6のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項8】
前記一般式(1)の化合物の分子量は、300以上650以下であることを特徴とする請求項1〜7のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項9】
前記一般式(1)中、R1の分子量は、1以上250以下であることを特徴とする請求項1〜8のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項10】
前記トランスポーターは血液脳関門、又は血液脳脊髄液関門に存在するトランスポーターであることを特徴とする、請求項1〜9のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項11】
前記トランスポーターに対する阻害剤の存在下では中枢神経組織への移行性が変化することを特徴とする、請求項1〜10のいずれか1項に記載の中枢神経移行性評価用プローブ。
【請求項12】
前記トランスポーターはABCトランスポーター、又は有機アニオントランスポーターであることを特徴とする、請求項11に記載の中枢神経移行性評価用プローブ。
【請求項13】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する工程、及び、該生物試料の中枢神経組織内外への該プローブの移行を検出する工程を含むことを特徴とする、中枢神経組織内外の物質移行を評価する評価方法。
【請求項14】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する第1の工程、第1の工程とは独立に、一般式(1)の化合物を含む中枢神経移行性評価用プローブと共に被験物質を生物試料に投与する第2の工程、並びに第1の工程及び第2の工程のそれぞれにおける生物試料の中枢神経組織内外への該プローブの移行を検出し、比較する第3の工程を含むことを特徴とする、被験物質の中枢神経組織内外の物質移行に対する影響を評価する評価方法。
【請求項15】
前記トランスポーターはABCトランスポーター、又は、有機アニオントランスポーターであることを特徴とする、請求項14に記載の評価方法。
【請求項16】
前記プローブの移行を検出する工程は、生物試料に励起光を照射し、該中枢神経移行性評価用プローブに由来する蛍光を観察する工程を含むことを特徴とする請求項13〜15のいずれか1項に記載の評価方法。
【請求項17】
前記生物試料をin vivoで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項18】
前記生物試料をin vitroで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項19】
前記生物試料をex vivoで用いることを特徴とする請求項13〜16のいずれか1項に記載の評価方法。
【請求項20】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを使用することを特徴とする、中枢神経組織内外の物質移行に影響する物質のスクリーニング方法。
【請求項21】
請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブを生物試料に投与する第1の工程、第1の工程とは独立に、請求項1〜12のいずれか1項に記載の中枢神経移行性評価用プローブと共に、中枢神経組織内外の物質移行に影響する物質の候補となる被験物質を生物試料に投与する第2の工程、並びに第1の工程及び第2の工程のそれぞれにおける生物試料の中枢神経組織内外への該プローブの移行を検出し、比較する第3の工程を含むことを特徴とする、中枢神経組織内外の物質移行に影響する物質のスクリーニング方法。
【請求項22】
前記トランスポーターはABCトランスポーター、又は有機アニオントランスポーターであることを特徴とする、請求項21に記載のスクリーニング方法。
【請求項23】
小型硬骨魚類を用いることを特徴とする、請求項20〜22のいずれか1項に記載のスクリーニング方法。
【請求項24】
前記小型硬骨魚類はゼブラフィッシュであることを特徴とする、請求項20〜23のいずれか1項に記載のスクリーニング方法。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公開番号】特開2012−184217(P2012−184217A)
【公開日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願番号】特願2011−187500(P2011−187500)
【出願日】平成23年8月30日(2011.8.30)
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成24年9月27日(2012.9.27)
【国際特許分類】
【出願日】平成23年8月30日(2011.8.30)
【出願人】(304026696)国立大学法人三重大学 (270)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

