中間代謝物質濃度の操作による免疫反応の調節
【課題】癌、感染症例えばウイルス性感染症、細菌性感染症あるいは免疫性機能不全の特に自己免疫障害、例えば糖尿病、クローン病、慢性間接リューマチ、動脈硬化および潰瘍性大腸炎などの疾患に悩まされる哺乳類被験者、例えば人間における免疫応答を調節する新規な方法を提供する。より詳しくは、高い濃度の中間代謝物質、例えば脂質あるいは共役生体分子、例えば糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質を生成することに関する。
【解決手段】処置は中間代謝物質を悩まされる被験者に導入するかあるいは投与した場合に濃度を上昇させる試薬により実施される。投薬方法は生体内あるいは生体外において処置される。
【解決手段】処置は中間代謝物質を悩まされる被験者に導入するかあるいは投与した場合に濃度を上昇させる試薬により実施される。投薬方法は生体内あるいは生体外において処置される。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、哺乳類の被験者における免疫反応を調節して操作する方法に関する。より詳しくは、中間代謝物質濃度の濃度を操作することによる免疫反応調節に関する。これらの方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療、感染した被験者の治療または癌の治療に有効に適用される。
【0002】
本出願において引用あるいは記載される全ての特許、特許出願、特許公報、科学文献などは、本発明が関連する技術をより完全に記載するためにそれら全部をここに参考として組込まれる。
【背景技術】
【0003】
代謝経路に関連する欠陥遺伝子産物を有することが最近特徴づけられている多数の遺伝病がある。これらの欠陥はこの種の経路の正常な最終生成物の有効性を限定したり及び更なる処理を減少させるかあるいは除去された中間体を増加させる対をなす影響を及ぼしてきた。この欠損及び機能の減少が個々の発現にとって通常有害でありしばしば致命的であるが、この経路の遮断の結果として起こる多種多様な効果を理解するのに風穴を開けた。このような遺伝病の一つとしてゴーシェ病があり、グルコシルセレブロシドを分解する能力が減少することによりグルコシルセレブロシドが増加するものである。多数の突然変異部位が位置しており、これがグルコシルセレブロシド活性の欠損の原因であり疾患状態の発現の程度を変化させる。ゴーシェ病は疾患の特定の発現表現型によりI、II、IIIのクラスに現在分類されている。
【0004】
これは中間代謝物質の増加に伴う脂質貯蔵病あるいは脂質処理病であるが、この病気の顕著な提示は免疫性システムの欠陥が同様にあることである。実際に、この症候群を記載する従来の文献の一つに、「ゴーシェ病:免疫性システムの慢性刺激を有する疾患」(ショーンフェルド他,1982 アーチ パソール ラボ メッド106;388−391)があった。免疫性システムが研究されるにつれて、免疫活性を促進あるいは抑制するのに密接にかかわる多数のサイトカインが発見された。最近の報告書では、ゴーシェ病の患者では、いくつかのサイトカインの血清濃度が免疫性システムのほかの構成要素と同様に顕著に変化することが発見された。これらは、IL−1β、IL−1Ra、IL−2R、IL−6、IL−8、IL−10,M−CSF、sCD14、TNF−α、ガンマグロブリンおよびβ2ミクログロブリンが含まれる(リヒテンシュタイン他、1997 23;395−401,バラク他,1997 ユーロ サイトカイン ネットワーク 10;205−210,ホーラック他,1997 ブロッド セルズ モレキュールズ アンド ディシーズ 23;201−212,アレン他,1987 キュー ジェイ メッド90;19−25,ディーブナー他,1998,ヘマトロジカ 1998 83;479−480)。これらの研究はこれらの標識の反応の均一性を例示していないことは明らかであるが、ゴーシェ病の発現は非常に変異する表現型を有することは長く知られていた。
【0005】
免疫性標識におけるこの効果は直接グルコシルセレブロシドの濃度の蓄積につながる。例えば、すでに引用されたいくつかの研究では、アルグルセラーゼ(alglucerase)を伴う患者の治療の前後の両方において顕著な効果を奏した。これらの研究では、この治療の後に異常に高かった多くの免疫活性標識がより正常な濃度に戻されたことが発見された。さらに、培養中に成長するマクロファージにグルコシルセレブロシドを直接作用させると、IL−1の分泌が誘導されるとする早期の研究がある。これは、より有名なラックマン他による論文に記載され(ケンブリッジのティモシーコックスグループ)(キュージェイエム2000;93:237−244)、これは広範囲の肝繊維性を有する4人の患者が記載されており、ゴーシェ病の患者の肝硬変の発症は珍しく通常脾臓摘出を受けた患者において生じることが強調されている。未治療のゴーシェ病の患者の多くは肝腫にかかっており、およそ20%も(特に肝細胞の)LFTsが上昇しているため、何かがこれらの患者に対して肝硬変が発症することから保護していると考えられる。
【0006】
免疫性システムの刺激はα−グルコシルセラブロシドの導入によっても示される。(カワノ他,1997 サイエンス 278;1626−1629,ビュルダン他,1998 ジェイ イミュノール 161;3271−3281)。この化合物が海綿動物から分離され、且つ通常は哺乳類の細胞に存在する成分ではないため、これは明らかに抗原誘導の一連の事実を示す。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は哺乳類の被験者における免疫反応を調節して操作する方法に関する。より詳しくは、中間代謝物質濃度の濃度を操作することによる免疫反応調節に関する。これらの方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療、感染した被験者の治療または癌の治療に有効に適用される。より好適な実施形態として、この哺乳類の被験者とは人間である。
【課題を解決するための手段】
【0008】
本発明は、哺乳類被験者の疾患を治療する方法を提供し、哺乳類の中間代謝物質の有効量を被験者に投与し被験者の代謝産物の細胞内濃度あるいは細胞外濃度あるいは血清濃度を上昇させることである。
【0009】
本発明は、更に哺乳類被験者の疾患を治療する方法を提供し、被験者における哺乳類中間代謝物質の細胞内濃度あるいは細胞外濃度あるいは血清濃度を増加させる試薬の有効量を被験者に投与する方法からなる。
【0010】
本発明は、更に哺乳類被験者の疾患を治療する生体外の方法も提供する。この方法では、細胞は最初に被験者から採取する。取り除かれた細胞は次に哺乳類中間代謝物質の有効量で処理され細胞中の代謝物質の細胞内濃度を上昇させる。その後、処理された細胞は被験者に転移させる。
【0011】
本発明の別の態様として、哺乳類被験者の疾患を治療する方法に関する。最初の工程として、細胞を被験者から採取し、次に細胞中の哺乳類中間代謝物質の細胞内濃度を増加させる試薬の有効量により生体外で処置する。処置された細胞は次に被験者に転移させる。
【0012】
本発明の更に別の態様として、哺乳類被験者の疾患を治療する方法を含む。ここで、哺乳類代謝産物の有効量を被験者に投与し、被験者の免疫システムにおける少なくとも一つの構成要素を調整するかあるいは変化させるようにする。
【0013】
本発明の多くの他の態様あるいは実施例は以下に詳細に説明される。
【図面の簡単な説明】
【0014】
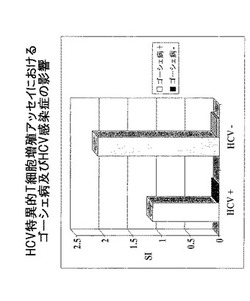
【図1】HCV特異的T細胞増殖アッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図2】HCV特異的IFNγELISPOTアッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図3】HCV特異的IL−10ELISPOTアッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図4】IFNγ血清濃度におけるゴーシェ病及びHCV感染症の影響を示す。
【図5】IL−4血清濃度におけるゴーシェ病及びHCV感染症の影響を示す。
【図6】末梢NKTリンパ球におけるゴーシェ病及びHCV感染症の影響を示す。
【発明を実施するための形態】
【0015】
本発明は、被験者における中間代謝物質の細胞内濃度あるいは血清濃度を変化させて哺乳類被験者の免疫性システムを調節あるいは操作する方法を提供する。この方法は、被験者における免疫性システムの一つ以上の構成要素の内の少なくとも一つを変化させる方法を提供し、更にこの変化は特定の抗原あるいは抗原群に特異的であり、あるいは普遍的な特徴であり、あるいはこれらの効果両方を構成することすらある。この免疫性応答における操作あるいは変化は直接的あるいは間接的に達成される。直接的な方法として、被験者に代謝物質を導入するものが含まれる。間接的な方法として、その代謝物質の合成速度を増加させることあるいは被験者における代謝物質の細胞内の分解を阻害することにより構成される。このような生体内処置に対して、免疫細胞は生体外で処置することができ更に被験者に再導入することができる。本発明の方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療に使用される。これらの方法は、癌患者の治療あるいは感染症患者の治療にも使用される。米国特許出願第08/808,629号明細書、1997年2月28日出願、また米国特許出願第09/356294号明細書、1999年7月16日出願、及び欧州特許出願第00114901.2号明細書(欧州特許出願公開第107227号明細書)、2000年7月17日出願を参照のこと。これらの従来文献は参考としてここに記載し、更に本発明と連動して利用される。
【0016】
本発明において、代謝物質あるいは中間代謝物質は哺乳類システムにおける酵素処理による生成物として考えられる。この処理には、酵素合成、酵素分解、酵素変性が含まれる。この生成物は脂質、糖類、糖脂質、リポタンパク質、および抗体、サイトカイン、あるいはホルモン以外の糖タンパク質が含まれるがこれらに限定されることはない。これらの生成物は、哺乳類システム、非哺乳類システムにおいて生成され、組み換えDNAを介して生成され、試験管内で生成され、合成して作成され、あるいはそれらのいかなる組合せにより生成される。更に、被験者においてこの代謝物質は、化合物の合成の増強あるいは化合物の分解の阻害のいずれかを介して間接的に高い濃度を得ることもできる。この増強手段の例として、前駆体及びその合成に起因する酵素あるいはその両方の導入が含まれる。阻害の手段の例として、分解酵素の阻害剤あるいはアンチセンス阻害の導入が含まれる。本発明に有効な糖タンパク質の例として、グリコシル化されたものがあるがこれに限定されない。代謝経路において、他の酵素が存在してもよく、それらが高濃度で存在する際には、免疫性調節に関与し得る。この例として、チオトリオシダーゼ(chiotriosidase)が挙げられ、これはゴーシェ病患者において増加が見られた。(ホーラック他,1994 ジェイ クリン インベスト93;1288−1292)。
【0017】
本発明の別の態様においては、免疫性システムの内の少なくとも一つの構成要素の調節あるいは感染症または癌患者の治療はここに記載される生体外の手段を含む原理及び方法により実現される。
【0018】
代謝及び細胞のプロセスの末梢調節はホルモン信号により決定される。免疫性システムの役割は、既に外部の病原体または化合物に対する保護を提供するものに主に限定されると早くから理解されていた。この効果は悪影響をもたらす自己(例えば自己免疫障害)を有する偶発的な相互作用により伴う。異物のこのような免疫監視に加えて、免疫性システムは代謝プロセスの監視にも携わることができる。このように、免疫反応は代謝物質の一部あるいは全てのクラスの異常な濃度を認識し、免疫性システム及び異常な濃度間にフィードバックプロセスを提供する。このようにして代謝物質は信号を出力し免疫性メッセンジャーとして作用する。類似したシステムにサイクリックAMPがあり、多数の異なる代謝方法を実施できることが知られている。
【0019】
この相互作用の裏付けは、異常な免疫状態が独立して免疫システムに影響を及ぼすことができる2つの異なる方法を重ね合わせることから導き出された予想外の結果から得られた。一つの方法としては、HCVによる感染であり、感染した被験者に対して免疫反応性応答並びに免疫抑制応答両方を伝達する作用因子であった。(フェラーリ シー,ウルバニ エス,ペンナ エー,キャバリ エー,バリ エー,ラモナカ ブイ,ベルトリ アール,ボニ シー,バルビエリ ケー,ウゲリ ジェイ,フィッカードリ エフ C型肝炎ウイルス感染症の免疫病理学、ジェイ ヘパトール 1999;31 サプル1:31−8; カーニー エー,チサリ エフブイ.慢性C型肝炎の病因:肝臓損傷及びウイルス持続の免疫学的特徴 ヘパトロジー 1999 9月;30(3):595−601;及びC型肝炎ウイルスに対するリーヘルマン ビー 細胞免疫応答 ジェイ ウイルス ヘパトロジー 1999 7月;6 サプル1:31−5)。もう一つの方法としては、中間代謝物質を高濃度にした結果多くの免疫性異常を有する前述したゴーシェ病であった。これらの驚くべき結果は、HCV感染を伴ったゴーシェ病患者(n=5)、HCV感染していないゴーシェ病患者(n=17)、慢性HCV感染したゴーシェ病でない患者(n=15)及び正常な対照者(n=11)からなるグループの分析から導かれた。これらの患者から得られた結果を図1〜図6に示す。これらの分析には、HCV特異的T細胞増殖(図1)、HCV特異的IFNγELISPOT(図2)、HCV特異的IL−10ELISPOT(図3)、IFNγ血清濃度(図4)、IL−4血清濃度(図5)、及び末梢NKTリンパ球測定値(図6)が含まれる。
【0020】
上記の分析を実施する方法は以下の通りである。
【0021】
T細胞増殖分析:サンプル採取、精製及び検定はゴストマン他,2000.アンチウイルスリサーチ、48:17−26及びアクバル他 イミュノロジー 1993;78:468−475に記載されており、以下の通りである。
【0022】
末梢血液単核細胞(PBMC)をフィコール(Ficoll)傾斜分離により分離した。100ulRPMI10%FCS中の1×105細胞が2つの別々のプレートA(3組の1及び2)及びB(3組の3及び4)上の4つの3組のウェル(1−4)に加えられた。プレートAには、3組の1のウェルが細胞及び溶媒のみを含み、3組の2のウェルが細胞、HCV NS3抗原(1ウェル当り10μg)及び溶媒を含み、プレートBでは、3組の3は細胞及び溶媒を含み、3組の4は細胞+PHA(2.5μg/mL)+溶媒を含む。2日後(プレートB)及び5日後(プレートA)に、メチル−H3チミジン(アメルシャム ファルマシア,英国)がウェル(1μCi/mL)に添加された。細胞は18時間培養された後に凍結され解凍されて採取された。データは、抗原の存在下あるいは存在しない状態における分当りの計測(cpm)で表されるT細胞培養の取り込み放射能率から計測された3組±SEMの平均刺激指数(SI)として得られた。この分析結果は図1に示される。
【0023】
IFNγELISPOT分析:HCV IFNγ斑点形成細胞(SPC)はゴストマン他 オペ シト 及びアクバル他 オペ シト に記載されるHCV−特異的ELISPOT分析(マブテック、ナカ、スウェーデン)を使用して同定された。簡単にいうと、高タンパク結合疎水性PVDF膜(ポリビニリデンジスルフィド)により被覆された96ウェル濾過プレートが使用された(ミルポアコーポレーション,ベッドフォード,MA,USA)。プレートは24時間40℃で抗−IFN−γ被覆抗体(15mg/ml,マブテック、ナカ、スウェーデン)を使用して被覆された。末梢血液単核細胞(PBMC)はフィコール(Ficoll)傾斜分離により分離された。細胞はRPMI1640及び10%FCSを有する96ウェルプレート(1×105細胞/ウェル)中で培養された。3つの3組は、HCV NS3(A)、フィトヘマグルチニン(2.5μg/ml)(B)及び抗原のないRPMIにより調整された。プレートは48時間、37℃で5%CO2の条件により培養された。洗浄した後に希薄ビオチニル化した(biotinylated)抗体(7−B6−1−ビオチン、マブテック、ナカ、スウェーデン)が、1μg/mlに対し0.5%FCSで濾過されたPBS中に、100μl/ウェルの全容積において加えられた。プレートは室温で3時間培養された。洗浄した後、100mlのストレプトアビジン(Streptavidin)−アルカリホスファターゼが加えられ、室温で90分培養された。洗浄後、暗赤紫色の斑点が発現するまで30分間支持体(BCIP/NBT,バイオラッド,リッチモンド,USA)が加えられた。洗浄し乾燥後、IFN−γ分泌クローンを示す暗色斑点は二人の検査員に解剖顕微鏡で計測された。結果はウイルス性抗原の存在しないウェルからの平均斑点を引き算した後に105リンパ球当り3組のIFN−γ分泌細胞の平均値として示した。この分析結果は図2に示される。
【0024】
IL−10ELISPOT分析:この分析は、抗IL−10被覆抗体及び抗IL−10(第2エピトープ)ビオチニル化抗体が使用された以外は、前述したIFN−γの分析と同様に実施された。この分析結果は図3に示される。
【0025】
IFN−γ及びIL4血清濃度測定値:これらの血清濃度はその製造者の指示に従ってゲンザイム(Genzyme)診断キット(ゲンザイム ダイアグノスティックス,MA,USA)を使用する「サンドイッチ」ELISAにより測定された。これらの分析結果は図4及び図5に示される。
【0026】
末梢血液中のNKTリンパ球用の流動血球計算分析:末梢血液単核細胞(PBMC)はフィコール(Ficoll)傾斜分離により分離された。分離後すぐに、2組の2−5×104細胞/500μL PBSはファルコン(Falcon)2052管に投入され4mlの1%BSAで10分間培養され更に1400rpmで5分間遠心分離された。細胞は10μL FCS中で、FITC抗ヒトCD3抗体とCD56抗体(ファルミンゲン,USA)が1:20の割合で10分おきに30分間再懸濁された。細胞は1%BSAで2回洗浄され、更に読み取られるまで4℃で保持された。分析細胞仕分けは蛍光活性化細胞ソーター(ファクスター プラス,べクトン ディキンソン)で各グループから得た1×104細胞により実施された。活細胞のみが計測され、抗体未処理リンパ球からの背景蛍光は得られたレベルから差し引かれた。ゲートは死細胞及び赤血球を除去するために前方と側方散乱上に設置された。データはコンソート30二色線プロットプログラム(べクトン ディキンソン,オックスナード,CA)あるいはセルクエストプログラム25で分析された。
【0027】
これらの分析値及び図から、代謝物質の増加した濃度の存在がこれらの被験者の免疫プロフィールに有意な変化をもたらすことが実証された。驚くべきことに、この状態は他の免疫システムの攻撃(HCV感染)により冒されると、代謝物質の上昇が起こらなかった患者に比較してHCV+の患者の免疫プロフィールに有意な影響を及ぼした。この差は、これら2つの状態を重ね合わせると免疫性システムの多様な構成要素において現れた。すなわち、本発明の一つの態様として、代謝物質の濃度を高めることにより患者の免疫構成要素の内の少なくとも一つの変化を起こすことができるよう患者を処置することである。この変化は増強した免疫性応答あるいは減少した免疫性応答のどちらかまたはその両方をもたらす。この変化は免疫性システム中の異なる構成要素で起こり、更に異なる構成要素において異なる方向性を提供し、すなわちある構成要素は増加され、一方の構成要素は減少する。例えば、Th1活性における増加はしばしばTh2反応の減少を伴い、また逆もしかり。また両方のグループが同じ方向に進行することも可能である。例えば、IFN−γ(Th1応答の標識)及びIL−10(Th2応答の標識)は両方とも図2、3及び4において増加することが示された。本発明の更に別の態様として、感染した個体、特にHCV、HBVあるいはHIV感染症の患者の治療は、別の疾患の進行を防ぐために代謝物質の濃度を高めることにより治療できることである。HBVあるいはHCVの場合において、この進行は一方で、線維症及び肝臓の滅失につながる。HIVの場合にはこの進行は免疫適格の損失につながる。
【0028】
本発明は様々な方法で実施することが可能である。例えば、代謝物質あるいはこの代謝物質の濃度に影響を及ぼす試薬は静脈内手段、筋肉内手段、皮下内手段、腹膜内手段、あるいは経口手段により患者へ導入できる。あるいは、その処置は患者から細胞を取り出し、代謝物質でこの細胞を処理し更に患者へその細胞を再導入することから構成される生体外の方法により行うことが可能である。このような方法で取り除かれ再導入される細胞の例としてはこれに限定されるものではないが末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、NK細胞、NKT細胞、CD1d細胞が別々かあるいは組み合わせで含まれる。このような生体外処置は更にサイトカイン、増殖因子、マトリックス、抗原あるいは成長または免疫応答を促進する他の因子への暴露などの別の処置が含まれる。
【0029】
細胞中間代謝物質中に導入される代謝物質あるいは試薬の有効量は、患者に要求される持続期間の間その代謝物質が充分な濃度となるためにはその化合物の個別の薬物速度論の特性に依存される。このような代謝物質の濃度は患者における免疫反応を誘発するために充分な時間に対しては正常な濃度以上であり得る。例えば、ゴーシェ病患者の代謝濃度はこの濃度のガイドとなることが考えられる。
【0030】
グルコシルセラミドのような中間代謝物質は、本発明において、癌、感染症及びいかなる免疫性伝達病原性状態を含む様々な疾患を治療するのに使用される。例えば、肺の小細胞癌の場合には、免疫性システムの内の少なくとも一つの構成要素がNKT細胞個体群の特異的活性化が起きる程度まで上昇するように患者にグルコシルセラミドを投与することにより治療される。これらの条件下で、癌細胞が転換するかあるいは破壊されるか破壊されるよう導かれるような方法において癌に対する免疫反応は変化し、患者は緩和されるかあるいは癌の有意な削減が起こる。共通の効果として、患者からNKT細胞を取り除き、これらの細胞を細胞の生存及び成長が可能な条件下で試験管内でグルコシルセラミドに曝すことにより達成される。これらの生体外で操作した細胞は患者の中へ戻される際に、これらの細胞は癌の緩和あるいは有意な削減を誘導するよう免疫反応を起こす。
【0031】
この効果としては潜在的に患者の免疫応答に基づくすべての病理の一部である何らかの疾患あるいは状態に対して、生体内あるいは生体外のいずれかの適切な代謝物質の処置を使用することができる。このような状態はHBV,HCV、HIVあるいは病因が免疫伝達性病因に基づく他のウイルス感染が含まれる。本発明は免疫応答が病因となる癌の処置に適用できる。自己免疫あるいは免疫伝達性起始の疾患の治療もまた本発明の課題の一つである。これらは限定されるものではないが、糖尿病タイプ1、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化、潰瘍性大腸炎及び当業者である専門家にとって明らかである別のものである。
【実施例】
【0032】
一つの実施態様として、本発明は哺乳類の被験者、例えば人間における疾患を治療するための方法であり、哺乳類性中間代謝物質あるいは試薬の有効量が被験者に投与される方法を提供する。それを実施することで、被験者の代謝物質の細胞内あるいは細胞外あるいは血清濃度が上昇する。中間代謝物質は脂質あるいは共役生体分子から構成される。後者は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質の形態をとることができる。この糖脂質はまた単糖類セラミド、例えばグルコシルセラミドあるいはガラクトシルセラミドなどを含むことができる。
【0033】
更に、以下に記載するように、中間代謝物質あるいは試薬の投与は静脈手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む従来公知の方法で実施される。
【0034】
本発明において治療できる疾患に関して、癌、感染症及び免疫性機能不全が含まれる。感染症は変異することができ、その病因が事実上ウイルス性あるいは細菌性のものも含まれる。ウイルス性感染症は例えばHBV,HCV及びHIVが含まれる。免疫性機能不全は自己免疫障害の形をとり、糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎などのいずれかが含まれる。
【0035】
本発明はまた、哺乳類の被験者、例えば人間における疾患を治療するための方法であり、試薬の有効量が、被験者例えば人間における哺乳類性中間代謝物質の細胞内、細胞外あるいは血清濃度が増加するよう投与される方法を提供する。前述したように、中間代謝物質は脂質かあるいは糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質などの共役生体分子から構成される。糖脂質は単糖類セラミドから構成される。好適には、グルコシルセラミドあるいはガラクトシルセラミドなどである。
【0036】
前述した方法の場合と同様に、投与は、静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む多くの従来公知の方法で実施される。
【0037】
本発明に適用される疾患は癌、感染症(ウイルス性例えばHBV,HCV,HIV及び細菌性)及び免疫性機能不全が含まれる。後者は自己免疫障害、特に糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎などが含まれる。
【0038】
前述した方法より、試薬は被験者の哺乳類性中間代謝物質の生成速度を増加させるかあるいは、被験者における哺乳類性中間代謝物質の崩壊速度を減少させるか代謝回転速度を減少させることができる。
【0039】
本発明により更に提供されるものとして哺乳類被験者における疾患を治療するための生体外の方法がある。この方法では、細胞は被験者から採取し、細胞中の代謝物質の細胞内濃度を上昇させるような哺乳類代謝物質の有効量で処理する方法である。その後、処理された細胞は従来の手順、静脈内投与などにより被験者に戻される。
【0040】
前述したように、中間代謝物質は脂質あるいは共役生体分子から構成され、後者は、糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質などから構成される。有効な糖脂質はグルコシルセラミド及びガラクトシルセラミドなど単糖類セラミドが含まれる。
【0041】
本発明に従って治療される疾患の状態は、例えば、癌、感染症及び免疫性機能不全が含まれる。これらは更に詳細に前述されている。
【0042】
処理され被験者に戻される細胞は、性質上様々であり、例えば、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞などが含まれる。
【0043】
別の態様においては、本発明は第一工程として被験者から細胞を採取し、次に細胞中の哺乳類性中間代謝物質の細胞内濃度が増加する試薬の有効量で細胞を処理することから構成される哺乳類被験者における疾患を治療する方法を提供する。処理後、細胞は被験者へ戻される。
【0044】
中間代謝物質については前述しており更に詳細には述べない。
【0045】
生体外処理の後、典型的には細胞は患者の静脈内に戻される。
【0046】
様々な疾患及び苦痛については前述の通りであり、本発明にすぐに適用可能である。
【0047】
前述したように、この方法を実行する際に、試薬は被験者の哺乳類性中間代謝物質の生成速度を増加させるかあるいは、被験者における哺乳類性中間代謝物質の崩壊速度を減少させるか代謝回転速度を減少させることが望ましい。
【0048】
前述しているが、被験者から採取した細胞は末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞などのいずれかからなる。
【0049】
本発明の更に別の態様として、哺乳類被験者、例えば人間の疾患を治療する方法であり、哺乳類性代謝産物の有効量を被験者に投与し、被験者の免疫性システムにおいて少なくとも一つの構成要素を調節あるいは変化させる方法である。このような免疫システム構成要素は細胞性、ホルモン性あるいはサイトカイン因子から構成され、更に調節または変化は特異的あるいは非特異的となり得る。
【0050】
中間代謝物質については前述しており、より詳細な説明は必要でない。前述したように、投与は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む多くの従来公知の方法で実施される。
【0051】
方法は前述した疾患状態にすぐに適用されるものであり、これ以上は詳細に記載しない。
【0052】
本発明の前述した記載及び実施例を考慮して、当業者は疑いなく多くの明白な多様性が示唆される。すべてのこのような多様性は特許請求の範囲においてより特徴的に定義される発明の範囲及び主旨において完全に包含される。
【技術分野】
【0001】
本発明は、哺乳類の被験者における免疫反応を調節して操作する方法に関する。より詳しくは、中間代謝物質濃度の濃度を操作することによる免疫反応調節に関する。これらの方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療、感染した被験者の治療または癌の治療に有効に適用される。
【0002】
本出願において引用あるいは記載される全ての特許、特許出願、特許公報、科学文献などは、本発明が関連する技術をより完全に記載するためにそれら全部をここに参考として組込まれる。
【背景技術】
【0003】
代謝経路に関連する欠陥遺伝子産物を有することが最近特徴づけられている多数の遺伝病がある。これらの欠陥はこの種の経路の正常な最終生成物の有効性を限定したり及び更なる処理を減少させるかあるいは除去された中間体を増加させる対をなす影響を及ぼしてきた。この欠損及び機能の減少が個々の発現にとって通常有害でありしばしば致命的であるが、この経路の遮断の結果として起こる多種多様な効果を理解するのに風穴を開けた。このような遺伝病の一つとしてゴーシェ病があり、グルコシルセレブロシドを分解する能力が減少することによりグルコシルセレブロシドが増加するものである。多数の突然変異部位が位置しており、これがグルコシルセレブロシド活性の欠損の原因であり疾患状態の発現の程度を変化させる。ゴーシェ病は疾患の特定の発現表現型によりI、II、IIIのクラスに現在分類されている。
【0004】
これは中間代謝物質の増加に伴う脂質貯蔵病あるいは脂質処理病であるが、この病気の顕著な提示は免疫性システムの欠陥が同様にあることである。実際に、この症候群を記載する従来の文献の一つに、「ゴーシェ病:免疫性システムの慢性刺激を有する疾患」(ショーンフェルド他,1982 アーチ パソール ラボ メッド106;388−391)があった。免疫性システムが研究されるにつれて、免疫活性を促進あるいは抑制するのに密接にかかわる多数のサイトカインが発見された。最近の報告書では、ゴーシェ病の患者では、いくつかのサイトカインの血清濃度が免疫性システムのほかの構成要素と同様に顕著に変化することが発見された。これらは、IL−1β、IL−1Ra、IL−2R、IL−6、IL−8、IL−10,M−CSF、sCD14、TNF−α、ガンマグロブリンおよびβ2ミクログロブリンが含まれる(リヒテンシュタイン他、1997 23;395−401,バラク他,1997 ユーロ サイトカイン ネットワーク 10;205−210,ホーラック他,1997 ブロッド セルズ モレキュールズ アンド ディシーズ 23;201−212,アレン他,1987 キュー ジェイ メッド90;19−25,ディーブナー他,1998,ヘマトロジカ 1998 83;479−480)。これらの研究はこれらの標識の反応の均一性を例示していないことは明らかであるが、ゴーシェ病の発現は非常に変異する表現型を有することは長く知られていた。
【0005】
免疫性標識におけるこの効果は直接グルコシルセレブロシドの濃度の蓄積につながる。例えば、すでに引用されたいくつかの研究では、アルグルセラーゼ(alglucerase)を伴う患者の治療の前後の両方において顕著な効果を奏した。これらの研究では、この治療の後に異常に高かった多くの免疫活性標識がより正常な濃度に戻されたことが発見された。さらに、培養中に成長するマクロファージにグルコシルセレブロシドを直接作用させると、IL−1の分泌が誘導されるとする早期の研究がある。これは、より有名なラックマン他による論文に記載され(ケンブリッジのティモシーコックスグループ)(キュージェイエム2000;93:237−244)、これは広範囲の肝繊維性を有する4人の患者が記載されており、ゴーシェ病の患者の肝硬変の発症は珍しく通常脾臓摘出を受けた患者において生じることが強調されている。未治療のゴーシェ病の患者の多くは肝腫にかかっており、およそ20%も(特に肝細胞の)LFTsが上昇しているため、何かがこれらの患者に対して肝硬変が発症することから保護していると考えられる。
【0006】
免疫性システムの刺激はα−グルコシルセラブロシドの導入によっても示される。(カワノ他,1997 サイエンス 278;1626−1629,ビュルダン他,1998 ジェイ イミュノール 161;3271−3281)。この化合物が海綿動物から分離され、且つ通常は哺乳類の細胞に存在する成分ではないため、これは明らかに抗原誘導の一連の事実を示す。
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明は哺乳類の被験者における免疫反応を調節して操作する方法に関する。より詳しくは、中間代謝物質濃度の濃度を操作することによる免疫反応調節に関する。これらの方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療、感染した被験者の治療または癌の治療に有効に適用される。より好適な実施形態として、この哺乳類の被験者とは人間である。
【課題を解決するための手段】
【0008】
本発明は、哺乳類被験者の疾患を治療する方法を提供し、哺乳類の中間代謝物質の有効量を被験者に投与し被験者の代謝産物の細胞内濃度あるいは細胞外濃度あるいは血清濃度を上昇させることである。
【0009】
本発明は、更に哺乳類被験者の疾患を治療する方法を提供し、被験者における哺乳類中間代謝物質の細胞内濃度あるいは細胞外濃度あるいは血清濃度を増加させる試薬の有効量を被験者に投与する方法からなる。
【0010】
本発明は、更に哺乳類被験者の疾患を治療する生体外の方法も提供する。この方法では、細胞は最初に被験者から採取する。取り除かれた細胞は次に哺乳類中間代謝物質の有効量で処理され細胞中の代謝物質の細胞内濃度を上昇させる。その後、処理された細胞は被験者に転移させる。
【0011】
本発明の別の態様として、哺乳類被験者の疾患を治療する方法に関する。最初の工程として、細胞を被験者から採取し、次に細胞中の哺乳類中間代謝物質の細胞内濃度を増加させる試薬の有効量により生体外で処置する。処置された細胞は次に被験者に転移させる。
【0012】
本発明の更に別の態様として、哺乳類被験者の疾患を治療する方法を含む。ここで、哺乳類代謝産物の有効量を被験者に投与し、被験者の免疫システムにおける少なくとも一つの構成要素を調整するかあるいは変化させるようにする。
【0013】
本発明の多くの他の態様あるいは実施例は以下に詳細に説明される。
【図面の簡単な説明】
【0014】
【図1】HCV特異的T細胞増殖アッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図2】HCV特異的IFNγELISPOTアッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図3】HCV特異的IL−10ELISPOTアッセイにおけるゴーシェ病及びHCV感染症の影響を示す。
【図4】IFNγ血清濃度におけるゴーシェ病及びHCV感染症の影響を示す。
【図5】IL−4血清濃度におけるゴーシェ病及びHCV感染症の影響を示す。
【図6】末梢NKTリンパ球におけるゴーシェ病及びHCV感染症の影響を示す。
【発明を実施するための形態】
【0015】
本発明は、被験者における中間代謝物質の細胞内濃度あるいは血清濃度を変化させて哺乳類被験者の免疫性システムを調節あるいは操作する方法を提供する。この方法は、被験者における免疫性システムの一つ以上の構成要素の内の少なくとも一つを変化させる方法を提供し、更にこの変化は特定の抗原あるいは抗原群に特異的であり、あるいは普遍的な特徴であり、あるいはこれらの効果両方を構成することすらある。この免疫性応答における操作あるいは変化は直接的あるいは間接的に達成される。直接的な方法として、被験者に代謝物質を導入するものが含まれる。間接的な方法として、その代謝物質の合成速度を増加させることあるいは被験者における代謝物質の細胞内の分解を阻害することにより構成される。このような生体内処置に対して、免疫細胞は生体外で処置することができ更に被験者に再導入することができる。本発明の方法は免疫性関連のあるいは免疫性伝達の疾患あるいは障害の治療に使用される。これらの方法は、癌患者の治療あるいは感染症患者の治療にも使用される。米国特許出願第08/808,629号明細書、1997年2月28日出願、また米国特許出願第09/356294号明細書、1999年7月16日出願、及び欧州特許出願第00114901.2号明細書(欧州特許出願公開第107227号明細書)、2000年7月17日出願を参照のこと。これらの従来文献は参考としてここに記載し、更に本発明と連動して利用される。
【0016】
本発明において、代謝物質あるいは中間代謝物質は哺乳類システムにおける酵素処理による生成物として考えられる。この処理には、酵素合成、酵素分解、酵素変性が含まれる。この生成物は脂質、糖類、糖脂質、リポタンパク質、および抗体、サイトカイン、あるいはホルモン以外の糖タンパク質が含まれるがこれらに限定されることはない。これらの生成物は、哺乳類システム、非哺乳類システムにおいて生成され、組み換えDNAを介して生成され、試験管内で生成され、合成して作成され、あるいはそれらのいかなる組合せにより生成される。更に、被験者においてこの代謝物質は、化合物の合成の増強あるいは化合物の分解の阻害のいずれかを介して間接的に高い濃度を得ることもできる。この増強手段の例として、前駆体及びその合成に起因する酵素あるいはその両方の導入が含まれる。阻害の手段の例として、分解酵素の阻害剤あるいはアンチセンス阻害の導入が含まれる。本発明に有効な糖タンパク質の例として、グリコシル化されたものがあるがこれに限定されない。代謝経路において、他の酵素が存在してもよく、それらが高濃度で存在する際には、免疫性調節に関与し得る。この例として、チオトリオシダーゼ(chiotriosidase)が挙げられ、これはゴーシェ病患者において増加が見られた。(ホーラック他,1994 ジェイ クリン インベスト93;1288−1292)。
【0017】
本発明の別の態様においては、免疫性システムの内の少なくとも一つの構成要素の調節あるいは感染症または癌患者の治療はここに記載される生体外の手段を含む原理及び方法により実現される。
【0018】
代謝及び細胞のプロセスの末梢調節はホルモン信号により決定される。免疫性システムの役割は、既に外部の病原体または化合物に対する保護を提供するものに主に限定されると早くから理解されていた。この効果は悪影響をもたらす自己(例えば自己免疫障害)を有する偶発的な相互作用により伴う。異物のこのような免疫監視に加えて、免疫性システムは代謝プロセスの監視にも携わることができる。このように、免疫反応は代謝物質の一部あるいは全てのクラスの異常な濃度を認識し、免疫性システム及び異常な濃度間にフィードバックプロセスを提供する。このようにして代謝物質は信号を出力し免疫性メッセンジャーとして作用する。類似したシステムにサイクリックAMPがあり、多数の異なる代謝方法を実施できることが知られている。
【0019】
この相互作用の裏付けは、異常な免疫状態が独立して免疫システムに影響を及ぼすことができる2つの異なる方法を重ね合わせることから導き出された予想外の結果から得られた。一つの方法としては、HCVによる感染であり、感染した被験者に対して免疫反応性応答並びに免疫抑制応答両方を伝達する作用因子であった。(フェラーリ シー,ウルバニ エス,ペンナ エー,キャバリ エー,バリ エー,ラモナカ ブイ,ベルトリ アール,ボニ シー,バルビエリ ケー,ウゲリ ジェイ,フィッカードリ エフ C型肝炎ウイルス感染症の免疫病理学、ジェイ ヘパトール 1999;31 サプル1:31−8; カーニー エー,チサリ エフブイ.慢性C型肝炎の病因:肝臓損傷及びウイルス持続の免疫学的特徴 ヘパトロジー 1999 9月;30(3):595−601;及びC型肝炎ウイルスに対するリーヘルマン ビー 細胞免疫応答 ジェイ ウイルス ヘパトロジー 1999 7月;6 サプル1:31−5)。もう一つの方法としては、中間代謝物質を高濃度にした結果多くの免疫性異常を有する前述したゴーシェ病であった。これらの驚くべき結果は、HCV感染を伴ったゴーシェ病患者(n=5)、HCV感染していないゴーシェ病患者(n=17)、慢性HCV感染したゴーシェ病でない患者(n=15)及び正常な対照者(n=11)からなるグループの分析から導かれた。これらの患者から得られた結果を図1〜図6に示す。これらの分析には、HCV特異的T細胞増殖(図1)、HCV特異的IFNγELISPOT(図2)、HCV特異的IL−10ELISPOT(図3)、IFNγ血清濃度(図4)、IL−4血清濃度(図5)、及び末梢NKTリンパ球測定値(図6)が含まれる。
【0020】
上記の分析を実施する方法は以下の通りである。
【0021】
T細胞増殖分析:サンプル採取、精製及び検定はゴストマン他,2000.アンチウイルスリサーチ、48:17−26及びアクバル他 イミュノロジー 1993;78:468−475に記載されており、以下の通りである。
【0022】
末梢血液単核細胞(PBMC)をフィコール(Ficoll)傾斜分離により分離した。100ulRPMI10%FCS中の1×105細胞が2つの別々のプレートA(3組の1及び2)及びB(3組の3及び4)上の4つの3組のウェル(1−4)に加えられた。プレートAには、3組の1のウェルが細胞及び溶媒のみを含み、3組の2のウェルが細胞、HCV NS3抗原(1ウェル当り10μg)及び溶媒を含み、プレートBでは、3組の3は細胞及び溶媒を含み、3組の4は細胞+PHA(2.5μg/mL)+溶媒を含む。2日後(プレートB)及び5日後(プレートA)に、メチル−H3チミジン(アメルシャム ファルマシア,英国)がウェル(1μCi/mL)に添加された。細胞は18時間培養された後に凍結され解凍されて採取された。データは、抗原の存在下あるいは存在しない状態における分当りの計測(cpm)で表されるT細胞培養の取り込み放射能率から計測された3組±SEMの平均刺激指数(SI)として得られた。この分析結果は図1に示される。
【0023】
IFNγELISPOT分析:HCV IFNγ斑点形成細胞(SPC)はゴストマン他 オペ シト 及びアクバル他 オペ シト に記載されるHCV−特異的ELISPOT分析(マブテック、ナカ、スウェーデン)を使用して同定された。簡単にいうと、高タンパク結合疎水性PVDF膜(ポリビニリデンジスルフィド)により被覆された96ウェル濾過プレートが使用された(ミルポアコーポレーション,ベッドフォード,MA,USA)。プレートは24時間40℃で抗−IFN−γ被覆抗体(15mg/ml,マブテック、ナカ、スウェーデン)を使用して被覆された。末梢血液単核細胞(PBMC)はフィコール(Ficoll)傾斜分離により分離された。細胞はRPMI1640及び10%FCSを有する96ウェルプレート(1×105細胞/ウェル)中で培養された。3つの3組は、HCV NS3(A)、フィトヘマグルチニン(2.5μg/ml)(B)及び抗原のないRPMIにより調整された。プレートは48時間、37℃で5%CO2の条件により培養された。洗浄した後に希薄ビオチニル化した(biotinylated)抗体(7−B6−1−ビオチン、マブテック、ナカ、スウェーデン)が、1μg/mlに対し0.5%FCSで濾過されたPBS中に、100μl/ウェルの全容積において加えられた。プレートは室温で3時間培養された。洗浄した後、100mlのストレプトアビジン(Streptavidin)−アルカリホスファターゼが加えられ、室温で90分培養された。洗浄後、暗赤紫色の斑点が発現するまで30分間支持体(BCIP/NBT,バイオラッド,リッチモンド,USA)が加えられた。洗浄し乾燥後、IFN−γ分泌クローンを示す暗色斑点は二人の検査員に解剖顕微鏡で計測された。結果はウイルス性抗原の存在しないウェルからの平均斑点を引き算した後に105リンパ球当り3組のIFN−γ分泌細胞の平均値として示した。この分析結果は図2に示される。
【0024】
IL−10ELISPOT分析:この分析は、抗IL−10被覆抗体及び抗IL−10(第2エピトープ)ビオチニル化抗体が使用された以外は、前述したIFN−γの分析と同様に実施された。この分析結果は図3に示される。
【0025】
IFN−γ及びIL4血清濃度測定値:これらの血清濃度はその製造者の指示に従ってゲンザイム(Genzyme)診断キット(ゲンザイム ダイアグノスティックス,MA,USA)を使用する「サンドイッチ」ELISAにより測定された。これらの分析結果は図4及び図5に示される。
【0026】
末梢血液中のNKTリンパ球用の流動血球計算分析:末梢血液単核細胞(PBMC)はフィコール(Ficoll)傾斜分離により分離された。分離後すぐに、2組の2−5×104細胞/500μL PBSはファルコン(Falcon)2052管に投入され4mlの1%BSAで10分間培養され更に1400rpmで5分間遠心分離された。細胞は10μL FCS中で、FITC抗ヒトCD3抗体とCD56抗体(ファルミンゲン,USA)が1:20の割合で10分おきに30分間再懸濁された。細胞は1%BSAで2回洗浄され、更に読み取られるまで4℃で保持された。分析細胞仕分けは蛍光活性化細胞ソーター(ファクスター プラス,べクトン ディキンソン)で各グループから得た1×104細胞により実施された。活細胞のみが計測され、抗体未処理リンパ球からの背景蛍光は得られたレベルから差し引かれた。ゲートは死細胞及び赤血球を除去するために前方と側方散乱上に設置された。データはコンソート30二色線プロットプログラム(べクトン ディキンソン,オックスナード,CA)あるいはセルクエストプログラム25で分析された。
【0027】
これらの分析値及び図から、代謝物質の増加した濃度の存在がこれらの被験者の免疫プロフィールに有意な変化をもたらすことが実証された。驚くべきことに、この状態は他の免疫システムの攻撃(HCV感染)により冒されると、代謝物質の上昇が起こらなかった患者に比較してHCV+の患者の免疫プロフィールに有意な影響を及ぼした。この差は、これら2つの状態を重ね合わせると免疫性システムの多様な構成要素において現れた。すなわち、本発明の一つの態様として、代謝物質の濃度を高めることにより患者の免疫構成要素の内の少なくとも一つの変化を起こすことができるよう患者を処置することである。この変化は増強した免疫性応答あるいは減少した免疫性応答のどちらかまたはその両方をもたらす。この変化は免疫性システム中の異なる構成要素で起こり、更に異なる構成要素において異なる方向性を提供し、すなわちある構成要素は増加され、一方の構成要素は減少する。例えば、Th1活性における増加はしばしばTh2反応の減少を伴い、また逆もしかり。また両方のグループが同じ方向に進行することも可能である。例えば、IFN−γ(Th1応答の標識)及びIL−10(Th2応答の標識)は両方とも図2、3及び4において増加することが示された。本発明の更に別の態様として、感染した個体、特にHCV、HBVあるいはHIV感染症の患者の治療は、別の疾患の進行を防ぐために代謝物質の濃度を高めることにより治療できることである。HBVあるいはHCVの場合において、この進行は一方で、線維症及び肝臓の滅失につながる。HIVの場合にはこの進行は免疫適格の損失につながる。
【0028】
本発明は様々な方法で実施することが可能である。例えば、代謝物質あるいはこの代謝物質の濃度に影響を及ぼす試薬は静脈内手段、筋肉内手段、皮下内手段、腹膜内手段、あるいは経口手段により患者へ導入できる。あるいは、その処置は患者から細胞を取り出し、代謝物質でこの細胞を処理し更に患者へその細胞を再導入することから構成される生体外の方法により行うことが可能である。このような方法で取り除かれ再導入される細胞の例としてはこれに限定されるものではないが末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、NK細胞、NKT細胞、CD1d細胞が別々かあるいは組み合わせで含まれる。このような生体外処置は更にサイトカイン、増殖因子、マトリックス、抗原あるいは成長または免疫応答を促進する他の因子への暴露などの別の処置が含まれる。
【0029】
細胞中間代謝物質中に導入される代謝物質あるいは試薬の有効量は、患者に要求される持続期間の間その代謝物質が充分な濃度となるためにはその化合物の個別の薬物速度論の特性に依存される。このような代謝物質の濃度は患者における免疫反応を誘発するために充分な時間に対しては正常な濃度以上であり得る。例えば、ゴーシェ病患者の代謝濃度はこの濃度のガイドとなることが考えられる。
【0030】
グルコシルセラミドのような中間代謝物質は、本発明において、癌、感染症及びいかなる免疫性伝達病原性状態を含む様々な疾患を治療するのに使用される。例えば、肺の小細胞癌の場合には、免疫性システムの内の少なくとも一つの構成要素がNKT細胞個体群の特異的活性化が起きる程度まで上昇するように患者にグルコシルセラミドを投与することにより治療される。これらの条件下で、癌細胞が転換するかあるいは破壊されるか破壊されるよう導かれるような方法において癌に対する免疫反応は変化し、患者は緩和されるかあるいは癌の有意な削減が起こる。共通の効果として、患者からNKT細胞を取り除き、これらの細胞を細胞の生存及び成長が可能な条件下で試験管内でグルコシルセラミドに曝すことにより達成される。これらの生体外で操作した細胞は患者の中へ戻される際に、これらの細胞は癌の緩和あるいは有意な削減を誘導するよう免疫反応を起こす。
【0031】
この効果としては潜在的に患者の免疫応答に基づくすべての病理の一部である何らかの疾患あるいは状態に対して、生体内あるいは生体外のいずれかの適切な代謝物質の処置を使用することができる。このような状態はHBV,HCV、HIVあるいは病因が免疫伝達性病因に基づく他のウイルス感染が含まれる。本発明は免疫応答が病因となる癌の処置に適用できる。自己免疫あるいは免疫伝達性起始の疾患の治療もまた本発明の課題の一つである。これらは限定されるものではないが、糖尿病タイプ1、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化、潰瘍性大腸炎及び当業者である専門家にとって明らかである別のものである。
【実施例】
【0032】
一つの実施態様として、本発明は哺乳類の被験者、例えば人間における疾患を治療するための方法であり、哺乳類性中間代謝物質あるいは試薬の有効量が被験者に投与される方法を提供する。それを実施することで、被験者の代謝物質の細胞内あるいは細胞外あるいは血清濃度が上昇する。中間代謝物質は脂質あるいは共役生体分子から構成される。後者は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質の形態をとることができる。この糖脂質はまた単糖類セラミド、例えばグルコシルセラミドあるいはガラクトシルセラミドなどを含むことができる。
【0033】
更に、以下に記載するように、中間代謝物質あるいは試薬の投与は静脈手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む従来公知の方法で実施される。
【0034】
本発明において治療できる疾患に関して、癌、感染症及び免疫性機能不全が含まれる。感染症は変異することができ、その病因が事実上ウイルス性あるいは細菌性のものも含まれる。ウイルス性感染症は例えばHBV,HCV及びHIVが含まれる。免疫性機能不全は自己免疫障害の形をとり、糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎などのいずれかが含まれる。
【0035】
本発明はまた、哺乳類の被験者、例えば人間における疾患を治療するための方法であり、試薬の有効量が、被験者例えば人間における哺乳類性中間代謝物質の細胞内、細胞外あるいは血清濃度が増加するよう投与される方法を提供する。前述したように、中間代謝物質は脂質かあるいは糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質などの共役生体分子から構成される。糖脂質は単糖類セラミドから構成される。好適には、グルコシルセラミドあるいはガラクトシルセラミドなどである。
【0036】
前述した方法の場合と同様に、投与は、静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む多くの従来公知の方法で実施される。
【0037】
本発明に適用される疾患は癌、感染症(ウイルス性例えばHBV,HCV,HIV及び細菌性)及び免疫性機能不全が含まれる。後者は自己免疫障害、特に糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎などが含まれる。
【0038】
前述した方法より、試薬は被験者の哺乳類性中間代謝物質の生成速度を増加させるかあるいは、被験者における哺乳類性中間代謝物質の崩壊速度を減少させるか代謝回転速度を減少させることができる。
【0039】
本発明により更に提供されるものとして哺乳類被験者における疾患を治療するための生体外の方法がある。この方法では、細胞は被験者から採取し、細胞中の代謝物質の細胞内濃度を上昇させるような哺乳類代謝物質の有効量で処理する方法である。その後、処理された細胞は従来の手順、静脈内投与などにより被験者に戻される。
【0040】
前述したように、中間代謝物質は脂質あるいは共役生体分子から構成され、後者は、糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質などから構成される。有効な糖脂質はグルコシルセラミド及びガラクトシルセラミドなど単糖類セラミドが含まれる。
【0041】
本発明に従って治療される疾患の状態は、例えば、癌、感染症及び免疫性機能不全が含まれる。これらは更に詳細に前述されている。
【0042】
処理され被験者に戻される細胞は、性質上様々であり、例えば、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞などが含まれる。
【0043】
別の態様においては、本発明は第一工程として被験者から細胞を採取し、次に細胞中の哺乳類性中間代謝物質の細胞内濃度が増加する試薬の有効量で細胞を処理することから構成される哺乳類被験者における疾患を治療する方法を提供する。処理後、細胞は被験者へ戻される。
【0044】
中間代謝物質については前述しており更に詳細には述べない。
【0045】
生体外処理の後、典型的には細胞は患者の静脈内に戻される。
【0046】
様々な疾患及び苦痛については前述の通りであり、本発明にすぐに適用可能である。
【0047】
前述したように、この方法を実行する際に、試薬は被験者の哺乳類性中間代謝物質の生成速度を増加させるかあるいは、被験者における哺乳類性中間代謝物質の崩壊速度を減少させるか代謝回転速度を減少させることが望ましい。
【0048】
前述しているが、被験者から採取した細胞は末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞などのいずれかからなる。
【0049】
本発明の更に別の態様として、哺乳類被験者、例えば人間の疾患を治療する方法であり、哺乳類性代謝産物の有効量を被験者に投与し、被験者の免疫性システムにおいて少なくとも一つの構成要素を調節あるいは変化させる方法である。このような免疫システム構成要素は細胞性、ホルモン性あるいはサイトカイン因子から構成され、更に調節または変化は特異的あるいは非特異的となり得る。
【0050】
中間代謝物質については前述しており、より詳細な説明は必要でない。前述したように、投与は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段などを含む多くの従来公知の方法で実施される。
【0051】
方法は前述した疾患状態にすぐに適用されるものであり、これ以上は詳細に記載しない。
【0052】
本発明の前述した記載及び実施例を考慮して、当業者は疑いなく多くの明白な多様性が示唆される。すべてのこのような多様性は特許請求の範囲においてより特徴的に定義される発明の範囲及び主旨において完全に包含される。
【特許請求の範囲】
【請求項1】
哺乳類性中間代謝物質の有効量を哺乳類被験者に投与し被験者の代謝産物の細胞内あるいは細胞外あるいは血清濃度を上昇させるよう構成する哺乳類被験者の疾患を治療する方法。
【請求項2】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項1記載の方法。
【請求項3】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項2記載の方法。
【請求項4】
前記糖脂質は単糖類セラミドから構成される請求項3記載の方法。
【請求項5】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項4記載の方法。
【請求項6】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項1記載の方法。
【請求項7】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項1記載の方法。
【請求項8】
前記感染症はウイルス性あるいは細菌性である請求項7記載の方法。
【請求項9】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項8記載の方法。
【請求項10】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項7記載の方法。
【請求項11】
前記哺乳類被験者は人間である請求項1記載の方法。
【請求項12】
哺乳類被験者における哺乳類性中間代謝物質の細胞内あるいは細胞外あるいは血清濃度を増加させる試薬の有効量を前記被験者に投与することから構成される哺乳類被験者における疾患を治療する方法。
【請求項13】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項12記載の方法。
【請求項14】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項13記載の方法。
【請求項15】
前記糖脂質は単糖類セラミドから構成される請求項14記載の方法。
【請求項16】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項15記載の方法。
【請求項17】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項12記載の方法。
【請求項18】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項12記載の方法。
【請求項19】
前記感染症はウイルス性あるいは細菌性である請求項18記載の方法。
【請求項20】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項19記載の方法。
【請求項21】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項18記載の方法。
【請求項22】
前記試薬は前記被験者における哺乳類性中間代謝物質の生成速度を増加する請求項12記載の方法。
【請求項23】
前記試薬は前記被験者における哺乳類性中間代謝物質の崩壊速度を減少するか代謝回転速度を減少する請求項12記載の方法。
【請求項24】
前記哺乳類被験者は人間である請求項12記載の方法。
【請求項25】
哺乳類被験者における疾患を治療する方法であって、
a)前記被験者から細胞を採取し、
b)前記細胞を哺乳類性中間代謝物質の有効量で処理し前記細胞の代謝物質の細胞内濃度を上昇させ、更に
c)前記処理した細胞を前記被験者へ戻すことから構成される方法。
【請求項26】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項25記載の方法。
【請求項27】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項26記載の方法。
【請求項28】
前記糖脂質は単糖類セラミドから構成される請求項27記載の方法。
【請求項29】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項28記載の方法。
【請求項30】
前記戻す工程は静脈内手段により実施される請求項25記載の方法。
【請求項31】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項25記載の方法。
【請求項32】
前記感染症はウイルス性あるいは細菌性である請求項31記載の方法。
【請求項33】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項32記載の方法。
【請求項34】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項31記載の方法。
【請求項35】
前記被験者から採取された細胞は、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞を構成する請求項25記載の方法。
【請求項36】
前記哺乳類被験者は人間である請求項25記載の方法。
【請求項37】
哺乳類被験者における疾患を治療する方法であって、
a)前記被験者から細胞を採取し、
b)前記細胞中の哺乳類性中間代謝物質の細胞内濃度を増加させる試薬の有効量で前記細胞を処理し、更に
c)前記処理した細胞を前記被験者へ戻すことから構成される方法。
【請求項38】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項37記載の方法。
【請求項39】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項38記載の方法。
【請求項40】
前記糖脂質は単糖類セラミドから構成される請求項39記載の方法。
【請求項41】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項40記載の方法。
【請求項42】
前記戻す工程は静脈内手段により実施される請求項37記載の方法。
【請求項43】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項37記載の方法。
【請求項44】
前記感染症はウイルス性あるいは細菌性である請求項43記載の方法。
【請求項45】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項44記載の方法。
【請求項46】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項43記載の方法。
【請求項47】
前記試薬は前記被験者における哺乳類性中間代謝物質の生成速度を増加する請求項37記載の方法。
【請求項48】
前記試薬は前記被験者における哺乳類性中間代謝物質の崩壊速度を減少するか代謝回転速度を減少する請求項37記載の方法。
【請求項49】
前記被験者から採取された細胞は、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞を構成する請求項37記載の方法。
【請求項50】
哺乳類性中間代謝物質の有効量を哺乳類被験者に投与し前記被験者の免疫性システムの中の少なくとも一つの構成要素を調節あるいは変化させるよう構成する哺乳類被験者の疾患を治療する方法。
【請求項51】
前記免疫性システムの構成要素は細胞性、ホルモン性あるいはサイトカイン因子から構成される請求項50に記載の方法。
【請求項52】
前記調節あるいは変化は特異的あるいは非特異的である請求項50記載の方法。
【請求項53】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項50記載の方法。
【請求項54】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項53記載の方法。
【請求項55】
前記糖脂質は単糖類セラミドから構成される請求項54記載の方法。
【請求項56】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項55記載の方法。
【請求項57】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項50記載の方法。
【請求項58】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項50記載の方法。
【請求項59】
前記感染症はウイルス性あるいは細菌性である請求項58記載の方法。
【請求項60】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項59記載の方法。
【請求項61】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項58記載の方法。
【請求項62】
前記哺乳類被験者は人間である請求項50記載の方法。
【請求項1】
哺乳類性中間代謝物質の有効量を哺乳類被験者に投与し被験者の代謝産物の細胞内あるいは細胞外あるいは血清濃度を上昇させるよう構成する哺乳類被験者の疾患を治療する方法。
【請求項2】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項1記載の方法。
【請求項3】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項2記載の方法。
【請求項4】
前記糖脂質は単糖類セラミドから構成される請求項3記載の方法。
【請求項5】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項4記載の方法。
【請求項6】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項1記載の方法。
【請求項7】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項1記載の方法。
【請求項8】
前記感染症はウイルス性あるいは細菌性である請求項7記載の方法。
【請求項9】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項8記載の方法。
【請求項10】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項7記載の方法。
【請求項11】
前記哺乳類被験者は人間である請求項1記載の方法。
【請求項12】
哺乳類被験者における哺乳類性中間代謝物質の細胞内あるいは細胞外あるいは血清濃度を増加させる試薬の有効量を前記被験者に投与することから構成される哺乳類被験者における疾患を治療する方法。
【請求項13】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項12記載の方法。
【請求項14】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項13記載の方法。
【請求項15】
前記糖脂質は単糖類セラミドから構成される請求項14記載の方法。
【請求項16】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項15記載の方法。
【請求項17】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項12記載の方法。
【請求項18】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項12記載の方法。
【請求項19】
前記感染症はウイルス性あるいは細菌性である請求項18記載の方法。
【請求項20】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項19記載の方法。
【請求項21】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項18記載の方法。
【請求項22】
前記試薬は前記被験者における哺乳類性中間代謝物質の生成速度を増加する請求項12記載の方法。
【請求項23】
前記試薬は前記被験者における哺乳類性中間代謝物質の崩壊速度を減少するか代謝回転速度を減少する請求項12記載の方法。
【請求項24】
前記哺乳類被験者は人間である請求項12記載の方法。
【請求項25】
哺乳類被験者における疾患を治療する方法であって、
a)前記被験者から細胞を採取し、
b)前記細胞を哺乳類性中間代謝物質の有効量で処理し前記細胞の代謝物質の細胞内濃度を上昇させ、更に
c)前記処理した細胞を前記被験者へ戻すことから構成される方法。
【請求項26】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項25記載の方法。
【請求項27】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項26記載の方法。
【請求項28】
前記糖脂質は単糖類セラミドから構成される請求項27記載の方法。
【請求項29】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項28記載の方法。
【請求項30】
前記戻す工程は静脈内手段により実施される請求項25記載の方法。
【請求項31】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項25記載の方法。
【請求項32】
前記感染症はウイルス性あるいは細菌性である請求項31記載の方法。
【請求項33】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項32記載の方法。
【請求項34】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項31記載の方法。
【請求項35】
前記被験者から採取された細胞は、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞を構成する請求項25記載の方法。
【請求項36】
前記哺乳類被験者は人間である請求項25記載の方法。
【請求項37】
哺乳類被験者における疾患を治療する方法であって、
a)前記被験者から細胞を採取し、
b)前記細胞中の哺乳類性中間代謝物質の細胞内濃度を増加させる試薬の有効量で前記細胞を処理し、更に
c)前記処理した細胞を前記被験者へ戻すことから構成される方法。
【請求項38】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項37記載の方法。
【請求項39】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項38記載の方法。
【請求項40】
前記糖脂質は単糖類セラミドから構成される請求項39記載の方法。
【請求項41】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項40記載の方法。
【請求項42】
前記戻す工程は静脈内手段により実施される請求項37記載の方法。
【請求項43】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項37記載の方法。
【請求項44】
前記感染症はウイルス性あるいは細菌性である請求項43記載の方法。
【請求項45】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項44記載の方法。
【請求項46】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項43記載の方法。
【請求項47】
前記試薬は前記被験者における哺乳類性中間代謝物質の生成速度を増加する請求項37記載の方法。
【請求項48】
前記試薬は前記被験者における哺乳類性中間代謝物質の崩壊速度を減少するか代謝回転速度を減少する請求項37記載の方法。
【請求項49】
前記被験者から採取された細胞は、末梢血液単核細胞(PBMCs)、樹状細胞、T細胞、幹細胞、NK細胞、NKT細胞及びCD1d細胞を構成する請求項37記載の方法。
【請求項50】
哺乳類性中間代謝物質の有効量を哺乳類被験者に投与し前記被験者の免疫性システムの中の少なくとも一つの構成要素を調節あるいは変化させるよう構成する哺乳類被験者の疾患を治療する方法。
【請求項51】
前記免疫性システムの構成要素は細胞性、ホルモン性あるいはサイトカイン因子から構成される請求項50に記載の方法。
【請求項52】
前記調節あるいは変化は特異的あるいは非特異的である請求項50記載の方法。
【請求項53】
前記中間代謝物質は脂質あるいは共役生体分子から構成される請求項50記載の方法。
【請求項54】
前記共役生体分子は糖脂質、リポタンパク質及び抗体、サイトカインあるいはホルモン以外の糖タンパク質から構成される請求項53記載の方法。
【請求項55】
前記糖脂質は単糖類セラミドから構成される請求項54記載の方法。
【請求項56】
前記単糖類セラミドはグルコシルセラミド及びガラクトシルセラミドから構成される請求項55記載の方法。
【請求項57】
前記投与工程は静脈内手段、筋肉内手段、皮下手段、腹膜内手段あるいは経口手段から構成される手段により実施される請求項50記載の方法。
【請求項58】
前記疾患は癌、感染症あるいは免疫性機能不全から構成される請求項50記載の方法。
【請求項59】
前記感染症はウイルス性あるいは細菌性である請求項58記載の方法。
【請求項60】
前記ウイルス性感染症はHBV,HCVあるいはHIVから構成される請求項59記載の方法。
【請求項61】
前記免疫性機能不全は糖尿病タイプI、糖尿病タイプII、慢性間接リューマチ、クローン病、動脈硬化および潰瘍性大腸炎から構成される請求項58記載の方法。
【請求項62】
前記哺乳類被験者は人間である請求項50記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2011−137040(P2011−137040A)
【公開日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願番号】特願2011−82308(P2011−82308)
【出願日】平成23年4月1日(2011.4.1)
【分割の表示】特願2004−52560(P2004−52560)の分割
【原出願日】平成16年2月26日(2004.2.26)
【出願人】(504074732)エンゾー セラピューティクス インコーポレイテッド (1)
【Fターム(参考)】
【公開日】平成23年7月14日(2011.7.14)
【国際特許分類】
【出願日】平成23年4月1日(2011.4.1)
【分割の表示】特願2004−52560(P2004−52560)の分割
【原出願日】平成16年2月26日(2004.2.26)
【出願人】(504074732)エンゾー セラピューティクス インコーポレイテッド (1)
【Fターム(参考)】
[ Back to top ]

