乳癌の診断及び治療法
【課題】乳癌の診断及び治療法を提供する。
【解決手段】蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして、及びガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【効果】新しい乳癌の診断及び治療法を提供することができる。
【解決手段】蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして、及びガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【効果】新しい乳癌の診断及び治療法を提供することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乳癌の診断及び治療法に関するものであり、更に詳しくは、従来のプロテオーム解析法とは全く異なる新しいプロテオミクスアプローチである蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS法)による乳癌細胞の特異的発現タンパク質のプロテオーム解析により定量、同定された乳癌細胞株に特異的もしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を乳癌の診断及び治療マーカーとして利用して乳癌の診断及び治療を行う新規乳癌診断及び治療法に関するものである。
【背景技術】
【0002】
乳癌は、主に、老齢期における女性の死亡の主因となっているが、癌の病因は、明確に規定されておらず(非特許文献1)、診断及び治療のために使用される分子マーカーは、例えば、腫瘍によって分泌されるミルクムチン、発現エストロゲン受容体、及び癌遺伝子erbB2など、わずかしかない。エストロゲン受容体を発現する乳癌細胞は、抗エストロゲン剤のタモキシフェンによって処置される(非特許文献2)。
【0003】
しかし、全ての乳癌細胞が、エストロゲン受容体を発現するわけではなく、その治療法は、限定される。ミルクムチンのための血清検出マーカーCA15−3が遠隔転移のマーカーとして提案されたが、その信頼性不良のために、断念された(非特許文献3)。新たに単離された遺伝子の発現の検出及び定量化に続いて、乳癌のみが癌遺伝子erbB2を発現するという知見に基づいて、ハーセプチンが導入され、現在、乳癌治療のために使用されている(非特許文献4)。
【0004】
また、最近発見された腫瘍抑制遺伝子BRCA1及びBRCA2もあり、治療のためのそれらの使用について、目下研究されているが、5%の乳癌のみが、本遺伝子に関係すると言われている(非特許文献5)。これらの背景を考慮すれば、特にプロテオームの観点から、乳癌中で発現する治療及び診断のための分子マーカーのその他の候補があると考えられる。
【0005】
特異的プロテオーム分析は、通常、選ばれる唯一の方法である二次元電気泳動法(2D−PAGE)を使用して実施されている。しかし、2D−PAGE法は、得られたデータの再現性にいくつかの欠点を有しており、発現するタンパク質の癌細胞と正常細胞との間の微小な違いが失われる。
【0006】
ごく最近、本発明者らは、極めて再現可能なプロテオミクスアプローチである蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を開発し(非特許文献6、7)、肝炎Cウィルスコアタンパク質遺伝子導入マウスの肝臓と、非遺伝子導入マウスの肝臓の間で、発現タンパク質のわずかな変化を識別して同定した(非特許文献8)。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Phillips,K.A.,Glendon,G. & Knight,J.A.Putting the risk of breast cancer in perspective.New Engl.J.Med.340,141−144(1999)
【非特許文献2】Osborne,C.K.Tamoxifen in the treatment of breast cancer.New Engl.J.Med.339,1609−1618(1998)
【非特許文献3】Hondermarck,H.,et al.Proteomics of breast cancer for marker discovery and signal pathway profiling.Proteomics,1,1216−1232(2001)
【非特許文献4】Colome,R.,Shamon,L.A.,Tsai,M.S. & Lupu,R.Herceptin:From the Bench to the Clinic.Cancer Invest.19,49−56(2001)
【非特許文献5】Hamann,U.Hereditary breast cancer:high risk genes,genetic testing and clinical implications.Clin.Lab.46,447−461(2000)
【非特許文献6】Toriumi,C.& Imai,K.An identification method for altered proteins in tissues utilizing fluorescence derivatization,liquid chromatography,tandem mass spectrometry,and a database−searching algorithm.Anal.Chem.,75,3725−3730(2003)
【非特許文献7】Masuda,M.,Toriumi,C.,Santa,T.& Imai,K.Fluorogenic derivatization reagents suitable for isolation and identification of cysteine−containing proteins utilizing high−performance liquid chromatography−tandem mass spectrometry.Anal.Chem.76,728−735(2004)
【非特許文献8】Ichibangase,T.,Moriya,K.,Koike,K.& Imai,K.A proteomics method revealing disease−related proteins in livers of hepatitis−infected mouse model.J.Proteome Res.6,2841−2849(2007)
【発明の概要】
【発明が解決しようとする課題】
【0008】
このような状況の中で、本発明者らは、上記従来技術に鑑みて、ヒト乳癌細胞中で発現する、治療及び診断のための分子マーカーとして機能する特定のタンパク質を定量、同定し、当該分子マーカータンパク質を利用した新しい乳癌の診断法等を開発することを目標として鋭意研究を積み重ねた結果、乳癌細胞株に特異的にもしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を定量、同定し、当該タンパク質を分子マーカーとする新しい乳癌の診断及び治療法を確立することに成功し、本発明を完成するに至った。本発明は、乳癌細胞株に特異的にもしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を定量、同定し、当該タンパク質を分子マーカーとする新しい乳癌の診断及び治療法を提供することを目的とするものである。
【課題を解決するための手段】
【0009】
上記課題を解決するための本発明は、以下の技術的手段から構成される。
(1)蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(2)乳癌細胞株と正常細胞株で発現変動したタンパク質を同時解析する、前記(1)に記載の乳癌の診断方法。
(3)上記乳癌細胞が、MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、又はHCC1428である、前記(1)又は(2)に記載の乳癌の診断方法。
(4)上記正常細胞として、正常乳腺上皮細胞(HMEC)を用いる、前記(2)に記載の乳癌の診断方法。
(5)診断が、転移乳癌の診断である、前記(1)から(4)のいずれか1項に記載の乳癌の診断方法。
(6)上記特定のタンパク質が、Ran GTPase−活性化タンパク質(RanGAP)、ペルオキシレドキシン−1、コフィン−1、Raf−1キナーゼ阻害タンパク質(RKIP)、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)、ストラチフィン、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1から選択される1種以上である、前記(1)から(4)のいずれか1項に記載の乳癌の診断方法。
(7)ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(8)ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(9)前記(1)から(6)のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、から構成されることを特徴とする分子マーカー。
(10)前記(1)から(6)のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアから構成されることを特徴とする分子マーカー。
【0010】
次に、本発明について更に詳細に説明する。
本発明者らは、上述の課題を解決するために、蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS法)を用いて、ヒト乳癌細胞中で発現する治療及び診断のための分子マーカータンパク質のその他の候補を同定することを目指し、そのために、7つの細胞系及び1つの正常細胞を選んだ(表1)。
【0011】
特異的プロテオーム分析により、いくつかの発現増加されたタンパク質、Raf−1キナーゼ阻害タンパク質、コフィリン−1、プロフィリン−1、チオレドキシン−1、Ran、及びRho GDP解離阻害物質と共に、癌細胞中のペルオキシレドキシン−1、RanGTPase−活性化タンパク質の特異的発現を初めて実証した。
【0012】
そして、また、発現低下されたタンパク質、ガレクチン−1、EF−Tu、ストラチフィン、アネキシン−2、及びトロポミオシン−1も実証した。また、例えば、ガレクチン−1とアネキシン−2又はチオレドキシン−1、あるいはアネキシン−2とEF−Tuの発現間の顕著な相関も得られた。ガレクチン−1とアネキシン−2とトロポミオシン−1のペアが、転移乳癌のための診断又は治療マーカーとして有用であることが示された。
【0013】
本発明では、細胞系として、HMECを対照上皮細胞とする一方、受容体及び癌遺伝子の発現プロファイリングが異なる市販の7つの乳癌細胞系について調査した(表1)。MDA−MB−231は、転移性胸水に由来し、浸潤性及び転移性細胞移行のモデルとして広く使用されている。これは、ほとんどの上皮性マーカーと形質を失った高度に脱分化した間葉様系の代表例と考えられている。HCC1428は、転移に関して、記録がない。
【0014】
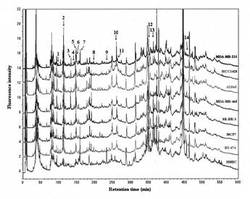
次に、乳癌細胞中で発現するタンパク質の蛍光誘導体化、液体クロマトグラフィー、及び同定については、実験手順に従って、7つの乳癌細胞及び1つの正常上皮細胞からの全タンパク質のそれぞれ40μgに相当する全ての抽出サンプルを、DAABD−Clで誘導体化し、蛍光検出器(505nmでの蛍光及び395nmでの励起)付きHPLCの対象とした。各細胞系について、8.0μgの注入タンパク質に相当する典型的なクロマトグラムを作成した(図1)。
【0015】
アクチン標準物質(分子量43000)のピーク信号対雑音比の計算に基づいて、本発明で使用するFD−LC−MS/MS法の検出限界(信号対雑音比、3)は、注入時440フェムトモルのタンパク質であった。したがって、各クロマトグラムにおいて、約500個のタンパク質ピークが検出された。ピーク数は、マウス肝臓サンプルを処理した以前の論文で観察されたものと類似していた。
【0016】
正常乳腺上皮細胞HMECと比べて、いくつかの異なって発現するタンパク質があった(図1)。図1では、タンパク質発現の順位は、各対応するピークのピーク高さ比(癌細胞−対−正常細胞)に従って、暫定的に決められた。無限大の比率は、極めて高度に発現増加されたタンパク質であり、5.0〜10.0の比率は、高度に発現増加されたタンパク質であり、2.0〜5.0の比率は、中程度に発現増加されたタンパク質であり、0.2未満の比率は、高度に発現低下されたタンパク質である。
【0017】
これらのタンパク質の対応するピーク画分を収集して、トリプシンで加水分解した。このようにして得られたペプチド混合物をLC−MS/MSの対象とし、文献(非特許文献6〜8)に従って、タンパク質の同定を実施した。異なって発現するタンパク質の名称を表2にまとめた。更に、癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、データを作表した(図2)。
【0018】
次に、乳癌細胞中の極めて高度に発現増加されたタンパク質について説明すると、本発明では、調べた全ての乳癌細胞中における、ペルオキシレドキシン−1及びRan GTPase−活性化タンパク質(RanGAP、別名Ran binding protein−1)の特異的発現を初めて実証した。チオレドキシンペルオキシダーゼ−1として知られているペルオキシレドキシン−1は、還元当量源としてチオレドキシン−1を使用して過酸化水素を除去する。これは、チオレドキシン−1で形質移入されたMCF7細胞中で増大し、ペルオキシレドキシン−1発現中で増大して、過酸化水素損傷からの細胞保護に寄与する。
【0019】
Ran GTPase−活性化タンパク質(RanGAP)は、核膜孔複合体の細胞質領域に局在し、RanGTP加水分解を制御して、核原形質の輸送に必須である核膜を横切るRanGTPの急激な濃度勾配を発生させるのに寄与する。
【0020】
ショウジョウバエ(Drosophila)のオス生殖細胞系における野生型RanGAPの過剰発現が、核RanGAPのレベルの上昇をもたらすことを考えれば、乳癌細胞系におけるRanGAPの過剰発現は、核中RanGAPの増大を引き起こして、核RanGTP濃度の低下をもたらすと考えられる。RanGTP/RanGDPの不均衡は、高分子の核原形質輸送と有糸分裂紡錘体形成の双方に影響して、乳癌における発癌を促進すると考えられる。
【0021】
次に、乳癌細胞中の高度に発現増加されたタンパク質について説明すると、Raf−1キナーゼ阻害タンパク質(RKIP)は、Raf/マイトジェン−活性化タンパク質キナーゼ(MAPK)/細胞外シグナル調節性キナーゼ(ERK)経路の生理学的阻害物質である。ERK経路は、乳癌中で過剰に活性化されることが多いので、RKIPは、細胞及び動物モデルにおいて転移抑止タンパク質として認識されており、RKIPの発現低下は、ヒト乳癌における転移と関連があると報告された。図2Fに示すように、RKIPの発現は、ER陰性細胞よりもER陽性癌細胞中で顕著に高かった。コフィリンは、単量体及び繊維状アクチンの双方に結合できる遍在性タンパク質であり、アクチン動態の必須制御因子である。コフィリン経路の特定遺伝子の発現は、乳癌細胞中で改変される。
【0022】
次に、乳癌細胞中の発現増加されたタンパク質について説明すると、プロフィリン−1は、G−アクチンモノマーに結合すると、ATPのADPによる交換を加速することでアクチン重合を制御する。プロフィリン−1発現の損失は、ヒト乳癌細胞MDA−MB−231に運動性及び浸潤性の増大を与えた。アクチン細胞骨格動態中のコフィリン、プロフィリン、及びアクチン間の濃度均衡の重要性が示唆された。
【0023】
チオレドキシン−1は、酸化還元−活性ジスルフィド/ジチオールを含有する多官能性タンパク質である。チオレドキシン−1の発現は、いくつかの癌において、対応する正常組織と比べて顕著に増大する。チオレドキシン−1発現の増大は、腫瘍血管新生の増強と共に、癌細胞における低酸素誘導因子1α(HIF−1α)レベルの増大と結びつけられる。
【0024】
チオレドキシン−1の発現とガレクチン−1の発現とで、顕著な相関が観察された(図2C)。これは、乳癌細胞系におけるRanの発現増加された発現の最初の例である。Rho GDP解離阻害物質(RhoGDI)は、RhoファミリーGTPaseとの相互作用を通じて、多様な細胞機能の制御において必須の役割を果たす。RhoGDIの上昇は、また、ヒト乳癌細胞系及び乳腫瘍組織でも検出された。
【0025】
次に、乳癌細胞中の高度に発現低下されたタンパク質について説明すると、アネキシン−2は、アクチンフィラメントと結びついてアクチン動態を制御する、カルシウム依存性リン脂質結合タンパク質である。細胞表面アネキシン−2は、プラスミン産生を調節し、それは、ECM分解、細胞浸潤、及び転移を容易にする。
【0026】
アネキシン−2が、卵巣癌及び腎細胞癌腫中で発現増加された以前の報告とは対照的に、発現レベルは非常に低かった(表2)。しかし、その発現は、ガレクチン−1、及びEF−Tu、と顕著に相関していた(図2A及び2B)。アネキシン−2の発現は、Her2陽性細胞中よりもHer2陰性癌細胞中で顕著に高かった(図2D)。
【0027】
EF−Tuは、GTP又はGDPのどちらかに結合して、アミノアシル−tRNAとリボソームの受容体部位への結合を促進できるグアニンヌクレオチド結合タンパク質のスーパーファミリーの一員であり、MDA−MB−435乳癌細胞の同質遺伝子型モデルを使用して、転移関連因子の1つとして同定された。生得及び適応免疫の双方で中心的役割を果たし、腫瘍のマウスモデルで治療効果を有するIL−12の発現を、それが顕著に増強することもまた実証された。
【0028】
本発明では、癌細胞中のEF−Tuの発現は、非常に低レベルであるが、EF−Tuとアネキシン−2との良好な相関が観察された。図2Eに示すように、EF−Tuの発現は、Her2陽性細胞中よりもHer2陰性癌細胞中で顕著に高かった。
【0029】
ガレクチン−1は、β−ガラクトシドへの親和性がある炭水化物結合タンパク質ファミリーの1つである。これは、生育、転移、Rasとの相互作用をはじめとする細胞シグナル伝達経路の調節、及びT細胞耐性と生体内(in vivo)恒常性の確立と維持に関連する。ガレクチン−1は、高度に転移性の乳癌細胞MDA−MB−435中で同定された。
【0030】
ガレクチン−1は、神経膠腫細胞中で、運動性の増大と、アクチン重合及び脱重合を調節するRhoシグナル経路中の重要な上流タンパク質であるRhoの発現増大と結びついたアクチン細胞骨格の再構築とを引き起こす。ガレクチン−1の発現は、アネキシン−2又はチオレドキシン−1(図2B及び2C)と顕著に相関していた。
【0031】
次に、正常細胞中のトロポミオシン−1の特異的発現について説明すると、トロポミオシンは、微小繊維を安定化してストレスファイバーを形成し、それらをADF/コフィリン及びゲルゾリンなどのアクチン不安定化タンパク質の結合から保護する、アクチン結合タンパク質のファミリーである。トロポミオシン−1をはじめとする複数の高分子量トロポミオシンが、上皮性細胞中で発現する。その発現は、癌細胞中では皆無であるが(表2)、本データは、トロポミオシンが良性病変と比べて悪性乳腫瘍中で発現低下されて発現され、トロポミオシン−1の発現の損失がMCF7及びMDA−MB−231中で観察されたという以前の観察を支持する。
【0032】
FD−LC−MS/MS法の高い再現性のために、定量的な特異的プロテオーム分析は、7つの乳癌細胞及び1つの正常細胞間におけるタンパク質発現レベルの容易な比較を達成した。得られた全ての新たな知見は、乳癌細胞における発現タンパク質の関係の概略マップの作成をもたらすことができる(図3)。データは、また、以下に示すように、ヒト乳癌の診断及び治療法に有用であることを示す。
【0033】
乳癌細胞中で誘導されたトロポミオシン−1は、F−アクチンからストレスファイバーを復元し、細胞中のトロポミオシン−1発現後、ストレスファイバー形成のためにMDA−MB−231転移の欠落が観察された。本プロテオーム分析は、正常な上皮性細胞HMECが、トロポミオシン−1を発現しない浸潤性乳癌細胞MDA−MB−231よりも多くのガレクチン−1、及びアネキシン−2を発現することを実証した。
【0034】
HMEC中では、F−アクチンがガレクチン−1及びアネキシン−2による誘導で生じれば、F−アクチンからストレスファイバーを復元するよう、トロポミオシン−1が作用できるのに対し、MDA−MB−231中では、ガレクチン−1及びアネキシン−2によって誘導されたF−アクチンは、トロポミオシン不在のためにストレスファイバーに形質転換されることができず、アクチン代謝回転を受けることが示唆される。
【0035】
したがって、トロポミオシン−1生成の活性化は、Smad3,4又はp38MAPKの生合成などの刺激、又はmiRNA(mir−21)の阻害を通じて、転移特性を低下させるので転移乳癌治療のために好ましい。
【0036】
これは、抗ガレクチン−1化合物が大規模に検索される抗ガレクチン治療法とは対照的であり、更に、本発明で実証されたように、ガレクチン−1は、転移乳癌細胞MDA−MB−231と比べて、正常な乳腺上皮性細胞中で高度に発現したので、抗ガレクチン−1治療法は、奨励されない。しかし、診断については、組織中にガレクチン−1及びアネキシン−2が同時に存在し、トロポミオシン−1が不在することが、転移乳癌の診断マーカーになり得る。
【0037】
図2F中の相関データを考えると、高いRKIPを発現する乳癌は、タモキシフェンに対して陽性であると考えられる。低レベルのEF−Tu(図2E)、アネキシン−2(図2D)を発現する乳癌についても、ハーセプチンに対してそうであると考えられる。この概念は、乳癌組織中で、これらのタンパク質を検出した後の治療のために有用と考えられる。
【0038】
RanGAPは、全癌細胞中で検出されたが、正常細胞には検出されず、存在する場合は、その阻害剤又は抑止剤が、乳癌の治療薬になることが示された。図2A−Cに列挙される発現間の顕著な相関は、図3に示すような癌細胞中の事象を理解する手がかりになり得るし、追加的データもまた役に立つ。ペルオキシレドキシン−1及びチオレドキシン−1の双方の発現増加は、酸化ストレス条件下での乳癌細胞の生存に役立つと考えられる。プロフィリン及びコフィリンの発現増加は、持続性の浸潤活性に寄与すると考えられる。
【0039】
本発明では、蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いて、乳癌細胞(MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、及びHCC1428)及び正常細胞(HMEC)について、特異的プロテオーム分析を実施した。
【0040】
その結果、癌細胞中に、特異的発現タンパク質である、RanGTPase−活性化タンパク質及びペルオキシレドキシン−1と、過剰発現されるRaf−1キナーゼ阻害タンパク質、コフィリン−1、プロフィリン−1、チオレドキシン−1、Ran、及びRho GDP解離阻害物質と、発現低下しているEF−Tu、ストラチフィン、アネキシン−2、トロポミオシン−1及びガレクチン−1とを実証した。
【0041】
得られた発現間の以下の顕著な相関は、癌細胞中の事象を理解する手がかりになる。ガレクチン−1とアネキシン−2又はチオレドキシン−1、アネキシン−2とEF−Tu、ペルオキシレドキシン−1とRanGAP、ガレクチン−1ないしアネキシン−2とトロポミオシン−1のペアが、転移乳癌の診断又は治療マーカーとして有用であることが示された。定量的な特異的プロテオーム分析は、生物医学的科学における研究のための強力なツールとなることが示された。
【発明の効果】
【0042】
本発明により、次のような効果が奏される。
(1)ヒト乳癌細胞株のプロテオーム解析を行い、ヒト乳癌細胞株で特異的、あるいは過剰発現又は発現低下している特定のタンパク質を乳癌診断の分子マーカーとして利用した新しい乳癌診断法を提供することができる。
(2)本発明により、高感度で再現性に優れた乳癌の診断及び治療を可能にする新しい乳癌の診断及び治療法を提供することができる。
【図面の簡単な説明】
【0043】
【図1】DAABD−Clで誘導体化したヒト乳癌細胞及び正常ヒト乳線上皮性細胞(HMEC)タンパク質のクロマトグラムである。
【図2】乳癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、作表したデータである。
【図3】ヒト乳癌細胞の浸潤、転移、及び増殖をもたらすタンパク質動態フローの概略図である。
【発明を実施するための形態】
【0044】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら限定されるものではない。
【実施例】
【0045】
(1)方法
細胞培養:MDA−MB−231などのヒト乳癌細胞系は、メリーランド州ロックヴィル(Rockville, MD)のAmerican Type Culture Collection(米国微生物系統保存機関)から得られ、10%熱不活性化ウシ胎仔血清、ペニシリン/ストレプトマイシン、及びメリーランド州ゲーサーズバーグのライフ・テクノロジーズ(Life Technologies(Gaithersburg, MD))からの1%のL−グルタミンで栄養強化したMEM中で単層培養として、6%CO2、37℃で生育させた。
【0046】
(2)サンプル調製及び総タンパク質測定
サンプルをかき集め、PBSで洗浄(3回)後、10mM CHAPS水中で均質化した。氷上で20回ピペットを用いて吸引と吐出を繰り返した後に、4℃、20,400gで、15分間遠心分離した。上清を収集して、総タンパク質を測定し、使用するまで、可溶性画分として−20℃で保存した。
【0047】
(3)FD及びHPLC条件
条件は、DAABD−Clによる肝臓タンパク質のFD手順を使用した。20μLの反応混合物(8.0μgのタンパク質)を、HPLCシステムに流速0.55mL/分で注入した。全体的システムは、日立L−2000シリーズHPLCシステム及び蛍光検出器(λex:395nm、λem:505nm)から構成された。
【0048】
移動相は、(A)9.0/1.0/90及び(B)69/1.0/30のアセトニトリル/イソプロパノール/水中の0.15%TFAから構成された。移動相(C)は、TFAが0.20%であったこと以外は、(A)と同一であった。
【0049】
次の溶出で、勾配条件を確立した:5.0%のB及び1.0%のCで、15.0分間保持し、15分かけて、30%のB及び35%のCにして、次に、35分間保持し、50分かけて35%のB及び35%Cにし、次に、60分かけて38%のB及び35%のCにし、120分かけて44%のB及び55%のCにして、次に、40分間保持し、40分かけて、47%のB及び53%のCにし、150分かけて、60%のB及び40%のCにし、40分かけて、70%のB及び30%のCにし、次に、50分かけて、90%のB及び10%のCにする。
【0050】
(4)誘導体化タンパク質の同定
対象タンパク質の各溶出液を減圧下で5.0μLに濃縮した。残留物を0.50Uのトリプシン及び10mMの塩化カルシウムを含有する50μLの50mMアンモニウム炭酸水素塩溶液(pH7.8)で希釈し、得られた混合物を37℃で2.0時間インキュベートした。ペプチド混合物を直接、ブルカー・ダルトニクス(Bruker Daltonics)からのナノ−LC−ESI−タンデムMS分光計(HCT plus)の対象とした。
【0051】
Ultimate/Famos/Switchos suiteの装置を使用して、クロマトグラフィーを実施した。サンプルを注入ループ内のナノプレカラム(内径300μmx1.0mm、C18 PepMap)に装入して、2.0%アセトニトリル中の0.10%TFAを使用し、Switchosポンプを使用して30μL/分で洗浄した。
【0052】
次に、ペプチドをナノフローカラム(内径75μmx15cm、C18 PepMap)上で35分間かけて、緩衝液B(80%アセトニトリル中の0.10%ギ酸)の5.0%から60%への勾配を用いて、流速170μL/分で分離した(A緩衝液:2.0%アセトニトリル中の0.10%ギ酸)。1300?1800Vのキャピラリー電圧でイオン化後、各前駆物質イオンについて、350〜1250m/zでイオンを観察し、MS/MSスキャンを実施した。
【0053】
(5)統計学的分析
結果を平均±SDとして表す。平均の差の有意性は、スチューデントの両側t−検定によって判定した。
【0054】
本発明では、以下の細胞系を使用した。表1に、本発明で採用した乳癌細胞系の特性を示す。
正常乳腺上皮細胞(HMEC)
MCF7(ER+、PR−、EGFR−、Her2±、p53±wt)
MDA−MB−231(ER−、PR−、EGFR+、Her2−,p53+mt)
HCC1428(ER+、PR−、EGFR+、Her2−、p53−)
AU565(ER−、PR−、EGFR+、Her2+、p53+wt)
BT−474(ER+、PR+、EGFR+、Her2+、p53+mt)
SK−BR−3(ER−、PR−、EGFR+、Her2+、p53+mt)
MDA−MB−468(ER−、PR−、EGFR+、Her2±、p53+mt)
【0055】
【表1】

【0056】
表中の略号は以下の意味を有する。
ER:エストロゲン受容体、PR:プロゲステロン受容体、EGFR:表皮性成長因子受容体、Her2:表皮性成長因子受容体2、wt:野性型、mt:突然変異体
n.d.:検出されず
【0057】
表2に、乳癌細胞系及びHMEC中の異なって発現されるタンパク質を示す。極めて高度に発現増加されたタンパク質は、Ran GTPase活性化タンパク質(RanGAP)、ペルオキシレドキシン−1である。また、高度に発現増加されたタンパク質は、コフィリン−1、Raf−1キナーゼ阻害タンパク質(RKIP)である。また、中程度に発現増加されたタンパク質は、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)である。また、高度に発現低下されたタンパク質は、ストラチフィン(14−3−3シグマ)、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1である。
【0058】
【表2】

【0059】
BCs/HMEC比率は、乳癌細胞中及びHMEC中のタンパク質の量の比率である。各値は、各細胞あたり3〜9回の実験を行った値について、平均±SDを表す。無限の比率は、極めて高度に発現増加されたタンパク質、5.0〜10.0の比率は高度に発現増加されたタンパク質、2.0〜5.0の比率は中程度に発現増加されたタンパク質、0.2未満の比率は、高度に発現低下されたタンパク質を意味する。
【0060】
図1は、DAABD−Clで誘導体化したヒト乳癌細胞及び正常なヒト乳線上皮性細胞(HMEC)タンパク質(8.0μgのタンパク質)のクロマトグラムである。図2は、乳癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、作表したデータである。
【0061】
図3は、本発明の知見に基づく、ヒト乳癌細胞の浸潤、転移、及び増殖をもたらすタンパク質動態フローの概略図である。最初に、乳癌細胞の高度な活動性に由来する酸化ストレスが、ガレクチン−1、アネキシン−2,チオレドキシン−1、ペルオキシレドキシン−1、プロフィリン−1、コフィリン−1及びRanをはじめとする様々なタンパク質の発現に影響する(赤字は、HMECと比べて発現増加されたタンパク質、水色字は、癌細胞中の発現低下されたタンパク質、青字は、調べたいずれの癌細胞中にも検出されなかったことを示す)。
【0062】
次に、ガレクチン−1及びアネキシン−2によって、Rhoシグナル経路の活性化が起き、それに続いて、プロフィリン−1の活性化がアクチンフィラメント(F−アクチン)生成の増大をもたらした。ホスホリパーゼCγ(PLCγ)によって原形質膜から放出された活性コフィリン−1は、F−アクチンに、まとまりのない微小繊維を形成させて、樹状核形成及び突出を開始させた。プラスミノーゲン及び組織型プラスミノーゲン活性化因子(tPA)の細胞表面受容体であるアネキシン−2が、プラスミノーゲンからプラスミンへの変換を媒介した。
【0063】
得られたプラスミンが、マトリックスメタロプロテアーゼ(MMP)を活性化し、細胞外マトリックス(ECM)分解を誘発して、塩基性線維芽細胞成長因子(bFGF)及び血管内皮成長因子(VEGF)をはじめとするマトリックス結合プロ成長因子を遊離して、活性形態にした。ガレクチン−1は、また、活性化T細胞中にアポトーシスを誘発することで、免疫回避に寄与した。これらの分子事象が統合されることで、乳癌細胞は、血管形成性/浸潤性/転移性表現型を得た。
【0064】
他方、トロポミオシン−1が発現される場合、トロポミオシン−1は、コフィリン−1活性及びF−アクチンの樹状核形成に対抗して阻害し、細胞運動性の低下をもたらす。DNAメチル化、ヒストン脱アセチル化、及びmir−21過剰発現をはじめとする様々な因子によって引き起こされるトロポミオシン−1の発現低下は、乳癌細胞の細胞運動性に有利に働いた。
【0065】
チオレドキシン−1の発現増加は、有毒な過酸化水素を無毒の水に転換するペルオキシレドキシン−1誘導と、アポトーシスシグナル制御性キナーゼ−1(ASK−1)/p38 MAPキナーゼ(MAPK)経路を通じたストレス誘発性アポトーシスの阻害とによって、酸化ストレスからの乳癌細胞自身の防御に寄与した。
【0066】
チオレドキシン−1は、核因子κB(NF−κB)をはじめとするレドックス感受性転写因子を活性化して、発癌に関与する多数の遺伝子のトランス活性化をもたらした。過酸化水素は、ホスファチジルイノシトール3−キナーゼ(PI3K)/Akt/哺乳類ラパマイシン標的タンパク質(mTOR)経路の活性化を通じて、Ranを発現増加させた。
【0067】
乳癌細胞中のRan及びRan GTPase活性化タンパク質(RanGAP)の発現増加は、レドックス感受性転写因子によるトランス活性化の増強に応じた、核細胞質輸送の促進をもたらした。これらの細胞事象は、酸化ストレス条件下における乳癌細胞の増殖能の獲得に寄与できると考えられる。
【産業上の利用可能性】
【0068】
以上詳述したように、本発明は、乳癌の診断及び治療法に係るものであり、本発明は、FD−LC−MS/MS法による解析した乳癌細胞特異的発現タンパク質を利用した新しい乳癌診断及び治療法を提供するものとして有用である。
【技術分野】
【0001】
本発明は、乳癌の診断及び治療法に関するものであり、更に詳しくは、従来のプロテオーム解析法とは全く異なる新しいプロテオミクスアプローチである蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS法)による乳癌細胞の特異的発現タンパク質のプロテオーム解析により定量、同定された乳癌細胞株に特異的もしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を乳癌の診断及び治療マーカーとして利用して乳癌の診断及び治療を行う新規乳癌診断及び治療法に関するものである。
【背景技術】
【0002】
乳癌は、主に、老齢期における女性の死亡の主因となっているが、癌の病因は、明確に規定されておらず(非特許文献1)、診断及び治療のために使用される分子マーカーは、例えば、腫瘍によって分泌されるミルクムチン、発現エストロゲン受容体、及び癌遺伝子erbB2など、わずかしかない。エストロゲン受容体を発現する乳癌細胞は、抗エストロゲン剤のタモキシフェンによって処置される(非特許文献2)。
【0003】
しかし、全ての乳癌細胞が、エストロゲン受容体を発現するわけではなく、その治療法は、限定される。ミルクムチンのための血清検出マーカーCA15−3が遠隔転移のマーカーとして提案されたが、その信頼性不良のために、断念された(非特許文献3)。新たに単離された遺伝子の発現の検出及び定量化に続いて、乳癌のみが癌遺伝子erbB2を発現するという知見に基づいて、ハーセプチンが導入され、現在、乳癌治療のために使用されている(非特許文献4)。
【0004】
また、最近発見された腫瘍抑制遺伝子BRCA1及びBRCA2もあり、治療のためのそれらの使用について、目下研究されているが、5%の乳癌のみが、本遺伝子に関係すると言われている(非特許文献5)。これらの背景を考慮すれば、特にプロテオームの観点から、乳癌中で発現する治療及び診断のための分子マーカーのその他の候補があると考えられる。
【0005】
特異的プロテオーム分析は、通常、選ばれる唯一の方法である二次元電気泳動法(2D−PAGE)を使用して実施されている。しかし、2D−PAGE法は、得られたデータの再現性にいくつかの欠点を有しており、発現するタンパク質の癌細胞と正常細胞との間の微小な違いが失われる。
【0006】
ごく最近、本発明者らは、極めて再現可能なプロテオミクスアプローチである蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を開発し(非特許文献6、7)、肝炎Cウィルスコアタンパク質遺伝子導入マウスの肝臓と、非遺伝子導入マウスの肝臓の間で、発現タンパク質のわずかな変化を識別して同定した(非特許文献8)。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Phillips,K.A.,Glendon,G. & Knight,J.A.Putting the risk of breast cancer in perspective.New Engl.J.Med.340,141−144(1999)
【非特許文献2】Osborne,C.K.Tamoxifen in the treatment of breast cancer.New Engl.J.Med.339,1609−1618(1998)
【非特許文献3】Hondermarck,H.,et al.Proteomics of breast cancer for marker discovery and signal pathway profiling.Proteomics,1,1216−1232(2001)
【非特許文献4】Colome,R.,Shamon,L.A.,Tsai,M.S. & Lupu,R.Herceptin:From the Bench to the Clinic.Cancer Invest.19,49−56(2001)
【非特許文献5】Hamann,U.Hereditary breast cancer:high risk genes,genetic testing and clinical implications.Clin.Lab.46,447−461(2000)
【非特許文献6】Toriumi,C.& Imai,K.An identification method for altered proteins in tissues utilizing fluorescence derivatization,liquid chromatography,tandem mass spectrometry,and a database−searching algorithm.Anal.Chem.,75,3725−3730(2003)
【非特許文献7】Masuda,M.,Toriumi,C.,Santa,T.& Imai,K.Fluorogenic derivatization reagents suitable for isolation and identification of cysteine−containing proteins utilizing high−performance liquid chromatography−tandem mass spectrometry.Anal.Chem.76,728−735(2004)
【非特許文献8】Ichibangase,T.,Moriya,K.,Koike,K.& Imai,K.A proteomics method revealing disease−related proteins in livers of hepatitis−infected mouse model.J.Proteome Res.6,2841−2849(2007)
【発明の概要】
【発明が解決しようとする課題】
【0008】
このような状況の中で、本発明者らは、上記従来技術に鑑みて、ヒト乳癌細胞中で発現する、治療及び診断のための分子マーカーとして機能する特定のタンパク質を定量、同定し、当該分子マーカータンパク質を利用した新しい乳癌の診断法等を開発することを目標として鋭意研究を積み重ねた結果、乳癌細胞株に特異的にもしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を定量、同定し、当該タンパク質を分子マーカーとする新しい乳癌の診断及び治療法を確立することに成功し、本発明を完成するに至った。本発明は、乳癌細胞株に特異的にもしくは大過剰に発現するタンパク質、発現増加並びに発現低下を示すタンパク質を定量、同定し、当該タンパク質を分子マーカーとする新しい乳癌の診断及び治療法を提供することを目的とするものである。
【課題を解決するための手段】
【0009】
上記課題を解決するための本発明は、以下の技術的手段から構成される。
(1)蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(2)乳癌細胞株と正常細胞株で発現変動したタンパク質を同時解析する、前記(1)に記載の乳癌の診断方法。
(3)上記乳癌細胞が、MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、又はHCC1428である、前記(1)又は(2)に記載の乳癌の診断方法。
(4)上記正常細胞として、正常乳腺上皮細胞(HMEC)を用いる、前記(2)に記載の乳癌の診断方法。
(5)診断が、転移乳癌の診断である、前記(1)から(4)のいずれか1項に記載の乳癌の診断方法。
(6)上記特定のタンパク質が、Ran GTPase−活性化タンパク質(RanGAP)、ペルオキシレドキシン−1、コフィン−1、Raf−1キナーゼ阻害タンパク質(RKIP)、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)、ストラチフィン、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1から選択される1種以上である、前記(1)から(4)のいずれか1項に記載の乳癌の診断方法。
(7)ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(8)ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
(9)前記(1)から(6)のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、から構成されることを特徴とする分子マーカー。
(10)前記(1)から(6)のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアから構成されることを特徴とする分子マーカー。
【0010】
次に、本発明について更に詳細に説明する。
本発明者らは、上述の課題を解決するために、蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS法)を用いて、ヒト乳癌細胞中で発現する治療及び診断のための分子マーカータンパク質のその他の候補を同定することを目指し、そのために、7つの細胞系及び1つの正常細胞を選んだ(表1)。
【0011】
特異的プロテオーム分析により、いくつかの発現増加されたタンパク質、Raf−1キナーゼ阻害タンパク質、コフィリン−1、プロフィリン−1、チオレドキシン−1、Ran、及びRho GDP解離阻害物質と共に、癌細胞中のペルオキシレドキシン−1、RanGTPase−活性化タンパク質の特異的発現を初めて実証した。
【0012】
そして、また、発現低下されたタンパク質、ガレクチン−1、EF−Tu、ストラチフィン、アネキシン−2、及びトロポミオシン−1も実証した。また、例えば、ガレクチン−1とアネキシン−2又はチオレドキシン−1、あるいはアネキシン−2とEF−Tuの発現間の顕著な相関も得られた。ガレクチン−1とアネキシン−2とトロポミオシン−1のペアが、転移乳癌のための診断又は治療マーカーとして有用であることが示された。
【0013】
本発明では、細胞系として、HMECを対照上皮細胞とする一方、受容体及び癌遺伝子の発現プロファイリングが異なる市販の7つの乳癌細胞系について調査した(表1)。MDA−MB−231は、転移性胸水に由来し、浸潤性及び転移性細胞移行のモデルとして広く使用されている。これは、ほとんどの上皮性マーカーと形質を失った高度に脱分化した間葉様系の代表例と考えられている。HCC1428は、転移に関して、記録がない。
【0014】
次に、乳癌細胞中で発現するタンパク質の蛍光誘導体化、液体クロマトグラフィー、及び同定については、実験手順に従って、7つの乳癌細胞及び1つの正常上皮細胞からの全タンパク質のそれぞれ40μgに相当する全ての抽出サンプルを、DAABD−Clで誘導体化し、蛍光検出器(505nmでの蛍光及び395nmでの励起)付きHPLCの対象とした。各細胞系について、8.0μgの注入タンパク質に相当する典型的なクロマトグラムを作成した(図1)。
【0015】
アクチン標準物質(分子量43000)のピーク信号対雑音比の計算に基づいて、本発明で使用するFD−LC−MS/MS法の検出限界(信号対雑音比、3)は、注入時440フェムトモルのタンパク質であった。したがって、各クロマトグラムにおいて、約500個のタンパク質ピークが検出された。ピーク数は、マウス肝臓サンプルを処理した以前の論文で観察されたものと類似していた。
【0016】
正常乳腺上皮細胞HMECと比べて、いくつかの異なって発現するタンパク質があった(図1)。図1では、タンパク質発現の順位は、各対応するピークのピーク高さ比(癌細胞−対−正常細胞)に従って、暫定的に決められた。無限大の比率は、極めて高度に発現増加されたタンパク質であり、5.0〜10.0の比率は、高度に発現増加されたタンパク質であり、2.0〜5.0の比率は、中程度に発現増加されたタンパク質であり、0.2未満の比率は、高度に発現低下されたタンパク質である。
【0017】
これらのタンパク質の対応するピーク画分を収集して、トリプシンで加水分解した。このようにして得られたペプチド混合物をLC−MS/MSの対象とし、文献(非特許文献6〜8)に従って、タンパク質の同定を実施した。異なって発現するタンパク質の名称を表2にまとめた。更に、癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、データを作表した(図2)。
【0018】
次に、乳癌細胞中の極めて高度に発現増加されたタンパク質について説明すると、本発明では、調べた全ての乳癌細胞中における、ペルオキシレドキシン−1及びRan GTPase−活性化タンパク質(RanGAP、別名Ran binding protein−1)の特異的発現を初めて実証した。チオレドキシンペルオキシダーゼ−1として知られているペルオキシレドキシン−1は、還元当量源としてチオレドキシン−1を使用して過酸化水素を除去する。これは、チオレドキシン−1で形質移入されたMCF7細胞中で増大し、ペルオキシレドキシン−1発現中で増大して、過酸化水素損傷からの細胞保護に寄与する。
【0019】
Ran GTPase−活性化タンパク質(RanGAP)は、核膜孔複合体の細胞質領域に局在し、RanGTP加水分解を制御して、核原形質の輸送に必須である核膜を横切るRanGTPの急激な濃度勾配を発生させるのに寄与する。
【0020】
ショウジョウバエ(Drosophila)のオス生殖細胞系における野生型RanGAPの過剰発現が、核RanGAPのレベルの上昇をもたらすことを考えれば、乳癌細胞系におけるRanGAPの過剰発現は、核中RanGAPの増大を引き起こして、核RanGTP濃度の低下をもたらすと考えられる。RanGTP/RanGDPの不均衡は、高分子の核原形質輸送と有糸分裂紡錘体形成の双方に影響して、乳癌における発癌を促進すると考えられる。
【0021】
次に、乳癌細胞中の高度に発現増加されたタンパク質について説明すると、Raf−1キナーゼ阻害タンパク質(RKIP)は、Raf/マイトジェン−活性化タンパク質キナーゼ(MAPK)/細胞外シグナル調節性キナーゼ(ERK)経路の生理学的阻害物質である。ERK経路は、乳癌中で過剰に活性化されることが多いので、RKIPは、細胞及び動物モデルにおいて転移抑止タンパク質として認識されており、RKIPの発現低下は、ヒト乳癌における転移と関連があると報告された。図2Fに示すように、RKIPの発現は、ER陰性細胞よりもER陽性癌細胞中で顕著に高かった。コフィリンは、単量体及び繊維状アクチンの双方に結合できる遍在性タンパク質であり、アクチン動態の必須制御因子である。コフィリン経路の特定遺伝子の発現は、乳癌細胞中で改変される。
【0022】
次に、乳癌細胞中の発現増加されたタンパク質について説明すると、プロフィリン−1は、G−アクチンモノマーに結合すると、ATPのADPによる交換を加速することでアクチン重合を制御する。プロフィリン−1発現の損失は、ヒト乳癌細胞MDA−MB−231に運動性及び浸潤性の増大を与えた。アクチン細胞骨格動態中のコフィリン、プロフィリン、及びアクチン間の濃度均衡の重要性が示唆された。
【0023】
チオレドキシン−1は、酸化還元−活性ジスルフィド/ジチオールを含有する多官能性タンパク質である。チオレドキシン−1の発現は、いくつかの癌において、対応する正常組織と比べて顕著に増大する。チオレドキシン−1発現の増大は、腫瘍血管新生の増強と共に、癌細胞における低酸素誘導因子1α(HIF−1α)レベルの増大と結びつけられる。
【0024】
チオレドキシン−1の発現とガレクチン−1の発現とで、顕著な相関が観察された(図2C)。これは、乳癌細胞系におけるRanの発現増加された発現の最初の例である。Rho GDP解離阻害物質(RhoGDI)は、RhoファミリーGTPaseとの相互作用を通じて、多様な細胞機能の制御において必須の役割を果たす。RhoGDIの上昇は、また、ヒト乳癌細胞系及び乳腫瘍組織でも検出された。
【0025】
次に、乳癌細胞中の高度に発現低下されたタンパク質について説明すると、アネキシン−2は、アクチンフィラメントと結びついてアクチン動態を制御する、カルシウム依存性リン脂質結合タンパク質である。細胞表面アネキシン−2は、プラスミン産生を調節し、それは、ECM分解、細胞浸潤、及び転移を容易にする。
【0026】
アネキシン−2が、卵巣癌及び腎細胞癌腫中で発現増加された以前の報告とは対照的に、発現レベルは非常に低かった(表2)。しかし、その発現は、ガレクチン−1、及びEF−Tu、と顕著に相関していた(図2A及び2B)。アネキシン−2の発現は、Her2陽性細胞中よりもHer2陰性癌細胞中で顕著に高かった(図2D)。
【0027】
EF−Tuは、GTP又はGDPのどちらかに結合して、アミノアシル−tRNAとリボソームの受容体部位への結合を促進できるグアニンヌクレオチド結合タンパク質のスーパーファミリーの一員であり、MDA−MB−435乳癌細胞の同質遺伝子型モデルを使用して、転移関連因子の1つとして同定された。生得及び適応免疫の双方で中心的役割を果たし、腫瘍のマウスモデルで治療効果を有するIL−12の発現を、それが顕著に増強することもまた実証された。
【0028】
本発明では、癌細胞中のEF−Tuの発現は、非常に低レベルであるが、EF−Tuとアネキシン−2との良好な相関が観察された。図2Eに示すように、EF−Tuの発現は、Her2陽性細胞中よりもHer2陰性癌細胞中で顕著に高かった。
【0029】
ガレクチン−1は、β−ガラクトシドへの親和性がある炭水化物結合タンパク質ファミリーの1つである。これは、生育、転移、Rasとの相互作用をはじめとする細胞シグナル伝達経路の調節、及びT細胞耐性と生体内(in vivo)恒常性の確立と維持に関連する。ガレクチン−1は、高度に転移性の乳癌細胞MDA−MB−435中で同定された。
【0030】
ガレクチン−1は、神経膠腫細胞中で、運動性の増大と、アクチン重合及び脱重合を調節するRhoシグナル経路中の重要な上流タンパク質であるRhoの発現増大と結びついたアクチン細胞骨格の再構築とを引き起こす。ガレクチン−1の発現は、アネキシン−2又はチオレドキシン−1(図2B及び2C)と顕著に相関していた。
【0031】
次に、正常細胞中のトロポミオシン−1の特異的発現について説明すると、トロポミオシンは、微小繊維を安定化してストレスファイバーを形成し、それらをADF/コフィリン及びゲルゾリンなどのアクチン不安定化タンパク質の結合から保護する、アクチン結合タンパク質のファミリーである。トロポミオシン−1をはじめとする複数の高分子量トロポミオシンが、上皮性細胞中で発現する。その発現は、癌細胞中では皆無であるが(表2)、本データは、トロポミオシンが良性病変と比べて悪性乳腫瘍中で発現低下されて発現され、トロポミオシン−1の発現の損失がMCF7及びMDA−MB−231中で観察されたという以前の観察を支持する。
【0032】
FD−LC−MS/MS法の高い再現性のために、定量的な特異的プロテオーム分析は、7つの乳癌細胞及び1つの正常細胞間におけるタンパク質発現レベルの容易な比較を達成した。得られた全ての新たな知見は、乳癌細胞における発現タンパク質の関係の概略マップの作成をもたらすことができる(図3)。データは、また、以下に示すように、ヒト乳癌の診断及び治療法に有用であることを示す。
【0033】
乳癌細胞中で誘導されたトロポミオシン−1は、F−アクチンからストレスファイバーを復元し、細胞中のトロポミオシン−1発現後、ストレスファイバー形成のためにMDA−MB−231転移の欠落が観察された。本プロテオーム分析は、正常な上皮性細胞HMECが、トロポミオシン−1を発現しない浸潤性乳癌細胞MDA−MB−231よりも多くのガレクチン−1、及びアネキシン−2を発現することを実証した。
【0034】
HMEC中では、F−アクチンがガレクチン−1及びアネキシン−2による誘導で生じれば、F−アクチンからストレスファイバーを復元するよう、トロポミオシン−1が作用できるのに対し、MDA−MB−231中では、ガレクチン−1及びアネキシン−2によって誘導されたF−アクチンは、トロポミオシン不在のためにストレスファイバーに形質転換されることができず、アクチン代謝回転を受けることが示唆される。
【0035】
したがって、トロポミオシン−1生成の活性化は、Smad3,4又はp38MAPKの生合成などの刺激、又はmiRNA(mir−21)の阻害を通じて、転移特性を低下させるので転移乳癌治療のために好ましい。
【0036】
これは、抗ガレクチン−1化合物が大規模に検索される抗ガレクチン治療法とは対照的であり、更に、本発明で実証されたように、ガレクチン−1は、転移乳癌細胞MDA−MB−231と比べて、正常な乳腺上皮性細胞中で高度に発現したので、抗ガレクチン−1治療法は、奨励されない。しかし、診断については、組織中にガレクチン−1及びアネキシン−2が同時に存在し、トロポミオシン−1が不在することが、転移乳癌の診断マーカーになり得る。
【0037】
図2F中の相関データを考えると、高いRKIPを発現する乳癌は、タモキシフェンに対して陽性であると考えられる。低レベルのEF−Tu(図2E)、アネキシン−2(図2D)を発現する乳癌についても、ハーセプチンに対してそうであると考えられる。この概念は、乳癌組織中で、これらのタンパク質を検出した後の治療のために有用と考えられる。
【0038】
RanGAPは、全癌細胞中で検出されたが、正常細胞には検出されず、存在する場合は、その阻害剤又は抑止剤が、乳癌の治療薬になることが示された。図2A−Cに列挙される発現間の顕著な相関は、図3に示すような癌細胞中の事象を理解する手がかりになり得るし、追加的データもまた役に立つ。ペルオキシレドキシン−1及びチオレドキシン−1の双方の発現増加は、酸化ストレス条件下での乳癌細胞の生存に役立つと考えられる。プロフィリン及びコフィリンの発現増加は、持続性の浸潤活性に寄与すると考えられる。
【0039】
本発明では、蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いて、乳癌細胞(MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、及びHCC1428)及び正常細胞(HMEC)について、特異的プロテオーム分析を実施した。
【0040】
その結果、癌細胞中に、特異的発現タンパク質である、RanGTPase−活性化タンパク質及びペルオキシレドキシン−1と、過剰発現されるRaf−1キナーゼ阻害タンパク質、コフィリン−1、プロフィリン−1、チオレドキシン−1、Ran、及びRho GDP解離阻害物質と、発現低下しているEF−Tu、ストラチフィン、アネキシン−2、トロポミオシン−1及びガレクチン−1とを実証した。
【0041】
得られた発現間の以下の顕著な相関は、癌細胞中の事象を理解する手がかりになる。ガレクチン−1とアネキシン−2又はチオレドキシン−1、アネキシン−2とEF−Tu、ペルオキシレドキシン−1とRanGAP、ガレクチン−1ないしアネキシン−2とトロポミオシン−1のペアが、転移乳癌の診断又は治療マーカーとして有用であることが示された。定量的な特異的プロテオーム分析は、生物医学的科学における研究のための強力なツールとなることが示された。
【発明の効果】
【0042】
本発明により、次のような効果が奏される。
(1)ヒト乳癌細胞株のプロテオーム解析を行い、ヒト乳癌細胞株で特異的、あるいは過剰発現又は発現低下している特定のタンパク質を乳癌診断の分子マーカーとして利用した新しい乳癌診断法を提供することができる。
(2)本発明により、高感度で再現性に優れた乳癌の診断及び治療を可能にする新しい乳癌の診断及び治療法を提供することができる。
【図面の簡単な説明】
【0043】
【図1】DAABD−Clで誘導体化したヒト乳癌細胞及び正常ヒト乳線上皮性細胞(HMEC)タンパク質のクロマトグラムである。
【図2】乳癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、作表したデータである。
【図3】ヒト乳癌細胞の浸潤、転移、及び増殖をもたらすタンパク質動態フローの概略図である。
【発明を実施するための形態】
【0044】
次に、実施例に基づいて本発明を具体的に説明するが、本発明は、以下の実施例によって何ら限定されるものではない。
【実施例】
【0045】
(1)方法
細胞培養:MDA−MB−231などのヒト乳癌細胞系は、メリーランド州ロックヴィル(Rockville, MD)のAmerican Type Culture Collection(米国微生物系統保存機関)から得られ、10%熱不活性化ウシ胎仔血清、ペニシリン/ストレプトマイシン、及びメリーランド州ゲーサーズバーグのライフ・テクノロジーズ(Life Technologies(Gaithersburg, MD))からの1%のL−グルタミンで栄養強化したMEM中で単層培養として、6%CO2、37℃で生育させた。
【0046】
(2)サンプル調製及び総タンパク質測定
サンプルをかき集め、PBSで洗浄(3回)後、10mM CHAPS水中で均質化した。氷上で20回ピペットを用いて吸引と吐出を繰り返した後に、4℃、20,400gで、15分間遠心分離した。上清を収集して、総タンパク質を測定し、使用するまで、可溶性画分として−20℃で保存した。
【0047】
(3)FD及びHPLC条件
条件は、DAABD−Clによる肝臓タンパク質のFD手順を使用した。20μLの反応混合物(8.0μgのタンパク質)を、HPLCシステムに流速0.55mL/分で注入した。全体的システムは、日立L−2000シリーズHPLCシステム及び蛍光検出器(λex:395nm、λem:505nm)から構成された。
【0048】
移動相は、(A)9.0/1.0/90及び(B)69/1.0/30のアセトニトリル/イソプロパノール/水中の0.15%TFAから構成された。移動相(C)は、TFAが0.20%であったこと以外は、(A)と同一であった。
【0049】
次の溶出で、勾配条件を確立した:5.0%のB及び1.0%のCで、15.0分間保持し、15分かけて、30%のB及び35%のCにして、次に、35分間保持し、50分かけて35%のB及び35%Cにし、次に、60分かけて38%のB及び35%のCにし、120分かけて44%のB及び55%のCにして、次に、40分間保持し、40分かけて、47%のB及び53%のCにし、150分かけて、60%のB及び40%のCにし、40分かけて、70%のB及び30%のCにし、次に、50分かけて、90%のB及び10%のCにする。
【0050】
(4)誘導体化タンパク質の同定
対象タンパク質の各溶出液を減圧下で5.0μLに濃縮した。残留物を0.50Uのトリプシン及び10mMの塩化カルシウムを含有する50μLの50mMアンモニウム炭酸水素塩溶液(pH7.8)で希釈し、得られた混合物を37℃で2.0時間インキュベートした。ペプチド混合物を直接、ブルカー・ダルトニクス(Bruker Daltonics)からのナノ−LC−ESI−タンデムMS分光計(HCT plus)の対象とした。
【0051】
Ultimate/Famos/Switchos suiteの装置を使用して、クロマトグラフィーを実施した。サンプルを注入ループ内のナノプレカラム(内径300μmx1.0mm、C18 PepMap)に装入して、2.0%アセトニトリル中の0.10%TFAを使用し、Switchosポンプを使用して30μL/分で洗浄した。
【0052】
次に、ペプチドをナノフローカラム(内径75μmx15cm、C18 PepMap)上で35分間かけて、緩衝液B(80%アセトニトリル中の0.10%ギ酸)の5.0%から60%への勾配を用いて、流速170μL/分で分離した(A緩衝液:2.0%アセトニトリル中の0.10%ギ酸)。1300?1800Vのキャピラリー電圧でイオン化後、各前駆物質イオンについて、350〜1250m/zでイオンを観察し、MS/MSスキャンを実施した。
【0053】
(5)統計学的分析
結果を平均±SDとして表す。平均の差の有意性は、スチューデントの両側t−検定によって判定した。
【0054】
本発明では、以下の細胞系を使用した。表1に、本発明で採用した乳癌細胞系の特性を示す。
正常乳腺上皮細胞(HMEC)
MCF7(ER+、PR−、EGFR−、Her2±、p53±wt)
MDA−MB−231(ER−、PR−、EGFR+、Her2−,p53+mt)
HCC1428(ER+、PR−、EGFR+、Her2−、p53−)
AU565(ER−、PR−、EGFR+、Her2+、p53+wt)
BT−474(ER+、PR+、EGFR+、Her2+、p53+mt)
SK−BR−3(ER−、PR−、EGFR+、Her2+、p53+mt)
MDA−MB−468(ER−、PR−、EGFR+、Her2±、p53+mt)
【0055】
【表1】

【0056】
表中の略号は以下の意味を有する。
ER:エストロゲン受容体、PR:プロゲステロン受容体、EGFR:表皮性成長因子受容体、Her2:表皮性成長因子受容体2、wt:野性型、mt:突然変異体
n.d.:検出されず
【0057】
表2に、乳癌細胞系及びHMEC中の異なって発現されるタンパク質を示す。極めて高度に発現増加されたタンパク質は、Ran GTPase活性化タンパク質(RanGAP)、ペルオキシレドキシン−1である。また、高度に発現増加されたタンパク質は、コフィリン−1、Raf−1キナーゼ阻害タンパク質(RKIP)である。また、中程度に発現増加されたタンパク質は、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)である。また、高度に発現低下されたタンパク質は、ストラチフィン(14−3−3シグマ)、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1である。
【0058】
【表2】

【0059】
BCs/HMEC比率は、乳癌細胞中及びHMEC中のタンパク質の量の比率である。各値は、各細胞あたり3〜9回の実験を行った値について、平均±SDを表す。無限の比率は、極めて高度に発現増加されたタンパク質、5.0〜10.0の比率は高度に発現増加されたタンパク質、2.0〜5.0の比率は中程度に発現増加されたタンパク質、0.2未満の比率は、高度に発現低下されたタンパク質を意味する。
【0060】
図1は、DAABD−Clで誘導体化したヒト乳癌細胞及び正常なヒト乳線上皮性細胞(HMEC)タンパク質(8.0μgのタンパク質)のクロマトグラムである。図2は、乳癌細胞中の発現タンパク質間の相関、及び発現タンパク質と発現する受容体との関係性を計算し、作表したデータである。
【0061】
図3は、本発明の知見に基づく、ヒト乳癌細胞の浸潤、転移、及び増殖をもたらすタンパク質動態フローの概略図である。最初に、乳癌細胞の高度な活動性に由来する酸化ストレスが、ガレクチン−1、アネキシン−2,チオレドキシン−1、ペルオキシレドキシン−1、プロフィリン−1、コフィリン−1及びRanをはじめとする様々なタンパク質の発現に影響する(赤字は、HMECと比べて発現増加されたタンパク質、水色字は、癌細胞中の発現低下されたタンパク質、青字は、調べたいずれの癌細胞中にも検出されなかったことを示す)。
【0062】
次に、ガレクチン−1及びアネキシン−2によって、Rhoシグナル経路の活性化が起き、それに続いて、プロフィリン−1の活性化がアクチンフィラメント(F−アクチン)生成の増大をもたらした。ホスホリパーゼCγ(PLCγ)によって原形質膜から放出された活性コフィリン−1は、F−アクチンに、まとまりのない微小繊維を形成させて、樹状核形成及び突出を開始させた。プラスミノーゲン及び組織型プラスミノーゲン活性化因子(tPA)の細胞表面受容体であるアネキシン−2が、プラスミノーゲンからプラスミンへの変換を媒介した。
【0063】
得られたプラスミンが、マトリックスメタロプロテアーゼ(MMP)を活性化し、細胞外マトリックス(ECM)分解を誘発して、塩基性線維芽細胞成長因子(bFGF)及び血管内皮成長因子(VEGF)をはじめとするマトリックス結合プロ成長因子を遊離して、活性形態にした。ガレクチン−1は、また、活性化T細胞中にアポトーシスを誘発することで、免疫回避に寄与した。これらの分子事象が統合されることで、乳癌細胞は、血管形成性/浸潤性/転移性表現型を得た。
【0064】
他方、トロポミオシン−1が発現される場合、トロポミオシン−1は、コフィリン−1活性及びF−アクチンの樹状核形成に対抗して阻害し、細胞運動性の低下をもたらす。DNAメチル化、ヒストン脱アセチル化、及びmir−21過剰発現をはじめとする様々な因子によって引き起こされるトロポミオシン−1の発現低下は、乳癌細胞の細胞運動性に有利に働いた。
【0065】
チオレドキシン−1の発現増加は、有毒な過酸化水素を無毒の水に転換するペルオキシレドキシン−1誘導と、アポトーシスシグナル制御性キナーゼ−1(ASK−1)/p38 MAPキナーゼ(MAPK)経路を通じたストレス誘発性アポトーシスの阻害とによって、酸化ストレスからの乳癌細胞自身の防御に寄与した。
【0066】
チオレドキシン−1は、核因子κB(NF−κB)をはじめとするレドックス感受性転写因子を活性化して、発癌に関与する多数の遺伝子のトランス活性化をもたらした。過酸化水素は、ホスファチジルイノシトール3−キナーゼ(PI3K)/Akt/哺乳類ラパマイシン標的タンパク質(mTOR)経路の活性化を通じて、Ranを発現増加させた。
【0067】
乳癌細胞中のRan及びRan GTPase活性化タンパク質(RanGAP)の発現増加は、レドックス感受性転写因子によるトランス活性化の増強に応じた、核細胞質輸送の促進をもたらした。これらの細胞事象は、酸化ストレス条件下における乳癌細胞の増殖能の獲得に寄与できると考えられる。
【産業上の利用可能性】
【0068】
以上詳述したように、本発明は、乳癌の診断及び治療法に係るものであり、本発明は、FD−LC−MS/MS法による解析した乳癌細胞特異的発現タンパク質を利用した新しい乳癌診断及び治療法を提供するものとして有用である。
【特許請求の範囲】
【請求項1】
蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項2】
乳癌細胞株と正常細胞株で発現変動したタンパク質を同時解析する、請求項1に記載の乳癌の診断方法。
【請求項3】
上記乳癌細胞が、MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、又はHCC1428である、請求項1又は2に記載の乳癌の診断方法。
【請求項4】
上記正常細胞として、正常乳腺上皮細胞(HMEC)を用いる、請求項2に記載の乳癌の診断方法。
【請求項5】
診断が、転移乳癌の診断である、請求項1から4のいずれか1項に記載の乳癌の診断方法。
【請求項6】
上記特定のタンパク質が、Ran GTPase−活性化タンパク質(RanGAP)、ペルオキシレドキシン−1、コフィン−1、Raf−1キナーゼ阻害タンパク質(RKIP)、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)、ストラチフィン、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1から選択される1種以上である、請求項1から4のいずれか1項に記載の乳癌の診断方法。
【請求項7】
ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項8】
ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項9】
請求項1から6のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、から構成されることを特徴とする分子マーカー。
【請求項10】
請求項1から6のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアから構成されることを特徴とする分子マーカー。
【請求項1】
蛍光誘導体化−液体クロマトグラフィー−タンデム質量分析法(FD−LC−MS/MS)を用いてプロテオーム解析して同定したヒト乳癌細胞株で発現変動した特定のタンパク質を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項2】
乳癌細胞株と正常細胞株で発現変動したタンパク質を同時解析する、請求項1に記載の乳癌の診断方法。
【請求項3】
上記乳癌細胞が、MCF7、SK−BR−3、BT−474、MDA−MB−231、MDA−MB−468、AU565、又はHCC1428である、請求項1又は2に記載の乳癌の診断方法。
【請求項4】
上記正常細胞として、正常乳腺上皮細胞(HMEC)を用いる、請求項2に記載の乳癌の診断方法。
【請求項5】
診断が、転移乳癌の診断である、請求項1から4のいずれか1項に記載の乳癌の診断方法。
【請求項6】
上記特定のタンパク質が、Ran GTPase−活性化タンパク質(RanGAP)、ペルオキシレドキシン−1、コフィン−1、Raf−1キナーゼ阻害タンパク質(RKIP)、プロフィリン−1、Ran、チオレドキシン−1、Rho GDP解離阻害物質(RhoGDI)、ストラチフィン、ガレクチン−1、アネキシン−2、EF−Tu、トロポミオシン−1から選択される1種以上である、請求項1から4のいずれか1項に記載の乳癌の診断方法。
【請求項7】
ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、を分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項8】
ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアを分子マーカーとして乳癌の診断を行うことを特徴とする乳癌の診断方法。
【請求項9】
請求項1から6のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1とアネキシン−2又はチオドレキシン−1、あるいはアネキシン−2とEF−Tu、あるいはペルオキシレドキシン−1とRanGAP、から構成されることを特徴とする分子マーカー。
【請求項10】
請求項1から6のいずれかに記載の乳癌の診断方法に使用する分子マーカーであって、ガレクチン−1及び/又はアネキシン−2とトロポミオシン−1のペアから構成されることを特徴とする分子マーカー。
【図2】


【図1】


【図3】




【図1】


【図3】


【公開番号】特開2009−236908(P2009−236908A)
【公開日】平成21年10月15日(2009.10.15)
【国際特許分類】
【出願番号】特願2009−51390(P2009−51390)
【出願日】平成21年3月4日(2009.3.4)
【出願人】(592191793)
【Fターム(参考)】
【公開日】平成21年10月15日(2009.10.15)
【国際特許分類】
【出願日】平成21年3月4日(2009.3.4)
【出願人】(592191793)

【Fターム(参考)】
[ Back to top ]

