乳酸脱水素酵素測定用試験片
【課題】測定誤差が小さく、かつ保存安定性に優れた乳酸脱水素酵素(LDH)測定用試験片を提供する。
【解決手段】LDH測定用試験片は、試薬層4に乳酸リチウム、塩基性緩衝剤、ジアホラーゼが配合され、試料保持層5にβ−NAD、テトラゾリウムバイオレット、酸性緩衝剤が配合されている。β−NADが塩基性緩衝剤と異なる層に配置されるため、使用前にβ−NADが変質して、還元型補酵素(NADH)になることが防止される。また、テトラゾリウムバイオレットがジアホラーゼと異なる層に配置されているため、使用前に色素が殆ど形成されない。そして、LDH測定用試験片は、かかる分離された構成を有するため、長期間の保存にも耐えることができる。
【解決手段】LDH測定用試験片は、試薬層4に乳酸リチウム、塩基性緩衝剤、ジアホラーゼが配合され、試料保持層5にβ−NAD、テトラゾリウムバイオレット、酸性緩衝剤が配合されている。β−NADが塩基性緩衝剤と異なる層に配置されるため、使用前にβ−NADが変質して、還元型補酵素(NADH)になることが防止される。また、テトラゾリウムバイオレットがジアホラーゼと異なる層に配置されているため、使用前に色素が殆ど形成されない。そして、LDH測定用試験片は、かかる分離された構成を有するため、長期間の保存にも耐えることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、乳酸脱水素酵素測定用試験片に関する。
【背景技術】
【0002】
血液、血清、血漿、尿等の液状試料を用いる乳酸脱水素酵素(LDH:Lactate DeHydrogenase)の定量分析には、従来、検出反応を試薬溶液中で実施する湿式法(ウェットケミストリー)が一般的に利用されてきた。しかし、湿式法を用いる場合には、試薬溶液を調製する手間がかかり、大型の装置を必要とするとともに、結果が得られるまでに長時間を要するという欠点があった。
【0003】
そこで、これらの欠点を解決する方法として、例えば特許文献1に示されるように、支持体の上に検出反応に関与する試薬組成物を含む試薬層が形成された試験片を用いる乾式法(ドライケミストリー)が実用化されている。この乾式法は、試験片の試薬層に液状試料を滴下して試薬と反応させるものである。反応後の試薬層を小型の光学分析装置で分析することによって、短時間で分析結果が得られる。
【0004】
乳酸脱水素酵素は、肝臓、赤血球、心筋及び骨格筋等に含まれる。肝臓病、溶血、心筋梗塞、悪性腫瘍及び癌等の場合には、血清または血漿中のLDH濃度が上昇する。このため、血清または血漿に含まれるLDHの定量分析は、臨床検査の中でも極めて重要である。
【0005】
LDHの定量分析は、一般的にはJSCC(日本臨床化学会)の勧告法に則って行われる(非特許文献1)。JSCC勧告法は湿式法であって、液体の緩衝液を用いる必要があり、かつ、分析波長が紫外領域(340nm)である。乾式法では固体の緩衝剤が用いられ、また可視光を照射してその反射光を測定することによって分析が行われることがより好ましい。したがって、JSCC勧告法を、そのまま乾式法に適用することは困難である。
【0006】
そこで、JSCC勧告法とは異なる測定原理に基づいて、乾式法でLDHの定量分析を行う技術が、特許文献2に開示されている。この技術においては、支持体上に試薬層及び多孔性展開層を有し、電子伝達剤であるジアホラーゼ、色素形成前駆物質、酸化型補酵素、緩衝剤及び還元試薬を含有する試験片(分析素子)が用いられる。この試験片に液状試料が滴下されると、液状試料中のLDHを触媒として、還元試薬である乳酸と酸化型補酵素が反応することによって補酵素が還元される。そして、電子伝達剤であるジアホラーゼが、生成する還元型補酵素によって還元される。更に、還元されたジアホラーゼが色素形成前駆物質を還元して、可視領域に吸収を有する色素を生成する。この色素の濃度を光学分析装置(比色法)で測定することによって、液状試料中のLDHの含有量が定量される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平11−000195号公報
【特許文献2】特開平05−176795号公報
【非特許文献】
【0008】
【非特許文献1】日本臨床化学会編、「ヒト血清中酵素活性測定の勧告法」、臨床化学、発行所:日本臨床化学会、発行日:1990年6月1日、第19巻第2号、228頁〜231頁
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、上記特許文献2に記載された試験片においては、ジアホラーゼと色素形成前駆物質が、試薬層または多孔性展開層のうち一方の層に共存している。このため、保存状態によっては、使用前にジアホラーゼが色素形成前駆物質に作用して色素が形成される恐れがある。このようなLDHに起因しない発色があると、液状試料の比色法による測定時に、この発色がバックグラウンドとなって測定誤差を生じる。特に、かかるバックグラウンドの存在によって、LDHの低濃度領域における測定誤差が大きくなり、感度直線性が損なわれる。
【0010】
また、上記特許文献2に記載された試験片においては、酸化型補酵素と緩衝剤をそれぞれどちらの層に含有させるかについても、全く考慮されていない。LDH測定の際には酵素反応を塩基性条件下で行う必要があるため、緩衝剤としては少なくとも塩基性緩衝剤が用いられる。この塩基性緩衝剤と酸化型補酵素とを同一の層に共存させると、使用前に酸化型補酵素の一部が還元型補酵素に変化して、やはりLDHに起因しない色素が生ずる。このため、長期間保存すると、測定誤差が一層大きくなる恐れがあるという問題点があった。
【0011】
本発明は、かかる問題点に鑑みてなされたものであって、測定誤差が小さく、かつ保存安定性に優れた乳酸脱水素酵素測定用試験片を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記目的を達成するために、本発明に係る乳酸脱水素酵素測定用試験片は、
支持体と、
該支持体の上に設けられた試薬層と、
該試薬層の上に設けられた試料保持層と、
を有し、
前記試薬層は、乳酸またはその塩と塩基性緩衝剤と電子伝達剤とを含有し、
前記試料保持層は、酸化型補酵素と色素形成前駆物質とを含有することを特徴とする。
【0013】
好ましくは、前記試料保持層は、更に酸性緩衝剤を含有する。
【0014】
好ましくは、前記酸性緩衝剤は、水素イオン濃度指数(pH)がpH4〜6の範囲内である。
【0015】
好ましくは、前記酸化型補酵素は、酸化型ニコチンアミドアデニンジヌクレオチド(β−NAD)または酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )である。
【0016】
好ましくは、前記色素形成前駆物質は、テトラゾリウム塩である。
【0017】
好ましくは、前記塩基性緩衝剤は、グリシンまたはN−シクロヘキシル−2−アミノエタンスルホン酸である。
【0018】
好ましくは、前記電子伝達剤は、ジアホラーゼである。
【0019】
好ましくは、前記試薬層は、乳酸またはその塩と前記塩基性緩衝剤と前記電子伝達剤とを含有する水溶性高分子化合物からなる。
【0020】
好ましくは、前記試料保持層は、少なくとも前記酸化型補酵素と前記色素形成前駆物質を含有する布帛材からなる。
【0021】
好ましくは、前記試料保持層は、接着剤を介して前記試薬層の上に積層される。
【0022】
好ましくは、前記接着剤は、アクリル系高分子化合物である。
【発明の効果】
【0023】
本発明によれば、酸化型補酵素が塩基性緩衝剤と異なる層に配置されているので、乳酸脱水素酵素測定用試験片の使用前に、酸化型補酵素が還元型補酵素に変質することを抑制することができる。これによって、乳酸脱水素酵素測定用試験片による乳酸脱水素酵素濃度の測定時の測定誤差を低減することができる。そして、本発明に係る乳酸脱水素酵素測定用試験片は、かかる分離された配置を有するため、保存安定性にも優れている。
【0024】
また、色素形成前駆物質が電子伝達剤と異なる層に配置されているので、乳酸脱水素酵素測定用試験片の使用前に電子伝達剤が色素形成前駆物質に作用することによる色素の生成を抑制することができる。これによって、乳酸脱水素酵素測定用試験片による乳酸脱水素酵素濃度の測定時の測定誤差を低減することができる。そして、本発明に係る乳酸脱水素酵素測定用試験片は、かかる分離された配置を有するため、保存安定性にも優れている。
【図面の簡単な説明】
【0025】
【図1】(a)は本発明の実施の形態1に係る乳酸脱水素酵素測定用試験片の構成を示す斜視図、(b)は(a)のA−A縦断面図である。
【図2】(a)は本発明の実施の形態2に係る乳酸脱水素酵素測定用試験片の構成を示す斜視図、(b)は(a)のB−B縦断面図である。
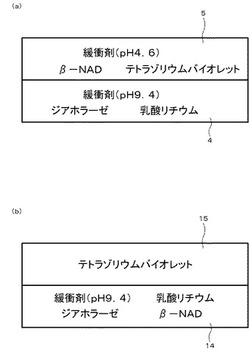
【図3】(a)は本発明の実施例に係る乳酸脱水素酵素測定用試験片の試薬配置を示す模式図、(b)は比較例の試験片の試薬配置を示す模式図である。
【図4】本発明の実施例に係る乳酸脱水素酵素測定用試験片の感度直線性を、比較例の試験片と比較して示す図である。
【図5】本発明の実施例に係る乳酸脱水素酵素測定用試験片で生理食塩水を測定したときのタイムコースを、比較例の試験片と比較して示す図である。
【図6】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して低濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図7】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して中程度の濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図8】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して高濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図9】比較例の試験片を40℃で7日間及び14日間保存して生理食塩水を測定したときのタイムコースを示す図である。
【図10】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して生理食塩水を測定したときのタイムコースを示す図である。
【発明を実施するための形態】
【0026】
[実施の形態1]
本発明の実施の形態1に係る乳酸脱水素酵素測定用試験片(以下、「LDH測定用試験片」とも言う。)は、図1(a)に示されるように、支持体としての細長い短冊形状片2と、その一端に形成された試薬部3から構成されている。図1(b)に示されるように、試薬部3は、支持体2の上に形成された試薬層4と試薬層4の上に形成された試料保持層5とを備える。
【0027】
支持体2としては、紙片、プラスチック(合成樹脂)片、金属片等を用いることができる。量産性・低コスト・保存性・耐水性等の観点からは、合成樹脂片を用いるのが好ましい。また、微量の液状試料による測定を可能にするため、支持体2は数mm〜1cm程度の幅の細長い片として、その先端に数mm×数mm程度の面積で試薬層4と試料保持層5を設けるのが好ましい。
【0028】
更に、支持体2は液体浸透性のないことが好ましい。これによって、本実施の形態1に係るLDH測定用試験片1を用いてLDHを測定する際、後述するように、試薬層4、試料保持層5に滴下される液状試料が試薬層4・試料保持層5内に留まるため、精度よく測定することができる。また、液状試料を滴下して検出反応を起こさせた後の光学的分析において、光を支持体側から照射する場合には、支持体2は光透過性を有する必要がある。これに対して、光を試料保持層5側から照射する場合には、光透過性は要求されない。
【0029】
支持体2の上には、まず試薬層4が形成される。試薬層4は、LDHの基質としての乳酸またはその塩、塩基性緩衝剤、電子伝達剤を含有する。
【0030】
試薬層4の上には、試料保持層5が形成される。このため、試薬層4に含有されるこれらの試薬は、上層に位置する試料保持層5に滴下された液状試料に取り込まれる必要がある。したがって、試薬層4は、液体浸透性を有する材質を主体として構成される必要がある。特に、水溶性の材質を主体として、その中にこれらの試薬が分散していることが好ましい。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、液体浸透性を有する紙、編物、織物等の布帛材中に、これらの試薬が分散していてもよい。
【0031】
試料保持層5は、試薬層4の上に直接形成してもよく、液体浸透性を有する他の層を間に介して形成してもよい。
【0032】
試料保持層5には、酸化型補酵素及び色素形成前駆物質が含有される。酸化型補酵素としては、酸化型ニコチンアミドアデニンジヌクレオチド(β−NADまたはNAD+ と略称される)、酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )等を用いることが好ましい。
【0033】
また、色素形成前駆物質としては、例えば、テトラゾリウムバイオレット(2,5−ジフェニル−3−(1−ナフチル)−2H−テトラゾリウムクロリド)を始めとするテトラゾリウム塩を用いることができる。他にも、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス[2−(p−ニトロフェニル)−5−フェニルテトラゾリウムクロリド]、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス(2,5−ジフェニルテトラゾリウムクロリド)、3−(4,5−ジメチル−2−チアゾリル)−2,5−ジフェニルテトラゾリウムブロミド、3−(p−ヨードフェニル)−2−(p−ニトロフェニル)−5−フェニル−テトラゾリウムクロリド、2,2′,5,5′−テトラ−(p−ニトロフェニル)−3,3′−(3−ジメトキシ−4−ジフェニレン)−ジテトラゾリウムクロリド、2,3,5−トリフェニルテトラゾリウムクロリド、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス−[2,5−ビス(p−ニトロフェニル)テトラゾリウムクロリド]、3,3′−(4,4′−ビフェニレン)−ビス(2,5−ジフェニルテトラゾリウムクロリド)、等を用いることができる。しかし、色素形成前駆物質は、これらに限定されるものではない。
【0034】
更に、試料保持層5には、酸性緩衝剤が含有されることが好ましい。これによって、LDH測定用試験片1の使用前に、酸化型補酵素(β−NAD,NADP+ 等)が還元されて還元型(NADH,NADPH等)になるのを防止することができる。酸性緩衝剤としては、リン酸2水素ナトリウム、N−(2−アセトアミド)−アミノエタンスルホン酸、N−(2−アセトアミド)イミノジアセト酸、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン、2−モルフォリノエタンスルホン酸・一水和物、ピペラジン−1,4−ビス(2−エタンスルホン酸)等を用いることができる。特に、pHを4〜6の範囲内とする酸性緩衝剤を用いることが好ましい。これによって、pH4〜6の範囲内で最も安定なβ−NADを長期間保存できる。
【0035】
本実施の形態1に用いられる乳酸塩としては、特に、乳酸リチウム等の乳酸のアルカリ金属塩が好ましい。塩基性緩衝剤としては、グリシン、N,N−ビス(2−ヒドロキシエチル)グリシン、N−シクロヘキシル−3−アミノプロパンスルホン酸、N−シクロヘキシル−2−ヒドロキシ−3−アミノプロパンスルホン酸、N−シクロヘキシル−2−アミノエタンスルホン酸、3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸、N−トリス(ヒドロキシメチル)メチル−3−アミノプロパンスルホン酸、等を用いることができる。
【0036】
また、電子伝達剤としては、ジアホラーゼ、N−メチルフェナジン・メトサルフェート類(例えばN−メチルフェナジン・メトサルフェート、1−メトキシ−5−メチルフェナジン・メトサルフェート等)、メルドラブルー、メチレンブルー、等を用いることができる。
【0037】
試料保持層5においては、滴下された液状試料は迅速に拡散される必要がある。したがって、試料保持層5は、液体浸透性を有する材質を主体として構成される必要がある。特に、液体浸透性を有する紙、編物、織物等の布帛材中に、これらの試薬が分散していることが好ましい。
【0038】
本発明の実施の形態1に係るLDH測定用試験片1は、次のようにして作製することができる。
【0039】
まず、支持体2となる所定の材質の所定の厚さを有するシートを、所定の寸法を有する細長い片として切り出す。この細長い片を洗浄、乾燥することにより、支持体2が作製される。
【0040】
次に、試薬層4を作製する。まず、液体浸透性を有する材質に乳酸またはその塩、塩基性緩衝剤、電子伝達剤を分散させる。液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、支持体2の所定箇所に塗布し、乾燥して試薬層4とする。液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させる。そして、乾燥して水分を除去して、試薬層4とする。
【0041】
このようにして作製した試薬層4を、支持体2に積層する。その方法としては、試薬層4が水溶性の材質を主体としたものである場合には、底面を純水で濡らして、支持体2の所定の位置に圧着する。これによって、底面の水溶性の材質が溶解して、接着剤としての役割を果たす。または、水溶性の材質をペースト状として、上述したように、支持体2の所定の位置に塗布して乾燥させる。
【0042】
更に、試薬層4の上に試料保持層5を積層する。試料保持層5は、液体浸透性を有する材質に、試薬層4の作製方法と同様にして、酸化型補酵素、色素形成前駆物質及び必要に応じて酸性緩衝剤を分散させて作製する。そして、接着剤6を用いて試薬層4の上に接着する。
【0043】
特に、試料保持層5が布帛材のように水溶性でない材質を主体としたものである場合には、接着剤を用いて、試薬層4の上に接着する。
【0044】
ここで、接着剤6によって形成される層は、液体浸透性を有する必要がある。したがって、接着剤6は、液体浸透性を有することが好ましい。または、接着剤6が、試薬層4の全面に塗布されるのではなく、液体浸透性を有するように塗布される。
【0045】
このようにして、本発明の実施の形態1に係るLDH測定用試験片1を作製することができる。
【0046】
本発明の実施の形態1に係るLDH測定用試験片1を用いたLDHの測定は、次のように行うことができる。
【0047】
予め定められた一定量の液状試料(血清または血漿)を、試料保持層5に滴下する。液状試料は、試料保持層5の全体に瞬時に拡散し、更にその下の試薬層4にも浸透して、全ての試薬を一体化させる。これによって、LDHの検出反応が開始され、LDHの量に応じて酸化型補酵素が還元される。生成した還元型補酵素によって、電子伝達剤を介して色素形成前駆物質が還元され、色素が生成する。
【0048】
生成した色素によって、試料保持層5及び試薬層4が着色される。この着色の度合い(K/S値)を、試料保持層5に可視光を照射して反射光を受光することによって算出する。K/S値は、着色の度合いを表す数値で、対象の着色の度合い(濃度)が高いほど反射光の強度も大きくなることを利用して算出される。すなわち、K/S値は、可視光の反射率をRとすると、下記の式で算出される。
(式) K/S=(1−R)2 /2R
【0049】
このような分析方法を応用した光学分析装置としては、例えば、富士フィルム(株)の富士ドライケム(登録商標)7000、コニカミノルタ(株)のコレステックLDX(登録商標)KM、アークレイ(株)のスポットケム(登録商標)EZ、等がある。
【0050】
このようにして得られたK/S値から、液状試料中の正確なLDH濃度を知ることができる。
【0051】
[実施の形態2]
次に、本発明の実施の形態2に係るLDH測定用試験片について、図2を参照して説明する。なお、上記実施の形態1に係るLDH測定用試験片1と同一の部分には同一の符号を付す。
【0052】
図2(a)に示されるように、実施の形態2に係るLDH測定用試験片10は、LDH測定用試験片1と同様に、支持体としての細長い短冊形状片2と、その一端に形成された試薬部13から構成されている。LDH測定用試験片10が、LDH測定用試験片1と異なるのは、試薬部13の構造及び製造方法である。
【0053】
すなわち、図2(b)に示されるように、試薬部13は試薬層4の上に、接着剤を介することなく、直接試料保持層5を積層して構成されている。試薬層4は、水溶性の材質を主体としており、その中に各試薬が分散している。
【0054】
実施の形態2においては、試薬層4が水溶性の材質を主体としたものであることから、試薬保持層5の底面または試薬層4の表面を純水で濡らして、試薬層4の表面に圧着して積層する。これによって、水溶性の材質の表面が溶解して、接着剤の役割を果たす。
【実施例】
【0055】
以下、本発明の実施例に係るLDH測定用試験片について、添付の図面を参照しつつ更に詳細に説明するが、本発明は以下の実施例の範囲に限定されるものではない。なお、以下の実施例において特に記載のないものについては市販の試薬を用いた。
【0056】
最初に、本発明の実施例に係るLDH測定用試験片を次のように作製した。
【0057】
まず、厚さ0.2mmの白色のポリエチレンテレフタレート(PET)シートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とした。
【0058】
次に、2mLの純水に、水溶性高分子化合物であるポリビニルピロリドン(PVP)を0.5mg溶解させた。この水溶液中に、乳酸リチウムを0.093mg、グリシン緩衝剤(pH9.4)を0.486mg、ジアホラーゼを0.029mg溶解させた。そして、十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層とした。なお、PVPとしては、(株)日本触媒のポリビニルピロリドンK−90を用いた。
【0059】
この試薬層の上に、布帛材を主体として構成した試料保持層を積層した。布帛材としては、KBセーレン(株)のザヴィーナ(登録商標)を用いた。4mLの純水に、β−NADを0.166mg、テトラゾリウムバイオレットを0.069mg、リン酸2水素ナトリウム(pH4.6)を0.003mg溶解させた。この水溶液を十分攪拌した後、脱泡して、全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、40℃で20分間乾燥して水分を蒸発させた。
【0060】
この試料保持層を、接着剤を用いて試薬層の上に接着して積層した。接着剤としては、アクリル系接着剤を用いて、試薬層の上に接着した。
【0061】
このように作製した実施例に係るLDH測定用試験片の試料保持層に、5μLのヒト血清を滴下した。そして、40℃で3分間放置した。その結果、テトラゾリウムバイオレットが色素に変化して、試薬層及び試料保持層が着色された。この着色を、アークレイ(株)のスポットケム(登録商標)EZで、550nmの可視光を用いて分析することによって、液状試料であるヒト血清中のLDH濃度を測定した。
【0062】
このLDH測定用試験片のLDH検出特性について、図4乃至図10を参照して説明する。
【0063】
(比較例)
なお、実施例のLDH測定用試験片との比較のために、比較例の試験片を作製した。すなわち、実施例と同様に、厚さ0.2mmの白色のPETシートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とし、この支持体の一端に、図3(b)に示されるように、試薬層14と試料保持層15を有する試薬部を形成した。試薬層14の寸法は、長さ7mm×幅5mm×厚さ0.1mmとした。試料保持層15の寸法は、長さ7mm×幅5mm×厚さ0.2mmとした。
【0064】
PVPの水溶液中に、乳酸リチウムを0.093mg、グリシン緩衝剤(pH9.4)を0.486mg、ジアホラーゼを0.029mg、β−NADを0.166mg溶解させた。そして、十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層14を形成した。
【0065】
また、純水に、テトラゾリウムバイオレットを0.069mg溶解させた。この水溶液の全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、乾燥して水分を蒸発させ、試料保持層15を作製した。図3(b)に示されるように、この試料保持層15を、アクリル系接着剤を用いて試薬層14の上に接着して積層した。
【0066】
図3(a)に示されるように、実施例においては、試薬層4に乳酸リチウム、塩基性緩衝剤(グリシン)、ジアホラーゼを配合した。また、試料保持層5にβ−NAD、テトラゾリウムバイオレット(2,5−ジフェニル−3−(1−ナフチル)−2H−テトラゾリウムクロリド)、酸性緩衝剤(リン酸2水素ナトリウム)を配合した。図3(b)に示されるように、比較例の試験片においては、β−NADを試料保持層15ではなく試薬層14に含有させた。すなわち、β−NADを、安定でない塩基性条件下に配置した。
【0067】
(感度直線性の評価)
まず、実施例のLDH測定用試験片及び比較例の試験片の感度直線性を評価するため、LDH濃度が48,114,193,826,1473(U/L)の5種類の液状試料(LDH水溶液)5μLを、各試験片の試料保持層に滴下して、着色度(K/S値)の変化量(Δ(K/S)/min)を測定した。その結果を、図4に示す。
【0068】
図4に示されるように、比較例の試験片においては、LDHが低濃度の場合(48,114,193(U/L))は、測定値がそれぞれ0.2563、0.2864、0.3018と、実施例に係る試験片と比較して高い値であった。一方、LDHが高濃度の場合(1473(U/L))は、測定値が0.6263と、実施例に係る試験片と比較して低い値であった。すなわち、実施例に係る試験片と比べて、比較例の試験片は感度直線性が劣っていた。
【0069】
これに対して、実施例においては、LDH濃度がゼロに近い場合は測定値もゼロに近い。具体的には、LDHが低濃度の場合(48,114,193(U/L))は、測定値もそれぞれ0.0219、0.0519、0.0901と低い値であった。一方、LDH濃度が高い場合(1473(U/L))は、測定値も0.8290と高い値であった。そして、図4に示されるように、各濃度の測定値を結んだ線は、原点を通過する直線に限りなく近くなっていた。このように、実施例のLDH測定用試験片は、優れた感度直線性を有していることが確認された。したがって、実施例のLDH測定用試験片では、LDH濃度が低い領域でも測定誤差が小さくなる。
【0070】
(バックグラウンド値の測定)
次に、生理食塩水5μLを、実施例の試料保持層5及び比較例の試料保持層15に滴下して、着色度の時間変化(反応タイムコース)を測定した。その結果を、図5に示す。図5に示されるように、比較例の試験片においては、試料がLDHを全く含まない生理食塩水であるにも関わらず、着色度(K/S値)が時間と共に大幅に増加していた。具体的には、滴下後60秒でK/S値=0.1798、滴下後120秒で0.3436、滴下後180秒で0.4751、滴下後240秒で0.5742となった。すなわち、比較例の試験片では、LDH濃度がゼロの場合のバックグラウンドが大きいことが確認された。
【0071】
これに対して、実施例に係る試験片においては、時間が経過してもK/S値は殆ど上昇しなかった。具体的には、滴下後60秒でK/S値=0.0071、滴下後120秒で0.0106、滴下後180秒で0.0144、滴下後240秒で0.0182となった。すなわち、実施例のLDH測定用試験片では、バックグラウンドが極めて小さいことが確認された。したがって、実施例に係る試験片では、精度の高いLDH濃度の測定が可能となる。
【0072】
次に、LDH測定用試験片の保存安定性をみるために、加速安定性の試験を行った。具体的には、実施例と比較例の試験片を40℃で7日間及び14日間保存したものについて、3種類のLDH濃度の試料についての測定値の初期値からの乖離度を測定した。ここで、初期値とは、作製後1日以内の試験片による測定値である。結果を、図6乃至図8に示す。
【0073】
図6に示されるように、低濃度(50U/L)の試料の場合、比較例の試験片では7日間保存したもので221%の乖離が起きており、14日間保存したものでも220%の乖離が起きていた。これに対して、実施例では7日間保存したもので9.8%、14日間保存したものでも10.3%の乖離が見られるに過ぎなかった。
【0074】
図7に示されるように、中濃度(117U/L)の試料の場合、比較例の試験片では7日間保存したもので135%の乖離が起きており、14日間保存したものでは逆に小さくなっているが、それでも46%の乖離が起きていた。これに対して、実施例では7日間保存したもので7.9%、14日間保存したものでも5.6%の乖離が見られるに過ぎなかった。
【0075】
図8に示されるように、高濃度(1460U/L)の試料の場合、比較例の試験片では7日間保存したもので64%の乖離が起きており、14日間保存したものでは75%の乖離が起きていた。これに対して、実施例では7日間保存したもので−10.5%、14日間保存したものでも−13.1%の乖離が見られるに過ぎなかった。
【0076】
このように、比較例の試験片では、40℃で7日間及び14日間保存した場合に、LDHの各濃度で、測定値の初期値からの大きな乖離が見られた。すなわち、比較例の試験片は、保存安定性が悪い。これに対して、実施例においては、40℃で7日間及び14日間保存した場合でも、測定値の初期値からの乖離は小さかった。これによって、実施例のLDH測定用試験片は、保存安定性に優れていることが明らかとなった。
【0077】
更に、保存安定性とバックグラウンドについて確認するために、作製直後の試験片及び40℃で7日間及び14日間保存したものについて、生理食塩水を測定した場合の反応タイムコースを取得した。結果を、図9及び図10に示す。
【0078】
図9に示されるように、比較例の試験片では、作製直後(0日間保存)のものでも高いバックグラウンドが認められた。40℃で7日間及び14日間保存したものでは、バックグラウンドが更に大きくなった。具体的には、反応開始から240秒後のK/S値が、作製直後の試験片では0.5742、7日間保存したものでは0.9235、14日間保存したものでは0.8768と高い値を示した。
【0079】
これに対して、図10に示されるように、実施例に係る試験片においては、作製後1日以内(0日間保存)のものでも、40℃で7日間及び14日間保存したものでも、バックグラウンドは殆ど検出されなかった。具体的には、反応開始から240秒後のK/S値が、作製直後の試験片では0.0182、7日間保存したものでは0.0240、14日間保存したものでは0.0276、と極めて低い値であった。
【0080】
このように、実施例のLDH測定用試験片では、バックグラウンドが殆ど認められず、保存安定性にも優れていることが実証された。
【0081】
以上説明したように、本実施例に係るLDH測定用試験片は、試薬層に乳酸リチウム、グリシン緩衝剤、ジアホラーゼが配合されている。また、試料保持層にβ−NAD、テトラゾリウムバイオレット、リン酸2水素ナトリウムが配合されている。
【0082】
これによって、β−NADがグリシン緩衝剤と異なる層に配置される。したがって、LDH測定用試験片の使用前に、β−NADが変質して、還元型補酵素(NADH)になることが防止された。この結果、LDH測定用試験片によるLDH濃度の測定時に、LDHに起因しないNADHの存在でバックグラウンドが大きくなることを回避できた。
【0083】
また、テトラゾリウムバイオレットがジアホラーゼと異なる層に配置されている。したがって、LDH測定用試験片の使用前に色素が殆ど形成されない。そして、LDH測定用試験片1は、かかる分離された構成を有するため、長期間の保存でも変化が小さいことが確認できた。
【0084】
このようにして、本実施例に係るLDH測定用試験片は、測定誤差が小さく、かつ保存安定性に優れている(経時変化が小さい)。
【0085】
なお、本発明は、本発明の広義の精神と範囲を逸脱することなく、様々な実施の形態及び変形が可能とされるものである。また、上述した各実施の形態及び実施例は、本発明を説明するためのものであり、本発明の範囲を限定するものではない。
【符号の説明】
【0086】
1,10 乳酸脱水素酵素測定用試験片(LDH測定用試験片)
2 支持体
3,13 試薬部
4 試薬層
5 試料保持層
6 接着剤
【技術分野】
【0001】
本発明は、乳酸脱水素酵素測定用試験片に関する。
【背景技術】
【0002】
血液、血清、血漿、尿等の液状試料を用いる乳酸脱水素酵素(LDH:Lactate DeHydrogenase)の定量分析には、従来、検出反応を試薬溶液中で実施する湿式法(ウェットケミストリー)が一般的に利用されてきた。しかし、湿式法を用いる場合には、試薬溶液を調製する手間がかかり、大型の装置を必要とするとともに、結果が得られるまでに長時間を要するという欠点があった。
【0003】
そこで、これらの欠点を解決する方法として、例えば特許文献1に示されるように、支持体の上に検出反応に関与する試薬組成物を含む試薬層が形成された試験片を用いる乾式法(ドライケミストリー)が実用化されている。この乾式法は、試験片の試薬層に液状試料を滴下して試薬と反応させるものである。反応後の試薬層を小型の光学分析装置で分析することによって、短時間で分析結果が得られる。
【0004】
乳酸脱水素酵素は、肝臓、赤血球、心筋及び骨格筋等に含まれる。肝臓病、溶血、心筋梗塞、悪性腫瘍及び癌等の場合には、血清または血漿中のLDH濃度が上昇する。このため、血清または血漿に含まれるLDHの定量分析は、臨床検査の中でも極めて重要である。
【0005】
LDHの定量分析は、一般的にはJSCC(日本臨床化学会)の勧告法に則って行われる(非特許文献1)。JSCC勧告法は湿式法であって、液体の緩衝液を用いる必要があり、かつ、分析波長が紫外領域(340nm)である。乾式法では固体の緩衝剤が用いられ、また可視光を照射してその反射光を測定することによって分析が行われることがより好ましい。したがって、JSCC勧告法を、そのまま乾式法に適用することは困難である。
【0006】
そこで、JSCC勧告法とは異なる測定原理に基づいて、乾式法でLDHの定量分析を行う技術が、特許文献2に開示されている。この技術においては、支持体上に試薬層及び多孔性展開層を有し、電子伝達剤であるジアホラーゼ、色素形成前駆物質、酸化型補酵素、緩衝剤及び還元試薬を含有する試験片(分析素子)が用いられる。この試験片に液状試料が滴下されると、液状試料中のLDHを触媒として、還元試薬である乳酸と酸化型補酵素が反応することによって補酵素が還元される。そして、電子伝達剤であるジアホラーゼが、生成する還元型補酵素によって還元される。更に、還元されたジアホラーゼが色素形成前駆物質を還元して、可視領域に吸収を有する色素を生成する。この色素の濃度を光学分析装置(比色法)で測定することによって、液状試料中のLDHの含有量が定量される。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開平11−000195号公報
【特許文献2】特開平05−176795号公報
【非特許文献】
【0008】
【非特許文献1】日本臨床化学会編、「ヒト血清中酵素活性測定の勧告法」、臨床化学、発行所:日本臨床化学会、発行日:1990年6月1日、第19巻第2号、228頁〜231頁
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、上記特許文献2に記載された試験片においては、ジアホラーゼと色素形成前駆物質が、試薬層または多孔性展開層のうち一方の層に共存している。このため、保存状態によっては、使用前にジアホラーゼが色素形成前駆物質に作用して色素が形成される恐れがある。このようなLDHに起因しない発色があると、液状試料の比色法による測定時に、この発色がバックグラウンドとなって測定誤差を生じる。特に、かかるバックグラウンドの存在によって、LDHの低濃度領域における測定誤差が大きくなり、感度直線性が損なわれる。
【0010】
また、上記特許文献2に記載された試験片においては、酸化型補酵素と緩衝剤をそれぞれどちらの層に含有させるかについても、全く考慮されていない。LDH測定の際には酵素反応を塩基性条件下で行う必要があるため、緩衝剤としては少なくとも塩基性緩衝剤が用いられる。この塩基性緩衝剤と酸化型補酵素とを同一の層に共存させると、使用前に酸化型補酵素の一部が還元型補酵素に変化して、やはりLDHに起因しない色素が生ずる。このため、長期間保存すると、測定誤差が一層大きくなる恐れがあるという問題点があった。
【0011】
本発明は、かかる問題点に鑑みてなされたものであって、測定誤差が小さく、かつ保存安定性に優れた乳酸脱水素酵素測定用試験片を提供することを目的とする。
【課題を解決するための手段】
【0012】
上記目的を達成するために、本発明に係る乳酸脱水素酵素測定用試験片は、
支持体と、
該支持体の上に設けられた試薬層と、
該試薬層の上に設けられた試料保持層と、
を有し、
前記試薬層は、乳酸またはその塩と塩基性緩衝剤と電子伝達剤とを含有し、
前記試料保持層は、酸化型補酵素と色素形成前駆物質とを含有することを特徴とする。
【0013】
好ましくは、前記試料保持層は、更に酸性緩衝剤を含有する。
【0014】
好ましくは、前記酸性緩衝剤は、水素イオン濃度指数(pH)がpH4〜6の範囲内である。
【0015】
好ましくは、前記酸化型補酵素は、酸化型ニコチンアミドアデニンジヌクレオチド(β−NAD)または酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )である。
【0016】
好ましくは、前記色素形成前駆物質は、テトラゾリウム塩である。
【0017】
好ましくは、前記塩基性緩衝剤は、グリシンまたはN−シクロヘキシル−2−アミノエタンスルホン酸である。
【0018】
好ましくは、前記電子伝達剤は、ジアホラーゼである。
【0019】
好ましくは、前記試薬層は、乳酸またはその塩と前記塩基性緩衝剤と前記電子伝達剤とを含有する水溶性高分子化合物からなる。
【0020】
好ましくは、前記試料保持層は、少なくとも前記酸化型補酵素と前記色素形成前駆物質を含有する布帛材からなる。
【0021】
好ましくは、前記試料保持層は、接着剤を介して前記試薬層の上に積層される。
【0022】
好ましくは、前記接着剤は、アクリル系高分子化合物である。
【発明の効果】
【0023】
本発明によれば、酸化型補酵素が塩基性緩衝剤と異なる層に配置されているので、乳酸脱水素酵素測定用試験片の使用前に、酸化型補酵素が還元型補酵素に変質することを抑制することができる。これによって、乳酸脱水素酵素測定用試験片による乳酸脱水素酵素濃度の測定時の測定誤差を低減することができる。そして、本発明に係る乳酸脱水素酵素測定用試験片は、かかる分離された配置を有するため、保存安定性にも優れている。
【0024】
また、色素形成前駆物質が電子伝達剤と異なる層に配置されているので、乳酸脱水素酵素測定用試験片の使用前に電子伝達剤が色素形成前駆物質に作用することによる色素の生成を抑制することができる。これによって、乳酸脱水素酵素測定用試験片による乳酸脱水素酵素濃度の測定時の測定誤差を低減することができる。そして、本発明に係る乳酸脱水素酵素測定用試験片は、かかる分離された配置を有するため、保存安定性にも優れている。
【図面の簡単な説明】
【0025】
【図1】(a)は本発明の実施の形態1に係る乳酸脱水素酵素測定用試験片の構成を示す斜視図、(b)は(a)のA−A縦断面図である。
【図2】(a)は本発明の実施の形態2に係る乳酸脱水素酵素測定用試験片の構成を示す斜視図、(b)は(a)のB−B縦断面図である。
【図3】(a)は本発明の実施例に係る乳酸脱水素酵素測定用試験片の試薬配置を示す模式図、(b)は比較例の試験片の試薬配置を示す模式図である。
【図4】本発明の実施例に係る乳酸脱水素酵素測定用試験片の感度直線性を、比較例の試験片と比較して示す図である。
【図5】本発明の実施例に係る乳酸脱水素酵素測定用試験片で生理食塩水を測定したときのタイムコースを、比較例の試験片と比較して示す図である。
【図6】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して低濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図7】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して中程度の濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図8】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して高濃度の乳酸脱水素酵素を測定したときの初期値からの乖離%を、比較例の試験片と比較して示す図である。
【図9】比較例の試験片を40℃で7日間及び14日間保存して生理食塩水を測定したときのタイムコースを示す図である。
【図10】本発明の実施例に係る乳酸脱水素酵素測定用試験片を40℃で7日間及び14日間保存して生理食塩水を測定したときのタイムコースを示す図である。
【発明を実施するための形態】
【0026】
[実施の形態1]
本発明の実施の形態1に係る乳酸脱水素酵素測定用試験片(以下、「LDH測定用試験片」とも言う。)は、図1(a)に示されるように、支持体としての細長い短冊形状片2と、その一端に形成された試薬部3から構成されている。図1(b)に示されるように、試薬部3は、支持体2の上に形成された試薬層4と試薬層4の上に形成された試料保持層5とを備える。
【0027】
支持体2としては、紙片、プラスチック(合成樹脂)片、金属片等を用いることができる。量産性・低コスト・保存性・耐水性等の観点からは、合成樹脂片を用いるのが好ましい。また、微量の液状試料による測定を可能にするため、支持体2は数mm〜1cm程度の幅の細長い片として、その先端に数mm×数mm程度の面積で試薬層4と試料保持層5を設けるのが好ましい。
【0028】
更に、支持体2は液体浸透性のないことが好ましい。これによって、本実施の形態1に係るLDH測定用試験片1を用いてLDHを測定する際、後述するように、試薬層4、試料保持層5に滴下される液状試料が試薬層4・試料保持層5内に留まるため、精度よく測定することができる。また、液状試料を滴下して検出反応を起こさせた後の光学的分析において、光を支持体側から照射する場合には、支持体2は光透過性を有する必要がある。これに対して、光を試料保持層5側から照射する場合には、光透過性は要求されない。
【0029】
支持体2の上には、まず試薬層4が形成される。試薬層4は、LDHの基質としての乳酸またはその塩、塩基性緩衝剤、電子伝達剤を含有する。
【0030】
試薬層4の上には、試料保持層5が形成される。このため、試薬層4に含有されるこれらの試薬は、上層に位置する試料保持層5に滴下された液状試料に取り込まれる必要がある。したがって、試薬層4は、液体浸透性を有する材質を主体として構成される必要がある。特に、水溶性の材質を主体として、その中にこれらの試薬が分散していることが好ましい。水溶性の材質としては、ポリビニルピロリドン(PVP)を始めとする水溶性高分子化合物等を用いることができる。また、液体浸透性を有する紙、編物、織物等の布帛材中に、これらの試薬が分散していてもよい。
【0031】
試料保持層5は、試薬層4の上に直接形成してもよく、液体浸透性を有する他の層を間に介して形成してもよい。
【0032】
試料保持層5には、酸化型補酵素及び色素形成前駆物質が含有される。酸化型補酵素としては、酸化型ニコチンアミドアデニンジヌクレオチド(β−NADまたはNAD+ と略称される)、酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )等を用いることが好ましい。
【0033】
また、色素形成前駆物質としては、例えば、テトラゾリウムバイオレット(2,5−ジフェニル−3−(1−ナフチル)−2H−テトラゾリウムクロリド)を始めとするテトラゾリウム塩を用いることができる。他にも、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス[2−(p−ニトロフェニル)−5−フェニルテトラゾリウムクロリド]、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス(2,5−ジフェニルテトラゾリウムクロリド)、3−(4,5−ジメチル−2−チアゾリル)−2,5−ジフェニルテトラゾリウムブロミド、3−(p−ヨードフェニル)−2−(p−ニトロフェニル)−5−フェニル−テトラゾリウムクロリド、2,2′,5,5′−テトラ−(p−ニトロフェニル)−3,3′−(3−ジメトキシ−4−ジフェニレン)−ジテトラゾリウムクロリド、2,3,5−トリフェニルテトラゾリウムクロリド、3,3′−(3,3′−ジメトキシ−4,4′−ビフェニレン)−ビス−[2,5−ビス(p−ニトロフェニル)テトラゾリウムクロリド]、3,3′−(4,4′−ビフェニレン)−ビス(2,5−ジフェニルテトラゾリウムクロリド)、等を用いることができる。しかし、色素形成前駆物質は、これらに限定されるものではない。
【0034】
更に、試料保持層5には、酸性緩衝剤が含有されることが好ましい。これによって、LDH測定用試験片1の使用前に、酸化型補酵素(β−NAD,NADP+ 等)が還元されて還元型(NADH,NADPH等)になるのを防止することができる。酸性緩衝剤としては、リン酸2水素ナトリウム、N−(2−アセトアミド)−アミノエタンスルホン酸、N−(2−アセトアミド)イミノジアセト酸、ビス(2−ヒドロキシエチル)イミノトリス(ヒドロキシメチル)メタン、2−モルフォリノエタンスルホン酸・一水和物、ピペラジン−1,4−ビス(2−エタンスルホン酸)等を用いることができる。特に、pHを4〜6の範囲内とする酸性緩衝剤を用いることが好ましい。これによって、pH4〜6の範囲内で最も安定なβ−NADを長期間保存できる。
【0035】
本実施の形態1に用いられる乳酸塩としては、特に、乳酸リチウム等の乳酸のアルカリ金属塩が好ましい。塩基性緩衝剤としては、グリシン、N,N−ビス(2−ヒドロキシエチル)グリシン、N−シクロヘキシル−3−アミノプロパンスルホン酸、N−シクロヘキシル−2−ヒドロキシ−3−アミノプロパンスルホン酸、N−シクロヘキシル−2−アミノエタンスルホン酸、3−[4−(2−ヒドロキシエチル)−1−ピペラジニル]エタンスルホン酸、N−トリス(ヒドロキシメチル)メチル−3−アミノプロパンスルホン酸、等を用いることができる。
【0036】
また、電子伝達剤としては、ジアホラーゼ、N−メチルフェナジン・メトサルフェート類(例えばN−メチルフェナジン・メトサルフェート、1−メトキシ−5−メチルフェナジン・メトサルフェート等)、メルドラブルー、メチレンブルー、等を用いることができる。
【0037】
試料保持層5においては、滴下された液状試料は迅速に拡散される必要がある。したがって、試料保持層5は、液体浸透性を有する材質を主体として構成される必要がある。特に、液体浸透性を有する紙、編物、織物等の布帛材中に、これらの試薬が分散していることが好ましい。
【0038】
本発明の実施の形態1に係るLDH測定用試験片1は、次のようにして作製することができる。
【0039】
まず、支持体2となる所定の材質の所定の厚さを有するシートを、所定の寸法を有する細長い片として切り出す。この細長い片を洗浄、乾燥することにより、支持体2が作製される。
【0040】
次に、試薬層4を作製する。まず、液体浸透性を有する材質に乳酸またはその塩、塩基性緩衝剤、電子伝達剤を分散させる。液体浸透性を有する材質が、水溶性高分子化合物等の水溶性の材質である場合には、純水に溶解させて水溶液として、この水溶液に上記各試薬を溶解させて攪拌することによって、分散させる。そして、支持体2の所定箇所に塗布し、乾燥して試薬層4とする。液体浸透性を有する材質が、紙、編物、織物等の布帛材の場合には、純水に上記各試薬を溶解させて攪拌した水溶液を、所定の寸法の布帛材に吸収させる。そして、乾燥して水分を除去して、試薬層4とする。
【0041】
このようにして作製した試薬層4を、支持体2に積層する。その方法としては、試薬層4が水溶性の材質を主体としたものである場合には、底面を純水で濡らして、支持体2の所定の位置に圧着する。これによって、底面の水溶性の材質が溶解して、接着剤としての役割を果たす。または、水溶性の材質をペースト状として、上述したように、支持体2の所定の位置に塗布して乾燥させる。
【0042】
更に、試薬層4の上に試料保持層5を積層する。試料保持層5は、液体浸透性を有する材質に、試薬層4の作製方法と同様にして、酸化型補酵素、色素形成前駆物質及び必要に応じて酸性緩衝剤を分散させて作製する。そして、接着剤6を用いて試薬層4の上に接着する。
【0043】
特に、試料保持層5が布帛材のように水溶性でない材質を主体としたものである場合には、接着剤を用いて、試薬層4の上に接着する。
【0044】
ここで、接着剤6によって形成される層は、液体浸透性を有する必要がある。したがって、接着剤6は、液体浸透性を有することが好ましい。または、接着剤6が、試薬層4の全面に塗布されるのではなく、液体浸透性を有するように塗布される。
【0045】
このようにして、本発明の実施の形態1に係るLDH測定用試験片1を作製することができる。
【0046】
本発明の実施の形態1に係るLDH測定用試験片1を用いたLDHの測定は、次のように行うことができる。
【0047】
予め定められた一定量の液状試料(血清または血漿)を、試料保持層5に滴下する。液状試料は、試料保持層5の全体に瞬時に拡散し、更にその下の試薬層4にも浸透して、全ての試薬を一体化させる。これによって、LDHの検出反応が開始され、LDHの量に応じて酸化型補酵素が還元される。生成した還元型補酵素によって、電子伝達剤を介して色素形成前駆物質が還元され、色素が生成する。
【0048】
生成した色素によって、試料保持層5及び試薬層4が着色される。この着色の度合い(K/S値)を、試料保持層5に可視光を照射して反射光を受光することによって算出する。K/S値は、着色の度合いを表す数値で、対象の着色の度合い(濃度)が高いほど反射光の強度も大きくなることを利用して算出される。すなわち、K/S値は、可視光の反射率をRとすると、下記の式で算出される。
(式) K/S=(1−R)2 /2R
【0049】
このような分析方法を応用した光学分析装置としては、例えば、富士フィルム(株)の富士ドライケム(登録商標)7000、コニカミノルタ(株)のコレステックLDX(登録商標)KM、アークレイ(株)のスポットケム(登録商標)EZ、等がある。
【0050】
このようにして得られたK/S値から、液状試料中の正確なLDH濃度を知ることができる。
【0051】
[実施の形態2]
次に、本発明の実施の形態2に係るLDH測定用試験片について、図2を参照して説明する。なお、上記実施の形態1に係るLDH測定用試験片1と同一の部分には同一の符号を付す。
【0052】
図2(a)に示されるように、実施の形態2に係るLDH測定用試験片10は、LDH測定用試験片1と同様に、支持体としての細長い短冊形状片2と、その一端に形成された試薬部13から構成されている。LDH測定用試験片10が、LDH測定用試験片1と異なるのは、試薬部13の構造及び製造方法である。
【0053】
すなわち、図2(b)に示されるように、試薬部13は試薬層4の上に、接着剤を介することなく、直接試料保持層5を積層して構成されている。試薬層4は、水溶性の材質を主体としており、その中に各試薬が分散している。
【0054】
実施の形態2においては、試薬層4が水溶性の材質を主体としたものであることから、試薬保持層5の底面または試薬層4の表面を純水で濡らして、試薬層4の表面に圧着して積層する。これによって、水溶性の材質の表面が溶解して、接着剤の役割を果たす。
【実施例】
【0055】
以下、本発明の実施例に係るLDH測定用試験片について、添付の図面を参照しつつ更に詳細に説明するが、本発明は以下の実施例の範囲に限定されるものではない。なお、以下の実施例において特に記載のないものについては市販の試薬を用いた。
【0056】
最初に、本発明の実施例に係るLDH測定用試験片を次のように作製した。
【0057】
まず、厚さ0.2mmの白色のポリエチレンテレフタレート(PET)シートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とした。
【0058】
次に、2mLの純水に、水溶性高分子化合物であるポリビニルピロリドン(PVP)を0.5mg溶解させた。この水溶液中に、乳酸リチウムを0.093mg、グリシン緩衝剤(pH9.4)を0.486mg、ジアホラーゼを0.029mg溶解させた。そして、十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層とした。なお、PVPとしては、(株)日本触媒のポリビニルピロリドンK−90を用いた。
【0059】
この試薬層の上に、布帛材を主体として構成した試料保持層を積層した。布帛材としては、KBセーレン(株)のザヴィーナ(登録商標)を用いた。4mLの純水に、β−NADを0.166mg、テトラゾリウムバイオレットを0.069mg、リン酸2水素ナトリウム(pH4.6)を0.003mg溶解させた。この水溶液を十分攪拌した後、脱泡して、全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、40℃で20分間乾燥して水分を蒸発させた。
【0060】
この試料保持層を、接着剤を用いて試薬層の上に接着して積層した。接着剤としては、アクリル系接着剤を用いて、試薬層の上に接着した。
【0061】
このように作製した実施例に係るLDH測定用試験片の試料保持層に、5μLのヒト血清を滴下した。そして、40℃で3分間放置した。その結果、テトラゾリウムバイオレットが色素に変化して、試薬層及び試料保持層が着色された。この着色を、アークレイ(株)のスポットケム(登録商標)EZで、550nmの可視光を用いて分析することによって、液状試料であるヒト血清中のLDH濃度を測定した。
【0062】
このLDH測定用試験片のLDH検出特性について、図4乃至図10を参照して説明する。
【0063】
(比較例)
なお、実施例のLDH測定用試験片との比較のために、比較例の試験片を作製した。すなわち、実施例と同様に、厚さ0.2mmの白色のPETシートから、長さ70mm×幅5mmの寸法の細長い片を切り出して支持体とし、この支持体の一端に、図3(b)に示されるように、試薬層14と試料保持層15を有する試薬部を形成した。試薬層14の寸法は、長さ7mm×幅5mm×厚さ0.1mmとした。試料保持層15の寸法は、長さ7mm×幅5mm×厚さ0.2mmとした。
【0064】
PVPの水溶液中に、乳酸リチウムを0.093mg、グリシン緩衝剤(pH9.4)を0.486mg、ジアホラーゼを0.029mg、β−NADを0.166mg溶解させた。そして、十分攪拌した後、脱泡して、その全量を支持体の一端に、長さ7mm×幅5mm×厚さ0.1mmの寸法になるように塗布した。その後、40℃で20分間乾燥させて、水分を完全に蒸発させて、フィルム状の試薬層14を形成した。
【0065】
また、純水に、テトラゾリウムバイオレットを0.069mg溶解させた。この水溶液の全量を、長さ7mm×幅5mm×厚さ0.2mmのザヴィーナに染み込ませた。そして、乾燥して水分を蒸発させ、試料保持層15を作製した。図3(b)に示されるように、この試料保持層15を、アクリル系接着剤を用いて試薬層14の上に接着して積層した。
【0066】
図3(a)に示されるように、実施例においては、試薬層4に乳酸リチウム、塩基性緩衝剤(グリシン)、ジアホラーゼを配合した。また、試料保持層5にβ−NAD、テトラゾリウムバイオレット(2,5−ジフェニル−3−(1−ナフチル)−2H−テトラゾリウムクロリド)、酸性緩衝剤(リン酸2水素ナトリウム)を配合した。図3(b)に示されるように、比較例の試験片においては、β−NADを試料保持層15ではなく試薬層14に含有させた。すなわち、β−NADを、安定でない塩基性条件下に配置した。
【0067】
(感度直線性の評価)
まず、実施例のLDH測定用試験片及び比較例の試験片の感度直線性を評価するため、LDH濃度が48,114,193,826,1473(U/L)の5種類の液状試料(LDH水溶液)5μLを、各試験片の試料保持層に滴下して、着色度(K/S値)の変化量(Δ(K/S)/min)を測定した。その結果を、図4に示す。
【0068】
図4に示されるように、比較例の試験片においては、LDHが低濃度の場合(48,114,193(U/L))は、測定値がそれぞれ0.2563、0.2864、0.3018と、実施例に係る試験片と比較して高い値であった。一方、LDHが高濃度の場合(1473(U/L))は、測定値が0.6263と、実施例に係る試験片と比較して低い値であった。すなわち、実施例に係る試験片と比べて、比較例の試験片は感度直線性が劣っていた。
【0069】
これに対して、実施例においては、LDH濃度がゼロに近い場合は測定値もゼロに近い。具体的には、LDHが低濃度の場合(48,114,193(U/L))は、測定値もそれぞれ0.0219、0.0519、0.0901と低い値であった。一方、LDH濃度が高い場合(1473(U/L))は、測定値も0.8290と高い値であった。そして、図4に示されるように、各濃度の測定値を結んだ線は、原点を通過する直線に限りなく近くなっていた。このように、実施例のLDH測定用試験片は、優れた感度直線性を有していることが確認された。したがって、実施例のLDH測定用試験片では、LDH濃度が低い領域でも測定誤差が小さくなる。
【0070】
(バックグラウンド値の測定)
次に、生理食塩水5μLを、実施例の試料保持層5及び比較例の試料保持層15に滴下して、着色度の時間変化(反応タイムコース)を測定した。その結果を、図5に示す。図5に示されるように、比較例の試験片においては、試料がLDHを全く含まない生理食塩水であるにも関わらず、着色度(K/S値)が時間と共に大幅に増加していた。具体的には、滴下後60秒でK/S値=0.1798、滴下後120秒で0.3436、滴下後180秒で0.4751、滴下後240秒で0.5742となった。すなわち、比較例の試験片では、LDH濃度がゼロの場合のバックグラウンドが大きいことが確認された。
【0071】
これに対して、実施例に係る試験片においては、時間が経過してもK/S値は殆ど上昇しなかった。具体的には、滴下後60秒でK/S値=0.0071、滴下後120秒で0.0106、滴下後180秒で0.0144、滴下後240秒で0.0182となった。すなわち、実施例のLDH測定用試験片では、バックグラウンドが極めて小さいことが確認された。したがって、実施例に係る試験片では、精度の高いLDH濃度の測定が可能となる。
【0072】
次に、LDH測定用試験片の保存安定性をみるために、加速安定性の試験を行った。具体的には、実施例と比較例の試験片を40℃で7日間及び14日間保存したものについて、3種類のLDH濃度の試料についての測定値の初期値からの乖離度を測定した。ここで、初期値とは、作製後1日以内の試験片による測定値である。結果を、図6乃至図8に示す。
【0073】
図6に示されるように、低濃度(50U/L)の試料の場合、比較例の試験片では7日間保存したもので221%の乖離が起きており、14日間保存したものでも220%の乖離が起きていた。これに対して、実施例では7日間保存したもので9.8%、14日間保存したものでも10.3%の乖離が見られるに過ぎなかった。
【0074】
図7に示されるように、中濃度(117U/L)の試料の場合、比較例の試験片では7日間保存したもので135%の乖離が起きており、14日間保存したものでは逆に小さくなっているが、それでも46%の乖離が起きていた。これに対して、実施例では7日間保存したもので7.9%、14日間保存したものでも5.6%の乖離が見られるに過ぎなかった。
【0075】
図8に示されるように、高濃度(1460U/L)の試料の場合、比較例の試験片では7日間保存したもので64%の乖離が起きており、14日間保存したものでは75%の乖離が起きていた。これに対して、実施例では7日間保存したもので−10.5%、14日間保存したものでも−13.1%の乖離が見られるに過ぎなかった。
【0076】
このように、比較例の試験片では、40℃で7日間及び14日間保存した場合に、LDHの各濃度で、測定値の初期値からの大きな乖離が見られた。すなわち、比較例の試験片は、保存安定性が悪い。これに対して、実施例においては、40℃で7日間及び14日間保存した場合でも、測定値の初期値からの乖離は小さかった。これによって、実施例のLDH測定用試験片は、保存安定性に優れていることが明らかとなった。
【0077】
更に、保存安定性とバックグラウンドについて確認するために、作製直後の試験片及び40℃で7日間及び14日間保存したものについて、生理食塩水を測定した場合の反応タイムコースを取得した。結果を、図9及び図10に示す。
【0078】
図9に示されるように、比較例の試験片では、作製直後(0日間保存)のものでも高いバックグラウンドが認められた。40℃で7日間及び14日間保存したものでは、バックグラウンドが更に大きくなった。具体的には、反応開始から240秒後のK/S値が、作製直後の試験片では0.5742、7日間保存したものでは0.9235、14日間保存したものでは0.8768と高い値を示した。
【0079】
これに対して、図10に示されるように、実施例に係る試験片においては、作製後1日以内(0日間保存)のものでも、40℃で7日間及び14日間保存したものでも、バックグラウンドは殆ど検出されなかった。具体的には、反応開始から240秒後のK/S値が、作製直後の試験片では0.0182、7日間保存したものでは0.0240、14日間保存したものでは0.0276、と極めて低い値であった。
【0080】
このように、実施例のLDH測定用試験片では、バックグラウンドが殆ど認められず、保存安定性にも優れていることが実証された。
【0081】
以上説明したように、本実施例に係るLDH測定用試験片は、試薬層に乳酸リチウム、グリシン緩衝剤、ジアホラーゼが配合されている。また、試料保持層にβ−NAD、テトラゾリウムバイオレット、リン酸2水素ナトリウムが配合されている。
【0082】
これによって、β−NADがグリシン緩衝剤と異なる層に配置される。したがって、LDH測定用試験片の使用前に、β−NADが変質して、還元型補酵素(NADH)になることが防止された。この結果、LDH測定用試験片によるLDH濃度の測定時に、LDHに起因しないNADHの存在でバックグラウンドが大きくなることを回避できた。
【0083】
また、テトラゾリウムバイオレットがジアホラーゼと異なる層に配置されている。したがって、LDH測定用試験片の使用前に色素が殆ど形成されない。そして、LDH測定用試験片1は、かかる分離された構成を有するため、長期間の保存でも変化が小さいことが確認できた。
【0084】
このようにして、本実施例に係るLDH測定用試験片は、測定誤差が小さく、かつ保存安定性に優れている(経時変化が小さい)。
【0085】
なお、本発明は、本発明の広義の精神と範囲を逸脱することなく、様々な実施の形態及び変形が可能とされるものである。また、上述した各実施の形態及び実施例は、本発明を説明するためのものであり、本発明の範囲を限定するものではない。
【符号の説明】
【0086】
1,10 乳酸脱水素酵素測定用試験片(LDH測定用試験片)
2 支持体
3,13 試薬部
4 試薬層
5 試料保持層
6 接着剤
【特許請求の範囲】
【請求項1】
支持体と、
該支持体の上に設けられた試薬層と、
該試薬層の上に設けられた試料保持層と、
を有し、
前記試薬層は、乳酸またはその塩と塩基性緩衝剤と電子伝達剤とを含有し、
前記試料保持層は、酸化型補酵素と色素形成前駆物質とを含有することを特徴とする乳酸脱水素酵素測定用試験片。
【請求項2】
前記試料保持層は、更に酸性緩衝剤を含有することを特徴とする請求項1に記載の乳酸脱水素酵素測定用試験片。
【請求項3】
前記酸性緩衝剤は、水素イオン濃度指数(pH)がpH4〜6の範囲内であることを特徴とする請求項2に記載の乳酸脱水素酵素測定用試験片。
【請求項4】
前記酸化型補酵素は、酸化型ニコチンアミドアデニンジヌクレオチド(β−NAD)または酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )であることを特徴とする請求項1乃至3のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項5】
前記色素形成前駆物質は、テトラゾリウム塩であることを特徴とする請求項1乃至4のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項6】
前記塩基性緩衝剤は、グリシンまたはN−シクロヘキシル−2−アミノエタンスルホン酸であることを特徴とする請求項1乃至5のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項7】
前記電子伝達剤は、ジアホラーゼであることを特徴とする請求項1乃至6のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項8】
前記試薬層は、乳酸またはその塩と前記塩基性緩衝剤と前記電子伝達剤とを含有する水溶性高分子化合物からなることを特徴とする請求項1乃至7のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項9】
前記試料保持層は、少なくとも前記酸化型補酵素と前記色素形成前駆物質を含有する布帛材からなることを特徴とする請求項1乃至8のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項10】
前記試料保持層は、接着剤を介して前記試薬層の上に積層されることを特徴とする請求項1乃至9のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項11】
前記接着剤は、アクリル系高分子化合物であることを特徴とする請求項10に記載の乳酸脱水素酵素測定用試験片。
【請求項1】
支持体と、
該支持体の上に設けられた試薬層と、
該試薬層の上に設けられた試料保持層と、
を有し、
前記試薬層は、乳酸またはその塩と塩基性緩衝剤と電子伝達剤とを含有し、
前記試料保持層は、酸化型補酵素と色素形成前駆物質とを含有することを特徴とする乳酸脱水素酵素測定用試験片。
【請求項2】
前記試料保持層は、更に酸性緩衝剤を含有することを特徴とする請求項1に記載の乳酸脱水素酵素測定用試験片。
【請求項3】
前記酸性緩衝剤は、水素イオン濃度指数(pH)がpH4〜6の範囲内であることを特徴とする請求項2に記載の乳酸脱水素酵素測定用試験片。
【請求項4】
前記酸化型補酵素は、酸化型ニコチンアミドアデニンジヌクレオチド(β−NAD)または酸化型ニコチンアミドアデニンジヌクレオチドリン酸(NADP+ )であることを特徴とする請求項1乃至3のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項5】
前記色素形成前駆物質は、テトラゾリウム塩であることを特徴とする請求項1乃至4のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項6】
前記塩基性緩衝剤は、グリシンまたはN−シクロヘキシル−2−アミノエタンスルホン酸であることを特徴とする請求項1乃至5のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項7】
前記電子伝達剤は、ジアホラーゼであることを特徴とする請求項1乃至6のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項8】
前記試薬層は、乳酸またはその塩と前記塩基性緩衝剤と前記電子伝達剤とを含有する水溶性高分子化合物からなることを特徴とする請求項1乃至7のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項9】
前記試料保持層は、少なくとも前記酸化型補酵素と前記色素形成前駆物質を含有する布帛材からなることを特徴とする請求項1乃至8のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項10】
前記試料保持層は、接着剤を介して前記試薬層の上に積層されることを特徴とする請求項1乃至9のいずれか1項に記載の乳酸脱水素酵素測定用試験片。
【請求項11】
前記接着剤は、アクリル系高分子化合物であることを特徴とする請求項10に記載の乳酸脱水素酵素測定用試験片。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【公開番号】特開2012−231737(P2012−231737A)
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願番号】特願2011−102425(P2011−102425)
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
【公開日】平成24年11月29日(2012.11.29)
【国際特許分類】
【出願日】平成23年4月28日(2011.4.28)
【出願人】(000141897)アークレイ株式会社 (288)
【Fターム(参考)】
[ Back to top ]

