事前算出フィードフォワード制御と画像フィードバック制御とを介して細胞に対する制御を自動化し殲滅することで標的へエネルギを供給するようにしたフォトン利用の非侵襲的外科手術システム
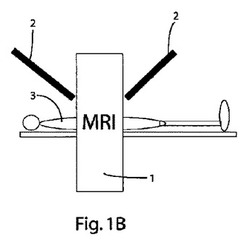
フォトン利用の非侵襲的外科手術システムであり、MRI装置などの画像形成装置と、少なくとも2つのビーム発生器とを備えており、それらビーム発生器は、処置対象者の体内の標的にエネルギを供給するための複数本のエネルギビームを発生し、それら複数本のエネルギビームが1箇所で交差するようにしてある。このシステムは更に、複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出するフィードフォワード制御手段と、前記画像形成装置により収集される情報を取得して利用するフィードバック制御手段とを備えている。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願の言及: 本願は、米国仮特許出願第60/976699号(2007年10月1日付けで米国特許庁に出願)、米国仮特許出願第60/982542号(2007年10月15日付けで米国特許庁に出願)、及び米国仮特許出願第61/021941号(200位年1月18日付けで米国特許庁に出願)に基づく優先権を主張するものであり、また更に、米国仮特許出願第60/954364号(2007年8月7日付け出願)の開示内容を包含するものである。
【0002】
連邦主催の研究又は開発に関する言明: 本願は、2008年8月5日付け研究補助金交付申請書により米国国立衛生研究所に研究助成金の交付を申請し、交付決定第00499945号により研究助成金(CFDA検索番号第93.394号)の交付を受けた研究の主題に関するものである。尚、同研究補助金交付申請書の開示内容はこの言及をもって本願開示に組込まれたものとする。
【0003】
共同研究契約者の名前: 第三者との間で締結された共同研究契約などは一切存在していない。
【発明の概要】
【発明が解決しようとする課題】
【0004】
MRI装置とビーム発生器とを用いた癌治療システムが公知となっている。しかしながら、在来のその種の癌治療システムの多くは、治療対象の癌組織の周囲に存在する健康な組織にもダメージを及ぼすものであった。本願に記載するシステムは、在来の癌治療システムを改良して、特に、癌組織の周囲領域に存在する健康な組織に及ぼすダメージを極力低減しつつ、標的組織をより確実に死滅させることを目的とするものである。
【課題を解決するための手段】
【0005】
本発明の1つの実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。そして、前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して機能するようにしてある。
【0006】
本発明の別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームはビーム径路に沿って進行して処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また更に、前記複数本のエネルギビームは、前記ビーム径路に沿って進行して互いに異なる種類のエネルギを供給するためのビームである。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。
【0007】
本発明の更に別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。また、このシステムは前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている。
【0008】
本発明の更に別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものである。このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも1つのビーム発生器を備えており、該ビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。少なくとも1つのビーム発生器は、該ビーム発生器から射出するエネルギビームに処理を施すためのビームプロセッサを備えている。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムは更にフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。また、このシステムは前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている。
【図面の簡単な説明】
【0009】
【図1A】MRI装置の正面図である。
【図1B】MRI装置の側面図である。
【図2】本発明の1つの実施の形態の特徴を示したシステムブロック図である。
【図3A】ビーム発生器を示すと共に、ビームが皮膚表面に入射するときのビームの偏向(屈折)を示した図である。
【図3B】ビームの入射角、屈折角、及び散乱角を示した拡大図である。
【図4】ビーム発生器を示すと共に、ビームが処置対象者の皮膚、骨、及び腱を通過して標的細胞に達するときのビームの屈折を示した図である。
【図5】本発明の実施の形態において4通りのエネルギビームを用いるときの、エネルギ量、エネルギ勾配、エネルギ吸収率、及び細胞死率の、4つのパラメータの値を示したグラフである。
【図6】3次元空間における4本の電磁波ビームを示した図である。
【図7A】3本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7B】3本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7C】6本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7D】6本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図8A】互いに位相の揃った2つの電磁波を示した図である。
【図8B】互いに位相の異なる2つの電磁波を示した図である。
【図9A】2本のビームが交差したビーム交差部の形状を示した図である。
【図9B】2本のビームが交差したビーム交差部の形状を示した図である。
【図9C】2本のビームが交差したビーム交差部の形状を示した図である。
【図9D】3本のビームが交差したビーム交差部の形状を示した図である。
【図10】電磁波を示した図である。
【図11】3本の効力曲線を示したグラフであり、それら効力曲線は夫々、エネルギビームを3本使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力(曲線A)、エネルギビームを1本だけ使用し細胞内小器官にナノ粒子を付着させるようにした本発明の本発明の実施の形態の効力(曲線B)、それに、従来の放射線治療の効力(曲線C)を表したものである。
【図12】MRI装置またはCT装置から成る画像スキャナを第1レベルに設置し、それより低位のレベルに3台のビーム発生器を設置した、本発明の二階建型の実施の形態を示した図である。
【図13】ビーム発生器におけるX線ビームを示した図である。
【図14】本発明の実施の形態における制御シーケンスにおける時系列に従った6つの画像フレームのうちの1つを示した図である。この制御シーケンスは、ビーム発生器を標的に対して初期照準合わせしたときの誤差に対処するために、フィードフォワード制御とともにフィードバック誤差信号の値に基づいてエネルギビームの位置を調節し、最終的にエネルギビームの位置を標的領域に収束させるものであり、エネルギビームの位置が収束したならば、エネルギビームのパルスを発射して標的細胞を破壊する。
【図15】図14に示した画像フレームに続く次の画像フレームを示した図である。
【図16】図15に示した画像フレームに続く次の画像フレームを示した図である。
【図17】図16に示した画像フレームに続く次の画像フレームを示した図である。
【図18】図17に示した画像フレームに続く次の画像フレームを示した図である。
【図19】図18に示した画像フレームに続く次の画像フレームを示した図である。
【図20】ビームスプリッタと照準合わせ機構とを組合せた複合機構(ビームプロセッサ)の実施の形態を示した図であり、図中、ミラー遮蔽洞、前方ミラー群と、導波管集合体とはビームスプリッタの構成要素であり、後部ミラー群は照準合わせ機構である。
【発明を実施するための形態】
【0010】
本願明細書に記載する本発明の様々な実施の形態はいずれも、癌細胞などの特定の細胞を標的として、或いは、癌細胞と非癌細胞とを含む細胞群を標的として、その標的に放射線などのエネルギを供給するシステムを提供するものである。また、それら実施の形態の説明では、周囲の組織に全く或いは最小限度のダメージしか及ぼさずに特定の細胞または細胞群にエネルギを供給することのできる、それら実施の形態に組込まれた方法及びエネルギ供給システムについても説明する。
【0011】
本願明細書に記載する技術は、それ自体が新機軸を成す技術であるのみならず、更に、他の様々な技術と組合せることのできる技術でもあり、組合せることのできる技術としては、例えば、画像形成技術、放射線技術、マイクロ波技術、超音波技術、レーザ技術、ロボット技術、及びその他の様々な技術がある。本発明の実施の形態は、様々な技術の主題を含むものであり、それら技術としては、例えば、標的捕捉技術、制御技術、エネルギ供給方式技術、エネルギ供給機構技術、それにシステム統合技術などがある。
【0012】
本発明に係る技術の利点を享受し得る分野はヘルスケアのみに限られず、その他の様々な分野にまで及んでいる。しかしながら、本発明の初期の目的はヘルスケア関連用途である。例えば、本明細書に記載するように、本発明を用いることにより、外科的処置をなんら必要とすることなく、体内のあらゆる部位の癌細胞を殲滅することが可能である。この癌細胞の除去処置は、腫瘍を形成している癌細胞に対して適用される他に、全身に広がった転移癌の癌細胞に対しても適用される。この技術が更に発展することによって、いずれは、体内からウイルスを駆逐することや、細菌感染を除去することも可能となるであろう。更に、B型肝炎やエイズなどの疾病も治療可能となるかもしれない。その他の可能性のある用途としては、前立腺細胞などの特定臓器の細胞だけを選択的に除去するという用途などがある。臓器の縮小、臓器の機能改善、それに医療上または美容上の理由による脂肪細胞の破壊なども、可能性のある用途である。更には、血行の改善や関節可動域の拡大などのために、非細胞組織の破壊または解放の処置を施すために利用することも可能であると思われる。
【0013】
材料学−分析、試験、及び補修:材料学の分野では、X線を使用して、材料の分析、試験、及び補修が行われている。本発明を用いることで利用可能な、高エネルギのX線ビーム交差部と、高精度の照準合わせとは、この分野において大きな価値を持ち得るものである。本発明は、顕微鏡レベルで、問題発生箇所にピンポイントで照準を合わせ、その問題発生箇所に対処するための処置を実行し得るものである。
【0014】
研究室用途−化学分析及び結晶分析:化学物質ないし結晶の分析の仕事をしている科学者にとって、本発明の技術は、研究計画の進行速度を速めるものであり、また、本発明の技術を用いなければ収集できないデータの収集を可能にするものである。この分野においても、本発明のビーム交差部の寸法が小さいこと、並びに、そのビーム交差部の位置制御が高精度で行えることは、それらの仕事を行うための他の手段と比べて、利点となるものと予期される。
【0015】
有害ないし不要な細胞の殲滅は、その周囲の細胞の機能を改善することができる。それゆえここに記載する方法及びシステムは、細胞の機能を制御ないし改善するためにも利用可能である。その種の用途のうちには、低強度のエネルギを標的箇所へ供給して細胞を刺激し、或いは細胞治療を行うというものがある。また細胞治療のうちには、細胞膜の薄膜化、細胞移動、不要細胞内物質の分解または破壊、不要細胞外物質または不要非細胞物質の分解または破壊、それに細胞内小器官の刺激などがあり、それらのうちには高調波を利用して行われるものもある。
【0016】
本発明と放射線治療との比較:本発明は、X線を使用するようにした場合であっても、放射線治療とは以下の5つの点において大きく異なるものとなる。第1に、本発明では、細胞死に至らせる方法が異なる。第2に、本発明では、エネルギ量を増大させる際にフォトン1個あたりのエネルギを増大させるのではなく、1秒間あたりのフォトンの個数を増大させる。第3に、本発明では、細胞に本来備わっている機構を巧みに利用するため、処置を1回実施するだけで速やかに細胞死に至らせることができる。第4に、本発明では、供給するエネルギ総量が小さく、フォトン1個あたりのエネルギも小さいため、DNAには殆どダメージを及ぼさない。第5に、放射線治療における標的選択メカニズムが生物学的であり、内部的であり、制御不可能であり、不確実なものであるのに対して、本発明における標的選択メカニズムは機械的であり、外部的であり、制御可能である。
【0017】
放射線治療は、多数の遊離ラジカルを発生させるようにしたものであり、それら遊離ラジカルによって、DNA二重螺旋鎖に二重鎖切断が引き起こされる。ヒトの身体にはこの種の細胞損傷を修復するための修復機構が組込まれている。そのため、放射線治療においては、その修復機構を圧倒できるように、多数の二重鎖切断を引き起こさなければならない。放射線治療を実施するごとに、ヒトの身体の損傷を修復しようとする能力が高まり、そのため、放射線治療を反復して実施していると、次第に治療の効果が低下して行く。
【0018】
本発明は、極めて短時間のうちに(所与の細胞に対して数ミリ秒以内の処置を施すだけで)細胞内プロセスを崩壊させ、細胞内膜を破壊することにより、細胞を死に至らせるものである。細胞内プロセスの崩壊や細胞内膜の破壊が行われると直ちに、細胞のアポトーシスや自己消化のプロセスが開始される。放射線治療の場合でも、その治療により死ぬ細胞は最終的にアポトーシスが発生することで細胞死に至っている。しかしながら、放射線治療の場合には、あくまでも、所与の細胞が死ぬ確率を増大させているに過ぎず、更に、放射線治療を施してから細胞が死ぬまでに数日かかることもあり、場合によっては数週間かかることすらある。これほどの時間がかかるのは、放射線治療の作用を受けるという事象から始まって、細胞のアポトーシスが発生するという事象に至るまでの間には、非常に長い事象の連鎖が存在しているからであり、これに対して、本発明の事象の連鎖は非常に短い。この事象の連鎖が長くなるほど、実際に細胞のアポトーシスの発生という結果に至ることが不確実なものとなる。
【0019】
本発明では、複数本のエネルギビームを用いて、体積の小さな標的空間に多量のエネルギを供給する。そして、各々のエネルギビームが、ビーム交差部において、さらなるエネルギをもたらす。ビーム交差部における合計の電子ボルト(エネルギ)は、それら複数本のエネルギビームによって制御され、このことは、個々のフォトンの電子ボルトを増大させることでエネルギを制御している放射線治療と異なる点である。この相違点は重要であり、なぜならば、本発明はこれによって、a)より早く吸収されやすいフォトンエネルギを利用することと、b)処置対象者の体内に供給するエネルギの総量を低下させることとが可能となっているからである。
【0020】
標的へ流入するエネルギのピークの絶対値は本発明と放射線治療と同様であるが、そのエネルギの形態が異なっている。本発明におけるエネルギの形態は、低エネルギのフォトンを大量に使用するものであり、これに対して、放射線治療におけるエネルギの形態は、高エネルギのフォトンを小量使用するものである。
【0021】
本発明では、ビーム交差部に大きなエネルギを供給することによって、細胞を焼灼することなく、細胞膜や細胞内小器官を破壊し得る程度の化学的及び生理学的な崩壊を引き起こすようにしている。この化学的及び生理学的な崩壊は、ビーム交差部において大量のフォトンが低エネルギの反応である減衰反応を発生することによって引き起こされるものである。放射線治療は、より高いエネルギ領域の反応であるコンプトン反応に大きく依存しており、DNA鎖を切断することのできる遊離ラジカルをコンプトン反応によって大量に発生させるものである。
【0022】
本発明は、ビーム交差部及び/またはナノ技術を利用して、標的細胞を非標的細胞から区別する選択性を確保している。本発明のアーキテクチャに用いられているコンピュータ及びマニピュレータは、ビーム交差部における選択性を制御することができる。また、ナノ粒子にモノクローナル抗体などの標的化分子を付着させることによって、本発明に二次的な選択性を付与することができる。ナノ粒子に標的化分子を付着させることによって、そのナノ粒子を特定の種類の細胞により高い密度で蓄積させることができる。より具体的には、この方法によれば、例えば癌細胞を標的化することができる。ナノ粒子を使用することで、本発明を用いて細胞死を惹起するために必要なエネルギ量を大幅に低減することができるため、本発明を実施する際の出力エネルギのエネルギレベルを引き下げて、細胞に蓄積したナノ粒子の密度が標的細胞であることを示すスレショルド密度以上になっている領域で複数本のエネルギビームが互いに交差した場合にのみ、細胞死が惹起されるようにすることができる。この方法を採用することによって、本発明の標的特定の能力が倍増する。なぜならば、細胞に蓄積したナノ粒子の密度がスレショルド密度より低いか、または細胞の位置にビーム交差部の位置が一致していないかの、何れかが該当していれば不発モードとなり、その細胞に対しては何も行われないからである。この選択性の高さは、処置を施す対象領域が、例えば神経細胞などのようなエネルギビームの影響を受けやすい組織に近接している場合に、特に重要なものである。
【0023】
放射線治療では、破壊する細胞を選択するために、細胞分裂サイクルを利用している。細胞は、細胞複製過程のある特定の段階で、そのDNA鎖が特に切断され易くなる。癌細胞は、細胞複製のためにより長い時間を費やすことから、放射線治療の影響をより大きく受けることになる。ただしこれは、正常細胞より癌細胞の方が、放射線治療の影響を受ける状態にある確率が高いというだけのことである。実際には、正常細胞であっても放射線治療が実施されたときに細胞分裂過程にあった細胞は殺され、一方、癌細胞であっても放射線治療が実施されたときに細胞分裂過程になかった細胞は、その放射線治療の影響をあまり受けずに済む。このことが、放射線治療を反復して実施する理由でもあり、また、放射線治療では全ての癌細胞を殺せないことが少なくないことの原因でもある。放射線治療では、たとえ標的細胞がどれほど少なくとも、それら標的細胞の全てを確実に死滅させることのできる方法は存在していない。またそれと表裏一体を成す事実として、放射線治療において照射される放射線ビームの経路上にある健康細胞が絶対に殺されずに済むような方法も存在していない。
【0024】
本発明でも、健康な細胞を殺してしまう可能性はあるが、ただし、その確率は放射線治療と比べればはるかに小さい。実際に、本発明によって健康な細胞にダメージを与えてしまう確率は、診断用X線によって健康な細胞にダメージを与えてしまう確率以上のものではない(場合によっては本発明の方がその確率がはるかに小さい)。
【0025】
二次癌を発生させる確率も、本発明より放射線治療の方がはるかに大きい。この確率の相違は、細胞を死滅させる方式が異なることと同様、患者の体内に導入するエネルギ総量が異なることによるものである。DNA鎖を切断する場合には、意図した通りの切断が行われずに、DNA鎖が改変されてしまうことがある。DNAが改変された細胞はある確率をもって癌化し、二次癌になる。
【0026】
以下に説明する本発明の実施の形態は、人に治療を施すことを目的としたものである。ただし、本発明は、犬や猫、その他の動物の治療にも利用することができる。それゆえ、特許請求の範囲の記載中に使用している「処置対象者」の定義としては、犬や猫などの動物をも含むものと解釈されるべきである。
【0027】
図1A及び図1Bに示した本発明の実施の形態は、在来の画像形成システム1を用いて構成したものであり、この画像形成システム1は例えば磁気共鳴画像形成装置(MRI)や、コンピュータトモグラフィ装置(CTないしCATスキャンと略称されている)などである。画像形成システム1は、図2に示したように、制御システムへ画像情報を出力しており、この制御システムは、破壊すべき細胞を標的として特定する。この制御システムは更に、2本またはそれ以上の複数本のエネルギビーム2を、処置対象者3の標的領域に照準合わせする。尚、それらエネルギビーム2は、ビーム角の非常に小さな超ナロービームとすることが好ましい。制御システムによるこの照準合わせは、画像形成システムから連続的にフィードバックされている画像情報に基づいて行われ、それによって照準合わせの検証と精度向上とがなされている。後に更に詳細に説明するように、この制御システムは、エネルギビームの位置及び方向の制御を行うと共に、エネルギビームのエネルギ強度の制御も行うことができるため、複数本のエネルギビームを標的上に収束させて、エネルギのバーストを発射する。図1Aに示した具体的な実施の形態は、可動水平テーブル4を備えており、同図には、このテーブル4上に載せられた処置対象者3も示されている。この実施の形態は、処置対象者3の上方に、互いに直交するように配設された3台のビーム発生器2を備えている。図1Bに側面図で示した別の実施の形態は、互いに直交するように配設された2台のビーム発生器を備えている。当業者には容易に理解されるように、それらビーム発生器2は、MRI装置1の下方や側方に配設するようにしてもよい。
【0028】
使用するエネルギビーム2の本数は、個々の用途に応じて、2本またはそれ以上の適宜の本数とすればよい。1本のエネルギビームにより供給する最大エネルギレベルは、細胞にダメージを与え得る最小エネルギレベルより更に小さなレベルに設定している。ただし複数本のエネルギビームが交差する合焦点のエネルギレベルは、使用しているエネルギビームの本数に応じて、1本のエネルギビームによるエネルギレベルの2倍、3倍、4倍、…となる。このように複数本のエネルギビームを照射することにより、人体の深部の細胞を、その周囲の細胞にダメージを与えることなく破壊することができる。人体を透過する個々のエネルギビームは(標的領域に到達するまでのビーム部分と標的領域を通過した後のビーム部分とのいずれにおいても)そのエネルギレベルが十分に低いため、標的領域の周囲の健康な細胞には全く或いは殆どダメージを与えることがない。従って、ビーム交差部の中に位置する細胞だけに、その細胞を破壊するのに十分なエネルギが供給されることになる。
【0029】
ビームスプリッタの基本構造:図20に示したビームスプリッタは、以上に説明したような、個々に独立した複数台のビーム発生器を備えた実施の形態とは異なる、別の実施の形態に用いられるものである。この別の実施の形態は、ただ1台のビーム発生器(例えばX線管やライナックなど)を備え、そのビーム発生器から射出される1本のエネルギビームをこのビームスプリッタによって複数本のビームエレメントに分割するものである。これによって、複数台のビーム発生器を使用せずに済むことからコスト及び複雑度が低減されるが、ただしその一方で、1台のビーム発生器から射出される1本のエネルギビームを複数本のビームエレメントに分割して利用するためコスト及び複雑度が幾分増大する。本発明のこの実施の形態のビームスプリッタは、複数本のビームエレメントのうちから使用するビームエレメントを選択して夫々の導波管の中へ導くための複数枚のX線ミラーと、導波管を通過したビームエレメントをビーム交差部へ導くための別の複数枚のX線ミラーとを備えている。また、本発明の更に別の実施の形態として、複数台のビーム発生器を備え、それらビーム発生器の各々に、ビームプロセッサ(このビームプロセッサは、ビームスプリッタと照準合わせデバイスとを含むものである)を装備したものがある。複数台のビーム発生器の各々にビームプロセッサを装備した実施の形態では、ビーム交差部におけるエネルギレベルを更に増大させることができるため、それによって本発明の有用性が更に高まる。
【0030】
図9A〜図9Dに、エネルギビームどうしが交差したビーム交差部を示した。これらのビーム交差部は非常に小さく、そのことによって、高精度の処置が行えるようになっている。図9A〜図9Cに示したビーム交差部の具体例は、2本のエネルギビームが交差したビーム交差部であり、図9Dに示したビーム交差部の具体例は、図9Aに示した2本のエネルギビームが交差したビーム交差部の一部に、更に第3のエネルギビームが交差して形成された、部分ビーム交差部である。このような部分ビーム交差部を形成するためには、個々のビームの照準合わせ精度を更に向上させる必要があり、それには追加の信号処理を行うようにするとよく、この追加の信号処理は「エネルギレベル」をフィードバックするループを形成して、ビーム交差部の内部の電磁気エネルギレベルを計測するものである。ビーム交差部の内部の電磁気エネルギレベルは、使用している個々の電磁気エネルギビームの電磁気エネルギレベルが一定であるならば、そのビーム交差部におけるビーム重なり率に比例したものとなる。そのため、そのビーム交差部の大きさを、フィードバックされるエネルギレベルの大きさの関数として計測することができる。
【0031】
ここに記載するシステムは、特に、ミトコンドリアやリソソームなどの細胞内小器官を標的として破壊することにより、細胞がみずから溶解するようにするという方法を用いることができる。当業者には容易に理解されるように、細胞の種類によっては、1つの細胞内に多数のミトコンドリアが存在しているものもあり、また、1つの細胞内にリソソームなどのその他の細胞内小器官が多数存在しているものもある。そのような細胞をこの方法で細胞死に至らせるには、1つの細胞内に多数存在している細胞内小器官の大部分を破壊する必要がある。ただし、いかなる機序によってもたらされる細胞死であれ、最終的にはその細胞が消化されるということに帰着する。この方法は、ミトコンドリアやリソソームなどの細胞内小器官を攻撃することによって、細胞が消化される過程を開始させるというものであり、そのため、所与の細胞を細胞死に至らせる作業を完遂するために要するエネルギ量を低減できるという、重要な利点を提供するものである。
【0032】
細胞死に至らせるための好適な方法の1つに、細胞内小器官に結合するナノ粒子を使用するという方法がある。使用するナノ粒子の種類には、例えば、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、それに、それらが組合わさった粒子などがある。それらナノ粒子を使用して、細胞内小器官の内部で分子を発熱させて細胞内小器官を膨張させて破裂させ、或いは、細胞そのものを発熱させることによって、細胞死に至らせることができる。細胞死に至らせる別の1つの方法に、ビームストリームの中に高調波を混合することにより、細胞を構成している物質に影響を及ぼすという方法もある。
【0033】
更に別法として、細胞膜を破壊することにより細胞を殺すという方法もある。これを行うには、例えば、図9Dに示したような部分ビーム交差部を形成して、細胞膜のうちの小さな部分がこの部分ビーム交差部の中に入るようにすればよい。複数のエネルギビームが交差することによって、合焦点にエネルギのバーストが発生し、それによってホットスポットが形成され、その結果、細胞膜に穴が開けられる。この穴から細胞構成物質が流出することにより細胞死に至る。この方法では、一度に2個以上の細胞を殺すことができ、なぜならば、ある細胞の細胞膜を破壊するときには、それに隣接する細胞の細胞膜も同時に破壊されるからである。ここに記載するシステムは、以上の説明した様々な方法のうちの何れか1つの方法、幾つかの方法、または全ての方法を用いることで、ただ1個だけの細胞を破壊することも、また、小規模な細胞群を破壊することも可能である。制約要因となるのは、画像解像度、ビーム径、標的特定精度、それに照準合わせ精度である。
【0034】
上で説明したように、本発明の好適な実施の形態の1つは、複数本のエネルギビームを使用しており、それらエネルギビームは、1本だけのエネルギビームでは患者の身体を透過する際に標的領域の周囲の健康な組織に悪影響を及ぼすことのない、低エネルギのビームとされている。そして、複数本のエネルギビームを互いに交差させることによってエネルギのバーストを発生させ、それによって標的細胞を殺すようにしている。図6並びに図7A〜図7Dは、このビーム交差部がどのように形成されるかを、当業者が容易に理解できるようにするための説明図である。例えば図6は、3次元空間内で互いに交差する4本の電磁波ビームを示した図である。それらは電磁波ビームであるため、互いに同一面上に位置させる必要はない。また、それら電磁波ビームが互いに直交している場合には、それらビームの電磁波の位相を揃える必要もない。互いに交差している複数の電磁波の振幅は個々の電磁波の振幅の和となり、この振幅の和は、そのキロ電子ボルト(KeV)の値がビーム交差部の内部の複数の点において極大値を取る。周期関数である個々の電磁波は、その各々がこのKeVの極大値を取る。
【0035】
当業者には容易に理解されるように、合焦点は実際には小さな3次元空間であり、ここに記載する本発明の好適な実施の形態は、その3次元空間を標的として特定する。一般的に、点は大きさを持たないものである。しかしながら、ここでいう合焦点とは、複数本のエネルギビームが互いに交差するビーム交差部を意味している。複数本のエネルギビームが円筒形ビームであって、それらの径が互いに略々等しい場合には、この合焦点の大きさは、それらエネルギビームの断面形状である円形を回転させることで形成される球の大きさに略々等しくなる。図7A〜図7Dに示したように、ビーム交差部の実際の形状は、いわゆるスタインメッツ立体の形状となる。図7Aに示した具体例は、3本の円筒形ビームにより形成された菱形十二面体であり、それら3本の円筒形ビームはこの菱形十二面体の夫々の構成面の中心を通っている。それら3本の円筒形ビームの相対的な配列は、個々の円筒形ビームが正八面体の対向する2つずつの頂点を通る場合の配列と同じである。また、この具体例ににおいて、3本の円筒形ビームにより形成された菱形十二面体の体積は(16−sqrt(128))r3で表される。図7Cに示した具体例は、6本の円筒形ビームにより形成された立方八面体であり、6本の円筒形ビームはこの立方八面体の夫々の辺の中心点を通っている。また、この具体例において、その立方八面体の体積は(16/3)(3=sqrt(12)−sqrt(32))r3で表される。本発明の好適な実施の形態においては、使用する複数本のエネルギビームを互いに直交するビームとすることによって、標的の特定を好適に、そして最良に行うことができ、なぜならば、そうすることによってそれらエネルギビームが交差するビーム交差部の大きさが最小となるからである。使用する複数本のエネルギビームのビーム径が互いに同一でない場合や、それらエネルギビームが互いに直交していない場合には、ビーム交差部の形状が、変形スタインメッツ立体の形状(不図示)になる。4本以上のエネルギビームを必要とする用途では、ビーム交差部の寸法及び形状の、それらビームの収束角に対する依存性は小さなものとなる。
【0036】
図5からは、複数本のエネルギビームを組合せて、各々のエネルギビームのエネルギ密度を低く抑えることにより、解像度及び制御機能が向上することが分かる。より詳しく説明すると、図5に示したのは、複数本の電離放射線ビームを使用したときの合焦点における幾つかのパラメータの概略予測値である。例えば、エネルギ量、エネルギ勾配、細胞のエネルギ吸収量、及び細胞死率は、電離放射線ビームを4本使用したときに最も大きくなっている。電子顕微鏡の場合と同様に、合焦点におけるエネルギ集中度を高めることによって、合焦点に存在する細胞からの放出を発生させることができる。その放出を計測して解析することによって、画像情報を補強することができ、ひいてはシステムの制御機能及び標的特定機能を向上させることができる。
【0037】
MRI装置及びCT装置の多くは、処置対象者3の位置を移動させるための高精度のロボット式ガントリテーブルを既に備えている。本発明の好適な実施の形態の1つにおいては、標的特定及びエネルギ供給のためのシステムにも、そのようなロボット式ガントリテーブルのものと同様のロボット機構を装備してあり、そのロボット機構によって、処置対象者の標的領域を視界の中へ移動させ、また更に、精密照準合わせ領域の中へ移動させることができるようにしている。MRI装置またはCT装置を用いて画像情報を取得するようにしている実施の形態では、このロボット機構を、MRI装置またはCT装置に組込むようにしてもよい。また、本発明の別の実施の形態として、MRI装置またはCT装置からは独立したロボット式ガントリテーブルを装備して、そのテーブルの上に処置対象者を載置して移動させるようにしてもよい。また更に別の実施の形態として、精密照準合わせを行うための手段として圧電デバイス上に搭載されたミラー、或いは、液晶技術やプラズマ技術などを利用したビーム偏向機構を備えるようにしてもよい。これら技術を利用することにより、小さな領域の中でエネルギビームを高精度で照準合わせしてエネルギを供給することが可能となる。画像形成のためのシステム、位置方向制御のためのシステム、及びエネルギ供給制御のためのシステムは、それらの間で衝突ないし干渉を生じるおそれがあるが、そのようなおそれはガウス面緩和法などの方法を用いて低減ないし解消することができる。また、それらシステムの間で高速のスイッチングを行うようにするのも一法である。
【0038】
図12に示したのは、本発明の二階建型の実施の形態の具体例を示した図であり、この具体例では、MRI装置またはCT装置から成る画像スキャナが第1レベルに設置され、それより低位のレベルに3台のビーム発生器が設置されている。そして、3台のビーム発生器が射出する放射線ビームを、第1レベルに設置されているMRI装置またはCT装置の水平テーブル上に載せられた処置対象者に照射することができるようにしてある。この実施の形態において、図12に示したシステムを収容している施設の床構造は、実質的に全てのX線散乱を遮蔽できる遮蔽能力を備えている。この遮蔽能力を実現するための条件は、鉛層で遮蔽するのであればその厚さを14インチとする必要があり、コンクリート床版(鉄筋コンクリート床版)で遮蔽するのであればその厚さを96インチとする必要があるというものである。更にもう1つの条件として、この床構造では床の有効厚さを24インチにしなければならないということがある。ここで、鉛層の厚さをxインチ、コンクリート床版の厚さをyインチとするならば、以上の条件は、X線散乱量−14L=0、X線散乱量−96C=0、X線散乱量−x・L−y・C=0、そして、x+y=24という式で表される。更に、鉛層xの構築コストはコンクリート床版yの構築コストよりはるかに高額であることも考慮する必要がある。以上のデータから最適解を求めると、コンクリート床版の厚さy=12.5インチ、鉛層の厚さx=11.5インチとして、コンクリート床版の表面に鉛層の覆いを設けた床構造とすることによって、鉛層だけで遮蔽するよりもはるかに低コストで目標とする遮蔽能力を得ることができる。以上の評価値は、100MeVのX線を使用するという最も過酷な状況に対応したものである。本発明の好適な実施の形態を採用する場合には、これよりもエネルギレベルの低いX線ビームを使用することが予期されるため、これほどの遮蔽構造とする必要はなく、おそらくは、以上に示した評価値から25%少ない値とすることができるものと考えられる。以上の解析は、最も過酷な状況に対応したものである。
【0039】
図2に示したのは、本発明の1つの好適な実施の形態における構成要素を示したシステムブロック図である。図中、マグネット、RFコイル、RF検出器/増幅器、MRIパルス発生制御部/磁界制御部、それにデジタイザは、MRI装置の構成要素であり、これら構成要素から得られる情報は中央プロセッサへ供給されて処理される。本発明のこの好適な実施の形態は更にその他の様々な構成要素を含むものであるが、それら構成要素のうちの主要なものとしては、ビーム制御部、D/Aコンバータ、電力増幅器、ロボット機構、ロボット式マニピュレータ、処置の実行中に処置対象者を載置する水平テーブルの位置を制御するためのロボット式システム、ビーム発生器、照準合わせ機構、それに様々なデバイス制御部がある。また更に、標的計算コンピュータがあり、この標的計算コンピュータは中央プロセッサに接続されている。標的計算コンピュータはサブプロセッサであり、フィードフォワード制御の命令に関する値を算出して命令の更新を行い、更新した命令を中央プロセッサへ渡す。このサブプロセッサは、処置を施すのに先立って行われる事前スキャンにより得られた処置対象者の身体データを保持しており、また、フィードフォワード制御に用いられる様々なドライバ値及びゲイン値を算出するための数学モデルを保持している。標的計算コンピュータは、それら身体データ及び数学モデルに基づいて、フィードフォワード制御に必要な高度に数学的な計算処理を実行する。その計算処理が完了したならば、算出したフィードフォワード制御に用いられる諸々の値を中央プロセッサへ渡し、そして、その時点で更新されている新たなフィードバック情報を取得して、フィードフォワード制御のための次のラウンドの計算処理を開始する。実際に制御ループを実行しているのは中央プロセッサであり、中央プロセッサは、画像形成装置からの入力、及びその他のセンサからの入力と同様に標的計算コンピュータからの入力に基づいてその制御ループを実行するようにしてある。本発明の好適な実施の形態のうちには、制御アーキテクチャを可能な限り最善のものとするために制御ゲインを動的ゲインとしたものがある。そのような実施の形態では、フィードフォワード制御に関する制御ゲインがゼロになる可能性もあり、フィードバック制御に関する制御ゲインがゼロになる可能性もあるが、ただし、それら両方が同時にゼロにはならないようにしている。このことは、事実上、本発明がフィードフォワード制御だけで実行されることも、またフィードバック制御だけで実行されることもあり得るということを意味している。ただし、このように一方だけの制御で実行されるという状態が1秒以上の長さにわたって継続する可能性は小さい。
【0040】
本発明の好適な実施の形態では、第1段階の照準合わせ(粗照準合わせ)のための手段としては、撮像装置を備えた工業用ロボットに用いられているものと同様の照準合わせ技術を使用している。また、第2段階の照準合わせ(精密照準合わせ)のための手段としては、精密加工や高精細度テレビジョン製造などに用いられているものと同様の照準合わせ技術を使用することができる。いずれの照準合わせ技術にも、標的移動、ビーム偏向(屈折)、ビーム分散、及びその他の様々な誤差発生要因を予測して制御を行うフィードフォワード制御を適用することができる。例えば、呼吸運動は周期的であるため、呼吸運動に伴う標的移動は特定のパラメータ内で予測可能である。また、骨以外の組織の密度に対する骨の密度の比から、発生するビーム屈折及びビーム分散の上限及び下限を予測することができる。フィードフォワード制御に用いる数学モデルをそれら予測値に対応したものとすることにより、フィードバックループの精度を向上させることができる。
【0041】
医療用途におけるX線ビームに関しては、これまで一般的に、そのビーム屈折は無視して構わないものと考えられていた。X線ビームの一般基準としては、1箇所で屈折することによって生じる偏位量の上限を1万分の1以下とすることが定められている。これは、屈折発生点から10cm離れた位置におけるビーム偏位量が約10μm以下であることを意味している。複数の屈折は累積するため、最終的なビーム偏位量はこれよりずっと大きくなる。図3A及び図3Bは、本発明の1つの好適な実施の形態を用いる場合に発生する入射角に関連した問題を説明するための図である。ここでいう入射角とは、エネルギビームが例えば、骨、組織、靱帯、腱、臓器、及びそれらに関連した身体部分などの、ヒトの様々な身体部分に入射するときの角度である。これらの図に示したように、入射角による影響は、細胞の大きさと比べてビーム径が小さくなるほど低下する。ビーム径が細胞の大きさより小さくなると、もはやエネルギビームにとって、人体の表面は平滑面や平坦面とは見なし得ないものとなる。即ち、人体の表面は凹凸のある不規則な形状の面であると見なさねばならず、その上更に、人体の表面は体毛などのエネルギビームにとって障碍物となるものによって覆われている。このように人体の表面が不規則な形状であり、また、人体の表面に障碍物が存在することから、それらに対する補償手段として、剃毛や塗布剤の塗布などが必要となる。更に、本発明の1つの実施の形態における制御システムでは、フィードバック制御の制御ループと、フィードフォワード制御の数学モデルとを用いて、残留偏位量を補償するようにしている。より詳細に説明すると、図3Aにはビーム発生器が示されており、このビーム発生器で発生したエネルギビームが、処置対象者の皮膚に入射している。そしてこの入射に伴って、ビーム偏向(屈折)が発生している。図3Bはこのビーム偏向を更に詳細に示した図である。入射角は、図中に記入したように、人体の皮膚の表面にエネルギビームが入射する角度である。屈折角は、これも図中に記入したように、人体の表面(例えば人体の皮膚の表面)から下方へエネルギビームが進行して行く角度である。図から明らかなように、ここでは入射角と屈折角との和が180度より小さくなっている。尚、当業者には容易に理解されるように、エネルギビームが皮膚へ入射する際のビーム偏向は、そのエネルギビームが図3Bで見て左側へ移動するような方向の屈折となることもあり、その場合には入射角と屈折角との和が180度より大きくなる。いずれの場合も、エネルギビームは人体の表面によっていずれかの方向へ屈折し、それゆえ、健康な組織が受けるダメージを可及的に低減するべく合焦点及び標的領域を適切に定めるためには、このようなビーム偏向を発生させるエネルギビームにとっての障害物を考慮に入れる必要がある。更に、これも図3Bから明らかなように、エネルギビームは人体の表面へ入射した後にビーム径が拡大している。このビーム径の拡大は、図3Bに示したように、入射角、屈折角、それに分散角によるものであり、分散角はエネルギビームが人体の内部のある部分から別の部分へ進入する際などに発生する。
【0042】
本発明の1つの好適な実施の形態では、ビーム偏位量の許容値は約2μmという微細な値であるため、ビーム偏向を考慮した補正が必要とされている。ビーム偏向によって発生するビーム偏位量は、使用するエネルギビームが電離放射線ビームである場合に最も小さく、その他のエネルギビームではそれより大きくなる。そして、偏向比が最も小さいエネルギビームである電離放射線ビームの偏位量が補正を必要とするほどに大きければ、その他のいかなるエネルギビームについても、ビーム偏向の影響を補償するためのフィードフォワード制御が必要である。図4は、フィードフォワード制御システムがどのように利用されるかについての具体例と、それに関連したビーム偏向の具体例とを示した図であり、同図には、エネルギビームが合焦点に達するまでの間に透過する処置対象者の皮膚、骨、及び腱が示され、そして標的細胞が示されている。かかる状況において、図2に示した標的計算コンピュータに搭載されたソフトウェアプログラムは、発生すると予測されるビーム偏向と、その結果として形成されるはずのビーム経路とを事前算出するフィードフォワード制御のための数学モデルを含むと共に、画像形成装置により得られる情報を収集するフィードバック制御を含んでいる。従って、本発明の1つの好適な実施の形態を使用して以上のように構成したシステムは、リアルタイムでの画像取得と、解析と、処置の実施とを、自動化作業として行う能力を備えている。使用するエネルギビームのビーム径を7μmとしたときのこのシステムの動作速度は、1秒間あたり細胞10個〜細胞1000個である。
【0043】
本発明の好適な実施の形態によれば、現在市場に提供されている、エネルギビームを利用するようにした最先端のシステムと比べて、エネルギレベルのスレショルド値をより低く設定することができ、また、正確度、精密度、及び動作速度をより優れたものとすることができる。本発明の好適な実施の形態によれば、エネルギビームのビーム径を小さくすることができると共に、エネルギビームのエネルギレベルを低く設定することができるという利点が得られ、それらによって画像形成装置の信号ノイズが低下するため、システムの性能が更に向上するという利点も得られる。
【0044】
エネルギレベルのスレショルド値をより低く設定できるのは、高熱で細胞を破壊するという方法以外の方法を用いることができるからである。本発明の実施の形態のうちには、高熱で細胞を破壊することに替えて、細胞それ自体の持つ崩壊機構を利用するようにしたものがある。これによって、細胞を破壊するために必要なエネルギ量が低減され、破壊されずに残る細胞も殆どなくなる。その方法とは、リソソームやミトコンドリアなどの細胞内小器官を攻撃するというものであり、これは単に高熱で組織を焼灼する方法と比べてはるかに洗練された方法であるといえる。本発明にとって、組織を焼灼して除去するという方法は、最後にやむなく選択する方法であり、なぜならば、組織の焼灼は、多量のエネルギを必要とするため、体内に傷痕組織を形成してしまうおそれがあるからである。
【0045】
正確度、精密度、及び動作速度の改善は、フィードバック制御にフィードフォワード制御を組合せて用いることによって達成されており、これによって、それらは直接的に且つ劇的に改善される。更に加えて、フィードフォワード制御を組合せることによって、フィードバック制御の作業領域を減縮できるため、フィードフォワード制御のループ1回分のデータ処理量が格段に減少する。そして、このデータ処理量の減少によって、フィードバックループの動作速度が格段に高速化し、それによって更に、プロセス全体としての正確度、精密度、及び動作速度が向上する。
【0046】
本発明の好適な実施の形態のうちには、精密度及び正確度の初期値が約7μm±2μmのものがある。この値は、最も小さいヒト細胞の大きさよりも更に僅かに小さな値である。また、この値は、エネルギビームを利用した在来の装置における各軸方向の精密度及び正確度の値と比べて約50倍も優れた値である。本発明の技術は、画像形成技術及びビーム発生技術が今後向上するのに伴って、精密度及び正確度の値を更に一桁以上改善できる潜在的可能性を有している。また、本発明の好適な実施の形態としてここに記載している技術は、現時点では治癒不能とされている多くの疾病を治癒可能にすることのできる潜在的可能性を有している。また更に、この技術は、治療法ないし処置法が既に存在する多くの領域においても大躍進をもたらし得るものである。
【0047】
在来の癌治療法は、本発明の好適な実施の形態を用いて実施する癌治療法と比べれば、極めて稚拙なものでしかなかった。在来の癌治療法は、ビーム径の大きな1本の放射線ビームを使用したものであり、このような放射線ビームは周囲の組織にダメージを及ぼしていた。また、病変領域の画像を形成して、診断を下し、必要な行動をとるまでの間に時間遅れが存在していた。この時間遅れは、かなり大きなものであることもあり、それによって患者の生死が分かれることもあった。また、再現性が低く、人為的過誤が発生することも多かった。標的特定及び照準合わせの技法としては、非常に初歩的な技法しか採用されていなかった。更に、特定の細胞や、極めて少数の細胞から成る細胞群を標的として設定することは(本発明と比べれば)全く行われていないも同然であった。
【0048】
本発明に係る装置は、癌治療以外のヘルスケアに利用した場合にも、正確度及び再現性が非常に良好であるということが大きな利点となる。また、自動化されたリアルタイムの動作を行うものであるため、人為的過誤が発生する余地がないということも、重要な点である。また、ここに記載している本発明に係る技術が提供する更なる大きな利点として、この技術が非侵襲的であり、従って、侵襲的処置を回避できるということがある。癌治療以外のその他の用途としては、例えば、気道拡大、心臓弁修復、前立腺縮小、聴力改善、脳細胞刺激、止血のための内部焼灼、脂肪肝の治療、ポリープの除去などがある。
【0049】
本発明の好適な実施の形態は、初期設定を行った後には自動化装置として動作するものであり、そのことによって少なくとも、過失の低減、再現性の向上、正確度の向上、動作速度の高速化、それに追跡性能の向上という利点が得られる。また、自動化装置として動作することから、システムの動作形態が有利なものとなっており、これは、細胞を標的として選択して特定する作業を、集中的な計算処理によって行えるからである。エネルギビームの照準合わせ作業は、特に高速で行わなければならず、しかも、特に高精度で行わなければならない。もし人間が、ある1個の細胞に関する情報を取得して正確に判断を下すという作業を行うならば、場合によっては数時間もの時間を要することになる。この作業には非常に手間がかかる上に、過誤も避けられない。たとえ人為的過誤の問題が解決されたとしても、この作業が自動化されていない場合に、処置対象者はその長時間の作業が行われる間じっと動かずにいることに耐えられるものではない。処置対象者が身体を僅かに動かしただけでも、解析対象の領域を数ミリ秒以上の長さに亘って追跡し続けるという作業は非常に困難なものとなる。解析作業と処置作業とは共にリアルタイムで行われる。
【0050】
また画像情報は、目で見る画像としての重要度よりも、数値情報としての重要度の方が更に大きい。MRIシステムにおいては、画像情報を数値情報として取得した数学上の空間(k空間)に対して変換処理を行い、それを目で見るピクセル情報に変換している。この変換処理のための演算の過程で、誤差が入り込む可能性がある。更に、こうして画像情報を目で見る画像の形とした後にも、更に、その画像を読影する人間の視覚的及び心理的な制約がその画像情報に影響を及ぼす。これに対して、自動化作業は、客観性を有し、再現性を有し、作業速度が高速であり、正確度が高く、信頼性が高い。これらの特性は、プロシージャの開始後に行わねばならない様々な作業にとって、単に非常に望ましいということにとどまらず、必須の特性であるといえるものである。記述のごとく、図2は本発明の好適な実施の形態を示したシステムブロック図であり、同図には、システムを自動化して、処置対象者により効果的に処置を施せるようにするための様々な構成要素が示されている。
【0051】
発生させるエネルギビームに関する上の説明では、放射線ビームを発生させる場合について述べた。本発明の好適な実施の形態にとって、放射線ビームを使用することは論理的に妥当性のある選択であるが、ただし、エネルギビームとして放射線ビームを使用することは唯一の選択肢ではなく、実際の用途によっては、放射線ビームを使用することが最善の選択とはならないこともある。本発明におけるアーキテクチャは、人体の組織を透過することのできるエネルギビームでありさえすれば、いかなる種類のエネルギビームを用いても機能し得るものである。本発明の様々な好適な実施の形態のうちには、電波ビームを使用するもの、超音波ビームを使用するもの、それに更にその他のエネルギビームを使用ものがある。本発明には、様々な波長及び様々なエネルギレベルの電磁波ビーム(フォトンビーム)及び機械波ビーム(超音波ビーム)を用いることができる。電離放射線ビームには、かなり大きな副作用があり、リスクがある。また、放射線ビームは、たとえそれが低エネルギのものであっても、あらゆる用途において常に最善の選択肢となるものではない。その他のエネルギビームの方が、合焦性能、透過能力、エネルギ供給能力、安全性、破壊能力、及び/または、副作用の点でより優れていることもある。
【0052】
本発明の好適な実施の形態のうちの1つに、最小の副作用で最大の効果が得られるエネルギビームを選択するという判断基準に基づいて、複数の放射線ビームを組合せて用いるようにしたものがある。また、好適な実施の形態のうちの1つに、細胞膜を破壊するだけで、或いは、細胞内小器官を不活性化するだけで、細胞を殺すようにしたものがある。また、好適な実施の形態のうちの1つに、上で言及したように、細胞を自己崩壊させることによって、細胞がみずから溶解するようにしたものがある。細胞膜を破壊する方法では、その破壊後に残った細胞構成物質が崩壊して行く際に感染が生じるおそれがある。組織を除去する方法では、傷痕組織が形成されるおそれがある。それらに対して、細胞がみずから溶解した後の細胞構成物質はより容易に吸収されて、体内で再利用されるか或いは体外へ排出される。放射線の照射は、細胞膜を分解し或いは崩壊させて、最終的に細胞膜を破壊するように作用する。本発明によって複数本のエネルギビームを制御して、それらエネルギビームを互いに交差させて合焦させることによって、特に、細胞内小器官(リソソームやミトコンドリアなど)または細胞液を加熱し、それによって細胞内小器官を不活性化して細胞死を引き起こすようにしたものもある。またこれと同様に、本発明の好適な実施の形態のうちには、超音波ビームを用いてリソソームなどの細胞構成要素を振動させ、しかもそれを十分に高いエネルギレベルで行うことによって細胞死に至らせることができるようにしたものもある。エネルギビームのエネルギレベルを決定するについては、副作用の大きさとの兼ね合いを考慮する必要があり、ここでいう副作用の大きさとは、使用する特定の種類のエネルギビームが、標的に達するまでの経路上及び標的を抜けた後の経路上に存在する組織に及ぼすダメージの大きさである。使用するエネルギビームがマイクロ波ビームであって、標的細胞が体内深部(身体表面から3〜4cm以上の深部)にある場合には、その標的細胞に到達できるだけの透過能力を持つようにマイクロ波ビームのエネルギ強度を決定したならば、身体表面のビーム入射領域にダメージを及ぼすことが避けられないほど大きなエネルギ強度になる。図11に3本の効力曲線を示した。それらのうち曲線Aは、エネルギビームを3本使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力を表した曲線である。この実施の形態を用いた場合には、標的領域内の細胞死率は100%になる。曲線Bは、エネルギビームを1本だけ使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力を表した曲線である。この実施の形態を用いた場合には、細胞死率は約50%になり、曲線Aと比べて細胞死率が低下しているのはエネルギビームを1本しか使用しないことが制約となっているからである。曲線Cは、従来の放射線治療の効率を表した曲線であり、この曲線Cを見れば分かるように、ある種の状況下では、従来の放射線治療が、実は、人体に負の効力を及ぼす結果となることがあり、癌を発生させることが知られている。曲線Cからは更に、効力がプラトーに達していることが見て取れ、これは、標的領域ないし合焦点の周囲の健康組織に関する細胞死によるものである。尚、以上の3本の効力曲線は、本発明の発明者が計算により求めた予測値であり、実験データに基づいたものではない。
【0053】
本発明の1つの好適な実施の形態に用いられるビーム発生器は、適用対象に応じて、複数の種類のエネルギビームや、互いにビーム径の異なる複数本のエネルギビームを発生し得るものである。複数の種類のエネルギビームは、最適の結果が得られるように、それらを適宜切替えて使用することもでき、それらを適宜組合せて使用することもできるようにしてある。複数の種類のエネルギビームを併合して1本のエネルギビームにすることにより、目標とする効果を得るために必要とされるエネルギ量という点で、最善の結果を得ることができる。図13に、その1つの具体例として、ビーム発生器装置と組合せて使用されるX線ビームを示した。
【0054】
基本波に高調波を混入することによって、または、基本波を高調波で変調することによって、目標とする効果を得るために必要とされるエネルギ量を、更に低減することができる。その高調波を、細胞内小器官の中の分子の大きさ、細胞内小器官それ自体の大きさ、または、細胞それ自体の大きさに適合したものとすることによって、エネルギ吸収速度を高めることができ、それによって、必要とされるエネルギ量を低減することができる。身体組織を透過することのできるエネルギビームの波長は非常に短い(必要とされる高調波の波長より更に短い)ため、エネルギビームの発射動作を変調することによって高調波を得るようにするとよい。高調波を使用することによって、細胞内小器官を標的として特定することが非常に容易になり、それは、ビーム交差部を細胞内小器官に合焦させる必要がなく、単に細胞小器官がビーム交差部の中に含まれるようにするだけでよいからである。
【0055】
エネルギビームのビーム径及びエネルギレベルは、画像形成にも関連している。当業者には容易に理解されるように、一般的にMRI装置やCT装置などの画像形成装置は、漂遊エネルギの影響を非常に受け易い。X線はコンプトン散乱及びトムソン散乱を発生させるため、X線を照射しつつ同時に画像形成装置を稼働させることは困難である。X線によって発生する散乱の大部分はコンプトン散乱によるものであり、それゆえ画像の歪みの主要原因を成しているのはコンプトン散乱である。コンプトン散乱では、フォトンがランダムな方向に飛び出す。コンプトン散乱が発生するときには、先ず、フォトンが電子に衝突して一時的に電子に吸収される。フォトンを吸収した電子は、原子から飛び出すか、または、より高位の電子殻へ遷移し、それによって、その電子が元々位置していた電子殻に空位が生じる。より高位の電子殻の電子がその空位へ遷移する際に、ランダムな方向にフォトンを放出する。ランダムな方向に放出されたフォトンのうちには、センサアレイに作用を及ぼすものもある。X線ビームのエネルギレベルを低下させることによって、また、そのビーム径を小さくすることによって、以上のようにして発生する散乱の散乱量を低減することができる。即ち、単位時間あたりの入力フォトンの個数が減少するため、単位時間あたりの散乱量も減少する。そして、画像情報を取得するために要する時間が一定であるならば、単位時間当たりの散乱量が減少することによって画像の歪みが軽減される。
【0056】
身体組織へ打込まれるフォトンのエネルギレベルを低く設定することによっても、散乱量を低減することができる。X線のフォトンは、そのエネルギレベルが14.32KeVのスレショルド値以下である場合には、L殻またはM殻の電子しか叩き出すことができない。より高位の電子殻からL殻またはM殻へ電子が遷移するときに放出されるフォトンのエネルギは非常に小さく、そのためそのフォトンの身体組織を透過する能力は弱い。これに加えて、そのような電子の遷移が発生する確率も小さく、従ってそのようなフォトンの発生頻度も少ない。従って、そのようにして発生してセンサアレイに到達するフォトンは極めて少ない。ただし本出願人は、X線ビームを使用する本発明の実施の形態を、そのエネルギレベルが14.32KeV以下のものだけに限定するものではない。本出願人がここで示唆しているのは、エネルギビームのエネルギレベルを低く設定することによって散乱量を低減することができ、その結果として画像の歪みを低減できるという利点が得られるということである。このように、散乱量及び画像の歪みは、入射するフォトンのエネルギレベルに関係している。その関係は線形関係ではないが、ただしその関係が存在しているということは、本発明に用いるエネルギビームに関して、そのフォトンの最適エネルギレベルが存在することを意味している。尚、最適エネルギレベルを決定するための判断基準としては、これ以外に、身体組織の透過能力や、患者及び医療従事者に対するリスクも考慮する必要がある。
【0057】
図14〜図19は、本発明の好適な実施の形態における標的特定のための作業、並びにエネルギビームの照準合わせのための作業に関連した特徴を説明するための図である。当業者には周知のごとく、「標的特定(targeting)」とは標的細胞を選択することであり、「照準合わせ(aiming)」とはその標的細胞にエネルギを供給するためにエネルギビームを案内することである。標的特定のためには、事前スキャンと、リアルタイムスキャンとを必要としている。事前スキャンによって、フィードフォワード制御に必要な数学モデルを自動的に作成するモデル作成プロセスに必要な情報と、医師が入力操作をするグラフィカルユーザインターフェース(GUI)画面に表示するための情報が得られる。医師はこのGUI画面において、標的を選択し、パラメータの値の初期設定を行う。初期設定を行うパラメータの値は、システムが動作することのできる空間の境界を規定するものである。事前スキャンにおいては、標的計算コンピュータが標的の候補を特定してGUIに表示し、医師はそこに表示された標的の候補のうちから、最終的に標的とすべき対象を選択することができる。
【0058】
エネルギビームの照準合わせに用いるフィードバック制御ループは、画像情報取得システムから供給される画像情報を利用するものとすることが好ましい。その場合に、標準的な画像形成装置のうちでも例えばMRI装置などは、そのままでは画像にエネルギビームが映し出されないため、何らかの改変を加える必要がある。また、ビーム発生器が発生するエネルギビームがトレーサ成分(付加的な波長成分)を含むようにすることによって、画像にエネルギビームが映し出されるようにするという方法もある。一方、使用するエネルギビームが高エネルギX線ビームであって、しかも画像形成装置としてCT装置またはPET装置を使用する場合には、改変を加えるまでもなく、その高エネルギX線ビームはコンプトン散乱及び/または光電散乱によって画像に映し出される。図14〜図19は、本発明の好適な実施の形態における制御シーケンスの具体例を説明するために、その制御シーケンスにおける時系列に従った6つの画像フレームを示した図である。この制御シーケンスは、ビーム発生器を標的領域に対して初期照準合わせしたときの誤差に対処するために、フィードフォワード制御とともにフィードバック誤差信号の値に基づいて、エネルギビームの位置を調節し、最終的にエネルギビームの位置を標的領域に収束させるものであり、エネルギビームの位置が収束したならば、エネルギビームのパルスを発射して標的細胞を破壊する。更に詳しく説明すると、図14には、本発明に用いられている画像形成装置の画面に表示された、標的領域に関するフルフレームの視界及びサブフレームの視界が示されている。図中の参照符号「a1」、「a2」、「b1」、「b2」、「c1」、「c2」、「d1」、「d2」、「ex」、「ey」、「fx」、「fy」、「gx」、及び「gy」は、3本のエネルギビームA1、A2、及びA3が、標的「T」に収束していないために発生しているフィードバック誤差信号を表している。これらの参照符号において、例えば文字「a」及び「b」は、ロボットアームの位置誤差を表しており、文字「c」及び「d」はガントリテーブルの位置誤差を表しており、文字「e」、「f」、及び「g」は最終的な照準合わせ誤差を表している。参照符号によって表される誤差とともにフィードフォワード制御を用いることにより、エネルギビームを標的領域に収束させることができ、収束後にエネルギビームのパルスを標的「T」へ発射したときには、標的領域の周囲の健康な組織が破壊されることなく、標的細胞だけが破壊される。図15には、特定の標的「T」と、この標的「T」の周囲にあるエネルギビームA1、A2、及びA3の位置とが示されている。図を見れば明らかなように、図15に示した段階では、まだ3本のエネルギビームA1、A2、及びA3は標的領域Tに収束していない。続いて、3本のエネルギビームA1、A2、及びA3と標的領域Tとの間の夫々の間隔を算出し、それら算出値に基づいて、複数のビーム発生器の夫々に装備されているビーム偏向機構を操作する。図15は、3本のエネルギビームA1、A2、及びA3に対する標的領域「T」の位置関係を例示したものである。図15を見れば分かるように、夫々のビーム偏向機構がエネルギビームA1、A2、及びA3を標的「T」に近付けるように移動させることによって、それらエネルギビームA1、A2、及びA3と標的領域Tとの間隔は次第に小さくなって行く。図16に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束して全ての誤差が許容レベル範囲内に入るまでの、その手前の段階である。図17に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束した段階である。図18に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束した後に、エネルギビームのパルスを発射して細胞を破壊している段階である。図19に例示したのは、標的が破壊されたことをシステムが検証している段階である。
【0059】
標的と非標的との差別化について:標的と非標的とを判別するためには、標的細胞と非標的細胞との差違を明瞭にする差別化を施すことが、即ち、数学的ないし制御的に差違を明瞭にすることが重要な課題となる。またこのことは、標的細胞とエネルギビームの影響を受け易い非標的細胞(例えば神経細胞など)とが、互いに近接して位置しているときに特に重要である。標的細胞の見た目及び/または反応が非標的細胞の反応と大きく異なるようにすることも容易ではない。差別化のための可能な方法としては、例えば以下に列挙する方法などがある。1)標的細胞にナノ粒子を付着させることによって、標的細胞を細胞死に至らせるために必要なエネルギ量を低減し、もって、標的細胞が選択されていないがエネルギビームの影響を受ける領域及びその近傍にエネルギ量の余裕分を設定する方法。この方法については後に更に詳細に説明する。2)標的物質ないし標的細胞をマーカー染料で染色する方法。3)制御ルールの中に標的物質と非標的物質との差違を明瞭にする数学的アルゴリズムを組込む方法。この方法についても後に更に詳細に説明する。尚、本発明の好適な実施の形態においてエネルギビームのビーム径を非常に小さなものとしていることも、また、本発明の好適な実施の形態における制御アーキテクチャも、標的細胞だけを確実に破壊するための手段であるといえる。
【0060】
放熱について:体内での放熱が問題となることがあり、特に、ある領域に集中的に大量のエネルギを注入することが必要とされるような用途ではこのことが重要になる。1つの好適な実施の形態に係るシステムでは、不都合な熱の蓄積を回避するために、エネルギ供給量を自動的に最適化して、所望の効果を得るのに必要とされる最小限度のエネルギ量しか供給しないようにしている。また、このエネルギ供給量の自動的な最適化は、フィードフォワード制御において自動的に数学モデルを作成する過程の一部として実行するようにしている。ミトコンドリアやリソソームなどの細胞内小器官を破壊するために必要なエネルギ量は通常十分に小さく、そのため、それらを破壊する処置に伴って発生する熱は、人体に元々備わっているシステムによって容易に自然放散される。処置の種類によっては補助的な冷却を必要とするものもあり、その場合の補助的な冷却は例えば吸熱性のIVないし冷却したIVなどを用いて行われる。標的を分散させることによって特定の領域に集中して過大なエネルギが放出されるのを回避するという方法もある。また、最も簡明な解決方法は、人体の備わっている自然放熱の能力に適合するまで、システムの動作速度を低下させるという方法である。ただし、この方法が有効である用途もあるが、用途によっては処置時間が長くなりすぎるため、この方法を採用できない場合もある。
【0061】
ミトコンドリアやリソソームなどの細胞内小器官を利用して細胞を溶解させる方法について:リソソームの持つ細胞を溶解させる能力を利用することで、より少ないエネルギを使用するだけで細胞死に至らせることができる。ただしその場合に多少やっかいであるのは、単にリソソームを破壊しただけではこの方法は機能しないことであり、なぜならば、リソソーム内の酵素が活性化するためには、低pHレベルであることが必要とされるからである。細胞内の通常のpHレベルは高い。リソソームに関連した1つの方策として、ミトコンドリアを攻撃するのもよい。ミトコンドリアに十分なダメージを与えれば、それによって細胞が消化される過程が開始される。実際に、ミトコンドリアを破壊することによって細胞を殺すことができ、それによって細胞は分解し、単なる細胞構成物質の混合体になる。いかなる種類の細胞内小器官であれ、細胞内に存在するその細胞内小器官の全てもしくは大部分を破壊すれば、それによって細胞死に至らせることができる。
【0062】
ミトコンドリアを標的化するための好適な方法の1つに、金ナノ粒子または炭素ナノ粒子に標的化剤を付着させたものを使用するという方法がある。そのような方法の一例として、ナノ粒子にペプチドを付着させて、そのナノ粒子がある種の細胞のミトコンドリアを追い求めて付着するようにする方法がある。またそのような方法の別の一例として、ナノ粒子にモノクローナル抗体を付着させて、そのナノ粒子が特定の種類の細胞(標的細胞)のもとへ行くようにすると共に、更にペプチド鎖を付着させて、そのナノ粒子がその標的細胞のミトコンドリアの細孔に入り込むようにし、そして、エネルギビームを用いてそのナノ粒子を活性化することによってミトコンドリアを破壊し、アポトーシスを開始させ、細胞を破壊するという方法がある。また、ナノ粒子にモノクローナル抗体を付着させる代わりに、アプタマーを付着させるという方法もある。アプタマーとしては、DNAまたはRNAのオリゴヌクレオチドや、修飾されたDNAまたはRNAのオリゴヌクレオチドなどがある。そのようなアプタマーは、長さが短く(ヌクレオチド10個分〜15個分の長さである)、特定のタンパク質に対して特異的に結合する。これまでに約200種類のアプタマーが特定されている。それらのうちには、肝癌細胞(ヘパトーマ)に特異的に結合することが確かめられているものがある。また、ヘパトーマに特異的に結合するアプタマーとして特定されているもののうちには、通常は胎児にのみ発現するPDGFα(血小板由来増殖因子α受容体)を認識して結合するものがある。本発明の好適な実施の形態の1つに、このアプタマーを付着させたナノ粒子を用いて、肝癌細胞を標的化するようにしたものがある。また別のアプタマーとして、前立腺特異的膜抗原を認識するといわれているものもある。或いはまた、Eyetech, Inc社が開発した、VEGFに対するアプタマー剤であるMacugen(登録商標)を使用するのもよい。VEGFは腫瘍において過剰発現するものであり、これは、腫瘍が血管新生を必要としていることによるものである
【0063】
ナノ粒子は、ペプチド、抗体、抗体断片、ないしはアプタマーを付着させることによって、病的細胞を標的化することのできる標識となる。ナノ粒子は更に、ミトコンドリア標的化ペプチドを付着させることによって、標的細胞内に入った後にミトコンドリアの細孔の中へ入り込むようにすることができる。ナノ粒子は、ミトコンドリアの細孔より僅かに大きいため、細孔に入り込んだならば、その細孔にぴったりと嵌合する。続いて、フォトンによってそのナノ粒子を活性化すると、そのナノ粒子がミトコンドリア膜に孔を開けるため、その孔から「シトクロムc」が漏出する。こうして「シトクロムc」が細胞質の中へ漏出することによって、アポトーシス(細胞の自殺過程)の引金が引かれ、細胞がみずから分解し始める。本発明に使用することのできるナノ粒子には、例えば、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、それに、それらが組合わさった粒子などがある。
【0064】
ビーム径及び波長が屈折に及ぼす影響について:高エネルギX線ビームは、通常、互いに密度の異なる2種類の物質の間の境界面を通過する際に、何ら影響を受けないエネルギビームとしてモデル化されている。しかしながら、このようなモデルが妥当性を有するのは、X線ビームのビーム径が大きく、実際には発生している小さな屈折が、そのビーム径より小さい場合に限られる。ビーム径及び標的寸法が(本発明のように)小さくなると、その小さな屈折が無視できないものとなる。即ち、屈折が非常に小さくても、その屈折によってビームが移動してしまうのである。標的は非常に小さく、また望ましいビーム交差部の寸法も同じように小さいため、小さな屈折といえども無視することはできない。
【0065】
波長が短くなるほど屈折は小さくなる。このことは虹を見れば即座に理解できることであり、また、屈折が回折による場合もそのようになる。波長がゼロに近付くにつれて屈折もゼロに近付く。そのため、異なる波長どうしは互いに分離され、夫々に異なった経路をたどることになる。それが偏光であるならば、虹色を呈することになる。それが非偏光X線でしかも非コヒーレントなX線であるならば、一見してランダムなように見える散乱が発生する(ただし散乱角は小さい)。また、それが超音波であるならば、分散が発生し、移相が発生し、更には波長の変化も発生する。エネルギビームに発生する変化を予測可能にするには、そのエネルギビームを改良しておく必要がある。エネルギビームがX線ビームであるならば、導波管を用いる公知の方法によって、それをコヒーレントなビームにすることができる。そのためには、そのX線ビームのビーム径に適合した断面寸法を有し、導波長さが僅か3フィート(約90cm)程度の直線導波管を用いればよく、それによって所望の結果を得ることができる。更にその導波管に、低エネルギのフォトンを吸収するフィルタを付加すると共に、X線源としてエネルギ上限値を超えないX線を射出するようなX線源(例えばX線管)を使用することにより、高度の均質性を備えたX線ビームを得ることができる。また、更に高い精度が得られる別の方法として、X線ビーム(例えばライナックで発生させたX線ビーム)を偏向させることによって、そのX線ビームに含まれる様々な波長のうちのただ1つの波長だけを導波管へ入射させるという方法もある。
【0066】
ビーム経路の選択、ビーム発生器の移動操作、患者の移動操作について:互いに直交する3本のエネルギビームを使用し、それらエネルギビームの交差部が画像形成システムのアクティブ領域に位置するようにしてある本発明の好適な実施の形態を用いるならば、ビーム発生器の移動操作は、精密照準合わせ機構による移動操作が可能な範囲内に位置付けるための移動操作だけでよく、その範囲を超えて移動操作する必要はない。患者の位置を移動操作するためにMRI装置に備えられているガントリテーブル機構は、処置を施すために患者を適切な位置に移動させるのに必要な全ての自由度である6つの自由度を備えている。しかしながら、処置を施す身体の部分によっては、互いに直交する3本のエネルギビームが夫々に標的に至る経路を最適経路とすることができないこともある。1つの好適な実施の形態においては、全てのビーム経路を最適化するために、少なくとも2台のビーム発生器を、6つの移動自由度を備えたものとする必要がある。どのビーム径路を選択すれば最適ビーム経路となり得るかの判断は、エネルギビームの影響を受けやすい組織を損傷させないようにすること、複雑な形状のエネルギビームにとって障害物となる部分を回避すること、それに、所望の結果を達成するために必要なエネルギビームによって供給するエネルギ総量をできる限り抑えるようにすることを考慮して決められる。
【0067】
ビーム経路の偏向量などの諸量の算出:本発明の好適な実施の形態の一部に、フィードフォワード制御量、ビーム径路、ビーム偏向量、吸収量、減衰量、散乱量、及びそれらの結果としてのロボット式駆動機構の制御量を事前算出するということがある。事前算出する、ロボット式駆動機構の様々な構成要素に必要とされる、移動量、トルクの大きさ、及びモータ電流の大きさは、ビーム径路、ビーム偏向量、吸収量、減衰量、及び散乱量の関数である。事前算出しておいた移動量に、フィードバック制御が更に組合わさることによって、ビーム交差部を標的に高い精度と高い正確度をもって定位することが可能となっている。
【0068】
特異点について:特異点というのは、数学的に不定であるために制御上の問題となる動作点のことである。特異点が発生するのは通常、自動化された演算処理においてゼロで除する除算が行われたとき、または、演算処理の結果、解が複数存在したときである。本発明の好適な実施の形態は、本来的に特異点を生じる性質を備えたものである。特異点の問題を解決する方法としては、幾つかの方法が考えられる。それらのうちの1つは、標準移動量及び標準移動経路として夫々複数通りの移動量び移動経路を定め、それらの間に一意の優先順位を付しておくというものである。即ち、初めて標的へ接近するときに用いる標準移動経路と、2度目、3度目、4度目、…に標的へ接近するときに用いる標準移動経路とを異ならせる。更に、そのような標準移動経路が、標準移動量を含んでいるようにしてもよく、以上によって殆どの特異点を除去することができる。
【0069】
図3及び図4に関連して上で述べたように、ビーム経路を選定するための演算は、標的の周囲の組織の中に存在している障害物、その組織の中における距離、及び、その組織の中における密度から算出する演算である。ここでいう障害部分には、ビームの影響を受け易いためにビーム経路が避けなければならない部分の組織も含まれる。障害部分の距離及び密度は周知であり、通常のヒトの身体(変形または損傷のない)についてのパラメータの範囲内であり、患者の事前スキャンによって迅速且つ容易に検証される。この知識ベースに基づいて計画プロセス及び標的化プロセスにおける演算時間を短縮することができる。ある密度の組織の中を進行してきたビームがそれと異なる密度の組織へ入る遷移点ごとに屈折角を算出し、その屈折角は、標的から手前と向こうとの両方向に有効である。屈折は複数箇所で発生することがあり、その場合にはビーム径路は複雑なものとなる。このプロセスを簡明にして特異点を低減または消滅させるには、身体の個々の領域にある標的ごとに、夫々の種別のプロシージャに対応した標準ビーム径路を用いるとよい。ビーム径路の選定という目的のための体内に必要とされる領域の合計個数は、現時点では定かでないが、おそらく100個を超えると思われる。標準ビーム径路は、患者の特定の用途ごとに自動的に適合させるための許容誤差と共に定義される。
【0070】
骨及び組織の密度の算出について:事前スキャンにおいては骨及び組織の密度の算出も行われ、それらの算出値は標的特定及びビーム径路選定に用いられる。画像形成システムによっては、密度情報が得られるようにするために何らかの適合を施さねばならないものもある。場合によっては、システムに更にセンサを追加して、そのセンサからシステムに入力を取り込むことが必要なこともある。年齢、性別、それに健康上の問題点などをシステムに入力して利用することによって、プロセスを迅速化し、また、密度の値を求めるための演算負荷を低減することができる。更に、CTスキャン装置やPETスキャン装置を用いることにより、密度に関する有用な情報を得ることができ、なぜならば、骨に関しては(骨以外の組織についても多少は)、そこに含まれる分子の個数が密度の指標となるからである。
【0071】
入射部位の形状単純化(浸漬、ジェルの塗布)について:超音波ビームでは(或いはその他のエネルギビームでも)、それを超ナロービームとして用いる場合には、身体の入射部位の表面に形状単純化を施すことが必要なことがある。それは、皮膚の表面の形状が凹凸のある不規則形状であると、それによって予測不可能な大きな屈折が発生する可能性があるからである。このような身体の表面の形状に由来する誤差導入原因の多くは、皮膚の表面に塗布剤を塗布することによって、或いは、身体を水中に浸漬することによって、低減ないし解消できることができる。塗布剤や水の密度は皮膚の密度と同程度であるため、塗布剤または水と皮膚との境界面の形状が不規則形状であっても、エネルギビームは、その境界面を通過する際に全くもしくは極めて小さな屈折しか発生しないのである。
【0072】
エネルギの種類と速度について:ある密度を有する物質の中を、超音波、マイクロ波、及び放射線が夫々に進行する速度は既知であり、また、その速度は互いに異なっている。互いに異なった種類のエネルギビームを組合せて用いる複合ビーム方式とする場合には、段階的発射方式とすることが必要なことがある。この段階的発射方式とは、互いに異なる種類のエネルギビームが所望の時刻に所望の順序で標的に達するようにする方式である。これに関しては、例えば、ある種類のエネルギビームが標的に到達する時刻より僅かに先行して、或いはその時刻より僅かに遅れて、別の種類のエネルギビームが標的に到達するようにすることが望ましいこともあれば、全ての種類のエネルギビームが同時に標的に到達することによって、それらエネルギビームの合計エネルギレベルがスレショルド値を超えるようにすることが最善であることもある。種類の異なったエネルギビームが標的に順次到着するようにした好適な実施の形態によって期待できる効果は、順次到達する複数種類のエネルギビームの夫々のエネルギレベルのスレショルド値をより低く設定できることである。例えば、最初に放射線ビームで細胞膜を弱らせ、続いて、マイクロ波ビームで加熱して細胞を膨張させ、続いて、弱った細胞を超音波ビームで振動させて速やかに破壊するようにすれば、それらエネルギビームのスレショルド値をより低く設定することができる。一方、種類の異なったエネルギビームが標的に同時に到達する方式によって期待できる効果は、所望の作用を発生させるために必要とされる合計エネルギレベルのスレショルド値を短時間で超えられることである。
【0073】
速度差を利用してビーム交差部を形成することについて:同一種類のエネルギビームであっても、そのエネルギビームがその中を透過して進行する物質が異なれば進行速度は異なる。これとは逆に、単一種類の物質の中を互いに種類の異なるエネルギビームが互いに異なる進行速度で進行する場合には、更に複雑なことになる。例えば、その中を通過する物質がいかなるものであっても、超音波ビームの進行速度は常に放射線ビームの進行速度よりはるかに遅い。これに加えて更に、超音波ビームは、その中を透過して進行する物質が異なれば、その進行速度も異なったものとなる。
【0074】
本発明の好適な実施の形態では、このようなエネルギビームの進行速度の相違には、フィードフォワード制御のためのモデル作成を行う過程で対処するようにしている。ただし本発明は、このようなエネルギビームの進行速度の相違を利用して、単一のビーム発生器から射出される互いに異なるエネルギビームどうしを交差させてビーム交差部を形成するようなものとすることも可能である。これを実現するには、進行速度の遅い種類のエネルギビームを先に発射し、進行速度の速い種類のエネルギビームを後から発射して、標的上で進行速度の遅いエネルギビームに進行速度の早いエネルギビームが追い付き、それにより、複数のエネルギビームが集まったバーストとして、高エネルギのビーム交差部が形成されるようにすればよい。
【0075】
腫瘍の密度を利用して標的特定及び照準合わせを行うことについて:一般的に腫瘍細胞ないし癌細胞の密度特性は、健康な正常細胞の密度特性とは異なっている。そこで、この密度特性の相違を利用して、標的特定及び標的破壊を容易化することができる。即ち、エネルギビームの吸収率が異なるために画像コントラストが発生し、このことは、本発明の好適な実施の形態において利用することのできる有用な特性である。更に、エネルギレベルをフィードバック制御するためのフィードバックループを本発明において利用するようにすれば、組織の密度に対してエネルギビームをの照準合わせを行うことも可能であり、それによって照準合わせの作業を大いに改善することができ、ひいては正確度及び/または動作速度が改善される。
【0076】
画像形成装置によるエネルギビームの位置の継続的な監視は、そのエネルギビームがイオンを含んでいると行いやすく、なぜならば、荷電粒子の電荷それ自体も、またその電荷の運動によって発生する電磁界も、磁気共鳴装置に用いられている検出器にとっては検出可能なものだからである。ただし、荷電粒子が検出器を通過する際に発生する磁界によって、画像の歪み即ち干渉が発生する。この画像の歪みは、数学的処理によって補償することができ、また、例えば画像間の減算処理や画像の一部除去などのその他の処理によっても補償することができる。
【0077】
更に、イオンを含むエネルギビームは、そのような2本のビームが互いに近接していると、そのことによって生じるビーム径路の偏向が複雑なものとなり、そのことが制御システムにとってはやっかいな問題となる。同種電荷の荷電粒子どうしは反発し合い、異種電荷の荷電粒子どうしは引き合う。エネルギビームが体内に進入した後にまで荷電粒子がそのビーム中に残っている場合には、そのような反発力ないし引力がビーム経路に影響を及ぼすことになる。
【0078】
デジタル化方式(演算解析よりも視覚解析を優先させる方式)−MRI装置のアーキテクチャに施す改変について:可能最善の画像解像度を達成し、且つ、画像ジッタを回避するためには、フレームグラビング方式ではなく、ダイレクトデジタイゼーション方式を採用する必要がある。ソースデータを標準ビデオ信号(RS170)に変換した後にフレームグラバ及びデジタイザを使用すると、それによって誤差が入り込み、情報が失われることになる。本発明のシステムパフォーマンスを改善するためには、ダイレクトデジタイゼーションを行えるように、画像形成装置のハードウェアに対して、コンフィギュレーションの変更を施すか、ないしは、そのハードウェア自体に改変を施す必要がある。
【0079】
波の弱め合いと強め合いについて:使用するエネルギビームが、連続した均一なエネルギ波のビームとしてモデル化し得るものである場合には、そのエネルギ波の移相制御が重要であることは、考えるまでもなく理解されることである。この移相制御は、ビーム交差部において最大エネルギが放出されるようにするために必要なものである。当業者には容易に理解されるように、標的位置へのエネルギ供給を最適化するためには、この移相制御を非常に高い精度で行う必要がある。ただし、移相制御が意味を持つのは、使用する複数本のエネルギビームの軸心が同軸的関係にあるか、或いは、それらエネルギビームの軸心どうしのオフセット角が小さいかの、いずれかの場合だけである。エネルギビームの軸心どうしのオフセット角が大きくなるにつれて、移相制御の効果は小さくなり、そのオフセット角が90度になれば効果はゼロになる。オフセット角が90度のときには、移相とは無関係に、ビーム交差部のどの部分にも、完全に足し合わせとなる領域と、完全な相殺となる領域とが存在することになる。
【0080】
一方、使用する複数本のエネルギビームが、電子と衝突するサブ原子粒子(フォトン)のビームとしてモデル化することが妥当なものである場合には、結論は上と異なるものとなる。ビーム交差部において単なるエネルギビームどうしの足し合せとなることの合理性は明瞭である。実際に、周知の方法でX線を原子に作用させて調べると、ビーム交差部において弱め合いは殆ど若しくは全く発生していないことが分かる。ビーム交差部におけるエネルギの放出は、コンプトン効果及びトムソン効果によるものである。またそれらに加えて更に、高エネルギのフォトンどうしの衝突が発生する可能性もあり、その場合には、その衝突によってもエネルギが放出される。
【0081】
図8A、図8B、及び図10は、標的細胞を破壊するために2つのビーム発生器から射出されたエネルギ波を示した図である。当業者であれば、エネルギ波の特性、並びに、ビーム交差部におけるエネルギ波どうしの強め合いについては、既に理解しているはずであり、それらを考えれば、標的細胞に対するそれらエネルギ波の作用についても明瞭に理解されるはずである。例えば、図8A及び図8Bは、ビーム交差部の内部でのエネルギ波の強め合いについて説明した図である。図8Aの左側に示したように、2つのエネルギ波の各々が単独で存在するとき、それらの振幅は「x」であり、波長は「y」である。それら2つのエネルギ波が互いに同位相で重なり合うと、振幅は「2x」となり、波長は「y」のままである。一方、図8Bに示したように、ビーム交差部で、それら2つのエネルギ波が互いに位相がずれた状態で重なり合うと、エネルギ波2、3によってエネルギ波1が形成される。図10に示したのは磁界と電界とから成る電磁波であり、図中にはこの電磁波の波長と伝搬方向を併せて記入してある。図10に示した電磁波は、1個の波の開始点から強度が上昇して行き終了点ヘ向かって強度が減少して行っている。最も重要なことは、図10から明らかなように、ビーム交差部においては磁界と電界の両方が強め合うということである。
【0082】
合焦点の集中について:もしエネルギの発射と発射との間に処置対象者も移動させず、ビーム発生器も移動させなかったならば、処置対象者の身体のビーム発生器に最も近接した部分の表面に合焦点の集中が発生する。同一の標的に対してエネルギの発射を複数回に亘って行う必要があり、しかも、エネルギの発射と発射との間に実行される精密照準合わせの際に、1つまたは2つの角度の調節しか行われない場合には、実際にこの合焦点の集中が発生する。またその場合に、合焦点が集中する領域の形状は、標的の最外周を囲繞する円を底面とし、ビーム発生器の端を頂点とする円錐形となる。この円錐形の切断面(この切断面は様々なビーム径路から成る)は、ビーム発生器に近付くほど小さくなり、そのため、身体の表面において集中は最大となる。図4に示したように、患者ないしガントリテーブルを僅かに移動させるだけで、ビーム径路を十分に変化させることができれば、それによって、この合焦点の集中に関する問題は回避することができる。
【0083】
エネルギレベルのスレショルド値に関する考慮事項について:図5は、既述のごとく、複数本の電離放射線ビームを使用したときの合焦点における幾つかのパラメータの概略予測値を示した図である。例えば、エネルギ量、エネルギ勾配、細胞のエネルギ吸収量、及び細胞死率は、4本のビームを使用したときに最も大きくなっている。電子顕微鏡の場合と同様に、合焦点におけるエネルギ集中度を高めることによって、合焦点に存在する細胞からの放出を発生させることができる。その放出を計測して解析することによって、画像情報を補強することができ、ひいてはシステムの制御機能及び標的特定機能を向上させることができる。
【0084】
細胞にダメージを与えるために必要とされる最小限度のエネルギ吸収量をzとし、人体への入射点におけるビームの強度ないし吸収量をyとし、標的におけるビームの強度ないし吸収量をxとし、ビームの本数をwとするならば、、
1/w・z<x<y<z
となる。
【0085】
エネルギ吸収速度を算出する際には、エネルギ勾配も考慮しなければならない。エネルギレベルが高いほどエネルギ吸収速度が高速となると考えられ、それゆえ、ビーム交差部の外部でのエネルギ吸収速度よりも、ビーム交差部の内部でのエネルギ吸収速度の方が大きくなり、どれほど大きくなるかは、エネルギビームの本数に応じて決まる。ビーム交差部の外部でのエネルギ吸収速度をmとし、ビーム交差部の内部でのエネルギ吸収速度をnとし、エネルギビームの本数をwとするならば、
w・m<n
となる。
【0086】
エネルギレベルのスレショルド値を低く設定できることについて:本発明においては、細胞を破壊するために有用な細胞それ自体の特性を利用するという方式を用いることで、エネルギレベルのスレショルド値を低く設定しようとするものである。この方式を用いることによって達成される、細胞の破壊に必要とされるエネルギ量の低減の程度は、細胞全体に対するミトコンドリアまたはリソソームの体積割合が5%以下の場合に、約100分の1になると予測される。またこの方式では、実際に細胞を破壊しているのはエネルギビームから供給されるエネルギではなく、細胞中の酵素である。
【0087】
制御アーキテクチャ(図14〜図19)について:フィードフォワード制御である。本発明に用いるフィードフォワード制御の好適な実施の形態では、プロセスの物理特性を表すパラメータとして、標的位置と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率及び減衰率と、個々のビーム経路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、6自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するようにしている。このフィードフォワード制御における具体的な制御動作は、これら全てのパラメータに基づいて決定されるものである。
【0088】
ロボット式駆動機構は、複数の静止位置の各々において自己キャリブレーション方式で再キャリブレーションを実行し、この再キャリブレーションは処置対象者の体内の静的または準静的な複数のランドマークに基づいて行われる。更に、標的またはエネルギビームが視界の外へ移動してしまった場合にも、ロボット式駆動システムは自動的に再キャリブレーションを実行し、そしてフィードバック入力が失われた位置から再始動する。
【0089】
フィードバック制御と精密照準合わせについて:フィードバックループは画像形成装置のサブフレームから収集されるデジタル情報に基づいて動作する。サブフレームからは、標的近傍の小さな領域についての情報が得られる。サブフレームの大きさは、標的とフィードフォワード制御によって照準合わせされた複数本のエネルギビームとが、確実にこのサブフレームの中に位置することができるだけの大きさがあればよい。標的とそれらエネルギビームとがサブフレームの中に位置したならば、そこからフィードバックループによる制御を開始してエネルギビームの精密照準合わせを行い、それによって、それらエネルギビームビームを標的の内部のビーム交差部目標位置に収束させる。
【0090】
この多段階式の照準合わせ方式を有効に機能させる上で、ロボット式駆動機構に要求される精度は、標的に対する相対的な静止位置を約100〜200μmの許容誤差の範囲内で保持することのできる精度である。これに関して、1つの好適な実施の形態では、ロボット式駆動機構それ自体が、画像形成装置から得られるフィードバック信号に基づいたフィードバック制御を行うことによって、この許容誤差の基準に適合するようにしている。ただし、この許容誤差の値を、移動サイクル中にシーケンシャルに変化させるようにしてもよい。即ち、移動サイクル中の、本発明がバーストの発射に取りかかる1つまたは2つの時点でのみ、そのとき静止しているロボット式駆動機構がこの許容誤差の中に収まっているようにしてもよい。尚、この方法を用いる場合には、その移動サイクルに合わせて、画像形成フェーズと制御フェーズとを適宜切替えることが必要になる。
【0091】
ロボット式駆動機構が実行する照準合わせの目的は、標的及び全てのエネルギビームをサブフレームの視界の中心から400〜500μm以内に位置付けることにある。サブフレームの視界の大きさが4mm平方であれば、このように位置付けることによって、それに続いて実行される精密照準合わせ制御において、標的の位置に対する夫々のエネルギビームの位置を誤差として測定することのできる適当な広さのスペースが確保される。そして、そのように測定された夫々のエネルギビームの位置の誤差の値が、フィードバックループの制御ルールへの入力として用いられる。
【0092】
フィードバックループの制御ルールは、入力されたそれら誤差の値を、精密照準合わせ機構を制御するための夫々の制御信号に変換する。例えば、その精密照準合わせ機構が、電磁石で発生させた磁界によってエネルギビームを偏向させる機構である場合には、制御ルールは、それら誤差の値に対応した大きさの夫々の電流を発生させる。それら電流で精密照準合わせ機構が駆動されることによって、エネルギビームが所望の偏向量だけ偏向させられる。
【0093】
精密照準合わせのための制御ルールのゲインは、比例動作を考慮して可変的に自動で調節される。即ち、サブフレームの視界の中での個々のエネルギビームの移動量が、精密照準合わせ機構の磁界変化量に比例したものとなることは当然であるが、ただし両者の関係は必ずしも正比例関係となるとは限らない。精密照準合わせ機構において発生したエネルギビームの偏向量が同じであっても、そのエネルギビームが標的に到達するまでに透過して行かねばならない媒体が異なれば、サブフレームの視界の中での個々のエネルギビームの移動量は、多少なりとも異なったものとならざるを得ない。例えば、図4に示したように、腱または骨のすぐ横をかすめて透過しているエネルギビームは、精密照準合わせによって移動させられて、それまで透過していた媒体とは異なる媒体に接触し、或いはその異なる媒体の中を透過するようになったならば、それによって、そのエネルギビームの偏向パターンは急変することになる。ただしその場合であってもなお、サブフレームの視界の中でのそのエネルギビームの位置は、精密照準合わせ機構による制御の連続関数となる。従って、精密照準合わせ機構による制御とエネルギビームの移動量とが正比例関係になくても、エネルギビームの移動量は測定可能であり、それゆえ、エネルギビームの移動量を制御ルールに適切に組込むことによって、所要の精度を達成することができる(ただし、エネルギビームを所望の偏向量だけ偏向させることができるように、精密照準合わせ機構が十分な感度をもってエネルギビームを移動させることができるものである必要がある)。尚、フィードバック制御の一部として、移相量を調節するための制御を組込むことが必要となることもある。
【0094】
画像を用いた制御について:サブフレームの画像を用いて制御を行うようにしているのは、本発明の好適な実施の形態に必要とされる高速の動作速度と高い精度とを共に実現するためである。それらを共に実現できるのは、センサアレイの全体のうちの小さな部分だけを最大限の精度で処理するようにしているからである。1枚の画像の全体に対応したセンサアレイの全体の大きさは40cm平方〜60cm平方であるのに対して、フィードバック制御のための処理対象となるサブフレームに対応した部分の大きさは約3mm平方〜4mm平方である。センサアレイを構成している個々のセンサにより収集される個々のピクセルについての基本情報は、センサアレイの大きな部分に亘って分布している。そのため、サブフレームに関連した全ての有用情報を収集するには、直感的に考える大きさよりもはるかに大きなセンサアレイの一部分だけを処理する部分的処理が必要とされている。
【0095】
ロボット式駆動機構の安定条件について:このシステムは複数のロボット式駆動機構を作動させているため、それらロボット式駆動機構の夫々に対応した座標系どうしが互いに安定している必要があり、その安定度の許容誤差は、フィードバック制御ループが1サイクルの動作を行う間に生じる相対的なずれが約0.1μm以下になるようにするというものである。この設計基準は、フィードバック制御ループの動作速度に応じて決められる。フィードバック制御ループの動作速度が高速になれば、この許容誤差を大きくすることができる。フィードバック制御ループの動作速度にとって制約要因となるのは、MRI装置のフレームレートである。文献に記載されているところによれば、高精度の画像が得られるMRI装置のフレームレートは毎秒約10フレームである。ロボット式駆動機構のエンドエフェクタ(ビーム発生器)にジャイロスコープを装着することが、上記の設計基準を達成する上で有効である場合がある。
【0096】
このシステムは、プロシージャの実行速度を向上させるために、エネルギビームのビーム径を変化させる機能を備えている。大きな細胞群を形成している多数の細胞を殲滅する際には、ビーム径の大きなエネルギビームを使用すれば、より短時間で殲滅を完了することができる。小さな細胞群や個々の細胞を標的とする際には、ビーム径の小さなエネルギビームを使用すればよい。
【0097】
このシステムは、個々の患者に合わせた初期設定を行う際に、医師が非常に多くのパラメータの値を入力する。そして、医師によって初期設定されたパラメータの範囲内でのみこのシステムは動作する。ただし、このシステムが実行するプロセスは高度に自動化されており、一旦プロセスが開始されたならばその後は自動的に実行される。それゆえ、このシステムには、緊急停止ボタンなどのフェイルセーフ手段を組込んでおくとよい。
【技術分野】
【0001】
関連出願の言及: 本願は、米国仮特許出願第60/976699号(2007年10月1日付けで米国特許庁に出願)、米国仮特許出願第60/982542号(2007年10月15日付けで米国特許庁に出願)、及び米国仮特許出願第61/021941号(200位年1月18日付けで米国特許庁に出願)に基づく優先権を主張するものであり、また更に、米国仮特許出願第60/954364号(2007年8月7日付け出願)の開示内容を包含するものである。
【0002】
連邦主催の研究又は開発に関する言明: 本願は、2008年8月5日付け研究補助金交付申請書により米国国立衛生研究所に研究助成金の交付を申請し、交付決定第00499945号により研究助成金(CFDA検索番号第93.394号)の交付を受けた研究の主題に関するものである。尚、同研究補助金交付申請書の開示内容はこの言及をもって本願開示に組込まれたものとする。
【0003】
共同研究契約者の名前: 第三者との間で締結された共同研究契約などは一切存在していない。
【発明の概要】
【発明が解決しようとする課題】
【0004】
MRI装置とビーム発生器とを用いた癌治療システムが公知となっている。しかしながら、在来のその種の癌治療システムの多くは、治療対象の癌組織の周囲に存在する健康な組織にもダメージを及ぼすものであった。本願に記載するシステムは、在来の癌治療システムを改良して、特に、癌組織の周囲領域に存在する健康な組織に及ぼすダメージを極力低減しつつ、標的組織をより確実に死滅させることを目的とするものである。
【課題を解決するための手段】
【0005】
本発明の1つの実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。そして、前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して機能するようにしてある。
【0006】
本発明の別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームはビーム径路に沿って進行して処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また更に、前記複数本のエネルギビームは、前記ビーム径路に沿って進行して互いに異なる種類のエネルギを供給するためのビームである。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。
【0007】
本発明の更に別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものであり、このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムはフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。また、このシステムは前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている。
【0008】
本発明の更に別の実施の形態は、フォトン利用の非侵襲的外科手術システムに関するものである。このシステムは画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供する。また、このシステムは少なくとも1つのビーム発生器を備えており、該ビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームである。少なくとも1つのビーム発生器は、該ビーム発生器から射出するエネルギビームに処理を施すためのビームプロセッサを備えている。そして、前記複数本のエネルギビームが1箇所で交差するようにしてある。また、このシステムは更にフィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出する。また、このシステムはフィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである。また、このシステムは前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている。
【図面の簡単な説明】
【0009】
【図1A】MRI装置の正面図である。
【図1B】MRI装置の側面図である。
【図2】本発明の1つの実施の形態の特徴を示したシステムブロック図である。
【図3A】ビーム発生器を示すと共に、ビームが皮膚表面に入射するときのビームの偏向(屈折)を示した図である。
【図3B】ビームの入射角、屈折角、及び散乱角を示した拡大図である。
【図4】ビーム発生器を示すと共に、ビームが処置対象者の皮膚、骨、及び腱を通過して標的細胞に達するときのビームの屈折を示した図である。
【図5】本発明の実施の形態において4通りのエネルギビームを用いるときの、エネルギ量、エネルギ勾配、エネルギ吸収率、及び細胞死率の、4つのパラメータの値を示したグラフである。
【図6】3次元空間における4本の電磁波ビームを示した図である。
【図7A】3本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7B】3本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7C】6本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図7D】6本の円筒形ビームが交差したビーム交差部の形状を示した図である。
【図8A】互いに位相の揃った2つの電磁波を示した図である。
【図8B】互いに位相の異なる2つの電磁波を示した図である。
【図9A】2本のビームが交差したビーム交差部の形状を示した図である。
【図9B】2本のビームが交差したビーム交差部の形状を示した図である。
【図9C】2本のビームが交差したビーム交差部の形状を示した図である。
【図9D】3本のビームが交差したビーム交差部の形状を示した図である。
【図10】電磁波を示した図である。
【図11】3本の効力曲線を示したグラフであり、それら効力曲線は夫々、エネルギビームを3本使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力(曲線A)、エネルギビームを1本だけ使用し細胞内小器官にナノ粒子を付着させるようにした本発明の本発明の実施の形態の効力(曲線B)、それに、従来の放射線治療の効力(曲線C)を表したものである。
【図12】MRI装置またはCT装置から成る画像スキャナを第1レベルに設置し、それより低位のレベルに3台のビーム発生器を設置した、本発明の二階建型の実施の形態を示した図である。
【図13】ビーム発生器におけるX線ビームを示した図である。
【図14】本発明の実施の形態における制御シーケンスにおける時系列に従った6つの画像フレームのうちの1つを示した図である。この制御シーケンスは、ビーム発生器を標的に対して初期照準合わせしたときの誤差に対処するために、フィードフォワード制御とともにフィードバック誤差信号の値に基づいてエネルギビームの位置を調節し、最終的にエネルギビームの位置を標的領域に収束させるものであり、エネルギビームの位置が収束したならば、エネルギビームのパルスを発射して標的細胞を破壊する。
【図15】図14に示した画像フレームに続く次の画像フレームを示した図である。
【図16】図15に示した画像フレームに続く次の画像フレームを示した図である。
【図17】図16に示した画像フレームに続く次の画像フレームを示した図である。
【図18】図17に示した画像フレームに続く次の画像フレームを示した図である。
【図19】図18に示した画像フレームに続く次の画像フレームを示した図である。
【図20】ビームスプリッタと照準合わせ機構とを組合せた複合機構(ビームプロセッサ)の実施の形態を示した図であり、図中、ミラー遮蔽洞、前方ミラー群と、導波管集合体とはビームスプリッタの構成要素であり、後部ミラー群は照準合わせ機構である。
【発明を実施するための形態】
【0010】
本願明細書に記載する本発明の様々な実施の形態はいずれも、癌細胞などの特定の細胞を標的として、或いは、癌細胞と非癌細胞とを含む細胞群を標的として、その標的に放射線などのエネルギを供給するシステムを提供するものである。また、それら実施の形態の説明では、周囲の組織に全く或いは最小限度のダメージしか及ぼさずに特定の細胞または細胞群にエネルギを供給することのできる、それら実施の形態に組込まれた方法及びエネルギ供給システムについても説明する。
【0011】
本願明細書に記載する技術は、それ自体が新機軸を成す技術であるのみならず、更に、他の様々な技術と組合せることのできる技術でもあり、組合せることのできる技術としては、例えば、画像形成技術、放射線技術、マイクロ波技術、超音波技術、レーザ技術、ロボット技術、及びその他の様々な技術がある。本発明の実施の形態は、様々な技術の主題を含むものであり、それら技術としては、例えば、標的捕捉技術、制御技術、エネルギ供給方式技術、エネルギ供給機構技術、それにシステム統合技術などがある。
【0012】
本発明に係る技術の利点を享受し得る分野はヘルスケアのみに限られず、その他の様々な分野にまで及んでいる。しかしながら、本発明の初期の目的はヘルスケア関連用途である。例えば、本明細書に記載するように、本発明を用いることにより、外科的処置をなんら必要とすることなく、体内のあらゆる部位の癌細胞を殲滅することが可能である。この癌細胞の除去処置は、腫瘍を形成している癌細胞に対して適用される他に、全身に広がった転移癌の癌細胞に対しても適用される。この技術が更に発展することによって、いずれは、体内からウイルスを駆逐することや、細菌感染を除去することも可能となるであろう。更に、B型肝炎やエイズなどの疾病も治療可能となるかもしれない。その他の可能性のある用途としては、前立腺細胞などの特定臓器の細胞だけを選択的に除去するという用途などがある。臓器の縮小、臓器の機能改善、それに医療上または美容上の理由による脂肪細胞の破壊なども、可能性のある用途である。更には、血行の改善や関節可動域の拡大などのために、非細胞組織の破壊または解放の処置を施すために利用することも可能であると思われる。
【0013】
材料学−分析、試験、及び補修:材料学の分野では、X線を使用して、材料の分析、試験、及び補修が行われている。本発明を用いることで利用可能な、高エネルギのX線ビーム交差部と、高精度の照準合わせとは、この分野において大きな価値を持ち得るものである。本発明は、顕微鏡レベルで、問題発生箇所にピンポイントで照準を合わせ、その問題発生箇所に対処するための処置を実行し得るものである。
【0014】
研究室用途−化学分析及び結晶分析:化学物質ないし結晶の分析の仕事をしている科学者にとって、本発明の技術は、研究計画の進行速度を速めるものであり、また、本発明の技術を用いなければ収集できないデータの収集を可能にするものである。この分野においても、本発明のビーム交差部の寸法が小さいこと、並びに、そのビーム交差部の位置制御が高精度で行えることは、それらの仕事を行うための他の手段と比べて、利点となるものと予期される。
【0015】
有害ないし不要な細胞の殲滅は、その周囲の細胞の機能を改善することができる。それゆえここに記載する方法及びシステムは、細胞の機能を制御ないし改善するためにも利用可能である。その種の用途のうちには、低強度のエネルギを標的箇所へ供給して細胞を刺激し、或いは細胞治療を行うというものがある。また細胞治療のうちには、細胞膜の薄膜化、細胞移動、不要細胞内物質の分解または破壊、不要細胞外物質または不要非細胞物質の分解または破壊、それに細胞内小器官の刺激などがあり、それらのうちには高調波を利用して行われるものもある。
【0016】
本発明と放射線治療との比較:本発明は、X線を使用するようにした場合であっても、放射線治療とは以下の5つの点において大きく異なるものとなる。第1に、本発明では、細胞死に至らせる方法が異なる。第2に、本発明では、エネルギ量を増大させる際にフォトン1個あたりのエネルギを増大させるのではなく、1秒間あたりのフォトンの個数を増大させる。第3に、本発明では、細胞に本来備わっている機構を巧みに利用するため、処置を1回実施するだけで速やかに細胞死に至らせることができる。第4に、本発明では、供給するエネルギ総量が小さく、フォトン1個あたりのエネルギも小さいため、DNAには殆どダメージを及ぼさない。第5に、放射線治療における標的選択メカニズムが生物学的であり、内部的であり、制御不可能であり、不確実なものであるのに対して、本発明における標的選択メカニズムは機械的であり、外部的であり、制御可能である。
【0017】
放射線治療は、多数の遊離ラジカルを発生させるようにしたものであり、それら遊離ラジカルによって、DNA二重螺旋鎖に二重鎖切断が引き起こされる。ヒトの身体にはこの種の細胞損傷を修復するための修復機構が組込まれている。そのため、放射線治療においては、その修復機構を圧倒できるように、多数の二重鎖切断を引き起こさなければならない。放射線治療を実施するごとに、ヒトの身体の損傷を修復しようとする能力が高まり、そのため、放射線治療を反復して実施していると、次第に治療の効果が低下して行く。
【0018】
本発明は、極めて短時間のうちに(所与の細胞に対して数ミリ秒以内の処置を施すだけで)細胞内プロセスを崩壊させ、細胞内膜を破壊することにより、細胞を死に至らせるものである。細胞内プロセスの崩壊や細胞内膜の破壊が行われると直ちに、細胞のアポトーシスや自己消化のプロセスが開始される。放射線治療の場合でも、その治療により死ぬ細胞は最終的にアポトーシスが発生することで細胞死に至っている。しかしながら、放射線治療の場合には、あくまでも、所与の細胞が死ぬ確率を増大させているに過ぎず、更に、放射線治療を施してから細胞が死ぬまでに数日かかることもあり、場合によっては数週間かかることすらある。これほどの時間がかかるのは、放射線治療の作用を受けるという事象から始まって、細胞のアポトーシスが発生するという事象に至るまでの間には、非常に長い事象の連鎖が存在しているからであり、これに対して、本発明の事象の連鎖は非常に短い。この事象の連鎖が長くなるほど、実際に細胞のアポトーシスの発生という結果に至ることが不確実なものとなる。
【0019】
本発明では、複数本のエネルギビームを用いて、体積の小さな標的空間に多量のエネルギを供給する。そして、各々のエネルギビームが、ビーム交差部において、さらなるエネルギをもたらす。ビーム交差部における合計の電子ボルト(エネルギ)は、それら複数本のエネルギビームによって制御され、このことは、個々のフォトンの電子ボルトを増大させることでエネルギを制御している放射線治療と異なる点である。この相違点は重要であり、なぜならば、本発明はこれによって、a)より早く吸収されやすいフォトンエネルギを利用することと、b)処置対象者の体内に供給するエネルギの総量を低下させることとが可能となっているからである。
【0020】
標的へ流入するエネルギのピークの絶対値は本発明と放射線治療と同様であるが、そのエネルギの形態が異なっている。本発明におけるエネルギの形態は、低エネルギのフォトンを大量に使用するものであり、これに対して、放射線治療におけるエネルギの形態は、高エネルギのフォトンを小量使用するものである。
【0021】
本発明では、ビーム交差部に大きなエネルギを供給することによって、細胞を焼灼することなく、細胞膜や細胞内小器官を破壊し得る程度の化学的及び生理学的な崩壊を引き起こすようにしている。この化学的及び生理学的な崩壊は、ビーム交差部において大量のフォトンが低エネルギの反応である減衰反応を発生することによって引き起こされるものである。放射線治療は、より高いエネルギ領域の反応であるコンプトン反応に大きく依存しており、DNA鎖を切断することのできる遊離ラジカルをコンプトン反応によって大量に発生させるものである。
【0022】
本発明は、ビーム交差部及び/またはナノ技術を利用して、標的細胞を非標的細胞から区別する選択性を確保している。本発明のアーキテクチャに用いられているコンピュータ及びマニピュレータは、ビーム交差部における選択性を制御することができる。また、ナノ粒子にモノクローナル抗体などの標的化分子を付着させることによって、本発明に二次的な選択性を付与することができる。ナノ粒子に標的化分子を付着させることによって、そのナノ粒子を特定の種類の細胞により高い密度で蓄積させることができる。より具体的には、この方法によれば、例えば癌細胞を標的化することができる。ナノ粒子を使用することで、本発明を用いて細胞死を惹起するために必要なエネルギ量を大幅に低減することができるため、本発明を実施する際の出力エネルギのエネルギレベルを引き下げて、細胞に蓄積したナノ粒子の密度が標的細胞であることを示すスレショルド密度以上になっている領域で複数本のエネルギビームが互いに交差した場合にのみ、細胞死が惹起されるようにすることができる。この方法を採用することによって、本発明の標的特定の能力が倍増する。なぜならば、細胞に蓄積したナノ粒子の密度がスレショルド密度より低いか、または細胞の位置にビーム交差部の位置が一致していないかの、何れかが該当していれば不発モードとなり、その細胞に対しては何も行われないからである。この選択性の高さは、処置を施す対象領域が、例えば神経細胞などのようなエネルギビームの影響を受けやすい組織に近接している場合に、特に重要なものである。
【0023】
放射線治療では、破壊する細胞を選択するために、細胞分裂サイクルを利用している。細胞は、細胞複製過程のある特定の段階で、そのDNA鎖が特に切断され易くなる。癌細胞は、細胞複製のためにより長い時間を費やすことから、放射線治療の影響をより大きく受けることになる。ただしこれは、正常細胞より癌細胞の方が、放射線治療の影響を受ける状態にある確率が高いというだけのことである。実際には、正常細胞であっても放射線治療が実施されたときに細胞分裂過程にあった細胞は殺され、一方、癌細胞であっても放射線治療が実施されたときに細胞分裂過程になかった細胞は、その放射線治療の影響をあまり受けずに済む。このことが、放射線治療を反復して実施する理由でもあり、また、放射線治療では全ての癌細胞を殺せないことが少なくないことの原因でもある。放射線治療では、たとえ標的細胞がどれほど少なくとも、それら標的細胞の全てを確実に死滅させることのできる方法は存在していない。またそれと表裏一体を成す事実として、放射線治療において照射される放射線ビームの経路上にある健康細胞が絶対に殺されずに済むような方法も存在していない。
【0024】
本発明でも、健康な細胞を殺してしまう可能性はあるが、ただし、その確率は放射線治療と比べればはるかに小さい。実際に、本発明によって健康な細胞にダメージを与えてしまう確率は、診断用X線によって健康な細胞にダメージを与えてしまう確率以上のものではない(場合によっては本発明の方がその確率がはるかに小さい)。
【0025】
二次癌を発生させる確率も、本発明より放射線治療の方がはるかに大きい。この確率の相違は、細胞を死滅させる方式が異なることと同様、患者の体内に導入するエネルギ総量が異なることによるものである。DNA鎖を切断する場合には、意図した通りの切断が行われずに、DNA鎖が改変されてしまうことがある。DNAが改変された細胞はある確率をもって癌化し、二次癌になる。
【0026】
以下に説明する本発明の実施の形態は、人に治療を施すことを目的としたものである。ただし、本発明は、犬や猫、その他の動物の治療にも利用することができる。それゆえ、特許請求の範囲の記載中に使用している「処置対象者」の定義としては、犬や猫などの動物をも含むものと解釈されるべきである。
【0027】
図1A及び図1Bに示した本発明の実施の形態は、在来の画像形成システム1を用いて構成したものであり、この画像形成システム1は例えば磁気共鳴画像形成装置(MRI)や、コンピュータトモグラフィ装置(CTないしCATスキャンと略称されている)などである。画像形成システム1は、図2に示したように、制御システムへ画像情報を出力しており、この制御システムは、破壊すべき細胞を標的として特定する。この制御システムは更に、2本またはそれ以上の複数本のエネルギビーム2を、処置対象者3の標的領域に照準合わせする。尚、それらエネルギビーム2は、ビーム角の非常に小さな超ナロービームとすることが好ましい。制御システムによるこの照準合わせは、画像形成システムから連続的にフィードバックされている画像情報に基づいて行われ、それによって照準合わせの検証と精度向上とがなされている。後に更に詳細に説明するように、この制御システムは、エネルギビームの位置及び方向の制御を行うと共に、エネルギビームのエネルギ強度の制御も行うことができるため、複数本のエネルギビームを標的上に収束させて、エネルギのバーストを発射する。図1Aに示した具体的な実施の形態は、可動水平テーブル4を備えており、同図には、このテーブル4上に載せられた処置対象者3も示されている。この実施の形態は、処置対象者3の上方に、互いに直交するように配設された3台のビーム発生器2を備えている。図1Bに側面図で示した別の実施の形態は、互いに直交するように配設された2台のビーム発生器を備えている。当業者には容易に理解されるように、それらビーム発生器2は、MRI装置1の下方や側方に配設するようにしてもよい。
【0028】
使用するエネルギビーム2の本数は、個々の用途に応じて、2本またはそれ以上の適宜の本数とすればよい。1本のエネルギビームにより供給する最大エネルギレベルは、細胞にダメージを与え得る最小エネルギレベルより更に小さなレベルに設定している。ただし複数本のエネルギビームが交差する合焦点のエネルギレベルは、使用しているエネルギビームの本数に応じて、1本のエネルギビームによるエネルギレベルの2倍、3倍、4倍、…となる。このように複数本のエネルギビームを照射することにより、人体の深部の細胞を、その周囲の細胞にダメージを与えることなく破壊することができる。人体を透過する個々のエネルギビームは(標的領域に到達するまでのビーム部分と標的領域を通過した後のビーム部分とのいずれにおいても)そのエネルギレベルが十分に低いため、標的領域の周囲の健康な細胞には全く或いは殆どダメージを与えることがない。従って、ビーム交差部の中に位置する細胞だけに、その細胞を破壊するのに十分なエネルギが供給されることになる。
【0029】
ビームスプリッタの基本構造:図20に示したビームスプリッタは、以上に説明したような、個々に独立した複数台のビーム発生器を備えた実施の形態とは異なる、別の実施の形態に用いられるものである。この別の実施の形態は、ただ1台のビーム発生器(例えばX線管やライナックなど)を備え、そのビーム発生器から射出される1本のエネルギビームをこのビームスプリッタによって複数本のビームエレメントに分割するものである。これによって、複数台のビーム発生器を使用せずに済むことからコスト及び複雑度が低減されるが、ただしその一方で、1台のビーム発生器から射出される1本のエネルギビームを複数本のビームエレメントに分割して利用するためコスト及び複雑度が幾分増大する。本発明のこの実施の形態のビームスプリッタは、複数本のビームエレメントのうちから使用するビームエレメントを選択して夫々の導波管の中へ導くための複数枚のX線ミラーと、導波管を通過したビームエレメントをビーム交差部へ導くための別の複数枚のX線ミラーとを備えている。また、本発明の更に別の実施の形態として、複数台のビーム発生器を備え、それらビーム発生器の各々に、ビームプロセッサ(このビームプロセッサは、ビームスプリッタと照準合わせデバイスとを含むものである)を装備したものがある。複数台のビーム発生器の各々にビームプロセッサを装備した実施の形態では、ビーム交差部におけるエネルギレベルを更に増大させることができるため、それによって本発明の有用性が更に高まる。
【0030】
図9A〜図9Dに、エネルギビームどうしが交差したビーム交差部を示した。これらのビーム交差部は非常に小さく、そのことによって、高精度の処置が行えるようになっている。図9A〜図9Cに示したビーム交差部の具体例は、2本のエネルギビームが交差したビーム交差部であり、図9Dに示したビーム交差部の具体例は、図9Aに示した2本のエネルギビームが交差したビーム交差部の一部に、更に第3のエネルギビームが交差して形成された、部分ビーム交差部である。このような部分ビーム交差部を形成するためには、個々のビームの照準合わせ精度を更に向上させる必要があり、それには追加の信号処理を行うようにするとよく、この追加の信号処理は「エネルギレベル」をフィードバックするループを形成して、ビーム交差部の内部の電磁気エネルギレベルを計測するものである。ビーム交差部の内部の電磁気エネルギレベルは、使用している個々の電磁気エネルギビームの電磁気エネルギレベルが一定であるならば、そのビーム交差部におけるビーム重なり率に比例したものとなる。そのため、そのビーム交差部の大きさを、フィードバックされるエネルギレベルの大きさの関数として計測することができる。
【0031】
ここに記載するシステムは、特に、ミトコンドリアやリソソームなどの細胞内小器官を標的として破壊することにより、細胞がみずから溶解するようにするという方法を用いることができる。当業者には容易に理解されるように、細胞の種類によっては、1つの細胞内に多数のミトコンドリアが存在しているものもあり、また、1つの細胞内にリソソームなどのその他の細胞内小器官が多数存在しているものもある。そのような細胞をこの方法で細胞死に至らせるには、1つの細胞内に多数存在している細胞内小器官の大部分を破壊する必要がある。ただし、いかなる機序によってもたらされる細胞死であれ、最終的にはその細胞が消化されるということに帰着する。この方法は、ミトコンドリアやリソソームなどの細胞内小器官を攻撃することによって、細胞が消化される過程を開始させるというものであり、そのため、所与の細胞を細胞死に至らせる作業を完遂するために要するエネルギ量を低減できるという、重要な利点を提供するものである。
【0032】
細胞死に至らせるための好適な方法の1つに、細胞内小器官に結合するナノ粒子を使用するという方法がある。使用するナノ粒子の種類には、例えば、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、それに、それらが組合わさった粒子などがある。それらナノ粒子を使用して、細胞内小器官の内部で分子を発熱させて細胞内小器官を膨張させて破裂させ、或いは、細胞そのものを発熱させることによって、細胞死に至らせることができる。細胞死に至らせる別の1つの方法に、ビームストリームの中に高調波を混合することにより、細胞を構成している物質に影響を及ぼすという方法もある。
【0033】
更に別法として、細胞膜を破壊することにより細胞を殺すという方法もある。これを行うには、例えば、図9Dに示したような部分ビーム交差部を形成して、細胞膜のうちの小さな部分がこの部分ビーム交差部の中に入るようにすればよい。複数のエネルギビームが交差することによって、合焦点にエネルギのバーストが発生し、それによってホットスポットが形成され、その結果、細胞膜に穴が開けられる。この穴から細胞構成物質が流出することにより細胞死に至る。この方法では、一度に2個以上の細胞を殺すことができ、なぜならば、ある細胞の細胞膜を破壊するときには、それに隣接する細胞の細胞膜も同時に破壊されるからである。ここに記載するシステムは、以上の説明した様々な方法のうちの何れか1つの方法、幾つかの方法、または全ての方法を用いることで、ただ1個だけの細胞を破壊することも、また、小規模な細胞群を破壊することも可能である。制約要因となるのは、画像解像度、ビーム径、標的特定精度、それに照準合わせ精度である。
【0034】
上で説明したように、本発明の好適な実施の形態の1つは、複数本のエネルギビームを使用しており、それらエネルギビームは、1本だけのエネルギビームでは患者の身体を透過する際に標的領域の周囲の健康な組織に悪影響を及ぼすことのない、低エネルギのビームとされている。そして、複数本のエネルギビームを互いに交差させることによってエネルギのバーストを発生させ、それによって標的細胞を殺すようにしている。図6並びに図7A〜図7Dは、このビーム交差部がどのように形成されるかを、当業者が容易に理解できるようにするための説明図である。例えば図6は、3次元空間内で互いに交差する4本の電磁波ビームを示した図である。それらは電磁波ビームであるため、互いに同一面上に位置させる必要はない。また、それら電磁波ビームが互いに直交している場合には、それらビームの電磁波の位相を揃える必要もない。互いに交差している複数の電磁波の振幅は個々の電磁波の振幅の和となり、この振幅の和は、そのキロ電子ボルト(KeV)の値がビーム交差部の内部の複数の点において極大値を取る。周期関数である個々の電磁波は、その各々がこのKeVの極大値を取る。
【0035】
当業者には容易に理解されるように、合焦点は実際には小さな3次元空間であり、ここに記載する本発明の好適な実施の形態は、その3次元空間を標的として特定する。一般的に、点は大きさを持たないものである。しかしながら、ここでいう合焦点とは、複数本のエネルギビームが互いに交差するビーム交差部を意味している。複数本のエネルギビームが円筒形ビームであって、それらの径が互いに略々等しい場合には、この合焦点の大きさは、それらエネルギビームの断面形状である円形を回転させることで形成される球の大きさに略々等しくなる。図7A〜図7Dに示したように、ビーム交差部の実際の形状は、いわゆるスタインメッツ立体の形状となる。図7Aに示した具体例は、3本の円筒形ビームにより形成された菱形十二面体であり、それら3本の円筒形ビームはこの菱形十二面体の夫々の構成面の中心を通っている。それら3本の円筒形ビームの相対的な配列は、個々の円筒形ビームが正八面体の対向する2つずつの頂点を通る場合の配列と同じである。また、この具体例ににおいて、3本の円筒形ビームにより形成された菱形十二面体の体積は(16−sqrt(128))r3で表される。図7Cに示した具体例は、6本の円筒形ビームにより形成された立方八面体であり、6本の円筒形ビームはこの立方八面体の夫々の辺の中心点を通っている。また、この具体例において、その立方八面体の体積は(16/3)(3=sqrt(12)−sqrt(32))r3で表される。本発明の好適な実施の形態においては、使用する複数本のエネルギビームを互いに直交するビームとすることによって、標的の特定を好適に、そして最良に行うことができ、なぜならば、そうすることによってそれらエネルギビームが交差するビーム交差部の大きさが最小となるからである。使用する複数本のエネルギビームのビーム径が互いに同一でない場合や、それらエネルギビームが互いに直交していない場合には、ビーム交差部の形状が、変形スタインメッツ立体の形状(不図示)になる。4本以上のエネルギビームを必要とする用途では、ビーム交差部の寸法及び形状の、それらビームの収束角に対する依存性は小さなものとなる。
【0036】
図5からは、複数本のエネルギビームを組合せて、各々のエネルギビームのエネルギ密度を低く抑えることにより、解像度及び制御機能が向上することが分かる。より詳しく説明すると、図5に示したのは、複数本の電離放射線ビームを使用したときの合焦点における幾つかのパラメータの概略予測値である。例えば、エネルギ量、エネルギ勾配、細胞のエネルギ吸収量、及び細胞死率は、電離放射線ビームを4本使用したときに最も大きくなっている。電子顕微鏡の場合と同様に、合焦点におけるエネルギ集中度を高めることによって、合焦点に存在する細胞からの放出を発生させることができる。その放出を計測して解析することによって、画像情報を補強することができ、ひいてはシステムの制御機能及び標的特定機能を向上させることができる。
【0037】
MRI装置及びCT装置の多くは、処置対象者3の位置を移動させるための高精度のロボット式ガントリテーブルを既に備えている。本発明の好適な実施の形態の1つにおいては、標的特定及びエネルギ供給のためのシステムにも、そのようなロボット式ガントリテーブルのものと同様のロボット機構を装備してあり、そのロボット機構によって、処置対象者の標的領域を視界の中へ移動させ、また更に、精密照準合わせ領域の中へ移動させることができるようにしている。MRI装置またはCT装置を用いて画像情報を取得するようにしている実施の形態では、このロボット機構を、MRI装置またはCT装置に組込むようにしてもよい。また、本発明の別の実施の形態として、MRI装置またはCT装置からは独立したロボット式ガントリテーブルを装備して、そのテーブルの上に処置対象者を載置して移動させるようにしてもよい。また更に別の実施の形態として、精密照準合わせを行うための手段として圧電デバイス上に搭載されたミラー、或いは、液晶技術やプラズマ技術などを利用したビーム偏向機構を備えるようにしてもよい。これら技術を利用することにより、小さな領域の中でエネルギビームを高精度で照準合わせしてエネルギを供給することが可能となる。画像形成のためのシステム、位置方向制御のためのシステム、及びエネルギ供給制御のためのシステムは、それらの間で衝突ないし干渉を生じるおそれがあるが、そのようなおそれはガウス面緩和法などの方法を用いて低減ないし解消することができる。また、それらシステムの間で高速のスイッチングを行うようにするのも一法である。
【0038】
図12に示したのは、本発明の二階建型の実施の形態の具体例を示した図であり、この具体例では、MRI装置またはCT装置から成る画像スキャナが第1レベルに設置され、それより低位のレベルに3台のビーム発生器が設置されている。そして、3台のビーム発生器が射出する放射線ビームを、第1レベルに設置されているMRI装置またはCT装置の水平テーブル上に載せられた処置対象者に照射することができるようにしてある。この実施の形態において、図12に示したシステムを収容している施設の床構造は、実質的に全てのX線散乱を遮蔽できる遮蔽能力を備えている。この遮蔽能力を実現するための条件は、鉛層で遮蔽するのであればその厚さを14インチとする必要があり、コンクリート床版(鉄筋コンクリート床版)で遮蔽するのであればその厚さを96インチとする必要があるというものである。更にもう1つの条件として、この床構造では床の有効厚さを24インチにしなければならないということがある。ここで、鉛層の厚さをxインチ、コンクリート床版の厚さをyインチとするならば、以上の条件は、X線散乱量−14L=0、X線散乱量−96C=0、X線散乱量−x・L−y・C=0、そして、x+y=24という式で表される。更に、鉛層xの構築コストはコンクリート床版yの構築コストよりはるかに高額であることも考慮する必要がある。以上のデータから最適解を求めると、コンクリート床版の厚さy=12.5インチ、鉛層の厚さx=11.5インチとして、コンクリート床版の表面に鉛層の覆いを設けた床構造とすることによって、鉛層だけで遮蔽するよりもはるかに低コストで目標とする遮蔽能力を得ることができる。以上の評価値は、100MeVのX線を使用するという最も過酷な状況に対応したものである。本発明の好適な実施の形態を採用する場合には、これよりもエネルギレベルの低いX線ビームを使用することが予期されるため、これほどの遮蔽構造とする必要はなく、おそらくは、以上に示した評価値から25%少ない値とすることができるものと考えられる。以上の解析は、最も過酷な状況に対応したものである。
【0039】
図2に示したのは、本発明の1つの好適な実施の形態における構成要素を示したシステムブロック図である。図中、マグネット、RFコイル、RF検出器/増幅器、MRIパルス発生制御部/磁界制御部、それにデジタイザは、MRI装置の構成要素であり、これら構成要素から得られる情報は中央プロセッサへ供給されて処理される。本発明のこの好適な実施の形態は更にその他の様々な構成要素を含むものであるが、それら構成要素のうちの主要なものとしては、ビーム制御部、D/Aコンバータ、電力増幅器、ロボット機構、ロボット式マニピュレータ、処置の実行中に処置対象者を載置する水平テーブルの位置を制御するためのロボット式システム、ビーム発生器、照準合わせ機構、それに様々なデバイス制御部がある。また更に、標的計算コンピュータがあり、この標的計算コンピュータは中央プロセッサに接続されている。標的計算コンピュータはサブプロセッサであり、フィードフォワード制御の命令に関する値を算出して命令の更新を行い、更新した命令を中央プロセッサへ渡す。このサブプロセッサは、処置を施すのに先立って行われる事前スキャンにより得られた処置対象者の身体データを保持しており、また、フィードフォワード制御に用いられる様々なドライバ値及びゲイン値を算出するための数学モデルを保持している。標的計算コンピュータは、それら身体データ及び数学モデルに基づいて、フィードフォワード制御に必要な高度に数学的な計算処理を実行する。その計算処理が完了したならば、算出したフィードフォワード制御に用いられる諸々の値を中央プロセッサへ渡し、そして、その時点で更新されている新たなフィードバック情報を取得して、フィードフォワード制御のための次のラウンドの計算処理を開始する。実際に制御ループを実行しているのは中央プロセッサであり、中央プロセッサは、画像形成装置からの入力、及びその他のセンサからの入力と同様に標的計算コンピュータからの入力に基づいてその制御ループを実行するようにしてある。本発明の好適な実施の形態のうちには、制御アーキテクチャを可能な限り最善のものとするために制御ゲインを動的ゲインとしたものがある。そのような実施の形態では、フィードフォワード制御に関する制御ゲインがゼロになる可能性もあり、フィードバック制御に関する制御ゲインがゼロになる可能性もあるが、ただし、それら両方が同時にゼロにはならないようにしている。このことは、事実上、本発明がフィードフォワード制御だけで実行されることも、またフィードバック制御だけで実行されることもあり得るということを意味している。ただし、このように一方だけの制御で実行されるという状態が1秒以上の長さにわたって継続する可能性は小さい。
【0040】
本発明の好適な実施の形態では、第1段階の照準合わせ(粗照準合わせ)のための手段としては、撮像装置を備えた工業用ロボットに用いられているものと同様の照準合わせ技術を使用している。また、第2段階の照準合わせ(精密照準合わせ)のための手段としては、精密加工や高精細度テレビジョン製造などに用いられているものと同様の照準合わせ技術を使用することができる。いずれの照準合わせ技術にも、標的移動、ビーム偏向(屈折)、ビーム分散、及びその他の様々な誤差発生要因を予測して制御を行うフィードフォワード制御を適用することができる。例えば、呼吸運動は周期的であるため、呼吸運動に伴う標的移動は特定のパラメータ内で予測可能である。また、骨以外の組織の密度に対する骨の密度の比から、発生するビーム屈折及びビーム分散の上限及び下限を予測することができる。フィードフォワード制御に用いる数学モデルをそれら予測値に対応したものとすることにより、フィードバックループの精度を向上させることができる。
【0041】
医療用途におけるX線ビームに関しては、これまで一般的に、そのビーム屈折は無視して構わないものと考えられていた。X線ビームの一般基準としては、1箇所で屈折することによって生じる偏位量の上限を1万分の1以下とすることが定められている。これは、屈折発生点から10cm離れた位置におけるビーム偏位量が約10μm以下であることを意味している。複数の屈折は累積するため、最終的なビーム偏位量はこれよりずっと大きくなる。図3A及び図3Bは、本発明の1つの好適な実施の形態を用いる場合に発生する入射角に関連した問題を説明するための図である。ここでいう入射角とは、エネルギビームが例えば、骨、組織、靱帯、腱、臓器、及びそれらに関連した身体部分などの、ヒトの様々な身体部分に入射するときの角度である。これらの図に示したように、入射角による影響は、細胞の大きさと比べてビーム径が小さくなるほど低下する。ビーム径が細胞の大きさより小さくなると、もはやエネルギビームにとって、人体の表面は平滑面や平坦面とは見なし得ないものとなる。即ち、人体の表面は凹凸のある不規則な形状の面であると見なさねばならず、その上更に、人体の表面は体毛などのエネルギビームにとって障碍物となるものによって覆われている。このように人体の表面が不規則な形状であり、また、人体の表面に障碍物が存在することから、それらに対する補償手段として、剃毛や塗布剤の塗布などが必要となる。更に、本発明の1つの実施の形態における制御システムでは、フィードバック制御の制御ループと、フィードフォワード制御の数学モデルとを用いて、残留偏位量を補償するようにしている。より詳細に説明すると、図3Aにはビーム発生器が示されており、このビーム発生器で発生したエネルギビームが、処置対象者の皮膚に入射している。そしてこの入射に伴って、ビーム偏向(屈折)が発生している。図3Bはこのビーム偏向を更に詳細に示した図である。入射角は、図中に記入したように、人体の皮膚の表面にエネルギビームが入射する角度である。屈折角は、これも図中に記入したように、人体の表面(例えば人体の皮膚の表面)から下方へエネルギビームが進行して行く角度である。図から明らかなように、ここでは入射角と屈折角との和が180度より小さくなっている。尚、当業者には容易に理解されるように、エネルギビームが皮膚へ入射する際のビーム偏向は、そのエネルギビームが図3Bで見て左側へ移動するような方向の屈折となることもあり、その場合には入射角と屈折角との和が180度より大きくなる。いずれの場合も、エネルギビームは人体の表面によっていずれかの方向へ屈折し、それゆえ、健康な組織が受けるダメージを可及的に低減するべく合焦点及び標的領域を適切に定めるためには、このようなビーム偏向を発生させるエネルギビームにとっての障害物を考慮に入れる必要がある。更に、これも図3Bから明らかなように、エネルギビームは人体の表面へ入射した後にビーム径が拡大している。このビーム径の拡大は、図3Bに示したように、入射角、屈折角、それに分散角によるものであり、分散角はエネルギビームが人体の内部のある部分から別の部分へ進入する際などに発生する。
【0042】
本発明の1つの好適な実施の形態では、ビーム偏位量の許容値は約2μmという微細な値であるため、ビーム偏向を考慮した補正が必要とされている。ビーム偏向によって発生するビーム偏位量は、使用するエネルギビームが電離放射線ビームである場合に最も小さく、その他のエネルギビームではそれより大きくなる。そして、偏向比が最も小さいエネルギビームである電離放射線ビームの偏位量が補正を必要とするほどに大きければ、その他のいかなるエネルギビームについても、ビーム偏向の影響を補償するためのフィードフォワード制御が必要である。図4は、フィードフォワード制御システムがどのように利用されるかについての具体例と、それに関連したビーム偏向の具体例とを示した図であり、同図には、エネルギビームが合焦点に達するまでの間に透過する処置対象者の皮膚、骨、及び腱が示され、そして標的細胞が示されている。かかる状況において、図2に示した標的計算コンピュータに搭載されたソフトウェアプログラムは、発生すると予測されるビーム偏向と、その結果として形成されるはずのビーム経路とを事前算出するフィードフォワード制御のための数学モデルを含むと共に、画像形成装置により得られる情報を収集するフィードバック制御を含んでいる。従って、本発明の1つの好適な実施の形態を使用して以上のように構成したシステムは、リアルタイムでの画像取得と、解析と、処置の実施とを、自動化作業として行う能力を備えている。使用するエネルギビームのビーム径を7μmとしたときのこのシステムの動作速度は、1秒間あたり細胞10個〜細胞1000個である。
【0043】
本発明の好適な実施の形態によれば、現在市場に提供されている、エネルギビームを利用するようにした最先端のシステムと比べて、エネルギレベルのスレショルド値をより低く設定することができ、また、正確度、精密度、及び動作速度をより優れたものとすることができる。本発明の好適な実施の形態によれば、エネルギビームのビーム径を小さくすることができると共に、エネルギビームのエネルギレベルを低く設定することができるという利点が得られ、それらによって画像形成装置の信号ノイズが低下するため、システムの性能が更に向上するという利点も得られる。
【0044】
エネルギレベルのスレショルド値をより低く設定できるのは、高熱で細胞を破壊するという方法以外の方法を用いることができるからである。本発明の実施の形態のうちには、高熱で細胞を破壊することに替えて、細胞それ自体の持つ崩壊機構を利用するようにしたものがある。これによって、細胞を破壊するために必要なエネルギ量が低減され、破壊されずに残る細胞も殆どなくなる。その方法とは、リソソームやミトコンドリアなどの細胞内小器官を攻撃するというものであり、これは単に高熱で組織を焼灼する方法と比べてはるかに洗練された方法であるといえる。本発明にとって、組織を焼灼して除去するという方法は、最後にやむなく選択する方法であり、なぜならば、組織の焼灼は、多量のエネルギを必要とするため、体内に傷痕組織を形成してしまうおそれがあるからである。
【0045】
正確度、精密度、及び動作速度の改善は、フィードバック制御にフィードフォワード制御を組合せて用いることによって達成されており、これによって、それらは直接的に且つ劇的に改善される。更に加えて、フィードフォワード制御を組合せることによって、フィードバック制御の作業領域を減縮できるため、フィードフォワード制御のループ1回分のデータ処理量が格段に減少する。そして、このデータ処理量の減少によって、フィードバックループの動作速度が格段に高速化し、それによって更に、プロセス全体としての正確度、精密度、及び動作速度が向上する。
【0046】
本発明の好適な実施の形態のうちには、精密度及び正確度の初期値が約7μm±2μmのものがある。この値は、最も小さいヒト細胞の大きさよりも更に僅かに小さな値である。また、この値は、エネルギビームを利用した在来の装置における各軸方向の精密度及び正確度の値と比べて約50倍も優れた値である。本発明の技術は、画像形成技術及びビーム発生技術が今後向上するのに伴って、精密度及び正確度の値を更に一桁以上改善できる潜在的可能性を有している。また、本発明の好適な実施の形態としてここに記載している技術は、現時点では治癒不能とされている多くの疾病を治癒可能にすることのできる潜在的可能性を有している。また更に、この技術は、治療法ないし処置法が既に存在する多くの領域においても大躍進をもたらし得るものである。
【0047】
在来の癌治療法は、本発明の好適な実施の形態を用いて実施する癌治療法と比べれば、極めて稚拙なものでしかなかった。在来の癌治療法は、ビーム径の大きな1本の放射線ビームを使用したものであり、このような放射線ビームは周囲の組織にダメージを及ぼしていた。また、病変領域の画像を形成して、診断を下し、必要な行動をとるまでの間に時間遅れが存在していた。この時間遅れは、かなり大きなものであることもあり、それによって患者の生死が分かれることもあった。また、再現性が低く、人為的過誤が発生することも多かった。標的特定及び照準合わせの技法としては、非常に初歩的な技法しか採用されていなかった。更に、特定の細胞や、極めて少数の細胞から成る細胞群を標的として設定することは(本発明と比べれば)全く行われていないも同然であった。
【0048】
本発明に係る装置は、癌治療以外のヘルスケアに利用した場合にも、正確度及び再現性が非常に良好であるということが大きな利点となる。また、自動化されたリアルタイムの動作を行うものであるため、人為的過誤が発生する余地がないということも、重要な点である。また、ここに記載している本発明に係る技術が提供する更なる大きな利点として、この技術が非侵襲的であり、従って、侵襲的処置を回避できるということがある。癌治療以外のその他の用途としては、例えば、気道拡大、心臓弁修復、前立腺縮小、聴力改善、脳細胞刺激、止血のための内部焼灼、脂肪肝の治療、ポリープの除去などがある。
【0049】
本発明の好適な実施の形態は、初期設定を行った後には自動化装置として動作するものであり、そのことによって少なくとも、過失の低減、再現性の向上、正確度の向上、動作速度の高速化、それに追跡性能の向上という利点が得られる。また、自動化装置として動作することから、システムの動作形態が有利なものとなっており、これは、細胞を標的として選択して特定する作業を、集中的な計算処理によって行えるからである。エネルギビームの照準合わせ作業は、特に高速で行わなければならず、しかも、特に高精度で行わなければならない。もし人間が、ある1個の細胞に関する情報を取得して正確に判断を下すという作業を行うならば、場合によっては数時間もの時間を要することになる。この作業には非常に手間がかかる上に、過誤も避けられない。たとえ人為的過誤の問題が解決されたとしても、この作業が自動化されていない場合に、処置対象者はその長時間の作業が行われる間じっと動かずにいることに耐えられるものではない。処置対象者が身体を僅かに動かしただけでも、解析対象の領域を数ミリ秒以上の長さに亘って追跡し続けるという作業は非常に困難なものとなる。解析作業と処置作業とは共にリアルタイムで行われる。
【0050】
また画像情報は、目で見る画像としての重要度よりも、数値情報としての重要度の方が更に大きい。MRIシステムにおいては、画像情報を数値情報として取得した数学上の空間(k空間)に対して変換処理を行い、それを目で見るピクセル情報に変換している。この変換処理のための演算の過程で、誤差が入り込む可能性がある。更に、こうして画像情報を目で見る画像の形とした後にも、更に、その画像を読影する人間の視覚的及び心理的な制約がその画像情報に影響を及ぼす。これに対して、自動化作業は、客観性を有し、再現性を有し、作業速度が高速であり、正確度が高く、信頼性が高い。これらの特性は、プロシージャの開始後に行わねばならない様々な作業にとって、単に非常に望ましいということにとどまらず、必須の特性であるといえるものである。記述のごとく、図2は本発明の好適な実施の形態を示したシステムブロック図であり、同図には、システムを自動化して、処置対象者により効果的に処置を施せるようにするための様々な構成要素が示されている。
【0051】
発生させるエネルギビームに関する上の説明では、放射線ビームを発生させる場合について述べた。本発明の好適な実施の形態にとって、放射線ビームを使用することは論理的に妥当性のある選択であるが、ただし、エネルギビームとして放射線ビームを使用することは唯一の選択肢ではなく、実際の用途によっては、放射線ビームを使用することが最善の選択とはならないこともある。本発明におけるアーキテクチャは、人体の組織を透過することのできるエネルギビームでありさえすれば、いかなる種類のエネルギビームを用いても機能し得るものである。本発明の様々な好適な実施の形態のうちには、電波ビームを使用するもの、超音波ビームを使用するもの、それに更にその他のエネルギビームを使用ものがある。本発明には、様々な波長及び様々なエネルギレベルの電磁波ビーム(フォトンビーム)及び機械波ビーム(超音波ビーム)を用いることができる。電離放射線ビームには、かなり大きな副作用があり、リスクがある。また、放射線ビームは、たとえそれが低エネルギのものであっても、あらゆる用途において常に最善の選択肢となるものではない。その他のエネルギビームの方が、合焦性能、透過能力、エネルギ供給能力、安全性、破壊能力、及び/または、副作用の点でより優れていることもある。
【0052】
本発明の好適な実施の形態のうちの1つに、最小の副作用で最大の効果が得られるエネルギビームを選択するという判断基準に基づいて、複数の放射線ビームを組合せて用いるようにしたものがある。また、好適な実施の形態のうちの1つに、細胞膜を破壊するだけで、或いは、細胞内小器官を不活性化するだけで、細胞を殺すようにしたものがある。また、好適な実施の形態のうちの1つに、上で言及したように、細胞を自己崩壊させることによって、細胞がみずから溶解するようにしたものがある。細胞膜を破壊する方法では、その破壊後に残った細胞構成物質が崩壊して行く際に感染が生じるおそれがある。組織を除去する方法では、傷痕組織が形成されるおそれがある。それらに対して、細胞がみずから溶解した後の細胞構成物質はより容易に吸収されて、体内で再利用されるか或いは体外へ排出される。放射線の照射は、細胞膜を分解し或いは崩壊させて、最終的に細胞膜を破壊するように作用する。本発明によって複数本のエネルギビームを制御して、それらエネルギビームを互いに交差させて合焦させることによって、特に、細胞内小器官(リソソームやミトコンドリアなど)または細胞液を加熱し、それによって細胞内小器官を不活性化して細胞死を引き起こすようにしたものもある。またこれと同様に、本発明の好適な実施の形態のうちには、超音波ビームを用いてリソソームなどの細胞構成要素を振動させ、しかもそれを十分に高いエネルギレベルで行うことによって細胞死に至らせることができるようにしたものもある。エネルギビームのエネルギレベルを決定するについては、副作用の大きさとの兼ね合いを考慮する必要があり、ここでいう副作用の大きさとは、使用する特定の種類のエネルギビームが、標的に達するまでの経路上及び標的を抜けた後の経路上に存在する組織に及ぼすダメージの大きさである。使用するエネルギビームがマイクロ波ビームであって、標的細胞が体内深部(身体表面から3〜4cm以上の深部)にある場合には、その標的細胞に到達できるだけの透過能力を持つようにマイクロ波ビームのエネルギ強度を決定したならば、身体表面のビーム入射領域にダメージを及ぼすことが避けられないほど大きなエネルギ強度になる。図11に3本の効力曲線を示した。それらのうち曲線Aは、エネルギビームを3本使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力を表した曲線である。この実施の形態を用いた場合には、標的領域内の細胞死率は100%になる。曲線Bは、エネルギビームを1本だけ使用し細胞内小器官にナノ粒子を付着させるようにした本発明の実施の形態の効力を表した曲線である。この実施の形態を用いた場合には、細胞死率は約50%になり、曲線Aと比べて細胞死率が低下しているのはエネルギビームを1本しか使用しないことが制約となっているからである。曲線Cは、従来の放射線治療の効率を表した曲線であり、この曲線Cを見れば分かるように、ある種の状況下では、従来の放射線治療が、実は、人体に負の効力を及ぼす結果となることがあり、癌を発生させることが知られている。曲線Cからは更に、効力がプラトーに達していることが見て取れ、これは、標的領域ないし合焦点の周囲の健康組織に関する細胞死によるものである。尚、以上の3本の効力曲線は、本発明の発明者が計算により求めた予測値であり、実験データに基づいたものではない。
【0053】
本発明の1つの好適な実施の形態に用いられるビーム発生器は、適用対象に応じて、複数の種類のエネルギビームや、互いにビーム径の異なる複数本のエネルギビームを発生し得るものである。複数の種類のエネルギビームは、最適の結果が得られるように、それらを適宜切替えて使用することもでき、それらを適宜組合せて使用することもできるようにしてある。複数の種類のエネルギビームを併合して1本のエネルギビームにすることにより、目標とする効果を得るために必要とされるエネルギ量という点で、最善の結果を得ることができる。図13に、その1つの具体例として、ビーム発生器装置と組合せて使用されるX線ビームを示した。
【0054】
基本波に高調波を混入することによって、または、基本波を高調波で変調することによって、目標とする効果を得るために必要とされるエネルギ量を、更に低減することができる。その高調波を、細胞内小器官の中の分子の大きさ、細胞内小器官それ自体の大きさ、または、細胞それ自体の大きさに適合したものとすることによって、エネルギ吸収速度を高めることができ、それによって、必要とされるエネルギ量を低減することができる。身体組織を透過することのできるエネルギビームの波長は非常に短い(必要とされる高調波の波長より更に短い)ため、エネルギビームの発射動作を変調することによって高調波を得るようにするとよい。高調波を使用することによって、細胞内小器官を標的として特定することが非常に容易になり、それは、ビーム交差部を細胞内小器官に合焦させる必要がなく、単に細胞小器官がビーム交差部の中に含まれるようにするだけでよいからである。
【0055】
エネルギビームのビーム径及びエネルギレベルは、画像形成にも関連している。当業者には容易に理解されるように、一般的にMRI装置やCT装置などの画像形成装置は、漂遊エネルギの影響を非常に受け易い。X線はコンプトン散乱及びトムソン散乱を発生させるため、X線を照射しつつ同時に画像形成装置を稼働させることは困難である。X線によって発生する散乱の大部分はコンプトン散乱によるものであり、それゆえ画像の歪みの主要原因を成しているのはコンプトン散乱である。コンプトン散乱では、フォトンがランダムな方向に飛び出す。コンプトン散乱が発生するときには、先ず、フォトンが電子に衝突して一時的に電子に吸収される。フォトンを吸収した電子は、原子から飛び出すか、または、より高位の電子殻へ遷移し、それによって、その電子が元々位置していた電子殻に空位が生じる。より高位の電子殻の電子がその空位へ遷移する際に、ランダムな方向にフォトンを放出する。ランダムな方向に放出されたフォトンのうちには、センサアレイに作用を及ぼすものもある。X線ビームのエネルギレベルを低下させることによって、また、そのビーム径を小さくすることによって、以上のようにして発生する散乱の散乱量を低減することができる。即ち、単位時間あたりの入力フォトンの個数が減少するため、単位時間あたりの散乱量も減少する。そして、画像情報を取得するために要する時間が一定であるならば、単位時間当たりの散乱量が減少することによって画像の歪みが軽減される。
【0056】
身体組織へ打込まれるフォトンのエネルギレベルを低く設定することによっても、散乱量を低減することができる。X線のフォトンは、そのエネルギレベルが14.32KeVのスレショルド値以下である場合には、L殻またはM殻の電子しか叩き出すことができない。より高位の電子殻からL殻またはM殻へ電子が遷移するときに放出されるフォトンのエネルギは非常に小さく、そのためそのフォトンの身体組織を透過する能力は弱い。これに加えて、そのような電子の遷移が発生する確率も小さく、従ってそのようなフォトンの発生頻度も少ない。従って、そのようにして発生してセンサアレイに到達するフォトンは極めて少ない。ただし本出願人は、X線ビームを使用する本発明の実施の形態を、そのエネルギレベルが14.32KeV以下のものだけに限定するものではない。本出願人がここで示唆しているのは、エネルギビームのエネルギレベルを低く設定することによって散乱量を低減することができ、その結果として画像の歪みを低減できるという利点が得られるということである。このように、散乱量及び画像の歪みは、入射するフォトンのエネルギレベルに関係している。その関係は線形関係ではないが、ただしその関係が存在しているということは、本発明に用いるエネルギビームに関して、そのフォトンの最適エネルギレベルが存在することを意味している。尚、最適エネルギレベルを決定するための判断基準としては、これ以外に、身体組織の透過能力や、患者及び医療従事者に対するリスクも考慮する必要がある。
【0057】
図14〜図19は、本発明の好適な実施の形態における標的特定のための作業、並びにエネルギビームの照準合わせのための作業に関連した特徴を説明するための図である。当業者には周知のごとく、「標的特定(targeting)」とは標的細胞を選択することであり、「照準合わせ(aiming)」とはその標的細胞にエネルギを供給するためにエネルギビームを案内することである。標的特定のためには、事前スキャンと、リアルタイムスキャンとを必要としている。事前スキャンによって、フィードフォワード制御に必要な数学モデルを自動的に作成するモデル作成プロセスに必要な情報と、医師が入力操作をするグラフィカルユーザインターフェース(GUI)画面に表示するための情報が得られる。医師はこのGUI画面において、標的を選択し、パラメータの値の初期設定を行う。初期設定を行うパラメータの値は、システムが動作することのできる空間の境界を規定するものである。事前スキャンにおいては、標的計算コンピュータが標的の候補を特定してGUIに表示し、医師はそこに表示された標的の候補のうちから、最終的に標的とすべき対象を選択することができる。
【0058】
エネルギビームの照準合わせに用いるフィードバック制御ループは、画像情報取得システムから供給される画像情報を利用するものとすることが好ましい。その場合に、標準的な画像形成装置のうちでも例えばMRI装置などは、そのままでは画像にエネルギビームが映し出されないため、何らかの改変を加える必要がある。また、ビーム発生器が発生するエネルギビームがトレーサ成分(付加的な波長成分)を含むようにすることによって、画像にエネルギビームが映し出されるようにするという方法もある。一方、使用するエネルギビームが高エネルギX線ビームであって、しかも画像形成装置としてCT装置またはPET装置を使用する場合には、改変を加えるまでもなく、その高エネルギX線ビームはコンプトン散乱及び/または光電散乱によって画像に映し出される。図14〜図19は、本発明の好適な実施の形態における制御シーケンスの具体例を説明するために、その制御シーケンスにおける時系列に従った6つの画像フレームを示した図である。この制御シーケンスは、ビーム発生器を標的領域に対して初期照準合わせしたときの誤差に対処するために、フィードフォワード制御とともにフィードバック誤差信号の値に基づいて、エネルギビームの位置を調節し、最終的にエネルギビームの位置を標的領域に収束させるものであり、エネルギビームの位置が収束したならば、エネルギビームのパルスを発射して標的細胞を破壊する。更に詳しく説明すると、図14には、本発明に用いられている画像形成装置の画面に表示された、標的領域に関するフルフレームの視界及びサブフレームの視界が示されている。図中の参照符号「a1」、「a2」、「b1」、「b2」、「c1」、「c2」、「d1」、「d2」、「ex」、「ey」、「fx」、「fy」、「gx」、及び「gy」は、3本のエネルギビームA1、A2、及びA3が、標的「T」に収束していないために発生しているフィードバック誤差信号を表している。これらの参照符号において、例えば文字「a」及び「b」は、ロボットアームの位置誤差を表しており、文字「c」及び「d」はガントリテーブルの位置誤差を表しており、文字「e」、「f」、及び「g」は最終的な照準合わせ誤差を表している。参照符号によって表される誤差とともにフィードフォワード制御を用いることにより、エネルギビームを標的領域に収束させることができ、収束後にエネルギビームのパルスを標的「T」へ発射したときには、標的領域の周囲の健康な組織が破壊されることなく、標的細胞だけが破壊される。図15には、特定の標的「T」と、この標的「T」の周囲にあるエネルギビームA1、A2、及びA3の位置とが示されている。図を見れば明らかなように、図15に示した段階では、まだ3本のエネルギビームA1、A2、及びA3は標的領域Tに収束していない。続いて、3本のエネルギビームA1、A2、及びA3と標的領域Tとの間の夫々の間隔を算出し、それら算出値に基づいて、複数のビーム発生器の夫々に装備されているビーム偏向機構を操作する。図15は、3本のエネルギビームA1、A2、及びA3に対する標的領域「T」の位置関係を例示したものである。図15を見れば分かるように、夫々のビーム偏向機構がエネルギビームA1、A2、及びA3を標的「T」に近付けるように移動させることによって、それらエネルギビームA1、A2、及びA3と標的領域Tとの間隔は次第に小さくなって行く。図16に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束して全ての誤差が許容レベル範囲内に入るまでの、その手前の段階である。図17に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束した段階である。図18に例示したのは、3本のエネルギビームA1、A2、及びA3が標的「T」に収束した後に、エネルギビームのパルスを発射して細胞を破壊している段階である。図19に例示したのは、標的が破壊されたことをシステムが検証している段階である。
【0059】
標的と非標的との差別化について:標的と非標的とを判別するためには、標的細胞と非標的細胞との差違を明瞭にする差別化を施すことが、即ち、数学的ないし制御的に差違を明瞭にすることが重要な課題となる。またこのことは、標的細胞とエネルギビームの影響を受け易い非標的細胞(例えば神経細胞など)とが、互いに近接して位置しているときに特に重要である。標的細胞の見た目及び/または反応が非標的細胞の反応と大きく異なるようにすることも容易ではない。差別化のための可能な方法としては、例えば以下に列挙する方法などがある。1)標的細胞にナノ粒子を付着させることによって、標的細胞を細胞死に至らせるために必要なエネルギ量を低減し、もって、標的細胞が選択されていないがエネルギビームの影響を受ける領域及びその近傍にエネルギ量の余裕分を設定する方法。この方法については後に更に詳細に説明する。2)標的物質ないし標的細胞をマーカー染料で染色する方法。3)制御ルールの中に標的物質と非標的物質との差違を明瞭にする数学的アルゴリズムを組込む方法。この方法についても後に更に詳細に説明する。尚、本発明の好適な実施の形態においてエネルギビームのビーム径を非常に小さなものとしていることも、また、本発明の好適な実施の形態における制御アーキテクチャも、標的細胞だけを確実に破壊するための手段であるといえる。
【0060】
放熱について:体内での放熱が問題となることがあり、特に、ある領域に集中的に大量のエネルギを注入することが必要とされるような用途ではこのことが重要になる。1つの好適な実施の形態に係るシステムでは、不都合な熱の蓄積を回避するために、エネルギ供給量を自動的に最適化して、所望の効果を得るのに必要とされる最小限度のエネルギ量しか供給しないようにしている。また、このエネルギ供給量の自動的な最適化は、フィードフォワード制御において自動的に数学モデルを作成する過程の一部として実行するようにしている。ミトコンドリアやリソソームなどの細胞内小器官を破壊するために必要なエネルギ量は通常十分に小さく、そのため、それらを破壊する処置に伴って発生する熱は、人体に元々備わっているシステムによって容易に自然放散される。処置の種類によっては補助的な冷却を必要とするものもあり、その場合の補助的な冷却は例えば吸熱性のIVないし冷却したIVなどを用いて行われる。標的を分散させることによって特定の領域に集中して過大なエネルギが放出されるのを回避するという方法もある。また、最も簡明な解決方法は、人体の備わっている自然放熱の能力に適合するまで、システムの動作速度を低下させるという方法である。ただし、この方法が有効である用途もあるが、用途によっては処置時間が長くなりすぎるため、この方法を採用できない場合もある。
【0061】
ミトコンドリアやリソソームなどの細胞内小器官を利用して細胞を溶解させる方法について:リソソームの持つ細胞を溶解させる能力を利用することで、より少ないエネルギを使用するだけで細胞死に至らせることができる。ただしその場合に多少やっかいであるのは、単にリソソームを破壊しただけではこの方法は機能しないことであり、なぜならば、リソソーム内の酵素が活性化するためには、低pHレベルであることが必要とされるからである。細胞内の通常のpHレベルは高い。リソソームに関連した1つの方策として、ミトコンドリアを攻撃するのもよい。ミトコンドリアに十分なダメージを与えれば、それによって細胞が消化される過程が開始される。実際に、ミトコンドリアを破壊することによって細胞を殺すことができ、それによって細胞は分解し、単なる細胞構成物質の混合体になる。いかなる種類の細胞内小器官であれ、細胞内に存在するその細胞内小器官の全てもしくは大部分を破壊すれば、それによって細胞死に至らせることができる。
【0062】
ミトコンドリアを標的化するための好適な方法の1つに、金ナノ粒子または炭素ナノ粒子に標的化剤を付着させたものを使用するという方法がある。そのような方法の一例として、ナノ粒子にペプチドを付着させて、そのナノ粒子がある種の細胞のミトコンドリアを追い求めて付着するようにする方法がある。またそのような方法の別の一例として、ナノ粒子にモノクローナル抗体を付着させて、そのナノ粒子が特定の種類の細胞(標的細胞)のもとへ行くようにすると共に、更にペプチド鎖を付着させて、そのナノ粒子がその標的細胞のミトコンドリアの細孔に入り込むようにし、そして、エネルギビームを用いてそのナノ粒子を活性化することによってミトコンドリアを破壊し、アポトーシスを開始させ、細胞を破壊するという方法がある。また、ナノ粒子にモノクローナル抗体を付着させる代わりに、アプタマーを付着させるという方法もある。アプタマーとしては、DNAまたはRNAのオリゴヌクレオチドや、修飾されたDNAまたはRNAのオリゴヌクレオチドなどがある。そのようなアプタマーは、長さが短く(ヌクレオチド10個分〜15個分の長さである)、特定のタンパク質に対して特異的に結合する。これまでに約200種類のアプタマーが特定されている。それらのうちには、肝癌細胞(ヘパトーマ)に特異的に結合することが確かめられているものがある。また、ヘパトーマに特異的に結合するアプタマーとして特定されているもののうちには、通常は胎児にのみ発現するPDGFα(血小板由来増殖因子α受容体)を認識して結合するものがある。本発明の好適な実施の形態の1つに、このアプタマーを付着させたナノ粒子を用いて、肝癌細胞を標的化するようにしたものがある。また別のアプタマーとして、前立腺特異的膜抗原を認識するといわれているものもある。或いはまた、Eyetech, Inc社が開発した、VEGFに対するアプタマー剤であるMacugen(登録商標)を使用するのもよい。VEGFは腫瘍において過剰発現するものであり、これは、腫瘍が血管新生を必要としていることによるものである
【0063】
ナノ粒子は、ペプチド、抗体、抗体断片、ないしはアプタマーを付着させることによって、病的細胞を標的化することのできる標識となる。ナノ粒子は更に、ミトコンドリア標的化ペプチドを付着させることによって、標的細胞内に入った後にミトコンドリアの細孔の中へ入り込むようにすることができる。ナノ粒子は、ミトコンドリアの細孔より僅かに大きいため、細孔に入り込んだならば、その細孔にぴったりと嵌合する。続いて、フォトンによってそのナノ粒子を活性化すると、そのナノ粒子がミトコンドリア膜に孔を開けるため、その孔から「シトクロムc」が漏出する。こうして「シトクロムc」が細胞質の中へ漏出することによって、アポトーシス(細胞の自殺過程)の引金が引かれ、細胞がみずから分解し始める。本発明に使用することのできるナノ粒子には、例えば、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、それに、それらが組合わさった粒子などがある。
【0064】
ビーム径及び波長が屈折に及ぼす影響について:高エネルギX線ビームは、通常、互いに密度の異なる2種類の物質の間の境界面を通過する際に、何ら影響を受けないエネルギビームとしてモデル化されている。しかしながら、このようなモデルが妥当性を有するのは、X線ビームのビーム径が大きく、実際には発生している小さな屈折が、そのビーム径より小さい場合に限られる。ビーム径及び標的寸法が(本発明のように)小さくなると、その小さな屈折が無視できないものとなる。即ち、屈折が非常に小さくても、その屈折によってビームが移動してしまうのである。標的は非常に小さく、また望ましいビーム交差部の寸法も同じように小さいため、小さな屈折といえども無視することはできない。
【0065】
波長が短くなるほど屈折は小さくなる。このことは虹を見れば即座に理解できることであり、また、屈折が回折による場合もそのようになる。波長がゼロに近付くにつれて屈折もゼロに近付く。そのため、異なる波長どうしは互いに分離され、夫々に異なった経路をたどることになる。それが偏光であるならば、虹色を呈することになる。それが非偏光X線でしかも非コヒーレントなX線であるならば、一見してランダムなように見える散乱が発生する(ただし散乱角は小さい)。また、それが超音波であるならば、分散が発生し、移相が発生し、更には波長の変化も発生する。エネルギビームに発生する変化を予測可能にするには、そのエネルギビームを改良しておく必要がある。エネルギビームがX線ビームであるならば、導波管を用いる公知の方法によって、それをコヒーレントなビームにすることができる。そのためには、そのX線ビームのビーム径に適合した断面寸法を有し、導波長さが僅か3フィート(約90cm)程度の直線導波管を用いればよく、それによって所望の結果を得ることができる。更にその導波管に、低エネルギのフォトンを吸収するフィルタを付加すると共に、X線源としてエネルギ上限値を超えないX線を射出するようなX線源(例えばX線管)を使用することにより、高度の均質性を備えたX線ビームを得ることができる。また、更に高い精度が得られる別の方法として、X線ビーム(例えばライナックで発生させたX線ビーム)を偏向させることによって、そのX線ビームに含まれる様々な波長のうちのただ1つの波長だけを導波管へ入射させるという方法もある。
【0066】
ビーム経路の選択、ビーム発生器の移動操作、患者の移動操作について:互いに直交する3本のエネルギビームを使用し、それらエネルギビームの交差部が画像形成システムのアクティブ領域に位置するようにしてある本発明の好適な実施の形態を用いるならば、ビーム発生器の移動操作は、精密照準合わせ機構による移動操作が可能な範囲内に位置付けるための移動操作だけでよく、その範囲を超えて移動操作する必要はない。患者の位置を移動操作するためにMRI装置に備えられているガントリテーブル機構は、処置を施すために患者を適切な位置に移動させるのに必要な全ての自由度である6つの自由度を備えている。しかしながら、処置を施す身体の部分によっては、互いに直交する3本のエネルギビームが夫々に標的に至る経路を最適経路とすることができないこともある。1つの好適な実施の形態においては、全てのビーム経路を最適化するために、少なくとも2台のビーム発生器を、6つの移動自由度を備えたものとする必要がある。どのビーム径路を選択すれば最適ビーム経路となり得るかの判断は、エネルギビームの影響を受けやすい組織を損傷させないようにすること、複雑な形状のエネルギビームにとって障害物となる部分を回避すること、それに、所望の結果を達成するために必要なエネルギビームによって供給するエネルギ総量をできる限り抑えるようにすることを考慮して決められる。
【0067】
ビーム経路の偏向量などの諸量の算出:本発明の好適な実施の形態の一部に、フィードフォワード制御量、ビーム径路、ビーム偏向量、吸収量、減衰量、散乱量、及びそれらの結果としてのロボット式駆動機構の制御量を事前算出するということがある。事前算出する、ロボット式駆動機構の様々な構成要素に必要とされる、移動量、トルクの大きさ、及びモータ電流の大きさは、ビーム径路、ビーム偏向量、吸収量、減衰量、及び散乱量の関数である。事前算出しておいた移動量に、フィードバック制御が更に組合わさることによって、ビーム交差部を標的に高い精度と高い正確度をもって定位することが可能となっている。
【0068】
特異点について:特異点というのは、数学的に不定であるために制御上の問題となる動作点のことである。特異点が発生するのは通常、自動化された演算処理においてゼロで除する除算が行われたとき、または、演算処理の結果、解が複数存在したときである。本発明の好適な実施の形態は、本来的に特異点を生じる性質を備えたものである。特異点の問題を解決する方法としては、幾つかの方法が考えられる。それらのうちの1つは、標準移動量及び標準移動経路として夫々複数通りの移動量び移動経路を定め、それらの間に一意の優先順位を付しておくというものである。即ち、初めて標的へ接近するときに用いる標準移動経路と、2度目、3度目、4度目、…に標的へ接近するときに用いる標準移動経路とを異ならせる。更に、そのような標準移動経路が、標準移動量を含んでいるようにしてもよく、以上によって殆どの特異点を除去することができる。
【0069】
図3及び図4に関連して上で述べたように、ビーム経路を選定するための演算は、標的の周囲の組織の中に存在している障害物、その組織の中における距離、及び、その組織の中における密度から算出する演算である。ここでいう障害部分には、ビームの影響を受け易いためにビーム経路が避けなければならない部分の組織も含まれる。障害部分の距離及び密度は周知であり、通常のヒトの身体(変形または損傷のない)についてのパラメータの範囲内であり、患者の事前スキャンによって迅速且つ容易に検証される。この知識ベースに基づいて計画プロセス及び標的化プロセスにおける演算時間を短縮することができる。ある密度の組織の中を進行してきたビームがそれと異なる密度の組織へ入る遷移点ごとに屈折角を算出し、その屈折角は、標的から手前と向こうとの両方向に有効である。屈折は複数箇所で発生することがあり、その場合にはビーム径路は複雑なものとなる。このプロセスを簡明にして特異点を低減または消滅させるには、身体の個々の領域にある標的ごとに、夫々の種別のプロシージャに対応した標準ビーム径路を用いるとよい。ビーム径路の選定という目的のための体内に必要とされる領域の合計個数は、現時点では定かでないが、おそらく100個を超えると思われる。標準ビーム径路は、患者の特定の用途ごとに自動的に適合させるための許容誤差と共に定義される。
【0070】
骨及び組織の密度の算出について:事前スキャンにおいては骨及び組織の密度の算出も行われ、それらの算出値は標的特定及びビーム径路選定に用いられる。画像形成システムによっては、密度情報が得られるようにするために何らかの適合を施さねばならないものもある。場合によっては、システムに更にセンサを追加して、そのセンサからシステムに入力を取り込むことが必要なこともある。年齢、性別、それに健康上の問題点などをシステムに入力して利用することによって、プロセスを迅速化し、また、密度の値を求めるための演算負荷を低減することができる。更に、CTスキャン装置やPETスキャン装置を用いることにより、密度に関する有用な情報を得ることができ、なぜならば、骨に関しては(骨以外の組織についても多少は)、そこに含まれる分子の個数が密度の指標となるからである。
【0071】
入射部位の形状単純化(浸漬、ジェルの塗布)について:超音波ビームでは(或いはその他のエネルギビームでも)、それを超ナロービームとして用いる場合には、身体の入射部位の表面に形状単純化を施すことが必要なことがある。それは、皮膚の表面の形状が凹凸のある不規則形状であると、それによって予測不可能な大きな屈折が発生する可能性があるからである。このような身体の表面の形状に由来する誤差導入原因の多くは、皮膚の表面に塗布剤を塗布することによって、或いは、身体を水中に浸漬することによって、低減ないし解消できることができる。塗布剤や水の密度は皮膚の密度と同程度であるため、塗布剤または水と皮膚との境界面の形状が不規則形状であっても、エネルギビームは、その境界面を通過する際に全くもしくは極めて小さな屈折しか発生しないのである。
【0072】
エネルギの種類と速度について:ある密度を有する物質の中を、超音波、マイクロ波、及び放射線が夫々に進行する速度は既知であり、また、その速度は互いに異なっている。互いに異なった種類のエネルギビームを組合せて用いる複合ビーム方式とする場合には、段階的発射方式とすることが必要なことがある。この段階的発射方式とは、互いに異なる種類のエネルギビームが所望の時刻に所望の順序で標的に達するようにする方式である。これに関しては、例えば、ある種類のエネルギビームが標的に到達する時刻より僅かに先行して、或いはその時刻より僅かに遅れて、別の種類のエネルギビームが標的に到達するようにすることが望ましいこともあれば、全ての種類のエネルギビームが同時に標的に到達することによって、それらエネルギビームの合計エネルギレベルがスレショルド値を超えるようにすることが最善であることもある。種類の異なったエネルギビームが標的に順次到着するようにした好適な実施の形態によって期待できる効果は、順次到達する複数種類のエネルギビームの夫々のエネルギレベルのスレショルド値をより低く設定できることである。例えば、最初に放射線ビームで細胞膜を弱らせ、続いて、マイクロ波ビームで加熱して細胞を膨張させ、続いて、弱った細胞を超音波ビームで振動させて速やかに破壊するようにすれば、それらエネルギビームのスレショルド値をより低く設定することができる。一方、種類の異なったエネルギビームが標的に同時に到達する方式によって期待できる効果は、所望の作用を発生させるために必要とされる合計エネルギレベルのスレショルド値を短時間で超えられることである。
【0073】
速度差を利用してビーム交差部を形成することについて:同一種類のエネルギビームであっても、そのエネルギビームがその中を透過して進行する物質が異なれば進行速度は異なる。これとは逆に、単一種類の物質の中を互いに種類の異なるエネルギビームが互いに異なる進行速度で進行する場合には、更に複雑なことになる。例えば、その中を通過する物質がいかなるものであっても、超音波ビームの進行速度は常に放射線ビームの進行速度よりはるかに遅い。これに加えて更に、超音波ビームは、その中を透過して進行する物質が異なれば、その進行速度も異なったものとなる。
【0074】
本発明の好適な実施の形態では、このようなエネルギビームの進行速度の相違には、フィードフォワード制御のためのモデル作成を行う過程で対処するようにしている。ただし本発明は、このようなエネルギビームの進行速度の相違を利用して、単一のビーム発生器から射出される互いに異なるエネルギビームどうしを交差させてビーム交差部を形成するようなものとすることも可能である。これを実現するには、進行速度の遅い種類のエネルギビームを先に発射し、進行速度の速い種類のエネルギビームを後から発射して、標的上で進行速度の遅いエネルギビームに進行速度の早いエネルギビームが追い付き、それにより、複数のエネルギビームが集まったバーストとして、高エネルギのビーム交差部が形成されるようにすればよい。
【0075】
腫瘍の密度を利用して標的特定及び照準合わせを行うことについて:一般的に腫瘍細胞ないし癌細胞の密度特性は、健康な正常細胞の密度特性とは異なっている。そこで、この密度特性の相違を利用して、標的特定及び標的破壊を容易化することができる。即ち、エネルギビームの吸収率が異なるために画像コントラストが発生し、このことは、本発明の好適な実施の形態において利用することのできる有用な特性である。更に、エネルギレベルをフィードバック制御するためのフィードバックループを本発明において利用するようにすれば、組織の密度に対してエネルギビームをの照準合わせを行うことも可能であり、それによって照準合わせの作業を大いに改善することができ、ひいては正確度及び/または動作速度が改善される。
【0076】
画像形成装置によるエネルギビームの位置の継続的な監視は、そのエネルギビームがイオンを含んでいると行いやすく、なぜならば、荷電粒子の電荷それ自体も、またその電荷の運動によって発生する電磁界も、磁気共鳴装置に用いられている検出器にとっては検出可能なものだからである。ただし、荷電粒子が検出器を通過する際に発生する磁界によって、画像の歪み即ち干渉が発生する。この画像の歪みは、数学的処理によって補償することができ、また、例えば画像間の減算処理や画像の一部除去などのその他の処理によっても補償することができる。
【0077】
更に、イオンを含むエネルギビームは、そのような2本のビームが互いに近接していると、そのことによって生じるビーム径路の偏向が複雑なものとなり、そのことが制御システムにとってはやっかいな問題となる。同種電荷の荷電粒子どうしは反発し合い、異種電荷の荷電粒子どうしは引き合う。エネルギビームが体内に進入した後にまで荷電粒子がそのビーム中に残っている場合には、そのような反発力ないし引力がビーム経路に影響を及ぼすことになる。
【0078】
デジタル化方式(演算解析よりも視覚解析を優先させる方式)−MRI装置のアーキテクチャに施す改変について:可能最善の画像解像度を達成し、且つ、画像ジッタを回避するためには、フレームグラビング方式ではなく、ダイレクトデジタイゼーション方式を採用する必要がある。ソースデータを標準ビデオ信号(RS170)に変換した後にフレームグラバ及びデジタイザを使用すると、それによって誤差が入り込み、情報が失われることになる。本発明のシステムパフォーマンスを改善するためには、ダイレクトデジタイゼーションを行えるように、画像形成装置のハードウェアに対して、コンフィギュレーションの変更を施すか、ないしは、そのハードウェア自体に改変を施す必要がある。
【0079】
波の弱め合いと強め合いについて:使用するエネルギビームが、連続した均一なエネルギ波のビームとしてモデル化し得るものである場合には、そのエネルギ波の移相制御が重要であることは、考えるまでもなく理解されることである。この移相制御は、ビーム交差部において最大エネルギが放出されるようにするために必要なものである。当業者には容易に理解されるように、標的位置へのエネルギ供給を最適化するためには、この移相制御を非常に高い精度で行う必要がある。ただし、移相制御が意味を持つのは、使用する複数本のエネルギビームの軸心が同軸的関係にあるか、或いは、それらエネルギビームの軸心どうしのオフセット角が小さいかの、いずれかの場合だけである。エネルギビームの軸心どうしのオフセット角が大きくなるにつれて、移相制御の効果は小さくなり、そのオフセット角が90度になれば効果はゼロになる。オフセット角が90度のときには、移相とは無関係に、ビーム交差部のどの部分にも、完全に足し合わせとなる領域と、完全な相殺となる領域とが存在することになる。
【0080】
一方、使用する複数本のエネルギビームが、電子と衝突するサブ原子粒子(フォトン)のビームとしてモデル化することが妥当なものである場合には、結論は上と異なるものとなる。ビーム交差部において単なるエネルギビームどうしの足し合せとなることの合理性は明瞭である。実際に、周知の方法でX線を原子に作用させて調べると、ビーム交差部において弱め合いは殆ど若しくは全く発生していないことが分かる。ビーム交差部におけるエネルギの放出は、コンプトン効果及びトムソン効果によるものである。またそれらに加えて更に、高エネルギのフォトンどうしの衝突が発生する可能性もあり、その場合には、その衝突によってもエネルギが放出される。
【0081】
図8A、図8B、及び図10は、標的細胞を破壊するために2つのビーム発生器から射出されたエネルギ波を示した図である。当業者であれば、エネルギ波の特性、並びに、ビーム交差部におけるエネルギ波どうしの強め合いについては、既に理解しているはずであり、それらを考えれば、標的細胞に対するそれらエネルギ波の作用についても明瞭に理解されるはずである。例えば、図8A及び図8Bは、ビーム交差部の内部でのエネルギ波の強め合いについて説明した図である。図8Aの左側に示したように、2つのエネルギ波の各々が単独で存在するとき、それらの振幅は「x」であり、波長は「y」である。それら2つのエネルギ波が互いに同位相で重なり合うと、振幅は「2x」となり、波長は「y」のままである。一方、図8Bに示したように、ビーム交差部で、それら2つのエネルギ波が互いに位相がずれた状態で重なり合うと、エネルギ波2、3によってエネルギ波1が形成される。図10に示したのは磁界と電界とから成る電磁波であり、図中にはこの電磁波の波長と伝搬方向を併せて記入してある。図10に示した電磁波は、1個の波の開始点から強度が上昇して行き終了点ヘ向かって強度が減少して行っている。最も重要なことは、図10から明らかなように、ビーム交差部においては磁界と電界の両方が強め合うということである。
【0082】
合焦点の集中について:もしエネルギの発射と発射との間に処置対象者も移動させず、ビーム発生器も移動させなかったならば、処置対象者の身体のビーム発生器に最も近接した部分の表面に合焦点の集中が発生する。同一の標的に対してエネルギの発射を複数回に亘って行う必要があり、しかも、エネルギの発射と発射との間に実行される精密照準合わせの際に、1つまたは2つの角度の調節しか行われない場合には、実際にこの合焦点の集中が発生する。またその場合に、合焦点が集中する領域の形状は、標的の最外周を囲繞する円を底面とし、ビーム発生器の端を頂点とする円錐形となる。この円錐形の切断面(この切断面は様々なビーム径路から成る)は、ビーム発生器に近付くほど小さくなり、そのため、身体の表面において集中は最大となる。図4に示したように、患者ないしガントリテーブルを僅かに移動させるだけで、ビーム径路を十分に変化させることができれば、それによって、この合焦点の集中に関する問題は回避することができる。
【0083】
エネルギレベルのスレショルド値に関する考慮事項について:図5は、既述のごとく、複数本の電離放射線ビームを使用したときの合焦点における幾つかのパラメータの概略予測値を示した図である。例えば、エネルギ量、エネルギ勾配、細胞のエネルギ吸収量、及び細胞死率は、4本のビームを使用したときに最も大きくなっている。電子顕微鏡の場合と同様に、合焦点におけるエネルギ集中度を高めることによって、合焦点に存在する細胞からの放出を発生させることができる。その放出を計測して解析することによって、画像情報を補強することができ、ひいてはシステムの制御機能及び標的特定機能を向上させることができる。
【0084】
細胞にダメージを与えるために必要とされる最小限度のエネルギ吸収量をzとし、人体への入射点におけるビームの強度ないし吸収量をyとし、標的におけるビームの強度ないし吸収量をxとし、ビームの本数をwとするならば、、
1/w・z<x<y<z
となる。
【0085】
エネルギ吸収速度を算出する際には、エネルギ勾配も考慮しなければならない。エネルギレベルが高いほどエネルギ吸収速度が高速となると考えられ、それゆえ、ビーム交差部の外部でのエネルギ吸収速度よりも、ビーム交差部の内部でのエネルギ吸収速度の方が大きくなり、どれほど大きくなるかは、エネルギビームの本数に応じて決まる。ビーム交差部の外部でのエネルギ吸収速度をmとし、ビーム交差部の内部でのエネルギ吸収速度をnとし、エネルギビームの本数をwとするならば、
w・m<n
となる。
【0086】
エネルギレベルのスレショルド値を低く設定できることについて:本発明においては、細胞を破壊するために有用な細胞それ自体の特性を利用するという方式を用いることで、エネルギレベルのスレショルド値を低く設定しようとするものである。この方式を用いることによって達成される、細胞の破壊に必要とされるエネルギ量の低減の程度は、細胞全体に対するミトコンドリアまたはリソソームの体積割合が5%以下の場合に、約100分の1になると予測される。またこの方式では、実際に細胞を破壊しているのはエネルギビームから供給されるエネルギではなく、細胞中の酵素である。
【0087】
制御アーキテクチャ(図14〜図19)について:フィードフォワード制御である。本発明に用いるフィードフォワード制御の好適な実施の形態では、プロセスの物理特性を表すパラメータとして、標的位置と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率及び減衰率と、個々のビーム経路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、6自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するようにしている。このフィードフォワード制御における具体的な制御動作は、これら全てのパラメータに基づいて決定されるものである。
【0088】
ロボット式駆動機構は、複数の静止位置の各々において自己キャリブレーション方式で再キャリブレーションを実行し、この再キャリブレーションは処置対象者の体内の静的または準静的な複数のランドマークに基づいて行われる。更に、標的またはエネルギビームが視界の外へ移動してしまった場合にも、ロボット式駆動システムは自動的に再キャリブレーションを実行し、そしてフィードバック入力が失われた位置から再始動する。
【0089】
フィードバック制御と精密照準合わせについて:フィードバックループは画像形成装置のサブフレームから収集されるデジタル情報に基づいて動作する。サブフレームからは、標的近傍の小さな領域についての情報が得られる。サブフレームの大きさは、標的とフィードフォワード制御によって照準合わせされた複数本のエネルギビームとが、確実にこのサブフレームの中に位置することができるだけの大きさがあればよい。標的とそれらエネルギビームとがサブフレームの中に位置したならば、そこからフィードバックループによる制御を開始してエネルギビームの精密照準合わせを行い、それによって、それらエネルギビームビームを標的の内部のビーム交差部目標位置に収束させる。
【0090】
この多段階式の照準合わせ方式を有効に機能させる上で、ロボット式駆動機構に要求される精度は、標的に対する相対的な静止位置を約100〜200μmの許容誤差の範囲内で保持することのできる精度である。これに関して、1つの好適な実施の形態では、ロボット式駆動機構それ自体が、画像形成装置から得られるフィードバック信号に基づいたフィードバック制御を行うことによって、この許容誤差の基準に適合するようにしている。ただし、この許容誤差の値を、移動サイクル中にシーケンシャルに変化させるようにしてもよい。即ち、移動サイクル中の、本発明がバーストの発射に取りかかる1つまたは2つの時点でのみ、そのとき静止しているロボット式駆動機構がこの許容誤差の中に収まっているようにしてもよい。尚、この方法を用いる場合には、その移動サイクルに合わせて、画像形成フェーズと制御フェーズとを適宜切替えることが必要になる。
【0091】
ロボット式駆動機構が実行する照準合わせの目的は、標的及び全てのエネルギビームをサブフレームの視界の中心から400〜500μm以内に位置付けることにある。サブフレームの視界の大きさが4mm平方であれば、このように位置付けることによって、それに続いて実行される精密照準合わせ制御において、標的の位置に対する夫々のエネルギビームの位置を誤差として測定することのできる適当な広さのスペースが確保される。そして、そのように測定された夫々のエネルギビームの位置の誤差の値が、フィードバックループの制御ルールへの入力として用いられる。
【0092】
フィードバックループの制御ルールは、入力されたそれら誤差の値を、精密照準合わせ機構を制御するための夫々の制御信号に変換する。例えば、その精密照準合わせ機構が、電磁石で発生させた磁界によってエネルギビームを偏向させる機構である場合には、制御ルールは、それら誤差の値に対応した大きさの夫々の電流を発生させる。それら電流で精密照準合わせ機構が駆動されることによって、エネルギビームが所望の偏向量だけ偏向させられる。
【0093】
精密照準合わせのための制御ルールのゲインは、比例動作を考慮して可変的に自動で調節される。即ち、サブフレームの視界の中での個々のエネルギビームの移動量が、精密照準合わせ機構の磁界変化量に比例したものとなることは当然であるが、ただし両者の関係は必ずしも正比例関係となるとは限らない。精密照準合わせ機構において発生したエネルギビームの偏向量が同じであっても、そのエネルギビームが標的に到達するまでに透過して行かねばならない媒体が異なれば、サブフレームの視界の中での個々のエネルギビームの移動量は、多少なりとも異なったものとならざるを得ない。例えば、図4に示したように、腱または骨のすぐ横をかすめて透過しているエネルギビームは、精密照準合わせによって移動させられて、それまで透過していた媒体とは異なる媒体に接触し、或いはその異なる媒体の中を透過するようになったならば、それによって、そのエネルギビームの偏向パターンは急変することになる。ただしその場合であってもなお、サブフレームの視界の中でのそのエネルギビームの位置は、精密照準合わせ機構による制御の連続関数となる。従って、精密照準合わせ機構による制御とエネルギビームの移動量とが正比例関係になくても、エネルギビームの移動量は測定可能であり、それゆえ、エネルギビームの移動量を制御ルールに適切に組込むことによって、所要の精度を達成することができる(ただし、エネルギビームを所望の偏向量だけ偏向させることができるように、精密照準合わせ機構が十分な感度をもってエネルギビームを移動させることができるものである必要がある)。尚、フィードバック制御の一部として、移相量を調節するための制御を組込むことが必要となることもある。
【0094】
画像を用いた制御について:サブフレームの画像を用いて制御を行うようにしているのは、本発明の好適な実施の形態に必要とされる高速の動作速度と高い精度とを共に実現するためである。それらを共に実現できるのは、センサアレイの全体のうちの小さな部分だけを最大限の精度で処理するようにしているからである。1枚の画像の全体に対応したセンサアレイの全体の大きさは40cm平方〜60cm平方であるのに対して、フィードバック制御のための処理対象となるサブフレームに対応した部分の大きさは約3mm平方〜4mm平方である。センサアレイを構成している個々のセンサにより収集される個々のピクセルについての基本情報は、センサアレイの大きな部分に亘って分布している。そのため、サブフレームに関連した全ての有用情報を収集するには、直感的に考える大きさよりもはるかに大きなセンサアレイの一部分だけを処理する部分的処理が必要とされている。
【0095】
ロボット式駆動機構の安定条件について:このシステムは複数のロボット式駆動機構を作動させているため、それらロボット式駆動機構の夫々に対応した座標系どうしが互いに安定している必要があり、その安定度の許容誤差は、フィードバック制御ループが1サイクルの動作を行う間に生じる相対的なずれが約0.1μm以下になるようにするというものである。この設計基準は、フィードバック制御ループの動作速度に応じて決められる。フィードバック制御ループの動作速度が高速になれば、この許容誤差を大きくすることができる。フィードバック制御ループの動作速度にとって制約要因となるのは、MRI装置のフレームレートである。文献に記載されているところによれば、高精度の画像が得られるMRI装置のフレームレートは毎秒約10フレームである。ロボット式駆動機構のエンドエフェクタ(ビーム発生器)にジャイロスコープを装着することが、上記の設計基準を達成する上で有効である場合がある。
【0096】
このシステムは、プロシージャの実行速度を向上させるために、エネルギビームのビーム径を変化させる機能を備えている。大きな細胞群を形成している多数の細胞を殲滅する際には、ビーム径の大きなエネルギビームを使用すれば、より短時間で殲滅を完了することができる。小さな細胞群や個々の細胞を標的とする際には、ビーム径の小さなエネルギビームを使用すればよい。
【0097】
このシステムは、個々の患者に合わせた初期設定を行う際に、医師が非常に多くのパラメータの値を入力する。そして、医師によって初期設定されたパラメータの範囲内でのみこのシステムは動作する。ただし、このシステムが実行するプロセスは高度に自動化されており、一旦プロセスが開始されたならばその後は自動的に実行される。それゆえ、このシステムには、緊急停止ボタンなどのフェイルセーフ手段を組込んでおくとよい。
【特許請求の範囲】
【請求項1】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して機能するようにしてある、
ことを特徴とするシステム。
【請求項2】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項1記載のシステム。
【請求項3】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項2記載のシステム。
【請求項4】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項1記載のシステム。
【請求項5】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項1記載のシステム。
【請求項6】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項5記載のシステム。
【請求項7】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項1記載のシステム。
【請求項8】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項7記載のシステム。
【請求項9】
前記1箇所は前記標的であることを特徴とする請求項1記載のシステム。
【請求項10】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項1記載のシステム。
【請求項11】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームはビーム径路に沿って進行して処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
前記複数本のエネルギビームは、前記ビーム径路に沿って進行して互いに異なる種類のエネルギを供給するためのビームであり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム径路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである、
ことを特徴とするシステム。
【請求項12】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項11記載のシステム。
【請求項13】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項12記載のシステム。
【請求項14】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項11記載のシステム。
【請求項15】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項11記載のシステム。
【請求項16】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項15記載のシステム。
【請求項17】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項11記載のシステム。
【請求項18】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項17記載のシステム。
【請求項19】
前記1箇所は前記標的であることを特徴とする請求項11記載のシステム。
【請求項20】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項11記載のシステム。
【請求項21】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている、
ことを特徴とするシステム。
【請求項22】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項21記載のシステム。
【請求項23】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項22記載のシステム。
【請求項24】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項21記載のシステム。
【請求項25】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項21記載のシステム。
【請求項26】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項25記載のシステム。
【請求項27】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項21記載のシステム。
【請求項28】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項27記載のシステム。
【請求項29】
前記1箇所は前記標的であることを特徴とする請求項21記載のシステム。
【請求項30】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項21記載のシステム。
【請求項31】
前記ナノ粒子は、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、及び、それらが組合わさった粒子を含むことを特徴とする請求項21記載のシステム。
【請求項32】
前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して、または、互いに独立して機能するようにしてあることを特徴とする請求項21記載のシステム。
【請求項33】
前記ナノ粒子は、該ナノ粒子に付着したペプチド、モノクローナル抗体、モノクローナル抗体断片、またはアプタマーによって、標的細胞を標的化する標識とされていることを特徴とする請求項21記載のシステム。
【請求項34】
前記ナノ粒子は、該ナノ粒子に付着したミトコンドリア標的化ペプチドによって、ミトコンドリアを標識化する標識とされていることを特徴とする請求項21記載のシステム。
【請求項35】
前記ビーム径路は、個々の処置対象者の適用条件に自動的に適合させるための許容誤差を見込んで規定されることを特徴とする請求項30記載のシステム。
【請求項36】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも1つのビーム発生器を備えており、該ビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記少なくとも1つのビーム発生器は、該ビーム発生器から射出するエネルギビームに処理を施すためのビームプロセッサを備えており、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている、
ことを特徴とするシステム。
【請求項1】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して機能するようにしてある、
ことを特徴とするシステム。
【請求項2】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項1記載のシステム。
【請求項3】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項2記載のシステム。
【請求項4】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項1記載のシステム。
【請求項5】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項1記載のシステム。
【請求項6】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項5記載のシステム。
【請求項7】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項1記載のシステム。
【請求項8】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項7記載のシステム。
【請求項9】
前記1箇所は前記標的であることを特徴とする請求項1記載のシステム。
【請求項10】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項1記載のシステム。
【請求項11】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームはビーム径路に沿って進行して処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
前記複数本のエネルギビームは、前記ビーム径路に沿って進行して互いに異なる種類のエネルギを供給するためのビームであり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム径路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものである、
ことを特徴とするシステム。
【請求項12】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項11記載のシステム。
【請求項13】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項12記載のシステム。
【請求項14】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項11記載のシステム。
【請求項15】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項11記載のシステム。
【請求項16】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項15記載のシステム。
【請求項17】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項11記載のシステム。
【請求項18】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項17記載のシステム。
【請求項19】
前記1箇所は前記標的であることを特徴とする請求項11記載のシステム。
【請求項20】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項11記載のシステム。
【請求項21】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも2つのビーム発生器を備えており、それらビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている、
ことを特徴とするシステム。
【請求項22】
前記画像形成装置は、磁気共鳴画像形成装置またはコンピュータトモグラフィ装置から成ることを特徴とする請求項21記載のシステム。
【請求項23】
前記画像形成装置は、前記磁気共鳴画像形成装置またはコンピュータトモグラフィ装置の装置内で処置対象者を移動するためのガントリテーブルを含むことを特徴とする請求項22記載のシステム。
【請求項24】
前記少なくとも2つのビーム発生器は、互いに同一の種類のエネルギを発生することを特徴とする請求項21記載のシステム。
【請求項25】
前記少なくとも2つのビーム発生器は、互いに異なる種類のエネルギを発生することを特徴とする請求項21記載のシステム。
【請求項26】
前記複数本のエネルギビームは、放射線エネルギ、超音波エネルギ、及びマイクロ波エネルギを含むことを特徴とする請求項25記載のシステム。
【請求項27】
前記標的は、例えば癌細胞などの特定の細胞から成るか、または、非癌細胞を含む細胞群から成ることを特徴とする請求項21記載のシステム。
【請求項28】
前記標的は、前記細胞の中に存在するリソソーム、ミトコンドリア、及びその他の細胞内小器官を含むことを特徴とする請求項27記載のシステム。
【請求項29】
前記1箇所は前記標的であることを特徴とする請求項21記載のシステム。
【請求項30】
前記フィードフォワード制御手段は、標的計算コンピュータに搭載されたソフトウェアプログラムを含んでおり、該ソフトウェアプログラムは、標的位置と、処置対象者の身体の表面、骨、及び腱によって発生すると予測されるビーム偏向と、標的特定のためのランドマークと、標的寸法と、標的上の最適ビーム径と、標的から逆算したビーム径路と、回折角と、屈折角と、ビーム散乱量と、標的上の必要ビーム強度と、ビーム径路上の吸収率または減衰率と、ビーム径路上のエネルギ損失と、必要初期ビーム強度と、ビーム発生器上の必要ビーム径と、必要ビーム本数と、ガントリロボット位置と、個々のビーム発生器に対応したロボットアーム位置と、所定自由度の予測される移動と、処置対象者の移動範囲と、処置対象者の移動サイクルと、移相量と、ビーム発射順序とを事前算出するものであることを特徴とする請求項21記載のシステム。
【請求項31】
前記ナノ粒子は、金粒子、炭素粒子、鉄粒子、磁性材料粒子、複合金属材料粒子、チューブ状粒子、ボール状粒子、バブル状粒子、スプリング状粒子、コイル状粒子、ロッド状粒子、及び、それらが組合わさった粒子を含むことを特徴とする請求項21記載のシステム。
【請求項32】
前記フィードフォワード制御手段と前記フィードバック制御手段とは、互いに一体化して、または、互いに独立して機能するようにしてあることを特徴とする請求項21記載のシステム。
【請求項33】
前記ナノ粒子は、該ナノ粒子に付着したペプチド、モノクローナル抗体、モノクローナル抗体断片、またはアプタマーによって、標的細胞を標的化する標識とされていることを特徴とする請求項21記載のシステム。
【請求項34】
前記ナノ粒子は、該ナノ粒子に付着したミトコンドリア標的化ペプチドによって、ミトコンドリアを標識化する標識とされていることを特徴とする請求項21記載のシステム。
【請求項35】
前記ビーム径路は、個々の処置対象者の適用条件に自動的に適合させるための許容誤差を見込んで規定されることを特徴とする請求項30記載のシステム。
【請求項36】
フォトン利用の非侵襲的外科手術システムにおいて、
画像形成装置を備えており、該画像形成装置は、処置対象者の身体の画像を撮像して体内構造についての情報を提供し、
少なくとも1つのビーム発生器を備えており、該ビーム発生器は複数本のエネルギビームを発生し、それらエネルギビームは処置対象者の体内の標的にエネルギを供給するためのビームであり、
前記少なくとも1つのビーム発生器は、該ビーム発生器から射出するエネルギビームに処理を施すためのビームプロセッサを備えており、
前記複数本のエネルギビームが1箇所で交差するようにしてあり、
フィードフォワード制御手段を備えており、該フィードフォワード制御手段は、前記複数本のエネルギビームが処置対象者の身体を透過して進行する際に発生すると予測されるビーム偏向と、予測したビーム偏向が発生したならばその結果として形成されるはずのビーム経路とを事前算出し、
フィードバック制御手段を備えており、該フィードバック制御手段は、前記画像形成装置により収集される情報に関して動作するものであり、
前記標的に付着しまたは前記標的の中に入れられた複数のナノ粒子を備えている、
ことを特徴とするシステム。
【図1A】


【図1B】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】




【図1B】


【図2】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図8A】


【図8B】


【図9A】


【図9B】


【図9C】


【図9D】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【公表番号】特表2010−540163(P2010−540163A)
【公表日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願番号】特願2010−527969(P2010−527969)
【出願日】平成20年10月1日(2008.10.1)
【国際出願番号】PCT/US2008/011329
【国際公開番号】WO2009/045411
【国際公開日】平成21年4月9日(2009.4.9)
【出願人】(510089247)インスピレド スルギカル テクノロジーズ インコーポレーテッド (1)
【Fターム(参考)】
【公表日】平成22年12月24日(2010.12.24)
【国際特許分類】
【出願日】平成20年10月1日(2008.10.1)
【国際出願番号】PCT/US2008/011329
【国際公開番号】WO2009/045411
【国際公開日】平成21年4月9日(2009.4.9)
【出願人】(510089247)インスピレド スルギカル テクノロジーズ インコーポレーテッド (1)
【Fターム(参考)】
[ Back to top ]

