二次電池用正極及び二次電池
【課題】高い電位で充電反応が行われる正極活物質を用いた二次電池においても、導電助剤が充電時の高い電位において酸化されてしまったり、溶媒が分解したりしてしまうことのない二次電池用正極を提供する。
【解決手段】本発明の二次電池用正極は、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着している正極活物質粉末(例えばLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等の粉末)と、PTFE粉体との混合物が圧着によって成形されている。
【解決手段】本発明の二次電池用正極は、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着している正極活物質粉末(例えばLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等の粉末)と、PTFE粉体との混合物が圧着によって成形されている。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は二次電池用正極及び二次電池に関し、Li2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等、高い電位で充電反応が行われる正極活物質を利用した二次電池として好適に用いることができる。
【背景技術】
【0002】
従来、二次電池の正極活物質にカーボン粉を混合し、正極に必要な電子伝導性を付与することが行なわれている。例えば、リチウムイオン電池用の正極活物質として、コバルト酸リチウム(LiCoO2)、ニッケル酸リチウム(LiNiO2)、これらの固溶体、マンガン酸リチウム(LiMn2O4)等が用いられており、これら正極材料に導電助剤としてのカーボンを混合して正極に必要な電子伝導性を付与し、さらにはポリテトラフルオロエチレン(PTFE)やポリフッ化ビニリデン(PVdF)等のフッ素樹脂を結着剤として用いることにより正極が成形されている。
【0003】
そして、さらなる大出力化及び高速充電の要請に応えるため、電極を作製する時に原料を炭化したり、電極活物質と導電助剤と溶媒とを湿式法により混合粉砕した後、溶媒を除去したり(特許文献1)して、電子伝導性を向上させることが行なわれている。また、金属で表面を被覆した高分子材料を導電助剤として用いたり(特許文献2)、活物質層に導電助剤として金属粒子を含ませたり(特許文献3)して、電子伝導性を向上させることも提案されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−147024号公報
【特許文献2】特開2007−311057号公報
【特許文献3】特開2006−164823号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、上記のLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等の高い電位で充電反応が行われる正極活物質では、導電助剤としてこれらの正極活物質に添加したグラファイト粉等が、充電時の高い電位において酸化されてしまったり、グラファイト粉上での電気化学反応によって溶媒が分解されてしまったりするという問題があった。
【0006】
本発明は上記諸点に鑑みてなされたものであり、高い電位で充電反応が行われる、エネルギー密度の高い正極活物質を有効に活用することができる、二次電池用正極を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の二次電池用正極は、正極活物質からなる粒子の集合体が所定の形状に成形された二次電池用正極において、前記正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されていることを特徴とする。
【0008】
本発明の二次電池用正極では、正極活物質からなる粒子の集合体が所定の形状に成形されており、正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されている。このため、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが導電助剤の役割を果たし、二次電池用正極のために必要な特性である電子伝導性が付与される。しかも、本発明者らの試験結果によれば、ダイヤモンドライクカーボンやグラッシーカーボンは、グラファイトよりも広い電位窓を有しており、高い電位において安定であり、溶媒を分解するおそれも少ない。このため、充電時の高い電位においてダイヤモンドライクカーボンやグラッシーカーボンが酸化されてしまったり、溶媒が分解したりしてしまうおそれも少ない。このため、ひいては高い電位で充電反応が行われるエネルギー密度の高い正極活物質を、有効に活用することができる。
【0009】
ここで、導電性ダイヤモンドライクカーボンとは、ダイヤモンド結合(炭素同士のSP3混成軌道結合)とグラファイト結合(炭素同士のSP2混成軌道結合)の両方の結合が混在しているアモルファス構造をとるカーボンのうち、導電性が1000Ωcm以下のものをいう。ただし、アモルファス構造以外に、部分的にグラファイト構造からなる結晶構造(すなわちSP2混成軌道結合からなる六方晶系結晶構造)からなる相を有し、これにより導電性が発揮されるものも含まれる。グラファイトとダイヤモンドの中間の性質を有するダイヤモンドライクカーボンは、成膜時にダイヤモンドライクカーボンを構成する炭素原子のSP2混成軌道結合とSP3混成軌道結合の比率を調整することで、導電性を調節することができる。
【0010】
また、グラッシーカーボンとは、グラファイト系材料の基本構造である数ナノメータ程度の六角網面を方向性なく集合させたものであり、加熱処理してもグラファイト構造が発達し難く、非晶質に近い構造を有するカーボンをいう。
【0011】
正極活物質からなる粒子への導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンの付着は、乾式めっき法によってなされていることが好ましい。こうであれば、正極活物質からなる粒子の表面全体に均一に密着性良く導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させることができる。ここで、乾式めっき法とは、真空中又は気相中において導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンを正極活物質からなる粒子の表面に付着させる全ての方法をいう。
【0012】
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、例えば、CVD法、熱CVD、プラズマCVD(高周波、マイクロ波、直流等)、PVD法、真空蒸着法、イオンプレーティング(直流励起、高周波励起)法、スパッタ法(2極スパッタ、マグネトロンスパッタ、ECRスパッタ)、レーザーアブレーション法、イオンビームデポジション、イオン注入法等が挙げられる。
また、グラッシーカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、真空中でグラッシーカーボンのターゲットにイオンビームをあて、スパッタリング現象により、正極活物質表面に付着させるスパッタリング法や、正極活物質の粉末を炭化水素系ガスを含有する雰囲気内でプラズマ熱処理する方法等を採用することができる。
さらには、上記正極活物質の粉末へのダイヤモンドライクカーボンのコーティング方法と上記正極活物質の粉末へのグラッシーカーボンのコーティング方法を両方採用し、正極活物質の粉末にへダイヤモンドライクカーボンとグラッシーカーボンの両方が付着した正極活物質を正極材料として用いることもできる。
【0013】
本発明の二次電池用正極に用いられる正極活物質としては、Li2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4Fの少なくとも1種を含むことができる。これらの正極活物質は、高い電位において充電されるため、エネルギー密度が大きいという利点はあるものの、従来のグラファイトからなる導電助剤ではグラファイトが酸化されたり、溶媒が分解されたりするおそれがあった。これに対して本発明の二次電池用正極では、高い電位であっても安定なダイヤモンドライクカーボンが導電助剤として働き、電位窓が広くて溶媒の分解もされ難い。このため、エネルギー密度が大きなこれらの正極活物質の利点を有効に活用できるリチウムイオン電池として、好適に用いることができる。
【0014】
また、発明者らの試験結果によれば、ニトリル化合物を含む電解液は広い電位窓を有するため、Li2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4F等の高い電位において充電される正極活物質の充電領域でも安定に存在し、分解に耐えうる。このため、本発明の二次電池用正極用の電解液として好適である。このため、本発明の二次電池は、請求項1又は2記載の二次電池用正極と、ニトリル化合物を含む電解液と、を備えていることを特徴とするとした。
【図面の簡単な説明】
【0015】
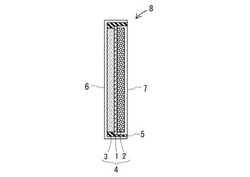
【図1】実施形態の二次電池の断面模式図である。
【図2】実施形態の二次電池用正極の拡大模式図である。
【図3】実験例1、2及び比較例1〜3の電極のLiPF6を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図4】実験例1、2及び比較例1〜3の電極のLiBF4を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図5】実験例1、2及び比較例1〜3の電極のLiTFSIを溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図6】実験例4、5及び比較例4の電極のNaPF6を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図7】実施例1のリチウムイオン電池用電極の充放電特性を示すグラフである。
【発明を実施するための形態】
【0016】
(実施形態)
以下、本発明を具体化した実施形態について説明する。
まず、正極活物質の粉末を用意し、乾式めっき法によって、正極活物質の粉末の表面にダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させる。
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、例えばイオン化蒸着法を用いることができる。すなわち、真空チャンバー中にベンゼンや炭化水素ガスを導入し、直流アーク放電プラズマ中でイオンを生成させ、直流の負電圧にバイアスされた正極活物質の粉末にバイアス電圧に応じたエネルギーで衝突させて正極活物質の粉末の表面にダイヤモンドライクカーボンを付着させる方法である。
【0017】
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるためのその他の方法としては、高周波プラズマ法が挙げられる。この方法は、メタンガスを原料に使い、容量結合型のプラズマ電極を用いる方法である。
【0018】
さらには、炭化水素ガスの熱分解によってダイヤモンドライクカーボンを正極活物質の粉末に付着させることもできる(例えば特開2008−260670号公報)。
【0019】
また、スパッタリングの手法で正極活物質の粉末の表面にダイヤモンドライクカーボンを付着させることもできる(例えば特開2004−339564号公報)。
すなわち、真空中において、電子を電界によって加速してアルゴンガスに衝突させてアルゴンをイオン化し、これを電界によって加速して固体カーボンターゲット衝突させてスパッタリングさせ、正極活物質の粉末上にダイヤモンドライクカーボンを形成させる方法である(このとき、正極活物質に印加する負のバイアス電圧をかけてもよい。)。
【0020】
上記のような、様々な乾式めっき法によって、表面にダイヤモンドライクカーボンを付着させた正極活物質の粉末を用意し、これに結合剤としてのポリテトラエチレン(PTFE)やポリフッ化ビニリデン(PVdF)等のフッ素樹脂粉末とを加え、ホットプレスによって所望の形状に成形し、実施形態の二次電池用正極を得る。正極活物質としては、例えばLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等のいずれか、あるいはこれらの混合物を用いることができる。これらの混合割合は、正極として必要とされる電子伝導性や、結合剤としての機能を奏するために必要なフッ素樹脂の添加量等を勘案して、適宜決定すればよい。
【0021】
また、グラッシーカーボンを正極活物質の粉末に付着させるための方法としては、正極活物質の粉末をメタン、エタン、プロパンなどの炭化水素系ガスを含有する0.1〜30torr、400〜1100℃の雰囲気内でプラズマ熱処理する方法を採用することができる(特開平11−43770号公報参照)。
【0022】
さらには、上記正極活物質の粉末へのダイヤモンドライクカーボンのコーティング方法と上記正極活物質の粉末へのグラッシーカーボンのコーティング方法を両方採用し、正極活物質の粉末にへダイヤモンドライクカーボンとグラッシーカーボンの両方が付着した正極活物質を正極材料として用いることもできる。
【0023】
このようにして成形したリチウムイオン電池用正極を用いて、図1に示すようなリチウムイオン電池8を製造することができる。すなわち、電解液が浸透可能なセパレータ1をリチウムイオン電池用正極2とグラファイトからなる負極3とで挟んで接合体4とし、電解液に浸漬する。そして、パッキン5を装填した負極用集電ケース6に負極3が接触するように接合体4を収容し、さらにリチウムイオン電池用正極2側から正極用集電板7を嵌挿した後、負極用集電ケース6と正極用集電板7とをかしめて密閉する。こうして、実施形態のリチウムイオン電池8を製造することができる。
【0024】
上記実施形態のリチウムイオン電池8のリチウムイオン電池用正極2では、図2に示すように、正極活物質粉末2a上にダイヤモンドライクカーボン2bとフッ素樹脂粉末2cが付着しており、フッ素樹脂粉末2cが結合剤として各粉末をつなぎとめて電極形状を保持している。そして、ダイヤモンドライクカーボン2bが電子伝導性を担う導電補助剤としての役割を果たす。後述するように、ダイヤモンドライクカーボン2bは、リチウムイオン電池の電解液中において、単なるカーボンブラック粉末やグラファイト粉末よりも広い電位窓を有している。このため、正極活物質の充電過程における高い電位においても、安定に存在し、電解液溶媒の分解もほとんど発生しない。このため、導電助剤が充電時の高い電位において酸化されてしまったり、溶媒が分解したりしてしまうことがなく、ひいては、高い電位で充電反応が行われ、エネルギー密度の高い正極活物質を有効に活用することができる。
【0025】
<実験例>
以下、本発明の二次電池用正極の発明の効果について立証するため、様々な導電性物質粉体をPTFE粉体と混合してホットプレス法によって円盤状電極を作製し、電位−電流曲線を測定した。
【0026】
(実験例1)
実験例1では、ダイヤモンドライクカーボン粉末(平均粒径0.03μm)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0027】
(実験例2)
実験例2では、グラッシーカーボン粉(平均粒径0.5μm)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0028】
(比較例1)
比較例1は、市販のグラッシーカーボン板そのものである
【0029】
(比較例2)
比較例2では、カーボンブラック(電気化学工業社製「HS−100」)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0030】
(比較例3)
実験例3では、カーボンブラック(電気化学工業社製「HS−100」)を真空中3000℃で3時間熱処理を行なったものとPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0031】
<電位−電流曲線の測定>
上記のようにして作製した実験例1、2及び比較例1〜3の電極について、リチウムイオン電池用電解液中で電位走査し、電位−電流曲線を測定した。電解液は次のように調製した。すなわち、エチレンカーボネートとジメチルカーボネートとセバコニトリルとを質量比で25:25:50となるように混合液を調製し、さらにリチウム電解質(LiPF6、LiBF4及びLiTFSIのいずれか)を1mol/Lとなるように溶解した溶液を電解液とし、三極式電解セル容器に入れた。
【0032】
電位−電流曲線の測定は、作用極として上記電極(面積1.0cm2)、対極として白金網、参照電極としてLi金属を用いた。掃引速度は5mV/secとした。
【0033】
結果を図3〜図5に示す。
(LiPF6を溶解したリチウムイオン電池用電解液中での測定結果)
ダイヤモンドライクカーボン粉末を用いた実験例1の電極及びグラッシーカーボン粉を用いた実験例2の電極では、図3に示すように、7V(vs Li/Li+)までほとんど電流は流れることはなく、比較例1のグラッシーカーボン板電極よりも
広い電位窓を有していることが分かった。
これに対して、カーボンブラックを用いた比較例2の電極では3.6V(vs Li/Li+)を超えると電流が急激に流れはじめ、電位窓が狭いことが分かった。
また、カーボンブラックを熱処理してグラファイト化したものを用いた比較例3の電極では、比較例2の電極より電位窓が多少広くなったものの、4Vを超えると酸化電流が流れ出し、実験例1や実験例2の電極と比較して、電位窓が狭いことが分かった。
【0034】
(LiBF4を溶解したリチウムイオン電池用電解液中での測定結果)
また、図4に示すように、LiBF4を溶解したリチウムイオン電池用電解液中においても、ダイヤモンドライクカーボン粉末を用いた実験例1の電極及びグラッシーカーボン粉を用いた実験例2の電極は、LiPF6を溶解したリチウムイオン電池用電解液中での測定と同様、広い電位窓を有することが分かった。
【0035】
(LiTFSIを溶解したリチウムイオン電池用電解液中での測定結果)
さらに、図5に示すように、LiTFSIを溶解したリチウムイオン電池用電解液中での測定においても、グラッシーカーボン粉を用いた実験例2の電極は、広い電位窓を有することが分かった。この結果、並びに、LiPF6を溶解したリチウムイオン電池用電解液中での測定結果(図3参照)及びLiBF4を溶解したリチウムイオン電池用電解液中での測定結果(図4参照)において、ダイヤモンドライクカーボンを用いた電極が、グラッシーカーボンを用いた電極と同様に、広い電位窓を有しているという結果から、LiTFSIを溶解したリチウムイオン電池用電解液中においても、グラッシーカーボンを用いた電極が広い電位窓を有することは明らかである。
【0036】
<ナトリウムイオン電池への適用例>
以上は、リチウムイオン電池を想定した、LiPF6を溶解した溶液を電解液中での電位−電流曲線の測定に関する実験例であった。本発明は、リチウムイオン電池以外にナトリウムイオン電池においても適用することができる。このことを実証するために、NaPF6を溶解した溶液を電解液中での電位−電流曲線の測定についても行った。
【0037】
(実験例3)
実験例3では、グラッシーカーボン粉(平均粒径0.5μm)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0038】
(実験例4)
実験例4では、ダイヤモンドライクカーボン粉(平均粒径0.03μm)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0039】
(比較例4)
比較例4では、カーボンブラック(商品名:デンカブラック 電気化学工業株式会社製)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0040】
<電位−電流曲線の測定>
上記のようにして作製した実験例3、4及び比較例4の電極について、ナトリウムイオン電池用電解液中で電位走査し、電位−電流曲線を測定した。電解液は次のように調製した。すなわち、エチレンカーボネートとジメチルカーボネートとセバコニトリルとを容量比で25:25:50となるように混合液を調製し、さらにNaPF6を0.5mol/Lとなるように溶解した溶液を電解液とし、三極式電解セル容器に入れた。
【0041】
電位−電流曲線の測定は、作用極として上記電極(面積1.0cm2)、対極として白金網、参照電極としてリチウム金属を用いた。掃引速度は5mV/secとした。
【0042】
その結果、図6に示すように、グラッシーカーボン粉末を用いた実験例3及びダイヤモンドライクカーボンを用いた実験例4の電極では、7V(vs.Li/ Li +)まで電流はほとんど流れず、広い電位窓を有していることが分かった。これに対してカーボンブラックを電極とした比較例4の電極では、4V(vs.Li/ Li +)付近で電流が立ち上がり、実験例3及び4と比較して、電位窓が狭いことが分かった。
【0043】
以上の結果から、ナトリウムイオン電池の正極活物質粉にグラッシーカーボンやダイヤモンドライクカーボンを付着させた正極は、リチウムイオン電池の場合と同様、充電時に高い電位とされる正極においても、分解されることなく、溶媒を分解するおそれも少ないことが分かった。そして、この結果から、高い電位で充電反応が行われるエネルギー密度の高いナトリウムイオン電池用の正極活物質を有効に活用できることが分かった。
【0044】
以上の結果から、リチウムイオン電池の正極活物質粉末に対して乾式めっき法によってダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させ、さらにこれにフッ素樹脂粉末を混合して成形した実施形態のリチウムイオン電池用正極は、リチウムイオン電池用の充電時に高い電位とされる正極においても、分解されることなく、溶媒を分解するおそれも少ないことが分かる。そして、この結果から、高い電位で充電反応が行われるエネルギー密度の高い正極活物質を有効に活用できることが分かる。また、ナトリウムイオン電池についても、同様である。以上のことを立証するために、実施例1では以下に示す方法でリチウム電池用正極を作製し、その充放電特性を測定した。
【0045】
(実施例1)
プラズマCVD法でDLCをコーティングしたLiCoPO4Fの粉末と、導電助剤(グラッシーカーボン)と、PTFE粉とを70:25:5の重量比で乳鉢により混合し、圧着成型してシート状とし、これを実施例1のリチウム電池用電極とした。
【0046】
(比較例5)
比較例5の電極は、正極活物質としてDLCをコーティングしていないLiCoPO4Fの粉末と導電助剤(グラッシーカーボン)とPTFE粉とを70:25:5の重量比で乳鉢により混合し、圧着成型してシート状とし、これを比較例5のリチウム電池用電極とした。
【0047】
以上のようにして作製した実施例1のリチウム電池用電極について、放電速度は0.01Cとし、充放電特性を調べた。その結果、図7に示すように、5V(vs Li/Li+)以上の充電電位においても充電が可能であることが分かった。これに対して、ダイヤモンドライクカーボンのコーティングを行わなかった比較例5では、放電容量が実施例1と比較して放電容量が大幅に小さくなった。これは、導電助剤であるグラッシーカーボンと、正極活物質であるLiCoPO4Fとの間の電子伝導性が悪いためであると推定される。
DLCコートすると電子のやり取りがスムーズに行われる。
【0048】
この発明はリチウムイオン電池やナトリウムイオン電池等の二次電池に適用される。ここに、リチウムイオン電池やナトリウムイオン電池等の二次電池は電解液、正極、負極、セパレータ及びケースを備えてなる。
【0049】
(リチウムイオン電池用電解液)
リチウムイオン電池用電解液はLi塩(電解質)と有機溶媒とを含んでいる。
Li塩には、Liイオン電池用の一般的なLi塩を用いることができる。例えば、LiPF6(六フッ化リン酸リチウム)、LiBF4(四フッ化ホウ酸リチウム)、LiTFSI(リチウムビス(トリフルオロメタンスルホニル)イミド)、LiTFS(トリフルオロメタンスルホン酸リチウム)、LiBETI(リチウムビス(ペンタフルオロエタンスルホニル)イミド)又はこれらの2種以上を用いることができる。
なかでも、正極の酸化還元電位が4.5V以上のものについては、LiPF6、及び/又はLiBF4を使用することが好ましい。また、LiTFSIやLiTFSやLiBETIを用いる場合、LiPF6又はLiBF4を添加することが好ましい。
【0050】
有機溶媒もLiイオン電池に用いられる一般的なものを採用できる。かかる有機溶媒としては環状炭酸エステル、環状カルボン酸エステル及び鎖状炭酸エステルの中から選ばれる1種、又は2種以上が好ましい。更に好ましくは、環状炭酸エステルと鎖状炭酸エステルとを併用する。具体的には、エチレンカーボネートとジメチルカーボネートとを併用することが特に好ましい。両者の配合割合は特に限定されない。環状カルボン酸エステルとしてはγ−ブチロラクトンを用いることができる。
更にはニトリル化合物を有機溶媒として用いることができる。ここで、ニトリル化合物としては、鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物、鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物及びシアノ酢酸エステルのうち少なくとも一つのニトリル化合物を挙げることができる。
【0051】
鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物としては、例えば、スクシノニトリルNC(CH2)2CN、グルタロニトリルNC(CH2)3CN、アジポニトリルNC(CH2)4CN、セバコニトリルNC(CH2)8CN、ドデカンジニトリルNC(CH2)10CNなどのような直鎖状のジニトリル化合物の他、2−メチルグルタロニトリルNCCH(CH3)CH2CH2CN等のように分枝を有していても良い。これらの鎖式飽和炭化水素ジニトリル化合物は、炭素数は特に限定されないが20以下であることが好ましい。更に好ましくは7〜12である。
【0052】
鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物としては、オキシジプロピオニトリルNCCH2CH2−O−CH2CH2CNや、3−メトキシプロピオニトリルCH3−O−CH2CH2CN等が挙げられる。これらの鎖式エーテルニトリル化合物は、炭素数は特に限定されないが、20以下であることが好ましい。
シアノ酢酸エステルとしてはシアノ酢酸メチル、シアノ酢酸エチル、シアノ酢酸プロピル、シアノ酢酸ブチル等が挙げられる。これらのシアノ酢酸エステルは、炭素数は特に限定されないが、20以下であることが好ましい。
【0053】
これらニトリル化合物は電解液において電位窓を特に正方向に広げる作用を奏する。
電位窓を広げる作用の観点からジニトリル化合物が好ましい。中でも、セバコニトリルの採用が更に好ましい。
ただし、ニトリル化合物は粘度が高いので、上述の鎖状炭酸エステル、環状炭酸エステル及び/又は環状カルボン酸エステルと併用することが好ましい。更に好ましくはニトリル化合物と鎖状炭酸エステル及び環状炭酸エステルとを併用する。鎖状炭酸エステルとしてはジメチルカーボネートを採用することができ、環状炭酸エステルとしてはエチレンカーボネートを採用することができる。
この場合、有機溶媒全体に占めるニトリル化合物の配合割合は1〜90容量%とすることが好ましい。更に好ましくは5〜70容量%であり、更に更に好ましくは、10〜50容量%である。
【0054】
また、各種添加剤(例えば、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンサルファイト)を0.1−3%程度入れることも好ましい。これにより、負極側で耐食性皮膜がで形成され、耐食性が向上する。
【0055】
Li塩の濃度は0.01mol/L以上であって、飽和状態よりも低い濃度とする。Li塩の濃度が0.01mol/L未満であると、Liイオンによるイオン伝導が小さくなり、電解液の電気抵抗が高くなるので好ましくない。他方、飽和状態を超えると、温度等の環境変化によって溶解しているLi塩が析出するので好ましくない。
【0056】
(ナトリウムイオン電池用電解液)
ナトリウムイオン電池用電解液はNa塩(電解質)と有機溶媒とを含んでいる。
Na塩には、従来からNaイオン電池用のNa塩として知られているものを用いることができる。例えば、例えば、NaClO4、NaPF6、NaBF4、NaCF3SO3、NaN(CF3SO2)2、NaN(FSO2)2、NaN(C2F5SO2)2、NaC(CF3SO2)3等が挙げられる。溶媒及び溶質の混合比は特に限定されず、目的に応じて適宜設定される。
また、各種添加剤(例えば、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンサルファイト)を0.1−3%程度入れることも好ましい。これにより、負極側で耐食性皮膜がで形成され、耐食性が向上する。
【0057】
有機溶媒もNaイオン電池に用いられる一般的なものを採用できる。かかる有機溶媒とし環状炭酸エステル、環状カルボン酸エステル及び鎖状炭酸エステルの中から選ばれる1種、又は2種以上が好ましい。更に好ましくは、環状炭酸エステルと鎖状炭酸エステルとを併用する。具体的には、エチレンカーボネートとジメチルカーボネートとを併用することが特に好ましい。両者の配合割合は特に限定されない。環状カルボン酸エステルとしはγ−ブチロラクトンやプロピレンカーボネートを用いることができる。
鎖状カーボネートは、ジメチルカーボネートのほかに、ジエチルカーボネートやエチルメチルカーボネートを使用することができる。
更にはニトリル化合物を有機溶媒として用いることができる。ここで、ニトリル化合物としては、鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物、鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物及びシアノ酢酸エステルのうち少なくとも一つのニトリル化合物を挙げることができる。
【0058】
鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物としては、例えば、スクシノニトリルNC(CH2)2CN、グルタロニトリルNC(CH2)3CN、アジポニトリルNC(CH2)4CN、セバコニトリルNC(CH2)8CN、ドデカンジニトリルNC(CH2)10CNなどのような直鎖状のジニトリル化合物の他、2−メチルグルタロニトリルNCCH(CH3)CH2CH2CN等のように分枝を有していても良い。これらの鎖式飽和炭化水素ジニトリル化合物は、炭素数は特に限定されないが、7〜20であることが好ましい。更に好ましくは10〜12である。
【0059】
鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物としては、オキシジプロピオニトリルNCCH2CH2−O−CH2CH2CNや、3−メトキシプロピオニトリルCH3−O−CH2CH2CN等が挙げられる。これらの鎖式エーテルニトリル化合物は、炭素数は特に限定されないが、20以下であることが好ましい。
シアノ酢酸エステルとしてはシアノ酢酸メチル、シアノ酢酸エチル、シアノ酢酸プロピル、シアノ酢酸ブチル等が挙げられる。これらのシアノ酢酸エステルは、炭素数は特に限定されないが、20以下であることが好ましい。
【0060】
これらニトリル化合物は電解液において電位窓を特に正方向に広げる作用を奏する。電位窓を広げる作用の観点からジニトリル化合物が好ましい。中でも、セバコニトリルの採用が更に好ましい。
ただし、ニトリル化合物は粘度が高いので、上述の鎖状炭酸エステル、環状炭酸エステル及び/又は環状カルボン酸エステルと併用することが好ましい。更に好ましくはニトリル化合物と鎖状炭酸エステル及び環状炭酸エステルとを併用する。鎖状炭酸エステルとしてはジメチルカーボネートを採用することができ、環状炭酸エステルとしてはエチレンカーボネートを採用することができる。
この場合、有機溶媒全体に占めるニトリル化合物の配合割合は1〜90容量%とすることが好ましい。更に好ましくは15〜70容量%であり、更に更に好ましくは、30〜50容量%である。
【0061】
Na塩の濃度は0.01mol/L以上であって、飽和状態よりも低い濃度とする。Na塩の濃度が0.01mol/L未満であると、Naイオンによるイオン伝導が小さくなり、電解液の電気抵抗が高くなるので好ましくない。他方、飽和状態を超えると、温度等の環境変化によって溶解しているNa塩が析出するので好ましくない。
【0062】
(正極)
正極は正極活物質と集電体とを備える。
(リチウムイオン電池用正極活物質)
リチウムイオン電池用正極活物質とは「負極よりも高い電位で結晶構造内にリチウムが挿入/離脱され、それに伴って酸化/還元が行われる物質」をいう。
正極活物質としては(1)酸化物系、(2)オリビン型結晶構造を有するリン酸塩系、及び(3)オリビンフッ化物系を挙げることができる。
【0063】
(1)酸化物系
1−1具体的物質
酸化物系としては、Li1−xCoO2(x=0〜1:層状構造)、Li1−xNiO2(x=0〜1:層状構造)、Li1−xMn2O4(x=0〜1:スピネル構造)、Li2-yMnO3系(y=0〜2)及びこれらの固溶体(ここで固溶体とは、上記酸化物系の正極活物質において金属原子が自由な割合で混合された物質を指す。)を挙げることができる。また、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Li、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又はそれ以上を用いることができる。
1−2 特性
この正極活物質の一般的な放電電位は5V (vs Li/Li+)未満である。但し、LiMn2O4系でNiに一部置換した、LiNi0.5Mn1.5O4は、放電電位が4.7Vであり、急速充電をおこなう際には過電圧分を加味し、5Vを超える充電電圧を必要とする場合がある。また、LiCoMnO4は放電電圧が5.2V程度から始まるため、これも充電電圧は5Vを超える。また、酸化物系は一般に300℃未満で分解し、酸素発生とともに比較的大きな発熱反応がある。このため、過充電が起こらないような制御回路が必要とされる。
【0064】
(2)オリビン型結晶構造を有するリン酸塩系
2−1具体的物質
オリビン型結晶構造を有するリン酸塩系としては、Li1−xNiPO4 (x=0〜1)、Li1−xCoPO4 (x=0〜1)、Li1−xMnPO4 (x=0〜1)、Li1−xFePO4 (x=0〜1)及びこれらの固溶体(ここで固溶体とは、上記リン酸塩系の正極活物質において金属原子が自由な割合で混合された物質を指す。)を挙げることができる。また、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又は2種以上を用いることができる(特開2008−130525号参照)。
2−2 特性
この正極活物質の酸化還元電位は、上記酸化物系とは異なり300℃未満では発熱反応が小さい上、酸素は発生せず、安全性が高いことから注目されている。また、リン酸塩系のうち、LiCoPO4系は放電電位が4.8V程度であり、急速充電に際しては5V以上で耐電圧を有する電解液が必要とされる。LiNiPO4の放電電位は5.2V (vs Li/Li+)が示唆されている。
【0065】
(3)オリビンフッ化物系
3−1 具体的物質
Li2−xNiPO4F (x=0〜2)、Li2−xCoPO4F (x=0〜2)が知られており、その他Li2−xMnPO4F (x=0〜2)、Li2−xFePO4F (x=0〜2)が考えられる。
また、これらの固溶体(ここで固溶体とは、上記オリビンフッ化物系の正極活物質において金属原子が自由な割合で混合された物質を指す。)も挙げることができる。さらに、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又はそれ以上を用いることができる。
3−2 特性
この正極活物質の酸化還元電位はオリビン系と同様に、上記酸化物系とは異なり、300℃未満の分解では、発熱反応が小さい上、酸素発生がないため、正極活物質由来の電池発火の影響は小さいと考えられ安全性の面で注目されている。また、電池の電気容量密度(mAh/g)を上記リン酸塩系よりも高くできる(特開2003−229126号公報参照)。しかし、例えばLi2CoPO4F系は、平均放電電位が4.8V程度であり、急速充電に際しては5V以上で耐電圧を有する電解液が必要とされる。また、Li2NiPO4F系の放電電位は5.2V(vs Li/Li+)程度であり、5V以上で耐電圧を有する電解液が必要とされる。
【0066】
(4)その他
その他、リチウム非含有のFeF3、有機導電性物質を用いた共役系ポリマー、シェブレル相化合物等を用いることもできる。また、遷移金属カルコゲン化物、バナジウム酸化物およびそのリチウム塩、ニオブ酸化物およびそのリチウム塩、さらには、複数の異なった正極活物質を混合して用いることも可能である。
正極活物質粒子の平均粒径は、特に限定はされないが、10nm〜30μmであることが好ましい。
【0067】
(ナトリウムイオン電池用正極活物質)
ナトリウムイオン電池用正極活物質は、充放電によって可逆的に酸化−還元を繰り返すことのできる物質であって、ナトリウムイオンを可逆的にインターカレート−デインターカレートできる物質であることが要求される。
このような正極活物質としては、特開2009−129741号公報に記載されているNaFeO2、NaNiO2、NaCoO2、NaMnO2、NaFe1−xM1xO2、NaNi1−xM1xO2、NaCo1−xM1xO2、NaMn1−xM1xO2(ただし、M1は3価金属からなる群より選ばれる1種以上の元素であり、0≦x<0.5である。)で示される化合物等が挙げられる。これらのなかでも、主に鉄とナトリウムとを含有する複合酸化物であって、六方晶の結晶構造からなる複合酸化物を正極活物質として用いることにより、高い放電電圧を得ることができ、エネルギー密度の高い二次電池を得ることができる。
【0068】
上記正極活物質として、さらに好ましくは、主に鉄とナトリウムとを含有する複合酸化物であって、六方晶の結晶構造を有し、かつ該複合酸化物のX線回折分析において、面間隔2.20オングストロームのピークの強度を面間隔5.36オングストロームのピークの強度で除した値が2以下である複合酸化物である。またナトリウム化合物と鉄化合物とを含有する金属化合物混合物を、400℃以上900℃以下の温度範囲で加熱するにあたり、温度上昇中の100℃未満の温度範囲においては雰囲気を不活性雰囲気として加熱することが好ましい。
また、これらの化合物うちの遷移金属原子を他の金属原子でドープしたものでもよい。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。
【0069】
(正極用集電体)
正極用集電体とは正極活物質を担持する導電性の基板である。
正極の集電体の成形材料は、充電時において安定であることが要求される。特に、酸化還元電位の高いオリビン型結晶構造を有するリン酸塩系及びオリビンフッ化物系の正極活物質を用いるときには、耐食性に優れた素材を使用することが好ましい。
例えば、電解質としてLiPF6、LiBF4を使用する場合、オーステナイト系ステンレス、Ni、Al、Ti等を用いることができるが、使用する正極活物質の動作電位を考慮し、適宜選択することが好ましい。例えば、電解質としてLiPF6を用いる場合は、Li/Li+電極に対して6Vでも使用することができるが、電解質としてLiBF4を用いる場合、SUS304はLi/Li+電極に対し5.8V以下で充放電可能な場合のみ用いることができる。また、電解質としてLiTFSIを使用する場合、正極集電体表面に耐食性皮膜を形成させるべく、LiPF6を共存させることが好ましい。LiBETI及びLiTFSもLiTFSIの場合と同様である。
また、Al等の導電金属材料へ導電性DLC(ダイヤモンドライクカーボン)を周知の方法で被覆したものを集電体として用いることもできる。電解質がLiBF4やLiPF6など、容易にフッ化物皮膜を形成するようなリチウム塩の場合は、アルミニウム上へ厚いフッ化皮膜が形成し、耐食性は向上するものの、電子伝導性が低下し、ひいてはオーミック過電圧増加に伴う、高出力化が阻害されることとなる。Al等の導電金属材料へ導電性DLCを被覆すれば、フッ化物皮膜は導電性DLCの欠陥部分の極わずかな面積でのみ発生するだけである。このため、高電圧化しても電子伝導性の低下は無視できる程度となり、懸念されている高電圧化による出力低下は防ぐことが可能となる。
ここで、導電性ダイヤモンドライクカーボンとは、ダイヤモンド結合(炭素同士のSP3混成軌道結合)とグラファイト結合(炭素同士のSP2混成軌道結合)の両方の結合が混在しているアモルファス構造をとるカーボンのうち、導電性が1000Ωcm以下のものをいう。ただし、アモルファス構造以外に、部分的にグラファイト構造からなる結晶構造(すなわちSP2混成軌道結合からなる六方晶系結晶構造)からなる相を有し、これにより導電性が発揮されるものも含まれる。グラファイトとダイヤモンドの中間の性質を有するダイヤモンドライクカーボンは、成膜時にダイヤモンドライクカーボンを構成する炭素原子のSP2混成軌道結合とSP3混成軌道結合の比率を調整することで、導電性を調節することができる。
勿論、上記耐食性導電性金属材料を導電性DLCで被覆してもよい。
集電体の形状及び構造は、正極活物質や電池の構造に応じて、任意に設計可能である。
【0070】
(正極の前処理)
リチウムイオン電池用正極やナトリウムイオン電池用正極は、電池に組み込む前に、ニトリル化合物を1容量%以上含む有機溶媒中にリチウム塩(あるいはナトリウム塩)が溶解した前処理用電解液中に正電極を浸漬する浸漬処理工程を行い、さらに電極に正電圧を付与する正電圧処理工程を行なう。こうして前処理された電極は、ニトリル化合物を全く含まない電解液や、ニトリル化合物の添加量の少ない電解液を用いたリチウムイオン電池に用いても、電位窓が広く、高い電位においても電解液を分解し難くなる(特願2009−180007号参照)。このような広い電位窓の電極となる理由は、電極上に窒素を成分として含む耐食性の皮膜が形成されるためであると推測される。
【0071】
(負極)
負極は負極活物質と集電体とを備える。
(リチウムイオン電池用負極活物質)
リチウムイオン電池用負極活物質とは「正極よりも低い電位で結晶構造内にリチウムが挿入/離脱され、それに伴って酸化/還元が行われる物質」をいう。
リチウムイオン電池用負極活物質としては、例えば、人造黒鉛、天然黒鉛、ハードカーボン等の種々の炭素材料やチタン酸リチウム(Li4Ti5O12)、H2Ti12O25、H2Ti6O13、Fe2O3などが挙げられる。また、これらを適宜混合した複合体も挙げることができる。さらには、Si微粒子やSi薄膜、これらのSiがSi−Ni、Si−Cu、Si−Nb、Si−Zn、Si−Sn等のSi系合金となった微粒子や薄膜が挙げられる。さらには、SiO酸化物、Si−SiO2複合体、Si−SiO2−カーボンなどの複合体等を挙げることができる。
【0072】
(ナトリウムイオン電池用負極活物質)
また、ナトリウムイオン電池用負極活物質とは「二次電池の負極として充放電によってナトリウムイオンが出入りするとともに可逆的に酸化−還元を繰り返すことのできる物質」であり、本発明においてはLi4Ti5O12を用いる。
【0073】
(負極用集電体)
負極用の集電体は汎用的な導電性金属材料、Cu、Al、Ni、Ti、オーステナイト系ステンレス等で形成することができる。
但し、電解液にニトリル化合物を用いたとき(他の有機溶剤との併用を含む)には、電解液中のLi塩に応じて適宜選択する必要がある。すなわち、電解質としてLiPF6、LiBF4を使用する場合、オーステナイト系ステンレス、Ni、Al、Ti等の使用が可能となる。ただし、使用する負極活物質の動作電位に応じて、適宜選択する必要がある。負極活物質としてカーボン系やSi系を使用する場合において、電解質としてLiBF4を使用した場合は、Cu以外のAl、Ni、Ti、オーステナイト系ステンレス等からなる集電体を使用することができる。負極活物質としてチタン酸リチウムやFe2O3系の化合物を用いた場合は、Cuを含む上記材料の全てが適用可能である。一方、電解質としてLiPF6使用時はAl、Ni及びTiが好ましく、オーステナイト系ステンレス及びCuは好ましくない。また、電解質としてLiTFSIや、LiBETI、やLiTFSを使用する場合、Ni、Ti、Al、Cu、オーステナイト系ステンレスの何れも使用することができる。
【0074】
(正極用電子伝導部材)
正極活物質には導電性の小さいものがある。従って、正極活物質と集電体との間に導電性の電子伝導部材を介在させて、両者の間に十分な電子伝導パスを確保することが好ましい。
ここで電子伝導部材は正極活物質と集電体との間に電子伝導パスを形成できればその形態は特に限定されるものではなく、例えばアセチレンブラック等のカーボンブラック、グラファイト粉、ダイヤモンドライクカーボン、グラッシーカーボン等の導電性粉体(導電助剤)を用いることができる。ダイヤモンドライクカーボン及びグラッシーカーボンは、カーボンブラックやグラファイトよりもはるかに広い電位窓を有しており、高電位を付与した場合の耐食性に優れているため、好適に用いることができる。また、これらの導電助剤に金属微粒子が担持されていることも好ましい。金属微粒子としては、例えばPt、Au、Ni等が挙げられる。これらは、単独で用いても良いし、これらの合金であっても良い。
電子伝導材料として、本発明において用いている、正極活物質をダイヤモンドライクカーボンにより導電性皮膜の他、正極活物質を埋入させた導電性薄膜(金の薄膜等)を併用することもできる。
【0075】
(負極用電子伝導部材)
正極用電子伝導部材と同様な物を用いることができる。
【0076】
(セパレータ)
セパレータは電解液中へ浸漬され、正極と負極とを分離し両者の短絡を防ぐとともに、Liイオンの通過を許容する。
かかるセパレータには、ポリエチレン、ポリプロピレン等のポリオレフィン系樹脂から成る多孔質フィルムが挙げられる。
【0077】
(ケース)
ケースは電解液に対する耐食性を有する材質で形成される。その形状は、電池の目的用途に応じて任意に設計できる。
リチウム塩が溶解している電解液を使用する場合には、オーステナイト系ステンレスからなる基材、Ti、Ni及び/又はAlからなるケースを用いることができる。但し使用する正極、負極活物質の動作電位により適宜選択しなければならない場合もある。
ケースが集電体を兼ねる場合や集電体に電気的に結合される場合は、各電極の集電体形成材料と同一若しくは同種の材料で形成される。
【0078】
この発明は、上記発明の実施形態の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【産業上の利用可能性】
【0079】
本発明の二次電池用正極は、高い電位で充電反応が行われるエネルギー密度の高い正極活物質を有効に活用可能な二次電池のための正極として、好適に用いることができる。
【符号の説明】
【0080】
2a…正極活物質
2b…ダイヤモンドライクカーボン
2c…フッ素樹脂粉末
2…二次電池用正極
3…負極
【技術分野】
【0001】
本発明は二次電池用正極及び二次電池に関し、Li2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等、高い電位で充電反応が行われる正極活物質を利用した二次電池として好適に用いることができる。
【背景技術】
【0002】
従来、二次電池の正極活物質にカーボン粉を混合し、正極に必要な電子伝導性を付与することが行なわれている。例えば、リチウムイオン電池用の正極活物質として、コバルト酸リチウム(LiCoO2)、ニッケル酸リチウム(LiNiO2)、これらの固溶体、マンガン酸リチウム(LiMn2O4)等が用いられており、これら正極材料に導電助剤としてのカーボンを混合して正極に必要な電子伝導性を付与し、さらにはポリテトラフルオロエチレン(PTFE)やポリフッ化ビニリデン(PVdF)等のフッ素樹脂を結着剤として用いることにより正極が成形されている。
【0003】
そして、さらなる大出力化及び高速充電の要請に応えるため、電極を作製する時に原料を炭化したり、電極活物質と導電助剤と溶媒とを湿式法により混合粉砕した後、溶媒を除去したり(特許文献1)して、電子伝導性を向上させることが行なわれている。また、金属で表面を被覆した高分子材料を導電助剤として用いたり(特許文献2)、活物質層に導電助剤として金属粒子を含ませたり(特許文献3)して、電子伝導性を向上させることも提案されている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2008−147024号公報
【特許文献2】特開2007−311057号公報
【特許文献3】特開2006−164823号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
しかし、上記のLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等の高い電位で充電反応が行われる正極活物質では、導電助剤としてこれらの正極活物質に添加したグラファイト粉等が、充電時の高い電位において酸化されてしまったり、グラファイト粉上での電気化学反応によって溶媒が分解されてしまったりするという問題があった。
【0006】
本発明は上記諸点に鑑みてなされたものであり、高い電位で充電反応が行われる、エネルギー密度の高い正極活物質を有効に活用することができる、二次電池用正極を提供することを目的とする。
【課題を解決するための手段】
【0007】
本発明の二次電池用正極は、正極活物質からなる粒子の集合体が所定の形状に成形された二次電池用正極において、前記正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されていることを特徴とする。
【0008】
本発明の二次電池用正極では、正極活物質からなる粒子の集合体が所定の形状に成形されており、正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されている。このため、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが導電助剤の役割を果たし、二次電池用正極のために必要な特性である電子伝導性が付与される。しかも、本発明者らの試験結果によれば、ダイヤモンドライクカーボンやグラッシーカーボンは、グラファイトよりも広い電位窓を有しており、高い電位において安定であり、溶媒を分解するおそれも少ない。このため、充電時の高い電位においてダイヤモンドライクカーボンやグラッシーカーボンが酸化されてしまったり、溶媒が分解したりしてしまうおそれも少ない。このため、ひいては高い電位で充電反応が行われるエネルギー密度の高い正極活物質を、有効に活用することができる。
【0009】
ここで、導電性ダイヤモンドライクカーボンとは、ダイヤモンド結合(炭素同士のSP3混成軌道結合)とグラファイト結合(炭素同士のSP2混成軌道結合)の両方の結合が混在しているアモルファス構造をとるカーボンのうち、導電性が1000Ωcm以下のものをいう。ただし、アモルファス構造以外に、部分的にグラファイト構造からなる結晶構造(すなわちSP2混成軌道結合からなる六方晶系結晶構造)からなる相を有し、これにより導電性が発揮されるものも含まれる。グラファイトとダイヤモンドの中間の性質を有するダイヤモンドライクカーボンは、成膜時にダイヤモンドライクカーボンを構成する炭素原子のSP2混成軌道結合とSP3混成軌道結合の比率を調整することで、導電性を調節することができる。
【0010】
また、グラッシーカーボンとは、グラファイト系材料の基本構造である数ナノメータ程度の六角網面を方向性なく集合させたものであり、加熱処理してもグラファイト構造が発達し難く、非晶質に近い構造を有するカーボンをいう。
【0011】
正極活物質からなる粒子への導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンの付着は、乾式めっき法によってなされていることが好ましい。こうであれば、正極活物質からなる粒子の表面全体に均一に密着性良く導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させることができる。ここで、乾式めっき法とは、真空中又は気相中において導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンを正極活物質からなる粒子の表面に付着させる全ての方法をいう。
【0012】
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、例えば、CVD法、熱CVD、プラズマCVD(高周波、マイクロ波、直流等)、PVD法、真空蒸着法、イオンプレーティング(直流励起、高周波励起)法、スパッタ法(2極スパッタ、マグネトロンスパッタ、ECRスパッタ)、レーザーアブレーション法、イオンビームデポジション、イオン注入法等が挙げられる。
また、グラッシーカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、真空中でグラッシーカーボンのターゲットにイオンビームをあて、スパッタリング現象により、正極活物質表面に付着させるスパッタリング法や、正極活物質の粉末を炭化水素系ガスを含有する雰囲気内でプラズマ熱処理する方法等を採用することができる。
さらには、上記正極活物質の粉末へのダイヤモンドライクカーボンのコーティング方法と上記正極活物質の粉末へのグラッシーカーボンのコーティング方法を両方採用し、正極活物質の粉末にへダイヤモンドライクカーボンとグラッシーカーボンの両方が付着した正極活物質を正極材料として用いることもできる。
【0013】
本発明の二次電池用正極に用いられる正極活物質としては、Li2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4Fの少なくとも1種を含むことができる。これらの正極活物質は、高い電位において充電されるため、エネルギー密度が大きいという利点はあるものの、従来のグラファイトからなる導電助剤ではグラファイトが酸化されたり、溶媒が分解されたりするおそれがあった。これに対して本発明の二次電池用正極では、高い電位であっても安定なダイヤモンドライクカーボンが導電助剤として働き、電位窓が広くて溶媒の分解もされ難い。このため、エネルギー密度が大きなこれらの正極活物質の利点を有効に活用できるリチウムイオン電池として、好適に用いることができる。
【0014】
また、発明者らの試験結果によれば、ニトリル化合物を含む電解液は広い電位窓を有するため、Li2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4F等の高い電位において充電される正極活物質の充電領域でも安定に存在し、分解に耐えうる。このため、本発明の二次電池用正極用の電解液として好適である。このため、本発明の二次電池は、請求項1又は2記載の二次電池用正極と、ニトリル化合物を含む電解液と、を備えていることを特徴とするとした。
【図面の簡単な説明】
【0015】
【図1】実施形態の二次電池の断面模式図である。
【図2】実施形態の二次電池用正極の拡大模式図である。
【図3】実験例1、2及び比較例1〜3の電極のLiPF6を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図4】実験例1、2及び比較例1〜3の電極のLiBF4を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図5】実験例1、2及び比較例1〜3の電極のLiTFSIを溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図6】実験例4、5及び比較例4の電極のNaPF6を溶解したリチウムイオン電池用電解液中での電位−電流曲線である。
【図7】実施例1のリチウムイオン電池用電極の充放電特性を示すグラフである。
【発明を実施するための形態】
【0016】
(実施形態)
以下、本発明を具体化した実施形態について説明する。
まず、正極活物質の粉末を用意し、乾式めっき法によって、正極活物質の粉末の表面にダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させる。
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるための乾式めっき法としては、特に限定はされないが、例えばイオン化蒸着法を用いることができる。すなわち、真空チャンバー中にベンゼンや炭化水素ガスを導入し、直流アーク放電プラズマ中でイオンを生成させ、直流の負電圧にバイアスされた正極活物質の粉末にバイアス電圧に応じたエネルギーで衝突させて正極活物質の粉末の表面にダイヤモンドライクカーボンを付着させる方法である。
【0017】
ダイヤモンドライクカーボンを正極活物質の粉末に付着させるためのその他の方法としては、高周波プラズマ法が挙げられる。この方法は、メタンガスを原料に使い、容量結合型のプラズマ電極を用いる方法である。
【0018】
さらには、炭化水素ガスの熱分解によってダイヤモンドライクカーボンを正極活物質の粉末に付着させることもできる(例えば特開2008−260670号公報)。
【0019】
また、スパッタリングの手法で正極活物質の粉末の表面にダイヤモンドライクカーボンを付着させることもできる(例えば特開2004−339564号公報)。
すなわち、真空中において、電子を電界によって加速してアルゴンガスに衝突させてアルゴンをイオン化し、これを電界によって加速して固体カーボンターゲット衝突させてスパッタリングさせ、正極活物質の粉末上にダイヤモンドライクカーボンを形成させる方法である(このとき、正極活物質に印加する負のバイアス電圧をかけてもよい。)。
【0020】
上記のような、様々な乾式めっき法によって、表面にダイヤモンドライクカーボンを付着させた正極活物質の粉末を用意し、これに結合剤としてのポリテトラエチレン(PTFE)やポリフッ化ビニリデン(PVdF)等のフッ素樹脂粉末とを加え、ホットプレスによって所望の形状に成形し、実施形態の二次電池用正極を得る。正極活物質としては、例えばLi2NiPO4F、LiNiPO4、LiCoPO4、Li2CoPO4F等のいずれか、あるいはこれらの混合物を用いることができる。これらの混合割合は、正極として必要とされる電子伝導性や、結合剤としての機能を奏するために必要なフッ素樹脂の添加量等を勘案して、適宜決定すればよい。
【0021】
また、グラッシーカーボンを正極活物質の粉末に付着させるための方法としては、正極活物質の粉末をメタン、エタン、プロパンなどの炭化水素系ガスを含有する0.1〜30torr、400〜1100℃の雰囲気内でプラズマ熱処理する方法を採用することができる(特開平11−43770号公報参照)。
【0022】
さらには、上記正極活物質の粉末へのダイヤモンドライクカーボンのコーティング方法と上記正極活物質の粉末へのグラッシーカーボンのコーティング方法を両方採用し、正極活物質の粉末にへダイヤモンドライクカーボンとグラッシーカーボンの両方が付着した正極活物質を正極材料として用いることもできる。
【0023】
このようにして成形したリチウムイオン電池用正極を用いて、図1に示すようなリチウムイオン電池8を製造することができる。すなわち、電解液が浸透可能なセパレータ1をリチウムイオン電池用正極2とグラファイトからなる負極3とで挟んで接合体4とし、電解液に浸漬する。そして、パッキン5を装填した負極用集電ケース6に負極3が接触するように接合体4を収容し、さらにリチウムイオン電池用正極2側から正極用集電板7を嵌挿した後、負極用集電ケース6と正極用集電板7とをかしめて密閉する。こうして、実施形態のリチウムイオン電池8を製造することができる。
【0024】
上記実施形態のリチウムイオン電池8のリチウムイオン電池用正極2では、図2に示すように、正極活物質粉末2a上にダイヤモンドライクカーボン2bとフッ素樹脂粉末2cが付着しており、フッ素樹脂粉末2cが結合剤として各粉末をつなぎとめて電極形状を保持している。そして、ダイヤモンドライクカーボン2bが電子伝導性を担う導電補助剤としての役割を果たす。後述するように、ダイヤモンドライクカーボン2bは、リチウムイオン電池の電解液中において、単なるカーボンブラック粉末やグラファイト粉末よりも広い電位窓を有している。このため、正極活物質の充電過程における高い電位においても、安定に存在し、電解液溶媒の分解もほとんど発生しない。このため、導電助剤が充電時の高い電位において酸化されてしまったり、溶媒が分解したりしてしまうことがなく、ひいては、高い電位で充電反応が行われ、エネルギー密度の高い正極活物質を有効に活用することができる。
【0025】
<実験例>
以下、本発明の二次電池用正極の発明の効果について立証するため、様々な導電性物質粉体をPTFE粉体と混合してホットプレス法によって円盤状電極を作製し、電位−電流曲線を測定した。
【0026】
(実験例1)
実験例1では、ダイヤモンドライクカーボン粉末(平均粒径0.03μm)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0027】
(実験例2)
実験例2では、グラッシーカーボン粉(平均粒径0.5μm)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0028】
(比較例1)
比較例1は、市販のグラッシーカーボン板そのものである
【0029】
(比較例2)
比較例2では、カーボンブラック(電気化学工業社製「HS−100」)とPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0030】
(比較例3)
実験例3では、カーボンブラック(電気化学工業社製「HS−100」)を真空中3000℃で3時間熱処理を行なったものとPTFE粉体とを80:20の質量割合で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0031】
<電位−電流曲線の測定>
上記のようにして作製した実験例1、2及び比較例1〜3の電極について、リチウムイオン電池用電解液中で電位走査し、電位−電流曲線を測定した。電解液は次のように調製した。すなわち、エチレンカーボネートとジメチルカーボネートとセバコニトリルとを質量比で25:25:50となるように混合液を調製し、さらにリチウム電解質(LiPF6、LiBF4及びLiTFSIのいずれか)を1mol/Lとなるように溶解した溶液を電解液とし、三極式電解セル容器に入れた。
【0032】
電位−電流曲線の測定は、作用極として上記電極(面積1.0cm2)、対極として白金網、参照電極としてLi金属を用いた。掃引速度は5mV/secとした。
【0033】
結果を図3〜図5に示す。
(LiPF6を溶解したリチウムイオン電池用電解液中での測定結果)
ダイヤモンドライクカーボン粉末を用いた実験例1の電極及びグラッシーカーボン粉を用いた実験例2の電極では、図3に示すように、7V(vs Li/Li+)までほとんど電流は流れることはなく、比較例1のグラッシーカーボン板電極よりも
広い電位窓を有していることが分かった。
これに対して、カーボンブラックを用いた比較例2の電極では3.6V(vs Li/Li+)を超えると電流が急激に流れはじめ、電位窓が狭いことが分かった。
また、カーボンブラックを熱処理してグラファイト化したものを用いた比較例3の電極では、比較例2の電極より電位窓が多少広くなったものの、4Vを超えると酸化電流が流れ出し、実験例1や実験例2の電極と比較して、電位窓が狭いことが分かった。
【0034】
(LiBF4を溶解したリチウムイオン電池用電解液中での測定結果)
また、図4に示すように、LiBF4を溶解したリチウムイオン電池用電解液中においても、ダイヤモンドライクカーボン粉末を用いた実験例1の電極及びグラッシーカーボン粉を用いた実験例2の電極は、LiPF6を溶解したリチウムイオン電池用電解液中での測定と同様、広い電位窓を有することが分かった。
【0035】
(LiTFSIを溶解したリチウムイオン電池用電解液中での測定結果)
さらに、図5に示すように、LiTFSIを溶解したリチウムイオン電池用電解液中での測定においても、グラッシーカーボン粉を用いた実験例2の電極は、広い電位窓を有することが分かった。この結果、並びに、LiPF6を溶解したリチウムイオン電池用電解液中での測定結果(図3参照)及びLiBF4を溶解したリチウムイオン電池用電解液中での測定結果(図4参照)において、ダイヤモンドライクカーボンを用いた電極が、グラッシーカーボンを用いた電極と同様に、広い電位窓を有しているという結果から、LiTFSIを溶解したリチウムイオン電池用電解液中においても、グラッシーカーボンを用いた電極が広い電位窓を有することは明らかである。
【0036】
<ナトリウムイオン電池への適用例>
以上は、リチウムイオン電池を想定した、LiPF6を溶解した溶液を電解液中での電位−電流曲線の測定に関する実験例であった。本発明は、リチウムイオン電池以外にナトリウムイオン電池においても適用することができる。このことを実証するために、NaPF6を溶解した溶液を電解液中での電位−電流曲線の測定についても行った。
【0037】
(実験例3)
実験例3では、グラッシーカーボン粉(平均粒径0.5μm)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0038】
(実験例4)
実験例4では、ダイヤモンドライクカーボン粉(平均粒径0.03μm)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0039】
(比較例4)
比較例4では、カーボンブラック(商品名:デンカブラック 電気化学工業株式会社製)とPTFE粉体とを90:10の重量比で混合し、ホットプレスによって8mmφの円盤状の電極を作製した。
【0040】
<電位−電流曲線の測定>
上記のようにして作製した実験例3、4及び比較例4の電極について、ナトリウムイオン電池用電解液中で電位走査し、電位−電流曲線を測定した。電解液は次のように調製した。すなわち、エチレンカーボネートとジメチルカーボネートとセバコニトリルとを容量比で25:25:50となるように混合液を調製し、さらにNaPF6を0.5mol/Lとなるように溶解した溶液を電解液とし、三極式電解セル容器に入れた。
【0041】
電位−電流曲線の測定は、作用極として上記電極(面積1.0cm2)、対極として白金網、参照電極としてリチウム金属を用いた。掃引速度は5mV/secとした。
【0042】
その結果、図6に示すように、グラッシーカーボン粉末を用いた実験例3及びダイヤモンドライクカーボンを用いた実験例4の電極では、7V(vs.Li/ Li +)まで電流はほとんど流れず、広い電位窓を有していることが分かった。これに対してカーボンブラックを電極とした比較例4の電極では、4V(vs.Li/ Li +)付近で電流が立ち上がり、実験例3及び4と比較して、電位窓が狭いことが分かった。
【0043】
以上の結果から、ナトリウムイオン電池の正極活物質粉にグラッシーカーボンやダイヤモンドライクカーボンを付着させた正極は、リチウムイオン電池の場合と同様、充電時に高い電位とされる正極においても、分解されることなく、溶媒を分解するおそれも少ないことが分かった。そして、この結果から、高い電位で充電反応が行われるエネルギー密度の高いナトリウムイオン電池用の正極活物質を有効に活用できることが分かった。
【0044】
以上の結果から、リチウムイオン電池の正極活物質粉末に対して乾式めっき法によってダイヤモンドライクカーボン及び/又はグラッシーカーボンを付着させ、さらにこれにフッ素樹脂粉末を混合して成形した実施形態のリチウムイオン電池用正極は、リチウムイオン電池用の充電時に高い電位とされる正極においても、分解されることなく、溶媒を分解するおそれも少ないことが分かる。そして、この結果から、高い電位で充電反応が行われるエネルギー密度の高い正極活物質を有効に活用できることが分かる。また、ナトリウムイオン電池についても、同様である。以上のことを立証するために、実施例1では以下に示す方法でリチウム電池用正極を作製し、その充放電特性を測定した。
【0045】
(実施例1)
プラズマCVD法でDLCをコーティングしたLiCoPO4Fの粉末と、導電助剤(グラッシーカーボン)と、PTFE粉とを70:25:5の重量比で乳鉢により混合し、圧着成型してシート状とし、これを実施例1のリチウム電池用電極とした。
【0046】
(比較例5)
比較例5の電極は、正極活物質としてDLCをコーティングしていないLiCoPO4Fの粉末と導電助剤(グラッシーカーボン)とPTFE粉とを70:25:5の重量比で乳鉢により混合し、圧着成型してシート状とし、これを比較例5のリチウム電池用電極とした。
【0047】
以上のようにして作製した実施例1のリチウム電池用電極について、放電速度は0.01Cとし、充放電特性を調べた。その結果、図7に示すように、5V(vs Li/Li+)以上の充電電位においても充電が可能であることが分かった。これに対して、ダイヤモンドライクカーボンのコーティングを行わなかった比較例5では、放電容量が実施例1と比較して放電容量が大幅に小さくなった。これは、導電助剤であるグラッシーカーボンと、正極活物質であるLiCoPO4Fとの間の電子伝導性が悪いためであると推定される。
DLCコートすると電子のやり取りがスムーズに行われる。
【0048】
この発明はリチウムイオン電池やナトリウムイオン電池等の二次電池に適用される。ここに、リチウムイオン電池やナトリウムイオン電池等の二次電池は電解液、正極、負極、セパレータ及びケースを備えてなる。
【0049】
(リチウムイオン電池用電解液)
リチウムイオン電池用電解液はLi塩(電解質)と有機溶媒とを含んでいる。
Li塩には、Liイオン電池用の一般的なLi塩を用いることができる。例えば、LiPF6(六フッ化リン酸リチウム)、LiBF4(四フッ化ホウ酸リチウム)、LiTFSI(リチウムビス(トリフルオロメタンスルホニル)イミド)、LiTFS(トリフルオロメタンスルホン酸リチウム)、LiBETI(リチウムビス(ペンタフルオロエタンスルホニル)イミド)又はこれらの2種以上を用いることができる。
なかでも、正極の酸化還元電位が4.5V以上のものについては、LiPF6、及び/又はLiBF4を使用することが好ましい。また、LiTFSIやLiTFSやLiBETIを用いる場合、LiPF6又はLiBF4を添加することが好ましい。
【0050】
有機溶媒もLiイオン電池に用いられる一般的なものを採用できる。かかる有機溶媒としては環状炭酸エステル、環状カルボン酸エステル及び鎖状炭酸エステルの中から選ばれる1種、又は2種以上が好ましい。更に好ましくは、環状炭酸エステルと鎖状炭酸エステルとを併用する。具体的には、エチレンカーボネートとジメチルカーボネートとを併用することが特に好ましい。両者の配合割合は特に限定されない。環状カルボン酸エステルとしてはγ−ブチロラクトンを用いることができる。
更にはニトリル化合物を有機溶媒として用いることができる。ここで、ニトリル化合物としては、鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物、鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物及びシアノ酢酸エステルのうち少なくとも一つのニトリル化合物を挙げることができる。
【0051】
鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物としては、例えば、スクシノニトリルNC(CH2)2CN、グルタロニトリルNC(CH2)3CN、アジポニトリルNC(CH2)4CN、セバコニトリルNC(CH2)8CN、ドデカンジニトリルNC(CH2)10CNなどのような直鎖状のジニトリル化合物の他、2−メチルグルタロニトリルNCCH(CH3)CH2CH2CN等のように分枝を有していても良い。これらの鎖式飽和炭化水素ジニトリル化合物は、炭素数は特に限定されないが20以下であることが好ましい。更に好ましくは7〜12である。
【0052】
鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物としては、オキシジプロピオニトリルNCCH2CH2−O−CH2CH2CNや、3−メトキシプロピオニトリルCH3−O−CH2CH2CN等が挙げられる。これらの鎖式エーテルニトリル化合物は、炭素数は特に限定されないが、20以下であることが好ましい。
シアノ酢酸エステルとしてはシアノ酢酸メチル、シアノ酢酸エチル、シアノ酢酸プロピル、シアノ酢酸ブチル等が挙げられる。これらのシアノ酢酸エステルは、炭素数は特に限定されないが、20以下であることが好ましい。
【0053】
これらニトリル化合物は電解液において電位窓を特に正方向に広げる作用を奏する。
電位窓を広げる作用の観点からジニトリル化合物が好ましい。中でも、セバコニトリルの採用が更に好ましい。
ただし、ニトリル化合物は粘度が高いので、上述の鎖状炭酸エステル、環状炭酸エステル及び/又は環状カルボン酸エステルと併用することが好ましい。更に好ましくはニトリル化合物と鎖状炭酸エステル及び環状炭酸エステルとを併用する。鎖状炭酸エステルとしてはジメチルカーボネートを採用することができ、環状炭酸エステルとしてはエチレンカーボネートを採用することができる。
この場合、有機溶媒全体に占めるニトリル化合物の配合割合は1〜90容量%とすることが好ましい。更に好ましくは5〜70容量%であり、更に更に好ましくは、10〜50容量%である。
【0054】
また、各種添加剤(例えば、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンサルファイト)を0.1−3%程度入れることも好ましい。これにより、負極側で耐食性皮膜がで形成され、耐食性が向上する。
【0055】
Li塩の濃度は0.01mol/L以上であって、飽和状態よりも低い濃度とする。Li塩の濃度が0.01mol/L未満であると、Liイオンによるイオン伝導が小さくなり、電解液の電気抵抗が高くなるので好ましくない。他方、飽和状態を超えると、温度等の環境変化によって溶解しているLi塩が析出するので好ましくない。
【0056】
(ナトリウムイオン電池用電解液)
ナトリウムイオン電池用電解液はNa塩(電解質)と有機溶媒とを含んでいる。
Na塩には、従来からNaイオン電池用のNa塩として知られているものを用いることができる。例えば、例えば、NaClO4、NaPF6、NaBF4、NaCF3SO3、NaN(CF3SO2)2、NaN(FSO2)2、NaN(C2F5SO2)2、NaC(CF3SO2)3等が挙げられる。溶媒及び溶質の混合比は特に限定されず、目的に応じて適宜設定される。
また、各種添加剤(例えば、ビニレンカーボネート、フルオロエチレンカーボネート、エチレンサルファイト)を0.1−3%程度入れることも好ましい。これにより、負極側で耐食性皮膜がで形成され、耐食性が向上する。
【0057】
有機溶媒もNaイオン電池に用いられる一般的なものを採用できる。かかる有機溶媒とし環状炭酸エステル、環状カルボン酸エステル及び鎖状炭酸エステルの中から選ばれる1種、又は2種以上が好ましい。更に好ましくは、環状炭酸エステルと鎖状炭酸エステルとを併用する。具体的には、エチレンカーボネートとジメチルカーボネートとを併用することが特に好ましい。両者の配合割合は特に限定されない。環状カルボン酸エステルとしはγ−ブチロラクトンやプロピレンカーボネートを用いることができる。
鎖状カーボネートは、ジメチルカーボネートのほかに、ジエチルカーボネートやエチルメチルカーボネートを使用することができる。
更にはニトリル化合物を有機溶媒として用いることができる。ここで、ニトリル化合物としては、鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物、鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物及びシアノ酢酸エステルのうち少なくとも一つのニトリル化合物を挙げることができる。
【0058】
鎖式飽和炭化水素化合物の両末端にニトリル基が結合した鎖式飽和炭化水素ジニトリル化合物としては、例えば、スクシノニトリルNC(CH2)2CN、グルタロニトリルNC(CH2)3CN、アジポニトリルNC(CH2)4CN、セバコニトリルNC(CH2)8CN、ドデカンジニトリルNC(CH2)10CNなどのような直鎖状のジニトリル化合物の他、2−メチルグルタロニトリルNCCH(CH3)CH2CH2CN等のように分枝を有していても良い。これらの鎖式飽和炭化水素ジニトリル化合物は、炭素数は特に限定されないが、7〜20であることが好ましい。更に好ましくは10〜12である。
【0059】
鎖式エーテル化合物の末端の少なくとも一つにニトリル基が結合した鎖式エーテルニトリル化合物としては、オキシジプロピオニトリルNCCH2CH2−O−CH2CH2CNや、3−メトキシプロピオニトリルCH3−O−CH2CH2CN等が挙げられる。これらの鎖式エーテルニトリル化合物は、炭素数は特に限定されないが、20以下であることが好ましい。
シアノ酢酸エステルとしてはシアノ酢酸メチル、シアノ酢酸エチル、シアノ酢酸プロピル、シアノ酢酸ブチル等が挙げられる。これらのシアノ酢酸エステルは、炭素数は特に限定されないが、20以下であることが好ましい。
【0060】
これらニトリル化合物は電解液において電位窓を特に正方向に広げる作用を奏する。電位窓を広げる作用の観点からジニトリル化合物が好ましい。中でも、セバコニトリルの採用が更に好ましい。
ただし、ニトリル化合物は粘度が高いので、上述の鎖状炭酸エステル、環状炭酸エステル及び/又は環状カルボン酸エステルと併用することが好ましい。更に好ましくはニトリル化合物と鎖状炭酸エステル及び環状炭酸エステルとを併用する。鎖状炭酸エステルとしてはジメチルカーボネートを採用することができ、環状炭酸エステルとしてはエチレンカーボネートを採用することができる。
この場合、有機溶媒全体に占めるニトリル化合物の配合割合は1〜90容量%とすることが好ましい。更に好ましくは15〜70容量%であり、更に更に好ましくは、30〜50容量%である。
【0061】
Na塩の濃度は0.01mol/L以上であって、飽和状態よりも低い濃度とする。Na塩の濃度が0.01mol/L未満であると、Naイオンによるイオン伝導が小さくなり、電解液の電気抵抗が高くなるので好ましくない。他方、飽和状態を超えると、温度等の環境変化によって溶解しているNa塩が析出するので好ましくない。
【0062】
(正極)
正極は正極活物質と集電体とを備える。
(リチウムイオン電池用正極活物質)
リチウムイオン電池用正極活物質とは「負極よりも高い電位で結晶構造内にリチウムが挿入/離脱され、それに伴って酸化/還元が行われる物質」をいう。
正極活物質としては(1)酸化物系、(2)オリビン型結晶構造を有するリン酸塩系、及び(3)オリビンフッ化物系を挙げることができる。
【0063】
(1)酸化物系
1−1具体的物質
酸化物系としては、Li1−xCoO2(x=0〜1:層状構造)、Li1−xNiO2(x=0〜1:層状構造)、Li1−xMn2O4(x=0〜1:スピネル構造)、Li2-yMnO3系(y=0〜2)及びこれらの固溶体(ここで固溶体とは、上記酸化物系の正極活物質において金属原子が自由な割合で混合された物質を指す。)を挙げることができる。また、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Li、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又はそれ以上を用いることができる。
1−2 特性
この正極活物質の一般的な放電電位は5V (vs Li/Li+)未満である。但し、LiMn2O4系でNiに一部置換した、LiNi0.5Mn1.5O4は、放電電位が4.7Vであり、急速充電をおこなう際には過電圧分を加味し、5Vを超える充電電圧を必要とする場合がある。また、LiCoMnO4は放電電圧が5.2V程度から始まるため、これも充電電圧は5Vを超える。また、酸化物系は一般に300℃未満で分解し、酸素発生とともに比較的大きな発熱反応がある。このため、過充電が起こらないような制御回路が必要とされる。
【0064】
(2)オリビン型結晶構造を有するリン酸塩系
2−1具体的物質
オリビン型結晶構造を有するリン酸塩系としては、Li1−xNiPO4 (x=0〜1)、Li1−xCoPO4 (x=0〜1)、Li1−xMnPO4 (x=0〜1)、Li1−xFePO4 (x=0〜1)及びこれらの固溶体(ここで固溶体とは、上記リン酸塩系の正極活物質において金属原子が自由な割合で混合された物質を指す。)を挙げることができる。また、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又は2種以上を用いることができる(特開2008−130525号参照)。
2−2 特性
この正極活物質の酸化還元電位は、上記酸化物系とは異なり300℃未満では発熱反応が小さい上、酸素は発生せず、安全性が高いことから注目されている。また、リン酸塩系のうち、LiCoPO4系は放電電位が4.8V程度であり、急速充電に際しては5V以上で耐電圧を有する電解液が必要とされる。LiNiPO4の放電電位は5.2V (vs Li/Li+)が示唆されている。
【0065】
(3)オリビンフッ化物系
3−1 具体的物質
Li2−xNiPO4F (x=0〜2)、Li2−xCoPO4F (x=0〜2)が知られており、その他Li2−xMnPO4F (x=0〜2)、Li2−xFePO4F (x=0〜2)が考えられる。
また、これらの固溶体(ここで固溶体とは、上記オリビンフッ化物系の正極活物質において金属原子が自由な割合で混合された物質を指す。)も挙げることができる。さらに、これらのうちの金属原子を他の金属原子でドープしたものも含まれる。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。例えば、Mg、Al、Ti、V、Mn、Fe、Co、Ni、Cu、Zn、Zr、Nb及びMoの1種又はそれ以上を用いることができる。
3−2 特性
この正極活物質の酸化還元電位はオリビン系と同様に、上記酸化物系とは異なり、300℃未満の分解では、発熱反応が小さい上、酸素発生がないため、正極活物質由来の電池発火の影響は小さいと考えられ安全性の面で注目されている。また、電池の電気容量密度(mAh/g)を上記リン酸塩系よりも高くできる(特開2003−229126号公報参照)。しかし、例えばLi2CoPO4F系は、平均放電電位が4.8V程度であり、急速充電に際しては5V以上で耐電圧を有する電解液が必要とされる。また、Li2NiPO4F系の放電電位は5.2V(vs Li/Li+)程度であり、5V以上で耐電圧を有する電解液が必要とされる。
【0066】
(4)その他
その他、リチウム非含有のFeF3、有機導電性物質を用いた共役系ポリマー、シェブレル相化合物等を用いることもできる。また、遷移金属カルコゲン化物、バナジウム酸化物およびそのリチウム塩、ニオブ酸化物およびそのリチウム塩、さらには、複数の異なった正極活物質を混合して用いることも可能である。
正極活物質粒子の平均粒径は、特に限定はされないが、10nm〜30μmであることが好ましい。
【0067】
(ナトリウムイオン電池用正極活物質)
ナトリウムイオン電池用正極活物質は、充放電によって可逆的に酸化−還元を繰り返すことのできる物質であって、ナトリウムイオンを可逆的にインターカレート−デインターカレートできる物質であることが要求される。
このような正極活物質としては、特開2009−129741号公報に記載されているNaFeO2、NaNiO2、NaCoO2、NaMnO2、NaFe1−xM1xO2、NaNi1−xM1xO2、NaCo1−xM1xO2、NaMn1−xM1xO2(ただし、M1は3価金属からなる群より選ばれる1種以上の元素であり、0≦x<0.5である。)で示される化合物等が挙げられる。これらのなかでも、主に鉄とナトリウムとを含有する複合酸化物であって、六方晶の結晶構造からなる複合酸化物を正極活物質として用いることにより、高い放電電圧を得ることができ、エネルギー密度の高い二次電池を得ることができる。
【0068】
上記正極活物質として、さらに好ましくは、主に鉄とナトリウムとを含有する複合酸化物であって、六方晶の結晶構造を有し、かつ該複合酸化物のX線回折分析において、面間隔2.20オングストロームのピークの強度を面間隔5.36オングストロームのピークの強度で除した値が2以下である複合酸化物である。またナトリウム化合物と鉄化合物とを含有する金属化合物混合物を、400℃以上900℃以下の温度範囲で加熱するにあたり、温度上昇中の100℃未満の温度範囲においては雰囲気を不活性雰囲気として加熱することが好ましい。
また、これらの化合物うちの遷移金属原子を他の金属原子でドープしたものでもよい。ドーパントとしては酸化還元反応において電気化学的な特性を変化させられるものであれば特に限定されるものではない。
【0069】
(正極用集電体)
正極用集電体とは正極活物質を担持する導電性の基板である。
正極の集電体の成形材料は、充電時において安定であることが要求される。特に、酸化還元電位の高いオリビン型結晶構造を有するリン酸塩系及びオリビンフッ化物系の正極活物質を用いるときには、耐食性に優れた素材を使用することが好ましい。
例えば、電解質としてLiPF6、LiBF4を使用する場合、オーステナイト系ステンレス、Ni、Al、Ti等を用いることができるが、使用する正極活物質の動作電位を考慮し、適宜選択することが好ましい。例えば、電解質としてLiPF6を用いる場合は、Li/Li+電極に対して6Vでも使用することができるが、電解質としてLiBF4を用いる場合、SUS304はLi/Li+電極に対し5.8V以下で充放電可能な場合のみ用いることができる。また、電解質としてLiTFSIを使用する場合、正極集電体表面に耐食性皮膜を形成させるべく、LiPF6を共存させることが好ましい。LiBETI及びLiTFSもLiTFSIの場合と同様である。
また、Al等の導電金属材料へ導電性DLC(ダイヤモンドライクカーボン)を周知の方法で被覆したものを集電体として用いることもできる。電解質がLiBF4やLiPF6など、容易にフッ化物皮膜を形成するようなリチウム塩の場合は、アルミニウム上へ厚いフッ化皮膜が形成し、耐食性は向上するものの、電子伝導性が低下し、ひいてはオーミック過電圧増加に伴う、高出力化が阻害されることとなる。Al等の導電金属材料へ導電性DLCを被覆すれば、フッ化物皮膜は導電性DLCの欠陥部分の極わずかな面積でのみ発生するだけである。このため、高電圧化しても電子伝導性の低下は無視できる程度となり、懸念されている高電圧化による出力低下は防ぐことが可能となる。
ここで、導電性ダイヤモンドライクカーボンとは、ダイヤモンド結合(炭素同士のSP3混成軌道結合)とグラファイト結合(炭素同士のSP2混成軌道結合)の両方の結合が混在しているアモルファス構造をとるカーボンのうち、導電性が1000Ωcm以下のものをいう。ただし、アモルファス構造以外に、部分的にグラファイト構造からなる結晶構造(すなわちSP2混成軌道結合からなる六方晶系結晶構造)からなる相を有し、これにより導電性が発揮されるものも含まれる。グラファイトとダイヤモンドの中間の性質を有するダイヤモンドライクカーボンは、成膜時にダイヤモンドライクカーボンを構成する炭素原子のSP2混成軌道結合とSP3混成軌道結合の比率を調整することで、導電性を調節することができる。
勿論、上記耐食性導電性金属材料を導電性DLCで被覆してもよい。
集電体の形状及び構造は、正極活物質や電池の構造に応じて、任意に設計可能である。
【0070】
(正極の前処理)
リチウムイオン電池用正極やナトリウムイオン電池用正極は、電池に組み込む前に、ニトリル化合物を1容量%以上含む有機溶媒中にリチウム塩(あるいはナトリウム塩)が溶解した前処理用電解液中に正電極を浸漬する浸漬処理工程を行い、さらに電極に正電圧を付与する正電圧処理工程を行なう。こうして前処理された電極は、ニトリル化合物を全く含まない電解液や、ニトリル化合物の添加量の少ない電解液を用いたリチウムイオン電池に用いても、電位窓が広く、高い電位においても電解液を分解し難くなる(特願2009−180007号参照)。このような広い電位窓の電極となる理由は、電極上に窒素を成分として含む耐食性の皮膜が形成されるためであると推測される。
【0071】
(負極)
負極は負極活物質と集電体とを備える。
(リチウムイオン電池用負極活物質)
リチウムイオン電池用負極活物質とは「正極よりも低い電位で結晶構造内にリチウムが挿入/離脱され、それに伴って酸化/還元が行われる物質」をいう。
リチウムイオン電池用負極活物質としては、例えば、人造黒鉛、天然黒鉛、ハードカーボン等の種々の炭素材料やチタン酸リチウム(Li4Ti5O12)、H2Ti12O25、H2Ti6O13、Fe2O3などが挙げられる。また、これらを適宜混合した複合体も挙げることができる。さらには、Si微粒子やSi薄膜、これらのSiがSi−Ni、Si−Cu、Si−Nb、Si−Zn、Si−Sn等のSi系合金となった微粒子や薄膜が挙げられる。さらには、SiO酸化物、Si−SiO2複合体、Si−SiO2−カーボンなどの複合体等を挙げることができる。
【0072】
(ナトリウムイオン電池用負極活物質)
また、ナトリウムイオン電池用負極活物質とは「二次電池の負極として充放電によってナトリウムイオンが出入りするとともに可逆的に酸化−還元を繰り返すことのできる物質」であり、本発明においてはLi4Ti5O12を用いる。
【0073】
(負極用集電体)
負極用の集電体は汎用的な導電性金属材料、Cu、Al、Ni、Ti、オーステナイト系ステンレス等で形成することができる。
但し、電解液にニトリル化合物を用いたとき(他の有機溶剤との併用を含む)には、電解液中のLi塩に応じて適宜選択する必要がある。すなわち、電解質としてLiPF6、LiBF4を使用する場合、オーステナイト系ステンレス、Ni、Al、Ti等の使用が可能となる。ただし、使用する負極活物質の動作電位に応じて、適宜選択する必要がある。負極活物質としてカーボン系やSi系を使用する場合において、電解質としてLiBF4を使用した場合は、Cu以外のAl、Ni、Ti、オーステナイト系ステンレス等からなる集電体を使用することができる。負極活物質としてチタン酸リチウムやFe2O3系の化合物を用いた場合は、Cuを含む上記材料の全てが適用可能である。一方、電解質としてLiPF6使用時はAl、Ni及びTiが好ましく、オーステナイト系ステンレス及びCuは好ましくない。また、電解質としてLiTFSIや、LiBETI、やLiTFSを使用する場合、Ni、Ti、Al、Cu、オーステナイト系ステンレスの何れも使用することができる。
【0074】
(正極用電子伝導部材)
正極活物質には導電性の小さいものがある。従って、正極活物質と集電体との間に導電性の電子伝導部材を介在させて、両者の間に十分な電子伝導パスを確保することが好ましい。
ここで電子伝導部材は正極活物質と集電体との間に電子伝導パスを形成できればその形態は特に限定されるものではなく、例えばアセチレンブラック等のカーボンブラック、グラファイト粉、ダイヤモンドライクカーボン、グラッシーカーボン等の導電性粉体(導電助剤)を用いることができる。ダイヤモンドライクカーボン及びグラッシーカーボンは、カーボンブラックやグラファイトよりもはるかに広い電位窓を有しており、高電位を付与した場合の耐食性に優れているため、好適に用いることができる。また、これらの導電助剤に金属微粒子が担持されていることも好ましい。金属微粒子としては、例えばPt、Au、Ni等が挙げられる。これらは、単独で用いても良いし、これらの合金であっても良い。
電子伝導材料として、本発明において用いている、正極活物質をダイヤモンドライクカーボンにより導電性皮膜の他、正極活物質を埋入させた導電性薄膜(金の薄膜等)を併用することもできる。
【0075】
(負極用電子伝導部材)
正極用電子伝導部材と同様な物を用いることができる。
【0076】
(セパレータ)
セパレータは電解液中へ浸漬され、正極と負極とを分離し両者の短絡を防ぐとともに、Liイオンの通過を許容する。
かかるセパレータには、ポリエチレン、ポリプロピレン等のポリオレフィン系樹脂から成る多孔質フィルムが挙げられる。
【0077】
(ケース)
ケースは電解液に対する耐食性を有する材質で形成される。その形状は、電池の目的用途に応じて任意に設計できる。
リチウム塩が溶解している電解液を使用する場合には、オーステナイト系ステンレスからなる基材、Ti、Ni及び/又はAlからなるケースを用いることができる。但し使用する正極、負極活物質の動作電位により適宜選択しなければならない場合もある。
ケースが集電体を兼ねる場合や集電体に電気的に結合される場合は、各電極の集電体形成材料と同一若しくは同種の材料で形成される。
【0078】
この発明は、上記発明の実施形態の説明に何ら限定されるものではない。特許請求の範囲の記載を逸脱せず、当業者が容易に想到できる範囲で種々の変形態様もこの発明に含まれる。
【産業上の利用可能性】
【0079】
本発明の二次電池用正極は、高い電位で充電反応が行われるエネルギー密度の高い正極活物質を有効に活用可能な二次電池のための正極として、好適に用いることができる。
【符号の説明】
【0080】
2a…正極活物質
2b…ダイヤモンドライクカーボン
2c…フッ素樹脂粉末
2…二次電池用正極
3…負極
【特許請求の範囲】
【請求項1】
正極活物質からなる粒子の集合体が所定の形状に成形された二次電池用正極において、
前記正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されていることを特徴とする二次電池用正極。
【請求項2】
前記正極活物質への導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンの付着は乾式めっき法によってなされていることを特徴とする請求項1記載の二次電池用正極。
【請求項3】
前記正極活物質はLi2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4Fの少なくとも1種を含むことを特徴とする請求項1又は2記載の二次電池用正極。
【請求項4】
請求項1乃至3のいずれか1項記載の二次電池用正極と、ニトリル化合物を含む電解液と、を備えていることを特徴とする二次電池。
【請求項1】
正極活物質からなる粒子の集合体が所定の形状に成形された二次電池用正極において、
前記正極活物質からなる粒子には、導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンが付着されていることを特徴とする二次電池用正極。
【請求項2】
前記正極活物質への導電性ダイヤモンドライクカーボン及び/又はグラッシーカーボンの付着は乾式めっき法によってなされていることを特徴とする請求項1記載の二次電池用正極。
【請求項3】
前記正極活物質はLi2NiPO4F、LiNiPO4、LiCoPO4及びLi2CoPO4Fの少なくとも1種を含むことを特徴とする請求項1又は2記載の二次電池用正極。
【請求項4】
請求項1乃至3のいずれか1項記載の二次電池用正極と、ニトリル化合物を含む電解液と、を備えていることを特徴とする二次電池。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2011−71084(P2011−71084A)
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願番号】特願2010−2478(P2010−2478)
【出願日】平成22年1月8日(2010.1.8)
【出願人】(591261509)株式会社エクォス・リサーチ (1,360)
【Fターム(参考)】
【公開日】平成23年4月7日(2011.4.7)
【国際特許分類】
【出願日】平成22年1月8日(2010.1.8)
【出願人】(591261509)株式会社エクォス・リサーチ (1,360)
【Fターム(参考)】
[ Back to top ]

