二次電池用電極活物質及び二次電池
【課題】二次電池用電極活物質として、耐電解液溶解性を従来の低分子ラジカル化合物よりも向上させ、高分子化合物よりも単位体積当たりの蓄電容量が大きい二次電池用電極用低分子ラジカル化合物を提供する。
【解決手段】正極3と、負極5と、該正極3と該負極5との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質は、下記式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなる。

但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【解決手段】正極3と、負極5と、該正極3と該負極5との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質は、下記式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなる。

但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、二次電池用電極活物質及び、それを用いた二次電池に関する。
【背景技術】
【0002】
携帯電話、デジタルカメラなどの携帯機器の小型、高性能化に伴いこれらに用いられる蓄電デバイスの高性能化が求められている。代表的な蓄電デバイスとして、二次電池が挙げられる。その中でも正極にリチウム含有遷移金属酸化物、負極に炭素材料を用いたリチウムイオン二次電池は高エネルギー密度を有する二次電池として、広く利用されている。
しかしながら、リチウムイオン二次電池は電極におけるリチウムイオンの挿入脱離反応速度が遅いため、例えばデジタルカメラのフラッシュの発光を伴う連写のような高出力を必要とする使用方法は不可能であった。
【0003】
一方、電極に活性炭を用いた電気二重層キャパシタは高出力特性に優れた蓄電デバイスとして広く検討されている。
【0004】
しかしながら、電気二重層キャパシタは単位容積あたりの蓄電容量が小さく、小型化が求められる携帯機器用蓄電デバイスとしては不向きであった。そこで、高容量、高出力を両立する新しい二次電池が検討されている。
【0005】
特許文献1には安定ラジカルの酸化還元反応を利用した二次電池が開示されている。この二次電池は、正極または負極の活物質として下記式(6)に示すラジカル化合物(2,2,6,6−テトラメチルピペリジン 1−オキシル。以下、TEMPOと略すことがある。)を用いた二次電池である。
【0006】
【化1】

【0007】
この活物質TEMPOは炭素や窒素といった比重の小さな元素のみから構成されたものであり、また、ラジカル化合物では反応する不対電子がラジカル原子に局在化して存在するので、反応部位の濃度を増大させることができるので、電極の高容量化が期待できる。また、ラジカル部位のみが反応に寄与するため、サイクル特性が活物質の拡散に依存しない安定性に優れた二次電池となりうる。さらに、この酸化還元過程において化合物構造の変化を伴わないため酸化還元反応速度が大きく、高出力が期待できる。
【0008】
一方、このようなTEMPOを用いた二次電池には以下の課題がある。
【0009】
電位窓を広くするために、二次電池の電解質中の電解液の溶媒としては、一般的に有機溶剤が用いられている。しかしながら、TEMPOは有機物であり、電解質の溶媒として一般的な有機溶剤に溶解してしまうという課題がある。
【0010】
このような課題を解決するものとして、特許文献2にはTEMPOを高分子化することにより、耐電解液溶解性を高めた電極活物質及び二次電池が開示されている。
【0011】
しかしながら、特許文献2に記載の二次電池にも以下のような課題が残されている。
【0012】
ラジカル化合物を電極活物質として用いる場合、一般的なリチウムイオン二次電池の場合と同様に、電極中に導電助剤を添加して導電性を補うことが多い。しかしながら、特許文献2のようにTEMPOを高分子化すると、TEMPO部位と導電助剤との接触性が低化し、より多くの導電助剤の添加が必要となるため、電極全体としての容量低下を招く可能性があった。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開2002−151084号公報
【特許文献2】特開2002−304996号公報
【発明の概要】
【発明が解決しようとする課題】
【0014】
そこで本発明は、二次電池用電極活物質として、耐電解液溶解性を従来の低分子ラジカル化合物よりも向上させ、上記高分子化合物よりも単位体積当たりの蓄電容量が大きい二次電池用電極を実現できる低分子ラジカル化合物を提供することを目的とする。
【課題を解決するための手段】
【0015】
上記の目的を達成するために、本発明の一側面としての二次電池用電極活物質は、正極と、負極と、該正極と該負極との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質であって、下記式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなることを特徴とする。
【0016】
【化2】

【0017】
但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【発明の効果】
【0018】
本発明によれば、二次電池用電極活物質として、従来の低分子ラジカル化合物よりも耐電解液溶解性が高い低分子ラジカル化合物を提供することができる。また、本発明により提供される二次電池用電極活物質は低分子のラジカル化合物であるため、高分子化されたラジカル化合物と比較して導電助剤との接触性が良く、単位体積当たりの蓄電容量を大きくすることができる。
【図面の簡単な説明】
【0019】
【図1】中性ラジカルとカチオン間の酸化還元反応の模式図である。
【図2】中性ラジカルとアニオン間の酸化還元反応の模式図である。
【図3】二次電池の構成の一例を示す模式図である。
【図4】実施例1〜2及び比較例1の二次電池のサイクリックボルタンメトリーを行った結果である。
【発明を実施するための形態】
【0020】
本発明者らは、ラジカルの酸化還元反応を利用した二次電池用電極活物質として、耐電解液溶解性と導電助剤との接触性向上を両立できるラジカル化合物について検討した。検討の結果、下記式(1)で表わされる低分子ラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなる二次電池用電極活物質が、前記式(6)に示されるラジカル化合物(TEMPO)よりも耐電解液溶解性が高いことを見出した。尚、下記式(1)のR1〜R6のうち少なくとも1つはプロトン性親水性基である。また、本発明においてアルカリ土類金属とはいわゆる広義のアルカリ土類金属であり、ベリリウムやマグネシウムも含む第2族元素のことを指す。また、本発明において、「親水性基」という場合、イオン化した親水性基も含む。
【0021】
【化3】

【0022】
式(1)のラジカル化合物は、TEMPOの3位、4位、5位のHのうち少なくとも1つをプロトン性親水性基に置換したものであり、同位のHを双方ともにプロトン親水性基で置換しても良い。この、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる電極活物質は、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とが塩を形成した、TEMPO誘導体の金属塩であると考えられる。この電極活物質は、低分子であっても二次電池の電解液に溶解しにくいため、電解質として電解液を備えた二次電池の電極活物質として機能する。また、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる電極活物質は、低分子であるため、高分子化されたラジカル化合物よりも導電助剤との接触性が良い。導電助剤との接触性が良いと導電助剤の量が少なくても済むため、電極に導電助剤を加えることにより生じる電極全体の容量を高分子化した場合と比べて大きくすることができる。
【0023】
以下、本発明の二次電池用電極活物質の好ましい実施の形態と、その電極活物質を用いた二次電池の好ましい実施の形態を挙げて、本発明を更に詳細に説明する。
【0024】
<二次電池用電極活物質>
本実施形態に係る電極活物質は式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる。但し、前述のように、R1〜R6の少なくとも一つはプロトン性親水性基である。プロトン性親水基の位置、種類及びアルカリ金属又はアルカリ土類金属の種類については特に限定するものではないが、特に好ましい態様について以下に示す。
【0025】
(プロトン性親水性基)
本実施形態に係るラジカル化合物が有するプロトン性親水性基は、特定のpHの下で水中でプロトンを解離してアニオン化するものであり、−COOH、−S(=O)2OH、−P(=O)(OH)2などを用いることができる。プロトン性親水性基の種類としては特に限定するものではなく、親水性を発現できればよい。しかし、電極活物質の分子量が小さいほど単位ラジカルあたりの分子量が小さいため、活物質としての蓄電容量(mAh/g)が大きくなる。したがって、プロトン性親水性基としては、分子量の小さい−COOHが好ましい。また、R1〜R6のいずれがプロトン性親水性基であるか、およびこれらのうちプロトン性親水性基の数は特に限定されるものではない。しかし、前述の分子量の観点から、R1〜R6のうちいずれか1つのみがプロトン性親水性基であり、その他のR1〜R6はHであることが好ましい。また、電子吸引性の強いカルボキシル基が4位(R3又はR4の位置)につくとニトロキシル基がアニオン状態で安定化する。その結果、図1に示す中性ラジカルとカチオン間の酸化還元反応のみならず、図2に示す中性ラジカルとアニオン間の酸化還元反応も安定に進行するため、4位のHがカルボキシル基で置換されていることがより好ましい。なお、前述した「親水性基」同様、本発明において、「カルボキシル基」は、イオン化した(プロトンが脱離した)カルボキシル基も含む概念である。
【0026】
(アルカリ金属又はアルカリ土類金属)
本実施形態に係る電極活物質が有するアルカリ金属又はアルカリ土類金属は、前述のとおり、式(1)で表されるラジカル化合物と塩を形成していると考えられる。アルカリ金属又はアルカリ土類金属は特に限定されるものではない。しかし、前述のように電極活物質の分子量が小さいほど電極活物質としての蓄電容量が大きくなるので、アルカリ金属又はアルカリ土類金属の分子量も小さい方が好ましい。したがって、電極活物質が有するアルカリ金属又はアルカリ土類金属として、Li、Na、Mg、Caが好ましい。
【0027】
また、二次電池の電解質中にアルカリ金属又はアルカリ土類金属のイオンが存在する場合、電極活物質が有するアルカリ金属又はアルカリ土類金属は、その電解質中に存在するイオンを形成するアルカリ金属又はアルカリ土類金属であることが好ましい。
【0028】
電極活物質が有するアルカリ金属又はアルカリ土類金属のイオンが電解質中に存在すると、電極活物質は電解質にさらに溶けにくくなる。例えば、リチウムイオン2次電池ではリチウム塩を有機溶剤に溶解した電解液が広く使用されており、このような電解液を用いる場合、電極活物質は式(1)で表わされるラジカル化合物とLiからなることが好ましい。
【0029】
(その他)
R1〜R6のうち、少なくとも一つがプロトン性親水性基であれば、その他のR1〜R6は特に限定されるものではない。但し、R1〜R6が疎水性の置換基であると、式(1)で表されるラジカル化合物の親水性が下がり、電極活物質の有機溶剤への溶解性が上がるため、有機溶剤を含む電解液への溶解性も向上する。つまり、電極活物質の耐電解液溶解性が低下する。したがって、式(1)の化合物は疎水性の置換基を有していないことが好ましい。
【0030】
本発明においては、R1〜R6が親水性の置換基であるので式(1)で表されるラジカル化合物の親水性が上がり、耐電解液溶解性も向上する。また、R1〜R6がプロトン性の親水性置換基であれば、アルカリ金属又はアルカリ土類金属と塩を形成できると考えられる。
【0031】
また、プロトン性親水性基の項で上述した通り、分子量の観点から、R1〜R6は分子量が小さい置換基又はHであることが好ましく、R1〜R6のうち3つ以上がHであることが好ましい。更に、R1〜R6のうち1つだけがプロトン性親水性基であり、他の5つはHであることがより好ましい。
【0032】
つまり、たとえば、R1〜R6のうち、1つだけがプロトン性親水性基で他の2つが疎水性基で残り3つがHであるよりも、1つだけがプロトン性親水性基で他の2つがプロトン性以外の親水性基で残り3つがHであるほうが好ましい。更に好ましくは3つがプロトン性親水性基であり、残り3つがHであることであり、3つがプロトン性親水性基であるよりも、1つだけがプロトン性親水性基であり、残り5つがHであることがより好ましい。
【0033】
<二次電池>
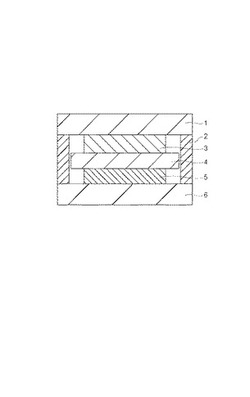
本実施形態の二次電池は、少なくとも正極、負極、電解質を備えている。その構造の一例を図3に示す。図に示された二次電池は正極集電体1、正極3、セパレーター4、負極5、負極集電体6を順に重ね合わせた構成を有している。セパレーター4には電解質が含ませてある。また、正極集電体1と負極集電体6はプラスチック樹脂からなる絶縁パッキン2により絶縁されている。電解質を含んだセパレーターの代わりに高分子ゲル電解質を用いることも可能である。なお、正極3は、正極材料層あるいは正極活物質層、負極5は、負極材料層あるいは負極活物質層と呼称することも可能である。
【0034】
二次電池の形状は、公知の形状を用いることができる。二次電池の形状の例としては、電極の積層体あるいは巻回体を、金属ケース、樹脂ケース、あるいはラミネートフィルム等によって封止したものが挙げられる。また外観としては、円筒型、角型、コイン型、およびシート型等が挙げられる。
【0035】
以下、本実施形態の二次電池について構成毎に説明をする。
【0036】
(正極)
本実施形態の二次電池は、少なくとも、正極又は負極の電極活物質として本実施形態に係る二次電池用活物質を用いる。正極と負極のどちらか一方にのみ本実施形態に係る活物質を用いる場合は、正極に用いるのが好ましい。正極中には本実施形態に係る電極活物質に加えその他の構成成分として、従来公知のものを含有することができる。従来公知の構成成分として、例えば、導電助剤やバインダー(結着材)が挙げられる。導電助剤の例としては、活性炭やグラファイト、カーボンブラック、アセチレンブラック等の炭素材料、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子が挙げられる。また、バインダーの例としては、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、ポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体、スチレン−ブタジエン共重合ゴム、ポリプロピレン、ポリエチレン、ポリイミド等の樹脂バインダー、イオン導電性高分子等を適宜含有させることができる。
【0037】
また、負極のみに本実施形態に係る二次電池用活物質を用いる場合は、正極として従来公知のものを用いることができる。例えば、コバルト酸リチウム、マンガン酸リチウムなどの金属酸化物の粒子、ジスルフィド化合物、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子を用いることができる。また、従来公知の活物質と本実施形態の活物質を混合して用いても良い。
【0038】
(負極)
負極の活物質として本実施形態の電極活物質を用いる場合、正極と同様に、負極中には本実施形態に係る電極活物質に加えその他の構成成分として、従来公知のものを含有することができる。
【0039】
また、本実施形態に係る二次電池用電極活物質を正極のみに用いる場合は負極としては従来公知のものが利用できる。例えば、活性炭やグラファイト、カーボンブラック、アセチレンブラック等の炭素材料、リチウム金属またはリチウム合金、リチウムイオン吸蔵炭素、スズ金属またはスズ合金、シリコン金属またはシリコン合金、その他各種の金属単体または合金、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子を電極活物質として用いることができる。また、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、ポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体、スチレン−ブタジエン共重合ゴム、ポリプロピレン、ポリエチレン、ポリイミド等の樹脂バインダー、イオン導電性高分子等を適宜含有させることができる。
【0040】
(集電体)
正極集電体1および負極集電体6の材質としては、導電性が高く、耐腐食性にすぐれているものであればよく、特に限定するものではない。例えば、ニッケルやアルミニウム、銅、金、銀、チタン等の金属、アルミニウム合金、ステンレス等の合金、炭素素材等を用いることができる。また、形状としては、箔や平板、メッシュ状のもの等を用いることができる。
【0041】
(セパレーター)
本実施形態の二次電池は、正極3および負極5の電気的接触を防ぐ目的でセパレーター4を備える。セパレーターとして、多孔質フィルムからなるセパレーターや不織布等を用いることができる。また、本実施形態のセパレーターには後程説明する電解質が含ませてある。
【0042】
(電解質)
本実施形態の二次電池は電解質を備える。電解質は、負極と正極との間の荷電担体輸送を行うものであり、一般には室温で10−5〜10−1S/cmの電解質イオン伝導性を有している。本実施形態における電解質としては、例えば電解質塩を溶剤に溶解した電解液を利用することができる。電解液の溶剤は、電位窓が広く、電解質塩を電離することのできるものであればよく、特に限定するものではない。例えば、エチレンカーボネート、プロピレンカーボネート、ジメチルカーボネート、ジエチルカーボネート、メチルエチルカーボネート、γ−ブチロラクトン、テトラヒドロフラン、ジオキソラン、スルホラン、ジメチルホルムアミド、ジメチルアセトアミド、N−メチル−2−ピロリドン等の有機溶媒などが用いることができる。また、これらの溶剤を単独又は2種類以上混合して用いることもできる。
【0043】
また、電解質塩としては、例えばLiPF6、LiClO4、LiBF4、LiCF3SO3、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiC(CF3SO2)3、LiC(C2F5SO2)3、LiBr、LiCl、LiF等を用いることができる。
【0044】
尚、図3に示した二次電池の構造では、セパレーター4に電解質を含ませて使用される。
【0045】
また、前述の電解液の代わりに、例えば電解液をゲル状にした固体の電解質を用いても良い。この場合、得られる二次電池はいわゆるポリマー二次電池となる。ゲル状の電解質を用いても、電解質に有機溶剤が含まれている場合、有機溶剤への溶解性が高い電極活物質を用いるとその電極活物質は電極から電解質へ溶解してしまうことがある。しかし、本実施形態に係る電極活物質を用いれば電極活物質の電解質への溶解を軽減することができる。
【実施例】
【0046】
本実施形態のより具体的な実施例を挙げて説明する。
【0047】
<電極活物質Aの製造>
水酸化リチウム(東京化成製)0.12g(0.005mol)をイオン交換水50ccに溶解し、0.1M水酸化リチウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Aを得た。電極活物質Aは、式(3)のように式(2)で表されるラジカル化合物とリチウムの塩であると考えられる。
【0048】
【化4】

【0049】
【化5】

【0050】
<電極活物質Bの製造>
1M水酸化ナトリウム水溶液(東京化成製)5ccにイオン交換水45ccを加え、0.1M水酸化ナトリウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Bを得た。電極活物質Bは、式(4)のように式(2)で表されるラジカル化合物とナトリウムの塩であると考えられる。
【0051】
【化6】

【0052】
<電極活物質Cの作製>
水酸化カルシウム(キシダ化学製)0.185g(0.0025mol)をイオン交換水50ccに溶解し、0.05M水酸化カルシウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Cを得た。電極活物質Cは、式(5)のように式(2)で表されるラジカル化合物とカルシウムの塩であると考えられる。
【0053】
【化7】

【0054】
<正極の作製>
電極活物質(A〜Cのいずれか)2.4g、導電助剤としてアセチレンブラック(電気化学工業製)1.2g、バインダーとしてポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体0.4g(アルドリッチ製)、N−メチルピロリドン(キシダ化学製)4ccを混合し、遊星型ボールミルを用いて150rpm、30分撹拌することでスラリー状にした。得られたスラリーをアルミ箔上にブレードコーターで塗布し、80℃で8時間、真空乾燥を行うことでN−メチルピロリドンを除去し、電極シート(前記正極3と正極集電体1の一体物)を作製した。この電極シートは、電極活物質A、B,Cのそれぞれについて1個、合計3個作製した。
【0055】
<電解質の作製>
電解質塩としてLiPF6(キシダ化学製)152g(1mol)を、エチレンカーボネート(キシダ化学製)300ccとジエチルカーボネート(キシダ化学製)700ccを混合させた溶剤に溶解させ、電解液を作製した。作製した電解液中に多孔質セパレーターを8時間含浸させることで電解質を含んだセパレータ―を作製した。
【0056】
<二次電池の作製>
前述で作製した正極を8mmφ、電解質を12mmφ、負極としてリチウム金属箔を10mmφに打抜き、電解質を含んだセパレーターを正極、負極で挟み込む形で積層し、3種類の積層体を得た。得られた積層体を宝泉社製の実験用セルであるHSセル(商品名)に組み込むことで二次電池を作製した。
【0057】
<実施例1>
正極の電極活物質として電極活物質Aを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0058】
<実施例2>
正極の電極活物質として電極活物質Bを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0059】
<実施例3>
正極の電極活物質として電極活物質Cを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0060】
<比較例1>
正極の電極活物質として、式(6)で表わされる電極活物質を用い、実施例1〜3と同様に二次電池を作製した例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0061】
<比較例2>
正極の電極活物質に式(2)で表わされる電極活物質を用い、実施例1〜3と同様に二次電池を作製した例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0062】
以上のように作製した実施例1〜3及び、比較例1〜2の二次電池の電池特性を評価した。図4に実施例1〜2、及び比較例1の二次電池を用いてサイクリックボルタンメトリーを行った結果を示す。走査速度は1mV/s、走査範囲は4.2〜1.8Vとした。比較例1の二次電池は式(6)で表わされる電極活物質が電解液中に溶出し、充放電ピークを示さなかった。これに対し、実施例1〜2の二次電池は3.6Vと3.4V付近及び、2.8Vと2.6V付近にそれぞれレドックス対が観測され、電極活物質が電解液中に溶出していないことがわかる。実施例1〜2の電極活物質A及びBと比較例1の式(6)で表わされる電極活物質の差異は、ラジカル化合物にプロトン性親水基であるカルボキシル基を付与し、さらに電極活物質がLi又はNa(Liイオン又はNaイオン)を有することにある。したがって、これらにより、耐電解液溶解性が向上し、その結果、電極活物質の電解液への溶出が抑制されていると考えられる。
【0063】
また、実施例1〜2の二次電池のサイクリックボルタンメトリー前の開回路電圧(OCV)はともに3.2Vであった。このことより、OCVより高い電圧で観測された3.6Vと3.4Vのレドックス対は図1に示す中性ラジカルとカチオン間の酸化還元反応に起因すると考えられる。また、OCVよりも低い電圧で観測された2.8Vと2.6Vのレドックス対は図2に示す中性ラジカルとアニオン間の酸化還元反応に起因すると考えられる。一般にニトロキシル基はアニオン状態では不安定であり、図2で示す中性ラジカルとアニオン間の酸化還元反応は進行しにくいが、ニトロキシル基の2位又は4位に電子吸引性基が存在するとアニオン状態で安定な構造をとることが知られている。実施例1の二次電池中の電極活物質A及び、実施例2中の電極活物質Bともに、ニトロキシル基の4位の位置に電子吸引性基であるカルボキシル基が存在するためニトロキシル基がアニオン状態で安定したと考えられる。
【0064】
次に、本発明の電極活物質の耐電解液溶解性を定量的に評価するために、実施例1、3及び比較例2の二次電池について定電流充放電試験を行った。評価方法としては二次電池作製直後の正極容量と、作製後24時間放置した後の正極容量を測定し、電極活物質の容量を算出して比較し、電極活物質の電解液への溶出を評価した。また、定電流充放電試験の電圧範囲は図1に示す中性ラジカルとカチオン間の酸化還元反応のみを進行させるために、2.8V〜3.8Vとした。電流密度は各電極活物質の理論容量と電極重量から算出して、5C(1/5時間=12分で充電及び放電完了)となるようにした。具体的には、実施例1の二次電池は0.9075mA(=1.815mA/cm2)、実施例3の二次電池は0.855mA(=1.71mA/cm2)、比較例2の二次電池は0.93mA(=1.86mA/cm2)で充放電試験を行った。充放電試験の結果を表1に示す。実施例1の二次電池において、電極活物質Aは理論容量121mAh/gに対し、電池作製直後の正極中の電極活物質Aの容量は118mAh/gと、ほぼ理論容量と同様の容量を示した。さらに電池作製後24時間放置した後の試験結果においても116mAh/gと容量の低下はほとんど見られなかった。電極活物質Aを用いた正極が電解液と24時間接触しても、正極は初期容量及び理論容量からの容量低下を示さないことから、電極活物質Aの電解液への溶出はほとんど起こっていないことがわかる。また、実施例3の二次電池においても、電極活物質Cは理論容量114mAh/gに対して電池作製から24時間後においても110mAh/gの容量を示している。このことから、電極活物質A同様に電極活物質Cを用いた正極が電解液と24時間接触しても電極活物質Cの溶出は起こらないことが示された。これに対し、比較例2の二次電池においては、式(2)で表わされる電極活物質の理論容量124mAh/gに対し、電池作製直後で86mAh/g、電池作製から24時間後で41mAh/gと容量の低下がみられた。このことから、式(2)で表わされる電極活物質は電池作製直後より電解液への溶出が始まり、時間とともに溶出量が増えていると考えられる。式(6)で表わされる電極活物質を用いた比較例1は充放電反応を示さなかったのに対し、式(2)で表わされる電極活物質を用いた比較例2は理論容量からは大きく低下するものの、充放電反応を示している。式(2)で表わされる電極活物質は式(6)で表わされる電極活物質にプロトン性親水性基であるカルボキシル基を付与したものなので、プロトン性親水性基により耐電解液溶解性が向上し、充放電反応を示したと考えられる。しかしながら、長時間の電解液の接触により電解液への溶出が進行していると考えられる。このことから、安定に電極活物質として使用するには、式(6)で表されるラジカルにプロトン性親水性基を付与し、かつアルカリ金属又はアルカリ土類金属と反応させることが効果的であることがわかる。
【0065】
【表1】

【符号の説明】
【0066】
1 正極集電体
2 絶縁パッキン
3 正極
4 セパレーター
5 負極
6 負極集電体
【技術分野】
【0001】
本発明は、二次電池用電極活物質及び、それを用いた二次電池に関する。
【背景技術】
【0002】
携帯電話、デジタルカメラなどの携帯機器の小型、高性能化に伴いこれらに用いられる蓄電デバイスの高性能化が求められている。代表的な蓄電デバイスとして、二次電池が挙げられる。その中でも正極にリチウム含有遷移金属酸化物、負極に炭素材料を用いたリチウムイオン二次電池は高エネルギー密度を有する二次電池として、広く利用されている。
しかしながら、リチウムイオン二次電池は電極におけるリチウムイオンの挿入脱離反応速度が遅いため、例えばデジタルカメラのフラッシュの発光を伴う連写のような高出力を必要とする使用方法は不可能であった。
【0003】
一方、電極に活性炭を用いた電気二重層キャパシタは高出力特性に優れた蓄電デバイスとして広く検討されている。
【0004】
しかしながら、電気二重層キャパシタは単位容積あたりの蓄電容量が小さく、小型化が求められる携帯機器用蓄電デバイスとしては不向きであった。そこで、高容量、高出力を両立する新しい二次電池が検討されている。
【0005】
特許文献1には安定ラジカルの酸化還元反応を利用した二次電池が開示されている。この二次電池は、正極または負極の活物質として下記式(6)に示すラジカル化合物(2,2,6,6−テトラメチルピペリジン 1−オキシル。以下、TEMPOと略すことがある。)を用いた二次電池である。
【0006】
【化1】

【0007】
この活物質TEMPOは炭素や窒素といった比重の小さな元素のみから構成されたものであり、また、ラジカル化合物では反応する不対電子がラジカル原子に局在化して存在するので、反応部位の濃度を増大させることができるので、電極の高容量化が期待できる。また、ラジカル部位のみが反応に寄与するため、サイクル特性が活物質の拡散に依存しない安定性に優れた二次電池となりうる。さらに、この酸化還元過程において化合物構造の変化を伴わないため酸化還元反応速度が大きく、高出力が期待できる。
【0008】
一方、このようなTEMPOを用いた二次電池には以下の課題がある。
【0009】
電位窓を広くするために、二次電池の電解質中の電解液の溶媒としては、一般的に有機溶剤が用いられている。しかしながら、TEMPOは有機物であり、電解質の溶媒として一般的な有機溶剤に溶解してしまうという課題がある。
【0010】
このような課題を解決するものとして、特許文献2にはTEMPOを高分子化することにより、耐電解液溶解性を高めた電極活物質及び二次電池が開示されている。
【0011】
しかしながら、特許文献2に記載の二次電池にも以下のような課題が残されている。
【0012】
ラジカル化合物を電極活物質として用いる場合、一般的なリチウムイオン二次電池の場合と同様に、電極中に導電助剤を添加して導電性を補うことが多い。しかしながら、特許文献2のようにTEMPOを高分子化すると、TEMPO部位と導電助剤との接触性が低化し、より多くの導電助剤の添加が必要となるため、電極全体としての容量低下を招く可能性があった。
【先行技術文献】
【特許文献】
【0013】
【特許文献1】特開2002−151084号公報
【特許文献2】特開2002−304996号公報
【発明の概要】
【発明が解決しようとする課題】
【0014】
そこで本発明は、二次電池用電極活物質として、耐電解液溶解性を従来の低分子ラジカル化合物よりも向上させ、上記高分子化合物よりも単位体積当たりの蓄電容量が大きい二次電池用電極を実現できる低分子ラジカル化合物を提供することを目的とする。
【課題を解決するための手段】
【0015】
上記の目的を達成するために、本発明の一側面としての二次電池用電極活物質は、正極と、負極と、該正極と該負極との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質であって、下記式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなることを特徴とする。
【0016】
【化2】

【0017】
但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【発明の効果】
【0018】
本発明によれば、二次電池用電極活物質として、従来の低分子ラジカル化合物よりも耐電解液溶解性が高い低分子ラジカル化合物を提供することができる。また、本発明により提供される二次電池用電極活物質は低分子のラジカル化合物であるため、高分子化されたラジカル化合物と比較して導電助剤との接触性が良く、単位体積当たりの蓄電容量を大きくすることができる。
【図面の簡単な説明】
【0019】
【図1】中性ラジカルとカチオン間の酸化還元反応の模式図である。
【図2】中性ラジカルとアニオン間の酸化還元反応の模式図である。
【図3】二次電池の構成の一例を示す模式図である。
【図4】実施例1〜2及び比較例1の二次電池のサイクリックボルタンメトリーを行った結果である。
【発明を実施するための形態】
【0020】
本発明者らは、ラジカルの酸化還元反応を利用した二次電池用電極活物質として、耐電解液溶解性と導電助剤との接触性向上を両立できるラジカル化合物について検討した。検討の結果、下記式(1)で表わされる低分子ラジカル化合物と、アルカリ金属又はアルカリ土類金属と、からなる二次電池用電極活物質が、前記式(6)に示されるラジカル化合物(TEMPO)よりも耐電解液溶解性が高いことを見出した。尚、下記式(1)のR1〜R6のうち少なくとも1つはプロトン性親水性基である。また、本発明においてアルカリ土類金属とはいわゆる広義のアルカリ土類金属であり、ベリリウムやマグネシウムも含む第2族元素のことを指す。また、本発明において、「親水性基」という場合、イオン化した親水性基も含む。
【0021】
【化3】

【0022】
式(1)のラジカル化合物は、TEMPOの3位、4位、5位のHのうち少なくとも1つをプロトン性親水性基に置換したものであり、同位のHを双方ともにプロトン親水性基で置換しても良い。この、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる電極活物質は、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とが塩を形成した、TEMPO誘導体の金属塩であると考えられる。この電極活物質は、低分子であっても二次電池の電解液に溶解しにくいため、電解質として電解液を備えた二次電池の電極活物質として機能する。また、式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる電極活物質は、低分子であるため、高分子化されたラジカル化合物よりも導電助剤との接触性が良い。導電助剤との接触性が良いと導電助剤の量が少なくても済むため、電極に導電助剤を加えることにより生じる電極全体の容量を高分子化した場合と比べて大きくすることができる。
【0023】
以下、本発明の二次電池用電極活物質の好ましい実施の形態と、その電極活物質を用いた二次電池の好ましい実施の形態を挙げて、本発明を更に詳細に説明する。
【0024】
<二次電池用電極活物質>
本実施形態に係る電極活物質は式(1)で表されるラジカル化合物と、アルカリ金属又はアルカリ土類金属とからなる。但し、前述のように、R1〜R6の少なくとも一つはプロトン性親水性基である。プロトン性親水基の位置、種類及びアルカリ金属又はアルカリ土類金属の種類については特に限定するものではないが、特に好ましい態様について以下に示す。
【0025】
(プロトン性親水性基)
本実施形態に係るラジカル化合物が有するプロトン性親水性基は、特定のpHの下で水中でプロトンを解離してアニオン化するものであり、−COOH、−S(=O)2OH、−P(=O)(OH)2などを用いることができる。プロトン性親水性基の種類としては特に限定するものではなく、親水性を発現できればよい。しかし、電極活物質の分子量が小さいほど単位ラジカルあたりの分子量が小さいため、活物質としての蓄電容量(mAh/g)が大きくなる。したがって、プロトン性親水性基としては、分子量の小さい−COOHが好ましい。また、R1〜R6のいずれがプロトン性親水性基であるか、およびこれらのうちプロトン性親水性基の数は特に限定されるものではない。しかし、前述の分子量の観点から、R1〜R6のうちいずれか1つのみがプロトン性親水性基であり、その他のR1〜R6はHであることが好ましい。また、電子吸引性の強いカルボキシル基が4位(R3又はR4の位置)につくとニトロキシル基がアニオン状態で安定化する。その結果、図1に示す中性ラジカルとカチオン間の酸化還元反応のみならず、図2に示す中性ラジカルとアニオン間の酸化還元反応も安定に進行するため、4位のHがカルボキシル基で置換されていることがより好ましい。なお、前述した「親水性基」同様、本発明において、「カルボキシル基」は、イオン化した(プロトンが脱離した)カルボキシル基も含む概念である。
【0026】
(アルカリ金属又はアルカリ土類金属)
本実施形態に係る電極活物質が有するアルカリ金属又はアルカリ土類金属は、前述のとおり、式(1)で表されるラジカル化合物と塩を形成していると考えられる。アルカリ金属又はアルカリ土類金属は特に限定されるものではない。しかし、前述のように電極活物質の分子量が小さいほど電極活物質としての蓄電容量が大きくなるので、アルカリ金属又はアルカリ土類金属の分子量も小さい方が好ましい。したがって、電極活物質が有するアルカリ金属又はアルカリ土類金属として、Li、Na、Mg、Caが好ましい。
【0027】
また、二次電池の電解質中にアルカリ金属又はアルカリ土類金属のイオンが存在する場合、電極活物質が有するアルカリ金属又はアルカリ土類金属は、その電解質中に存在するイオンを形成するアルカリ金属又はアルカリ土類金属であることが好ましい。
【0028】
電極活物質が有するアルカリ金属又はアルカリ土類金属のイオンが電解質中に存在すると、電極活物質は電解質にさらに溶けにくくなる。例えば、リチウムイオン2次電池ではリチウム塩を有機溶剤に溶解した電解液が広く使用されており、このような電解液を用いる場合、電極活物質は式(1)で表わされるラジカル化合物とLiからなることが好ましい。
【0029】
(その他)
R1〜R6のうち、少なくとも一つがプロトン性親水性基であれば、その他のR1〜R6は特に限定されるものではない。但し、R1〜R6が疎水性の置換基であると、式(1)で表されるラジカル化合物の親水性が下がり、電極活物質の有機溶剤への溶解性が上がるため、有機溶剤を含む電解液への溶解性も向上する。つまり、電極活物質の耐電解液溶解性が低下する。したがって、式(1)の化合物は疎水性の置換基を有していないことが好ましい。
【0030】
本発明においては、R1〜R6が親水性の置換基であるので式(1)で表されるラジカル化合物の親水性が上がり、耐電解液溶解性も向上する。また、R1〜R6がプロトン性の親水性置換基であれば、アルカリ金属又はアルカリ土類金属と塩を形成できると考えられる。
【0031】
また、プロトン性親水性基の項で上述した通り、分子量の観点から、R1〜R6は分子量が小さい置換基又はHであることが好ましく、R1〜R6のうち3つ以上がHであることが好ましい。更に、R1〜R6のうち1つだけがプロトン性親水性基であり、他の5つはHであることがより好ましい。
【0032】
つまり、たとえば、R1〜R6のうち、1つだけがプロトン性親水性基で他の2つが疎水性基で残り3つがHであるよりも、1つだけがプロトン性親水性基で他の2つがプロトン性以外の親水性基で残り3つがHであるほうが好ましい。更に好ましくは3つがプロトン性親水性基であり、残り3つがHであることであり、3つがプロトン性親水性基であるよりも、1つだけがプロトン性親水性基であり、残り5つがHであることがより好ましい。
【0033】
<二次電池>
本実施形態の二次電池は、少なくとも正極、負極、電解質を備えている。その構造の一例を図3に示す。図に示された二次電池は正極集電体1、正極3、セパレーター4、負極5、負極集電体6を順に重ね合わせた構成を有している。セパレーター4には電解質が含ませてある。また、正極集電体1と負極集電体6はプラスチック樹脂からなる絶縁パッキン2により絶縁されている。電解質を含んだセパレーターの代わりに高分子ゲル電解質を用いることも可能である。なお、正極3は、正極材料層あるいは正極活物質層、負極5は、負極材料層あるいは負極活物質層と呼称することも可能である。
【0034】
二次電池の形状は、公知の形状を用いることができる。二次電池の形状の例としては、電極の積層体あるいは巻回体を、金属ケース、樹脂ケース、あるいはラミネートフィルム等によって封止したものが挙げられる。また外観としては、円筒型、角型、コイン型、およびシート型等が挙げられる。
【0035】
以下、本実施形態の二次電池について構成毎に説明をする。
【0036】
(正極)
本実施形態の二次電池は、少なくとも、正極又は負極の電極活物質として本実施形態に係る二次電池用活物質を用いる。正極と負極のどちらか一方にのみ本実施形態に係る活物質を用いる場合は、正極に用いるのが好ましい。正極中には本実施形態に係る電極活物質に加えその他の構成成分として、従来公知のものを含有することができる。従来公知の構成成分として、例えば、導電助剤やバインダー(結着材)が挙げられる。導電助剤の例としては、活性炭やグラファイト、カーボンブラック、アセチレンブラック等の炭素材料、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子が挙げられる。また、バインダーの例としては、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、ポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体、スチレン−ブタジエン共重合ゴム、ポリプロピレン、ポリエチレン、ポリイミド等の樹脂バインダー、イオン導電性高分子等を適宜含有させることができる。
【0037】
また、負極のみに本実施形態に係る二次電池用活物質を用いる場合は、正極として従来公知のものを用いることができる。例えば、コバルト酸リチウム、マンガン酸リチウムなどの金属酸化物の粒子、ジスルフィド化合物、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子を用いることができる。また、従来公知の活物質と本実施形態の活物質を混合して用いても良い。
【0038】
(負極)
負極の活物質として本実施形態の電極活物質を用いる場合、正極と同様に、負極中には本実施形態に係る電極活物質に加えその他の構成成分として、従来公知のものを含有することができる。
【0039】
また、本実施形態に係る二次電池用電極活物質を正極のみに用いる場合は負極としては従来公知のものが利用できる。例えば、活性炭やグラファイト、カーボンブラック、アセチレンブラック等の炭素材料、リチウム金属またはリチウム合金、リチウムイオン吸蔵炭素、スズ金属またはスズ合金、シリコン金属またはシリコン合金、その他各種の金属単体または合金、ポリアセチレン、ポリフェニレン、ポリアニリン、ポリピロール等の導電性高分子を電極活物質として用いることができる。また、ポリフッ化ビニリデン、ポリテトラフルオロエチレン、ポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体、スチレン−ブタジエン共重合ゴム、ポリプロピレン、ポリエチレン、ポリイミド等の樹脂バインダー、イオン導電性高分子等を適宜含有させることができる。
【0040】
(集電体)
正極集電体1および負極集電体6の材質としては、導電性が高く、耐腐食性にすぐれているものであればよく、特に限定するものではない。例えば、ニッケルやアルミニウム、銅、金、銀、チタン等の金属、アルミニウム合金、ステンレス等の合金、炭素素材等を用いることができる。また、形状としては、箔や平板、メッシュ状のもの等を用いることができる。
【0041】
(セパレーター)
本実施形態の二次電池は、正極3および負極5の電気的接触を防ぐ目的でセパレーター4を備える。セパレーターとして、多孔質フィルムからなるセパレーターや不織布等を用いることができる。また、本実施形態のセパレーターには後程説明する電解質が含ませてある。
【0042】
(電解質)
本実施形態の二次電池は電解質を備える。電解質は、負極と正極との間の荷電担体輸送を行うものであり、一般には室温で10−5〜10−1S/cmの電解質イオン伝導性を有している。本実施形態における電解質としては、例えば電解質塩を溶剤に溶解した電解液を利用することができる。電解液の溶剤は、電位窓が広く、電解質塩を電離することのできるものであればよく、特に限定するものではない。例えば、エチレンカーボネート、プロピレンカーボネート、ジメチルカーボネート、ジエチルカーボネート、メチルエチルカーボネート、γ−ブチロラクトン、テトラヒドロフラン、ジオキソラン、スルホラン、ジメチルホルムアミド、ジメチルアセトアミド、N−メチル−2−ピロリドン等の有機溶媒などが用いることができる。また、これらの溶剤を単独又は2種類以上混合して用いることもできる。
【0043】
また、電解質塩としては、例えばLiPF6、LiClO4、LiBF4、LiCF3SO3、LiN(CF3SO2)2、LiN(C2F5SO2)2、LiC(CF3SO2)3、LiC(C2F5SO2)3、LiBr、LiCl、LiF等を用いることができる。
【0044】
尚、図3に示した二次電池の構造では、セパレーター4に電解質を含ませて使用される。
【0045】
また、前述の電解液の代わりに、例えば電解液をゲル状にした固体の電解質を用いても良い。この場合、得られる二次電池はいわゆるポリマー二次電池となる。ゲル状の電解質を用いても、電解質に有機溶剤が含まれている場合、有機溶剤への溶解性が高い電極活物質を用いるとその電極活物質は電極から電解質へ溶解してしまうことがある。しかし、本実施形態に係る電極活物質を用いれば電極活物質の電解質への溶解を軽減することができる。
【実施例】
【0046】
本実施形態のより具体的な実施例を挙げて説明する。
【0047】
<電極活物質Aの製造>
水酸化リチウム(東京化成製)0.12g(0.005mol)をイオン交換水50ccに溶解し、0.1M水酸化リチウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Aを得た。電極活物質Aは、式(3)のように式(2)で表されるラジカル化合物とリチウムの塩であると考えられる。
【0048】
【化4】

【0049】
【化5】

【0050】
<電極活物質Bの製造>
1M水酸化ナトリウム水溶液(東京化成製)5ccにイオン交換水45ccを加え、0.1M水酸化ナトリウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Bを得た。電極活物質Bは、式(4)のように式(2)で表されるラジカル化合物とナトリウムの塩であると考えられる。
【0051】
【化6】

【0052】
<電極活物質Cの作製>
水酸化カルシウム(キシダ化学製)0.185g(0.0025mol)をイオン交換水50ccに溶解し、0.05M水酸化カルシウム水溶液とした。その後、式(2)で表わされる、4−カルボキシ−2,2,6,6−テトラメチルピペリジン1−オキシル フリーラジカル(東京化成製)1g(0.005mol)を加え撹拌し、溶解させた。得られた溶液を60℃で8時間、真空乾燥させることにより電極活物質Cを得た。電極活物質Cは、式(5)のように式(2)で表されるラジカル化合物とカルシウムの塩であると考えられる。
【0053】
【化7】

【0054】
<正極の作製>
電極活物質(A〜Cのいずれか)2.4g、導電助剤としてアセチレンブラック(電気化学工業製)1.2g、バインダーとしてポリフッ化ビニリデン−ヘキサフルオロプロピレン共重合体0.4g(アルドリッチ製)、N−メチルピロリドン(キシダ化学製)4ccを混合し、遊星型ボールミルを用いて150rpm、30分撹拌することでスラリー状にした。得られたスラリーをアルミ箔上にブレードコーターで塗布し、80℃で8時間、真空乾燥を行うことでN−メチルピロリドンを除去し、電極シート(前記正極3と正極集電体1の一体物)を作製した。この電極シートは、電極活物質A、B,Cのそれぞれについて1個、合計3個作製した。
【0055】
<電解質の作製>
電解質塩としてLiPF6(キシダ化学製)152g(1mol)を、エチレンカーボネート(キシダ化学製)300ccとジエチルカーボネート(キシダ化学製)700ccを混合させた溶剤に溶解させ、電解液を作製した。作製した電解液中に多孔質セパレーターを8時間含浸させることで電解質を含んだセパレータ―を作製した。
【0056】
<二次電池の作製>
前述で作製した正極を8mmφ、電解質を12mmφ、負極としてリチウム金属箔を10mmφに打抜き、電解質を含んだセパレーターを正極、負極で挟み込む形で積層し、3種類の積層体を得た。得られた積層体を宝泉社製の実験用セルであるHSセル(商品名)に組み込むことで二次電池を作製した。
【0057】
<実施例1>
正極の電極活物質として電極活物質Aを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0058】
<実施例2>
正極の電極活物質として電極活物質Bを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0059】
<実施例3>
正極の電極活物質として電極活物質Cを用いた例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0060】
<比較例1>
正極の電極活物質として、式(6)で表わされる電極活物質を用い、実施例1〜3と同様に二次電池を作製した例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0061】
<比較例2>
正極の電極活物質に式(2)で表わされる電極活物質を用い、実施例1〜3と同様に二次電池を作製した例である。作製した電極シートの重量は集電体部を除いて5mg/cm2であった。
【0062】
以上のように作製した実施例1〜3及び、比較例1〜2の二次電池の電池特性を評価した。図4に実施例1〜2、及び比較例1の二次電池を用いてサイクリックボルタンメトリーを行った結果を示す。走査速度は1mV/s、走査範囲は4.2〜1.8Vとした。比較例1の二次電池は式(6)で表わされる電極活物質が電解液中に溶出し、充放電ピークを示さなかった。これに対し、実施例1〜2の二次電池は3.6Vと3.4V付近及び、2.8Vと2.6V付近にそれぞれレドックス対が観測され、電極活物質が電解液中に溶出していないことがわかる。実施例1〜2の電極活物質A及びBと比較例1の式(6)で表わされる電極活物質の差異は、ラジカル化合物にプロトン性親水基であるカルボキシル基を付与し、さらに電極活物質がLi又はNa(Liイオン又はNaイオン)を有することにある。したがって、これらにより、耐電解液溶解性が向上し、その結果、電極活物質の電解液への溶出が抑制されていると考えられる。
【0063】
また、実施例1〜2の二次電池のサイクリックボルタンメトリー前の開回路電圧(OCV)はともに3.2Vであった。このことより、OCVより高い電圧で観測された3.6Vと3.4Vのレドックス対は図1に示す中性ラジカルとカチオン間の酸化還元反応に起因すると考えられる。また、OCVよりも低い電圧で観測された2.8Vと2.6Vのレドックス対は図2に示す中性ラジカルとアニオン間の酸化還元反応に起因すると考えられる。一般にニトロキシル基はアニオン状態では不安定であり、図2で示す中性ラジカルとアニオン間の酸化還元反応は進行しにくいが、ニトロキシル基の2位又は4位に電子吸引性基が存在するとアニオン状態で安定な構造をとることが知られている。実施例1の二次電池中の電極活物質A及び、実施例2中の電極活物質Bともに、ニトロキシル基の4位の位置に電子吸引性基であるカルボキシル基が存在するためニトロキシル基がアニオン状態で安定したと考えられる。
【0064】
次に、本発明の電極活物質の耐電解液溶解性を定量的に評価するために、実施例1、3及び比較例2の二次電池について定電流充放電試験を行った。評価方法としては二次電池作製直後の正極容量と、作製後24時間放置した後の正極容量を測定し、電極活物質の容量を算出して比較し、電極活物質の電解液への溶出を評価した。また、定電流充放電試験の電圧範囲は図1に示す中性ラジカルとカチオン間の酸化還元反応のみを進行させるために、2.8V〜3.8Vとした。電流密度は各電極活物質の理論容量と電極重量から算出して、5C(1/5時間=12分で充電及び放電完了)となるようにした。具体的には、実施例1の二次電池は0.9075mA(=1.815mA/cm2)、実施例3の二次電池は0.855mA(=1.71mA/cm2)、比較例2の二次電池は0.93mA(=1.86mA/cm2)で充放電試験を行った。充放電試験の結果を表1に示す。実施例1の二次電池において、電極活物質Aは理論容量121mAh/gに対し、電池作製直後の正極中の電極活物質Aの容量は118mAh/gと、ほぼ理論容量と同様の容量を示した。さらに電池作製後24時間放置した後の試験結果においても116mAh/gと容量の低下はほとんど見られなかった。電極活物質Aを用いた正極が電解液と24時間接触しても、正極は初期容量及び理論容量からの容量低下を示さないことから、電極活物質Aの電解液への溶出はほとんど起こっていないことがわかる。また、実施例3の二次電池においても、電極活物質Cは理論容量114mAh/gに対して電池作製から24時間後においても110mAh/gの容量を示している。このことから、電極活物質A同様に電極活物質Cを用いた正極が電解液と24時間接触しても電極活物質Cの溶出は起こらないことが示された。これに対し、比較例2の二次電池においては、式(2)で表わされる電極活物質の理論容量124mAh/gに対し、電池作製直後で86mAh/g、電池作製から24時間後で41mAh/gと容量の低下がみられた。このことから、式(2)で表わされる電極活物質は電池作製直後より電解液への溶出が始まり、時間とともに溶出量が増えていると考えられる。式(6)で表わされる電極活物質を用いた比較例1は充放電反応を示さなかったのに対し、式(2)で表わされる電極活物質を用いた比較例2は理論容量からは大きく低下するものの、充放電反応を示している。式(2)で表わされる電極活物質は式(6)で表わされる電極活物質にプロトン性親水性基であるカルボキシル基を付与したものなので、プロトン性親水性基により耐電解液溶解性が向上し、充放電反応を示したと考えられる。しかしながら、長時間の電解液の接触により電解液への溶出が進行していると考えられる。このことから、安定に電極活物質として使用するには、式(6)で表されるラジカルにプロトン性親水性基を付与し、かつアルカリ金属又はアルカリ土類金属と反応させることが効果的であることがわかる。
【0065】
【表1】

【符号の説明】
【0066】
1 正極集電体
2 絶縁パッキン
3 正極
4 セパレーター
5 負極
6 負極集電体
【特許請求の範囲】
【請求項1】
正極と、負極と、該正極と該負極との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質であって、
下記式(1)で表されるラジカル化合物と、
アルカリ金属又はアルカリ土類金属と、からなることを特徴とする二次電池用電極活物質。
【化1】

但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【請求項2】
前記R1〜R6はHまたはプロトン性親水性基であることを特徴とする請求項1に記載の二次電池用電極活物質。
【請求項3】
前記プロトン性親水性基がカルボキシル基であることを特徴とする請求項1又は2に記載の二次電池用電極活物質。
【請求項4】
前記アルカリ金属又は前記アルカリ土類金属が、リチウムであることを特徴とする請求項1乃至3のいずれか1項に記載の二次電池用電極活物質。
【請求項5】
正極と、負極と、該正極と該負極との間に存在する電解質と、を備える二次電池において、
前記正極と前記負極とのうち少なくとも一方が請求項1乃至4のいずれか1項に記載の二次電池用電極活物質を有することを特徴とする二次電池。
【請求項6】
前記電解質が、前記アルカリ金属又はアルカリ土類金属のイオンを有することを特徴とする請求項5に記載の二次電池。
【請求項1】
正極と、負極と、該正極と該負極との間に存在する電解質とを備える二次電池に用いられる二次電池用電極活物質であって、
下記式(1)で表されるラジカル化合物と、
アルカリ金属又はアルカリ土類金属と、からなることを特徴とする二次電池用電極活物質。
【化1】

但し、R1〜R6のうち少なくとも1つはプロトン性親水性基である。
【請求項2】
前記R1〜R6はHまたはプロトン性親水性基であることを特徴とする請求項1に記載の二次電池用電極活物質。
【請求項3】
前記プロトン性親水性基がカルボキシル基であることを特徴とする請求項1又は2に記載の二次電池用電極活物質。
【請求項4】
前記アルカリ金属又は前記アルカリ土類金属が、リチウムであることを特徴とする請求項1乃至3のいずれか1項に記載の二次電池用電極活物質。
【請求項5】
正極と、負極と、該正極と該負極との間に存在する電解質と、を備える二次電池において、
前記正極と前記負極とのうち少なくとも一方が請求項1乃至4のいずれか1項に記載の二次電池用電極活物質を有することを特徴とする二次電池。
【請求項6】
前記電解質が、前記アルカリ金属又はアルカリ土類金属のイオンを有することを特徴とする請求項5に記載の二次電池。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−89413(P2013−89413A)
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2011−227972(P2011−227972)
【出願日】平成23年10月17日(2011.10.17)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年10月17日(2011.10.17)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

