二薬ステント
【課題】治療薬及び/又は治療薬の組み合わせの局所送達のための管腔内医療デバイスを提供する。
【解決手段】植え込み可能な医療デバイスは、植え込み可能な医療デバイスの導入に対する生物学的な生体反応の治療を含む、様々な状態の治療のために1種以上の薬物又は治療薬を局所送達するよう使用され得る。これらの治療薬は、1種以上の治療薬が正確な標的領域、例えば周囲組織及び/又は血流に到達するように、制御された定方向条件下で放出され得る。
【解決手段】植え込み可能な医療デバイスは、植え込み可能な医療デバイスの導入に対する生物学的な生体反応の治療を含む、様々な状態の治療のために1種以上の薬物又は治療薬を局所送達するよう使用され得る。これらの治療薬は、1種以上の治療薬が正確な標的領域、例えば周囲組織及び/又は血流に到達するように、制御された定方向条件下で放出され得る。
【発明の詳細な説明】
【開示の内容】
【0001】
〔発明の背景〕
1.発明の分野
本発明は、血管疾患の予防及び治療のための治療薬及び/又は治療薬の組み合わせの局所投与、特に治療薬及び/又は治療薬の組み合わせの局所送達のための管腔内医療デバイスに関する。
【0002】
2.関連技術の考察
多くの個人は、心臓及び他の主な器官を灌流する血管の進行性の閉塞により生じる循環器疾患に苦しんでいる。そのような個人におけるより重篤な血管閉塞によって、多くの場合、高血圧、虚血性損傷、卒中又は心筋梗塞がもたされる。冠動脈血流を制限又は妨害する動脈硬化病変は、虚血性心疾患の主な原因である。経皮的冠動脈形成術は、動脈を通る血流を増大させることを目的とする医療処置である。経皮的冠動脈形成術は、広く行われている冠動脈狭窄の治療法である。この処置が益々使用されている理由は、冠動脈バイパス手術と比較したその比較的高い成功率と低侵襲性に起因する。経皮的冠動脈形成術に関する限界は、この処置の直後に生じ得る血管の突然閉鎖、及びこの処置の後に徐々に生じる再狭窄である。加えて、再狭窄は、伏在静脈バイパス移植を受けた患者における慢性的な問題である。急性閉塞のメカニズムはいくつかの要因が関与すると思われ、血管反跳及びその結果の動脈閉鎖、並びに/又は新たに開放した血管の、損傷した長さに沿った血小板及びフィブリンの沈着により生じ得る。
【0003】
経皮的冠動脈形成術後の再狭窄は、血管損傷により開始される、より漸進的なプロセスである。再狭窄のプロセスには、血栓症、炎症、増殖因子及びサイトカイン放出、細胞増殖、細胞遊走並びに細胞外マトリックス合成を含む多数のプロセスのそれぞれが寄与する。
【0004】
再狭窄の正確なメカニズムは完全には理解されていないが、再狭窄プロセスの一般的な局面は確認されている。正常な動脈壁では、平滑筋細胞は、1日当たり約0.1パーセント未満の低速で増殖する。血管壁内の平滑筋細胞は、細胞質体積の80%〜90%が収縮器官で占められるという特徴を有する収縮表現型で存在する。小胞体、ゴルジ及び遊離リボソームは殆ど存在せず、核周辺領域内に位置している。細胞外マトリックスは平滑筋を包囲し、平滑筋細胞を収縮表現型の状態に維持する役割を有すると思われるヘパリン様グリコシルアミノグリカンに富んでいる(Campbell and Campbell,1985)。
【0005】
血管形成術中の冠動脈内バルーンカテーテルの加圧拡張により、血管壁内の平滑筋細胞及び内皮細胞が損傷され、血栓性及び炎症性応答が開始する。血小板、侵入するマクロファージ及び/又は白血球から、又は平滑筋細胞から直接放出される、血小板由来増殖因子、塩基性線維芽細胞増殖因子、上皮増殖因子、トロンビン等の細胞由来増殖因子は、中膜平滑筋細胞における増殖及び遊走応答を誘発する。これらの細胞は、収縮表現型から合成表現型への変化を受け、合成表現型は僅かな収縮フィラメント束、大幅に粗い小胞体、ゴルジ及び遊離リボソームにより特徴付けられる。増殖/遊走は、通常、損傷から1〜2日後に開始し、その後数日でピークに達する(Campbell and Campbell,1987;Clowes and Schwartz,1985)。
【0006】
娘細胞は、動脈平滑筋の内膜層に遊走し、増殖を継続して有意な量の細胞外マトリックスタンパク質を分泌する。増殖、遊走及び細胞外マトリックスの合成は、損傷した内皮層が修復される迄継続し、その時点で、増殖は、通常損傷から7〜14日後、内膜内で遅延する。新たに形成された組織は、新生内膜と呼ばれる。次の3〜6ヶ月間に亘って生じる更なる血管の狭まりは、主に負のリモデリング又は狭窄リモデリングによるものである。
【0007】
局所増殖及び遊走と同時に、炎症細胞が血管損傷の部位に付着する。損傷から3〜7日後には、炎症細胞が血管壁のより深い層に遊走している。バルーン損傷又はステント植え込みのいずれかを用いた動物モデルでは、炎症細胞は、血管損傷部位に少なくとも30日間存続し得る(Tanaka et al.,1993;Edelman et al.,1998)。したがって、炎症細胞は存在し、再狭窄の急性期及び慢性期の両方に寄与し得る。
【0008】
多数の薬剤が、再狭窄における推定抗増殖作用に関して試験されており、実験動物モデルにて幾分かの活性を示している。動物モデルで内膜過形成の程度を首尾良く低減したいくつかの薬剤は:ヘパリン及びヘパリン断片(Clowes,A.W.and Karnovsky M.,Nature 265:25〜26,1977;Guyton,J.R.et al.,Circ.Res.,46:625〜634,1980;Clowes,A.W.and Clowes,M.M.,Lab.Invest.52:611〜616,1985;Clowes,A.W.and Clowes,M.M.,Circ.Res.58:839〜845,1986;Majesky et al.,Circ.Res.61:296〜300,1987;Snow et al.,Am.J.Pathol.137:313〜330,1990;Okada,T.et al.,Neurosurgery 25:92〜98,1989)、コルヒチン(Currier,J.W.et al.,Circ.80:11〜66,1989)、タキソール((Sollot,S.J. et al.,J.Clin.Invest.95:1869〜1876,1995)、アンジオテンシン変換酵素(ACE)阻害剤(Powell,J.S.et al.,Science,245:186〜188,1989)、アンジオペプチン(Lundergan,C.F.et al.Am.J.Cardiol.17(Suppl.B):132B〜136B,1991)、シクロスポリンA(Jonasson,L.et al.,Proc.Natl.,Acad.Sci.,85:2303,1988)、ヤギ抗ウサギPDGF抗体(Ferns,G.A.A.,et al.,Science 253:1129〜1132,1991)、テルビナフィン(Nemecek,G.M.et al.,J.Pharmacol.Exp.Thera.248:1167〜1174,1989)、トラピジル(Liu,M.W.et al.,Circ.81:1089〜1093,1990)、トラニラスト(Fukuyama,J.et al.,Eur.J.Pharmacol.318:327〜332,1996)、インターフェロン−γ(Hansson,G.K.and Holm,J.,Circ.84:1266〜1272,1991)、ラパマイシン(Marx,S.O.et al.,Circ.Res.76:412〜417,1995)、ステロイド(Colburn,M.D.et al.,J.Vasc.Surg.15:510〜518,1992),Berk,B.C.et al.,J.Am.Coll.Cardiol.17:111B〜117B,1991も参照のこと)、電離放射線(Weinberger,J.et al.,Int.J.Rad.Onc.Biol.Phys.36:767〜775,1996)、融合毒素(Farb,A.et al.,Circ.Res.80:542〜550,1997)、アンチセンスオリゴヌクレオチド(Simons,M.et al.,Nature 359:67〜70,1992)及び遺伝子ベクター(Chang,M.W.et al.,J.Clin.Invest.96:2260〜2268,1995)を含む。ヘパリン及びヘパリンコンジュゲート、タキソール、トラニラスト、コルヒチン、ACE阻害剤、融合毒素、アンチセンスオリゴヌクレオチド、ラパマイシン並びに電離放射線を含むこれらの多数の薬剤に関して、平滑筋細胞に対するインビトロでの抗増殖作用が示されている。それ故、平滑筋細胞抑制の多様なメカニズムを有する薬剤は、内膜過形成の低減における治療的用途を有する可能性がある。
【0009】
しかしながら、動物モデルとは対照的に、全身的な薬理学的手段によるヒト血管形成術患者の再狭窄予防の試みは、成功とは程遠いものとなっている。アスピリン−ジピリダモール、チクロピジン、抗血液凝固療法(急性ヘパリン、慢性ワルファリン、ヒルジン又はヒルログ)、トロンボキサン受容体拮抗作用及びステロイドのいずれも、再狭窄の予防に有効なものとなってはいないが、血小板阻害剤は血管形成術後の急性再閉塞の予防に有効なものとなっている(Mak and Topol,1997;Lang et al.,1991;Popma et al.,1991)。血小板GP IIb/IIIa受容体、拮抗薬、Reopro(登録商標)は尚研究中であるが、Reopro(登録商標)は、血管形成術及びステント留置後の再狭窄の低減に関して決定的な結果を示していない。再狭窄の予防において不成功であった他の薬剤は、カルシウムチャネル拮抗薬、プロスタサイクリン模倣体、アンジオテンシン変換酵素阻害剤、セロトニン受容体拮抗薬及び抗増殖剤を含む。しかしながら、これらの薬剤は全身に提供される必要があり、治療的有効用量の達成が不可能であり得て、抗増殖(又は抗再狭窄)濃度がこれらの薬剤の公知の毒性濃度を超え、平滑筋抑制を生じるに十分なレベルに到達し得ない可能性がある(Mak and Topol,1997;Lang et al.,1991;Popma et al.,1991)。
【0010】
食用魚油サプリメント又はコレステロール低下薬を使用して再狭窄予防の効果を試験した更なる臨床試験では、矛盾した又は負の結果を示したため、血管形成術後の再狭窄の予防に臨床的に利用可能な薬理学的薬剤は今尚存在しない(Mak and Topol,1997;Franklin and Faxon,1993:Serruys,P.W.et al.,1993)。最近の観察により、抗脂肪/抗酸化剤、プロブコールが再狭窄の予防に有用であり得ることが示唆されているが、この研究は立証されることが必要である(Tardif et al.,1997;Yokoi,et al.,1997)。プロブコールは現在、米国内での使用が承認されていず、30日間の前処理期間により、緊急血管形成術におけるその使用は不可能であると思われる。また、電離放射線の適用は、ステントによる血管形成術後の患者の再狭窄の低減又は予防に有意な展望を示している(Teirstein et al.,1997)。しかしながら、米国食品医薬品局の承認を有する血管形成術後の再狭窄の予防のために使用される治療薬は現在全く存在しないため、再狭窄の最も有効な治療は、目下の所、反復血管形成術、粥腫切除術又は冠動脈バイパス移植である。
【0011】
全身的な薬理学的療法とは異なり、ステントは、再狭窄の有意な低減に有用であることが証明されている。一般に、ステントはバルーン拡張型の孔のある金属管(通常、非限定的に、ステンレス鋼)であり、血管形成術が実行された冠動脈管腔内で拡張されると、動脈壁に対する剛性の足場作用により構造的支持を提供する。この支持は、血管管腔の開通性の維持に役立つ。2つの無作為化臨床試験では、ステントは最小の管腔直径を増大させ、6ヶ月後の再狭窄の発生率を、排除せずとも低減したことにより、経皮的冠動脈形成術後の血管造影成功率を向上させた(Serruys et al.,1994;Fischman et al.,1994)。
【0012】
また、ステントのヘパリン被覆は、ステント植え込み後の亜急性血栓症の低減を生じる付加的な利益を有すると思われる(Serruys et al.,1996)。このように、ステントによる狭窄した冠動脈の持続性の機械的拡張は、再狭窄予防の、ある手段を提供することが示されており、ステントをヘパリンで被覆することは、損傷組織の部位に薬物を局所送達する実行可能性及び臨床的有用性の両方を示している。
【0013】
上述したように、ヘパリン被覆ステントの使用は、局所薬物送達の実行可能性と臨床的有用性を示すが、特定の薬物又は薬物の組み合わせが局所送達デバイスに付着される形態は、この種類の治療の有効性にある役割を果たすであろう。例えば、局所送達デバイスに薬物/薬物の組み合わせを付着させるために使用されるプロセス及び材料は、薬物/薬物の組み合わせの作用を妨害するものであってはならない。また、使用されるプロセス及び材料は、生体適合性を有し、かつ薬物/薬物の組み合わせを、送達中に及び所定の時間に亘り、局所デバイス上に維持する必要がある。例えば、局所送達デバイスの送達中の薬物/薬物の組み合わせの除去により、デバイスが破損する可能性があり得る。
【0014】
したがって、生物学的に誘導される(例えばアテローム性動脈硬化症)か、又は例えば経皮的冠動脈形成術を介して機械的に誘導された、内膜肥厚を生じる血管損傷の予防及び治療のための薬物/薬物の組み合わせ、及び関連した局所送達デバイスが必要とされている。
【0015】
〔発明の概要〕
本発明の二薬ステントは、上記に示した先行技術によるデバイスの限界を克服するものである。
【0016】
例示的な一実施形態によれば、本発明は、薬物送達デバイスに関する。薬物送達デバイスは、管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、管腔内足場内の複数の開口部、mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む複数の開口部の第1の部分、並びにホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む複数の開口部の第2の部分、を備える。
【0017】
本発明は、上述したような、リザーバを有する血管二薬溶出ステントに関し、これらのリザーバの一部は、シロリムス(ラパマイシン)を壁又は反管腔方向に優位に放出する組成物を含み、これらのリザーバの補足的部分は、シロスタゾールを管腔方向に優位に放出する組成物を含む。より詳細には、二薬溶出ステントが患者の動脈内に配置された際に、シロリムスが動脈組織内に局所的に溶出し、動脈内の再狭窄を治療及び緩和する一方、シロスタゾールが血流中に溶出して、二薬溶出ステントの管腔内及び薬物溶出ステントに隣接した局所動脈壁内の抗血栓効果を提供するであろう。抗血栓効果は二倍であり、即ち、植え込まれた二薬溶出ステント上の、又は同ステント近傍の血栓形成の軽減、並びに二薬溶出ステント上の、又は同ステント近傍の血小板凝集及び沈着の阻害である。また、二薬溶出ステントが急性心筋梗塞に苦しむ患者の治療に使用される場合、シロスタゾールは、例えばステント留置後の「無再流」状態を制限し、再灌流損傷を軽減し、及び/又は梗塞寸法を縮小することにより、治療された動脈により血液が供給される心筋組織に対して心保護効果を提供することができる。二薬溶出ステントは、糖尿病を有する患者等、乏しい治癒特性を有する患者の臨床成績を改善することができる。
【0018】
この二薬溶出ステントの例示的な実施形態において、リザーバは、ステントからの2種の異なる治療薬又は薬物の定方向送達に使用される。ポリマー及びシロリムスの組成物は、ステントのリザーバの一部から患者の動脈組織への反管腔方向のシロリムスの制御された徐放性局所送達を提供する。ポリマー及びシロスタゾールの組成物は、ステントの異なる及び別個のリザーバから、治療中の動脈の血流への直接的な、又はステントの植え込み後、ステントの管腔表面を覆うよう成長する生物学的組織内へのシロスタゾールの制御された徐放性送達を提供する。
【0019】
本明細書では別個の区別されるリザーバが記載されているが、任意の他の好適な定方向送達メカニズムを使用できることに留意することが重要である。
【0020】
本発明の二薬ステントのデザインは、シロリムス及びシロスタゾールの独立した溶出速度と、各薬物の定方向送達とを提供する。
【図面の簡単な説明】
【0021】
本発明の前述の及び他の特徴及び利点は、以下の付随する図面に示される本発明の好ましい実施態様のより詳細な説明から明らかとなるであろう。
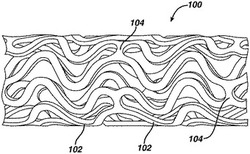
【図1】ステントの外面及び特徴的なバンド模様を示す、拡張前のステント(末端部は図示せず)の長さに沿った図。
【図2】本発明によるリザーバを有する図1のステントの長さに沿った斜視図。
【図3】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第1の例示的な実施形態の図表示。
【図4】本発明による第1の例示的なシロリムスとシロスタゾールとの組み合わせのステント被膜のインビトロでの放出動力学のグラフ。
【図5】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第2の例示的な実施形態の図表示。
【図6】本発明による第2の例示的なシロリムスとシロスタゾールとの組み合わせのステント被膜のインビトロでの放出動力学のグラフ。
【図7】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第3の例示的な実施形態の図表示。
【図8】本発明によるインビトロでのウシ血液ループモデルにおける、シロリムスとシロスタゾールの組み合わせの薬物溶出ステントの抗血栓活性のグラフ。
【図9】図11に示すステントからのシロリムス及びシロスタゾールのインビボでの放出動力学のグラフ。
【図10】図11に示すステントからのシロリムス及びシロスタゾールのインビトロでの放出動力学のグラフ。
【図11】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第4の例示的な実施形態の図表示。
【図12】図3に示したステントからのシロリムス及びシロスタゾールのインビボでの放出動力学のグラフ。
【図13】図3に示したステントからのシロリムス及びシロスタゾールのインビトロでの放出動力学のグラフ。
【図14】末端部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図15】中心部分に有益な薬剤を有し、末端部に有益な薬剤を有さない、本発明による拡張可能な医療デバイスの等角図。
【図16】異なる孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図17】交互孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図18】架橋要素内の開口部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの一部分の拡大された側面図。
【図19】分岐開口部を有する、本発明による拡張可能な医療デバイスの一部分の拡大側面図。
【図20】第1の複数の孔内の、例えば抗炎症剤等の第1の薬剤と、第2の複数の孔内の、例えば抗増殖剤等の第2の薬剤との組み合わせを有する、本発明による拡張可能な医療デバイスの断面図。
【図21】本発明による図20の拡張可能な医療デバイスにより送達される、抗炎症剤及び抗増殖剤の一例の放出速度のグラフ。
【図22A】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図22B】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図22C】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図23A】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図23B】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図23C】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図24】本発明によるポリL−ラクチド。
【図25】本発明によるポリD−ラクチド。
【図26A】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図26B】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図26C】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図27A】ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有する溶液を使用した、本発明による被覆又は堆積スキーム。
【図27B】ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有する溶液を使用した、本発明による被覆又は堆積スキーム。
【図28】本発明による二薬溶出ステントの概略側面図。
【図29】本発明による、累積的なインビボでの薬物放出の百分率によるグラフ。
【図30】本発明による、累積的なインビボでの薬物放出の重量によるグラフ。
【0022】
〔好適な実施形態の詳細な説明〕
本発明の薬物/薬物の組み合わせ及び送達デバイスは、血管疾患、特に損傷により生じる血管疾患を有効に予防及び治療するために使用することができる。血管疾患の処置に使用されている様々な医療用治療デバイスは、最終的には更なる合併症を誘導し得る。例えば、バルーン血管形成術は、動脈を通る血流を増大させるために使用される処置であり、冠動脈血管狭窄の優位な治療法である。しかしながら、上述したように、この処置は一般に、血管壁に対してある程度の損傷をもたらすため、後の時点で問題を悪化させる可能性がある。他の処置及び疾病も同様の損傷をもたらし得るが、本発明の例示的な実施形態では、経皮的冠動脈形成術、並びに動脈、静脈及び他の流体輸送導管の連結を含む他の同様の動脈/静脈処置後の再狭窄及び関連した合併症の治療に関して記載する。また、被覆された医療デバイスを有効に送達するための様々な方法及びデバイスを記載する。
【0023】
本発明の例示的な実施形態を、経皮的冠動脈形成術後の再狭窄及び関連した合併症の治療に関連付けて記載するが、薬物/薬物の組み合わせの局所送達は、任意の数の医療デバイスを使用する非常に様々な状態の治療、又はデバイスの機能及び/若しくは寿命の向上に使用し得ることに留意することが重要である。例えば、白内障の手術後に視力を回復するために留置される眼内レンズはしばしば後発白内障の形成によって機能が損なわれる。後発白内障はしばしばレンズ表面における細胞の異常増殖の結果起こり、薬剤をデバイスと組み合わせることによって最小限にされる可能性がある。組織の内部成長やデバイスの内部、表面及び周囲へのタンパク性物質の蓄積によってその機能がしばしば損なわれる、水頭症用のシャント、透析グラフト、人工肛門形成術用バッグ取り付けデバイス、耳のドレナージ管、ペースメーカーのリード及び植え込み可能な除細動器といった他の医療デバイスもこうしたデバイス/薬剤の複合的アプローチによって利するものである。組織又は器官の構造体及び機能を改善する機能を有するデバイスも、適当な薬剤と組み合わせた場合にやはり効果を示す。例えば、植え込まれるデバイスの安定性を高める整形外科用デバイスの骨結合(osteointegration)の改善は、デバイスを骨形成タンパク質などの薬剤と組み合わせることによって達成される可能性がある。同様に他の手術器具、縫合糸、ステープル、吻合デバイス、椎間板(vertebral disk)、骨ピン、縫合糸アンカー、止血バリア、クランプ、スクリュー、プレート、クリップ、血管インプラント、組織接着剤及びシーラント、組織足場、各種ドレッシング、骨代用材、管腔内デバイス及び血管支持具も、こうしたデバイス/薬剤の複合的アプローチを用いることで患者にとって利するところが大きい。血管周囲ラップは単独又は他の医療デバイスと組み合わせても特に効果的である。血管周囲ラップは治療部位に更なる薬剤を供給することが可能である。本質的に、任意の種類の医療デバイスを薬剤又は薬剤の組み合わせによって何らかの方法で被覆することが可能であり、これによりデバイス又は薬剤の単独の使用と比較して優れた治療効果が得られる。
【0024】
様々な医療デバイスに加えて、これらのデバイス上の被膜は:ビンカアルカロイド等の天然産物を含む抗増殖剤/有糸分裂阻害剤(即ち、ビンブラスチン、ビンクリスチン及びビノレルビン)、パクリタキセル、エピジポドフィルロトキシン(即ち、エトポシド、テニポシド)、抗生物質(ダクチノマイシン(アクチノマイシンD)ダウノルビシン、ドキソルビシン及びイダルビシン)、アントラサイクリン、ミトキサントロン、ブレオマイシン、プリカマイシン(ミトラマイシン)及びマイトマイシン、酵素(L−アスパラギンを全身で代謝し、それら自体のアスパラギン合成能力を有さない細胞を枯渇させるL−アスパラギナーゼ);G(GP)IIb/IIIa阻害剤及びビトロネクチン受容体拮抗薬等の抗血小板薬;窒素マスタード(メクロレタミン、シクロホスファミド及び類似体、メルファラン、クロラムブシル)、エチレンイミン及びメチルメラミン(ヘキサメチルメラミン及びチオテパ)、アルキルスルホネート−ブスルファン、ニトロソウレア(カルムスチン(BCNU)及び類似体、ストレプトゾシン)、トラゼンス−ダカルバジニン(trazenes - dacarbazinine)(DTIC)等の抗増殖剤/抗有糸分裂アルキル化剤(antimitotic alkylating agent);葉酸類似体(メトトレキサート)、ピリミジン類似体(フルオロウラシル、フロクスウリジン及びシタラビン)、プリン類似体及び関連した阻害剤(メルカプトプリン、チオグアニン、ペントスタチン及び2−クロロデオキシアデノシン{クラドリビン})等の抗増殖/抗有糸分裂代謝拮抗剤;白金配位錯体(シスプラチン、カルボプラチン)、プロカルバジン、ヒドロキシウレア、ミトタン、アミノグルテチミド;ホルモン(即ち、エストロゲン);抗凝固剤(ヘパリン、合成ヘパリン塩及びトロンビンの他の阻害剤);線維素溶解剤(例えば、組織プラスミノーゲン活性化因子、ストレプトキナーゼ及びウロキナーゼ等)、アスピリン、ジピリダモール、チクロピジン、クロピドグレル、アブシキシマブ;抗遊走剤;抗分泌剤(antisecretory)(ブレベルジン);副腎皮質ステロイド(コルチゾール、コルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、6a−メチルプレドニゾロン、トリアムシノロン、ベタメタゾン及びデキサメタゾン)、非ステロイド性薬剤(サリチル酸誘導体、即ちアスピリン:等の抗炎症剤;パラ−アミノフェノール誘導体、即ちアセトアミノフェン;インドール及びインデン酢酸(インドメタシン、スリンダク及びエトドラク)、ヘテロアリール酢酸(トルメチン、ジクロフェナク及びケトロラク)、アリールプロピオン酸(イブプロフェン及び誘導体)、アントラニル酸(メフェナム酸、及びメクロフェナム酸)、エノール酸(ピロキシカム、テノキシカム、フェニルブタゾン及びオキシフェンタトラゾン)、ナブメトン、金化合物(オーラノフィン、オーロチオグルコース、金チオリンゴ酸ナトリウム);免疫抑制剤:(シクロスポリン、タクロリムス(FK−506)、シロリムス(ラパマイシン)、アザチオプリン、ミコフェノール酸モフェチル);血管形成剤:血管内皮増殖因子(VEGF)、線維芽細胞増殖因子(FGF);アンジオテンシン受容体遮断薬;一酸化窒素ドナー;アンチセンスオリゴヌクレオチド及びそれらの組み合わせ;細胞周期阻害剤、mTOR阻害剤、並びに増殖因子受容体シグナル伝達キナーゼ阻害剤;レテノイド;サイクリン/CDK阻害剤;HMG補酵素レダクターゼ阻害剤(スタチン);並びにプロテアーゼ阻害剤を含む治療的及び薬学的薬剤の送達に使用することができる。
【0025】
前述したように、バルーン血管形成術に伴う冠動脈ステントの植え込みは、急性血管閉鎖の治療に非常に有効であり、再狭窄の危険を低減し得る。血管内超音波試験(Mintz et al.,1996)は、冠動脈ステント留置が血管収縮を効果的に予防し、またステントの植え込み後の後期管腔損失の殆どが、おそらく新生内膜過形成に関連したプラーク増殖によるものであることを示唆している。冠動脈ステント留置後の後期管腔損失は、従来型バルーン血管形成術後に観察される損失のほぼ2倍高い。このように、ステントが再狭窄プロセスのうちの少なくとも一部を防止するため、平滑筋細胞増殖を防止する、炎症を低減及び凝集を低減する、又は多数のメカニズムにより平滑筋細胞増殖を防止する、ステントと組み合わされて炎症を低減及び凝集を低減する薬物、薬剤又は化合物の組み合わせは、血管形成術後の再狭窄の最も効果的な治療を提供し得る。同一又は異なる薬物/薬物の組み合わせの局所送達と組み合わせた、薬物、薬剤又は化合物の全身使用も、有益な治療選択を提供し得る。
【0026】
ステントからの薬物/薬物の組み合わせの局所送達は、以下の利点を有する。即ち、ステントの足場作用を介した血管反跳及びリモデリングの予防、新生内膜過形成又は再狭窄の多数の構成成分の予防、並びに炎症及び血栓症の低減である。この薬物、薬剤又は化合物の、ステント留置された冠動脈への局所投与は、更なる治療的利益も有し得る。例えば、全身投与ではなく局所送達を用いると、薬物、薬剤又は化合物のより高い組織濃度が達成され得る。加えて、全身投与ではなく局所送達を用いると、より高い組織濃度を維持する一方、低減された全身毒性が達成され得る。また、全身投与ではなくステントからの局所送達を用いると、単一の手順により患者コンプライアンスをより満足し得る。組み合わせ薬物、薬剤及び/又は化合物療法の更なる利益は、治療的薬物、薬剤又は化合物のそれぞれの用量が低下されることにより、それらの毒性が制限される一方、尚、再狭窄、炎症及び血栓症の低下が達成されることであり得る。したがって、局所ステントベースの治療法は、抗再狭窄、抗炎症、抗血栓の薬物、薬剤又は化合物の治療的な比(有効性/毒性)を改善する手段である。
【0027】
経皮的冠動脈形成術後に使用し得る多数の異なるステントが存在する。本発明に従って任意数のステントを使用し得るが、簡略化のため、本発明の例示的な実施形態では、限定数のステントを記載する。当業者は、本発明に関連して任意数のステントを使用し得ることを認識するであろう。加えて、上述したように、他の医療デバイスを使用することもできる。
【0028】
ステントは通常、閉塞を解放するために、管の管腔内部に残された管状構造体として使用される。通常、ステントは非拡張形態で管腔内に挿入され、次いで自発的に拡張され、又は第2のデバイスの補助によりその場で拡張される。典型的な拡張方法は、カテーテルに装着された血管形成術用バルーンの使用を介して生じ、このバルーンは狭窄した血管又は身体通路内で膨張されて、血管の壁構成成分に関連した閉塞を剪断及び破壊し、拡大した管腔を得る。
【0029】
図1に、本発明の例示的な実施形態に従って使用し得る例示的なステント100を示す。拡張可能な円筒形のステント100は、血管、管又は管腔内に配置されて血管、管又は管腔の開放を保持するための、より詳細には動脈セグメントを血管形成術後の再狭窄から保護するための有窓の構造体を含む。ステント100は、周囲方向に拡張され、周囲方向又は径方向に剛性な拡張形態で維持され得る。ステント100は軸線方向に可撓性であり、バンドにて屈曲された場合、ステント100は任意の構成成分の部分が外部に突出するのを回避する。
【0030】
ステント100は一般に、第1の及び第2の末端部と、その間の中間部分とを含む。ステント100は長手方向軸線を有し、長手方向に配置された複数のバンド102を含み、各バンド102は、長手方向軸線に平行な線セグメントに沿って概ね連続する波を定めている。周囲方向に配置された複数の結合部104は、バンド102を実質的に管状構造体に維持する。本質的に、長手方向に配置された各バンド102は、周囲方向に配置された短い結合部104により、隣接するバンド102に複数の周期的位置にて接続されている。各バンド102に関連した波は、中間部分においてほぼ同一の基本空間頻度を有し、バンド102は、該バンドに関連した波が概ね整合されるように配置され、それにより波は互いに概ね同相である。図に示すように、長手方向に配置された各バンド102は、隣接するバンド102に対する結合部が存在する前に、ほぼ2周期を経て波状にうねる。
【0031】
ステント100は、任意数の方法を用いて製作することができる。例えば、ステント100は、レーザー、放電フライス加工、化学的エッチング又は他の手段を用いて機械加工されてもよい中空又は形成されたステンレス鋼管から製作することができる。ステント100は未拡張形態で身体内に挿入され、所望の部位に配置される。例示的な一実施形態では、拡張はバルーンカテーテルにより血管内で達成されてもよく、ステント100の最終直径は、使用されるバルーンカテーテルの直径の関数である。
【0032】
本発明によるステント100は、ニッケル及びチタン又はステンレス鋼の適切な合金等を含む、形状記憶合金で具体化し得ることを理解するべきである。ステンレス鋼から形成される構造体は、ステンレス鋼を所定の様式に構成することにより、例えば網目状に編むことにより自己拡張型に作製されてもよい。この実施形態では、ステント100の形成後、ステントは圧縮されて、好適なカテーテル又は可撓性のロッドを含む挿入手段による血管又は他の組織へのステントの挿入を可能にするよう十分に小さい空間を占めることができる。カテーテルから出現した際、ステント100は所望の形態に拡張するよう構成されてもよく、拡張は自動的であるか、又は圧力、温度若しくは電気刺激の変化により誘発される。
【0033】
図2に、図1に示したステント100を使用した本発明の例示的な実施形態を示す。図示するように、ステント100は、1つ以上のリザーバ106を含むよう変更されてもよい。各リザーバ106は、所望により開放又は閉鎖されてもよい。これらのリザーバ106は、送達するべき薬物/薬物の組み合わせを保持するよう特に設計されていてもよい。ステント100のデザインに関わらず、病変領域内に有効用量を提供するのに十分な特異性及び十分な濃度にて適用される薬物/薬物の組み合わせの用量を有することが好ましい。この点から、バンド102内のリザーバの寸法は、薬物/薬物の組み合わせの用量を所望の位置及び所望の量で十分に適用する寸法であることが好ましい。
【0034】
代替的な例示的実施形態では、ステント100の内面及び外面全体が、治療的用量の薬物/薬物の組み合わせで被覆されてもよい。以下に、再狭窄の治療用の薬物、及び例示的な被覆技術の詳細な説明を記載する。しかしながら、被覆技術は、薬物/薬物の組み合わせに応じて異なっていてもよいことに留意することが重要である。また、被覆技術は、ステント又は他の管腔内医療デバイスを構成する材料に応じて異なっていてもよい。
【0035】
ラパマイシンは、米国特許第3,929,992号に開示されているように、ストレプトマイセス・ハイグロスコピカス(Streptomyces hygroscopicus)により産生される大環状トリエン抗生物質である。とりわけラパマイシンは、インビボで血管平滑筋細胞の増殖を阻害することが見出されている。したがって、ラパマイシン(1種又は複数種)は、特に生物学的若しくは機械的に仲介される血管損傷後の哺乳動物における内膜平滑筋細胞過形成、再狭窄及び血管閉塞の治療に使用され、又はそのような血管損傷により哺乳動物が苦しむであろう条件下で使用され得る。ラパマイシンは、平滑筋細胞増殖を阻害するよう機能し、血管壁の再内皮化を妨害しない。
【0036】
ラパマイシンは、血管形成術により誘導された損傷の期間に放出される細胞増殖シグナルに応答した平滑筋増殖に拮抗することにより、血管過形成を低減する。細胞周期の後期G1期における増殖因子及びサイトカイン仲介による平滑筋増殖の阻害は、ラパマイシンの優勢な作用メカニズムであると思われる。しかしながら、ラパマイシンは、全身投与された際に、T細胞増殖及び分化を防止することも公知である。このことは、その免疫抑制活性、及びその移植片拒絶を防止する能力の基礎である。
【0037】
本明細書で使用されるように、ラパマイシンは、ラパマイシン、並びにFKBP12及び他のイムノフィリンに結合し、TOR阻害剤を含むラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及びコンジュゲートを含む。
【0038】
ラパマイシンの抗増殖効果は、全身使用を介して達成され得るが、優れた結果は、化合物の局所送達を介して達成され得る。本質的に、ラパマイシンは、化合物に近接する組織内で作用し、送達デバイスからの距離が増大するにつれその効果が減少する。この効果の利点を利用するために、ラパマイシンを管腔壁と直接接触させることが望まれるであろう。したがって、好ましい実施形態では、ラパマイシンはステント又はステントの一部の表面上に組み込まれる。基本的に、ラパマイシンは、図1に示したステント100内に、ステント100が管腔壁と接触する箇所にて組み込まれることが好ましい。
【0039】
ラパマイシンは、多数の方法でステント上に組み込まれ、又はステントに付着され得る。例示的な一実施形態において、ラパマイシンはポリマーマトリックス中に直接組み込まれ、ステントの外面上に噴霧される。ラパマイシンは時間と共にポリマーマトリックスから溶出し、周囲の組織に入り込む。ラパマイシンは、少なくとも3日間〜約6ヶ月間、より好ましくは7〜30日間、ステント上に残留することが好ましい。
【0040】
ラパマイシンの被膜は、浸漬、噴霧若しくは回転被覆方法、及び/又はこれらの方法の任意の組み合わせにより、ステント上に適用され得る。様々なポリマーを使用することができる。例えば、ポリ(エチレン−コ−ビニルアセテート)及びポリブチルメタクリレートのブレンドを使用することができる。他のポリマー、例えばフッ化ポリビニリデン−コ−ヘキサフルオロプロピレン及びポリエチルブチルメタクリレート−コ−ヘキシルメタクリレートも使用することができるが、これらに限定されない。バリア又は頂部被膜を適用して、ポリマーマトリックスからのラパマイシンの溶解を調節してもよい。
【0041】
上述したように、ステントは、様々な金属、ポリマー材料及びセラミック材料を含む任意数の材料から形成され得ることに留意することが重要である。したがって、様々な技術を使用して、様々な薬物、薬剤及び化合物の組み合わせをステント上に固定化し得る。詳細には、上述したポリマーマトリックスに加えて、バイオポリマーを使用してもよい。バイオポリマーは一般に天然ポリマーとして分類され得る一方、上述したポリマーは合成ポリマーとして記載され得る。使用し得る例示的なバイオポリマーは、アガロース、アルギネート、ゼラチン、コラーゲン及びエラスチンを含む。加えて、薬物、薬剤又は化合物は、例えば移植片及び多数のバルーン等、他の経皮送達医療デバイスと共に使用されてもよい。
【0042】
新生内膜過形成の大きさ及び持続時間を低減するよう作用する、公知の抗増殖剤であるラパマイシンの作用を担う分子事象は、尚解明中である。しかしながら、ラパマイシンは細胞に入り込み、FKBP12と称される高親和性の細胞質タンパク質に結合することが公知である。ラパマイシンとFKPB12との複合体は、次に「ラパマイシンの哺乳動物標的(mammalian Target of Rapamycin)」又はTORと称されるホスホイノシチド(Pl)−3キナーゼに結合し、ホスホイノシチド(Pl)−3キナーゼを阻害する。TORは、平滑筋細胞及びTリンパ球内でのマイトジェン(mitogenic)増殖因子及びサイトカインに関連した下流シグナリング事象を仲介する、キーとなる役割を果たすタンパク質キナーゼである。これらの事象には、p27のリン酸化、p70 s6キナーゼのリン酸化、及び、タンパク質翻訳の重要な制御因子である4BP−1のリン酸化が含まれる。
【0043】
ラパマイシンが新生内膜過形成を抑制することにより再狭窄を低減することは認識されている。しかしながら、ラパマイシンが再狭窄の他の主な構成成分、即ち負のリモデリングも抑制し得る証拠が存在する。リモデリングは、そのメカニズムが明白に理解されていないが、時間と共に、一般にヒトでほぼ3〜6ヶ月間の期間で外弾性板の収縮と、管腔面積の縮小とをもたらすプロセスである。
【0044】
負のリモデリング又は狭窄血管リモデリングは、病変部位におけるパーセント直径狭窄として血管造影法により定量することができ、ここでプロセスを妨害するステントは全く存在しない。後期管腔損失が病変内で消滅した場合、負のリモデリングが抑制されていることを推測し得る。リモデリングの程度を決定する他の方法は、血管内超音波(IVUS)を使用して、病変内外弾性板領域を測定することを含む。血管内超音波は、外弾性板と血管腔とを画像化することができる技術である。処置後の時点から4ヶ月及び12ヶ月の経過観察の、ステント近位及び遠位における外弾性板の変化は、リモデリング変化を反映する。
【0045】
ラパマイシンがリモデリングに影響を及ぼす証拠は、ラパマイシン被覆ステントが非常に低い程度の病変内及びステント内再狭窄を示したヒトインプラント研究に由来する。病変内パラメータは、通常、ステントの両側の約5ミリメートル、即ち近位及び遠位で測定される。ステントは、尚バルーン拡張の影響を受けるこれらのゾーン内のリモデリングを制御するよう存在しないため、ラパマイシンが血管リモデリングを予防することが推測され得る。
【0046】
下記の表1のデータは、ラパマイシン処理グループにおいて、病変内パーセント直径狭窄が12ヶ月後でも低いままであることを示す。したがって、これらの結果は、ラパマイシンがリモデリングを低減するという仮説を支持する。
【表1】

【0047】
ラパマイシンによる負のリモデリングの低減を支持する更なる証拠は、下記の表2に示すファースト・イン・ヒューマン(first-in-man)臨床プログラムから得られた血管内超音波データに由来する。
【表2】

【0048】
データは、近位又は遠位で血管面積の最小損失が存在することを示し、このことはラパマイシン被覆ステントで治療した血管内で、負のリモデリングの抑制が生じたことを示す。
【0049】
ステント自体を除けば、血管リモデリングの問題に対する有効な解決法は全く存在しなかった。したがって、ラパマイシンは、血管リモデリング現象を制御する生物学的アプローチを提示し得る。
【0050】
ラパマイシンがいくつかの方法で作用して負のリモデリングを低減すると仮定することができる。ラパマイシンは、損傷に応答した血管壁内での線維芽細胞の増殖を特異的に遮断することにより、血管瘢痕組織の形成を低減し得る。ラパマイシンは、コラーゲン形成又は代謝に関与するキーとなるタンパク質の翻訳にも影響し得る。
【0051】
好ましい実施形態において、ラパマイシンは、再狭窄を低減又は予防する手段として局所送達デバイスにより送達されて、バルーン血管形成術後の動脈セグメントの負のリモデリングを制御する。任意の送達デバイスを使用することができるが、送達デバイスは、ラパマイシンを溶出又は放出する被膜又はシースを含むステントを含むことが好ましい。それらのデバイスのための送達システムは、ラパマイシンを管理者により制御される速度で送達する局所注入カテーテルを含んでもよい。別の実施形態では、注射針を使用し得る。
【0052】
またラパマイシンを経口剤形又は慢性注射デポー形態若しくはパッチを使用して全身に送達し、ラパマイシンを約7〜45日の範囲の期間送達して、負のリモデリングを抑制するのに十分な血管組織レベルを達成してもよい。そのような治療は、ステントを用いた又は用いない選択的血管形成術(elective angioplasty)に先だって数日間投与される場合、再狭窄を低減又は予防するよう使用されるべきである。
【0053】
ブタ及びウサギモデルにて生成されたデータは、表3に示すように、ラパマイシンの耐食性ポリマーステント被膜から血管壁内への用量範囲(35〜430μg/15〜18mm冠動脈ステント)での放出が、新生内膜過形成のピーク50〜55パーセント低下を生じたことを示している。約28〜30日にて最大であるこの低下は、一般に、下記の表4に示すように、ブタモデルにて90〜180日の範囲内で持続されない。
【表3−1】

【表3−2】

1ステント名称:EVA/BMA 1X、2X及び3Xは、それぞれ約500μg、1000μg及び1500μgの全質量(ポリマー+薬物)を意味する。TC、頂部皮膜30μg、100μg又は300mgの薬物フリーBMA;二相;100μgの薬物フリーBMA層により分離されたEVA/BMA中ラパマイシンの2×1X層。2ステント植え込み前の負荷用量0.5μg/kg/d×3dにより先行された0.25μg/kg/d×14d。
*p<0.05EVA/BMA対照から。**p<0.05金属から;
#炎症スコア:(0=本質的に内膜関与なし;1=<25%内膜関与;2=≧25%内膜関与;3=>50%内膜関与)
【表4】

【0054】
耐食性ポリマーステント被膜からのラパマイシンのヒト血管壁内への放出は、ステント内での新生内膜過形成の低減の大きさ及び持続時間に関して、上記に示した動物の血管壁と比較して優れた結果を提供する。
【0055】
上述したものと同一のポリマーマトリックスを使用して、動物モデルで研究されたものと同一の用量範囲のラパマイシンを含有するラパマイシン被覆ステントを植え込まれたヒトは、新生内膜の低減の大きさ及び持続時間に基づき、動物モデルで観察されたものと比較してかなり大きい新生内膜過形成の低減を示す。血管造影法及び血管内超音波測定の両方を使用した、ラパマイシンに対するヒト臨床応答は、本質的に、ステント内部での新生内膜過形成の全消滅を示す。これらの結果は、下記の表5に示すように、少なくとも1年持続される。
【表5】

QCA=定量的冠動脈血管造影
SD=標準偏差
IVUS=血管内超音波
【0056】
ラパマイシンは、ステントから送達された際、少なくとも1年持続するステント内新生内膜過形成の大きな低減をもたらすことにより、ヒト内で予想外の利益を生じる。ヒトでのこの利益の大きさ及び持続時間は、動物モデルデータから予想されない。この状況で使用されるラパマイシンは、ラパマイシン、並びにFKBP12に結合し、ラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及び同類物を含む。
【0057】
これらの結果は、多数の因子によるものであり得る。例えば、ヒトでのラパマイシンのより高い効果は、血管形成術の動物モデルの病態生理学と比較してヒト血管病変の病態生理学に対するその作用機構(1つ又は複数)の感受性が高いことによる。加えて、ステントに適用される用量と、薬物放出を制御するポリマー被膜との組み合わせが薬物の効果に重要である。
【0058】
上述したように、ラパマイシンは、血管形成術損傷の期間に放出される細胞増殖シグナルに応答した平滑筋増殖に拮抗することにより、血管過形成を低減する。また、ラパマイシンは、全身投与された際に、T細胞の増殖及び分化を防止することが公知である。ラパマイシンは、持続された期間(約2〜6週間)、ステントから低用量で投与された際に、血管壁内で局所炎症効果を与えることも測定されている。局所抗炎症の利益は顕著であり、予想外である。平滑筋抗増殖効果と組み合わせて、このラパマイシンの二重の作用モードは、その並外れた有効性を担い得る。
【0059】
したがって、局所デバイスプラットホームから送達されるラパマイシンが、抗炎症効果と平滑筋抗増殖効果との組み合わせにより、新生内膜過形成を低減する。この状況で使用されるラパマイシンは、ラパマイシン、並びにFKBP12に結合し、ラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及び同類物を意味する。局所デバイスプラットホームは、ステント被膜、ステントシース、移植片及び局所薬物注入カテーテル若しくは多孔質バルーン、又は薬物、薬剤若しくは化合物のその場での、若しくは局所送達のための任意の他の好適な手段を含む。
【0060】
ラパマイシンの抗炎症効果は、ステントから送達されたラパマイシンがステントから送達されたデキサメタゾンと比較された、表6に示す実験からのデータにて明らかである。強力なステロイド性抗炎症薬剤であるデキサメタゾンは、参照基準として使用された。デキサメタゾンは炎症スコアを低下できるが、ラパマイシンは、炎症スコアの低下においてデキサメタゾンより遙かに効果的であった。加えて、ラパマイシンはデキサメタゾンとは異なり、新生内膜過形成を有意に低減する。
【表6】

*=有意水準P<0.05
【0061】
ラパマイシンは、ステントから送達された際に、血管組織内のサイトカインレベルを低減することも見出されている。図1のデータは、ラパマイシンが血管壁内の単球走化性タンパク質(MCP−1)レベルの低減に高い効果を有することを示す。MCP−1は、血管損傷中に生産される炎症性/走化性サイトカインの一例である。MCP−1の低下は、炎症性メディエータの発現の低減と、ステントから局所的に送達されるラパマイシンの抗炎症効果に対する寄与とにおけるラパマイシンの有益な効果を示す。損傷に応答した血管炎症は、新生内膜過形成の発達に対する主な貢献物であることが認識されている。
【0062】
ラパマイシンは、局所炎症事象を阻害することが示され得るため、このことが新生内膜阻害におけるラパマイシンの予想外の優位性を説明し得ると思われる。
【0063】
上記に示したように、ラパマイシンは、T細胞増殖の防止、負のリモデリングの阻害、炎症の低減及び平滑筋細胞増殖の防止等の所望の効果を生成するよう多数の水準にて機能する。これらの機能の正確なメカニズムは完全には分かっていないが、確認されたメカニズムを発展させることができる。
【0064】
ラパマイシンを使用した研究は、細胞周期の遮断による平滑筋細胞増殖の防止が、新生内膜過形成の低減に有効な戦略であることを示唆している。後期管腔損失及び新生内膜プラーク容積の劇的かつ持続的な低下が、ステントから局所的に送達されるラパマイシンを受容している患者に観察されている。本発明は、ラパマイシンのメカニズムを、毒性を生成することなく細胞周期を阻害し、新生内膜過形成を低減する追加のアプローチを含むように発展させる。
【0065】
細胞周期は、細胞複製のプロセスを調整する、厳重に制御された生化学的な事象カスケードである。細胞が適切な増殖因子により刺激されると、細胞は細胞周期のG0(静止状態)からG1期へ移動する。DNA複製(S期)に先だったG1期における細胞周期の選択的阻害は、細胞周期の後期に、即ちS期、G2期又はM期に作用する治療薬(therapeutics)と比較した場合、抗増殖効果を保持すると共に細胞を保存及び生存させる治療的利点を提供することができる。
【0066】
したがって、血管及び身体内の他の導血管内での内膜過形成の予防は、細胞周期のG1期に選択的に作用する細胞周期阻害剤を使用して達成することができる。これらの細胞周期のG1期の阻害剤は、小分子、ペプチド、タンパク質、オリゴヌクレオチド又はDNA配列であってもよい。より詳細には、これらの薬物又は薬剤は、G1期を通した細胞周期の進行に関与したサイクリン依存性キナーゼ(cdk)、特にcdk2及びcdk4の阻害剤を含む。
【0067】
細胞周期のG1期に選択的に作用する薬物、薬剤又は化合物の例は、フラボピリドール及びその構造的類似体等の小分子を含み、該小分子は、サイクリン依存性キナーゼの拮抗作用により後期G1期における細胞周期を阻害することが見出されている。サイクリン依存性キナーゼを選択的に阻害する、時折P27kip1として参照され、P27と呼ばれる内在性キナーゼ阻害タンパク質kip、を上昇させる治療薬を使用することができる。この治療薬は、遺伝子をトランスフェクトしてP27を生成し得る遺伝子ベクターを含む、P27の分解を遮断し又はP27の細胞生産を向上させる小分子、ペプチド及びタンパク質を含む。タンパク質キナーゼの阻害により細胞周期を遮断するスタウロスポリン及び関連した小分子を使用することができる。タンパク質キナーゼを選択的に阻害して、PDGF及びFGF等の広い範囲の増殖因子に応答した平滑筋内のシグナル伝達に拮抗する、チロホスチンのクラスを含むタンパク質キナーゼ阻害剤も使用することができる。
【0068】
上述した任意の薬物、薬剤又は化合物は、全身に、例えば経口、静脈内、筋内、皮下、経鼻若しくは皮内投与され、又は例えばステント被膜、ステント覆い若しくは局所送達カテーテルにより局所投与され得る。加えて、上述した薬物又は薬剤は、3日間〜8週間の範囲の期間、薬物又は薬剤の標的組織との接触を維持する目的で、急速放出又は遅延放出用に処方されてもよい。
【0069】
上述したように、ラパマイシンとFKPB12との複合体は「ラパマイシンの哺乳動物標的」又はTORと称されるホスホイノシチド(PI)−3キナーゼに結合し、ホスホイノシチド(PI)−3キナーゼを阻害する。活性部位阻害剤、又はアロステリックモジュレータ、即ちアロステリックに調節する間接的な阻害剤のいずれかとして機能する、TORの触媒活性の拮抗薬は、ラパマイシンの作用を模倣するが、FKBP12に関する要求を迂回するであろう。TORの直接阻害剤の潜在的な利点は、より良好な組織浸透と、より良好な物理的/化学的安定性とを含む。また、他の潜在的な利点は、異なる組織内に存在し得るTORの多数のイソ型の1つに対する拮抗薬の特異性と、薬物のより高い効果及び/又は安全性をもたらす、下流効果の潜在的に異なる範囲とに起因する、作用の、より高い選択性及び特異性を含む。
【0070】
阻害剤は、合成又は天然由来の生成物のいずれかである小有機分子(概算mw<1000)であってもよい。ワートマニン(Wortmanin)は、このクラスのタンパク質の機能を阻害する薬剤であり得る。阻害剤は、ペプチド又はオリゴヌクレオチド配列でもあり得る。阻害剤は、全身に(経口、静脈内、筋内、皮下、経鼻、若しくは皮内)又は局所的に(ステント被膜、ステント覆い、局所薬物送達カテーテル)投与されてもよい。例えば、阻害剤は、耐食性ポリマーステント被膜からヒトの血管壁内へ放出されてもよい。加えて、阻害剤は、3日間〜8週間の範囲の期間、ラパマイシン又は他の薬物、薬剤若しくは化合物の標的組織との接触を維持する目的で、急速放出又は遅延放出用に処方されてもよい。
【0071】
前述したように、バルーン血管形成術に伴う冠動脈ステントの植え込みは、急性血管閉鎖の治療に非常に有効であり、再狭窄の危険を低減し得る。血管内超音波試験(Mintz et al.,1996)は、冠動脈ステント留置が血管収縮を効果的に予防し、またステント植え込み後の後期管腔損失の殆どが、おそらく新生内膜過形成に関連したプラーク増殖によるものであることを示唆している。冠動脈ステント留置後の後期管腔損失は、従来型バルーン血管形成術後に観察される損失のほぼ2倍高い。このように、ステントが再狭窄プロセスのうちのなくとも一部を防止するため、炎症及び増殖を予防する、又は多数のメカニズムにより増殖を防止する、薬物、薬剤又は化合物の使用は、ステントと組み合わせて血管形成術後の再狭窄に最も効果的な治療を提供することができる。
【0072】
更に、ステント等のラパマイシン溶出血管デバイスを受容しているインスリン補充糖尿病患者は、該患者の正常な又は非インスリン補充糖尿病相対者よりも高い再狭窄の発生率を示し得る。したがって、薬物の組み合わせは有益であり得る。
【0073】
ステントからの薬物、薬剤又は化合物の局所送達は、以下の利点を有する。即ち、ステント及び薬物、薬剤又は化合物の足場作用を介した血管反跳及びリモデリングの予防、並びに新生内膜過形成の多数の構成成分の予防である。この薬物、薬剤又は化合物の、ステント留置された冠動脈への局所投与は、更なる治療的利益も有し得る。例えば、全身投与にて生じるであろう組織濃度よりも高い組織濃度、全身毒性の低減、並びに単一治療及び投与の容易さが達成できるであろう。薬物療法の更なる利益は、再狭窄の低減を尚達成する一方で治療的化合物の用量が低下し、それによりそれらの毒性が制限されることであり得る。
【0074】
尚別の代替的な例示的実施形態では、ラパマイシンはシロスタゾールと組み合わせて使用され得る。シロスタゾール{6[4−(1−シクロヘキシル−1H−テトラゾール−5−イル)−ブトキシ]−3,4−ジヒドロ−2−(1H)−キノリノン}は、タイプIII(環状GMP阻害)ホスホジエステラーゼの阻害剤であり、抗血小板及び血管拡張特性を有する。シロスタゾールは、元は、環状ヌクレオチドホスホジエステラーゼ3の選択的阻害剤として開発された。血小板及び血管平滑筋細胞内のホスホジエステラーゼ3の阻害は、抗血小板効果及び血管拡張を提供することが期待された。しかしながら、最近の前臨床試験では、シロスタゾールが様々な細胞によるアデノシン取り込みを阻害する能力も有することが証明されており、この性質はシロスタゾールをミルリノン等の他のホスホジエステラーゼ3阻害剤から区別している。したがって、シロスタゾールは、多数の新規な作用メカニズムに基づく独特な抗血栓及び血管拡張特性を有することが示されている。このクラスの他の薬物は、ミルリノン、ベスナリノン(vesnarionone)、エノキシモン、ピモベンダン及びメリベンダンを含む。
【0075】
研究により、ステント植え込み後の再狭窄を低減するシロスタゾールの有効性も示されている。例えば、Matsutani M.,Ueda H.et al.:「Effect of cilostazol in preventing restenosis after percutaneous transluminal coronary angioplastyy)、Am.J.Cardiol Cardiol 1997,79:1097〜1099、Kunishima T.,Musha H.,Eto F.,et al.:A randomized trial of aspirin versus cilostazol therapy after successful coronary stent implantation,Clin Thor 1997,19:1058〜1066、及びTsuchikane E.,Fukuhara A.,Kobayashi T.,et al.:Impact of cilostazol on restenosis after percutaneous coronary balloon angioplasty,Circulation 1999,100:21〜26を参照されたい。
【0076】
本発明によれば、シロスタゾールは、医療デバイス又は医療デバイス被膜からの持続放出用に構成されて、医療デバイスの表面上の血小板沈着及び血栓形成の低減を助けてもよい。本明細書に記載するように、そのような医療デバイスは、例えば心血管、末梢及び頭蓋内ステント等の、血液と定常的に接触する任意の短期及び長期インプラントを含む。場合により、シロスタゾールは、ラパマイシン又は他の強力な抗再狭窄剤と組み合わせて適切なポリマー被膜又はマトリックス中に組み込まれてもよい。
【0077】
シロスタゾールの医療デバイス又は医療デバイス被膜への組み込み及び続く医療デバイス又は医療デバイス被膜からの持続放出は、医療デバイス表面上の血小板沈着及び血栓形成を低減することが好ましいであろう。上記に記載したように、シロスタゾールは、その血管拡張作用に一部起因して、抗再狭窄効果も有することを示す前臨床及び臨床的証拠が存在する。したがって、シロスタゾールは薬物溶出ステント等の血液接触デバイスのうちの少なくとも2つの局面に有効である。したがって、シロスタゾールと、シロリムス、その類似体、誘導体、同類物及びコンジュゲート、又はパクリトキセル(paclitoxel)、その類似体、誘導体、同類物及びコンジュゲート等のラパマイシンを含む他の強力な抗再狭窄剤の1種との組み合わせは、心血管疾患の局所治療、並びに医療デバイスの表面上の血小板沈着及び血栓形成の低減に使用することができる。ステントに関して記載したが、この例示的な実施形態に関して記載した薬物の組み合わせは、そのいくつかが本明細書に記載されている任意数の医療デバイスに関連して使用し得ることに留意することが重要である。
【0078】
図3に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第1の例示的な形態を示す。この例示的な実施形態では、ステントは、コーディス社(Cordis Corporation)から入手可能なBx Velocity(登録商標)ステントである。この特定の形態において、ステント7500は、3つの層で被覆されている。第1の層、即ち内側層7502は、内側層7502の総重量の45重量パーセントと等価である180(μg)マイクログラムのシロリムスと、内側層7502の総重量の55重量パーセントと等価であるポリエチレン−コ−ビニルアセテート及びポリブチルメタクリレート、EVA/BMAのコポリマーマトリックスとを含有する。第2の層、即ち外側層7504は、外側層7504の総重量の45重量パーセントと等価である100(μg)マイクログラムのシロスタゾールと、外側層7504の総重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第3の層、即ち拡散オーバーコート7506は、200(μg)マイクログラムのBMAを含有する。含有量回復の範囲は、シロリムスに関して公称薬物含有量の85パーセント、シロスタゾールに関して公称薬物含有量の98パーセントであった。シロスタゾールとシロリムスの両方に関するインビトロでの放出動力学を図4に示し、次により詳細に記載する。
【0079】
図5に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第2の例示的な形態を示す。上述したように、ステントは、コーディス社(Cordis Corporation)から入手可能なBx Velocity(登録商標)ステントである。この例示的な実施形態において、ステント7700は、3つの層で被覆されている。第1の層、即ち内側層7702は、内側層7702の総重量の45重量パーセントと等価である180(μg)マイクログラムのシロリムスと、内側層7702の総重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第2の層、即ち外側層7704は、外側層7704の総重量の45パーセントと等価である100(μg)マイクログラムのシロスタゾールと、外側層7704の重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第三の層、即ち拡散オーバーコート7706は、100(μg)マイクログラムのBMAを含有する。再度、含有量回収の範囲は、シロリムスに関して公称薬物含有量の85パーセント、シロスタゾールに関して公称薬物含有量の98パーセントであった。シロスタゾールとシロリムスの両方に関するインビトロでの放出動力学を図6に示し、次により詳細に記載する。
【0080】
図4と図6との比較から容易に理解し得るように、シロリムスとシロスタゾールの両方の薬物放出速度は、より厚いBMA、即ち100マイクログラムではなく200マイクログラムの拡散オーバーコートを含む形態にて比較的遅い。したがって、本明細書により完全に記載するように、拡散オーバーコートの選択的使用により、両方の薬物に関する薬物溶出速度の追加の制御を達成することができる。拡散オーバーコートの選択的な使用は、厚さ、及び化学的不適合を含む他の特徴を含む。
【0081】
図7に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第3の例示的な形態を示す。この形態は、図3の形態と同一の構造体であるが、シロスタゾールの量が、50(μg)マイクログラムに低下されている。以前の例示的な実施形態と同様、ステント7900と、3つの追加の層7902、層7904及び層7906が存在する。しかしながら、重量の百分率は同一のままである。
【0082】
図8に、上述した3つの形態の抗血栓効果を示す。図8は、インビトロでのウシ血液ループモデル(bovine blood loop model)での上述したシロリムス/シロスタゾールの組み合わせ被膜の抗血栓特性を示す。インビトロでのウシ血液ループモデルでは、新鮮なウシ血液にヘパリンが添加されて急性凝固時間(ACT)が約200秒に調整される。血液中の血小板含有量を、インジウム111の使用により標識する。この研究では、血液循環の閉ループシステムの一部であるシリコーン管内にステントを留置する。循環ポンプを用いて、ヘパリン添加血液を、閉ループシステムを通して循環させる。時間と共にステント表面上に凝血及び血栓が蓄積し、ステント留置ループを通した血液の流量が低下する。流量は、開始値の50パーセント迄低下した時、又は試験ステントのいずれも流量を50パーセントだけ低下させない場合90分後に、停止される。ステント表面上の総放射能(111内)をβカウンターにより計数し、チャート内で100パーセントに設定した対照ユニットにより正規化する。より小さい数は、表面の血栓形成がより低いことを示す。全3種のシロリムス/シロスタゾール二薬被膜群は、ステント表面上の血小板沈着と血栓形成とを、追加のシロスタゾール化合物なしで、対照薬物溶出ステントと比較して90パーセントを超えて低減した。棒グラフ8002は、100パーセントに正規化された対照薬物溶出ステントを表す。対照薬物溶出ステントは、コーディス社から入手可能なCypher(登録商標)シロリムス溶出冠動脈ステントである。棒グラフ8004は、ヘパリンで被覆されたステントであり、コーディス社から、Bx Velocity(登録商標)冠動脈ステント商標上のHEPACOAT(登録商標)で入手可能である。棒グラフ8006は、図3に示す構造に関連して示されるよう構成されたステントである。棒グラフ8008は、図5に示す構造に関連して示されるよう構成されたステントである。棒グラフ8010は、図7に示す構造に関連して示されるよう構成されたステントである。図8から容易に理解し得るように、シロスタゾールは血栓形成を有意に低減する。
【0083】
シロスタゾールで被覆されたデバイスの血栓抵抗性の能力に関する他の臨床パラメータは、被膜からの薬物放出の持続時間である。これは、デバイス植え込みから2週間後に特に有意である。二薬溶出被膜のブタ薬物溶出PK研究において、シロスタゾール及びシロリムスの両方が被膜から遅延放出され、持続薬物放出プロファイルが得られた。ブタPK研究の目的は、所定の植え込み時間における薬物溶出ステントの局所薬物動態の評価である。通常、ブタの3つの異なる冠動脈内に、所定の時点で3つのステントが植え込まれ、その後薬物回収分析のために回収される。ステントは、所定の時点で、即ち1、3及び8日目に回収される。ステントが抽出され、ステント上に残留する総薬物量は、HPLC(高速液体クロマトグラフィー)を用いて総薬物量に関して分析することにより決定される。ステント上の元の薬物量と、所定の時間に回収された薬物量との間の差異は、その期間に放出された薬物量を表す。周囲の動脈組織内への薬物の連続放出は、冠動脈内の新生内膜増殖と再狭窄を防止するものである。正規プロットは、全薬物放出の百分率(%、y軸)対植え込みの時間(日、x軸)を表す。図9に示すように、植え込みから8日後、2種の薬物の約80パーセント(80%)が薬物被膜中に残留していた。加えて、それぞれのlogP値及び水溶性が比較的大きい差を有するにも関わらず、両方の薬物は同様の速度で放出されていた。曲線8102はシロスタゾールを表し、曲線8104はシロリムスを表す。それらのそれぞれのインビトロでの放出プロファイルを、図10に示す。インビボでの放出プロファイルと同様、正方形で表すシロリムスと菱形で表すシロスタゾールとの両方が比較的ゆっくりと放出され、両方の薬物から約35パーセントのみ放出された。図9及び図10は、それぞれ、図11の形態に従って被覆されたステントからのインビボ及びインビトロでの放出速度を表し、ここでシロリムス及びシロスタゾールは2つの別個の層ではなく、単一の層である。この例示的な形態において、ステント8300は、2つの層で被覆されている。第1の層8302は、シロリムス、シロスタゾールの組み合わせ及びEVA/BMAのコポリマーマトリックスを含有する。第2の層、即ち拡散オーバーコート8304は、BMAのみを含む。より詳細には、この実施形態において、第1の層8302は第1の層8302の総重量の45重量パーセントを占めるシロリムスとシロスタゾールとの組み合わせと、第1の層8302の総重量の55パーセントを占めるEVA/BMAコポリマーマトリックスとを含有する。拡散オーバーコートは、100(μg)マイクログラムのBMAを含有する。
【0084】
図12及び図13は、それぞれ、図3の形態に従って被覆されたステントからのインビボ及びインビトロでの放出速度を表す。層状の二薬溶出被膜は、図12と図9との比較から容易に理解し得るように、同一のブタPKモデルにおいて、二薬ベースの被膜と比較してより速い放出速度を有した。図12にて、曲線8402はシロスタゾールを表し、曲線8404はシロリムスを表す。しかしながら、両方の薬物の放出の百分率は、各時点で類似している。それぞれのインビトロでの放出速度プロファイルを図12に示し、ここで菱形はシロスタゾールを表し、正方形はシロリムスを表す。二薬ベースの被膜と比較して、両方の薬物は遙かに速い速度で放出され、インビボでのPK研究に示された速い放出プロファイルを反映している。したがって、単一層中の薬物の組み合わせにより、より高い程度の溶出速度の制御がもたらされる。
【0085】
シロリムス等のラパマイシンとシロスタゾールとの組み合わせは、上述したように、いずれかの薬物単独と比較して、平滑筋細胞増殖及び遊走の低減においてより有効であり得る。加えて、本明細書に示すように、組み合わせ被膜からのシロスタゾールの放出は持続様式で制御されて、ステント表面又は他の血液接触医療デバイスの表面上の延長された抗血小板沈着及び血栓形成を達成することができる。組み合わせ被膜中のシロスタゾールは、シロリムスと共に単一の層で、又はシロリムス含有層の外部の別個の層中に組み込まれてもよい。その比較的低い水溶性により、シロスタゾールは、ステント又は他の医療デバイスの留置後、身体内で被膜中に比較的長時間維持される可能性がある。内側層中のシロリムスと比較すると比較的遅いインビトロでの溶出は、そのような可能性を示唆する。シロスタゾールは、安定で、通常の有機溶媒に可溶であり、本明細書に記載する様々な皮膜技術と類似する。シロリムス及びシロスタゾールの両方が、非吸収性ポリマーマトリックス又は吸収性マトリックス中に組み込めることに留意することも重要である。
【0086】
図14は、拡張可能な医療デバイスにより組織に送達される有益な薬剤を含有する複数の孔を有する、代替の例示的な拡張可能な医療デバイスを示す。図14に示す拡張可能な医療デバイス9900は、材料の管から切られて、円筒形の拡張可能なデバイスが形成される。拡張可能な医療デバイス9900は、複数の架橋要素9904により相互接続された複数の円筒部分9902を含む。架橋要素9904は、脈管の曲がりくねった経路を留置部位まで通過する際に、組織支持デバイスが軸方向に屈曲することを可能にし、また支持される管腔の屈曲に一致する必要がある場合、デバイスが軸方向に屈曲することを可能にする。各円筒管9902は、延性ヒンジ9910及び周囲方向ストラット9912により相互接続された細長いストラット9908のネットワークにより形成される。医療デバイス9900の拡張中、延性ヒンジ9910は変形するが、ストラット9908は変形されない。拡張可能な医療デバイスの一例の更なる詳細は、その全体が参照により本明細書に組み込まれる米国特許第6,241,762号に記載されている。
【0087】
図14に示すように、細長いストラット9908及び周囲方向ストラット9912は開口部9914を含み、開口部の数個は、内部に拡張可能な医療デバイスが植え込まれた管腔に送達するための有益な薬剤を収容する。加えて、図18に関連して下記に説明するように、架橋要素9904等のデバイス9900の他の部分は、開口部を含んでもよい。好ましくは、開口部9914は、ストラット9908等のデバイス9900の非変形部分に提供され、それ故、デバイスの拡張中に開口部が変形されず、有益な薬剤は破砕、排出、又は別様に損傷される危険性なしで送達される。有益な薬剤を開口部9914内に負荷し得る方法の一例の更なる説明は、その全体が参照により本明細書に組み込まれる2001年9月7日出願の米国特許出願第09/948,987号に記載されている。
【0088】
図示した本発明の例示的な実施形態は、有限要素解析(Finite Element Analysis)及び他の技術により更に洗練されて、開口部9914内の有益な薬剤の留置を最適化してもよい。基本的に、開口部9914の形状及び位置は、空隙の容積を最大にすると共に、延性ヒンジ9910に関連したストラットの比較的高い強度及び剛性を保持するように変更されてもよい。本発明の一つの好ましい例示的な実施形態によれば、開口部は、少なくとも3.2E−5cm2(5×10−6平方インチ)、好ましくは少なくとも4.5E−5cm2(7×10−6平方インチ)の面積を有する。一般に、開口部は、約50%〜約95%だけ有益な薬剤で充填される。
【0089】
本明細書に記載される本発明の様々な例示的な実施形態は、拡張可能なデバイス内の異なる開口部内に異なる有益な薬剤を提供し、又は数個の開口部内に有益な薬剤を提供して他には提供しない。別の実施形態では、有益な薬剤又は治療薬の組み合わせは、単一の開口部内で使用されてもよい。拡張可能な医療デバイスの特定の構造体は、本発明の趣旨から逸脱せずに変更することができる。各開口部が独立して充填されるので、各開口部における有益な薬剤に別々の化学組成及び薬物動態学特性を付与することができる。
【0090】
拡張可能な医療デバイス内の異なる開口部内に異なる有益な薬剤を使用すること、又は一部の開口部内にはあるが他の開口部内にはない有益な薬剤の使用の一例は、縁効果再狭窄の対処におけるものである。上記に説明したように、現世代の被覆ステントは、ステント縁を丁度越えた箇所で生じ、ステントの周囲及び管腔空間内に進行する縁効果再狭窄又は再狭窄による問題を有し得る。
【0091】
第一世代の薬物送達ステントにおける縁効果再狭窄の原因は、現在よく理解されていない。血管形成術及び/又はステント植え込みによる組織損傷領域が、パクリタキセル及びラパマイシン等の現世代の有益な薬剤の拡散範囲を超えて拡大し、これが組織内で強く仕切る傾向を有するためであり得る。同様の現象が放射線療法に観察されており、この療法にてステントの縁における低線量の放射線が、損傷の存在下で刺激性を有することが証明されている。この場合、無傷の組織が照射されるまで、より長い長さに亘り放射することが、問題を解決した。薬物送達ステントの場合、より高い用量若しくはより高い濃度の有益な薬剤をステント縁に沿って配置し、より容易に組織を通して拡散する異なる薬剤をステント縁に配置し、又は異なる有益な薬剤若しくは有益な薬剤の組み合わせをデバイスの縁に配置することは、縁効果再狭窄の問題を改善する助けとなり得る。
【0092】
図14に、縁効果再狭窄を治療及び低減するために「ホットエンド」又は有益な薬剤がデバイスの末端部の開口部9914a内に提供された拡張可能な医療デバイス9900を示す。デバイスの中心部分内のその他の開口部9914bは、空(図示するように)であっても、又はより低い濃度の有益な薬剤を含んでいてもよい。
【0093】
縁効果再狭窄の他の機構は、特定の薬物又は薬物の組み合わせの細胞毒性に関するものであり得る。そのような機構は、上皮瘢痕組織形成にて見られるものと同様の組織の物理的又は機械的収縮を含んでもよく、ステントはそれ自体の境界内で収縮反応を防止し得るが、その縁を越えては防止しない。更に、再狭窄のこの後者の形態の機構は、薬物自体がもはや壁内に存在しなくなった後でも発生する動脈壁に対する持続又は局所薬物送達の後遺症に関連している場合がある。即ち、再狭窄は、薬物及び/又は薬物担体に関連した有害な損傷の形態に対する反応であり得る。この状況下で、デバイスの縁から所定の薬剤を排除することは有益であり得る。
【0094】
図15は、デバイスの中心部分内の開口部10230bが有益な薬剤で充填され、デバイスの縁の開口部10230aが空のままである、複数の開口部10230を有する拡張可能な医療デバイス10200の別の例示的な実施形態を示す。図15のデバイスは、「クールエンド」を有すると称される。
【0095】
再狭窄の低減における使用に加えて、図15の拡張可能な医療デバイス10200は、最初のステント留置の手順が追加のステントを用いて補足される必要がある場合、図14の拡張可能な医療デバイス9900又は別の薬物送達ステントと共に使用することができる。例えば、場合によっては、「ホットエンド」を有する図14のデバイス9900、又は均一な薬物分配を有するデバイスは、不適切に植え込まれ得る。デバイスが管腔の十分な部分を覆っていないと医者が確定した場合、補足デバイスを現存するデバイスの一方の末端部に、この現存するデバイスと僅かに重なって付加することができる。補足デバイスが植え込まれる際、図15のデバイス10200は、医療デバイス10200の「クールエンド」がデバイス9900及びデバイス10200の重なる部分に有益な薬剤が二重に投与されることを防止するように使用される。
【0096】
図16に、拡張可能な医療デバイス11300の異なる孔内に異なる有益な薬剤が配置された、本発明の更なる代替的な例示的実施形態を示す。第1の有益な薬剤はデバイス末端部の孔11330a内に提供され、第2の有益な薬剤はデバイス中心部分の孔11330b内に提供されている。有益な薬剤は、異なる薬物、異なる濃度の同一の薬物、又は同一の薬物の異なる変更物を含有し得る。図16の例示的な実施形態を用いて、「ホットエンド」又は「クールエンド」のいずれかを有する拡張可能な医療デバイス11300を提供することができる。
【0097】
好ましくは、第1の有益な薬剤を含む孔11330aを含むデバイス11300の各末端部は、縁から少なくとも1つの孔、最大約15個の孔まで延びる。この距離は、未拡張デバイスの縁から約0.127〜約2.54mm(約0.005〜約0.1インチ)に対応する。第1の有益な薬剤を含むデバイス11300の縁からの距離は、好ましくは約一部分であり、ここで一部分は架橋要素間で画定される。
【0098】
異なる薬物を含む異なる有益な薬剤は、ステント内の異なる開口部内に配置され得る。このことは、単一のステントから任意の所望の送達パターンで2種以上の有益な薬剤を送達することを可能にする。代替的に、異なる濃度の同一の薬物を含む異なる有益な薬剤を、異なる開口部内に配置してもよい。このことは、非均一なデバイス構造体により薬物を組織に均一に分配することを可能にする。
【0099】
本明細書に記載されるデバイス内に提供される2種以上の異なる有益な薬剤は、(1)異なる薬物、(2)異なる濃度の同一の薬物、(3)異なる放出動力学、即ち、異なるマトリックス浸食速度を有する同一の薬物、又は(4)異なる形態の同一の薬物を含み得る。異なる放出動力学を有する同一の薬物を含む、異なる有益な薬剤の例は、異なる担体を使用して、異なる形状の溶出プロファイルを達成し得る。同一の薬物の異なる形態のいくつかの例は、様々な親水性又は親油性を有する薬物の形態を含む。
【0100】
図16のデバイス11300の一例において、デバイス末端部の孔11330aは、高い親油性を有する薬物を含有する第1の有益な薬剤で負荷される一方、デバイス中心部分の孔11330bは、より低い親油性を有する薬物を含有する第2の有益な薬剤で負荷される。「ホットエンド」で高い親油性を有する第1の有益な薬剤は、より容易に周辺の組織に放散して、縁効果再狭窄を低減する。
【0101】
デバイス11300は、有益な薬剤が第1の薬剤から第2の薬剤へ変化する突然移行ラインを有していてもよい。例えば、デバイスの末端部から1.27mm(0.05インチ)内にある全ての開口部が第1の薬剤を収容し、残りの開口部が第2の薬剤を収容してもよい。あるいは、このデバイスでは、第1の薬剤と第2の薬剤との間が徐々に移行してもよい。例えば、開口部内の薬物の濃度は、デバイス末端部に向かって次第に増大(又は低下)してもよい。別の実施例において、デバイス末端に向かって移動するにつれ、開口部内の第1の薬物の量が増加する一方、開口部内の第2の薬物の量は減少する。
【0102】
図17に、拡張可能な医療デバイス12400の更なる別の例示的な実施形態を示し、ここで異なる有益な薬剤は、デバイス内の異なる開口部12430a、12430b内に交互又は散在様式で配置されている。この様式では、デバイスにより支持される全面積又は面積の一部分上の組織に、多数の有益な薬剤を送達することができる。この例示的な実施形態は、有益な薬剤間の相互作用又は安定性の問題により、多数の薬剤を単一の組成物に組み合わせてデバイス内に負荷することが不可能な場合に、多数の有益な薬剤の送達に有用であろう。
【0103】
拡張可能な医療デバイスが拡張形態にて非均一な開口部の分配を有する場合、異なる既定組織領域にて異なる薬物濃度を達成するために、異なる開口部内における異なる有益な薬剤の使用に加えて、異なる開口部内に異なる有益な薬剤を負荷して、送達される有益な薬剤のより均等な空間分配を提供することができる。
【0104】
異なる開口部内に異なる薬物を散在又は交互様式にて使用することにより、同一のポリマー/薬物マトリックス組成物中で組み合わされた場合に送達不可能であり得る2種の異なる薬物を送達することができる。例えば、薬物自体は、望ましくないように相互作用し得る。あるいは、2種の薬物は、マトリックスを形成するために同一のポリマーと適合可能でなくてもよく、又はポリマー/薬物マトリックスを開口部内へ送達するために同一の溶媒と適合可能でなくてもよい。
【0105】
更に、散在配置で異なる開口部内に異なる薬物を有する図17の例示的な実施形態は、異なる薬物を同一の医療デバイス又はステントから極めて異なる所望の放出動力学で送達する能力と、個々の薬剤の作用機構及び性質に応じて放出動力学を最適化する能力とを提供する。例えば、薬剤の水溶性は、ポリマー又は他のマトリックスからの薬剤放出に多大に影響する。高い水溶性を有する化合物は、一般にポリマーマトリックスから非常に急速に送達される一方、親油性薬剤は同一のマトリックスからより長い時間に亘り送達されるであろう。したがって、親水性薬剤及び親油性薬剤が医療デバイスから二薬の組み合わせとして送達される場合、同一のポリマーマトリクスから送達されるこれら2種の薬剤に関する所望の放出プロファイルをもたらすことは困難である。
【0106】
図17のシステムにより、同一のステントから親水性薬物及び親油性薬物を容易に送達することができる。更に、図17のシステムにより、2種の薬剤を2つの異なる放出動力学及び/又は投与期間にて送達することができる。最初の24時間の各初期放出、最初の24時間後の放出速度、2種の薬物の総投与期間及び任意の他の放出特性は、独立して制御することができる。例えば、第1の有益な薬剤の放出速度を、最初の24時間中に送達される薬物の少なくとも40%(好ましくは、少なくとも50%)が送達されるように準備し、第2の有益な薬剤は最初の24時間中に送達される薬物の20%(好ましくは、10%より少ない)未満が送達されるよう準備することができる。第1の有益な薬剤の投与期間は、約3週間以下(好ましくは、2週間以下)であってもよく、第2の有益な薬剤の投与期間は、約4週間以上であってもよい。
【0107】
再狭窄、即ち介入後の閉塞の再発は、生物学的過程の組み合わせ又は一連の生物学的過程を伴う。これらの過程は、血小板及びマクロファージの活性化を含む。サイトカイン及び増殖因子は、平滑筋細胞増殖に寄与し、遺伝子及びメタロプロテイナーゼの上方制御は、細胞増殖、細胞外マトリックスのリモデリング、及び平滑筋細胞遊走を誘導する。複数のこれらの過程に対処する、薬物の組み合わせによる薬物療法は、最も成功する抗再狭窄療法であり得る。本発明は、そのような成功する組み合わせられた薬物療法を達成する手段を提供する。
【0108】
以下に説明する実施例は、異なる孔又は開口部内の異なる薬物を放出する能力から利益を得る、組み合わせられた薬物システムのいくつかを示す。散在する又は交互の孔から2種の薬物を送達するための有益なシステムの一例は、抗増殖剤又は抗遊走剤と組み合わせた抗炎症剤又は免疫抑制剤の送達である。再狭窄に関与する多数の生物学的過程を標的とするのに、これら薬剤の他の組み合わせも使用することができる。抗炎症剤は血管形成術及びステント留置に対する血管の最初の炎症性反応を緩和し、炎症性反応を刺激するマクロファージの発達のピークに一致させて、最初は速い速度で送達され、その後、約2週間の期間にわたりゆっくりと送達される。抗増殖剤は、より長期間に亘って比較的均等な速度で送達されて、平滑筋細胞の移動及び増殖を低下させる。
【0109】
以下に示す実施例に加えて、以下の表、表7.0は、医療デバイス内の異なる開口部に薬物を配置することにより達成し得る、有用な二薬組み合わせ療法のいくつかを示す。
【表7】

【0110】
異なる開口部内に薬物を配置することにより、薬物が疎水性又は疎油性であるかに関わらず、特定の薬剤に対して放出動力学を誂えることができる。実質的に一定又は線形の放出速度における親油性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年12月23日公開の国際公開第04/110302号に記載されている。親水性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年5月27日公開の国際公開第04/043510号に記載されている。上記に列挙した親水性薬物には、CdA、グリベック、VIP、インスリン、及びアポリポタンパク質A−1ミラノが挙げられる。上記に列挙した親油性薬物には、パクリタキセル、エポシロンD、ラパマイシン、ピメクロリムス、PKC−412及びデキサメタゾンが挙げられる。ファルグリタザルは、一部親油性で、一部親水性である。
【0111】
再狭窄に関連した異なる生物学的過程に対処する多数の薬物の送達に加えて、本発明は、同一のステントから2種の異なる薬物を送達して、異なる疾病を治療することができる。例えば、ステントは、例えばパクリタキセル又はリムス(limus)薬等の抗増殖剤を、一組の開口部から送達して再狭窄を治療する一方、例えばインスリン等の心筋保護剤を他の開口部から送達して、急性心筋梗塞を治療することができる。
【0112】
公知の拡張可能なデバイスの多数において、また図18に示したデバイスに関して、デバイス13500の適用範囲は、デバイスの円筒形の管部分13512が架橋要素13514と比較して大きい。適用範囲は、デバイス表面面積の、デバイスが留置される管腔の面積に対する比として定義される。可変の適用範囲を有するデバイスが、デバイス内の開口部内に収容された有益な薬剤の送達に使用される場合、円筒形の管部分13512に隣接した組織に送達される有益な薬剤の濃度は、架橋要素13514に隣接した組織に送達される有益な薬剤よりも高い。このデバイス構造体内の長手方向の変動、及び不均等な有益な薬剤送達濃度に繋がるデバイス適用範囲の他の変動に対処するため、デバイスの一部分において開口部内で有益な薬剤の濃度を変更して、組織全体での有益な薬剤のより均等な分配を達成する。図18に示す例示的な実施形態の場合、管部分13512内の開口部13530aは、架橋要素13514内の開口部13530bよりも低い薬物濃度を有する有益な薬剤を収容する。薬剤送達の均一性は、薬物濃度、開口部の直径又は形状、開口部内の薬剤の量(即ち、開口部の充填(filed)の百分率)、マトリックス材料、又は薬物の形態を変更することを含む様々な方法で達成することができる。
【0113】
異なる開口部内に異なる有益な薬剤を使用する他の適用の例は、血管内の分岐に使用するよう構成された図19に示す拡張可能な医療デバイス14600にある。分岐デバイスは側部孔14610を含み、この側部孔は、血管の側枝を通して血液を流すように配置されている。分岐デバイスの一例は、その全体が参照により本明細書に組み込まれる米国特許第6,293,967号に記載されている。分岐デバイス14600は、デバイスのその他の部分を形成するビームの規則的なパターンを中断する側部孔の特徴14610を含む。分岐の周囲の領域は、再狭窄に関して特に問題のある領域であるため、抗増殖薬物の濃度は、デバイス14600の側部孔14610を囲む領域における開口部14630a内で増大されて、必要な場所に、増大した濃度の薬物を送達することができる。側部孔から離れた範囲内の残りの開口部14630bは、より低い濃度の抗増殖剤を有する有益な薬物を収容する。分岐孔を囲む領域への抗増殖剤送達の増大は、異なる薬物を含有する異なる有益な薬剤、又はより高い濃度の同一の薬物を含有する異なる有益な薬剤により提供され得る。
【0114】
拡張可能な医療デバイスの壁面又は反管腔側に異なる有益な薬剤を送達して、血管壁を治療することに加えて、有益な薬剤は拡張可能な医療デバイスの管腔側に送達されて、血栓症を予防又は低減することができる。デバイスの管腔側から血液流中に送達される薬物は、デバイスの近位端、又はデバイスの遠位端に位置していてもよい。
【0115】
異なる有益な薬剤を、拡張可能な医療デバイス内の異なる開口部内に負荷するための方法は、例えば浸漬及び被覆等の公知の技術、並びに公知の圧電マイクロジェット技術も含み得る。マイクロインジェクションデバイスは、コンピュータ制御されて、正確な量の2種以上の有益な液体薬剤を、公知の方法にて、拡張可能な医療デバイス上の正確な位置へ送達することができる。例えば、二薬噴射デバイスは、2種の薬剤を同時に又は連続的に開口部内に送達することができる。有益な薬剤が、拡張可能な医療デバイス内の貫通開口部内へ負荷される際に、貫通開口部の管腔側は、負荷中、弾性マンドレルにより遮断されて、有益な薬剤が液体形態で、例えば溶媒と共に送達されることを可能にし得る。有益な薬剤は、手動注入デバイスによっても負荷することができる。
【0116】
図20に、ステント内の異なる孔から送達される抗炎症剤及び抗増殖剤を有して、再狭窄の生物学的過程に一致するよう特にプログラムされた2種の薬物の独立した放出動力学を提供する二薬ステント15700を示す。この実施例によれば、二薬ステントは、第2の組の開口部15720内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部15710内の抗炎症剤であるピメクロリムスを含む。各薬剤は、ステントの孔内のマトリックス材料中に、図21に示す放出動力学をもたらすよう構成された特定のインレー配置で提供される。各薬物は、再狭窄の治療のために主に壁面側へ送達される。
【0117】
図20に示すように、ピメクロリムスは、孔の管腔側にバリア15712を用いることにより、ステントの壁面側に定方向送達されるようステント内に提供されている。バリア15712は、生分解性ポリマーにより形成されている。ピメクロリムスは、二重相を有する放出動力学を形成する様式で孔内に負荷される。ピメクロリムス放出の第1の相は、マトリックスの壁面に位置する領域15716により提供され、この領域は急速放出製剤を含み、製剤は、ピメクロリムスと生分解性ポリマー(PLGA)とを含み、ここで薬物は高い百分率を有し、例えば約10%のポリマーに対して約90%の薬物を含む。放出の第2の相は、ピメクロリムスと生分解性ポリマー(PLGA)が、50%のポリマーに対して約50%の薬物の比を有するマトリックスの中心領域15714により提供される。図21のグラフから明らかであり得るように、ピメクロリムス放出の第1の相は、ほぼ最初の24時間にて約50%の負荷薬物を送達する。放出の第2の相は、残りの50%を約2週間かけて送達する。この放出は、血管形成術及びステント留置に続く炎症過程の進行に一致するよう詳細にプログラミングされる。2つの領域間で薬物濃度を変えて二相放出を達成することに加えて、又はそれに代替して、異なるポリマー又は異なるコモノマー比の同一のポリマーを、2つの薬物の異なる領域内で使用して、2つの異なる放出速度を達成することができる。
【0118】
パクリタキセルは、図21に示すように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部15720内に負荷される。パクリタキセル開口部15720は3つの領域で負荷され、該領域は、孔の管腔側の最小限の薬物を含む主にポリマーでできた基部領域15722、濃度勾配にて提供されるパクリタキセル及びポリマー(PLGA)を有する中心領域15724、並びにパクリタキセル放出を制御する主にポリマーを有するキャップ領域15726を含む。パクリタキセルは、第一日目にて全薬物負荷の約5〜約15%が初期放出された後、約20〜90日間、実質的に線形放出される。濃度勾配を有する孔内のパクリタキセルに関する配置の更なる例は、上記の国際公開第04/110302号に記載されている。
【0119】
図20に、説明を容易にするために、開口部内の区別される領域として薬物、バリア及びキャップ領域を示す。これらの領域は不明瞭であり、異なる領域を一体化することにより形成されることを理解するべきである。それ故、バリア層は薬物を有さない主にポリマーであるが、使用する製造過程に応じて、続く領域のいくらかの少量の薬物がバリア領域内に組み込まれ得る。
【0120】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、ピメクロリムスの量は約50〜約3マイクログラム、好ましくは約100〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。一例において、約200マイクログラムのピメクロリムス及び約20マイクログラムのパクリタキセルが送達される。薬物は、ステント内の交互孔内に位置していてもよい。しかしながら、送達される2種の薬物の用量間の大きな相違に鑑みると、パクリタキセルをステント内の4つの孔の各3番目に配置することが望ましいと思われる。あるいは、低用量の薬物(パクリタキセル)を送達するための孔は、高用量用の孔よりも小さく形成されてもよい。
【0121】
ポリマー/薬物インレーは、その全体が参照により本明細書に組み込まれる2004年4月1日公開の国際公開第04/026182号に記載されている、コンピュータ制御による圧電インジェクション技術により形成される。第1の薬剤のインレーが最初に形成された後、圧電インジェクタを使用して第2の薬剤のインレーが形成され得る。あるいは、国際公開第04/02182号のシステムに二重圧電ディスペンサーを搭載して、2種の薬剤を同時に分配してもよい。
【0122】
この例示的な実施形態によれば、二薬ステントは、第2の組の開口部15720内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部15710内のグリベックを含む。各薬剤は、ステントの孔内のマトリックス材料中に、図21に示す放出動力学をもたらすよう構成された特定のインレー配置で提供される。
【0123】
グリベックは、二相放出により送達され、この放出は、第1日目の高い初期放出と、次の1〜2週間の遅延放出とを含む。グリベック放出の第1の相は、ほぼ最初の24時間で、負荷した薬物の約50%を送達する。放出の第2の相は、残りの50%を約1〜2週間で送達する。パクリタキセルは、図21に示し、また上述したように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部15720内に負荷される。
【0124】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、グリベックの量は、約200〜約500マイクログラム、好ましくは約300〜約400マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。上述した例示的な実施形態と同様、薬物は、ステント内の交互孔内に配置され、又は非交互に散在されてもよい。ポリマー/薬物インレーは、上述した方法により形成される。
【0125】
この例示的な実施形態によれば、二薬ステントは、第2の組の開口部内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部内のPKC−412(細胞増殖制御因子)を含む。各薬剤は、ステントの孔内のマトリックス材料中に、以下に説明する放出動力学をもたらすよう設計された特定のインレー配置で提供される。
【0126】
PKC−412は、最初の約24時間の後、実質的に一定の放出速度で送達され、約4〜16週間、好ましくは約6〜12週間の間放出される。パクリタキセルは、最初の約24時間後、実質的に線形放出を有する放出動力学を形成するように、開口部内に負荷され、放出は、約4〜16週間、好ましくは約6〜12週間の間にわたる。
【0127】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、PKC−412の量は、約100〜約400マイクログラム、好ましくは約150〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。上述した例示的な実施形態と同様、薬物は、ステント内の交互孔内に配置され、又は非交互に散在されてもよい。ポリマー/薬物インレーは、上述した方法により形成される。
【0128】
本明細書に記載される薬剤のいくつかは、それらの活性を保存する添加剤と組み合わされてもよい。例えば界面活性剤、制酸薬、抗酸化剤、及び洗剤を含む添加剤を使用してタンパク質薬物の変性及び凝集を最小にすることができる。陰イオン性、陽イオン性、又は非イオン性界面活性剤を使用することができる。非イオン性賦形剤の例には、ソルビトール、ショ糖、トレハロースを含む糖;デキストラン、カルボキシメチル(CM)デキストラン、ジエチルアミノエチル(DEAE)デキストランを含むデキストラン;D−グルコサミン酸、及びD−ブドウ糖ジエチルメルカプタールを含む糖誘導体;ポリエチレングリコール(PEO)及びポリビニルピロリドン(PVP)を含む合成ポリエステル;D−乳酸、グリコール酸、及びプロピオン酸を含むカルボン酸;n−ドデシル−.β.−D−マルトシド、n−オクチル−.β.−D−グルコシド、PEO−脂肪酸エステル(例えば、ステアリン酸エステル(myrj 59)又はオレイン酸エステル)、PEO−ソルビタン−脂肪酸エステル(例えば、Tween 80、PEO−20モノオレイン酸ソルビタン)、ソルビタン−脂肪酸エステル(例えば、SPAN 60、モノステアリン酸ソルビタン)、PEO−グリセリル−脂肪酸エステルを含む、疎水性界面のための親和性を伴う界面活性剤;グリセリル脂肪酸エステル(例えば、モノステアリン酸グリセリル)、PEO−炭化水素−エーテル(例えば、PEO−10オレイルエーテル;トリトンX−100;並びにルブロールが挙げられるが、これらに限定されない。イオン性洗剤の例は、ステアリン酸カルシウム、ステアリン酸マグネシウム、及びステアリン酸亜鉛を含む脂肪酸塩;レシチン及びホスファチジルコリンを含むリン脂質;(PC)CM−PEG;コール酸;ドデシル硫酸ナトリウム(SDS);ドクサート(AOT);並びにタウモコール酸を含むが、これらに限定されない。
【0129】
別の例示的な実施形態によれば、ステント又は管腔内足場は、本明細書に記載されるように、孔又は開口部内に堆積した1種以上の治療薬に加えて、抗血栓剤で被覆され得る。例示的な一実施形態において、ステントは、内部に開口部を製作され、開口部内に他の治療薬を追加又は堆積するに先立って、担体ビヒクル(ポリマー又はポリマー性マトリックス)を伴う又は伴わない抗血栓剤が、ステント又はこのステントの一部分に付着され得る。この例示的な実施形態において、ステントの管腔側及び反管腔側表面を、また開口部の壁の表面を、抗血栓剤又は皮膜で被覆し得る。代替的な例示的な実施形態において、ステントは、最初に抗血栓剤又は皮膜で被覆された後、開口部が製作され得る。この例示的な実施形態では、管腔側表面と反管腔側表面のみが抗血栓剤又は皮膜を有し、開口部の壁は皮膜を有さない。これらの各実施形態において、任意の数の抗血栓薬剤を、ステントの全部又は一部に付着させることができる。加えて、例えばコーディス社製のBx Velocity(登録商標)冠状動脈ステント上のHEPACOAT(商標)と共に使用されるような任意の数の公知の技術を使用して抗血栓剤をステントに付着させることができる。あるいは、ステントは、抗血栓皮膜とは独立して又はこの皮膜に加えて、粗い表面テクスチャーで加工されてもよく、又はマイクロテクスチャーを有して、細胞付着性及び内皮化を向上させてもよい。加えて、任意の数の治療薬を開口部内に堆積することができ、また、異なる薬剤をステントの異なる領域内に使用することができる。
【0130】
図22A、図22B及び図22Cを参照すると、ステントの一部分の図表示が示されている。
【0131】
図22Aに示すように、ステント17900は、実質的に円形の複数の開口部17902を含む。この例示的な実施形態では、実質的に円形の複数の開口部17902は、ステント17900の壁を貫通して延びる。換言すれば、実質的に円形の複数の開口部17902は、ステント17904の反管腔側表面からステント17906の反管腔側表面へ延び、ここで壁厚は、管腔側表面と、反管腔側表面との間の距離として定義される。しかしながら別の実施形態では、開口部は、ステント17900の壁を貫通して延びる必要はない。例えば、開口部又はリザーバは、管腔側表面若しくは反管腔側表面又は両方のいずれかから部分的に延びていてもよい。図22Aのステント17900は、未処理の表面17904及び17906、並びに空の開口部17902を有する。
【0132】
図22Bでは、少なくとも1つの表面が、治療薬17908で被覆されている。治療薬は、好ましくは例えばヘパリン等の抗血栓剤を含むが、任意の抗血栓剤を使用することができる。抗血栓剤は、上記に簡略的に記載したように、任意の技術を用いて付着させることができる。この例示的な実施形態では、反管腔側表面及び管腔側表面の両方が、そこに付着された抗血栓剤を有している。加えて、この時点では実質的に円形の複数の開口部17902内に何も存在しないため、開口部17902の壁は、そこに付着された幾分かの抗血栓剤を有し得る。開口部17910の壁に付着される抗血栓剤の量は、薬物の付着方法に依存する。例えば、薬剤が浸漬被覆により付着される場合、開口部の壁には、薬剤が噴霧被覆技術を用いて付着される場合と比較してより多量の薬剤が付着されるであろう。本明細書に記載するように、この例示的な実施形態において、暴露される全表面は、相当の抗血栓皮膜が付着される。しかしながら、別の例示的な実施形態では、特定の表面のみが抗血栓を付着され得る。例えば、例示的な一実施形態では、血液と接触する表面のみが、抗凝固剤で処理されてよい。尚別の例示的な一実施形態では、片方又は両方の表面が抗血栓剤で被覆され得る一方、開口部の壁は被覆されない。これは、被覆前に開口部を塞ぎ、又は抗血栓剤の付着後に開口部を形成することを含む、多数の方法にて達成することができる。
【0133】
図22Cに、この例示的な実施形態による完成したステントを示す。この図に示すように、実質的に円形の複数の開口部17902は、再狭窄及び炎症等の血管疾患、又は本明細書に記載される任意の他の疾病(dieses)を治療するための1種以上の治療薬で充填されている。各開口部17902は、上記に詳細に説明したように、同一の治療薬又は異なる薬剤で充填され得る。図に示すように、これらの異なる薬剤17912、17914及び17916は特定のパターンで使用されるが、上記に詳細したように、任意の組み合わせが可能であり、1種の薬剤を異なる濃度で使用することも可能である。ラパマイシン等の薬物は、任意の好適な方法で開口部17902内に堆積され得る。薬剤を堆積する技術には、マイクロピペッティング及び/又はインクジェット充填方法が挙げられる。例示的な一実施形態において、薬物は、開口部内の薬物及び/又は薬物/ポリマーマトリックスが、ステント表面の水平面の下方となり、周辺の組織と接触しないように満たされ得る。代替的に、開口部は、薬物及び/又は薬物/ポリマーマトリックスが、周辺の組織と接触し得るように充填されてもよい。加えて、各薬物の総用量は、多数の薬物が使用される場合、最大の柔軟性をもって設計され得る。加えて、各薬物の放出速度は、個別に制御され得る。例えば、末端部付近の開口部は、縁再狭窄を治療するよう、より多量の薬物を収容し得る。
【0134】
この例示的な実施形態によれば、孔又は開口部は、最も有効な薬物療法のためにのみ構成されるのではなく、異なる薬物間に物理的分離を形成するためにも構成され得る。この物理的分離は、薬剤の相互作用を防止するのを助けることができる。
【0135】
別の例示的な実施形態によれば、立体特異的なポリマーの層対層配置を含むポリマー構成物は、医療デバイスと共に使用される薬物又は治療薬デポー剤担体又は被膜として使用されてもよい。本明細書で使用される医療デバイスは、局所又は領域薬物送達のための本明細書に記載される任意のデバイスを意味する。本質的に、このポリマー構成物は、本明細書に記載される任意の治療薬又は治療薬の組み合わせ、本明細書に記載される任意の薬物送達デバイス、及び本明細書に記載される任意の植え込み可能な医療デバイスと共に使用されることができる。加えて、上記に暗示したように、ポリマー構成物は、植え込み可能な医療デバイスの表面の一部又は全部を被覆するための被膜として、又は植え込み可能な医療デバイス内の充填リザーバ用の担体として使用されてもよい。ポリマー構成物は、以下に詳細に記載するように、任意数の形態をとることができる。
【0136】
例示的な一実施形態において、構成物は、異なる光学回転を有する、化学的に同一の生分解性ポリマーの交互層から形成される。この例示的な実施形態では、生分解性ポリマーは、ポリ(D−乳酸)(PDLA)及びポリ(L−乳酸)(PLLA)である。ポリ(D−乳酸)は、開環重合(ROP)プロセス中にキラル配置を維持する触媒を使用して、立体特異的なRR−ラクチド二量体から合成される。逆に、ポリ(L−乳酸)は、ROPプロセスを用いてSS−ラクチド二量体から合成される。ROP条件は、関連技術の当業者でもある当業者に公知である。互いにごく接近したこれらの交互層は、局所及び領域的な薬物及び/又は治療薬送達に関連して優れた結果を提供する立体複合体(sterocomplex)を形成する。換言すれば、様々な物理的性質を有する2種の立体特異的なポリマーの同一の化学的性質は、治療薬の幅広い安定性と放出制御とを可能にする。加えて、これらの立体複合生分解性ポリマーの流動学的性質における変化は、これらの材料の密度をより高くし、非立体複合ポリマーと等しいか又はより良好な結果を達成する一方で、厚さがより薄い被膜と、潜在的により小さい分子量のポリマーとの使用がもたらされる。より薄いこれらの被膜は、好ましくは被膜の長期間の生体適合性を改善し、再吸収時間を短縮させる筈である。本質的に、層状のポリ(D−乳酸)とポリ(L−乳酸)とは立体複合体をその場で形成し、該立体複合体は、より少量の薬物担体マトリックスにより治療薬放出の薬物動態(pharmakinetics)をより良好に制御する。
【0137】
ポリマー−ポリマー複合体は、異なる化学組成を有するポリマーを、好適な条件下で混合して形成することができる。これらの複合体は、ポリカチオンとポリアニオンとの間のポリ電解質複合体、ポリ(カルボン酸)とポリエーテル又はポリオールとの間の水素結合複合体、及びポリマードナーとアクセプターとの間の電荷移動複合体を含む。しかしながら、同一の組成を有するが異なる立体構造体を有するポリマー間で複合体の形成が生じ得る、限定された場合のみ公知である。そのような想定された最初の複合体は、Ikada,Y.,et al.,Sterocomplex formation Between Enantiomeric poly(lactides),Marcomolecter,1987,20,904〜906,in 1987により、ポリ(L−乳酸)とポリ(D−乳酸)との間で観察された。D,L−ラクチドから形成されるポリマーは無定形であり、光学不活性である一方、L−ラクチドとD−ラクチドとから形成されるポリマーは部分結晶性であり、光学活性であることが公知である。L−ラクチドポリマーは、D−ラクチドベースのポリマーよりも結晶性が高く、より疎水性であり得るため、結果として分解がより遅い。イケダ(Ikada)の研究は、等モルのポリ(L−乳酸)及びポリ(D−乳酸)が混合された場合、ポリマーブレンドは、約180℃である個々の融点のいずれよりも高い230℃の単一の融点を有することも示した。図23Aに示すように、SS−ラクチドから形成されたポリ(L−ラクチド)の結晶構造体は、左回転の螺旋鎖からなり、図23Bに示すように、RR−ラクチドから形成されたポリ(D−ラクチド)の結晶構造体は、右回転の螺旋結晶構造体を有する。図23Cに、重合した場合、無定形のラセミ体ポリマーをもたらすメソ−ラクチドを示す。
【0138】
イケダ(Ikada)らにより為された観察は、これらのラクチド二量体が、図24にポリ(L−ラクチド)及び図25にポリ(D−ラクチド)を示すように、立体特異的なポリラクチドの合成に使用された場合に有意な意味を有し得る。これは、ポリ(D−乳酸)とポリ(L−乳酸)との間で形成される立体複合体が、比較的少量の担体又はより薄い被膜又は場合により、より低い分子量によって、薬物溶出に制御を提供する上でより効果的であり得る、本明細書に記載される理由による。ポリ(D−乳酸)とポリ(L−乳酸)との間で形成される立体複合体は、結果として得られるそのより高い融点によって、物理的安定性がより高くなる可能性があり、また立体複合体中に含まれる治療薬又は薬剤の貯蔵も良好になる可能性がある。加えて、立体複合体に使用されるポリ(D−乳酸)及びポリ(L−乳酸)のより低い分子量は、より高い分子量の個々のポリマーと比較して、より短い再吸収時間とより良好な生体適合性とをもたらす可能性がある。
【0139】
そのようなポリ(D−乳酸)とポリ(L−乳酸)との立体複合体の利点を利用した例示的なプロセスは、立体特異的かつ光学的に純粋なポリ乳酸の1つを、治療薬又は薬剤の組み合わせと混合し、噴霧被覆等の通常の被覆方法を使用して医療デバイスのうちの少なくとも一部の表面に被覆することを含む。本明細書に記載したような任意の種類の被膜技術を使用することができる。次の工程は、反対の光学回転を有する別の立体特異的かつ光学的に純粋なポリ乳酸を治療薬又は薬剤の組み合わせと混合し、場合により以前の層が尚「湿潤」している間に、以前の層の頂部に被覆することを含む。反対の立体特異性を有するこれらのポリマーは、その場で結合して立体複合体を形成し、治療薬又は治療薬の組み合わせを局所又は領域薬物送達のために定位置に保持するであろう。上述したプロセスは、治療薬又は治療薬の組み合わせの適切なレベルが達成される迄、任意の回数だけ反復されてもよい。2種の光学活性ポリマーのいずれか又はその組み合わせの頂部層又は被膜は、被膜からの治療薬又は薬剤の組み合わせの放出速度を更に調節するよう適用されてもよい。
【0140】
このプロセスは、本明細書に記載した任意の医療デバイスの表面のうちの少なくとも一部又は複数の表面に、本明細書に記載した任意の治療薬又はその組み合わせを使用し、また本明細書に記載した任意の被覆技術を使用して適用されてもよい。加えて、上述したプロセスは、治療薬を用いて又は用いずに使用することができる。
【0141】
代替的な例示的実施形態では、治療薬は、ポリマー層と混合されず、各層がデバイス上に被覆された後に加えられてもよい。
【0142】
尚別の代替的な例示的実施形態では、上述した光学的に純粋なポリラクチド及び/又は治療薬の組み合わせを混合し、医療デバイス内の置場、例えばウェル内に堆積して、層対層の治療薬案内形態を達成してもよい。
【0143】
図26A、図26B及び図26Cを参照すると、場合により間に治療薬又は薬剤が入れられたポリ(D−乳酸)及びポリ(L−乳酸)の交互の層対層を用いた例示的な被膜又は堆積スキームが示されている。詳細には、図26Aにおいて、上部に層対層の立体複合被膜を有する医療デバイスの部分11102が示されている。この例示的な実施形態では、1つ以上の第1の治療薬11104がポリ(D−乳酸)11106と混合され、医療デバイスの部分11102の表面に付着されている。ポリ(L−乳酸)11108を含む第2の層が第1の層に付着され、それにより層対層構成物の基本構築ブロックを形成している。化学的に同一であるが物理的に異なるポリマーが使用される限り、同一又は異なる治療薬1110を用いた追加の層を使用し得ることに留意することが重要である。図示するように、1つ以上の追加の治療薬11110がポリマー構築ブロック層に付着された後、ポリ(D−乳酸)11106及びポリ(L−乳酸)11108を含む第2のポリマー構築ブロック層がそこに付着される。
【0144】
図26Bに、内部に層対層の立体複合被膜が堆積された、医療デバイスの部分11114内のリザーバ11112を示す。この例示的な実施形態では、ポリ(D−乳酸)11116及びポリ(L−乳酸)11118からなる第1の底部バリア層が、インクジェット等の標準的な堆積方法により置かれている。ポリ(D−乳酸)とポリ(L−乳酸)とは通常の溶媒中で予め混合され、リザーバ内に堆積され、連続的に堆積されて立体複合体バリア層が形成されてもよい。ポリ(D−乳酸)及びポリ(L−乳酸)の量は、実質的に同一であることが好ましい。次に、治療薬11120又は治療薬11120の組み合わせと混合したポリ(D−乳酸)11116をリザーバ内に堆積し、その後ポリ(D−乳酸)11118を堆積して、その場で立体複合体及び薬物ポリマーマトリックスを形成する。場合により同一又は異なる治療薬11122と混合されたポリ(D−乳酸)及びポリ(L−乳酸)の立体複合体の第2の層が、第1の層上に堆積されて、再度、層対層構成物を形成し得る。そのような交互層は、多数回反復されてもよい。ポリ(D−乳酸)及びポリ(L−乳酸)1118を含む、随意の頂部バリア層を堆積して、リザーバの頂部側からの薬物放出を調節してもよい。
【0145】
上記に示したように、治療薬又は薬剤は、ポリマーと混合され、又はポリマー間に単に堆積若しくは被覆されてもよい。
【0146】
図26Cに、医療デバイスの部分11126の表面上の治療薬又は薬剤の組み合わせ11128のための薬物拡散バリアとして使用される、ポリ(D−乳酸)11130とポリ(L−乳酸)11132の層対層堆積を示す。
【0147】
図27A及び図27Bに、ポリマー溶液11202を用いた被膜又は堆積スキームを示し、該溶液は、ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有し、場合により溶液中に治療薬又は薬剤11204が分散され、デバイス表面11206上に付着され、又はデバイスのリザーバ11208内に堆積される。
【0148】
別の例示的な実施形態によれば、本発明は、上述したような、リザーバを有する血管二薬溶出ステントに関し、これらのリザーバの一部はシロリムス(ラパマイシン)を壁面又は反管腔方向に優位に放出する組成物を含み、これらのリザーバの補足的部分は、シロスタゾールを管腔方向に優位に放出する組成物を含む。より詳細には、二薬溶出ステントが患者の動脈内に配置された際に、シロリムスが動脈組織内に局所的に溶出し、動脈内の再狭窄を治療及び緩和する一方、シロスタゾールが血流中に溶出して、二薬溶出ステントの管腔内及び薬物溶出ステントに隣接した局所動脈壁内の抗血栓効果を提供する。抗血栓効果は二倍である。即ち、植え込まれた二薬溶出ステント上の、又は同ステント近傍の血栓形成の軽減、並びに二薬溶出ステント上の、又は同ステント近傍の血小板凝集及び沈着の阻害である。また、二薬溶出ステントが心筋梗塞に苦しむ患者の治療に使用される場合、シロスタゾールは、例えばステント留置後の「無再流」状態を制限し、再灌流損傷を軽減し、及び/又は梗塞寸法を縮小することにより、処置動脈により血液が供給される心筋組織に対して心保護効果を提供することができる。二薬溶出ステントは、糖尿病を有する患者等、乏しい治癒特性を有する患者の臨床成績を改善することができる。
【0149】
この二薬溶出ステントの例示的な実施形態では、リザーバは、ステントからの2種の異なる治療薬又は薬物の定方向送達に使用される。ポリマー及びシロリムスの組成物は、ステントのリザーバの一部から患者の動脈組織への反管腔方向のシロリムスの制御された徐放性局所送達を提供する。ポリマー及びシロスタゾールの組成物は、ステントの異なる及び別個のリザーバから、治療中の動脈の血流への直接的な、又はステント植え込み後、ステントの管腔表面を覆うよう成長する生物学的組織内へのシロスタゾールの制御された徐放性送達を提供する。
【0150】
本明細書では別個の区別されるリザーバが記載されているが、任意の他の好適な定方向送達メカニズムを使用できることに留意することが重要である。
【0151】
図28は、本発明による二薬溶出ステントの一部の概略側面図である。治療薬又は薬物送達に関するパターンは多数の異なる状況又は治療計画に対して誂えることができるが、説明の容易さのため、隣接するリザーバは異なる薬物を含むものとして記載される。二薬溶出ステント2800は、2つのリザーバ2802及びリザーバ2804を含むよう図示され、一方はシロリムス組成物2806で充填され、他方はシロスタゾール組成物2808で充填されている。
【0152】
シロリムス組成物は、シロリムス及びPLGAマトリックスを含有する。例示的な実施形態において、162マイクログラムのシロリムスが93マイクログラムのPLGAと混合される。混合及びリザーバ充填プロセスは、以下に詳細に記載される。大部分のシロリムスが、矢印2810で示されるように二薬ステント2800の壁面又は反管腔側に確実に放出されるために、基部構造体2812は、リザーバ2802の管腔側の開口部内の栓として使用される。この基部構造体2812は、任意の好適な生体適合性材料を含んでもよい。例示的な実施形態において、基部構造体2812はPLGAを含む。基部構造体2812の形成は、次に詳細に説明される。
【0153】
シロスタゾール組成物は、シロスタゾール及びPLGAマトリックスを含有する。例示的な実施形態において、120マイクログラムのシロスタゾールが120マイクログラムのPLGAと混合される。混合及びリザーバ充填プロセスは、以下に詳細に記載される。大部分のシロスタゾールが、矢印2814で示されるように二薬ステント2800の管腔側に確実に放出されるために、キャップ構造体2816は、リザーバ2804の反管腔側の開口部内の栓として使用される。このキャップ構造体2816は、任意の好適な生体適合性材料を含んでもよい。例示的な実施形態において、キャップ構造体2816はPLGAを含む。キャップ構造体2816の形成は、次に詳細に説明される。
【0154】
上記に示された薬物及びポリマーの量は、3.5ミリメートル×17ミリメートル寸法のステントに関する合計である。各薬物に関する用量範囲は、次に詳細に説明される。加えて、ポリマー重量は、基部又はキャップ構造体内のマトリックス+ポリマー中のポリマーの合計である。使用されるポリマーの量も、次に詳細に説明される。
【0155】
上述したように、ステントのリザーバは、任意数の方法により充填され、又は負荷され得る。例示的な実施形態において、組成物は、2つの別個の連続した一連の工程にてリザーバウェル又はリザーバ内に充填され、該工程は、最初に流体充填溶液組成物をリザーバ内に堆積し、次に充填溶液の溶媒の実質的に全部ではなくとも大部分を蒸発させることを含む。溶媒を全く有さないことが、理想的な状況である。上述した本発明による組成物は、充填溶液組成物から溶媒を実質的に全部、好ましくは全部除去した後、リザーバ内に残留する固体材料である。
【0156】
シロリムスを含有する固体組成物の形成に使用される流体組成物は、生体再吸収性(bioresorbable)ポリマー又は生体吸収性(bioabsorbable)ポリマー、好ましくはポリ(ラクチド−コ−グリコリド)、PLGA、ポリマー、ジメチルスルホキシド、DMSO又はN−メチルピロリジノン等の好適な溶媒、NMP、シロリムス及び場合により安定剤又はBHT等の抗酸化剤を含有する。好ましくは、ステントリザーバ内の最終的なシロリムス組成物を形成する堆積工程に使用される流体充填溶液組成物のうちの少なくとも1つは、BHTを含有する。BHTの代替物は、ブチル化ヒドロキシアニソール、BHA、没食子酸プロピル等の没食子酸エステル、又はパルミトイルアスコルビン酸等のアスコルビン酸エステルを含む。BHTは、シロリムスの安定化におけるその高いレベルの有効性、その低い毒性、及びその疎水性に基づき好ましい。BHTはリザーバからシロリムスとほぼ同一の速度で溶出するため、BHTは常にシロリムスと共に存在する。DMSO及びNMPの代替物は、ジメチルアセトアミド(DMAc)又はジメチルホルムアミド(DMF)を含む。DMSOは、シロリムスがDMSO中でより安定に存在するため好ましい。
【0157】
堆積される各連続流体組成物は同一の成分を含有してもよく、又は連続充填溶液は異なる成分を含有する充填溶液から調製されてもよい。好ましくは、最初の一連の充填溶液堆積物は、ポリマー及び溶媒のみ含有し、これらは各充填工程後に乾燥される。プロセスのこの部分により、基部構造体2812が形成又は構築される。基部構造体2812が形成された後、ポリマー、溶媒、シロリムス及び好ましくはBHTを含有する次の溶液を加え、これらも各充填工程後に乾燥される。この製造の連続は、リザーバの管腔側面の領域内でより低い濃度のシロリムスが存在し、各リザーバの壁面の領域内で比較的高い濃度のシロリムスが存在するリザーバ組成物を形成するであろう。そのような形態は、上記に詳細に説明したように、壁面と比較して、薬物の管腔側面へのより長い経路、又は薬物の管腔側面への溶出に対するより高い抵抗を形成し、したがって実質的に全部のシロリムスがステントの壁面側へ、そして動脈組織内へ送達される筈である。換言すれば、シロリムスを優位に壁方向へ送達するリザーバ部分は、ステントの管腔側表面上及び該表面近傍のリザーバの容積が優位にポリマーを含み、最小量のシロリムスを含む一方、同一のリザーバの壁面又は壁面近傍の容積は、優位にシロリムスを含み、最小の割合のポリマーを含むデザインを有するであろう。
【0158】
リザーバ内のシロリムス組成物は、好ましくはシロリムス、生体再吸収性ポリマー、安定化剤及び溶媒を含有し、互いに所定の割合で存在するであろう。好ましくは、薬物溶出ステントから入手可能なシロリムスの全用量又は全量は、動脈組織領域1平方ミリメートル当たり0.6〜3.2マイクログラムであり、ここで動脈組織領域は、その直径及び長さが、動脈内に留置された際の拡張されたステントの直径及び長さである理論円筒の表面積として定義される。より好ましくは、薬物溶出ステントから入手可能なシロリムスの全用量又は全量は、動脈組織1平方ミリメートル当たり0.78〜1.05マイクログラムである。
【0159】
上記に示したように、組成物中に使用される生体再吸収性ポリマーは、PLGAを含む。より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約85:15〜約65:35である。尚より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約80:20〜70:30である。PLGAは、約0.3〜約0.9の範囲内の固有粘度を有することが好ましいと思われる。PLGAは、約0.6〜約0.7の範囲内の固有粘度を有することが、尚より好ましいと思われる。シロリムス対PLGAの重量比はD/P比と指定され、好ましくは約50/50〜約70/30の範囲内、より好ましくは約54/46〜約66/34の範囲内にある。全ての比は、重量の百分率である。あるいは、シロリムスとPLGAとの相対的な重量の割合は、正規化した形態D:Pで表わされてもよい。したがって、好ましいD:P比は、約1:0.4〜約1:1.2の範囲内、より好ましくは約1:0.52〜約1:0.85の範囲内にある。
【0160】
また上述したように、シロリムス組成物は、好ましくはBHT、ブチル化ヒドロキシルトルエンを含有する。添加されるBHTの量は、好ましくはシロリムスの量の約1重量パーセント〜約3重量パーセントの範囲内にある。尚より好ましくは、添加されるBHTの量は、好ましくはシロリムスの量の約1.2重量パーセント〜約2.6重量パーセントの範囲内にある。
【0161】
上述した成分を作製するためには、充填目的のための溶液、好適な溶媒が必要である。ジメチルスルホキシド、DMSOが好ましい溶媒であり、好ましくはシロリムスの重量に対して約1重量パーセント〜約20重量パーセントの範囲内の量で使用される。尚より好ましくは、DMSOは、シロリムスの重量に対して約1重量パーセント〜約15重量パーセントの範囲内の量で使用される。更により好ましくは、DMSOは、シロリムスの重量に対して約4重量パーセント〜約12重量パーセントの範囲内の量で使用される。
【0162】
シロスタゾールを含有する固体組成物の形成に使用される流体組成物は、生体再吸収性又は生体吸収性ポリマー、好ましくはポリ(ラクチド−コ−グリコリド)、PLGA、ポリマー、DMSO又はNMP等の好適な溶媒及びシロスタゾールを含有する。この組成物中にDMSO及びNMPに関する同一の代替物を使用してもよいが、ここでも、DMSOが好ましい。
【0163】
堆積される各連続流体組成物は同一の成分を含有してもよく、又は連続充填溶液は異なる成分を含有する充填溶液から調製されてもよい。好ましくは、最初の一連の充填溶液堆積物は、ポリマー、シロスタゾール及び溶媒を含有し、これらは各充填工程後に乾燥され、最後の一連の充填溶液は、ポリマー及び溶媒のみ含有し、これらも各充填工程後に乾燥される。このプロセスにより、キャップ構造体2816が形成又は構築される。この製造の連続は、リザーバの壁面の領域内でより低い濃度のシロスタゾールが存在し、各リザーバの管腔側面の領域内で比較的高い濃度のシロスタゾールが存在するリザーバ組成物を形成するであろう。そのような形態は、上記に詳細に説明したように、壁面と比較して、薬物の管腔側面へのより長い経路、又は薬物の管腔側面への溶出に対するより高い抵抗を形成し、したがって実質的に全部のシロスタゾールがステントの壁面側へ、そして血流及び/又は動脈組織内へ送達される筈である。換言すれば、シロスタゾールを優位に壁方向へ送達するリザーバ部分は、ステントの管腔側表面上及び該表面近傍のリザーバの容積が優位にポリマーを含み、最小量のシロスタゾールを含む一方、同一のリザーバの壁面又は壁面近傍の容積は、優位にシロスタゾールを含み、最小の割合のポリマーを含むデザインを有するであろう。
【0164】
リザーバ内のシロスタゾール組成物は、好ましくはシロスタゾール、生体再吸収性ポリマー及び溶媒を含有し、互いに所定の割合で存在するであろう。好ましくは、薬物溶出ステント入手可能なシロスタゾールの全用量又は全量は、動脈組織領域1平方ミリメートル当たり0.4〜2.5マイクログラムであり、ここで動脈組織領域は、その直径及び長さが、動脈内に留置された際の拡張されたステントの直径及び長さである理論円筒の表面積として定義される。より好ましくは、薬物溶出ステントから入手可能なシロスタゾールの全用量又は全量は、動脈組織1平方ミリメートル当たり0.56〜1.53マイクログラムである。
【0165】
上記に示したように、組成物中に使用される生体再吸収性ポリマーは、PLGAを含む。より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約90:10〜約25:75である。尚より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約80:20〜45:55である。PLGAは、約0.1〜約0.9の範囲内の固有粘度を有することが好ましいと思われる。尚より好ましくは、PLGAは、約0.4〜約0.7の範囲内の固有粘度を有するべきである。シロスタゾール対PLGAの重量比はD/P比と指定され、好ましくは約35/65〜約95/5の範囲内、より好ましくは約47/53〜約86/14の範囲内にある。全ての比は、重量の百分率である。あるいは、シロスタゾールとPLGAとの相対的な重量の割合は、正規化した形態D:Pで表わされてもよい。したがって、好ましいD:P比は、約1:0.05〜約1:2.0の範囲内、より好ましくは約1:0.16〜約1:1.20の範囲内にある。
【0166】
上述した成分を作製するためには、充填又は負荷目的のための溶液、好適な溶媒が必要である。ジメチルスルホキシド、DMSOが好ましい溶媒であり、好ましくはシロスタゾールの重量に対して約0.01重量パーセント〜約20重量パーセントの範囲内の量で使用される。尚より好ましくは、DMSOは、シロスタゾールの重量に対して約1重量パーセント〜約15重量パーセントの範囲内の量で使用される。更により好ましくは、DMSOは、シロスタゾールの重量に対して約3重量パーセント〜約12重量パーセントの範囲内の量で使用される。
【0167】
本明細書に示すように、ステントは任意の好適な生体適合性材料から製作されてもよい。この例示的な実施形態では、ステントは、好ましくはコバルト−クロム合金から形成される。加えて、PLGA中のポリマーの比は変動してもよい。例えば、PLGAは、約100:0〜約0:100、より好ましくは約50:50〜約85:15、より好ましくは約60:40〜約80:20のL:G比を有してもよい。
【0168】
本発明の二薬溶出ステントの独特のデザイン又は構成は、シロリムス及びシロスタゾールの完全に独立した溶出速度を提供する。加えて、この独特の構成は、シロリムスを優位に壁面又は反管腔方向へ送達させる一方、シロスタゾールを優位に管腔方向へ送達させる。
【0169】
図29を参照すると、30日間に亘る各薬物に関する累積的なインビボでの薬物放出百分率が示されている。曲線2902は、シロスタゾールに関するプロファイルを表す一方、曲線2904は、シロリムスに関するプロファイルを表す。図30は、インビボで放出される、各薬物のマイクログラムでの量のグラフである。曲線3002は、シロスタゾールに関するプロファイルを表す一方、曲線3004は、シロリムスに関するプロファイルを表す。図の曲線は、両方の薬物が互いに独立して溶出し、相互作用は最小か又は実質的に存在しないことを示す。両方の薬物に関して、30日の時点で約60〜70パーセント溶出が観察された。薬物の量(重量による)は、それらの対応するリザーバ内の薬物に関して異なるため、30日間で放出された薬物の全量は、シロスタゾールと比較してシロリムスがより多かった。
【0170】
各薬物に関する薬物負荷又は用量は、上記に示すものを含む任意数の方法で表し得ることに留意することが重要である。好ましい例示的な実施形態では、用量範囲は、標準的な3.5mm×17mmステント寸法に基づき、薬物重量のネスト絶対範囲(nested absolute range)として表されてもよい。この方法では、用量範囲は、ステントの寸法及びリザーバ数に対応するであろう。例えば、3.5mm×17mmのステント寸法では、孔又はリザーバの数は585である。別の例示的な実施形態では、所定の寸法のステントのリザーバの数は、2.5mm×8mmステントに関して211のリザーバ、3.0mm×8mmステントに関して238、3.5mm×8mmステントに関して290のリザーバ、2.5mm×12mmステントに関して311のリザーバ、3.0mm×12mmステントに関して347、3.5mm×12mmステントに関して417のリザーバ、2.5mm×17mmステントに関して431のリザーバ、3.0mm×17mmステントに関して501、2.5mm×22mmステントに関して551のリザーバ、3.0mm×22mmステントに関して633、3.5mm×22mmステントに関して753のリザーバ、2.5mm×28mmステントに関して711のリザーバ、3.0mm×28mmステントに関して809、3.5mm×28mmステントに関して949のリザーバ、2.5mm×33mmステントに関して831のリザーバ、3.0mm×33mmステントに関して963及び3.5mm×33mmステントに関して1117のリザーバを含んでもよい。本明細書に提供される用量範囲は、シロリムスを収容するリザーバのシロスタゾールを収容するリザーバに対する比が、20パーセント/80パーセント〜80パーセント/20パーセントに亘るであろう。3.5mm×17mmステント上のシロリムスの負荷又は用量は、約30マイクログラム〜約265マイクログラム、より好ましくは約130マイクログラム〜約200マイクログラム、尚より好ましくは約150マイクログラム〜約180マイクログラムの範囲内にあってもよい。これらは例示的な寸法及びリザーバ数であることに留意することが重要である。同一の3.5mm×17mmステント上のシロスタゾールの負荷又は用量は、約50マイクログラム〜約200マイクログラム、より好ましくは約90マイクログラム〜約200マイクログラム、尚より好ましくは約100マイクログラム〜約150マイクログラムの範囲内にあってもよい。上述したように、用量範囲は、ステントの寸法及びリザーバ数に対応するであろう。これらの用量は、最終的な滅菌済みステント製品のためのものである。
【0171】
本発明の二薬溶出ステントは、再狭窄、血栓症、急性心筋梗塞、再灌流損傷(reprofusion injury)、毛細血管の非再流状態、虚血関連の状態を含む、上記に示した多数の疾病状態の治療に、及び/又はシロリムスの抗再狭窄効果に対する糖尿病患者の応答を高めるために、使用することができる。シロリムス及びシロスタゾールの使用に加えて、デバイスに他の薬物を追加してもよい。例えば、上記に示したように、ヘパリン等の抗血栓剤を追加してもよい。追加の薬物が被膜として又はリザーバ内に含まれてもよい。留意される重要な点は、任意数の薬物とリザーバの組み合わせ、及び被膜を使用して、特定の疾病状態にデバイスを誂えることができることである。
【0172】
本明細書で使用されるように、ラパマイシンは、ラパマイシン、並びにFKBP12及び他のイムノフィリンに結合し、TOR阻害剤を含むラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及びコンジュゲートを含む。シロスタゾールのクラスに属する他の薬物は、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン、イナムリノン、シロスタミド、サテリノン、モタピゾン、リキサジノン、イマゾダン、プレタール、プリマコール、乳酸アムリノン及びメリベンダンを含む。
【0173】
放出の継続時間も誂え得ることに留意することも重要である。例えば、シロリムスに関するインビトロでの放出は、約7〜約120日間、より好ましくは約14〜約90日間であってもよい一方、シロスタゾールに関するインビトロでの放出は、約5〜約61日間であってもよい。放出状態は、異なる各薬物に関して誂えることができる。
【0174】
最も実際的で好ましいと思われる実施形態を示し記載したが、記載し示した特定の構成及び方法からの逸脱は、それ自体が当業者に示唆され、本発明の趣旨から逸脱することなく使用され得ることは明らかである。本発明は、記載及び図示された特定の構成に限定されず、添付の特許請求の範囲内に含まれ得る全ての変更物と一致するよう構成されるべきである。
【0175】
〔実施の態様〕
(1) 薬物送達デバイスにおいて、
管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、
前記管腔内足場内の複数の開口部、
mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む、前記複数の開口部の第1の部分、並びに、
ホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔方向又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む、前記複数の開口部の第2の部分、を備える、薬物送達デバイス。
(2) 前記mTOR阻害剤組成物がラパマイシン組成物を含む、実施態様1に記載の薬物送達デバイス。
(3) 前記ラパマイシン組成物がシロリムス組成物を含む、実施態様2に記載の薬物送達デバイス。
(4) 前記ホスホジエステラーゼIII阻害剤組成物がシロスタゾールを含む、実施態様1に記載の薬物送達デバイス。
(5) 前記ホスホジエステラーゼIII阻害剤組成物が、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン及びメリベンダンのうちの少なくとも1つを含む、実施態様1に記載の薬物送達デバイス。
(6) 前記植え込み可能な管腔内足場がステントを含む、実施態様1に記載の薬物送達デバイス。
【開示の内容】
【0001】
〔発明の背景〕
1.発明の分野
本発明は、血管疾患の予防及び治療のための治療薬及び/又は治療薬の組み合わせの局所投与、特に治療薬及び/又は治療薬の組み合わせの局所送達のための管腔内医療デバイスに関する。
【0002】
2.関連技術の考察
多くの個人は、心臓及び他の主な器官を灌流する血管の進行性の閉塞により生じる循環器疾患に苦しんでいる。そのような個人におけるより重篤な血管閉塞によって、多くの場合、高血圧、虚血性損傷、卒中又は心筋梗塞がもたされる。冠動脈血流を制限又は妨害する動脈硬化病変は、虚血性心疾患の主な原因である。経皮的冠動脈形成術は、動脈を通る血流を増大させることを目的とする医療処置である。経皮的冠動脈形成術は、広く行われている冠動脈狭窄の治療法である。この処置が益々使用されている理由は、冠動脈バイパス手術と比較したその比較的高い成功率と低侵襲性に起因する。経皮的冠動脈形成術に関する限界は、この処置の直後に生じ得る血管の突然閉鎖、及びこの処置の後に徐々に生じる再狭窄である。加えて、再狭窄は、伏在静脈バイパス移植を受けた患者における慢性的な問題である。急性閉塞のメカニズムはいくつかの要因が関与すると思われ、血管反跳及びその結果の動脈閉鎖、並びに/又は新たに開放した血管の、損傷した長さに沿った血小板及びフィブリンの沈着により生じ得る。
【0003】
経皮的冠動脈形成術後の再狭窄は、血管損傷により開始される、より漸進的なプロセスである。再狭窄のプロセスには、血栓症、炎症、増殖因子及びサイトカイン放出、細胞増殖、細胞遊走並びに細胞外マトリックス合成を含む多数のプロセスのそれぞれが寄与する。
【0004】
再狭窄の正確なメカニズムは完全には理解されていないが、再狭窄プロセスの一般的な局面は確認されている。正常な動脈壁では、平滑筋細胞は、1日当たり約0.1パーセント未満の低速で増殖する。血管壁内の平滑筋細胞は、細胞質体積の80%〜90%が収縮器官で占められるという特徴を有する収縮表現型で存在する。小胞体、ゴルジ及び遊離リボソームは殆ど存在せず、核周辺領域内に位置している。細胞外マトリックスは平滑筋を包囲し、平滑筋細胞を収縮表現型の状態に維持する役割を有すると思われるヘパリン様グリコシルアミノグリカンに富んでいる(Campbell and Campbell,1985)。
【0005】
血管形成術中の冠動脈内バルーンカテーテルの加圧拡張により、血管壁内の平滑筋細胞及び内皮細胞が損傷され、血栓性及び炎症性応答が開始する。血小板、侵入するマクロファージ及び/又は白血球から、又は平滑筋細胞から直接放出される、血小板由来増殖因子、塩基性線維芽細胞増殖因子、上皮増殖因子、トロンビン等の細胞由来増殖因子は、中膜平滑筋細胞における増殖及び遊走応答を誘発する。これらの細胞は、収縮表現型から合成表現型への変化を受け、合成表現型は僅かな収縮フィラメント束、大幅に粗い小胞体、ゴルジ及び遊離リボソームにより特徴付けられる。増殖/遊走は、通常、損傷から1〜2日後に開始し、その後数日でピークに達する(Campbell and Campbell,1987;Clowes and Schwartz,1985)。
【0006】
娘細胞は、動脈平滑筋の内膜層に遊走し、増殖を継続して有意な量の細胞外マトリックスタンパク質を分泌する。増殖、遊走及び細胞外マトリックスの合成は、損傷した内皮層が修復される迄継続し、その時点で、増殖は、通常損傷から7〜14日後、内膜内で遅延する。新たに形成された組織は、新生内膜と呼ばれる。次の3〜6ヶ月間に亘って生じる更なる血管の狭まりは、主に負のリモデリング又は狭窄リモデリングによるものである。
【0007】
局所増殖及び遊走と同時に、炎症細胞が血管損傷の部位に付着する。損傷から3〜7日後には、炎症細胞が血管壁のより深い層に遊走している。バルーン損傷又はステント植え込みのいずれかを用いた動物モデルでは、炎症細胞は、血管損傷部位に少なくとも30日間存続し得る(Tanaka et al.,1993;Edelman et al.,1998)。したがって、炎症細胞は存在し、再狭窄の急性期及び慢性期の両方に寄与し得る。
【0008】
多数の薬剤が、再狭窄における推定抗増殖作用に関して試験されており、実験動物モデルにて幾分かの活性を示している。動物モデルで内膜過形成の程度を首尾良く低減したいくつかの薬剤は:ヘパリン及びヘパリン断片(Clowes,A.W.and Karnovsky M.,Nature 265:25〜26,1977;Guyton,J.R.et al.,Circ.Res.,46:625〜634,1980;Clowes,A.W.and Clowes,M.M.,Lab.Invest.52:611〜616,1985;Clowes,A.W.and Clowes,M.M.,Circ.Res.58:839〜845,1986;Majesky et al.,Circ.Res.61:296〜300,1987;Snow et al.,Am.J.Pathol.137:313〜330,1990;Okada,T.et al.,Neurosurgery 25:92〜98,1989)、コルヒチン(Currier,J.W.et al.,Circ.80:11〜66,1989)、タキソール((Sollot,S.J. et al.,J.Clin.Invest.95:1869〜1876,1995)、アンジオテンシン変換酵素(ACE)阻害剤(Powell,J.S.et al.,Science,245:186〜188,1989)、アンジオペプチン(Lundergan,C.F.et al.Am.J.Cardiol.17(Suppl.B):132B〜136B,1991)、シクロスポリンA(Jonasson,L.et al.,Proc.Natl.,Acad.Sci.,85:2303,1988)、ヤギ抗ウサギPDGF抗体(Ferns,G.A.A.,et al.,Science 253:1129〜1132,1991)、テルビナフィン(Nemecek,G.M.et al.,J.Pharmacol.Exp.Thera.248:1167〜1174,1989)、トラピジル(Liu,M.W.et al.,Circ.81:1089〜1093,1990)、トラニラスト(Fukuyama,J.et al.,Eur.J.Pharmacol.318:327〜332,1996)、インターフェロン−γ(Hansson,G.K.and Holm,J.,Circ.84:1266〜1272,1991)、ラパマイシン(Marx,S.O.et al.,Circ.Res.76:412〜417,1995)、ステロイド(Colburn,M.D.et al.,J.Vasc.Surg.15:510〜518,1992),Berk,B.C.et al.,J.Am.Coll.Cardiol.17:111B〜117B,1991も参照のこと)、電離放射線(Weinberger,J.et al.,Int.J.Rad.Onc.Biol.Phys.36:767〜775,1996)、融合毒素(Farb,A.et al.,Circ.Res.80:542〜550,1997)、アンチセンスオリゴヌクレオチド(Simons,M.et al.,Nature 359:67〜70,1992)及び遺伝子ベクター(Chang,M.W.et al.,J.Clin.Invest.96:2260〜2268,1995)を含む。ヘパリン及びヘパリンコンジュゲート、タキソール、トラニラスト、コルヒチン、ACE阻害剤、融合毒素、アンチセンスオリゴヌクレオチド、ラパマイシン並びに電離放射線を含むこれらの多数の薬剤に関して、平滑筋細胞に対するインビトロでの抗増殖作用が示されている。それ故、平滑筋細胞抑制の多様なメカニズムを有する薬剤は、内膜過形成の低減における治療的用途を有する可能性がある。
【0009】
しかしながら、動物モデルとは対照的に、全身的な薬理学的手段によるヒト血管形成術患者の再狭窄予防の試みは、成功とは程遠いものとなっている。アスピリン−ジピリダモール、チクロピジン、抗血液凝固療法(急性ヘパリン、慢性ワルファリン、ヒルジン又はヒルログ)、トロンボキサン受容体拮抗作用及びステロイドのいずれも、再狭窄の予防に有効なものとなってはいないが、血小板阻害剤は血管形成術後の急性再閉塞の予防に有効なものとなっている(Mak and Topol,1997;Lang et al.,1991;Popma et al.,1991)。血小板GP IIb/IIIa受容体、拮抗薬、Reopro(登録商標)は尚研究中であるが、Reopro(登録商標)は、血管形成術及びステント留置後の再狭窄の低減に関して決定的な結果を示していない。再狭窄の予防において不成功であった他の薬剤は、カルシウムチャネル拮抗薬、プロスタサイクリン模倣体、アンジオテンシン変換酵素阻害剤、セロトニン受容体拮抗薬及び抗増殖剤を含む。しかしながら、これらの薬剤は全身に提供される必要があり、治療的有効用量の達成が不可能であり得て、抗増殖(又は抗再狭窄)濃度がこれらの薬剤の公知の毒性濃度を超え、平滑筋抑制を生じるに十分なレベルに到達し得ない可能性がある(Mak and Topol,1997;Lang et al.,1991;Popma et al.,1991)。
【0010】
食用魚油サプリメント又はコレステロール低下薬を使用して再狭窄予防の効果を試験した更なる臨床試験では、矛盾した又は負の結果を示したため、血管形成術後の再狭窄の予防に臨床的に利用可能な薬理学的薬剤は今尚存在しない(Mak and Topol,1997;Franklin and Faxon,1993:Serruys,P.W.et al.,1993)。最近の観察により、抗脂肪/抗酸化剤、プロブコールが再狭窄の予防に有用であり得ることが示唆されているが、この研究は立証されることが必要である(Tardif et al.,1997;Yokoi,et al.,1997)。プロブコールは現在、米国内での使用が承認されていず、30日間の前処理期間により、緊急血管形成術におけるその使用は不可能であると思われる。また、電離放射線の適用は、ステントによる血管形成術後の患者の再狭窄の低減又は予防に有意な展望を示している(Teirstein et al.,1997)。しかしながら、米国食品医薬品局の承認を有する血管形成術後の再狭窄の予防のために使用される治療薬は現在全く存在しないため、再狭窄の最も有効な治療は、目下の所、反復血管形成術、粥腫切除術又は冠動脈バイパス移植である。
【0011】
全身的な薬理学的療法とは異なり、ステントは、再狭窄の有意な低減に有用であることが証明されている。一般に、ステントはバルーン拡張型の孔のある金属管(通常、非限定的に、ステンレス鋼)であり、血管形成術が実行された冠動脈管腔内で拡張されると、動脈壁に対する剛性の足場作用により構造的支持を提供する。この支持は、血管管腔の開通性の維持に役立つ。2つの無作為化臨床試験では、ステントは最小の管腔直径を増大させ、6ヶ月後の再狭窄の発生率を、排除せずとも低減したことにより、経皮的冠動脈形成術後の血管造影成功率を向上させた(Serruys et al.,1994;Fischman et al.,1994)。
【0012】
また、ステントのヘパリン被覆は、ステント植え込み後の亜急性血栓症の低減を生じる付加的な利益を有すると思われる(Serruys et al.,1996)。このように、ステントによる狭窄した冠動脈の持続性の機械的拡張は、再狭窄予防の、ある手段を提供することが示されており、ステントをヘパリンで被覆することは、損傷組織の部位に薬物を局所送達する実行可能性及び臨床的有用性の両方を示している。
【0013】
上述したように、ヘパリン被覆ステントの使用は、局所薬物送達の実行可能性と臨床的有用性を示すが、特定の薬物又は薬物の組み合わせが局所送達デバイスに付着される形態は、この種類の治療の有効性にある役割を果たすであろう。例えば、局所送達デバイスに薬物/薬物の組み合わせを付着させるために使用されるプロセス及び材料は、薬物/薬物の組み合わせの作用を妨害するものであってはならない。また、使用されるプロセス及び材料は、生体適合性を有し、かつ薬物/薬物の組み合わせを、送達中に及び所定の時間に亘り、局所デバイス上に維持する必要がある。例えば、局所送達デバイスの送達中の薬物/薬物の組み合わせの除去により、デバイスが破損する可能性があり得る。
【0014】
したがって、生物学的に誘導される(例えばアテローム性動脈硬化症)か、又は例えば経皮的冠動脈形成術を介して機械的に誘導された、内膜肥厚を生じる血管損傷の予防及び治療のための薬物/薬物の組み合わせ、及び関連した局所送達デバイスが必要とされている。
【0015】
〔発明の概要〕
本発明の二薬ステントは、上記に示した先行技術によるデバイスの限界を克服するものである。
【0016】
例示的な一実施形態によれば、本発明は、薬物送達デバイスに関する。薬物送達デバイスは、管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、管腔内足場内の複数の開口部、mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む複数の開口部の第1の部分、並びにホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む複数の開口部の第2の部分、を備える。
【0017】
本発明は、上述したような、リザーバを有する血管二薬溶出ステントに関し、これらのリザーバの一部は、シロリムス(ラパマイシン)を壁又は反管腔方向に優位に放出する組成物を含み、これらのリザーバの補足的部分は、シロスタゾールを管腔方向に優位に放出する組成物を含む。より詳細には、二薬溶出ステントが患者の動脈内に配置された際に、シロリムスが動脈組織内に局所的に溶出し、動脈内の再狭窄を治療及び緩和する一方、シロスタゾールが血流中に溶出して、二薬溶出ステントの管腔内及び薬物溶出ステントに隣接した局所動脈壁内の抗血栓効果を提供するであろう。抗血栓効果は二倍であり、即ち、植え込まれた二薬溶出ステント上の、又は同ステント近傍の血栓形成の軽減、並びに二薬溶出ステント上の、又は同ステント近傍の血小板凝集及び沈着の阻害である。また、二薬溶出ステントが急性心筋梗塞に苦しむ患者の治療に使用される場合、シロスタゾールは、例えばステント留置後の「無再流」状態を制限し、再灌流損傷を軽減し、及び/又は梗塞寸法を縮小することにより、治療された動脈により血液が供給される心筋組織に対して心保護効果を提供することができる。二薬溶出ステントは、糖尿病を有する患者等、乏しい治癒特性を有する患者の臨床成績を改善することができる。
【0018】
この二薬溶出ステントの例示的な実施形態において、リザーバは、ステントからの2種の異なる治療薬又は薬物の定方向送達に使用される。ポリマー及びシロリムスの組成物は、ステントのリザーバの一部から患者の動脈組織への反管腔方向のシロリムスの制御された徐放性局所送達を提供する。ポリマー及びシロスタゾールの組成物は、ステントの異なる及び別個のリザーバから、治療中の動脈の血流への直接的な、又はステントの植え込み後、ステントの管腔表面を覆うよう成長する生物学的組織内へのシロスタゾールの制御された徐放性送達を提供する。
【0019】
本明細書では別個の区別されるリザーバが記載されているが、任意の他の好適な定方向送達メカニズムを使用できることに留意することが重要である。
【0020】
本発明の二薬ステントのデザインは、シロリムス及びシロスタゾールの独立した溶出速度と、各薬物の定方向送達とを提供する。
【図面の簡単な説明】
【0021】
本発明の前述の及び他の特徴及び利点は、以下の付随する図面に示される本発明の好ましい実施態様のより詳細な説明から明らかとなるであろう。
【図1】ステントの外面及び特徴的なバンド模様を示す、拡張前のステント(末端部は図示せず)の長さに沿った図。
【図2】本発明によるリザーバを有する図1のステントの長さに沿った斜視図。
【図3】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第1の例示的な実施形態の図表示。
【図4】本発明による第1の例示的なシロリムスとシロスタゾールとの組み合わせのステント被膜のインビトロでの放出動力学のグラフ。
【図5】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第2の例示的な実施形態の図表示。
【図6】本発明による第2の例示的なシロリムスとシロスタゾールとの組み合わせのステント被膜のインビトロでの放出動力学のグラフ。
【図7】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第3の例示的な実施形態の図表示。
【図8】本発明によるインビトロでのウシ血液ループモデルにおける、シロリムスとシロスタゾールの組み合わせの薬物溶出ステントの抗血栓活性のグラフ。
【図9】図11に示すステントからのシロリムス及びシロスタゾールのインビボでの放出動力学のグラフ。
【図10】図11に示すステントからのシロリムス及びシロスタゾールのインビトロでの放出動力学のグラフ。
【図11】本発明によるシロリムスとシロスタゾールの組み合わせを被覆されたステントの第4の例示的な実施形態の図表示。
【図12】図3に示したステントからのシロリムス及びシロスタゾールのインビボでの放出動力学のグラフ。
【図13】図3に示したステントからのシロリムス及びシロスタゾールのインビトロでの放出動力学のグラフ。
【図14】末端部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図15】中心部分に有益な薬剤を有し、末端部に有益な薬剤を有さない、本発明による拡張可能な医療デバイスの等角図。
【図16】異なる孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図17】交互孔内に異なる有益な薬剤を有する、本発明による拡張可能な医療デバイスの等角図。
【図18】架橋要素内の開口部に有益な薬剤を有する、本発明による拡張可能な医療デバイスの一部分の拡大された側面図。
【図19】分岐開口部を有する、本発明による拡張可能な医療デバイスの一部分の拡大側面図。
【図20】第1の複数の孔内の、例えば抗炎症剤等の第1の薬剤と、第2の複数の孔内の、例えば抗増殖剤等の第2の薬剤との組み合わせを有する、本発明による拡張可能な医療デバイスの断面図。
【図21】本発明による図20の拡張可能な医療デバイスにより送達される、抗炎症剤及び抗増殖剤の一例の放出速度のグラフ。
【図22A】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図22B】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図22C】本発明による拡張可能な医療デバイスの代替的な例示的実施形態の部分図表示。
【図23A】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図23B】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図23C】本発明による立体特異的なポリラクチドの合成に使用される例示的なラクチド二量体。
【図24】本発明によるポリL−ラクチド。
【図25】本発明によるポリD−ラクチド。
【図26A】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図26B】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図26C】同一の化学組成を有するが異なる光学回転を有する、交互の層対層ポリマーと、治療薬とを使用した、本発明による被覆又は堆積スキーム。
【図27A】ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有する溶液を使用した、本発明による被覆又は堆積スキーム。
【図27B】ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有する溶液を使用した、本発明による被覆又は堆積スキーム。
【図28】本発明による二薬溶出ステントの概略側面図。
【図29】本発明による、累積的なインビボでの薬物放出の百分率によるグラフ。
【図30】本発明による、累積的なインビボでの薬物放出の重量によるグラフ。
【0022】
〔好適な実施形態の詳細な説明〕
本発明の薬物/薬物の組み合わせ及び送達デバイスは、血管疾患、特に損傷により生じる血管疾患を有効に予防及び治療するために使用することができる。血管疾患の処置に使用されている様々な医療用治療デバイスは、最終的には更なる合併症を誘導し得る。例えば、バルーン血管形成術は、動脈を通る血流を増大させるために使用される処置であり、冠動脈血管狭窄の優位な治療法である。しかしながら、上述したように、この処置は一般に、血管壁に対してある程度の損傷をもたらすため、後の時点で問題を悪化させる可能性がある。他の処置及び疾病も同様の損傷をもたらし得るが、本発明の例示的な実施形態では、経皮的冠動脈形成術、並びに動脈、静脈及び他の流体輸送導管の連結を含む他の同様の動脈/静脈処置後の再狭窄及び関連した合併症の治療に関して記載する。また、被覆された医療デバイスを有効に送達するための様々な方法及びデバイスを記載する。
【0023】
本発明の例示的な実施形態を、経皮的冠動脈形成術後の再狭窄及び関連した合併症の治療に関連付けて記載するが、薬物/薬物の組み合わせの局所送達は、任意の数の医療デバイスを使用する非常に様々な状態の治療、又はデバイスの機能及び/若しくは寿命の向上に使用し得ることに留意することが重要である。例えば、白内障の手術後に視力を回復するために留置される眼内レンズはしばしば後発白内障の形成によって機能が損なわれる。後発白内障はしばしばレンズ表面における細胞の異常増殖の結果起こり、薬剤をデバイスと組み合わせることによって最小限にされる可能性がある。組織の内部成長やデバイスの内部、表面及び周囲へのタンパク性物質の蓄積によってその機能がしばしば損なわれる、水頭症用のシャント、透析グラフト、人工肛門形成術用バッグ取り付けデバイス、耳のドレナージ管、ペースメーカーのリード及び植え込み可能な除細動器といった他の医療デバイスもこうしたデバイス/薬剤の複合的アプローチによって利するものである。組織又は器官の構造体及び機能を改善する機能を有するデバイスも、適当な薬剤と組み合わせた場合にやはり効果を示す。例えば、植え込まれるデバイスの安定性を高める整形外科用デバイスの骨結合(osteointegration)の改善は、デバイスを骨形成タンパク質などの薬剤と組み合わせることによって達成される可能性がある。同様に他の手術器具、縫合糸、ステープル、吻合デバイス、椎間板(vertebral disk)、骨ピン、縫合糸アンカー、止血バリア、クランプ、スクリュー、プレート、クリップ、血管インプラント、組織接着剤及びシーラント、組織足場、各種ドレッシング、骨代用材、管腔内デバイス及び血管支持具も、こうしたデバイス/薬剤の複合的アプローチを用いることで患者にとって利するところが大きい。血管周囲ラップは単独又は他の医療デバイスと組み合わせても特に効果的である。血管周囲ラップは治療部位に更なる薬剤を供給することが可能である。本質的に、任意の種類の医療デバイスを薬剤又は薬剤の組み合わせによって何らかの方法で被覆することが可能であり、これによりデバイス又は薬剤の単独の使用と比較して優れた治療効果が得られる。
【0024】
様々な医療デバイスに加えて、これらのデバイス上の被膜は:ビンカアルカロイド等の天然産物を含む抗増殖剤/有糸分裂阻害剤(即ち、ビンブラスチン、ビンクリスチン及びビノレルビン)、パクリタキセル、エピジポドフィルロトキシン(即ち、エトポシド、テニポシド)、抗生物質(ダクチノマイシン(アクチノマイシンD)ダウノルビシン、ドキソルビシン及びイダルビシン)、アントラサイクリン、ミトキサントロン、ブレオマイシン、プリカマイシン(ミトラマイシン)及びマイトマイシン、酵素(L−アスパラギンを全身で代謝し、それら自体のアスパラギン合成能力を有さない細胞を枯渇させるL−アスパラギナーゼ);G(GP)IIb/IIIa阻害剤及びビトロネクチン受容体拮抗薬等の抗血小板薬;窒素マスタード(メクロレタミン、シクロホスファミド及び類似体、メルファラン、クロラムブシル)、エチレンイミン及びメチルメラミン(ヘキサメチルメラミン及びチオテパ)、アルキルスルホネート−ブスルファン、ニトロソウレア(カルムスチン(BCNU)及び類似体、ストレプトゾシン)、トラゼンス−ダカルバジニン(trazenes - dacarbazinine)(DTIC)等の抗増殖剤/抗有糸分裂アルキル化剤(antimitotic alkylating agent);葉酸類似体(メトトレキサート)、ピリミジン類似体(フルオロウラシル、フロクスウリジン及びシタラビン)、プリン類似体及び関連した阻害剤(メルカプトプリン、チオグアニン、ペントスタチン及び2−クロロデオキシアデノシン{クラドリビン})等の抗増殖/抗有糸分裂代謝拮抗剤;白金配位錯体(シスプラチン、カルボプラチン)、プロカルバジン、ヒドロキシウレア、ミトタン、アミノグルテチミド;ホルモン(即ち、エストロゲン);抗凝固剤(ヘパリン、合成ヘパリン塩及びトロンビンの他の阻害剤);線維素溶解剤(例えば、組織プラスミノーゲン活性化因子、ストレプトキナーゼ及びウロキナーゼ等)、アスピリン、ジピリダモール、チクロピジン、クロピドグレル、アブシキシマブ;抗遊走剤;抗分泌剤(antisecretory)(ブレベルジン);副腎皮質ステロイド(コルチゾール、コルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、6a−メチルプレドニゾロン、トリアムシノロン、ベタメタゾン及びデキサメタゾン)、非ステロイド性薬剤(サリチル酸誘導体、即ちアスピリン:等の抗炎症剤;パラ−アミノフェノール誘導体、即ちアセトアミノフェン;インドール及びインデン酢酸(インドメタシン、スリンダク及びエトドラク)、ヘテロアリール酢酸(トルメチン、ジクロフェナク及びケトロラク)、アリールプロピオン酸(イブプロフェン及び誘導体)、アントラニル酸(メフェナム酸、及びメクロフェナム酸)、エノール酸(ピロキシカム、テノキシカム、フェニルブタゾン及びオキシフェンタトラゾン)、ナブメトン、金化合物(オーラノフィン、オーロチオグルコース、金チオリンゴ酸ナトリウム);免疫抑制剤:(シクロスポリン、タクロリムス(FK−506)、シロリムス(ラパマイシン)、アザチオプリン、ミコフェノール酸モフェチル);血管形成剤:血管内皮増殖因子(VEGF)、線維芽細胞増殖因子(FGF);アンジオテンシン受容体遮断薬;一酸化窒素ドナー;アンチセンスオリゴヌクレオチド及びそれらの組み合わせ;細胞周期阻害剤、mTOR阻害剤、並びに増殖因子受容体シグナル伝達キナーゼ阻害剤;レテノイド;サイクリン/CDK阻害剤;HMG補酵素レダクターゼ阻害剤(スタチン);並びにプロテアーゼ阻害剤を含む治療的及び薬学的薬剤の送達に使用することができる。
【0025】
前述したように、バルーン血管形成術に伴う冠動脈ステントの植え込みは、急性血管閉鎖の治療に非常に有効であり、再狭窄の危険を低減し得る。血管内超音波試験(Mintz et al.,1996)は、冠動脈ステント留置が血管収縮を効果的に予防し、またステントの植え込み後の後期管腔損失の殆どが、おそらく新生内膜過形成に関連したプラーク増殖によるものであることを示唆している。冠動脈ステント留置後の後期管腔損失は、従来型バルーン血管形成術後に観察される損失のほぼ2倍高い。このように、ステントが再狭窄プロセスのうちの少なくとも一部を防止するため、平滑筋細胞増殖を防止する、炎症を低減及び凝集を低減する、又は多数のメカニズムにより平滑筋細胞増殖を防止する、ステントと組み合わされて炎症を低減及び凝集を低減する薬物、薬剤又は化合物の組み合わせは、血管形成術後の再狭窄の最も効果的な治療を提供し得る。同一又は異なる薬物/薬物の組み合わせの局所送達と組み合わせた、薬物、薬剤又は化合物の全身使用も、有益な治療選択を提供し得る。
【0026】
ステントからの薬物/薬物の組み合わせの局所送達は、以下の利点を有する。即ち、ステントの足場作用を介した血管反跳及びリモデリングの予防、新生内膜過形成又は再狭窄の多数の構成成分の予防、並びに炎症及び血栓症の低減である。この薬物、薬剤又は化合物の、ステント留置された冠動脈への局所投与は、更なる治療的利益も有し得る。例えば、全身投与ではなく局所送達を用いると、薬物、薬剤又は化合物のより高い組織濃度が達成され得る。加えて、全身投与ではなく局所送達を用いると、より高い組織濃度を維持する一方、低減された全身毒性が達成され得る。また、全身投与ではなくステントからの局所送達を用いると、単一の手順により患者コンプライアンスをより満足し得る。組み合わせ薬物、薬剤及び/又は化合物療法の更なる利益は、治療的薬物、薬剤又は化合物のそれぞれの用量が低下されることにより、それらの毒性が制限される一方、尚、再狭窄、炎症及び血栓症の低下が達成されることであり得る。したがって、局所ステントベースの治療法は、抗再狭窄、抗炎症、抗血栓の薬物、薬剤又は化合物の治療的な比(有効性/毒性)を改善する手段である。
【0027】
経皮的冠動脈形成術後に使用し得る多数の異なるステントが存在する。本発明に従って任意数のステントを使用し得るが、簡略化のため、本発明の例示的な実施形態では、限定数のステントを記載する。当業者は、本発明に関連して任意数のステントを使用し得ることを認識するであろう。加えて、上述したように、他の医療デバイスを使用することもできる。
【0028】
ステントは通常、閉塞を解放するために、管の管腔内部に残された管状構造体として使用される。通常、ステントは非拡張形態で管腔内に挿入され、次いで自発的に拡張され、又は第2のデバイスの補助によりその場で拡張される。典型的な拡張方法は、カテーテルに装着された血管形成術用バルーンの使用を介して生じ、このバルーンは狭窄した血管又は身体通路内で膨張されて、血管の壁構成成分に関連した閉塞を剪断及び破壊し、拡大した管腔を得る。
【0029】
図1に、本発明の例示的な実施形態に従って使用し得る例示的なステント100を示す。拡張可能な円筒形のステント100は、血管、管又は管腔内に配置されて血管、管又は管腔の開放を保持するための、より詳細には動脈セグメントを血管形成術後の再狭窄から保護するための有窓の構造体を含む。ステント100は、周囲方向に拡張され、周囲方向又は径方向に剛性な拡張形態で維持され得る。ステント100は軸線方向に可撓性であり、バンドにて屈曲された場合、ステント100は任意の構成成分の部分が外部に突出するのを回避する。
【0030】
ステント100は一般に、第1の及び第2の末端部と、その間の中間部分とを含む。ステント100は長手方向軸線を有し、長手方向に配置された複数のバンド102を含み、各バンド102は、長手方向軸線に平行な線セグメントに沿って概ね連続する波を定めている。周囲方向に配置された複数の結合部104は、バンド102を実質的に管状構造体に維持する。本質的に、長手方向に配置された各バンド102は、周囲方向に配置された短い結合部104により、隣接するバンド102に複数の周期的位置にて接続されている。各バンド102に関連した波は、中間部分においてほぼ同一の基本空間頻度を有し、バンド102は、該バンドに関連した波が概ね整合されるように配置され、それにより波は互いに概ね同相である。図に示すように、長手方向に配置された各バンド102は、隣接するバンド102に対する結合部が存在する前に、ほぼ2周期を経て波状にうねる。
【0031】
ステント100は、任意数の方法を用いて製作することができる。例えば、ステント100は、レーザー、放電フライス加工、化学的エッチング又は他の手段を用いて機械加工されてもよい中空又は形成されたステンレス鋼管から製作することができる。ステント100は未拡張形態で身体内に挿入され、所望の部位に配置される。例示的な一実施形態では、拡張はバルーンカテーテルにより血管内で達成されてもよく、ステント100の最終直径は、使用されるバルーンカテーテルの直径の関数である。
【0032】
本発明によるステント100は、ニッケル及びチタン又はステンレス鋼の適切な合金等を含む、形状記憶合金で具体化し得ることを理解するべきである。ステンレス鋼から形成される構造体は、ステンレス鋼を所定の様式に構成することにより、例えば網目状に編むことにより自己拡張型に作製されてもよい。この実施形態では、ステント100の形成後、ステントは圧縮されて、好適なカテーテル又は可撓性のロッドを含む挿入手段による血管又は他の組織へのステントの挿入を可能にするよう十分に小さい空間を占めることができる。カテーテルから出現した際、ステント100は所望の形態に拡張するよう構成されてもよく、拡張は自動的であるか、又は圧力、温度若しくは電気刺激の変化により誘発される。
【0033】
図2に、図1に示したステント100を使用した本発明の例示的な実施形態を示す。図示するように、ステント100は、1つ以上のリザーバ106を含むよう変更されてもよい。各リザーバ106は、所望により開放又は閉鎖されてもよい。これらのリザーバ106は、送達するべき薬物/薬物の組み合わせを保持するよう特に設計されていてもよい。ステント100のデザインに関わらず、病変領域内に有効用量を提供するのに十分な特異性及び十分な濃度にて適用される薬物/薬物の組み合わせの用量を有することが好ましい。この点から、バンド102内のリザーバの寸法は、薬物/薬物の組み合わせの用量を所望の位置及び所望の量で十分に適用する寸法であることが好ましい。
【0034】
代替的な例示的実施形態では、ステント100の内面及び外面全体が、治療的用量の薬物/薬物の組み合わせで被覆されてもよい。以下に、再狭窄の治療用の薬物、及び例示的な被覆技術の詳細な説明を記載する。しかしながら、被覆技術は、薬物/薬物の組み合わせに応じて異なっていてもよいことに留意することが重要である。また、被覆技術は、ステント又は他の管腔内医療デバイスを構成する材料に応じて異なっていてもよい。
【0035】
ラパマイシンは、米国特許第3,929,992号に開示されているように、ストレプトマイセス・ハイグロスコピカス(Streptomyces hygroscopicus)により産生される大環状トリエン抗生物質である。とりわけラパマイシンは、インビボで血管平滑筋細胞の増殖を阻害することが見出されている。したがって、ラパマイシン(1種又は複数種)は、特に生物学的若しくは機械的に仲介される血管損傷後の哺乳動物における内膜平滑筋細胞過形成、再狭窄及び血管閉塞の治療に使用され、又はそのような血管損傷により哺乳動物が苦しむであろう条件下で使用され得る。ラパマイシンは、平滑筋細胞増殖を阻害するよう機能し、血管壁の再内皮化を妨害しない。
【0036】
ラパマイシンは、血管形成術により誘導された損傷の期間に放出される細胞増殖シグナルに応答した平滑筋増殖に拮抗することにより、血管過形成を低減する。細胞周期の後期G1期における増殖因子及びサイトカイン仲介による平滑筋増殖の阻害は、ラパマイシンの優勢な作用メカニズムであると思われる。しかしながら、ラパマイシンは、全身投与された際に、T細胞増殖及び分化を防止することも公知である。このことは、その免疫抑制活性、及びその移植片拒絶を防止する能力の基礎である。
【0037】
本明細書で使用されるように、ラパマイシンは、ラパマイシン、並びにFKBP12及び他のイムノフィリンに結合し、TOR阻害剤を含むラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及びコンジュゲートを含む。
【0038】
ラパマイシンの抗増殖効果は、全身使用を介して達成され得るが、優れた結果は、化合物の局所送達を介して達成され得る。本質的に、ラパマイシンは、化合物に近接する組織内で作用し、送達デバイスからの距離が増大するにつれその効果が減少する。この効果の利点を利用するために、ラパマイシンを管腔壁と直接接触させることが望まれるであろう。したがって、好ましい実施形態では、ラパマイシンはステント又はステントの一部の表面上に組み込まれる。基本的に、ラパマイシンは、図1に示したステント100内に、ステント100が管腔壁と接触する箇所にて組み込まれることが好ましい。
【0039】
ラパマイシンは、多数の方法でステント上に組み込まれ、又はステントに付着され得る。例示的な一実施形態において、ラパマイシンはポリマーマトリックス中に直接組み込まれ、ステントの外面上に噴霧される。ラパマイシンは時間と共にポリマーマトリックスから溶出し、周囲の組織に入り込む。ラパマイシンは、少なくとも3日間〜約6ヶ月間、より好ましくは7〜30日間、ステント上に残留することが好ましい。
【0040】
ラパマイシンの被膜は、浸漬、噴霧若しくは回転被覆方法、及び/又はこれらの方法の任意の組み合わせにより、ステント上に適用され得る。様々なポリマーを使用することができる。例えば、ポリ(エチレン−コ−ビニルアセテート)及びポリブチルメタクリレートのブレンドを使用することができる。他のポリマー、例えばフッ化ポリビニリデン−コ−ヘキサフルオロプロピレン及びポリエチルブチルメタクリレート−コ−ヘキシルメタクリレートも使用することができるが、これらに限定されない。バリア又は頂部被膜を適用して、ポリマーマトリックスからのラパマイシンの溶解を調節してもよい。
【0041】
上述したように、ステントは、様々な金属、ポリマー材料及びセラミック材料を含む任意数の材料から形成され得ることに留意することが重要である。したがって、様々な技術を使用して、様々な薬物、薬剤及び化合物の組み合わせをステント上に固定化し得る。詳細には、上述したポリマーマトリックスに加えて、バイオポリマーを使用してもよい。バイオポリマーは一般に天然ポリマーとして分類され得る一方、上述したポリマーは合成ポリマーとして記載され得る。使用し得る例示的なバイオポリマーは、アガロース、アルギネート、ゼラチン、コラーゲン及びエラスチンを含む。加えて、薬物、薬剤又は化合物は、例えば移植片及び多数のバルーン等、他の経皮送達医療デバイスと共に使用されてもよい。
【0042】
新生内膜過形成の大きさ及び持続時間を低減するよう作用する、公知の抗増殖剤であるラパマイシンの作用を担う分子事象は、尚解明中である。しかしながら、ラパマイシンは細胞に入り込み、FKBP12と称される高親和性の細胞質タンパク質に結合することが公知である。ラパマイシンとFKPB12との複合体は、次に「ラパマイシンの哺乳動物標的(mammalian Target of Rapamycin)」又はTORと称されるホスホイノシチド(Pl)−3キナーゼに結合し、ホスホイノシチド(Pl)−3キナーゼを阻害する。TORは、平滑筋細胞及びTリンパ球内でのマイトジェン(mitogenic)増殖因子及びサイトカインに関連した下流シグナリング事象を仲介する、キーとなる役割を果たすタンパク質キナーゼである。これらの事象には、p27のリン酸化、p70 s6キナーゼのリン酸化、及び、タンパク質翻訳の重要な制御因子である4BP−1のリン酸化が含まれる。
【0043】
ラパマイシンが新生内膜過形成を抑制することにより再狭窄を低減することは認識されている。しかしながら、ラパマイシンが再狭窄の他の主な構成成分、即ち負のリモデリングも抑制し得る証拠が存在する。リモデリングは、そのメカニズムが明白に理解されていないが、時間と共に、一般にヒトでほぼ3〜6ヶ月間の期間で外弾性板の収縮と、管腔面積の縮小とをもたらすプロセスである。
【0044】
負のリモデリング又は狭窄血管リモデリングは、病変部位におけるパーセント直径狭窄として血管造影法により定量することができ、ここでプロセスを妨害するステントは全く存在しない。後期管腔損失が病変内で消滅した場合、負のリモデリングが抑制されていることを推測し得る。リモデリングの程度を決定する他の方法は、血管内超音波(IVUS)を使用して、病変内外弾性板領域を測定することを含む。血管内超音波は、外弾性板と血管腔とを画像化することができる技術である。処置後の時点から4ヶ月及び12ヶ月の経過観察の、ステント近位及び遠位における外弾性板の変化は、リモデリング変化を反映する。
【0045】
ラパマイシンがリモデリングに影響を及ぼす証拠は、ラパマイシン被覆ステントが非常に低い程度の病変内及びステント内再狭窄を示したヒトインプラント研究に由来する。病変内パラメータは、通常、ステントの両側の約5ミリメートル、即ち近位及び遠位で測定される。ステントは、尚バルーン拡張の影響を受けるこれらのゾーン内のリモデリングを制御するよう存在しないため、ラパマイシンが血管リモデリングを予防することが推測され得る。
【0046】
下記の表1のデータは、ラパマイシン処理グループにおいて、病変内パーセント直径狭窄が12ヶ月後でも低いままであることを示す。したがって、これらの結果は、ラパマイシンがリモデリングを低減するという仮説を支持する。
【表1】

【0047】
ラパマイシンによる負のリモデリングの低減を支持する更なる証拠は、下記の表2に示すファースト・イン・ヒューマン(first-in-man)臨床プログラムから得られた血管内超音波データに由来する。
【表2】

【0048】
データは、近位又は遠位で血管面積の最小損失が存在することを示し、このことはラパマイシン被覆ステントで治療した血管内で、負のリモデリングの抑制が生じたことを示す。
【0049】
ステント自体を除けば、血管リモデリングの問題に対する有効な解決法は全く存在しなかった。したがって、ラパマイシンは、血管リモデリング現象を制御する生物学的アプローチを提示し得る。
【0050】
ラパマイシンがいくつかの方法で作用して負のリモデリングを低減すると仮定することができる。ラパマイシンは、損傷に応答した血管壁内での線維芽細胞の増殖を特異的に遮断することにより、血管瘢痕組織の形成を低減し得る。ラパマイシンは、コラーゲン形成又は代謝に関与するキーとなるタンパク質の翻訳にも影響し得る。
【0051】
好ましい実施形態において、ラパマイシンは、再狭窄を低減又は予防する手段として局所送達デバイスにより送達されて、バルーン血管形成術後の動脈セグメントの負のリモデリングを制御する。任意の送達デバイスを使用することができるが、送達デバイスは、ラパマイシンを溶出又は放出する被膜又はシースを含むステントを含むことが好ましい。それらのデバイスのための送達システムは、ラパマイシンを管理者により制御される速度で送達する局所注入カテーテルを含んでもよい。別の実施形態では、注射針を使用し得る。
【0052】
またラパマイシンを経口剤形又は慢性注射デポー形態若しくはパッチを使用して全身に送達し、ラパマイシンを約7〜45日の範囲の期間送達して、負のリモデリングを抑制するのに十分な血管組織レベルを達成してもよい。そのような治療は、ステントを用いた又は用いない選択的血管形成術(elective angioplasty)に先だって数日間投与される場合、再狭窄を低減又は予防するよう使用されるべきである。
【0053】
ブタ及びウサギモデルにて生成されたデータは、表3に示すように、ラパマイシンの耐食性ポリマーステント被膜から血管壁内への用量範囲(35〜430μg/15〜18mm冠動脈ステント)での放出が、新生内膜過形成のピーク50〜55パーセント低下を生じたことを示している。約28〜30日にて最大であるこの低下は、一般に、下記の表4に示すように、ブタモデルにて90〜180日の範囲内で持続されない。
【表3−1】

【表3−2】

1ステント名称:EVA/BMA 1X、2X及び3Xは、それぞれ約500μg、1000μg及び1500μgの全質量(ポリマー+薬物)を意味する。TC、頂部皮膜30μg、100μg又は300mgの薬物フリーBMA;二相;100μgの薬物フリーBMA層により分離されたEVA/BMA中ラパマイシンの2×1X層。2ステント植え込み前の負荷用量0.5μg/kg/d×3dにより先行された0.25μg/kg/d×14d。
*p<0.05EVA/BMA対照から。**p<0.05金属から;
#炎症スコア:(0=本質的に内膜関与なし;1=<25%内膜関与;2=≧25%内膜関与;3=>50%内膜関与)
【表4】

【0054】
耐食性ポリマーステント被膜からのラパマイシンのヒト血管壁内への放出は、ステント内での新生内膜過形成の低減の大きさ及び持続時間に関して、上記に示した動物の血管壁と比較して優れた結果を提供する。
【0055】
上述したものと同一のポリマーマトリックスを使用して、動物モデルで研究されたものと同一の用量範囲のラパマイシンを含有するラパマイシン被覆ステントを植え込まれたヒトは、新生内膜の低減の大きさ及び持続時間に基づき、動物モデルで観察されたものと比較してかなり大きい新生内膜過形成の低減を示す。血管造影法及び血管内超音波測定の両方を使用した、ラパマイシンに対するヒト臨床応答は、本質的に、ステント内部での新生内膜過形成の全消滅を示す。これらの結果は、下記の表5に示すように、少なくとも1年持続される。
【表5】

QCA=定量的冠動脈血管造影
SD=標準偏差
IVUS=血管内超音波
【0056】
ラパマイシンは、ステントから送達された際、少なくとも1年持続するステント内新生内膜過形成の大きな低減をもたらすことにより、ヒト内で予想外の利益を生じる。ヒトでのこの利益の大きさ及び持続時間は、動物モデルデータから予想されない。この状況で使用されるラパマイシンは、ラパマイシン、並びにFKBP12に結合し、ラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及び同類物を含む。
【0057】
これらの結果は、多数の因子によるものであり得る。例えば、ヒトでのラパマイシンのより高い効果は、血管形成術の動物モデルの病態生理学と比較してヒト血管病変の病態生理学に対するその作用機構(1つ又は複数)の感受性が高いことによる。加えて、ステントに適用される用量と、薬物放出を制御するポリマー被膜との組み合わせが薬物の効果に重要である。
【0058】
上述したように、ラパマイシンは、血管形成術損傷の期間に放出される細胞増殖シグナルに応答した平滑筋増殖に拮抗することにより、血管過形成を低減する。また、ラパマイシンは、全身投与された際に、T細胞の増殖及び分化を防止することが公知である。ラパマイシンは、持続された期間(約2〜6週間)、ステントから低用量で投与された際に、血管壁内で局所炎症効果を与えることも測定されている。局所抗炎症の利益は顕著であり、予想外である。平滑筋抗増殖効果と組み合わせて、このラパマイシンの二重の作用モードは、その並外れた有効性を担い得る。
【0059】
したがって、局所デバイスプラットホームから送達されるラパマイシンが、抗炎症効果と平滑筋抗増殖効果との組み合わせにより、新生内膜過形成を低減する。この状況で使用されるラパマイシンは、ラパマイシン、並びにFKBP12に結合し、ラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及び同類物を意味する。局所デバイスプラットホームは、ステント被膜、ステントシース、移植片及び局所薬物注入カテーテル若しくは多孔質バルーン、又は薬物、薬剤若しくは化合物のその場での、若しくは局所送達のための任意の他の好適な手段を含む。
【0060】
ラパマイシンの抗炎症効果は、ステントから送達されたラパマイシンがステントから送達されたデキサメタゾンと比較された、表6に示す実験からのデータにて明らかである。強力なステロイド性抗炎症薬剤であるデキサメタゾンは、参照基準として使用された。デキサメタゾンは炎症スコアを低下できるが、ラパマイシンは、炎症スコアの低下においてデキサメタゾンより遙かに効果的であった。加えて、ラパマイシンはデキサメタゾンとは異なり、新生内膜過形成を有意に低減する。
【表6】

*=有意水準P<0.05
【0061】
ラパマイシンは、ステントから送達された際に、血管組織内のサイトカインレベルを低減することも見出されている。図1のデータは、ラパマイシンが血管壁内の単球走化性タンパク質(MCP−1)レベルの低減に高い効果を有することを示す。MCP−1は、血管損傷中に生産される炎症性/走化性サイトカインの一例である。MCP−1の低下は、炎症性メディエータの発現の低減と、ステントから局所的に送達されるラパマイシンの抗炎症効果に対する寄与とにおけるラパマイシンの有益な効果を示す。損傷に応答した血管炎症は、新生内膜過形成の発達に対する主な貢献物であることが認識されている。
【0062】
ラパマイシンは、局所炎症事象を阻害することが示され得るため、このことが新生内膜阻害におけるラパマイシンの予想外の優位性を説明し得ると思われる。
【0063】
上記に示したように、ラパマイシンは、T細胞増殖の防止、負のリモデリングの阻害、炎症の低減及び平滑筋細胞増殖の防止等の所望の効果を生成するよう多数の水準にて機能する。これらの機能の正確なメカニズムは完全には分かっていないが、確認されたメカニズムを発展させることができる。
【0064】
ラパマイシンを使用した研究は、細胞周期の遮断による平滑筋細胞増殖の防止が、新生内膜過形成の低減に有効な戦略であることを示唆している。後期管腔損失及び新生内膜プラーク容積の劇的かつ持続的な低下が、ステントから局所的に送達されるラパマイシンを受容している患者に観察されている。本発明は、ラパマイシンのメカニズムを、毒性を生成することなく細胞周期を阻害し、新生内膜過形成を低減する追加のアプローチを含むように発展させる。
【0065】
細胞周期は、細胞複製のプロセスを調整する、厳重に制御された生化学的な事象カスケードである。細胞が適切な増殖因子により刺激されると、細胞は細胞周期のG0(静止状態)からG1期へ移動する。DNA複製(S期)に先だったG1期における細胞周期の選択的阻害は、細胞周期の後期に、即ちS期、G2期又はM期に作用する治療薬(therapeutics)と比較した場合、抗増殖効果を保持すると共に細胞を保存及び生存させる治療的利点を提供することができる。
【0066】
したがって、血管及び身体内の他の導血管内での内膜過形成の予防は、細胞周期のG1期に選択的に作用する細胞周期阻害剤を使用して達成することができる。これらの細胞周期のG1期の阻害剤は、小分子、ペプチド、タンパク質、オリゴヌクレオチド又はDNA配列であってもよい。より詳細には、これらの薬物又は薬剤は、G1期を通した細胞周期の進行に関与したサイクリン依存性キナーゼ(cdk)、特にcdk2及びcdk4の阻害剤を含む。
【0067】
細胞周期のG1期に選択的に作用する薬物、薬剤又は化合物の例は、フラボピリドール及びその構造的類似体等の小分子を含み、該小分子は、サイクリン依存性キナーゼの拮抗作用により後期G1期における細胞周期を阻害することが見出されている。サイクリン依存性キナーゼを選択的に阻害する、時折P27kip1として参照され、P27と呼ばれる内在性キナーゼ阻害タンパク質kip、を上昇させる治療薬を使用することができる。この治療薬は、遺伝子をトランスフェクトしてP27を生成し得る遺伝子ベクターを含む、P27の分解を遮断し又はP27の細胞生産を向上させる小分子、ペプチド及びタンパク質を含む。タンパク質キナーゼの阻害により細胞周期を遮断するスタウロスポリン及び関連した小分子を使用することができる。タンパク質キナーゼを選択的に阻害して、PDGF及びFGF等の広い範囲の増殖因子に応答した平滑筋内のシグナル伝達に拮抗する、チロホスチンのクラスを含むタンパク質キナーゼ阻害剤も使用することができる。
【0068】
上述した任意の薬物、薬剤又は化合物は、全身に、例えば経口、静脈内、筋内、皮下、経鼻若しくは皮内投与され、又は例えばステント被膜、ステント覆い若しくは局所送達カテーテルにより局所投与され得る。加えて、上述した薬物又は薬剤は、3日間〜8週間の範囲の期間、薬物又は薬剤の標的組織との接触を維持する目的で、急速放出又は遅延放出用に処方されてもよい。
【0069】
上述したように、ラパマイシンとFKPB12との複合体は「ラパマイシンの哺乳動物標的」又はTORと称されるホスホイノシチド(PI)−3キナーゼに結合し、ホスホイノシチド(PI)−3キナーゼを阻害する。活性部位阻害剤、又はアロステリックモジュレータ、即ちアロステリックに調節する間接的な阻害剤のいずれかとして機能する、TORの触媒活性の拮抗薬は、ラパマイシンの作用を模倣するが、FKBP12に関する要求を迂回するであろう。TORの直接阻害剤の潜在的な利点は、より良好な組織浸透と、より良好な物理的/化学的安定性とを含む。また、他の潜在的な利点は、異なる組織内に存在し得るTORの多数のイソ型の1つに対する拮抗薬の特異性と、薬物のより高い効果及び/又は安全性をもたらす、下流効果の潜在的に異なる範囲とに起因する、作用の、より高い選択性及び特異性を含む。
【0070】
阻害剤は、合成又は天然由来の生成物のいずれかである小有機分子(概算mw<1000)であってもよい。ワートマニン(Wortmanin)は、このクラスのタンパク質の機能を阻害する薬剤であり得る。阻害剤は、ペプチド又はオリゴヌクレオチド配列でもあり得る。阻害剤は、全身に(経口、静脈内、筋内、皮下、経鼻、若しくは皮内)又は局所的に(ステント被膜、ステント覆い、局所薬物送達カテーテル)投与されてもよい。例えば、阻害剤は、耐食性ポリマーステント被膜からヒトの血管壁内へ放出されてもよい。加えて、阻害剤は、3日間〜8週間の範囲の期間、ラパマイシン又は他の薬物、薬剤若しくは化合物の標的組織との接触を維持する目的で、急速放出又は遅延放出用に処方されてもよい。
【0071】
前述したように、バルーン血管形成術に伴う冠動脈ステントの植え込みは、急性血管閉鎖の治療に非常に有効であり、再狭窄の危険を低減し得る。血管内超音波試験(Mintz et al.,1996)は、冠動脈ステント留置が血管収縮を効果的に予防し、またステント植え込み後の後期管腔損失の殆どが、おそらく新生内膜過形成に関連したプラーク増殖によるものであることを示唆している。冠動脈ステント留置後の後期管腔損失は、従来型バルーン血管形成術後に観察される損失のほぼ2倍高い。このように、ステントが再狭窄プロセスのうちのなくとも一部を防止するため、炎症及び増殖を予防する、又は多数のメカニズムにより増殖を防止する、薬物、薬剤又は化合物の使用は、ステントと組み合わせて血管形成術後の再狭窄に最も効果的な治療を提供することができる。
【0072】
更に、ステント等のラパマイシン溶出血管デバイスを受容しているインスリン補充糖尿病患者は、該患者の正常な又は非インスリン補充糖尿病相対者よりも高い再狭窄の発生率を示し得る。したがって、薬物の組み合わせは有益であり得る。
【0073】
ステントからの薬物、薬剤又は化合物の局所送達は、以下の利点を有する。即ち、ステント及び薬物、薬剤又は化合物の足場作用を介した血管反跳及びリモデリングの予防、並びに新生内膜過形成の多数の構成成分の予防である。この薬物、薬剤又は化合物の、ステント留置された冠動脈への局所投与は、更なる治療的利益も有し得る。例えば、全身投与にて生じるであろう組織濃度よりも高い組織濃度、全身毒性の低減、並びに単一治療及び投与の容易さが達成できるであろう。薬物療法の更なる利益は、再狭窄の低減を尚達成する一方で治療的化合物の用量が低下し、それによりそれらの毒性が制限されることであり得る。
【0074】
尚別の代替的な例示的実施形態では、ラパマイシンはシロスタゾールと組み合わせて使用され得る。シロスタゾール{6[4−(1−シクロヘキシル−1H−テトラゾール−5−イル)−ブトキシ]−3,4−ジヒドロ−2−(1H)−キノリノン}は、タイプIII(環状GMP阻害)ホスホジエステラーゼの阻害剤であり、抗血小板及び血管拡張特性を有する。シロスタゾールは、元は、環状ヌクレオチドホスホジエステラーゼ3の選択的阻害剤として開発された。血小板及び血管平滑筋細胞内のホスホジエステラーゼ3の阻害は、抗血小板効果及び血管拡張を提供することが期待された。しかしながら、最近の前臨床試験では、シロスタゾールが様々な細胞によるアデノシン取り込みを阻害する能力も有することが証明されており、この性質はシロスタゾールをミルリノン等の他のホスホジエステラーゼ3阻害剤から区別している。したがって、シロスタゾールは、多数の新規な作用メカニズムに基づく独特な抗血栓及び血管拡張特性を有することが示されている。このクラスの他の薬物は、ミルリノン、ベスナリノン(vesnarionone)、エノキシモン、ピモベンダン及びメリベンダンを含む。
【0075】
研究により、ステント植え込み後の再狭窄を低減するシロスタゾールの有効性も示されている。例えば、Matsutani M.,Ueda H.et al.:「Effect of cilostazol in preventing restenosis after percutaneous transluminal coronary angioplastyy)、Am.J.Cardiol Cardiol 1997,79:1097〜1099、Kunishima T.,Musha H.,Eto F.,et al.:A randomized trial of aspirin versus cilostazol therapy after successful coronary stent implantation,Clin Thor 1997,19:1058〜1066、及びTsuchikane E.,Fukuhara A.,Kobayashi T.,et al.:Impact of cilostazol on restenosis after percutaneous coronary balloon angioplasty,Circulation 1999,100:21〜26を参照されたい。
【0076】
本発明によれば、シロスタゾールは、医療デバイス又は医療デバイス被膜からの持続放出用に構成されて、医療デバイスの表面上の血小板沈着及び血栓形成の低減を助けてもよい。本明細書に記載するように、そのような医療デバイスは、例えば心血管、末梢及び頭蓋内ステント等の、血液と定常的に接触する任意の短期及び長期インプラントを含む。場合により、シロスタゾールは、ラパマイシン又は他の強力な抗再狭窄剤と組み合わせて適切なポリマー被膜又はマトリックス中に組み込まれてもよい。
【0077】
シロスタゾールの医療デバイス又は医療デバイス被膜への組み込み及び続く医療デバイス又は医療デバイス被膜からの持続放出は、医療デバイス表面上の血小板沈着及び血栓形成を低減することが好ましいであろう。上記に記載したように、シロスタゾールは、その血管拡張作用に一部起因して、抗再狭窄効果も有することを示す前臨床及び臨床的証拠が存在する。したがって、シロスタゾールは薬物溶出ステント等の血液接触デバイスのうちの少なくとも2つの局面に有効である。したがって、シロスタゾールと、シロリムス、その類似体、誘導体、同類物及びコンジュゲート、又はパクリトキセル(paclitoxel)、その類似体、誘導体、同類物及びコンジュゲート等のラパマイシンを含む他の強力な抗再狭窄剤の1種との組み合わせは、心血管疾患の局所治療、並びに医療デバイスの表面上の血小板沈着及び血栓形成の低減に使用することができる。ステントに関して記載したが、この例示的な実施形態に関して記載した薬物の組み合わせは、そのいくつかが本明細書に記載されている任意数の医療デバイスに関連して使用し得ることに留意することが重要である。
【0078】
図3に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第1の例示的な形態を示す。この例示的な実施形態では、ステントは、コーディス社(Cordis Corporation)から入手可能なBx Velocity(登録商標)ステントである。この特定の形態において、ステント7500は、3つの層で被覆されている。第1の層、即ち内側層7502は、内側層7502の総重量の45重量パーセントと等価である180(μg)マイクログラムのシロリムスと、内側層7502の総重量の55重量パーセントと等価であるポリエチレン−コ−ビニルアセテート及びポリブチルメタクリレート、EVA/BMAのコポリマーマトリックスとを含有する。第2の層、即ち外側層7504は、外側層7504の総重量の45重量パーセントと等価である100(μg)マイクログラムのシロスタゾールと、外側層7504の総重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第3の層、即ち拡散オーバーコート7506は、200(μg)マイクログラムのBMAを含有する。含有量回復の範囲は、シロリムスに関して公称薬物含有量の85パーセント、シロスタゾールに関して公称薬物含有量の98パーセントであった。シロスタゾールとシロリムスの両方に関するインビトロでの放出動力学を図4に示し、次により詳細に記載する。
【0079】
図5に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第2の例示的な形態を示す。上述したように、ステントは、コーディス社(Cordis Corporation)から入手可能なBx Velocity(登録商標)ステントである。この例示的な実施形態において、ステント7700は、3つの層で被覆されている。第1の層、即ち内側層7702は、内側層7702の総重量の45重量パーセントと等価である180(μg)マイクログラムのシロリムスと、内側層7702の総重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第2の層、即ち外側層7704は、外側層7704の総重量の45パーセントと等価である100(μg)マイクログラムのシロスタゾールと、外側層7704の重量の55重量パーセントと等価であるEVA/BMAのコポリマーマトリックスとを含有する。第三の層、即ち拡散オーバーコート7706は、100(μg)マイクログラムのBMAを含有する。再度、含有量回収の範囲は、シロリムスに関して公称薬物含有量の85パーセント、シロスタゾールに関して公称薬物含有量の98パーセントであった。シロスタゾールとシロリムスの両方に関するインビトロでの放出動力学を図6に示し、次により詳細に記載する。
【0080】
図4と図6との比較から容易に理解し得るように、シロリムスとシロスタゾールの両方の薬物放出速度は、より厚いBMA、即ち100マイクログラムではなく200マイクログラムの拡散オーバーコートを含む形態にて比較的遅い。したがって、本明細書により完全に記載するように、拡散オーバーコートの選択的使用により、両方の薬物に関する薬物溶出速度の追加の制御を達成することができる。拡散オーバーコートの選択的な使用は、厚さ、及び化学的不適合を含む他の特徴を含む。
【0081】
図7に、ステント上のシロスタゾールとラパマイシンとの組み合わせの第3の例示的な形態を示す。この形態は、図3の形態と同一の構造体であるが、シロスタゾールの量が、50(μg)マイクログラムに低下されている。以前の例示的な実施形態と同様、ステント7900と、3つの追加の層7902、層7904及び層7906が存在する。しかしながら、重量の百分率は同一のままである。
【0082】
図8に、上述した3つの形態の抗血栓効果を示す。図8は、インビトロでのウシ血液ループモデル(bovine blood loop model)での上述したシロリムス/シロスタゾールの組み合わせ被膜の抗血栓特性を示す。インビトロでのウシ血液ループモデルでは、新鮮なウシ血液にヘパリンが添加されて急性凝固時間(ACT)が約200秒に調整される。血液中の血小板含有量を、インジウム111の使用により標識する。この研究では、血液循環の閉ループシステムの一部であるシリコーン管内にステントを留置する。循環ポンプを用いて、ヘパリン添加血液を、閉ループシステムを通して循環させる。時間と共にステント表面上に凝血及び血栓が蓄積し、ステント留置ループを通した血液の流量が低下する。流量は、開始値の50パーセント迄低下した時、又は試験ステントのいずれも流量を50パーセントだけ低下させない場合90分後に、停止される。ステント表面上の総放射能(111内)をβカウンターにより計数し、チャート内で100パーセントに設定した対照ユニットにより正規化する。より小さい数は、表面の血栓形成がより低いことを示す。全3種のシロリムス/シロスタゾール二薬被膜群は、ステント表面上の血小板沈着と血栓形成とを、追加のシロスタゾール化合物なしで、対照薬物溶出ステントと比較して90パーセントを超えて低減した。棒グラフ8002は、100パーセントに正規化された対照薬物溶出ステントを表す。対照薬物溶出ステントは、コーディス社から入手可能なCypher(登録商標)シロリムス溶出冠動脈ステントである。棒グラフ8004は、ヘパリンで被覆されたステントであり、コーディス社から、Bx Velocity(登録商標)冠動脈ステント商標上のHEPACOAT(登録商標)で入手可能である。棒グラフ8006は、図3に示す構造に関連して示されるよう構成されたステントである。棒グラフ8008は、図5に示す構造に関連して示されるよう構成されたステントである。棒グラフ8010は、図7に示す構造に関連して示されるよう構成されたステントである。図8から容易に理解し得るように、シロスタゾールは血栓形成を有意に低減する。
【0083】
シロスタゾールで被覆されたデバイスの血栓抵抗性の能力に関する他の臨床パラメータは、被膜からの薬物放出の持続時間である。これは、デバイス植え込みから2週間後に特に有意である。二薬溶出被膜のブタ薬物溶出PK研究において、シロスタゾール及びシロリムスの両方が被膜から遅延放出され、持続薬物放出プロファイルが得られた。ブタPK研究の目的は、所定の植え込み時間における薬物溶出ステントの局所薬物動態の評価である。通常、ブタの3つの異なる冠動脈内に、所定の時点で3つのステントが植え込まれ、その後薬物回収分析のために回収される。ステントは、所定の時点で、即ち1、3及び8日目に回収される。ステントが抽出され、ステント上に残留する総薬物量は、HPLC(高速液体クロマトグラフィー)を用いて総薬物量に関して分析することにより決定される。ステント上の元の薬物量と、所定の時間に回収された薬物量との間の差異は、その期間に放出された薬物量を表す。周囲の動脈組織内への薬物の連続放出は、冠動脈内の新生内膜増殖と再狭窄を防止するものである。正規プロットは、全薬物放出の百分率(%、y軸)対植え込みの時間(日、x軸)を表す。図9に示すように、植え込みから8日後、2種の薬物の約80パーセント(80%)が薬物被膜中に残留していた。加えて、それぞれのlogP値及び水溶性が比較的大きい差を有するにも関わらず、両方の薬物は同様の速度で放出されていた。曲線8102はシロスタゾールを表し、曲線8104はシロリムスを表す。それらのそれぞれのインビトロでの放出プロファイルを、図10に示す。インビボでの放出プロファイルと同様、正方形で表すシロリムスと菱形で表すシロスタゾールとの両方が比較的ゆっくりと放出され、両方の薬物から約35パーセントのみ放出された。図9及び図10は、それぞれ、図11の形態に従って被覆されたステントからのインビボ及びインビトロでの放出速度を表し、ここでシロリムス及びシロスタゾールは2つの別個の層ではなく、単一の層である。この例示的な形態において、ステント8300は、2つの層で被覆されている。第1の層8302は、シロリムス、シロスタゾールの組み合わせ及びEVA/BMAのコポリマーマトリックスを含有する。第2の層、即ち拡散オーバーコート8304は、BMAのみを含む。より詳細には、この実施形態において、第1の層8302は第1の層8302の総重量の45重量パーセントを占めるシロリムスとシロスタゾールとの組み合わせと、第1の層8302の総重量の55パーセントを占めるEVA/BMAコポリマーマトリックスとを含有する。拡散オーバーコートは、100(μg)マイクログラムのBMAを含有する。
【0084】
図12及び図13は、それぞれ、図3の形態に従って被覆されたステントからのインビボ及びインビトロでの放出速度を表す。層状の二薬溶出被膜は、図12と図9との比較から容易に理解し得るように、同一のブタPKモデルにおいて、二薬ベースの被膜と比較してより速い放出速度を有した。図12にて、曲線8402はシロスタゾールを表し、曲線8404はシロリムスを表す。しかしながら、両方の薬物の放出の百分率は、各時点で類似している。それぞれのインビトロでの放出速度プロファイルを図12に示し、ここで菱形はシロスタゾールを表し、正方形はシロリムスを表す。二薬ベースの被膜と比較して、両方の薬物は遙かに速い速度で放出され、インビボでのPK研究に示された速い放出プロファイルを反映している。したがって、単一層中の薬物の組み合わせにより、より高い程度の溶出速度の制御がもたらされる。
【0085】
シロリムス等のラパマイシンとシロスタゾールとの組み合わせは、上述したように、いずれかの薬物単独と比較して、平滑筋細胞増殖及び遊走の低減においてより有効であり得る。加えて、本明細書に示すように、組み合わせ被膜からのシロスタゾールの放出は持続様式で制御されて、ステント表面又は他の血液接触医療デバイスの表面上の延長された抗血小板沈着及び血栓形成を達成することができる。組み合わせ被膜中のシロスタゾールは、シロリムスと共に単一の層で、又はシロリムス含有層の外部の別個の層中に組み込まれてもよい。その比較的低い水溶性により、シロスタゾールは、ステント又は他の医療デバイスの留置後、身体内で被膜中に比較的長時間維持される可能性がある。内側層中のシロリムスと比較すると比較的遅いインビトロでの溶出は、そのような可能性を示唆する。シロスタゾールは、安定で、通常の有機溶媒に可溶であり、本明細書に記載する様々な皮膜技術と類似する。シロリムス及びシロスタゾールの両方が、非吸収性ポリマーマトリックス又は吸収性マトリックス中に組み込めることに留意することも重要である。
【0086】
図14は、拡張可能な医療デバイスにより組織に送達される有益な薬剤を含有する複数の孔を有する、代替の例示的な拡張可能な医療デバイスを示す。図14に示す拡張可能な医療デバイス9900は、材料の管から切られて、円筒形の拡張可能なデバイスが形成される。拡張可能な医療デバイス9900は、複数の架橋要素9904により相互接続された複数の円筒部分9902を含む。架橋要素9904は、脈管の曲がりくねった経路を留置部位まで通過する際に、組織支持デバイスが軸方向に屈曲することを可能にし、また支持される管腔の屈曲に一致する必要がある場合、デバイスが軸方向に屈曲することを可能にする。各円筒管9902は、延性ヒンジ9910及び周囲方向ストラット9912により相互接続された細長いストラット9908のネットワークにより形成される。医療デバイス9900の拡張中、延性ヒンジ9910は変形するが、ストラット9908は変形されない。拡張可能な医療デバイスの一例の更なる詳細は、その全体が参照により本明細書に組み込まれる米国特許第6,241,762号に記載されている。
【0087】
図14に示すように、細長いストラット9908及び周囲方向ストラット9912は開口部9914を含み、開口部の数個は、内部に拡張可能な医療デバイスが植え込まれた管腔に送達するための有益な薬剤を収容する。加えて、図18に関連して下記に説明するように、架橋要素9904等のデバイス9900の他の部分は、開口部を含んでもよい。好ましくは、開口部9914は、ストラット9908等のデバイス9900の非変形部分に提供され、それ故、デバイスの拡張中に開口部が変形されず、有益な薬剤は破砕、排出、又は別様に損傷される危険性なしで送達される。有益な薬剤を開口部9914内に負荷し得る方法の一例の更なる説明は、その全体が参照により本明細書に組み込まれる2001年9月7日出願の米国特許出願第09/948,987号に記載されている。
【0088】
図示した本発明の例示的な実施形態は、有限要素解析(Finite Element Analysis)及び他の技術により更に洗練されて、開口部9914内の有益な薬剤の留置を最適化してもよい。基本的に、開口部9914の形状及び位置は、空隙の容積を最大にすると共に、延性ヒンジ9910に関連したストラットの比較的高い強度及び剛性を保持するように変更されてもよい。本発明の一つの好ましい例示的な実施形態によれば、開口部は、少なくとも3.2E−5cm2(5×10−6平方インチ)、好ましくは少なくとも4.5E−5cm2(7×10−6平方インチ)の面積を有する。一般に、開口部は、約50%〜約95%だけ有益な薬剤で充填される。
【0089】
本明細書に記載される本発明の様々な例示的な実施形態は、拡張可能なデバイス内の異なる開口部内に異なる有益な薬剤を提供し、又は数個の開口部内に有益な薬剤を提供して他には提供しない。別の実施形態では、有益な薬剤又は治療薬の組み合わせは、単一の開口部内で使用されてもよい。拡張可能な医療デバイスの特定の構造体は、本発明の趣旨から逸脱せずに変更することができる。各開口部が独立して充填されるので、各開口部における有益な薬剤に別々の化学組成及び薬物動態学特性を付与することができる。
【0090】
拡張可能な医療デバイス内の異なる開口部内に異なる有益な薬剤を使用すること、又は一部の開口部内にはあるが他の開口部内にはない有益な薬剤の使用の一例は、縁効果再狭窄の対処におけるものである。上記に説明したように、現世代の被覆ステントは、ステント縁を丁度越えた箇所で生じ、ステントの周囲及び管腔空間内に進行する縁効果再狭窄又は再狭窄による問題を有し得る。
【0091】
第一世代の薬物送達ステントにおける縁効果再狭窄の原因は、現在よく理解されていない。血管形成術及び/又はステント植え込みによる組織損傷領域が、パクリタキセル及びラパマイシン等の現世代の有益な薬剤の拡散範囲を超えて拡大し、これが組織内で強く仕切る傾向を有するためであり得る。同様の現象が放射線療法に観察されており、この療法にてステントの縁における低線量の放射線が、損傷の存在下で刺激性を有することが証明されている。この場合、無傷の組織が照射されるまで、より長い長さに亘り放射することが、問題を解決した。薬物送達ステントの場合、より高い用量若しくはより高い濃度の有益な薬剤をステント縁に沿って配置し、より容易に組織を通して拡散する異なる薬剤をステント縁に配置し、又は異なる有益な薬剤若しくは有益な薬剤の組み合わせをデバイスの縁に配置することは、縁効果再狭窄の問題を改善する助けとなり得る。
【0092】
図14に、縁効果再狭窄を治療及び低減するために「ホットエンド」又は有益な薬剤がデバイスの末端部の開口部9914a内に提供された拡張可能な医療デバイス9900を示す。デバイスの中心部分内のその他の開口部9914bは、空(図示するように)であっても、又はより低い濃度の有益な薬剤を含んでいてもよい。
【0093】
縁効果再狭窄の他の機構は、特定の薬物又は薬物の組み合わせの細胞毒性に関するものであり得る。そのような機構は、上皮瘢痕組織形成にて見られるものと同様の組織の物理的又は機械的収縮を含んでもよく、ステントはそれ自体の境界内で収縮反応を防止し得るが、その縁を越えては防止しない。更に、再狭窄のこの後者の形態の機構は、薬物自体がもはや壁内に存在しなくなった後でも発生する動脈壁に対する持続又は局所薬物送達の後遺症に関連している場合がある。即ち、再狭窄は、薬物及び/又は薬物担体に関連した有害な損傷の形態に対する反応であり得る。この状況下で、デバイスの縁から所定の薬剤を排除することは有益であり得る。
【0094】
図15は、デバイスの中心部分内の開口部10230bが有益な薬剤で充填され、デバイスの縁の開口部10230aが空のままである、複数の開口部10230を有する拡張可能な医療デバイス10200の別の例示的な実施形態を示す。図15のデバイスは、「クールエンド」を有すると称される。
【0095】
再狭窄の低減における使用に加えて、図15の拡張可能な医療デバイス10200は、最初のステント留置の手順が追加のステントを用いて補足される必要がある場合、図14の拡張可能な医療デバイス9900又は別の薬物送達ステントと共に使用することができる。例えば、場合によっては、「ホットエンド」を有する図14のデバイス9900、又は均一な薬物分配を有するデバイスは、不適切に植え込まれ得る。デバイスが管腔の十分な部分を覆っていないと医者が確定した場合、補足デバイスを現存するデバイスの一方の末端部に、この現存するデバイスと僅かに重なって付加することができる。補足デバイスが植え込まれる際、図15のデバイス10200は、医療デバイス10200の「クールエンド」がデバイス9900及びデバイス10200の重なる部分に有益な薬剤が二重に投与されることを防止するように使用される。
【0096】
図16に、拡張可能な医療デバイス11300の異なる孔内に異なる有益な薬剤が配置された、本発明の更なる代替的な例示的実施形態を示す。第1の有益な薬剤はデバイス末端部の孔11330a内に提供され、第2の有益な薬剤はデバイス中心部分の孔11330b内に提供されている。有益な薬剤は、異なる薬物、異なる濃度の同一の薬物、又は同一の薬物の異なる変更物を含有し得る。図16の例示的な実施形態を用いて、「ホットエンド」又は「クールエンド」のいずれかを有する拡張可能な医療デバイス11300を提供することができる。
【0097】
好ましくは、第1の有益な薬剤を含む孔11330aを含むデバイス11300の各末端部は、縁から少なくとも1つの孔、最大約15個の孔まで延びる。この距離は、未拡張デバイスの縁から約0.127〜約2.54mm(約0.005〜約0.1インチ)に対応する。第1の有益な薬剤を含むデバイス11300の縁からの距離は、好ましくは約一部分であり、ここで一部分は架橋要素間で画定される。
【0098】
異なる薬物を含む異なる有益な薬剤は、ステント内の異なる開口部内に配置され得る。このことは、単一のステントから任意の所望の送達パターンで2種以上の有益な薬剤を送達することを可能にする。代替的に、異なる濃度の同一の薬物を含む異なる有益な薬剤を、異なる開口部内に配置してもよい。このことは、非均一なデバイス構造体により薬物を組織に均一に分配することを可能にする。
【0099】
本明細書に記載されるデバイス内に提供される2種以上の異なる有益な薬剤は、(1)異なる薬物、(2)異なる濃度の同一の薬物、(3)異なる放出動力学、即ち、異なるマトリックス浸食速度を有する同一の薬物、又は(4)異なる形態の同一の薬物を含み得る。異なる放出動力学を有する同一の薬物を含む、異なる有益な薬剤の例は、異なる担体を使用して、異なる形状の溶出プロファイルを達成し得る。同一の薬物の異なる形態のいくつかの例は、様々な親水性又は親油性を有する薬物の形態を含む。
【0100】
図16のデバイス11300の一例において、デバイス末端部の孔11330aは、高い親油性を有する薬物を含有する第1の有益な薬剤で負荷される一方、デバイス中心部分の孔11330bは、より低い親油性を有する薬物を含有する第2の有益な薬剤で負荷される。「ホットエンド」で高い親油性を有する第1の有益な薬剤は、より容易に周辺の組織に放散して、縁効果再狭窄を低減する。
【0101】
デバイス11300は、有益な薬剤が第1の薬剤から第2の薬剤へ変化する突然移行ラインを有していてもよい。例えば、デバイスの末端部から1.27mm(0.05インチ)内にある全ての開口部が第1の薬剤を収容し、残りの開口部が第2の薬剤を収容してもよい。あるいは、このデバイスでは、第1の薬剤と第2の薬剤との間が徐々に移行してもよい。例えば、開口部内の薬物の濃度は、デバイス末端部に向かって次第に増大(又は低下)してもよい。別の実施例において、デバイス末端に向かって移動するにつれ、開口部内の第1の薬物の量が増加する一方、開口部内の第2の薬物の量は減少する。
【0102】
図17に、拡張可能な医療デバイス12400の更なる別の例示的な実施形態を示し、ここで異なる有益な薬剤は、デバイス内の異なる開口部12430a、12430b内に交互又は散在様式で配置されている。この様式では、デバイスにより支持される全面積又は面積の一部分上の組織に、多数の有益な薬剤を送達することができる。この例示的な実施形態は、有益な薬剤間の相互作用又は安定性の問題により、多数の薬剤を単一の組成物に組み合わせてデバイス内に負荷することが不可能な場合に、多数の有益な薬剤の送達に有用であろう。
【0103】
拡張可能な医療デバイスが拡張形態にて非均一な開口部の分配を有する場合、異なる既定組織領域にて異なる薬物濃度を達成するために、異なる開口部内における異なる有益な薬剤の使用に加えて、異なる開口部内に異なる有益な薬剤を負荷して、送達される有益な薬剤のより均等な空間分配を提供することができる。
【0104】
異なる開口部内に異なる薬物を散在又は交互様式にて使用することにより、同一のポリマー/薬物マトリックス組成物中で組み合わされた場合に送達不可能であり得る2種の異なる薬物を送達することができる。例えば、薬物自体は、望ましくないように相互作用し得る。あるいは、2種の薬物は、マトリックスを形成するために同一のポリマーと適合可能でなくてもよく、又はポリマー/薬物マトリックスを開口部内へ送達するために同一の溶媒と適合可能でなくてもよい。
【0105】
更に、散在配置で異なる開口部内に異なる薬物を有する図17の例示的な実施形態は、異なる薬物を同一の医療デバイス又はステントから極めて異なる所望の放出動力学で送達する能力と、個々の薬剤の作用機構及び性質に応じて放出動力学を最適化する能力とを提供する。例えば、薬剤の水溶性は、ポリマー又は他のマトリックスからの薬剤放出に多大に影響する。高い水溶性を有する化合物は、一般にポリマーマトリックスから非常に急速に送達される一方、親油性薬剤は同一のマトリックスからより長い時間に亘り送達されるであろう。したがって、親水性薬剤及び親油性薬剤が医療デバイスから二薬の組み合わせとして送達される場合、同一のポリマーマトリクスから送達されるこれら2種の薬剤に関する所望の放出プロファイルをもたらすことは困難である。
【0106】
図17のシステムにより、同一のステントから親水性薬物及び親油性薬物を容易に送達することができる。更に、図17のシステムにより、2種の薬剤を2つの異なる放出動力学及び/又は投与期間にて送達することができる。最初の24時間の各初期放出、最初の24時間後の放出速度、2種の薬物の総投与期間及び任意の他の放出特性は、独立して制御することができる。例えば、第1の有益な薬剤の放出速度を、最初の24時間中に送達される薬物の少なくとも40%(好ましくは、少なくとも50%)が送達されるように準備し、第2の有益な薬剤は最初の24時間中に送達される薬物の20%(好ましくは、10%より少ない)未満が送達されるよう準備することができる。第1の有益な薬剤の投与期間は、約3週間以下(好ましくは、2週間以下)であってもよく、第2の有益な薬剤の投与期間は、約4週間以上であってもよい。
【0107】
再狭窄、即ち介入後の閉塞の再発は、生物学的過程の組み合わせ又は一連の生物学的過程を伴う。これらの過程は、血小板及びマクロファージの活性化を含む。サイトカイン及び増殖因子は、平滑筋細胞増殖に寄与し、遺伝子及びメタロプロテイナーゼの上方制御は、細胞増殖、細胞外マトリックスのリモデリング、及び平滑筋細胞遊走を誘導する。複数のこれらの過程に対処する、薬物の組み合わせによる薬物療法は、最も成功する抗再狭窄療法であり得る。本発明は、そのような成功する組み合わせられた薬物療法を達成する手段を提供する。
【0108】
以下に説明する実施例は、異なる孔又は開口部内の異なる薬物を放出する能力から利益を得る、組み合わせられた薬物システムのいくつかを示す。散在する又は交互の孔から2種の薬物を送達するための有益なシステムの一例は、抗増殖剤又は抗遊走剤と組み合わせた抗炎症剤又は免疫抑制剤の送達である。再狭窄に関与する多数の生物学的過程を標的とするのに、これら薬剤の他の組み合わせも使用することができる。抗炎症剤は血管形成術及びステント留置に対する血管の最初の炎症性反応を緩和し、炎症性反応を刺激するマクロファージの発達のピークに一致させて、最初は速い速度で送達され、その後、約2週間の期間にわたりゆっくりと送達される。抗増殖剤は、より長期間に亘って比較的均等な速度で送達されて、平滑筋細胞の移動及び増殖を低下させる。
【0109】
以下に示す実施例に加えて、以下の表、表7.0は、医療デバイス内の異なる開口部に薬物を配置することにより達成し得る、有用な二薬組み合わせ療法のいくつかを示す。
【表7】

【0110】
異なる開口部内に薬物を配置することにより、薬物が疎水性又は疎油性であるかに関わらず、特定の薬剤に対して放出動力学を誂えることができる。実質的に一定又は線形の放出速度における親油性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年12月23日公開の国際公開第04/110302号に記載されている。親水性薬物の送達のためのいくつかの配置の例は、その全体が参照により本明細書に組み込まれる2004年5月27日公開の国際公開第04/043510号に記載されている。上記に列挙した親水性薬物には、CdA、グリベック、VIP、インスリン、及びアポリポタンパク質A−1ミラノが挙げられる。上記に列挙した親油性薬物には、パクリタキセル、エポシロンD、ラパマイシン、ピメクロリムス、PKC−412及びデキサメタゾンが挙げられる。ファルグリタザルは、一部親油性で、一部親水性である。
【0111】
再狭窄に関連した異なる生物学的過程に対処する多数の薬物の送達に加えて、本発明は、同一のステントから2種の異なる薬物を送達して、異なる疾病を治療することができる。例えば、ステントは、例えばパクリタキセル又はリムス(limus)薬等の抗増殖剤を、一組の開口部から送達して再狭窄を治療する一方、例えばインスリン等の心筋保護剤を他の開口部から送達して、急性心筋梗塞を治療することができる。
【0112】
公知の拡張可能なデバイスの多数において、また図18に示したデバイスに関して、デバイス13500の適用範囲は、デバイスの円筒形の管部分13512が架橋要素13514と比較して大きい。適用範囲は、デバイス表面面積の、デバイスが留置される管腔の面積に対する比として定義される。可変の適用範囲を有するデバイスが、デバイス内の開口部内に収容された有益な薬剤の送達に使用される場合、円筒形の管部分13512に隣接した組織に送達される有益な薬剤の濃度は、架橋要素13514に隣接した組織に送達される有益な薬剤よりも高い。このデバイス構造体内の長手方向の変動、及び不均等な有益な薬剤送達濃度に繋がるデバイス適用範囲の他の変動に対処するため、デバイスの一部分において開口部内で有益な薬剤の濃度を変更して、組織全体での有益な薬剤のより均等な分配を達成する。図18に示す例示的な実施形態の場合、管部分13512内の開口部13530aは、架橋要素13514内の開口部13530bよりも低い薬物濃度を有する有益な薬剤を収容する。薬剤送達の均一性は、薬物濃度、開口部の直径又は形状、開口部内の薬剤の量(即ち、開口部の充填(filed)の百分率)、マトリックス材料、又は薬物の形態を変更することを含む様々な方法で達成することができる。
【0113】
異なる開口部内に異なる有益な薬剤を使用する他の適用の例は、血管内の分岐に使用するよう構成された図19に示す拡張可能な医療デバイス14600にある。分岐デバイスは側部孔14610を含み、この側部孔は、血管の側枝を通して血液を流すように配置されている。分岐デバイスの一例は、その全体が参照により本明細書に組み込まれる米国特許第6,293,967号に記載されている。分岐デバイス14600は、デバイスのその他の部分を形成するビームの規則的なパターンを中断する側部孔の特徴14610を含む。分岐の周囲の領域は、再狭窄に関して特に問題のある領域であるため、抗増殖薬物の濃度は、デバイス14600の側部孔14610を囲む領域における開口部14630a内で増大されて、必要な場所に、増大した濃度の薬物を送達することができる。側部孔から離れた範囲内の残りの開口部14630bは、より低い濃度の抗増殖剤を有する有益な薬物を収容する。分岐孔を囲む領域への抗増殖剤送達の増大は、異なる薬物を含有する異なる有益な薬剤、又はより高い濃度の同一の薬物を含有する異なる有益な薬剤により提供され得る。
【0114】
拡張可能な医療デバイスの壁面又は反管腔側に異なる有益な薬剤を送達して、血管壁を治療することに加えて、有益な薬剤は拡張可能な医療デバイスの管腔側に送達されて、血栓症を予防又は低減することができる。デバイスの管腔側から血液流中に送達される薬物は、デバイスの近位端、又はデバイスの遠位端に位置していてもよい。
【0115】
異なる有益な薬剤を、拡張可能な医療デバイス内の異なる開口部内に負荷するための方法は、例えば浸漬及び被覆等の公知の技術、並びに公知の圧電マイクロジェット技術も含み得る。マイクロインジェクションデバイスは、コンピュータ制御されて、正確な量の2種以上の有益な液体薬剤を、公知の方法にて、拡張可能な医療デバイス上の正確な位置へ送達することができる。例えば、二薬噴射デバイスは、2種の薬剤を同時に又は連続的に開口部内に送達することができる。有益な薬剤が、拡張可能な医療デバイス内の貫通開口部内へ負荷される際に、貫通開口部の管腔側は、負荷中、弾性マンドレルにより遮断されて、有益な薬剤が液体形態で、例えば溶媒と共に送達されることを可能にし得る。有益な薬剤は、手動注入デバイスによっても負荷することができる。
【0116】
図20に、ステント内の異なる孔から送達される抗炎症剤及び抗増殖剤を有して、再狭窄の生物学的過程に一致するよう特にプログラムされた2種の薬物の独立した放出動力学を提供する二薬ステント15700を示す。この実施例によれば、二薬ステントは、第2の組の開口部15720内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部15710内の抗炎症剤であるピメクロリムスを含む。各薬剤は、ステントの孔内のマトリックス材料中に、図21に示す放出動力学をもたらすよう構成された特定のインレー配置で提供される。各薬物は、再狭窄の治療のために主に壁面側へ送達される。
【0117】
図20に示すように、ピメクロリムスは、孔の管腔側にバリア15712を用いることにより、ステントの壁面側に定方向送達されるようステント内に提供されている。バリア15712は、生分解性ポリマーにより形成されている。ピメクロリムスは、二重相を有する放出動力学を形成する様式で孔内に負荷される。ピメクロリムス放出の第1の相は、マトリックスの壁面に位置する領域15716により提供され、この領域は急速放出製剤を含み、製剤は、ピメクロリムスと生分解性ポリマー(PLGA)とを含み、ここで薬物は高い百分率を有し、例えば約10%のポリマーに対して約90%の薬物を含む。放出の第2の相は、ピメクロリムスと生分解性ポリマー(PLGA)が、50%のポリマーに対して約50%の薬物の比を有するマトリックスの中心領域15714により提供される。図21のグラフから明らかであり得るように、ピメクロリムス放出の第1の相は、ほぼ最初の24時間にて約50%の負荷薬物を送達する。放出の第2の相は、残りの50%を約2週間かけて送達する。この放出は、血管形成術及びステント留置に続く炎症過程の進行に一致するよう詳細にプログラミングされる。2つの領域間で薬物濃度を変えて二相放出を達成することに加えて、又はそれに代替して、異なるポリマー又は異なるコモノマー比の同一のポリマーを、2つの薬物の異なる領域内で使用して、2つの異なる放出速度を達成することができる。
【0118】
パクリタキセルは、図21に示すように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部15720内に負荷される。パクリタキセル開口部15720は3つの領域で負荷され、該領域は、孔の管腔側の最小限の薬物を含む主にポリマーでできた基部領域15722、濃度勾配にて提供されるパクリタキセル及びポリマー(PLGA)を有する中心領域15724、並びにパクリタキセル放出を制御する主にポリマーを有するキャップ領域15726を含む。パクリタキセルは、第一日目にて全薬物負荷の約5〜約15%が初期放出された後、約20〜90日間、実質的に線形放出される。濃度勾配を有する孔内のパクリタキセルに関する配置の更なる例は、上記の国際公開第04/110302号に記載されている。
【0119】
図20に、説明を容易にするために、開口部内の区別される領域として薬物、バリア及びキャップ領域を示す。これらの領域は不明瞭であり、異なる領域を一体化することにより形成されることを理解するべきである。それ故、バリア層は薬物を有さない主にポリマーであるが、使用する製造過程に応じて、続く領域のいくらかの少量の薬物がバリア領域内に組み込まれ得る。
【0120】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、ピメクロリムスの量は約50〜約3マイクログラム、好ましくは約100〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。一例において、約200マイクログラムのピメクロリムス及び約20マイクログラムのパクリタキセルが送達される。薬物は、ステント内の交互孔内に位置していてもよい。しかしながら、送達される2種の薬物の用量間の大きな相違に鑑みると、パクリタキセルをステント内の4つの孔の各3番目に配置することが望ましいと思われる。あるいは、低用量の薬物(パクリタキセル)を送達するための孔は、高用量用の孔よりも小さく形成されてもよい。
【0121】
ポリマー/薬物インレーは、その全体が参照により本明細書に組み込まれる2004年4月1日公開の国際公開第04/026182号に記載されている、コンピュータ制御による圧電インジェクション技術により形成される。第1の薬剤のインレーが最初に形成された後、圧電インジェクタを使用して第2の薬剤のインレーが形成され得る。あるいは、国際公開第04/02182号のシステムに二重圧電ディスペンサーを搭載して、2種の薬剤を同時に分配してもよい。
【0122】
この例示的な実施形態によれば、二薬ステントは、第2の組の開口部15720内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部15710内のグリベックを含む。各薬剤は、ステントの孔内のマトリックス材料中に、図21に示す放出動力学をもたらすよう構成された特定のインレー配置で提供される。
【0123】
グリベックは、二相放出により送達され、この放出は、第1日目の高い初期放出と、次の1〜2週間の遅延放出とを含む。グリベック放出の第1の相は、ほぼ最初の24時間で、負荷した薬物の約50%を送達する。放出の第2の相は、残りの50%を約1〜2週間で送達する。パクリタキセルは、図21に示し、また上述したように、最初の約24時間後に実質的に線形放出を有する放出動力学を形成するよう、開口部15720内に負荷される。
【0124】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmのステントに関して、グリベックの量は、約200〜約500マイクログラム、好ましくは約300〜約400マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。上述した例示的な実施形態と同様、薬物は、ステント内の交互孔内に配置され、又は非交互に散在されてもよい。ポリマー/薬物インレーは、上述した方法により形成される。
【0125】
この例示的な実施形態によれば、二薬ステントは、第2の組の開口部内の抗増殖剤であるパクリタキセルと組み合わせて、第1の組の開口部内のPKC−412(細胞増殖制御因子)を含む。各薬剤は、ステントの孔内のマトリックス材料中に、以下に説明する放出動力学をもたらすよう設計された特定のインレー配置で提供される。
【0126】
PKC−412は、最初の約24時間の後、実質的に一定の放出速度で送達され、約4〜16週間、好ましくは約6〜12週間の間放出される。パクリタキセルは、最初の約24時間後、実質的に線形放出を有する放出動力学を形成するように、開口部内に負荷され、放出は、約4〜16週間、好ましくは約6〜12週間の間にわたる。
【0127】
送達される薬物の量は、ステントの寸法に応じて変動する。3mm×6mmステントに関して、PKC−412の量は、約100〜約400マイクログラム、好ましくは約150〜約250マイクログラムである。このステントから送達されるパクリタキセルの量は、約5〜約50マイクログラム、好ましくは約10〜約30マイクログラムである。上述した例示的な実施形態と同様、薬物は、ステント内の交互孔内に配置され、又は非交互に散在されてもよい。ポリマー/薬物インレーは、上述した方法により形成される。
【0128】
本明細書に記載される薬剤のいくつかは、それらの活性を保存する添加剤と組み合わされてもよい。例えば界面活性剤、制酸薬、抗酸化剤、及び洗剤を含む添加剤を使用してタンパク質薬物の変性及び凝集を最小にすることができる。陰イオン性、陽イオン性、又は非イオン性界面活性剤を使用することができる。非イオン性賦形剤の例には、ソルビトール、ショ糖、トレハロースを含む糖;デキストラン、カルボキシメチル(CM)デキストラン、ジエチルアミノエチル(DEAE)デキストランを含むデキストラン;D−グルコサミン酸、及びD−ブドウ糖ジエチルメルカプタールを含む糖誘導体;ポリエチレングリコール(PEO)及びポリビニルピロリドン(PVP)を含む合成ポリエステル;D−乳酸、グリコール酸、及びプロピオン酸を含むカルボン酸;n−ドデシル−.β.−D−マルトシド、n−オクチル−.β.−D−グルコシド、PEO−脂肪酸エステル(例えば、ステアリン酸エステル(myrj 59)又はオレイン酸エステル)、PEO−ソルビタン−脂肪酸エステル(例えば、Tween 80、PEO−20モノオレイン酸ソルビタン)、ソルビタン−脂肪酸エステル(例えば、SPAN 60、モノステアリン酸ソルビタン)、PEO−グリセリル−脂肪酸エステルを含む、疎水性界面のための親和性を伴う界面活性剤;グリセリル脂肪酸エステル(例えば、モノステアリン酸グリセリル)、PEO−炭化水素−エーテル(例えば、PEO−10オレイルエーテル;トリトンX−100;並びにルブロールが挙げられるが、これらに限定されない。イオン性洗剤の例は、ステアリン酸カルシウム、ステアリン酸マグネシウム、及びステアリン酸亜鉛を含む脂肪酸塩;レシチン及びホスファチジルコリンを含むリン脂質;(PC)CM−PEG;コール酸;ドデシル硫酸ナトリウム(SDS);ドクサート(AOT);並びにタウモコール酸を含むが、これらに限定されない。
【0129】
別の例示的な実施形態によれば、ステント又は管腔内足場は、本明細書に記載されるように、孔又は開口部内に堆積した1種以上の治療薬に加えて、抗血栓剤で被覆され得る。例示的な一実施形態において、ステントは、内部に開口部を製作され、開口部内に他の治療薬を追加又は堆積するに先立って、担体ビヒクル(ポリマー又はポリマー性マトリックス)を伴う又は伴わない抗血栓剤が、ステント又はこのステントの一部分に付着され得る。この例示的な実施形態において、ステントの管腔側及び反管腔側表面を、また開口部の壁の表面を、抗血栓剤又は皮膜で被覆し得る。代替的な例示的な実施形態において、ステントは、最初に抗血栓剤又は皮膜で被覆された後、開口部が製作され得る。この例示的な実施形態では、管腔側表面と反管腔側表面のみが抗血栓剤又は皮膜を有し、開口部の壁は皮膜を有さない。これらの各実施形態において、任意の数の抗血栓薬剤を、ステントの全部又は一部に付着させることができる。加えて、例えばコーディス社製のBx Velocity(登録商標)冠状動脈ステント上のHEPACOAT(商標)と共に使用されるような任意の数の公知の技術を使用して抗血栓剤をステントに付着させることができる。あるいは、ステントは、抗血栓皮膜とは独立して又はこの皮膜に加えて、粗い表面テクスチャーで加工されてもよく、又はマイクロテクスチャーを有して、細胞付着性及び内皮化を向上させてもよい。加えて、任意の数の治療薬を開口部内に堆積することができ、また、異なる薬剤をステントの異なる領域内に使用することができる。
【0130】
図22A、図22B及び図22Cを参照すると、ステントの一部分の図表示が示されている。
【0131】
図22Aに示すように、ステント17900は、実質的に円形の複数の開口部17902を含む。この例示的な実施形態では、実質的に円形の複数の開口部17902は、ステント17900の壁を貫通して延びる。換言すれば、実質的に円形の複数の開口部17902は、ステント17904の反管腔側表面からステント17906の反管腔側表面へ延び、ここで壁厚は、管腔側表面と、反管腔側表面との間の距離として定義される。しかしながら別の実施形態では、開口部は、ステント17900の壁を貫通して延びる必要はない。例えば、開口部又はリザーバは、管腔側表面若しくは反管腔側表面又は両方のいずれかから部分的に延びていてもよい。図22Aのステント17900は、未処理の表面17904及び17906、並びに空の開口部17902を有する。
【0132】
図22Bでは、少なくとも1つの表面が、治療薬17908で被覆されている。治療薬は、好ましくは例えばヘパリン等の抗血栓剤を含むが、任意の抗血栓剤を使用することができる。抗血栓剤は、上記に簡略的に記載したように、任意の技術を用いて付着させることができる。この例示的な実施形態では、反管腔側表面及び管腔側表面の両方が、そこに付着された抗血栓剤を有している。加えて、この時点では実質的に円形の複数の開口部17902内に何も存在しないため、開口部17902の壁は、そこに付着された幾分かの抗血栓剤を有し得る。開口部17910の壁に付着される抗血栓剤の量は、薬物の付着方法に依存する。例えば、薬剤が浸漬被覆により付着される場合、開口部の壁には、薬剤が噴霧被覆技術を用いて付着される場合と比較してより多量の薬剤が付着されるであろう。本明細書に記載するように、この例示的な実施形態において、暴露される全表面は、相当の抗血栓皮膜が付着される。しかしながら、別の例示的な実施形態では、特定の表面のみが抗血栓を付着され得る。例えば、例示的な一実施形態では、血液と接触する表面のみが、抗凝固剤で処理されてよい。尚別の例示的な一実施形態では、片方又は両方の表面が抗血栓剤で被覆され得る一方、開口部の壁は被覆されない。これは、被覆前に開口部を塞ぎ、又は抗血栓剤の付着後に開口部を形成することを含む、多数の方法にて達成することができる。
【0133】
図22Cに、この例示的な実施形態による完成したステントを示す。この図に示すように、実質的に円形の複数の開口部17902は、再狭窄及び炎症等の血管疾患、又は本明細書に記載される任意の他の疾病(dieses)を治療するための1種以上の治療薬で充填されている。各開口部17902は、上記に詳細に説明したように、同一の治療薬又は異なる薬剤で充填され得る。図に示すように、これらの異なる薬剤17912、17914及び17916は特定のパターンで使用されるが、上記に詳細したように、任意の組み合わせが可能であり、1種の薬剤を異なる濃度で使用することも可能である。ラパマイシン等の薬物は、任意の好適な方法で開口部17902内に堆積され得る。薬剤を堆積する技術には、マイクロピペッティング及び/又はインクジェット充填方法が挙げられる。例示的な一実施形態において、薬物は、開口部内の薬物及び/又は薬物/ポリマーマトリックスが、ステント表面の水平面の下方となり、周辺の組織と接触しないように満たされ得る。代替的に、開口部は、薬物及び/又は薬物/ポリマーマトリックスが、周辺の組織と接触し得るように充填されてもよい。加えて、各薬物の総用量は、多数の薬物が使用される場合、最大の柔軟性をもって設計され得る。加えて、各薬物の放出速度は、個別に制御され得る。例えば、末端部付近の開口部は、縁再狭窄を治療するよう、より多量の薬物を収容し得る。
【0134】
この例示的な実施形態によれば、孔又は開口部は、最も有効な薬物療法のためにのみ構成されるのではなく、異なる薬物間に物理的分離を形成するためにも構成され得る。この物理的分離は、薬剤の相互作用を防止するのを助けることができる。
【0135】
別の例示的な実施形態によれば、立体特異的なポリマーの層対層配置を含むポリマー構成物は、医療デバイスと共に使用される薬物又は治療薬デポー剤担体又は被膜として使用されてもよい。本明細書で使用される医療デバイスは、局所又は領域薬物送達のための本明細書に記載される任意のデバイスを意味する。本質的に、このポリマー構成物は、本明細書に記載される任意の治療薬又は治療薬の組み合わせ、本明細書に記載される任意の薬物送達デバイス、及び本明細書に記載される任意の植え込み可能な医療デバイスと共に使用されることができる。加えて、上記に暗示したように、ポリマー構成物は、植え込み可能な医療デバイスの表面の一部又は全部を被覆するための被膜として、又は植え込み可能な医療デバイス内の充填リザーバ用の担体として使用されてもよい。ポリマー構成物は、以下に詳細に記載するように、任意数の形態をとることができる。
【0136】
例示的な一実施形態において、構成物は、異なる光学回転を有する、化学的に同一の生分解性ポリマーの交互層から形成される。この例示的な実施形態では、生分解性ポリマーは、ポリ(D−乳酸)(PDLA)及びポリ(L−乳酸)(PLLA)である。ポリ(D−乳酸)は、開環重合(ROP)プロセス中にキラル配置を維持する触媒を使用して、立体特異的なRR−ラクチド二量体から合成される。逆に、ポリ(L−乳酸)は、ROPプロセスを用いてSS−ラクチド二量体から合成される。ROP条件は、関連技術の当業者でもある当業者に公知である。互いにごく接近したこれらの交互層は、局所及び領域的な薬物及び/又は治療薬送達に関連して優れた結果を提供する立体複合体(sterocomplex)を形成する。換言すれば、様々な物理的性質を有する2種の立体特異的なポリマーの同一の化学的性質は、治療薬の幅広い安定性と放出制御とを可能にする。加えて、これらの立体複合生分解性ポリマーの流動学的性質における変化は、これらの材料の密度をより高くし、非立体複合ポリマーと等しいか又はより良好な結果を達成する一方で、厚さがより薄い被膜と、潜在的により小さい分子量のポリマーとの使用がもたらされる。より薄いこれらの被膜は、好ましくは被膜の長期間の生体適合性を改善し、再吸収時間を短縮させる筈である。本質的に、層状のポリ(D−乳酸)とポリ(L−乳酸)とは立体複合体をその場で形成し、該立体複合体は、より少量の薬物担体マトリックスにより治療薬放出の薬物動態(pharmakinetics)をより良好に制御する。
【0137】
ポリマー−ポリマー複合体は、異なる化学組成を有するポリマーを、好適な条件下で混合して形成することができる。これらの複合体は、ポリカチオンとポリアニオンとの間のポリ電解質複合体、ポリ(カルボン酸)とポリエーテル又はポリオールとの間の水素結合複合体、及びポリマードナーとアクセプターとの間の電荷移動複合体を含む。しかしながら、同一の組成を有するが異なる立体構造体を有するポリマー間で複合体の形成が生じ得る、限定された場合のみ公知である。そのような想定された最初の複合体は、Ikada,Y.,et al.,Sterocomplex formation Between Enantiomeric poly(lactides),Marcomolecter,1987,20,904〜906,in 1987により、ポリ(L−乳酸)とポリ(D−乳酸)との間で観察された。D,L−ラクチドから形成されるポリマーは無定形であり、光学不活性である一方、L−ラクチドとD−ラクチドとから形成されるポリマーは部分結晶性であり、光学活性であることが公知である。L−ラクチドポリマーは、D−ラクチドベースのポリマーよりも結晶性が高く、より疎水性であり得るため、結果として分解がより遅い。イケダ(Ikada)の研究は、等モルのポリ(L−乳酸)及びポリ(D−乳酸)が混合された場合、ポリマーブレンドは、約180℃である個々の融点のいずれよりも高い230℃の単一の融点を有することも示した。図23Aに示すように、SS−ラクチドから形成されたポリ(L−ラクチド)の結晶構造体は、左回転の螺旋鎖からなり、図23Bに示すように、RR−ラクチドから形成されたポリ(D−ラクチド)の結晶構造体は、右回転の螺旋結晶構造体を有する。図23Cに、重合した場合、無定形のラセミ体ポリマーをもたらすメソ−ラクチドを示す。
【0138】
イケダ(Ikada)らにより為された観察は、これらのラクチド二量体が、図24にポリ(L−ラクチド)及び図25にポリ(D−ラクチド)を示すように、立体特異的なポリラクチドの合成に使用された場合に有意な意味を有し得る。これは、ポリ(D−乳酸)とポリ(L−乳酸)との間で形成される立体複合体が、比較的少量の担体又はより薄い被膜又は場合により、より低い分子量によって、薬物溶出に制御を提供する上でより効果的であり得る、本明細書に記載される理由による。ポリ(D−乳酸)とポリ(L−乳酸)との間で形成される立体複合体は、結果として得られるそのより高い融点によって、物理的安定性がより高くなる可能性があり、また立体複合体中に含まれる治療薬又は薬剤の貯蔵も良好になる可能性がある。加えて、立体複合体に使用されるポリ(D−乳酸)及びポリ(L−乳酸)のより低い分子量は、より高い分子量の個々のポリマーと比較して、より短い再吸収時間とより良好な生体適合性とをもたらす可能性がある。
【0139】
そのようなポリ(D−乳酸)とポリ(L−乳酸)との立体複合体の利点を利用した例示的なプロセスは、立体特異的かつ光学的に純粋なポリ乳酸の1つを、治療薬又は薬剤の組み合わせと混合し、噴霧被覆等の通常の被覆方法を使用して医療デバイスのうちの少なくとも一部の表面に被覆することを含む。本明細書に記載したような任意の種類の被膜技術を使用することができる。次の工程は、反対の光学回転を有する別の立体特異的かつ光学的に純粋なポリ乳酸を治療薬又は薬剤の組み合わせと混合し、場合により以前の層が尚「湿潤」している間に、以前の層の頂部に被覆することを含む。反対の立体特異性を有するこれらのポリマーは、その場で結合して立体複合体を形成し、治療薬又は治療薬の組み合わせを局所又は領域薬物送達のために定位置に保持するであろう。上述したプロセスは、治療薬又は治療薬の組み合わせの適切なレベルが達成される迄、任意の回数だけ反復されてもよい。2種の光学活性ポリマーのいずれか又はその組み合わせの頂部層又は被膜は、被膜からの治療薬又は薬剤の組み合わせの放出速度を更に調節するよう適用されてもよい。
【0140】
このプロセスは、本明細書に記載した任意の医療デバイスの表面のうちの少なくとも一部又は複数の表面に、本明細書に記載した任意の治療薬又はその組み合わせを使用し、また本明細書に記載した任意の被覆技術を使用して適用されてもよい。加えて、上述したプロセスは、治療薬を用いて又は用いずに使用することができる。
【0141】
代替的な例示的実施形態では、治療薬は、ポリマー層と混合されず、各層がデバイス上に被覆された後に加えられてもよい。
【0142】
尚別の代替的な例示的実施形態では、上述した光学的に純粋なポリラクチド及び/又は治療薬の組み合わせを混合し、医療デバイス内の置場、例えばウェル内に堆積して、層対層の治療薬案内形態を達成してもよい。
【0143】
図26A、図26B及び図26Cを参照すると、場合により間に治療薬又は薬剤が入れられたポリ(D−乳酸)及びポリ(L−乳酸)の交互の層対層を用いた例示的な被膜又は堆積スキームが示されている。詳細には、図26Aにおいて、上部に層対層の立体複合被膜を有する医療デバイスの部分11102が示されている。この例示的な実施形態では、1つ以上の第1の治療薬11104がポリ(D−乳酸)11106と混合され、医療デバイスの部分11102の表面に付着されている。ポリ(L−乳酸)11108を含む第2の層が第1の層に付着され、それにより層対層構成物の基本構築ブロックを形成している。化学的に同一であるが物理的に異なるポリマーが使用される限り、同一又は異なる治療薬1110を用いた追加の層を使用し得ることに留意することが重要である。図示するように、1つ以上の追加の治療薬11110がポリマー構築ブロック層に付着された後、ポリ(D−乳酸)11106及びポリ(L−乳酸)11108を含む第2のポリマー構築ブロック層がそこに付着される。
【0144】
図26Bに、内部に層対層の立体複合被膜が堆積された、医療デバイスの部分11114内のリザーバ11112を示す。この例示的な実施形態では、ポリ(D−乳酸)11116及びポリ(L−乳酸)11118からなる第1の底部バリア層が、インクジェット等の標準的な堆積方法により置かれている。ポリ(D−乳酸)とポリ(L−乳酸)とは通常の溶媒中で予め混合され、リザーバ内に堆積され、連続的に堆積されて立体複合体バリア層が形成されてもよい。ポリ(D−乳酸)及びポリ(L−乳酸)の量は、実質的に同一であることが好ましい。次に、治療薬11120又は治療薬11120の組み合わせと混合したポリ(D−乳酸)11116をリザーバ内に堆積し、その後ポリ(D−乳酸)11118を堆積して、その場で立体複合体及び薬物ポリマーマトリックスを形成する。場合により同一又は異なる治療薬11122と混合されたポリ(D−乳酸)及びポリ(L−乳酸)の立体複合体の第2の層が、第1の層上に堆積されて、再度、層対層構成物を形成し得る。そのような交互層は、多数回反復されてもよい。ポリ(D−乳酸)及びポリ(L−乳酸)1118を含む、随意の頂部バリア層を堆積して、リザーバの頂部側からの薬物放出を調節してもよい。
【0145】
上記に示したように、治療薬又は薬剤は、ポリマーと混合され、又はポリマー間に単に堆積若しくは被覆されてもよい。
【0146】
図26Cに、医療デバイスの部分11126の表面上の治療薬又は薬剤の組み合わせ11128のための薬物拡散バリアとして使用される、ポリ(D−乳酸)11130とポリ(L−乳酸)11132の層対層堆積を示す。
【0147】
図27A及び図27Bに、ポリマー溶液11202を用いた被膜又は堆積スキームを示し、該溶液は、ポリ(D−乳酸)及びポリ(L−乳酸)の両方を実質的に1対1のモル比で含有し、場合により溶液中に治療薬又は薬剤11204が分散され、デバイス表面11206上に付着され、又はデバイスのリザーバ11208内に堆積される。
【0148】
別の例示的な実施形態によれば、本発明は、上述したような、リザーバを有する血管二薬溶出ステントに関し、これらのリザーバの一部はシロリムス(ラパマイシン)を壁面又は反管腔方向に優位に放出する組成物を含み、これらのリザーバの補足的部分は、シロスタゾールを管腔方向に優位に放出する組成物を含む。より詳細には、二薬溶出ステントが患者の動脈内に配置された際に、シロリムスが動脈組織内に局所的に溶出し、動脈内の再狭窄を治療及び緩和する一方、シロスタゾールが血流中に溶出して、二薬溶出ステントの管腔内及び薬物溶出ステントに隣接した局所動脈壁内の抗血栓効果を提供する。抗血栓効果は二倍である。即ち、植え込まれた二薬溶出ステント上の、又は同ステント近傍の血栓形成の軽減、並びに二薬溶出ステント上の、又は同ステント近傍の血小板凝集及び沈着の阻害である。また、二薬溶出ステントが心筋梗塞に苦しむ患者の治療に使用される場合、シロスタゾールは、例えばステント留置後の「無再流」状態を制限し、再灌流損傷を軽減し、及び/又は梗塞寸法を縮小することにより、処置動脈により血液が供給される心筋組織に対して心保護効果を提供することができる。二薬溶出ステントは、糖尿病を有する患者等、乏しい治癒特性を有する患者の臨床成績を改善することができる。
【0149】
この二薬溶出ステントの例示的な実施形態では、リザーバは、ステントからの2種の異なる治療薬又は薬物の定方向送達に使用される。ポリマー及びシロリムスの組成物は、ステントのリザーバの一部から患者の動脈組織への反管腔方向のシロリムスの制御された徐放性局所送達を提供する。ポリマー及びシロスタゾールの組成物は、ステントの異なる及び別個のリザーバから、治療中の動脈の血流への直接的な、又はステント植え込み後、ステントの管腔表面を覆うよう成長する生物学的組織内へのシロスタゾールの制御された徐放性送達を提供する。
【0150】
本明細書では別個の区別されるリザーバが記載されているが、任意の他の好適な定方向送達メカニズムを使用できることに留意することが重要である。
【0151】
図28は、本発明による二薬溶出ステントの一部の概略側面図である。治療薬又は薬物送達に関するパターンは多数の異なる状況又は治療計画に対して誂えることができるが、説明の容易さのため、隣接するリザーバは異なる薬物を含むものとして記載される。二薬溶出ステント2800は、2つのリザーバ2802及びリザーバ2804を含むよう図示され、一方はシロリムス組成物2806で充填され、他方はシロスタゾール組成物2808で充填されている。
【0152】
シロリムス組成物は、シロリムス及びPLGAマトリックスを含有する。例示的な実施形態において、162マイクログラムのシロリムスが93マイクログラムのPLGAと混合される。混合及びリザーバ充填プロセスは、以下に詳細に記載される。大部分のシロリムスが、矢印2810で示されるように二薬ステント2800の壁面又は反管腔側に確実に放出されるために、基部構造体2812は、リザーバ2802の管腔側の開口部内の栓として使用される。この基部構造体2812は、任意の好適な生体適合性材料を含んでもよい。例示的な実施形態において、基部構造体2812はPLGAを含む。基部構造体2812の形成は、次に詳細に説明される。
【0153】
シロスタゾール組成物は、シロスタゾール及びPLGAマトリックスを含有する。例示的な実施形態において、120マイクログラムのシロスタゾールが120マイクログラムのPLGAと混合される。混合及びリザーバ充填プロセスは、以下に詳細に記載される。大部分のシロスタゾールが、矢印2814で示されるように二薬ステント2800の管腔側に確実に放出されるために、キャップ構造体2816は、リザーバ2804の反管腔側の開口部内の栓として使用される。このキャップ構造体2816は、任意の好適な生体適合性材料を含んでもよい。例示的な実施形態において、キャップ構造体2816はPLGAを含む。キャップ構造体2816の形成は、次に詳細に説明される。
【0154】
上記に示された薬物及びポリマーの量は、3.5ミリメートル×17ミリメートル寸法のステントに関する合計である。各薬物に関する用量範囲は、次に詳細に説明される。加えて、ポリマー重量は、基部又はキャップ構造体内のマトリックス+ポリマー中のポリマーの合計である。使用されるポリマーの量も、次に詳細に説明される。
【0155】
上述したように、ステントのリザーバは、任意数の方法により充填され、又は負荷され得る。例示的な実施形態において、組成物は、2つの別個の連続した一連の工程にてリザーバウェル又はリザーバ内に充填され、該工程は、最初に流体充填溶液組成物をリザーバ内に堆積し、次に充填溶液の溶媒の実質的に全部ではなくとも大部分を蒸発させることを含む。溶媒を全く有さないことが、理想的な状況である。上述した本発明による組成物は、充填溶液組成物から溶媒を実質的に全部、好ましくは全部除去した後、リザーバ内に残留する固体材料である。
【0156】
シロリムスを含有する固体組成物の形成に使用される流体組成物は、生体再吸収性(bioresorbable)ポリマー又は生体吸収性(bioabsorbable)ポリマー、好ましくはポリ(ラクチド−コ−グリコリド)、PLGA、ポリマー、ジメチルスルホキシド、DMSO又はN−メチルピロリジノン等の好適な溶媒、NMP、シロリムス及び場合により安定剤又はBHT等の抗酸化剤を含有する。好ましくは、ステントリザーバ内の最終的なシロリムス組成物を形成する堆積工程に使用される流体充填溶液組成物のうちの少なくとも1つは、BHTを含有する。BHTの代替物は、ブチル化ヒドロキシアニソール、BHA、没食子酸プロピル等の没食子酸エステル、又はパルミトイルアスコルビン酸等のアスコルビン酸エステルを含む。BHTは、シロリムスの安定化におけるその高いレベルの有効性、その低い毒性、及びその疎水性に基づき好ましい。BHTはリザーバからシロリムスとほぼ同一の速度で溶出するため、BHTは常にシロリムスと共に存在する。DMSO及びNMPの代替物は、ジメチルアセトアミド(DMAc)又はジメチルホルムアミド(DMF)を含む。DMSOは、シロリムスがDMSO中でより安定に存在するため好ましい。
【0157】
堆積される各連続流体組成物は同一の成分を含有してもよく、又は連続充填溶液は異なる成分を含有する充填溶液から調製されてもよい。好ましくは、最初の一連の充填溶液堆積物は、ポリマー及び溶媒のみ含有し、これらは各充填工程後に乾燥される。プロセスのこの部分により、基部構造体2812が形成又は構築される。基部構造体2812が形成された後、ポリマー、溶媒、シロリムス及び好ましくはBHTを含有する次の溶液を加え、これらも各充填工程後に乾燥される。この製造の連続は、リザーバの管腔側面の領域内でより低い濃度のシロリムスが存在し、各リザーバの壁面の領域内で比較的高い濃度のシロリムスが存在するリザーバ組成物を形成するであろう。そのような形態は、上記に詳細に説明したように、壁面と比較して、薬物の管腔側面へのより長い経路、又は薬物の管腔側面への溶出に対するより高い抵抗を形成し、したがって実質的に全部のシロリムスがステントの壁面側へ、そして動脈組織内へ送達される筈である。換言すれば、シロリムスを優位に壁方向へ送達するリザーバ部分は、ステントの管腔側表面上及び該表面近傍のリザーバの容積が優位にポリマーを含み、最小量のシロリムスを含む一方、同一のリザーバの壁面又は壁面近傍の容積は、優位にシロリムスを含み、最小の割合のポリマーを含むデザインを有するであろう。
【0158】
リザーバ内のシロリムス組成物は、好ましくはシロリムス、生体再吸収性ポリマー、安定化剤及び溶媒を含有し、互いに所定の割合で存在するであろう。好ましくは、薬物溶出ステントから入手可能なシロリムスの全用量又は全量は、動脈組織領域1平方ミリメートル当たり0.6〜3.2マイクログラムであり、ここで動脈組織領域は、その直径及び長さが、動脈内に留置された際の拡張されたステントの直径及び長さである理論円筒の表面積として定義される。より好ましくは、薬物溶出ステントから入手可能なシロリムスの全用量又は全量は、動脈組織1平方ミリメートル当たり0.78〜1.05マイクログラムである。
【0159】
上記に示したように、組成物中に使用される生体再吸収性ポリマーは、PLGAを含む。より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約85:15〜約65:35である。尚より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約80:20〜70:30である。PLGAは、約0.3〜約0.9の範囲内の固有粘度を有することが好ましいと思われる。PLGAは、約0.6〜約0.7の範囲内の固有粘度を有することが、尚より好ましいと思われる。シロリムス対PLGAの重量比はD/P比と指定され、好ましくは約50/50〜約70/30の範囲内、より好ましくは約54/46〜約66/34の範囲内にある。全ての比は、重量の百分率である。あるいは、シロリムスとPLGAとの相対的な重量の割合は、正規化した形態D:Pで表わされてもよい。したがって、好ましいD:P比は、約1:0.4〜約1:1.2の範囲内、より好ましくは約1:0.52〜約1:0.85の範囲内にある。
【0160】
また上述したように、シロリムス組成物は、好ましくはBHT、ブチル化ヒドロキシルトルエンを含有する。添加されるBHTの量は、好ましくはシロリムスの量の約1重量パーセント〜約3重量パーセントの範囲内にある。尚より好ましくは、添加されるBHTの量は、好ましくはシロリムスの量の約1.2重量パーセント〜約2.6重量パーセントの範囲内にある。
【0161】
上述した成分を作製するためには、充填目的のための溶液、好適な溶媒が必要である。ジメチルスルホキシド、DMSOが好ましい溶媒であり、好ましくはシロリムスの重量に対して約1重量パーセント〜約20重量パーセントの範囲内の量で使用される。尚より好ましくは、DMSOは、シロリムスの重量に対して約1重量パーセント〜約15重量パーセントの範囲内の量で使用される。更により好ましくは、DMSOは、シロリムスの重量に対して約4重量パーセント〜約12重量パーセントの範囲内の量で使用される。
【0162】
シロスタゾールを含有する固体組成物の形成に使用される流体組成物は、生体再吸収性又は生体吸収性ポリマー、好ましくはポリ(ラクチド−コ−グリコリド)、PLGA、ポリマー、DMSO又はNMP等の好適な溶媒及びシロスタゾールを含有する。この組成物中にDMSO及びNMPに関する同一の代替物を使用してもよいが、ここでも、DMSOが好ましい。
【0163】
堆積される各連続流体組成物は同一の成分を含有してもよく、又は連続充填溶液は異なる成分を含有する充填溶液から調製されてもよい。好ましくは、最初の一連の充填溶液堆積物は、ポリマー、シロスタゾール及び溶媒を含有し、これらは各充填工程後に乾燥され、最後の一連の充填溶液は、ポリマー及び溶媒のみ含有し、これらも各充填工程後に乾燥される。このプロセスにより、キャップ構造体2816が形成又は構築される。この製造の連続は、リザーバの壁面の領域内でより低い濃度のシロスタゾールが存在し、各リザーバの管腔側面の領域内で比較的高い濃度のシロスタゾールが存在するリザーバ組成物を形成するであろう。そのような形態は、上記に詳細に説明したように、壁面と比較して、薬物の管腔側面へのより長い経路、又は薬物の管腔側面への溶出に対するより高い抵抗を形成し、したがって実質的に全部のシロスタゾールがステントの壁面側へ、そして血流及び/又は動脈組織内へ送達される筈である。換言すれば、シロスタゾールを優位に壁方向へ送達するリザーバ部分は、ステントの管腔側表面上及び該表面近傍のリザーバの容積が優位にポリマーを含み、最小量のシロスタゾールを含む一方、同一のリザーバの壁面又は壁面近傍の容積は、優位にシロスタゾールを含み、最小の割合のポリマーを含むデザインを有するであろう。
【0164】
リザーバ内のシロスタゾール組成物は、好ましくはシロスタゾール、生体再吸収性ポリマー及び溶媒を含有し、互いに所定の割合で存在するであろう。好ましくは、薬物溶出ステント入手可能なシロスタゾールの全用量又は全量は、動脈組織領域1平方ミリメートル当たり0.4〜2.5マイクログラムであり、ここで動脈組織領域は、その直径及び長さが、動脈内に留置された際の拡張されたステントの直径及び長さである理論円筒の表面積として定義される。より好ましくは、薬物溶出ステントから入手可能なシロスタゾールの全用量又は全量は、動脈組織1平方ミリメートル当たり0.56〜1.53マイクログラムである。
【0165】
上記に示したように、組成物中に使用される生体再吸収性ポリマーは、PLGAを含む。より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約90:10〜約25:75である。尚より好ましくは、組成物はPLGAポリマーを含み、ここでポリマー鎖中のラクチド対グリコリド残基のモル比(L:G)は、約80:20〜45:55である。PLGAは、約0.1〜約0.9の範囲内の固有粘度を有することが好ましいと思われる。尚より好ましくは、PLGAは、約0.4〜約0.7の範囲内の固有粘度を有するべきである。シロスタゾール対PLGAの重量比はD/P比と指定され、好ましくは約35/65〜約95/5の範囲内、より好ましくは約47/53〜約86/14の範囲内にある。全ての比は、重量の百分率である。あるいは、シロスタゾールとPLGAとの相対的な重量の割合は、正規化した形態D:Pで表わされてもよい。したがって、好ましいD:P比は、約1:0.05〜約1:2.0の範囲内、より好ましくは約1:0.16〜約1:1.20の範囲内にある。
【0166】
上述した成分を作製するためには、充填又は負荷目的のための溶液、好適な溶媒が必要である。ジメチルスルホキシド、DMSOが好ましい溶媒であり、好ましくはシロスタゾールの重量に対して約0.01重量パーセント〜約20重量パーセントの範囲内の量で使用される。尚より好ましくは、DMSOは、シロスタゾールの重量に対して約1重量パーセント〜約15重量パーセントの範囲内の量で使用される。更により好ましくは、DMSOは、シロスタゾールの重量に対して約3重量パーセント〜約12重量パーセントの範囲内の量で使用される。
【0167】
本明細書に示すように、ステントは任意の好適な生体適合性材料から製作されてもよい。この例示的な実施形態では、ステントは、好ましくはコバルト−クロム合金から形成される。加えて、PLGA中のポリマーの比は変動してもよい。例えば、PLGAは、約100:0〜約0:100、より好ましくは約50:50〜約85:15、より好ましくは約60:40〜約80:20のL:G比を有してもよい。
【0168】
本発明の二薬溶出ステントの独特のデザイン又は構成は、シロリムス及びシロスタゾールの完全に独立した溶出速度を提供する。加えて、この独特の構成は、シロリムスを優位に壁面又は反管腔方向へ送達させる一方、シロスタゾールを優位に管腔方向へ送達させる。
【0169】
図29を参照すると、30日間に亘る各薬物に関する累積的なインビボでの薬物放出百分率が示されている。曲線2902は、シロスタゾールに関するプロファイルを表す一方、曲線2904は、シロリムスに関するプロファイルを表す。図30は、インビボで放出される、各薬物のマイクログラムでの量のグラフである。曲線3002は、シロスタゾールに関するプロファイルを表す一方、曲線3004は、シロリムスに関するプロファイルを表す。図の曲線は、両方の薬物が互いに独立して溶出し、相互作用は最小か又は実質的に存在しないことを示す。両方の薬物に関して、30日の時点で約60〜70パーセント溶出が観察された。薬物の量(重量による)は、それらの対応するリザーバ内の薬物に関して異なるため、30日間で放出された薬物の全量は、シロスタゾールと比較してシロリムスがより多かった。
【0170】
各薬物に関する薬物負荷又は用量は、上記に示すものを含む任意数の方法で表し得ることに留意することが重要である。好ましい例示的な実施形態では、用量範囲は、標準的な3.5mm×17mmステント寸法に基づき、薬物重量のネスト絶対範囲(nested absolute range)として表されてもよい。この方法では、用量範囲は、ステントの寸法及びリザーバ数に対応するであろう。例えば、3.5mm×17mmのステント寸法では、孔又はリザーバの数は585である。別の例示的な実施形態では、所定の寸法のステントのリザーバの数は、2.5mm×8mmステントに関して211のリザーバ、3.0mm×8mmステントに関して238、3.5mm×8mmステントに関して290のリザーバ、2.5mm×12mmステントに関して311のリザーバ、3.0mm×12mmステントに関して347、3.5mm×12mmステントに関して417のリザーバ、2.5mm×17mmステントに関して431のリザーバ、3.0mm×17mmステントに関して501、2.5mm×22mmステントに関して551のリザーバ、3.0mm×22mmステントに関して633、3.5mm×22mmステントに関して753のリザーバ、2.5mm×28mmステントに関して711のリザーバ、3.0mm×28mmステントに関して809、3.5mm×28mmステントに関して949のリザーバ、2.5mm×33mmステントに関して831のリザーバ、3.0mm×33mmステントに関して963及び3.5mm×33mmステントに関して1117のリザーバを含んでもよい。本明細書に提供される用量範囲は、シロリムスを収容するリザーバのシロスタゾールを収容するリザーバに対する比が、20パーセント/80パーセント〜80パーセント/20パーセントに亘るであろう。3.5mm×17mmステント上のシロリムスの負荷又は用量は、約30マイクログラム〜約265マイクログラム、より好ましくは約130マイクログラム〜約200マイクログラム、尚より好ましくは約150マイクログラム〜約180マイクログラムの範囲内にあってもよい。これらは例示的な寸法及びリザーバ数であることに留意することが重要である。同一の3.5mm×17mmステント上のシロスタゾールの負荷又は用量は、約50マイクログラム〜約200マイクログラム、より好ましくは約90マイクログラム〜約200マイクログラム、尚より好ましくは約100マイクログラム〜約150マイクログラムの範囲内にあってもよい。上述したように、用量範囲は、ステントの寸法及びリザーバ数に対応するであろう。これらの用量は、最終的な滅菌済みステント製品のためのものである。
【0171】
本発明の二薬溶出ステントは、再狭窄、血栓症、急性心筋梗塞、再灌流損傷(reprofusion injury)、毛細血管の非再流状態、虚血関連の状態を含む、上記に示した多数の疾病状態の治療に、及び/又はシロリムスの抗再狭窄効果に対する糖尿病患者の応答を高めるために、使用することができる。シロリムス及びシロスタゾールの使用に加えて、デバイスに他の薬物を追加してもよい。例えば、上記に示したように、ヘパリン等の抗血栓剤を追加してもよい。追加の薬物が被膜として又はリザーバ内に含まれてもよい。留意される重要な点は、任意数の薬物とリザーバの組み合わせ、及び被膜を使用して、特定の疾病状態にデバイスを誂えることができることである。
【0172】
本明細書で使用されるように、ラパマイシンは、ラパマイシン、並びにFKBP12及び他のイムノフィリンに結合し、TOR阻害剤を含むラパマイシンと同一の薬理学的性質を所有する全ての類似体、誘導体及びコンジュゲートを含む。シロスタゾールのクラスに属する他の薬物は、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン、イナムリノン、シロスタミド、サテリノン、モタピゾン、リキサジノン、イマゾダン、プレタール、プリマコール、乳酸アムリノン及びメリベンダンを含む。
【0173】
放出の継続時間も誂え得ることに留意することも重要である。例えば、シロリムスに関するインビトロでの放出は、約7〜約120日間、より好ましくは約14〜約90日間であってもよい一方、シロスタゾールに関するインビトロでの放出は、約5〜約61日間であってもよい。放出状態は、異なる各薬物に関して誂えることができる。
【0174】
最も実際的で好ましいと思われる実施形態を示し記載したが、記載し示した特定の構成及び方法からの逸脱は、それ自体が当業者に示唆され、本発明の趣旨から逸脱することなく使用され得ることは明らかである。本発明は、記載及び図示された特定の構成に限定されず、添付の特許請求の範囲内に含まれ得る全ての変更物と一致するよう構成されるべきである。
【0175】
〔実施の態様〕
(1) 薬物送達デバイスにおいて、
管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、
前記管腔内足場内の複数の開口部、
mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む、前記複数の開口部の第1の部分、並びに、
ホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔方向又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む、前記複数の開口部の第2の部分、を備える、薬物送達デバイス。
(2) 前記mTOR阻害剤組成物がラパマイシン組成物を含む、実施態様1に記載の薬物送達デバイス。
(3) 前記ラパマイシン組成物がシロリムス組成物を含む、実施態様2に記載の薬物送達デバイス。
(4) 前記ホスホジエステラーゼIII阻害剤組成物がシロスタゾールを含む、実施態様1に記載の薬物送達デバイス。
(5) 前記ホスホジエステラーゼIII阻害剤組成物が、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン及びメリベンダンのうちの少なくとも1つを含む、実施態様1に記載の薬物送達デバイス。
(6) 前記植え込み可能な管腔内足場がステントを含む、実施態様1に記載の薬物送達デバイス。
【特許請求の範囲】
【請求項1】
薬物送達デバイスにおいて、
管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、
前記管腔内足場内の複数の開口部、
mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む、前記複数の開口部の第1の部分、並びに、
ホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔方向又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む、前記複数の開口部の第2の部分、を備える、薬物送達デバイス。
【請求項2】
前記mTOR阻害剤組成物がラパマイシン組成物を含む、請求項1に記載の薬物送達デバイス。
【請求項3】
前記ラパマイシン組成物がシロリムス組成物を含む、請求項2に記載の薬物送達デバイス。
【請求項4】
前記ホスホジエステラーゼIII阻害剤組成物がシロスタゾールを含む、請求項1に記載の薬物送達デバイス。
【請求項5】
前記ホスホジエステラーゼIII阻害剤組成物が、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン及びメリベンダンのうちの少なくとも1つを含む、請求項1に記載の薬物送達デバイス。
【請求項6】
前記植え込み可能な管腔内足場がステントを含む、請求項1に記載の薬物送達デバイス。
【請求項1】
薬物送達デバイスにおいて、
管腔側表面及び反管腔側表面を有する植え込み可能な管腔内足場、
前記管腔内足場内の複数の開口部、
mTOR阻害剤組成物と、該mTOR阻害剤組成物中のmTOR阻害剤を実質的に反管腔方向へ溶出させるよう構成された基部構造体とを含む、前記複数の開口部の第1の部分、並びに、
ホスホジエステラーゼIII阻害剤組成物と、該ホスホジエステラーゼIII阻害剤組成物中のホスホジエステラーゼIII阻害剤を実質的に管腔方向又は反管腔方向のうちの少なくとも1つへ溶出させるよう構成されたキャップ又は基部構造体のうちの少なくとも1つとを含む、前記複数の開口部の第2の部分、を備える、薬物送達デバイス。
【請求項2】
前記mTOR阻害剤組成物がラパマイシン組成物を含む、請求項1に記載の薬物送達デバイス。
【請求項3】
前記ラパマイシン組成物がシロリムス組成物を含む、請求項2に記載の薬物送達デバイス。
【請求項4】
前記ホスホジエステラーゼIII阻害剤組成物がシロスタゾールを含む、請求項1に記載の薬物送達デバイス。
【請求項5】
前記ホスホジエステラーゼIII阻害剤組成物が、ミルリノン、ベスナリノン、エノキシモン、ピモベンダン及びメリベンダンのうちの少なくとも1つを含む、請求項1に記載の薬物送達デバイス。
【請求項6】
前記植え込み可能な管腔内足場がステントを含む、請求項1に記載の薬物送達デバイス。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図22C】


【図23A】


【図23B】


【図23C】


【図24】


【図25】


【図26A】


【図26B】


【図26C】


【図27A】


【図27B】


【図28】


【図29】


【図30】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22A】


【図22B】


【図22C】


【図23A】


【図23B】


【図23C】


【図24】


【図25】


【図26A】


【図26B】


【図26C】


【図27A】


【図27B】


【図28】


【図29】


【図30】


【公開番号】特開2010−259793(P2010−259793A)
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【外国語出願】
【出願番号】特願2010−103033(P2010−103033)
【出願日】平成22年4月28日(2010.4.28)
【出願人】(597041828)コーディス・コーポレイション (206)
【氏名又は名称原語表記】Cordis Corporation
【Fターム(参考)】
【公開日】平成22年11月18日(2010.11.18)
【国際特許分類】
【出願番号】特願2010−103033(P2010−103033)
【出願日】平成22年4月28日(2010.4.28)
【出願人】(597041828)コーディス・コーポレイション (206)
【氏名又は名称原語表記】Cordis Corporation
【Fターム(参考)】
[ Back to top ]

