二酸化チタンを製造する方法
【課題】 同様の出発原料からアナターゼ、ルチルおよびブルッカイトの相制御された二酸化チタンの製造方法を提供すること。
【解決手段】 二酸化チタンを製造する方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程と、混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程とを包含し、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1である。
【解決手段】 二酸化チタンを製造する方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程と、混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程とを包含し、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、マイルドな反応条件にて二酸化チタンを製造する方法に関する。より詳細には、マイルドな反応条件にて、同じ原料から出発して、ルチル、アナターゼおよびブルッカイトの相制御された二酸化チタンを製造する方法に関する。
【背景技術】
【0002】
二酸化チタンは、例えば、ペンキおよび化粧品用の白色顔料として古くから知られている。また、近年、ナノ結晶からなる二酸化チタンは、大気または水から汚染物質を除去するための光触媒、太陽エネルギーを収集するための光電池材料、次世代超薄キャパシタ用の誘電体材料、さらには、高屈折率(2.4〜2.9)を利用した光学素子として注目されている。
【0003】
二酸化チタン(TiO2)は、3つの結晶構造(すなわち、ルチル(正方晶系)、アナ
ターゼ(正方晶系)およびブルッカイト(斜方晶系))を有する。ルチル型二酸化チタン(以降では、単に、ルチルまたはR−TiO2と称する)は、主に、白色顔料、塗料、着
色料、化粧品に応用されている。アナターゼ型二酸化チタン(以降では、単に、アナターゼまたはA−TiO2と称する)は、光触媒技術に応用されている。また、ブルッカイト
型二酸化チタン(以降では、単に、ブルッカイトまたはB−TiO2と称する)は、ルチ
ルおよびアナターゼに比べて光触媒特性が高いことが示唆されており、有望な光触媒候補でもある。
【0004】
ルチルとアナターゼとブルッカイトとは、結晶構造の違いから、用途に応じて製造され用いられ得る。例えば、空気中にて安定で取り扱いの簡便なTiCl3水溶液を出発原料
として、ブルッカイトを製造する方法がある(例えば、特許文献1を参照)。
【0005】
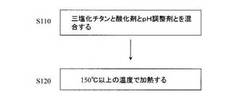
図11は、従来技術によるブルッカイトを製造する工程を示す図である。工程ごとに説明する。
【0006】
工程S1110:三塩化チタンと尿素とを混合する。
工程S1120:工程S1110で得られた混合溶液を加熱し、水酸化チタン(III)を析出させる。ここで析出する水酸化チタン(III)の粒子の形状およびサイズ(すなわち、粒径)を制御することにより、単分散状ブルッカイト団粒を得ることができる。
工程S1130:工程S1120で析出された水酸化チタン(III)を大気中で洗浄する。
工程S1140:工程S1130で洗浄された水酸化チタン(III)を大気中で乾燥させる。この結果、ナトリウム等の不純物を含有せず、かつ、ルチルおよび/またはアナターゼを含有しない、単相ブルッカイト型二酸化チタンが得られる。
工程S1150:工程S1140で得られたB−TiO2を大気中でアニールする。こ
のアニールによって、単分散B−TiO2の結晶性が向上し得る。
従来技術によれば、水熱処理を用いることなく、反応温度100℃以下かつ大気圧下でブルッカイト単体を得ることができる。
【0007】
【特許文献1】特開2005−336015号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
特許文献1に示されるように、例えば、ブルッカイト型二酸化チタンを製造する技術は
確立されている。しかしながら、特許文献1の技術ではブルッカイト単相しか得られず、その他の相を得るためには、別の出発原料および別の反応系を用いる必要があった。このように、所望する相に応じて、出発原料および反応系を変更することは、製造プロセスを複雑にし、コストを要する等の問題が生じ得る。したがって、同様の出発原料から条件を変更するだけで、アナターゼ、ルチルおよびブルッカイトを作りわけ可能とする技術が望ましい。このような技術があれば、製造ラインを相に応じて別個に設ける必要がないので、コストを削減でき有利である。また、条件の変更だけで、同様の出発原料から所望の相の二酸化チタンが得られれば、従来に比べてプロセスが簡略化できるので、歩留まりの向上が期待できる。
したがって、本発明の目的は、同様の出発原料からアナターゼ、ルチルおよびブルッカイトの相制御された二酸化チタンの製造方法を提供することである。
【課題を解決するための手段】
【0009】
本発明による二酸化チタンを製造する方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程であって、前記酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、前記三塩化チタン中のチタンTi3+と前記酸化剤とのモル比は、1:1である、工程と、前記混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程とを包含し、これにより上記目的を達成する。
【0010】
前記加熱する工程は、150℃以上250℃以下の温度範囲で、1時間〜12時間の間加熱し得る。
【0011】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過硫酸アンモニウムであり得る。
【0012】
前記三塩化チタンの濃度C(mol/L)は、0<C<0.6の範囲であり得る。
【0013】
前記二酸化チタンが、ルチル型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、0.5未満に調整され、前記三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲であり得る。
【0014】
前記二酸化チタンが、ブルッカイト型二酸化チタンの場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、1.0〜1.5の範囲に調整され、前記三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲であり得る。
【0015】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、4.0〜14の範囲に調整され得る。
【0016】
前記三塩化チタンの濃度C(mol/L)が0.5以下である場合、前記混合溶液のpHは4.0より大きくなるように調整され、前記三塩化チタンの濃度C(mol/L)が0.5を越える場合、前記混合溶液のpHは7.0より大きくなるように調整され得る。
【0017】
前記加熱する工程で得られた生成物を洗浄し、乾燥する工程をさらに包含し得る。
【発明の効果】
【0018】
本発明による方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程と、混合溶液を150℃以上の温度で加熱する工程とを包含する。三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1であり、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、
および、過酸化水素からなる群から選択される。選択された酸化剤によって、二酸化チタンの相制御が可能となる。また、三塩化チタン中のチタン濃度、さらには、pHを調整することによって、より高精度に二酸化チタンの相制御が可能となり得る。このように、同一の出発原料から所望の相を有する二酸化チタンを製造できるため、従来に比べて製造プロセスが簡略化され、コストが削減され得る。また、煩雑な原料調整が不要であるため、製造が簡便であり、製造時間を短縮でき、かつ、歩留まり向上が期待される。
【発明を実施するための最良の形態】
【0019】
本発明の実施の形態を、図面を参照して詳述する。
図1は、本発明による二酸化チタンを製造する工程を示す図である。
工程ごとに説明する。
【0020】
工程S110:三塩化チタンと酸化剤とpH調整剤とを混合する。ここで、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択される。三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1となるように調整される。pH調整剤は、尿素または水酸化アンモニウムであるが、これに限定されない。ここで、後述するように、選択される酸化剤、pH値、および/または、三塩化チタンの濃度によって所望の相を有する二酸化チタンが得られる。なお、本明細書において、「三塩化チタン」、「過硫酸アンモニウム」、「過塩素酸」、「硝酸」、「過酸化水素」等は、その水溶液を意図していることに留意されたい。
【0021】
工程S120:工程S110で得られた混合溶液を150℃以上の温度で加熱する。150℃未満の温度の場合、反応が進まない場合がある。また、高温であっても出発原料が分解してしまう恐れがあるため、好ましくは、150℃以上250℃以下で、1時間〜12時間加熱する。なお、反応時の圧力、温度によって加熱時間を短縮することもできる。このような調整は、当業者であれば適宜設定可能であり得る。
加熱は、混合溶液を所定の容器に封止した状態で行うことが好ましい。この際、加熱によって圧力がかかる(例えば、100大気圧)が、これによって、反応時間を短くすることができる。また、容器が封止されているので、不純物が混入する恐れもなく、高品質な二酸化チタンが得られ得る。
【0022】
次に、アナターゼ、ルチルおよびブルッカイトそれぞれの二酸化チタンの製造方法を、表1を参照して詳述する。
【表1】

【0023】
(1)アナターゼ単相を製造する場合
(i)酸化剤として過硫酸アンモニウム((NH4)2S2O8)を選択する。
この場合、三塩化チタンの濃度およびpHの調整をすることなく、所望のアナターゼ単相が得られる。これは、硫酸イオン(SO42-)の影響によるものと考えられる。詳細に
は、硫酸イオンは、その他の酸化剤による塩素イオン(Cl-)、硝酸イオン(NO3-)
、ヒドロペルオキシド(HOO-)および塩素酸イオン(ClO3-)に比べて、より多く
の電荷を有しているため、強い錯化剤として機能し得る。
【0024】
図2は、アナターゼ、ブルッカイトおよびルチルの模式図を示す。
硫酸イオンは、Ti(OH)xXy(H2O)6-x-y八面体の配向性に影響を与え、かつ、酸素を提供する。その結果、図2に示される八面体であるアナターゼを安定化させ得る。
なお、三塩化チタンの濃度C(mol/L)を0<C<0.6の範囲に調整すると、微細粒子のアナターゼが得られ得る。
【0025】
(ii)酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。
この場合、混合溶液のpHは、4.0〜14に調整される。これは、比較的高いpH値(すなわち、pH4.0以上)においては、Ti(OH)xXy(H2O)6-x-y八面体中により多くのOHを有するので、エッジ共有の割合が増加し、その結果、エッジ共有数が最も多いアナターゼが安定に得られ得るためである。詳細には、図2に示されるように、アナターゼは、八面体構造を有しており、エッジ共有数がもっとも多い。1つのエッジ共有には、2つの脱水反応が必要である。したがって、アナターゼは、ブルッカイトおよびルチルに比べてより脱水反応を必要とするため、より多くのOHを有したTi(OH)xXy(H2O)6-x-y八面体が有利である。
【0026】
(a)三塩化チタンの濃度C(mol/L)が0.5以下であれば、混合溶液のpHを4.0より大きく調整するか、または、(b)三塩化チタンの濃度C(mol/L)が0.5を越える場合、混合溶液のpHを7.0より大きく調整すればよい。これにより、より高精度にアナターゼが得られる。これは、混合溶液中の三塩化チタンの濃度が低い方が、Ti(OH)xXy(H2O)6-x-y八面体の凝集が促進され、エッジ共有の割合を増加させるためである。
【0027】
(2)ルチル単相を製造する場合
酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。この場合、pHは0.5未満に、かつ、三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲に調整される。
これは、アナターゼおよびブルッカイトと比較して、エッジ共有数の少ないルチルを得るためには、Ti(OH)xXy(H2O)6-x-y八面体中に含まれるOH数を下げること、すなわち、混合溶液のpHが低いことが有利であるためである。
【0028】
(3)ブルッカイト単相を製造する場合
(1)(ii)および(2)と同様に、酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。この場合、pHは、1.0〜1.5の範囲に、かつ、三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲に調整される。
ブルッカイトは、図2に示されるように、ルチルとアナターゼとの中間構造を有する。したがって、pHの範囲は、ルチルの製造に好ましいpHの範囲とアナターゼの製造に好ましいpHの範囲との間になる。この範囲において、上記三塩化チタンの濃度範囲であれば、ブルッカイト単相が得られ得る。
【0029】
このように、本発明によれば、同じ原料から出発して、表1に示されるpHおよび/ま
たは三塩化チタンの濃度を調整するだけで、所望の相を単相で有する二酸化チタンを製造することができる。また、出発原料として三塩化チタンを用いているため、四塩化チタンと比較して、空気中でも安定であるため、取り扱いが簡便である。また、三塩化チタンは、150℃以上で加熱すれば容易に反応が進むため、比較的マイルドな条件下での製造が可能となり、複雑な製造装置を必要としない。このため、製造コストを削減できる。
【0030】
なお、本発明の方法を応用すれば、特定比を有する混合物(例えば、アナターゼとブルッカイトとの比4:6)を製造することができることは言うまでもない。このような成分制御によって、用途に応じたアナターゼ、ブルッカイトおよび/またはルチルの混合物を所定比で提供することができるので有利であり得る。
【0031】
次に、本発明を実施例に基づいて具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例1】
【0032】
(1)三塩化チタン(0.9mol/L)80mLと、酸化剤として過硫酸アンモニウム粉末16.5gとを混合し、混合溶液のpHが0以下となるように調整した。混合溶液を100大気圧下で180℃まで加熱し、3時間保持し、反応させた。得られた反応生成物を分離し、純粋で洗浄した。その後、洗浄された反応生成物をオーブンにて100℃、24時間保持し、乾燥させた。
(2)三塩化チタン(0.15mol/L)13mLと、酸化剤として過硫酸アンモニウム粉末2.7gと、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHが0.75となるように調整した以外は、上記(1)と同様である。混合溶液の容量は、80mL(調整用の水を含む)であった。
【0033】
Philips PW1800X−Ray回折装置(Philips Research Laboratories,Netherlands)によるX線回折法、および、NR−1800機器(JASCO,Tokyo,Japan)によるラマン分光法を用いて、上記(1)および(2)から得られた生成物の同定を行った。X線回折装置の動作条件は、Cu−Kα線を用いて、40kV/50mA、0.5°2θ/分の走査速度であった。ラマン分光は、光源出力20mWおよび解像度1cm-1でAr+レーザ(波長514
.5nm)を用いた。それぞれの結果を図3および図4に示し詳述する。
【0034】
生成物の表面観察を、JOEL FEM−3000透過型電子顕微鏡TEMを用いて行った。なお、加速電圧は300kVであった。結果を図5に示し詳述する。
【0035】
図3は、実施例1によるX線回折パターンを示す図である。
図3(A)は、上記(1)の条件の混合溶液から得られた生成物のX線回折パターンを示し、(B)は、上記(2)の条件の混合溶液から得られた生成物のX線回折パターンを示す。いずれの回折パターンも、(101)、(004)、(200)、(105)および(204)のアナターゼの回折ピークを示し、その他の相を示す回折ピークは見られなかった。
【0036】
図4は、実施例1によるラマンスペクトルを示す図である。
図4(A)は、上記(1)の条件の混合溶液から得られた生成物のラマンスペクトルを示し、(B)は、上記(2)の条件の混合溶液から得られた生成物のラマンスペクトルを示す。いずれのラマンスペクトルも、151.6cm-1、403.4cm-1、520.2cm-1、641.3cm-1のアナターゼを示すピークを示し、その他の相を示すピークは見られなかった。
【0037】
図3および図4から、酸化剤として過硫酸アンモニウムを用いた場合、任意の濃度およびpHに関わらず、アナターゼ単相が得られたことが分かった。
【0038】
図5は、実施例1による生成物のTEM観察像および電子線回折像を示している図である。
図5中(A)は、上記(1)の条件の混合溶液から得られた生成物を示し、(B)は、上記(2)の条件の混合溶液から得られた生成物を示している。また、図5(A)の電子線回折像(挿入図)によれば、不明瞭なもののリングが見られ、(B)の電子線回折像(挿入図)には、明瞭なリングが示されている。このことから、いずれの生成物も多結晶であることが理解される。また、これらのリングから算出される面指数は、それぞれ、図3(A)および(B)の回折パターンから得られる面指数に一致することが確認された。
【0039】
図5(A)は、虫食い状態の球状粒子が凝集している様子を示している。
また、細孔分布測定装置による吸脱着等温線の結果(図示せず)によれば、IUPACのIV型に分類される等温線が得られた。等温線から算出される比表面積は、297m2
/gであり、2〜50nm径の細孔を有することが分かった。
【0040】
一方、図5(B)は、分離した粒子を示し、その粒径はナノメートルオーダであった。その比表面積は、134m2/gであり、細孔を有しないナノ結晶であることが分かる。
【0041】
これらの結果から、酸化剤として過硫酸アンモニウムを用いた場合、三塩化チタンの濃度によって得られるアナターゼの粒形状を制御できることが示唆される。特に、濃度が低い場合には、ナノメートルオーダの粒径を有する微細粒子が得られ得る。このような粒子は、安定なゾルの製造、ならびに、ナノメートルサイズの粒子からなるバルク体の製造に有利である。また、このような粒子を用いれば、焼結温度を下げることができるので、製造コストの削減にもなり得る。
【実施例2】
【0042】
各種の濃度の三塩化チタン(0.05mol/L〜0.90mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHが0以下〜1.68となるように調整した。
【0043】
それぞれの混合溶液における三塩化チタンの濃度とpHとの組み合わせ、すなわち、([Ti3+](mol/L):pH)は、(0.05:1.68)、(0.0625:1.32)、(0.075:1.1)、(0.10:0.90)、(0.15:0.75)、(0.30:0.58)、(0.45:0.40)、(0.60:0.25)、および、(0.90:0以下)とした。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)とした。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0044】
上記実施例2の条件で得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、各生成物の重量パーセントを、X線回折パターンに基づいて、J.Phys.Chem.B2000,104,3481−3487に記載の式から求めた。得られた結果を図6に示し、詳述する。
【0045】
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.90:0以下)および(0.0625:1.32)である混合溶液から得られた生成物の表面観察の結果を図7(A)および(B)にそれぞれ示し、詳述する。表面観察は、実施例1と同様に、TEMを用いて行った。
【0046】
図6は、実施例2による各混合溶液の条件、対応する各相の重量パーセント、および、X線回折パターンを示す図である。
【0047】
図6より、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.0625:1.32)および(0.075:1.1)である混合溶液から得られた生成物は、ブルッカイトのみを示す回折ピークを示した。
【0048】
また、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.60:0.25)および(0.90:0以下)である混合溶液から得られた生成物は、ルチルのみを示す回折ピークを示した。
【0049】
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.05:1.68)、(0.10:0.90)および(0.15:0.75)である混合溶液から得られた生成物は、アナターゼおよびブルッカイトそれぞれを示す回折ピーク、および、それらが混合した回折ピークを示した。
【0050】
それぞれの混合溶液から得られたアナターゼおよびブルッカイトの重量パーセントは図6に示されるとおりである。
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.30:0.58)および(0.45:0.40)である混合溶液から得られた生成物は、アナターゼ、ブルッカイトおよびルチルそれぞれを示す回折ピーク、および、それらが混合した回折ピークを示した。それぞれの混合溶液から得られたアナターゼ、ブルッカイトおよびルチルの重量パーセントは図6に示されるとおりである。
図6から、同じ出発原料を用いても、その濃度および混合溶液のpHによって、各種の相の二酸化チタンを製造することができることが分かる。
【0051】
図7は、実施例2によるTEM観察像を示す図である。
図7(A)は、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.90:0以下)である混合溶液から得られたルチルを示す。ルチルは、ナノメートルサイズのロッド状であり凝集していることが分かった。
図7(B)は、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.0625:1.32)である混合溶液から得られたブルッカイトを示す。ブルッカイトは、薄板状であった。
【0052】
次に、三塩化チタンの濃度を固定し、混合溶液のpHが生成される相に及ぼす影響を調べた。
【実施例3】
【0053】
固定濃度の三塩化チタン(0.0625mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、pHが0.44、0.67、1.32、1.72、6.53および9.0となるように混合溶液をそれぞれ調整した。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)であった。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0054】
得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、実施例2と同様の方法で、ブルッカイトについて重量パーセントを求めた。結果を図8に示し、詳述する。
混合溶液のpHが、9.0および0.44である混合溶液から得られた生成物の表面観察の結果を図9(A)および(B)にそれぞれ示し、詳述する。表面観察には、実施例1と同様に、TEMを用いた。
【0055】
図8は、実施例3による各種混合溶液のpH、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図である。
図8から、混合溶液のpHが大きくなると、ブルッカイトが減少し、アナターゼが増加することが分かった。この際、ルチルは生成されなかった。pHが9.0に達すると、アナターゼ単相が得られた。一方、混合溶液のpHが小さくなると、同様にブルッカイトが減少し、ルチルが増加することが分かった。この際、アナターゼは生成されなかった。pHが0.44に達すると、ルチル単相が得られた。このことから、三塩化チタンの濃度を固定した場合、混合溶液のpHを制御するだけで、所望の相のみを有する二酸化チタンが得られることが分かる。また、アナターゼの生成は、高いpHの混合溶液で促進され、ルチルの生成は、低いpHの混合溶液で促進される。
【0056】
図9は、実施例3によるTEM観察像を示す図である。
図9(A)は、pH=9.0である混合溶液から得られたアナターゼを示す。図5(B)と同様の形状のアナターゼが得られたことが分かる。図9(B)は、pH=0.44である混合溶液から得られたルチルを示す。図7(A)と同様にナノメートルサイズのロッド状であるが、図7(A)のルチルと比べて、各ロッドが分散した状態であることが分かった。このことから、三塩化チタンの濃度が、高いほど凝集したロッド状のルチルが得られ、低いほど各ロッドが分散したルチルが得られることが示唆される。
【0057】
次に、混合溶液のpHを固定し、三塩化チタンの濃度が生成される相に及ぼす影響を調べた。
【実施例4】
【0058】
各種濃度の三塩化チタン(0.005mol/L〜0.90mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHがそれぞれ1.32となるように調整した。用いたTiCl3溶液の濃度(mol/L)は
、それぞれ、0.005、0.015、0.03、0.0625、0.25および0.90であった。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)であった。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0059】
得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、実施例2と同様に、各種生成物の重量パーセントを求めた。結果を図10に示し、詳述する。結果を図10に示し、詳述する。
図10は、実施例4による各種三塩化チタンの濃度、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図である。
図10から、pH=1.32では、三塩化チタンの濃度を変化させてもルチルは生成しないことが分かった。このことは、ルチルが低いpHの混合溶液で生成されるという図8の結果に一致する。また、pHを固定した場合、濃度制御が必要なものの、三塩化チタンの濃度0.0625mol/Lを含む近傍にて、ブルッカイト単相が得られることが分かった。
【産業上の利用可能性】
【0060】
本発明による二酸化チタンは、環境有害物質を分解する光触媒、紫外光遮蔽材、フォトニック結晶に利用可能である。本発明によれば、用途に応じた相のみを有する二酸化チタンを同様の出発原料から製造することができるので、製造ラインを簡略化できる。
【図面の簡単な説明】
【0061】
【図1】本発明による二酸化チタンを製造する工程を示す図
【図2】アナターゼ、ブルッカイトおよびルチルの模式図
【図3】実施例1によるX線回折パターンを示す図
【図4】実施例1によるラマンスペクトルを示す図
【図5】実施例1によるTEM観察像および電子線回折像を示す図
【図6】実施例2による各種混合溶液の条件、対応する各相の重量パーセント、および、X線回折パターンを示す図
【図7】実施例2によるTEM観察像を示す図
【図8】実施例3による各種混合溶液のpH、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図
【図9】実施例3によるTEM観察像を示す図
【図10】実施例4による各種三塩化チタンの濃度、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図
【図11】従来技術によるブルッカイトを製造する工程を示す図
【技術分野】
【0001】
本発明は、マイルドな反応条件にて二酸化チタンを製造する方法に関する。より詳細には、マイルドな反応条件にて、同じ原料から出発して、ルチル、アナターゼおよびブルッカイトの相制御された二酸化チタンを製造する方法に関する。
【背景技術】
【0002】
二酸化チタンは、例えば、ペンキおよび化粧品用の白色顔料として古くから知られている。また、近年、ナノ結晶からなる二酸化チタンは、大気または水から汚染物質を除去するための光触媒、太陽エネルギーを収集するための光電池材料、次世代超薄キャパシタ用の誘電体材料、さらには、高屈折率(2.4〜2.9)を利用した光学素子として注目されている。
【0003】
二酸化チタン(TiO2)は、3つの結晶構造(すなわち、ルチル(正方晶系)、アナ
ターゼ(正方晶系)およびブルッカイト(斜方晶系))を有する。ルチル型二酸化チタン(以降では、単に、ルチルまたはR−TiO2と称する)は、主に、白色顔料、塗料、着
色料、化粧品に応用されている。アナターゼ型二酸化チタン(以降では、単に、アナターゼまたはA−TiO2と称する)は、光触媒技術に応用されている。また、ブルッカイト
型二酸化チタン(以降では、単に、ブルッカイトまたはB−TiO2と称する)は、ルチ
ルおよびアナターゼに比べて光触媒特性が高いことが示唆されており、有望な光触媒候補でもある。
【0004】
ルチルとアナターゼとブルッカイトとは、結晶構造の違いから、用途に応じて製造され用いられ得る。例えば、空気中にて安定で取り扱いの簡便なTiCl3水溶液を出発原料
として、ブルッカイトを製造する方法がある(例えば、特許文献1を参照)。
【0005】
図11は、従来技術によるブルッカイトを製造する工程を示す図である。工程ごとに説明する。
【0006】
工程S1110:三塩化チタンと尿素とを混合する。
工程S1120:工程S1110で得られた混合溶液を加熱し、水酸化チタン(III)を析出させる。ここで析出する水酸化チタン(III)の粒子の形状およびサイズ(すなわち、粒径)を制御することにより、単分散状ブルッカイト団粒を得ることができる。
工程S1130:工程S1120で析出された水酸化チタン(III)を大気中で洗浄する。
工程S1140:工程S1130で洗浄された水酸化チタン(III)を大気中で乾燥させる。この結果、ナトリウム等の不純物を含有せず、かつ、ルチルおよび/またはアナターゼを含有しない、単相ブルッカイト型二酸化チタンが得られる。
工程S1150:工程S1140で得られたB−TiO2を大気中でアニールする。こ
のアニールによって、単分散B−TiO2の結晶性が向上し得る。
従来技術によれば、水熱処理を用いることなく、反応温度100℃以下かつ大気圧下でブルッカイト単体を得ることができる。
【0007】
【特許文献1】特開2005−336015号公報
【発明の開示】
【発明が解決しようとする課題】
【0008】
特許文献1に示されるように、例えば、ブルッカイト型二酸化チタンを製造する技術は
確立されている。しかしながら、特許文献1の技術ではブルッカイト単相しか得られず、その他の相を得るためには、別の出発原料および別の反応系を用いる必要があった。このように、所望する相に応じて、出発原料および反応系を変更することは、製造プロセスを複雑にし、コストを要する等の問題が生じ得る。したがって、同様の出発原料から条件を変更するだけで、アナターゼ、ルチルおよびブルッカイトを作りわけ可能とする技術が望ましい。このような技術があれば、製造ラインを相に応じて別個に設ける必要がないので、コストを削減でき有利である。また、条件の変更だけで、同様の出発原料から所望の相の二酸化チタンが得られれば、従来に比べてプロセスが簡略化できるので、歩留まりの向上が期待できる。
したがって、本発明の目的は、同様の出発原料からアナターゼ、ルチルおよびブルッカイトの相制御された二酸化チタンの製造方法を提供することである。
【課題を解決するための手段】
【0009】
本発明による二酸化チタンを製造する方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程であって、前記酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、前記三塩化チタン中のチタンTi3+と前記酸化剤とのモル比は、1:1である、工程と、前記混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程とを包含し、これにより上記目的を達成する。
【0010】
前記加熱する工程は、150℃以上250℃以下の温度範囲で、1時間〜12時間の間加熱し得る。
【0011】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過硫酸アンモニウムであり得る。
【0012】
前記三塩化チタンの濃度C(mol/L)は、0<C<0.6の範囲であり得る。
【0013】
前記二酸化チタンが、ルチル型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、0.5未満に調整され、前記三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲であり得る。
【0014】
前記二酸化チタンが、ブルッカイト型二酸化チタンの場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、1.0〜1.5の範囲に調整され、前記三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲であり得る。
【0015】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、4.0〜14の範囲に調整され得る。
【0016】
前記三塩化チタンの濃度C(mol/L)が0.5以下である場合、前記混合溶液のpHは4.0より大きくなるように調整され、前記三塩化チタンの濃度C(mol/L)が0.5を越える場合、前記混合溶液のpHは7.0より大きくなるように調整され得る。
【0017】
前記加熱する工程で得られた生成物を洗浄し、乾燥する工程をさらに包含し得る。
【発明の効果】
【0018】
本発明による方法は、三塩化チタンと酸化剤とpH調整剤とを混合する工程と、混合溶液を150℃以上の温度で加熱する工程とを包含する。三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1であり、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、
および、過酸化水素からなる群から選択される。選択された酸化剤によって、二酸化チタンの相制御が可能となる。また、三塩化チタン中のチタン濃度、さらには、pHを調整することによって、より高精度に二酸化チタンの相制御が可能となり得る。このように、同一の出発原料から所望の相を有する二酸化チタンを製造できるため、従来に比べて製造プロセスが簡略化され、コストが削減され得る。また、煩雑な原料調整が不要であるため、製造が簡便であり、製造時間を短縮でき、かつ、歩留まり向上が期待される。
【発明を実施するための最良の形態】
【0019】
本発明の実施の形態を、図面を参照して詳述する。
図1は、本発明による二酸化チタンを製造する工程を示す図である。
工程ごとに説明する。
【0020】
工程S110:三塩化チタンと酸化剤とpH調整剤とを混合する。ここで、酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択される。三塩化チタン中のチタンTi3+と酸化剤とのモル比は、1:1となるように調整される。pH調整剤は、尿素または水酸化アンモニウムであるが、これに限定されない。ここで、後述するように、選択される酸化剤、pH値、および/または、三塩化チタンの濃度によって所望の相を有する二酸化チタンが得られる。なお、本明細書において、「三塩化チタン」、「過硫酸アンモニウム」、「過塩素酸」、「硝酸」、「過酸化水素」等は、その水溶液を意図していることに留意されたい。
【0021】
工程S120:工程S110で得られた混合溶液を150℃以上の温度で加熱する。150℃未満の温度の場合、反応が進まない場合がある。また、高温であっても出発原料が分解してしまう恐れがあるため、好ましくは、150℃以上250℃以下で、1時間〜12時間加熱する。なお、反応時の圧力、温度によって加熱時間を短縮することもできる。このような調整は、当業者であれば適宜設定可能であり得る。
加熱は、混合溶液を所定の容器に封止した状態で行うことが好ましい。この際、加熱によって圧力がかかる(例えば、100大気圧)が、これによって、反応時間を短くすることができる。また、容器が封止されているので、不純物が混入する恐れもなく、高品質な二酸化チタンが得られ得る。
【0022】
次に、アナターゼ、ルチルおよびブルッカイトそれぞれの二酸化チタンの製造方法を、表1を参照して詳述する。
【表1】

【0023】
(1)アナターゼ単相を製造する場合
(i)酸化剤として過硫酸アンモニウム((NH4)2S2O8)を選択する。
この場合、三塩化チタンの濃度およびpHの調整をすることなく、所望のアナターゼ単相が得られる。これは、硫酸イオン(SO42-)の影響によるものと考えられる。詳細に
は、硫酸イオンは、その他の酸化剤による塩素イオン(Cl-)、硝酸イオン(NO3-)
、ヒドロペルオキシド(HOO-)および塩素酸イオン(ClO3-)に比べて、より多く
の電荷を有しているため、強い錯化剤として機能し得る。
【0024】
図2は、アナターゼ、ブルッカイトおよびルチルの模式図を示す。
硫酸イオンは、Ti(OH)xXy(H2O)6-x-y八面体の配向性に影響を与え、かつ、酸素を提供する。その結果、図2に示される八面体であるアナターゼを安定化させ得る。
なお、三塩化チタンの濃度C(mol/L)を0<C<0.6の範囲に調整すると、微細粒子のアナターゼが得られ得る。
【0025】
(ii)酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。
この場合、混合溶液のpHは、4.0〜14に調整される。これは、比較的高いpH値(すなわち、pH4.0以上)においては、Ti(OH)xXy(H2O)6-x-y八面体中により多くのOHを有するので、エッジ共有の割合が増加し、その結果、エッジ共有数が最も多いアナターゼが安定に得られ得るためである。詳細には、図2に示されるように、アナターゼは、八面体構造を有しており、エッジ共有数がもっとも多い。1つのエッジ共有には、2つの脱水反応が必要である。したがって、アナターゼは、ブルッカイトおよびルチルに比べてより脱水反応を必要とするため、より多くのOHを有したTi(OH)xXy(H2O)6-x-y八面体が有利である。
【0026】
(a)三塩化チタンの濃度C(mol/L)が0.5以下であれば、混合溶液のpHを4.0より大きく調整するか、または、(b)三塩化チタンの濃度C(mol/L)が0.5を越える場合、混合溶液のpHを7.0より大きく調整すればよい。これにより、より高精度にアナターゼが得られる。これは、混合溶液中の三塩化チタンの濃度が低い方が、Ti(OH)xXy(H2O)6-x-y八面体の凝集が促進され、エッジ共有の割合を増加させるためである。
【0027】
(2)ルチル単相を製造する場合
酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。この場合、pHは0.5未満に、かつ、三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲に調整される。
これは、アナターゼおよびブルッカイトと比較して、エッジ共有数の少ないルチルを得るためには、Ti(OH)xXy(H2O)6-x-y八面体中に含まれるOH数を下げること、すなわち、混合溶液のpHが低いことが有利であるためである。
【0028】
(3)ブルッカイト単相を製造する場合
(1)(ii)および(2)と同様に、酸化剤として過塩素酸、硝酸および過酸化水素からなる群から少なくとも1つ選択する。この場合、pHは、1.0〜1.5の範囲に、かつ、三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲に調整される。
ブルッカイトは、図2に示されるように、ルチルとアナターゼとの中間構造を有する。したがって、pHの範囲は、ルチルの製造に好ましいpHの範囲とアナターゼの製造に好ましいpHの範囲との間になる。この範囲において、上記三塩化チタンの濃度範囲であれば、ブルッカイト単相が得られ得る。
【0029】
このように、本発明によれば、同じ原料から出発して、表1に示されるpHおよび/ま
たは三塩化チタンの濃度を調整するだけで、所望の相を単相で有する二酸化チタンを製造することができる。また、出発原料として三塩化チタンを用いているため、四塩化チタンと比較して、空気中でも安定であるため、取り扱いが簡便である。また、三塩化チタンは、150℃以上で加熱すれば容易に反応が進むため、比較的マイルドな条件下での製造が可能となり、複雑な製造装置を必要としない。このため、製造コストを削減できる。
【0030】
なお、本発明の方法を応用すれば、特定比を有する混合物(例えば、アナターゼとブルッカイトとの比4:6)を製造することができることは言うまでもない。このような成分制御によって、用途に応じたアナターゼ、ブルッカイトおよび/またはルチルの混合物を所定比で提供することができるので有利であり得る。
【0031】
次に、本発明を実施例に基づいて具体的に説明するが、本発明はこれらの実施例により限定されるものではない。
【実施例1】
【0032】
(1)三塩化チタン(0.9mol/L)80mLと、酸化剤として過硫酸アンモニウム粉末16.5gとを混合し、混合溶液のpHが0以下となるように調整した。混合溶液を100大気圧下で180℃まで加熱し、3時間保持し、反応させた。得られた反応生成物を分離し、純粋で洗浄した。その後、洗浄された反応生成物をオーブンにて100℃、24時間保持し、乾燥させた。
(2)三塩化チタン(0.15mol/L)13mLと、酸化剤として過硫酸アンモニウム粉末2.7gと、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHが0.75となるように調整した以外は、上記(1)と同様である。混合溶液の容量は、80mL(調整用の水を含む)であった。
【0033】
Philips PW1800X−Ray回折装置(Philips Research Laboratories,Netherlands)によるX線回折法、および、NR−1800機器(JASCO,Tokyo,Japan)によるラマン分光法を用いて、上記(1)および(2)から得られた生成物の同定を行った。X線回折装置の動作条件は、Cu−Kα線を用いて、40kV/50mA、0.5°2θ/分の走査速度であった。ラマン分光は、光源出力20mWおよび解像度1cm-1でAr+レーザ(波長514
.5nm)を用いた。それぞれの結果を図3および図4に示し詳述する。
【0034】
生成物の表面観察を、JOEL FEM−3000透過型電子顕微鏡TEMを用いて行った。なお、加速電圧は300kVであった。結果を図5に示し詳述する。
【0035】
図3は、実施例1によるX線回折パターンを示す図である。
図3(A)は、上記(1)の条件の混合溶液から得られた生成物のX線回折パターンを示し、(B)は、上記(2)の条件の混合溶液から得られた生成物のX線回折パターンを示す。いずれの回折パターンも、(101)、(004)、(200)、(105)および(204)のアナターゼの回折ピークを示し、その他の相を示す回折ピークは見られなかった。
【0036】
図4は、実施例1によるラマンスペクトルを示す図である。
図4(A)は、上記(1)の条件の混合溶液から得られた生成物のラマンスペクトルを示し、(B)は、上記(2)の条件の混合溶液から得られた生成物のラマンスペクトルを示す。いずれのラマンスペクトルも、151.6cm-1、403.4cm-1、520.2cm-1、641.3cm-1のアナターゼを示すピークを示し、その他の相を示すピークは見られなかった。
【0037】
図3および図4から、酸化剤として過硫酸アンモニウムを用いた場合、任意の濃度およびpHに関わらず、アナターゼ単相が得られたことが分かった。
【0038】
図5は、実施例1による生成物のTEM観察像および電子線回折像を示している図である。
図5中(A)は、上記(1)の条件の混合溶液から得られた生成物を示し、(B)は、上記(2)の条件の混合溶液から得られた生成物を示している。また、図5(A)の電子線回折像(挿入図)によれば、不明瞭なもののリングが見られ、(B)の電子線回折像(挿入図)には、明瞭なリングが示されている。このことから、いずれの生成物も多結晶であることが理解される。また、これらのリングから算出される面指数は、それぞれ、図3(A)および(B)の回折パターンから得られる面指数に一致することが確認された。
【0039】
図5(A)は、虫食い状態の球状粒子が凝集している様子を示している。
また、細孔分布測定装置による吸脱着等温線の結果(図示せず)によれば、IUPACのIV型に分類される等温線が得られた。等温線から算出される比表面積は、297m2
/gであり、2〜50nm径の細孔を有することが分かった。
【0040】
一方、図5(B)は、分離した粒子を示し、その粒径はナノメートルオーダであった。その比表面積は、134m2/gであり、細孔を有しないナノ結晶であることが分かる。
【0041】
これらの結果から、酸化剤として過硫酸アンモニウムを用いた場合、三塩化チタンの濃度によって得られるアナターゼの粒形状を制御できることが示唆される。特に、濃度が低い場合には、ナノメートルオーダの粒径を有する微細粒子が得られ得る。このような粒子は、安定なゾルの製造、ならびに、ナノメートルサイズの粒子からなるバルク体の製造に有利である。また、このような粒子を用いれば、焼結温度を下げることができるので、製造コストの削減にもなり得る。
【実施例2】
【0042】
各種の濃度の三塩化チタン(0.05mol/L〜0.90mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHが0以下〜1.68となるように調整した。
【0043】
それぞれの混合溶液における三塩化チタンの濃度とpHとの組み合わせ、すなわち、([Ti3+](mol/L):pH)は、(0.05:1.68)、(0.0625:1.32)、(0.075:1.1)、(0.10:0.90)、(0.15:0.75)、(0.30:0.58)、(0.45:0.40)、(0.60:0.25)、および、(0.90:0以下)とした。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)とした。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0044】
上記実施例2の条件で得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、各生成物の重量パーセントを、X線回折パターンに基づいて、J.Phys.Chem.B2000,104,3481−3487に記載の式から求めた。得られた結果を図6に示し、詳述する。
【0045】
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.90:0以下)および(0.0625:1.32)である混合溶液から得られた生成物の表面観察の結果を図7(A)および(B)にそれぞれ示し、詳述する。表面観察は、実施例1と同様に、TEMを用いて行った。
【0046】
図6は、実施例2による各混合溶液の条件、対応する各相の重量パーセント、および、X線回折パターンを示す図である。
【0047】
図6より、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.0625:1.32)および(0.075:1.1)である混合溶液から得られた生成物は、ブルッカイトのみを示す回折ピークを示した。
【0048】
また、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.60:0.25)および(0.90:0以下)である混合溶液から得られた生成物は、ルチルのみを示す回折ピークを示した。
【0049】
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.05:1.68)、(0.10:0.90)および(0.15:0.75)である混合溶液から得られた生成物は、アナターゼおよびブルッカイトそれぞれを示す回折ピーク、および、それらが混合した回折ピークを示した。
【0050】
それぞれの混合溶液から得られたアナターゼおよびブルッカイトの重量パーセントは図6に示されるとおりである。
三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.30:0.58)および(0.45:0.40)である混合溶液から得られた生成物は、アナターゼ、ブルッカイトおよびルチルそれぞれを示す回折ピーク、および、それらが混合した回折ピークを示した。それぞれの混合溶液から得られたアナターゼ、ブルッカイトおよびルチルの重量パーセントは図6に示されるとおりである。
図6から、同じ出発原料を用いても、その濃度および混合溶液のpHによって、各種の相の二酸化チタンを製造することができることが分かる。
【0051】
図7は、実施例2によるTEM観察像を示す図である。
図7(A)は、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.90:0以下)である混合溶液から得られたルチルを示す。ルチルは、ナノメートルサイズのロッド状であり凝集していることが分かった。
図7(B)は、三塩化チタンの濃度とpHとの組み合わせ([Ti3+](mol/L):pH)が、(0.0625:1.32)である混合溶液から得られたブルッカイトを示す。ブルッカイトは、薄板状であった。
【0052】
次に、三塩化チタンの濃度を固定し、混合溶液のpHが生成される相に及ぼす影響を調べた。
【実施例3】
【0053】
固定濃度の三塩化チタン(0.0625mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、pHが0.44、0.67、1.32、1.72、6.53および9.0となるように混合溶液をそれぞれ調整した。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)であった。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0054】
得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、実施例2と同様の方法で、ブルッカイトについて重量パーセントを求めた。結果を図8に示し、詳述する。
混合溶液のpHが、9.0および0.44である混合溶液から得られた生成物の表面観察の結果を図9(A)および(B)にそれぞれ示し、詳述する。表面観察には、実施例1と同様に、TEMを用いた。
【0055】
図8は、実施例3による各種混合溶液のpH、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図である。
図8から、混合溶液のpHが大きくなると、ブルッカイトが減少し、アナターゼが増加することが分かった。この際、ルチルは生成されなかった。pHが9.0に達すると、アナターゼ単相が得られた。一方、混合溶液のpHが小さくなると、同様にブルッカイトが減少し、ルチルが増加することが分かった。この際、アナターゼは生成されなかった。pHが0.44に達すると、ルチル単相が得られた。このことから、三塩化チタンの濃度を固定した場合、混合溶液のpHを制御するだけで、所望の相のみを有する二酸化チタンが得られることが分かる。また、アナターゼの生成は、高いpHの混合溶液で促進され、ルチルの生成は、低いpHの混合溶液で促進される。
【0056】
図9は、実施例3によるTEM観察像を示す図である。
図9(A)は、pH=9.0である混合溶液から得られたアナターゼを示す。図5(B)と同様の形状のアナターゼが得られたことが分かる。図9(B)は、pH=0.44である混合溶液から得られたルチルを示す。図7(A)と同様にナノメートルサイズのロッド状であるが、図7(A)のルチルと比べて、各ロッドが分散した状態であることが分かった。このことから、三塩化チタンの濃度が、高いほど凝集したロッド状のルチルが得られ、低いほど各ロッドが分散したルチルが得られることが示唆される。
【0057】
次に、混合溶液のpHを固定し、三塩化チタンの濃度が生成される相に及ぼす影響を調べた。
【実施例4】
【0058】
各種濃度の三塩化チタン(0.005mol/L〜0.90mol/L)と、酸化剤として過酸化水素と、pH調整剤として水酸化アンモニウムとを混合し、混合溶液のpHがそれぞれ1.32となるように調整した。用いたTiCl3溶液の濃度(mol/L)は
、それぞれ、0.005、0.015、0.03、0.0625、0.25および0.90であった。それぞれの混合溶液の容量は、いずれも80mL(調整用の水を含む)であった。得られた混合溶液は、実施例1と同様の条件で反応、分離・洗浄、および、乾燥させた。
【0059】
得られた各生成物を、実施例1と同様に、X線回折法を用いて同定した。また、実施例2と同様に、各種生成物の重量パーセントを求めた。結果を図10に示し、詳述する。結果を図10に示し、詳述する。
図10は、実施例4による各種三塩化チタンの濃度、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図である。
図10から、pH=1.32では、三塩化チタンの濃度を変化させてもルチルは生成しないことが分かった。このことは、ルチルが低いpHの混合溶液で生成されるという図8の結果に一致する。また、pHを固定した場合、濃度制御が必要なものの、三塩化チタンの濃度0.0625mol/Lを含む近傍にて、ブルッカイト単相が得られることが分かった。
【産業上の利用可能性】
【0060】
本発明による二酸化チタンは、環境有害物質を分解する光触媒、紫外光遮蔽材、フォトニック結晶に利用可能である。本発明によれば、用途に応じた相のみを有する二酸化チタンを同様の出発原料から製造することができるので、製造ラインを簡略化できる。
【図面の簡単な説明】
【0061】
【図1】本発明による二酸化チタンを製造する工程を示す図
【図2】アナターゼ、ブルッカイトおよびルチルの模式図
【図3】実施例1によるX線回折パターンを示す図
【図4】実施例1によるラマンスペクトルを示す図
【図5】実施例1によるTEM観察像および電子線回折像を示す図
【図6】実施例2による各種混合溶液の条件、対応する各相の重量パーセント、および、X線回折パターンを示す図
【図7】実施例2によるTEM観察像を示す図
【図8】実施例3による各種混合溶液のpH、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図
【図9】実施例3によるTEM観察像を示す図
【図10】実施例4による各種三塩化チタンの濃度、対応するブルッカイトの重量パーセント、および、X線回折パターンを示す図
【図11】従来技術によるブルッカイトを製造する工程を示す図
【特許請求の範囲】
【請求項1】
二酸化チタンを製造する方法であって、
三塩化チタンと酸化剤とpH調整剤とを混合する工程であって、前記酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、前記三塩化チタン中のチタンTi3+と前記酸化剤とのモル比は、1:1である、工程と、
前記混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程と
を包含する、方法。
【請求項2】
前記加熱する工程は、150℃以上250℃以下の温度範囲で、1時間〜12時間の間加熱する、請求項1に記載の方法。
【請求項3】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過硫酸アンモニウムである、請求項1に記載の方法。
【請求項4】
前記三塩化チタンの濃度C(mol/L)は、0<C<0.6の範囲である、請求項3に記載の方法。
【請求項5】
前記二酸化チタンが、ルチル型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、0.5未満に調整され、前記三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲である、請求項1に記載の方法。
【請求項6】
前記二酸化チタンが、ブルッカイト型二酸化チタンの場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、1.0〜1.5の範囲に調整され、前記三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲である、請求項1に記載の方法。
【請求項7】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、4.0〜14の範囲に調整される、請求項1に記載の方法。
【請求項8】
前記三塩化チタンの濃度C(mol/L)が0.5以下である場合、前記混合溶液のpHは4.0より大きくなるように調整され、前記三塩化チタンの濃度C(mol/L)が0.5を越える場合、前記混合溶液のpHは7.0より大きくなるように調整される、請求項7に記載の方法。
【請求項9】
前記加熱する工程で得られた生成物を洗浄し、乾燥する工程をさらに包含する、請求項1に記載の方法。
【請求項1】
二酸化チタンを製造する方法であって、
三塩化チタンと酸化剤とpH調整剤とを混合する工程であって、前記酸化剤は、過硫酸アンモニウム、過塩素酸、硝酸、および、過酸化水素からなる群から選択され、前記三塩化チタン中のチタンTi3+と前記酸化剤とのモル比は、1:1である、工程と、
前記混合する工程で得られた混合溶液を150℃以上の温度で加熱する工程と
を包含する、方法。
【請求項2】
前記加熱する工程は、150℃以上250℃以下の温度範囲で、1時間〜12時間の間加熱する、請求項1に記載の方法。
【請求項3】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過硫酸アンモニウムである、請求項1に記載の方法。
【請求項4】
前記三塩化チタンの濃度C(mol/L)は、0<C<0.6の範囲である、請求項3に記載の方法。
【請求項5】
前記二酸化チタンが、ルチル型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、0.5未満に調整され、前記三塩化チタンの濃度C(mol/L)は、0<C<1.5の範囲である、請求項1に記載の方法。
【請求項6】
前記二酸化チタンが、ブルッカイト型二酸化チタンの場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、1.0〜1.5の範囲に調整され、前記三塩化チタンの濃度C(mol/L)は、0.05<C<0.1の範囲である、請求項1に記載の方法。
【請求項7】
前記二酸化チタンが、アナターゼ型二酸化チタンである場合、前記酸化剤は、過塩素酸、硝酸および過酸化水素からなる群から選択され、前記混合溶液のpHは、4.0〜14の範囲に調整される、請求項1に記載の方法。
【請求項8】
前記三塩化チタンの濃度C(mol/L)が0.5以下である場合、前記混合溶液のpHは4.0より大きくなるように調整され、前記三塩化チタンの濃度C(mol/L)が0.5を越える場合、前記混合溶液のpHは7.0より大きくなるように調整される、請求項7に記載の方法。
【請求項9】
前記加熱する工程で得られた生成物を洗浄し、乾燥する工程をさらに包含する、請求項1に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2007−230809(P2007−230809A)
【公開日】平成19年9月13日(2007.9.13)
【国際特許分類】
【出願番号】特願2006−52959(P2006−52959)
【出願日】平成18年2月28日(2006.2.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2005年9月27日 社団法人日本セラミックス協会発行の「第18回秋季シンポジウム第1回アジア−オセアニアセラミック連盟国際会議講演予稿集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年2月15日〜16日 独立行政法人物質・材料研究機構主催の「NIMSフォーラム2006」において文書をもって発表
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
【公開日】平成19年9月13日(2007.9.13)
【国際特許分類】
【出願日】平成18年2月28日(2006.2.28)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2005年9月27日 社団法人日本セラミックス協会発行の「第18回秋季シンポジウム第1回アジア−オセアニアセラミック連盟国際会議講演予稿集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 2006年2月15日〜16日 独立行政法人物質・材料研究機構主催の「NIMSフォーラム2006」において文書をもって発表
【出願人】(301023238)独立行政法人物質・材料研究機構 (1,333)
【Fターム(参考)】
[ Back to top ]

