二酸化炭素の変換方法および二酸化炭素変換用触媒
【課題】二酸化炭素を有機化合物に変換することができる方法を提供する。
【解決手段】二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に溶存する炭酸水素イオンを有機化合物に変換する。
【解決手段】二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に溶存する炭酸水素イオンを有機化合物に変換する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、二酸化炭素を蟻酸(HCOOH)、酢酸(CH3COOH)、コハク酸(HOOH2C−CH2COOH)または乳酸(CH3CH(OH)COOH)等のカルボン酸(カルボシル基COOHを含む酸)等の有機化合物に変換する方法および二酸化炭素変換用触媒に関するものである。
【背景技術】
【0002】
温暖化の進行に対処するため、種々の科学技術が模索されている。中でも、二酸化炭素を有用な物質に変換して固定する機能を有した触媒材料の開発に対する期待は極めて高い。二酸化マンガンの結晶構造にはアルファ型、ベータ型、ガンマ型、ラムダ型、イプシロン型、デルタ型、アール型(以下、ラムズデライト型、またはR型とも表記する)など種々の結晶構造が存在することが知られている。本発明者は、これまでに特許文献1においてR型の結晶構造を高純度に結晶内に含んだ二酸化マンガン触媒が二酸化炭素ガスCO2をアセトン(CH3COCH3)、アセトアルデヒト(CH3CHO)、および酢酸(CH3COOH)、等に変換する機能性を示すことを報告している。
【0003】
二酸化炭素を他の物質に変換する機能性を有した触媒材料としては、二酸化炭素をポリカーボナートに変換するコバルト触媒(非特許文献1)や、超臨界二酸化炭素中における二酸化炭素の高速水素化反応を利用した蟻酸に変換するルテニウム触媒(特許文献2)等が存在する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−106924号公報
【特許文献2】特開平07−173098号公報
【非特許文献】
【0005】
【非特許文献1】Nakano, K.; Hashimoto, S.; Nozaki, K. Chem. Sci. 2010, 1, 369−373.
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1では、二酸化マンガン触媒の存在下で二酸化炭素ガスを他の物質に変換しているが、その変換効率が低いことが実用上問題であった。また、非特許文献1で使用されるコバルト触媒は高価であり、プラスチックの原料となるポリカーボナートへの変換に機能性が限られる。特許文献2で使用されるルテニウム触媒も高価であり、また二酸化炭素を超臨界にする必要があるなどコスト的な問題を有している。
【0007】
そこで本発明は以上の通りの背景から、二酸化炭素を有機化合物に変換することができる方法および二酸化炭素変換用触媒を提供することを課題としている。
【課題を解決するための手段】
【0008】
本発明の二酸化炭素の変換方法は、二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に二酸化炭素の溶解により発生する炭酸水素イオンを有機化合物に変換することを特徴とする。
【0009】
この二酸化炭素の変換方法においては、前記水溶液が、その液性が弱酸性からアルカリ性に保たれた水溶液、または、アルカリ性緩衝液であることが好ましい。
【0010】
また、この二酸化炭素の変換方法においては、前記アルカリ性緩衝溶液が、アルカリ性の、Trishydroxymethyl amino methane、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid、ホウ酸緩衝溶液、および重炭酸塩緩衝液からなる群から選ばれる少なくとも1種であることが好ましい。
【0011】
さらにまた、この二酸化炭素の変換方法においては、前記水溶液中に、さらに貴金属錯体を共存させることが好ましい。
【0012】
そして、この二酸化炭素の変換方法においては、前記水溶液の温度が、100℃以下であることが好ましい。
【0013】
また、この二酸化炭素の変換方法においては、前記水溶液と、前記二酸化マンガンとを密閉容器内に封入し、この密閉容器内に前記二酸化炭素を圧入して前記水溶液中に前記二酸化炭素を溶解させることが好ましい。
【0014】
さらにまた、この二酸化炭素の変換方法においては、前記有機化合物が、カルボン酸であることが好ましい。
【0015】
また、この二酸化炭素の変換方法においては、前記カルボン酸が、蟻酸、酢酸、コハク酸および乳酸からなる群から選ばれる少なくとも1種であることが好ましい。
【0016】
また、本発明の二酸化炭素変換用触媒は、上記の二酸化炭素の変換方法に用いられる触媒であって、ラムズデライト型の結晶構造を含む二酸化マンガンで構成されることを特徴とする。
【発明の効果】
【0017】
本発明によれば、ラムズデライト型の結晶構造を含む二酸化マンガンを用いて、二酸化炭素を有機化合物に変換することができる。
【図面の簡単な説明】
【0018】
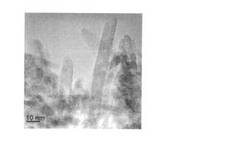
【図1】実施例1−8において使用したR型二酸化マンガンの透過型電子顕微鏡写真である。
【図2】R型二酸化マンガンのX線回折パターンである。
【図3】実施例8において使用した市販ガンマ型二酸化マンガンのX線回折パターンである。
【図4】実施例8において使用したベータ型二酸化マンガンのX線回折パターンである。
【発明を実施するための最良の形態】
【0019】
以下、本発明を詳細に説明する。
【0020】
本発明は、上記のとおり、二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガン(以下、R型二酸化マンガンともいう)を共存させ、二酸化炭素が水溶液中に溶解した際に発生する炭酸水素イオン(HCO3−)を有機化合物に変換する。
【0021】
ここで、R型二酸化マンガンは、例えば、本発明者が上記特許文献1において報告している方法によって合成される。具体的には、炭酸マンガン、水酸化マンガン、塩化マンガン、硫酸マンガン、硝酸マンガン、シュウ酸マンガン等の2価のマンガン化合物を焼成し、これを酸処理することで得られる。
【0022】
焼成温度は、例えば180℃〜300℃であり、焼成時間は、1時間〜20時間程度である。酸処理は、希塩酸、希硫酸、希硝酸等の希酸中に被処理物を添加し、これを10分〜3時間程度撹拌することによってなされる。この酸処理は、1回または2回以上繰り返して行うことができる。
【0023】
上記した合成方法以外に、次のステップ1〜3を経てR型二酸化マンガンを合成することもできる。
【0024】
塩化マンガンや硫酸マンガンなどの水溶性の高い2価のマンガンを含むマンガン化合物の水溶液を調製し、この水溶液に水酸化ナトリウムなどのアルカリ試薬を加えてマンガンイオンを水酸化マンガンMn(OH)2に変換する。これをステップ1とする。
【0025】
2価のマンガンを含むマンガン化合物の水溶液は、例えば、マンガンイオン濃度が0.05〜1.0wt%、好ましくは0.08〜0.2wt%の水溶液が用いられる。
【0026】
ステップ2として、アルカリ試薬を添加した2価のマンガン化合物の水溶液に過酸化水素水を加えて、水酸化マンガンを、マンガンの価数が2.67の酸化マンガンMn3O4に変換する。このステップ2において、水溶液の水温を25℃以下に保つことが好ましい。
【0027】
ステップ3として、酸化マンガンMn3O4に希酸を加えて攪拌処理することによってR型二酸化マンガンを得る。
【0028】
以上の方法によって合成された二酸化マンガンがラムズデライト型の結晶構造を有する二酸化マンガンであることは、非特許文献2(Fong, C., Kennedy, B. J. and Elcombe, M. M. A powder neutron diffraction study of lambda and gamma manganese dioxide and of LiMn2O4. Zeitschrift Fuer Kristallographie 209, 941−945 (1994).)のX線回折パターンデータを参照し、一般的な実験室用X線回折分析装置でX線回折パターンを分析することで確認できる。
【0029】
以上のR型二酸化マンガンは、二酸化炭素を溶解した水溶液中、二酸化炭素変換用触媒として使用される。この二酸化炭素変換用触媒は、水中の水酸化物イオン(OH−)から酸素を発生させながらプロトン(H+)と電子を生成し、同触媒表面に帯電する性質を有しており、同触媒を懸濁させる水のpHを弱酸性〜アルカリ性に保つことにより触媒活性が高められる。
【0030】
本発明においては、水溶液の液性を弱酸性〜アルカリ性に調整し、この水溶液に二酸化炭素を溶解している。水溶液の液性が弱酸性〜アルカリ性であれば、二酸化炭素(CO2)は水溶液中で炭酸水素イオン(HCO3−)として溶存する。ここで、弱酸性の水溶液とはpH5以上の酸性水溶液のことをいう。そして、水溶液に二酸化炭素を溶解した後も水溶液の液性を弱酸性〜アルカリ性に保ち、炭酸水素イオンが溶存する水溶液に、二酸化炭素変換用触媒を共存させることで、炭酸水素イオンを有機化合物に変換することができる。
【0031】
本発明においては、二酸化炭素を溶解させる水溶液として、アルカリ性緩衝液を用いることが好ましい。これによって炭酸水素イオンから有機化合物への変換効率を高めることができる。アルカリ性緩衝液の具体例としては、アルカリ性の、Trishydroxymethyl amino methane: NH2(OH)3 (以下トリスと記載)、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid: C8H18N2O4S(以下ヘペスと記載)や、ホウ酸緩衝液等を挙げることができる。また、重炭酸ナトリウム等のアルカリ性の重炭酸塩緩衝液や、リン酸緩衝溶液等を挙げることもできる。
【0032】
また、本発明においては、二酸化炭素を溶解した水溶液中に、二酸化炭素変換用触媒とともに貴金属錯体を共存させることが好ましい。これによって炭酸水素イオンから有機化合物への変換効率を高めることができる。貴金属錯体の具体例としては、金錯体(例えばAuCl4−)やパラジウム錯体(例えばPd(Cl)2またはPd(OH)2)等を挙げることができる。このような貴金属錯体は、例えば、水溶液中の金やパラジウム等の貴金属の濃度が10〜1000mg/Lとなるように添加される。
【0033】
本発明の二酸化炭素の変換方法では、二酸化炭素を溶解した水溶液の温度を100℃以下にして炭酸水素イオンを有機化合物に変換することができる。後述するように、水溶液の界面を大気中に開放するなどして二酸化炭素を大気圧下で水溶液中に溶解させる場合には、水溶液の温度を、水溶液の加熱によって、例えば40℃〜90℃、好ましくは50℃〜70℃に保持することで二酸化炭素の変換効率をより高めることができる。
【0034】
水溶液中に二酸化炭素を溶解させる方法としては、水溶液の界面を大気中に開放し、水溶液の界面と大気とを接触させるなどして大気中の二酸化炭素を水溶液中に溶解させる方法であってもよい。この手法ではギ酸や酢酸が乳酸およびコハク酸らと共に検出される。また、密閉容器に水溶液と二酸化炭素変換用触媒とを封入し、この密閉容器内に二酸化炭素を圧入して水溶液中に二酸化炭素を溶解させる方法であってもよい。後者の方法は、前者の方法と比べて、低酸素分圧下で二酸化炭素を高濃度に溶解させることができ、変換後に主として乳酸が得られる。
【0035】
本発明においては、上記のとおり、炭酸水素イオンを有機化合物に変換することができる。例えば、炭酸水素イオンを蟻酸、酢酸、コハク酸、乳酸等のカルボン酸に変換することができる。
【0036】
酢酸およびコハク酸は、その分子構造に炭素−炭素結合(C−C結合)を有するカルボン酸であり、乳酸は、炭素−炭素−炭素(C−C−C結合)を有するカルボン酸である。二酸化炭素変換用触媒によってC−C結合やC−C−C結合を作り出せることは、本発明の大きな特徴である。また、従来の二酸化炭素変換触媒材料には確認されていなかった乳酸、コハク酸への変換を可能としたことも本発明の大きな特徴である。さらにまた本発明の大きな特徴として、二酸化炭素を効率よく変換できることも挙げられる。例えば、特許文献2に記載の蟻酸の合成方法では、高価なルテニウム触媒を用いるとともに二酸化炭素を超臨界にする必要があったが、本発明では、二酸化炭素変換用触媒を低コストで製造でき、また従来の二酸化炭素変換触媒材料と比べて安価に入手でき、しかも反応系を超臨界(7.382MPa)にする必要がなく、より穏和な条件(例えば、0.5MPa)で二酸化炭素を蟻酸などの有機化合物に変換することができる。
【0037】
以下に実施例を示し、さらに詳しく説明する。もちろん以下の例によって本発明の実施態様が限定されることはない。
【実施例】
【0038】
<実施例1>大気中に置かれたアルカリ性水溶液中で大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0039】
ガラス製ビーカーに超純水(ミリポア社製の超純水製造装置で製造)100mLに、予め大気圧下130℃で2週間以上乾燥した二酸化マンガン触媒0.5gを懸濁させ、ガラス製のマグネチック・スターラーで攪拌しながら5日間、水温約50℃を保った。水量の減少は適時、超純水を追加して100mLを保った。水溶液のpHは水溶液にR型二酸化マンガン触媒を懸濁させた後、適時、水酸化ナトリウム水溶液を添加してpH7.26から7.83を保った。
【0040】
図1に、使用したR型二酸化マンガンの透過型電子検鏡写真、および図2に、そのX線回折パターンを示す。図2のX線回折パターンでは、図の横軸上に記載したR型に特有なピーク位置を示す目盛りとほぼ同じ回折角度にピークが現れていることがわかる。具体的には、回折角21.5°近辺にR型に特有な回折ピークが見られる。
【0041】
5日間の攪拌後に、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。
【0042】
その結果、乳酸濃度が6.093mg/L、蟻酸濃度が0.190mg/L、および酢酸濃度は0.684mg/Lと定量された。使用したガラス器具類や特級薬品類、およびR型二酸化マンガン触媒にはこれらのカルボン酸による汚染は存在しないため、大気中から二酸化炭素が実験水溶液に炭酸水素イオンとして溶解し、R型二酸化マンガン触媒と反応することでカルボン酸に変換されたものと考えられた。
【0043】
また、50℃から室温に冷ました上記実験水溶液の水面には油膜の発生が見られた。そこで、冷蔵庫内で3℃に同実験水溶液を1時間冷やして再度サンプリングし、同様にカルボン酸濃度を調べたところ、乳酸濃度が1.389mg/Lと、50℃の場合に比べて低下し、蟻酸濃度は0.213mg/Lとほぼ変わらず、酢酸濃度は検出されなかった。この理由は、乳酸は融点が16.8℃であるため、3℃への冷却によって水面に固化浮遊したために実験水溶液のサンプルからは検出されなかったものと考えられる。
【0044】
<実施例2>大気中に置かれたアルカリ性水溶液中に金錯体を添加し、大気中から自然に溶解してくる二酸化炭素が、同アルカリ水溶液中でR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0045】
実施例1に示した実験を、同様なR型二酸化マンガン触媒の添加量(0.5g)、および容量200mLの水溶液中に金錯体(AuCl4−)(金濃度1000mg/L)を共存させて実施し、50℃に保温しながらpH8.0から9.0を4日間保持した。
【0046】
その結果、実施例1と同様な実験水溶液のサンプリングと分析によって、コハク酸濃度12.345mg/L、蟻酸濃度2.817mg/L、および酢酸濃度5.885mg/Lを確認した。
【0047】
実施例1の結果と異なって乳酸の発生を確認できなかった。実施例1に記載した、R型二酸化マンガン触媒だけをアルカリ性の水溶液に懸濁させて50℃に加温した場合に比較して、金錯体を共存させた本実施例2では乳酸の代わりにコハク酸が検出されたことが特徴である。
【0048】
<実施例3>大気中に置かれたアルカリ性水溶液中にパラジウム錯体を添加し、大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0049】
実施例1に示した実験を、同様なR型二酸化マンガン触媒の添加量(0.5g)、および容量100mLの水溶液中にパラジウム錯体(Pd(Cl)2またはPd(OH)2)(パラジウム濃度1000mg/L)を共存させて実施し、室温24℃下で、pH6.0から7.0を4日間保持した。
【0050】
その結果、実験水溶液の水面に油膜の発生が観察された。実施例1と同様な実験水溶液のサンプリングと分析によって、コハク酸濃度0.629mg/L、蟻酸濃度2.779mg/L、および酢酸濃度4.906mg/Lを確認した。
【0051】
その後、同実験水溶液を50℃に加温した状態で2日間攪拌した実験水溶液からは、乳酸濃度0.723mg/L、コハク酸濃度0.592mg/L、蟻酸濃度0.285mg/L、酢酸濃度7.737mg/Lが検出された。
【0052】
実施例1に記載した、R型二酸化マンガン触媒だけをアルカリ性の水溶液に懸濁させて50℃に加温した場合に比較して、パラジウム錯体を共存させた実施例3ではコハク酸が検出されることが特徴である。
【0053】
<実施例4>大気中に置かれたアルカリ性緩衝水溶液(トリス水溶液)中で大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0054】
実験に使用したトリス水溶液は和光純薬製試薬トリス0.12gを100mLの超純水(ミリポア社製の超純水製造装置で製造)に溶解させて作成した。これに水酸化ナトリウム水溶液を適量滴下してpH10とした。水温は19℃であった。このトリス水溶液をガラスビーカー内でR型二酸化マンガン0.25gを懸濁させて、ガラス製のマグネチック・スターラーで室温下攪拌しながら1日間保持した。攪拌終了時のpHは9.14、水温は21.4℃であった。次に、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、乳酸濃度4.794mg/L、ギ酸濃度26.549mg/Lを確認した。トリスはその化学式 NH2(OH)3に炭素やカルボシル基COOHを含まないため、大気中から実験水溶液への二酸化炭素の溶解が炭素の起源であると考えられた。
【0055】
<実施例5>二酸化炭素を圧入した密閉容器内で、アルカリ性緩衝水溶液(トリス水溶液)中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
上記の実施例1−4では、大気開放した実験水溶液中に大気から自然に溶解してくる二酸化炭素がカルボン酸へ変換された例について述べた。
【0056】
本実施例5では、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒を準備し、この触媒0.25gを実施例4と同様のトリス水溶液100mL(pH10)に懸濁させて実験水溶液とし、この実験水溶液を密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)内に密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを取り扱い説明書にしたがって同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温21℃下で1日間保った。次に同密閉容器を開封し、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、コハク酸1.638mg/L、乳酸1.138mg/L、ギ酸11.563mg/Lが確認された。また、開封直後の実験水溶液がpH5.4、および水温20.8℃であることを測定確認した。実施例4の結果と比較して乳酸濃度およびギ酸濃度は本実施例の方が低い値であったが、密閉容器内で加圧することによってコハク酸の発生が見られた。ギ酸濃度が低い値であった理由は密閉容器内の酸素分圧が大気中に比べて低いことが原因のひとつとして考えられた。
【0057】
<実施例6>二酸化炭素を圧入した密閉容器内で、アルカリ性緩衝水溶液(ヘペス水溶液)中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0058】
本実施例6では、実施例5と同様の実験を、ヘペス水溶液をアルカリ性緩衝水溶液として用いた。ヘペス水溶液の調整にあたっては、和光純薬製試薬HEPES:4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid(C8H18N2O4S)23.8gを200mLの超純水に溶解させた後、水酸化ナトリウム水溶液を適量滴下してpH8.2とした。予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒を準備し、この触媒0.25gをヘペス水溶液100mL(pH8.2)に懸濁させて実験水溶液とし、この実験水溶液を容量5Lのステンレス製密閉容器内に密栓し、二酸化炭素ボンベから二酸化炭素ガスを0.05MPaの圧力で同密閉容器内に圧入・保持した。密閉容器内部の0.05MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温21℃下で1日間保った。次に同密閉容器を開封し、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、乳酸1.142mg/L、ギ酸9.695mg/Lが確認された。また、開封直後の実験水溶液がpH7.12、および水温21.2℃であることを測定確認した。
【0059】
<実施例7>二酸化炭素を圧入した密閉容器内で、重炭酸ナトリウムを添加したアルカリ性の水溶液中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0060】
本実施例7では、密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)中に200mLの超純水(ミリポア社製の超純水製造装置で製造)をとり、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒0.5g、および重炭酸ナトリウム10gを懸濁させた後、密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを取り扱い説明書にしたがって同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温24℃下で2日間保った。
【0061】
2日後に密閉容器を開栓し、実施例1と同様に実験水溶液をサンプリングし、開封直後のpHとカルボン酸濃度をpHメーターと有機酸分析装置で調べたところ、pH7.0、乳酸濃度1.932mg/Lを検出した。
【0062】
<実施例8>二酸化炭素を圧入した密閉容器内で、アルカリ性のホウ酸緩衝水溶液中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0063】
密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)中に100mLのアルカリ性ホウ酸緩衝水溶液(pH9.53)をとり、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒0.25gを懸濁させた後、密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温22℃下で1日間保った。そして、1日後に密閉容器を開栓した。ホウ酸緩衝水溶液の調整にあたっては、和光純薬製特級試薬ホウ酸、および濃度1Mの水酸化ナトリウム水溶液を用いて、ホウ酸濃度0.1Mのホウ酸緩衝水溶液90mLに水酸化ナトリウム水溶液と超純水を滴下して、容量100mL、pH9.53のホウ酸緩衝水溶液とした。
【0064】
開栓後に他の実施例と同様に実験水溶液をサンプリングし、開封直後のpHおよび水温とカルボン酸濃度をpHメーターと有機酸分析装置で調べたところ、pH6.07、22.0℃、乳酸濃度7.676mg/Lを検出した。
【0065】
また、R型二酸化マンガン触媒の代わりに下記の市販の2種のガンマ型二酸化マンガンの各々について本実施例と同条件で実験したところ、それぞれ乳酸濃度約2mg/Lを検出した。この結果から、本実施形態に係るR型二酸化マンガン触媒の方が、二酸化炭素変換用触媒としての性能が優れていることが確認できた。
【0066】
使用した2種のガンマ型二酸化マンガンは、添川理化学株式会社製のガンマ型二酸化マンガン(02320B)、中央電気工業株式会社製の化成二酸化マンガン(CMD−100)である。これら市販のガンマ型二酸化マンガンのX線回折パターンを図3に示す。図3(a)が添川理化学株式会社製のガンマ型二酸化マンガン(02320B)のX線回折パターンであり、図3(b)が中央電気工業株式会社製の化成二酸化マンガン(CMD−100)のX線回折パターンである。
【0067】
さらにまた、R型二酸化マンガン触媒の代わりにベータ型二酸化マンガンについて本実施例と同条件で実験したところ、乳酸濃度約2mg/Lを検出した。この結果から、本実施形態に係るR型二酸化マンガン触媒の方が、二酸化炭素変換用触媒としての性能が優れていることが確認できた。
【0068】
上記のベータ型二酸化マンガンは、ベータ型の結晶構造を有する二酸化マンガンである。ここで使用したベータ型二酸化マンガンは、平均粒子径1〜50nmのサイズを有している。このようなベータ型二酸化マンガンは、上記した添川理化学株式会社製のガンマ型二酸化マンガン(02320B)をセラミックるつぼにとり、電気炉内で、大気中400℃で3日間加熱する操作によって合成することができる。このベータ型二酸化マンガンのX線回折パターンを図4に示す。
【0069】
以上に記載の全実施例において、アルカリ緩衝水溶液の使用やアルカリ試薬の添加によって実験溶液を弱酸性からアルカリ性(pH5〜9)に保った際に、カルボン酸が検出された。これに対して、0.1Mの希硫酸または希塩酸などを添加したpH1〜4の酸性水溶液中でも実験を実施したが、乳酸の発生も他のカルボン酸の発生も検出できなかった。したがって、二酸化炭素を溶解した水溶液のpHを二酸化炭素変換用触媒の活性が高まる弱酸性からアルカリ性に保つことが、実験水溶液を加熱するなど外部エネルギーを加える手法と共に、二酸化炭素からカルボン酸への変換を促す重要な要素であることがわかった。
【技術分野】
【0001】
本発明は、二酸化炭素を蟻酸(HCOOH)、酢酸(CH3COOH)、コハク酸(HOOH2C−CH2COOH)または乳酸(CH3CH(OH)COOH)等のカルボン酸(カルボシル基COOHを含む酸)等の有機化合物に変換する方法および二酸化炭素変換用触媒に関するものである。
【背景技術】
【0002】
温暖化の進行に対処するため、種々の科学技術が模索されている。中でも、二酸化炭素を有用な物質に変換して固定する機能を有した触媒材料の開発に対する期待は極めて高い。二酸化マンガンの結晶構造にはアルファ型、ベータ型、ガンマ型、ラムダ型、イプシロン型、デルタ型、アール型(以下、ラムズデライト型、またはR型とも表記する)など種々の結晶構造が存在することが知られている。本発明者は、これまでに特許文献1においてR型の結晶構造を高純度に結晶内に含んだ二酸化マンガン触媒が二酸化炭素ガスCO2をアセトン(CH3COCH3)、アセトアルデヒト(CH3CHO)、および酢酸(CH3COOH)、等に変換する機能性を示すことを報告している。
【0003】
二酸化炭素を他の物質に変換する機能性を有した触媒材料としては、二酸化炭素をポリカーボナートに変換するコバルト触媒(非特許文献1)や、超臨界二酸化炭素中における二酸化炭素の高速水素化反応を利用した蟻酸に変換するルテニウム触媒(特許文献2)等が存在する。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009−106924号公報
【特許文献2】特開平07−173098号公報
【非特許文献】
【0005】
【非特許文献1】Nakano, K.; Hashimoto, S.; Nozaki, K. Chem. Sci. 2010, 1, 369−373.
【発明の概要】
【発明が解決しようとする課題】
【0006】
特許文献1では、二酸化マンガン触媒の存在下で二酸化炭素ガスを他の物質に変換しているが、その変換効率が低いことが実用上問題であった。また、非特許文献1で使用されるコバルト触媒は高価であり、プラスチックの原料となるポリカーボナートへの変換に機能性が限られる。特許文献2で使用されるルテニウム触媒も高価であり、また二酸化炭素を超臨界にする必要があるなどコスト的な問題を有している。
【0007】
そこで本発明は以上の通りの背景から、二酸化炭素を有機化合物に変換することができる方法および二酸化炭素変換用触媒を提供することを課題としている。
【課題を解決するための手段】
【0008】
本発明の二酸化炭素の変換方法は、二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に二酸化炭素の溶解により発生する炭酸水素イオンを有機化合物に変換することを特徴とする。
【0009】
この二酸化炭素の変換方法においては、前記水溶液が、その液性が弱酸性からアルカリ性に保たれた水溶液、または、アルカリ性緩衝液であることが好ましい。
【0010】
また、この二酸化炭素の変換方法においては、前記アルカリ性緩衝溶液が、アルカリ性の、Trishydroxymethyl amino methane、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid、ホウ酸緩衝溶液、および重炭酸塩緩衝液からなる群から選ばれる少なくとも1種であることが好ましい。
【0011】
さらにまた、この二酸化炭素の変換方法においては、前記水溶液中に、さらに貴金属錯体を共存させることが好ましい。
【0012】
そして、この二酸化炭素の変換方法においては、前記水溶液の温度が、100℃以下であることが好ましい。
【0013】
また、この二酸化炭素の変換方法においては、前記水溶液と、前記二酸化マンガンとを密閉容器内に封入し、この密閉容器内に前記二酸化炭素を圧入して前記水溶液中に前記二酸化炭素を溶解させることが好ましい。
【0014】
さらにまた、この二酸化炭素の変換方法においては、前記有機化合物が、カルボン酸であることが好ましい。
【0015】
また、この二酸化炭素の変換方法においては、前記カルボン酸が、蟻酸、酢酸、コハク酸および乳酸からなる群から選ばれる少なくとも1種であることが好ましい。
【0016】
また、本発明の二酸化炭素変換用触媒は、上記の二酸化炭素の変換方法に用いられる触媒であって、ラムズデライト型の結晶構造を含む二酸化マンガンで構成されることを特徴とする。
【発明の効果】
【0017】
本発明によれば、ラムズデライト型の結晶構造を含む二酸化マンガンを用いて、二酸化炭素を有機化合物に変換することができる。
【図面の簡単な説明】
【0018】
【図1】実施例1−8において使用したR型二酸化マンガンの透過型電子顕微鏡写真である。
【図2】R型二酸化マンガンのX線回折パターンである。
【図3】実施例8において使用した市販ガンマ型二酸化マンガンのX線回折パターンである。
【図4】実施例8において使用したベータ型二酸化マンガンのX線回折パターンである。
【発明を実施するための最良の形態】
【0019】
以下、本発明を詳細に説明する。
【0020】
本発明は、上記のとおり、二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガン(以下、R型二酸化マンガンともいう)を共存させ、二酸化炭素が水溶液中に溶解した際に発生する炭酸水素イオン(HCO3−)を有機化合物に変換する。
【0021】
ここで、R型二酸化マンガンは、例えば、本発明者が上記特許文献1において報告している方法によって合成される。具体的には、炭酸マンガン、水酸化マンガン、塩化マンガン、硫酸マンガン、硝酸マンガン、シュウ酸マンガン等の2価のマンガン化合物を焼成し、これを酸処理することで得られる。
【0022】
焼成温度は、例えば180℃〜300℃であり、焼成時間は、1時間〜20時間程度である。酸処理は、希塩酸、希硫酸、希硝酸等の希酸中に被処理物を添加し、これを10分〜3時間程度撹拌することによってなされる。この酸処理は、1回または2回以上繰り返して行うことができる。
【0023】
上記した合成方法以外に、次のステップ1〜3を経てR型二酸化マンガンを合成することもできる。
【0024】
塩化マンガンや硫酸マンガンなどの水溶性の高い2価のマンガンを含むマンガン化合物の水溶液を調製し、この水溶液に水酸化ナトリウムなどのアルカリ試薬を加えてマンガンイオンを水酸化マンガンMn(OH)2に変換する。これをステップ1とする。
【0025】
2価のマンガンを含むマンガン化合物の水溶液は、例えば、マンガンイオン濃度が0.05〜1.0wt%、好ましくは0.08〜0.2wt%の水溶液が用いられる。
【0026】
ステップ2として、アルカリ試薬を添加した2価のマンガン化合物の水溶液に過酸化水素水を加えて、水酸化マンガンを、マンガンの価数が2.67の酸化マンガンMn3O4に変換する。このステップ2において、水溶液の水温を25℃以下に保つことが好ましい。
【0027】
ステップ3として、酸化マンガンMn3O4に希酸を加えて攪拌処理することによってR型二酸化マンガンを得る。
【0028】
以上の方法によって合成された二酸化マンガンがラムズデライト型の結晶構造を有する二酸化マンガンであることは、非特許文献2(Fong, C., Kennedy, B. J. and Elcombe, M. M. A powder neutron diffraction study of lambda and gamma manganese dioxide and of LiMn2O4. Zeitschrift Fuer Kristallographie 209, 941−945 (1994).)のX線回折パターンデータを参照し、一般的な実験室用X線回折分析装置でX線回折パターンを分析することで確認できる。
【0029】
以上のR型二酸化マンガンは、二酸化炭素を溶解した水溶液中、二酸化炭素変換用触媒として使用される。この二酸化炭素変換用触媒は、水中の水酸化物イオン(OH−)から酸素を発生させながらプロトン(H+)と電子を生成し、同触媒表面に帯電する性質を有しており、同触媒を懸濁させる水のpHを弱酸性〜アルカリ性に保つことにより触媒活性が高められる。
【0030】
本発明においては、水溶液の液性を弱酸性〜アルカリ性に調整し、この水溶液に二酸化炭素を溶解している。水溶液の液性が弱酸性〜アルカリ性であれば、二酸化炭素(CO2)は水溶液中で炭酸水素イオン(HCO3−)として溶存する。ここで、弱酸性の水溶液とはpH5以上の酸性水溶液のことをいう。そして、水溶液に二酸化炭素を溶解した後も水溶液の液性を弱酸性〜アルカリ性に保ち、炭酸水素イオンが溶存する水溶液に、二酸化炭素変換用触媒を共存させることで、炭酸水素イオンを有機化合物に変換することができる。
【0031】
本発明においては、二酸化炭素を溶解させる水溶液として、アルカリ性緩衝液を用いることが好ましい。これによって炭酸水素イオンから有機化合物への変換効率を高めることができる。アルカリ性緩衝液の具体例としては、アルカリ性の、Trishydroxymethyl amino methane: NH2(OH)3 (以下トリスと記載)、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid: C8H18N2O4S(以下ヘペスと記載)や、ホウ酸緩衝液等を挙げることができる。また、重炭酸ナトリウム等のアルカリ性の重炭酸塩緩衝液や、リン酸緩衝溶液等を挙げることもできる。
【0032】
また、本発明においては、二酸化炭素を溶解した水溶液中に、二酸化炭素変換用触媒とともに貴金属錯体を共存させることが好ましい。これによって炭酸水素イオンから有機化合物への変換効率を高めることができる。貴金属錯体の具体例としては、金錯体(例えばAuCl4−)やパラジウム錯体(例えばPd(Cl)2またはPd(OH)2)等を挙げることができる。このような貴金属錯体は、例えば、水溶液中の金やパラジウム等の貴金属の濃度が10〜1000mg/Lとなるように添加される。
【0033】
本発明の二酸化炭素の変換方法では、二酸化炭素を溶解した水溶液の温度を100℃以下にして炭酸水素イオンを有機化合物に変換することができる。後述するように、水溶液の界面を大気中に開放するなどして二酸化炭素を大気圧下で水溶液中に溶解させる場合には、水溶液の温度を、水溶液の加熱によって、例えば40℃〜90℃、好ましくは50℃〜70℃に保持することで二酸化炭素の変換効率をより高めることができる。
【0034】
水溶液中に二酸化炭素を溶解させる方法としては、水溶液の界面を大気中に開放し、水溶液の界面と大気とを接触させるなどして大気中の二酸化炭素を水溶液中に溶解させる方法であってもよい。この手法ではギ酸や酢酸が乳酸およびコハク酸らと共に検出される。また、密閉容器に水溶液と二酸化炭素変換用触媒とを封入し、この密閉容器内に二酸化炭素を圧入して水溶液中に二酸化炭素を溶解させる方法であってもよい。後者の方法は、前者の方法と比べて、低酸素分圧下で二酸化炭素を高濃度に溶解させることができ、変換後に主として乳酸が得られる。
【0035】
本発明においては、上記のとおり、炭酸水素イオンを有機化合物に変換することができる。例えば、炭酸水素イオンを蟻酸、酢酸、コハク酸、乳酸等のカルボン酸に変換することができる。
【0036】
酢酸およびコハク酸は、その分子構造に炭素−炭素結合(C−C結合)を有するカルボン酸であり、乳酸は、炭素−炭素−炭素(C−C−C結合)を有するカルボン酸である。二酸化炭素変換用触媒によってC−C結合やC−C−C結合を作り出せることは、本発明の大きな特徴である。また、従来の二酸化炭素変換触媒材料には確認されていなかった乳酸、コハク酸への変換を可能としたことも本発明の大きな特徴である。さらにまた本発明の大きな特徴として、二酸化炭素を効率よく変換できることも挙げられる。例えば、特許文献2に記載の蟻酸の合成方法では、高価なルテニウム触媒を用いるとともに二酸化炭素を超臨界にする必要があったが、本発明では、二酸化炭素変換用触媒を低コストで製造でき、また従来の二酸化炭素変換触媒材料と比べて安価に入手でき、しかも反応系を超臨界(7.382MPa)にする必要がなく、より穏和な条件(例えば、0.5MPa)で二酸化炭素を蟻酸などの有機化合物に変換することができる。
【0037】
以下に実施例を示し、さらに詳しく説明する。もちろん以下の例によって本発明の実施態様が限定されることはない。
【実施例】
【0038】
<実施例1>大気中に置かれたアルカリ性水溶液中で大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0039】
ガラス製ビーカーに超純水(ミリポア社製の超純水製造装置で製造)100mLに、予め大気圧下130℃で2週間以上乾燥した二酸化マンガン触媒0.5gを懸濁させ、ガラス製のマグネチック・スターラーで攪拌しながら5日間、水温約50℃を保った。水量の減少は適時、超純水を追加して100mLを保った。水溶液のpHは水溶液にR型二酸化マンガン触媒を懸濁させた後、適時、水酸化ナトリウム水溶液を添加してpH7.26から7.83を保った。
【0040】
図1に、使用したR型二酸化マンガンの透過型電子検鏡写真、および図2に、そのX線回折パターンを示す。図2のX線回折パターンでは、図の横軸上に記載したR型に特有なピーク位置を示す目盛りとほぼ同じ回折角度にピークが現れていることがわかる。具体的には、回折角21.5°近辺にR型に特有な回折ピークが見られる。
【0041】
5日間の攪拌後に、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。
【0042】
その結果、乳酸濃度が6.093mg/L、蟻酸濃度が0.190mg/L、および酢酸濃度は0.684mg/Lと定量された。使用したガラス器具類や特級薬品類、およびR型二酸化マンガン触媒にはこれらのカルボン酸による汚染は存在しないため、大気中から二酸化炭素が実験水溶液に炭酸水素イオンとして溶解し、R型二酸化マンガン触媒と反応することでカルボン酸に変換されたものと考えられた。
【0043】
また、50℃から室温に冷ました上記実験水溶液の水面には油膜の発生が見られた。そこで、冷蔵庫内で3℃に同実験水溶液を1時間冷やして再度サンプリングし、同様にカルボン酸濃度を調べたところ、乳酸濃度が1.389mg/Lと、50℃の場合に比べて低下し、蟻酸濃度は0.213mg/Lとほぼ変わらず、酢酸濃度は検出されなかった。この理由は、乳酸は融点が16.8℃であるため、3℃への冷却によって水面に固化浮遊したために実験水溶液のサンプルからは検出されなかったものと考えられる。
【0044】
<実施例2>大気中に置かれたアルカリ性水溶液中に金錯体を添加し、大気中から自然に溶解してくる二酸化炭素が、同アルカリ水溶液中でR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0045】
実施例1に示した実験を、同様なR型二酸化マンガン触媒の添加量(0.5g)、および容量200mLの水溶液中に金錯体(AuCl4−)(金濃度1000mg/L)を共存させて実施し、50℃に保温しながらpH8.0から9.0を4日間保持した。
【0046】
その結果、実施例1と同様な実験水溶液のサンプリングと分析によって、コハク酸濃度12.345mg/L、蟻酸濃度2.817mg/L、および酢酸濃度5.885mg/Lを確認した。
【0047】
実施例1の結果と異なって乳酸の発生を確認できなかった。実施例1に記載した、R型二酸化マンガン触媒だけをアルカリ性の水溶液に懸濁させて50℃に加温した場合に比較して、金錯体を共存させた本実施例2では乳酸の代わりにコハク酸が検出されたことが特徴である。
【0048】
<実施例3>大気中に置かれたアルカリ性水溶液中にパラジウム錯体を添加し、大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0049】
実施例1に示した実験を、同様なR型二酸化マンガン触媒の添加量(0.5g)、および容量100mLの水溶液中にパラジウム錯体(Pd(Cl)2またはPd(OH)2)(パラジウム濃度1000mg/L)を共存させて実施し、室温24℃下で、pH6.0から7.0を4日間保持した。
【0050】
その結果、実験水溶液の水面に油膜の発生が観察された。実施例1と同様な実験水溶液のサンプリングと分析によって、コハク酸濃度0.629mg/L、蟻酸濃度2.779mg/L、および酢酸濃度4.906mg/Lを確認した。
【0051】
その後、同実験水溶液を50℃に加温した状態で2日間攪拌した実験水溶液からは、乳酸濃度0.723mg/L、コハク酸濃度0.592mg/L、蟻酸濃度0.285mg/L、酢酸濃度7.737mg/Lが検出された。
【0052】
実施例1に記載した、R型二酸化マンガン触媒だけをアルカリ性の水溶液に懸濁させて50℃に加温した場合に比較して、パラジウム錯体を共存させた実施例3ではコハク酸が検出されることが特徴である。
【0053】
<実施例4>大気中に置かれたアルカリ性緩衝水溶液(トリス水溶液)中で大気中から自然に溶解してくる二酸化炭素がR型二酸化マンガン触媒との反応によってカルボン酸に変換された例
【0054】
実験に使用したトリス水溶液は和光純薬製試薬トリス0.12gを100mLの超純水(ミリポア社製の超純水製造装置で製造)に溶解させて作成した。これに水酸化ナトリウム水溶液を適量滴下してpH10とした。水温は19℃であった。このトリス水溶液をガラスビーカー内でR型二酸化マンガン0.25gを懸濁させて、ガラス製のマグネチック・スターラーで室温下攪拌しながら1日間保持した。攪拌終了時のpHは9.14、水温は21.4℃であった。次に、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、乳酸濃度4.794mg/L、ギ酸濃度26.549mg/Lを確認した。トリスはその化学式 NH2(OH)3に炭素やカルボシル基COOHを含まないため、大気中から実験水溶液への二酸化炭素の溶解が炭素の起源であると考えられた。
【0055】
<実施例5>二酸化炭素を圧入した密閉容器内で、アルカリ性緩衝水溶液(トリス水溶液)中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
上記の実施例1−4では、大気開放した実験水溶液中に大気から自然に溶解してくる二酸化炭素がカルボン酸へ変換された例について述べた。
【0056】
本実施例5では、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒を準備し、この触媒0.25gを実施例4と同様のトリス水溶液100mL(pH10)に懸濁させて実験水溶液とし、この実験水溶液を密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)内に密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを取り扱い説明書にしたがって同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温21℃下で1日間保った。次に同密閉容器を開封し、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、コハク酸1.638mg/L、乳酸1.138mg/L、ギ酸11.563mg/Lが確認された。また、開封直後の実験水溶液がpH5.4、および水温20.8℃であることを測定確認した。実施例4の結果と比較して乳酸濃度およびギ酸濃度は本実施例の方が低い値であったが、密閉容器内で加圧することによってコハク酸の発生が見られた。ギ酸濃度が低い値であった理由は密閉容器内の酸素分圧が大気中に比べて低いことが原因のひとつとして考えられた。
【0057】
<実施例6>二酸化炭素を圧入した密閉容器内で、アルカリ性緩衝水溶液(ヘペス水溶液)中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0058】
本実施例6では、実施例5と同様の実験を、ヘペス水溶液をアルカリ性緩衝水溶液として用いた。ヘペス水溶液の調整にあたっては、和光純薬製試薬HEPES:4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid(C8H18N2O4S)23.8gを200mLの超純水に溶解させた後、水酸化ナトリウム水溶液を適量滴下してpH8.2とした。予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒を準備し、この触媒0.25gをヘペス水溶液100mL(pH8.2)に懸濁させて実験水溶液とし、この実験水溶液を容量5Lのステンレス製密閉容器内に密栓し、二酸化炭素ボンベから二酸化炭素ガスを0.05MPaの圧力で同密閉容器内に圧入・保持した。密閉容器内部の0.05MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温21℃下で1日間保った。次に同密閉容器を開封し、テフロン(登録商標)製のメンブラン膜ろ過ユニット(アドバンテック製DISMIC)を用いて実験水溶液中から水をサンプリングし、島津製作所製の有機酸分析装置でサンプル水中に含まれるカルボン酸濃度を計測した。その結果、乳酸1.142mg/L、ギ酸9.695mg/Lが確認された。また、開封直後の実験水溶液がpH7.12、および水温21.2℃であることを測定確認した。
【0059】
<実施例7>二酸化炭素を圧入した密閉容器内で、重炭酸ナトリウムを添加したアルカリ性の水溶液中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0060】
本実施例7では、密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)中に200mLの超純水(ミリポア社製の超純水製造装置で製造)をとり、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒0.5g、および重炭酸ナトリウム10gを懸濁させた後、密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを取り扱い説明書にしたがって同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温24℃下で2日間保った。
【0061】
2日後に密閉容器を開栓し、実施例1と同様に実験水溶液をサンプリングし、開封直後のpHとカルボン酸濃度をpHメーターと有機酸分析装置で調べたところ、pH7.0、乳酸濃度1.932mg/Lを検出した。
【0062】
<実施例8>二酸化炭素を圧入した密閉容器内で、アルカリ性のホウ酸緩衝水溶液中においてR型二酸化マンガン触媒が二酸化炭素をカルボン酸に変換した例
【0063】
密閉容器(日本炭酸瓦斯社製のステンレス製サイホン・エスプーマスパークリングM)中に100mLのアルカリ性ホウ酸緩衝水溶液(pH9.53)をとり、予め大気圧下130℃で2週間以上乾燥したR型二酸化マンガン触媒0.25gを懸濁させた後、密栓し、付属のソーダカートリッジに封入された二酸化炭素8gを同密閉容器内に圧入した。密閉容器内部の0.5〜0.7MPa圧力下にある実験水溶液をガラス製のマグネチック・スターラーで攪拌しながら室温22℃下で1日間保った。そして、1日後に密閉容器を開栓した。ホウ酸緩衝水溶液の調整にあたっては、和光純薬製特級試薬ホウ酸、および濃度1Mの水酸化ナトリウム水溶液を用いて、ホウ酸濃度0.1Mのホウ酸緩衝水溶液90mLに水酸化ナトリウム水溶液と超純水を滴下して、容量100mL、pH9.53のホウ酸緩衝水溶液とした。
【0064】
開栓後に他の実施例と同様に実験水溶液をサンプリングし、開封直後のpHおよび水温とカルボン酸濃度をpHメーターと有機酸分析装置で調べたところ、pH6.07、22.0℃、乳酸濃度7.676mg/Lを検出した。
【0065】
また、R型二酸化マンガン触媒の代わりに下記の市販の2種のガンマ型二酸化マンガンの各々について本実施例と同条件で実験したところ、それぞれ乳酸濃度約2mg/Lを検出した。この結果から、本実施形態に係るR型二酸化マンガン触媒の方が、二酸化炭素変換用触媒としての性能が優れていることが確認できた。
【0066】
使用した2種のガンマ型二酸化マンガンは、添川理化学株式会社製のガンマ型二酸化マンガン(02320B)、中央電気工業株式会社製の化成二酸化マンガン(CMD−100)である。これら市販のガンマ型二酸化マンガンのX線回折パターンを図3に示す。図3(a)が添川理化学株式会社製のガンマ型二酸化マンガン(02320B)のX線回折パターンであり、図3(b)が中央電気工業株式会社製の化成二酸化マンガン(CMD−100)のX線回折パターンである。
【0067】
さらにまた、R型二酸化マンガン触媒の代わりにベータ型二酸化マンガンについて本実施例と同条件で実験したところ、乳酸濃度約2mg/Lを検出した。この結果から、本実施形態に係るR型二酸化マンガン触媒の方が、二酸化炭素変換用触媒としての性能が優れていることが確認できた。
【0068】
上記のベータ型二酸化マンガンは、ベータ型の結晶構造を有する二酸化マンガンである。ここで使用したベータ型二酸化マンガンは、平均粒子径1〜50nmのサイズを有している。このようなベータ型二酸化マンガンは、上記した添川理化学株式会社製のガンマ型二酸化マンガン(02320B)をセラミックるつぼにとり、電気炉内で、大気中400℃で3日間加熱する操作によって合成することができる。このベータ型二酸化マンガンのX線回折パターンを図4に示す。
【0069】
以上に記載の全実施例において、アルカリ緩衝水溶液の使用やアルカリ試薬の添加によって実験溶液を弱酸性からアルカリ性(pH5〜9)に保った際に、カルボン酸が検出された。これに対して、0.1Mの希硫酸または希塩酸などを添加したpH1〜4の酸性水溶液中でも実験を実施したが、乳酸の発生も他のカルボン酸の発生も検出できなかった。したがって、二酸化炭素を溶解した水溶液のpHを二酸化炭素変換用触媒の活性が高まる弱酸性からアルカリ性に保つことが、実験水溶液を加熱するなど外部エネルギーを加える手法と共に、二酸化炭素からカルボン酸への変換を促す重要な要素であることがわかった。
【特許請求の範囲】
【請求項1】
二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に溶存する炭酸水素イオンを有機化合物に変換することを特徴とする二酸化炭素の変換方法。
【請求項2】
前記水溶液が、その液性が弱酸性からアルカリ性に保たれた水溶液、または、アルカリ性緩衝液であることを特徴とする請求項1に記載の二酸化炭素の変換方法。
【請求項3】
前記アルカリ性緩衝溶液が、アルカリ性の、Trishydroxymethyl amino methane、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid、ホウ酸緩衝溶液、および重炭酸塩緩衝液からなる群から選ばれる少なくとも1種であることを特徴とする請求項2に記載の二酸化炭素の変換方法。
【請求項4】
前記水溶液中に、さらに貴金属錯体を共存させることを特徴とする請求項1から3のいずれか一項に記載の二酸化炭素の変換方法。
【請求項5】
前記水溶液の温度が、100℃以下であることを特徴とする請求項1から4のいずれか一項に記載の二酸化炭素の変換方法。
【請求項6】
前記水溶液と、前記二酸化マンガンとを密閉容器内に封入し、この密閉容器内に前記二酸化炭素を圧入して前記水溶液中に前記二酸化炭素を溶解させることを特徴とする請求項1から5のいずれか一項に記載の二酸化炭素の変換方法。
【請求項7】
前記有機化合物が、カルボン酸であることを特徴とする請求項1から6のいずれか一項に記載の二酸化炭素の変換方法。
【請求項8】
前記カルボン酸が、蟻酸、酢酸、コハク酸および乳酸からなる群から選ばれる少なくとも1種であることを特徴とする請求項7に記載の二酸化炭素の変換方法。
【請求項9】
請求項1から8のいずれかの二酸化炭素の変換方法に用いられる触媒であって、ラムズデライト型の結晶構造を含む二酸化マンガンで構成されることを特徴とする二酸化炭素変換用触媒。
【請求項1】
二酸化炭素を溶解した弱酸性、中性またはアルカリ性の水溶液中に、ラムズデライト型の結晶構造を含む二酸化マンガンを共存させ、前記水溶液中に溶存する炭酸水素イオンを有機化合物に変換することを特徴とする二酸化炭素の変換方法。
【請求項2】
前記水溶液が、その液性が弱酸性からアルカリ性に保たれた水溶液、または、アルカリ性緩衝液であることを特徴とする請求項1に記載の二酸化炭素の変換方法。
【請求項3】
前記アルカリ性緩衝溶液が、アルカリ性の、Trishydroxymethyl amino methane、4-(2-hydroxyethl)-1-piperazinee thanesulfonic acid、ホウ酸緩衝溶液、および重炭酸塩緩衝液からなる群から選ばれる少なくとも1種であることを特徴とする請求項2に記載の二酸化炭素の変換方法。
【請求項4】
前記水溶液中に、さらに貴金属錯体を共存させることを特徴とする請求項1から3のいずれか一項に記載の二酸化炭素の変換方法。
【請求項5】
前記水溶液の温度が、100℃以下であることを特徴とする請求項1から4のいずれか一項に記載の二酸化炭素の変換方法。
【請求項6】
前記水溶液と、前記二酸化マンガンとを密閉容器内に封入し、この密閉容器内に前記二酸化炭素を圧入して前記水溶液中に前記二酸化炭素を溶解させることを特徴とする請求項1から5のいずれか一項に記載の二酸化炭素の変換方法。
【請求項7】
前記有機化合物が、カルボン酸であることを特徴とする請求項1から6のいずれか一項に記載の二酸化炭素の変換方法。
【請求項8】
前記カルボン酸が、蟻酸、酢酸、コハク酸および乳酸からなる群から選ばれる少なくとも1種であることを特徴とする請求項7に記載の二酸化炭素の変換方法。
【請求項9】
請求項1から8のいずれかの二酸化炭素の変換方法に用いられる触媒であって、ラムズデライト型の結晶構造を含む二酸化マンガンで構成されることを特徴とする二酸化炭素変換用触媒。
【図2】


【図3】


【図4】


【図1】




【図3】


【図4】


【図1】


【公開番号】特開2012−102093(P2012−102093A)
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願番号】特願2011−227481(P2011−227481)
【出願日】平成23年10月14日(2011.10.14)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
【公開日】平成24年5月31日(2012.5.31)
【国際特許分類】
【出願日】平成23年10月14日(2011.10.14)
【出願人】(504132272)国立大学法人京都大学 (1,269)
【Fターム(参考)】
[ Back to top ]

