二酸化炭素固定化方法
【課題】高炉スラグを用いて、二酸化炭素を固定化する方法が、従来から様々に提示されているが、高炉スラグの結晶相のひとつである硬石膏(CaSO4)が炭酸化過程を経た後にも依然として存在し、CaOの炭酸化効率が60%内外に低くなる弊害があった。硬石膏のCaOを完全に分解し、炭酸化反応後に硬石膏の再沈殿を抑制し、炭酸化効率を画期的に増加させる方法を提供する。
【解決手段】二酸化炭素固定化方法において、高炉スラグを粉砕した後、水100重量部に対して高炉スラグが5〜15重量部になるように水、高炉スラグ、およびNaOHを混合し、前記混合した混合物に二酸化炭素を供給して水熱反応を行う。
【解決手段】二酸化炭素固定化方法において、高炉スラグを粉砕した後、水100重量部に対して高炉スラグが5〜15重量部になるように水、高炉スラグ、およびNaOHを混合し、前記混合した混合物に二酸化炭素を供給して水熱反応を行う。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、産業副産物である高炉スラグを利用して二酸化炭素を固定化させ、生成された炭酸カルシウムの品位を向上させる方法に関する。
【背景技術】
【0002】
地球温暖化の対策方案として提示された国際的協約である“京都議定書”に基づき、これを承認した国家は、二酸化炭素を含む6種の温室ガスの排出量を1990年対比5.2%減縮しなければならないという時点が到来した。そこで、先進国を中心に温室ガス、特にCO2ガスを鉱物構造の構成成分として固定化させる様々な種類の鉱物炭酸化方法が工夫されている。この方法は1990年にSeifritzによって最初に提案され、初めは玄武岩、橄欖石、蛇紋石、および珪灰石などのような天然岩石およびケイ酸塩鉱物が対象であったが、その後、産業活動から由来した様々な種類の産業副産物または廃棄物にまでその研究幅を広めている。鉱物炭酸化法は、大きく、直接法(direct method:単一プロセスによる鉱物の炭酸化)と間接法(indirect method:CaまたはMgを鉱物から先に抽出した後に炭酸化)とに分けることができる。現在、様々な母材に対する直接法および間接法を用いた研究がオランダで活発に遂行されており、日本の場合には主に産業副産物である廃セメント/コンクリートなどに対する炭酸化反応研究が進行中にある。米国の場合、1998年に米国エネルギー省が主管して「the DOE Mineral Carbonation Study Group」が結成され、Alabany Research Center、Arizona State University、Los Alamos National Laboratory、National Energy Technology LatoratoryおよびSicence Applications International Corp.などの機関が共同研究を遂行し始めた。2005年には二酸化炭素の捕集および貯蔵と関わるIPCC特別報告書中の1分科として鉱物炭酸化が含まれた。特許文献1においては、マグネシウムシリケートヒドロキシド鉱物使用による金属酸化物を炭酸化させて固体物質に切り換える方法について開示されている。
【0003】
本発明で用いられた高炉スラグは製鋼産業で発生する物質であって、年間で約830万トンが発生しており、鉱物炭酸化の主要元素であるCaOを約44%含有している。仮に高炉スラグを母材とした鉱物炭酸化反応が成功的に遂行されるときには、年間で約290万トンのCO2低減効果があると考えられ、結果物である炭酸塩鉱物が約660万トン生産されることにより、CO2低減効果は勿論のこと、副産物である炭酸塩鉱物資源を確保できるという附加的な効果が期待される。
【0004】
このような鉄鋼産業の副産物である高炉スラグを利用して二酸化炭素を固定化させる方法は特許文献2に開示されているが、高炉スラグの結晶相の一つである硬石膏(CaSO4)が炭酸化過程を経た後にも依然として存在していた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】大韓民国公開特許第2011−0061558号公報
【特許文献2】大韓民国登録特許第10−0891551号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
既存の様々な方法による高炉スラグからの二酸化炭素固定化方法が提示されているが、高炉スラグの結晶相の一つである硬石膏(CaSO4)が炭酸化過程を経た後にも依然として存在していた。このような硬石膏の存在は、炭酸化反応の主要酸化物であるCaOを含むため、CaOの炭酸化効率が60%内外に低くなる原因となった。そこで、本発明は、硬石膏のCaOを完全に分解し、炭酸化反応後にも硬石膏の再沈殿を抑制する技術を発明することによって、炭酸化効率を画期的に増加させることをその目的とする。
【0007】
また、本発明は、世界的に注目を浴びている気候変化の主要原因であるCO2ガスを安定した状態の炭酸塩鉱物に変化させることにより、CO2低減効果と共に地質学的に親環境的な物質である炭酸塩鉱物を製造する方法を提供することをその目的とする。
【課題を解決するための手段】
【0008】
前記目的を達成するために、本発明は、効果的な二酸化炭素固定化法において、
a)高炉スラグを粉砕するステップ、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ、
c)前記b)ステップの混合物にNaOHを添加するステップ、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ
を含むことを特徴とする二酸化炭素固定化方法を提供する。
【0009】
本発明による二酸化炭素固定化方法において、前記a)ステップでは高炉スラグを150〜500メッシュになるように粉砕することを特徴とする。
本発明による二酸化炭素固定化方法において、前記c)ステップでは、NaOHは、前記d)ステップにおいて残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)が生成されるように、1モルSO3:2〜4モルNaOHの重量比で投入され、水熱反応後にも高炉スラグに含まれた硬石膏(CaSO4)の再沈殿が抑制されることを特徴とする。
【0010】
また、本発明は、
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップをさらに含むことを特徴とする二酸化炭素固定化方法を提供する。
このとき、残留塩類の除去は水洗いによって遂行される。
【0011】
本発明による二酸化炭素固定化方法において、前記d)ステップの二酸化炭素は、前記c)ステップの混合物が投入された反応器内部の二酸化炭素分圧が10〜30barになるように供給されることを特徴とする。
また、前記水熱反応は150〜300℃で行われることが望ましく、前記水熱反応時に1200〜1700rpmの回転速度で攪拌しながら行うことを特徴とする。
【0012】
また、前記水熱反応後、前記e)ステップの残留塩類の除去は水洗いによって遂行されるとき、濾過乾燥させるステップを含むことができ、このときの乾燥温度は80〜100℃であることが望ましい。
【発明の効果】
【0013】
本発明による二酸化炭素固定化方法は、二酸化炭素ガスを安全に固定化させ、高炉スラグに含まれたCaOの炭酸化効率を画期的に増大させる効果がある。また、高炉スラグを処理することにより、親環境的な効果があるだけでなく、高炉スラグを使って最終産物として炭酸塩鉱物を生産することができる。
【図面の簡単な説明】
【0014】
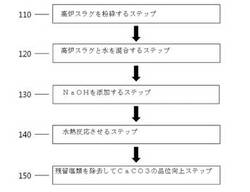
【図1】本発明による二酸化炭素を固定化する方法を図式化したものである。
【図2】比較例1および実施例1〜2のXRD分析を行った結果である。
【図3】比較例2および実施例3〜4のXRD分析を行った結果である。
【図4】比較例3および実施例5〜7のXRD分析を行った結果である。
【発明を実施するための形態】
【0015】
以下、図面を参照して本発明をより詳細に説明する。下記図1は、本発明による二酸化炭素を固定化する方法を図式化したものである。
本発明は、
a)高炉スラグを粉砕するステップ110、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ120、
c)前記b)ステップの混合物にNaOHを添加するステップ130、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ140
を含む二酸化炭素固定化方法を提供する。
【0016】
前記a)ステップにおいて、高炉スラグは150〜500メッシュになるように粉砕することが望ましい。前記粉砕範囲において、即ち150メッシュ以上において粉砕された高炉スラグの取り扱いが容易であり、且つ、500メッシュ以下において高炉スラグの表面積が増加して、二酸化炭素との接触面が増加し、水熱反応効果が増加する。
【0017】
前記b)ステップにおいて、水100重量部に対する高炉スラグの量は大きくは制限されないが、5〜15重量部であることが好適である。5重量部未満の場合には、炭酸化率には問題がないが、費用面での効率性の問題点があり、15重量部超過の場合には、高炉スラグの濃度が濃くなるため、高炉スラグの分散性および比表面積がかえって減少して炭酸化率が低くなるという問題点がある。
【0018】
硬石膏(CaSO4)は水溶液上でCa2+およびSO42-のイオン形態で存在する。
前記c)ステップは混合物にNaOHを添加するステップ130であり、NaOHは、前記d)ステップの水熱反応を通じた炭酸化反応時、硬石膏(CaSO4)のCa2+およびSO42-が水熱反応後にも再結合して再沈殿しないように抑制させる重要な機能を果たす。
【0019】
このとき、NaOHは、水熱反応後の硬石膏の再沈殿を無くすために、硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)、特に硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2モル以上NaOHの重量比で投入されることを特徴とする。
【0020】
より望ましくは、NaOHは1モルSO3:2〜4モルNaOHの重量比で投入されることを特徴とする。
これは、水熱反応ステップ後に硬石膏が再沈殿することなく、Ca2+が鉱物炭酸化に参加してCaCO3の構成成分となることにより、CaOの炭酸化効率を増大させられるように誘導したものである。
【0021】
より具体的には、本発明は、高炉スラグに含まれたSO3の含量を考慮し、これに対応するNaOHは水熱反応ステップで残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)、特に硫酸ナトリウム(Na2SO4)が生成されるように1モルSO3:2〜4モルNaOHの重量比で投入され、炭酸化反応時、高炉スラグに含まれている硬石膏をCa2+とSO42-に完全に解離して再沈殿を抑制した。これは、高炉スラグの結晶相の一つである硬石膏をCa2+とSO42-に完全に解離させ、硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)を生成させることにより、炭酸化反応後にも硬石膏の再沈殿を抑制する技術であり、炭酸化効率を画期的に増大させることができる。また、分解反応の中間相である硫酸ナトリウム(Na2SO4)およびバーカイト(Na6CO3(SO4)2)は、水に溶解する性質を有しているため、数回の洗浄で完全に除去されることによって、鉱物炭酸化反応の効率を増大させることに貢献する。
【0022】
本発明の実施例によれば、特に高炉スラグ20g当たり0.2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを確認した。
本発明の実施例によれば、NaOHの添加によって硬石膏から解離したSO42-イオンは、NaOHとの反応によって硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)を生成し、解離したCa2+イオンは、CO2との反応によってCaCO3を生成する。また、前記硫酸ナトリウム(Na2SO4)およびバーカイト(Na6CO3(SO4)2)は、いずれも水に溶解する性質を有しているため、数回の洗浄で完全に除去されることによって、鉱物炭酸化反応の効率を増大させることに貢献する。
【0023】
前記d)ステップの水熱反応時の二酸化炭素の供給は、c)ステップの混合物が投入された密閉反応器内部の二酸化炭素分圧が10〜30barになるように供給することが望ましい。10bar未満の場合には高炉スラグに含まれたCaOが炭酸化に参加できずに未反応状態で残る余地があり、30bar超過の場合には非経済的である。
【0024】
d)ステップの水熱反応は150〜300℃で行われることが望ましい。150℃未満の場合には炭酸化反応の効率が減少する問題点があり、300℃超過の場合には非経済的だけでなく他の相ができる余地がある。
また、前記d)ステップの水熱反応時の反応器は1200〜1700rpmの回転速度で攪拌しながらなされることが望ましい。このような高速の攪拌は炭酸化反応度を高める長所がある。
【0025】
また、本発明は、
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップ150をさらに含む二酸化炭素固定化方法を提供する。
前記e)ステップの残留塩類の除去は水洗いによってなされる。
このとき、濾過、洗浄、および乾燥ステップを含むことができ、乾燥ステップ時の乾燥温度は80〜100℃であることが望ましい。
このような残留塩類の除去によってCaCO3の品位を向上させることができる。
【0026】
以下、本発明のより具体的な説明のために実施例および比較例を挙げて説明するが、本発明が下記実施例に限定されるものではない。
表1は、高炉スラグに含まれた全体CaOの含量がCaCO3に変換されたとき、即ち理想的なCaCO3の含量を数式的に予測した資料である。このような理想的な含量は、各実験から得られた試料に対する炭素分析時、炭酸化効率および炭酸塩鉱物の含量を測定する基準となる。
【0027】
初期物質である高炉スラグの組成中のCaOの含量は約44wt%である。これらのCaOの全量は全てCO2と反応するという仮定を設定するとき、CaCO3においてCaOとCO2の質量比はCaO:CO2=56:44であるため、CaO含量(44wt%)対比CO2の含量は34.6wt%であり、CO2含量を高炉スラグの組成に加えて百分率にすれば、CaOが32.73wt%およびCO2が25.72wt%であり、炭酸化反応後の物質内のCaCO3の含量は58.45wt%(以下「理想的CaCO3の含量」と記載)となる(表1)。したがって、これに基づいて下記式(1)のようにCaCO3の含量を計算した後、下記式(2)のように「理想的CaCO3の含量」で分けて100をかければ、この値が高炉スラグ内のCaO含量中の炭酸化に参加した含量比、即ちCaOの炭酸化率が計算される。
【0028】
CaCO3(wt%)=C(wt%)×3.6641×2.2743 ・・・(1)
CaOの炭酸化率(%)=(CaCO3(wt%)/58.45(wt%))×100(%) ・・・(2)
【0029】
ここで、3.6641はC(炭素分析から得られたCの含量、wt%)からCO2への変換係数であり、2.2743はCO2からCaCO3への変換係数である。
【0030】
【表1】

【0031】
[実施例1〜2]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々1.013g(実施例1)および2.026g(実施例2)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、150℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0032】
[実施例3〜4]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々1.013g(実施例3)および2.026g(実施例4)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、200℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0033】
[実施例5〜7]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々0.64g(実施例5)、1.013g(実施例6)、および2.026g(実施例7)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、290℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0034】
[比較例1]
比較例1は、NaOHを添加せず、密閉反応容器のCO2分圧が5barになるようにCO2ガスを注入したことを除いては、実施例1と同一の工程で実施した。
[比較例2]
比較例2は、反応温度を200℃に増加したことを除いては、比較例1と同一の工程で実施した。
[比較例3]
比較例3は、反応温度を290℃に増加したことを除いては、比較例1と同一の工程で実施した。
【0035】
図2は、比較例1と実施例1〜2のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対する図2のXRD分析結果、比較例1の場合、非晶質相が相当の量を占めているが、CO2分圧の増加と添加されたNaOH量に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、前記XRD資料に基づいて回折パターンを示す構成鉱物(結晶質鉱物)に対し、SIROQUANTプログラムを利用して構成鉱物の含量を測定した結果を下記表1に提示する。
【0036】
実施例1〜実施例2で得られたCaCO3の含量は、各々、43.95wt%と52.26wt%、そしてCaOの炭酸化率は、各々、75.20%と89.42%であって、比較例1に対し、1.6倍および1.9倍に画期的に増加することを示している。このような結果値を下記表2に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0037】
【表2】

【0038】
図3は、比較例2と実施例3〜4のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対するXRD分析結果、比較例2の場合、比較例1と同様に非晶質相が相当の量を占めているが、CO2分圧の増加とNaOH量の添加に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、SIROQUANTプログラムを用いた結晶相の含量および炭酸化過程に参加したCaOの含量比、即ちCaOの炭酸化率を計算して下記表3に示す。
【0039】
実施例3〜実施例4で得られたCaCO3の含量は、各々、45.33wt%と53.02wt%、そしてCaOの炭酸化率は、各々、77.56%と90.72%であって、比較例2に対し1.5倍および1.8倍に画期的に増加することを示している。このような結果値を下記表3に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0040】
【表3】

【0041】
図4は、比較例3と実施例5〜7のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対するXRD分析結果、比較例3の場合、比較例1と同様に非晶質相が相当の量を占めているが、CO2分圧の増加とNaOH量の添加に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、SIROQUANTプログラムを用いた結晶相の含量および炭酸化に参加したCaOの含量比、即ち炭酸化率を計算して下記表4に示す。
【0042】
実施例5〜実施例7で得られたCaCO3の含量は、各々、45.76wt%、48.17wt%、および52.16wt%、そしてCaOの炭酸化率は、各々、78.29%、82.41%、および89.24%であって、比較例3に対し1.5倍、1.6倍、および1.7倍に画期的に増加することを示している。このような結果値を下記表4に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0043】
【表4】

【技術分野】
【0001】
本発明は、産業副産物である高炉スラグを利用して二酸化炭素を固定化させ、生成された炭酸カルシウムの品位を向上させる方法に関する。
【背景技術】
【0002】
地球温暖化の対策方案として提示された国際的協約である“京都議定書”に基づき、これを承認した国家は、二酸化炭素を含む6種の温室ガスの排出量を1990年対比5.2%減縮しなければならないという時点が到来した。そこで、先進国を中心に温室ガス、特にCO2ガスを鉱物構造の構成成分として固定化させる様々な種類の鉱物炭酸化方法が工夫されている。この方法は1990年にSeifritzによって最初に提案され、初めは玄武岩、橄欖石、蛇紋石、および珪灰石などのような天然岩石およびケイ酸塩鉱物が対象であったが、その後、産業活動から由来した様々な種類の産業副産物または廃棄物にまでその研究幅を広めている。鉱物炭酸化法は、大きく、直接法(direct method:単一プロセスによる鉱物の炭酸化)と間接法(indirect method:CaまたはMgを鉱物から先に抽出した後に炭酸化)とに分けることができる。現在、様々な母材に対する直接法および間接法を用いた研究がオランダで活発に遂行されており、日本の場合には主に産業副産物である廃セメント/コンクリートなどに対する炭酸化反応研究が進行中にある。米国の場合、1998年に米国エネルギー省が主管して「the DOE Mineral Carbonation Study Group」が結成され、Alabany Research Center、Arizona State University、Los Alamos National Laboratory、National Energy Technology LatoratoryおよびSicence Applications International Corp.などの機関が共同研究を遂行し始めた。2005年には二酸化炭素の捕集および貯蔵と関わるIPCC特別報告書中の1分科として鉱物炭酸化が含まれた。特許文献1においては、マグネシウムシリケートヒドロキシド鉱物使用による金属酸化物を炭酸化させて固体物質に切り換える方法について開示されている。
【0003】
本発明で用いられた高炉スラグは製鋼産業で発生する物質であって、年間で約830万トンが発生しており、鉱物炭酸化の主要元素であるCaOを約44%含有している。仮に高炉スラグを母材とした鉱物炭酸化反応が成功的に遂行されるときには、年間で約290万トンのCO2低減効果があると考えられ、結果物である炭酸塩鉱物が約660万トン生産されることにより、CO2低減効果は勿論のこと、副産物である炭酸塩鉱物資源を確保できるという附加的な効果が期待される。
【0004】
このような鉄鋼産業の副産物である高炉スラグを利用して二酸化炭素を固定化させる方法は特許文献2に開示されているが、高炉スラグの結晶相の一つである硬石膏(CaSO4)が炭酸化過程を経た後にも依然として存在していた。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】大韓民国公開特許第2011−0061558号公報
【特許文献2】大韓民国登録特許第10−0891551号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
既存の様々な方法による高炉スラグからの二酸化炭素固定化方法が提示されているが、高炉スラグの結晶相の一つである硬石膏(CaSO4)が炭酸化過程を経た後にも依然として存在していた。このような硬石膏の存在は、炭酸化反応の主要酸化物であるCaOを含むため、CaOの炭酸化効率が60%内外に低くなる原因となった。そこで、本発明は、硬石膏のCaOを完全に分解し、炭酸化反応後にも硬石膏の再沈殿を抑制する技術を発明することによって、炭酸化効率を画期的に増加させることをその目的とする。
【0007】
また、本発明は、世界的に注目を浴びている気候変化の主要原因であるCO2ガスを安定した状態の炭酸塩鉱物に変化させることにより、CO2低減効果と共に地質学的に親環境的な物質である炭酸塩鉱物を製造する方法を提供することをその目的とする。
【課題を解決するための手段】
【0008】
前記目的を達成するために、本発明は、効果的な二酸化炭素固定化法において、
a)高炉スラグを粉砕するステップ、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ、
c)前記b)ステップの混合物にNaOHを添加するステップ、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ
を含むことを特徴とする二酸化炭素固定化方法を提供する。
【0009】
本発明による二酸化炭素固定化方法において、前記a)ステップでは高炉スラグを150〜500メッシュになるように粉砕することを特徴とする。
本発明による二酸化炭素固定化方法において、前記c)ステップでは、NaOHは、前記d)ステップにおいて残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)が生成されるように、1モルSO3:2〜4モルNaOHの重量比で投入され、水熱反応後にも高炉スラグに含まれた硬石膏(CaSO4)の再沈殿が抑制されることを特徴とする。
【0010】
また、本発明は、
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップをさらに含むことを特徴とする二酸化炭素固定化方法を提供する。
このとき、残留塩類の除去は水洗いによって遂行される。
【0011】
本発明による二酸化炭素固定化方法において、前記d)ステップの二酸化炭素は、前記c)ステップの混合物が投入された反応器内部の二酸化炭素分圧が10〜30barになるように供給されることを特徴とする。
また、前記水熱反応は150〜300℃で行われることが望ましく、前記水熱反応時に1200〜1700rpmの回転速度で攪拌しながら行うことを特徴とする。
【0012】
また、前記水熱反応後、前記e)ステップの残留塩類の除去は水洗いによって遂行されるとき、濾過乾燥させるステップを含むことができ、このときの乾燥温度は80〜100℃であることが望ましい。
【発明の効果】
【0013】
本発明による二酸化炭素固定化方法は、二酸化炭素ガスを安全に固定化させ、高炉スラグに含まれたCaOの炭酸化効率を画期的に増大させる効果がある。また、高炉スラグを処理することにより、親環境的な効果があるだけでなく、高炉スラグを使って最終産物として炭酸塩鉱物を生産することができる。
【図面の簡単な説明】
【0014】
【図1】本発明による二酸化炭素を固定化する方法を図式化したものである。
【図2】比較例1および実施例1〜2のXRD分析を行った結果である。
【図3】比較例2および実施例3〜4のXRD分析を行った結果である。
【図4】比較例3および実施例5〜7のXRD分析を行った結果である。
【発明を実施するための形態】
【0015】
以下、図面を参照して本発明をより詳細に説明する。下記図1は、本発明による二酸化炭素を固定化する方法を図式化したものである。
本発明は、
a)高炉スラグを粉砕するステップ110、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ120、
c)前記b)ステップの混合物にNaOHを添加するステップ130、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ140
を含む二酸化炭素固定化方法を提供する。
【0016】
前記a)ステップにおいて、高炉スラグは150〜500メッシュになるように粉砕することが望ましい。前記粉砕範囲において、即ち150メッシュ以上において粉砕された高炉スラグの取り扱いが容易であり、且つ、500メッシュ以下において高炉スラグの表面積が増加して、二酸化炭素との接触面が増加し、水熱反応効果が増加する。
【0017】
前記b)ステップにおいて、水100重量部に対する高炉スラグの量は大きくは制限されないが、5〜15重量部であることが好適である。5重量部未満の場合には、炭酸化率には問題がないが、費用面での効率性の問題点があり、15重量部超過の場合には、高炉スラグの濃度が濃くなるため、高炉スラグの分散性および比表面積がかえって減少して炭酸化率が低くなるという問題点がある。
【0018】
硬石膏(CaSO4)は水溶液上でCa2+およびSO42-のイオン形態で存在する。
前記c)ステップは混合物にNaOHを添加するステップ130であり、NaOHは、前記d)ステップの水熱反応を通じた炭酸化反応時、硬石膏(CaSO4)のCa2+およびSO42-が水熱反応後にも再結合して再沈殿しないように抑制させる重要な機能を果たす。
【0019】
このとき、NaOHは、水熱反応後の硬石膏の再沈殿を無くすために、硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)、特に硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2モル以上NaOHの重量比で投入されることを特徴とする。
【0020】
より望ましくは、NaOHは1モルSO3:2〜4モルNaOHの重量比で投入されることを特徴とする。
これは、水熱反応ステップ後に硬石膏が再沈殿することなく、Ca2+が鉱物炭酸化に参加してCaCO3の構成成分となることにより、CaOの炭酸化効率を増大させられるように誘導したものである。
【0021】
より具体的には、本発明は、高炉スラグに含まれたSO3の含量を考慮し、これに対応するNaOHは水熱反応ステップで残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)、特に硫酸ナトリウム(Na2SO4)が生成されるように1モルSO3:2〜4モルNaOHの重量比で投入され、炭酸化反応時、高炉スラグに含まれている硬石膏をCa2+とSO42-に完全に解離して再沈殿を抑制した。これは、高炉スラグの結晶相の一つである硬石膏をCa2+とSO42-に完全に解離させ、硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)を生成させることにより、炭酸化反応後にも硬石膏の再沈殿を抑制する技術であり、炭酸化効率を画期的に増大させることができる。また、分解反応の中間相である硫酸ナトリウム(Na2SO4)およびバーカイト(Na6CO3(SO4)2)は、水に溶解する性質を有しているため、数回の洗浄で完全に除去されることによって、鉱物炭酸化反応の効率を増大させることに貢献する。
【0022】
本発明の実施例によれば、特に高炉スラグ20g当たり0.2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを確認した。
本発明の実施例によれば、NaOHの添加によって硬石膏から解離したSO42-イオンは、NaOHとの反応によって硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)を生成し、解離したCa2+イオンは、CO2との反応によってCaCO3を生成する。また、前記硫酸ナトリウム(Na2SO4)およびバーカイト(Na6CO3(SO4)2)は、いずれも水に溶解する性質を有しているため、数回の洗浄で完全に除去されることによって、鉱物炭酸化反応の効率を増大させることに貢献する。
【0023】
前記d)ステップの水熱反応時の二酸化炭素の供給は、c)ステップの混合物が投入された密閉反応器内部の二酸化炭素分圧が10〜30barになるように供給することが望ましい。10bar未満の場合には高炉スラグに含まれたCaOが炭酸化に参加できずに未反応状態で残る余地があり、30bar超過の場合には非経済的である。
【0024】
d)ステップの水熱反応は150〜300℃で行われることが望ましい。150℃未満の場合には炭酸化反応の効率が減少する問題点があり、300℃超過の場合には非経済的だけでなく他の相ができる余地がある。
また、前記d)ステップの水熱反応時の反応器は1200〜1700rpmの回転速度で攪拌しながらなされることが望ましい。このような高速の攪拌は炭酸化反応度を高める長所がある。
【0025】
また、本発明は、
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップ150をさらに含む二酸化炭素固定化方法を提供する。
前記e)ステップの残留塩類の除去は水洗いによってなされる。
このとき、濾過、洗浄、および乾燥ステップを含むことができ、乾燥ステップ時の乾燥温度は80〜100℃であることが望ましい。
このような残留塩類の除去によってCaCO3の品位を向上させることができる。
【0026】
以下、本発明のより具体的な説明のために実施例および比較例を挙げて説明するが、本発明が下記実施例に限定されるものではない。
表1は、高炉スラグに含まれた全体CaOの含量がCaCO3に変換されたとき、即ち理想的なCaCO3の含量を数式的に予測した資料である。このような理想的な含量は、各実験から得られた試料に対する炭素分析時、炭酸化効率および炭酸塩鉱物の含量を測定する基準となる。
【0027】
初期物質である高炉スラグの組成中のCaOの含量は約44wt%である。これらのCaOの全量は全てCO2と反応するという仮定を設定するとき、CaCO3においてCaOとCO2の質量比はCaO:CO2=56:44であるため、CaO含量(44wt%)対比CO2の含量は34.6wt%であり、CO2含量を高炉スラグの組成に加えて百分率にすれば、CaOが32.73wt%およびCO2が25.72wt%であり、炭酸化反応後の物質内のCaCO3の含量は58.45wt%(以下「理想的CaCO3の含量」と記載)となる(表1)。したがって、これに基づいて下記式(1)のようにCaCO3の含量を計算した後、下記式(2)のように「理想的CaCO3の含量」で分けて100をかければ、この値が高炉スラグ内のCaO含量中の炭酸化に参加した含量比、即ちCaOの炭酸化率が計算される。
【0028】
CaCO3(wt%)=C(wt%)×3.6641×2.2743 ・・・(1)
CaOの炭酸化率(%)=(CaCO3(wt%)/58.45(wt%))×100(%) ・・・(2)
【0029】
ここで、3.6641はC(炭素分析から得られたCの含量、wt%)からCO2への変換係数であり、2.2743はCO2からCaCO3への変換係数である。
【0030】
【表1】

【0031】
[実施例1〜2]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々1.013g(実施例1)および2.026g(実施例2)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、150℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0032】
[実施例3〜4]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々1.013g(実施例3)および2.026g(実施例4)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、200℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0033】
[実施例5〜7]
高炉スラグを粉砕して150〜200メッシュの大きさに選別した後、高炉スラグと水を混合する際に水200g当たり高炉スラグが20gになるように調節して混合した後に、NaOHを各々0.64g(実施例5)、1.013g(実施例6)、および2.026g(実施例7)を添加した。このような添加されたNaOHの含量は、高炉スラグ20g内に含まれたSO3の含量を考慮して硫酸ナトリウム(Na2SO4)が生成されるように、1モルSO3:2〜4モルNaOHの重量比から計算された量である。前記混合物を含む密閉反応容器のCO2分圧が10barになるようにCO2ガスを注入した後、1500rpmで攪拌しながら、290℃で6時間反応させた。前記水熱反応後に得られた生成物を濾過し、数回の洗浄過程を経て残存塩類を除去した後、90℃で乾燥して生成物を得た。
【0034】
[比較例1]
比較例1は、NaOHを添加せず、密閉反応容器のCO2分圧が5barになるようにCO2ガスを注入したことを除いては、実施例1と同一の工程で実施した。
[比較例2]
比較例2は、反応温度を200℃に増加したことを除いては、比較例1と同一の工程で実施した。
[比較例3]
比較例3は、反応温度を290℃に増加したことを除いては、比較例1と同一の工程で実施した。
【0035】
図2は、比較例1と実施例1〜2のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対する図2のXRD分析結果、比較例1の場合、非晶質相が相当の量を占めているが、CO2分圧の増加と添加されたNaOH量に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、前記XRD資料に基づいて回折パターンを示す構成鉱物(結晶質鉱物)に対し、SIROQUANTプログラムを利用して構成鉱物の含量を測定した結果を下記表1に提示する。
【0036】
実施例1〜実施例2で得られたCaCO3の含量は、各々、43.95wt%と52.26wt%、そしてCaOの炭酸化率は、各々、75.20%と89.42%であって、比較例1に対し、1.6倍および1.9倍に画期的に増加することを示している。このような結果値を下記表2に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0037】
【表2】

【0038】
図3は、比較例2と実施例3〜4のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対するXRD分析結果、比較例2の場合、比較例1と同様に非晶質相が相当の量を占めているが、CO2分圧の増加とNaOH量の添加に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、SIROQUANTプログラムを用いた結晶相の含量および炭酸化過程に参加したCaOの含量比、即ちCaOの炭酸化率を計算して下記表3に示す。
【0039】
実施例3〜実施例4で得られたCaCO3の含量は、各々、45.33wt%と53.02wt%、そしてCaOの炭酸化率は、各々、77.56%と90.72%であって、比較例2に対し1.5倍および1.8倍に画期的に増加することを示している。このような結果値を下記表3に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0040】
【表3】

【0041】
図4は、比較例3と実施例5〜7のXRD回折パターンを示す結果である。
前記水熱反応後に得られた生成物に対するXRD分析結果、比較例3の場合、比較例1と同様に非晶質相が相当の量を占めているが、CO2分圧の増加とNaOH量の添加に比例してCaSO4の含量が減少する代わりにCaCO3の含量が増加することを示している。また、SIROQUANTプログラムを用いた結晶相の含量および炭酸化に参加したCaOの含量比、即ち炭酸化率を計算して下記表4に示す。
【0042】
実施例5〜実施例7で得られたCaCO3の含量は、各々、45.76wt%、48.17wt%、および52.16wt%、そしてCaOの炭酸化率は、各々、78.29%、82.41%、および89.24%であって、比較例3に対し1.5倍、1.6倍、および1.7倍に画期的に増加することを示している。このような結果値を下記表4に示す。結果的に、鉱物炭酸化工程時のNaOHの添加量の増加、特に高炉スラグ20g当たり2g以上のNaOHを添加するときに、CaOの炭酸化率が非常に効果的であることを示している。
【0043】
【表4】

【特許請求の範囲】
【請求項1】
a)高炉スラグを粉砕するステップ(110)、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ(120)、
c)前記b)ステップの混合物にNaOHを添加するステップ(130)、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ(140)
を含むことを特徴とする二酸化炭素固定化方法。
【請求項2】
前記a)ステップでは高炉スラグを150〜500メッシュになるように粉砕することを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項3】
前記c)ステップにおいて、NaOHは、前記d)ステップにおいて残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)が生成されるように、1モルSO3:2〜4モルNaOHの重量比で投入され、水熱反応後にも高炉スラグに含まれた硬石膏(CaSO4)の再沈殿が抑制されることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項4】
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップ(150)をさらに含むことを特徴とする、請求項3に記載の二酸化炭素固定化方法。
【請求項5】
前記d)ステップの二酸化炭素は、前記c)ステップの混合物が投入された反応器内部の二酸化炭素分圧が10〜30barになるように供給されることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項6】
前記d)ステップの水熱反応は150〜300℃で行われるものであることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項7】
前記d)ステップの水熱反応は、1200〜1700rpmの回転速度で攪拌しながら行われるものであることを特徴とする、請求項6に記載の二酸化炭素固定化方法。
【請求項8】
前記e)ステップにおいて、残留塩類の除去は水洗いによるものであることを特徴とする、請求項4に記載の二酸化炭素固定化方法。
【請求項1】
a)高炉スラグを粉砕するステップ(110)、
b)水100重量部に対して高炉スラグが5〜15重量部になるように水および高炉スラグを混合するステップ(120)、
c)前記b)ステップの混合物にNaOHを添加するステップ(130)、および
d)前記c)ステップの分解された混合物に二酸化炭素を供給して水熱反応させるステップ(140)
を含むことを特徴とする二酸化炭素固定化方法。
【請求項2】
前記a)ステップでは高炉スラグを150〜500メッシュになるように粉砕することを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項3】
前記c)ステップにおいて、NaOHは、前記d)ステップにおいて残留塩類である硫酸ナトリウム(Na2SO4)またはバーカイト(Na6CO3(SO4)2)が生成されるように、1モルSO3:2〜4モルNaOHの重量比で投入され、水熱反応後にも高炉スラグに含まれた硬石膏(CaSO4)の再沈殿が抑制されることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項4】
e)前記d)ステップ後、残留塩類を除去してCaCO3の品位を向上するステップ(150)をさらに含むことを特徴とする、請求項3に記載の二酸化炭素固定化方法。
【請求項5】
前記d)ステップの二酸化炭素は、前記c)ステップの混合物が投入された反応器内部の二酸化炭素分圧が10〜30barになるように供給されることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項6】
前記d)ステップの水熱反応は150〜300℃で行われるものであることを特徴とする、請求項1に記載の二酸化炭素固定化方法。
【請求項7】
前記d)ステップの水熱反応は、1200〜1700rpmの回転速度で攪拌しながら行われるものであることを特徴とする、請求項6に記載の二酸化炭素固定化方法。
【請求項8】
前記e)ステップにおいて、残留塩類の除去は水洗いによるものであることを特徴とする、請求項4に記載の二酸化炭素固定化方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−95662(P2013−95662A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2012−236644(P2012−236644)
【出願日】平成24年10月26日(2012.10.26)
【出願人】(510230311)コリア・インスティテュート・オヴ・ジオサイエンス・アンド・ミネラル・リソーシズ (4)
【氏名又は名称原語表記】Korea Institute of Geoscience & Mineral Resources
【住所又は居所原語表記】92, Gwahang−no, Yuseong−gu, Daejeon, 305−350, Republic of Korea
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成24年10月26日(2012.10.26)
【出願人】(510230311)コリア・インスティテュート・オヴ・ジオサイエンス・アンド・ミネラル・リソーシズ (4)
【氏名又は名称原語表記】Korea Institute of Geoscience & Mineral Resources
【住所又は居所原語表記】92, Gwahang−no, Yuseong−gu, Daejeon, 305−350, Republic of Korea
【Fターム(参考)】
[ Back to top ]

