二酸化炭素/エポキシド共重合触媒システム
本発明は、配位子が含むアンモニウムカチオンの総数が三つ以上であり、中心金属が−1価の形式電荷を有しており、二つのアンモニウムカチオンの対アニオンが酸−塩基ホモ共役(homoconjugation)であるコバルト3価またはクロム3価の錯化合物及びこれを触媒として使用してエポキシド化合物と二酸化炭素を共重合し、ポリカーボネートを製造する方法に関する。
本発明によると、前記ポリカーボネートを製造する際に、初期誘導時間を減少させるとともに活性を向上させることができ、また、製造された高分子の分子量を向上させることができる。
本発明によると、前記ポリカーボネートを製造する際に、初期誘導時間を減少させるとともに活性を向上させることができ、また、製造された高分子の分子量を向上させることができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アンモニウム塩を含む配位子から合成されたコバルトまたはクロム錯化合物を触媒として使用し、エポキシド化合物と二酸化炭素を共重合してポリカーボネートを製造する方法に関する。
【背景技術】
【0002】
脂肪族ポリカーボネートは、生分解が容易な高分子であって、例えば、包装材またはコーティング材として有用な材料である。ポリカーボネートをエポキシド化合物と二酸化炭素から製造する方法は、有毒化合物であるホスゲンを使用しないという点と、二酸化炭素を安価で得られるという点において環境にやさしいという価値がある。
【0003】
1960年代から多くの発明者らがエポキシド化合物と二酸化炭素からポリカーボネートを製造するために様々な形態の触媒を開発してきた。最近、本発明者は、第四級アンモニウム塩を含むサレン[Salen:([H2Salen=N、N´−bis(3,5−dialkylsalicylidene)−1,2−ethylenediamine]−型の配位子から合成された高活性、高選択性の触媒を開示した[Bun Yeoul Lee、韓国特許登録10−0853358(登録日:2008.08.13);Bun Yeoul Lee、Sujith S、Eun Kyoung Noh、Jae Ki Min、韓国特許出願10−2008−0015454(出願日:2008.02.20);Bun Yeoul Lee、Sujith S、Eun Kyoung Noh、Jae Ki Min、PCT/KR2008/002453(出願日:2008.04.30);Eun Kyung Noh、Sung Jae Na、Sujith S、Sang−Wook Kim、and Bun Yeoul Lee*J.Am.Chem.Soc.2007,129,8082−8083(2007.07.04);Sujith S、Jae Ki min、Jong Eon Seong、Sung Jea Na、and Bun Yeoul Lee、Angew.Chem.Int.Ed.,2008,47,7306−7309.(2008.09.08)]。本発明者が開示した触媒は、高活性、高選択性を有しており、分子量が多い共重合体を製造することができ、高温でも重合が可能であるため、商業工程に適用することができる。また、第四級アンモニウム塩を配位子に含んでおり、二酸化炭素/エポキシド共重合反応後、共重合体から触媒を容易に分離して再使用することができるという長所がある。
【0004】
また、本発明者は、前記特許の触媒群の他のものと対比して、特に高活性と高選択性を有する触媒の構造を綿密に分析し、その構造が、サレン(salen)−配位子の窒素原子は配位せず、酸素原子のみが金属に配位した、公知されていない独特の構造を有していることを開示し(例1)、これから新規の触媒システムを特許出願した(韓国特許出願10−2008−0074435(出願日:2008.07.30))。
【0005】
[例1]

【0006】
また、前記例1の化合物のNMR研究によりジニトロフェノラート(DNP)の状態を明らかにすることができた。即ち、化合物が含んでいる四つのDNPのうち二つは常にコバルトに配位した状態にあり、残る二つは配位状態と脱配位状態を往復している状態であるが、配位状態に滞留している程度が温度、溶媒、及び配位子の置換体(R、R1、R2)の変化に応じて異なる。下記図は、重合反応媒質と非常に類似したTHFを溶媒とし、常温での触媒構造におけるDNPの状態を示す図である。化合物1´では、配位と脱配位状態をNMRタイムスケールで盛んに往復しており、NMRでシグナルが観察されていない。また、化合物2´及び3´のどちらもDNPがコバルトにある程度配位と脱配位を往復しており、主に脱配位状態に滞留しているが、2´が脱配位状態により長く滞留していることが見られた。即ち、脱配位の状態に主に滞留する二つのDNPの配位状態に滞留する程度(コバルトに対する結合親和性(binding affinity))は、1´>3´>2´の順である。一方、二酸化炭素/プロピレンオキシド共重合実験で観察された活性の順序(TOF)は、その逆順である2´>3´>1´であった。これは、コバルトに配位−脱配位を往復して弱く結合(binding)する二つのDNPのコバルトに対する結合親和性(binding affinity)が高いと、活性が低下するということを暗示する。

【0007】
前記構造の化合物が高活性を有する理由は、前記二つのアニオン性のDNP配位子が配位状態と脱配位状態を絶えず往復する性質のためであると説明した。以下の図は、二酸化炭素/エポキシド共重合の高分子鎖の成長メカニズムを示す。このメカニズムにおいて、鎖の末端に形成されたカーボネートアニオンが、配位したエポキシドを攻撃する段階が重要である。配位状態と脱配位状態を絶えず往復する性質によって、カーボネートアニオンが、配位したエポキシドを背面から攻撃することが可能になる。通常、求核攻撃は脱離基の背面から攻撃して行われる。下記メカニズムは、配位したカーボネートアニオンが脱配位状態に容易に転移できる場合、高活性を期待することができるが、観察された活性の順序と一致する。

【0008】
前記化合物を用いた二酸化炭素/エポキシド共重合触媒反応において重合反応溶液の[水]/[触媒]の割合が触媒活性の具現に重要な役目をする。エポキシド及び二酸化炭素を徹底的に精製して水を除去した場合でも、[エポキシド]/[触媒]の割合が100000のように相当少量の触媒を入れた重合条件下では、残存する水分子による[水]/[触媒]の割合が無視できない可能性がある。[エポキシド]/[触媒]の割合が100000のように高い条件下でも重合を具現することができると、高活性(TON)を得ることができる。そのため、商業的に価値のある触媒とするためには、触媒の水に対する敏感度が少なくなければならない。前記構造を有する触媒の場合、重合溶液内の水分量に応じて誘導時間が相当変わることが観察された。たとえば、乾燥した冬に重合反応を行うと、重合反応は約1〜2時間後に開始されるが、湿度及び温度の高い夏に重合を行うと、ひどいときは12時間後に重合が開始されることが観察された。一旦重合反応が開始されると、その後の活性(TOF)はあまり変化しなかった。1H NMR分光学実験で、化合物が含んでいるDNPがプロピレンオキシドを攻撃する反応が観察されるが、その反応速度は、水がある程度存在すると急激に低下する。配位状態と脱配位状態を絶えず往復している二つのアニオンが水と水素結合して求核攻撃能力が低下するため反応速度が遅くなると類推される。
【0009】
下記表1は、プロピレンオキシド(PO)とシクロヘキセンオキシド(CyO)を混合し、前記例1の2´化合物を用いた二酸化炭素との共重合反応結果を示す。表に示されたように、誘導時間が短い場合は45分、長い場合は9時間10分も観察された。また、誘導時間が長い場合、分子量が減少する傾向が観察された。このような不規則、かつ場合に応じて長い誘導時間は、この触媒を用いて商業工程を開発することに大きな障害となる。また、分子量が多い高分子を一貫性を持って製造できることも商業化の必須要素である。
【0010】
表1.2´触媒を用いたPO−CyO−CO2共重合の結果
【表1】

【先行技術文献】
【特許文献】
【0011】
【特許文献1】韓国特許登録10−0853358
【特許文献2】韓国特許出願10−2008−0015454
【特許文献3】PCT/KR2008/002453
【特許文献4】韓国特許出願10−2008−0074435
【非特許文献】
【0012】
【非特許文献1】J.Am.Chem.Soc.2007,129,8082−8083
【非特許文献2】Angew.Chem.Int.Ed.,2008,47,7306−7309
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、二酸化炭素とエポキシドを共重合してポリカーボネート製造する際における、前記触媒システムが提示する誘導時間が長かったり一貫していない問題、分子量が少ない高分子が得られる問題、及び活性が低い問題を解決することを目的とする。
【課題を解決するための手段】
【0014】
本発明の課題を果たすために、配位子が含むアンモニウムカチオンの総数が三つ以上であり、中心金属が−1価の形式電荷を有しており、二つのアンモニウムカチオンの対アニオンが酸−塩基ホモ共役(homoconjugation)であるコバルト3価またはクロム3価の錯化合物(下記化学式1)を触媒として使用し、エポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0015】
[化学式1]

【0016】
前記化学式1中、Mは、コバルト3価またはクロム3価であり、L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても相違してよく、また、互いに連結されて二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり、aまたはbは整数であり、aまたはbは特に限定されず、好ましくは0〜15の整数であり、1+a+bを満たすものを含む。
【0017】
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、Zは、BF4−、ClO4−、NO3−またはPF6−である。
【0018】
X型配位子は、Gary O.SpessardとGary L.Miesslerが執筆したOrganometallic Chemistry(出版社:Prentice Hall)のp46に詳細に記述されている。X型配位子は、水素、塩素またはメチルのようなアニオン性配位子を意味し、X−アニオンが金属原素M+カチオンに結合されたものであって、X型配位子の結合は金属の酸化状態に影響を与える。
【0019】
本発明の具体的な様態として、下記化学式2の触媒を使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0020】
[化学式2]

【0021】
前記化学式2中、L5、L6、X3またはX4は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン;炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、cは、1または0であり、Zは、BF4−、ClO4−、NO3−またはPF6−であり、R12とR14は、メチル、エチル、イソプロピルまたは水素から選択され、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、Qは、二つの窒素原子を連結するために結合するジラジカルであり、前記Qは、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは融合された(C3〜C20)シクロアルキレンであるか、または前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは融合されたシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上含むことを特徴とする。
【0022】
より具体的に、前記化学式2中、Qは、trans−1,2−シクロヘキシレンまたはエチレンであり、Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり、Zは、BF4−である。
【0023】
本発明は、より具体的に、下記化学式3の触媒を使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0024】
[化学式3]

【0025】
前記化学式3中、L7、L8、X5またはX6は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、Zは、BF4−、ClO4−、NO3−またはPF6−であり、R12とR14は、メチル、エチル、イソプロピル、または水素から選択されるものであり、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、Qは、二つの窒素原子を連結するジラジカルであり、前記Qは、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは融合された(C3〜C20)シクロアルキレンであるか、または前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは融合されたシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上を含むことを特徴とする。
【0026】
より具体的には、前記化学式3中、Qは、trans−1,2−シクロヘキシレンまたはエチレンであり、Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり、Zは、BF4−である。
【0027】
本発明による錯化合物は、アンモニウム塩を含んでいる配位子をまず合成して酢酸金属(金属はコバルトまたはクロムである。)をアンモニウム塩を含む配位子と反応させ、アセテート配位子を脱配位させて酢酸を除去しコバルト2価化合物を得て、これを適当な酸(HX)存在の下で酸素を酸化剤として使用して酸化させ、コバルト3価化合物を得る段階を含み、60〜100mol%のNaXを用いたアニオン交換反応を含む触媒の製造方法により製造される。アンモニウム塩を含んでいる配位子は、本発明者によって開発されて公開された公知の方法(Bull.Korean Chem.Soc.2009,30,745)に従って製造されたものである。
【0028】
前記酸(HX)のXは、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;炭素数1〜20のカルバメートアニオンである。
【0029】
本発明は、前記化学式1〜化学式3から選択されるコバルト錯化合物を触媒として使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0030】
前記エポキシド化合物は、ハロゲンまたはアルコキシで置換または非置換の(C2〜C20)アルキレンオキシド;ハロゲンまたはアルコキシで置換または非置換の(C4〜C20)シクロアルキレンオキシド;ハロゲン、アルコキシ、アルキルまたはアリールで置換または非置換の(C8〜C20)スチレンオキシドからなる群から選択されてもよい。前記アルコキシは、具体的にアルキルオキシ、アリールオキシ、アラルキル(aralkyl)オキシなどがあり、前記アリールオキシは、フェノキシ、ビフェニルオキシ、ナフチルオキシなどが挙げられる。前記アルコキシ、アルキル及びアリールはハロゲン元素またはアルコキシ基から選択される置換基を有してもよい。
【0031】
前記エポキシド化合物の具体例は、エチレンオキシド、プロピレンオキシド、ブテンオキシド、ペンテンオキシド、ヘキセンオキシド、オクテンオキシド、デセンオキシド、ドデセンオキシド、テトラデセンオキシド、ヘキサデセンオキシド、オクタデセンオキシド、ブタジエンモノオキシド、1,2−エポキシド−7−オクテン、エピフルオロヒドリン、エピクロロヒドリン、エピブロモヒドリン、イソプロピルグリシジルエーテル、ブチルグリシジルエーテル、t−ブチルグリシジルエーテル、2−エチルヘキシルグリシジルエーテル、アリールグリシジルエーテル、シクロペンテンオキシド、シクロヘキセンオキシド、シクロオクテンオキシド、シクロドデセンオキシド、アルファ−ピネンオキシド、2,3−エポキシドノルボルネン、リモネンオキシド、ディルドリン、2,3−エポキシドプロピルベンゼン、スチレンオキシド、フェニルプロピレンオキシド、スチルベンオキシド、クロロスチルベンオキシド、ジクロロスチルベンオキシド、1,2−エポキシ−3−フェノキシプロパン、ベンジルオキシメチルオキシラン、グリシジル−メチルフェニルエーテル、クロロフェニル−2,3−エポキシドプロピルエーテル、エポキシプロピルメトキシフェニルエーテルビフェニルグリシジルエーテル、グリシジルナフチルエーテルなどが挙げられる。
【0032】
エポキシド化合物は、有機溶媒を反応媒質として重合に用いられることができ、前記溶媒としては、ペンタン、オクタン、デカン及びシクロヘキサンなどの脂肪族炭化水素、ベンゼン、トルエン、及びキシレンなどのような芳香族炭化水素、クロロメタン、メチレンクロライド、クロロホルム、カーボンテトラクロライド、1,1−ジクロロエタン、1,2−ジクロロエタン、エチルクロライド、トリクロロエタン、1−クロロプロパン、2−クロロプロパン、1−クロロブタン、2−クロロブタン、1−クロロ−2−メチルプロパン、クロロベンゼン及びブロモベンゼンなどのようなハロゲン化炭化水素のうち一つまたは2つ以上を組み合わせて使用することができる。より好ましくは、単量体自体を溶媒として使用するバルク重合を行うことができる。
【0033】
エポキシド化合物に対する触媒のモル比、即ちエポキシド化合物に対する触媒モル比は、1,000〜1,000,000で使用することができ、好ましくは、50,000〜200,000で使用することができる。
【0034】
前記共重合段階で二酸化炭素の圧力は、常圧〜100気圧まで可能であり、好ましくは、5気圧〜30気圧が好適である。
【0035】
前記共重合段階における重合温度は20℃〜120℃まで可能であり、好ましくは、50℃〜90℃が好適である。
【0036】
ポリカーボネートを重合する方法としては、バッチ重合法、半バッチ重合法、または連続重合法がある。バッチまたは半バッチ重合法を使用する場合、反応時間は1〜24時間、好ましくは1.5〜4時間が可能である。連続重合法を使用する場合の触媒の平均滞留時間も同じく1.5〜4時間にすることが好ましい。
【0037】
本発明によると、数平均分子量(Mn)が5,000〜1,000,000の分子量を有し、分子量分布(Mw/Mn)が1.05〜4.0の値を有するポリカーボネートを製造することができる。ここで、Mnは単一分子量分布のポリスチレンを標準物質に補正してGPCで測定した数平均分子量を意味し、分子量分布Mw/Mn値は同一の方法により、GPCによって特定した重量平均分子量と数平均分子量との割合である。
【0038】
製造されたポリカーボネート重合体は、80%以上のカーボネート結合で構成されており、時々95%以上のカーボネート結合で構成される。本発明によって製造されるポリカーボネートは、分解が容易で燃焼時の残渣とススがない高分子であって、例えば、包装材、断熱材、またはコーティング材として有用な材料である。
【発明の効果】
【0039】
前記背景技術で記述したように、従来触媒が高活性を有する理由は、二つのアニオン性の配位子が配位状態と脱配位状態を絶えず往復する性質のためである。そしてこのアニオン性の配位子が金属中心からより容易に分離されることができれば、すなわち、金属中心との相互作用が弱いほど、活性が増加した。本発明は、配位状態と脱配位状態を往復するアニオン性の配位子を酸−塩基ホモ共役(homoconjugation)、例えば[DNP...H...DNP]−に代替することにより、アニオンの金属中心との相互作用を弱化して活性を増大させた(表2及び表3参照)。触媒の活性が増加すると、一般的に分子量は増大する(表2及び表3参照)。また、二つのアニオンを酸−塩基ホモ共役(homoconjugation)に代替することにより、水に対する敏感度を低下することができる(表2及び表3参照)。前記のように従来触媒の場合、重合溶液内の水分量に応じて誘導時間の変化がはげしく、これは配位状態と脱配位状態を絶えず往復しているアニオンが水と水素結合してプロピレンオキシドに対する求核攻撃能力が低下するためであると説明した。酸−塩基ホモ共役の場合、既に水素結合をしており、水との水素結合親和力が低下して水に対する敏感度が緩和され、誘導時間の変化が相対的に小さい。
【0040】
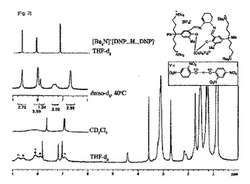
DNPに水が水素結合をすると求核攻撃能力が低下してPOとの反応速度が低下することが観察されるが、ホモ共役の場合、自体内の水素結合をしているものの、POに対する求核反応速度はむしろ向上することが観察される。図1は、下記化学式2の化合物6のプロピレンオキシドとの反応を示す1H NMRスペクトルである。ホモ共役がプロピレンオキシドと反応してマイゼンハイマー(Meisenheimer)塩のアニオン(*でマークしたシグナル)とアルコール化合物2,4−(NO2)2C6H3−OCH2CH(Me)OHと2,4−(NO2)2C6H3−OCH(Me)CH2OH(xでマークしたシグナル)が生成し、配位しているDNP(^でマークしたシグナル)はそのまま存在することが分かる(反応式1)。初期30分間反応したプロピレンオキシド数を数えて化合物3と6のプロピレンオキシドとの反応性を比較すると、化合物6が約2倍さらに速いことが分かり、化合物6の活性が化合物3の活性より大きいという結果と一致する。また、化合物3の場合、50当量の水を入れると、プロピレンオキシドとの反応性が著しく低下されることが観察されたが、図1に示されたように、化合物6は50当量の水の存在下でプロピレンオキシドとの反応速度が低下しない。この結果は、重合反応で化合物6の水に対する敏感度が化合物3より低い理由を説明する。
【0041】
[化学式4]

【0042】
[化学式5]

【0043】
[反応式1]

【0044】
酸−塩基ホモ共役における水素結合強度は通常の水素結合強度に比べてはるかに強い。Shan,S.−o.とLoh,S.とHerschlag,D.がScience1996,272,97に報告した論文を参照すると、水素結合して二つの酸塩基がホモ共役のようにPKa値が0である場合特に水素結合強度が増大し、この現象により酵素の反応性が極大化されるということが開示されている。また、Barnes,J.C.とWeakley,T.J.R.がActa Cryst.2003、E59、m160に報告した(18−Crown−6−k6O)potassium2,4−dinitrophenolate2,4−dinitrophenolホモ共役のx−ray単結晶構造で、水素結合によって連結された酸素−酸素結合の長さが2.453(4)Åであることが開示されている。この結合長さは、水素結合が相当強いものを支持する(Paola Gilli,P.;Bertolasi,V.;Ferretti,V.;and Gilli、V.J.Am.Chem.Sec.1994,116,909.)。また、Magonski,J.とPawlak,Z.及びJasinski,T.がJ.Chem.Soc.Faraday Trans.1993,89,119に報告した論文を参照すると、ホモ共役形成に対する平衡定数が約100であり、二つの成分が有機溶媒でほぼ化学式4で提示したように、ホモ共役として存在することを支持する。実際、thf−d8溶媒で測定した化合物6の1H NMRスペクトルを参照すると、*でマークした配位したDNPシグナルと、^でマークしたホモ共役[DNP...H...DNP]−シグナルとを区別して確認することができる。
【図面の簡単な説明】
【0045】
【図1】化合物4とプロピレンオキシドとの反応を示すdmso−d6での1H NMRスペクトルである(*でマークしたシグナルはDNPアニオンが反応して生成されたマイゼンハイマー(Meisenheimer)塩のアニオンであり、xでマークしたシグナルはマイゼンハイマー(Meisenheimer)塩のアニオンに陽性子が反応して生成されたアルコール2,4−(NO2)2C6H3−OCH2CH(Me)OHと2,4−(NO2)2C6H3−OCH(Me)CH2OHであり、^でマークしたシグナルはDNPである)。
【図2】thf−d8溶媒から測定した化合物4の1H NMRスペクトルである(*でマークしたシグナルは配位したDNPシグナルであり、^でマークしたシグナルはホモ共役シグナルである)。
【発明を実施するための形態】
【0046】
下記実施例及び比較例は、本発明の効果を具体的に説明する。但し、下記実施例は、本発明を例示するためのものに過ぎず、本発明の範囲を限定するものではない。
【0047】
[製造例1]60mol%ソジウムジニトロフェノラート(NaDNP)の合成
市販のジニトロフェノール(10.0g、54.3mmol)をメチレンクロライド250mLに溶解した後、無水硫酸マグネシウムにより水を除去して濾過し、減圧下で溶媒を除去した。グローブボックスの中で前記水を除去したジニトロフェノール(10.0g、54.3mmol)を無水THF(300mL)に溶解した後、NaH(0.782g、32.6mmol)を少しずつ加えた。NaHを全部加えた後、3時間攪拌して減圧下で溶媒を除去し、60mol%ソジウムジニトロフェノラートを得た。
【0048】
[製造例2]100mol%ソジウムジニトロフェノラートの合成法
市販のジニトロフェノール(10.0g、54.3mmol)をメチレンクロライド250mLに溶解した後、無水硫酸マグネシウムを添加して水を除去して濾過し、減圧下で溶媒を除去した。グローブボックスの中で水を除去したジニトロフェノール(10.0g、54.3mmol)を無水THF300(mL)に溶解した後、NaH(1.30g、54.3mmol)を少しずつゆっくり加えた。3時間攪拌して減圧下で溶媒を除去し、100mol%ソジウムジニトロフェノラートを得た。
【実施例】
【0049】
[化学式4]

【0050】
[実施例1]化合物4の合成
配位子の合成は、既に公知された文献に従って合成した(Bull.Korean Chem.Soc.2009,30,745)。グローブボックスの中で50mL丸底フラスコに配位子(0.376g、0.230mmol)及びCo(OAc)2(0.041g、0.230mmol)を定量して入れた後、エチルアルコール(17mL)を加えて3時間攪拌した。ジエチルエーテル20mLを添加して沈殿させ、ガラスフィルターを用いて濾過した後、ジエチルエーテル10mLでさらに3回洗浄した。得られたオレンジ色の固体を減圧下で溶媒を完全に除去した。このように製造したCo(II)化合物(0.200g、0.117mmol)に2,4−ジニトロフェノール(0.022g、0.117mmol)を加えてメチレンクロライド(5mL)を添加して溶解した。その後、酸素雰囲気下で3時間攪拌して酸化させ、前記方法により製造された60mol%ソジウムジニトロフェノラート(0.121g、0.585mmol)を添加して12時間攪拌した。ガラスフィルターを用いて濾過して固体を除去し、得られたメチレンクロライド溶液を減圧下で溶媒を除去し、赤褐色の固体を得た(0.284g、0.111mmol)。収率95%1H NMR(dmso−d6、40℃):δ8.62(br、3H、(NO2)2C6H3O)、8.03(br、3H、(NO2)2C6H3O)、7.87(br、1H、CH=N)、7.41−7.22(br、2H、m−H)、6.71(br、3H、(NO2)2C6H3O)、3.62(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.09(1H、cyclohexyl−CH)、1.89(1H、cyclohexyl−CH)、1.72−1.09(br、37H)、0.87(br、18H、CH3)ppm。
【0051】
[実施例2]化合物5の合成
4−ニトロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム4−ニトロフェノラートを用いてアニオン交換反応を行った。収率95%.1H NMR(dmso−d6、40℃):δ7.96(br、4H、(NO2)C6H4O)、7.77(br、1H、CH=N)、7.49(br、1H、(NO2)C6H-4O)、7.10(br、1H、m−H)、7.02(br、2H、m−H、(NO2)C6H-4O)、6.56(br、4H、(NO2)C6H-4O)、3.97(br、1H、cyclohexyl−CH)、2.96(br、16H、NCH2)、2.61(s、3H、CH3)、2.09(1H、cyclohexyl−CH)、1.89(1H、cyclohexyl−CH)、1.55−1.05(br、37H)、0.83(br、18H、CH3)ppm。
【0052】
[実施例3]化合物6の合成
2,4,5−卜リクロロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム2,4,5−卜リクロロフェノラートを用いてアニオン交換反応を行った。収率95%.1H NMR(dmso−d6、40℃):δ8.34(s、1H、C6H2Cl3O)、7.70(s、1H、CH=N)、7.39(s、2H、C6H2Cl3O)、7.09(s、1H、m−H)、6.97(s、1H、m−H)、6.85(s、2H、C6H2Cl3O)、6.69(s、1H、C6H2Cl3O)、4.13(br、1H、cyclohexyl−CH)、2.99(br、16H、NCH2)、2.63(s、3H、CH3)、2.10(br、1H、cyclohexyl−CH2)、1.84(br、1H、cyclohexyl−CH2)、1.57−1.05(br、37H)、0.84(br、18H、CH3)ppm。
【0053】
[実施例4]化合物7の合成
2,4,6−卜リクロロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム2,4,6−卜リクロロフェノラートを用いてアニオン交換反応を行った。収率98%.1H NMR(dmso−d6、40℃):δ7.92(br、1H、CH=N)、7.44(br、1H、m−H)、7.31(br、1H、m−H)、7.20(br、6H、C6H3Cl3O)、3.60(br、1H、cyclohexyl−CH)、3.10(br、16H、NCH2)、2.65(s、3H、CH3)、2.01(br、1H、cyclohexyl−CH2)、1.83(br、1H、cyclohexyl−CH2)、1.66−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0054】
[実施例5]化合物8の合成
ペンタフルオロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウムペンタフルオロフェノラート用いてアニオン交換反応を行った。収率97%.1H NMR(dmso−d6、40℃):δ7.85(br、1H、CH=N)、7.18(br、1H、m−H)、7.10(br、1H、m−H)、4.03(br、1H、cyclohexyl−CH)、3.09(br、16H、NCH2)、2。46(br、3H、CH3)、2.09(br、1H、cyclohexyl−CH2)、1.87(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0055】
[実施例6]〜[実施例10]二酸化炭素/プロピレンオキシド共重合
50mLボム反応器(bomb reactor)に前記実施例1〜5で製造された化合物4〜8(0.0027mmol、単量体/触媒=50,000)とプロピレンオキシド(7.71g、135mmol)を入れて反応器を組み立てた。80℃に予め温度が調整されたオイルバスに反応器を浸漬して約15分間攪拌して反応器温度がバス温度と一致するようにした。20barの二酸化炭素ガス圧力を印加した。反応が進むにつれて二酸化炭素圧力が低下することが観察され、圧力が約7barまで低下した点(30分反応)で二酸化炭素ガス圧力を除去して反応を終了させた。得られた粘性の溶液に単量体10gをさらに投入して溶液の粘度を低下させた後、シリカゲル(400mg、メルク社製、0.040〜0.063mm粒径(230〜400メッシュ)パッドを通過させて無色の溶液を得た。単量体を真空減圧して除去し、白色固体のポリマーを得た。質量を測定してTON(Turnover Number)とTOF(Turnover Frequency)を計算し、得られた高分子の分子量はGPCを用いて測定した。1H NMRスペクトルを分析してポリマー形成に対する選択性を計算した。下記表2で重合結果を整理して示す。
【0056】
表2.実施例6〜10の二酸化炭素/プロピレンオキシド共重合の結果
【表2】


a単量体/触媒=100,000
【0057】
[比較例]
[化学式5]

【0058】
[比較例1]化合物3の合成
化合物4の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を前記製造した100mol%ソジウムジニトロフェノラート(5当量)を用いて行った。収率94%.1H NMR(dmso−d6、40℃):δ8.59(br、2H、(NO2)2C6H3O)、7.89(br、1H、CH=N)、7.79(br、2H、(NO2)2C6H3O)、7.41−7.18(br、2H、m−H)、6.32(br、2H、(NO2)2C6H3O)、3.62(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.08(1H、cyclohexyl−CH)、1.82(1H、cyclohexyl−CH)、1.69−1.05(br、37H)、0.83(br、18H、CH3)ppm。
【0059】
[比較例2]化合物9の合成
化合物5の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム4−ニトロフェノラート(5当量)を用いて行った。収率98%.1H NMR(dmso−d6、40℃):δ7.75(br、2H、C6H4NO2O)、7.66(br、1H、CH=N)、7.37(br、2H、C6H4NO2O)、6.98(br、1H、m−H)、6.91(br、3H、m−H、C6H4NO2O)、6.21(br、2H、C6H4NO2O)、3.85(br、1H、cyclohexyl−CH)、2.86(br、16H、NCH2)、2.50(s、3H、CH3)、1.98(br、1H、cyclohexyl−CH2)、1.78(br、1H、cyclohexyl−CH2)、1.56−0.90(br、37H)、0.72(br、18H、CH3)ppm。
【0060】
[比較例3]化合物10の合成
化合物6の製造方法と同じ方法によりCo(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム2,4,5−卜リクロロフェノラート(5当量)を用いて行った。収率94%.1H NMR(dmso−d6、40℃):δ8.34(s、1H、C6H2Cl3O)、7.70(s、1H、CH=N)、7.11(s、1.5H、C6H2Cl3O)、7.09(s、1H、m−H)、6.97(s、1H、m−H)、6.69(s、1H、C6H2Cl3O)、6.39(s、1.5H、C6H2Cl3O)、4.13(br、1H、cyclohexyl−CH)、2.99(br、16H、NCH2)、2.63(s、3H、CH3)、2.10(br、1H、cyclohexyl−CH2)、1.84(br、1H、cyclohexyl−CH2)、1.57−1.05(br、37H)、0.84(br、18H、CH3)ppm。
【0061】
[比較例4]化合物11の合成
化合物7の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム2,4,6−卜リクロロフェノラートで(5当量)を用いて行った。収率99%.1H NMR(dmso−d6、40℃):δ7.99(br、1H、CH=N)、7.46(br、1H、m−H)、7.31(br、1H、m−H)、6.91(br、5H、C6H2Cl3O)、3.55(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.00(br、1H、cyclohexyl−CH2)、1.80(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.87(br、18H、CH3)ppm。
【0062】
[比較例5]化合物12の合成
化合物8の製造方法と同じ方法によりCo(III)化合物を製造した後、アニオン交換反応を100mol%ソジウムペンタフルオロフェノラート(5当量)を用いて行った。収率97%.1H NMR(dmso−d6、40℃):δ7.85(br、1H、CH=N)、7.18(br、1H、m−H)、7.10(br、1H、m−H)、4.03(br、1H、cyclohexyl−CH)、3.09(br、16H、NCH2)、2.46(br、3H、CH3)、2.07(br、1H、cyclohexyl−CH2)、1.89(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0063】
[比較例6]〜[比較例10]二酸化炭素/プロピレンオキシド共重合
化学式5の触媒を用いて実施例6〜10と同じ方法により共重合を行った。下記表3で重合結果を整理して示す。
【0064】
表3.比較例6〜10の二酸化炭素/プロピレンオキシド共重合の結果
【表3】

a単量体/触媒=100,000
b誘導時間は一定でなく、60〜600分間の値が観察された。
【産業上の利用可能性】
【0065】
本発明によると、数平均分子量(Mn)が5,000〜1,000,000の分子量を有し、分子量分布(Mw/Mn)が1.05〜4.0の値を有するポリカーボネートを製造することができる。ここで、Mnは単一分子量分布のポリスチレンを標準物質に補正してGPCで測定した数平均分子量を意味し、分子量分布Mw/Mn値は同一の方法により、GPCによって特定した重量平均分子量と数平均分子量との割合である。製造されたポリカーボネート重合体は、80%以上のカーボネート結合で構成されており、時々95%以上のカーボネート結合で構成される。本発明によって製造されるポリカーボネートは、分解が容易で燃焼時の残渣とススがない高分子であって、例えば、包装材、断熱材、またはコーティング材として有用な材料である。
【技術分野】
【0001】
本発明は、アンモニウム塩を含む配位子から合成されたコバルトまたはクロム錯化合物を触媒として使用し、エポキシド化合物と二酸化炭素を共重合してポリカーボネートを製造する方法に関する。
【背景技術】
【0002】
脂肪族ポリカーボネートは、生分解が容易な高分子であって、例えば、包装材またはコーティング材として有用な材料である。ポリカーボネートをエポキシド化合物と二酸化炭素から製造する方法は、有毒化合物であるホスゲンを使用しないという点と、二酸化炭素を安価で得られるという点において環境にやさしいという価値がある。
【0003】
1960年代から多くの発明者らがエポキシド化合物と二酸化炭素からポリカーボネートを製造するために様々な形態の触媒を開発してきた。最近、本発明者は、第四級アンモニウム塩を含むサレン[Salen:([H2Salen=N、N´−bis(3,5−dialkylsalicylidene)−1,2−ethylenediamine]−型の配位子から合成された高活性、高選択性の触媒を開示した[Bun Yeoul Lee、韓国特許登録10−0853358(登録日:2008.08.13);Bun Yeoul Lee、Sujith S、Eun Kyoung Noh、Jae Ki Min、韓国特許出願10−2008−0015454(出願日:2008.02.20);Bun Yeoul Lee、Sujith S、Eun Kyoung Noh、Jae Ki Min、PCT/KR2008/002453(出願日:2008.04.30);Eun Kyung Noh、Sung Jae Na、Sujith S、Sang−Wook Kim、and Bun Yeoul Lee*J.Am.Chem.Soc.2007,129,8082−8083(2007.07.04);Sujith S、Jae Ki min、Jong Eon Seong、Sung Jea Na、and Bun Yeoul Lee、Angew.Chem.Int.Ed.,2008,47,7306−7309.(2008.09.08)]。本発明者が開示した触媒は、高活性、高選択性を有しており、分子量が多い共重合体を製造することができ、高温でも重合が可能であるため、商業工程に適用することができる。また、第四級アンモニウム塩を配位子に含んでおり、二酸化炭素/エポキシド共重合反応後、共重合体から触媒を容易に分離して再使用することができるという長所がある。
【0004】
また、本発明者は、前記特許の触媒群の他のものと対比して、特に高活性と高選択性を有する触媒の構造を綿密に分析し、その構造が、サレン(salen)−配位子の窒素原子は配位せず、酸素原子のみが金属に配位した、公知されていない独特の構造を有していることを開示し(例1)、これから新規の触媒システムを特許出願した(韓国特許出願10−2008−0074435(出願日:2008.07.30))。
【0005】
[例1]

【0006】
また、前記例1の化合物のNMR研究によりジニトロフェノラート(DNP)の状態を明らかにすることができた。即ち、化合物が含んでいる四つのDNPのうち二つは常にコバルトに配位した状態にあり、残る二つは配位状態と脱配位状態を往復している状態であるが、配位状態に滞留している程度が温度、溶媒、及び配位子の置換体(R、R1、R2)の変化に応じて異なる。下記図は、重合反応媒質と非常に類似したTHFを溶媒とし、常温での触媒構造におけるDNPの状態を示す図である。化合物1´では、配位と脱配位状態をNMRタイムスケールで盛んに往復しており、NMRでシグナルが観察されていない。また、化合物2´及び3´のどちらもDNPがコバルトにある程度配位と脱配位を往復しており、主に脱配位状態に滞留しているが、2´が脱配位状態により長く滞留していることが見られた。即ち、脱配位の状態に主に滞留する二つのDNPの配位状態に滞留する程度(コバルトに対する結合親和性(binding affinity))は、1´>3´>2´の順である。一方、二酸化炭素/プロピレンオキシド共重合実験で観察された活性の順序(TOF)は、その逆順である2´>3´>1´であった。これは、コバルトに配位−脱配位を往復して弱く結合(binding)する二つのDNPのコバルトに対する結合親和性(binding affinity)が高いと、活性が低下するということを暗示する。

【0007】
前記構造の化合物が高活性を有する理由は、前記二つのアニオン性のDNP配位子が配位状態と脱配位状態を絶えず往復する性質のためであると説明した。以下の図は、二酸化炭素/エポキシド共重合の高分子鎖の成長メカニズムを示す。このメカニズムにおいて、鎖の末端に形成されたカーボネートアニオンが、配位したエポキシドを攻撃する段階が重要である。配位状態と脱配位状態を絶えず往復する性質によって、カーボネートアニオンが、配位したエポキシドを背面から攻撃することが可能になる。通常、求核攻撃は脱離基の背面から攻撃して行われる。下記メカニズムは、配位したカーボネートアニオンが脱配位状態に容易に転移できる場合、高活性を期待することができるが、観察された活性の順序と一致する。

【0008】
前記化合物を用いた二酸化炭素/エポキシド共重合触媒反応において重合反応溶液の[水]/[触媒]の割合が触媒活性の具現に重要な役目をする。エポキシド及び二酸化炭素を徹底的に精製して水を除去した場合でも、[エポキシド]/[触媒]の割合が100000のように相当少量の触媒を入れた重合条件下では、残存する水分子による[水]/[触媒]の割合が無視できない可能性がある。[エポキシド]/[触媒]の割合が100000のように高い条件下でも重合を具現することができると、高活性(TON)を得ることができる。そのため、商業的に価値のある触媒とするためには、触媒の水に対する敏感度が少なくなければならない。前記構造を有する触媒の場合、重合溶液内の水分量に応じて誘導時間が相当変わることが観察された。たとえば、乾燥した冬に重合反応を行うと、重合反応は約1〜2時間後に開始されるが、湿度及び温度の高い夏に重合を行うと、ひどいときは12時間後に重合が開始されることが観察された。一旦重合反応が開始されると、その後の活性(TOF)はあまり変化しなかった。1H NMR分光学実験で、化合物が含んでいるDNPがプロピレンオキシドを攻撃する反応が観察されるが、その反応速度は、水がある程度存在すると急激に低下する。配位状態と脱配位状態を絶えず往復している二つのアニオンが水と水素結合して求核攻撃能力が低下するため反応速度が遅くなると類推される。
【0009】
下記表1は、プロピレンオキシド(PO)とシクロヘキセンオキシド(CyO)を混合し、前記例1の2´化合物を用いた二酸化炭素との共重合反応結果を示す。表に示されたように、誘導時間が短い場合は45分、長い場合は9時間10分も観察された。また、誘導時間が長い場合、分子量が減少する傾向が観察された。このような不規則、かつ場合に応じて長い誘導時間は、この触媒を用いて商業工程を開発することに大きな障害となる。また、分子量が多い高分子を一貫性を持って製造できることも商業化の必須要素である。
【0010】
表1.2´触媒を用いたPO−CyO−CO2共重合の結果
【表1】

【先行技術文献】
【特許文献】
【0011】
【特許文献1】韓国特許登録10−0853358
【特許文献2】韓国特許出願10−2008−0015454
【特許文献3】PCT/KR2008/002453
【特許文献4】韓国特許出願10−2008−0074435
【非特許文献】
【0012】
【非特許文献1】J.Am.Chem.Soc.2007,129,8082−8083
【非特許文献2】Angew.Chem.Int.Ed.,2008,47,7306−7309
【発明の概要】
【発明が解決しようとする課題】
【0013】
本発明は、二酸化炭素とエポキシドを共重合してポリカーボネート製造する際における、前記触媒システムが提示する誘導時間が長かったり一貫していない問題、分子量が少ない高分子が得られる問題、及び活性が低い問題を解決することを目的とする。
【課題を解決するための手段】
【0014】
本発明の課題を果たすために、配位子が含むアンモニウムカチオンの総数が三つ以上であり、中心金属が−1価の形式電荷を有しており、二つのアンモニウムカチオンの対アニオンが酸−塩基ホモ共役(homoconjugation)であるコバルト3価またはクロム3価の錯化合物(下記化学式1)を触媒として使用し、エポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0015】
[化学式1]

【0016】
前記化学式1中、Mは、コバルト3価またはクロム3価であり、L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても相違してよく、また、互いに連結されて二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり、aまたはbは整数であり、aまたはbは特に限定されず、好ましくは0〜15の整数であり、1+a+bを満たすものを含む。
【0017】
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、Zは、BF4−、ClO4−、NO3−またはPF6−である。
【0018】
X型配位子は、Gary O.SpessardとGary L.Miesslerが執筆したOrganometallic Chemistry(出版社:Prentice Hall)のp46に詳細に記述されている。X型配位子は、水素、塩素またはメチルのようなアニオン性配位子を意味し、X−アニオンが金属原素M+カチオンに結合されたものであって、X型配位子の結合は金属の酸化状態に影響を与える。
【0019】
本発明の具体的な様態として、下記化学式2の触媒を使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0020】
[化学式2]

【0021】
前記化学式2中、L5、L6、X3またはX4は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン;炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、cは、1または0であり、Zは、BF4−、ClO4−、NO3−またはPF6−であり、R12とR14は、メチル、エチル、イソプロピルまたは水素から選択され、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、Qは、二つの窒素原子を連結するために結合するジラジカルであり、前記Qは、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは融合された(C3〜C20)シクロアルキレンであるか、または前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは融合されたシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上含むことを特徴とする。
【0022】
より具体的に、前記化学式2中、Qは、trans−1,2−シクロヘキシレンまたはエチレンであり、Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり、Zは、BF4−である。
【0023】
本発明は、より具体的に、下記化学式3の触媒を使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0024】
[化学式3]

【0025】
前記化学式3中、L7、L8、X5またはX6は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(silfonamide)アニオン;炭素数1〜20のカルバメートアニオンであり、Zは、BF4−、ClO4−、NO3−またはPF6−であり、R12とR14は、メチル、エチル、イソプロピル、または水素から選択されるものであり、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、Qは、二つの窒素原子を連結するジラジカルであり、前記Qは、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは融合された(C3〜C20)シクロアルキレンであるか、または前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは融合されたシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上を含むことを特徴とする。
【0026】
より具体的には、前記化学式3中、Qは、trans−1,2−シクロヘキシレンまたはエチレンであり、Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり、Zは、BF4−である。
【0027】
本発明による錯化合物は、アンモニウム塩を含んでいる配位子をまず合成して酢酸金属(金属はコバルトまたはクロムである。)をアンモニウム塩を含む配位子と反応させ、アセテート配位子を脱配位させて酢酸を除去しコバルト2価化合物を得て、これを適当な酸(HX)存在の下で酸素を酸化剤として使用して酸化させ、コバルト3価化合物を得る段階を含み、60〜100mol%のNaXを用いたアニオン交換反応を含む触媒の製造方法により製造される。アンモニウム塩を含んでいる配位子は、本発明者によって開発されて公開された公知の方法(Bull.Korean Chem.Soc.2009,30,745)に従って製造されたものである。
【0028】
前記酸(HX)のXは、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;炭素数1〜20のカルバメートアニオンである。
【0029】
本発明は、前記化学式1〜化学式3から選択されるコバルト錯化合物を触媒として使用してエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法を提供する。
【0030】
前記エポキシド化合物は、ハロゲンまたはアルコキシで置換または非置換の(C2〜C20)アルキレンオキシド;ハロゲンまたはアルコキシで置換または非置換の(C4〜C20)シクロアルキレンオキシド;ハロゲン、アルコキシ、アルキルまたはアリールで置換または非置換の(C8〜C20)スチレンオキシドからなる群から選択されてもよい。前記アルコキシは、具体的にアルキルオキシ、アリールオキシ、アラルキル(aralkyl)オキシなどがあり、前記アリールオキシは、フェノキシ、ビフェニルオキシ、ナフチルオキシなどが挙げられる。前記アルコキシ、アルキル及びアリールはハロゲン元素またはアルコキシ基から選択される置換基を有してもよい。
【0031】
前記エポキシド化合物の具体例は、エチレンオキシド、プロピレンオキシド、ブテンオキシド、ペンテンオキシド、ヘキセンオキシド、オクテンオキシド、デセンオキシド、ドデセンオキシド、テトラデセンオキシド、ヘキサデセンオキシド、オクタデセンオキシド、ブタジエンモノオキシド、1,2−エポキシド−7−オクテン、エピフルオロヒドリン、エピクロロヒドリン、エピブロモヒドリン、イソプロピルグリシジルエーテル、ブチルグリシジルエーテル、t−ブチルグリシジルエーテル、2−エチルヘキシルグリシジルエーテル、アリールグリシジルエーテル、シクロペンテンオキシド、シクロヘキセンオキシド、シクロオクテンオキシド、シクロドデセンオキシド、アルファ−ピネンオキシド、2,3−エポキシドノルボルネン、リモネンオキシド、ディルドリン、2,3−エポキシドプロピルベンゼン、スチレンオキシド、フェニルプロピレンオキシド、スチルベンオキシド、クロロスチルベンオキシド、ジクロロスチルベンオキシド、1,2−エポキシ−3−フェノキシプロパン、ベンジルオキシメチルオキシラン、グリシジル−メチルフェニルエーテル、クロロフェニル−2,3−エポキシドプロピルエーテル、エポキシプロピルメトキシフェニルエーテルビフェニルグリシジルエーテル、グリシジルナフチルエーテルなどが挙げられる。
【0032】
エポキシド化合物は、有機溶媒を反応媒質として重合に用いられることができ、前記溶媒としては、ペンタン、オクタン、デカン及びシクロヘキサンなどの脂肪族炭化水素、ベンゼン、トルエン、及びキシレンなどのような芳香族炭化水素、クロロメタン、メチレンクロライド、クロロホルム、カーボンテトラクロライド、1,1−ジクロロエタン、1,2−ジクロロエタン、エチルクロライド、トリクロロエタン、1−クロロプロパン、2−クロロプロパン、1−クロロブタン、2−クロロブタン、1−クロロ−2−メチルプロパン、クロロベンゼン及びブロモベンゼンなどのようなハロゲン化炭化水素のうち一つまたは2つ以上を組み合わせて使用することができる。より好ましくは、単量体自体を溶媒として使用するバルク重合を行うことができる。
【0033】
エポキシド化合物に対する触媒のモル比、即ちエポキシド化合物に対する触媒モル比は、1,000〜1,000,000で使用することができ、好ましくは、50,000〜200,000で使用することができる。
【0034】
前記共重合段階で二酸化炭素の圧力は、常圧〜100気圧まで可能であり、好ましくは、5気圧〜30気圧が好適である。
【0035】
前記共重合段階における重合温度は20℃〜120℃まで可能であり、好ましくは、50℃〜90℃が好適である。
【0036】
ポリカーボネートを重合する方法としては、バッチ重合法、半バッチ重合法、または連続重合法がある。バッチまたは半バッチ重合法を使用する場合、反応時間は1〜24時間、好ましくは1.5〜4時間が可能である。連続重合法を使用する場合の触媒の平均滞留時間も同じく1.5〜4時間にすることが好ましい。
【0037】
本発明によると、数平均分子量(Mn)が5,000〜1,000,000の分子量を有し、分子量分布(Mw/Mn)が1.05〜4.0の値を有するポリカーボネートを製造することができる。ここで、Mnは単一分子量分布のポリスチレンを標準物質に補正してGPCで測定した数平均分子量を意味し、分子量分布Mw/Mn値は同一の方法により、GPCによって特定した重量平均分子量と数平均分子量との割合である。
【0038】
製造されたポリカーボネート重合体は、80%以上のカーボネート結合で構成されており、時々95%以上のカーボネート結合で構成される。本発明によって製造されるポリカーボネートは、分解が容易で燃焼時の残渣とススがない高分子であって、例えば、包装材、断熱材、またはコーティング材として有用な材料である。
【発明の効果】
【0039】
前記背景技術で記述したように、従来触媒が高活性を有する理由は、二つのアニオン性の配位子が配位状態と脱配位状態を絶えず往復する性質のためである。そしてこのアニオン性の配位子が金属中心からより容易に分離されることができれば、すなわち、金属中心との相互作用が弱いほど、活性が増加した。本発明は、配位状態と脱配位状態を往復するアニオン性の配位子を酸−塩基ホモ共役(homoconjugation)、例えば[DNP...H...DNP]−に代替することにより、アニオンの金属中心との相互作用を弱化して活性を増大させた(表2及び表3参照)。触媒の活性が増加すると、一般的に分子量は増大する(表2及び表3参照)。また、二つのアニオンを酸−塩基ホモ共役(homoconjugation)に代替することにより、水に対する敏感度を低下することができる(表2及び表3参照)。前記のように従来触媒の場合、重合溶液内の水分量に応じて誘導時間の変化がはげしく、これは配位状態と脱配位状態を絶えず往復しているアニオンが水と水素結合してプロピレンオキシドに対する求核攻撃能力が低下するためであると説明した。酸−塩基ホモ共役の場合、既に水素結合をしており、水との水素結合親和力が低下して水に対する敏感度が緩和され、誘導時間の変化が相対的に小さい。
【0040】
DNPに水が水素結合をすると求核攻撃能力が低下してPOとの反応速度が低下することが観察されるが、ホモ共役の場合、自体内の水素結合をしているものの、POに対する求核反応速度はむしろ向上することが観察される。図1は、下記化学式2の化合物6のプロピレンオキシドとの反応を示す1H NMRスペクトルである。ホモ共役がプロピレンオキシドと反応してマイゼンハイマー(Meisenheimer)塩のアニオン(*でマークしたシグナル)とアルコール化合物2,4−(NO2)2C6H3−OCH2CH(Me)OHと2,4−(NO2)2C6H3−OCH(Me)CH2OH(xでマークしたシグナル)が生成し、配位しているDNP(^でマークしたシグナル)はそのまま存在することが分かる(反応式1)。初期30分間反応したプロピレンオキシド数を数えて化合物3と6のプロピレンオキシドとの反応性を比較すると、化合物6が約2倍さらに速いことが分かり、化合物6の活性が化合物3の活性より大きいという結果と一致する。また、化合物3の場合、50当量の水を入れると、プロピレンオキシドとの反応性が著しく低下されることが観察されたが、図1に示されたように、化合物6は50当量の水の存在下でプロピレンオキシドとの反応速度が低下しない。この結果は、重合反応で化合物6の水に対する敏感度が化合物3より低い理由を説明する。
【0041】
[化学式4]

【0042】
[化学式5]

【0043】
[反応式1]

【0044】
酸−塩基ホモ共役における水素結合強度は通常の水素結合強度に比べてはるかに強い。Shan,S.−o.とLoh,S.とHerschlag,D.がScience1996,272,97に報告した論文を参照すると、水素結合して二つの酸塩基がホモ共役のようにPKa値が0である場合特に水素結合強度が増大し、この現象により酵素の反応性が極大化されるということが開示されている。また、Barnes,J.C.とWeakley,T.J.R.がActa Cryst.2003、E59、m160に報告した(18−Crown−6−k6O)potassium2,4−dinitrophenolate2,4−dinitrophenolホモ共役のx−ray単結晶構造で、水素結合によって連結された酸素−酸素結合の長さが2.453(4)Åであることが開示されている。この結合長さは、水素結合が相当強いものを支持する(Paola Gilli,P.;Bertolasi,V.;Ferretti,V.;and Gilli、V.J.Am.Chem.Sec.1994,116,909.)。また、Magonski,J.とPawlak,Z.及びJasinski,T.がJ.Chem.Soc.Faraday Trans.1993,89,119に報告した論文を参照すると、ホモ共役形成に対する平衡定数が約100であり、二つの成分が有機溶媒でほぼ化学式4で提示したように、ホモ共役として存在することを支持する。実際、thf−d8溶媒で測定した化合物6の1H NMRスペクトルを参照すると、*でマークした配位したDNPシグナルと、^でマークしたホモ共役[DNP...H...DNP]−シグナルとを区別して確認することができる。
【図面の簡単な説明】
【0045】
【図1】化合物4とプロピレンオキシドとの反応を示すdmso−d6での1H NMRスペクトルである(*でマークしたシグナルはDNPアニオンが反応して生成されたマイゼンハイマー(Meisenheimer)塩のアニオンであり、xでマークしたシグナルはマイゼンハイマー(Meisenheimer)塩のアニオンに陽性子が反応して生成されたアルコール2,4−(NO2)2C6H3−OCH2CH(Me)OHと2,4−(NO2)2C6H3−OCH(Me)CH2OHであり、^でマークしたシグナルはDNPである)。
【図2】thf−d8溶媒から測定した化合物4の1H NMRスペクトルである(*でマークしたシグナルは配位したDNPシグナルであり、^でマークしたシグナルはホモ共役シグナルである)。
【発明を実施するための形態】
【0046】
下記実施例及び比較例は、本発明の効果を具体的に説明する。但し、下記実施例は、本発明を例示するためのものに過ぎず、本発明の範囲を限定するものではない。
【0047】
[製造例1]60mol%ソジウムジニトロフェノラート(NaDNP)の合成
市販のジニトロフェノール(10.0g、54.3mmol)をメチレンクロライド250mLに溶解した後、無水硫酸マグネシウムにより水を除去して濾過し、減圧下で溶媒を除去した。グローブボックスの中で前記水を除去したジニトロフェノール(10.0g、54.3mmol)を無水THF(300mL)に溶解した後、NaH(0.782g、32.6mmol)を少しずつ加えた。NaHを全部加えた後、3時間攪拌して減圧下で溶媒を除去し、60mol%ソジウムジニトロフェノラートを得た。
【0048】
[製造例2]100mol%ソジウムジニトロフェノラートの合成法
市販のジニトロフェノール(10.0g、54.3mmol)をメチレンクロライド250mLに溶解した後、無水硫酸マグネシウムを添加して水を除去して濾過し、減圧下で溶媒を除去した。グローブボックスの中で水を除去したジニトロフェノール(10.0g、54.3mmol)を無水THF300(mL)に溶解した後、NaH(1.30g、54.3mmol)を少しずつゆっくり加えた。3時間攪拌して減圧下で溶媒を除去し、100mol%ソジウムジニトロフェノラートを得た。
【実施例】
【0049】
[化学式4]

【0050】
[実施例1]化合物4の合成
配位子の合成は、既に公知された文献に従って合成した(Bull.Korean Chem.Soc.2009,30,745)。グローブボックスの中で50mL丸底フラスコに配位子(0.376g、0.230mmol)及びCo(OAc)2(0.041g、0.230mmol)を定量して入れた後、エチルアルコール(17mL)を加えて3時間攪拌した。ジエチルエーテル20mLを添加して沈殿させ、ガラスフィルターを用いて濾過した後、ジエチルエーテル10mLでさらに3回洗浄した。得られたオレンジ色の固体を減圧下で溶媒を完全に除去した。このように製造したCo(II)化合物(0.200g、0.117mmol)に2,4−ジニトロフェノール(0.022g、0.117mmol)を加えてメチレンクロライド(5mL)を添加して溶解した。その後、酸素雰囲気下で3時間攪拌して酸化させ、前記方法により製造された60mol%ソジウムジニトロフェノラート(0.121g、0.585mmol)を添加して12時間攪拌した。ガラスフィルターを用いて濾過して固体を除去し、得られたメチレンクロライド溶液を減圧下で溶媒を除去し、赤褐色の固体を得た(0.284g、0.111mmol)。収率95%1H NMR(dmso−d6、40℃):δ8.62(br、3H、(NO2)2C6H3O)、8.03(br、3H、(NO2)2C6H3O)、7.87(br、1H、CH=N)、7.41−7.22(br、2H、m−H)、6.71(br、3H、(NO2)2C6H3O)、3.62(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.09(1H、cyclohexyl−CH)、1.89(1H、cyclohexyl−CH)、1.72−1.09(br、37H)、0.87(br、18H、CH3)ppm。
【0051】
[実施例2]化合物5の合成
4−ニトロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム4−ニトロフェノラートを用いてアニオン交換反応を行った。収率95%.1H NMR(dmso−d6、40℃):δ7.96(br、4H、(NO2)C6H4O)、7.77(br、1H、CH=N)、7.49(br、1H、(NO2)C6H-4O)、7.10(br、1H、m−H)、7.02(br、2H、m−H、(NO2)C6H-4O)、6.56(br、4H、(NO2)C6H-4O)、3.97(br、1H、cyclohexyl−CH)、2.96(br、16H、NCH2)、2.61(s、3H、CH3)、2.09(1H、cyclohexyl−CH)、1.89(1H、cyclohexyl−CH)、1.55−1.05(br、37H)、0.83(br、18H、CH3)ppm。
【0052】
[実施例3]化合物6の合成
2,4,5−卜リクロロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム2,4,5−卜リクロロフェノラートを用いてアニオン交換反応を行った。収率95%.1H NMR(dmso−d6、40℃):δ8.34(s、1H、C6H2Cl3O)、7.70(s、1H、CH=N)、7.39(s、2H、C6H2Cl3O)、7.09(s、1H、m−H)、6.97(s、1H、m−H)、6.85(s、2H、C6H2Cl3O)、6.69(s、1H、C6H2Cl3O)、4.13(br、1H、cyclohexyl−CH)、2.99(br、16H、NCH2)、2.63(s、3H、CH3)、2.10(br、1H、cyclohexyl−CH2)、1.84(br、1H、cyclohexyl−CH2)、1.57−1.05(br、37H)、0.84(br、18H、CH3)ppm。
【0053】
[実施例4]化合物7の合成
2,4,6−卜リクロロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウム2,4,6−卜リクロロフェノラートを用いてアニオン交換反応を行った。収率98%.1H NMR(dmso−d6、40℃):δ7.92(br、1H、CH=N)、7.44(br、1H、m−H)、7.31(br、1H、m−H)、7.20(br、6H、C6H3Cl3O)、3.60(br、1H、cyclohexyl−CH)、3.10(br、16H、NCH2)、2.65(s、3H、CH3)、2.01(br、1H、cyclohexyl−CH2)、1.83(br、1H、cyclohexyl−CH2)、1.66−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0054】
[実施例5]化合物8の合成
ペンタフルオロフェノールを用いて化合物4と同じ方法により合成した。酸素を用いた酸化反応は反応速度が遅いため3日間反応させた。前記60mol%ソジウム2,4−ジニトロフェノラートの製造方法に従って製造した60mol%ソジウムペンタフルオロフェノラート用いてアニオン交換反応を行った。収率97%.1H NMR(dmso−d6、40℃):δ7.85(br、1H、CH=N)、7.18(br、1H、m−H)、7.10(br、1H、m−H)、4.03(br、1H、cyclohexyl−CH)、3.09(br、16H、NCH2)、2。46(br、3H、CH3)、2.09(br、1H、cyclohexyl−CH2)、1.87(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0055】
[実施例6]〜[実施例10]二酸化炭素/プロピレンオキシド共重合
50mLボム反応器(bomb reactor)に前記実施例1〜5で製造された化合物4〜8(0.0027mmol、単量体/触媒=50,000)とプロピレンオキシド(7.71g、135mmol)を入れて反応器を組み立てた。80℃に予め温度が調整されたオイルバスに反応器を浸漬して約15分間攪拌して反応器温度がバス温度と一致するようにした。20barの二酸化炭素ガス圧力を印加した。反応が進むにつれて二酸化炭素圧力が低下することが観察され、圧力が約7barまで低下した点(30分反応)で二酸化炭素ガス圧力を除去して反応を終了させた。得られた粘性の溶液に単量体10gをさらに投入して溶液の粘度を低下させた後、シリカゲル(400mg、メルク社製、0.040〜0.063mm粒径(230〜400メッシュ)パッドを通過させて無色の溶液を得た。単量体を真空減圧して除去し、白色固体のポリマーを得た。質量を測定してTON(Turnover Number)とTOF(Turnover Frequency)を計算し、得られた高分子の分子量はGPCを用いて測定した。1H NMRスペクトルを分析してポリマー形成に対する選択性を計算した。下記表2で重合結果を整理して示す。
【0056】
表2.実施例6〜10の二酸化炭素/プロピレンオキシド共重合の結果
【表2】


a単量体/触媒=100,000
【0057】
[比較例]
[化学式5]

【0058】
[比較例1]化合物3の合成
化合物4の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を前記製造した100mol%ソジウムジニトロフェノラート(5当量)を用いて行った。収率94%.1H NMR(dmso−d6、40℃):δ8.59(br、2H、(NO2)2C6H3O)、7.89(br、1H、CH=N)、7.79(br、2H、(NO2)2C6H3O)、7.41−7.18(br、2H、m−H)、6.32(br、2H、(NO2)2C6H3O)、3.62(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.08(1H、cyclohexyl−CH)、1.82(1H、cyclohexyl−CH)、1.69−1.05(br、37H)、0.83(br、18H、CH3)ppm。
【0059】
[比較例2]化合物9の合成
化合物5の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム4−ニトロフェノラート(5当量)を用いて行った。収率98%.1H NMR(dmso−d6、40℃):δ7.75(br、2H、C6H4NO2O)、7.66(br、1H、CH=N)、7.37(br、2H、C6H4NO2O)、6.98(br、1H、m−H)、6.91(br、3H、m−H、C6H4NO2O)、6.21(br、2H、C6H4NO2O)、3.85(br、1H、cyclohexyl−CH)、2.86(br、16H、NCH2)、2.50(s、3H、CH3)、1.98(br、1H、cyclohexyl−CH2)、1.78(br、1H、cyclohexyl−CH2)、1.56−0.90(br、37H)、0.72(br、18H、CH3)ppm。
【0060】
[比較例3]化合物10の合成
化合物6の製造方法と同じ方法によりCo(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム2,4,5−卜リクロロフェノラート(5当量)を用いて行った。収率94%.1H NMR(dmso−d6、40℃):δ8.34(s、1H、C6H2Cl3O)、7.70(s、1H、CH=N)、7.11(s、1.5H、C6H2Cl3O)、7.09(s、1H、m−H)、6.97(s、1H、m−H)、6.69(s、1H、C6H2Cl3O)、6.39(s、1.5H、C6H2Cl3O)、4.13(br、1H、cyclohexyl−CH)、2.99(br、16H、NCH2)、2.63(s、3H、CH3)、2.10(br、1H、cyclohexyl−CH2)、1.84(br、1H、cyclohexyl−CH2)、1.57−1.05(br、37H)、0.84(br、18H、CH3)ppm。
【0061】
[比較例4]化合物11の合成
化合物7の製造方法と同じ方法により、Co(III)化合物を製造した後、アニオン交換反応を100mol%ソジウム2,4,6−卜リクロロフェノラートで(5当量)を用いて行った。収率99%.1H NMR(dmso−d6、40℃):δ7.99(br、1H、CH=N)、7.46(br、1H、m−H)、7.31(br、1H、m−H)、6.91(br、5H、C6H2Cl3O)、3.55(br、1H、cyclohexyl−CH)、3.08(br、16H、NCH2)、2.62(s、3H、CH3)、2.00(br、1H、cyclohexyl−CH2)、1.80(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.87(br、18H、CH3)ppm。
【0062】
[比較例5]化合物12の合成
化合物8の製造方法と同じ方法によりCo(III)化合物を製造した後、アニオン交換反応を100mol%ソジウムペンタフルオロフェノラート(5当量)を用いて行った。収率97%.1H NMR(dmso−d6、40℃):δ7.85(br、1H、CH=N)、7.18(br、1H、m−H)、7.10(br、1H、m−H)、4.03(br、1H、cyclohexyl−CH)、3.09(br、16H、NCH2)、2.46(br、3H、CH3)、2.07(br、1H、cyclohexyl−CH2)、1.89(br、1H、cyclohexyl−CH2)、1.70−1.15(br、37H)、0.88(br、18H、CH3)ppm。
【0063】
[比較例6]〜[比較例10]二酸化炭素/プロピレンオキシド共重合
化学式5の触媒を用いて実施例6〜10と同じ方法により共重合を行った。下記表3で重合結果を整理して示す。
【0064】
表3.比較例6〜10の二酸化炭素/プロピレンオキシド共重合の結果
【表3】

a単量体/触媒=100,000
b誘導時間は一定でなく、60〜600分間の値が観察された。
【産業上の利用可能性】
【0065】
本発明によると、数平均分子量(Mn)が5,000〜1,000,000の分子量を有し、分子量分布(Mw/Mn)が1.05〜4.0の値を有するポリカーボネートを製造することができる。ここで、Mnは単一分子量分布のポリスチレンを標準物質に補正してGPCで測定した数平均分子量を意味し、分子量分布Mw/Mn値は同一の方法により、GPCによって特定した重量平均分子量と数平均分子量との割合である。製造されたポリカーボネート重合体は、80%以上のカーボネート結合で構成されており、時々95%以上のカーボネート結合で構成される。本発明によって製造されるポリカーボネートは、分解が容易で燃焼時の残渣とススがない高分子であって、例えば、包装材、断熱材、またはコーティング材として有用な材料である。
【特許請求の範囲】
【請求項1】
下記化学式1の構造を有する錯化合物。
[化学式1]

(前記化学式1中、Mは、コバルト3価またはクロム3価であり;
L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても異なっていてもよく、また、互いに結合して二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり;
aまたはbは整数であり;
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
Zは、BF4−、ClO4−、NO3−、またはPF6−である。)
【請求項2】
錯化合物が下記化学式2の構造を有する請求項1に記載の錯化合物。
[化学式2]

(前記化学式2中、L5、L6、X3またはX4は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
cは、1または0であり、
Zは、BF4−、ClO4−、NO3−またはPF6−であり、
R12とR14は、メチル、エチル、イソプロピルまたは水素から選択され、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、
Qは、二つの窒素原子を連結するために結合するジラジカルである。)
【請求項3】
化学式2中、Qが、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは結合した(C3〜C20)シクロアルキレンであるか、または、前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは結合したシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上を含むことを特徴とする請求項2に記載の錯化合物。
【請求項4】
Qが、trans−1,2−シクロヘキシレンまたはエチレンであり;Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり;Zが、BF4−である請求項2に記載の錯化合物。
【請求項5】
錯化合物が下記化学式4の構造を有する請求項2に記載の錯化合物。
[化学式4]

【請求項6】
請求項1〜5のうち何れか一項に記載の錯化合物を触媒として使用し、
ハロゲンまたはアルコキシで置換または非置換の炭素数2〜20のアルキレンオキシド;ハロゲンまたはアルコキシで置換または非置換の炭素数4〜20のシクロアルケンオキシド;及び、ハロゲン、アルコキシ、アルキルまたはアリールで置換または非置換の炭素数8〜20のスチレンオキシドからなる群から選択されるエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法。
【請求項7】
L1またはL2の配位子と酢酸金属(金属はコバルトまたはクロムである。)が反応して、金属と配位子が結合する段階と、
前記金属と配位子が結合した後、酸(HX)を加え、酸素の存在下で反応させて金属を酸化し、アニオンXが金属に配位結合する段階と、
アニオンXを含む金属塩(金属はリチウム、ナトリウム、カリウム)を用いてイオン交換反応を行う段階と、
を含む下記化学式1の錯化合物の製造方法。
(前記L1、L2及びXは、下記化学式1のものと同一である。)
[化学式1]

(前記化学式1中、Mは、コバルト3価またはクロム3価であり;
L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても異なっていてもよく、また、互いに結合して二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり;
aまたはbは整数であり;
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
Zは、BF4−、ClO4−、NO3−、またはPF6−である。)
【請求項1】
下記化学式1の構造を有する錯化合物。
[化学式1]

(前記化学式1中、Mは、コバルト3価またはクロム3価であり;
L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても異なっていてもよく、また、互いに結合して二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり;
aまたはbは整数であり;
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
Zは、BF4−、ClO4−、NO3−、またはPF6−である。)
【請求項2】
錯化合物が下記化学式2の構造を有する請求項1に記載の錯化合物。
[化学式2]

(前記化学式2中、L5、L6、X3またはX4は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
cは、1または0であり、
Zは、BF4−、ClO4−、NO3−またはPF6−であり、
R12とR14は、メチル、エチル、イソプロピルまたは水素から選択され、R11とR13は、−[CH{(CH2)3N+Bu3}2]または−[CMe{(CH2)3N+Bu3}2]であり、
Qは、二つの窒素原子を連結するために結合するジラジカルである。)
【請求項3】
化学式2中、Qが、(C6〜C30)アリーレン、(C1〜C20)アルキレン、(C2〜C20)アルケニレン、(C2〜C20)アルキニレン、(C3〜C20)シクロアルキレンまたは結合した(C3〜C20)シクロアルキレンであるか、または、前記アリーレン、アルキレン、アルケニレン、アルキニレン、シクロアルキレンまたは結合したシクロアルキレンは、ハロゲン原子、(C1〜C7)アルキル、(C6〜C30)アリールまたはニトロ基から選択される置換基でさらに置換されてもよく、酸素、硫黄及び窒素から選択されるヘテロ原子を1つ以上を含むことを特徴とする請求項2に記載の錯化合物。
【請求項4】
Qが、trans−1,2−シクロヘキシレンまたはエチレンであり;Xは、2,4−ジニトロフェノラート、4−ニトロフェノラート、2,4,5−卜リクロロフェノラート、2,4,6−卜リクロロフェノラート、またはペンタフルオロフェノラートであり;Zが、BF4−である請求項2に記載の錯化合物。
【請求項5】
錯化合物が下記化学式4の構造を有する請求項2に記載の錯化合物。
[化学式4]

【請求項6】
請求項1〜5のうち何れか一項に記載の錯化合物を触媒として使用し、
ハロゲンまたはアルコキシで置換または非置換の炭素数2〜20のアルキレンオキシド;ハロゲンまたはアルコキシで置換または非置換の炭素数4〜20のシクロアルケンオキシド;及び、ハロゲン、アルコキシ、アルキルまたはアリールで置換または非置換の炭素数8〜20のスチレンオキシドからなる群から選択されるエポキシド化合物及び二酸化炭素を共重合する段階を含むポリカーボネートの製造方法。
【請求項7】
L1またはL2の配位子と酢酸金属(金属はコバルトまたはクロムである。)が反応して、金属と配位子が結合する段階と、
前記金属と配位子が結合した後、酸(HX)を加え、酸素の存在下で反応させて金属を酸化し、アニオンXが金属に配位結合する段階と、
アニオンXを含む金属塩(金属はリチウム、ナトリウム、カリウム)を用いてイオン交換反応を行う段階と、
を含む下記化学式1の錯化合物の製造方法。
(前記L1、L2及びXは、下記化学式1のものと同一である。)
[化学式1]

(前記化学式1中、Mは、コバルト3価またはクロム3価であり;
L1〜L4は、アニオン性のX型配位子であり、L1〜L4は、互いに同一であっても異なっていてもよく、また、互いに結合して二座配位子、三座配位子、または四座配位子を形成してもよく、L1〜L4のうち少なくとも一つは第四級アンモニウムカチオンを含み、L1〜L4が含むアンモニウムカチオンの総数は1+a+bであり、錯化合物は全体的に中性であり;
aまたはbは整数であり;
L1〜L4のうち第四級アンモニウムカチオンを含む配位子を除いた配位子、またはX1及びX2は、互いに独立して、ハロゲンアニオンまたはHCO3−であるか、ハロゲン原子、窒素原子、酸素原子、ケイ素原子、硫黄原子及びリン原子のうち一つ以上を含むか含まない炭素数6〜20のアリールオキシアニオン、炭素数1〜20のカルボキシアニオン;炭素数1〜20のアルコキシアニオン;炭素数1〜20のカーボネートアニオン;炭素数1〜20のアルキルスルホネート(alkylsulfonate)アニオン;炭素数1〜20のアミド(amide)アニオン;炭素数1〜20のカルボキシアミド(carboxamide)アニオン;炭素数1〜20のスルホンアミド(sulfonamide)アニオン;又は炭素数1〜20のカルバメートアニオンであり、
Zは、BF4−、ClO4−、NO3−、またはPF6−である。)
【図1】


【図2】




【図2】


【公表番号】特表2012−530795(P2012−530795A)
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−515988(P2012−515988)
【出願日】平成22年6月18日(2010.6.18)
【国際出願番号】PCT/KR2010/003939
【国際公開番号】WO2010/147421
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(508171000)エスケー イノベーション シーオー., エルティーディー. (19)
【Fターム(参考)】
【公表日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成22年6月18日(2010.6.18)
【国際出願番号】PCT/KR2010/003939
【国際公開番号】WO2010/147421
【国際公開日】平成22年12月23日(2010.12.23)
【出願人】(508171000)エスケー イノベーション シーオー., エルティーディー. (19)
【Fターム(参考)】
[ Back to top ]

