人工皮膚モデルの製造方法、及び人工皮膚モデル
【課題】人工皮膚モデルを製造可能な新たな方法を提供する。
【解決手段】細胞外マトリックス成分を含む被膜2で細胞3の表面が被覆された被覆細胞1を準備すること、被覆細胞1を培養し、被覆細胞1が積層された真皮組織層7を形成すること、及び、真皮組織層7上に表皮細胞8を配置して表皮層12を形成することを含む、人工皮膚モデルの製造方法。
【解決手段】細胞外マトリックス成分を含む被膜2で細胞3の表面が被覆された被覆細胞1を準備すること、被覆細胞1を培養し、被覆細胞1が積層された真皮組織層7を形成すること、及び、真皮組織層7上に表皮細胞8を配置して表皮層12を形成することを含む、人工皮膚モデルの製造方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、人工皮膚モデルの製造方法、及びその方法により製造される人工皮膚モデルに関する。
【背景技術】
【0002】
化粧品、医薬品及び医薬部外品等といったヒトに直接適用される物質の研究開発において、薬効試験、薬理試験及び安全性試験等といった物質の評価試験は重要である。これらの試験は、従来、マウスやラット等の動物を用いて行われているが、近年、動物愛護の観点から動物実験の見直しが求められ、これまでに動物実験に代わる様々な方法が提案されている。その方法の1つとして、培養皮膚モデルを用いたin vitro試験等がある。
【0003】
また、移植医療や再生医療の分野において、培養皮膚は、火傷や創傷の治療のための被覆材として用いられている。
【0004】
このような理由から、培養表皮や培養皮膚等の研究開発が広く行われており、様々な提案がなされている。例えば、表皮細胞をコラーゲンゲル上で三次元的に培養した培養表皮(例えば、特許文献1)、線維芽細胞を埋め込んだコラーゲン上に上皮を除去した羊膜を配置し、その上で正常ヒト角化細胞を分化誘導して表皮層を形成した、真皮と表皮とを含む培養皮膚等がある(例えば、特許文献2、非特許文献1等)。また、その他には、細胞外マトリックス成分と細胞とを含む細胞培養液を循環培養する経路内にメッシュ部材と液流制御部材とが配設されたリアクターを用いて高密度真皮様組織を作製し、ついで細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質及び表皮細胞を用いて表皮層を形成する方法がある(例えば、特許文献3)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許2773058号
【特許文献2】WO2005/087286
【特許文献3】特開2010−172247号公報
【非特許文献】
【0006】
【非特許文献1】K. Hashimoto et al., Cell Tissue Res. 2006, 69, 326.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1及び2並びに非特許文献1のように、支持体としてコラーゲンゲルを用いた場合、コラーゲンゲルの収縮や分解に伴い、長期安定性に劣るという問題や表皮層と真皮層との接着性が不安定であるという問題がある。また、特許文献3の方法では、真皮層形成のために特別な装置が必要であるという問題や、表皮層形成のために細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質が必要であるという問題がある。このため、人工皮膚モデルを製造可能な新たな方法が求められている。
【0008】
そこで、本発明は、人工皮膚モデルを製造可能な新たな方法を提供する。
【課題を解決するための手段】
【0009】
本発明は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む人工皮膚モデルの製造方法に関する。
【発明の効果】
【0010】
本発明によれば、例えば、人工皮膚モデルを製造可能な新たな方法を提供できる。
【図面の簡単な説明】
【0011】
【図1】図1は、本発明の人工皮膚モデルの製造方法の一例を示す模式図である。
【図2】図2Aは、播種した細胞数と積層された細胞の層数との関係を示すグラフの一例であり、図2Bは、播種した細胞数と収率との関係を示すグラフの一例である。
【図3】図3Aは、培養日数とDNA量との関係を示すグラフの一例であり、図3Bは、培養日数と三次元組織の厚みとの関係を示すグラフの一例である。
【図4】図4Aは、実施例1の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図4Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図5】図5Aは、実施例2の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図5Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図6】図6Aは、実施例3の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図6Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図7】図7は、比較例1の培養皮膚の顕微鏡写真の一例である。
【図8】図8Aは、参考例1の培養皮膚の分化誘導前の顕微鏡写真の一例であり、図8Bは、培養皮膚の顕微鏡写真の一例である。
【図9】図9Aは、人工皮膚モデル又は培養皮膚の培養日数と経皮電気抵抗(TER)との関係を示すグラフの一例であり、図9Bは、真皮組織層における細胞の層数とTERとの極大日との関係を示すグラフの一例である。
【図10】図10は、実施例5の人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例である。
【図11】図11は、実施例6の人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例である。
【発明を実施するための形態】
【0012】
本発明は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を培養して真皮組織層を形成し、その真皮組織層上に表皮層を形成すれば、例えば、細胞積層のための支持体としてコラーゲンゲルや、特別な装置及び組換えタンパク質等を使用しない場合であっても、人工皮膚モデルを得ることができる、という知見に基づく。なお、本発明においてこれらの特別な装置及び又は細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質を使用することを排除するものではなく、本発明の製造方法においてこれらを使用してもよいし、使用しなくてもよい。
【0013】
本発明の製造方法によれば、真皮組織層の形成に被覆細胞を使用するため、例えば、簡単かつ短時間で真皮組織層を形成できる。また、本発明の製造方法によれば、真皮組織層の形成に被覆細胞を使用するため、積層構造の長期安定性に優れる真皮組織層を形成することができる。このため、本発明の製造方法によれば、簡単かつ短時間で、長期安定性に優れる人工皮膚モデルを製造することができる。本発明の製造方法によれば、真皮組織層上に表皮層を直接形成できるため、真皮組織層と表皮層との接着性に優れる人工皮膚モデルを製造することができる。
【0014】
本発明の製造方法によれば、経皮電気抵抗(TER)を測定可能な、真皮組織層と表皮層とを含む人工皮膚モデルを製造することができる。このため、本発明の人工皮膚モデルによれば、例えば、in vivoにより近い状態で皮膚(表皮層)のバリア機能の評価を行うことができる。本発明の製造方法により製造される人工皮膚モデルがTERを測定できるメカニズムは定かではないが、以下のように推測される。すなわち、被覆細胞を培養することにより形成された真皮組織層上で、表皮細胞の分化誘導を行うことにより、表皮層における緻密性が向上し、隣接する表皮細胞同士が密着し、かつそれらの間にタイトジャンクションが形成されるものと考えられる。但し、本発明はこれらのメカニズムに限定して解釈されなくてもよい。
【0015】
すなわち、本発明は、
[1] 細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む人工皮膚モデルの製造方法;
[2] 前記被覆細胞の準備は、細胞を、RGD配列を有する第1物質と、前記第1物質と相互作用する第2物質とに交互に接触させ、前記細胞表面に前記第1物質を含む被膜と前記第2物質を含む被膜とを含む細胞外マトリックス成分を含む被膜を形成することを含む[1]記載の製造方法;
[3] 前記第1物質は、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、及びキトサンからなる群から選択され、前記第2物質は、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、及びエラスチンからなる群から選択される[2]記載の製造方法;
[4] 前記真皮組織層内に組織付属器官を形成することを含む[1]から[3]のいずれかに記載の製造方法;
[5] 前記真皮組織層の形成は、前記被覆細胞を培養して前記被覆細胞が積層された細胞層を形成すること、前記細胞層上に組織付属器官を構成する細胞を配置すること、及び前記組織付属器官を構成する細胞が配置された細胞層上に前記被覆細胞を配置し、培養して前記被覆細胞が積層された細胞層を形成することを含む[1]から[4]のいずれかに記載の製造方法;
[6] 前記真皮組織層の形成は、前記被覆細胞が少なくとも2層以上積層されるように、前記被覆細胞を配置することを含む[1]から[5]のいずれかに記載の製造方法;
[7] 細胞外マトリックス成分と積層された細胞とを含む真皮組織層と、前記真皮組織層上に形成された表皮層とを含み[1]から[6]のいずれかに記載の製造方法により製造される人工皮膚モデル;
[8] 前記表皮層において、隣接する表皮細胞間にタイトジャンクションが形成されている、[7]記載の人工皮膚モデル;
[9] 前記真皮組織層に形成された組織付属器官を含む[7]又は[8]に記載の人工皮膚モデル;
[10] [7]から[9]のいずれかに記載の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法であって、前記被検物質を前記人工皮膚モデルと接触させること、及び、前記被検物質の接触による刺激に対する応答を測定することを含む、評価方法;
[11] 被検物質の刺激性の評価キットであって[7]から[9]のいずれかに記載の人工皮膚モデルを含む評価キット;
に関する。
【0016】
本明細書において「人工皮膚モデル」とは、ヒトの皮膚の構造、特に表皮と真皮とを含む部分の構造及びその環境を再現又は模倣したものをいう。また、人工皮膚モデルは、好ましくは被検物質の皮膚に対する薬効試験、薬理試験及び安全性試験等といった薬剤評価のために利用可能な実験又は試験ツールとなりうるものを含み、より好ましくは本発明の製造方法により製造された人工皮膚モデルを含む。人工皮膚モデルは、例えば、皮膚に含まれる組織付属器官及び又はそれを構成する細胞等を含んでいてもよい。組織付属器官としては、例えば、血管、リンパ管、脂腺、汗腺、毛、及び毛嚢等が挙げられる。組織付属器官を構成する細胞としては、例えば、血管内皮細胞、リンパ管内皮細胞、免疫細胞、メラニン細胞、樹状細胞、ランゲルハンス細胞、毛胞細胞、毛乳頭細胞、皮脂腺細胞、及び脂肪細胞等が挙げられる。また、人工皮膚モデルは、上記以外のその他の細胞を含んでいてもよい。その他の細胞としては、例えば、癌細胞、癌周辺に存在する又は存在しうる細胞等が挙げられる。
【0017】
本明細書において「被覆細胞」とは、細胞外マトリックス成分を含む被膜と細胞とを含み、その細胞表面が該被膜によって被覆されている細胞をいう。細胞としては、例えば、線維芽細胞、上皮細胞、血管内皮細胞、リンパ管内皮細胞、神経細胞、組織幹細胞、胚性幹細胞、及び免疫細胞等の接着性細胞が挙げられる。細胞は、一種類でもよいし、二種類以上を用いてもよい。
【0018】
本明細書において「真皮組織層」とは、細胞と細胞外マトリックス成分との集合体で構成されるものであって、被覆細胞が三次元に積層されたものをいい、好ましくは皮膚の真皮の形態及び又は環境に類似及び又は模したものをいう。真皮組織層は、上記の組織付属器官及び又はそれを構成する細胞を含んでいてもよい。
【0019】
[人工皮膚モデルの製造方法]
本発明の人工皮膚モデルの製造方法は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む。
【0020】
[被覆細胞]
被覆細胞は、細胞の表面に細胞外マトリックス成分を含む被膜を形成することにより調製できる。本明細書において「細胞外マトリックス成分」とは、生体内で細胞の外の空間を充填し、骨格的役割、足場を提供する役割、及び又は生体因子を保持する役割等の機能を果たす生体内物質をいう。また、細胞外マトリックス成分は、さらに、in vitro細胞培養において骨格的役割、足場を提供する役割及び又は生体因子を保持する役割等の機能を果たしうる物質を含んでいてもよい。
【0021】
細胞外マトリックス成分を含む被膜は、形成作業の容易性、厚みの調整の容易性、及び細胞培養効率の観点から、RGD配列を有する第1物質(以下、「第1物質」ともいう)を含む膜と、前記第1物質と相互作用する第2物質(以下、「第2物質」ともいう)を含む膜とを含むことが好ましく、隣接する被覆細胞間の接着性向上の観点から、これらの膜が交互に積層されていることがより好ましい。細胞外マトリックス成分を含む被膜において、隣接する被覆細胞間の接着性向上の観点から、細胞表面に隣接して形成された膜及び又は最外層の膜であることが好ましく、より好ましくは少なくとも最外層の膜が第1物質を含む膜であり、さらにより好ましくは細胞表面に隣接する膜及び最外層の膜が第1物質を含む膜である。第1物質を含む膜は、実質的に第1物質からなる膜であることが好ましく、第2物質を含む膜は、実質的に第2物質からなる膜であることが好ましい。また、RGD配列を有する第1物質は、正の電荷を有する第1物質であってもよく、第1物質と相互作用する第2物質は、負の電荷を有する第2物質であってもよい。
【0022】
(RGD配列を有する第1物質)
RGD配列を有する第1物質とは、細胞接着活性を担うアミノ酸配列である「Arg−Gly−Asp」(RGD)配列をするタンパク質又は高分子をいう。本明細書において「RGD配列を有する」とは、元来RGD配列を有するものでもよいし、RGD配列が化学的に結合されたものでもよい。RGD配列を有する第1物質は、生分解性であることが好ましい。
【0023】
RGD配列を有するタンパク質としては、例えば、従来公知の接着性タンパク質、又はRGD配列を有する水溶性タンパク質等が挙げられる。接着性タンパク質としては、例えば、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、又はコラーゲン等が挙げられる。RGD配列を有する水溶性タンパク質としては、例えば、RGD配列を結合させたコラーゲン、ゼラチン、アルブミン、グロブリン、プロテオグリカン、酵素、又は抗体等が挙げられる。
【0024】
RGD配列を有する高分子としては、例えば、天然由来高分子、又は合成高分子が挙げられる。RGD配列を有する天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、α−ポリリジン又はε−ポリリジン等のポリアミノ酸、キチン又はキトサン等の糖等が挙げられる。RGD配列を有する合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のRGD配列を有するポリマー又は共重合体が挙げられる。ポリマー又は共重合体としては、例えば、ポリウレタン、ポリカーボネート、ポリアミド、又はこれらの共重合体、ポリエステル、ポリ(N−イソプロピルアクリルアミド−co−ポリアクリル酸)、ポリアミドアミンデンドリマー、ポリエチレンオキサイド、ポリε−カプロラクタム、ポリアクリルアミド、又はポリ(メタクリル酸メチル−γ−ポリメタクリル酸オキシエチレン)等が挙げられる。
【0025】
第1物質は、これらの中でも、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、又はキトサンが好ましく、より好ましくはフィブロネクチン、ビトロネクチン、ラミニン、ポリリジン、RGD配列を結合させたコラーゲン、又はRGD配列を結合させたゼラチンである。
【0026】
(相互作用する第2物質)
相互作用する第2物質とは、RGD配列を有する第1物質と相互作用するタンパク質若しくは高分子をいう。本明細書において「相互作用する」とは、例えば、静電的相互作用、疎水性相互作用、水素結合、電荷移動相互作用、共有結合形成、タンパク質間の特異的相互作用、及び又はファンデルワールス力等により、化学的及び又は物理的に第1物質と第2物質とが結合、接着、吸着又は電子の授受が可能な程度に近接することを意味する。相互作用する第2物質は、生分解性であることが好ましい。
【0027】
第1物質と相互作用するタンパク質としては、例えば、コラーゲン、ゼラチン、プロテオグリカン、インテグリン、酵素、又は抗体等が挙げられる。第1物質と相互作用する高分子としては、例えば、天然由来高分子、又は合成高分子が挙げられる。第1物質と相互作用する天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリアミノ酸、エラスチン、ヘパリン、ヘパラン硫酸又はデキストラン硫酸等の糖、及びヒアルロン酸等が挙げられる。ポリアミノ酸としては、例えば、α−ポリリジン又はε−ポリリジン等のポリリジン、ポリグルタミン酸、又はポリアスパラギン酸等が挙げられる。第1物質と相互作用する合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のRGD配列を有するポリマー又は共重合体が挙げられる。ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、又はこれらの共重合体、ポリエステル、ポリアクリル酸、ポリメタクリル酸、ポリエチレングリコール−グラフト−ポリアクリル酸、ポリ(N−イソプロピルアクリルアミド−co−ポリアクリル酸)、ポリアミドアミンデンドリマー、ポリエチレンオキサイド、ポリε−カプロラクタム、ポリアクリルアミド、ポリ(メタクリル酸メチル−γ−ポリメタクリル酸オキシエチレン)等が挙げられる。
【0028】
第2物質は、これらの中でも、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、又はエラスチンが好ましく、より好ましくはゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、又はコラーゲン、さらに好ましくはゼラチン、デキストラン硫酸、ヘパリン、又はヒアルロン酸である。
【0029】
第1物質と第2物質との組み合わせは、特に制限されず、相互作用する異なる物質の組み合わせであればよく、いずれか一方がRGD配列を含む高分子又はタンパク質であり、他方がこれと相互作用する高分子またはタンパク質であればよい。第1物質と第2物質との組み合わせとしては、例えば、フィブロネクチンとゼラチン、フィブロネクチンとε−ポリリジン、フィブロネクチンとヒアルロン酸、フィブロネクチンとデキストラン硫酸、フィブロネクチンとヘパリン、フィブロネクチンとコラーゲン、ラミニンとゼラチン、ラミニンとコラーゲン、ポリリジンとエラスチン、ビトロネクチンとコラーゲン、RGD結合コラーゲン又はRGD結合ゼラチンとコラーゲン又はゼラチン等が挙げられる。中でも、フィブロネクチンとゼラチン、フィブロネクチンとε−ポリリジン、フィブロネクチンとヒアルロン酸、フィブロネクチンとデキストラン硫酸、フィブロネクチンとヘパリン、又はラミニンとゼラチンが好ましく、より好ましくはフィブロネクチンとゼラチンである。なお、第1物質及び第2物質は、それぞれ一種類ずつでもよいし、相互作用を示す範囲で二種類以上をそれぞれ併用してもよい。
【0030】
(正の電荷を有する第1物質)
正の電荷を有する第1物質とは、正の電荷を有するタンパク質又は高分子をいう。正の電荷を有するタンパク質としては、例えば、水溶性タンパク質が好ましい。水溶性タンパク質としては、例えば、塩基性コラーゲン、塩基性ゼラチン、リゾチーム、シトクロムc、ペルオキシダーゼ、又はミオグロビン等が挙げられる。正の電荷を有する高分子としては、例えば、天然由来高分子及び合成高分子が挙げられる。天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリアミノ酸、キチン又はキトサン等の糖等が挙げられる。ポリアミノ酸としては、ポリ(α−リジン)、ポリ(ε−リジン)等のポリリジン、ポリアルギニン、又はポリヒスチジン等が挙げられる。合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のポリマー又は共重合体が挙げられる。前記ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、又はこれらの共重合体、ポリエステル、ポリジアリルジメチルアンモニウムクロライド、ポリアリルアミンハイドロクロライド、ポリエチレンイミン、ポリビニルアミン、又はポリアミドアミンデンドリマー等が挙げられる。
【0031】
(負の電荷を有する第2物質)
負の電荷を有する第2物質とは、負の電荷を有するタンパク質又は高分子をいう。負の電荷を有するタンパク質としては、例えば、水溶性タンパク質が好ましい。水溶性タンパク質としては、例えば、酸性コラーゲン、酸性ゼラチン、アルブミン、グロブリン、カタラーゼ、β−ラクトグロブリン、チログロブリン、α−ラクトアルブミン、又は卵白アルブミン等が挙げられる。負の電荷を有する高分子としては、天然由来高分子及び合成高分子が挙げられる。天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリ(βリジン)等のポリアミノ酸、又はデキストラン硫酸等が挙げられる。合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のポリマー又は共重合体が挙げられる。前記ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、及びこれらの共重合体、ポリエステル、ポリアクリル酸、ポリメタクリル酸、ポリスチレンスルホン酸、ポリアクリルアミドメチルプロパンスルホン酸、末端カルボキシ化ポリエチレングリコール、ポリジアリルジメチルアンモニウム塩、ポリアリルアミン塩、ポリエチレンイミン、ポリビニルアミン、又はポリアミドアミンデンドリマー等が挙げられる。
【0032】
正の電荷を有する第1物質と負の電荷を有する第2物質との組み合わせとしては、例えば、ε−ポリリジン塩とポリスルホン酸塩、ε−ポリリジンとポリスルホン酸塩、キトサンとデキストラン硫酸、ポリアリルアミンハイドロクロライドとポリスチレンスルホン酸塩、ポリジアリルジメチルアンモニウムクロライドとポリスチレンスルホン酸塩、又はポリジアリルジメチルアンモニウムクロライドとポリアクリル酸塩等が挙げられ、好ましくはε−ポリリジン塩とポリスルホン酸塩、又はポリジアリルジメチルアンモニウムクロライドとポリアクリル酸塩である。なお、正の電荷を有する第1物質及び負の電荷を有する第2物質は、それぞれ、一種類ずつでもよいし、相互作用を示す範囲で二種類以上をそれぞれ併用してもよい。
【0033】
細胞外マトリックス成分を含む被膜の厚みは、例えば、1nm〜1×103nmが好ましく、より好ましくは2nm〜1×102nm、被覆細胞がより密に積層された真皮組織層が得られるという理由から、3nm〜1×102nmがさらに好ましい。細胞外マトリックス成分を含む被膜の厚みは、例えば、被膜を構成する膜の数によって適宜制御することができる。細胞外マトリックス成分を含む被膜は、特に制限されず、1層であってもよいし、例えば、3、5、7、9、11、13、15層又はそれ以上の多層であってもよい。なお、被膜の厚みは、実施例に記載の方法により求めることができる。
【0034】
被覆細胞は、例えば、細胞を、細胞外マトリックス成分に接触させることにより調製でき、真皮組織層において隣接する被覆細胞間の接着性が向上され、被覆細胞がより密に積層された真皮組織層が得られるという理由から、第1物質と第2物質とに交互に接触させて調製することが好ましい。これにより、細胞表面に、第1物質を含む膜と第2物質とを含む膜が交互に積層された被膜を形成することができる。接触させる順序は、特に制限されず、被覆細胞がより密に積層された真皮組織層が得られるという理由から、最初に第1物質と接触させた後、第2物質と接触させることが好ましく、この順序で第1物質と第2物質とを交互に接触させることがより好ましく、さらに好ましくはこの順序で第1物質と第2物質とを交互に接触させた後、最後に第1物質と接触させることである。
【0035】
以下に、最初に第1物質と接触させた後、第2物質と接触させ、この順序でこれらを交互に接触させる方法を例にとり、被覆細胞の調製方法を説明する。
【0036】
まず、細胞を第1物質と接触させる。これにより、細胞表面に第1物質を含む膜が形成され、細胞表面が第1物質を含む膜によって被覆される。細胞と第1物質との接触は、例えば、第1物質を細胞に塗布又は添加すること、第1物質含有液に細胞を浸漬させること、第1物質含有液を細胞に滴下又は噴霧すること等により行うことができる。中でも、操作が容易であるという理由から、第1物質含有液に細胞を浸漬させることにより、細胞と第1物質とを接触させることが好ましい。
【0037】
接触条件は、例えば、接触方法、第1物質及び又は細胞の種類、及び含有液の濃度等に応じて適宜決定できる。接触時間は、例えば、30秒〜24時間であり、好ましくは1分〜60分、より好ましくは1分〜15分、さらに好ましくは1分〜10分、さらにより好ましくは1分〜5分である。接触時の雰囲気温度及び又は含有液の温度は、例えば、4〜60℃であり、好ましくは20〜40℃、より好ましくは30〜37℃である。
【0038】
第1物質含有液は、第1物質を含んでいればよく、好ましくは第1物質と溶媒又は分散媒体(以下、「溶媒」ともいう)とを含む。第1物質含有液における、第1物質の含有量は、例えば、0.0001〜1質量%が好ましく、より好ましくは0.01〜0.5質量%、さらに好ましくは0.02〜0.1質量%である。溶媒としては、水、リン酸緩衝生理食塩水(PBS)及び緩衝液等の水性溶媒が挙げられる。緩衝液としては、例えば、Tris−HCl緩衝液等のTris緩衝液、リン酸緩衝液、HEPES緩衝液、クエン酸−リン酸緩衝液、グリシルグリシン−水酸化ナトリウム緩衝液、Britton−Robinson緩衝液、又はGTA緩衝液等が挙げられる。溶媒のpHは、特に制限されず、例えば、3〜11であり、好ましくは6〜8、より好ましくは7.2〜7.4である。
【0039】
第1物質含有液は、さらに、塩を含有してもよく、必要に応じて、例えば、細胞成長因子、サイトカイン、ケモカイン、ホルモン、生理活性ペプチド、疾患の治療剤、予防剤、抑制剤、抗菌剤、又は抗炎症剤等の医薬組成物等を含有してもよい。塩としては、例えば、塩化ナトリウム、塩化カルシウム、炭酸水素ナトリウム、酢酸ナトリウム、クエン酸ナトリウム、塩化カリウム、リン酸水素ナトリウム、硫酸マグネシウム、コハク酸ナトリウム等が挙げられる。塩は、一種類でもよいし二種類以上含有していてもよい。第1液及び第2液の双方が塩を含有していてもよいし、いずれか一方が塩を含有していてもよい。第1物質含有液中の塩濃度は、特に制限されないが、例えば、1×10-6M〜2Mであり、好ましくは1×10-4M〜1M、より好ましくは1×10-4M〜0.05Mである。
【0040】
ついで、第1物質を含む膜の形成に使用されなかった第1物質を除去する。第1物質の除去は、細胞と第1物質との接触を第1物質含有液に細胞を浸漬させて行った場合、例えば、遠心分離によって細胞と第1物質含有液とを分離し、上澄みを取り除くことによって行うことができる。これにより、第1物質を含む膜で被覆された細胞を得ることができる。また、第1物質の除去は、例えば、ろ過等によって行ってもよい。
【0041】
第1物質の除去に加えて、上記の溶媒を用いた洗浄を行ってもよい。洗浄は、例えば、遠心分離又はろ過等により行うことができる。遠心分離を用いた方法としては、例えば、上澄みを除去後に溶媒を添加し、遠心分離及び上澄みの除去を行う方法が挙げられる。洗浄に用いる溶媒は、第1物質含有液に用いた溶媒と同じであることが好ましい。
【0042】
ついで、第1物質を含む膜で被覆された細胞を第2物質と接触させる。これにより、第1物質を含む膜表面に第2物質を含む膜が形成され、第1物質を含む膜で被覆された細胞表面が第2物質を含む膜によって被覆される。第2物質との接触は、接触させる物質を第2物質にする以外は、上記の第1物質との接触と同様に行うことができる。
【0043】
第1物質又は第2物質と細胞との接触とを交互に繰り返し行うことにより、細胞表面全体に、第1物質を含む膜と第2物質を含む膜とが交互に積層された細胞外マトリックス成分を含む被膜を形成することができる。第1物質又は第2物質と細胞との接触を行う回数は、例えば、形成する細胞外マトリックス成分を含む被膜の厚み等に応じて適宜決定できる。
【0044】
[真皮組織層]
真皮組織層は、三次元に積層された被覆細胞を含む。真皮組織層の厚み及び真皮組織層において積層される細胞の数(層数)は特に制限されない。真皮組織層において積層される細胞の数(層数)は、例えば、ヒト等の生体組織とより同等の性質及び又は機能を発揮させる観点から、3層以上が好ましく、より好ましくは4層以上、さらに好ましくは5層以上、さらにより好ましくは6層以上である。積層される細胞数の上限は特に制限されないが、例えば、100層以下、50層以下、40層以下、20層以下、又は10層以下等である。
【0045】
真皮組織層の形成は、被覆細胞を培養することにより行う。細胞外マトリックス成分を含む被膜で表面が被覆された被覆細胞を培養することにより、被覆細胞が集積され、さらには細胞外マトリックス成分を含む被膜を介して隣接する被覆細胞同士が接着することにより、被覆細胞が三次元に積層された真皮組織層を形成することができる。
【0046】
被覆細胞の培養は、例えば、基材上に被覆細胞を播種し、一定時間インキュベーションすることにより行う。このインキュベーションにより、細胞外マトリックス成分を含む被膜を介して隣接する被覆細胞が互いに接着し、被覆細胞が三次元に積層されるとともに、隣接する被覆細胞同士の間隔が密になり、緻密な構造の真皮組織層が形成される。インキュベーションの条件は、特に制限されず、細胞に応じて適宜決定できる。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1時間〜168時間、好ましくは3時間〜24時間、より好ましくは3時間〜12時間である。培地は、特に制限されず、細胞に応じて適宜決定でき、例えば、Eagle's MEM培地、Dulbecco's Modified Eagle培地(DMEM)、Modified Eagle培地(MEM)、Minimum Essential培地、RDMI、GlutaMax培地、又は無血清培地等が挙げられる。
【0047】
播種時の被覆細胞の密度は、例えば、形成する真皮組織層に含まれる細胞層数等に応じて適宜決定でき、例えば、1×102個/cm3〜1×109個/cm3であり、好ましくは1×104個/cm3〜1×108個/cm3、より好ましくは1×105個/cm3〜1×107個/cm3である。
【0048】
被覆細胞の培養は、表皮細胞の分化誘導のための気液培養の準備や取扱が容易となるという理由から、メンブレンフィルタ上で行うことが好ましく、より好ましくはメンブレンフィルタを備える培養プレート、さらに好ましくはハウジング部と基底部とを備え、基底部がメンブレンフィルタである培養プレートを用いて行う。ハウジング部は、透明であることが好ましい。該培養プレートは、市販品を使用してもよい。市販品としては、例えば、トランスウェル(登録商標)、セルカルチャーインサート(商品名)等が挙げられる。
【0049】
メンブレンフィルタの孔径は、培養した細胞がメンブレンフィルタ上に保持可能な範囲であれば特に制限されず、例えば、0.1μm〜2μmであり、好ましくは0.4μm〜1.0μmである。また、メンブレンの材質は、例えば、ポリエチレンテレフタレート(PET)、ポリカーボネート、又はポリテトラフルオロエチレン(PTFE)等が挙げられる。
【0050】
このようにして形成された真皮組織層は、例えば、真皮組織層の形成後、例えば、2週間以上、好ましくは3週間以上、より好ましくは4週間以上、さらに好ましくは5週間以上、さらにより好ましくは6週間以上保存した場合であっても細胞の積層構造が保持でき、長期安定性に優れうる。真皮組織層の形成は、1回であってもよいし、複数回繰り返し行ってもよい。複数回繰り返し行うことにより、より多くの細胞が積層された多層の真皮組織層を形成することができる。
【0051】
[表皮層]
表皮層は、真皮組織層上で表皮細胞を培養した後、気液培養して表皮細胞を分化誘導させることによって形成することができる。表皮細胞としては、例えば、表皮角化細胞が使用できる。
【0052】
表皮細胞の培養は、例えば、真皮組織層上に被覆細胞を播種し、一定時間インキュベーションすることが好ましい。インキュベーションの条件は、特に制限されず、細胞に応じて適宜決定できる。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1日〜3日、好ましくは1日〜2日である。
【0053】
培地は、特に制限されず、細胞に応じて適宜決定でき、表皮細胞の増殖に用いられる培地が好ましい。表皮細胞の増殖に用いられる培地としては、例えば、無血清培地が挙げられる。無血清培地としては、例えば、MCDB153培地、EpiLife(登録商標)培地、これらの培地のアミノ酸組成等が改変された培地、又はDulbecco's Modified Eagle培地(DMEM)とハムF-12培地とを所定の割合で混合した培地等が挙げられる。MCDB153培地のアミノ酸組成が改変された培地としては、MCDB153培地のアミノ酸比率を、L−アスパラギン酸(塩)を1.5〜4倍、L−イソロイシン(塩)を22〜26倍、L−グルタミン(塩)を1.5〜3倍、L−グルタミン酸(塩)を1.1〜2倍、L−チロシン(塩)を3〜6倍、L−トリプトファン(塩)を5〜7倍、L−バリン(塩)を0.4〜0.7倍、L−ヒスチジン(塩)を2〜4倍、L−プロリン(塩)を0.4〜0.7倍、L−フェニルアラニン(塩)を4〜7倍、L−メチオニン(塩)を4〜6倍、L−リジン(塩)1.1〜2倍になるようにし、総アミノ酸中のL−グルタミン(塩)の含有量を65重量%以上にしたMCDB153改変培地等がある(例えば、特開2005-269923号公報)。なお、MCDB153培地のアミノ酸組成は表1の通りである。
【0054】
【表1】

【0055】
培地は、例えば、塩類、又はビタミン類等を含んでいてもよい。塩類としては、例えば、塩化カリウム、塩化ナトリウム、塩化マグネシウム、リン酸一水素二ナトリウム等が挙げられる。ビタミン類としては、例えば塩化コリン、シアノコバラミン、ニコチン酸アミド、D−パントテン酸又はその塩、塩酸ピリドキシン又は塩酸ピリドキサール、D−ビオチン、塩酸チアミン、リボフラビン、葉酸、DL−α−リポ酸、又はミオ−イノシトール等が挙げられる。
【0056】
播種時の表皮細胞の密度は、例えば、1×102個/cm2〜1×109個/cm2であり、好ましくは1×104個/cm2〜1×108個/cm2、より好ましくは1×105個/cm2〜1×107個/cm2である。
【0057】
気液培養は、培地を角化培地に培地交換した後、表皮細胞の表面を空気に曝した状態でインキュベーションすることによって行う。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1日〜40日、好ましくは5日〜30日、より好ましくは7日〜10日である。角化培地(重層化培地)は、上記表皮細胞の増殖に用いた培地に、例えば、カルシウム、及び又はウシ胎仔血清を添加した培地等が使用できる。培地のカルシウム濃度は、例えば、約0.4mM〜2.0mMとすることが好ましい。
【0058】
表皮細胞の播種に先立ち、真皮組織層上に細胞外マトリックス成分で形成された膜を形成することが好ましい。これにより、真皮組織層と表皮層との接着性をより向上させることができる。細胞外マトリックス成分で形成された膜は、上記の第1物質含有液と第2物質含有液とを交互に真皮組織層に接触させることにより形成できる。第1物質含有液及び第2物質含有液の接触は、例えば、塗布、浸漬、滴下、又は噴霧等により行うことができる。
【0059】
本発明の人工皮膚モデルの製造方法は、真皮組織層内に組織付属器官を形成することを含んでいてもよい。組織付属器官の形成は、例えば、真皮組織層の形成において、組織付属器官を構成する細胞を、真皮組織層を構成するための被覆細胞(例えば、線維芽細胞等)と混合させて培養すること、あるいは、組織付属器官を構成する細胞を、真皮組織層を構成するための被覆細胞が積層された細胞層間に配置して培養すること等により行うことができる。細胞層間への組織付属器官を構成する細胞の配置は、例えば、被覆細胞が積層された細胞層上に組織付属器官を構成する細胞を配置し、必要に応じて所定の期間培養した後、その上に被覆細胞を配置すること等により行うことができる。このため、本発明の人工皮膚モデルの製造方法は、真皮組織層の形成において、被覆細胞を培養して被覆細胞が積層された細胞層を形成すること、細胞層上に組織付属器官を構成する細胞を配置すること、及び組織付属器官を構成する細胞が配置された細胞層上に被覆細胞を配置し、培養して被覆細胞が積層された細胞層を形成することを含んでいてもよい。
【0060】
組織付属器官として血管及びリンパ管といった網の目のように組織内に形成される器官を形成する場合、組織付属器官の形成は、組織付属器官を構成する細胞を被覆細胞が積層された細胞層で挟んだ状態で培養することにより行うことが好ましい。このように、細胞層間に挟まれた状態で組織付属器官を構成する細胞を培養することにより、ヒトの生体内により近い緻密な血管網又はリンパ管網が形成されうる。組織付属器官として血管を形成する場合、組織付属器官を構成する細胞は血管内皮細胞を使用すればよく、組織付属器官としてリンパ管を形成する場合は、組織付属器官を構成する細胞はリンパ管内皮細胞を使用すればよい。
【0061】
組織付属器官を構成する細胞は、上記のとおりである。また、組織付属器官を構成する細胞に加えて又は替えて、組織付属器官を構成する細胞の幹細胞及び又は前駆細胞を使用してもよい。組織付属器官を構成する細胞は、真皮組織層の形成に用いる被覆細胞と同様に、細胞表面に細胞外マトリックス成分を含む被膜を形成したものを使用してもよいし、表皮層の形成と同様に、被膜を形成することなくそのまま使用してもよい。作業効率の向上の観点からは、細胞表面に細胞外マトリックス成分を含む被膜が形成された細胞が好ましい。播種する細胞の数、及び培養条件等は、組織付属器官を構成する細胞等に応じて適宜決定できる。細胞外マトリックス成分を含む被膜の形成は、上記の被覆細胞と同様に行うことができる。
【0062】
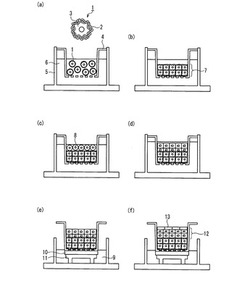
以下に、本発明の人工皮膚モデルの製造方法を、メンブレンフィルタを備えるプレート(セルカルチャーインサート)を基体として用いた形態を例にとり、図面を用いて説明する。図1は、本発明の人工皮膚モデルの製造方法の一例を示す模式図である。
【0063】
まず、細胞外マトリックス成分を含む被膜2で細胞表面3が被覆された被覆細胞1をセルカルチャーインサート4内に播種し、ついでセルカルチャーインサート4が配置されたウェル5内に培地6を添加し、その状態で所定の期間培養を行う。図1(a)に示すように、培養開始初期の時点では、被覆細胞1はセルカルチャーインサート4内の培地6中に分散された状態となっている。培養を行うことにより、被覆細胞1はセルカルチャーインサート4の底面に集積され、隣接する被覆細胞1同士が被膜2を介して接着される。これにより、図1(b)に示すように、被覆細胞1が三次元に積層された真皮組織層7が形成される。
【0064】
ついで、真皮組織層7上に表皮細胞8を播種し(図1(c))、所定の期間培養を行う。この培養を行うことにより、表皮細胞8が、真皮組織層7上に積層された状態で配置される(図1(d))。表皮細胞の播種に先立ち、真皮組織層上に細胞外マトリックス成分を含む膜を形成しておくことが好ましい(図示せず)。これにより、真皮組織層と表皮細胞との接着性を向上させることができる。
【0065】
そして、培地を角化培地9に培地交換し、所定の期間気液培養を行う。気液培養は、例えば、図1(e)に示すように、セルカルチャーインサート4のメンブレンフィルタ部分が気液界面に位置するようにセルカルチャーインサート4をろ紙10が配置された台11上に配置し、その状態でインキュベーションすることにより行うことができる。真皮組織層7上に配置した表皮細胞のうち表面付近に位置する表皮細胞が空気に曝された状態でインキュベーションすることにより、表面の表皮細胞が分化誘導され、角化され角質層13となり表皮層12が形成される(例えば、図1(f))。
【0066】
[人工皮膚モデル]
本発明は、その他の態様として、本発明の製造方法により製造される人工皮膚モデルに関する。本発明の人工皮膚モデルは、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を含む真皮組織層と、真皮組織層上に形成された表皮層とを含む。本発明の人工皮膚モデルによれば、例えば、実際の皮膚に近い環境で、被検物質の薬効試験、薬理試験及び安全性試験等の評価を行うことができる。また、本発明の人工皮膚モデルは、例えば、火傷や創傷の治療のための被覆材として用いることもできる。
【0067】
表皮層において、例えば、隣接する表皮細胞間にタイトジャンクションが形成されていることが好ましい。表皮層においてタイトジャンクションが形成されていることにより、例えば、TERを測定することによる表皮層のバリア機能等を評価することができる。
【0068】
本発明の人工皮膚モデルは、真皮組織層に形成された組織付属器官を含むことが好ましい。これにより、実際の皮膚により近い環境、被検物質の薬効試験、薬理試験及び又は安全性試験等の評価を行うことができる。
【0069】
真皮組織層において積層される細胞の数は、特に制限されず、ヒト等の皮膚とより同等の性質・機能を発揮させる観点から、3層以上が好ましく、より好ましくは4層以上、さらに好ましくは5層以上、さらにより好ましくは6層以上である。積層される細胞数の上限は特に制限されないが、例えば、100層以下、50層以下、40層以下、20層以下、又は10層以下等である。
【0070】
[評価方法]
本発明は、さらにその他の態様として、本発明の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法に関する。本発明の評価方法によれば、例えば、従来の方法と比較して実際の皮膚に近い環境で被検物質の評価を行うことができるという効果を奏しうる。また、本発明の評価方法は、例えば、新薬の創出(スクリーニング)等における各種分子量の薬物の動態評価、化粧品や医薬部外品等の開発における評価において極めて有用なツールとなりうる。
【0071】
本発明の評価方法は、例えば、被検物質を前記人工皮膚モデルと接触させること、及び、被検物質の接触による刺激に対する応答を測定することにより行うことができる。応答の測定は、例えば、TERを測定すること等によって行うことができる。被検物質は、評価対象となる物質のことをいい、例えば、無機化合物及有機化合物等が挙げられる。
【0072】
[評価キット]
本発明は、さらにその他の態様として、被検物質の刺激性の評価キットに関する。本発明の評価キットは、本発明の人工皮膚モデルを含む。本発明の評価キットによれば、例えば、本発明の評価方法をより簡便に行うことができる。
【0073】
評価キットは、所定の検査に用いる試薬、材料、用具、及び装置、並びに、その評価についての説明書(取扱説明書)の少なくとも1つを含む製品をさらに含んでいてもよい。
【0074】
[人工皮膚モデル製造キット]
本発明は、さらにその他の態様として、人工皮膚モデル製造用キットに関する。本発明の人工皮膚モデル製造用キットは、例えば、細胞外マトリックス成分を含む被膜の形成に用いる試薬、及び本発明の人工皮膚モデルの製造方法が記載された説明書を含むことが好ましい。本発明の人工皮膚モデル製造用キットによれば、より簡便に本発明の人工皮膚モデルを製造することができる。
【0075】
本発明の人工皮膚モデル製造用キットは、さらに、真皮組織層が形成された基材を含んでいてもよい。これにより、真皮組織層が形成された基材を含むことにより、例えば、より簡便に短時間で本発明の人工皮膚モデルを製造することができ、さらには組織付属器官を形成するまでの時間を短縮できる。
【実施例】
【0076】
被覆細胞の被膜の厚み、及び三次元組織の厚みは、以下のように測定した。
[被膜の厚み]
細胞表面に形成された細胞外マトリックス成分を含む被膜の厚みは、別途、基材上に被膜の形成を行い、水晶発振子マイクロバランス(QCM)測定法を用いて、行った処理(ステップ)数と形成される厚みとを測定し、その結果から細胞表面への被膜形成時に行ったステップ数に応じて算出した。QCM測定法を用いた測定は以下のように行った。QCM水晶センサをピランハ溶液で1分間洗浄してから、0.2mg/mLフィブロネクチン(以下、「FN」ともいう)の50mMトリス緩衝液(pH7.4)に37℃で1分間浸漬し、50mMトリス緩衝液(pH7.4)で洗浄して風乾した後、振動数シフトを測定した(ステップ1)。ついで0.2mg/mLゼラチン(以下、「G」ともいう)の50mMトリス緩衝液(pH7.4)に37℃で1分間浸漬し、50mMトリス緩衝液(pH7.4)で洗浄して風乾した後、振動数シフトを測定した(ステップ2)。このステップ1及び2を交互に繰り返すことによりQCM水晶センサに被膜を形成すると共に、振動数シフトの測定を行った。得られた振動数シフトに基づき、ステップの数とそれにより形成される被膜の厚みとを得た。
[三次元組織(真皮組織層)の厚み]
三次元組織の厚みは、三次元組織(真皮組織層)の切片を作製し、作製した切片をヘマトキシリン−エオジン(HE)染色した後、顕微鏡で観察することで測定した。
【0077】
(実験例1)
[播種細胞数と積層細胞数又は収率との関係]
細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を調製し、得られた被覆細胞を培養して被覆細胞が積層された三次元組織を形成した。播種した細胞数と積層される細胞の数との関係、及び収率を評価した。
【0078】
[被覆細胞の調製]
細胞外マトリックス成分を含む被膜として、第1物質を含む膜と第2物質を含む膜とが交互に積層された膜を形成した。第1物質としてフィブロネクチン ウシ血漿由来(商品コード:F4759、シグマアルドリッチ製)、第2物質としてゼラチン(商品コード:077−03155、和光純薬工業社製)、細胞としてヒト線維芽細胞(正常ヒト皮膚線維芽細胞(NHDF)、Cambrex社製)を準備した。
【0079】
5×106個のヒト線維芽細胞に、0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)を1mL加え、37℃で1分間インキュベートした後、2000rpmで2分間遠心分離を行い、上澄みを除去した。ついで、50mMトリス緩衝液(pH7.4)を1mL加えて1分間洗浄した後、2000rpmで2分間の遠心分離を行い、上澄みを除去した。0.2mg/mLゼラチンの50mMトリス緩衝液(pH7.4)を加え、37℃で1分間インキュベートした後、2000rpmで2分間遠心分離を行い、上澄みを除去した。50mMトリス緩衝液(pH7.4)を1mL加えて1分間洗浄した後、2000rpmで2分間の遠心分離を行い、上澄みを除去した。この、フィブロネクチン含有液でのインキュベート、洗浄、ゼラチン含有液でのインキュベート、及び洗浄を1ステップとし、4ステップ行った後、フィブロネクチン含有液でのインキュベート及び洗浄を行った。これにより、5層のフィブロネクチンからなる膜と4層のゼラチンからなる膜とを含み、これらの層が交互に積層された被膜((FN/G)4FN膜)をヒト線維芽細胞表面に形成した。細胞表面に形成された被膜の厚みは、6nmであった。
【0080】
[三次元組織の作製]
まず、6ウェル培養プレートに配置したセルカルチャーインサート(カタログ番号:353090、ベクトンディッキソン社製;ポアサイズ:0.4μm、表面積:4.2cm2)のメンブレンフィルタ上に、(FN/G)4FN膜が形成されたヒト線維芽細胞を1×106個播種し、10重量%ウシ胎仔血清を含むEagle’s MEM培地を添加して37℃で1日培養した。これによりヒト線維芽細胞が8層積層された三次元組織(厚み:35μm)が得られた。
【0081】
播種する細胞の数を0.1×106個、0.5×106個、2×106個、3×106個、4×106個、5×106個、又は10×106個とした以外は、上記と同様の条件で培養を行い、三次元組織を作製した。得られた三次元組織に基づき、播種した細胞数と、積層される細胞の層数及び収率との関係を下記表2及び図2に示す。なお、収率(%)は、得られた三次元組織から回収された生細胞数と播種細胞数とに基づき下記式から算出した。
収率(%)=(三次元組織から回収された生細胞数/播種細胞数)×100
三次元組織からの細胞の回収及び生細胞数の計測は、下記のように行った。まず、得られた三次元組織に、0.1%トリプシンを含むPBSを1mL添加し、5分程度静置して細胞を単離した後、遠心分離により回収した。回収された細胞に、3%トリパンブルーを含むPBSを添加し、位相差顕微鏡にて血球計を用いて生細胞の数を計測した。
【0082】
【表2】

【0083】
図2Aは、播種した細胞数と積層された細胞の層数との関係を示すグラフであり、図2Bは、播種した細胞数と収率との関係を示すグラフである。表2及び図2Aに示すように、播種した細胞の数が2×106個以下の範囲では、播種した細胞の数に応じて積層されて形成される細胞層の数が増加した。また、表2及び図2Bに示すように、播種した細胞の数が3×106個以下の範囲では、90%以上の収率を示した。
【0084】
(実験例2)
[三次元組織構造の安定性]
実験例1と同様にして被覆細胞の準備及び三次元組織の作製を行い、NHDFが1層、2層又は5層積層された三次元組織を作製した。得られた三次元組織を、10%ウシ胎仔血清を含むDMEM培地で37℃で28日間培養し、三次元組織中のDNA量及び三次元組織の厚みを測定した。その結果を図3に示す。なお、DNA量は、DNeasy Blood&Tissue Kit(商品名、QIAGEN製)で測定した。
【0085】
図3Aは、培養日数とDNA量との関係を示すグラフであり、図3Bは、培養日数と三次元組織の厚みとの関係を示すグラフである。図3A及びBにおいて、三角のマーカーが1層のNHDF層を含む三次元組織の結果を示し、四角のマーカーが2層のNHDF層を含む三次元組織の結果を示し、丸のマーカーが5層のNHDF層を含む三次元組織の結果を示す。図3A及びBに示すように、三次元組織を製造してから1ヶ月経過しても、細胞の積層構造が保持されていることが確認された。
【0086】
(実施例1)
NHDFが8層積層された真皮組織層上に表皮層が形成された人工皮膚モデルを作製した。
【0087】
[真皮組織層の形成]
播種する(FN/G)4FN膜が形成されたNHDFの数を2×106個とした以外は、実験例1と同様の条件で培養を1日行い、NHDFが8層積層された真皮組織層を形成した。
【0088】
[表皮層の形成]
得られた真皮組織層の表面に、0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)と0.2mg/mLゼラチンの50mMトリス緩衝液(pH7.4)とを交互にそれぞれ4回添加した後、さらに0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)を添加し、(FN/G)4FN膜を形成した。(FN/G)4FN膜が形成された真皮組織層表面にケラチノサイト(KC)を6×105個を播種し、37℃で2日間培養した。ついで、培地を角化培地(重層化培地)に交換し、セルカルチャーインサートのメンブレンフィルタが角化培地の気液界面に位置するようにセルカルチャーインサートを配置した。その状態で10日間気液培養することにより分化誘導を行い、人工皮膚モデルを作製した。気液培養は37℃で行った。また、培養開始から1日ごとに培地交換を行った。
【0089】
得られた人工皮膚モデル及びその分化誘導(播種して2日間培養)前の三次元培養体をそれぞれHE染色し、それを顕微鏡観察して得られた写真を図4に示す。図4Aは分化誘導前の顕微鏡写真であり、図4Bは得られた人工皮膚モデルの顕微鏡写真である。図4Bに示すように、本発明の方法により、NHDFが積層された真皮組織層と、その表面に形成された表皮層とを含む人工皮膚モデルを作製することができた。
【0090】
(実施例2)
真皮組織層形成において、播種するNHDFの数を1×106個とし、真皮組織層において積層されるNHDFの層数を4層とした以外は、実施例1と同様にして人工皮膚モデルを作製した。得られた人工皮膚モデル及びその分化誘導前(播種して2日間培養)のHE染色後の顕微鏡写真を図5に示す。図5Aは分化誘導前の顕微鏡写真であり、図5Bは人工皮膚モデルの顕微鏡写真である。
【0091】
(実施例3)
真皮組織層形成において、播種するNHDFの数を0.5×106個とし、真皮組織層において積層されるNHDFの層数を2層とした以外は、実施例1と同様にして人工皮膚モデルを作製した。得られた人工皮膚モデル及びその分化誘導前(播種して2日間培養)のHE染色後の顕微鏡写真を図6に示す。図6Aは分化誘導前の顕微鏡写真であり、図6Bは人工皮膚モデルの顕微鏡写真である。
【0092】
(比較例1)
コラーゲンゲルを支持体として使用し、コラーゲンゲル上に表皮層を形成して培養皮膚を作成した。まず、Cell matrix type I−A(新田ゼラチン製と20%ウシ胎仔血清とを含むDMEM溶液(溶液I)を作製し、約0.25mLをセルカルチャーインサートに注ぎ、インキュベーターに5分間静置した。5×105個/mLの濃度でNHDFを添加した溶液Iを約0.75mL、上記セルカルチャーインサートに加え、インキュベーターに30分間静置してゲル化した。ついで、NHDFを含むコラーゲンゲルを、アスコルビン酸を含むDMEMにて5日間培養した後、コラーゲンゲル表面に実施例1と同様の方法でケラチノサイトを播種接着させ、分化誘導して培養皮膚を得た。得られた培養皮膚の写真を図7に示す。
【0093】
コラーゲンゲルを支持体として使用して表皮層を形成した場合、図7に示すように、コラーゲンゲルの収縮に起因して、セルカルチャーインサート外縁部におけるコラーゲンゲルの剥離や、コラーゲンゲル上に表皮細胞が存在していない部分が観察された。これに対し、本発明の方法は、支持体としてコラーゲンゲルを使用しないため、コラーゲンゲルの収縮に起因する細胞の偏りが生じることもなく、細胞が均一に配置された人工皮膚モデルを作製することができた。
【0094】
(参考例1)
真皮組織層を形成することなく、セルカルチャーインサートのメンブレンフィルタ上に、ケラチノサイトを6×105個を播種した以外は、実施例1と同様にして表皮層を形成した。得られた培養皮膚及びその分化誘導前(播種して2日間培養)ののHE染色後の顕微鏡写真を図8に示す。図8Aは分化誘導前の顕微鏡写真であり、図8Bは人工皮膚モデルの顕微鏡写真である。
【0095】
(実施例4)
[バリア機能の評価]
実施例1〜3の人工皮膚モデル、並びに比較例1及び参考例1の培養皮膚について、経皮電気抵抗(TER)を測定することによりバリア機能の評価を行った。
【0096】
人工皮膚モデル又は培養皮膚が配置されたセルカルチャーインサートを、リン酸緩衝溶液(pH7.4)を添加されたウェル内に配置した。セルカルチャーインサートの内部と外部(ウェル内)にそれぞれ電極を配置し、電極間に電圧をかけることによって抵抗を測定し、得られた抵抗値をTER(Ω)とした。なお、得られた人工皮膚モデル及び培養皮膚の培養は、角化培地で37℃で行った。TERの測定は、培養開始から1日ごとに行った。その結果を図9のグラフに示す。
【0097】
図9Aは、人工皮膚モデル又は培養皮膚の培養日数とTERとの関係を示すグラフであり、図9Bは、真皮組織層におけるNHDFの層数とTERとの極大日との関係を示すグラフである。図9Aにおいて、ひし形のマーカーが実施例1(NHDF8層+KC)、四角のマーカーが実施例2(NHDF4層+KC)、三角のマーカーが実施例3(NHDF2層+KC)、バツのマーカーが参考例1(KCのみ)、丸のマーカーが比較例1(コラーゲンゲル+KC)の結果を示す。図9Aに示すように、実施例1〜3の人工皮膚モデルは、コラーゲンゲル上に表皮層が形成された比較例1の培養皮膚に比べてTERが高かった。このことから、実施例1〜3の人工皮膚モデルは、表皮層において隣接する表皮細胞間にタイトジャンクションが形成されているといえる。したがって、本発明によれば、皮膚のバリア機能を評価可能な人工皮膚モデルを提供できうることが示唆された。
【0098】
また、図9Bに示すように、真皮組織層におけるヒト皮膚繊維芽細胞の層数の増加に伴い、TERの極大日が増加した。このことから、真皮組織層に積層するヒト皮膚繊維芽細胞の層数を増加させることにより、生体皮膚のターンオーバー(分化時間、28日)に近づくことが示唆された。
【0099】
なお、真皮組織層のみの三次元組織では、積層されたNHDFの層数に関らずTERはほとんど0であった(date not shown)。
【0100】
(実施例5)
血管網を含む人工皮膚モデルを作製した。血管内皮細胞としては、ヒト臍帯静脈内皮細胞(HUVEC)を使用した。
【0101】
まず、(FN/G)4FN被膜が形成されたNHDFと、(FN/G)4FN被膜が形成されたHUVECを準備した。(FN/G)4FN被膜が形成されたHUVECは、NHDFに替えて、HUVECを使用した以外は、実験例1と同様の手順でHUVEC表面に(FN/G)4FN被膜を形成した。なお、(FN/G)4FN被膜が形成されたNHDFは、緑色蛍光色素(商品名:Cell TrackerTM Green Fluorescent Probe、製品コード:PA−3011、タカラバイオ製、)で着色した。
【0102】
つぎに、(FN/G)4FN被膜が形成されたNHDFを1×106個播種し、実験例1と同様にして37℃で1日間培養し、NHDFが4層積層された第1の真皮組織層を形成した。得られた第1の真皮組織層の表面に、実施例1の表皮層の形成と同様にして、(FN/G)4FN膜を形成し、その上に(FN/G)4FN被膜が形成されたHUVECを2×105個播種した。37℃で1日間培養し、真皮組織層上にHUVEC層を1層形成した。HUVEC層表面に、実施例1の表皮層の形成と同様にして、(FN/G)4FN膜を形成し、その上に(FN/G)4FN被膜が形成されたNHDFを1×106個播種し、実験例1と同様にして37℃で1日間培養し、NHDFが4層積層された第2の真皮組織層を形成した。そして、第2の真皮組織層表面に、実施例1と同様にして表皮層を形成した。表皮層を形成後、角化培地中で37℃で7日間培養し、人工皮膚モデルを得た。ついで、得られた人工皮膚モデルについてmonoclocal mouse anti-human CD31抗体(製品コード:JC70A、Dako製)とGoat anti-mouse Alexa Fluor546-conjugated IgG抗体(製品コード:A11001、Invitrogen製)とを用いたHUVECに対する免疫染色を行った。
【0103】
得られた人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例を図10に示す。図10は、得られた人工皮膚モデルのCLSM画像であって、図10Aは、赤で染色されたHUVECの画像であり、図10Bは、緑で染色されたNHDFの画像である。
【0104】
HUVEC層を第1の真皮組織層と第2の真皮組織層との間にはさみこんだ状態で培養を行うことにより、培養前には、敷石状の形態で第1の真皮組織層表面に位置していたHUVEC由来の細胞が、キャピラリー状に形態変化した。さらに7日間の培養を行うことによって、HUVEC由来の細胞が、チューブ構造を形成するようになり、かつそれらが連結することによって、図10に示すように、人工皮膚モデル内にチューブ構造を有する血管網が形成された。また、形成された血管網は、緻密であり、人工皮膚モデルを横方向(平面方向)に切断した断面で観察した場合、その面において血管網が占める面積の割合は45〜60%程度であり、互いに隣接する血管網の間隔は50〜100μmであった。
【0105】
また、HUVEC層を真皮組織層間にはさみこんだ状態で培養を行うことにより、HUVECとNHDFとを混合した状態で培養した場合と比較して、非常に緻密な血管網が形成されることが確認できた(date not shown)。
【0106】
(実施例6)
ヒト臍帯静脈内皮細胞(HUVEC)に替えてリンパ管内皮細胞(LEC)を用いた以外は、実施例5と同様にして、リンパ管網を含む人工皮膚モデルを作製した。
【0107】
得られた人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例を図11に示す。図11は、得られた人工皮膚モデルのCLSM画像であって、図11Aは、赤で染色されたLECの画像であり、図11Bは、緑で染色されたNHDFの画像である。
【0108】
HUVECを用いた実施例5と同様に、LECを用いた場合においても、LEC層を第1の真皮組織層と第2の真皮組織層との間にはさみこんだ状態で培養を行うことにより、培養前には、敷石状の形態で第1の真皮組織層表面に位置していたLEC由来の細胞が、キャピラリー状に形態変化し、さらに7日間の培養を行うことによって、図11に示すように、人工皮膚モデル内にチューブ構造を有するリンパ管網が形成された。
【0109】
実施例5及び6の結果から、血管網やリンパ管等の組織付属器官を含む、より生体の皮膚に近い新たな人工皮膚モデルを提供できることが示唆された。
【産業上の利用可能性】
【0110】
本発明によれば、被検物質の透過性や、それに伴う微小応答等が評価可能な人工皮膚モデルを提供できる。このため、本発明は、例えば、化粧品、医薬、製薬等の分野において有用である。
【技術分野】
【0001】
本発明は、人工皮膚モデルの製造方法、及びその方法により製造される人工皮膚モデルに関する。
【背景技術】
【0002】
化粧品、医薬品及び医薬部外品等といったヒトに直接適用される物質の研究開発において、薬効試験、薬理試験及び安全性試験等といった物質の評価試験は重要である。これらの試験は、従来、マウスやラット等の動物を用いて行われているが、近年、動物愛護の観点から動物実験の見直しが求められ、これまでに動物実験に代わる様々な方法が提案されている。その方法の1つとして、培養皮膚モデルを用いたin vitro試験等がある。
【0003】
また、移植医療や再生医療の分野において、培養皮膚は、火傷や創傷の治療のための被覆材として用いられている。
【0004】
このような理由から、培養表皮や培養皮膚等の研究開発が広く行われており、様々な提案がなされている。例えば、表皮細胞をコラーゲンゲル上で三次元的に培養した培養表皮(例えば、特許文献1)、線維芽細胞を埋め込んだコラーゲン上に上皮を除去した羊膜を配置し、その上で正常ヒト角化細胞を分化誘導して表皮層を形成した、真皮と表皮とを含む培養皮膚等がある(例えば、特許文献2、非特許文献1等)。また、その他には、細胞外マトリックス成分と細胞とを含む細胞培養液を循環培養する経路内にメッシュ部材と液流制御部材とが配設されたリアクターを用いて高密度真皮様組織を作製し、ついで細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質及び表皮細胞を用いて表皮層を形成する方法がある(例えば、特許文献3)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特許2773058号
【特許文献2】WO2005/087286
【特許文献3】特開2010−172247号公報
【非特許文献】
【0006】
【非特許文献1】K. Hashimoto et al., Cell Tissue Res. 2006, 69, 326.
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら、特許文献1及び2並びに非特許文献1のように、支持体としてコラーゲンゲルを用いた場合、コラーゲンゲルの収縮や分解に伴い、長期安定性に劣るという問題や表皮層と真皮層との接着性が不安定であるという問題がある。また、特許文献3の方法では、真皮層形成のために特別な装置が必要であるという問題や、表皮層形成のために細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質が必要であるという問題がある。このため、人工皮膚モデルを製造可能な新たな方法が求められている。
【0008】
そこで、本発明は、人工皮膚モデルを製造可能な新たな方法を提供する。
【課題を解決するための手段】
【0009】
本発明は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む人工皮膚モデルの製造方法に関する。
【発明の効果】
【0010】
本発明によれば、例えば、人工皮膚モデルを製造可能な新たな方法を提供できる。
【図面の簡単な説明】
【0011】
【図1】図1は、本発明の人工皮膚モデルの製造方法の一例を示す模式図である。
【図2】図2Aは、播種した細胞数と積層された細胞の層数との関係を示すグラフの一例であり、図2Bは、播種した細胞数と収率との関係を示すグラフの一例である。
【図3】図3Aは、培養日数とDNA量との関係を示すグラフの一例であり、図3Bは、培養日数と三次元組織の厚みとの関係を示すグラフの一例である。
【図4】図4Aは、実施例1の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図4Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図5】図5Aは、実施例2の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図5Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図6】図6Aは、実施例3の人工皮膚モデルの分化誘導前の顕微鏡写真の一例であり、図6Bは、人工皮膚モデルの顕微鏡写真の一例である。
【図7】図7は、比較例1の培養皮膚の顕微鏡写真の一例である。
【図8】図8Aは、参考例1の培養皮膚の分化誘導前の顕微鏡写真の一例であり、図8Bは、培養皮膚の顕微鏡写真の一例である。
【図9】図9Aは、人工皮膚モデル又は培養皮膚の培養日数と経皮電気抵抗(TER)との関係を示すグラフの一例であり、図9Bは、真皮組織層における細胞の層数とTERとの極大日との関係を示すグラフの一例である。
【図10】図10は、実施例5の人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例である。
【図11】図11は、実施例6の人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例である。
【発明を実施するための形態】
【0012】
本発明は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を培養して真皮組織層を形成し、その真皮組織層上に表皮層を形成すれば、例えば、細胞積層のための支持体としてコラーゲンゲルや、特別な装置及び組換えタンパク質等を使用しない場合であっても、人工皮膚モデルを得ることができる、という知見に基づく。なお、本発明においてこれらの特別な装置及び又は細胞成長因子とコラーゲン結合ドメインとを組み合わせた組換えタンパク質を使用することを排除するものではなく、本発明の製造方法においてこれらを使用してもよいし、使用しなくてもよい。
【0013】
本発明の製造方法によれば、真皮組織層の形成に被覆細胞を使用するため、例えば、簡単かつ短時間で真皮組織層を形成できる。また、本発明の製造方法によれば、真皮組織層の形成に被覆細胞を使用するため、積層構造の長期安定性に優れる真皮組織層を形成することができる。このため、本発明の製造方法によれば、簡単かつ短時間で、長期安定性に優れる人工皮膚モデルを製造することができる。本発明の製造方法によれば、真皮組織層上に表皮層を直接形成できるため、真皮組織層と表皮層との接着性に優れる人工皮膚モデルを製造することができる。
【0014】
本発明の製造方法によれば、経皮電気抵抗(TER)を測定可能な、真皮組織層と表皮層とを含む人工皮膚モデルを製造することができる。このため、本発明の人工皮膚モデルによれば、例えば、in vivoにより近い状態で皮膚(表皮層)のバリア機能の評価を行うことができる。本発明の製造方法により製造される人工皮膚モデルがTERを測定できるメカニズムは定かではないが、以下のように推測される。すなわち、被覆細胞を培養することにより形成された真皮組織層上で、表皮細胞の分化誘導を行うことにより、表皮層における緻密性が向上し、隣接する表皮細胞同士が密着し、かつそれらの間にタイトジャンクションが形成されるものと考えられる。但し、本発明はこれらのメカニズムに限定して解釈されなくてもよい。
【0015】
すなわち、本発明は、
[1] 細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む人工皮膚モデルの製造方法;
[2] 前記被覆細胞の準備は、細胞を、RGD配列を有する第1物質と、前記第1物質と相互作用する第2物質とに交互に接触させ、前記細胞表面に前記第1物質を含む被膜と前記第2物質を含む被膜とを含む細胞外マトリックス成分を含む被膜を形成することを含む[1]記載の製造方法;
[3] 前記第1物質は、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、及びキトサンからなる群から選択され、前記第2物質は、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、及びエラスチンからなる群から選択される[2]記載の製造方法;
[4] 前記真皮組織層内に組織付属器官を形成することを含む[1]から[3]のいずれかに記載の製造方法;
[5] 前記真皮組織層の形成は、前記被覆細胞を培養して前記被覆細胞が積層された細胞層を形成すること、前記細胞層上に組織付属器官を構成する細胞を配置すること、及び前記組織付属器官を構成する細胞が配置された細胞層上に前記被覆細胞を配置し、培養して前記被覆細胞が積層された細胞層を形成することを含む[1]から[4]のいずれかに記載の製造方法;
[6] 前記真皮組織層の形成は、前記被覆細胞が少なくとも2層以上積層されるように、前記被覆細胞を配置することを含む[1]から[5]のいずれかに記載の製造方法;
[7] 細胞外マトリックス成分と積層された細胞とを含む真皮組織層と、前記真皮組織層上に形成された表皮層とを含み[1]から[6]のいずれかに記載の製造方法により製造される人工皮膚モデル;
[8] 前記表皮層において、隣接する表皮細胞間にタイトジャンクションが形成されている、[7]記載の人工皮膚モデル;
[9] 前記真皮組織層に形成された組織付属器官を含む[7]又は[8]に記載の人工皮膚モデル;
[10] [7]から[9]のいずれかに記載の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法であって、前記被検物質を前記人工皮膚モデルと接触させること、及び、前記被検物質の接触による刺激に対する応答を測定することを含む、評価方法;
[11] 被検物質の刺激性の評価キットであって[7]から[9]のいずれかに記載の人工皮膚モデルを含む評価キット;
に関する。
【0016】
本明細書において「人工皮膚モデル」とは、ヒトの皮膚の構造、特に表皮と真皮とを含む部分の構造及びその環境を再現又は模倣したものをいう。また、人工皮膚モデルは、好ましくは被検物質の皮膚に対する薬効試験、薬理試験及び安全性試験等といった薬剤評価のために利用可能な実験又は試験ツールとなりうるものを含み、より好ましくは本発明の製造方法により製造された人工皮膚モデルを含む。人工皮膚モデルは、例えば、皮膚に含まれる組織付属器官及び又はそれを構成する細胞等を含んでいてもよい。組織付属器官としては、例えば、血管、リンパ管、脂腺、汗腺、毛、及び毛嚢等が挙げられる。組織付属器官を構成する細胞としては、例えば、血管内皮細胞、リンパ管内皮細胞、免疫細胞、メラニン細胞、樹状細胞、ランゲルハンス細胞、毛胞細胞、毛乳頭細胞、皮脂腺細胞、及び脂肪細胞等が挙げられる。また、人工皮膚モデルは、上記以外のその他の細胞を含んでいてもよい。その他の細胞としては、例えば、癌細胞、癌周辺に存在する又は存在しうる細胞等が挙げられる。
【0017】
本明細書において「被覆細胞」とは、細胞外マトリックス成分を含む被膜と細胞とを含み、その細胞表面が該被膜によって被覆されている細胞をいう。細胞としては、例えば、線維芽細胞、上皮細胞、血管内皮細胞、リンパ管内皮細胞、神経細胞、組織幹細胞、胚性幹細胞、及び免疫細胞等の接着性細胞が挙げられる。細胞は、一種類でもよいし、二種類以上を用いてもよい。
【0018】
本明細書において「真皮組織層」とは、細胞と細胞外マトリックス成分との集合体で構成されるものであって、被覆細胞が三次元に積層されたものをいい、好ましくは皮膚の真皮の形態及び又は環境に類似及び又は模したものをいう。真皮組織層は、上記の組織付属器官及び又はそれを構成する細胞を含んでいてもよい。
【0019】
[人工皮膚モデルの製造方法]
本発明の人工皮膚モデルの製造方法は、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び前記真皮組織層上に表皮細胞を配置して表皮層を形成することを含む。
【0020】
[被覆細胞]
被覆細胞は、細胞の表面に細胞外マトリックス成分を含む被膜を形成することにより調製できる。本明細書において「細胞外マトリックス成分」とは、生体内で細胞の外の空間を充填し、骨格的役割、足場を提供する役割、及び又は生体因子を保持する役割等の機能を果たす生体内物質をいう。また、細胞外マトリックス成分は、さらに、in vitro細胞培養において骨格的役割、足場を提供する役割及び又は生体因子を保持する役割等の機能を果たしうる物質を含んでいてもよい。
【0021】
細胞外マトリックス成分を含む被膜は、形成作業の容易性、厚みの調整の容易性、及び細胞培養効率の観点から、RGD配列を有する第1物質(以下、「第1物質」ともいう)を含む膜と、前記第1物質と相互作用する第2物質(以下、「第2物質」ともいう)を含む膜とを含むことが好ましく、隣接する被覆細胞間の接着性向上の観点から、これらの膜が交互に積層されていることがより好ましい。細胞外マトリックス成分を含む被膜において、隣接する被覆細胞間の接着性向上の観点から、細胞表面に隣接して形成された膜及び又は最外層の膜であることが好ましく、より好ましくは少なくとも最外層の膜が第1物質を含む膜であり、さらにより好ましくは細胞表面に隣接する膜及び最外層の膜が第1物質を含む膜である。第1物質を含む膜は、実質的に第1物質からなる膜であることが好ましく、第2物質を含む膜は、実質的に第2物質からなる膜であることが好ましい。また、RGD配列を有する第1物質は、正の電荷を有する第1物質であってもよく、第1物質と相互作用する第2物質は、負の電荷を有する第2物質であってもよい。
【0022】
(RGD配列を有する第1物質)
RGD配列を有する第1物質とは、細胞接着活性を担うアミノ酸配列である「Arg−Gly−Asp」(RGD)配列をするタンパク質又は高分子をいう。本明細書において「RGD配列を有する」とは、元来RGD配列を有するものでもよいし、RGD配列が化学的に結合されたものでもよい。RGD配列を有する第1物質は、生分解性であることが好ましい。
【0023】
RGD配列を有するタンパク質としては、例えば、従来公知の接着性タンパク質、又はRGD配列を有する水溶性タンパク質等が挙げられる。接着性タンパク質としては、例えば、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、又はコラーゲン等が挙げられる。RGD配列を有する水溶性タンパク質としては、例えば、RGD配列を結合させたコラーゲン、ゼラチン、アルブミン、グロブリン、プロテオグリカン、酵素、又は抗体等が挙げられる。
【0024】
RGD配列を有する高分子としては、例えば、天然由来高分子、又は合成高分子が挙げられる。RGD配列を有する天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、α−ポリリジン又はε−ポリリジン等のポリアミノ酸、キチン又はキトサン等の糖等が挙げられる。RGD配列を有する合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のRGD配列を有するポリマー又は共重合体が挙げられる。ポリマー又は共重合体としては、例えば、ポリウレタン、ポリカーボネート、ポリアミド、又はこれらの共重合体、ポリエステル、ポリ(N−イソプロピルアクリルアミド−co−ポリアクリル酸)、ポリアミドアミンデンドリマー、ポリエチレンオキサイド、ポリε−カプロラクタム、ポリアクリルアミド、又はポリ(メタクリル酸メチル−γ−ポリメタクリル酸オキシエチレン)等が挙げられる。
【0025】
第1物質は、これらの中でも、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、又はキトサンが好ましく、より好ましくはフィブロネクチン、ビトロネクチン、ラミニン、ポリリジン、RGD配列を結合させたコラーゲン、又はRGD配列を結合させたゼラチンである。
【0026】
(相互作用する第2物質)
相互作用する第2物質とは、RGD配列を有する第1物質と相互作用するタンパク質若しくは高分子をいう。本明細書において「相互作用する」とは、例えば、静電的相互作用、疎水性相互作用、水素結合、電荷移動相互作用、共有結合形成、タンパク質間の特異的相互作用、及び又はファンデルワールス力等により、化学的及び又は物理的に第1物質と第2物質とが結合、接着、吸着又は電子の授受が可能な程度に近接することを意味する。相互作用する第2物質は、生分解性であることが好ましい。
【0027】
第1物質と相互作用するタンパク質としては、例えば、コラーゲン、ゼラチン、プロテオグリカン、インテグリン、酵素、又は抗体等が挙げられる。第1物質と相互作用する高分子としては、例えば、天然由来高分子、又は合成高分子が挙げられる。第1物質と相互作用する天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリアミノ酸、エラスチン、ヘパリン、ヘパラン硫酸又はデキストラン硫酸等の糖、及びヒアルロン酸等が挙げられる。ポリアミノ酸としては、例えば、α−ポリリジン又はε−ポリリジン等のポリリジン、ポリグルタミン酸、又はポリアスパラギン酸等が挙げられる。第1物質と相互作用する合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のRGD配列を有するポリマー又は共重合体が挙げられる。ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、又はこれらの共重合体、ポリエステル、ポリアクリル酸、ポリメタクリル酸、ポリエチレングリコール−グラフト−ポリアクリル酸、ポリ(N−イソプロピルアクリルアミド−co−ポリアクリル酸)、ポリアミドアミンデンドリマー、ポリエチレンオキサイド、ポリε−カプロラクタム、ポリアクリルアミド、ポリ(メタクリル酸メチル−γ−ポリメタクリル酸オキシエチレン)等が挙げられる。
【0028】
第2物質は、これらの中でも、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、又はエラスチンが好ましく、より好ましくはゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、又はコラーゲン、さらに好ましくはゼラチン、デキストラン硫酸、ヘパリン、又はヒアルロン酸である。
【0029】
第1物質と第2物質との組み合わせは、特に制限されず、相互作用する異なる物質の組み合わせであればよく、いずれか一方がRGD配列を含む高分子又はタンパク質であり、他方がこれと相互作用する高分子またはタンパク質であればよい。第1物質と第2物質との組み合わせとしては、例えば、フィブロネクチンとゼラチン、フィブロネクチンとε−ポリリジン、フィブロネクチンとヒアルロン酸、フィブロネクチンとデキストラン硫酸、フィブロネクチンとヘパリン、フィブロネクチンとコラーゲン、ラミニンとゼラチン、ラミニンとコラーゲン、ポリリジンとエラスチン、ビトロネクチンとコラーゲン、RGD結合コラーゲン又はRGD結合ゼラチンとコラーゲン又はゼラチン等が挙げられる。中でも、フィブロネクチンとゼラチン、フィブロネクチンとε−ポリリジン、フィブロネクチンとヒアルロン酸、フィブロネクチンとデキストラン硫酸、フィブロネクチンとヘパリン、又はラミニンとゼラチンが好ましく、より好ましくはフィブロネクチンとゼラチンである。なお、第1物質及び第2物質は、それぞれ一種類ずつでもよいし、相互作用を示す範囲で二種類以上をそれぞれ併用してもよい。
【0030】
(正の電荷を有する第1物質)
正の電荷を有する第1物質とは、正の電荷を有するタンパク質又は高分子をいう。正の電荷を有するタンパク質としては、例えば、水溶性タンパク質が好ましい。水溶性タンパク質としては、例えば、塩基性コラーゲン、塩基性ゼラチン、リゾチーム、シトクロムc、ペルオキシダーゼ、又はミオグロビン等が挙げられる。正の電荷を有する高分子としては、例えば、天然由来高分子及び合成高分子が挙げられる。天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリアミノ酸、キチン又はキトサン等の糖等が挙げられる。ポリアミノ酸としては、ポリ(α−リジン)、ポリ(ε−リジン)等のポリリジン、ポリアルギニン、又はポリヒスチジン等が挙げられる。合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のポリマー又は共重合体が挙げられる。前記ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、又はこれらの共重合体、ポリエステル、ポリジアリルジメチルアンモニウムクロライド、ポリアリルアミンハイドロクロライド、ポリエチレンイミン、ポリビニルアミン、又はポリアミドアミンデンドリマー等が挙げられる。
【0031】
(負の電荷を有する第2物質)
負の電荷を有する第2物質とは、負の電荷を有するタンパク質又は高分子をいう。負の電荷を有するタンパク質としては、例えば、水溶性タンパク質が好ましい。水溶性タンパク質としては、例えば、酸性コラーゲン、酸性ゼラチン、アルブミン、グロブリン、カタラーゼ、β−ラクトグロブリン、チログロブリン、α−ラクトアルブミン、又は卵白アルブミン等が挙げられる。負の電荷を有する高分子としては、天然由来高分子及び合成高分子が挙げられる。天然由来高分子としては、例えば、水溶性ポリペプチド、低分子ペプチド、ポリ(βリジン)等のポリアミノ酸、又はデキストラン硫酸等が挙げられる。合成高分子としては、例えば、直鎖型、グラフト型、くし型、樹状型、又は星型等のポリマー又は共重合体が挙げられる。前記ポリマー又は共重合体としては、例えば、ポリウレタン、ポリアミド、ポリカーボネート、及びこれらの共重合体、ポリエステル、ポリアクリル酸、ポリメタクリル酸、ポリスチレンスルホン酸、ポリアクリルアミドメチルプロパンスルホン酸、末端カルボキシ化ポリエチレングリコール、ポリジアリルジメチルアンモニウム塩、ポリアリルアミン塩、ポリエチレンイミン、ポリビニルアミン、又はポリアミドアミンデンドリマー等が挙げられる。
【0032】
正の電荷を有する第1物質と負の電荷を有する第2物質との組み合わせとしては、例えば、ε−ポリリジン塩とポリスルホン酸塩、ε−ポリリジンとポリスルホン酸塩、キトサンとデキストラン硫酸、ポリアリルアミンハイドロクロライドとポリスチレンスルホン酸塩、ポリジアリルジメチルアンモニウムクロライドとポリスチレンスルホン酸塩、又はポリジアリルジメチルアンモニウムクロライドとポリアクリル酸塩等が挙げられ、好ましくはε−ポリリジン塩とポリスルホン酸塩、又はポリジアリルジメチルアンモニウムクロライドとポリアクリル酸塩である。なお、正の電荷を有する第1物質及び負の電荷を有する第2物質は、それぞれ、一種類ずつでもよいし、相互作用を示す範囲で二種類以上をそれぞれ併用してもよい。
【0033】
細胞外マトリックス成分を含む被膜の厚みは、例えば、1nm〜1×103nmが好ましく、より好ましくは2nm〜1×102nm、被覆細胞がより密に積層された真皮組織層が得られるという理由から、3nm〜1×102nmがさらに好ましい。細胞外マトリックス成分を含む被膜の厚みは、例えば、被膜を構成する膜の数によって適宜制御することができる。細胞外マトリックス成分を含む被膜は、特に制限されず、1層であってもよいし、例えば、3、5、7、9、11、13、15層又はそれ以上の多層であってもよい。なお、被膜の厚みは、実施例に記載の方法により求めることができる。
【0034】
被覆細胞は、例えば、細胞を、細胞外マトリックス成分に接触させることにより調製でき、真皮組織層において隣接する被覆細胞間の接着性が向上され、被覆細胞がより密に積層された真皮組織層が得られるという理由から、第1物質と第2物質とに交互に接触させて調製することが好ましい。これにより、細胞表面に、第1物質を含む膜と第2物質とを含む膜が交互に積層された被膜を形成することができる。接触させる順序は、特に制限されず、被覆細胞がより密に積層された真皮組織層が得られるという理由から、最初に第1物質と接触させた後、第2物質と接触させることが好ましく、この順序で第1物質と第2物質とを交互に接触させることがより好ましく、さらに好ましくはこの順序で第1物質と第2物質とを交互に接触させた後、最後に第1物質と接触させることである。
【0035】
以下に、最初に第1物質と接触させた後、第2物質と接触させ、この順序でこれらを交互に接触させる方法を例にとり、被覆細胞の調製方法を説明する。
【0036】
まず、細胞を第1物質と接触させる。これにより、細胞表面に第1物質を含む膜が形成され、細胞表面が第1物質を含む膜によって被覆される。細胞と第1物質との接触は、例えば、第1物質を細胞に塗布又は添加すること、第1物質含有液に細胞を浸漬させること、第1物質含有液を細胞に滴下又は噴霧すること等により行うことができる。中でも、操作が容易であるという理由から、第1物質含有液に細胞を浸漬させることにより、細胞と第1物質とを接触させることが好ましい。
【0037】
接触条件は、例えば、接触方法、第1物質及び又は細胞の種類、及び含有液の濃度等に応じて適宜決定できる。接触時間は、例えば、30秒〜24時間であり、好ましくは1分〜60分、より好ましくは1分〜15分、さらに好ましくは1分〜10分、さらにより好ましくは1分〜5分である。接触時の雰囲気温度及び又は含有液の温度は、例えば、4〜60℃であり、好ましくは20〜40℃、より好ましくは30〜37℃である。
【0038】
第1物質含有液は、第1物質を含んでいればよく、好ましくは第1物質と溶媒又は分散媒体(以下、「溶媒」ともいう)とを含む。第1物質含有液における、第1物質の含有量は、例えば、0.0001〜1質量%が好ましく、より好ましくは0.01〜0.5質量%、さらに好ましくは0.02〜0.1質量%である。溶媒としては、水、リン酸緩衝生理食塩水(PBS)及び緩衝液等の水性溶媒が挙げられる。緩衝液としては、例えば、Tris−HCl緩衝液等のTris緩衝液、リン酸緩衝液、HEPES緩衝液、クエン酸−リン酸緩衝液、グリシルグリシン−水酸化ナトリウム緩衝液、Britton−Robinson緩衝液、又はGTA緩衝液等が挙げられる。溶媒のpHは、特に制限されず、例えば、3〜11であり、好ましくは6〜8、より好ましくは7.2〜7.4である。
【0039】
第1物質含有液は、さらに、塩を含有してもよく、必要に応じて、例えば、細胞成長因子、サイトカイン、ケモカイン、ホルモン、生理活性ペプチド、疾患の治療剤、予防剤、抑制剤、抗菌剤、又は抗炎症剤等の医薬組成物等を含有してもよい。塩としては、例えば、塩化ナトリウム、塩化カルシウム、炭酸水素ナトリウム、酢酸ナトリウム、クエン酸ナトリウム、塩化カリウム、リン酸水素ナトリウム、硫酸マグネシウム、コハク酸ナトリウム等が挙げられる。塩は、一種類でもよいし二種類以上含有していてもよい。第1液及び第2液の双方が塩を含有していてもよいし、いずれか一方が塩を含有していてもよい。第1物質含有液中の塩濃度は、特に制限されないが、例えば、1×10-6M〜2Mであり、好ましくは1×10-4M〜1M、より好ましくは1×10-4M〜0.05Mである。
【0040】
ついで、第1物質を含む膜の形成に使用されなかった第1物質を除去する。第1物質の除去は、細胞と第1物質との接触を第1物質含有液に細胞を浸漬させて行った場合、例えば、遠心分離によって細胞と第1物質含有液とを分離し、上澄みを取り除くことによって行うことができる。これにより、第1物質を含む膜で被覆された細胞を得ることができる。また、第1物質の除去は、例えば、ろ過等によって行ってもよい。
【0041】
第1物質の除去に加えて、上記の溶媒を用いた洗浄を行ってもよい。洗浄は、例えば、遠心分離又はろ過等により行うことができる。遠心分離を用いた方法としては、例えば、上澄みを除去後に溶媒を添加し、遠心分離及び上澄みの除去を行う方法が挙げられる。洗浄に用いる溶媒は、第1物質含有液に用いた溶媒と同じであることが好ましい。
【0042】
ついで、第1物質を含む膜で被覆された細胞を第2物質と接触させる。これにより、第1物質を含む膜表面に第2物質を含む膜が形成され、第1物質を含む膜で被覆された細胞表面が第2物質を含む膜によって被覆される。第2物質との接触は、接触させる物質を第2物質にする以外は、上記の第1物質との接触と同様に行うことができる。
【0043】
第1物質又は第2物質と細胞との接触とを交互に繰り返し行うことにより、細胞表面全体に、第1物質を含む膜と第2物質を含む膜とが交互に積層された細胞外マトリックス成分を含む被膜を形成することができる。第1物質又は第2物質と細胞との接触を行う回数は、例えば、形成する細胞外マトリックス成分を含む被膜の厚み等に応じて適宜決定できる。
【0044】
[真皮組織層]
真皮組織層は、三次元に積層された被覆細胞を含む。真皮組織層の厚み及び真皮組織層において積層される細胞の数(層数)は特に制限されない。真皮組織層において積層される細胞の数(層数)は、例えば、ヒト等の生体組織とより同等の性質及び又は機能を発揮させる観点から、3層以上が好ましく、より好ましくは4層以上、さらに好ましくは5層以上、さらにより好ましくは6層以上である。積層される細胞数の上限は特に制限されないが、例えば、100層以下、50層以下、40層以下、20層以下、又は10層以下等である。
【0045】
真皮組織層の形成は、被覆細胞を培養することにより行う。細胞外マトリックス成分を含む被膜で表面が被覆された被覆細胞を培養することにより、被覆細胞が集積され、さらには細胞外マトリックス成分を含む被膜を介して隣接する被覆細胞同士が接着することにより、被覆細胞が三次元に積層された真皮組織層を形成することができる。
【0046】
被覆細胞の培養は、例えば、基材上に被覆細胞を播種し、一定時間インキュベーションすることにより行う。このインキュベーションにより、細胞外マトリックス成分を含む被膜を介して隣接する被覆細胞が互いに接着し、被覆細胞が三次元に積層されるとともに、隣接する被覆細胞同士の間隔が密になり、緻密な構造の真皮組織層が形成される。インキュベーションの条件は、特に制限されず、細胞に応じて適宜決定できる。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1時間〜168時間、好ましくは3時間〜24時間、より好ましくは3時間〜12時間である。培地は、特に制限されず、細胞に応じて適宜決定でき、例えば、Eagle's MEM培地、Dulbecco's Modified Eagle培地(DMEM)、Modified Eagle培地(MEM)、Minimum Essential培地、RDMI、GlutaMax培地、又は無血清培地等が挙げられる。
【0047】
播種時の被覆細胞の密度は、例えば、形成する真皮組織層に含まれる細胞層数等に応じて適宜決定でき、例えば、1×102個/cm3〜1×109個/cm3であり、好ましくは1×104個/cm3〜1×108個/cm3、より好ましくは1×105個/cm3〜1×107個/cm3である。
【0048】
被覆細胞の培養は、表皮細胞の分化誘導のための気液培養の準備や取扱が容易となるという理由から、メンブレンフィルタ上で行うことが好ましく、より好ましくはメンブレンフィルタを備える培養プレート、さらに好ましくはハウジング部と基底部とを備え、基底部がメンブレンフィルタである培養プレートを用いて行う。ハウジング部は、透明であることが好ましい。該培養プレートは、市販品を使用してもよい。市販品としては、例えば、トランスウェル(登録商標)、セルカルチャーインサート(商品名)等が挙げられる。
【0049】
メンブレンフィルタの孔径は、培養した細胞がメンブレンフィルタ上に保持可能な範囲であれば特に制限されず、例えば、0.1μm〜2μmであり、好ましくは0.4μm〜1.0μmである。また、メンブレンの材質は、例えば、ポリエチレンテレフタレート(PET)、ポリカーボネート、又はポリテトラフルオロエチレン(PTFE)等が挙げられる。
【0050】
このようにして形成された真皮組織層は、例えば、真皮組織層の形成後、例えば、2週間以上、好ましくは3週間以上、より好ましくは4週間以上、さらに好ましくは5週間以上、さらにより好ましくは6週間以上保存した場合であっても細胞の積層構造が保持でき、長期安定性に優れうる。真皮組織層の形成は、1回であってもよいし、複数回繰り返し行ってもよい。複数回繰り返し行うことにより、より多くの細胞が積層された多層の真皮組織層を形成することができる。
【0051】
[表皮層]
表皮層は、真皮組織層上で表皮細胞を培養した後、気液培養して表皮細胞を分化誘導させることによって形成することができる。表皮細胞としては、例えば、表皮角化細胞が使用できる。
【0052】
表皮細胞の培養は、例えば、真皮組織層上に被覆細胞を播種し、一定時間インキュベーションすることが好ましい。インキュベーションの条件は、特に制限されず、細胞に応じて適宜決定できる。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1日〜3日、好ましくは1日〜2日である。
【0053】
培地は、特に制限されず、細胞に応じて適宜決定でき、表皮細胞の増殖に用いられる培地が好ましい。表皮細胞の増殖に用いられる培地としては、例えば、無血清培地が挙げられる。無血清培地としては、例えば、MCDB153培地、EpiLife(登録商標)培地、これらの培地のアミノ酸組成等が改変された培地、又はDulbecco's Modified Eagle培地(DMEM)とハムF-12培地とを所定の割合で混合した培地等が挙げられる。MCDB153培地のアミノ酸組成が改変された培地としては、MCDB153培地のアミノ酸比率を、L−アスパラギン酸(塩)を1.5〜4倍、L−イソロイシン(塩)を22〜26倍、L−グルタミン(塩)を1.5〜3倍、L−グルタミン酸(塩)を1.1〜2倍、L−チロシン(塩)を3〜6倍、L−トリプトファン(塩)を5〜7倍、L−バリン(塩)を0.4〜0.7倍、L−ヒスチジン(塩)を2〜4倍、L−プロリン(塩)を0.4〜0.7倍、L−フェニルアラニン(塩)を4〜7倍、L−メチオニン(塩)を4〜6倍、L−リジン(塩)1.1〜2倍になるようにし、総アミノ酸中のL−グルタミン(塩)の含有量を65重量%以上にしたMCDB153改変培地等がある(例えば、特開2005-269923号公報)。なお、MCDB153培地のアミノ酸組成は表1の通りである。
【0054】
【表1】

【0055】
培地は、例えば、塩類、又はビタミン類等を含んでいてもよい。塩類としては、例えば、塩化カリウム、塩化ナトリウム、塩化マグネシウム、リン酸一水素二ナトリウム等が挙げられる。ビタミン類としては、例えば塩化コリン、シアノコバラミン、ニコチン酸アミド、D−パントテン酸又はその塩、塩酸ピリドキシン又は塩酸ピリドキサール、D−ビオチン、塩酸チアミン、リボフラビン、葉酸、DL−α−リポ酸、又はミオ−イノシトール等が挙げられる。
【0056】
播種時の表皮細胞の密度は、例えば、1×102個/cm2〜1×109個/cm2であり、好ましくは1×104個/cm2〜1×108個/cm2、より好ましくは1×105個/cm2〜1×107個/cm2である。
【0057】
気液培養は、培地を角化培地に培地交換した後、表皮細胞の表面を空気に曝した状態でインキュベーションすることによって行う。インキュベーション温度は、例えば、4〜60℃、好ましくは20〜40℃、より好ましくは30〜37℃である。インキュベーション時間は、例えば、1日〜40日、好ましくは5日〜30日、より好ましくは7日〜10日である。角化培地(重層化培地)は、上記表皮細胞の増殖に用いた培地に、例えば、カルシウム、及び又はウシ胎仔血清を添加した培地等が使用できる。培地のカルシウム濃度は、例えば、約0.4mM〜2.0mMとすることが好ましい。
【0058】
表皮細胞の播種に先立ち、真皮組織層上に細胞外マトリックス成分で形成された膜を形成することが好ましい。これにより、真皮組織層と表皮層との接着性をより向上させることができる。細胞外マトリックス成分で形成された膜は、上記の第1物質含有液と第2物質含有液とを交互に真皮組織層に接触させることにより形成できる。第1物質含有液及び第2物質含有液の接触は、例えば、塗布、浸漬、滴下、又は噴霧等により行うことができる。
【0059】
本発明の人工皮膚モデルの製造方法は、真皮組織層内に組織付属器官を形成することを含んでいてもよい。組織付属器官の形成は、例えば、真皮組織層の形成において、組織付属器官を構成する細胞を、真皮組織層を構成するための被覆細胞(例えば、線維芽細胞等)と混合させて培養すること、あるいは、組織付属器官を構成する細胞を、真皮組織層を構成するための被覆細胞が積層された細胞層間に配置して培養すること等により行うことができる。細胞層間への組織付属器官を構成する細胞の配置は、例えば、被覆細胞が積層された細胞層上に組織付属器官を構成する細胞を配置し、必要に応じて所定の期間培養した後、その上に被覆細胞を配置すること等により行うことができる。このため、本発明の人工皮膚モデルの製造方法は、真皮組織層の形成において、被覆細胞を培養して被覆細胞が積層された細胞層を形成すること、細胞層上に組織付属器官を構成する細胞を配置すること、及び組織付属器官を構成する細胞が配置された細胞層上に被覆細胞を配置し、培養して被覆細胞が積層された細胞層を形成することを含んでいてもよい。
【0060】
組織付属器官として血管及びリンパ管といった網の目のように組織内に形成される器官を形成する場合、組織付属器官の形成は、組織付属器官を構成する細胞を被覆細胞が積層された細胞層で挟んだ状態で培養することにより行うことが好ましい。このように、細胞層間に挟まれた状態で組織付属器官を構成する細胞を培養することにより、ヒトの生体内により近い緻密な血管網又はリンパ管網が形成されうる。組織付属器官として血管を形成する場合、組織付属器官を構成する細胞は血管内皮細胞を使用すればよく、組織付属器官としてリンパ管を形成する場合は、組織付属器官を構成する細胞はリンパ管内皮細胞を使用すればよい。
【0061】
組織付属器官を構成する細胞は、上記のとおりである。また、組織付属器官を構成する細胞に加えて又は替えて、組織付属器官を構成する細胞の幹細胞及び又は前駆細胞を使用してもよい。組織付属器官を構成する細胞は、真皮組織層の形成に用いる被覆細胞と同様に、細胞表面に細胞外マトリックス成分を含む被膜を形成したものを使用してもよいし、表皮層の形成と同様に、被膜を形成することなくそのまま使用してもよい。作業効率の向上の観点からは、細胞表面に細胞外マトリックス成分を含む被膜が形成された細胞が好ましい。播種する細胞の数、及び培養条件等は、組織付属器官を構成する細胞等に応じて適宜決定できる。細胞外マトリックス成分を含む被膜の形成は、上記の被覆細胞と同様に行うことができる。
【0062】
以下に、本発明の人工皮膚モデルの製造方法を、メンブレンフィルタを備えるプレート(セルカルチャーインサート)を基体として用いた形態を例にとり、図面を用いて説明する。図1は、本発明の人工皮膚モデルの製造方法の一例を示す模式図である。
【0063】
まず、細胞外マトリックス成分を含む被膜2で細胞表面3が被覆された被覆細胞1をセルカルチャーインサート4内に播種し、ついでセルカルチャーインサート4が配置されたウェル5内に培地6を添加し、その状態で所定の期間培養を行う。図1(a)に示すように、培養開始初期の時点では、被覆細胞1はセルカルチャーインサート4内の培地6中に分散された状態となっている。培養を行うことにより、被覆細胞1はセルカルチャーインサート4の底面に集積され、隣接する被覆細胞1同士が被膜2を介して接着される。これにより、図1(b)に示すように、被覆細胞1が三次元に積層された真皮組織層7が形成される。
【0064】
ついで、真皮組織層7上に表皮細胞8を播種し(図1(c))、所定の期間培養を行う。この培養を行うことにより、表皮細胞8が、真皮組織層7上に積層された状態で配置される(図1(d))。表皮細胞の播種に先立ち、真皮組織層上に細胞外マトリックス成分を含む膜を形成しておくことが好ましい(図示せず)。これにより、真皮組織層と表皮細胞との接着性を向上させることができる。
【0065】
そして、培地を角化培地9に培地交換し、所定の期間気液培養を行う。気液培養は、例えば、図1(e)に示すように、セルカルチャーインサート4のメンブレンフィルタ部分が気液界面に位置するようにセルカルチャーインサート4をろ紙10が配置された台11上に配置し、その状態でインキュベーションすることにより行うことができる。真皮組織層7上に配置した表皮細胞のうち表面付近に位置する表皮細胞が空気に曝された状態でインキュベーションすることにより、表面の表皮細胞が分化誘導され、角化され角質層13となり表皮層12が形成される(例えば、図1(f))。
【0066】
[人工皮膚モデル]
本発明は、その他の態様として、本発明の製造方法により製造される人工皮膚モデルに関する。本発明の人工皮膚モデルは、細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を含む真皮組織層と、真皮組織層上に形成された表皮層とを含む。本発明の人工皮膚モデルによれば、例えば、実際の皮膚に近い環境で、被検物質の薬効試験、薬理試験及び安全性試験等の評価を行うことができる。また、本発明の人工皮膚モデルは、例えば、火傷や創傷の治療のための被覆材として用いることもできる。
【0067】
表皮層において、例えば、隣接する表皮細胞間にタイトジャンクションが形成されていることが好ましい。表皮層においてタイトジャンクションが形成されていることにより、例えば、TERを測定することによる表皮層のバリア機能等を評価することができる。
【0068】
本発明の人工皮膚モデルは、真皮組織層に形成された組織付属器官を含むことが好ましい。これにより、実際の皮膚により近い環境、被検物質の薬効試験、薬理試験及び又は安全性試験等の評価を行うことができる。
【0069】
真皮組織層において積層される細胞の数は、特に制限されず、ヒト等の皮膚とより同等の性質・機能を発揮させる観点から、3層以上が好ましく、より好ましくは4層以上、さらに好ましくは5層以上、さらにより好ましくは6層以上である。積層される細胞数の上限は特に制限されないが、例えば、100層以下、50層以下、40層以下、20層以下、又は10層以下等である。
【0070】
[評価方法]
本発明は、さらにその他の態様として、本発明の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法に関する。本発明の評価方法によれば、例えば、従来の方法と比較して実際の皮膚に近い環境で被検物質の評価を行うことができるという効果を奏しうる。また、本発明の評価方法は、例えば、新薬の創出(スクリーニング)等における各種分子量の薬物の動態評価、化粧品や医薬部外品等の開発における評価において極めて有用なツールとなりうる。
【0071】
本発明の評価方法は、例えば、被検物質を前記人工皮膚モデルと接触させること、及び、被検物質の接触による刺激に対する応答を測定することにより行うことができる。応答の測定は、例えば、TERを測定すること等によって行うことができる。被検物質は、評価対象となる物質のことをいい、例えば、無機化合物及有機化合物等が挙げられる。
【0072】
[評価キット]
本発明は、さらにその他の態様として、被検物質の刺激性の評価キットに関する。本発明の評価キットは、本発明の人工皮膚モデルを含む。本発明の評価キットによれば、例えば、本発明の評価方法をより簡便に行うことができる。
【0073】
評価キットは、所定の検査に用いる試薬、材料、用具、及び装置、並びに、その評価についての説明書(取扱説明書)の少なくとも1つを含む製品をさらに含んでいてもよい。
【0074】
[人工皮膚モデル製造キット]
本発明は、さらにその他の態様として、人工皮膚モデル製造用キットに関する。本発明の人工皮膚モデル製造用キットは、例えば、細胞外マトリックス成分を含む被膜の形成に用いる試薬、及び本発明の人工皮膚モデルの製造方法が記載された説明書を含むことが好ましい。本発明の人工皮膚モデル製造用キットによれば、より簡便に本発明の人工皮膚モデルを製造することができる。
【0075】
本発明の人工皮膚モデル製造用キットは、さらに、真皮組織層が形成された基材を含んでいてもよい。これにより、真皮組織層が形成された基材を含むことにより、例えば、より簡便に短時間で本発明の人工皮膚モデルを製造することができ、さらには組織付属器官を形成するまでの時間を短縮できる。
【実施例】
【0076】
被覆細胞の被膜の厚み、及び三次元組織の厚みは、以下のように測定した。
[被膜の厚み]
細胞表面に形成された細胞外マトリックス成分を含む被膜の厚みは、別途、基材上に被膜の形成を行い、水晶発振子マイクロバランス(QCM)測定法を用いて、行った処理(ステップ)数と形成される厚みとを測定し、その結果から細胞表面への被膜形成時に行ったステップ数に応じて算出した。QCM測定法を用いた測定は以下のように行った。QCM水晶センサをピランハ溶液で1分間洗浄してから、0.2mg/mLフィブロネクチン(以下、「FN」ともいう)の50mMトリス緩衝液(pH7.4)に37℃で1分間浸漬し、50mMトリス緩衝液(pH7.4)で洗浄して風乾した後、振動数シフトを測定した(ステップ1)。ついで0.2mg/mLゼラチン(以下、「G」ともいう)の50mMトリス緩衝液(pH7.4)に37℃で1分間浸漬し、50mMトリス緩衝液(pH7.4)で洗浄して風乾した後、振動数シフトを測定した(ステップ2)。このステップ1及び2を交互に繰り返すことによりQCM水晶センサに被膜を形成すると共に、振動数シフトの測定を行った。得られた振動数シフトに基づき、ステップの数とそれにより形成される被膜の厚みとを得た。
[三次元組織(真皮組織層)の厚み]
三次元組織の厚みは、三次元組織(真皮組織層)の切片を作製し、作製した切片をヘマトキシリン−エオジン(HE)染色した後、顕微鏡で観察することで測定した。
【0077】
(実験例1)
[播種細胞数と積層細胞数又は収率との関係]
細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を調製し、得られた被覆細胞を培養して被覆細胞が積層された三次元組織を形成した。播種した細胞数と積層される細胞の数との関係、及び収率を評価した。
【0078】
[被覆細胞の調製]
細胞外マトリックス成分を含む被膜として、第1物質を含む膜と第2物質を含む膜とが交互に積層された膜を形成した。第1物質としてフィブロネクチン ウシ血漿由来(商品コード:F4759、シグマアルドリッチ製)、第2物質としてゼラチン(商品コード:077−03155、和光純薬工業社製)、細胞としてヒト線維芽細胞(正常ヒト皮膚線維芽細胞(NHDF)、Cambrex社製)を準備した。
【0079】
5×106個のヒト線維芽細胞に、0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)を1mL加え、37℃で1分間インキュベートした後、2000rpmで2分間遠心分離を行い、上澄みを除去した。ついで、50mMトリス緩衝液(pH7.4)を1mL加えて1分間洗浄した後、2000rpmで2分間の遠心分離を行い、上澄みを除去した。0.2mg/mLゼラチンの50mMトリス緩衝液(pH7.4)を加え、37℃で1分間インキュベートした後、2000rpmで2分間遠心分離を行い、上澄みを除去した。50mMトリス緩衝液(pH7.4)を1mL加えて1分間洗浄した後、2000rpmで2分間の遠心分離を行い、上澄みを除去した。この、フィブロネクチン含有液でのインキュベート、洗浄、ゼラチン含有液でのインキュベート、及び洗浄を1ステップとし、4ステップ行った後、フィブロネクチン含有液でのインキュベート及び洗浄を行った。これにより、5層のフィブロネクチンからなる膜と4層のゼラチンからなる膜とを含み、これらの層が交互に積層された被膜((FN/G)4FN膜)をヒト線維芽細胞表面に形成した。細胞表面に形成された被膜の厚みは、6nmであった。
【0080】
[三次元組織の作製]
まず、6ウェル培養プレートに配置したセルカルチャーインサート(カタログ番号:353090、ベクトンディッキソン社製;ポアサイズ:0.4μm、表面積:4.2cm2)のメンブレンフィルタ上に、(FN/G)4FN膜が形成されたヒト線維芽細胞を1×106個播種し、10重量%ウシ胎仔血清を含むEagle’s MEM培地を添加して37℃で1日培養した。これによりヒト線維芽細胞が8層積層された三次元組織(厚み:35μm)が得られた。
【0081】
播種する細胞の数を0.1×106個、0.5×106個、2×106個、3×106個、4×106個、5×106個、又は10×106個とした以外は、上記と同様の条件で培養を行い、三次元組織を作製した。得られた三次元組織に基づき、播種した細胞数と、積層される細胞の層数及び収率との関係を下記表2及び図2に示す。なお、収率(%)は、得られた三次元組織から回収された生細胞数と播種細胞数とに基づき下記式から算出した。
収率(%)=(三次元組織から回収された生細胞数/播種細胞数)×100
三次元組織からの細胞の回収及び生細胞数の計測は、下記のように行った。まず、得られた三次元組織に、0.1%トリプシンを含むPBSを1mL添加し、5分程度静置して細胞を単離した後、遠心分離により回収した。回収された細胞に、3%トリパンブルーを含むPBSを添加し、位相差顕微鏡にて血球計を用いて生細胞の数を計測した。
【0082】
【表2】

【0083】
図2Aは、播種した細胞数と積層された細胞の層数との関係を示すグラフであり、図2Bは、播種した細胞数と収率との関係を示すグラフである。表2及び図2Aに示すように、播種した細胞の数が2×106個以下の範囲では、播種した細胞の数に応じて積層されて形成される細胞層の数が増加した。また、表2及び図2Bに示すように、播種した細胞の数が3×106個以下の範囲では、90%以上の収率を示した。
【0084】
(実験例2)
[三次元組織構造の安定性]
実験例1と同様にして被覆細胞の準備及び三次元組織の作製を行い、NHDFが1層、2層又は5層積層された三次元組織を作製した。得られた三次元組織を、10%ウシ胎仔血清を含むDMEM培地で37℃で28日間培養し、三次元組織中のDNA量及び三次元組織の厚みを測定した。その結果を図3に示す。なお、DNA量は、DNeasy Blood&Tissue Kit(商品名、QIAGEN製)で測定した。
【0085】
図3Aは、培養日数とDNA量との関係を示すグラフであり、図3Bは、培養日数と三次元組織の厚みとの関係を示すグラフである。図3A及びBにおいて、三角のマーカーが1層のNHDF層を含む三次元組織の結果を示し、四角のマーカーが2層のNHDF層を含む三次元組織の結果を示し、丸のマーカーが5層のNHDF層を含む三次元組織の結果を示す。図3A及びBに示すように、三次元組織を製造してから1ヶ月経過しても、細胞の積層構造が保持されていることが確認された。
【0086】
(実施例1)
NHDFが8層積層された真皮組織層上に表皮層が形成された人工皮膚モデルを作製した。
【0087】
[真皮組織層の形成]
播種する(FN/G)4FN膜が形成されたNHDFの数を2×106個とした以外は、実験例1と同様の条件で培養を1日行い、NHDFが8層積層された真皮組織層を形成した。
【0088】
[表皮層の形成]
得られた真皮組織層の表面に、0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)と0.2mg/mLゼラチンの50mMトリス緩衝液(pH7.4)とを交互にそれぞれ4回添加した後、さらに0.2mg/mLフィブロネクチンの50mMトリス緩衝液(pH7.4)を添加し、(FN/G)4FN膜を形成した。(FN/G)4FN膜が形成された真皮組織層表面にケラチノサイト(KC)を6×105個を播種し、37℃で2日間培養した。ついで、培地を角化培地(重層化培地)に交換し、セルカルチャーインサートのメンブレンフィルタが角化培地の気液界面に位置するようにセルカルチャーインサートを配置した。その状態で10日間気液培養することにより分化誘導を行い、人工皮膚モデルを作製した。気液培養は37℃で行った。また、培養開始から1日ごとに培地交換を行った。
【0089】
得られた人工皮膚モデル及びその分化誘導(播種して2日間培養)前の三次元培養体をそれぞれHE染色し、それを顕微鏡観察して得られた写真を図4に示す。図4Aは分化誘導前の顕微鏡写真であり、図4Bは得られた人工皮膚モデルの顕微鏡写真である。図4Bに示すように、本発明の方法により、NHDFが積層された真皮組織層と、その表面に形成された表皮層とを含む人工皮膚モデルを作製することができた。
【0090】
(実施例2)
真皮組織層形成において、播種するNHDFの数を1×106個とし、真皮組織層において積層されるNHDFの層数を4層とした以外は、実施例1と同様にして人工皮膚モデルを作製した。得られた人工皮膚モデル及びその分化誘導前(播種して2日間培養)のHE染色後の顕微鏡写真を図5に示す。図5Aは分化誘導前の顕微鏡写真であり、図5Bは人工皮膚モデルの顕微鏡写真である。
【0091】
(実施例3)
真皮組織層形成において、播種するNHDFの数を0.5×106個とし、真皮組織層において積層されるNHDFの層数を2層とした以外は、実施例1と同様にして人工皮膚モデルを作製した。得られた人工皮膚モデル及びその分化誘導前(播種して2日間培養)のHE染色後の顕微鏡写真を図6に示す。図6Aは分化誘導前の顕微鏡写真であり、図6Bは人工皮膚モデルの顕微鏡写真である。
【0092】
(比較例1)
コラーゲンゲルを支持体として使用し、コラーゲンゲル上に表皮層を形成して培養皮膚を作成した。まず、Cell matrix type I−A(新田ゼラチン製と20%ウシ胎仔血清とを含むDMEM溶液(溶液I)を作製し、約0.25mLをセルカルチャーインサートに注ぎ、インキュベーターに5分間静置した。5×105個/mLの濃度でNHDFを添加した溶液Iを約0.75mL、上記セルカルチャーインサートに加え、インキュベーターに30分間静置してゲル化した。ついで、NHDFを含むコラーゲンゲルを、アスコルビン酸を含むDMEMにて5日間培養した後、コラーゲンゲル表面に実施例1と同様の方法でケラチノサイトを播種接着させ、分化誘導して培養皮膚を得た。得られた培養皮膚の写真を図7に示す。
【0093】
コラーゲンゲルを支持体として使用して表皮層を形成した場合、図7に示すように、コラーゲンゲルの収縮に起因して、セルカルチャーインサート外縁部におけるコラーゲンゲルの剥離や、コラーゲンゲル上に表皮細胞が存在していない部分が観察された。これに対し、本発明の方法は、支持体としてコラーゲンゲルを使用しないため、コラーゲンゲルの収縮に起因する細胞の偏りが生じることもなく、細胞が均一に配置された人工皮膚モデルを作製することができた。
【0094】
(参考例1)
真皮組織層を形成することなく、セルカルチャーインサートのメンブレンフィルタ上に、ケラチノサイトを6×105個を播種した以外は、実施例1と同様にして表皮層を形成した。得られた培養皮膚及びその分化誘導前(播種して2日間培養)ののHE染色後の顕微鏡写真を図8に示す。図8Aは分化誘導前の顕微鏡写真であり、図8Bは人工皮膚モデルの顕微鏡写真である。
【0095】
(実施例4)
[バリア機能の評価]
実施例1〜3の人工皮膚モデル、並びに比較例1及び参考例1の培養皮膚について、経皮電気抵抗(TER)を測定することによりバリア機能の評価を行った。
【0096】
人工皮膚モデル又は培養皮膚が配置されたセルカルチャーインサートを、リン酸緩衝溶液(pH7.4)を添加されたウェル内に配置した。セルカルチャーインサートの内部と外部(ウェル内)にそれぞれ電極を配置し、電極間に電圧をかけることによって抵抗を測定し、得られた抵抗値をTER(Ω)とした。なお、得られた人工皮膚モデル及び培養皮膚の培養は、角化培地で37℃で行った。TERの測定は、培養開始から1日ごとに行った。その結果を図9のグラフに示す。
【0097】
図9Aは、人工皮膚モデル又は培養皮膚の培養日数とTERとの関係を示すグラフであり、図9Bは、真皮組織層におけるNHDFの層数とTERとの極大日との関係を示すグラフである。図9Aにおいて、ひし形のマーカーが実施例1(NHDF8層+KC)、四角のマーカーが実施例2(NHDF4層+KC)、三角のマーカーが実施例3(NHDF2層+KC)、バツのマーカーが参考例1(KCのみ)、丸のマーカーが比較例1(コラーゲンゲル+KC)の結果を示す。図9Aに示すように、実施例1〜3の人工皮膚モデルは、コラーゲンゲル上に表皮層が形成された比較例1の培養皮膚に比べてTERが高かった。このことから、実施例1〜3の人工皮膚モデルは、表皮層において隣接する表皮細胞間にタイトジャンクションが形成されているといえる。したがって、本発明によれば、皮膚のバリア機能を評価可能な人工皮膚モデルを提供できうることが示唆された。
【0098】
また、図9Bに示すように、真皮組織層におけるヒト皮膚繊維芽細胞の層数の増加に伴い、TERの極大日が増加した。このことから、真皮組織層に積層するヒト皮膚繊維芽細胞の層数を増加させることにより、生体皮膚のターンオーバー(分化時間、28日)に近づくことが示唆された。
【0099】
なお、真皮組織層のみの三次元組織では、積層されたNHDFの層数に関らずTERはほとんど0であった(date not shown)。
【0100】
(実施例5)
血管網を含む人工皮膚モデルを作製した。血管内皮細胞としては、ヒト臍帯静脈内皮細胞(HUVEC)を使用した。
【0101】
まず、(FN/G)4FN被膜が形成されたNHDFと、(FN/G)4FN被膜が形成されたHUVECを準備した。(FN/G)4FN被膜が形成されたHUVECは、NHDFに替えて、HUVECを使用した以外は、実験例1と同様の手順でHUVEC表面に(FN/G)4FN被膜を形成した。なお、(FN/G)4FN被膜が形成されたNHDFは、緑色蛍光色素(商品名:Cell TrackerTM Green Fluorescent Probe、製品コード:PA−3011、タカラバイオ製、)で着色した。
【0102】
つぎに、(FN/G)4FN被膜が形成されたNHDFを1×106個播種し、実験例1と同様にして37℃で1日間培養し、NHDFが4層積層された第1の真皮組織層を形成した。得られた第1の真皮組織層の表面に、実施例1の表皮層の形成と同様にして、(FN/G)4FN膜を形成し、その上に(FN/G)4FN被膜が形成されたHUVECを2×105個播種した。37℃で1日間培養し、真皮組織層上にHUVEC層を1層形成した。HUVEC層表面に、実施例1の表皮層の形成と同様にして、(FN/G)4FN膜を形成し、その上に(FN/G)4FN被膜が形成されたNHDFを1×106個播種し、実験例1と同様にして37℃で1日間培養し、NHDFが4層積層された第2の真皮組織層を形成した。そして、第2の真皮組織層表面に、実施例1と同様にして表皮層を形成した。表皮層を形成後、角化培地中で37℃で7日間培養し、人工皮膚モデルを得た。ついで、得られた人工皮膚モデルについてmonoclocal mouse anti-human CD31抗体(製品コード:JC70A、Dako製)とGoat anti-mouse Alexa Fluor546-conjugated IgG抗体(製品コード:A11001、Invitrogen製)とを用いたHUVECに対する免疫染色を行った。
【0103】
得られた人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例を図10に示す。図10は、得られた人工皮膚モデルのCLSM画像であって、図10Aは、赤で染色されたHUVECの画像であり、図10Bは、緑で染色されたNHDFの画像である。
【0104】
HUVEC層を第1の真皮組織層と第2の真皮組織層との間にはさみこんだ状態で培養を行うことにより、培養前には、敷石状の形態で第1の真皮組織層表面に位置していたHUVEC由来の細胞が、キャピラリー状に形態変化した。さらに7日間の培養を行うことによって、HUVEC由来の細胞が、チューブ構造を形成するようになり、かつそれらが連結することによって、図10に示すように、人工皮膚モデル内にチューブ構造を有する血管網が形成された。また、形成された血管網は、緻密であり、人工皮膚モデルを横方向(平面方向)に切断した断面で観察した場合、その面において血管網が占める面積の割合は45〜60%程度であり、互いに隣接する血管網の間隔は50〜100μmであった。
【0105】
また、HUVEC層を真皮組織層間にはさみこんだ状態で培養を行うことにより、HUVECとNHDFとを混合した状態で培養した場合と比較して、非常に緻密な血管網が形成されることが確認できた(date not shown)。
【0106】
(実施例6)
ヒト臍帯静脈内皮細胞(HUVEC)に替えてリンパ管内皮細胞(LEC)を用いた以外は、実施例5と同様にして、リンパ管網を含む人工皮膚モデルを作製した。
【0107】
得られた人工皮膚モデルの共焦点レーザー走査顕微鏡(CLSM)画像の一例を図11に示す。図11は、得られた人工皮膚モデルのCLSM画像であって、図11Aは、赤で染色されたLECの画像であり、図11Bは、緑で染色されたNHDFの画像である。
【0108】
HUVECを用いた実施例5と同様に、LECを用いた場合においても、LEC層を第1の真皮組織層と第2の真皮組織層との間にはさみこんだ状態で培養を行うことにより、培養前には、敷石状の形態で第1の真皮組織層表面に位置していたLEC由来の細胞が、キャピラリー状に形態変化し、さらに7日間の培養を行うことによって、図11に示すように、人工皮膚モデル内にチューブ構造を有するリンパ管網が形成された。
【0109】
実施例5及び6の結果から、血管網やリンパ管等の組織付属器官を含む、より生体の皮膚に近い新たな人工皮膚モデルを提供できることが示唆された。
【産業上の利用可能性】
【0110】
本発明によれば、被検物質の透過性や、それに伴う微小応答等が評価可能な人工皮膚モデルを提供できる。このため、本発明は、例えば、化粧品、医薬、製薬等の分野において有用である。
【特許請求の範囲】
【請求項1】
細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、
前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、
前記真皮組織層上に表皮細胞を配置して表皮層を形成すること、を含む、人工皮膚モデルの製造方法。
【請求項2】
前記被覆細胞の準備は、細胞を、RGD配列を有する第1物質と、前記第1物質と相互作用する第2物質とに交互に接触させ、前記細胞表面に前記第1物質を含む被膜と前記第2物質を含む被膜とを含む細胞外マトリックス成分を含む被膜を形成することを含む、請求項1記載の製造方法。
【請求項3】
前記第1物質は、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、及びキトサンからなる群から選択され、前記第2物質は、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、及びエラスチンからなる群から選択される、請求項2記載の製造方法。
【請求項4】
前記真皮組織層内に、組織付属器官を形成することを含む、請求項1から3のいずれかに記載の製造方法。
【請求項5】
前記真皮組織層の形成は、前記被覆細胞を培養して前記被覆細胞が積層された細胞層を形成すること、前記細胞層上に組織付属器官を構成する細胞を配置すること、及び前記組織付属器官を構成する細胞が配置された細胞層上に前記被覆細胞を配置し、培養して前記被覆細胞が積層された細胞層を形成することを含む、請求項1から4のいずれかに記載の製造方法。
【請求項6】
前記真皮組織層の形成は、前記被覆細胞が少なくとも2層以上積層されるように、前記被覆細胞を配置することを含む、請求項1から5のいずれかに記載の製造方法。
【請求項7】
細胞外マトリックス成分と積層された細胞とを含む真皮組織層と、
前記真皮組織層上に形成された表皮層とを含み、
請求項1から6のいずれかに記載の製造方法により製造される人工皮膚モデル。
【請求項8】
前記表皮層において、隣接する表皮細胞間にタイトジャンクションが形成されている、請求項7記載の人工皮膚モデル。
【請求項9】
前記真皮組織層に形成された組織付属器官を含む、請求項7又は8に記載の人工皮膚モデル。
【請求項10】
請求項7から9のいずれかに記載の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法であって、
前記被検物質を前記人工皮膚モデルと接触させること、及び、
前記被検物質の接触による刺激に対する応答を測定することを含む、評価方法。
【請求項11】
被検物質の刺激性の評価キットであって、請求項7から9のいずれかに記載の人工皮膚モデルを含む、評価キット。
【請求項1】
細胞外マトリックス成分を含む被膜で細胞の表面が被覆された被覆細胞を準備すること、
前記被覆細胞を培養し、前記被覆細胞が積層された真皮組織層を形成すること、及び、
前記真皮組織層上に表皮細胞を配置して表皮層を形成すること、を含む、人工皮膚モデルの製造方法。
【請求項2】
前記被覆細胞の準備は、細胞を、RGD配列を有する第1物質と、前記第1物質と相互作用する第2物質とに交互に接触させ、前記細胞表面に前記第1物質を含む被膜と前記第2物質を含む被膜とを含む細胞外マトリックス成分を含む被膜を形成することを含む、請求項1記載の製造方法。
【請求項3】
前記第1物質は、フィブロネクチン、ビトロネクチン、ラミニン、カドヘリン、ポリリジン、エラスチン、RGD配列を結合させたコラーゲン、RGD配列を結合させたゼラチン、キチン、及びキトサンからなる群から選択され、前記第2物質は、ゼラチン、デキストラン硫酸、ヘパリン、ヒアルロン酸、グロブリン、アルブミン、ポリグルタミン酸、コラーゲン、及びエラスチンからなる群から選択される、請求項2記載の製造方法。
【請求項4】
前記真皮組織層内に、組織付属器官を形成することを含む、請求項1から3のいずれかに記載の製造方法。
【請求項5】
前記真皮組織層の形成は、前記被覆細胞を培養して前記被覆細胞が積層された細胞層を形成すること、前記細胞層上に組織付属器官を構成する細胞を配置すること、及び前記組織付属器官を構成する細胞が配置された細胞層上に前記被覆細胞を配置し、培養して前記被覆細胞が積層された細胞層を形成することを含む、請求項1から4のいずれかに記載の製造方法。
【請求項6】
前記真皮組織層の形成は、前記被覆細胞が少なくとも2層以上積層されるように、前記被覆細胞を配置することを含む、請求項1から5のいずれかに記載の製造方法。
【請求項7】
細胞外マトリックス成分と積層された細胞とを含む真皮組織層と、
前記真皮組織層上に形成された表皮層とを含み、
請求項1から6のいずれかに記載の製造方法により製造される人工皮膚モデル。
【請求項8】
前記表皮層において、隣接する表皮細胞間にタイトジャンクションが形成されている、請求項7記載の人工皮膚モデル。
【請求項9】
前記真皮組織層に形成された組織付属器官を含む、請求項7又は8に記載の人工皮膚モデル。
【請求項10】
請求項7から9のいずれかに記載の人工皮膚モデルを用いた被検物質の皮膚に対する刺激性を評価する方法であって、
前記被検物質を前記人工皮膚モデルと接触させること、及び、
前記被検物質の接触による刺激に対する応答を測定することを含む、評価方法。
【請求項11】
被検物質の刺激性の評価キットであって、請求項7から9のいずれかに記載の人工皮膚モデルを含む、評価キット。
【図1】


【図2】


【図3】


【図9】


【図4】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】




【図2】


【図3】


【図9】


【図4】


【図5】


【図6】


【図7】


【図8】


【図10】


【図11】


【公開番号】特開2012−205516(P2012−205516A)
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願番号】特願2011−72207(P2011−72207)
【出願日】平成23年3月29日(2011.3.29)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願日】平成23年3月29日(2011.3.29)
【出願人】(504176911)国立大学法人大阪大学 (1,536)
【出願人】(000002141)住友ベークライト株式会社 (2,927)
【出願人】(504147254)国立大学法人愛媛大学 (214)
【Fターム(参考)】
[ Back to top ]

