人造ポリペプチド極細繊維及びその製造方法
【課題】単繊維直径の細い人造ポリペプチド極細繊維及びその製造方法を提供する。
【解決手段】本発明の人造ポリペプチド極細繊維は、天然クモ糸タンパク質に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、極細繊維の単繊維の平均直径が1μm以下であり、極細繊維自体の絡み合いによりシートを構成している。この繊維の製造方法は、紡糸液(2)は溶媒により前記ポリペプチドを溶解させたものであり、紡糸液(2)を、電圧をかけた口金(3)からエレクトロスピニングにより吐出させて繊維形成し、繊維(7)から溶媒を脱離させて人造ポリペプチド繊維を得る。
【解決手段】本発明の人造ポリペプチド極細繊維は、天然クモ糸タンパク質に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、極細繊維の単繊維の平均直径が1μm以下であり、極細繊維自体の絡み合いによりシートを構成している。この繊維の製造方法は、紡糸液(2)は溶媒により前記ポリペプチドを溶解させたものであり、紡糸液(2)を、電圧をかけた口金(3)からエレクトロスピニングにより吐出させて繊維形成し、繊維(7)から溶媒を脱離させて人造ポリペプチド繊維を得る。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は合成タンパク質繊維の一種である人造ポリペプチド極細繊維及びその製造方法に関する。
【背景技術】
【0002】
クモ糸繊維は、高い強度とタフネスを有する繊維であり、高張力鋼、ナイロン6繊維、アラミド繊維、炭素繊維などよりも高い強度とタフネスを有することが知られている。加えて、石油を原料とせず、原料をバイオマス化できる利点もある。人工クモ糸繊維もいくつか提案されており、例えば特許文献1には合成タンパク質紡糸溶液を、湿式紡糸し、90%メタノールからなる凝固浴中に押し出して繊維とすることが提案されている。特許文献2には湿式紡糸し、200MPaまたはそれ以上の引張強度を有する本繊維が提案されている。非特許文献1には、湿式紡糸し、メタノール浴と水浴で延伸倍率5倍により強度1.91〜2.26g/d、伸度43.4〜59.6%の延伸糸が開示されている。非特許文献2には湿式紡糸し、延伸倍率を5倍とすることにより応力600MPa、伸度25%の延伸糸が開示されている。非特許文献3には、湿式紡糸した未延伸糸をスチーム中に5分間滞留させて5倍に延伸させることにより応力280〜350MPa、伸度30〜40%の延伸糸が開示されている。
【0003】
しかし、従来の人工クモ繊維は湿式紡糸によって製造されており、湿式紡糸法では、極細繊維を得ることは困難であり、とりわけ直径8μm(単繊維繊度で約1deci tex)以下の繊維を安定して得ることは困難であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2004−503204号公報
【特許文献2】特表2009−521921号公報
【非特許文献】
【0005】
【非特許文献1】Anthoula Lazaris,et.al.,"Spider Silk Fiber Spun from Soluble Recombinant Silk Produced in Mammalian Cells",Science,295,p472,2002年1月18日
【非特許文献2】Xiao-Xia Xia,et.al.,"Native-sized recombinant spider silk protein produced in metabolically engineered Escherichia coil results in a strong fiber",PNAS,vol.107,No.32,p14059-14063,2010年8月10日
【非特許文献3】M. Elice,et.al.,"Bioinspired Fibers Follow the Track of Natural Spider Silk",Macromolecules,Vol. 44,No.5,p1166-1176,2011年4月2日
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は前記従来の問題を解決するため、単繊維直径の細い人造ポリペプチド極細繊維及びその製造方法を提供する。
【課題を解決するための手段】
【0007】
本発明の人造ポリペプチド極細繊維は、天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、前記極細繊維の単繊維の平均直径が1μm以下であり、前記極細繊維自体の絡み合いによりシートを構成していることを特徴とする。
【0008】
本発明の人造ポリペプチド極細繊維の製造方法は、天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドを含む紡糸液をエレクトロスピニングして得られる前記の人造ポリペプチド極細繊維の製造方法であって、前記紡糸液は溶媒により前記ポリペプチドを溶解させたものであり、前記紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、前記繊維から溶媒を脱離させて人造ポリペプチド繊維を得ることを特徴とする。
【発明の効果】
【0009】
本発明は、天然クモ糸タンパク質に由来するポリペプチドを溶媒に溶解させた紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、前記繊維から溶媒を脱離させることにより、湿式紡糸法では得ることができない極細繊維を得ることができる。
【図面の簡単な説明】
【0010】
【図1】図1は本発明の一実施例のエレクトロスピニング装置の説明図である。
【図2】図2は本発明の別の実施例のエレクトロスピニング装置の説明図である。
【図3】図3は本発明の実施例1で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線である。
【図4】図4は本発明の実施例2で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線である。
【図5】図5は本発明の実施例2で得られた人造ポリペプチド極細繊維シートの走査型電子顕微鏡(SEM)写真である。
【発明を実施するための形態】
【0011】
(1)ポリペプチド
本発明においては、原料として天然型クモ糸タンパク質に由来するポリペプチドを用いる。前記ポリペプチドは、天然型クモ糸タンパク質に由来するものであればよく、特に限定されない。前記ポリペプチドは、強靭性に優れるという観点からクモの大瓶状線で産生される大吐糸管しおり糸タンパク質に由来するポリペプチドであることが好ましい。前記大吐糸管しおり糸タンパク質としては、アメリカジョロウグモ(Nephila clavipes)に由来する大瓶状線スピドロインMaSp1やMaSp2、二ワオニグモ(Araneus diadematus)に由来するADF3やADF4などが挙げられる。前記大吐糸管しおり糸タンパク質に由来するポリペプチドは、大吐糸管しおり糸タンパク質の変異体、類似体又は誘導体などを含む。
【0012】
前記大吐糸管しおり糸タンパク質に由来するポリペプチドとしては、式1:REP1−REP2(1)で示されるアミノ酸配列の単位を2以上、好ましくは5以上、より好ましくは10以上含むポリペプチドが挙げられる。或いは、前記大吐糸管しおり糸タンパク質に由来するポリペプチドは、式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列であるポリペプチドであってもよい。なお、前記大吐糸管しおり糸タンパク質に由来するポリペプチドにおいて、式(1):REP1−REP2(1)で示されるアミノ酸配列の単位は、同一であってもよく、異なっていてもよい。上記大吐糸管しおり糸タンパク質に由来するポリペプチドは、大腸菌等の微生物を宿主とした組み換えタンパク質生産を行う場合、生産性の観点から、分子量が500kDa以下であることが好ましく、より好ましくは300kDa以下であり、さらに好ましくは200kDa以下である。
【0013】
前記式(1)において、REP1は、ポリアラニンを意味しており、アラニンが連続して2〜20残基、より好ましくは3〜16残基、さらに好ましくは4〜12残基、最も好ましくは5〜8残基並んでいるアミノ酸配列である。前記式(1)において、REP2は、10〜200残基のアミノ酸からなるアミノ酸配列であり、前記アミノ酸配列中に含まれるグリシン、セリン、グルタミン及びアラニンの合計残基数がアミノ酸残基数全体に対して40%以上、好ましくは60%以上、より好ましくは70%以上である。
【0014】
大吐糸管しおり糸において、上記REP1は、繊維内で結晶βシートを形成する結晶領域に該当し、上記REP2は、繊維内でより柔軟性があり大部分が規則正しい構造を欠いている無定型領域に該当する。そして、上記[REP1−REP2]は、結晶領域と無定型領域からなる繰り返し領域(反復配列)に該当し、しおり糸タンパク質の特徴的配列である。
【0015】
配列番号1に示されるアミノ酸配列は、ADF3(GI:1263287)のアミノ酸配列のC末端の50残基のアミノ酸からなるアミノ酸配列と同一であり、配列番号2に示されるアミノ酸配列は、配列番号1に示されるアミノ酸配列のC末端から20残基取り除いたアミノ酸配列と同一であり、配列番号3に示されるアミノ酸配列は、配列番号1に示されるアミノ酸配列のC末端から29残基取り除いたアミノ酸配列と同一である。
【0016】
前記式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列からなるポリペプチドとしては、例えば、配列番号4に示されるアミノ酸配列からなるポリペプチドを用いることができる。配列番号4に示されるアミノ酸配列からなるポリペプチドは、N末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ(Human rhinovirus 3Cプロテアーゼ)認識サイトからなるアミノ酸配列(配列番号5)を付加したADF3のアミノ酸配列において、第1〜13番目の反復領域をおよそ2倍になるように増やすとともに、翻訳が第1154番目アミノ酸残基で終止するように変異させたものである。配列番号4に示されるアミノ酸配列からなるポリペプチドにおいて、C末端配列は、配列番号3に示すアミノ酸配列と同一である。
【0017】
また、前記式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列からなるポリペプチドとしては、配列番号4に示されるアミノ酸配列において1若しくは複数個のアミノ酸が置換、欠失、挿入及び/又は付加されたアミノ酸配列からなり、結晶領域と無定型領域からなる繰り返し領域を有するタンパク質を用いることができる。本発明において、「1若しくは複数個」とは、例えば、1〜40個、1〜35個1〜30個、1〜25個、1〜20個、1〜15個、1〜10個、又は1若しくは数個を意味する。また、本発明において、「1若しくは数個」は、1〜9個、1〜8個、1〜7個、1〜6個、1〜5個、1〜4個、1〜3個、1〜2個、又は1個を意味する。
【0018】
配列番号9に示されるアミノ酸配列からなるポリペプチド(以下において、ADF3kai−Fと記す。)は、ADF3のアミノ酸配列(GI:1263287)のN末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ認識サイトからなるアミノ酸配列(配列番号5)が付加され、C末端から29個のアミノ酸残基が削除され、すなわちC末端に配列番号10に示されるアミノ酸配列が配置されたアミノ酸配列(配列番号7)において、第22、31及び32番目のGlnがLysに置換され、第26番目のアルギニン(Arg)がLysに置換されたものである。
【0019】
前記ポリペプチドは、ポリペプチドをコードする遺伝子を含有する発現ベクターで形質転換した宿主を用いて製造することができる。遺伝子の製造方法は特に制限されず、天然型クモ糸タンパク質をコードする遺伝子をクモ由来の細胞からポリメラーゼ連鎖反応(PCR)などで増幅しクローニングするか、若しくは化学的に合成する。遺伝子の化学的な合成方法も特に制限されず、例えば、NCBIのウェブデータベースなどより入手した天然型クモ糸タンパク質のアミノ酸配列情報をもとに、AKTA oligopilot plus 10/100(GEヘルスケア・ジャパン株式会社)などで自動合成したオリゴヌクレオチドをPCRなどで連結して合成することができる。この際に、タンパク質の精製や確認を容易にするため、上記のアミノ酸配列のN末端に開始コドン及びHis10タグからなるアミノ酸配列を付加したアミノ酸配列からなるタンパク質をコードする遺伝子を合成してもよい。上記発現ベクターとしては、DNA配列からタンパク質を発現し得るプラスミド、ファジー、ウイルスなどを用いることができる。上記プラスミド型発現ベクターとしては、宿主細胞内で目的の遺伝子が発現し、かつ自身が増幅することのできるものであればよく、特に限定されない。例えば宿主として大腸菌Rosetta(DE3)を用いる場合は、pET22b(+)プラスミドベクター、pColdプラスミドベクターなどを用いることができる。中でも、タンパク質の生産性の観点から、pET22b(+)プラスミドベクターを用いることが好ましい。上記宿主としては、例えば動物細胞、植物細胞、微生物などを用いることができる。
【0020】
(2)紡糸液
紡糸液(ドープ液)は、前記ポリペプチドに溶媒を加え、紡糸できる粘度に調整して作成する。例えば前記ポリペプチドがニワオニグモに由来する場合、溶媒は前記ポリペプチドを溶解することができるものであればどのようなものでも良い。一例としてヘキサフルオロイソプロパノール(HFIP)、ヘキサフルオロアセトン(HFA)、蟻酸、尿素、グアニジン、ドデシル硫酸ナトリウム(SDS)、臭化リチウム、塩化カルシウム、チオシアン酸リチウム等を含む水溶液等などを溶媒とし、適量加えて溶液粘度を100〜10,000cP(センチポイズ)とする。これを紡糸液とする。アルカリ金属ハロゲン化物は、LiCl,NaCl等がある。
【0021】
(3)エレクトロスピニング
エレクトロスピニング法(静電紡糸法)は、供給側電極(紡糸口金と兼用できる)と捕集側電極(例えば金属ロール又は金属ネット等)間に電圧を印加し、紡糸口金から押し出したドープ液に電荷を与えて捕集側電極に吹き飛ばす。この際にドープ液は伸張されて繊維形成される。本発明において、好ましい印加電圧は、5〜100kVであり、さらに好ましくは10〜50kVである。電圧が5kV未満であると、雰囲気中の空間(電極間)において電極間の抵抗があるため、電子の流れが悪くなり、ドープ液が帯電しにくくなる。また、100kVを超えると、電極間でスパークがおこり、ドープ液に引火する恐れがある。電極間距離は1〜25cmが好ましく、さらに好ましくは2〜20cmである。電極間距離が1cm未満であると電極間でスパークが起こりやすくなり、ドープ液に引火する恐れがあり、25cmを超えると、電極間の抵抗が高くなり、電子の流れが妨げられ、ドープ液が帯電しにくくなる。
【0022】
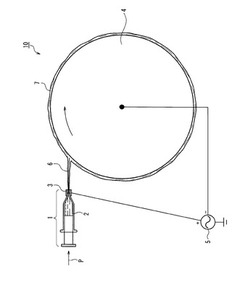
図1は本発明の一実施例のエレクトロスピニング装置10の説明図である。まず金属製口金ノズル3と金属製ロール4との間に電源5により電圧をかけておく。マイクロシリンジ1内にドープ液2を入れておき、シリンジポンプを用いて矢印P方向に移動させ、金属製口金ノズル3からドープ液2を押し出し、電荷によってドープ液を吹き飛ばし繊維状物6にして金属ロール4の表面に堆積すると同時に巻き上げる。7は巻き上げられたシート状(不織布状)極細繊維である。シート状(不織布状)極細繊維は、次に溶媒を脱離する。溶媒を脱離する方法は、減圧乾燥又は脱溶媒槽への浸漬であることが好ましい。
【0023】
図2は本発明の別の実施例のエレクトロスピニング装置20の説明図である。図1と異なる点は、捕集側電極として金属ネット8を使用した点である。供給側電極の紡糸口金ノズル3と金属ネット8との間に電圧をかけ、電荷によってドープ液を伸張し繊維状物6にして金属製ネット8の表面に堆積させる。9は堆積されたシート状(不織布状)極細繊維である。シート状(不織布状)極細繊維は、次に溶媒を脱離する。溶媒を脱離する方法は、減圧乾燥又は脱溶媒槽への浸漬であることが好ましい。金属製ネットを使用する利点は、様々な形状の金属製ネットを使用できる点にある。例えばお椀状、ボール状、波状等、ネット自体の形状に沿ってシート状(不織布状)極細繊維を形成できる。本発明の繊維は極細であることから繊維自体が絡み合い、シートを形成している。
【0024】
本発明の人造ポリペプチド繊維は平均直径が1μm以下であり、0.1〜1μmの範囲が好ましい。前記の範囲であれば安定して繊維を得ることができる。より好ましい平均直径は0.2〜0.9μmの範囲、さらに好ましくは0.3〜0.8μmの範囲である。また、本発明の極細繊維の単繊維直径は、0.1〜1μmの間で変動している。これはエレクトロスピニング特有の現象である。本発明の繊維の比重は1.34である。繊度(単位:texまたはdeci tex)を算出する場合は、繊維断面が丸の場合は前記繊維直径から計算される断面積と比重と長さから算出する。なお、本発明の人造ポリペプチド繊維は、断面が円形とは限らず様々な形状を含むため、断面を円形と想定した場合の平均径をいう。繊維直径は前記の範囲で変動している。
【0025】
前記ポリペプチドは、ニワオニグモ(Araneus diadematus)の2つの主要なしおり糸タンパク質の一つであるADF3由来のポリペプチドであることが好ましい。このポリペプチドは強伸度及びタフネスが基本的に高く、合成し易いことも利点として上げられる。
【0026】
本発明の人造ポリペプチド繊維は延伸後、フィブロイン繊維内のポリペプチド分子間について化学的に架橋させてもよい。ポリペプチドにおいて架橋に使える官能基は例えばアミノ基、カルボキシル基、チオール基、ヒドロキシ基等があるが、これに限定されるものではない。ポリペプチドに含まれるリジン側鎖のアミノ基は、グルタミン酸若しくはアスパラギン酸側鎖のカルボキシル基と脱水縮合によりアミド結合で架橋できる。架橋は真空加熱下で脱水縮合反応を行なっても良いし、カルボジイミド等の脱水縮合剤により架橋させても良い。また、グルタルアルデヒド等の架橋剤を用いても良い。また、トランスグルタミナーゼ等の酵素により架橋することもできる。一例として、カルボジイミド、グルタルアルデヒド等の架橋剤で架橋反応させても良い。カルボジイミドは一般式R1N=C=NR2(但し、R1,R2は炭素数1〜6のアルキル基、シクロアルキル基を含む有機基を示す。)で示され、具体的化合物は1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)、N,N’−ジシクロヘキシルカルボジイミド(DCC)、1−シクロヘキシル−3−(2−モルホリノエチル)カルボジイミド、ジイソプロピルカルボジイミド(DIC)などがある。この中でもEDC、DICはペプチド鎖のアミド結合形成能が高く、架橋反応し易いことから好ましい。架橋処理は、延伸糸に架橋剤を付与して真空熱乾燥で重合するのが好ましい。架橋剤は100%品を繊維に付与しても良いし、炭素数1〜5の低級アルコールや緩衝液などで希釈して0.005〜10質量%の濃度で繊維に付与しても良い。処理条件は、温度20〜45℃で3〜42時間が好ましい。架橋剤による架橋処理により、人造ポリペプチド繊維の強度、タフネス、耐薬品性等を上げることができる。
【実施例】
【0027】
以下実施例を用いて、本発明をさらに具体的に説明する。なお、本発明は下記の実施例に限定されるものではない。
【0028】
(実施例1)
<遺伝子合成>
(1)ADF3Kaiの遺伝子の合成
ニワオニグモの2つの主要なしおり糸タンパク質の一つであるADF3(GI:1263287)の部分的なアミノ酸配列をNCBIのウェブデータベースより取得し、同配列のN末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ認識サイトからなるアミノ酸配列(配列番号5)を付加したアミノ酸配列(配列番号6)からなるタンパク質をコードする遺伝子を、GenScript社に合成受託した。その結果、配列番号11に示す塩基配列からなるADF3Kaiの遺伝子が導入されたpUC57ベクター(遺伝子の5’末端直上流にNde Iサイト、及び5’末端直下流にXba Iサイト有り)を取得した。その後、同遺伝子をNde I及びEcoR Iで制限酵素処理し、pET22b(+)発現ベクターに組み換えた。
【0029】
(2)ADF3Kai−NRSH1の合成
ADF3Kaiの遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kaiのアミノ酸配列(配列番号6)の第632番目のアミノ酸残基Glyに対応するコドンGGCを終止コドンTAAに変異させ、配列番号12に示すADF3Kai−NRSH1の遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−NRSH1のアミノ酸配列は配列番号7に示すとおりである。
【0030】
(3)ADF3Kai−Bの合成
ADF3Kai−NRSH1の遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kai−NRSH1のアミノ酸配列(配列番号7)の第22番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに変異させ、配列番号13に示すADF3Kai−Bの遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Bのアミノ酸配列は配列番号8に示すとおりである。
【0031】
(4)ADF3Kai−Fの合成
ADF3Kai−Bの遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kai−Bのアミノ酸配列(配列番号8)の第26番目のアミノ酸残基Argに対応するコドンCGAをLysをコードするコドンAAAに、第31番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに、第32番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに変異させ、配列番号14に示すADF3Kai−Fの遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Fのアミノ酸配列は配列番号9に示すとおりである。
【0032】
<タンパク質の発現>
ADF3Kai、ADF3Kai−NRSH1、ADF3Kai−B又はADF3Kai−Fの遺伝子を含むpET22b(+)発現ベクターを大腸菌Rosetta(DE3)に形質転換した。得られたシングルコロニーを、アンピシリンを含む2mLのLB培地で15時間培養後、同培養液を、アンピシリンを含む140mLのLB培地に1.4mL添加し、37℃、200rpmの条件下で、培養液のOD600が3.5になるまで培養した。次に、OD600が3.5の培養液を、アンピシリンを含む7Lの2×YT培地に50%グルコース140mLと共に加え、OD600が4.0になるまで培養した。その後、得られたOD600が4.0の培養液に、終濃度が0.5mMになるようにイソプロピル−β−チオガラクトビラノシド(IPTG)を添加してタンパク質発現を誘導した。IPTGを添加してから2時間経過した時点で、培養液を遠心分離により回収した。IPTG添加前とIPTG添加後の培養液から調製したタンパク質溶液をポリアクリルアミドゲルで電気泳動させ、IPTG添加に依存して目的サイズ(ADF3Kai約58.8kDa、ADF3Kai−NRSH1約55.9kDa、ADF3Kai−B約55.9kDa、ADF3Kai−F約55.9kDa)のバンドが観察されたことから、目的とするタンパク質が発現していることを確認した。
【0033】
<精製>
IPTGを添加してから2時間後に回収した菌体を20mMTris−HCl(pH7.4)で洗浄した後、高圧ホモジナイザー(GEA Niro Soavi社)で細胞を破砕した。破砕した細胞を遠心分離し、得られた沈殿物を7.5MUrea DB緩衝液(7.5M尿素、10mMリン酸二水素ナトリウム、20mM NaCl、1mMTris−HCl、pH7.0)で溶解し、スターラーで撹拌した後、透析チューブ(三光純薬株式会社セルロースチューブ36/32)を用いて水で透析を行った。透析後に得られた白色の凝集タンパク質を遠心分離により回収し、凍結乾燥機で水分をのぞき、凍結乾燥粉末を回収した。上記凍結乾燥粉末における目的タンパク質の精製度を下記のように測定した結果、ADF3Kai、ADF3Kai−NRSH1、ADF3Kai−B又はADF3Kai−Fの精製度は、それぞれ、73.0%、94.7%、95.2%、97.4%であった。
【0034】
≪精製度の測定≫
凍結乾燥粉末における目的タンパク質の精製度は、凍結乾燥粉末のポリアクリルアミドゲル電気泳動の結果をTotallab(nonlinear dynamics ltd.)を用いて画像解析することにより測定した。まず、精密天秤を用いて凍結乾燥粉末をエッペンチューブに4mg測り取った後、7.5MUrea DB緩衝液(7.5M尿素、10mMリン酸二水素ナトリウム、20mMNaCl、1mMTris−HCl、pH7.0)1mLを加え、ボルテックス20分間、室温放置30分間により十分に溶解させた。
【0035】
≪溶解性の評価≫
(1)紡糸液(ドープ液)の調製
上記で得られたADF3Kai−F(分子量6万)の凍結乾燥粉末を、真空ポンプ(ULVAC G−50DA)を使用して約2時間程度真空乾燥し、凍結乾燥したタンパク質粉末から完全に水分を除去した。その後、乳鉢を使用して、水分を除去したタンパク質を出来るだけ優しく押しつぶし、約1mmの粒径を有するタンパク質粉末にした。次に、得られたタンパク粉末にHFIPを添加し、25℃で180rpmのシェーカーで振動を与えながら約19.5時間溶解し、タンパク質の濃度が7質量%のドープ液を調製した。
【0036】
(5)エレクトロスピニング
図1に示すエレクトロスピニング装置10を用いて紡糸した。マイクロシリンジ1内のドープ液2の押し出し速度は2.4ml/hとし、金属製口金ノズル3と金属製ロール4との間の電圧は13.1kV、距離は75mmとした。金属製口金ノズル3の内直径は0.32mmとし、4本ノズルとした。金属製ロール4(直径214mm)の回転数は170rpmとし、巻き取り速度は114.2m/minとした。この条件で4時間紡糸した。金属ロール4の表面に巻き上げられたシート状(不織布状)極細繊維7は、0.1Pa、35℃、1時間の真空乾燥により溶媒のHFIPを除去した。
【0037】
<物性測定>
(a)引張り試験
得られた人造ポリペプチド極細繊維シート(幅8mm、長さ20mm、厚さ0.036mm、単位面積当たりの質量(目付け)5.68g/m2)の引張り速度10mm/minにおける引張り試験結果は、次の表1に示すとおりであった。
【0038】
【表1】

【0039】
(b)走査型電子顕微鏡による表面の観察
走査型電子顕微鏡(SEM)を使用して5500倍で観察し、単繊維の直径を測定した。その結果、側定数5(0.335μm,0.392μm,0.402μm,0.556μm,0.602μm)の平均直径は0.457μmであった。図3に実施例1で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線を示す。
【0040】
(実施例2)
<遺伝子合成>
(1)ADF3Kai−Largeの遺伝子の合成
ADF3Kaiを鋳型にT7プロモータープライマー(配列番号18)とRep Xba Iプライマー(配列番号19)を用いてPCR反応を行い、ADF3Kaiの遺伝子配列における5’側半分の配列(以下、配列Aと記す。)を増幅し、同断片をMighty Cloning Kit(タカラバイオ株式会社製)を使用して、予めNde I及びXba Iで制限酵素処理をしておいたpUC118ベクターに組み換えた。同様に、ADF3Kaiを鋳型にXba I Repプライマー(配列番号21)とT7ターミネータープライマー(配列番号20)を用いてPCR反応を行い、ADF3Kaiの遺伝子配列にける3’側半分の配列(以下、配列Bと記す。)を増幅し、同断片をMighty Cloning Kit(タカラバイオ株式会社製)を使用して、予めXba I、EcoR Iで制限酵素処理をしておいたpUC118ベクターに組み換えた。配列Aの導入されたpUC118ベクターをNde I、Xba Iで、配列Bの導入されたpUC118ベクターをXba I、EcoR Iでそれぞれ制限酵素処理し、ゲルの切り出しによって配列AのDNA断片及び配列BのDNA断片を精製した。DNA断片A、DNA断片B及び予めNde I及びEcoR Iで制限酵素処理をしておいたpET−22b(+)をライゲーション反応させ、大腸菌DH5αに形質転換した。T7プロモータープライマー及びT7ターミネータープライマーを用いたコロニーPCRにより、目的DNA断片の挿入を確認した後、目的サイズ(約3.6kbp)付近のバンドが得られたコロニーからプラスミドを抽出し、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により全塩基配列を確認した。その結果、配列番号16に示す塩基配列からなるADF3Kai−Largeの遺伝子の構築が確認された。なお、ADF3Kai−Largeのアミノ酸配列は配列番号4に示すとおりである。
【0041】
(2)ADF3Kai−Large−NRSH1の遺伝子の合成
ADF3Kai−Largeの遺伝子が導入されたpET22b(+)ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入によりADF3Kai−Largeのアミノ酸配列(配列番号4)の第1155番目のアミノ酸残基Glyに対応するコドンGGCを終止コドンTAAに変異させ、配列番号17に示す塩基配列からなるADF3Kai−Large−NRSH1の遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Large−NRSH1のアミノ酸配列は配列番号15に示すとおりである。
【0042】
上記のようにして得られたADF3Kai−Large−NRSH1(分子量約10万)を使用して実施例1と同様に精製し、ドープ濃度を4質量%とした以外は実施例と同様にドープ液を作成し、エレクトロスピニングを行った。
【0043】
<物性測定>
(a)引張り試験
得られた人造ポリペプチド極細繊維シート(幅8mm、長さ20mm、厚さ0.024mm、単位面積当たりの質量(目付け)3.58g/m2)の引張り速度10mm/minにおける引張り試験結果は、次の表2に示すとおりであった。
【0044】
【表2】

【0045】
(b)走査型電子顕微鏡による観察
走査型電子顕微鏡(SEM)を使用して5500倍で観察し、単繊維の直径を測定した。その結果、側定数5(0.259μm,0.230μm,0.257μm,0.181μm,0.181μm)の平均直径は0.22μmであった。図4に実施例2で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線を示し、図5にSEMの写真を示す。
【産業上の利用可能性】
【0046】
本発明の人造ポリペプチド繊維は、樹脂や金属の強化繊維、複合材料、射出成形等に好適に使用できる。その用途は、自動車等の輸送機器部材、タイヤの補強繊維等に適用できる。また形態としては織物、編物、組み物、不織布などに応用できる。
【符号の説明】
【0047】
1 マイクロシリンジ
2 ドープ液
3 口金ノズル
4 金属ロール
5 電源
6 繊維状物
7,9 シート状(不織布状)極細繊維
8 金網ネット
10,20 エレクトロスピニング装置
【配列表フリーテキスト】
【0048】
配列番号1〜10、15 アミノ酸配列
配列番号11〜14、16、17 塩基配列
配列番号18〜21 プライマーシーケンス
【技術分野】
【0001】
本発明は合成タンパク質繊維の一種である人造ポリペプチド極細繊維及びその製造方法に関する。
【背景技術】
【0002】
クモ糸繊維は、高い強度とタフネスを有する繊維であり、高張力鋼、ナイロン6繊維、アラミド繊維、炭素繊維などよりも高い強度とタフネスを有することが知られている。加えて、石油を原料とせず、原料をバイオマス化できる利点もある。人工クモ糸繊維もいくつか提案されており、例えば特許文献1には合成タンパク質紡糸溶液を、湿式紡糸し、90%メタノールからなる凝固浴中に押し出して繊維とすることが提案されている。特許文献2には湿式紡糸し、200MPaまたはそれ以上の引張強度を有する本繊維が提案されている。非特許文献1には、湿式紡糸し、メタノール浴と水浴で延伸倍率5倍により強度1.91〜2.26g/d、伸度43.4〜59.6%の延伸糸が開示されている。非特許文献2には湿式紡糸し、延伸倍率を5倍とすることにより応力600MPa、伸度25%の延伸糸が開示されている。非特許文献3には、湿式紡糸した未延伸糸をスチーム中に5分間滞留させて5倍に延伸させることにより応力280〜350MPa、伸度30〜40%の延伸糸が開示されている。
【0003】
しかし、従来の人工クモ繊維は湿式紡糸によって製造されており、湿式紡糸法では、極細繊維を得ることは困難であり、とりわけ直径8μm(単繊維繊度で約1deci tex)以下の繊維を安定して得ることは困難であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特表2004−503204号公報
【特許文献2】特表2009−521921号公報
【非特許文献】
【0005】
【非特許文献1】Anthoula Lazaris,et.al.,"Spider Silk Fiber Spun from Soluble Recombinant Silk Produced in Mammalian Cells",Science,295,p472,2002年1月18日
【非特許文献2】Xiao-Xia Xia,et.al.,"Native-sized recombinant spider silk protein produced in metabolically engineered Escherichia coil results in a strong fiber",PNAS,vol.107,No.32,p14059-14063,2010年8月10日
【非特許文献3】M. Elice,et.al.,"Bioinspired Fibers Follow the Track of Natural Spider Silk",Macromolecules,Vol. 44,No.5,p1166-1176,2011年4月2日
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は前記従来の問題を解決するため、単繊維直径の細い人造ポリペプチド極細繊維及びその製造方法を提供する。
【課題を解決するための手段】
【0007】
本発明の人造ポリペプチド極細繊維は、天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、前記極細繊維の単繊維の平均直径が1μm以下であり、前記極細繊維自体の絡み合いによりシートを構成していることを特徴とする。
【0008】
本発明の人造ポリペプチド極細繊維の製造方法は、天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドを含む紡糸液をエレクトロスピニングして得られる前記の人造ポリペプチド極細繊維の製造方法であって、前記紡糸液は溶媒により前記ポリペプチドを溶解させたものであり、前記紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、前記繊維から溶媒を脱離させて人造ポリペプチド繊維を得ることを特徴とする。
【発明の効果】
【0009】
本発明は、天然クモ糸タンパク質に由来するポリペプチドを溶媒に溶解させた紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、前記繊維から溶媒を脱離させることにより、湿式紡糸法では得ることができない極細繊維を得ることができる。
【図面の簡単な説明】
【0010】
【図1】図1は本発明の一実施例のエレクトロスピニング装置の説明図である。
【図2】図2は本発明の別の実施例のエレクトロスピニング装置の説明図である。
【図3】図3は本発明の実施例1で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線である。
【図4】図4は本発明の実施例2で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線である。
【図5】図5は本発明の実施例2で得られた人造ポリペプチド極細繊維シートの走査型電子顕微鏡(SEM)写真である。
【発明を実施するための形態】
【0011】
(1)ポリペプチド
本発明においては、原料として天然型クモ糸タンパク質に由来するポリペプチドを用いる。前記ポリペプチドは、天然型クモ糸タンパク質に由来するものであればよく、特に限定されない。前記ポリペプチドは、強靭性に優れるという観点からクモの大瓶状線で産生される大吐糸管しおり糸タンパク質に由来するポリペプチドであることが好ましい。前記大吐糸管しおり糸タンパク質としては、アメリカジョロウグモ(Nephila clavipes)に由来する大瓶状線スピドロインMaSp1やMaSp2、二ワオニグモ(Araneus diadematus)に由来するADF3やADF4などが挙げられる。前記大吐糸管しおり糸タンパク質に由来するポリペプチドは、大吐糸管しおり糸タンパク質の変異体、類似体又は誘導体などを含む。
【0012】
前記大吐糸管しおり糸タンパク質に由来するポリペプチドとしては、式1:REP1−REP2(1)で示されるアミノ酸配列の単位を2以上、好ましくは5以上、より好ましくは10以上含むポリペプチドが挙げられる。或いは、前記大吐糸管しおり糸タンパク質に由来するポリペプチドは、式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列であるポリペプチドであってもよい。なお、前記大吐糸管しおり糸タンパク質に由来するポリペプチドにおいて、式(1):REP1−REP2(1)で示されるアミノ酸配列の単位は、同一であってもよく、異なっていてもよい。上記大吐糸管しおり糸タンパク質に由来するポリペプチドは、大腸菌等の微生物を宿主とした組み換えタンパク質生産を行う場合、生産性の観点から、分子量が500kDa以下であることが好ましく、より好ましくは300kDa以下であり、さらに好ましくは200kDa以下である。
【0013】
前記式(1)において、REP1は、ポリアラニンを意味しており、アラニンが連続して2〜20残基、より好ましくは3〜16残基、さらに好ましくは4〜12残基、最も好ましくは5〜8残基並んでいるアミノ酸配列である。前記式(1)において、REP2は、10〜200残基のアミノ酸からなるアミノ酸配列であり、前記アミノ酸配列中に含まれるグリシン、セリン、グルタミン及びアラニンの合計残基数がアミノ酸残基数全体に対して40%以上、好ましくは60%以上、より好ましくは70%以上である。
【0014】
大吐糸管しおり糸において、上記REP1は、繊維内で結晶βシートを形成する結晶領域に該当し、上記REP2は、繊維内でより柔軟性があり大部分が規則正しい構造を欠いている無定型領域に該当する。そして、上記[REP1−REP2]は、結晶領域と無定型領域からなる繰り返し領域(反復配列)に該当し、しおり糸タンパク質の特徴的配列である。
【0015】
配列番号1に示されるアミノ酸配列は、ADF3(GI:1263287)のアミノ酸配列のC末端の50残基のアミノ酸からなるアミノ酸配列と同一であり、配列番号2に示されるアミノ酸配列は、配列番号1に示されるアミノ酸配列のC末端から20残基取り除いたアミノ酸配列と同一であり、配列番号3に示されるアミノ酸配列は、配列番号1に示されるアミノ酸配列のC末端から29残基取り除いたアミノ酸配列と同一である。
【0016】
前記式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列からなるポリペプチドとしては、例えば、配列番号4に示されるアミノ酸配列からなるポリペプチドを用いることができる。配列番号4に示されるアミノ酸配列からなるポリペプチドは、N末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ(Human rhinovirus 3Cプロテアーゼ)認識サイトからなるアミノ酸配列(配列番号5)を付加したADF3のアミノ酸配列において、第1〜13番目の反復領域をおよそ2倍になるように増やすとともに、翻訳が第1154番目アミノ酸残基で終止するように変異させたものである。配列番号4に示されるアミノ酸配列からなるポリペプチドにおいて、C末端配列は、配列番号3に示すアミノ酸配列と同一である。
【0017】
また、前記式1:REP1−REP2(1)で示されるアミノ酸配列の単位を含み、かつC末端配列が配列番号1〜3のいずれかに示されるアミノ酸配列又は配列番号1〜3のいずれかに示されるアミノ酸配列と90%以上の相同性を有するアミノ酸配列からなるポリペプチドとしては、配列番号4に示されるアミノ酸配列において1若しくは複数個のアミノ酸が置換、欠失、挿入及び/又は付加されたアミノ酸配列からなり、結晶領域と無定型領域からなる繰り返し領域を有するタンパク質を用いることができる。本発明において、「1若しくは複数個」とは、例えば、1〜40個、1〜35個1〜30個、1〜25個、1〜20個、1〜15個、1〜10個、又は1若しくは数個を意味する。また、本発明において、「1若しくは数個」は、1〜9個、1〜8個、1〜7個、1〜6個、1〜5個、1〜4個、1〜3個、1〜2個、又は1個を意味する。
【0018】
配列番号9に示されるアミノ酸配列からなるポリペプチド(以下において、ADF3kai−Fと記す。)は、ADF3のアミノ酸配列(GI:1263287)のN末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ認識サイトからなるアミノ酸配列(配列番号5)が付加され、C末端から29個のアミノ酸残基が削除され、すなわちC末端に配列番号10に示されるアミノ酸配列が配置されたアミノ酸配列(配列番号7)において、第22、31及び32番目のGlnがLysに置換され、第26番目のアルギニン(Arg)がLysに置換されたものである。
【0019】
前記ポリペプチドは、ポリペプチドをコードする遺伝子を含有する発現ベクターで形質転換した宿主を用いて製造することができる。遺伝子の製造方法は特に制限されず、天然型クモ糸タンパク質をコードする遺伝子をクモ由来の細胞からポリメラーゼ連鎖反応(PCR)などで増幅しクローニングするか、若しくは化学的に合成する。遺伝子の化学的な合成方法も特に制限されず、例えば、NCBIのウェブデータベースなどより入手した天然型クモ糸タンパク質のアミノ酸配列情報をもとに、AKTA oligopilot plus 10/100(GEヘルスケア・ジャパン株式会社)などで自動合成したオリゴヌクレオチドをPCRなどで連結して合成することができる。この際に、タンパク質の精製や確認を容易にするため、上記のアミノ酸配列のN末端に開始コドン及びHis10タグからなるアミノ酸配列を付加したアミノ酸配列からなるタンパク質をコードする遺伝子を合成してもよい。上記発現ベクターとしては、DNA配列からタンパク質を発現し得るプラスミド、ファジー、ウイルスなどを用いることができる。上記プラスミド型発現ベクターとしては、宿主細胞内で目的の遺伝子が発現し、かつ自身が増幅することのできるものであればよく、特に限定されない。例えば宿主として大腸菌Rosetta(DE3)を用いる場合は、pET22b(+)プラスミドベクター、pColdプラスミドベクターなどを用いることができる。中でも、タンパク質の生産性の観点から、pET22b(+)プラスミドベクターを用いることが好ましい。上記宿主としては、例えば動物細胞、植物細胞、微生物などを用いることができる。
【0020】
(2)紡糸液
紡糸液(ドープ液)は、前記ポリペプチドに溶媒を加え、紡糸できる粘度に調整して作成する。例えば前記ポリペプチドがニワオニグモに由来する場合、溶媒は前記ポリペプチドを溶解することができるものであればどのようなものでも良い。一例としてヘキサフルオロイソプロパノール(HFIP)、ヘキサフルオロアセトン(HFA)、蟻酸、尿素、グアニジン、ドデシル硫酸ナトリウム(SDS)、臭化リチウム、塩化カルシウム、チオシアン酸リチウム等を含む水溶液等などを溶媒とし、適量加えて溶液粘度を100〜10,000cP(センチポイズ)とする。これを紡糸液とする。アルカリ金属ハロゲン化物は、LiCl,NaCl等がある。
【0021】
(3)エレクトロスピニング
エレクトロスピニング法(静電紡糸法)は、供給側電極(紡糸口金と兼用できる)と捕集側電極(例えば金属ロール又は金属ネット等)間に電圧を印加し、紡糸口金から押し出したドープ液に電荷を与えて捕集側電極に吹き飛ばす。この際にドープ液は伸張されて繊維形成される。本発明において、好ましい印加電圧は、5〜100kVであり、さらに好ましくは10〜50kVである。電圧が5kV未満であると、雰囲気中の空間(電極間)において電極間の抵抗があるため、電子の流れが悪くなり、ドープ液が帯電しにくくなる。また、100kVを超えると、電極間でスパークがおこり、ドープ液に引火する恐れがある。電極間距離は1〜25cmが好ましく、さらに好ましくは2〜20cmである。電極間距離が1cm未満であると電極間でスパークが起こりやすくなり、ドープ液に引火する恐れがあり、25cmを超えると、電極間の抵抗が高くなり、電子の流れが妨げられ、ドープ液が帯電しにくくなる。
【0022】
図1は本発明の一実施例のエレクトロスピニング装置10の説明図である。まず金属製口金ノズル3と金属製ロール4との間に電源5により電圧をかけておく。マイクロシリンジ1内にドープ液2を入れておき、シリンジポンプを用いて矢印P方向に移動させ、金属製口金ノズル3からドープ液2を押し出し、電荷によってドープ液を吹き飛ばし繊維状物6にして金属ロール4の表面に堆積すると同時に巻き上げる。7は巻き上げられたシート状(不織布状)極細繊維である。シート状(不織布状)極細繊維は、次に溶媒を脱離する。溶媒を脱離する方法は、減圧乾燥又は脱溶媒槽への浸漬であることが好ましい。
【0023】
図2は本発明の別の実施例のエレクトロスピニング装置20の説明図である。図1と異なる点は、捕集側電極として金属ネット8を使用した点である。供給側電極の紡糸口金ノズル3と金属ネット8との間に電圧をかけ、電荷によってドープ液を伸張し繊維状物6にして金属製ネット8の表面に堆積させる。9は堆積されたシート状(不織布状)極細繊維である。シート状(不織布状)極細繊維は、次に溶媒を脱離する。溶媒を脱離する方法は、減圧乾燥又は脱溶媒槽への浸漬であることが好ましい。金属製ネットを使用する利点は、様々な形状の金属製ネットを使用できる点にある。例えばお椀状、ボール状、波状等、ネット自体の形状に沿ってシート状(不織布状)極細繊維を形成できる。本発明の繊維は極細であることから繊維自体が絡み合い、シートを形成している。
【0024】
本発明の人造ポリペプチド繊維は平均直径が1μm以下であり、0.1〜1μmの範囲が好ましい。前記の範囲であれば安定して繊維を得ることができる。より好ましい平均直径は0.2〜0.9μmの範囲、さらに好ましくは0.3〜0.8μmの範囲である。また、本発明の極細繊維の単繊維直径は、0.1〜1μmの間で変動している。これはエレクトロスピニング特有の現象である。本発明の繊維の比重は1.34である。繊度(単位:texまたはdeci tex)を算出する場合は、繊維断面が丸の場合は前記繊維直径から計算される断面積と比重と長さから算出する。なお、本発明の人造ポリペプチド繊維は、断面が円形とは限らず様々な形状を含むため、断面を円形と想定した場合の平均径をいう。繊維直径は前記の範囲で変動している。
【0025】
前記ポリペプチドは、ニワオニグモ(Araneus diadematus)の2つの主要なしおり糸タンパク質の一つであるADF3由来のポリペプチドであることが好ましい。このポリペプチドは強伸度及びタフネスが基本的に高く、合成し易いことも利点として上げられる。
【0026】
本発明の人造ポリペプチド繊維は延伸後、フィブロイン繊維内のポリペプチド分子間について化学的に架橋させてもよい。ポリペプチドにおいて架橋に使える官能基は例えばアミノ基、カルボキシル基、チオール基、ヒドロキシ基等があるが、これに限定されるものではない。ポリペプチドに含まれるリジン側鎖のアミノ基は、グルタミン酸若しくはアスパラギン酸側鎖のカルボキシル基と脱水縮合によりアミド結合で架橋できる。架橋は真空加熱下で脱水縮合反応を行なっても良いし、カルボジイミド等の脱水縮合剤により架橋させても良い。また、グルタルアルデヒド等の架橋剤を用いても良い。また、トランスグルタミナーゼ等の酵素により架橋することもできる。一例として、カルボジイミド、グルタルアルデヒド等の架橋剤で架橋反応させても良い。カルボジイミドは一般式R1N=C=NR2(但し、R1,R2は炭素数1〜6のアルキル基、シクロアルキル基を含む有機基を示す。)で示され、具体的化合物は1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド塩酸塩(EDC)、N,N’−ジシクロヘキシルカルボジイミド(DCC)、1−シクロヘキシル−3−(2−モルホリノエチル)カルボジイミド、ジイソプロピルカルボジイミド(DIC)などがある。この中でもEDC、DICはペプチド鎖のアミド結合形成能が高く、架橋反応し易いことから好ましい。架橋処理は、延伸糸に架橋剤を付与して真空熱乾燥で重合するのが好ましい。架橋剤は100%品を繊維に付与しても良いし、炭素数1〜5の低級アルコールや緩衝液などで希釈して0.005〜10質量%の濃度で繊維に付与しても良い。処理条件は、温度20〜45℃で3〜42時間が好ましい。架橋剤による架橋処理により、人造ポリペプチド繊維の強度、タフネス、耐薬品性等を上げることができる。
【実施例】
【0027】
以下実施例を用いて、本発明をさらに具体的に説明する。なお、本発明は下記の実施例に限定されるものではない。
【0028】
(実施例1)
<遺伝子合成>
(1)ADF3Kaiの遺伝子の合成
ニワオニグモの2つの主要なしおり糸タンパク質の一つであるADF3(GI:1263287)の部分的なアミノ酸配列をNCBIのウェブデータベースより取得し、同配列のN末端に開始コドン、His10タグ及びHRV3Cプロテアーゼ認識サイトからなるアミノ酸配列(配列番号5)を付加したアミノ酸配列(配列番号6)からなるタンパク質をコードする遺伝子を、GenScript社に合成受託した。その結果、配列番号11に示す塩基配列からなるADF3Kaiの遺伝子が導入されたpUC57ベクター(遺伝子の5’末端直上流にNde Iサイト、及び5’末端直下流にXba Iサイト有り)を取得した。その後、同遺伝子をNde I及びEcoR Iで制限酵素処理し、pET22b(+)発現ベクターに組み換えた。
【0029】
(2)ADF3Kai−NRSH1の合成
ADF3Kaiの遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kaiのアミノ酸配列(配列番号6)の第632番目のアミノ酸残基Glyに対応するコドンGGCを終止コドンTAAに変異させ、配列番号12に示すADF3Kai−NRSH1の遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−NRSH1のアミノ酸配列は配列番号7に示すとおりである。
【0030】
(3)ADF3Kai−Bの合成
ADF3Kai−NRSH1の遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kai−NRSH1のアミノ酸配列(配列番号7)の第22番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに変異させ、配列番号13に示すADF3Kai−Bの遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Bのアミノ酸配列は配列番号8に示すとおりである。
【0031】
(4)ADF3Kai−Fの合成
ADF3Kai−Bの遺伝子が導入されたpET22b(+)発現ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入により、ADF3Kai−Bのアミノ酸配列(配列番号8)の第26番目のアミノ酸残基Argに対応するコドンCGAをLysをコードするコドンAAAに、第31番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに、第32番目のアミノ酸残基Glnに対応するコドンCAAをLysをコードするコドンAAAに変異させ、配列番号14に示すADF3Kai−Fの遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Fのアミノ酸配列は配列番号9に示すとおりである。
【0032】
<タンパク質の発現>
ADF3Kai、ADF3Kai−NRSH1、ADF3Kai−B又はADF3Kai−Fの遺伝子を含むpET22b(+)発現ベクターを大腸菌Rosetta(DE3)に形質転換した。得られたシングルコロニーを、アンピシリンを含む2mLのLB培地で15時間培養後、同培養液を、アンピシリンを含む140mLのLB培地に1.4mL添加し、37℃、200rpmの条件下で、培養液のOD600が3.5になるまで培養した。次に、OD600が3.5の培養液を、アンピシリンを含む7Lの2×YT培地に50%グルコース140mLと共に加え、OD600が4.0になるまで培養した。その後、得られたOD600が4.0の培養液に、終濃度が0.5mMになるようにイソプロピル−β−チオガラクトビラノシド(IPTG)を添加してタンパク質発現を誘導した。IPTGを添加してから2時間経過した時点で、培養液を遠心分離により回収した。IPTG添加前とIPTG添加後の培養液から調製したタンパク質溶液をポリアクリルアミドゲルで電気泳動させ、IPTG添加に依存して目的サイズ(ADF3Kai約58.8kDa、ADF3Kai−NRSH1約55.9kDa、ADF3Kai−B約55.9kDa、ADF3Kai−F約55.9kDa)のバンドが観察されたことから、目的とするタンパク質が発現していることを確認した。
【0033】
<精製>
IPTGを添加してから2時間後に回収した菌体を20mMTris−HCl(pH7.4)で洗浄した後、高圧ホモジナイザー(GEA Niro Soavi社)で細胞を破砕した。破砕した細胞を遠心分離し、得られた沈殿物を7.5MUrea DB緩衝液(7.5M尿素、10mMリン酸二水素ナトリウム、20mM NaCl、1mMTris−HCl、pH7.0)で溶解し、スターラーで撹拌した後、透析チューブ(三光純薬株式会社セルロースチューブ36/32)を用いて水で透析を行った。透析後に得られた白色の凝集タンパク質を遠心分離により回収し、凍結乾燥機で水分をのぞき、凍結乾燥粉末を回収した。上記凍結乾燥粉末における目的タンパク質の精製度を下記のように測定した結果、ADF3Kai、ADF3Kai−NRSH1、ADF3Kai−B又はADF3Kai−Fの精製度は、それぞれ、73.0%、94.7%、95.2%、97.4%であった。
【0034】
≪精製度の測定≫
凍結乾燥粉末における目的タンパク質の精製度は、凍結乾燥粉末のポリアクリルアミドゲル電気泳動の結果をTotallab(nonlinear dynamics ltd.)を用いて画像解析することにより測定した。まず、精密天秤を用いて凍結乾燥粉末をエッペンチューブに4mg測り取った後、7.5MUrea DB緩衝液(7.5M尿素、10mMリン酸二水素ナトリウム、20mMNaCl、1mMTris−HCl、pH7.0)1mLを加え、ボルテックス20分間、室温放置30分間により十分に溶解させた。
【0035】
≪溶解性の評価≫
(1)紡糸液(ドープ液)の調製
上記で得られたADF3Kai−F(分子量6万)の凍結乾燥粉末を、真空ポンプ(ULVAC G−50DA)を使用して約2時間程度真空乾燥し、凍結乾燥したタンパク質粉末から完全に水分を除去した。その後、乳鉢を使用して、水分を除去したタンパク質を出来るだけ優しく押しつぶし、約1mmの粒径を有するタンパク質粉末にした。次に、得られたタンパク粉末にHFIPを添加し、25℃で180rpmのシェーカーで振動を与えながら約19.5時間溶解し、タンパク質の濃度が7質量%のドープ液を調製した。
【0036】
(5)エレクトロスピニング
図1に示すエレクトロスピニング装置10を用いて紡糸した。マイクロシリンジ1内のドープ液2の押し出し速度は2.4ml/hとし、金属製口金ノズル3と金属製ロール4との間の電圧は13.1kV、距離は75mmとした。金属製口金ノズル3の内直径は0.32mmとし、4本ノズルとした。金属製ロール4(直径214mm)の回転数は170rpmとし、巻き取り速度は114.2m/minとした。この条件で4時間紡糸した。金属ロール4の表面に巻き上げられたシート状(不織布状)極細繊維7は、0.1Pa、35℃、1時間の真空乾燥により溶媒のHFIPを除去した。
【0037】
<物性測定>
(a)引張り試験
得られた人造ポリペプチド極細繊維シート(幅8mm、長さ20mm、厚さ0.036mm、単位面積当たりの質量(目付け)5.68g/m2)の引張り速度10mm/minにおける引張り試験結果は、次の表1に示すとおりであった。
【0038】
【表1】

【0039】
(b)走査型電子顕微鏡による表面の観察
走査型電子顕微鏡(SEM)を使用して5500倍で観察し、単繊維の直径を測定した。その結果、側定数5(0.335μm,0.392μm,0.402μm,0.556μm,0.602μm)の平均直径は0.457μmであった。図3に実施例1で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線を示す。
【0040】
(実施例2)
<遺伝子合成>
(1)ADF3Kai−Largeの遺伝子の合成
ADF3Kaiを鋳型にT7プロモータープライマー(配列番号18)とRep Xba Iプライマー(配列番号19)を用いてPCR反応を行い、ADF3Kaiの遺伝子配列における5’側半分の配列(以下、配列Aと記す。)を増幅し、同断片をMighty Cloning Kit(タカラバイオ株式会社製)を使用して、予めNde I及びXba Iで制限酵素処理をしておいたpUC118ベクターに組み換えた。同様に、ADF3Kaiを鋳型にXba I Repプライマー(配列番号21)とT7ターミネータープライマー(配列番号20)を用いてPCR反応を行い、ADF3Kaiの遺伝子配列にける3’側半分の配列(以下、配列Bと記す。)を増幅し、同断片をMighty Cloning Kit(タカラバイオ株式会社製)を使用して、予めXba I、EcoR Iで制限酵素処理をしておいたpUC118ベクターに組み換えた。配列Aの導入されたpUC118ベクターをNde I、Xba Iで、配列Bの導入されたpUC118ベクターをXba I、EcoR Iでそれぞれ制限酵素処理し、ゲルの切り出しによって配列AのDNA断片及び配列BのDNA断片を精製した。DNA断片A、DNA断片B及び予めNde I及びEcoR Iで制限酵素処理をしておいたpET−22b(+)をライゲーション反応させ、大腸菌DH5αに形質転換した。T7プロモータープライマー及びT7ターミネータープライマーを用いたコロニーPCRにより、目的DNA断片の挿入を確認した後、目的サイズ(約3.6kbp)付近のバンドが得られたコロニーからプラスミドを抽出し、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により全塩基配列を確認した。その結果、配列番号16に示す塩基配列からなるADF3Kai−Largeの遺伝子の構築が確認された。なお、ADF3Kai−Largeのアミノ酸配列は配列番号4に示すとおりである。
【0041】
(2)ADF3Kai−Large−NRSH1の遺伝子の合成
ADF3Kai−Largeの遺伝子が導入されたpET22b(+)ベクターを鋳型に、PrimeStar Mutagenesis Basal Kit(タカラバイオ株式会社製)を用いた部位特異的変異導入によりADF3Kai−Largeのアミノ酸配列(配列番号4)の第1155番目のアミノ酸残基Glyに対応するコドンGGCを終止コドンTAAに変異させ、配列番号17に示す塩基配列からなるADF3Kai−Large−NRSH1の遺伝子をpET22b(+)上に構築した。変異の導入の正確性については、3130xl Genetic Analyzer(Applied Biosystems)を用いたシーケンス反応により確認した。なお、ADF3Kai−Large−NRSH1のアミノ酸配列は配列番号15に示すとおりである。
【0042】
上記のようにして得られたADF3Kai−Large−NRSH1(分子量約10万)を使用して実施例1と同様に精製し、ドープ濃度を4質量%とした以外は実施例と同様にドープ液を作成し、エレクトロスピニングを行った。
【0043】
<物性測定>
(a)引張り試験
得られた人造ポリペプチド極細繊維シート(幅8mm、長さ20mm、厚さ0.024mm、単位面積当たりの質量(目付け)3.58g/m2)の引張り速度10mm/minにおける引張り試験結果は、次の表2に示すとおりであった。
【0044】
【表2】

【0045】
(b)走査型電子顕微鏡による観察
走査型電子顕微鏡(SEM)を使用して5500倍で観察し、単繊維の直径を測定した。その結果、側定数5(0.259μm,0.230μm,0.257μm,0.181μm,0.181μm)の平均直径は0.22μmであった。図4に実施例2で得られた人造ポリペプチド極細繊維シートの応力−変位(ひずみ)曲線を示し、図5にSEMの写真を示す。
【産業上の利用可能性】
【0046】
本発明の人造ポリペプチド繊維は、樹脂や金属の強化繊維、複合材料、射出成形等に好適に使用できる。その用途は、自動車等の輸送機器部材、タイヤの補強繊維等に適用できる。また形態としては織物、編物、組み物、不織布などに応用できる。
【符号の説明】
【0047】
1 マイクロシリンジ
2 ドープ液
3 口金ノズル
4 金属ロール
5 電源
6 繊維状物
7,9 シート状(不織布状)極細繊維
8 金網ネット
10,20 エレクトロスピニング装置
【配列表フリーテキスト】
【0048】
配列番号1〜10、15 アミノ酸配列
配列番号11〜14、16、17 塩基配列
配列番号18〜21 プライマーシーケンス
【特許請求の範囲】
【請求項1】
天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、
前記極細繊維の単繊維の平均直径が1μm以下であり、
前記極細繊維自体の絡み合いによりシートを構成していることを特徴とする人造ポリペプチド極細繊維シート。
【請求項2】
前記人造ポリペプチド極細繊維の単繊維直径は、0.1〜1μmの間で変動している請求項1に記載の人造ポリペプチド極細繊維シート。
【請求項3】
前記人造ポリペプチド極細繊維は、さらに前記繊維に含まれるポリペプチド分子間の一部において化学的に架橋されている請求項1又は2に記載の人造ポリペプチド極細繊維シート。
【請求項4】
天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドを含む紡糸液をエレクトロスピニングして得られる請求項1〜3のいずれか1項に記載の人造ポリペプチド極細繊維シートの製造方法であって、
前記紡糸液は溶媒により前記ポリペプチドを溶解させたものであり、
前記紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、
前記繊維から溶媒を脱離させて人造ポリペプチド繊維シートを得ることを特徴とする人造ポリペプチド極細繊維シートの製造方法。
【請求項5】
前記紡糸液の溶媒がヘキサフルオロイソプロパノール:HFIPである請求項4に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項6】
前記溶媒を脱離する方法が、減圧乾燥又は脱溶媒槽への浸漬である請求項4又は5に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項7】
前記口金から吐出させた繊維形成物質をローラーに巻き取るか又は金網に捕集してシートとする請求項4に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項8】
前記極細繊維シートをさらにカルボジイミド及びグルタルアルデヒドから選ばれる少なくとも一つの架橋剤を反応させて架橋させる請求項4〜7のいずれか1項に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項1】
天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドをエレクトロスピニングして得られる人造ポリペプチド極細繊維シートであって、
前記極細繊維の単繊維の平均直径が1μm以下であり、
前記極細繊維自体の絡み合いによりシートを構成していることを特徴とする人造ポリペプチド極細繊維シート。
【請求項2】
前記人造ポリペプチド極細繊維の単繊維直径は、0.1〜1μmの間で変動している請求項1に記載の人造ポリペプチド極細繊維シート。
【請求項3】
前記人造ポリペプチド極細繊維は、さらに前記繊維に含まれるポリペプチド分子間の一部において化学的に架橋されている請求項1又は2に記載の人造ポリペプチド極細繊維シート。
【請求項4】
天然クモ糸タンパク質(spider silk proteins)に由来するポリペプチドを含む紡糸液をエレクトロスピニングして得られる請求項1〜3のいずれか1項に記載の人造ポリペプチド極細繊維シートの製造方法であって、
前記紡糸液は溶媒により前記ポリペプチドを溶解させたものであり、
前記紡糸液を、電圧をかけた口金からエレクトロスピニングにより吐出させて繊維形成し、
前記繊維から溶媒を脱離させて人造ポリペプチド繊維シートを得ることを特徴とする人造ポリペプチド極細繊維シートの製造方法。
【請求項5】
前記紡糸液の溶媒がヘキサフルオロイソプロパノール:HFIPである請求項4に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項6】
前記溶媒を脱離する方法が、減圧乾燥又は脱溶媒槽への浸漬である請求項4又は5に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項7】
前記口金から吐出させた繊維形成物質をローラーに巻き取るか又は金網に捕集してシートとする請求項4に記載の人造ポリペプチド極細繊維シートの製造方法。
【請求項8】
前記極細繊維シートをさらにカルボジイミド及びグルタルアルデヒドから選ばれる少なくとも一つの架橋剤を反応させて架橋させる請求項4〜7のいずれか1項に記載の人造ポリペプチド極細繊維シートの製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−96037(P2013−96037A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−241488(P2011−241488)
【出願日】平成23年11月2日(2011.11.2)
【出願人】(508113022)スパイバー株式会社 (1)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月2日(2011.11.2)
【出願人】(508113022)スパイバー株式会社 (1)
【Fターム(参考)】
[ Back to top ]

