代謝障害の処置のための化合物
【課題】代謝障害の処置のための化合物の提供。
【解決手段】インスリン抵抗性症候群、糖尿病、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症、及び動脈硬化症等の種々の代謝障害の処置に有用な薬剤を、化学式Iとして開示する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を有する哺乳動物の被験体を処置する方法であって、上記の薬剤の有効量を被験体に投与することを含む、方法を提供する。本発明は、上記の薬剤を含む薬学的組成物、及び薬学的に許容される担体を提供する。
【解決手段】インスリン抵抗性症候群、糖尿病、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症、及び動脈硬化症等の種々の代謝障害の処置に有用な薬剤を、化学式Iとして開示する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を有する哺乳動物の被験体を処置する方法であって、上記の薬剤の有効量を被験体に投与することを含む、方法を提供する。本発明は、上記の薬剤を含む薬学的組成物、及び薬学的に許容される担体を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願の引用)
本出願は、米国仮特許出願第60/734,803号(2005年11月9日出願)に対する優先権を主張し、その内容は、本明細書中で参考として援用される。
【背景技術】
【0002】
(発明の背景)
糖尿病は、罹患率及び死亡率の主因である。慢性的な血糖上昇が以下の消耗性合併症につながる:透析又は腎移植が必要になることが多い腎症;末梢腎症;失明につながる網膜症;切断につながる下肢の潰瘍形成;肝硬変に進行することがある脂肪肝疾患;並びに冠動脈疾患及び心筋梗塞に対する脆弱性。
【0003】
糖尿病には主に2つの型がある。I型、即ちインスリン依存性糖尿病(IDDM)は、膵臓ランゲルハンス島のインスリン産生β細胞の自己免疫性の破壊による。通常、この疾患は小児期又は青年期に発症する。処置は主に、1日複数回のインスリン投与からなり、インスリン用量を調節する目安となる血糖濃度の頻回な測定と組み合わせて行う。これは、インスリン用量が過剰になると、低血糖症を生じ、その結果、脳やその他の機能に障害を生じる恐れがあるためである。
【0004】
II型、即ちインスリン非依存性糖尿病(NIDDM)は、一般的に成人期に発症する。NIDDMは、インスリン作用に対する脂肪組織、筋及び肝臓等の糖利用組織の低抗性に関連する。最初は、膵臓ランゲルハンス島β細胞が過剰なインスリンを分泌することにより代償する。最終的には、ランゲルハンス島の不全によって代償不全及び慢性的な高血糖が生じる。一方で、中等度のランゲルハンス島の機能不全が、末梢インスリン抵抗性よりも先に、又はこれと同時に発生する恐れがある。NIDDMの処置に有用な薬剤には幾つかのクラスがある:1)インスリンの放出を直接刺激して、低血糖症の危険を取り除く、インスリン放出剤;2)糖誘導性インスリン分泌を増強し、毎食前に服用しなければならない、食事性のインスリン放出剤;3)肝臓の糖新生を減衰する(逆に言えば、糖尿病では上昇する)、メトホルミンを含めたビグアナイド;4)インスリンに対する末梢の反応性を改善するが、体重増加、浮腫及び偶発性の肝臓毒性等の副作用を生じる、インスリン増感剤、例えば、チアゾリジンジオン誘導体であるロシグリタゾン及びピオグリタゾン;5)ランゲルハンス島が慢性的な過剰刺激下で機能しなくなったNIDDMの後期に必要となることが多い、インスリン注射。
【0005】
インスリン抵抗性は又、顕著な高血糖症を伴うことなく生じる恐れがあり、一般的にはアテローム性動脈硬化、肥満、高脂血症、及び本態性高血圧に関連する。この異常群は、「代謝症候群」又は「インスリン抵抗性症候群」を構成する。インスリン抵抗性は又、脂肪肝とも関連し、これは、慢性的な炎症(NASH;「非アルコール性脂肪肝炎」)、線維症及び肝硬変に進行する恐れがある。累積的に、糖尿病を含むがこれに限定されないインスリン抵抗性症候群は、40歳以上の罹患率及び死亡率の主因の多くの基となる。
【0006】
このような薬剤が存在するにもかかわらず、糖尿病は依然として、増大を続ける社会の主要な健康上の問題となっている。糖尿病の後期の合併症には、国の医療財源の大部分が費やされている。従って、インスリン抵抗性及びランゲルハンス島不全の原発性欠損に効果的に対処し、既存の薬剤に比べて副作用が少なく軽い、新規の経口活性治療剤が必要とされている。
【0007】
現在、脂肪肝疾患の安全且つ効果的な処置法は存在しない。そのため、このような処置法があれば、この病態の処置において価値のあるものになると思われる。
【0008】
特許文献1(Wellstat Therapeutics Corp.)及び特許文献2(Wellstat Therapeutics Corp.)では、酸の末尾が2つの水素により置換されている特定の化合物、例えば、4−(3−(2,6−ジメチルベンジルオキシ)フェニル)酪酸及び3−(2,6−ジメチルベンジルオキシ)フェニル酢酸が開示されている。特許文献3(Wellstat Therapeutics Corp.)では、酸の末尾がヒドロキシにより置換されている特定の化合物、例えば、4−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−4−ヒドロキシブタン酸が開示されている。但し、上述の特許公開では、以下に示す化学式Iの範囲内に含まれ、酸の末尾がアルキルにより置換されている化合物は開示されていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第02/100341号パンフレット
【特許文献2】国際公開第04/073611号パンフレット
【特許文献3】国際公開第04/091486号パンフレット
【発明の概要】
【課題を解決するための手段】
【0010】
(発明の要旨)
本発明は、以下に記載の生物活性剤を提供する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を処置する医薬品の製造における、以下に記載の生物活性剤の使用を提供する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を有する哺乳動物の被験体を処置する方法であって、以下に記載の生物活性剤の有効量を被験体に投与することを含む、方法を提供する。本発明は、以下に記載の生物活性剤を含む薬学的組成物、及び薬学的に許容される担体を提供する。
【0011】
本発明における生物活性剤は、以下の化学式Iの化合物であって:
【0012】
【化5】

式中、nが1又は2であり;m及びnの一方が0であり、他方が0、1、2、3又は4であり;qが0又は1であり;tが0又は1であり;R2が1〜3個の炭素原子を有するアルキルであり;R3が水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;R4及びR5の一方が1〜3個の炭素原子を有するアルキルであり、他方が水素、又は1〜3個の炭素原子を有するアルキルであり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル又はエチルによりモノ置換される、シクロアルキル;或いはN、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りに共有結合する、ヘテロ芳香族環であり;R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、化合物である。或いは、R1が水素である場合に、生物活性剤は、化学式Iの化合物の薬学的に許容される塩であってよい。
【0013】
上記の生物活性剤は、ヒト糖尿病及びインスリン抵抗性症候群の動物試験により確立されている、以下に記載の1つ以上の生物学的活性検定において活性を有する。そのため、このような薬剤は、糖尿病及びインスリン抵抗性症候群の処置に有用であると考えられる。試験を行った例示の化合物は全て、これらを試験した生物学的活性検定の少なくとも1つにおいて活性を示した。
例えば、本願発明は以下の項目を提供する。
(項目1)
インスリン抵抗性症候群、I型糖尿病及びII型糖尿病を含めた糖尿病、並びに多嚢胞性卵巣症候群からなる群から選択される病態を処置する;又はアテローム性動脈硬化症、動脈硬化症、肥満、高血圧、高脂血症、脂肪肝疾患、腎症、神経障害、網膜症、糖尿病に関連する下肢潰瘍又は白内障を処置する又は発症の可能性を低下させる;或いは高脂血症、悪液質及び肥満からなる群から選択される病態を処置する、医薬品の製造における生物活性剤の使用であって;
前記薬剤が以下の化学式の化合物であって:
【化1】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
使用。
(項目2)
m及びxの一方が0であり、他方が0、2又は4である、項目1に記載の使用。
(項目3)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいはハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目2に記載の使用。
(項目4)
R4及びR5の一方が水素である、項目3に記載の使用。
(項目5)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目3に記載の使用。
(項目6)
Aが2,6−ジメチルフェニルである、項目3に記載の使用。
(項目7)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目6に記載の使用。
(項目8)
前記医薬品が経口投与用に配合される、項目1〜7の何れか1項に記載の使用。
(項目9)
インスリン抵抗性症候群、糖尿病、嚢胞性卵巣症候群、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症及び動脈硬化症からなる群から選択される病態を有する哺乳動物の被験体を処置する方法であって、生物活性剤の一定量を前記被験体に投与することを含み、前記薬剤が以下の化学式の化合物であって:
【化2】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が1〜3個の炭素原子を有するアルキルであり、他方が水素、又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;又は
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であり、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
方法。
(項目10)
m及びxの一方が0であり、他方が0、2又は4である、項目9に記載の方法。
(項目11)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目10に記載の方法。
(項目12)
R4及びR5の一方が水素である、項目11に記載の方法。
(項目13)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目11に記載の方法。
(項目14)
Aが2,6−ジメチルフェニルである、項目11に記載の方法。
(項目15)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目14に記載の方法。
(項目16)
前記被験体がヒトである、項目9〜15の何れか1項に記載の方法。
(項目17)
前記薬剤が1日当たり1mg〜400mgの量で経口投与される、項目16に記載の方法。
(項目18)
前記病態がインスリン抵抗性症候群又はII型糖尿病である、項目9に記載の方法。
(項目19)
前記処置が、糖尿病の症状又は糖尿病の症状を発症する可能性を軽減し、前記症状が、アテローム性動脈硬化症、肥満、高血圧、高脂血症、脂肪肝疾患、腎症、神経障害、網膜症、糖尿病に関連する下肢潰瘍及び白内障からなる群から選択される、項目9に記載の方法。
(項目20)
インスリン抵抗性症候群、糖尿病、嚢胞性卵巣症候群、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症、動脈硬化症からなる群から選択される病態の処置に使用し、経口投与に適合した薬学的組成物であって、薬学的に許容される担体及び1mg〜400mgの生物活性剤を含み、
前記薬剤が以下の化学式の化合物であって:
【化3】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;又は
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5若しくは6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
薬学的組成物。
(項目21)
m及びxの一方が0であり、他方が0、2又は4である、項目20に記載の薬学的組成物。
(項目22)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目21に記載の薬学的組成物。
(項目23)
R4及びR5の一方が水素である、項目22に記載の薬学的組成物。
(項目24)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目22に記載の薬学的組成物。
(項目25)
Aが2,6−ジメチルフェニルである、項目22に記載の薬学的組成物。
(項目26)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目25に記載の薬学的組成物。
(項目27)
経口投与形態の、項目20〜26の何れか1項に記載の薬学的組成物。
(項目28)
生物活性剤であって、前記薬剤が以下の化学式の化合物であって:
【化4】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
生物活性剤。
(項目29)
m及びxの一方が0であり、他方が0、2又は4である、項目28に記載の生物活性剤。
(項目30)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目29に記載の生物活性剤。
(項目31)
R4及びR5の一方が水素である、項目30に記載の生物活性剤。
(項目32)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目30に記載の生物活性剤。
(項目33)
Aが2,6−ジメチルフェニルである、項目30に記載の生物活性剤。
(項目34)
2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目33に記載の生物活性剤。
【図面の簡単な説明】
【0014】
【図1】ヒトPPARαトランス活性化検定における化合物CWの用量−反応曲線である。
【発明を実施するための形態】
【0015】
定義
本明細書で使用される「アルキル」は、直鎖又は分岐鎖アルキル基を意味する。特定の炭素原子数を有するものとして同定されるアルキル基は、所定の炭素数を有するアルキル基を意味する。例えば、3個の炭素原子を有するアルキルは、プロピル又はイソプロピルであってよく、4個の炭素原子を有するアルキルは、n−ブチル、1−メチルプロピル、2−メチルプロピル又はt−ブチルであってよい。
【0016】
本明細書で使用される「ハロ」は、1つ以上のフルオロ、クロロ、ブロモ及びヨードを指す。
【0017】
本明細書で使用される、ペルフルオロメチル又はペルフルオロメトキシの場合のような「ペルフルオロ」とは、当該基が水素原子の全てに代わってフッ素原子を有することを意味する。
【0018】
本明細書で使用される「Ac」は、CH3C(O)−基を指す。
【0019】
本明細書において、特定の化学化合物は、それぞれの化学名又は以下に示される2文字のコードにより表される。化合物CW、CX及びDPは、上に示す化学式Iの範囲内に含まれる。
CW 2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−メチル酢酸
CX 2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−エチル酢酸
DP 3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−メチルプロパン酸
本明細書で使用される「含む(comprising)」という移行句は、オープンエンド形式である。この用語を使用する請求項は、このような請求項において列挙されるものに加えて複数の要素を含有してよい。
【0020】
本発明の化合物
上記の化学式Iの図のアスタリスクは、キラル中心を示す。本発明は、化学式Iの化合物のラセミ体、(R)型鏡像異性体、及び(S)型鏡像異性体を提供し、これらは全て活性である。これらの鏡像異性体の混合物は、例えば、Chirality 11:420−425 (1999)に記載の通り、HPLCを使用することによって分離してもよい。
【0021】
上記の要約に記載の薬剤、使用、方法又は薬学的組成物の実施形態において、xは0であり、mは0、1、2、3又は4である。より具体的な実施形態において、mは0、2又は4である。別の実施形態において、mは0であり、xは0、1、2、3又は4である。より具体的な実施形態において、xは0、2又は4である。
【0022】
上記の要約に記載の薬剤、使用、方法又は薬学的組成物の実施形態において、nは1であり;qは0であり;tは0であり;R3は水素であり;Aは、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである。より具体的な実施形態において、Aは、2,6−ジメチルフェニルである。このような化合物の例には、化合物CW、CX及びDPが含まれる。
【0023】
本発明の生物活性剤の好ましい実施形態において、本薬剤は、実質的に(少なくとも98%)純粋な形態である。
【0024】
反応スキーム
本発明の生物活性剤を、以下の反応スキームに従い作製することができる。
化学式Iの化合物であって、式中、mが0であり、xが0又は1であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が、1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0025】
【化6】

(式中、Aは上に記載されている)は、スキーム1の反応スキームを介して調製することができる。
【0026】
スキーム1の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。R1は、1〜2個の炭素原子を有するアルキル基である。R7は、1〜3個の炭素原子を有するアルキル基であり、Y1はハロゲン化物である。
【0027】
化学式IIの化合物を、手順(a)の反応を介して化学式IIIの化合物でアルキル化し、化学式IVの化合物を生成する。反応は、テトラヒドロフラン、テトラヒドロフラン/1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン、テトラヒドロフラン/ヘキサメチルホスホルアミド等の適切な溶媒において行われる。一般的に、反応は、2〜3モル当量の塩基の存在下において行われ、化学式IVの化合物(式中、R4は、1〜3個の炭素原子を有するアルキルであり、R5は、水素又は4〜6モル当量の塩基である)を生成するか、又は化学式IVの化合物(式中、R4及びR5は、1〜3個の炭素原子を有するアルキルである)を生成する。これを行うための従来の塩基は、水素化ナトリウム、水素化カリウム、カリウムビス(トリメチルシリル)アミド、リチウムビス(トリメチルシリル)アミド、リチウムジイソプロピルアミド等であってよい。本反応を実施する場合、一般的には、ヘキサメチルジシランのアルカリ金属塩を使用するのが好ましい。反応は、−78℃〜25℃にて行われる。一般的に、反応には6〜72時間が必要となる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0028】
化学式IVの化合物は、化学式Iの化合物であって、式中、R1が、1〜2個の炭素原子を有するアルキル基である、化合物である。化学式IVの化合物は、エステル加水分解により、遊離酸、即ち、化学式Iの化合物(式中、R1はHである)に変換することができる。エステル加水分解の従来の何れかの方法によっても、化学式Iの化合物(式中、R1はHである)が生成される。
【0029】
Aがヒドロキシルの1又は2個の基により置換されるフェニルである場合、一般的には、化学式IIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T.
GreeneによるProtective Groups in Organic Synthesisに記載されている。
【0030】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0031】
反応スキーム1
【0032】
【化7】

化学式Iの化合物であって、式中、mが1〜4であり、xが0であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0033】
【化8】

(式中、Aは上に記載されている)は、スキーム2の反応スキームを介して調製することができる。
【0034】
スキーム2の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。R1は、1〜2個の炭素原子を有するアルキル基である。Y1は、ハロゲン化物である。
【0035】
化学式IVの化合物は、手順(b)の反応を介して化学式Vの化合物に環元することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応はテトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(b)の反応を実施することができる。
【0036】
化学式Vの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式VIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の条件の何れかを利用して、手順(c)の反応を実施することができる。
【0037】
化学式VIの化合物は、化学式VIをシアン化アルカリ金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式VIIの化合物に変換することができる。反応は、N,N−ジメチルホルムアミド、エタノール、ジメチルスルホキシド等の適切な溶媒において行われる。ニトリルの調製に従来使用されている条件の何れかを利用して、手順(d)の反応を実施することができる。
【0038】
化学式VIIの化合物は、酸又は塩基の加水分解により反応手順(e)を介して化学式VIIIの化合物に変換することができる。本反応を実施する場合、一般的には、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解に従来使用されている条件の何れかを利用して、手順(e)の反応を実施することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0039】
化学式VIIIの化合物は、化学式Iの化合物であって、式中、mが1であり、R1がHである、化合物である。
【0040】
化学式VIIIの化合物は、化学式VIIIの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0041】
化学式VIの化合物は、適切な塩基、例えば水素化ナトリウムを利用して、マロン酸ジエチルと反応させ、化学式IXの化合物を得ることができる。反応は、ジメチルホルムアミド、テトラヒドロフラン等の適切な溶媒において行われる。このようなアルキル化反応で慣行の条件の何れかを利用して、手順(f)の反応を実施することができる。
【0042】
化学式IXの化合物は、エタノール水等の適切な溶媒として水酸化ナトリウムを利用して、加水分解及び脱カルボキシル化し、化学式Xの化合物を得ることができる。このような反応で慣行の条件の何れかを利用して、手順(g)の反応を実施することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0043】
化学式Xの化合物は、化学式Iの化合物であって、式中、mが2であり、R1がHである、化合物である。
【0044】
化学式Xの化合物は、化学式Xの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0045】
化学式Xの化合物を環元し、手順(h)の反応を介して化学式XIの化合物を得ることができる。本反応を前述の手順(b)の反応と同じ様式において実施することができる。
【0046】
化学式XIの化合物は、手順(c)の反応と合わせて、前述と同じ様式の手順(i)の反応を介して化学式VIIの化合物に変換することができる。
【0047】
化学式XIIの化合物は、手順(d)の反応と合わせて、前述と同じ様式の手順(j)の反応を介して化学式VIIIの化合物に変換することができる。
【0048】
化学式XIIIの化合物は、手順(e)の反応と合わせて、前述と同じ様式の手順(k)の反応を介して化学式VIVの化合物に変換することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0049】
化学式XIVの化合物は、化学式Iの化合物であって、式中、mが3であり、R1がHである、化合物である。
【0050】
化学式XIVの化合物は、化学式XIVの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0051】
化学式XIIの化合物は、手順(f)の反応と合わせて、前述と同じ様式の手順(l)の反応を介して化学式XVの化合物に変換することができる。
【0052】
化学式XVの化合物は、手順(g)の反応と合わせて、前述と同じ様式の手順(m)の反応を介して化学式XVIの化合物に変換することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0053】
化学式XVIの化合物は、化学式Iの化合物であって、式中、mが4であり、R1がHである、化合物である。
【0054】
化学式XVIの化合物は、化学式XVIの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0055】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的に、化学式IVの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0056】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0057】
反応スキーム2
【0058】
【化9】

化学式Iであって、式中、xが2〜4であり、mが0であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が、水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0059】
【化10】

(式中、Aは上に記載されている)は、スキーム3の反応スキームを介して調製することができる。
【0060】
スキーム3の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。Yは、ハロゲン化物又は放出基であり、pは2〜4であり、sは1〜3であり、uは1〜3であり、Y1はハロゲン化物である。R1は、1〜2個の炭素原子を有するアルキル基である。
【0061】
化学式XVIIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用してXVIIをXVIIIで光延縮合することにより、手順(n)の反応を介して化学式XIXの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて実施することができる。光延反応において従来使用されている条件の何れかを利用して、手順(n)の反応を実施することができる。
【0062】
化学式XIXの化合物は又、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基を使用することにより、手順(o)の反応を介して化学式XXの化合物又は化学式XXIの化合物で化学式XVIIの化合物をエーテル化又はアルキル化することにより調製することもできる。化学式XXIの化合物において、Yには、メシルオキシ、トシルオキシ、クロロ、ブロモ、ヨード等が含まれるが、これらに限定されない。ハロゲン化物又は放出基でヒドロキシル基をアルキル化する従来の何れかの条件を利用して、手順(o)の反応を実施することができる。手順(o)の反応は、化学式XXIの化合物が容易に利用可能である場合、手順(n)以降が好ましい。
【0063】
化学式XIXの化合物は、化学式XXIIの化合物で化学式XIXの化合物を処理することによりウィッティヒ反応を使用する手順(p)の反応を介して化学式XXIIIの化合物に変換する。アルデヒドとハロゲン酸トリアリールホスフィンを反応させる従来の何れかの方法を利用して、手順(p)の反応を実施することができる。ウィッティヒ反応で慣行の条件の何れかを利用して、手順(p)の反応を実施することができる。生成物は、抽出、気化、クロマトグラフィー及び再結晶等の技法により分離し、精製することができる。
【0064】
化学式XXIIIの化合物は、水素化により手順(q)の反応を介して化学式XXIVの化合物に変換される。反応は、クロロトリス(トリフェニルホスフィン)ロジウム(ウィルキンソン触媒)を利用して行われる。反応は、適切な溶媒、例えば、無水エタノール等において行われる。このような反応で慣行の条件の何れかを利用して、手順(q)の反応を実施することができる。生成物は、抽出、気化、クロマトグラフィー及び再結晶等の技法により分離し、精製することができる。
【0065】
化学式XXIVの化合物は、手順(r)の反応を介して化学式IIIの化合物でアルキル化し、化学式XXVの化合物を生成する。反応は、テトラヒドロフラン、テトラヒドロフラン/1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン、テトラヒドロフラン/ヘキサメチルホスホルアミド等の適切な溶媒において行われる。一般的に、反応は、2〜3モル当量の塩基の存在下において行われ、化学式XXVの化合物(式中、R4は1〜3個の炭素原子を有するアルキルであり、R5は水素又は4〜6モル当量の塩基である)を生成するか、又は化学式XXVの化合物(式中、R4及びR5は、1〜3個の炭素原子を有するアルキルである)を生成する。これを行うための従来の塩基は、水素化ナトリウム、水素化カリウム、カリウムビス(トリメチルシリル)アミド、リチウムビス(トリメチルシリル)アミド、リチウムジイソプロピルアミド等であってよい。本反応を実施する場合、一般的には、ヘキサメチルジシランのアルカリ金属塩を使用するのが好ましい。反応は、−78℃〜25℃にて実施される。一般的に、反応には6〜72時間が必要となる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0066】
化学式XXVの化合物は、化学式Iの化合物であって、式中、R1が、1〜2個の炭素原子を有するアルキル基である、化合物である。化学式XXVの化合物は、エステル加水分解により、遊離酸、即ち、化学式Iの化合物(式中、R1はHである)に変換することができる。エステル加水分解の従来の何れかの方法によって、化学式Iの化合物(式中、R1はHである)が生成される。
【0067】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、化学式XVIIIの化合物、化学式XXの化合物及び化学式XXIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0068】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0069】
反応スキーム3
【0070】
【化11】

化学式IIであって、式中、mが0であり、xが0であり、qが0であり、tが0又は1であり、nが1又は2であり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0071】
【化12】

(式中、Aは上に記載されている)は、スキーム4の反応スキームを介して調製することができる。
【0072】
スキーム4の反応スキームにおいて、A、t、n、m、q、x、R1及びR3は上に記載されている。Yは、ハロゲン化物又は放出基である。
【0073】
化学式XXVIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用して、XXVIをXVIIで光延縮合を使用する手順(s)の反応を介して化学式IIの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて行われる。光延反応において従来使用されている条件の何れかを利用して、手順(s)の反応を実施することができる。
【0074】
化学式IIの化合物は又、手順(s)の反応を介して化学式XXIの化合物で化学式XXVIの化合物をエーテル化又はアルキル化することにより調製することができる。化学式XXIの化合物において、Yには、メシルオキシ、トシルオキシ、クロロ、ブロモ、ヨード等が含まれるが、これらに限定されない。ハロゲン化物又は放出基との反応により、ヒドロキシル基をエーテル化する従来の何れかの方法を利用して、手順(s)の反応を実施することができる。
【0075】
反応スキーム4
【0076】
【化13】

化学式IIであって、式中、mが0であり、xが0であり、qが1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0077】
【化14】

(式中、Aは上に記載されている)は、スキーム5の反応スキームを介して調製することができる。
【0078】
スキーム5の反応スキームにおいて、A、t、m、n、q、x、R1、R2及びR3は上に記載されている。Y1は、ハロゲン化物である。
【0079】
化学式XXVIIの化合物は、メシレート化して、手順(t)の反応を介して化学式XXVIIIの化合物を供給することができる。ヒドロキシル基のメシレート化反応を実施する従来の何れかの条件を利用して、手順(t)を実施することができる。次いで、化学式XXVIIIの化合物を化学式XXIXの化合物で加熱し、化学式XXXの化合物を生成する。アミノアルコールを生成する慣行の条件の何れかを利用して、手順(u)の反応を実施することができる。
【0080】
化学式XXXの化合物において、アルコールを塩化オキサリル、塩化チオニル、臭素、三臭化リン等で化学式XXXの化合物を処理することによりクロロ又はブロモにより置き換えられ、化学式XXの化合物を生成することができる。アルコールをクロロ又はブロモで置き換える従来の何れかの方法を利用して、手順(v)の反応を実施することができる。
【0081】
化学式XXの化合物は、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基の存在下において、手順(w)の反応を介して化学式XXVIの化合物と反応させることができる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン、ジクロロメタン等の従来の溶媒において行われ、化学式IIに対応する化合物を生成する。クロロ又はブロモで、塩基(好ましい塩基は炭酸カリウムである)の存在下において、ヒドロキシル基のエーテル化の従来の何れかの方法を利用して、手順(w)の反応を実施することができる。
【0082】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、ヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0083】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0084】
反応スキーム5
【0085】
【化15】

化学式XXVIであって、式中、mが0であり、xが0であり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0086】
【化16】

は、スキーム6の反応スキームを介して調製することができる。
【0087】
スキーム6の反応スキームにおいて、R1及びR3は、上に記載されている。Y1は、ハロゲン化物である。
【0088】
化学式XXXIの化合物を環元して、手順(x)の反応を介して化学式XXXIIの化合物得ることができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応は、テトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(x)の反応を実施することができる。
【0089】
化学式XXXIIの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式XXXIIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の条件の何れかを利用して、手順(y)の反応を実施することができる。
【0090】
化学式XXXIIIの化合物は、XXXIIIとシアン化金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式XXXIVの化合物に変換することができる。反応は、N,N−ジメチルホルムアミド、エタノール、ジメチルスルホキシド等の適切な溶媒において行われる。ニトリルの調製において従来使用されている条件の何れかを利用して、手順(z)の反応を実施することができる。
【0091】
化学式XXXIVの化合物は、酸又は塩基の加水分解により手順(a’)の反応を介して化学式XXXVの化合物に変換することができる。本反応を実施する場合、一般的に、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解において従来使用されている条件の何れかを利用して、手順(a’)の反応を実施することができる。
【0092】
化学式XXXVの化合物は、化学式XXXVの化合物をメタノール又はエタノールでエステル化することにより、化学式XXVIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(b’)の反応を実施することができる。
【0093】
反応スキーム6
【0094】
【化17】

化学式XVIIIであって、式中、tが0又は1であり、nが1又は2である、化合物、即ち、以下の化学式の化合物:
A−(CH2)t+n−OH
及び化学式XXIであって、式中、tが0又は1であり、nが1又は2である、化合物、即ち、以下の化学式の化合物:
A−(CH2)t+n−Y
は、スキーム7の反応スキームを介して調製することができる。
【0095】
スキーム7の反応において、Aは上に記載されている。Yは、放出基である。
【0096】
化学式XXXVIの化合物は、手順(c’)の反応を介して化学式XXXVIIの化合物に環元することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応は、テトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(c’)の反応を実施することができる。
【0097】
化学式XXXVIIの化合物は、化学式XVIIIの化合物であって、式中、tが0であり、nが1である、化合物である。
【0098】
化学式XXXVIIの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式XXXVIIIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の幾つかの条件を利用して、手順(d’)の反応を実施することができる。
【0099】
化学式XXXVIIIの化合物は、化学式XXIの化合物であって、式中、tが0であり、nが1である、化合物である。
【0100】
化学式XXXVIIIの化合物は、XXXVIIIとシアン化金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式XXXIXの化合物に変換することができる。反応は、エタノール、ジメチルスルホキシド及びN,N−ジメチルホルムアミド並びに同等物等の適切な溶媒において行われる。ニトリルの調製において従来使用されている条件の何れかを利用して、手順(e’)の反応を実施することができる。
【0101】
化学式XXXIXの化合物は、酸又は塩基の加水分解により、反応手順(f’)を介して化学式XLの化合物に変換することができる。本反応を実施する場合、一般的に、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解において従来使用されている条件の何れかを利用して、手順(f’)の反応を実施することができる。
【0102】
化学式XLの化合物を環元し、手順(g’)の反応を介して化学式XLIの化合物を得ることができる。本反応を前述の手順(c’)の反応と同じ様式において実施することができる。
【0103】
化学式XLIの化合物は、化学式XVIIIの化合物であって、式中、tが1であり、nが1である、化合物である。
【0104】
化学式XLIの化合物は、手順(d’)の反応と合わせて、前述と同じ様式の手順(h’)の反応を介して化学式XLIIの化合物に変換することができる。
【0105】
化学式XLIIの化合物は、化学式XXIの化合物であって、式中、tが1であり、nが1である、化合物である。
【0106】
化学式XXXVIIIの化合物は、適切な塩基、例えば水素化ナトリウムを利用して、マロン酸ジエチルと反応させ、化学式XLIIIの化合物を得ることができる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン等の適切な溶媒において行われる。このようなアルキル化反応で慣行の条件の何れかを利用して、手順(i’)の反応を実施することができる。
【0107】
化学式XLIIIの化合物は、エタノール水等の適切な溶媒の水酸化ナトリウムを利用して加水分解及び脱カルボキシル化し、化学式XLIVの化合物を得ることができる。このような反応で慣行の条件の何れかを利用して、手順(j’)の反応を実施することができる。
【0108】
化学式XLIVの化合物は、手順(c’)の反応と合わせて、前述と同じ様式の手順(k’)の反応を介して化学式XLVの化合物に変換することができる。
【0109】
化学式XLIVの化合物は、化学式XVIIIの化合物であって、式中、tが1であり、nが2である、化合物である。
【0110】
化学式XLVの化合物は、手順(d’)の反応と合わせて、前述と同じ様式の手順(l’)の反応を介して化学式XLVIの化合物に変換することができる。
【0111】
化学式XLVIの化合物は、化学式XXIの化合物であって、式中、tが1であり、nが2である、化合物である。
【0112】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、化学式XXXVIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. GreeneによるProtective Groups in Organic
Synthesisに記載されている。
【0113】
保護基は、T.GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0114】
反応スキーム7
【0115】
【化18】

化学式XXXIであって、式中、R3がハロである、化合物、即ち、以下の化学式の化合物:
【0116】
【化19】

は、市販されているか、又は以下の文献に記載されている方法に従って調製することができるかのどちらかである。
1.3−BrまたはF−2−OHC6H3CO2H
Canadian Journal of Chemistry(2001),79(11)1541−1545.
2.4−Br−2−OHC6H3CO2H
WO 9916747またはJP 04154773.
3.2−Br−6−OHC6H3CO2H
JP 47039101.
4.2−Br−3−OHC6H3CO2H
WO 9628423.
5.4−Br−3−OHC6H3CO2H
WO 2001002388.
6.3−Br−5−OHC6H3CO2H
Journal of labelled Compounds and Radiopharmaceuticals(1992),31(3),175−82.
7.2−Br−5−OHC6H3CO2Hおよび3−Cl−4−OHC6H3CO2H
WO 9405153およびUS 5519133.
8.2−Br−4−OHC6H3CO2Hおよび3−Br−4−OHC6H3CO2H
WO 200220183239.2−Cl−6−OHC6H3CO2H
JP 06293700
10.2−Cl−3−OHC6H3CO2H
Proceedings of the Indiana Academy of Science(1983),Volume date 1982,92,145−51.
11.3−Cl−5−OHC6H3CO2H
WO 2002000633およびWO 2002044145.
12.2−Cl−5−OHC6H3CO2H
WO 9745400.
13.5−I−2−OHC6H3CO2Hおよび3−I,2−OHC6H3CO2H
Z.Chem.(1976),16(8),319−320.
14.4−I−2−OHC6H3CO2H
Journal of Chemical Research,Synopses(1994),(11),405.
15.6−I−2−OHC6H3CO2H
US 4932999.
16.2−I−3−OHC6H3CO2Hおよび4−I−3−OHC6H3CO2H
WO 9912928.
17.5−I−3−OHC6H3CO2H
J.Med.Chem.(1973),16(6),684−7.
18.2−I−4−OHC6H3CO2H
Collection of Czechoslovak Chemical Communications,(1991),56(2),459−77.
19.3−I−4−OHC6H3CO2,
J.O.C.(1990),55(18),5287−91.
化学式XXXIの化合物であって、式中、R3が1〜3個の炭素原子を有するアルコキシである、化合物、即ち、以下の化学式の化合物:
【0117】
【化20】

は、スキーム8の反応スキームを介して調製することができる。
【0118】
スキーム8の反応スキームにおいて、R1及びR3は上に記載されている。Rは、1〜2個の炭素原子を有するアルキル基である。R8は、1〜3個の炭素原子を有するアルキルである。Y1はハロゲン化物である。
【0119】
化学式XLVIIの化合物は、アルデヒドを第1級アルコールに環元することにより、化学式XLVIIIの化合物に変換することができる。本反応を実施する場合、環元剤として水素化ホウ素ナトリウムを使用するのが好ましいが、これに限定されない。このような環元反応に適した条件の何れかを利用して、手順(m’)の反応を実施することができる。
【0120】
化学式XLVIIIの化合物は、1,1,3,3−テトライソプロピルジシルオキサンを使用して、ジオール1〜3個を保護することにより、手順(n’)の反応を介して化学式XLIXの化合物に変換することができる。
【0121】
この保護基に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0122】
化学式XLIXの化合物は、臭化ベンジルを使用して、フェノール基を保護することにより、手順(o’)の反応を介して化学式Lの化合物に変換することができる。この保護基に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0123】
化学式Lの化合物は、フッ化テトラブチルアンモニウムを使用して脱保護することにより、手順(p’)の反応を介して化学式LIの化合物に変換することができる。脱保護に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0124】
化学式LIの化合物は、酸化により手順(q’)の反応を介して化学式LIIの化合物に変換することができる。第1級アルコールを酸、例えば、酸化クロム等に変換する従来の何れかの酸化基を利用して、手順(q’)の反応を実施することができる。
【0125】
化学式LIIの化合物は、化学式LIIの化合物をメタノール又はエタノールでエステル化することにより化学式LIIIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(r’)反応を実施することができる。
【0126】
化学式LIIIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用して、LIIIをLIVで光延縮合を使用する手順(s’)の反応を介して化学式LVIの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて実施することができる。光延反応において従来使用されている条件の何れかを利用して、手順(s’)の反応を実施することができる。
【0127】
又、化学式LIIIの化合物は、手順(s’)の反応の場合、化学式LVの化合物で化学式LIIIの化合物をエーテル化又はアルキル化することにより、化学式LVIの化合物に変換することができる。この反応は、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基を使用することにより行われる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン、ジクロロメタン等の従来の溶媒において行われる。クロロ又はブロモで、塩基(好ましい塩基は炭酸カリウムである)の存在下においてヒドロキシル基のエーテル化の従来の何れかの方法を利用して、手順(s’)の反応を実施することができる。
【0128】
化学式LVIの化合物は、エステル及びベンジル基の脱保護により、手順(t’)の反応を介して化学式XXXIの化合物に変換することができる。適切な脱保護試薬は、T.
GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0129】
反応スキーム8
【0130】
【化21】

化学式XXXIであって、式中、R3が1〜3個の炭素原子を有するアルコキシである、化合物、即ち、以下の化学式の化合物:
【0131】
【化22】

は、市販されているか、又は以下の文献に記載されている方法に従い調製することができるかのどちらかである。
1. 2−OMe−4−OHC6H3CO2H
US 2001034343またはWO 9725992.
2. 5−OMe−3−OHC6H3CO2H
J.O.C(2001),66(23),7883−88.
3. 2−OMe−5−OHC6H3CO2H
US 6194406(P.96)およびJournal of the American Chemical Society(1985),107(8),2571−3.4. 3−OEt−5−OHC6H3CO2H
Taiwan Kexue(1996),49(1),51−56.
5.4−OEt−3−OHC6H3CO2HWO 9626176
6.2−OEt−4−OHC6H3CO2H
Takeda Kenkyusho Nempo(1965),24,221−8.
JP 07070025.
7.3−OEt−4−OHC6H3CO2H
WO 9626176.
8.3−OPr−2−OHC6H3CO2H
JP 07206658,DE 2749518.
9.4−OPr−2−OHC6H3CO2H
Farmacia(Bucharest)(1970),18(8),461−6.
JP 08119959.
10.2−OPr−5−OHC6H3CO2Hおよび2−OEt−5−OHC6H3CO2H
ヨウ化プロピルおよびヨウ化エチルを用いることによって、US 6194406(P.96)からの合成に適合させる。
11.4−OPr−3−OHC6H3CO2H
WO 9626176からの合成に適合させる。
12.2−OPr−4−OHC6H3CO2H
ハロゲン化プロピルを用いることによって、Takeda Kenkyusho Nempo(1965),24,221−8からの合成に適合させる。
13.4−OEt−3−OHC6H3CO2H
Biomedical Mass Spectrometry(1985),12(4),163−9.
14.3−OPr−5−OHC6H3CO2H
ハロゲン化プロピルを用いることによって、Taiwan Kexue(1996),49(1),51−56からの合成に適合させる。
【0132】
化学式XXXI(式中、R3が1〜3個の炭素原子を有するアルキル、即ち、式の化合物である):
【0133】
【化23】

は、市販されているか、又は以下の文献に記載されている方法に従い調製することができるかのどちらかである。
1.5−Me−3−OHC6H3CO2Hおよび2−Me−5−OHC6H3CO2H
WO 9619437.
J.O.C.2001,66,7883−88.
2.2−Me−4−OHC6H3CO2H
WO 8503701.
3.3−Et−2−OHC6H3CO2Hおよび5−Et−2−OHC6H3CO2H
J.Med.Chem.(1971),14(3),265.
4.4−Et−2−OHC6H3CO2H
Yaoxue Xuebao(1998),33(1),67−71.
5.2−Et−6−OHC6H3CO2Hおよび2−n−Pr−6−OHC6H3CO2H
J.Chem.Soc.,Perkin Trans 1(1979),(8),2069−78.
6.2−Et−3−OHC6H3CO2H
JP 10087489およびWO 9628423.
7.4−Et−3−OHC6H3CO2H
J.O.C.2001,66,7883−88.
WO 9504046.
8.2−Et−5−OHC6H3CO2H
J.A.C.S(1974),96(7),2121−9.
9.2−Et−4−OHC6H3CO2Hおよび3−Et−4−OHC6H3CO2H
JP 04282345.
10.3−n−Pr−2−OHC6H3CO2H
J.O.C(1991),56(14),4525−29.
11.4−n−Pr−2−OHC6H3CO2H
EP 279630.
12.5−n−Pr−2−OHC6H3CO2H
J.Med.Chem(1981),24(10),1245−49.
13.2−n−Pr−3−OHC6H3CO2H
WO 9509843およびWO 9628423.
14.4−n−Pr−3−OHC6H3CO2H
WO 9504046.
15.2−n−Pr−5−OHC6H3CO2H
αホルミル吉草酸エチルを用いることによってJ.A.C.S(1974),96(7),2121−9からの合成に適合させる。
16.3−n−Pr−4−OHC6H3CO2H
Polymer(1991),32(11)2096−105.
17.2−n−Pr−4−OHC6H3CO2H
3−プロピルフェノールは、メチル化されて3−プロピルアニソールになり得、これは、次いでホルミル化されて、4−メトキシ−3−ベンズアルデヒドになり得る。このアルデヒドは、Jone’s試薬によって酸化されて、対応する酸を生じ得、そしてBBr3によるメチル基の脱保護は、表題化合物を生じる。
18.1.3−Et−5−OHC6H3CO2Hおよび3−Pr−n−5−OHC6H3CO2H
2−エチルアクロレインおよび2−プロピルアクロレインを用いることによって、J.O.C.2001,66,7883−88からの合成に適合させる。
【0134】
化学式XVIIであって、式中、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0135】
【化24】

は、スキーム9の反応を介して調製することができる。
【0136】
スキーム9の反応スキームにおいて、R3は上に記載されている。Rは、1〜2個の炭素原子を有するアルキル基であり、Pは保護基である。
【0137】
化学式LVIIの化合物は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されたもの等の適切な保護基を利用することにより、ヒドロキシ基を保護することにより、手順(u’)の反応を介して化学式LVIIIの化合物に変換することができる。化学式LVIIIの化合物は、酸をアルコールに環元することにより、手順(v’)の反応を介して化学式LIXの化合物に変換することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して実施することができる。反応は、テトラヒドロフラン等の適切な溶媒において実施することができる。このような環元反応で慣行の条件の何れかを利用して、手順(v’)の反応を実施することができる。
【0138】
化合物LIXの化合物は、アルコールをアルデヒドに酸化することにより、手順(w’)の反応を介して、化学式LXの化合物に変換することができる。反応は、Swern酸化条件(J.O.C. 2001, 66, 7901−7909)等下において、適切な酸化剤、例えば、クロロクロム酸ピリジニウム、2,4,6−トリクロロ[1,3,5]−トリアジンにより活性化されたジメチルスルホキシド(塩化シアヌル、TCT)を利用して実施することができる。このような酸化反応で慣行の条件の何れかを利用して、手順(w’)の反応を実施することができる。
【0139】
化学式LXの化合物において、ヒドロキシ基をT. GreeneによるProtecting Groups in Organic Synthesisに記載されたもの等の適切な脱保護試薬を利用することにより、手順(x’)の反応を介して脱保護することができる。
【0140】
反応スキーム9
【0141】
【化25】

化学式XXIIであって、式中、R1が1〜2個の炭素原子を有するアルキル基であり、pが2〜4である、化合物、即ち、以下の化学式の化合物:
Ph3P+−(CH2)PCO2R1}Br−
は、スキーム10の反応を介して調製することができる。
【0142】
スキーム10の反応スキームにおいて、R1及びpは上に記載されている。
【0143】
化学式LXIの化合物は、手順(y’)の反応を介して化学式LXIIの化合物と反応し、化学式XXIIの化合物を得る。トリフェニルホスフィンとハロゲン酸を反応させる場合に従来使用されている条件の何れかを利用して、手順(y’)の反応を実施することができる。
【0144】
反応スキーム10
【0145】
【化26】

化学式LVIIであって、式中、Rが1〜2個の炭素原子を有するアルキル基であり、R3がハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0146】
【化27】

は、スキーム11の反応を介して調製することができる。
【0147】
スキーム11の反応において、R3及びRは上に記載されている。
【0148】
化学式XXXIの化合物は、化学式XXXIの化合物をメタノール又はエタノールでエステル化することにより、手順(z’)の反応を介して化学式LVIIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(z’)の反応を実施することができる。
【0149】
反応スキーム11
【0150】
【化28】

治療方法としての使用
本発明は、インスリン抵抗性症候群、糖尿病(I型糖尿病又はII型糖尿病等の一次性本態性糖尿病及び二次性非本態性糖尿病)及び多嚢胞性卵巣症候群からなる群から選択される病態を有する哺乳動物の被験体を処置する方法であって、被験体に病態の処置に有効な本明細書に記載の生物活性剤の有効量を投与することを含む、方法を提供する。本発明の方法において、糖尿病又は、各症状が糖尿病に関連する、アテローム動脈硬化症、肥満、高血圧、高脂質血症、脂肪肝症候群、腎症、神経障害、網膜症、下肢潰瘍及び白内障の症状等の糖尿病の症状を進行させる可能性を軽減することができる。本発明は又、高脂血症を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。実施例に示す通り、化合物は、高脂血症動物の血清トリグリセリド及び遊離脂肪酸を減少させる。本発明は又、悪質液を処置する方法であって、悪質液の治療に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明は又、肥満を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明は又、アテローム性動脈硬化症又は動脈硬化症から選択される病態を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明の活性剤は、被験体が糖尿病又はインスリン抵抗性症候群を有するにかかわらず、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症又は動脈硬化症の治療に有効である。本薬剤を何れかの従来の全身投与経路により投与することができる。好ましくは、本薬剤を経口投与する。更に、医薬品を経口投与用に配合するのが好ましい。本発明において、使用することができる他の投与経路には、経腸、非経口、注射(例えば、静脈内、皮下、筋肉中又は腹腔内注射)又は経鼻が含まれる。
【0151】
本発明の処置の使用及び方法の更なる実施形態はそれぞれ、上記の生物活性剤の実施形態の何れか1つを投与することを含む。不必要な冗長を避ける目的において、このような薬剤及び薬剤群を、それぞれ繰り返さないが、繰り返す場合と同じく、処置の使用及び方法を本説明に組み込む。
【0152】
本発明の化合物により対処される疾患又は障害の多くは、インスリン抵抗性症候群及び慢性高血糖の結果の2つに大きく分類される。燃料代謝の調節異常、特にインスリン抵抗性は、本来糖尿病の非存在下において生じうるが(持続性高血糖)、高脂血症、アテローム性動脈硬化症、肥満、本態性高血圧、脂肪肝疾患(NASH;非アルコール性脂肪肝炎)を含めた種々の症状、及び特に癌又は全身炎症性疾患の悪質液の場合において関連する。悪質液は又、I型糖尿病又はII型糖尿病後期に関連して生じる恐れがある。組織燃料代謝を改善することにより、本実施例の動物において明らかである場合、本発明の活性剤は、インスリン抵抗性に関連する疾患及び症状の予防、又は緩和に有用である。インスリン抵抗性に関連する一群の兆候及び症状は、個々の患者において共存している恐れがあるが、多くの場合、インスリン抵抗性に罹患した多くの生理系の脆弱性に個体差があるため、一症状のみが著しく目立つ恐れがある。それにもかかわらず、インスリン抵抗性が多くの疾患条件に大きく寄与しているため、この細胞欠陥及び分子欠陥に対処する薬剤は、インスリン抵抗性により生じる又は悪化させられる恐れのある幾つかの器官系の幾つかの症状を事実上の予防、又は緩和に有用である。
【0153】
インスリン抵抗性と同時に膵臓ランゲルハンス島によるインスリン産生不足がかなり顕著である場合、慢性高血糖が生じ、II型糖尿病(NIDDM)の発症を確定する。上に示したインスリン抵抗性に関連する代謝障害に加えて、高血糖に続く疾患症状も又、NIDDMの患者において生じる。これらは、腎症、末梢神経障害、網膜症、微小血管疾患、四肢の潰瘍及びタンパク質の非酵素的グリコシル化の結果、例えば、コラーゲン及び他の結合組織への損傷を含む。高血糖を減弱することにより、これらの糖尿病の結果の開始速度及び重症度を軽減する。何故なら、実施例において明らかな通り、本発明の活性剤及び組成物は、糖尿病の高血糖を低下させることに役立ち、これらは、慢性高血糖の合併症の予防及び緩和に有用である。
【0154】
ヒト及び非ヒト哺乳動物の被験体は共に、本発明の処置方法に従って処置することができる。特定の被験体用の本発明の特定の活性剤の適切な用量を、熟練の臨床医により臨床設定を決定することができる。インスリン抵抗性、糖尿病、高脂血症、脂肪肝疾患、悪質液又は肥満に関連する障害の処置においてヒトに経口投与する場合、一般的に、本薬剤を、1日に1〜400mgの用量において、1回〜2回投与する。マウスに経口投与する場合、一般的に、本薬剤を1日に1〜300mg/体重kgの用量を投与する。本発明の活性剤を糖尿病若しくはインスリン抵抗性症候群の単剤療法、又はこれらのタイプの疾患に利用される1つ以上の他の薬剤、例えば、インスリン放出剤、食事性インスリン放出剤、ビグアニド又はインスリン自体を組み合わせて使用する。このような追加の薬剤を標準的な臨床診療を踏まえて投与する。幾つかの場合、本発明の薬剤は、他のクラスの薬物の有効性を改善し、治療効果を維持しながら、患者に投与するこのような薬剤の用量を減少させる(及びそのため、毒性を低下させる)ことができるであろう。代表的な化合物のヒトにおいて確立された安全及び有効な容量は、メトホルミン500〜2550mg/日;グリブリド1.25〜20mg/日;グルコバンズ(メトホルミン及びグリブリドの混合配合)グリブリド1.25〜20mg/日及びメトホルミン250〜2000mg/日;アトルバスタチン10〜80mg/日;ロバスタチン10〜80mg/日;プラバスタチン10〜40mg/日及びシンバスタチン5〜80mg/日;クロフィブラート2000mg/日;ジェムフィブロジル1200〜2400mg/日;ロシグリタゾン4〜8mg/日;ピオグリタゾン15〜45mg/日;アカルボース75〜300mg/日;レパグリニド0.5〜16mg/日である。
【0155】
I型糖尿病:I型糖尿病患者は主に、インスリン投与の用量及びタイミングを適宜、調節するために頻繁に血糖をモニタリングしながら、1日に1回から複数回の用量のインスリンを自己投与することにより、疾患を管理する。慢性的高血糖は、腎症、神経障害、網膜症、下肢潰瘍及び早期死亡等の合併症につながり、過剰インスリン投与のための高血糖は、認知機能障害又は意識消失を生じる恐れがある。I型糖尿病の患者に、本発明の活性剤1〜400mg/日、錠剤又はカプセル形態において単回又は分割投与のどちらかで処置する。期待される効果により、十分な範囲の血糖を維持するために必要なインスリン投与の用量及び頻度が低下し、高血糖発作の発症率並びに重症度が低下するであろう。血糖及びグリコシル化ヘモグロビン(数か月間以上を統合した血糖コントロールの妥当性の指数)の測定並びに糖尿病の一般的な合併症の発症率及び重症度の低下により、臨床転帰主にターする。本発明の生物活性剤をランゲルハンス島移植と併用して投与し、ランゲルハンス島移植の抗糖尿病有効性の維持に役立てる。
【0156】
II型糖尿病:II型糖尿病(NIDDM)の一般的な患者は、食事及び運動のプログラム及びメトホルミン、グリブリド、レパグリニド、ロシグリタゾン又はアカルボース等の医薬品を服用することにより疾患を管理し、これらの医薬品は全て、患者の血糖コントールを改善するが、これらは全て副作用があるか、又は疾患の進行により最終的な治療に失敗することがある。ランゲルハンス島不全は、NIDDMの患者において、長期間に生じ、大部分の患者にインスリン注射が必要になる。本発明の活性剤(場合により、追加のクラスの抗糖尿病療法)を用いた毎日の治療は、血糖コントロールを改善し、ランゲルハンス島不全の割合を低下させ、糖尿病の一般的な症状の発症率及び重症度を低下させることが期待される。更に、本発明の活性剤は、血清トリグリセリド及び脂肪酸上昇を軽減し、それにより、糖尿病患者の主な死亡原因である心血管系疾患の危険を減少させる。他の糖尿病用の治療剤全ての場合と同じように、用量の最適化は、必要性、臨床効果及び副作用に対する感受性に従い、個々の患者において行われる。
【0157】
高脂血症:血中のトリグリセリド及び遊離脂肪酸濃度の上昇は、かなり多くの集団に影響を与え、アテローム性動脈硬化及び心筋梗塞の重大な危険因子である。本発明の活性剤は、高脂血症患者のトリグリセリド及び遊離脂肪酸の循環を減少させることに有用である。高脂血症患者は又、多くの場合、血中コレステロール濃度が上昇し、これは又、心血管系疾患の危険を増加させる。HMG−CoA環元酵素阻害剤(「スタチン」)等のコレステロール低下薬を本発明の薬剤に加えて高脂血症患者に投与することができ、場合により、同様な薬学的組成物に組み込まれる。
【0158】
脂肪肝疾患:かなり多くの集団は、脂肪肝疾患に罹患し、これは又、非アルコール性脂肪肝炎(NASH)として知られており、NASHは、多くの場合、肥満及び糖尿病に関連する。肝細胞と共にトリグリセリドが点在する、肝脂肪症は、肝臓が慢性炎症になりやすく(炎症性白血球の浸潤として生検被験物質において検出)、これは、線維症及び肝硬変につながる恐れがある。一般的に、脂肪肝疾患は、肝細胞傷害の指数として作用するトランスアミナーゼであるALT及びAST等の肝特異的酵素の血清濃度の上昇が認められることにより、及び多くの場合、明確な診断に生検を必要とするが、肝領域の疲労及び疼痛を含む症状の顕在により検出される。期待される利点は、肝炎症及び脂肪量の低下であり、これは、NASHの線維症及び肝硬変への進行を減弱、停止又は軽減させる。
【0159】
薬学的組成物
本発明は、本明細書に記載の生物活性剤を含む医薬生成物及び薬学的に許容される担体を提供する。本発明の薬学的組成物の更なる実施形態は、上記の生物活性剤の実施形態の何れか1つを含む。不必要な冗長を避ける目的において、このような薬剤及び薬剤群を、それぞれ繰り返さないが、繰り返す場合と同じく、薬学的組成物を本説明に組み込む。
【0160】
好ましくは、組成物は、経口投与、例えば、錠剤、被覆錠剤、糖衣錠、ハード又はソフトゼラチンカプセル、溶液、乳液又は懸濁液の形態で適応される。一般的に、経口組成物は、このような薬剤1mg〜400mgを含むであろう。被験体にとって1日当たり1つ以上の錠剤、被覆錠剤、糖衣錠又はゼラチンカプセルの服用が都合がよい。しかし、組成物は又、経腸、例えば、座剤の形態、非経口、例えば、注射溶液の形態又は経鼻を含めた幾つか他の従来の全身投与手段による投与に適応してよい。
【0161】
生物学的活性化合物は、薬学的組成物の生成に薬学的に不活性な、無機又は有機担体を使用して加工することができる。ラクロース、コーンスターチ又はその誘導体、タルク、ステアリン酸又はその塩等は、例えば、錠剤、被覆錠剤、糖衣錠及びハードゼラチンカプセル等用のこのような担体として使用することができる。ソフトゼラチンカプセルに適切な担体は、例えば、植物油、ワックス、脂肪、半固体及び液体ポリオール等である。しかし、活性成分の性質に応じて、通常、ソフトゼラチンそのもの以外のソフトゼラチンカプセルの場合、担体を必要としない。溶液及びシロップの生成に適切な担体は、例えば、水、ポリオール、グリセロール、植物油等である。座剤に適切な担体は、例えば、天然又は硬化油、ワックス、脂肪、半固体又は液体ポリオール等である。
【0162】
更に、薬学的組成物は、防腐剤、可溶化剤、安定剤、湿潤剤、乳化剤、甘味剤、着色剤、香味剤、浸透圧を変化させる塩、緩衝剤、被覆剤又は抗酸化剤を含有することができる。これらは又、更に他の治療的価値のある物質、特に抗糖尿病又は脂質低下剤を含有することができ、これは、本発明の化合物の効果を基礎としたもの以外の機序を通して作用する。単一の配合において本発明の化合物と有利に結合することができる薬剤は、メトホルミン等のビグアニド、スルホニルウレアインスリン放出剤グリブリド及び他のスルホニルウレアインスリン放出剤などのインスリン放出剤、アトロバスタチン、ロバスタチン、プラバスタチン及びシンバスタチン等の「スタチン」HMG−CoA環元酵素阻害剤などのコレステロール低下薬、クロフィブラート及びジェムフィブロジル等のPPAR−α作用薬、チアゾリジンジオン(例えば、ロシグリタゾン及びピオグリタゾン)等のPPARγ作用薬、アカルボース(デンプン消化を阻害)等のα−グルコシダーゼ阻害剤、及びレパグリニド等の食事性インスリン放出剤を含むがこれらに限定されない。単一の配合において、本発明の化合物と結合される相補剤の一定量は、標準的な臨床診療において使用される用量に一致する。代表的な特定の化合物の確立された安全及び有効用量の範囲は、上記されている。
【0163】
本発明は、以下の実施例を参照することにより理解されるが、これらの実施例は、本明細書に記載の本発明を例示するものであるが、これを制限するものではない。
【実施例】
【0164】
(実施例1)
【0165】
【化29】

2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸
手順A:3−ヒドロキシフェニル酢酸エチルの調製:
無水エタノール(250ml)中3−ヒドロキシフェニル酢酸(25g、164.31mmol)及びp−トルエンスルホン酸一水和物(3.49g、18.3mmol)溶液を4時間又は出発材料全てを消費するまで還流した。反応混合物を濃縮し、酢酸エチルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル2:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 3.5 (s, 2H); 4.1 (q, 2H); 6.6−7.2 (m, 4H).手順B:3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの調製:
THF(30ml)及びDMF(13ml)中2,6−ジメチルベンジルアルコール(5.25g、38.6mmol)及びジイソプロピルアゾジカルボキシレート(DIAD、8.49g、42mmol)溶液をTHF(100ml)中3−ヒドロキシフェニル酢酸エチル(手順A、6.66g、37mmol)及びトリフェニルホスフィン(11g、42mmol)溶液に滴加した。反応混合物を室温にて4時間撹拌し、エーテルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 3.5 (s, 2H); 4.1 (q, 2H); 5.1
(s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順C:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸エチルの調製:
乾燥アルゴン雰囲気下において、−68℃にて、乾燥THF(30ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4g、13.6mmol)にLiHMDS(THF中1M溶液、17.45ml、17.4mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3I(5.71g、40.26mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、氷でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:エーテル5:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 1.5 (t, 3H); 2.4 (s, 6H); 3.7 (m, 1H); 4.1
(q, 2H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順D:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸の調製:
無水エタノール(60ml)中2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸の撹拌溶液(手順C、3g、9.6mmol)に室温にて1N NaOH(20ml)を添加した。反応混合物を3時間撹拌し、1N HClによりpH3.5〜4.0に酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.5 (t, 3H); 2.4 (s, 6H); 3.7 (m, 1H); 5.0 (s, 2H); 6.9
(m, 2H); 7.15−7.35 (m, 5H).
(実施例2)
【0166】
【化30】

2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸
手順A:3−ヒドロキシフェニル酢酸エチルの調製:
実施例1、手順Aの方法を使用して、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 3.5 (s, 2H); 4.1 (q, 2H); 6.6−7.2 (m, 4H).手順B:3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの調製:
実施例1、手順Bの方法を使用して、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 3.5 (s, 2H); 4.1 (q, 2H); 5.1
(s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順C:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸エチルの調製:
乾燥アルゴン雰囲気下において、−78℃にて、乾燥THF(60ml)及びHMPA(15ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4.84g、16.2mmol)にLDA(THF中2M溶液、25ml、48.72mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3CH2I(10.13g、64.96mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、クエン酸水溶液でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): .9 (t, 3H); 1.2
(t, 3H); 1.8 (m, 1H); 2.1(m, 1H); 2.4 (s, 6H); 3.4 (t, 1H); 4.1 (q, 2H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.30 (m, 5H).
手順D:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸の調製:
無水エタノール(60ml)中2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸エチルの撹拌溶液(手順C、3.26g、10.0mmol)に室温にて1N NaOH(20ml)を添加した。反応混合物を3時間撹拌し、1N HClにより酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5 酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): .9 (t, 3H); 1.8
(m, 1H); 2.1(m, 1H); 2.4 (s, 6H); 3.4 (t, 1H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.30 (m, 5H).
(実施例3)
【0167】
【化31】

3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸
手順A:3−(3−ヒドロキシフェニル)プロパン酸エチルの調製:
無水エタノール(250ml)中3−ヒドロキシフェニルプロパン酸(25g、150.60mmol)及びp−トルエンスルホン酸一水和物(3.80g、20mmol)溶液を4時間又は出発材料全てを消費するまで還流した。反応混合物を濃縮し、酢酸エチルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル2:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.6 (t, 2H); 2.8 (t, 2H); 4.2 (q, 2H); 6.7−6.8 (m, 3H); 7.2 (m, 1H).
手順B:3−(2,6−ジメチルベンジルオキシ)フェニル)プロパン酸エチルの調製:
THF(30ml)及びDMF(13ml)中2,6−ジメチルベンジルアルコール(7.71g、56.7mmol)及びジイソプロピルアゾジカルボキシレート(DIAD、11.36g、56.18mmol)溶液を0℃にてTHF(100ml)中3−(3−ヒドロキシフェニル)プロパン酸エチル(手順A、10.0g、51.5mmol)及びトリフェニルホスフィン(14.73g、56.18mmol)溶液に滴加した。反応混合物を同じ温度にて4時間撹拌し、エーテルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 2.6 (t, 2H); 3.0 (t, 2H); 4.2
(q, 2H); 5.1 (s, 2H); 6.8 (m, 3H); 7.2−7.4 (m, 4H).
手順C:3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸エチルの調製:
乾燥アルゴン雰囲気下において、−68℃にて、乾燥THF(30ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4.53g、14.5mmol)にLiHMDS(THF中1M溶液、21.77ml、21.77mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3I(20.60g、145.2mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、氷でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:エーテル5:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 1.5 (t, 3H); 2.4 (s, 6H); 2.51−2.58 (m, 1H); 2.71 (dd, 1H); 2.88 (dd, 1H); 4.2 (q,
2H); 5.1 (s, 2H); 6.9 (m, 3H); 7.2−7.4
(m, 4H).
手順D:3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸の調製:
無水エタノール(25ml)中3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸エチルの撹拌溶液(手順C、1.61g、4.9mmol)に室温にて1N NaOH(10ml)を添加した。反応混合物を3時間撹拌し、1N HClによりpH3.5〜4.0に酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5 酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.5 (t, 3H); 2.4 (s, 6H); 2.51−2.58 (m, 1H); 2.71 (dd, 1H); 2.88 (dd, 1H); 5.1 (s, 2H); 6.9 (m,
3H); 7.2−7.4 (m, 4H).
以下の生物学的活性の実施例全てにおいて、化合物CWを化学合成実施例1に従い生成した。
【0168】
生物学的活性実施例
(実施例A) db/dbマウスにおける化合物CWの抗糖尿病効果
db/dbマウスは、レプチンシグナル伝達を欠失し、過食、肥満及び糖尿病につながる。更に、C57BL/6Jバックグラウンドのob/obマウスと異なり、C57BLKSバックグラウンドのdb/dbマウスは、これらのインスリン産生膵臓ランゲルハンス島細胞の機能不全があり、高インスリン症(末梢インスリン抵抗性に関連)から低インスリン性糖尿病に進行する。
【0169】
およそ8週齢の肥満(db/dbホモ接合体)C57BL/Ksola雄マウスをJacson Labs(米国メイン州バーハーバー)から得え、体重(40〜45g)及び血清グルコース濃度(摂食状態≧300mg/dl)が群間で類似するように5〜7匹の群に任意に分け、細身(db/+ヘテロ接合体)の雄マウスをコホート試験の対照として使用した。購入後最短7日間で順応した。全ての動物を温度(23℃)、相対湿度(50±5%)及び照明(7:00〜19:00)の制御下において管理し、標準的な飼料(Formulab Diet 5008、Quality Lab Products[米国メリーランド州エルクリッジ])及び水に自由に摂取できるようにした。
【0170】
マウスに、ビヒクル及び化合物CWを2週間毎日経口投与した。処置期間の最後に、静脈血100μlを血清化学分析用に後眼窩洞からヘパリン処理した毛細管チューブに採取した。マウスは、採血時、摂食状態であった。
【0171】
2週間連日の経口投与後、化合物CWは、血糖の有意な低下を誘発した(表1)。同様に、化合物CWは、血清トリグリセリドを低下させた(表2)。
【0172】
(表1:II型糖尿病のdb/dbマウス試験における血清グルコースの化合物CWの効果)
【0173】
【表1】

*p<0.05 ビヒクル対照と比較した時の有意差
(表2:db/dbマウスにおける血清トリグリセリドの化合物CWの効果)
【0174】
【表2】

(実施例B) ヒトPPARαの化合物CW活性
PPARαの化合物CW活性を試験するために、トランス活性化検定を使用した。トランス活性化検定は、核受容体の分子ドメイン構造を利用する。融合タンパク質をヒト又はマウスのPPARリガンド結合ドメイン(PPAR−LBD)と酵母Ga14DNA結合ドメイン(「アクチベータープラスミド」)との間で作製した。レポーター遺伝子構築物は、ルシフェラーゼレポーターを有するcisのGa14DNA結合要素からなる。作用薬がGa14/PPAR−LBDを結合する場合、融合タンパク質がレポーター遺伝子上のGa14DNA結合要素を結合し、ホタルルシフェラーゼ遺伝子の転写を生じる。ルシフェラーゼは、ATP依存性反応において基質ルシフェリンを酸化し、放出された光量は、酵素濃度及び結果的にはPPAR−LBDを結合するリガンド活性濃度を直接測定する。
【0175】
アクチベーターを発現するプラスミドは、酵母GAL4DNA結合ドメインを含有し、このドメインは、ヒトPPARαリガンド結合及びヒンジドメイン(a.a.167〜468)を融合した。使用されたレポータープラスミドは、pFRLucであり、これは、GAL4UAS含有プロモーターの制御下において、ホタルルシフェラーゼ遺伝子を有する(Stratagene[米国カリフォルニア州ラホーヤ])。
【0176】
トランスフェクション1日前に、細胞型に応じて、細胞を5×104〜2×105個/ウェルの密度にて24ウェルプレートに播種した。細胞をLipofectamin2000試薬(Invitrogen[米国カリフォルニア州カルスバッド])を使用してトランスフェクトした。Lipofectamin2000を、オプチメン培地50μLを含有するチューブに添加した(2.5μL/ウェル)。2つ目のチューブにおいて、プラスミドDNAを4:3(レポーター:アクチベーター)の割合で添加し、適宜、サケ精子DNAを、プラスミドを発現するアクチベーター用に置換し、合計0.8μg/ウェルのDNAを生成した。DNAをオプチメン血清低減培地50μLに添加した(血清を添加せず)。
【0177】
2つの溶液を室温にて5分間インキュベート後、結合した。結合溶液を室温にて更に30分間インキュベートし、リポソーム複合体を形成した。
【0178】
細胞をPBSで1回洗浄し、トランスフェクション混合物100μLを各ウェルに添加した。5%CO2インキュベーターにおいて、プレートを37℃にて、およそ4時間インキュベート後、トランスフェクション混合物を吸引し、新鮮なEagle最少必須培地(10%FBS及びグルタミンを補充したEMEM(Cambrex(米国ニュージャージー州イーストラザーフォード)の「EMEMコンプリート」)で培地を置き換えた。トランスフェクション24時間後、プレートをEMEMコンプリート培地において適当な化合物で処理した。処理24時間後、細胞をPBSで1回洗浄し、レポーター溶解緩衝液100μL/ウェル(Promega[米国ウィスコンシン州マディソン])を添加した。細胞を分析前に一度凍結/融解した。溶解物およそ10μLをホタルルシフェラーゼ基質100μLに添加した。
【0179】
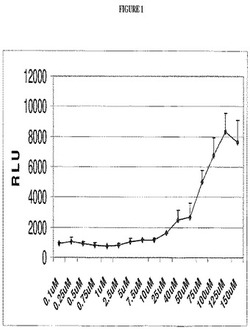
結果は、PN2069がヒトPPARαの部分作用薬であることを示す(同様の実験において、陽性対照のWy−14643は、最大活性、約40000RLUに達した)。
【0180】
図1を参照。
【技術分野】
【0001】
(関連出願の引用)
本出願は、米国仮特許出願第60/734,803号(2005年11月9日出願)に対する優先権を主張し、その内容は、本明細書中で参考として援用される。
【背景技術】
【0002】
(発明の背景)
糖尿病は、罹患率及び死亡率の主因である。慢性的な血糖上昇が以下の消耗性合併症につながる:透析又は腎移植が必要になることが多い腎症;末梢腎症;失明につながる網膜症;切断につながる下肢の潰瘍形成;肝硬変に進行することがある脂肪肝疾患;並びに冠動脈疾患及び心筋梗塞に対する脆弱性。
【0003】
糖尿病には主に2つの型がある。I型、即ちインスリン依存性糖尿病(IDDM)は、膵臓ランゲルハンス島のインスリン産生β細胞の自己免疫性の破壊による。通常、この疾患は小児期又は青年期に発症する。処置は主に、1日複数回のインスリン投与からなり、インスリン用量を調節する目安となる血糖濃度の頻回な測定と組み合わせて行う。これは、インスリン用量が過剰になると、低血糖症を生じ、その結果、脳やその他の機能に障害を生じる恐れがあるためである。
【0004】
II型、即ちインスリン非依存性糖尿病(NIDDM)は、一般的に成人期に発症する。NIDDMは、インスリン作用に対する脂肪組織、筋及び肝臓等の糖利用組織の低抗性に関連する。最初は、膵臓ランゲルハンス島β細胞が過剰なインスリンを分泌することにより代償する。最終的には、ランゲルハンス島の不全によって代償不全及び慢性的な高血糖が生じる。一方で、中等度のランゲルハンス島の機能不全が、末梢インスリン抵抗性よりも先に、又はこれと同時に発生する恐れがある。NIDDMの処置に有用な薬剤には幾つかのクラスがある:1)インスリンの放出を直接刺激して、低血糖症の危険を取り除く、インスリン放出剤;2)糖誘導性インスリン分泌を増強し、毎食前に服用しなければならない、食事性のインスリン放出剤;3)肝臓の糖新生を減衰する(逆に言えば、糖尿病では上昇する)、メトホルミンを含めたビグアナイド;4)インスリンに対する末梢の反応性を改善するが、体重増加、浮腫及び偶発性の肝臓毒性等の副作用を生じる、インスリン増感剤、例えば、チアゾリジンジオン誘導体であるロシグリタゾン及びピオグリタゾン;5)ランゲルハンス島が慢性的な過剰刺激下で機能しなくなったNIDDMの後期に必要となることが多い、インスリン注射。
【0005】
インスリン抵抗性は又、顕著な高血糖症を伴うことなく生じる恐れがあり、一般的にはアテローム性動脈硬化、肥満、高脂血症、及び本態性高血圧に関連する。この異常群は、「代謝症候群」又は「インスリン抵抗性症候群」を構成する。インスリン抵抗性は又、脂肪肝とも関連し、これは、慢性的な炎症(NASH;「非アルコール性脂肪肝炎」)、線維症及び肝硬変に進行する恐れがある。累積的に、糖尿病を含むがこれに限定されないインスリン抵抗性症候群は、40歳以上の罹患率及び死亡率の主因の多くの基となる。
【0006】
このような薬剤が存在するにもかかわらず、糖尿病は依然として、増大を続ける社会の主要な健康上の問題となっている。糖尿病の後期の合併症には、国の医療財源の大部分が費やされている。従って、インスリン抵抗性及びランゲルハンス島不全の原発性欠損に効果的に対処し、既存の薬剤に比べて副作用が少なく軽い、新規の経口活性治療剤が必要とされている。
【0007】
現在、脂肪肝疾患の安全且つ効果的な処置法は存在しない。そのため、このような処置法があれば、この病態の処置において価値のあるものになると思われる。
【0008】
特許文献1(Wellstat Therapeutics Corp.)及び特許文献2(Wellstat Therapeutics Corp.)では、酸の末尾が2つの水素により置換されている特定の化合物、例えば、4−(3−(2,6−ジメチルベンジルオキシ)フェニル)酪酸及び3−(2,6−ジメチルベンジルオキシ)フェニル酢酸が開示されている。特許文献3(Wellstat Therapeutics Corp.)では、酸の末尾がヒドロキシにより置換されている特定の化合物、例えば、4−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−4−ヒドロキシブタン酸が開示されている。但し、上述の特許公開では、以下に示す化学式Iの範囲内に含まれ、酸の末尾がアルキルにより置換されている化合物は開示されていない。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】国際公開第02/100341号パンフレット
【特許文献2】国際公開第04/073611号パンフレット
【特許文献3】国際公開第04/091486号パンフレット
【発明の概要】
【課題を解決するための手段】
【0010】
(発明の要旨)
本発明は、以下に記載の生物活性剤を提供する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を処置する医薬品の製造における、以下に記載の生物活性剤の使用を提供する。本発明は、インスリン抵抗性症候群、糖尿病、悪液質、高脂血症、脂肪肝疾患、肥満、アテローム性動脈硬化症又は動脈硬化症を有する哺乳動物の被験体を処置する方法であって、以下に記載の生物活性剤の有効量を被験体に投与することを含む、方法を提供する。本発明は、以下に記載の生物活性剤を含む薬学的組成物、及び薬学的に許容される担体を提供する。
【0011】
本発明における生物活性剤は、以下の化学式Iの化合物であって:
【0012】
【化5】

式中、nが1又は2であり;m及びnの一方が0であり、他方が0、1、2、3又は4であり;qが0又は1であり;tが0又は1であり;R2が1〜3個の炭素原子を有するアルキルであり;R3が水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;R4及びR5の一方が1〜3個の炭素原子を有するアルキルであり、他方が水素、又は1〜3個の炭素原子を有するアルキルであり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル又はエチルによりモノ置換される、シクロアルキル;或いはN、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りに共有結合する、ヘテロ芳香族環であり;R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、化合物である。或いは、R1が水素である場合に、生物活性剤は、化学式Iの化合物の薬学的に許容される塩であってよい。
【0013】
上記の生物活性剤は、ヒト糖尿病及びインスリン抵抗性症候群の動物試験により確立されている、以下に記載の1つ以上の生物学的活性検定において活性を有する。そのため、このような薬剤は、糖尿病及びインスリン抵抗性症候群の処置に有用であると考えられる。試験を行った例示の化合物は全て、これらを試験した生物学的活性検定の少なくとも1つにおいて活性を示した。
例えば、本願発明は以下の項目を提供する。
(項目1)
インスリン抵抗性症候群、I型糖尿病及びII型糖尿病を含めた糖尿病、並びに多嚢胞性卵巣症候群からなる群から選択される病態を処置する;又はアテローム性動脈硬化症、動脈硬化症、肥満、高血圧、高脂血症、脂肪肝疾患、腎症、神経障害、網膜症、糖尿病に関連する下肢潰瘍又は白内障を処置する又は発症の可能性を低下させる;或いは高脂血症、悪液質及び肥満からなる群から選択される病態を処置する、医薬品の製造における生物活性剤の使用であって;
前記薬剤が以下の化学式の化合物であって:
【化1】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
使用。
(項目2)
m及びxの一方が0であり、他方が0、2又は4である、項目1に記載の使用。
(項目3)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいはハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目2に記載の使用。
(項目4)
R4及びR5の一方が水素である、項目3に記載の使用。
(項目5)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目3に記載の使用。
(項目6)
Aが2,6−ジメチルフェニルである、項目3に記載の使用。
(項目7)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目6に記載の使用。
(項目8)
前記医薬品が経口投与用に配合される、項目1〜7の何れか1項に記載の使用。
(項目9)
インスリン抵抗性症候群、糖尿病、嚢胞性卵巣症候群、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症及び動脈硬化症からなる群から選択される病態を有する哺乳動物の被験体を処置する方法であって、生物活性剤の一定量を前記被験体に投与することを含み、前記薬剤が以下の化学式の化合物であって:
【化2】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が1〜3個の炭素原子を有するアルキルであり、他方が水素、又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;又は
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であり、前記ヘテロ芳香族環が、環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
方法。
(項目10)
m及びxの一方が0であり、他方が0、2又は4である、項目9に記載の方法。
(項目11)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目10に記載の方法。
(項目12)
R4及びR5の一方が水素である、項目11に記載の方法。
(項目13)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目11に記載の方法。
(項目14)
Aが2,6−ジメチルフェニルである、項目11に記載の方法。
(項目15)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目14に記載の方法。
(項目16)
前記被験体がヒトである、項目9〜15の何れか1項に記載の方法。
(項目17)
前記薬剤が1日当たり1mg〜400mgの量で経口投与される、項目16に記載の方法。
(項目18)
前記病態がインスリン抵抗性症候群又はII型糖尿病である、項目9に記載の方法。
(項目19)
前記処置が、糖尿病の症状又は糖尿病の症状を発症する可能性を軽減し、前記症状が、アテローム性動脈硬化症、肥満、高血圧、高脂血症、脂肪肝疾患、腎症、神経障害、網膜症、糖尿病に関連する下肢潰瘍及び白内障からなる群から選択される、項目9に記載の方法。
(項目20)
インスリン抵抗性症候群、糖尿病、嚢胞性卵巣症候群、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症、動脈硬化症からなる群から選択される病態の処置に使用し、経口投与に適合した薬学的組成物であって、薬学的に許容される担体及び1mg〜400mgの生物活性剤を含み、
前記薬剤が以下の化学式の化合物であって:
【化3】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;又は
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5若しくは6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
薬学的組成物。
(項目21)
m及びxの一方が0であり、他方が0、2又は4である、項目20に記載の薬学的組成物。
(項目22)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目21に記載の薬学的組成物。
(項目23)
R4及びR5の一方が水素である、項目22に記載の薬学的組成物。
(項目24)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目22に記載の薬学的組成物。
(項目25)
Aが2,6−ジメチルフェニルである、項目22に記載の薬学的組成物。
(項目26)
前記生物活性剤が、2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目25に記載の薬学的組成物。
(項目27)
経口投与形態の、項目20〜26の何れか1項に記載の薬学的組成物。
(項目28)
生物活性剤であって、前記薬剤が以下の化学式の化合物であって:
【化4】

式中、
nが1又は2であり;
m及びxの一方が0であり、他方が0、1、2、3又は4であり;
qが0又は1であり;
tが0又は1であり;
R2が、1〜3個の炭素原子を有するアルキルであり;
R3が、水素、ハロ、1〜3個の炭素原子を有するアルキル、又は1〜3個の炭素原子を有するアルコキシであり;
R4及びR5の一方が、1〜3個の炭素原子を有するアルキルであり、他方が、水素又は1〜3個の炭素原子を有するアルキルであり;
Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又2個の基により置換されるフェニル;或いは
3〜6個の環炭素原子を有するシクロアルキルであって、前記シクロアルキルが置換されないか、又は1若しくは2個の環炭素が独立してメチル若しくはエチルによりモノ置換される、シクロアルキル;或いは
N、S及びOから選択される1又は2個の環ヘテロ原子を有する5又は6員のヘテロ芳香族環であって、前記ヘテロ芳香族環が環炭素により化学式Iの化合物の残りの部分に共有結合する、ヘテロ芳香族環であり;
R1が、水素、又は1若しくは2個の炭素原子を有するアルキルである、
化合物;或いはR1が水素である場合に、前記化合物の薬学的に許容される塩である、
生物活性剤。
(項目29)
m及びxの一方が0であり、他方が0、2又は4である、項目28に記載の生物活性剤。
(項目30)
nが1であり;qが0であり;tが0であり;R3が水素であり;Aが、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである、項目29に記載の生物活性剤。
(項目31)
R4及びR5の一方が水素である、項目30に記載の生物活性剤。
(項目32)
R4及びR5がそれぞれ独立して1〜3個の炭素原子を有するアルキルである、項目30に記載の生物活性剤。
(項目33)
Aが2,6−ジメチルフェニルである、項目30に記載の生物活性剤。
(項目34)
2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチル酢酸;2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−エチル酢酸;及び3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−メチルプロパン酸からなる群から選択される、項目33に記載の生物活性剤。
【図面の簡単な説明】
【0014】
【図1】ヒトPPARαトランス活性化検定における化合物CWの用量−反応曲線である。
【発明を実施するための形態】
【0015】
定義
本明細書で使用される「アルキル」は、直鎖又は分岐鎖アルキル基を意味する。特定の炭素原子数を有するものとして同定されるアルキル基は、所定の炭素数を有するアルキル基を意味する。例えば、3個の炭素原子を有するアルキルは、プロピル又はイソプロピルであってよく、4個の炭素原子を有するアルキルは、n−ブチル、1−メチルプロピル、2−メチルプロピル又はt−ブチルであってよい。
【0016】
本明細書で使用される「ハロ」は、1つ以上のフルオロ、クロロ、ブロモ及びヨードを指す。
【0017】
本明細書で使用される、ペルフルオロメチル又はペルフルオロメトキシの場合のような「ペルフルオロ」とは、当該基が水素原子の全てに代わってフッ素原子を有することを意味する。
【0018】
本明細書で使用される「Ac」は、CH3C(O)−基を指す。
【0019】
本明細書において、特定の化学化合物は、それぞれの化学名又は以下に示される2文字のコードにより表される。化合物CW、CX及びDPは、上に示す化学式Iの範囲内に含まれる。
CW 2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−メチル酢酸
CX 2−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−エチル酢酸
DP 3−(3−(2,6−ジメチルベンジルオキシ)−フェニル)−2−(R,S)−メチルプロパン酸
本明細書で使用される「含む(comprising)」という移行句は、オープンエンド形式である。この用語を使用する請求項は、このような請求項において列挙されるものに加えて複数の要素を含有してよい。
【0020】
本発明の化合物
上記の化学式Iの図のアスタリスクは、キラル中心を示す。本発明は、化学式Iの化合物のラセミ体、(R)型鏡像異性体、及び(S)型鏡像異性体を提供し、これらは全て活性である。これらの鏡像異性体の混合物は、例えば、Chirality 11:420−425 (1999)に記載の通り、HPLCを使用することによって分離してもよい。
【0021】
上記の要約に記載の薬剤、使用、方法又は薬学的組成物の実施形態において、xは0であり、mは0、1、2、3又は4である。より具体的な実施形態において、mは0、2又は4である。別の実施形態において、mは0であり、xは0、1、2、3又は4である。より具体的な実施形態において、xは0、2又は4である。
【0022】
上記の要約に記載の薬剤、使用、方法又は薬学的組成物の実施形態において、nは1であり;qは0であり;tは0であり;R3は水素であり;Aは、置換されないか、あるいは、ハロ、1又は2個の炭素原子を有するアルキル、ペルフルオロメチル、1又は2個の炭素原子を有するアルコキシ、及びペルフルオロメトキシから選択される1又は2個の基により置換されるフェニルである。より具体的な実施形態において、Aは、2,6−ジメチルフェニルである。このような化合物の例には、化合物CW、CX及びDPが含まれる。
【0023】
本発明の生物活性剤の好ましい実施形態において、本薬剤は、実質的に(少なくとも98%)純粋な形態である。
【0024】
反応スキーム
本発明の生物活性剤を、以下の反応スキームに従い作製することができる。
化学式Iの化合物であって、式中、mが0であり、xが0又は1であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が、1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0025】
【化6】

(式中、Aは上に記載されている)は、スキーム1の反応スキームを介して調製することができる。
【0026】
スキーム1の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。R1は、1〜2個の炭素原子を有するアルキル基である。R7は、1〜3個の炭素原子を有するアルキル基であり、Y1はハロゲン化物である。
【0027】
化学式IIの化合物を、手順(a)の反応を介して化学式IIIの化合物でアルキル化し、化学式IVの化合物を生成する。反応は、テトラヒドロフラン、テトラヒドロフラン/1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン、テトラヒドロフラン/ヘキサメチルホスホルアミド等の適切な溶媒において行われる。一般的に、反応は、2〜3モル当量の塩基の存在下において行われ、化学式IVの化合物(式中、R4は、1〜3個の炭素原子を有するアルキルであり、R5は、水素又は4〜6モル当量の塩基である)を生成するか、又は化学式IVの化合物(式中、R4及びR5は、1〜3個の炭素原子を有するアルキルである)を生成する。これを行うための従来の塩基は、水素化ナトリウム、水素化カリウム、カリウムビス(トリメチルシリル)アミド、リチウムビス(トリメチルシリル)アミド、リチウムジイソプロピルアミド等であってよい。本反応を実施する場合、一般的には、ヘキサメチルジシランのアルカリ金属塩を使用するのが好ましい。反応は、−78℃〜25℃にて行われる。一般的に、反応には6〜72時間が必要となる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0028】
化学式IVの化合物は、化学式Iの化合物であって、式中、R1が、1〜2個の炭素原子を有するアルキル基である、化合物である。化学式IVの化合物は、エステル加水分解により、遊離酸、即ち、化学式Iの化合物(式中、R1はHである)に変換することができる。エステル加水分解の従来の何れかの方法によっても、化学式Iの化合物(式中、R1はHである)が生成される。
【0029】
Aがヒドロキシルの1又は2個の基により置換されるフェニルである場合、一般的には、化学式IIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T.
GreeneによるProtective Groups in Organic Synthesisに記載されている。
【0030】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0031】
反応スキーム1
【0032】
【化7】

化学式Iの化合物であって、式中、mが1〜4であり、xが0であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0033】
【化8】

(式中、Aは上に記載されている)は、スキーム2の反応スキームを介して調製することができる。
【0034】
スキーム2の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。R1は、1〜2個の炭素原子を有するアルキル基である。Y1は、ハロゲン化物である。
【0035】
化学式IVの化合物は、手順(b)の反応を介して化学式Vの化合物に環元することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応はテトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(b)の反応を実施することができる。
【0036】
化学式Vの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式VIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の条件の何れかを利用して、手順(c)の反応を実施することができる。
【0037】
化学式VIの化合物は、化学式VIをシアン化アルカリ金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式VIIの化合物に変換することができる。反応は、N,N−ジメチルホルムアミド、エタノール、ジメチルスルホキシド等の適切な溶媒において行われる。ニトリルの調製に従来使用されている条件の何れかを利用して、手順(d)の反応を実施することができる。
【0038】
化学式VIIの化合物は、酸又は塩基の加水分解により反応手順(e)を介して化学式VIIIの化合物に変換することができる。本反応を実施する場合、一般的には、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解に従来使用されている条件の何れかを利用して、手順(e)の反応を実施することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0039】
化学式VIIIの化合物は、化学式Iの化合物であって、式中、mが1であり、R1がHである、化合物である。
【0040】
化学式VIIIの化合物は、化学式VIIIの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0041】
化学式VIの化合物は、適切な塩基、例えば水素化ナトリウムを利用して、マロン酸ジエチルと反応させ、化学式IXの化合物を得ることができる。反応は、ジメチルホルムアミド、テトラヒドロフラン等の適切な溶媒において行われる。このようなアルキル化反応で慣行の条件の何れかを利用して、手順(f)の反応を実施することができる。
【0042】
化学式IXの化合物は、エタノール水等の適切な溶媒として水酸化ナトリウムを利用して、加水分解及び脱カルボキシル化し、化学式Xの化合物を得ることができる。このような反応で慣行の条件の何れかを利用して、手順(g)の反応を実施することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0043】
化学式Xの化合物は、化学式Iの化合物であって、式中、mが2であり、R1がHである、化合物である。
【0044】
化学式Xの化合物は、化学式Xの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0045】
化学式Xの化合物を環元し、手順(h)の反応を介して化学式XIの化合物を得ることができる。本反応を前述の手順(b)の反応と同じ様式において実施することができる。
【0046】
化学式XIの化合物は、手順(c)の反応と合わせて、前述と同じ様式の手順(i)の反応を介して化学式VIIの化合物に変換することができる。
【0047】
化学式XIIの化合物は、手順(d)の反応と合わせて、前述と同じ様式の手順(j)の反応を介して化学式VIIIの化合物に変換することができる。
【0048】
化学式XIIIの化合物は、手順(e)の反応と合わせて、前述と同じ様式の手順(k)の反応を介して化学式VIVの化合物に変換することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0049】
化学式XIVの化合物は、化学式Iの化合物であって、式中、mが3であり、R1がHである、化合物である。
【0050】
化学式XIVの化合物は、化学式XIVの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0051】
化学式XIIの化合物は、手順(f)の反応と合わせて、前述と同じ様式の手順(l)の反応を介して化学式XVの化合物に変換することができる。
【0052】
化学式XVの化合物は、手順(g)の反応と合わせて、前述と同じ様式の手順(m)の反応を介して化学式XVIの化合物に変換することができる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0053】
化学式XVIの化合物は、化学式Iの化合物であって、式中、mが4であり、R1がHである、化合物である。
【0054】
化学式XVIの化合物は、化学式XVIの化合物をメタノール又はエタノールでエステル化することにより、化学式Iの化合物(式中、R1は、1〜2個の炭素原子を有するアルキルである)に変換することができる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、反応を実施することができる。
【0055】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的に、化学式IVの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0056】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0057】
反応スキーム2
【0058】
【化9】

化学式Iであって、式中、xが2〜4であり、mが0であり、qが0又は1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が、水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R4及びR5が、1〜3個の炭素原子を有するアルキルであり、他方が、水素、又は1〜3個の炭素原子を有するアルキルであり;R1が、水素、又は1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0059】
【化10】

(式中、Aは上に記載されている)は、スキーム3の反応スキームを介して調製することができる。
【0060】
スキーム3の反応スキームにおいて、A、t、n、m、q、x、R2、R3、R4及びR5は上に記載されている。Yは、ハロゲン化物又は放出基であり、pは2〜4であり、sは1〜3であり、uは1〜3であり、Y1はハロゲン化物である。R1は、1〜2個の炭素原子を有するアルキル基である。
【0061】
化学式XVIIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用してXVIIをXVIIIで光延縮合することにより、手順(n)の反応を介して化学式XIXの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて実施することができる。光延反応において従来使用されている条件の何れかを利用して、手順(n)の反応を実施することができる。
【0062】
化学式XIXの化合物は又、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基を使用することにより、手順(o)の反応を介して化学式XXの化合物又は化学式XXIの化合物で化学式XVIIの化合物をエーテル化又はアルキル化することにより調製することもできる。化学式XXIの化合物において、Yには、メシルオキシ、トシルオキシ、クロロ、ブロモ、ヨード等が含まれるが、これらに限定されない。ハロゲン化物又は放出基でヒドロキシル基をアルキル化する従来の何れかの条件を利用して、手順(o)の反応を実施することができる。手順(o)の反応は、化学式XXIの化合物が容易に利用可能である場合、手順(n)以降が好ましい。
【0063】
化学式XIXの化合物は、化学式XXIIの化合物で化学式XIXの化合物を処理することによりウィッティヒ反応を使用する手順(p)の反応を介して化学式XXIIIの化合物に変換する。アルデヒドとハロゲン酸トリアリールホスフィンを反応させる従来の何れかの方法を利用して、手順(p)の反応を実施することができる。ウィッティヒ反応で慣行の条件の何れかを利用して、手順(p)の反応を実施することができる。生成物は、抽出、気化、クロマトグラフィー及び再結晶等の技法により分離し、精製することができる。
【0064】
化学式XXIIIの化合物は、水素化により手順(q)の反応を介して化学式XXIVの化合物に変換される。反応は、クロロトリス(トリフェニルホスフィン)ロジウム(ウィルキンソン触媒)を利用して行われる。反応は、適切な溶媒、例えば、無水エタノール等において行われる。このような反応で慣行の条件の何れかを利用して、手順(q)の反応を実施することができる。生成物は、抽出、気化、クロマトグラフィー及び再結晶等の技法により分離し、精製することができる。
【0065】
化学式XXIVの化合物は、手順(r)の反応を介して化学式IIIの化合物でアルキル化し、化学式XXVの化合物を生成する。反応は、テトラヒドロフラン、テトラヒドロフラン/1,3−ジメチル−3,4,5,6−テトラヒドロ−2(1H)−ピリミジノン、テトラヒドロフラン/ヘキサメチルホスホルアミド等の適切な溶媒において行われる。一般的に、反応は、2〜3モル当量の塩基の存在下において行われ、化学式XXVの化合物(式中、R4は1〜3個の炭素原子を有するアルキルであり、R5は水素又は4〜6モル当量の塩基である)を生成するか、又は化学式XXVの化合物(式中、R4及びR5は、1〜3個の炭素原子を有するアルキルである)を生成する。これを行うための従来の塩基は、水素化ナトリウム、水素化カリウム、カリウムビス(トリメチルシリル)アミド、リチウムビス(トリメチルシリル)アミド、リチウムジイソプロピルアミド等であってよい。本反応を実施する場合、一般的には、ヘキサメチルジシランのアルカリ金属塩を使用するのが好ましい。反応は、−78℃〜25℃にて実施される。一般的に、反応には6〜72時間が必要となる。抽出、気化、クロマトグラフィー及び再結晶等の従来の技法を利用して、生成物を精製することができる。
【0066】
化学式XXVの化合物は、化学式Iの化合物であって、式中、R1が、1〜2個の炭素原子を有するアルキル基である、化合物である。化学式XXVの化合物は、エステル加水分解により、遊離酸、即ち、化学式Iの化合物(式中、R1はHである)に変換することができる。エステル加水分解の従来の何れかの方法によって、化学式Iの化合物(式中、R1はHである)が生成される。
【0067】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、化学式XVIIIの化合物、化学式XXの化合物及び化学式XXIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0068】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0069】
反応スキーム3
【0070】
【化11】

化学式IIであって、式中、mが0であり、xが0であり、qが0であり、tが0又は1であり、nが1又は2であり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0071】
【化12】

(式中、Aは上に記載されている)は、スキーム4の反応スキームを介して調製することができる。
【0072】
スキーム4の反応スキームにおいて、A、t、n、m、q、x、R1及びR3は上に記載されている。Yは、ハロゲン化物又は放出基である。
【0073】
化学式XXVIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用して、XXVIをXVIIで光延縮合を使用する手順(s)の反応を介して化学式IIの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて行われる。光延反応において従来使用されている条件の何れかを利用して、手順(s)の反応を実施することができる。
【0074】
化学式IIの化合物は又、手順(s)の反応を介して化学式XXIの化合物で化学式XXVIの化合物をエーテル化又はアルキル化することにより調製することができる。化学式XXIの化合物において、Yには、メシルオキシ、トシルオキシ、クロロ、ブロモ、ヨード等が含まれるが、これらに限定されない。ハロゲン化物又は放出基との反応により、ヒドロキシル基をエーテル化する従来の何れかの方法を利用して、手順(s)の反応を実施することができる。
【0075】
反応スキーム4
【0076】
【化13】

化学式IIであって、式中、mが0であり、xが0であり、qが1であり、tが0又は1であり、nが1又は2であり、R2が1〜3個の炭素原子を有するアルキルであり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0077】
【化14】

(式中、Aは上に記載されている)は、スキーム5の反応スキームを介して調製することができる。
【0078】
スキーム5の反応スキームにおいて、A、t、m、n、q、x、R1、R2及びR3は上に記載されている。Y1は、ハロゲン化物である。
【0079】
化学式XXVIIの化合物は、メシレート化して、手順(t)の反応を介して化学式XXVIIIの化合物を供給することができる。ヒドロキシル基のメシレート化反応を実施する従来の何れかの条件を利用して、手順(t)を実施することができる。次いで、化学式XXVIIIの化合物を化学式XXIXの化合物で加熱し、化学式XXXの化合物を生成する。アミノアルコールを生成する慣行の条件の何れかを利用して、手順(u)の反応を実施することができる。
【0080】
化学式XXXの化合物において、アルコールを塩化オキサリル、塩化チオニル、臭素、三臭化リン等で化学式XXXの化合物を処理することによりクロロ又はブロモにより置き換えられ、化学式XXの化合物を生成することができる。アルコールをクロロ又はブロモで置き換える従来の何れかの方法を利用して、手順(v)の反応を実施することができる。
【0081】
化学式XXの化合物は、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基の存在下において、手順(w)の反応を介して化学式XXVIの化合物と反応させることができる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン、ジクロロメタン等の従来の溶媒において行われ、化学式IIに対応する化合物を生成する。クロロ又はブロモで、塩基(好ましい塩基は炭酸カリウムである)の存在下において、ヒドロキシル基のエーテル化の従来の何れかの方法を利用して、手順(w)の反応を実施することができる。
【0082】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、ヒドロキシル基を保護するのが好ましい。適切な保護基は、T. Greeneによるthe Protective Groups in Organic Synthesisに記載されている。
【0083】
保護基は、T. GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0084】
反応スキーム5
【0085】
【化15】

化学式XXVIであって、式中、mが0であり、xが0であり、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルであり、R1が、1〜2個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0086】
【化16】

は、スキーム6の反応スキームを介して調製することができる。
【0087】
スキーム6の反応スキームにおいて、R1及びR3は、上に記載されている。Y1は、ハロゲン化物である。
【0088】
化学式XXXIの化合物を環元して、手順(x)の反応を介して化学式XXXIIの化合物得ることができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応は、テトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(x)の反応を実施することができる。
【0089】
化学式XXXIIの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式XXXIIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の条件の何れかを利用して、手順(y)の反応を実施することができる。
【0090】
化学式XXXIIIの化合物は、XXXIIIとシアン化金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式XXXIVの化合物に変換することができる。反応は、N,N−ジメチルホルムアミド、エタノール、ジメチルスルホキシド等の適切な溶媒において行われる。ニトリルの調製において従来使用されている条件の何れかを利用して、手順(z)の反応を実施することができる。
【0091】
化学式XXXIVの化合物は、酸又は塩基の加水分解により手順(a’)の反応を介して化学式XXXVの化合物に変換することができる。本反応を実施する場合、一般的に、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解において従来使用されている条件の何れかを利用して、手順(a’)の反応を実施することができる。
【0092】
化学式XXXVの化合物は、化学式XXXVの化合物をメタノール又はエタノールでエステル化することにより、化学式XXVIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(b’)の反応を実施することができる。
【0093】
反応スキーム6
【0094】
【化17】

化学式XVIIIであって、式中、tが0又は1であり、nが1又は2である、化合物、即ち、以下の化学式の化合物:
A−(CH2)t+n−OH
及び化学式XXIであって、式中、tが0又は1であり、nが1又は2である、化合物、即ち、以下の化学式の化合物:
A−(CH2)t+n−Y
は、スキーム7の反応スキームを介して調製することができる。
【0095】
スキーム7の反応において、Aは上に記載されている。Yは、放出基である。
【0096】
化学式XXXVIの化合物は、手順(c’)の反応を介して化学式XXXVIIの化合物に環元することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して行われる。反応は、テトラヒドロフラン等の適切な溶媒において行われる。このような環元反応で慣行の条件の何れかを利用して、手順(c’)の反応を実施することができる。
【0097】
化学式XXXVIIの化合物は、化学式XVIIIの化合物であって、式中、tが0であり、nが1である、化合物である。
【0098】
化学式XXXVIIの化合物は、ヒドロキシル基をブロモ又はクロロである好ましいハロゲンのハロゲン基と置き換えることにより、化学式XXXVIIIの化合物に変換することができる。適当なハロゲン化試薬には、塩化オキサリル、塩化チオニル、臭素、三臭化リン、四臭化炭素等が含まれるが、これらに限定されない。このようなハロゲン化反応で慣行の幾つかの条件を利用して、手順(d’)の反応を実施することができる。
【0099】
化学式XXXVIIIの化合物は、化学式XXIの化合物であって、式中、tが0であり、nが1である、化合物である。
【0100】
化学式XXXVIIIの化合物は、XXXVIIIとシアン化金属、例えば、銅、シアン化ナトリウム又はシアン化カリウムと反応させることにより、化学式XXXIXの化合物に変換することができる。反応は、エタノール、ジメチルスルホキシド及びN,N−ジメチルホルムアミド並びに同等物等の適切な溶媒において行われる。ニトリルの調製において従来使用されている条件の何れかを利用して、手順(e’)の反応を実施することができる。
【0101】
化学式XXXIXの化合物は、酸又は塩基の加水分解により、反応手順(f’)を介して化学式XLの化合物に変換することができる。本反応を実施する場合、一般的に、塩基の加水分解、例えば、水酸化ナトリウム水溶液を利用するのが好ましい。ニトリルの加水分解において従来使用されている条件の何れかを利用して、手順(f’)の反応を実施することができる。
【0102】
化学式XLの化合物を環元し、手順(g’)の反応を介して化学式XLIの化合物を得ることができる。本反応を前述の手順(c’)の反応と同じ様式において実施することができる。
【0103】
化学式XLIの化合物は、化学式XVIIIの化合物であって、式中、tが1であり、nが1である、化合物である。
【0104】
化学式XLIの化合物は、手順(d’)の反応と合わせて、前述と同じ様式の手順(h’)の反応を介して化学式XLIIの化合物に変換することができる。
【0105】
化学式XLIIの化合物は、化学式XXIの化合物であって、式中、tが1であり、nが1である、化合物である。
【0106】
化学式XXXVIIIの化合物は、適切な塩基、例えば水素化ナトリウムを利用して、マロン酸ジエチルと反応させ、化学式XLIIIの化合物を得ることができる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン等の適切な溶媒において行われる。このようなアルキル化反応で慣行の条件の何れかを利用して、手順(i’)の反応を実施することができる。
【0107】
化学式XLIIIの化合物は、エタノール水等の適切な溶媒の水酸化ナトリウムを利用して加水分解及び脱カルボキシル化し、化学式XLIVの化合物を得ることができる。このような反応で慣行の条件の何れかを利用して、手順(j’)の反応を実施することができる。
【0108】
化学式XLIVの化合物は、手順(c’)の反応と合わせて、前述と同じ様式の手順(k’)の反応を介して化学式XLVの化合物に変換することができる。
【0109】
化学式XLIVの化合物は、化学式XVIIIの化合物であって、式中、tが1であり、nが2である、化合物である。
【0110】
化学式XLVの化合物は、手順(d’)の反応と合わせて、前述と同じ様式の手順(l’)の反応を介して化学式XLVIの化合物に変換することができる。
【0111】
化学式XLVIの化合物は、化学式XXIの化合物であって、式中、tが1であり、nが2である、化合物である。
【0112】
Aがヒドロキシル1又は2個の基により置換されるフェニルである場合、一般的には、化学式XXXVIの化合物のヒドロキシル基を保護するのが好ましい。適切な保護基は、T. GreeneによるProtective Groups in Organic
Synthesisに記載されている。
【0113】
保護基は、T.GreeneによるProtective Groups in Organic Synthesisに記載のもの等の適切な脱保護試薬を利用して脱保護することができる。
【0114】
反応スキーム7
【0115】
【化18】

化学式XXXIであって、式中、R3がハロである、化合物、即ち、以下の化学式の化合物:
【0116】
【化19】

は、市販されているか、又は以下の文献に記載されている方法に従って調製することができるかのどちらかである。
1.3−BrまたはF−2−OHC6H3CO2H
Canadian Journal of Chemistry(2001),79(11)1541−1545.
2.4−Br−2−OHC6H3CO2H
WO 9916747またはJP 04154773.
3.2−Br−6−OHC6H3CO2H
JP 47039101.
4.2−Br−3−OHC6H3CO2H
WO 9628423.
5.4−Br−3−OHC6H3CO2H
WO 2001002388.
6.3−Br−5−OHC6H3CO2H
Journal of labelled Compounds and Radiopharmaceuticals(1992),31(3),175−82.
7.2−Br−5−OHC6H3CO2Hおよび3−Cl−4−OHC6H3CO2H
WO 9405153およびUS 5519133.
8.2−Br−4−OHC6H3CO2Hおよび3−Br−4−OHC6H3CO2H
WO 200220183239.2−Cl−6−OHC6H3CO2H
JP 06293700
10.2−Cl−3−OHC6H3CO2H
Proceedings of the Indiana Academy of Science(1983),Volume date 1982,92,145−51.
11.3−Cl−5−OHC6H3CO2H
WO 2002000633およびWO 2002044145.
12.2−Cl−5−OHC6H3CO2H
WO 9745400.
13.5−I−2−OHC6H3CO2Hおよび3−I,2−OHC6H3CO2H
Z.Chem.(1976),16(8),319−320.
14.4−I−2−OHC6H3CO2H
Journal of Chemical Research,Synopses(1994),(11),405.
15.6−I−2−OHC6H3CO2H
US 4932999.
16.2−I−3−OHC6H3CO2Hおよび4−I−3−OHC6H3CO2H
WO 9912928.
17.5−I−3−OHC6H3CO2H
J.Med.Chem.(1973),16(6),684−7.
18.2−I−4−OHC6H3CO2H
Collection of Czechoslovak Chemical Communications,(1991),56(2),459−77.
19.3−I−4−OHC6H3CO2,
J.O.C.(1990),55(18),5287−91.
化学式XXXIの化合物であって、式中、R3が1〜3個の炭素原子を有するアルコキシである、化合物、即ち、以下の化学式の化合物:
【0117】
【化20】

は、スキーム8の反応スキームを介して調製することができる。
【0118】
スキーム8の反応スキームにおいて、R1及びR3は上に記載されている。Rは、1〜2個の炭素原子を有するアルキル基である。R8は、1〜3個の炭素原子を有するアルキルである。Y1はハロゲン化物である。
【0119】
化学式XLVIIの化合物は、アルデヒドを第1級アルコールに環元することにより、化学式XLVIIIの化合物に変換することができる。本反応を実施する場合、環元剤として水素化ホウ素ナトリウムを使用するのが好ましいが、これに限定されない。このような環元反応に適した条件の何れかを利用して、手順(m’)の反応を実施することができる。
【0120】
化学式XLVIIIの化合物は、1,1,3,3−テトライソプロピルジシルオキサンを使用して、ジオール1〜3個を保護することにより、手順(n’)の反応を介して化学式XLIXの化合物に変換することができる。
【0121】
この保護基に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0122】
化学式XLIXの化合物は、臭化ベンジルを使用して、フェノール基を保護することにより、手順(o’)の反応を介して化学式Lの化合物に変換することができる。この保護基に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0123】
化学式Lの化合物は、フッ化テトラブチルアンモニウムを使用して脱保護することにより、手順(p’)の反応を介して化学式LIの化合物に変換することができる。脱保護に適切な条件は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0124】
化学式LIの化合物は、酸化により手順(q’)の反応を介して化学式LIIの化合物に変換することができる。第1級アルコールを酸、例えば、酸化クロム等に変換する従来の何れかの酸化基を利用して、手順(q’)の反応を実施することができる。
【0125】
化学式LIIの化合物は、化学式LIIの化合物をメタノール又はエタノールでエステル化することにより化学式LIIIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(r’)反応を実施することができる。
【0126】
化学式LIIIの化合物は、トリフェニルホスフィン及びジエチルアゾジカルボキシレート又はジイソプロピルアゾジカルボキシレートを使用して、LIIIをLIVで光延縮合を使用する手順(s’)の反応を介して化学式LVIの化合物に変換することができる。反応は、適切な溶媒、例えばテトラヒドロフランにおいて実施することができる。光延反応において従来使用されている条件の何れかを利用して、手順(s’)の反応を実施することができる。
【0127】
又、化学式LIIIの化合物は、手順(s’)の反応の場合、化学式LVの化合物で化学式LIIIの化合物をエーテル化又はアルキル化することにより、化学式LVIの化合物に変換することができる。この反応は、炭酸カリウム、水素化ナトリウム、トリエチルアミン、ピリジン等の適切な塩基を使用することにより行われる。反応は、N,N−ジメチルホルムアミド、テトラヒドロフラン、ジクロロメタン等の従来の溶媒において行われる。クロロ又はブロモで、塩基(好ましい塩基は炭酸カリウムである)の存在下においてヒドロキシル基のエーテル化の従来の何れかの方法を利用して、手順(s’)の反応を実施することができる。
【0128】
化学式LVIの化合物は、エステル及びベンジル基の脱保護により、手順(t’)の反応を介して化学式XXXIの化合物に変換することができる。適切な脱保護試薬は、T.
GreeneによるProtecting Groups in Organic Synthesisに記載されている。
【0129】
反応スキーム8
【0130】
【化21】

化学式XXXIであって、式中、R3が1〜3個の炭素原子を有するアルコキシである、化合物、即ち、以下の化学式の化合物:
【0131】
【化22】

は、市販されているか、又は以下の文献に記載されている方法に従い調製することができるかのどちらかである。
1. 2−OMe−4−OHC6H3CO2H
US 2001034343またはWO 9725992.
2. 5−OMe−3−OHC6H3CO2H
J.O.C(2001),66(23),7883−88.
3. 2−OMe−5−OHC6H3CO2H
US 6194406(P.96)およびJournal of the American Chemical Society(1985),107(8),2571−3.4. 3−OEt−5−OHC6H3CO2H
Taiwan Kexue(1996),49(1),51−56.
5.4−OEt−3−OHC6H3CO2HWO 9626176
6.2−OEt−4−OHC6H3CO2H
Takeda Kenkyusho Nempo(1965),24,221−8.
JP 07070025.
7.3−OEt−4−OHC6H3CO2H
WO 9626176.
8.3−OPr−2−OHC6H3CO2H
JP 07206658,DE 2749518.
9.4−OPr−2−OHC6H3CO2H
Farmacia(Bucharest)(1970),18(8),461−6.
JP 08119959.
10.2−OPr−5−OHC6H3CO2Hおよび2−OEt−5−OHC6H3CO2H
ヨウ化プロピルおよびヨウ化エチルを用いることによって、US 6194406(P.96)からの合成に適合させる。
11.4−OPr−3−OHC6H3CO2H
WO 9626176からの合成に適合させる。
12.2−OPr−4−OHC6H3CO2H
ハロゲン化プロピルを用いることによって、Takeda Kenkyusho Nempo(1965),24,221−8からの合成に適合させる。
13.4−OEt−3−OHC6H3CO2H
Biomedical Mass Spectrometry(1985),12(4),163−9.
14.3−OPr−5−OHC6H3CO2H
ハロゲン化プロピルを用いることによって、Taiwan Kexue(1996),49(1),51−56からの合成に適合させる。
【0132】
化学式XXXI(式中、R3が1〜3個の炭素原子を有するアルキル、即ち、式の化合物である):
【0133】
【化23】

は、市販されているか、又は以下の文献に記載されている方法に従い調製することができるかのどちらかである。
1.5−Me−3−OHC6H3CO2Hおよび2−Me−5−OHC6H3CO2H
WO 9619437.
J.O.C.2001,66,7883−88.
2.2−Me−4−OHC6H3CO2H
WO 8503701.
3.3−Et−2−OHC6H3CO2Hおよび5−Et−2−OHC6H3CO2H
J.Med.Chem.(1971),14(3),265.
4.4−Et−2−OHC6H3CO2H
Yaoxue Xuebao(1998),33(1),67−71.
5.2−Et−6−OHC6H3CO2Hおよび2−n−Pr−6−OHC6H3CO2H
J.Chem.Soc.,Perkin Trans 1(1979),(8),2069−78.
6.2−Et−3−OHC6H3CO2H
JP 10087489およびWO 9628423.
7.4−Et−3−OHC6H3CO2H
J.O.C.2001,66,7883−88.
WO 9504046.
8.2−Et−5−OHC6H3CO2H
J.A.C.S(1974),96(7),2121−9.
9.2−Et−4−OHC6H3CO2Hおよび3−Et−4−OHC6H3CO2H
JP 04282345.
10.3−n−Pr−2−OHC6H3CO2H
J.O.C(1991),56(14),4525−29.
11.4−n−Pr−2−OHC6H3CO2H
EP 279630.
12.5−n−Pr−2−OHC6H3CO2H
J.Med.Chem(1981),24(10),1245−49.
13.2−n−Pr−3−OHC6H3CO2H
WO 9509843およびWO 9628423.
14.4−n−Pr−3−OHC6H3CO2H
WO 9504046.
15.2−n−Pr−5−OHC6H3CO2H
αホルミル吉草酸エチルを用いることによってJ.A.C.S(1974),96(7),2121−9からの合成に適合させる。
16.3−n−Pr−4−OHC6H3CO2H
Polymer(1991),32(11)2096−105.
17.2−n−Pr−4−OHC6H3CO2H
3−プロピルフェノールは、メチル化されて3−プロピルアニソールになり得、これは、次いでホルミル化されて、4−メトキシ−3−ベンズアルデヒドになり得る。このアルデヒドは、Jone’s試薬によって酸化されて、対応する酸を生じ得、そしてBBr3によるメチル基の脱保護は、表題化合物を生じる。
18.1.3−Et−5−OHC6H3CO2Hおよび3−Pr−n−5−OHC6H3CO2H
2−エチルアクロレインおよび2−プロピルアクロレインを用いることによって、J.O.C.2001,66,7883−88からの合成に適合させる。
【0134】
化学式XVIIであって、式中、R3が水素、ハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0135】
【化24】

は、スキーム9の反応を介して調製することができる。
【0136】
スキーム9の反応スキームにおいて、R3は上に記載されている。Rは、1〜2個の炭素原子を有するアルキル基であり、Pは保護基である。
【0137】
化学式LVIIの化合物は、T. GreeneによるProtecting Groups in Organic Synthesisに記載されたもの等の適切な保護基を利用することにより、ヒドロキシ基を保護することにより、手順(u’)の反応を介して化学式LVIIIの化合物に変換することができる。化学式LVIIIの化合物は、酸をアルコールに環元することにより、手順(v’)の反応を介して化学式LIXの化合物に変換することができる。反応は、従来の環元剤、例えば、水素化アルミニウムリチウム等のアルカリ金属水素化物を利用して実施することができる。反応は、テトラヒドロフラン等の適切な溶媒において実施することができる。このような環元反応で慣行の条件の何れかを利用して、手順(v’)の反応を実施することができる。
【0138】
化合物LIXの化合物は、アルコールをアルデヒドに酸化することにより、手順(w’)の反応を介して、化学式LXの化合物に変換することができる。反応は、Swern酸化条件(J.O.C. 2001, 66, 7901−7909)等下において、適切な酸化剤、例えば、クロロクロム酸ピリジニウム、2,4,6−トリクロロ[1,3,5]−トリアジンにより活性化されたジメチルスルホキシド(塩化シアヌル、TCT)を利用して実施することができる。このような酸化反応で慣行の条件の何れかを利用して、手順(w’)の反応を実施することができる。
【0139】
化学式LXの化合物において、ヒドロキシ基をT. GreeneによるProtecting Groups in Organic Synthesisに記載されたもの等の適切な脱保護試薬を利用することにより、手順(x’)の反応を介して脱保護することができる。
【0140】
反応スキーム9
【0141】
【化25】

化学式XXIIであって、式中、R1が1〜2個の炭素原子を有するアルキル基であり、pが2〜4である、化合物、即ち、以下の化学式の化合物:
Ph3P+−(CH2)PCO2R1}Br−
は、スキーム10の反応を介して調製することができる。
【0142】
スキーム10の反応スキームにおいて、R1及びpは上に記載されている。
【0143】
化学式LXIの化合物は、手順(y’)の反応を介して化学式LXIIの化合物と反応し、化学式XXIIの化合物を得る。トリフェニルホスフィンとハロゲン酸を反応させる場合に従来使用されている条件の何れかを利用して、手順(y’)の反応を実施することができる。
【0144】
反応スキーム10
【0145】
【化26】

化学式LVIIであって、式中、Rが1〜2個の炭素原子を有するアルキル基であり、R3がハロ、1〜3個の炭素原子を有するアルコキシ、又は1〜3個の炭素原子を有するアルキルである、化合物、即ち、以下の化学式の化合物:
【0146】
【化27】

は、スキーム11の反応を介して調製することができる。
【0147】
スキーム11の反応において、R3及びRは上に記載されている。
【0148】
化学式XXXIの化合物は、化学式XXXIの化合物をメタノール又はエタノールでエステル化することにより、手順(z’)の反応を介して化学式LVIIの化合物に変換できる。反応は、触媒、例えば、H2SO4、TsOH等を使用するか、又は脱水剤、例えば、ジシクロヘキシルカルボジイミド等使用することにより実施することができる。このようなエステル化反応で慣行の条件の何れかを利用して、手順(z’)の反応を実施することができる。
【0149】
反応スキーム11
【0150】
【化28】

治療方法としての使用
本発明は、インスリン抵抗性症候群、糖尿病(I型糖尿病又はII型糖尿病等の一次性本態性糖尿病及び二次性非本態性糖尿病)及び多嚢胞性卵巣症候群からなる群から選択される病態を有する哺乳動物の被験体を処置する方法であって、被験体に病態の処置に有効な本明細書に記載の生物活性剤の有効量を投与することを含む、方法を提供する。本発明の方法において、糖尿病又は、各症状が糖尿病に関連する、アテローム動脈硬化症、肥満、高血圧、高脂質血症、脂肪肝症候群、腎症、神経障害、網膜症、下肢潰瘍及び白内障の症状等の糖尿病の症状を進行させる可能性を軽減することができる。本発明は又、高脂血症を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。実施例に示す通り、化合物は、高脂血症動物の血清トリグリセリド及び遊離脂肪酸を減少させる。本発明は又、悪質液を処置する方法であって、悪質液の治療に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明は又、肥満を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明は又、アテローム性動脈硬化症又は動脈硬化症から選択される病態を処置する方法であって、病態の処置に有効な本明細書に記載の生物活性剤の一定量を被験体に投与することを含む、方法も提供する。本発明の活性剤は、被験体が糖尿病又はインスリン抵抗性症候群を有するにかかわらず、高脂血症、脂肪肝疾患、悪質液、肥満、アテローム性動脈硬化症又は動脈硬化症の治療に有効である。本薬剤を何れかの従来の全身投与経路により投与することができる。好ましくは、本薬剤を経口投与する。更に、医薬品を経口投与用に配合するのが好ましい。本発明において、使用することができる他の投与経路には、経腸、非経口、注射(例えば、静脈内、皮下、筋肉中又は腹腔内注射)又は経鼻が含まれる。
【0151】
本発明の処置の使用及び方法の更なる実施形態はそれぞれ、上記の生物活性剤の実施形態の何れか1つを投与することを含む。不必要な冗長を避ける目的において、このような薬剤及び薬剤群を、それぞれ繰り返さないが、繰り返す場合と同じく、処置の使用及び方法を本説明に組み込む。
【0152】
本発明の化合物により対処される疾患又は障害の多くは、インスリン抵抗性症候群及び慢性高血糖の結果の2つに大きく分類される。燃料代謝の調節異常、特にインスリン抵抗性は、本来糖尿病の非存在下において生じうるが(持続性高血糖)、高脂血症、アテローム性動脈硬化症、肥満、本態性高血圧、脂肪肝疾患(NASH;非アルコール性脂肪肝炎)を含めた種々の症状、及び特に癌又は全身炎症性疾患の悪質液の場合において関連する。悪質液は又、I型糖尿病又はII型糖尿病後期に関連して生じる恐れがある。組織燃料代謝を改善することにより、本実施例の動物において明らかである場合、本発明の活性剤は、インスリン抵抗性に関連する疾患及び症状の予防、又は緩和に有用である。インスリン抵抗性に関連する一群の兆候及び症状は、個々の患者において共存している恐れがあるが、多くの場合、インスリン抵抗性に罹患した多くの生理系の脆弱性に個体差があるため、一症状のみが著しく目立つ恐れがある。それにもかかわらず、インスリン抵抗性が多くの疾患条件に大きく寄与しているため、この細胞欠陥及び分子欠陥に対処する薬剤は、インスリン抵抗性により生じる又は悪化させられる恐れのある幾つかの器官系の幾つかの症状を事実上の予防、又は緩和に有用である。
【0153】
インスリン抵抗性と同時に膵臓ランゲルハンス島によるインスリン産生不足がかなり顕著である場合、慢性高血糖が生じ、II型糖尿病(NIDDM)の発症を確定する。上に示したインスリン抵抗性に関連する代謝障害に加えて、高血糖に続く疾患症状も又、NIDDMの患者において生じる。これらは、腎症、末梢神経障害、網膜症、微小血管疾患、四肢の潰瘍及びタンパク質の非酵素的グリコシル化の結果、例えば、コラーゲン及び他の結合組織への損傷を含む。高血糖を減弱することにより、これらの糖尿病の結果の開始速度及び重症度を軽減する。何故なら、実施例において明らかな通り、本発明の活性剤及び組成物は、糖尿病の高血糖を低下させることに役立ち、これらは、慢性高血糖の合併症の予防及び緩和に有用である。
【0154】
ヒト及び非ヒト哺乳動物の被験体は共に、本発明の処置方法に従って処置することができる。特定の被験体用の本発明の特定の活性剤の適切な用量を、熟練の臨床医により臨床設定を決定することができる。インスリン抵抗性、糖尿病、高脂血症、脂肪肝疾患、悪質液又は肥満に関連する障害の処置においてヒトに経口投与する場合、一般的に、本薬剤を、1日に1〜400mgの用量において、1回〜2回投与する。マウスに経口投与する場合、一般的に、本薬剤を1日に1〜300mg/体重kgの用量を投与する。本発明の活性剤を糖尿病若しくはインスリン抵抗性症候群の単剤療法、又はこれらのタイプの疾患に利用される1つ以上の他の薬剤、例えば、インスリン放出剤、食事性インスリン放出剤、ビグアニド又はインスリン自体を組み合わせて使用する。このような追加の薬剤を標準的な臨床診療を踏まえて投与する。幾つかの場合、本発明の薬剤は、他のクラスの薬物の有効性を改善し、治療効果を維持しながら、患者に投与するこのような薬剤の用量を減少させる(及びそのため、毒性を低下させる)ことができるであろう。代表的な化合物のヒトにおいて確立された安全及び有効な容量は、メトホルミン500〜2550mg/日;グリブリド1.25〜20mg/日;グルコバンズ(メトホルミン及びグリブリドの混合配合)グリブリド1.25〜20mg/日及びメトホルミン250〜2000mg/日;アトルバスタチン10〜80mg/日;ロバスタチン10〜80mg/日;プラバスタチン10〜40mg/日及びシンバスタチン5〜80mg/日;クロフィブラート2000mg/日;ジェムフィブロジル1200〜2400mg/日;ロシグリタゾン4〜8mg/日;ピオグリタゾン15〜45mg/日;アカルボース75〜300mg/日;レパグリニド0.5〜16mg/日である。
【0155】
I型糖尿病:I型糖尿病患者は主に、インスリン投与の用量及びタイミングを適宜、調節するために頻繁に血糖をモニタリングしながら、1日に1回から複数回の用量のインスリンを自己投与することにより、疾患を管理する。慢性的高血糖は、腎症、神経障害、網膜症、下肢潰瘍及び早期死亡等の合併症につながり、過剰インスリン投与のための高血糖は、認知機能障害又は意識消失を生じる恐れがある。I型糖尿病の患者に、本発明の活性剤1〜400mg/日、錠剤又はカプセル形態において単回又は分割投与のどちらかで処置する。期待される効果により、十分な範囲の血糖を維持するために必要なインスリン投与の用量及び頻度が低下し、高血糖発作の発症率並びに重症度が低下するであろう。血糖及びグリコシル化ヘモグロビン(数か月間以上を統合した血糖コントロールの妥当性の指数)の測定並びに糖尿病の一般的な合併症の発症率及び重症度の低下により、臨床転帰主にターする。本発明の生物活性剤をランゲルハンス島移植と併用して投与し、ランゲルハンス島移植の抗糖尿病有効性の維持に役立てる。
【0156】
II型糖尿病:II型糖尿病(NIDDM)の一般的な患者は、食事及び運動のプログラム及びメトホルミン、グリブリド、レパグリニド、ロシグリタゾン又はアカルボース等の医薬品を服用することにより疾患を管理し、これらの医薬品は全て、患者の血糖コントールを改善するが、これらは全て副作用があるか、又は疾患の進行により最終的な治療に失敗することがある。ランゲルハンス島不全は、NIDDMの患者において、長期間に生じ、大部分の患者にインスリン注射が必要になる。本発明の活性剤(場合により、追加のクラスの抗糖尿病療法)を用いた毎日の治療は、血糖コントロールを改善し、ランゲルハンス島不全の割合を低下させ、糖尿病の一般的な症状の発症率及び重症度を低下させることが期待される。更に、本発明の活性剤は、血清トリグリセリド及び脂肪酸上昇を軽減し、それにより、糖尿病患者の主な死亡原因である心血管系疾患の危険を減少させる。他の糖尿病用の治療剤全ての場合と同じように、用量の最適化は、必要性、臨床効果及び副作用に対する感受性に従い、個々の患者において行われる。
【0157】
高脂血症:血中のトリグリセリド及び遊離脂肪酸濃度の上昇は、かなり多くの集団に影響を与え、アテローム性動脈硬化及び心筋梗塞の重大な危険因子である。本発明の活性剤は、高脂血症患者のトリグリセリド及び遊離脂肪酸の循環を減少させることに有用である。高脂血症患者は又、多くの場合、血中コレステロール濃度が上昇し、これは又、心血管系疾患の危険を増加させる。HMG−CoA環元酵素阻害剤(「スタチン」)等のコレステロール低下薬を本発明の薬剤に加えて高脂血症患者に投与することができ、場合により、同様な薬学的組成物に組み込まれる。
【0158】
脂肪肝疾患:かなり多くの集団は、脂肪肝疾患に罹患し、これは又、非アルコール性脂肪肝炎(NASH)として知られており、NASHは、多くの場合、肥満及び糖尿病に関連する。肝細胞と共にトリグリセリドが点在する、肝脂肪症は、肝臓が慢性炎症になりやすく(炎症性白血球の浸潤として生検被験物質において検出)、これは、線維症及び肝硬変につながる恐れがある。一般的に、脂肪肝疾患は、肝細胞傷害の指数として作用するトランスアミナーゼであるALT及びAST等の肝特異的酵素の血清濃度の上昇が認められることにより、及び多くの場合、明確な診断に生検を必要とするが、肝領域の疲労及び疼痛を含む症状の顕在により検出される。期待される利点は、肝炎症及び脂肪量の低下であり、これは、NASHの線維症及び肝硬変への進行を減弱、停止又は軽減させる。
【0159】
薬学的組成物
本発明は、本明細書に記載の生物活性剤を含む医薬生成物及び薬学的に許容される担体を提供する。本発明の薬学的組成物の更なる実施形態は、上記の生物活性剤の実施形態の何れか1つを含む。不必要な冗長を避ける目的において、このような薬剤及び薬剤群を、それぞれ繰り返さないが、繰り返す場合と同じく、薬学的組成物を本説明に組み込む。
【0160】
好ましくは、組成物は、経口投与、例えば、錠剤、被覆錠剤、糖衣錠、ハード又はソフトゼラチンカプセル、溶液、乳液又は懸濁液の形態で適応される。一般的に、経口組成物は、このような薬剤1mg〜400mgを含むであろう。被験体にとって1日当たり1つ以上の錠剤、被覆錠剤、糖衣錠又はゼラチンカプセルの服用が都合がよい。しかし、組成物は又、経腸、例えば、座剤の形態、非経口、例えば、注射溶液の形態又は経鼻を含めた幾つか他の従来の全身投与手段による投与に適応してよい。
【0161】
生物学的活性化合物は、薬学的組成物の生成に薬学的に不活性な、無機又は有機担体を使用して加工することができる。ラクロース、コーンスターチ又はその誘導体、タルク、ステアリン酸又はその塩等は、例えば、錠剤、被覆錠剤、糖衣錠及びハードゼラチンカプセル等用のこのような担体として使用することができる。ソフトゼラチンカプセルに適切な担体は、例えば、植物油、ワックス、脂肪、半固体及び液体ポリオール等である。しかし、活性成分の性質に応じて、通常、ソフトゼラチンそのもの以外のソフトゼラチンカプセルの場合、担体を必要としない。溶液及びシロップの生成に適切な担体は、例えば、水、ポリオール、グリセロール、植物油等である。座剤に適切な担体は、例えば、天然又は硬化油、ワックス、脂肪、半固体又は液体ポリオール等である。
【0162】
更に、薬学的組成物は、防腐剤、可溶化剤、安定剤、湿潤剤、乳化剤、甘味剤、着色剤、香味剤、浸透圧を変化させる塩、緩衝剤、被覆剤又は抗酸化剤を含有することができる。これらは又、更に他の治療的価値のある物質、特に抗糖尿病又は脂質低下剤を含有することができ、これは、本発明の化合物の効果を基礎としたもの以外の機序を通して作用する。単一の配合において本発明の化合物と有利に結合することができる薬剤は、メトホルミン等のビグアニド、スルホニルウレアインスリン放出剤グリブリド及び他のスルホニルウレアインスリン放出剤などのインスリン放出剤、アトロバスタチン、ロバスタチン、プラバスタチン及びシンバスタチン等の「スタチン」HMG−CoA環元酵素阻害剤などのコレステロール低下薬、クロフィブラート及びジェムフィブロジル等のPPAR−α作用薬、チアゾリジンジオン(例えば、ロシグリタゾン及びピオグリタゾン)等のPPARγ作用薬、アカルボース(デンプン消化を阻害)等のα−グルコシダーゼ阻害剤、及びレパグリニド等の食事性インスリン放出剤を含むがこれらに限定されない。単一の配合において、本発明の化合物と結合される相補剤の一定量は、標準的な臨床診療において使用される用量に一致する。代表的な特定の化合物の確立された安全及び有効用量の範囲は、上記されている。
【0163】
本発明は、以下の実施例を参照することにより理解されるが、これらの実施例は、本明細書に記載の本発明を例示するものであるが、これを制限するものではない。
【実施例】
【0164】
(実施例1)
【0165】
【化29】

2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸
手順A:3−ヒドロキシフェニル酢酸エチルの調製:
無水エタノール(250ml)中3−ヒドロキシフェニル酢酸(25g、164.31mmol)及びp−トルエンスルホン酸一水和物(3.49g、18.3mmol)溶液を4時間又は出発材料全てを消費するまで還流した。反応混合物を濃縮し、酢酸エチルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル2:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 3.5 (s, 2H); 4.1 (q, 2H); 6.6−7.2 (m, 4H).手順B:3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの調製:
THF(30ml)及びDMF(13ml)中2,6−ジメチルベンジルアルコール(5.25g、38.6mmol)及びジイソプロピルアゾジカルボキシレート(DIAD、8.49g、42mmol)溶液をTHF(100ml)中3−ヒドロキシフェニル酢酸エチル(手順A、6.66g、37mmol)及びトリフェニルホスフィン(11g、42mmol)溶液に滴加した。反応混合物を室温にて4時間撹拌し、エーテルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 3.5 (s, 2H); 4.1 (q, 2H); 5.1
(s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順C:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸エチルの調製:
乾燥アルゴン雰囲気下において、−68℃にて、乾燥THF(30ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4g、13.6mmol)にLiHMDS(THF中1M溶液、17.45ml、17.4mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3I(5.71g、40.26mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、氷でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:エーテル5:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 1.5 (t, 3H); 2.4 (s, 6H); 3.7 (m, 1H); 4.1
(q, 2H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順D:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸の調製:
無水エタノール(60ml)中2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸の撹拌溶液(手順C、3g、9.6mmol)に室温にて1N NaOH(20ml)を添加した。反応混合物を3時間撹拌し、1N HClによりpH3.5〜4.0に酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.5 (t, 3H); 2.4 (s, 6H); 3.7 (m, 1H); 5.0 (s, 2H); 6.9
(m, 2H); 7.15−7.35 (m, 5H).
(実施例2)
【0166】
【化30】

2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチル酢酸
手順A:3−ヒドロキシフェニル酢酸エチルの調製:
実施例1、手順Aの方法を使用して、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 3.5 (s, 2H); 4.1 (q, 2H); 6.6−7.2 (m, 4H).手順B:3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの調製:
実施例1、手順Bの方法を使用して、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 3.5 (s, 2H); 4.1 (q, 2H); 5.1
(s, 2H); 6.9 (m, 2H); 7.15−7.35 (m, 5H).
手順C:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸エチルの調製:
乾燥アルゴン雰囲気下において、−78℃にて、乾燥THF(60ml)及びHMPA(15ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4.84g、16.2mmol)にLDA(THF中2M溶液、25ml、48.72mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3CH2I(10.13g、64.96mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、クエン酸水溶液でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): .9 (t, 3H); 1.2
(t, 3H); 1.8 (m, 1H); 2.1(m, 1H); 2.4 (s, 6H); 3.4 (t, 1H); 4.1 (q, 2H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.30 (m, 5H).
手順D:2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸の調製:
無水エタノール(60ml)中2−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−エチル酢酸エチルの撹拌溶液(手順C、3.26g、10.0mmol)に室温にて1N NaOH(20ml)を添加した。反応混合物を3時間撹拌し、1N HClにより酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5 酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): .9 (t, 3H); 1.8
(m, 1H); 2.1(m, 1H); 2.4 (s, 6H); 3.4 (t, 1H); 5.0 (s, 2H); 6.9 (m, 2H); 7.15−7.30 (m, 5H).
(実施例3)
【0167】
【化31】

3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸
手順A:3−(3−ヒドロキシフェニル)プロパン酸エチルの調製:
無水エタノール(250ml)中3−ヒドロキシフェニルプロパン酸(25g、150.60mmol)及びp−トルエンスルホン酸一水和物(3.80g、20mmol)溶液を4時間又は出発材料全てを消費するまで還流した。反応混合物を濃縮し、酢酸エチルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル2:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.6 (t, 2H); 2.8 (t, 2H); 4.2 (q, 2H); 6.7−6.8 (m, 3H); 7.2 (m, 1H).
手順B:3−(2,6−ジメチルベンジルオキシ)フェニル)プロパン酸エチルの調製:
THF(30ml)及びDMF(13ml)中2,6−ジメチルベンジルアルコール(7.71g、56.7mmol)及びジイソプロピルアゾジカルボキシレート(DIAD、11.36g、56.18mmol)溶液を0℃にてTHF(100ml)中3−(3−ヒドロキシフェニル)プロパン酸エチル(手順A、10.0g、51.5mmol)及びトリフェニルホスフィン(14.73g、56.18mmol)溶液に滴加した。反応混合物を同じ温度にて4時間撹拌し、エーテルで希釈し、水で洗浄した。有機層をNa2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:酢酸エチル4:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 2.4 (s, 6H); 2.6 (t, 2H); 3.0 (t, 2H); 4.2
(q, 2H); 5.1 (s, 2H); 6.8 (m, 3H); 7.2−7.4 (m, 4H).
手順C:3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸エチルの調製:
乾燥アルゴン雰囲気下において、−68℃にて、乾燥THF(30ml)中3−(2,6−ジメチルベンジルオキシ)フェニル酢酸エチルの撹拌溶液(手順B、4.53g、14.5mmol)にLiHMDS(THF中1M溶液、21.77ml、21.77mmol)を滴加し、得られた橙色溶液を低温にて30分間撹拌し、その後、CH3I(20.60g、145.2mmol)を添加した。反応混合物を室温まで緩徐に加温し、15時間撹拌した。反応は、氷でクエンチし、生成物をEtOAc(2回)で抽出し、有機相をブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(ヘキサン:エーテル5:1)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.2 (t, 3H); 1.5 (t, 3H); 2.4 (s, 6H); 2.51−2.58 (m, 1H); 2.71 (dd, 1H); 2.88 (dd, 1H); 4.2 (q,
2H); 5.1 (s, 2H); 6.9 (m, 3H); 7.2−7.4
(m, 4H).
手順D:3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸の調製:
無水エタノール(25ml)中3−(3−(2,6−ジメチルベンジルオキシ)フェニル)−2−メチルプロパン酸エチルの撹拌溶液(手順C、1.61g、4.9mmol)に室温にて1N NaOH(10ml)を添加した。反応混合物を3時間撹拌し、1N HClによりpH3.5〜4.0に酸性化し、濃縮した。残留物をクロロホルムに入れ、0.1N HCl、ブラインで洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮し、シリカゲルカラムのフラッシュクロマトグラフィーにより精製し(クロロホルム:メタノール95:5 酢酸を使用してスパイク)、表題化合物を得た。
1H NMR (270 MHz, CDCl3): 1.5 (t, 3H); 2.4 (s, 6H); 2.51−2.58 (m, 1H); 2.71 (dd, 1H); 2.88 (dd, 1H); 5.1 (s, 2H); 6.9 (m,
3H); 7.2−7.4 (m, 4H).
以下の生物学的活性の実施例全てにおいて、化合物CWを化学合成実施例1に従い生成した。
【0168】
生物学的活性実施例
(実施例A) db/dbマウスにおける化合物CWの抗糖尿病効果
db/dbマウスは、レプチンシグナル伝達を欠失し、過食、肥満及び糖尿病につながる。更に、C57BL/6Jバックグラウンドのob/obマウスと異なり、C57BLKSバックグラウンドのdb/dbマウスは、これらのインスリン産生膵臓ランゲルハンス島細胞の機能不全があり、高インスリン症(末梢インスリン抵抗性に関連)から低インスリン性糖尿病に進行する。
【0169】
およそ8週齢の肥満(db/dbホモ接合体)C57BL/Ksola雄マウスをJacson Labs(米国メイン州バーハーバー)から得え、体重(40〜45g)及び血清グルコース濃度(摂食状態≧300mg/dl)が群間で類似するように5〜7匹の群に任意に分け、細身(db/+ヘテロ接合体)の雄マウスをコホート試験の対照として使用した。購入後最短7日間で順応した。全ての動物を温度(23℃)、相対湿度(50±5%)及び照明(7:00〜19:00)の制御下において管理し、標準的な飼料(Formulab Diet 5008、Quality Lab Products[米国メリーランド州エルクリッジ])及び水に自由に摂取できるようにした。
【0170】
マウスに、ビヒクル及び化合物CWを2週間毎日経口投与した。処置期間の最後に、静脈血100μlを血清化学分析用に後眼窩洞からヘパリン処理した毛細管チューブに採取した。マウスは、採血時、摂食状態であった。
【0171】
2週間連日の経口投与後、化合物CWは、血糖の有意な低下を誘発した(表1)。同様に、化合物CWは、血清トリグリセリドを低下させた(表2)。
【0172】
(表1:II型糖尿病のdb/dbマウス試験における血清グルコースの化合物CWの効果)
【0173】
【表1】

*p<0.05 ビヒクル対照と比較した時の有意差
(表2:db/dbマウスにおける血清トリグリセリドの化合物CWの効果)
【0174】
【表2】

(実施例B) ヒトPPARαの化合物CW活性
PPARαの化合物CW活性を試験するために、トランス活性化検定を使用した。トランス活性化検定は、核受容体の分子ドメイン構造を利用する。融合タンパク質をヒト又はマウスのPPARリガンド結合ドメイン(PPAR−LBD)と酵母Ga14DNA結合ドメイン(「アクチベータープラスミド」)との間で作製した。レポーター遺伝子構築物は、ルシフェラーゼレポーターを有するcisのGa14DNA結合要素からなる。作用薬がGa14/PPAR−LBDを結合する場合、融合タンパク質がレポーター遺伝子上のGa14DNA結合要素を結合し、ホタルルシフェラーゼ遺伝子の転写を生じる。ルシフェラーゼは、ATP依存性反応において基質ルシフェリンを酸化し、放出された光量は、酵素濃度及び結果的にはPPAR−LBDを結合するリガンド活性濃度を直接測定する。
【0175】
アクチベーターを発現するプラスミドは、酵母GAL4DNA結合ドメインを含有し、このドメインは、ヒトPPARαリガンド結合及びヒンジドメイン(a.a.167〜468)を融合した。使用されたレポータープラスミドは、pFRLucであり、これは、GAL4UAS含有プロモーターの制御下において、ホタルルシフェラーゼ遺伝子を有する(Stratagene[米国カリフォルニア州ラホーヤ])。
【0176】
トランスフェクション1日前に、細胞型に応じて、細胞を5×104〜2×105個/ウェルの密度にて24ウェルプレートに播種した。細胞をLipofectamin2000試薬(Invitrogen[米国カリフォルニア州カルスバッド])を使用してトランスフェクトした。Lipofectamin2000を、オプチメン培地50μLを含有するチューブに添加した(2.5μL/ウェル)。2つ目のチューブにおいて、プラスミドDNAを4:3(レポーター:アクチベーター)の割合で添加し、適宜、サケ精子DNAを、プラスミドを発現するアクチベーター用に置換し、合計0.8μg/ウェルのDNAを生成した。DNAをオプチメン血清低減培地50μLに添加した(血清を添加せず)。
【0177】
2つの溶液を室温にて5分間インキュベート後、結合した。結合溶液を室温にて更に30分間インキュベートし、リポソーム複合体を形成した。
【0178】
細胞をPBSで1回洗浄し、トランスフェクション混合物100μLを各ウェルに添加した。5%CO2インキュベーターにおいて、プレートを37℃にて、およそ4時間インキュベート後、トランスフェクション混合物を吸引し、新鮮なEagle最少必須培地(10%FBS及びグルタミンを補充したEMEM(Cambrex(米国ニュージャージー州イーストラザーフォード)の「EMEMコンプリート」)で培地を置き換えた。トランスフェクション24時間後、プレートをEMEMコンプリート培地において適当な化合物で処理した。処理24時間後、細胞をPBSで1回洗浄し、レポーター溶解緩衝液100μL/ウェル(Promega[米国ウィスコンシン州マディソン])を添加した。細胞を分析前に一度凍結/融解した。溶解物およそ10μLをホタルルシフェラーゼ基質100μLに添加した。
【0179】
結果は、PN2069がヒトPPARαの部分作用薬であることを示す(同様の実験において、陽性対照のWy−14643は、最大活性、約40000RLUに達した)。
【0180】
図1を参照。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】




【公開番号】特開2013−82753(P2013−82753A)
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【外国語出願】
【出願番号】特願2013−23191(P2013−23191)
【出願日】平成25年2月8日(2013.2.8)
【分割の表示】特願2008−540343(P2008−540343)の分割
【原出願日】平成18年11月9日(2006.11.9)
【出願人】(501056821)ウェルスタット セラピューティクス コーポレイション (32)
【Fターム(参考)】
【公開日】平成25年5月9日(2013.5.9)
【国際特許分類】
【出願番号】特願2013−23191(P2013−23191)
【出願日】平成25年2月8日(2013.2.8)
【分割の表示】特願2008−540343(P2008−540343)の分割
【原出願日】平成18年11月9日(2006.11.9)
【出願人】(501056821)ウェルスタット セラピューティクス コーポレイション (32)
【Fターム(参考)】
[ Back to top ]

