低減された抗原用量を有するブースターワクチンの製造
【課題】低減された抗原用量を有するブースターワクチンの製造方法の提供。
【解決手段】ワクチンを製造する方法であって、ここでそのワクチンはジフテリアトキソイドおよび破傷風トキソイドを含み、この方法は(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクを(ii)破傷風トキソイドを含むがジフテリアトキソイドを含まない第二のバルクと組み合わせる工程を含む、方法。この準備は、同じバルクから小児用および青年用ワクチンの両方を簡便に製造することを促進する:第一のバルクは、小児用ワクチンに適当なジフテリア破傷風比を有し得、そして第二のバルクを、青年用ワクチンで見出されるように、ジフテリアトキソイドの相対的な量を抑制するために使用し得る。
【解決手段】ワクチンを製造する方法であって、ここでそのワクチンはジフテリアトキソイドおよび破傷風トキソイドを含み、この方法は(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクを(ii)破傷風トキソイドを含むがジフテリアトキソイドを含まない第二のバルクと組み合わせる工程を含む、方法。この準備は、同じバルクから小児用および青年用ワクチンの両方を簡便に製造することを促進する:第一のバルクは、小児用ワクチンに適当なジフテリア破傷風比を有し得、そして第二のバルクを、青年用ワクチンで見出されるように、ジフテリアトキソイドの相対的な量を抑制するために使用し得る。
【発明の詳細な説明】
【技術分野】
【0001】
本明細書中で引用された全ての文書は、その全体として参考文献に組み込まれる。
【0002】
本発明は、混合ワクチン、すなわち1つ以上の病原体由来の混合した免疫原を含むワクチンを製造する分野であり、そのワクチンの投与は、1つ以上の病原体に対して同時に患者を免疫し得る。
【背景技術】
【0003】
2005年、米国において2つの青年用ブースターワクチン−BOOSTRIXTMおよびADACELTMが認可された[1](非特許文献1)。どちらのワクチンも、ジフテリアトキソイド、破傷風トキソイド、および無細胞性百日咳抗原を含む。これら2つのワクチンの共通の特徴は、その小児用の対応物と比較して、それらはより少ない抗原用量を有することであり、例えばBOOSTRIXTMのジフテリアトキソイド含有量は、INFANRIXTM製品の10分の1であり、そしてADACELTMにおいてはDAPTACELTMの7.5分の1である。さらに、抗原性成分の比も変化している。特に、ジフテリアおよび破傷風トキソイドの比は、INFANRIXTM製品においては2.5:1であるが、BOOSTRIXTM製品では1:2であり、そしてDAPTACELTM製品においては3:1であるが、ADACELTM製品においては1:2.5である。
【0004】
従ってこれらのブースターワクチンは、絶対量および破傷風トキソイド含有量に対する比較の両方において、ジフテリアトキソイドの用量の大きな減少を示す。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Broderら、MMWR Recomm Rep(2006)55(RR−3):1−34
【発明の概要】
【発明が解決しようとする課題】
【0006】
この型のワクチン組成物を製造するための、さらなる、および改善された方法を提供することが、本発明の目的である。
【課題を解決するための手段】
【0007】
個々のバルクジフテリアおよび破傷風抗原を混合することを含む方法によってブースターワクチン組成物を製造することではなく、本発明は、(i)ジフテリアトキソイドおよび破傷風トキソイドを両方含む第一のバルク、および(ii)ジフテリアトキソイド無しに破傷風トキソイドを含む第二のバルクを使用する。この準備は、同じバルクからの小児用および青年用ワクチンの両方を簡便に製造することを促進する:第一のバルクは、小児用ワクチンに適当なジフテリア:破傷風の比を有し得、そして第二のバルクを使用して、青年用ワクチンにおいて見られるように、ジフテリアトキソイドの相対的な量を減少させ得る。
【0008】
従って、単一のバルクが、ワクチン製造者のために2つの役割を果たし得、それは物事を単純にし得る。例えば、混合ジフテリア/破傷風バルクを調製および臨床的放出パラメーター(無菌性、力価、抗原含有量、等)に関して試験し、そして次いで倉庫に保存し得る。もし小児量ワクチンが必要なら、ジフテリア/破傷風比のさらなる調整無しに使用し得るが、もし青年用ワクチンが必要なら、さらなるジフテリア材料を調製する必要がない。一価のジフテリアトキソイドバルクは、調製または試験または保管する必要がなく、それによって製造方法を単純にする。混合ジフテリア/破傷風バルクが貯蔵されていれば、製造者は容易に小児用ワクチンを調製し得る;ジフテリア/破傷風バルクに添加するための一価の破傷風トキソイドバルクをさらに貯蔵することによって、例えば医療提供者からの需要の変化に依存して、別の一価のジフテリアトキソイドバルクを必要とせずに、製造者は容易に小児用および青年用処方の間を交換し得る。
【0009】
従って、本発明は、ワクチンを製造する方法を提供し、ここでそのワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、この方法は(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクを、(ii)破傷風トキソイドを含むがジフテリアトキソイドを含まない第二のバルクと組み合わせる工程を含む。
【0010】
そのワクチンは、無細胞性百日咳抗原、不活化ポリオウイルス抗原等のような、さらなる抗原を含み得る。これらのさらなる抗原を、別のバルクとしてその方法において使用し得る、および/またはそれらは、方法の開始時に第一のバルクおよび/または第二のバルクに存在し得る。
【0011】
そのワクチンは、1つまたはそれ以上のアルミニウム塩、例えば水酸化アルミニウムを含むアジュバントのような、アジュバントを含み得る。アジュバントを、別のバルクとしてその方法において使用し得る、および/またはそれらは、方法の開始前に第一のバルクおよび/または第二のバルクに存在し得る。
【0012】
第一の水性バルク
本発明の方法で使用する第一のバルクは、ジフテリアトキソイドおよび破傷風トキソイドをどちらも含む。
【0013】
第一のバルクのジフテリアおよび破傷風トキソイドは、好ましくは水酸化アルミニウムアジュバントに吸着する(より好ましくは、完全に吸着する)。トキソイドを別々に調製し、それらをそれぞれ別々に水酸化アルミニウムアジュバントに吸着し、そして次いで2つの吸着したトキソイドを(任意でさらなるアジュバントおよびあらゆる他の望ましい成分と)混合することによって吸着を達成して、第一のバルクを生じ得る。
【0014】
第一のバルクは、1−ヒドロキシ−2−フェノキシエタン(「2−ヒドロキシエチルフェニルエーテル」、「2−フェノキシエタノール」、「エチレングリコールフェニルエーテル」等としても知られる)のような、保存剤を含み得る。しかし、好ましいバルクは、保存剤を含まず、そして特に1−ヒドロキシ−2−フェノキシエタンを含まない。しかし、もし第一のバルクが1−ヒドロキシ−2−フェノキシエタンを含むなら、その濃度は、好ましくは(a)ジフテリアトキソイド100Lfごとに、2.5mgおよび3.5mgの間(例えば約3mg)、および/または(b)破傷風トキソイド100Lfごとに、7mgおよび8mgの間(例えば約7.5mg)である。第一のバルクにおいて、3g/lおよび8g/lの間(例えば4−6g/lの間、または約5g/l)の1−ヒドロキシ−2−フェノキシエタン濃度を用い得る。その第一のバルクは、水銀保存剤(例えばチメロサール)を含まない。
【0015】
第一の成分中の、破傷風トキソイドに対するジフテリアトキソイドの比(Lf単位で測定)は、簡便に2:1および3:1の間、および好ましくは約2.5:1である。
【0016】
第一のバルク中のジフテリアトキソイドおよび破傷風トキソイドの濃度は、1ミリリットルあたりで表して(±10%)以下の通りであり得る:167Lfのジフテリアトキソイド;および67Lfの破傷風トキソイド。代案として、例えば単純な希釈によって得られるように、相対的な比率(比)が同じままであるなら、トキソイドの濃度は、これらの値の部分であり得る。
【0017】
その第一のバルクは、トキソイド、アジュバント、および任意の保存剤に加えて、さらなる化合物を含み得る。特に、それは塩化ナトリウムおよび/または残留性のホルムアルデヒドを含み得る。ジフテリアトキソイド100Lfあたり5mgおよび6mgの間、例えば8および9mg/ml(例えば約8.5mg/ml)の塩化ナトリウム濃度が好ましい。
【0018】
その第一のバルクは、好ましくはポリソルベート80を含まない。
【0019】
第二の水性バルク
本発明の方法で使用される第二のバルクは、破傷風トキソイドを含むが、ジフテリアトキソイドを含まない。
【0020】
第二のバルク中の破傷風トキソイドは、水酸化アルミニウムアジュバントに吸着し得る。しかし、好ましくは、その破傷風トキソイドはアジュバントを含まず、そして特にアルミニウム塩を含まない。もし第二のバルク中の破傷風トキソイドが水酸化アルミニウムアジュバントに吸着するなら、本発明の方法は、アルミニウムを含まない破傷風トキソイド調製物を、水酸化アルミニウムアジュバントと組み合わせることによって第二のバルクを調製する最初の工程を含み得る。本発明の方法において使用する前に、組み合わせたアジュバントおよびトキソイドを、ある期間置いて吸着を可能にし得る。
【0021】
その第二のバルクは、1−ヒドロキシ−2−フェノキシエタンのような保存剤を含み得る。しかし、好ましいバルクは、保存剤を含まず、そして特に1−ヒドロキシ−2−フェノキシエタンを含まない。その第二のバルクは、水銀保存剤(例えばチメロサール)を含まない。
【0022】
その第二のバルクは、好ましくはポリソルベート80を含まない。
【0023】
ジフテリアトキソイド
ジフテリアは、Corynebacterium diphtheriae、グラム陽性無芽胞好気性細菌によって引き起こされる。この生物は、プロファージがコードするADP−リボシル化外毒素(「ジフテリア毒素」)を発現し、それを処理して(例えばホルムアルデヒドを用いて)、毒性ではないが抗原性のままであり、そして注射後に特異的な抗毒素抗体の産生を刺激し得るトキソイドを得ることができる。ジフテリアトキソイドは、参考文献2の13章において、より詳細に開示される。好ましいジフテリアトキソイドは、ホルムアルデヒド処理によって調製されたものである。そのジフテリアトキソイドを、C.diphtehriaeを増殖培地(例えばフェントン培地、またはLinggoud & フェントン培地)中で増殖させ、それにウシ抽出物を添加し得、続いてホルムアルデヒド処理、限外ろ過および沈殿によって得ることができる。そのトキソイド材料を、次いで滅菌ろ過および/または透析を含む方法によって処理し得る。
【0024】
ジフテリアトキソイドの量を、国際単位(IU)で表し得る。例えば、NIBSC[3]は、「Diphtheria Toxoid Adsorbed Third International Standard 1999」[4、5]を供給し、それはアンプルあたり160IUを含む。IU系の代案として、「Lf」単位(「凝集単位」、「境界凝集用量」、または「凝集の限界」)が、1国際単位の抗毒素と混合した場合に、最適に凝集した混合物を産生するトキソイドの量として定義される[6]。例えば、NIBSCは、アンプルあたり300Lfを含む「Diphtheria Toxoid、Plain」[7]、アンプルあたり900Lfを含む「The 1st International Reference Reagent For Diphtheria Toxoid For Flocculation Test」[8]を供給する。IUおよびLf系の間の変換は、特定のトキソイド調製物に依存する。
【0025】
C.diphtheriaeの培養においてウシ材料を用いる場合、それらをウシ海綿状脳症(BSE)または他の伝染性海綿状脳症(TSE)を含まない供給源から得るべきである。
【0026】
破傷風トキソイド
破傷風は、Clostridium tetani、グラム陽性、芽胞形成桿菌によって引き起こされる。この生物は、エンドペプチダーゼ(「破傷風毒素」)を発現し、それを処理して毒性ではないが抗原性のままであり、そして注射後に特異的な抗毒素抗体の産生を刺激し得るトキソイドを得ることができる。破傷風トキソイドは、参考文献2の27章においてより詳細に開示される。好ましい破傷風トキソイドは、ホルムアルデヒド処理によって調製されたものである。破傷風トキソイドを、C.tetaniを増殖培地(例えばウシカゼイン由来のLatham培地)中で増殖させ、続いてホルムアルデヒド処理、限外ろ過および沈殿によって得ることができる。その材料を、次いで滅菌ろ過および/または透析を含む方法によって処理し得る。
【0027】
破傷風トキソイドの量を、国際単位(IU)で表し得る。例えば、NIBSC[9]は、「Tetanus Toxoid Adsorbed Third International Standard 2000」[10、11]を供給し、それはアンプルあたり469IUを含む。IU系の代案として、「Lf」単位が、1国際単位の抗毒素と混合した場合に、最適に凝集した混合物を産生するトキソイドの量として定義される[12]。例えば、NIBSCは、アンプルあたり1000Lfを含む「The 1st International Reference Reagent For Tetanus Toxoid For Flocculation Test」[13]を供給する。IUおよびLf系の間の変換は、特定のトキソイド調製物に依存する。
【0028】
C.tetaniの培養においてウシ材料を用いる場合、それらをウシ海綿状脳症(BSE)または他の伝染性海綿状脳症(TSE)を含まない供給源から得るべきである。
【0029】
無細胞性百日咳抗原
Bordetella pertussisは、グラム陰性無芽胞好気性菌であり、百日咳を引き起こす。参考文献2の21章においてより詳細に記載されるように、B.pertussisに対するワクチンが長年の間入手可能であり、そして2つのカテゴリー:細胞性および無細胞性に分類される。細胞性ワクチンは、殺菌および不活性化された(例えばホルマリンおよび/または熱による処置によって)B.pertussis細胞全体を含み、一方無細胞性ワクチンは、天然の細菌から精製されたか、または組換え宿主における発現後に精製された、特定の精製B.pertussis抗原を含む。
【0030】
本発明の方法は、ジフテリアトキソイド、破傷風トキソイド、および無細胞性百日咳抗原を含むワクチンを提供するために、無細胞性百日咳抗原を使用することを含み得る。
【0031】
本発明は、典型的には、単一のワクチンにおいて1つ以上の無細胞性百日咳(aP)抗原、例えば2つまたは3つの以下の周知およびよく特徴付けられたB.pertussis抗原を使用する:(1)無毒化百日咳毒素(百日咳毒素、または「PT」):(2)線維状ヘマグルチニン(「FHA」);(3)パータクチン(「69キロダルトン外膜タンパク質」としても知られる)。これらの抗原を3つ全て使用することが最も好ましい。これら3つの抗原を、好ましくは、改変Stainer−Scholte液体培地で増殖させたB.pertussis培養物からの単離によって調製する。PTおよびFHAを、発酵ブロスから単離し得(例えばヒドロキシアパタイトゲルに対する吸着によって)、一方パータクチンを、熱処理および凝集によって(例えば塩化バリウムを用いて)細胞から抽出し得る。抗原を、連続的なクロマトグラフィーおよび/または沈殿工程で精製し得る。PTおよびFHAを、疎水性クロマトグラフィー、アフィニティークロマトグラフィー、およびサイズ排除クロマトグラフィーによって精製し得る。パータクチンを、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、およびサイズ排除クロマトグラフィーによって精製し得る。
【0032】
FHAおよびパータクチンを、本発明による使用の前にホルムアルデヒドで処理し得る。PTを、好ましくは、ホルムアルデヒドおよび/またはグルタルアルデヒドによる処理によって無毒化する。この化学的無毒化手順の代案として、PTは、突然変異生成によって酵素活性が低減された変異PTであり得るが[14]、化学的処理による無毒化が好ましい。
【0033】
使用し得るさらなる無細胞性百日咳抗原は、線毛を含む(例えば凝集原2および3)。
【0034】
非吸着状態でaP抗原を使用し得るが、好ましくは使用する前に、1つまたはそれ以上のアルミニウム塩アジュバントに吸着する。aP抗原は、好ましくは水酸化アルミニウムアジュバントに吸着する。
【0035】
aP抗原を、第一のバルクおよび/または第二のバルクに加え得る、またはそれらを別のバルクとして加え得る。1つ以上のaP抗原を使用する場合、各aP抗原を、それ自身のバルクとして加え得る、またはaP抗原を、使用の前に同じバルクに組み合わせ得る。
【0036】
好ましくは、aP成分は、実質的に1−ヒドロキシ−2−フェノキシエタンを含まない。
【0037】
好ましくは、aP成分は、実質的に水銀保存剤(例えばチメロサール)を含まない。
【0038】
aP成分は、ポリソルベート80を含み得る。百日咳成分中のポリソルベート80のレベルは、百日咳抗原が、最終的なワクチン製品において望ましい濃度であることを確実にするための、いかなる成分の希釈の後でも、ポリソルベート80の濃度は200μg/mlより少ない、および好ましくは100μg/mlより少ないようになっている。最終的なワクチン製品中の典型的なポリソルベート濃度は、70および90μg/mlの間、例えば約80μg/mlである。
【0039】
本発明の方法におけるその使用の前に、aP成分におけるポリソルベート80の量の好ましい上限は、10μgのFHAあたり<40μgである。
【0040】
無細胞性百日咳抗原の量は、典型的にはマイクログラムで表される。PT、FHAおよびパータクチンの組み合わせのために、各抗原の量は、好ましくは最終ワクチンにおける最終的なPT:FHA:パータクチン重量比が8:8:2.5になるように選択される。
【0041】
不活化ポリオウイルス抗原
灰白脊髄炎は、3つの型のポリオウイルスのうち1つによって引き起こされ得る。その3つの型は類似であり、そして同じ症状を引き起こすが、抗原は非常に異なり、そして1つの型による感染は、他のものによる感染に対して保護しない。従って、参考文献2の24章において説明されるように、本発明の方法において3つのポリオウイルス抗原−ポリオウイルス1型(例えばMahoney株)、ポリオウイルス2型(例えばMEF−1株)およびポリオウイルス3型(例えばSaukett株)を使用することが好ましい。
【0042】
本発明の方法は、ジフテリアトキソイド、破傷風トキソイドおよび不活化ポリオウイルス抗原を含むワクチンを提供するために、不活化ポリオウイルス(IPV)抗原を使用することを含み得る。
【0043】
ポリオウイルスを、細胞培養において増殖させ得る。好ましい培養は、ベロ細胞株を使用し、それはサル腎臓由来の連続的な細胞株である。ベロ細胞は、簡便に、培養したマイクロキャリアであり得る。ウイルス感染前および感染中のベロ細胞の培養は、仔ウシ血清のようなウシ由来材料、およびラクトアルブミン加水分解産物(例えば、ラクトアルブミンの酵素的分解によって得られる)の使用を含み得る。そのようなウシ由来材料は、BSEまたは他のTSEを含まない供給源から得るべきである。増殖後、ウイルス粒子を、限外ろ過、ダイアフィルトレーション、およびクロマトグラフィーのような技術を用いて精製し得る。患者への投与の前に、ポリオウイルスを不活化しなければならず、そしてこれを、ウイルスを本発明の方法で使用する前にホルムアルデヒドで処理することによって達成し得る。
【0044】
3つのポリオウイルスを、好ましくは増殖させ、精製し、そして個々に不活化し、そして次いで組み合わせて本発明の方法で使用するためのバルク混合物を得る。組み合わせたポリオウイルスは、好ましくは、本発明の方法において使用する前に、いかなるアジュバントにも吸着しないが、加えた後、それらはワクチン組成物に既に存在するアルミニウムアジュバントに吸着し得る。
【0045】
IPV抗原を、第一のバルクおよび/または第二のバルクに加え得る、またはそれらを別のバルクとして加え得る。
【0046】
好ましくは、IPV抗原は、実質的に1−ヒドロキシ−2−フェノキシエタンを含まない。
【0047】
好ましくは、IPV抗原は、実質的に水銀保存剤(例えばチメロサール)を含まない。
【0048】
好ましくは、IPV抗原は、実質的にポリソルベート80を含まない、例えばそれらは0.1μg/mlより少ないポリソルベート80を含み、そして好ましくは検出可能なポリソルベート80を含まない。しかし、ポリソルベート80は、IPV成分の産生の間に使用されたかもしれない。
【0049】
IPV抗原は、微量のネオマイシンおよび/またはポリミキシンを含み得る。
【0050】
IPV抗原の量は、典型的には「DU」単位(「D−抗原単位」[15])で表す。別々の株それぞれの抗原の量を、好ましくは、最終的なワクチンにおける1:2:3型のDU比が5:1:4になるように選択する。
【0051】
さらなる任意の抗原
本発明は、好ましくは3価のジフテリア−破傷風−百日咳ワクチンを調製するために、または4価のジフテリア−破傷風−百日咳−ポリオウイルスワクチンを調製するために使用する。しかし、ジフテリア、破傷風、百日咳およびIPV抗原に加えて、本発明のワクチンは、例えばB型肝炎ウイルス由来、Haemophilus influenzae
B由来、Streptococcus pneumoniae由来、Neisseria meningitidis、A型肝炎ウイルス、麻疹ウイルス、流行性耳下腺炎ウイルス、風疹ウイルス、ロタウイルス、インフルエンザウイルス等由来の、1つまたはそれ以上のさらなる抗原を含み得る。
【0052】
アジュバント
上記で記載したように、本発明の方法で使用する前に、抗原をアルミニウムアジュバントに吸着し得る(それらは「予め吸着している」)
現在使用されているアルミニウムアジュバントは、典型的には「水酸化アルミニウム」または「リン酸アルミニウム」アジュバントのいずれかと呼ばれる。しかし、どれも存在する実際の化合物の正確な説明ではないので、これらは便宜上の名前である(例えば参考文献16の9章を参照のこと)。本発明は、アジュバントとして一般的に使用される「水酸化物」または「リン酸塩」のいずれも使用し得る。
【0053】
「水酸化アルミニウム」として知られるアジュバントは、典型的にはアルミニウムオキシ水酸化物塩であり、それは通常少なくとも部分的に結晶性である。式AlO(OH)によって示し得るオキシ水酸化アルミニウムを、赤外(IR)分光法によって、特に1070cm−1における吸着バンドおよび3090−3100cm−1における強いショルダーによって、水酸化アルミニウムAl(OH)3のような、他のアルミニウム化合物から区別し得る[参考文献16の9章]。水酸化アルミニウムアジュバントの結晶性の程度は、半分の高さにおける回折バンドの幅(WHH)を反映し、結晶性の低い粒子は、より小さい結晶サイズのために、より大きな線の広がりを示す。WHHが増加するにつれて表面積が増加し、そしてより高いWHH値を有するアジュバントが、より高い抗原吸着能力を有するようであった。線維性の形態(例えば透過型電子顕微鏡写真において見られるような)は、水酸化アルミニウムアジュバントに典型的である。水酸化アルミニウムアジュバントのpIは、典型的には約11であり、すなわち、アジュバント自身が、生理学的pHにおいて陽性の表面電荷を有する。pH7.4におけるAl+++1mgあたり、1.8−2.6mgの間のタンパク質の吸着能力が、水酸化アルミニウムアジュバントに関して報告された。
【0054】
「リン酸アルミニウム」として知られるアジュバントは、典型的にはアルミニウムの水酸化リン酸塩であり、多くの場合少量の硫酸塩も含む。それらを沈殿によって得ることができ、そしてその反応条件および沈殿の間の濃度が、塩の水酸基に関するリン酸の置換の程度に影響を与える。水酸化リン酸塩は、一般的に0.3および0.99の間のPO4/Alモル比を有する。水酸化リン酸塩を、水酸基の存在によって、厳密なAlPO4から区別し得る。例えば、3164cm−1におけるIRスペクトルバンド(例えば200℃に加熱した場合)は、構造的な水酸基の存在を示す[参考文献16の9章]。
【0055】
リン酸アルミニウムアジュバントのPO4/Al3+モル比は、一般的に0.3および1.2の間であり、好ましくは0.8および1.2の間であり、そしてより好ましくは0.95±0.1である。リン酸アルミニウムは、特に水酸化リン酸塩に関して、一般的に非晶質である。典型的なアジュバントは、0.84および0.92の間のPO4/Alモル比を有する、非晶質の水酸化リン酸アルミニウムであり、0.6mgAl3+/mlで含まれる。リン酸アルミニウムは、一般的に粒子状である(例えば透過型電子顕微鏡写真で見られるような、プレート様の形態)。粒子の典型的な直径は、いかなる抗原吸着後も、0.5−20μmの範囲(例えば約5−10μm)である。pH7.4においてAl+++1mgあたり0.7−1.5mgのタンパク質の吸着能力が、リン酸アルミニウムアジュバントに関して報告された。
【0056】
リン酸アルミニウムの電荷ゼロ点(PZC)は、水酸基に関するリン酸の置換の程度と反比例し、そしてこの置換の程度は、沈殿による塩の調製に使用した反応条件および反応物の濃度に依存して変化し得る。PZCはまた、溶液中の遊離のリン酸イオンの濃度を変化させることによって(より多くのリン酸塩=より酸性のPZC)、またはヒスチジン緩衝液のような緩衝液を加えることによって(PZCをより塩基性にする)、変化する。本発明によって使用されるリン酸アルミニウムは、一般的に4.0および7.0の間の、より好ましくは5.0および6.5の間、例えば約5.7のPZCを有する。
【0057】
本発明のワクチンは、水酸化アルミニウムアジュバントを有し得る、またはそれらは組み合わせた水酸化アルミニウム/リン酸アルミニウムアジュバントを有し得る。水酸化物およびリン酸塩がどちらも存在する場合、それぞれによって提供されるAl3+含有量の比は、好ましくは3:2である(例えば水酸化アルミニウムから0.6mg/mlのAl3+、およびリン酸アルミニウムから0.4mg/mlのAl3+)。
【0058】
青年用ブースターワクチンのAl3+含有量は、最適な免疫のために重要であり得る[17]。本発明によって産生されるワクチンのアルミニウム含有量全体は(Al3+によって測定される)、好ましくは0.25mg/mlより多いが、好ましくは1.5mg/mlより少ない、例えばそれは約0.6mg/mlである。
【0059】
望ましい最終的なAl3+含有量を得るために、それらを組み合わせる前に、および/または別のバルクとして余分なアルミニウム塩を加えて、例えば第一のバルク、第二のバルク、および3番目のバルクを組み合わせる前に、適当なAl3+含有量のバルクを使用することが可能であり、ここで3番目のバルクはアルミニウムアジュバントを含む。
【0060】
本発明の方法によって産生されたワクチン
典型的な使用において、本発明の方法を使用して、包装、そして次いで流通および投与に適当なバルク混合ワクチンを提供する。上記で述べた濃度は、典型的には最終的な包装されたワクチンの濃度であり、そしてバルクワクチン中の濃度は、より高くあり得る(例えば希釈によって最終的な濃度に低減される)。
【0061】
従って、本発明の方法は、ワクチンを使用のための容器に包装する、さらなる工程を含み得る。容器は、ワクチンの単回用量を含み得る、またはそれらは1回以上の用量、例えば10回用量を含み得る(「複数回投与」容器)。複数回投与のバイアルを使用する場合、各用量を、バイアル内容物の汚染を避けるよう気をつけて、厳密な無菌条件下で、滅菌針およびシリンジで取らなければならない。単回投与容器が好ましい。複数の単回投与容器を、例えば10個の単回投与バイアルを、一緒に包装し得る。
【0062】
適当な容器は、バイアルおよび使い捨てシリンジを含む。これらは、好ましくは滅菌である。ワクチンが最終使用者による投与のためにすぐ使用できるように、シリンジに包装することが特に好ましい。シリンジは、付属の針と共に流通し得るが、針無しで流通することも可能である。
【0063】
シリンジを、はぎ取り式のラベルと共に提供し得、そこにロットナンバーおよび内容物の有効期限を印刷して(例えばバーコードとして)、記録の保存を促進し得る。シリンジは、その内容物の同定を促進するために、着色した(例えば緑色の)バンドを含み得る。シリンジのプランジャーは。好ましくは、吸引の間にプランジャーが誤ってはずれるのを防ぐために、ストッパーを有する。シリンジは、ラテックスゴムキャップおよび/またはプランジャーを有し得る。シリンジは一般的に、針を取り付ける前に先端を密封する先端キャップを有し、そしてその先端キャップは、好ましくはブチルゴムでできている。シリンジおよび針が別々に包装されている場合、針は好ましくはブチルゴムの遮蔽物にはまっている。灰色のブチルゴムが好ましい。シリンジは、針を守るためのロッキングメカニズム、例えばLuer−LokTMを組み込んだ先端を有し得る。適当なシリンジは、「Tip−Lok」TMまたはHypakTMPRTCの商品名で市販されているものである。
【0064】
ワクチンがバイアルに包装される場合、これらはプラスチック材料製、または好ましくはガラス製であり得る。そのバイアルは、好ましくは、ワクチンをそれに加える前に滅菌される。ラテックス感受性の患者による問題を避けるために、バイアルを、好ましくはラテックスを含まないストッパーで密封する。
【0065】
ワクチンを容器に入れた後、その容器を次いで、流通のための箱に、例えば厚紙の箱の中に封入し得る。箱に、ワクチンの詳細、例えば商品名、ワクチン中の抗原のリスト(例えば「破傷風トキソイド、低減された(reduced)ジフテリアトキソイド、および無細胞性百日咳ワクチン、吸着済」および/または「Tdap」)、提示する容器(例えば「使い捨て充填済みTip−Lokシリンジ」または「10×0.5ml単回投与バイアル」)、その用量(例えば「それぞれ単回0.5ml用量を含む」)、警告(例えば「青年用限定」)、有効期限、製造者の名称等を書いたラベルを貼る。箱はそれぞれ、1つ以上の包装されたワクチン、例えば5本のシリンジまたは10本のバイアルのような、5個または10個の包装されたワクチンを含み得る。視覚的効果のために、箱の1つの角の背景色は、箱の残りと異なる色、例えば緑色の箱の紫色の角であり得る。
【0066】
ワクチンを、ワクチンの詳細、例えば投与の説明書、ワクチン中の抗原の詳細等を含むリーフレットと一緒に(例えば同じ箱に)包装し得る。その説明書はまた、例えば、ワクチン接種後のアナフィラキシー反応の場合にアドレナリンの溶液をすぐ使えるようにしておくこと等の警告を含み得る。
【0067】
本発明の方法は、1ミリリットルあたり以下の内容物を有するワクチンを調製するために特に有用である。
【0068】
【表1】

バルクワクチンにおける個々の抗原の濃度、抗原のバルクワクチンへの添加の前に必要な希釈、およびバルクから最終的なワクチンへ必要なあらゆる希釈を、それに応じて計算し得、そして従って本発明の方法を、投与あたりこれらの濃度で抗原を含む、最終的な混合ワクチンを産生するために行い得る。
【0069】
最終的なワクチンは、好ましくは滅菌である。
【0070】
最終的なワクチンは、好ましくは非発熱性であり、例えばそれは投与あたり<1EU(内毒素単位;1EUは0.2ngのFDA基準標準内毒素EC−2「RSE」と同等である)、そして好ましくは投与あたり<0.1EUを含む。
【0071】
最終的なワクチンは、好ましくはグルテンを含まない。
【0072】
最終的なワクチンのpHは、好ましくは6および8の間、例えば6.5および7.5の間である。本発明の方法は、従って包装の前にバルクワクチンのpHを調整する方法を含み得る。
【0073】
包装されたワクチンは、好ましくは白濁懸濁液である。
【0074】
包装されたワクチンは、好ましくは2℃および8℃の間で保存される。それは凍結してはいけない。
【0075】
最終的なワクチン製品の浸透圧をコントロールするために、ナトリウム塩のような生理学的塩を含むことが好ましい。等張塩化ナトリウムのような、塩化ナトリウム(NaCl)が好ましい。通常9mg/mlの最終的なNaCl濃度が適当である。
【0076】
本発明の方法の間、保存剤、および特に水銀保存剤(例えばチメロサール)は使用しないことが好ましい。
【0077】
ワクチンの投与
本発明の方法によって産生された混合ワクチンを、好ましくは注射によって患者に投与する。筋肉内注射が好ましい(例えば上腕の三角筋に)。理想的には、注射の前に、注射部位の皮膚を、適当な消毒薬によって清潔にし、そして準備する。典型的な注射は、0.5mlの容量を有し、そして本発明の方法は、バルク混合ワクチンの0.5mlのサンプルを容器に抽出し、そして包装する工程を含み得る。ワクチンBOOSTRIXの投与のために典型的な針のサイズは、22−25ゲージの針、1および1.25インチの長さ(2.5から3.2cm)である。
【0078】
ワクチンがアルミニウム塩アジュバントを含む場合、投与の前に、均一な、白濁した懸濁液を得るために、激しく振とうしなければならない。
【0079】
理想的には、ワクチンを、ブースターワクチンとして、以前にジフテリアおよび破傷風の両方に対して、および好ましくは百日咳に対しても、ワクチン接種した患者に投与する。以前のワクチンに対する免疫記憶反応を有することによって、これらの患者を、一般的な集団から区別し得る。好ましい患者は、その最も最近のジフテリアおよび/または破傷風ワクチンを、本発明のワクチンを受ける少なくとも5年前に受けた。ワクチンを投与される好ましい患者は、従って4歳および65歳の間、例えば11−64歳、10−18歳等である。
【0080】
本発明によって産生されたワクチンを、他のワクチンと実質的に同時に、例えば髄膜炎菌結合ワクチン(4価血清型A−C−W135−Yワクチンのような)、および/または多価肺炎球菌結合ワクチン等と実質的に同時に、患者に投与し得る(例えば医療専門家またはワクチンセンターへの、同じ診察または訪問中に)。そのようなさらなるワクチンを、本発明のワクチンとは、別のシリンジで、および異なる注射部位に投与する。そのワクチンを、同様に、破傷風免疫グロブリンと実質的に同時に投与し得る。
【0081】
いかなる特定の抗原に関しても、ワクチン接種ガイドライン(例えばWHOガイドライン)が、最終的なワクチン中に存在すべき量を推奨または処方し得る。その情報(例えば投与あたり10μg)を、ワクチン用量(例えば0.5mlの用量)と組み合わせて、その抗原に関してバルクワクチン中で必要な濃度を計算し得る。
【0082】
本発明の方法は、0.5mlの用量あたり以下の内容物を有するワクチンを調製するのに特に有用である:
【0083】
【表2】

一般
「含む(comprising)」という用語は、「含む(including)」および「構成する」を含み、例えばXを「含む(comprising)」組成物は、独占的にXから成る、または何か他のもの、例えばX+Yを含み得る(include)。
【0084】
「実質的に」という用語は、「完全に」を除外せず、例えばYを「実質的に含まない」組成物は、完全にYを含まないであり得る。必要な場合、「実質的に」という用語は、本発明の定義から省略し得る。
【0085】
数字の値xに関連して「約」という用語は、例えばx±10%を意味する。
【0086】
ガラス容器を使用する場合、ホウケイ酸ガラスがソーダ石灰ガラスよりも好ましい。
【0087】
成分がアジュバントに「吸着した」と記載される場合、その抗原の少なくとも50%(重量によって)、例えば50%、60%、70%、80%、90%、95%、98%、またはそれ以上が吸着していることが好ましい。成分が完全に吸着している場合、遠心後の組成物の上清に何も検出されない。
したがって、本発明は以下の項目を提供する:
(項目1)
ワクチンを製造するための方法であって、該ワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、該方法は、(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクと(ii)破傷風トキソイドを含むが、ジフテリアトキソイドは含まない第二のバルクとを合わせる工程を包含する、方法。
(項目2)
上記ワクチンが、1つ以上の無細胞性百日咳抗原もまた含む、項目1に記載の方法。
(項目3)
上記ワクチンが、不活化百日咳毒素、線維状ヘマグルチニンおよびパータクチンを含む、項目2に記載の方法。
(項目4)
上記不活化百日咳毒素、上記線維状ヘマグルチニンおよび上記パータクチンが、8:8:3の比(重量で測定)で存在する、項目3に記載の方法。
(項目5)
上記ワクチンが、不活化ポリオウイルス(IPV)抗原もまた含む、項目1〜4のいずれか一項に記載の方法。
(項目6)
上記ワクチンが、ポリオウイルス1型株、ポリオウイルス2型株およびポリオウイルス3型株の各々由来のIPV抗原を含む、項目5に記載の方法。
(項目7)
上記IPV抗原が、5:1:4の1型:2型:3型の比(DUで測定)で存在する、項目6に記載の方法。
(項目8)
上記ワクチンが、1つ以上のアルミニウム塩アジュバントを含む、項目1〜7のいずれか一項に記載の方法。
(項目9)
上記ワクチンが、水酸化アルミニウムアジュバントを含む、項目8に記載の方法。
(項目10)
上記ワクチンが、リン酸アルミニウムアジュバントをさらに含む、項目9に記載の方法。
(項目11)
上記ワクチンが、リン酸アルミニウムアジュバントを含まない、項目10に記載の方法。
(項目12)
上記第一のバルク内の上記ジフテリアトキソイドおよび上記破傷風トキソイドが、水酸化アルミニウムアジュバントに吸着される、項目1〜11のいずれか一項に記載の方法。(項目13)
上記第一のバルクが、水銀保存剤を含まない、項目1〜12のいずれか一項に記載の方法。
(項目14)
上記第一のバルクが保存剤を含む、項目1〜13のいずれか一項に記載の方法。
(項目15)
上記第一のバルクが、1−ヒドロキシ−2−フェノキシエタンを含む、項目14に記載の方法。
(項目16)
上記第一のバルクが、約5g/lの1−ヒドロキシ−2−フェノキシエタンを含む、項目15に記載の方法。
(項目17)
上記第一のバルクが保存剤を含まない、項目1〜12のいずれか一項に記載の方法。
(項目18)
上記ジフテリアトキソイドおよび上記破傷風トキソイドが、約2.5:1のジフテリア:破傷風の比(Lf単位で測定)で存在する、項目1〜17のいずれか一項に記載の方法。
(項目19)
上記第一のバルクが、ジフテリアトキソイド100Lfあたり5mgと6mgとの間の塩化ナトリウムを含む、項目1〜18のいずれか一項に記載の方法。
(項目20)
上記第一のバルクが、ポリソルベート80を含まない、項目1〜19のいずれか一項に記載の方法。
(項目21)
上記第二のバルクが、アルミニウム塩を含まない、項目1〜20のいずれか一項に記載の方法。
(項目22)
上記第二のバルクが、水銀保存剤を含まない、項目1〜21のいずれか一項に記載の方法。
(項目23)
上記第二のバルクが、保存剤を含まない、項目1〜22のいずれか一項に記載の方法。(項目24)
上記第二のバルクが、ポリソルベート80を含まない、項目1〜23のいずれか一項に記載の方法。
(項目25)
上記ワクチンが、0.25mg/mlと1.5mg/mlとの間のAl3+含有量を有する、項目1〜24のいずれか一項に記載の方法。
(項目26)
上記ワクチンが、約0.6mg/mlのAl3+含有量を有する、項目25に記載の方法。
(項目27)
上記ワクチンを容器に包装する工程をさらに包含する、項目1〜26のいずれか一項に記載の方法。
(項目28)
上記容器がバイアルである、項目27に記載の方法。
(項目29)
上記容器がシリンジである、項目27に記載の方法。
(項目30)
上記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン、
を有する、項目2〜29のいずれか一項に記載の方法。
(項目31)
上記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン;80DUのMahoney株ポリオウイルス;16DuのMEF1株ポリオウイルス;および64DUのSaukett株ポリオウイルス、
を有する、項目5〜29のいずれか一項に記載の方法。
(項目32)
上記ワクチンが、1mlあたり1未満の内毒素単位を含む、項目1〜31のいずれか一項に記載の方法。
(項目33)
上記ワクチンが保存剤を含まない、項目1〜32のいずれか一項に記載の方法。
【図面の簡単な説明】
【0088】
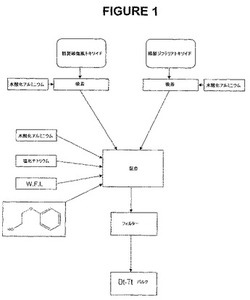
【図1】図1は、吸着したジフテリアおよび破傷風トキソイドの混合バルクの調製を説明する。
【実施例】
【0089】
実施例1/青年用ブースターとして使用するためのD−T−aPワクチン
第一のバルク抗原成分を、図1に示すように調製した。それは以下の組成物を有する:
【0090】
【表3】

ジフテリアおよび破傷風トキソイドは両方とも、完全にアジュバントに吸着し、バルクのサンプルの遠心後、上清に何も検出できなかった。
【0091】
このバルクを使用して、例えば用量あたり25Lfのジフテリアトキソイドおよび10Lfの破傷風トキソイドを含む、小児用D−T−aPワクチンを調製し得る。しかし、(Lf単位で測定して)ジフテリアトキソイドよりも多くの破傷風トキソイドを必要とする青年用ブースター投与に関しては、このバルクを使用することはできない。2.5Lfの望ましい最終的なジフテリアトキソイド用量にバルクを希釈すれば、希釈された破傷風トキソイド用量はわずかに1Lfであり、それは望ましい用量の5分の1である。希釈されたAl3+用量(<0.1mg)も、参考文献17で報告された最低有効用量よりも低い。従って、ジフテリア:破傷風の比およびAl3+用量を修正しなければならない。
【0092】
ジフテリア:破傷風の比の調整を可能にするために、濃縮破傷風トキソイド(3000Lf/mlおよび3000Lf/mlの間;8mg/mlおよび9mg/mlの間の塩化ナトリウム;7.0および7.8の間のpH)を含む、第二のバルクを調製した。第二のバルクは他の抗原、アジュバント、および保存剤を含まない。
【0093】
これら2つの抗原バルクを、さらなるアルミニウムアジュバント(水酸化物およびリン酸塩)、水酸化アルミニウムアジュバントに吸着した無細胞性百日咳抗原、および塩化ナトリウムを含むバルクと共に組み合わせ、そして希釈して、最終的な望ましい濃度および成分の比を有するバルク混合ワクチンを得る。この手順を使用して、1mlあたり以下の組成物を含むバルクを調製し得る:
【0094】
【表4】

このバルクを、Tip−LokTMシリンジに、0.5mlの用量で包装する。このワクチンを、以前にD−T−Pワクチンを投与された青年におけるブースターとして使用し得る。
【0095】
従って、第一のバルクを、小児用および青年用D−T−Pワクチン両方の基礎として使用し得る。
【0096】
実施例2/保存剤を含まない、低減されたアルミニウムD−T−aPワクチン
実施例1で調製したワクチンの保存剤を排除するために、異なる第一のバルクを使用する。混合工程の間に1−ヒドロキシ−2−フェノキシエタンを加えない。
【0097】
アルミニウム含有量を低減するために、リン酸アルミニウムアジュバントを加えない。
【0098】
包装後、保存剤を含まない0.5mlの用量はそれぞれ以下の組成物を有する:
【0099】
【表5】

実施例3/D−T−aP−IPVワクチン
4価のD−T−aP−IPVワクチンを作成するために、IPVと混合したバルクを、実施例1の方法に加えて、0.5mlの用量あたり以下の内容物を有する最終的なワクチンを得る:
【0100】
【表6】

本発明が例としてのみ記載され、そして本発明の範囲および意図のうちに留まりながら改変を行い得ることが理解される。
【0101】
参考文献(これらの内容は、参考として本明細書に援用される)
【0102】
【化1】

【技術分野】
【0001】
本明細書中で引用された全ての文書は、その全体として参考文献に組み込まれる。
【0002】
本発明は、混合ワクチン、すなわち1つ以上の病原体由来の混合した免疫原を含むワクチンを製造する分野であり、そのワクチンの投与は、1つ以上の病原体に対して同時に患者を免疫し得る。
【背景技術】
【0003】
2005年、米国において2つの青年用ブースターワクチン−BOOSTRIXTMおよびADACELTMが認可された[1](非特許文献1)。どちらのワクチンも、ジフテリアトキソイド、破傷風トキソイド、および無細胞性百日咳抗原を含む。これら2つのワクチンの共通の特徴は、その小児用の対応物と比較して、それらはより少ない抗原用量を有することであり、例えばBOOSTRIXTMのジフテリアトキソイド含有量は、INFANRIXTM製品の10分の1であり、そしてADACELTMにおいてはDAPTACELTMの7.5分の1である。さらに、抗原性成分の比も変化している。特に、ジフテリアおよび破傷風トキソイドの比は、INFANRIXTM製品においては2.5:1であるが、BOOSTRIXTM製品では1:2であり、そしてDAPTACELTM製品においては3:1であるが、ADACELTM製品においては1:2.5である。
【0004】
従ってこれらのブースターワクチンは、絶対量および破傷風トキソイド含有量に対する比較の両方において、ジフテリアトキソイドの用量の大きな減少を示す。
【先行技術文献】
【非特許文献】
【0005】
【非特許文献1】Broderら、MMWR Recomm Rep(2006)55(RR−3):1−34
【発明の概要】
【発明が解決しようとする課題】
【0006】
この型のワクチン組成物を製造するための、さらなる、および改善された方法を提供することが、本発明の目的である。
【課題を解決するための手段】
【0007】
個々のバルクジフテリアおよび破傷風抗原を混合することを含む方法によってブースターワクチン組成物を製造することではなく、本発明は、(i)ジフテリアトキソイドおよび破傷風トキソイドを両方含む第一のバルク、および(ii)ジフテリアトキソイド無しに破傷風トキソイドを含む第二のバルクを使用する。この準備は、同じバルクからの小児用および青年用ワクチンの両方を簡便に製造することを促進する:第一のバルクは、小児用ワクチンに適当なジフテリア:破傷風の比を有し得、そして第二のバルクを使用して、青年用ワクチンにおいて見られるように、ジフテリアトキソイドの相対的な量を減少させ得る。
【0008】
従って、単一のバルクが、ワクチン製造者のために2つの役割を果たし得、それは物事を単純にし得る。例えば、混合ジフテリア/破傷風バルクを調製および臨床的放出パラメーター(無菌性、力価、抗原含有量、等)に関して試験し、そして次いで倉庫に保存し得る。もし小児量ワクチンが必要なら、ジフテリア/破傷風比のさらなる調整無しに使用し得るが、もし青年用ワクチンが必要なら、さらなるジフテリア材料を調製する必要がない。一価のジフテリアトキソイドバルクは、調製または試験または保管する必要がなく、それによって製造方法を単純にする。混合ジフテリア/破傷風バルクが貯蔵されていれば、製造者は容易に小児用ワクチンを調製し得る;ジフテリア/破傷風バルクに添加するための一価の破傷風トキソイドバルクをさらに貯蔵することによって、例えば医療提供者からの需要の変化に依存して、別の一価のジフテリアトキソイドバルクを必要とせずに、製造者は容易に小児用および青年用処方の間を交換し得る。
【0009】
従って、本発明は、ワクチンを製造する方法を提供し、ここでそのワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、この方法は(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクを、(ii)破傷風トキソイドを含むがジフテリアトキソイドを含まない第二のバルクと組み合わせる工程を含む。
【0010】
そのワクチンは、無細胞性百日咳抗原、不活化ポリオウイルス抗原等のような、さらなる抗原を含み得る。これらのさらなる抗原を、別のバルクとしてその方法において使用し得る、および/またはそれらは、方法の開始時に第一のバルクおよび/または第二のバルクに存在し得る。
【0011】
そのワクチンは、1つまたはそれ以上のアルミニウム塩、例えば水酸化アルミニウムを含むアジュバントのような、アジュバントを含み得る。アジュバントを、別のバルクとしてその方法において使用し得る、および/またはそれらは、方法の開始前に第一のバルクおよび/または第二のバルクに存在し得る。
【0012】
第一の水性バルク
本発明の方法で使用する第一のバルクは、ジフテリアトキソイドおよび破傷風トキソイドをどちらも含む。
【0013】
第一のバルクのジフテリアおよび破傷風トキソイドは、好ましくは水酸化アルミニウムアジュバントに吸着する(より好ましくは、完全に吸着する)。トキソイドを別々に調製し、それらをそれぞれ別々に水酸化アルミニウムアジュバントに吸着し、そして次いで2つの吸着したトキソイドを(任意でさらなるアジュバントおよびあらゆる他の望ましい成分と)混合することによって吸着を達成して、第一のバルクを生じ得る。
【0014】
第一のバルクは、1−ヒドロキシ−2−フェノキシエタン(「2−ヒドロキシエチルフェニルエーテル」、「2−フェノキシエタノール」、「エチレングリコールフェニルエーテル」等としても知られる)のような、保存剤を含み得る。しかし、好ましいバルクは、保存剤を含まず、そして特に1−ヒドロキシ−2−フェノキシエタンを含まない。しかし、もし第一のバルクが1−ヒドロキシ−2−フェノキシエタンを含むなら、その濃度は、好ましくは(a)ジフテリアトキソイド100Lfごとに、2.5mgおよび3.5mgの間(例えば約3mg)、および/または(b)破傷風トキソイド100Lfごとに、7mgおよび8mgの間(例えば約7.5mg)である。第一のバルクにおいて、3g/lおよび8g/lの間(例えば4−6g/lの間、または約5g/l)の1−ヒドロキシ−2−フェノキシエタン濃度を用い得る。その第一のバルクは、水銀保存剤(例えばチメロサール)を含まない。
【0015】
第一の成分中の、破傷風トキソイドに対するジフテリアトキソイドの比(Lf単位で測定)は、簡便に2:1および3:1の間、および好ましくは約2.5:1である。
【0016】
第一のバルク中のジフテリアトキソイドおよび破傷風トキソイドの濃度は、1ミリリットルあたりで表して(±10%)以下の通りであり得る:167Lfのジフテリアトキソイド;および67Lfの破傷風トキソイド。代案として、例えば単純な希釈によって得られるように、相対的な比率(比)が同じままであるなら、トキソイドの濃度は、これらの値の部分であり得る。
【0017】
その第一のバルクは、トキソイド、アジュバント、および任意の保存剤に加えて、さらなる化合物を含み得る。特に、それは塩化ナトリウムおよび/または残留性のホルムアルデヒドを含み得る。ジフテリアトキソイド100Lfあたり5mgおよび6mgの間、例えば8および9mg/ml(例えば約8.5mg/ml)の塩化ナトリウム濃度が好ましい。
【0018】
その第一のバルクは、好ましくはポリソルベート80を含まない。
【0019】
第二の水性バルク
本発明の方法で使用される第二のバルクは、破傷風トキソイドを含むが、ジフテリアトキソイドを含まない。
【0020】
第二のバルク中の破傷風トキソイドは、水酸化アルミニウムアジュバントに吸着し得る。しかし、好ましくは、その破傷風トキソイドはアジュバントを含まず、そして特にアルミニウム塩を含まない。もし第二のバルク中の破傷風トキソイドが水酸化アルミニウムアジュバントに吸着するなら、本発明の方法は、アルミニウムを含まない破傷風トキソイド調製物を、水酸化アルミニウムアジュバントと組み合わせることによって第二のバルクを調製する最初の工程を含み得る。本発明の方法において使用する前に、組み合わせたアジュバントおよびトキソイドを、ある期間置いて吸着を可能にし得る。
【0021】
その第二のバルクは、1−ヒドロキシ−2−フェノキシエタンのような保存剤を含み得る。しかし、好ましいバルクは、保存剤を含まず、そして特に1−ヒドロキシ−2−フェノキシエタンを含まない。その第二のバルクは、水銀保存剤(例えばチメロサール)を含まない。
【0022】
その第二のバルクは、好ましくはポリソルベート80を含まない。
【0023】
ジフテリアトキソイド
ジフテリアは、Corynebacterium diphtheriae、グラム陽性無芽胞好気性細菌によって引き起こされる。この生物は、プロファージがコードするADP−リボシル化外毒素(「ジフテリア毒素」)を発現し、それを処理して(例えばホルムアルデヒドを用いて)、毒性ではないが抗原性のままであり、そして注射後に特異的な抗毒素抗体の産生を刺激し得るトキソイドを得ることができる。ジフテリアトキソイドは、参考文献2の13章において、より詳細に開示される。好ましいジフテリアトキソイドは、ホルムアルデヒド処理によって調製されたものである。そのジフテリアトキソイドを、C.diphtehriaeを増殖培地(例えばフェントン培地、またはLinggoud & フェントン培地)中で増殖させ、それにウシ抽出物を添加し得、続いてホルムアルデヒド処理、限外ろ過および沈殿によって得ることができる。そのトキソイド材料を、次いで滅菌ろ過および/または透析を含む方法によって処理し得る。
【0024】
ジフテリアトキソイドの量を、国際単位(IU)で表し得る。例えば、NIBSC[3]は、「Diphtheria Toxoid Adsorbed Third International Standard 1999」[4、5]を供給し、それはアンプルあたり160IUを含む。IU系の代案として、「Lf」単位(「凝集単位」、「境界凝集用量」、または「凝集の限界」)が、1国際単位の抗毒素と混合した場合に、最適に凝集した混合物を産生するトキソイドの量として定義される[6]。例えば、NIBSCは、アンプルあたり300Lfを含む「Diphtheria Toxoid、Plain」[7]、アンプルあたり900Lfを含む「The 1st International Reference Reagent For Diphtheria Toxoid For Flocculation Test」[8]を供給する。IUおよびLf系の間の変換は、特定のトキソイド調製物に依存する。
【0025】
C.diphtheriaeの培養においてウシ材料を用いる場合、それらをウシ海綿状脳症(BSE)または他の伝染性海綿状脳症(TSE)を含まない供給源から得るべきである。
【0026】
破傷風トキソイド
破傷風は、Clostridium tetani、グラム陽性、芽胞形成桿菌によって引き起こされる。この生物は、エンドペプチダーゼ(「破傷風毒素」)を発現し、それを処理して毒性ではないが抗原性のままであり、そして注射後に特異的な抗毒素抗体の産生を刺激し得るトキソイドを得ることができる。破傷風トキソイドは、参考文献2の27章においてより詳細に開示される。好ましい破傷風トキソイドは、ホルムアルデヒド処理によって調製されたものである。破傷風トキソイドを、C.tetaniを増殖培地(例えばウシカゼイン由来のLatham培地)中で増殖させ、続いてホルムアルデヒド処理、限外ろ過および沈殿によって得ることができる。その材料を、次いで滅菌ろ過および/または透析を含む方法によって処理し得る。
【0027】
破傷風トキソイドの量を、国際単位(IU)で表し得る。例えば、NIBSC[9]は、「Tetanus Toxoid Adsorbed Third International Standard 2000」[10、11]を供給し、それはアンプルあたり469IUを含む。IU系の代案として、「Lf」単位が、1国際単位の抗毒素と混合した場合に、最適に凝集した混合物を産生するトキソイドの量として定義される[12]。例えば、NIBSCは、アンプルあたり1000Lfを含む「The 1st International Reference Reagent For Tetanus Toxoid For Flocculation Test」[13]を供給する。IUおよびLf系の間の変換は、特定のトキソイド調製物に依存する。
【0028】
C.tetaniの培養においてウシ材料を用いる場合、それらをウシ海綿状脳症(BSE)または他の伝染性海綿状脳症(TSE)を含まない供給源から得るべきである。
【0029】
無細胞性百日咳抗原
Bordetella pertussisは、グラム陰性無芽胞好気性菌であり、百日咳を引き起こす。参考文献2の21章においてより詳細に記載されるように、B.pertussisに対するワクチンが長年の間入手可能であり、そして2つのカテゴリー:細胞性および無細胞性に分類される。細胞性ワクチンは、殺菌および不活性化された(例えばホルマリンおよび/または熱による処置によって)B.pertussis細胞全体を含み、一方無細胞性ワクチンは、天然の細菌から精製されたか、または組換え宿主における発現後に精製された、特定の精製B.pertussis抗原を含む。
【0030】
本発明の方法は、ジフテリアトキソイド、破傷風トキソイド、および無細胞性百日咳抗原を含むワクチンを提供するために、無細胞性百日咳抗原を使用することを含み得る。
【0031】
本発明は、典型的には、単一のワクチンにおいて1つ以上の無細胞性百日咳(aP)抗原、例えば2つまたは3つの以下の周知およびよく特徴付けられたB.pertussis抗原を使用する:(1)無毒化百日咳毒素(百日咳毒素、または「PT」):(2)線維状ヘマグルチニン(「FHA」);(3)パータクチン(「69キロダルトン外膜タンパク質」としても知られる)。これらの抗原を3つ全て使用することが最も好ましい。これら3つの抗原を、好ましくは、改変Stainer−Scholte液体培地で増殖させたB.pertussis培養物からの単離によって調製する。PTおよびFHAを、発酵ブロスから単離し得(例えばヒドロキシアパタイトゲルに対する吸着によって)、一方パータクチンを、熱処理および凝集によって(例えば塩化バリウムを用いて)細胞から抽出し得る。抗原を、連続的なクロマトグラフィーおよび/または沈殿工程で精製し得る。PTおよびFHAを、疎水性クロマトグラフィー、アフィニティークロマトグラフィー、およびサイズ排除クロマトグラフィーによって精製し得る。パータクチンを、イオン交換クロマトグラフィー、疎水性クロマトグラフィー、およびサイズ排除クロマトグラフィーによって精製し得る。
【0032】
FHAおよびパータクチンを、本発明による使用の前にホルムアルデヒドで処理し得る。PTを、好ましくは、ホルムアルデヒドおよび/またはグルタルアルデヒドによる処理によって無毒化する。この化学的無毒化手順の代案として、PTは、突然変異生成によって酵素活性が低減された変異PTであり得るが[14]、化学的処理による無毒化が好ましい。
【0033】
使用し得るさらなる無細胞性百日咳抗原は、線毛を含む(例えば凝集原2および3)。
【0034】
非吸着状態でaP抗原を使用し得るが、好ましくは使用する前に、1つまたはそれ以上のアルミニウム塩アジュバントに吸着する。aP抗原は、好ましくは水酸化アルミニウムアジュバントに吸着する。
【0035】
aP抗原を、第一のバルクおよび/または第二のバルクに加え得る、またはそれらを別のバルクとして加え得る。1つ以上のaP抗原を使用する場合、各aP抗原を、それ自身のバルクとして加え得る、またはaP抗原を、使用の前に同じバルクに組み合わせ得る。
【0036】
好ましくは、aP成分は、実質的に1−ヒドロキシ−2−フェノキシエタンを含まない。
【0037】
好ましくは、aP成分は、実質的に水銀保存剤(例えばチメロサール)を含まない。
【0038】
aP成分は、ポリソルベート80を含み得る。百日咳成分中のポリソルベート80のレベルは、百日咳抗原が、最終的なワクチン製品において望ましい濃度であることを確実にするための、いかなる成分の希釈の後でも、ポリソルベート80の濃度は200μg/mlより少ない、および好ましくは100μg/mlより少ないようになっている。最終的なワクチン製品中の典型的なポリソルベート濃度は、70および90μg/mlの間、例えば約80μg/mlである。
【0039】
本発明の方法におけるその使用の前に、aP成分におけるポリソルベート80の量の好ましい上限は、10μgのFHAあたり<40μgである。
【0040】
無細胞性百日咳抗原の量は、典型的にはマイクログラムで表される。PT、FHAおよびパータクチンの組み合わせのために、各抗原の量は、好ましくは最終ワクチンにおける最終的なPT:FHA:パータクチン重量比が8:8:2.5になるように選択される。
【0041】
不活化ポリオウイルス抗原
灰白脊髄炎は、3つの型のポリオウイルスのうち1つによって引き起こされ得る。その3つの型は類似であり、そして同じ症状を引き起こすが、抗原は非常に異なり、そして1つの型による感染は、他のものによる感染に対して保護しない。従って、参考文献2の24章において説明されるように、本発明の方法において3つのポリオウイルス抗原−ポリオウイルス1型(例えばMahoney株)、ポリオウイルス2型(例えばMEF−1株)およびポリオウイルス3型(例えばSaukett株)を使用することが好ましい。
【0042】
本発明の方法は、ジフテリアトキソイド、破傷風トキソイドおよび不活化ポリオウイルス抗原を含むワクチンを提供するために、不活化ポリオウイルス(IPV)抗原を使用することを含み得る。
【0043】
ポリオウイルスを、細胞培養において増殖させ得る。好ましい培養は、ベロ細胞株を使用し、それはサル腎臓由来の連続的な細胞株である。ベロ細胞は、簡便に、培養したマイクロキャリアであり得る。ウイルス感染前および感染中のベロ細胞の培養は、仔ウシ血清のようなウシ由来材料、およびラクトアルブミン加水分解産物(例えば、ラクトアルブミンの酵素的分解によって得られる)の使用を含み得る。そのようなウシ由来材料は、BSEまたは他のTSEを含まない供給源から得るべきである。増殖後、ウイルス粒子を、限外ろ過、ダイアフィルトレーション、およびクロマトグラフィーのような技術を用いて精製し得る。患者への投与の前に、ポリオウイルスを不活化しなければならず、そしてこれを、ウイルスを本発明の方法で使用する前にホルムアルデヒドで処理することによって達成し得る。
【0044】
3つのポリオウイルスを、好ましくは増殖させ、精製し、そして個々に不活化し、そして次いで組み合わせて本発明の方法で使用するためのバルク混合物を得る。組み合わせたポリオウイルスは、好ましくは、本発明の方法において使用する前に、いかなるアジュバントにも吸着しないが、加えた後、それらはワクチン組成物に既に存在するアルミニウムアジュバントに吸着し得る。
【0045】
IPV抗原を、第一のバルクおよび/または第二のバルクに加え得る、またはそれらを別のバルクとして加え得る。
【0046】
好ましくは、IPV抗原は、実質的に1−ヒドロキシ−2−フェノキシエタンを含まない。
【0047】
好ましくは、IPV抗原は、実質的に水銀保存剤(例えばチメロサール)を含まない。
【0048】
好ましくは、IPV抗原は、実質的にポリソルベート80を含まない、例えばそれらは0.1μg/mlより少ないポリソルベート80を含み、そして好ましくは検出可能なポリソルベート80を含まない。しかし、ポリソルベート80は、IPV成分の産生の間に使用されたかもしれない。
【0049】
IPV抗原は、微量のネオマイシンおよび/またはポリミキシンを含み得る。
【0050】
IPV抗原の量は、典型的には「DU」単位(「D−抗原単位」[15])で表す。別々の株それぞれの抗原の量を、好ましくは、最終的なワクチンにおける1:2:3型のDU比が5:1:4になるように選択する。
【0051】
さらなる任意の抗原
本発明は、好ましくは3価のジフテリア−破傷風−百日咳ワクチンを調製するために、または4価のジフテリア−破傷風−百日咳−ポリオウイルスワクチンを調製するために使用する。しかし、ジフテリア、破傷風、百日咳およびIPV抗原に加えて、本発明のワクチンは、例えばB型肝炎ウイルス由来、Haemophilus influenzae
B由来、Streptococcus pneumoniae由来、Neisseria meningitidis、A型肝炎ウイルス、麻疹ウイルス、流行性耳下腺炎ウイルス、風疹ウイルス、ロタウイルス、インフルエンザウイルス等由来の、1つまたはそれ以上のさらなる抗原を含み得る。
【0052】
アジュバント
上記で記載したように、本発明の方法で使用する前に、抗原をアルミニウムアジュバントに吸着し得る(それらは「予め吸着している」)
現在使用されているアルミニウムアジュバントは、典型的には「水酸化アルミニウム」または「リン酸アルミニウム」アジュバントのいずれかと呼ばれる。しかし、どれも存在する実際の化合物の正確な説明ではないので、これらは便宜上の名前である(例えば参考文献16の9章を参照のこと)。本発明は、アジュバントとして一般的に使用される「水酸化物」または「リン酸塩」のいずれも使用し得る。
【0053】
「水酸化アルミニウム」として知られるアジュバントは、典型的にはアルミニウムオキシ水酸化物塩であり、それは通常少なくとも部分的に結晶性である。式AlO(OH)によって示し得るオキシ水酸化アルミニウムを、赤外(IR)分光法によって、特に1070cm−1における吸着バンドおよび3090−3100cm−1における強いショルダーによって、水酸化アルミニウムAl(OH)3のような、他のアルミニウム化合物から区別し得る[参考文献16の9章]。水酸化アルミニウムアジュバントの結晶性の程度は、半分の高さにおける回折バンドの幅(WHH)を反映し、結晶性の低い粒子は、より小さい結晶サイズのために、より大きな線の広がりを示す。WHHが増加するにつれて表面積が増加し、そしてより高いWHH値を有するアジュバントが、より高い抗原吸着能力を有するようであった。線維性の形態(例えば透過型電子顕微鏡写真において見られるような)は、水酸化アルミニウムアジュバントに典型的である。水酸化アルミニウムアジュバントのpIは、典型的には約11であり、すなわち、アジュバント自身が、生理学的pHにおいて陽性の表面電荷を有する。pH7.4におけるAl+++1mgあたり、1.8−2.6mgの間のタンパク質の吸着能力が、水酸化アルミニウムアジュバントに関して報告された。
【0054】
「リン酸アルミニウム」として知られるアジュバントは、典型的にはアルミニウムの水酸化リン酸塩であり、多くの場合少量の硫酸塩も含む。それらを沈殿によって得ることができ、そしてその反応条件および沈殿の間の濃度が、塩の水酸基に関するリン酸の置換の程度に影響を与える。水酸化リン酸塩は、一般的に0.3および0.99の間のPO4/Alモル比を有する。水酸化リン酸塩を、水酸基の存在によって、厳密なAlPO4から区別し得る。例えば、3164cm−1におけるIRスペクトルバンド(例えば200℃に加熱した場合)は、構造的な水酸基の存在を示す[参考文献16の9章]。
【0055】
リン酸アルミニウムアジュバントのPO4/Al3+モル比は、一般的に0.3および1.2の間であり、好ましくは0.8および1.2の間であり、そしてより好ましくは0.95±0.1である。リン酸アルミニウムは、特に水酸化リン酸塩に関して、一般的に非晶質である。典型的なアジュバントは、0.84および0.92の間のPO4/Alモル比を有する、非晶質の水酸化リン酸アルミニウムであり、0.6mgAl3+/mlで含まれる。リン酸アルミニウムは、一般的に粒子状である(例えば透過型電子顕微鏡写真で見られるような、プレート様の形態)。粒子の典型的な直径は、いかなる抗原吸着後も、0.5−20μmの範囲(例えば約5−10μm)である。pH7.4においてAl+++1mgあたり0.7−1.5mgのタンパク質の吸着能力が、リン酸アルミニウムアジュバントに関して報告された。
【0056】
リン酸アルミニウムの電荷ゼロ点(PZC)は、水酸基に関するリン酸の置換の程度と反比例し、そしてこの置換の程度は、沈殿による塩の調製に使用した反応条件および反応物の濃度に依存して変化し得る。PZCはまた、溶液中の遊離のリン酸イオンの濃度を変化させることによって(より多くのリン酸塩=より酸性のPZC)、またはヒスチジン緩衝液のような緩衝液を加えることによって(PZCをより塩基性にする)、変化する。本発明によって使用されるリン酸アルミニウムは、一般的に4.0および7.0の間の、より好ましくは5.0および6.5の間、例えば約5.7のPZCを有する。
【0057】
本発明のワクチンは、水酸化アルミニウムアジュバントを有し得る、またはそれらは組み合わせた水酸化アルミニウム/リン酸アルミニウムアジュバントを有し得る。水酸化物およびリン酸塩がどちらも存在する場合、それぞれによって提供されるAl3+含有量の比は、好ましくは3:2である(例えば水酸化アルミニウムから0.6mg/mlのAl3+、およびリン酸アルミニウムから0.4mg/mlのAl3+)。
【0058】
青年用ブースターワクチンのAl3+含有量は、最適な免疫のために重要であり得る[17]。本発明によって産生されるワクチンのアルミニウム含有量全体は(Al3+によって測定される)、好ましくは0.25mg/mlより多いが、好ましくは1.5mg/mlより少ない、例えばそれは約0.6mg/mlである。
【0059】
望ましい最終的なAl3+含有量を得るために、それらを組み合わせる前に、および/または別のバルクとして余分なアルミニウム塩を加えて、例えば第一のバルク、第二のバルク、および3番目のバルクを組み合わせる前に、適当なAl3+含有量のバルクを使用することが可能であり、ここで3番目のバルクはアルミニウムアジュバントを含む。
【0060】
本発明の方法によって産生されたワクチン
典型的な使用において、本発明の方法を使用して、包装、そして次いで流通および投与に適当なバルク混合ワクチンを提供する。上記で述べた濃度は、典型的には最終的な包装されたワクチンの濃度であり、そしてバルクワクチン中の濃度は、より高くあり得る(例えば希釈によって最終的な濃度に低減される)。
【0061】
従って、本発明の方法は、ワクチンを使用のための容器に包装する、さらなる工程を含み得る。容器は、ワクチンの単回用量を含み得る、またはそれらは1回以上の用量、例えば10回用量を含み得る(「複数回投与」容器)。複数回投与のバイアルを使用する場合、各用量を、バイアル内容物の汚染を避けるよう気をつけて、厳密な無菌条件下で、滅菌針およびシリンジで取らなければならない。単回投与容器が好ましい。複数の単回投与容器を、例えば10個の単回投与バイアルを、一緒に包装し得る。
【0062】
適当な容器は、バイアルおよび使い捨てシリンジを含む。これらは、好ましくは滅菌である。ワクチンが最終使用者による投与のためにすぐ使用できるように、シリンジに包装することが特に好ましい。シリンジは、付属の針と共に流通し得るが、針無しで流通することも可能である。
【0063】
シリンジを、はぎ取り式のラベルと共に提供し得、そこにロットナンバーおよび内容物の有効期限を印刷して(例えばバーコードとして)、記録の保存を促進し得る。シリンジは、その内容物の同定を促進するために、着色した(例えば緑色の)バンドを含み得る。シリンジのプランジャーは。好ましくは、吸引の間にプランジャーが誤ってはずれるのを防ぐために、ストッパーを有する。シリンジは、ラテックスゴムキャップおよび/またはプランジャーを有し得る。シリンジは一般的に、針を取り付ける前に先端を密封する先端キャップを有し、そしてその先端キャップは、好ましくはブチルゴムでできている。シリンジおよび針が別々に包装されている場合、針は好ましくはブチルゴムの遮蔽物にはまっている。灰色のブチルゴムが好ましい。シリンジは、針を守るためのロッキングメカニズム、例えばLuer−LokTMを組み込んだ先端を有し得る。適当なシリンジは、「Tip−Lok」TMまたはHypakTMPRTCの商品名で市販されているものである。
【0064】
ワクチンがバイアルに包装される場合、これらはプラスチック材料製、または好ましくはガラス製であり得る。そのバイアルは、好ましくは、ワクチンをそれに加える前に滅菌される。ラテックス感受性の患者による問題を避けるために、バイアルを、好ましくはラテックスを含まないストッパーで密封する。
【0065】
ワクチンを容器に入れた後、その容器を次いで、流通のための箱に、例えば厚紙の箱の中に封入し得る。箱に、ワクチンの詳細、例えば商品名、ワクチン中の抗原のリスト(例えば「破傷風トキソイド、低減された(reduced)ジフテリアトキソイド、および無細胞性百日咳ワクチン、吸着済」および/または「Tdap」)、提示する容器(例えば「使い捨て充填済みTip−Lokシリンジ」または「10×0.5ml単回投与バイアル」)、その用量(例えば「それぞれ単回0.5ml用量を含む」)、警告(例えば「青年用限定」)、有効期限、製造者の名称等を書いたラベルを貼る。箱はそれぞれ、1つ以上の包装されたワクチン、例えば5本のシリンジまたは10本のバイアルのような、5個または10個の包装されたワクチンを含み得る。視覚的効果のために、箱の1つの角の背景色は、箱の残りと異なる色、例えば緑色の箱の紫色の角であり得る。
【0066】
ワクチンを、ワクチンの詳細、例えば投与の説明書、ワクチン中の抗原の詳細等を含むリーフレットと一緒に(例えば同じ箱に)包装し得る。その説明書はまた、例えば、ワクチン接種後のアナフィラキシー反応の場合にアドレナリンの溶液をすぐ使えるようにしておくこと等の警告を含み得る。
【0067】
本発明の方法は、1ミリリットルあたり以下の内容物を有するワクチンを調製するために特に有用である。
【0068】
【表1】

バルクワクチンにおける個々の抗原の濃度、抗原のバルクワクチンへの添加の前に必要な希釈、およびバルクから最終的なワクチンへ必要なあらゆる希釈を、それに応じて計算し得、そして従って本発明の方法を、投与あたりこれらの濃度で抗原を含む、最終的な混合ワクチンを産生するために行い得る。
【0069】
最終的なワクチンは、好ましくは滅菌である。
【0070】
最終的なワクチンは、好ましくは非発熱性であり、例えばそれは投与あたり<1EU(内毒素単位;1EUは0.2ngのFDA基準標準内毒素EC−2「RSE」と同等である)、そして好ましくは投与あたり<0.1EUを含む。
【0071】
最終的なワクチンは、好ましくはグルテンを含まない。
【0072】
最終的なワクチンのpHは、好ましくは6および8の間、例えば6.5および7.5の間である。本発明の方法は、従って包装の前にバルクワクチンのpHを調整する方法を含み得る。
【0073】
包装されたワクチンは、好ましくは白濁懸濁液である。
【0074】
包装されたワクチンは、好ましくは2℃および8℃の間で保存される。それは凍結してはいけない。
【0075】
最終的なワクチン製品の浸透圧をコントロールするために、ナトリウム塩のような生理学的塩を含むことが好ましい。等張塩化ナトリウムのような、塩化ナトリウム(NaCl)が好ましい。通常9mg/mlの最終的なNaCl濃度が適当である。
【0076】
本発明の方法の間、保存剤、および特に水銀保存剤(例えばチメロサール)は使用しないことが好ましい。
【0077】
ワクチンの投与
本発明の方法によって産生された混合ワクチンを、好ましくは注射によって患者に投与する。筋肉内注射が好ましい(例えば上腕の三角筋に)。理想的には、注射の前に、注射部位の皮膚を、適当な消毒薬によって清潔にし、そして準備する。典型的な注射は、0.5mlの容量を有し、そして本発明の方法は、バルク混合ワクチンの0.5mlのサンプルを容器に抽出し、そして包装する工程を含み得る。ワクチンBOOSTRIXの投与のために典型的な針のサイズは、22−25ゲージの針、1および1.25インチの長さ(2.5から3.2cm)である。
【0078】
ワクチンがアルミニウム塩アジュバントを含む場合、投与の前に、均一な、白濁した懸濁液を得るために、激しく振とうしなければならない。
【0079】
理想的には、ワクチンを、ブースターワクチンとして、以前にジフテリアおよび破傷風の両方に対して、および好ましくは百日咳に対しても、ワクチン接種した患者に投与する。以前のワクチンに対する免疫記憶反応を有することによって、これらの患者を、一般的な集団から区別し得る。好ましい患者は、その最も最近のジフテリアおよび/または破傷風ワクチンを、本発明のワクチンを受ける少なくとも5年前に受けた。ワクチンを投与される好ましい患者は、従って4歳および65歳の間、例えば11−64歳、10−18歳等である。
【0080】
本発明によって産生されたワクチンを、他のワクチンと実質的に同時に、例えば髄膜炎菌結合ワクチン(4価血清型A−C−W135−Yワクチンのような)、および/または多価肺炎球菌結合ワクチン等と実質的に同時に、患者に投与し得る(例えば医療専門家またはワクチンセンターへの、同じ診察または訪問中に)。そのようなさらなるワクチンを、本発明のワクチンとは、別のシリンジで、および異なる注射部位に投与する。そのワクチンを、同様に、破傷風免疫グロブリンと実質的に同時に投与し得る。
【0081】
いかなる特定の抗原に関しても、ワクチン接種ガイドライン(例えばWHOガイドライン)が、最終的なワクチン中に存在すべき量を推奨または処方し得る。その情報(例えば投与あたり10μg)を、ワクチン用量(例えば0.5mlの用量)と組み合わせて、その抗原に関してバルクワクチン中で必要な濃度を計算し得る。
【0082】
本発明の方法は、0.5mlの用量あたり以下の内容物を有するワクチンを調製するのに特に有用である:
【0083】
【表2】

一般
「含む(comprising)」という用語は、「含む(including)」および「構成する」を含み、例えばXを「含む(comprising)」組成物は、独占的にXから成る、または何か他のもの、例えばX+Yを含み得る(include)。
【0084】
「実質的に」という用語は、「完全に」を除外せず、例えばYを「実質的に含まない」組成物は、完全にYを含まないであり得る。必要な場合、「実質的に」という用語は、本発明の定義から省略し得る。
【0085】
数字の値xに関連して「約」という用語は、例えばx±10%を意味する。
【0086】
ガラス容器を使用する場合、ホウケイ酸ガラスがソーダ石灰ガラスよりも好ましい。
【0087】
成分がアジュバントに「吸着した」と記載される場合、その抗原の少なくとも50%(重量によって)、例えば50%、60%、70%、80%、90%、95%、98%、またはそれ以上が吸着していることが好ましい。成分が完全に吸着している場合、遠心後の組成物の上清に何も検出されない。
したがって、本発明は以下の項目を提供する:
(項目1)
ワクチンを製造するための方法であって、該ワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、該方法は、(i)ジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクと(ii)破傷風トキソイドを含むが、ジフテリアトキソイドは含まない第二のバルクとを合わせる工程を包含する、方法。
(項目2)
上記ワクチンが、1つ以上の無細胞性百日咳抗原もまた含む、項目1に記載の方法。
(項目3)
上記ワクチンが、不活化百日咳毒素、線維状ヘマグルチニンおよびパータクチンを含む、項目2に記載の方法。
(項目4)
上記不活化百日咳毒素、上記線維状ヘマグルチニンおよび上記パータクチンが、8:8:3の比(重量で測定)で存在する、項目3に記載の方法。
(項目5)
上記ワクチンが、不活化ポリオウイルス(IPV)抗原もまた含む、項目1〜4のいずれか一項に記載の方法。
(項目6)
上記ワクチンが、ポリオウイルス1型株、ポリオウイルス2型株およびポリオウイルス3型株の各々由来のIPV抗原を含む、項目5に記載の方法。
(項目7)
上記IPV抗原が、5:1:4の1型:2型:3型の比(DUで測定)で存在する、項目6に記載の方法。
(項目8)
上記ワクチンが、1つ以上のアルミニウム塩アジュバントを含む、項目1〜7のいずれか一項に記載の方法。
(項目9)
上記ワクチンが、水酸化アルミニウムアジュバントを含む、項目8に記載の方法。
(項目10)
上記ワクチンが、リン酸アルミニウムアジュバントをさらに含む、項目9に記載の方法。
(項目11)
上記ワクチンが、リン酸アルミニウムアジュバントを含まない、項目10に記載の方法。
(項目12)
上記第一のバルク内の上記ジフテリアトキソイドおよび上記破傷風トキソイドが、水酸化アルミニウムアジュバントに吸着される、項目1〜11のいずれか一項に記載の方法。(項目13)
上記第一のバルクが、水銀保存剤を含まない、項目1〜12のいずれか一項に記載の方法。
(項目14)
上記第一のバルクが保存剤を含む、項目1〜13のいずれか一項に記載の方法。
(項目15)
上記第一のバルクが、1−ヒドロキシ−2−フェノキシエタンを含む、項目14に記載の方法。
(項目16)
上記第一のバルクが、約5g/lの1−ヒドロキシ−2−フェノキシエタンを含む、項目15に記載の方法。
(項目17)
上記第一のバルクが保存剤を含まない、項目1〜12のいずれか一項に記載の方法。
(項目18)
上記ジフテリアトキソイドおよび上記破傷風トキソイドが、約2.5:1のジフテリア:破傷風の比(Lf単位で測定)で存在する、項目1〜17のいずれか一項に記載の方法。
(項目19)
上記第一のバルクが、ジフテリアトキソイド100Lfあたり5mgと6mgとの間の塩化ナトリウムを含む、項目1〜18のいずれか一項に記載の方法。
(項目20)
上記第一のバルクが、ポリソルベート80を含まない、項目1〜19のいずれか一項に記載の方法。
(項目21)
上記第二のバルクが、アルミニウム塩を含まない、項目1〜20のいずれか一項に記載の方法。
(項目22)
上記第二のバルクが、水銀保存剤を含まない、項目1〜21のいずれか一項に記載の方法。
(項目23)
上記第二のバルクが、保存剤を含まない、項目1〜22のいずれか一項に記載の方法。(項目24)
上記第二のバルクが、ポリソルベート80を含まない、項目1〜23のいずれか一項に記載の方法。
(項目25)
上記ワクチンが、0.25mg/mlと1.5mg/mlとの間のAl3+含有量を有する、項目1〜24のいずれか一項に記載の方法。
(項目26)
上記ワクチンが、約0.6mg/mlのAl3+含有量を有する、項目25に記載の方法。
(項目27)
上記ワクチンを容器に包装する工程をさらに包含する、項目1〜26のいずれか一項に記載の方法。
(項目28)
上記容器がバイアルである、項目27に記載の方法。
(項目29)
上記容器がシリンジである、項目27に記載の方法。
(項目30)
上記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン、
を有する、項目2〜29のいずれか一項に記載の方法。
(項目31)
上記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン;80DUのMahoney株ポリオウイルス;16DuのMEF1株ポリオウイルス;および64DUのSaukett株ポリオウイルス、
を有する、項目5〜29のいずれか一項に記載の方法。
(項目32)
上記ワクチンが、1mlあたり1未満の内毒素単位を含む、項目1〜31のいずれか一項に記載の方法。
(項目33)
上記ワクチンが保存剤を含まない、項目1〜32のいずれか一項に記載の方法。
【図面の簡単な説明】
【0088】
【図1】図1は、吸着したジフテリアおよび破傷風トキソイドの混合バルクの調製を説明する。
【実施例】
【0089】
実施例1/青年用ブースターとして使用するためのD−T−aPワクチン
第一のバルク抗原成分を、図1に示すように調製した。それは以下の組成物を有する:
【0090】
【表3】

ジフテリアおよび破傷風トキソイドは両方とも、完全にアジュバントに吸着し、バルクのサンプルの遠心後、上清に何も検出できなかった。
【0091】
このバルクを使用して、例えば用量あたり25Lfのジフテリアトキソイドおよび10Lfの破傷風トキソイドを含む、小児用D−T−aPワクチンを調製し得る。しかし、(Lf単位で測定して)ジフテリアトキソイドよりも多くの破傷風トキソイドを必要とする青年用ブースター投与に関しては、このバルクを使用することはできない。2.5Lfの望ましい最終的なジフテリアトキソイド用量にバルクを希釈すれば、希釈された破傷風トキソイド用量はわずかに1Lfであり、それは望ましい用量の5分の1である。希釈されたAl3+用量(<0.1mg)も、参考文献17で報告された最低有効用量よりも低い。従って、ジフテリア:破傷風の比およびAl3+用量を修正しなければならない。
【0092】
ジフテリア:破傷風の比の調整を可能にするために、濃縮破傷風トキソイド(3000Lf/mlおよび3000Lf/mlの間;8mg/mlおよび9mg/mlの間の塩化ナトリウム;7.0および7.8の間のpH)を含む、第二のバルクを調製した。第二のバルクは他の抗原、アジュバント、および保存剤を含まない。
【0093】
これら2つの抗原バルクを、さらなるアルミニウムアジュバント(水酸化物およびリン酸塩)、水酸化アルミニウムアジュバントに吸着した無細胞性百日咳抗原、および塩化ナトリウムを含むバルクと共に組み合わせ、そして希釈して、最終的な望ましい濃度および成分の比を有するバルク混合ワクチンを得る。この手順を使用して、1mlあたり以下の組成物を含むバルクを調製し得る:
【0094】
【表4】

このバルクを、Tip−LokTMシリンジに、0.5mlの用量で包装する。このワクチンを、以前にD−T−Pワクチンを投与された青年におけるブースターとして使用し得る。
【0095】
従って、第一のバルクを、小児用および青年用D−T−Pワクチン両方の基礎として使用し得る。
【0096】
実施例2/保存剤を含まない、低減されたアルミニウムD−T−aPワクチン
実施例1で調製したワクチンの保存剤を排除するために、異なる第一のバルクを使用する。混合工程の間に1−ヒドロキシ−2−フェノキシエタンを加えない。
【0097】
アルミニウム含有量を低減するために、リン酸アルミニウムアジュバントを加えない。
【0098】
包装後、保存剤を含まない0.5mlの用量はそれぞれ以下の組成物を有する:
【0099】
【表5】

実施例3/D−T−aP−IPVワクチン
4価のD−T−aP−IPVワクチンを作成するために、IPVと混合したバルクを、実施例1の方法に加えて、0.5mlの用量あたり以下の内容物を有する最終的なワクチンを得る:
【0100】
【表6】

本発明が例としてのみ記載され、そして本発明の範囲および意図のうちに留まりながら改変を行い得ることが理解される。
【0101】
参考文献(これらの内容は、参考として本明細書に援用される)
【0102】
【化1】

【特許請求の範囲】
【請求項1】
ワクチンを製造するための方法であって、該ワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、該方法は、(i)2:1と3:1との間のジフテリア:破傷風の比(Lf単位で測定)でジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクと(ii)破傷風トキソイドを含むが、ジフテリアトキソイドは含まない第二のバルクとを合わせる工程を包含する、方法。
【請求項2】
前記ワクチンが、1つ以上の無細胞性百日咳抗原もまた含む、請求項1に記載の方法。
【請求項3】
前記ワクチンが、不活化百日咳毒素、線維状ヘマグルチニンおよびパータクチンを含む、請求項2に記載の方法。
【請求項4】
前記不活化百日咳毒素、前記線維状ヘマグルチニンおよび前記パータクチンが、8:8:3の比(重量で測定)で存在する、請求項3に記載の方法。
【請求項5】
前記ワクチンが、不活化ポリオウイルス(IPV)抗原もまた含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記ワクチンが、ポリオウイルス1型株、ポリオウイルス2型株およびポリオウイルス3型株の各々由来のIPV抗原を含む、請求項5に記載の方法。
【請求項7】
前記IPV抗原が、5:1:4の1型:2型:3型の比(DUで測定)で存在する、請求項6に記載の方法。
【請求項8】
前記ワクチンが、1つ以上のアルミニウム塩アジュバントを含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記ワクチンが、水酸化アルミニウムアジュバントを含む、請求項8に記載の方法。
【請求項10】
前記ワクチンが、リン酸アルミニウムアジュバントをさらに含む、請求項9に記載の方法。
【請求項11】
前記ワクチンが、リン酸アルミニウムアジュバントを含まない、請求項10に記載の方法。
【請求項12】
前記第一のバルク内の前記ジフテリアトキソイドおよび前記破傷風トキソイドが、水酸化アルミニウムアジュバントに吸着される、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
前記第一のバルクが、水銀保存剤を含まない、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
前記第一のバルクが保存剤を含む、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
前記第一のバルクが、1−ヒドロキシ−2−フェノキシエタンを含む、請求項14に記載の方法。
【請求項16】
前記第一のバルクが、約5g/lの1−ヒドロキシ−2−フェノキシエタンを含む、請求項15に記載の方法。
【請求項17】
前記第一のバルクが保存剤を含まない、請求項1〜12のいずれか一項に記載の方法。
【請求項18】
前記ジフテリアトキソイドおよび前記破傷風トキソイドが、約2.5:1のジフテリア:破傷風の比(Lf単位で測定)で存在する、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
前記第一のバルクが、ジフテリアトキソイド100Lfあたり5mgと6mgとの間の塩化ナトリウムを含む、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
前記第一のバルクが、ポリソルベート80を含まない、請求項1〜19のいずれか一項に記載の方法。
【請求項21】
前記第二のバルクが、アルミニウム塩を含まない、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
前記第二のバルクが、水銀保存剤を含まない、請求項1〜21のいずれか一項に記載の方法。
【請求項23】
前記第二のバルクが、保存剤を含まない、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記第二のバルクが、ポリソルベート80を含まない、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記ワクチンが、0.25mg/mlと1.5mg/mlとの間のAl3+含有量を有する、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
前記ワクチンが、約0.6mg/mlのAl3+含有量を有する、請求項25に記載の方法。
【請求項27】
前記ワクチンを容器に包装する工程をさらに包含する、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記容器がバイアルである、請求項27に記載の方法。
【請求項29】
前記容器がシリンジである、請求項27に記載の方法。
【請求項30】
前記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン、
を有する、請求項2〜29のいずれか一項に記載の方法。
【請求項31】
前記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン;80DUのMahoney株ポリオウイルス;16DuのMEF1株ポリオウイルス;および64DUのSaukett株ポリオウイルス、
を有する、請求項5〜29のいずれか一項に記載の方法。
【請求項32】
前記ワクチンが、1mlあたり1未満の内毒素単位を含む、請求項1〜31のいずれか一項に記載の方法。
【請求項33】
前記ワクチンが保存剤を含まない、請求項1〜32のいずれか一項に記載の方法。
【請求項1】
ワクチンを製造するための方法であって、該ワクチンは、ジフテリアトキソイドおよび破傷風トキソイドを含み、該方法は、(i)2:1と3:1との間のジフテリア:破傷風の比(Lf単位で測定)でジフテリアトキソイドおよび破傷風トキソイドを含む第一のバルクと(ii)破傷風トキソイドを含むが、ジフテリアトキソイドは含まない第二のバルクとを合わせる工程を包含する、方法。
【請求項2】
前記ワクチンが、1つ以上の無細胞性百日咳抗原もまた含む、請求項1に記載の方法。
【請求項3】
前記ワクチンが、不活化百日咳毒素、線維状ヘマグルチニンおよびパータクチンを含む、請求項2に記載の方法。
【請求項4】
前記不活化百日咳毒素、前記線維状ヘマグルチニンおよび前記パータクチンが、8:8:3の比(重量で測定)で存在する、請求項3に記載の方法。
【請求項5】
前記ワクチンが、不活化ポリオウイルス(IPV)抗原もまた含む、請求項1〜4のいずれか一項に記載の方法。
【請求項6】
前記ワクチンが、ポリオウイルス1型株、ポリオウイルス2型株およびポリオウイルス3型株の各々由来のIPV抗原を含む、請求項5に記載の方法。
【請求項7】
前記IPV抗原が、5:1:4の1型:2型:3型の比(DUで測定)で存在する、請求項6に記載の方法。
【請求項8】
前記ワクチンが、1つ以上のアルミニウム塩アジュバントを含む、請求項1〜7のいずれか一項に記載の方法。
【請求項9】
前記ワクチンが、水酸化アルミニウムアジュバントを含む、請求項8に記載の方法。
【請求項10】
前記ワクチンが、リン酸アルミニウムアジュバントをさらに含む、請求項9に記載の方法。
【請求項11】
前記ワクチンが、リン酸アルミニウムアジュバントを含まない、請求項10に記載の方法。
【請求項12】
前記第一のバルク内の前記ジフテリアトキソイドおよび前記破傷風トキソイドが、水酸化アルミニウムアジュバントに吸着される、請求項1〜11のいずれか一項に記載の方法。
【請求項13】
前記第一のバルクが、水銀保存剤を含まない、請求項1〜12のいずれか一項に記載の方法。
【請求項14】
前記第一のバルクが保存剤を含む、請求項1〜13のいずれか一項に記載の方法。
【請求項15】
前記第一のバルクが、1−ヒドロキシ−2−フェノキシエタンを含む、請求項14に記載の方法。
【請求項16】
前記第一のバルクが、約5g/lの1−ヒドロキシ−2−フェノキシエタンを含む、請求項15に記載の方法。
【請求項17】
前記第一のバルクが保存剤を含まない、請求項1〜12のいずれか一項に記載の方法。
【請求項18】
前記ジフテリアトキソイドおよび前記破傷風トキソイドが、約2.5:1のジフテリア:破傷風の比(Lf単位で測定)で存在する、請求項1〜17のいずれか一項に記載の方法。
【請求項19】
前記第一のバルクが、ジフテリアトキソイド100Lfあたり5mgと6mgとの間の塩化ナトリウムを含む、請求項1〜18のいずれか一項に記載の方法。
【請求項20】
前記第一のバルクが、ポリソルベート80を含まない、請求項1〜19のいずれか一項に記載の方法。
【請求項21】
前記第二のバルクが、アルミニウム塩を含まない、請求項1〜20のいずれか一項に記載の方法。
【請求項22】
前記第二のバルクが、水銀保存剤を含まない、請求項1〜21のいずれか一項に記載の方法。
【請求項23】
前記第二のバルクが、保存剤を含まない、請求項1〜22のいずれか一項に記載の方法。
【請求項24】
前記第二のバルクが、ポリソルベート80を含まない、請求項1〜23のいずれか一項に記載の方法。
【請求項25】
前記ワクチンが、0.25mg/mlと1.5mg/mlとの間のAl3+含有量を有する、請求項1〜24のいずれか一項に記載の方法。
【請求項26】
前記ワクチンが、約0.6mg/mlのAl3+含有量を有する、請求項25に記載の方法。
【請求項27】
前記ワクチンを容器に包装する工程をさらに包含する、請求項1〜26のいずれか一項に記載の方法。
【請求項28】
前記容器がバイアルである、請求項27に記載の方法。
【請求項29】
前記容器がシリンジである、請求項27に記載の方法。
【請求項30】
前記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン、
を有する、請求項2〜29のいずれか一項に記載の方法。
【請求項31】
前記ワクチンが、1ミリリットルあたり、以下の含有量:
5Lfのジフテリアトキソイド;10Lfの破傷風トキソイド;16μgの不活化百日咳毒素;16μgの線維状ヘマグルチニン;5μgのパータクチン;80DUのMahoney株ポリオウイルス;16DuのMEF1株ポリオウイルス;および64DUのSaukett株ポリオウイルス、
を有する、請求項5〜29のいずれか一項に記載の方法。
【請求項32】
前記ワクチンが、1mlあたり1未満の内毒素単位を含む、請求項1〜31のいずれか一項に記載の方法。
【請求項33】
前記ワクチンが保存剤を含まない、請求項1〜32のいずれか一項に記載の方法。
【図1】




【公開番号】特開2012−236864(P2012−236864A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2012−200460(P2012−200460)
【出願日】平成24年9月12日(2012.9.12)
【分割の表示】特願2009−524255(P2009−524255)の分割
【原出願日】平成19年8月15日(2007.8.15)
【出願人】(504389991)ノバルティス アーゲー (806)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成24年9月12日(2012.9.12)
【分割の表示】特願2009−524255(P2009−524255)の分割
【原出願日】平成19年8月15日(2007.8.15)
【出願人】(504389991)ノバルティス アーゲー (806)
【Fターム(参考)】
[ Back to top ]

