低温至適プロテアーゼ及びこれをコードする遺伝子
【課題】低温条件下においても高い活性を保持する低温至適プロテアーゼ、これをコードする遺伝子及びこれを生産する形質転換体を提供する。
【解決手段】配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ。
以下の(a)、(b)又は(c)のDNAからなる低温至適プロテアーゼをコードする遺伝子。
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA
【解決手段】配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ。
以下の(a)、(b)又は(c)のDNAからなる低温至適プロテアーゼをコードする遺伝子。
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、低温至適プロテアーゼ及びこれをコードする遺伝子に関する。
【背景技術】
【0002】
プロテアーゼは、ペプチド結合の加水分解を触媒する酵素群の総称で、微生物、動物及び植物中に広く存在が知られている。その応用分野としては、衣料用洗浄剤、自動食器洗浄機用洗浄剤、コンタクトレンズ用洗浄剤、浴用剤、角質除去用化粧料、食品の改質剤(製パン、肉の軟化、水産加工など)、ビールの清澄剤、皮革なめし剤、写真フィルムのゼラチン除去剤、消化助剤又は消炎剤などがあり、多くの分野で盛んに利用されている。
【0003】
その中で最も大量に工業生産され、市場規模が大きいのは洗浄剤用プロテアーゼであり、例えばアルカラーゼ、サビナーゼ(ノボ・ノルディスク社製)、マクサカル(ギスト・ブロケイデス社製)、API−21(昭和電工社製)、ブラップ(ヘンケル社製)及びプロテアーゼK(KAP;花王社製)などが知られている。
【0004】
しかしながら、これらの大半は酵素が活性を最も発揮する温度、つまり至適温度が50〜80℃である(高温至適プロテアーゼ)ため、例えば、水道水をそのまま用いて低温領域(例えば25℃)で衣料等の洗浄を行う場合には、その酵素特性が充分に発揮されているとは言いがたい。また、前述の高温至適プロテアーゼは、その応用分野のほとんどにおいて、低温条件下(25〜50℃)で使用されており、酵素特性が十分に得られていない。しかしながら、高温至適プロテアーゼを用いて高温処理工程を行うことは、省エネルギーの観点からも好ましいとは言えない。
近年、洗浄剤をはじめとして、プロテアーゼの商品への配合や工業的プロセスなどにおける利用が考えられているが、この場合、25〜50℃の温度で有効に作用する酵素を見出すことは、省エネルギー化に加えて酵素の機能を十分発揮させるうえで、必須の条件である。したがって、低温でも十分な酵素特性が得られる低温至適プロテアーゼの開発が望まれている。特に、低温至適プロテアーゼは、反応系に熱を加えられないようなケース、すなわちチーズの熟成や肉の軟化等による食品の改質に有効であり、熱望されている。
【0005】
これまでに、寒冷地土壌等の寒冷環境に棲息する生物、海水あるいは冷蔵中のミルク等から分離されたプロテアーゼ生産菌及び生産されるプロテアーゼに関しては数多くの報告例がある。すなわち、シュードモナスエスピー(Pseudomonas sp.)No.548株(非特許文献1)、エシェリヒア フロインディ(Eschreichia freundii)(非特許文献2)、キサントモナスマルトフィラ(Xanthomonas maltophila)047/08株(非特許文献3)、シュードモナス フルオレセンス(Pseudomonas fluorescens)T16が(非特許文献4)、シュードモナス フルオレセンス(Pseudomonas fluorescens)AFT36株(非特許文献5)、シュードモナス エスピー(Pseudomonas sp.)145−2株(非特許文献6)、アエロモナス サルモニシダ(Aeromonas salmonicida)(非特許文献7)、シュードモナス パウシモビリス(Pseudomonas paucinomobilis),バチルス エスピー(Bacillus sp.)(非特許文献8)、ビブリオ エスピー(Vibrio sp.)SA 1株(非特許文献9)、シュードモナス フルオレセンス(Pseudomonas fluorescens)NCDO 2085株(非特許文献10)、シュードモナス フルオレセンス(Pseudomonas fluorescens)(非特許文献11)、シュードモナス フルオレセンス(Pseudomonas fluorescens)GR83株(非特許文献12)、ペシロミセス マルクアンディ(Paecilomyces marquandii)(特許文献2)及びキサントモナス エスピー(Xanthomonas sp.)S−1(特許文献3)などの低温で生育できる微生物が種々のプロテアーゼを生産する。また、好冷細菌(psychrotrophic bacterium)が生産するプロテアーゼに関しては、Fairbainらが要領よく総説にまとめている(非特許文献13)。しかしこれらのプロテアーゼについても、低温域における作用は、必ずしも満足できるものではない。また、プロテアーゼの安定性や界面活性剤耐性、低い自己分解特性など様々なニーズに対応できるように、今まで知られている微生物以外の新しい微生物からのプロテアーゼも望まれている。
【0006】
ところで、近年塩基配列決定技術の進展に伴って多種多様な生物のゲノムDNAの塩基配列が決定され、生物情報科学的な観点から遺伝子の配列や機能も予測されている。しかし、その遺伝子がコードするタンパク質の機能が実際に予測に一致しない例が多い。そのため、実際に生化学的解析をしなければ正確な機能が特定できないのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第2882652号
【特許文献2】国際公開第88/03948号
【特許文献3】特開平5−211868号
【非特許文献】
【0008】
【非特許文献1】Agric.Biol.Chem.,36巻,1185頁,1970年
【非特許文献2】Eur.J.Biochem.,44巻,87頁,1974年
【非特許文献3】FEMS Microbiol.Lett.,79巻,257頁,1991年
【非特許文献4】Appl.Environ.Microbiol.,46巻,333頁,1983年
【非特許文献5】Biochim.Biophys.Acta,717巻,376頁,1982年
【非特許文献6】Microbios.,36巻,7頁,1982年
【非特許文献7】J.Appl.Bacteriol.,53巻,289頁,1983年
【非特許文献8】J.Basic Microbiol.,31巻,377頁,1991年
【非特許文献9】Antonie van Leeuwenhoek,44巻,157頁,1978年
【非特許文献10】J.Dairy Res.,53巻,457頁,1986年
【非特許文献11】J.Dairy Res.,53巻,97頁,1986年
【非特許文献12】Lebensm.−Wiss.u.−Technol.,23巻,106頁,1990年
【非特許文献13】J.Dairy Res.,53巻,139頁,1986年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、低温(25〜50℃)において、高い活性を有する低温至適プロテアーゼ及びこれをコードする遺伝子を提供することにある。
【課題を解決するための手段】
【0010】
そこで本発明者らは、上記の目的を達成するべく検討を行った結果、本発明を完成するに至った。
すなわち、本発明は、配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ;以下の(a)、(b)又は(c)のDNAからなる請求項1又は2に記載の低温至適プロテアーゼをコードする遺伝子
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA;当該遺伝子がコードする低温至適プロテアーゼ活性を有するタンパク質;当該遺伝子を含有する組換えベクター;当該組換えベクターを有する形質転換体;当該低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤を提供するものである。
【発明の効果】
【0011】
本発明の低温至適プロテアーゼは、低温領域(25〜50℃)に酵素反応至適温度を有する。
また、本発明の遺伝子を微生物等の宿主に形質転換することにより、低温至適プロテアーゼを発現する株を得ることができる。
【図面の簡単な説明】
【0012】
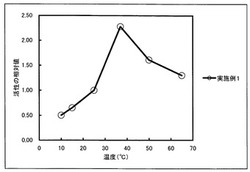
【図1】本発明の低温至適プロテアーゼ(実施例1)について、10〜65℃におけるプロテアーゼ活性を測定し、各々の温度での測定値を25℃での測定値を1とした場合の相対値とし、活性の温度依存性を表したグラフである。
【図2】市販のプロテアーゼ(比較例1)について、10〜65℃におけるプロテアーゼ活性を測定し、各々の温度での測定値を25℃での測定値を1とした場合の相対値とし、活性の温度依存性を表したグラフである。
【発明を実施するための形態】
【0013】
本発明において低温至適プロテアーゼとは、25〜50℃の範囲内に酵素の反応至適温度を有する低温至適プロテアーゼである。
本発明において、酵素の反応至適温度とは、酵素活性が最も高い温度である。
【0014】
本発明において、配列番号1のアミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼとは、依然として低温至適プロテアーゼの活性を保持するアミノ酸配列であり、配列番号1のアミノ酸配列と等価であるアミノ酸配列を意味する。
欠失、置換及び/又は付加されたアミノ酸の個数は、低温至適プロテアーゼ活性を保持する観点から、1〜10個が好ましく、さらに好ましくは1〜5個である。
依然として低温至適プロテアーゼの活性を保持するとは、25〜50℃の範囲内に酵素の反応至適温度を有することを意味する。
【0015】
本発明において、付加には、両末端への1若しくは数個のアミノ酸の付加が含まれ、例えば、酵素精製のためのタグ配列を付加したものが含まれる。
【0016】
本発明において、低温至適プロテアーゼの活性は、一般的なプロテアーゼ活性測定法によって測定され、例えば、アゾカゼインを用いた活性の測定法が挙げられる。
アゾカゼインを用いた活性の測定方法とは、アゾカゼインを基質として用いて反応させた後、未反応のアゾカゼインを沈殿させ、可溶性画分に存在するアゾカゼインの量を吸光度により測定することでプロテアーゼ活性を測定する方法である。
【0017】
本発明の低温至適プロテアーゼは、配列番号1に示すアミノ酸配列からなるプロテアーゼ又は当該アミノ酸配列と等価のアミノ酸配列からなるプロテアーゼをコードする遺伝子を微生物等の宿主に導入し、宿主を培養液中で培養し、培養液中からプロテアーゼを採取及び精製することによって生産することができる。
【0018】
なお、当該等価のアミノ酸配列からなるプロテアーゼをコードする遺伝子は、自然界等から得ることも可能ではあるが、更に部位特異的突然変異誘発法等の公知の手法を利用して調製することもできる。
【0019】
本発明の低温至適プロテアーゼは、低温(25℃〜50℃)での活性が高いので、衣料用洗浄剤をはじめ、食品改質剤(チーズの熟成や肉の軟化等)等の各種産業用の酵素として有用である。
【0020】
本発明の遺伝子は、以下の(a)、(b)又は(c)のDNAからなり、上記低温至適プロテアーゼをコードする遺伝子である。
(a)塩基配列が配列番号2からなるDNA。
(b)配列番号2に示す塩基配列のうち1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA。
【0021】
本発明の遺伝子は、塩基配列が配列番号2からなるDNA、該塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列を有するDNA又は該塩基配列からなるDNAにストリンジェントな条件下でハイブリダイズする低温至適プロテアーゼ前駆体をコードするDNAを含有する、低温至適プロテアーゼをコードする遺伝子である。尚、配列番号2に示す塩基配列は、本発明の低温至適プロテアーゼのプレプロ領域並びに成熟タンパク質を含む前駆体をコードするものである。
【0022】
本発明において、「ストリンジェントな条件下」とは、例えばMolecular cloning−a Laboratory manual 2nd edition(Sambrookら、1989)に記載の条件等が挙げられる。例えば、6×SSC(1×SSCの組成:0.15M 塩化ナトリウム、0.015M クエン酸ナトリウム、pH7.0)、0.5% SDS、5Xデンハート及び100mg/mLニシン精子DNAを含む溶液にプローブとともに65℃で8〜16時間恒温し、ハイブリダイズさせる条件が挙げられる。
【0023】
本発明に記載の遺伝子をクローニングする方法は、例えばMolecular cloning−a Laboratory manual 2nd edition(Sambrookら、1989)に記載の方法等が挙げられる。
【0024】
本発明の低温至適プロテアーゼは、本発明の遺伝子を、例えばカンジエラ属に属する微生物、例えばKangiella koreensis DSM 16069株(独立行政法人理化学研究所バイオリソースセンターから入手できる)等から、ショットガン法、PCR法を用いてクローニングし、適当なベクターと宿主菌を用いて大量に生産することができる。
【0025】
本発明の遺伝子を用いて低温至適プロテアーゼを生産する方法は、目的とする宿主内で遺伝子を発現するのに適した任意のベクターに、本発明の遺伝子を組込み、該組換えベクターを用いて宿主を形質転換し、組み換えベクターを含む形質転換体を得る。得られた形質転換体を培養し、当該培養液から低温至適プロテアーゼを採取すればよい。
【0026】
本発明の組換えベクターは、本発明の遺伝子を含有すれば特に限定されず、適当なベクターに本発明の遺伝子を挿入することによって得ることができる。
ベクターは種々のものが公知であり、市販品も多く存在する。当業者であれば、宿主の種類に応じて適切なベクターを容易に選択することができる。ベクターの具体例としては、pETシリーズ、pUCシリーズなどが挙げられる。
組換えベクターの調製方法自体は周知の常法である。適当なベクターに本発明の遺伝子を挿入し、宿主を形質転換する具体的な方法としては、エレクトロポレーション法、カルシウム法等が挙げられる。
【0027】
本発明において、宿主としては、動物細胞、昆虫細胞、微生物及び植物細胞等が挙げられる。
動物細胞としては、特に限定されないが、サル細胞COS−7、Vero、マウスL細胞、ラットGH3、ヒトFL細胞及びCHO細胞等が挙げられる。
昆虫細胞としては、特に限定されないが、Sf9細胞及びSf21細胞等が挙げられる。
微生物としては、特に限定されないが、細菌及び酵母等が挙げられる。
細菌としては、真正細菌及び古細菌が含まれる。
真正細菌には、グラム陰性菌及びグラム陽性菌が含まれる。グラム陰性細菌としては、エシェリチア属菌(Escherichia)、サーマス属菌(Thermus)、リゾビウム属菌(Rhizobium)、シュードモナス属菌(Pseudomonas)、シュワネラ属菌(Shewanella)、ビブリオ属菌(Vibrio)、サルモネラ属菌(Salmonella)、アセトバクター属(Acetobacter属)、シネコシスティス属(Synechocystis属)等が挙げられる。グラム陽性菌としては、バチルス属(Bacillus属)、ストレプトマイセス属(Streptmyces属)、コリネバクテリウム属(Corynebacterium属)、ブレビバチルス属(Brevibacillus属)、ビフィドバクテリウム属 (Bifidobacterium属)、ラクトコッカス属 (Lactococcus属)、エンテロコッカス属 (Enterococcus属)、ペディオコッカス属(Pediococcus属)、リューコノストック属 (Leuconostoc属)、ストレプトマイセス属(Streptomyces属)等が挙げられる。
植物細胞としては、特に限定されないが、BY−2細胞等が挙げられる。
【0028】
本発明において、宿主としては、クローニングの容易さの観点から、微生物が好ましく、さらに好ましくはエシェリチア属菌(Escherichia)、サーマス属菌(Thermus)、リゾビウム属菌(Rhizobium)、シュードモナス属菌(Pseudomonas)、シュワネラ属菌(Shewanella)、ビブリオ属菌(Vibrio)、サルモネラ属菌(Salmonella)、アセトバクター属(Acetobacter属)、シネコシスティス属(Synechocystis属)であり、特に好ましくはエシェリチア属菌(Escherichia)、シュワネラ属菌(Shewanella)、バチルス属(Bacillus属)、ブレビバチルス属(Brevibacillus属)である。
【0029】
培養は微生物の資化可能な炭素源、窒素源その他の必須栄養素を含む培地に接種し、常法に従って行えばよい。
【0030】
本発明において、培養液から低温至適プロテアーゼを採取及び精製する方法としては、常法に準じて行うことができる。例えば、培養物から遠心分離又は濾過することで菌体を除き、得られた培養上清液から常法手段により目的酵素を濃縮することができる。このようにして得られた酵素液又は乾燥粉末はそのまま用いることもできるが更に公知の方法により結晶化や造粒化することができる。
【0031】
本発明の洗浄剤組成物は、上記低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤組成物である。上記低温至適プロテアーゼを用いることにより、低温(25〜50℃)での洗浄性が優れた洗浄剤を得ることができる。
【0032】
洗浄剤組成物中の低温至適プロテアーゼの含有量は、洗浄性の観点から洗浄剤組成物の重量に対し、0.00001〜10重量%が好ましく、さらに好ましくは0.0001〜1重量%、特に好ましくは0.0002〜0.1重量%である。この範囲で含有することで、効率よく洗浄性を向上することができる。
【0033】
界面活性剤(A)は非イオン性界面活性剤(A−1)、アニオン性界面活性剤(A−2)、カチオン性界面活性剤(A−3)及び両性界面活性剤(A−4)が挙げられる。
【0034】
非イオン性界面活性剤(A−1)としては、アルキレンオキサイド付加型非イオン性界面活性剤(A−1−1)及び多価アルコール型非イオン性界面活性剤(A−1−2)等が挙げられる。
【0035】
(A−1−1)としては、高級アルコール(炭素数8〜18)アルキレン(炭素数2〜4、好ましいのは2)オキサイド付加物(活性水素1個当たりの付加モル数1〜30)、アルキル(炭素数1〜12)フェノールエチレンオキサイド(以下、EOと略記)付加物(付加モル数1〜30)、高級アミン(炭素数8〜22)アルキレン(炭素数2〜4、好ましいのは2)オキサイド付加物(活性水素1個当たりの付加モル数1〜40)、脂肪酸(炭素数8〜18)EO付加物(活性水素1個当たりの付加モル数1〜60)、ポリプロピレングリコール(分子量200〜4000)EO付加物(活性水素1個当たりの付加モル数1〜50)、ポリオキシエチレン(繰り返し単位数3〜30)アルキル(炭素数6〜20)アリルエーテル並びにソルビタンモノラウレートEO付加物(活性水素1個あたりの付加モル数1〜30)及びソルビタンモノオレートEO付加物(活性水素1個あたりの付加モル数1〜30)等の多価(2〜8価又はそれ以上)アルコール(炭素数2〜30)の脂肪酸(炭素数8〜24)エステルEO付加物(活性水素1個あたりの付加モル数1〜30)等が挙げられる。
【0036】
(A−1−2)としては、グリセリンモノステアレート、グリセリンモノオレート、ソルビタンモノラウレート及びソルビタンモノオレート等の多価(2〜8価又はそれ以上)アルコール(炭素数2〜30)の脂肪酸(炭素数8〜24)エステル並びにラウリン酸モノエタノールアミド及びラウリン酸ジエタノールアミド等の脂肪酸アルカノールアミド等が挙げられる。
【0037】
アニオン性界面活性剤(A−2)としては、炭素数8〜24のアルキルエーテルカルボン酸又はその塩及び炭素数8〜24のアルキル(ポリ)オキシエチレンエーテルカルボン酸又はその塩[(ポリ)オキシエチレン(重合度=1〜100)ラウリルエーテル酢酸ナトリウム及び(ポリ)オキシエチレン(重合度=1〜100)ラウリルスルホコハク酸2ナトリウム等]、炭素数8〜24のアルキル硫酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレン硫酸エステル塩[ラウリル硫酸ナトリウム、ラウリル(ポリ)オキシエチレン(重合度=1〜100)硫酸ナトリウム及びラウリル(ポリ)オキシエチレン(重合度=1〜100)硫酸−トリエタノールアミン塩等]、ヤシ油脂肪酸モノエタノールアミド硫酸スルホン酸ナトリウム、炭素数8〜24のアルキルフェニルスルホン酸塩[ドデシルベンゼンスルホン酸ナトリウム等]、炭素数8〜24のアルキルリン酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレンリン酸エステル塩[ラウリルリン酸ナトリウム及び(ポリ)オキシエチレン(重合度=1〜100)ラウリルエーテルリン酸ナトリウム等]、脂肪酸塩[ラウリン酸ナトリウム及びラウリン酸トリエタノールアミン等]、アシル化アミノ酸塩[ヤシ油脂肪酸メチルタウリンナトリウム、ヤシ油脂肪酸ザルコシンナトリウム、ヤシ油脂肪酸ザルコシントリエタノールアミン、N−ヤシ油脂肪酸アシル−L−グルタミン酸トリエタノールアミン、N−ヤシ油脂肪酸アシル−L−グルタミン酸ナトリウム及びラウロイルメチル−β−アラニンナトリウム等]が挙げられる。
【0038】
カチオン性界面活性剤(A−3)としては、第4級アンモニウム塩型[塩化ステアリルトリメチルアンモニウム、塩化ベヘニルトリメチルアンモニウム、塩化ジステアリルジメチルアンモニウム及びエチル硫酸ラノリン脂肪酸アミノプロピルエチルジメチルアンモニウム等]及びアミン塩型[ステアリン酸ジエチルアミノエチルアミド乳酸塩、ジラウリルアミン塩酸塩及びオレイルアミン乳酸塩等]等が挙げられる。
【0039】
両性界面活性剤(A−4)としては、ベタイン型両性界面活性剤[ヤシ油脂肪酸アミドプロピルジメチルアミノ酢酸ベタイン、ラウリルジメチルアミノ酢酸ベタイン、2−アルキル−N−カルボキシメチル−N−ヒドロキシエチルイミダゾリニウムベタイン、ラウリルヒドロキシスルホベタイン及びラウロイルアミドエチルヒドロキシエチルカルボキシメチルベタインヒドロキシプロピルリン酸ナトリウム等]、アミノ酸型両性界面活性剤[β−ラウリルアミノプロピオン酸ナトリウム等]が挙げられる。
【0040】
(A)としては、1種又は2種以上が使用出来る。2種以上を使用する場合、その組み合わせとしては、例えばノニオン性界面活性剤とアニオン性界面活性剤、ノニオン性界面活性剤とカチオン性界面活性剤及びノニオン性界面活性剤と両性界面活性剤の組み合わせ等が挙げられる。
【0041】
(A)として、洗浄性の観点から、ノニオン性界面活性剤単独での使用、及びノニオン性界面活性剤とアニオン性界面活性剤との組み合わせでの使用が好ましい。
ノニオン性界面活性剤としては、洗浄性の観点から、脂肪族アルコール(炭素数8〜24)EO付加物(重合度=1〜100)が好ましく、さらに好ましくは脂肪族アルコール(炭素数12〜18)EO付加物(重合度4〜20)、次にさらに好ましくは脂肪族アルコール(炭素数12〜15)EO付加物(重合度=8〜12)、特に好ましくはオレイルアルコールEO11モル付加物である。
アニオン性界面活性剤としては、洗浄性の観点から、炭素数8〜24のアルキルフェニルスルホン酸塩、脂肪酸塩、炭素数8〜24のアルキル硫酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレン硫酸エステル塩が好ましく、さらに好ましくは、炭素数12〜16のアルキルフェニルスルホン酸塩及び炭素数8〜16の脂肪酸塩、次にさらに好ましくは、ドデシルベンゼンスルホン酸モノエタノールアミン塩及びラウリン酸ナトリウムである。
【0042】
洗浄剤組成物に含まれる界面活性剤(A)の含有量は、洗浄性の観点から洗浄剤組成物の重量に対し、90〜99.99999重量%が好ましく、さらに好ましくは99〜99.99999重量%、特に好ましくは99.9〜99.9998重量%である。
【0043】
洗浄剤組成物には、必要により、水又は公知のその他の成分、例えば特開2004−27181号公報に記載のビルダー、キレート剤、親水性溶媒、消泡剤、蛍光増白剤、漂白剤、柔軟剤、除菌剤、香料及び着色剤等を含有してもよい。
【0044】
ビルダーとしては、ポリカルボン酸塩(アクリル酸塩ホモポリマー及びマレイン酸塩ホモポリマー等)、多価カルボン酸塩(クエン酸及びリンゴ酸等)、及びアルカリビルダー(苛性ソーダ、ソーダ灰、アンモニア、トリエタノールアミン、トリポリリン酸ソーダ及びケイ酸ソーダ等)等が挙げられる。キレート剤としては、EDTA及びNTA等が挙げられる。親水性溶媒としては、メタノール、エタノール、イソプロピルアルコール、エチレングリコール、ジエチレングリコール及びプロピレングリコール等が挙げられる。消泡剤としては、シリコーン系消泡剤、ポリオキシアルキレン系消泡剤及び鉱物油系消泡剤等が挙げられる。
【0045】
水の含有率は、洗浄性の観点から、洗浄剤組成物及び水の全重量に基づいて、0〜99重量%が好ましく、さらに好ましくは1〜95重量%であり、特に好ましくは1〜90重量%である。
その他の成分のうち、ビルダー及びキレート剤の含有率は、洗浄剤組成物、ビルダー及びキレート剤の全重量に基づいて、好ましくは10重量%以下であり、更に好ましくは5重量%以下である。
蛍光増白剤、漂白剤、柔軟剤、酵素、除菌剤、香料、着色剤及び消泡剤の含有率は、洗浄剤組成物、蛍光増白剤、漂白剤、柔軟剤、酵素、除菌剤、香料、着色剤及び消泡剤の全重量に基づいて、好ましくは5重量%以下であり、更に好ましくは2重量%以下である。
親水性溶媒の含有率は、洗浄剤組成物及び親水性溶媒の全重量に基づいて、好ましくは20重量%以下であり、更に好ましくは10重量%以下である。
【0046】
本発明の洗浄剤組成物の性状は特に限定されないが、液体状、ペースト状、粉末状、フレーク状及びブロック状等が挙げられる。これらのうち、取り扱い易さの観点から好ましいのは粉末状及び液体状である。
【0047】
本発明の洗浄剤組成物は、性状の違いにより、以下の方法を選択して製造することができる。
(1)洗浄剤組成物の性状が液体状又はペースト状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要により水及びその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌して製造する方法。
(2)洗浄剤組成物の性状が粉末状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要により水及びその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌した後、噴霧乾燥器(例えば圧力噴霧ノズル型噴霧乾燥機、2流体噴霧ノズル型噴霧乾燥機及び回転円盤式噴霧乾燥機等)で噴霧乾燥する方法。
(3)洗浄剤組成物の性状が粉末状、フレーク状及びブロック状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要によりその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌した後、離型紙上に溶融物を取り出して室温まで冷却し、得られた固化物を粉砕機(例えばミルミキサー、ボールミル、ジェット粉砕機、コロイドミル及びホモジナイザー等)で適度な大きさ(粉状、フレーク状又はブロック状)に粉砕する方法。
【0048】
上記洗浄剤組成物は、衣料用洗浄剤及び自動食器洗浄機用洗浄剤等に使用できる。
【0049】
洗浄剤組成物の使用方法は、従来の洗浄剤組成物の使用方法と同じでよく、特に限定されるものではない。衣料用洗浄剤としての使用方法の1例を下記に示す。
(1)洗濯物が入った洗濯機に水道水を張り、洗浄剤組成物を25℃で添加し、軽く撹拌して溶解させる。
(2)洗濯機で洗濯物を洗浄する。
(3)洗濯機から液を抜き、水道水で1〜2回すすぐ。
(4)適宜脱水をかける。
【実施例】
【0050】
以下の実施例、比較例により本発明をさらに説明するが、本発明はこれに限定されるものではない。
【0051】
<実施例1>
プライマー1と2(表1)を用いてPCR法により配列番号2のDNAを含むKangiella koreensis DSM16069株(独立行政法人理化学研究所バイオリソースセンターから提供をうけた株)の遺伝子を増幅した。PCR断片を制限酵素NcoIとBamHIで処理後、pET−22bプラスミド(Novagen社)のNcoI制限酵素サイトとBamHI制限酵素サイトに結合した。そのBL21(DE3)大腸菌株にこのプラスミドを形質転換してプロテアーゼ候補遺伝子発現株(α)を作成した。
【0052】
【表1】

【0053】
プロテアーゼ候補遺伝子発現株(α)のをLB培養液(アンピシリン 100mg/L含有)1mLに植菌して30℃で12時間培養を行い、終夜培養液を作成し、0.5mlをLB培養液(アンピシリン 100mg/L含有)5mlに植菌して30℃3時間振とう培養を行い前培養液を作成した。前培養液を50mLの培養液(酵母エキス(日本製薬社製)1.2g、ポリペプトン(日本製薬社製)0.6g、リン酸2カリウム0.47g、リン酸1カリウム0.11g、硫酸アンモニウム0.35g、リン酸2ナトリウム12水和物0.66g、クエン酸ナトリウム2水和物0.02g、グリセロール0.2g、ラクトアルブミン水解物1.5g、消泡剤(信越シリコーン製、「KM−70」)0.3g、1mM硫酸マグネシウム、微量金属溶液(塩化カルシウム18.9μg、塩化鉄(III)500μg、硫酸亜鉛7水和物9.0μg、硫酸銅5.1μg、塩化マンガン4水和物6.7μg、塩化コバルト4.9μg、エチレンジアミン4酢酸4ナトリウム200μg)、100mg/Lアンピシリン)に植菌し微生物培養装置(エイブル社製、製品名「BioJr.8」)を用いてpH6.8、30℃を維持したまま培養を行った。培養開始後1M IPTGを0.15mLを加えた。培養開始14時間後から、グリセリン/タンパク質溶液(50% グリセリン、50g/L ラクトアルブミン水解物、33g/L 消泡剤(信越シリコーン製、「KM−70」)、100mg/L アンピシリン)の滴下を開始した。培養開始後、48時間目に培養液(R−1)を回収した。
【0054】
得られた培養液(R−1)から遠心分離機(KUBTA社製「5922」、4℃、6000×g、10分)を用いて菌体を分離し上清のみを回収した。その後、上清25mlに1M CaCl2を25μlとイソプロパノール6.25ml加えて、遠心分離機(KUBTA社製「5922」、4℃、6000×g、10分)を用いて沈殿除去を行った後、限外ろ過膜(Millipore社製「アミコンウルトラ−15」分画分子量10000)を用いて、1ml程度になるまで上清の濃縮を行い、配列番号1の低温至適プロテアーゼ(A−1)を得た。
【0055】
<比較例1>
一般に市販されているプロテアーゼであるアルカラーゼ(ノボザイムズ社製)を比較のプロテアーゼ(A−2)として用いた。
【0056】
<プロテアーゼ活性>
プロテアーゼ(A−1)及び(A−2)を、最後の測定時の吸光度が0.1〜0.6くらいになるように希釈した。0.1mlずつ6つの容器に分注し、それぞれに基質溶液(アゾカゼイン 5mg/ml、100mM Tris−Cl(pH8.0)、2mM CaCl2)0.5mlを加えて混合した後、各々10℃、15℃、25℃、37℃、50℃、65℃で10分保温した後、15%TCAを400μl加えて反応停止した。不溶物を遠心分離(装置、条件)によって除去し上清を取り出した後、1.7%NaOHを加えて中和を行い、400nmの吸光度を測定した。それぞれの吸光度の測定結果について、25℃で10分間保存したものの測定値を1とした場合の相対値を算出した。結果を表2、図1及び図2に示す。
【0057】
【表2】

【0058】
表2、図1及び図2から、比較例のプロテアーゼ(A−2)は55℃付近に酵素の反応至適温度を有するのに対し、本発明の低温至適プロテアーゼ(A−1)は25〜50℃の間(37℃付近)に酵素の反応至適温度を有する酵素であることが分かる。
したがって、本発明の低温至適プロテアーゼは、一般的に用いられる市販の酵素アルカラーゼ(ノボザイムズ社製)よりも低温に、酵素の反応至適温度を有することが分かる。
【産業上の利用可能性】
【0059】
本発明の低温至適プロテアーゼは、低温条件下で使用する酵素として有用であり、特に、衣料用洗浄剤、自動食器洗浄機用洗浄剤、コンタクトレンズ用洗浄剤、浴用剤、角質除去用化粧料、食品の改質剤(製パン、肉の軟化、水産加工など)、ビールの清澄剤、皮革なめし剤、写真フィルムのゼラチン除去剤、消化助剤又は消炎剤に使用する酵素として有用である。
【技術分野】
【0001】
本発明は、低温至適プロテアーゼ及びこれをコードする遺伝子に関する。
【背景技術】
【0002】
プロテアーゼは、ペプチド結合の加水分解を触媒する酵素群の総称で、微生物、動物及び植物中に広く存在が知られている。その応用分野としては、衣料用洗浄剤、自動食器洗浄機用洗浄剤、コンタクトレンズ用洗浄剤、浴用剤、角質除去用化粧料、食品の改質剤(製パン、肉の軟化、水産加工など)、ビールの清澄剤、皮革なめし剤、写真フィルムのゼラチン除去剤、消化助剤又は消炎剤などがあり、多くの分野で盛んに利用されている。
【0003】
その中で最も大量に工業生産され、市場規模が大きいのは洗浄剤用プロテアーゼであり、例えばアルカラーゼ、サビナーゼ(ノボ・ノルディスク社製)、マクサカル(ギスト・ブロケイデス社製)、API−21(昭和電工社製)、ブラップ(ヘンケル社製)及びプロテアーゼK(KAP;花王社製)などが知られている。
【0004】
しかしながら、これらの大半は酵素が活性を最も発揮する温度、つまり至適温度が50〜80℃である(高温至適プロテアーゼ)ため、例えば、水道水をそのまま用いて低温領域(例えば25℃)で衣料等の洗浄を行う場合には、その酵素特性が充分に発揮されているとは言いがたい。また、前述の高温至適プロテアーゼは、その応用分野のほとんどにおいて、低温条件下(25〜50℃)で使用されており、酵素特性が十分に得られていない。しかしながら、高温至適プロテアーゼを用いて高温処理工程を行うことは、省エネルギーの観点からも好ましいとは言えない。
近年、洗浄剤をはじめとして、プロテアーゼの商品への配合や工業的プロセスなどにおける利用が考えられているが、この場合、25〜50℃の温度で有効に作用する酵素を見出すことは、省エネルギー化に加えて酵素の機能を十分発揮させるうえで、必須の条件である。したがって、低温でも十分な酵素特性が得られる低温至適プロテアーゼの開発が望まれている。特に、低温至適プロテアーゼは、反応系に熱を加えられないようなケース、すなわちチーズの熟成や肉の軟化等による食品の改質に有効であり、熱望されている。
【0005】
これまでに、寒冷地土壌等の寒冷環境に棲息する生物、海水あるいは冷蔵中のミルク等から分離されたプロテアーゼ生産菌及び生産されるプロテアーゼに関しては数多くの報告例がある。すなわち、シュードモナスエスピー(Pseudomonas sp.)No.548株(非特許文献1)、エシェリヒア フロインディ(Eschreichia freundii)(非特許文献2)、キサントモナスマルトフィラ(Xanthomonas maltophila)047/08株(非特許文献3)、シュードモナス フルオレセンス(Pseudomonas fluorescens)T16が(非特許文献4)、シュードモナス フルオレセンス(Pseudomonas fluorescens)AFT36株(非特許文献5)、シュードモナス エスピー(Pseudomonas sp.)145−2株(非特許文献6)、アエロモナス サルモニシダ(Aeromonas salmonicida)(非特許文献7)、シュードモナス パウシモビリス(Pseudomonas paucinomobilis),バチルス エスピー(Bacillus sp.)(非特許文献8)、ビブリオ エスピー(Vibrio sp.)SA 1株(非特許文献9)、シュードモナス フルオレセンス(Pseudomonas fluorescens)NCDO 2085株(非特許文献10)、シュードモナス フルオレセンス(Pseudomonas fluorescens)(非特許文献11)、シュードモナス フルオレセンス(Pseudomonas fluorescens)GR83株(非特許文献12)、ペシロミセス マルクアンディ(Paecilomyces marquandii)(特許文献2)及びキサントモナス エスピー(Xanthomonas sp.)S−1(特許文献3)などの低温で生育できる微生物が種々のプロテアーゼを生産する。また、好冷細菌(psychrotrophic bacterium)が生産するプロテアーゼに関しては、Fairbainらが要領よく総説にまとめている(非特許文献13)。しかしこれらのプロテアーゼについても、低温域における作用は、必ずしも満足できるものではない。また、プロテアーゼの安定性や界面活性剤耐性、低い自己分解特性など様々なニーズに対応できるように、今まで知られている微生物以外の新しい微生物からのプロテアーゼも望まれている。
【0006】
ところで、近年塩基配列決定技術の進展に伴って多種多様な生物のゲノムDNAの塩基配列が決定され、生物情報科学的な観点から遺伝子の配列や機能も予測されている。しかし、その遺伝子がコードするタンパク質の機能が実際に予測に一致しない例が多い。そのため、実際に生化学的解析をしなければ正確な機能が特定できないのが現状である。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第2882652号
【特許文献2】国際公開第88/03948号
【特許文献3】特開平5−211868号
【非特許文献】
【0008】
【非特許文献1】Agric.Biol.Chem.,36巻,1185頁,1970年
【非特許文献2】Eur.J.Biochem.,44巻,87頁,1974年
【非特許文献3】FEMS Microbiol.Lett.,79巻,257頁,1991年
【非特許文献4】Appl.Environ.Microbiol.,46巻,333頁,1983年
【非特許文献5】Biochim.Biophys.Acta,717巻,376頁,1982年
【非特許文献6】Microbios.,36巻,7頁,1982年
【非特許文献7】J.Appl.Bacteriol.,53巻,289頁,1983年
【非特許文献8】J.Basic Microbiol.,31巻,377頁,1991年
【非特許文献9】Antonie van Leeuwenhoek,44巻,157頁,1978年
【非特許文献10】J.Dairy Res.,53巻,457頁,1986年
【非特許文献11】J.Dairy Res.,53巻,97頁,1986年
【非特許文献12】Lebensm.−Wiss.u.−Technol.,23巻,106頁,1990年
【非特許文献13】J.Dairy Res.,53巻,139頁,1986年
【発明の概要】
【発明が解決しようとする課題】
【0009】
本発明の目的は、低温(25〜50℃)において、高い活性を有する低温至適プロテアーゼ及びこれをコードする遺伝子を提供することにある。
【課題を解決するための手段】
【0010】
そこで本発明者らは、上記の目的を達成するべく検討を行った結果、本発明を完成するに至った。
すなわち、本発明は、配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ;以下の(a)、(b)又は(c)のDNAからなる請求項1又は2に記載の低温至適プロテアーゼをコードする遺伝子
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA;当該遺伝子がコードする低温至適プロテアーゼ活性を有するタンパク質;当該遺伝子を含有する組換えベクター;当該組換えベクターを有する形質転換体;当該低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤を提供するものである。
【発明の効果】
【0011】
本発明の低温至適プロテアーゼは、低温領域(25〜50℃)に酵素反応至適温度を有する。
また、本発明の遺伝子を微生物等の宿主に形質転換することにより、低温至適プロテアーゼを発現する株を得ることができる。
【図面の簡単な説明】
【0012】
【図1】本発明の低温至適プロテアーゼ(実施例1)について、10〜65℃におけるプロテアーゼ活性を測定し、各々の温度での測定値を25℃での測定値を1とした場合の相対値とし、活性の温度依存性を表したグラフである。
【図2】市販のプロテアーゼ(比較例1)について、10〜65℃におけるプロテアーゼ活性を測定し、各々の温度での測定値を25℃での測定値を1とした場合の相対値とし、活性の温度依存性を表したグラフである。
【発明を実施するための形態】
【0013】
本発明において低温至適プロテアーゼとは、25〜50℃の範囲内に酵素の反応至適温度を有する低温至適プロテアーゼである。
本発明において、酵素の反応至適温度とは、酵素活性が最も高い温度である。
【0014】
本発明において、配列番号1のアミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼとは、依然として低温至適プロテアーゼの活性を保持するアミノ酸配列であり、配列番号1のアミノ酸配列と等価であるアミノ酸配列を意味する。
欠失、置換及び/又は付加されたアミノ酸の個数は、低温至適プロテアーゼ活性を保持する観点から、1〜10個が好ましく、さらに好ましくは1〜5個である。
依然として低温至適プロテアーゼの活性を保持するとは、25〜50℃の範囲内に酵素の反応至適温度を有することを意味する。
【0015】
本発明において、付加には、両末端への1若しくは数個のアミノ酸の付加が含まれ、例えば、酵素精製のためのタグ配列を付加したものが含まれる。
【0016】
本発明において、低温至適プロテアーゼの活性は、一般的なプロテアーゼ活性測定法によって測定され、例えば、アゾカゼインを用いた活性の測定法が挙げられる。
アゾカゼインを用いた活性の測定方法とは、アゾカゼインを基質として用いて反応させた後、未反応のアゾカゼインを沈殿させ、可溶性画分に存在するアゾカゼインの量を吸光度により測定することでプロテアーゼ活性を測定する方法である。
【0017】
本発明の低温至適プロテアーゼは、配列番号1に示すアミノ酸配列からなるプロテアーゼ又は当該アミノ酸配列と等価のアミノ酸配列からなるプロテアーゼをコードする遺伝子を微生物等の宿主に導入し、宿主を培養液中で培養し、培養液中からプロテアーゼを採取及び精製することによって生産することができる。
【0018】
なお、当該等価のアミノ酸配列からなるプロテアーゼをコードする遺伝子は、自然界等から得ることも可能ではあるが、更に部位特異的突然変異誘発法等の公知の手法を利用して調製することもできる。
【0019】
本発明の低温至適プロテアーゼは、低温(25℃〜50℃)での活性が高いので、衣料用洗浄剤をはじめ、食品改質剤(チーズの熟成や肉の軟化等)等の各種産業用の酵素として有用である。
【0020】
本発明の遺伝子は、以下の(a)、(b)又は(c)のDNAからなり、上記低温至適プロテアーゼをコードする遺伝子である。
(a)塩基配列が配列番号2からなるDNA。
(b)配列番号2に示す塩基配列のうち1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA。
【0021】
本発明の遺伝子は、塩基配列が配列番号2からなるDNA、該塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列を有するDNA又は該塩基配列からなるDNAにストリンジェントな条件下でハイブリダイズする低温至適プロテアーゼ前駆体をコードするDNAを含有する、低温至適プロテアーゼをコードする遺伝子である。尚、配列番号2に示す塩基配列は、本発明の低温至適プロテアーゼのプレプロ領域並びに成熟タンパク質を含む前駆体をコードするものである。
【0022】
本発明において、「ストリンジェントな条件下」とは、例えばMolecular cloning−a Laboratory manual 2nd edition(Sambrookら、1989)に記載の条件等が挙げられる。例えば、6×SSC(1×SSCの組成:0.15M 塩化ナトリウム、0.015M クエン酸ナトリウム、pH7.0)、0.5% SDS、5Xデンハート及び100mg/mLニシン精子DNAを含む溶液にプローブとともに65℃で8〜16時間恒温し、ハイブリダイズさせる条件が挙げられる。
【0023】
本発明に記載の遺伝子をクローニングする方法は、例えばMolecular cloning−a Laboratory manual 2nd edition(Sambrookら、1989)に記載の方法等が挙げられる。
【0024】
本発明の低温至適プロテアーゼは、本発明の遺伝子を、例えばカンジエラ属に属する微生物、例えばKangiella koreensis DSM 16069株(独立行政法人理化学研究所バイオリソースセンターから入手できる)等から、ショットガン法、PCR法を用いてクローニングし、適当なベクターと宿主菌を用いて大量に生産することができる。
【0025】
本発明の遺伝子を用いて低温至適プロテアーゼを生産する方法は、目的とする宿主内で遺伝子を発現するのに適した任意のベクターに、本発明の遺伝子を組込み、該組換えベクターを用いて宿主を形質転換し、組み換えベクターを含む形質転換体を得る。得られた形質転換体を培養し、当該培養液から低温至適プロテアーゼを採取すればよい。
【0026】
本発明の組換えベクターは、本発明の遺伝子を含有すれば特に限定されず、適当なベクターに本発明の遺伝子を挿入することによって得ることができる。
ベクターは種々のものが公知であり、市販品も多く存在する。当業者であれば、宿主の種類に応じて適切なベクターを容易に選択することができる。ベクターの具体例としては、pETシリーズ、pUCシリーズなどが挙げられる。
組換えベクターの調製方法自体は周知の常法である。適当なベクターに本発明の遺伝子を挿入し、宿主を形質転換する具体的な方法としては、エレクトロポレーション法、カルシウム法等が挙げられる。
【0027】
本発明において、宿主としては、動物細胞、昆虫細胞、微生物及び植物細胞等が挙げられる。
動物細胞としては、特に限定されないが、サル細胞COS−7、Vero、マウスL細胞、ラットGH3、ヒトFL細胞及びCHO細胞等が挙げられる。
昆虫細胞としては、特に限定されないが、Sf9細胞及びSf21細胞等が挙げられる。
微生物としては、特に限定されないが、細菌及び酵母等が挙げられる。
細菌としては、真正細菌及び古細菌が含まれる。
真正細菌には、グラム陰性菌及びグラム陽性菌が含まれる。グラム陰性細菌としては、エシェリチア属菌(Escherichia)、サーマス属菌(Thermus)、リゾビウム属菌(Rhizobium)、シュードモナス属菌(Pseudomonas)、シュワネラ属菌(Shewanella)、ビブリオ属菌(Vibrio)、サルモネラ属菌(Salmonella)、アセトバクター属(Acetobacter属)、シネコシスティス属(Synechocystis属)等が挙げられる。グラム陽性菌としては、バチルス属(Bacillus属)、ストレプトマイセス属(Streptmyces属)、コリネバクテリウム属(Corynebacterium属)、ブレビバチルス属(Brevibacillus属)、ビフィドバクテリウム属 (Bifidobacterium属)、ラクトコッカス属 (Lactococcus属)、エンテロコッカス属 (Enterococcus属)、ペディオコッカス属(Pediococcus属)、リューコノストック属 (Leuconostoc属)、ストレプトマイセス属(Streptomyces属)等が挙げられる。
植物細胞としては、特に限定されないが、BY−2細胞等が挙げられる。
【0028】
本発明において、宿主としては、クローニングの容易さの観点から、微生物が好ましく、さらに好ましくはエシェリチア属菌(Escherichia)、サーマス属菌(Thermus)、リゾビウム属菌(Rhizobium)、シュードモナス属菌(Pseudomonas)、シュワネラ属菌(Shewanella)、ビブリオ属菌(Vibrio)、サルモネラ属菌(Salmonella)、アセトバクター属(Acetobacter属)、シネコシスティス属(Synechocystis属)であり、特に好ましくはエシェリチア属菌(Escherichia)、シュワネラ属菌(Shewanella)、バチルス属(Bacillus属)、ブレビバチルス属(Brevibacillus属)である。
【0029】
培養は微生物の資化可能な炭素源、窒素源その他の必須栄養素を含む培地に接種し、常法に従って行えばよい。
【0030】
本発明において、培養液から低温至適プロテアーゼを採取及び精製する方法としては、常法に準じて行うことができる。例えば、培養物から遠心分離又は濾過することで菌体を除き、得られた培養上清液から常法手段により目的酵素を濃縮することができる。このようにして得られた酵素液又は乾燥粉末はそのまま用いることもできるが更に公知の方法により結晶化や造粒化することができる。
【0031】
本発明の洗浄剤組成物は、上記低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤組成物である。上記低温至適プロテアーゼを用いることにより、低温(25〜50℃)での洗浄性が優れた洗浄剤を得ることができる。
【0032】
洗浄剤組成物中の低温至適プロテアーゼの含有量は、洗浄性の観点から洗浄剤組成物の重量に対し、0.00001〜10重量%が好ましく、さらに好ましくは0.0001〜1重量%、特に好ましくは0.0002〜0.1重量%である。この範囲で含有することで、効率よく洗浄性を向上することができる。
【0033】
界面活性剤(A)は非イオン性界面活性剤(A−1)、アニオン性界面活性剤(A−2)、カチオン性界面活性剤(A−3)及び両性界面活性剤(A−4)が挙げられる。
【0034】
非イオン性界面活性剤(A−1)としては、アルキレンオキサイド付加型非イオン性界面活性剤(A−1−1)及び多価アルコール型非イオン性界面活性剤(A−1−2)等が挙げられる。
【0035】
(A−1−1)としては、高級アルコール(炭素数8〜18)アルキレン(炭素数2〜4、好ましいのは2)オキサイド付加物(活性水素1個当たりの付加モル数1〜30)、アルキル(炭素数1〜12)フェノールエチレンオキサイド(以下、EOと略記)付加物(付加モル数1〜30)、高級アミン(炭素数8〜22)アルキレン(炭素数2〜4、好ましいのは2)オキサイド付加物(活性水素1個当たりの付加モル数1〜40)、脂肪酸(炭素数8〜18)EO付加物(活性水素1個当たりの付加モル数1〜60)、ポリプロピレングリコール(分子量200〜4000)EO付加物(活性水素1個当たりの付加モル数1〜50)、ポリオキシエチレン(繰り返し単位数3〜30)アルキル(炭素数6〜20)アリルエーテル並びにソルビタンモノラウレートEO付加物(活性水素1個あたりの付加モル数1〜30)及びソルビタンモノオレートEO付加物(活性水素1個あたりの付加モル数1〜30)等の多価(2〜8価又はそれ以上)アルコール(炭素数2〜30)の脂肪酸(炭素数8〜24)エステルEO付加物(活性水素1個あたりの付加モル数1〜30)等が挙げられる。
【0036】
(A−1−2)としては、グリセリンモノステアレート、グリセリンモノオレート、ソルビタンモノラウレート及びソルビタンモノオレート等の多価(2〜8価又はそれ以上)アルコール(炭素数2〜30)の脂肪酸(炭素数8〜24)エステル並びにラウリン酸モノエタノールアミド及びラウリン酸ジエタノールアミド等の脂肪酸アルカノールアミド等が挙げられる。
【0037】
アニオン性界面活性剤(A−2)としては、炭素数8〜24のアルキルエーテルカルボン酸又はその塩及び炭素数8〜24のアルキル(ポリ)オキシエチレンエーテルカルボン酸又はその塩[(ポリ)オキシエチレン(重合度=1〜100)ラウリルエーテル酢酸ナトリウム及び(ポリ)オキシエチレン(重合度=1〜100)ラウリルスルホコハク酸2ナトリウム等]、炭素数8〜24のアルキル硫酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレン硫酸エステル塩[ラウリル硫酸ナトリウム、ラウリル(ポリ)オキシエチレン(重合度=1〜100)硫酸ナトリウム及びラウリル(ポリ)オキシエチレン(重合度=1〜100)硫酸−トリエタノールアミン塩等]、ヤシ油脂肪酸モノエタノールアミド硫酸スルホン酸ナトリウム、炭素数8〜24のアルキルフェニルスルホン酸塩[ドデシルベンゼンスルホン酸ナトリウム等]、炭素数8〜24のアルキルリン酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレンリン酸エステル塩[ラウリルリン酸ナトリウム及び(ポリ)オキシエチレン(重合度=1〜100)ラウリルエーテルリン酸ナトリウム等]、脂肪酸塩[ラウリン酸ナトリウム及びラウリン酸トリエタノールアミン等]、アシル化アミノ酸塩[ヤシ油脂肪酸メチルタウリンナトリウム、ヤシ油脂肪酸ザルコシンナトリウム、ヤシ油脂肪酸ザルコシントリエタノールアミン、N−ヤシ油脂肪酸アシル−L−グルタミン酸トリエタノールアミン、N−ヤシ油脂肪酸アシル−L−グルタミン酸ナトリウム及びラウロイルメチル−β−アラニンナトリウム等]が挙げられる。
【0038】
カチオン性界面活性剤(A−3)としては、第4級アンモニウム塩型[塩化ステアリルトリメチルアンモニウム、塩化ベヘニルトリメチルアンモニウム、塩化ジステアリルジメチルアンモニウム及びエチル硫酸ラノリン脂肪酸アミノプロピルエチルジメチルアンモニウム等]及びアミン塩型[ステアリン酸ジエチルアミノエチルアミド乳酸塩、ジラウリルアミン塩酸塩及びオレイルアミン乳酸塩等]等が挙げられる。
【0039】
両性界面活性剤(A−4)としては、ベタイン型両性界面活性剤[ヤシ油脂肪酸アミドプロピルジメチルアミノ酢酸ベタイン、ラウリルジメチルアミノ酢酸ベタイン、2−アルキル−N−カルボキシメチル−N−ヒドロキシエチルイミダゾリニウムベタイン、ラウリルヒドロキシスルホベタイン及びラウロイルアミドエチルヒドロキシエチルカルボキシメチルベタインヒドロキシプロピルリン酸ナトリウム等]、アミノ酸型両性界面活性剤[β−ラウリルアミノプロピオン酸ナトリウム等]が挙げられる。
【0040】
(A)としては、1種又は2種以上が使用出来る。2種以上を使用する場合、その組み合わせとしては、例えばノニオン性界面活性剤とアニオン性界面活性剤、ノニオン性界面活性剤とカチオン性界面活性剤及びノニオン性界面活性剤と両性界面活性剤の組み合わせ等が挙げられる。
【0041】
(A)として、洗浄性の観点から、ノニオン性界面活性剤単独での使用、及びノニオン性界面活性剤とアニオン性界面活性剤との組み合わせでの使用が好ましい。
ノニオン性界面活性剤としては、洗浄性の観点から、脂肪族アルコール(炭素数8〜24)EO付加物(重合度=1〜100)が好ましく、さらに好ましくは脂肪族アルコール(炭素数12〜18)EO付加物(重合度4〜20)、次にさらに好ましくは脂肪族アルコール(炭素数12〜15)EO付加物(重合度=8〜12)、特に好ましくはオレイルアルコールEO11モル付加物である。
アニオン性界面活性剤としては、洗浄性の観点から、炭素数8〜24のアルキルフェニルスルホン酸塩、脂肪酸塩、炭素数8〜24のアルキル硫酸エステル塩及び炭素数8〜24のアルキル(ポリ)オキシエチレン硫酸エステル塩が好ましく、さらに好ましくは、炭素数12〜16のアルキルフェニルスルホン酸塩及び炭素数8〜16の脂肪酸塩、次にさらに好ましくは、ドデシルベンゼンスルホン酸モノエタノールアミン塩及びラウリン酸ナトリウムである。
【0042】
洗浄剤組成物に含まれる界面活性剤(A)の含有量は、洗浄性の観点から洗浄剤組成物の重量に対し、90〜99.99999重量%が好ましく、さらに好ましくは99〜99.99999重量%、特に好ましくは99.9〜99.9998重量%である。
【0043】
洗浄剤組成物には、必要により、水又は公知のその他の成分、例えば特開2004−27181号公報に記載のビルダー、キレート剤、親水性溶媒、消泡剤、蛍光増白剤、漂白剤、柔軟剤、除菌剤、香料及び着色剤等を含有してもよい。
【0044】
ビルダーとしては、ポリカルボン酸塩(アクリル酸塩ホモポリマー及びマレイン酸塩ホモポリマー等)、多価カルボン酸塩(クエン酸及びリンゴ酸等)、及びアルカリビルダー(苛性ソーダ、ソーダ灰、アンモニア、トリエタノールアミン、トリポリリン酸ソーダ及びケイ酸ソーダ等)等が挙げられる。キレート剤としては、EDTA及びNTA等が挙げられる。親水性溶媒としては、メタノール、エタノール、イソプロピルアルコール、エチレングリコール、ジエチレングリコール及びプロピレングリコール等が挙げられる。消泡剤としては、シリコーン系消泡剤、ポリオキシアルキレン系消泡剤及び鉱物油系消泡剤等が挙げられる。
【0045】
水の含有率は、洗浄性の観点から、洗浄剤組成物及び水の全重量に基づいて、0〜99重量%が好ましく、さらに好ましくは1〜95重量%であり、特に好ましくは1〜90重量%である。
その他の成分のうち、ビルダー及びキレート剤の含有率は、洗浄剤組成物、ビルダー及びキレート剤の全重量に基づいて、好ましくは10重量%以下であり、更に好ましくは5重量%以下である。
蛍光増白剤、漂白剤、柔軟剤、酵素、除菌剤、香料、着色剤及び消泡剤の含有率は、洗浄剤組成物、蛍光増白剤、漂白剤、柔軟剤、酵素、除菌剤、香料、着色剤及び消泡剤の全重量に基づいて、好ましくは5重量%以下であり、更に好ましくは2重量%以下である。
親水性溶媒の含有率は、洗浄剤組成物及び親水性溶媒の全重量に基づいて、好ましくは20重量%以下であり、更に好ましくは10重量%以下である。
【0046】
本発明の洗浄剤組成物の性状は特に限定されないが、液体状、ペースト状、粉末状、フレーク状及びブロック状等が挙げられる。これらのうち、取り扱い易さの観点から好ましいのは粉末状及び液体状である。
【0047】
本発明の洗浄剤組成物は、性状の違いにより、以下の方法を選択して製造することができる。
(1)洗浄剤組成物の性状が液体状又はペースト状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要により水及びその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌して製造する方法。
(2)洗浄剤組成物の性状が粉末状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要により水及びその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌した後、噴霧乾燥器(例えば圧力噴霧ノズル型噴霧乾燥機、2流体噴霧ノズル型噴霧乾燥機及び回転円盤式噴霧乾燥機等)で噴霧乾燥する方法。
(3)洗浄剤組成物の性状が粉末状、フレーク状及びブロック状の場合
撹拌機及び加熱冷却装置を備えた混合槽に、界面活性剤(A)と、必要によりその他の成分を投入順序に特に制限なく投入し、10〜50℃で均一になるまで撹拌し、低温至適プロテアーゼを加えてさらに10〜50℃で均一になるまで攪拌した後、離型紙上に溶融物を取り出して室温まで冷却し、得られた固化物を粉砕機(例えばミルミキサー、ボールミル、ジェット粉砕機、コロイドミル及びホモジナイザー等)で適度な大きさ(粉状、フレーク状又はブロック状)に粉砕する方法。
【0048】
上記洗浄剤組成物は、衣料用洗浄剤及び自動食器洗浄機用洗浄剤等に使用できる。
【0049】
洗浄剤組成物の使用方法は、従来の洗浄剤組成物の使用方法と同じでよく、特に限定されるものではない。衣料用洗浄剤としての使用方法の1例を下記に示す。
(1)洗濯物が入った洗濯機に水道水を張り、洗浄剤組成物を25℃で添加し、軽く撹拌して溶解させる。
(2)洗濯機で洗濯物を洗浄する。
(3)洗濯機から液を抜き、水道水で1〜2回すすぐ。
(4)適宜脱水をかける。
【実施例】
【0050】
以下の実施例、比較例により本発明をさらに説明するが、本発明はこれに限定されるものではない。
【0051】
<実施例1>
プライマー1と2(表1)を用いてPCR法により配列番号2のDNAを含むKangiella koreensis DSM16069株(独立行政法人理化学研究所バイオリソースセンターから提供をうけた株)の遺伝子を増幅した。PCR断片を制限酵素NcoIとBamHIで処理後、pET−22bプラスミド(Novagen社)のNcoI制限酵素サイトとBamHI制限酵素サイトに結合した。そのBL21(DE3)大腸菌株にこのプラスミドを形質転換してプロテアーゼ候補遺伝子発現株(α)を作成した。
【0052】
【表1】

【0053】
プロテアーゼ候補遺伝子発現株(α)のをLB培養液(アンピシリン 100mg/L含有)1mLに植菌して30℃で12時間培養を行い、終夜培養液を作成し、0.5mlをLB培養液(アンピシリン 100mg/L含有)5mlに植菌して30℃3時間振とう培養を行い前培養液を作成した。前培養液を50mLの培養液(酵母エキス(日本製薬社製)1.2g、ポリペプトン(日本製薬社製)0.6g、リン酸2カリウム0.47g、リン酸1カリウム0.11g、硫酸アンモニウム0.35g、リン酸2ナトリウム12水和物0.66g、クエン酸ナトリウム2水和物0.02g、グリセロール0.2g、ラクトアルブミン水解物1.5g、消泡剤(信越シリコーン製、「KM−70」)0.3g、1mM硫酸マグネシウム、微量金属溶液(塩化カルシウム18.9μg、塩化鉄(III)500μg、硫酸亜鉛7水和物9.0μg、硫酸銅5.1μg、塩化マンガン4水和物6.7μg、塩化コバルト4.9μg、エチレンジアミン4酢酸4ナトリウム200μg)、100mg/Lアンピシリン)に植菌し微生物培養装置(エイブル社製、製品名「BioJr.8」)を用いてpH6.8、30℃を維持したまま培養を行った。培養開始後1M IPTGを0.15mLを加えた。培養開始14時間後から、グリセリン/タンパク質溶液(50% グリセリン、50g/L ラクトアルブミン水解物、33g/L 消泡剤(信越シリコーン製、「KM−70」)、100mg/L アンピシリン)の滴下を開始した。培養開始後、48時間目に培養液(R−1)を回収した。
【0054】
得られた培養液(R−1)から遠心分離機(KUBTA社製「5922」、4℃、6000×g、10分)を用いて菌体を分離し上清のみを回収した。その後、上清25mlに1M CaCl2を25μlとイソプロパノール6.25ml加えて、遠心分離機(KUBTA社製「5922」、4℃、6000×g、10分)を用いて沈殿除去を行った後、限外ろ過膜(Millipore社製「アミコンウルトラ−15」分画分子量10000)を用いて、1ml程度になるまで上清の濃縮を行い、配列番号1の低温至適プロテアーゼ(A−1)を得た。
【0055】
<比較例1>
一般に市販されているプロテアーゼであるアルカラーゼ(ノボザイムズ社製)を比較のプロテアーゼ(A−2)として用いた。
【0056】
<プロテアーゼ活性>
プロテアーゼ(A−1)及び(A−2)を、最後の測定時の吸光度が0.1〜0.6くらいになるように希釈した。0.1mlずつ6つの容器に分注し、それぞれに基質溶液(アゾカゼイン 5mg/ml、100mM Tris−Cl(pH8.0)、2mM CaCl2)0.5mlを加えて混合した後、各々10℃、15℃、25℃、37℃、50℃、65℃で10分保温した後、15%TCAを400μl加えて反応停止した。不溶物を遠心分離(装置、条件)によって除去し上清を取り出した後、1.7%NaOHを加えて中和を行い、400nmの吸光度を測定した。それぞれの吸光度の測定結果について、25℃で10分間保存したものの測定値を1とした場合の相対値を算出した。結果を表2、図1及び図2に示す。
【0057】
【表2】

【0058】
表2、図1及び図2から、比較例のプロテアーゼ(A−2)は55℃付近に酵素の反応至適温度を有するのに対し、本発明の低温至適プロテアーゼ(A−1)は25〜50℃の間(37℃付近)に酵素の反応至適温度を有する酵素であることが分かる。
したがって、本発明の低温至適プロテアーゼは、一般的に用いられる市販の酵素アルカラーゼ(ノボザイムズ社製)よりも低温に、酵素の反応至適温度を有することが分かる。
【産業上の利用可能性】
【0059】
本発明の低温至適プロテアーゼは、低温条件下で使用する酵素として有用であり、特に、衣料用洗浄剤、自動食器洗浄機用洗浄剤、コンタクトレンズ用洗浄剤、浴用剤、角質除去用化粧料、食品の改質剤(製パン、肉の軟化、水産加工など)、ビールの清澄剤、皮革なめし剤、写真フィルムのゼラチン除去剤、消化助剤又は消炎剤に使用する酵素として有用である。
【特許請求の範囲】
【請求項1】
配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ。
【請求項2】
以下の(a)、(b)又は(c)のDNAからなる請求項1に記載の低温至適プロテアーゼをコードする遺伝子。
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA
【請求項3】
請求項2に記載の遺伝子を含有する組換えベクター。
【請求項4】
請求項3に記載の組換えベクターを含む形質転換体。
【請求項5】
宿主が微生物である請求項4に記載の形質転換体。
【請求項6】
請求項1に記載の低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤組成物。
【請求項1】
配列番号1のアミノ酸配列又は該アミノ酸配列の1若しくは数個のアミノ酸が欠失、置換及び/又は付加されたアミノ酸配列からなる低温至適プロテアーゼ。
【請求項2】
以下の(a)、(b)又は(c)のDNAからなる請求項1に記載の低温至適プロテアーゼをコードする遺伝子。
(a)塩基配列が配列番号2からなるDNA
(b)配列番号2に示す塩基配列の1若しくは数個のアミノ酸塩基が欠失、置換及び/若しくは付加された塩基配列からなるDNA
(c)(a)のDNAとストリンジェントな条件下でハイブリダイズするDNA
【請求項3】
請求項2に記載の遺伝子を含有する組換えベクター。
【請求項4】
請求項3に記載の組換えベクターを含む形質転換体。
【請求項5】
宿主が微生物である請求項4に記載の形質転換体。
【請求項6】
請求項1に記載の低温至適プロテアーゼ及び界面活性剤(A)を含有する洗浄剤組成物。
【図1】


【図2】




【図2】


【公開番号】特開2012−110275(P2012−110275A)
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2010−262198(P2010−262198)
【出願日】平成22年11月25日(2010.11.25)
【出願人】(000002288)三洋化成工業株式会社 (1,719)
【Fターム(参考)】
【公開日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成22年11月25日(2010.11.25)
【出願人】(000002288)三洋化成工業株式会社 (1,719)
【Fターム(参考)】
[ Back to top ]

