低酸素応答因子の増強剤および増強方法
【課題】低酸素誘導因子が関与する疾患の予防・治療薬の提供。
【解決手段】一般式

で表されるフェニルプロペン誘導体および/または、一般式

で表されるフェノール誘導体、またはセンキュウ、チョウジおよびテンマから選ばれる生薬またはそのエキス。
【解決手段】一般式

で表されるフェニルプロペン誘導体および/または、一般式

で表されるフェノール誘導体、またはセンキュウ、チョウジおよびテンマから選ばれる生薬またはそのエキス。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、低酸素応答因子、特に、低酸素誘導因子HIF−1α(Hypoxia-Inducible Factor-1α)を増強するフェニルプロペン誘導体およびフェニルプロペン誘導体が含まれる植物エキス・生薬・生薬エキスを含有する低酸素応答因子の増強剤並びにフェニルプロペン誘導体およびフェニルプロペン誘導体が含まれ植物エキス・生薬・生薬エキスを用いることを特徴とする低酸素応答因子、特にHIF−1αの増強方法に関する。
【背景技術】
【0002】
透析患者や末期腎不全患者などの腎疾患患者は、アンジオテンシンII受容体拮抗薬 (AngiotensinII Receptor Blocker:ARB)などの薬剤、蛋白制限、腎移植などの治療方法の進歩にかかわらず世界中で増加してきている。このような腎疾患の有病率や死亡率の増加に対して新たな治療薬の開発が望まれている。
腎機能低下の進展に、動脈硬化、炎症、レニン・アンジオテンシン系、酸化ストレスなど多くの因子が関与していることが報告されているが、近年、慢性腎臓病の最終共通経路(final common pathway)として、慢性低酸素状態の関与が着目されている。
【0003】
一方、低酸素によって活性化される転写因子は、低酸素誘導因子−1(Hypoxia- inducible factor-1:HIF−1)とも称され、HIF−1αとβサブユニットからなるヘテロ二量体であり、グルコース輸送蛋白、血管内皮増殖因子(Vascular Endothelial Growth Factor:VEGF)などの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応を制御している。
HIF−1αの活性化方法・活性化物質に関して、2−オキソ酸(ピルビン酸、オキサロ酢酸、ケトイソ吉草酸など)によるHIF−1遺伝子発現の活性化方法(特許文献1)、アルギニンを有効成分とする低酸素応答亢進剤(特許文献2)、ロイシン、イソロシン、バリンまたはそれらの混合物を含有する低酸素応答促進剤(特許文献3)、カルジオリド及びブファジエノリド化合物(特許文献4)などが知られている。
【0004】
他方、八味地黄丸は、約2千年前に作られた漢方薬で地黄、山薬、山茱萸、牡丹皮、茯苓、沢瀉、桂皮、附子の8種類の生薬から構成されている。臨床的には、腰痛、頻尿、冷え性など多くの症状に用いられてきた。また、慢性腎不全に伴う全身倦怠感、浮腫などにも使用され、慢性腎臓病に対しても使用されている。
八味地黄丸に関する基礎研究では、腎摘モデル(非特許文献1)や糖尿病性腎症モデル(非特許文献2)に対する腎機能低下抑制作用が報告されている。
【0005】
5/6腎摘モデル(以下腎摘モデル)は進行性腎疾患の典型的モデルである。このモデルの初期変化は、糸球体高濾過と高血圧を生じる輸出小動脈の相対的拡張低下を伴う腎内血管拡張からなるが、本モデルの腎機能の悪化は、初期の血流の変化による慢性の組織低酸素が腎不全進展の要因とする報告が近年なされている(非特許文献3)。さらに、低酸素により誘導される低酸素誘導因子の活性化が、本モデルの腎機能保護作用を誘導することが報告されている(非特許文献4)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2007-510734
【特許文献2】再表2006-552951
【特許文献3】特開2008-056566
【特許文献4】特表2009-522383
【非特許文献】
【0007】
【非特許文献1】J Pharm Pharmacol 57:1637-1644, 2005.
【非特許文献2】J Pharm Pharmacol 57:1205-1212, 2005.
【非特許文献3】J Am Soc Nephrol 15:1277-1288, 2004.
【非特許文献4】J Am Soc Nephrol 14: 1825-1832, 2003.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、進行性腎疾患の典型的モデルである5/6腎摘モデルを用いて、八味地黄丸に、低酸素応答因子HIF−1α(Hypoxia-Inducible Factor-1α)の増強作用、血管内皮増殖因子の遺伝子(VEGF遺伝子)およびグルコース輸送体1(Glucose transporter-1:Glut−1)の遺伝子(Glut−1遺伝子)の発現誘導する作用があることを見出した。さらに、八味地黄丸の構成生薬の桂皮と牡丹皮がHIF−1αを増強することを確認した。
本発明の目的は、八味地黄丸の低酸素応答因子HIF−1αの増強作用を担う成分を特定し、さらに、特定された成分に類似する物質につき、低酸素応答因子HIF−1αの増強作用を確認することにより、それらを有効成分とする低酸素応答因子の増強剤およびそれらを用いる低酸素応答因子の増強方法を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、桂皮成分の桂皮酸およびシンナムアルデヒド、牡丹皮成分のペオノールがHIF−1αの増強作用を示す化学物質であること、桂皮酸およびシンナムアルデヒドが含まれる下記一般式[1]のフェニルプロペン誘導体およびペオノールが含まれる下記一般式[2]のフェノール誘導体が、HIF−1αの増強作用を有することを見出し、さらに桂皮、牡丹皮以外の生薬として川きゅう、丁字および天麻にもHIF−1αの増強作用を有することを見出し、本発明を完成した。
以下、本発明を詳細に説明する。
【0010】
本発明は、以下の有効成分として(a)〜(g)の1種以上を含有する低酸素応答因子の増強剤である。
(a)桂皮またはそのエキス
(b)牡丹皮またはそのエキス
(c)川きゅうまたはそのエキス
(d)丁字またはそのエキス
(e)天麻またはそのエキス
(f)一般式
【化1】

「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキル基を、それぞれ示す。」
で表されるフェニルプロペン誘導体。
(g)一般式
【化2】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
で表されるフェノール誘導体。
【0011】
また、本発明は、有効成分として上記の(a)〜(g)のいずれかまたはその組み合わせを利用した低酸素応答因子の増強方法である。
【0012】
本発明において、特に断らない限り、アルキル基とは、メチル、エチル、プロピル、イソプロピルなどC1-6アルキル基を;アルコキシ基とは、メトキシ、エトキシ、プロポキシ、イソプロポキシなどC1-6アルキルオキシ基を;アルキルオキシカルボニル基とは、メチルオキシカルボニル、エトキシ、プロポキシ、イソプロポキシなどC1-6アルキル−O−C(=O)基を;アルキルカルボニルオキシアルキルとは、アセチルオキシ、プロピオニルオキシ、イソブチリルオキシなどのC1-6アルキル−C(=O)−O基を;アルカノイル基とは、アセチル、プロピオニル、ブチリル、イソブチリル、バレリルなどC2-10アルキルカルボニル基を;それぞれ意味する。
【0013】
本発明において、「低酸素応答因子」とは、細胞に対する酸素供給が不足状態になった場合に誘導されてくる蛋白質であり、低酸素誘導因子HIF−1と称される転写因子である。好ましいものとしてHIF−1のサブユニットであるHIF−1αが挙げられる。
【0014】
また、本発明の「低酸素応答因子」が標的とする遺伝子は、VEGF遺伝子および/またはGlut−1遺伝子が挙げられる。
【0015】
本発明において、「低酸素応答因子増強剤」とは、上記「低酸素応答因子」である蛋白質の量を増加させる物質または作用を強める物質のことを意味する。
【発明の効果】
【0016】
上記の(a)〜(e)の生薬またはそれらのエキス、一般式[1]で表されるフェニルプロペン誘導体および上記一般式[2]で表されるフェノール誘導体は、低酸素培養下の尿細管上皮細胞において、HIF−1αの蛋白量を増加させる。従って、(a)〜(e)の生薬またはそれらのエキス並びに一般式[1]のフェニルプロペン誘導体および上記一般式[2]のフェノール誘導体またはそれらから選ばれる複数の化学物質の混合物(植物エキス、精油、樹脂を含む)は、低酸素応答因子増強剤として、低酸素応答機構が関与する、腎障害、脳血管障害、肝障害などの治療に用いることができる。
【図面の簡単な説明】
【0017】
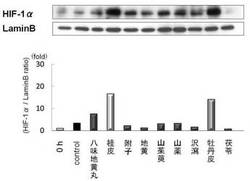
【図1】腎組織中における八味地黄丸のHIF−1α増加作用を示す図である。
【図2】八味地黄丸群おける低酸素関連遺伝子(VEGFおよびGLUT−1)のmRNAの増加を示す図である。
【図3】低酸素培養NRK−52Eにおける八味地黄丸のHIF−1αの増強作用を示す図である。
【図4】低酸素培養NRK−52Eにおける八味地黄丸の構成生薬のHIF−1αの増強示す図である。
【図5】低酸素培養NRK−52Eにおける川きゅう、丁字および天麻のHIF−1αの増強示す図である。
【図6】低酸素培養NRK−52Eにおけるフェニルプロペン誘導体(Cinnamaldehyde、Cinnamacid)、フェノール誘導体(Paeonol)のHIF−1αの増強示す図である。
【図7】低酸素培養NRK−52Eにおけるフェニルプロペン誘導体(Cinnamyl alcohol、Cinnamylacetate、Ferulic acid)、フェノール誘導体(Vanillin、Acetovanillone、Acetosyrigone)のHIF−1αの増強示す図である。
【図8】低酸素培養NRK−52Eにおけるフェノール誘導体(Eugenol、Ferulicadid)のHIF−1αの増強示す図である。
【発明を実施するための形態】
【0018】
本発明に使用されるフェニルプロペン誘導体は、以下の一般式[1]で表される。
【化3】

【0019】
「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキルを、それぞれ示す。」
【0020】
一般式[1]のフェニルプロペン誘導体の化合物として、例えば、桂皮酸、3-ヒドロキシけい皮酸、4-ヒドロキシけい皮酸、p-クマル酸、m-クマル酸、o-クマル酸、カフェー酸、カフェー酸メチル、カフェー酸ブチル、フェルラ酸、イソフェルラ酸、フェルラ酸メチル、シンナムアルデヒド、2-メトキシシンナムアルデヒド、桂皮アルコール、酢酸シンナミル、コニフェリルアルコール、アネトールなどが挙げられる。
上記したフェニルプロペン誘導体は、公知の有機合成方法に従って得られたもの、桂皮などの生薬またはフェニルプロペン誘導体を含有する植物から単離されたものを使用することができる。
【0021】
桂皮は、クスノキ科ニッケイ属のトンキンニッケイ(Cinnamomum cassia)、セイロンニッケイ(Cinnamomum
zeylanicum)またはニッケイ(Cinnamomum sieboldii)の樹皮を乾燥したものであればいずれであってもよいが、トンキンニッケイ(カシア)の樹皮を乾燥したものが好ましい。また、桂皮を粉末にしたケイヒ末を使用することができる。
【0022】
上記したフェニルプロペン誘導体を植物から得る方法としては、例えば、フェニルプロペン誘導体またはその混合物を含有する植物全体、葉、茎、樹皮根などの新鮮物または乾燥物を、有機溶媒(エタノールなどのアルコール類、アセトンなどのケトン類、エチルエーテルなどのエーテル類、酢酸エチルなどのエステル類、またはそれらの混合液)で抽出する、水または熱水での抽出する、含有機溶媒(前記有機溶媒に水を含有させたもの)で抽出する、液化炭酸ガスを用いて超臨界抽出するなどの方法が挙げられる。
【0023】
本発明で使用されるフェノール誘導体は、以下の一般式[2]で表される。
【化4】

【0024】
「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
【0025】
一般式[2]のフェノール誘導体は、例えば、以下の一般式[2a]、一般式[2b]、一般式[2c]のフェノール誘導体が含まれる。
【0026】
【化5】

「式中、R5は、アルコキシ基;R6aは、アシル基を、それぞれ示す。」
【0027】
【化6】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6aは、アルカノイル基を、それぞれ示す。」
【0028】
【化7】

「式中、R5は、アルコキシ基;R6bは、ホルミル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
【0029】
一般式[2a]のフェノール誘導体の具体的な化合物として、例えば、ペオノール(Peonol)、2‐ヒドロキシ‐4‐メトキシベンゾフェノンなどが挙げられる。
ペオノールは、公知の有機合成方法に従って得られたもの、牡丹皮などの生薬またはボタンなどペオノールを含有する植物から単離されたものを使用することができる。
【0030】
牡丹皮は、ボタン科ボタン属ボタン(Paeonia
suffruticosa)の根皮である。また、牡丹皮を粉末にしたボタンピ末を使用することができる。
【0031】
ボタン以外にペオノールを含有する植物として、ペオニア・スッフルチコーサ(Paeonia suffruticosa:ボタン)、ペオニア・ラクチフローラ(Paeonia
lactiflora:シャクヤク)、ペオニア・ベイチー(Paeonia veitchii:中国大輪ヤマシャクヤク)、ペオニア・オボバタ(Paeonia obovata: 紅花ヤマシャクヤク)などのボタン科ボタン属の植物;グリキリザ・グラブラ(Glycyrrhiza glabra:カンゾウ)などのマメ科カンゾウ属の植物;キナンクム・パニクラツム(Cynanchum panniculatum:スズサイコ)などのガガイモ科カモメヅル属の植物;レウム・パルマツム(Rheum palmatum:タングートダイオウ)などのタデ科ダイオウ属の植物;スクテラリア・バイカレンシス(Scutellaria baicalensis:コガネバナ)などのシソ科タツナミ属の植物などが挙げられる。
【0032】
一般式[2b]のフェノール誘導体の具体的な化合物として、例えば、アポシニン(Apocynin)、アセトシリンゴン(Acetosyringone)が挙げられる。
アポシニンは、公知の有機合成方法に従って得られたもの、胡黄連などの生薬またはラフマなどアポシニンを含有する植物から単離されたものを使用することができる。
アセトシリンゴンは、公知の有機合成方法に従って得られたもの、アセトシリンゴンを含有する植物から単離されたものを使用することができる。
【0033】
アポシニンを含有する植物として、例えば、ピクロリザ・クロア(Picrorhiza
kurrooa)などのゴマノハグサ科コオウレン属の植物:アポシナム・カンナビニウム(Apocynum
cannabinum:アメリカアサ)、アポシナム・ベネタム(Apocynum venetum: ラフマ)、アポシナム・アンドロサエミフォリウム(Apocynum androsaemifolium)などのキョウチクトウ科バシクルモン属の植物:バニラ・プラニフォリア(Vanilla planifolia:バニラ)などが挙げられる。
【0034】
一般式[2c]のフェノール誘導体の具体的な化合物として、例えば、バニリン(Vanillin)、バニルアルコール(Vanillyl alcohol)、オイゲノール(Eugenol)などが挙げられる。
バニリン(Vanillin)は、オイゲノールを原料とした合成、天麻、川きゅうなどの生薬またはバニラなどの植物から単離されたものを使用することができる。
バニルアルコール(Vanillyl alcohol)は、公知の有機合成方法に従って得られたもの、天麻などの生薬から単離されたものを使用することができる。
【0035】
オイゲノールは、精油から公知の方法に従って精製することにより得られた天然物であっても、公知の有機合成方法に従って得られたものであってもよい。オイゲノールを含有する精油は、例えば、クスノキ科のニッケイ(Cinnamomum zeylanicum)の葉から得られるシナモンリーフ油(Cinnamonleaf
oil)、フトモモ科のチョウジ(Eugenia caryophllata)から得られるクローブ油(Clove oil)、フトモモ科のピメンタ(Pimenta officinalis)から得られるピメンタ油(Pimenta oil)、フトモモ科のベイ(Pimenta racemosa)から得られるベイ油(Bay oil)が挙げられる。
【0036】
上記したフェノール誘導体を植物から得る方法としては、例えば、フェノール誘導体を含有する植物全体、葉、茎、樹皮根などの新鮮物または乾燥物を、有機溶媒(エタノールなどのアルコール類、アセトンなどのケトン類、エチルエーテルなどのエーテル類、酢酸エチルなどのエステル類、またはそれらの混合液)で抽出する、水または熱水で抽出する、含有機溶媒(前記有機溶媒に水を含有させたもの)で抽出する、液化炭酸ガスを用て超臨界抽出するなどの方法が挙げられる。
【0037】
本発明の低酸素応答因子増強剤は、生薬として漢方処方に配合するか、または、賦形剤、補助剤、添加剤などと組み合わせ、各種の医薬製剤、例えば、液剤、懸濁剤、シロップ剤、エリキシル剤、エキス剤、散剤、顆粒剤、細粒剤、錠剤、カプセル剤とすることができる。
【0038】
桂皮および牡丹皮を低酸素応答因子の増強剤として使用する場合、それらの配合比、含量などは特に限定されないが、例えば、八味地黄丸として処方する場合、生薬の比率は、桂皮1.0、 牡丹皮3.0、地黄6.0, 山茱萸3.0, 山薬3.0, 沢瀉3.0,茯苓3.0,附子0.5である。
【0039】
本発明の低酸素応答因子増強剤は、低酸素応答機構が関与する、腎障害、脳血管障害、肝障害などの治療に用いることができるが、腎不全の治療薬として用いることが好ましい。
【0040】
本発明の低酸素応答因子増強剤は、そのまま、または種々の栄養成分を加えて、食品・飲料の添加物として使用することができる。また、そのまま、または種々の栄養成分を加えて、顆粒状、粒状、ペースト状の形態の食品あるいは飲料とすることができる。
【実施例】
【0041】
以下、本発明を製造例、試験例で説明するが、本発明はこれらにより限定されるものではない。
八味地黄丸(地黄6.0, 山茱萸3.0, 山薬3.0, 沢瀉3.0,茯苓3.0, 牡丹皮3.0, 桂皮1.0,附子0.5)は、株式会社ツムラのエキス原末を使用した。
【0042】
製造例(生薬エキスの製造)
富山大学和漢薬研究所生薬ライブラリーから入手した生薬約45gを秤量した後、20倍量の水(900mL)を加え、煎じ器(ウチダ和漢薬製)を用いて抽出を行った。溶媒が沸騰するまで強火で加熱し(10〜15分)、その後トロ火で1時間加熱を行った。20〜30分間放置した後、綿栓濾過を行い、ろ液を得た。残渣に水800mLを加え同様の操作を行い,1回目のろ液に合わせた。ろ液は凍結乾燥により乾燥させた。乾燥物は4℃で保管した。
【0043】
試験例1
(生体試料調製)
体重260〜280gの雄のSprague-Dawleyラットを使用した。ラットは、7日間試験飼育の後、7日間の間隔で左腎2/3摘出と右腎全摘出をおこなった。1グループは正常対照群として疑似手術のみおこなった(ノーマル群)。腎摘群は対照群、低用量八味地黄丸群、高用量八味地黄丸群、Candesartan (ARB)群の10匹ずつに分けた。手術施行後5群の動物を7日間蒸留水投与で飼育し、血圧、体重測定、採血、採尿を実施した(9週齢)。その後、7日間、通常飼料と自由飲水で飼育し、低用量八味地黄丸群には220 mg/kg/day、高用量八味地黄丸群には660 mg/kg/dayの八味地黄丸を、胃管を用いて連日投与した。また、Candesartan群には3 mg/kg/dayのCandesartanを同様に投与した。採血は尾静脈から各々の薬物投与開始時と1週間後に実施した。また、採尿も同時期に実施した。実験終了時に、心臓採血により血液を採取し、腎臓を脱血して取りだし解析まで-80℃で凍結保存した。
【0044】
(細胞培養)
ラット近位尿細管上皮細胞(NRK-52E)をダルベッコ変法イーグル培地(Dulbecco’s modified Eagle’s medium;GIBCO,USA)を5%ウシ胎児血清 (fetal bovine serum;ICN
Biomedicals,USA)、1%非必須アミノ酸(Non-Essential
Amino Acids;GIBCO,USA)、100units/ml ペニシリン、100μg/ml ストレプトマイシンにて培養した。
各試料の細胞への添加濃度は、細胞増殖試薬WST-1(GIBCO, USA)により毒性の無いことを確認できた100μg/mlとした。低酸素培養は、94%窒素、5%二酸化炭素、1%酸素で行った。
【0045】
(VEGFおよびGLUT−1の測定)
腎組織からのtotal RNAの抽出および生成はRNeasy Mini kit (QIAGEN).を使用した。精製したtotal RNAに対してoligo dTプライマーを添加し、70℃で10分間の熱処理の後、4℃において5分以上急冷した。スーパースクリプト II 逆転写酵素(SuperScript II reverse transcriptase
;Invitrogen,USA)を用いた逆転写反応(42℃、50分間の後70℃、15分間)を行いcDNAを合成した。cDNAは各遺伝子に対するプライマーおよびSYBR Green I検出によるリアルタイムPCR専用のプレミックス試薬(SYBR Premix Ex Taq;タカラバイオ,日本)を用いて定量的に増幅を行い、PCR装置(Prism
7300 sequence detection system;Applied Biosystems, USA)を使用したリアルタイムRT-PCRを行った。なお、実験データは全てβ-actin mRNA量によって補正した。
【0046】
(HIFの測定)
サンプルをSDS-ポリアクリルアミドゲル(7.5%)にて電気泳動(30mA)した。ゲル内の蛋白質をメンブレンに転写(126mA、100min)した後、メンブレンをブロックエース(大日本製薬)でブロッキングした。抗HIF−1α抗体を10000倍で加え、24時間反応させた後、PBS-T (Phosphate Buffered Saline with Tween)で10分間の洗浄を3回行った。その後、2次抗体(HRP conjugated anti-mouse IgG)を2000倍希釈で加え、1時間反応させた。同様に洗浄した後、ECL Plusウェスタンブロッティング検出システム (GE healthcare)で発光させてX線フィルムを感光した。抗体の希釈溶液にはCanGetSignal(東洋紡)を用いた。
なお、抗HIF-1α(H1alpha67)抗体はabcam社製、抗LaminB(C-20)抗体はSanta Cruz Biotechnology社製を用いた。
【0047】
(結果1)
腎組織中のHIF−1αは、ノーマル群に比べて腎摘群はいずれも有意な上昇を認めた。さらに高用量八味地黄丸群は対照群に対しても有意な上昇を認めた(図1)。
VEGFは、ノーマル群に比べて、高用量八味地黄丸群において有意に上昇しており、対照群に比べても有意な上昇を認めた。GLUT−1はノーマル群に比べて、高用量八味地黄丸群において有意に上昇した(図2)。
尿細管上皮細胞に八味地黄丸ならびに構成生薬を添加し低酸素培養をした結果、八味地黄丸と構成生薬である桂皮、牡丹皮がHIF−1αの蛋白量の増加作用を示した(図3、図4)。
尿細管上皮細胞に、上記の生薬エキスの製造方法により調製した川きゅう、丁字、天麻の各エキスを添加(濃度100μg/mL)し、低酸素培養をした結果、各エキスは、HIF−1αの蛋白量の増加作用を示した(図5)。
【0048】
(結果2)
(1)尿細管上皮細胞に桂皮酸、シンナムアルデヒド、ペオノール、ペオニフロリン、エピガロカテキンを添加(濃度10μg/mL)し、低酸素培養をした結果、桂皮酸、シンナミルアルデヒド、ペオノールがHIF−1αの蛋白量の増加作用を示した(図6)。
(2)尿細管上皮細胞に桂皮アルコール、酢酸シンナミル、フェルラ酸、バニリン、アポシニン、アセトシリゴンを添加(濃度10μg/mL)し、低酸素培養をした結果、いずれの化合物もHIF−1αの蛋白量の増加作用を示した(図7)。
(3)尿細管上皮細胞にオイゲノール、バニルアルコールを添加(濃度10μg/mL)し、低酸素培養をした結果、いずれの化合物もHIF−1αの蛋白量の増加作用を示した(図8)。
【産業上の利用可能性】
【0049】
桂皮、牡丹皮、川きゅう、丁字および天麻は、HIF−αの増強作用を有し、慢性腎臓病のなどの低酸素応答因子が関与する疾患の予防・治療薬の成分として有用である。また、桂皮酸、シンナムアルデヒド、桂皮アルコール、酢酸シンナミル、フェルラ酸の含む一般式[1]のフェニルプロペン誘導体およびペオノール、バニリン、バニルアルコール、アポシニン、アセトシリゴン、オイゲノールを含む一般式[2]のフェノール誘導体は、HIF−αの増強作用を有し、慢性腎臓病のなどの低酸素応答因子が関与する疾患の予防・治療薬の成分として有用である。
【技術分野】
【0001】
本発明は、低酸素応答因子、特に、低酸素誘導因子HIF−1α(Hypoxia-Inducible Factor-1α)を増強するフェニルプロペン誘導体およびフェニルプロペン誘導体が含まれる植物エキス・生薬・生薬エキスを含有する低酸素応答因子の増強剤並びにフェニルプロペン誘導体およびフェニルプロペン誘導体が含まれ植物エキス・生薬・生薬エキスを用いることを特徴とする低酸素応答因子、特にHIF−1αの増強方法に関する。
【背景技術】
【0002】
透析患者や末期腎不全患者などの腎疾患患者は、アンジオテンシンII受容体拮抗薬 (AngiotensinII Receptor Blocker:ARB)などの薬剤、蛋白制限、腎移植などの治療方法の進歩にかかわらず世界中で増加してきている。このような腎疾患の有病率や死亡率の増加に対して新たな治療薬の開発が望まれている。
腎機能低下の進展に、動脈硬化、炎症、レニン・アンジオテンシン系、酸化ストレスなど多くの因子が関与していることが報告されているが、近年、慢性腎臓病の最終共通経路(final common pathway)として、慢性低酸素状態の関与が着目されている。
【0003】
一方、低酸素によって活性化される転写因子は、低酸素誘導因子−1(Hypoxia- inducible factor-1:HIF−1)とも称され、HIF−1αとβサブユニットからなるヘテロ二量体であり、グルコース輸送蛋白、血管内皮増殖因子(Vascular Endothelial Growth Factor:VEGF)などの遺伝子の発現を転写レベルで制御し、細胞から組織・個体にいたる全てのレベルの低酸素適応を制御している。
HIF−1αの活性化方法・活性化物質に関して、2−オキソ酸(ピルビン酸、オキサロ酢酸、ケトイソ吉草酸など)によるHIF−1遺伝子発現の活性化方法(特許文献1)、アルギニンを有効成分とする低酸素応答亢進剤(特許文献2)、ロイシン、イソロシン、バリンまたはそれらの混合物を含有する低酸素応答促進剤(特許文献3)、カルジオリド及びブファジエノリド化合物(特許文献4)などが知られている。
【0004】
他方、八味地黄丸は、約2千年前に作られた漢方薬で地黄、山薬、山茱萸、牡丹皮、茯苓、沢瀉、桂皮、附子の8種類の生薬から構成されている。臨床的には、腰痛、頻尿、冷え性など多くの症状に用いられてきた。また、慢性腎不全に伴う全身倦怠感、浮腫などにも使用され、慢性腎臓病に対しても使用されている。
八味地黄丸に関する基礎研究では、腎摘モデル(非特許文献1)や糖尿病性腎症モデル(非特許文献2)に対する腎機能低下抑制作用が報告されている。
【0005】
5/6腎摘モデル(以下腎摘モデル)は進行性腎疾患の典型的モデルである。このモデルの初期変化は、糸球体高濾過と高血圧を生じる輸出小動脈の相対的拡張低下を伴う腎内血管拡張からなるが、本モデルの腎機能の悪化は、初期の血流の変化による慢性の組織低酸素が腎不全進展の要因とする報告が近年なされている(非特許文献3)。さらに、低酸素により誘導される低酸素誘導因子の活性化が、本モデルの腎機能保護作用を誘導することが報告されている(非特許文献4)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特表2007-510734
【特許文献2】再表2006-552951
【特許文献3】特開2008-056566
【特許文献4】特表2009-522383
【非特許文献】
【0007】
【非特許文献1】J Pharm Pharmacol 57:1637-1644, 2005.
【非特許文献2】J Pharm Pharmacol 57:1205-1212, 2005.
【非特許文献3】J Am Soc Nephrol 15:1277-1288, 2004.
【非特許文献4】J Am Soc Nephrol 14: 1825-1832, 2003.
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明者らは、進行性腎疾患の典型的モデルである5/6腎摘モデルを用いて、八味地黄丸に、低酸素応答因子HIF−1α(Hypoxia-Inducible Factor-1α)の増強作用、血管内皮増殖因子の遺伝子(VEGF遺伝子)およびグルコース輸送体1(Glucose transporter-1:Glut−1)の遺伝子(Glut−1遺伝子)の発現誘導する作用があることを見出した。さらに、八味地黄丸の構成生薬の桂皮と牡丹皮がHIF−1αを増強することを確認した。
本発明の目的は、八味地黄丸の低酸素応答因子HIF−1αの増強作用を担う成分を特定し、さらに、特定された成分に類似する物質につき、低酸素応答因子HIF−1αの増強作用を確認することにより、それらを有効成分とする低酸素応答因子の増強剤およびそれらを用いる低酸素応答因子の増強方法を提供することである。
【課題を解決するための手段】
【0009】
本発明者らは、桂皮成分の桂皮酸およびシンナムアルデヒド、牡丹皮成分のペオノールがHIF−1αの増強作用を示す化学物質であること、桂皮酸およびシンナムアルデヒドが含まれる下記一般式[1]のフェニルプロペン誘導体およびペオノールが含まれる下記一般式[2]のフェノール誘導体が、HIF−1αの増強作用を有することを見出し、さらに桂皮、牡丹皮以外の生薬として川きゅう、丁字および天麻にもHIF−1αの増強作用を有することを見出し、本発明を完成した。
以下、本発明を詳細に説明する。
【0010】
本発明は、以下の有効成分として(a)〜(g)の1種以上を含有する低酸素応答因子の増強剤である。
(a)桂皮またはそのエキス
(b)牡丹皮またはそのエキス
(c)川きゅうまたはそのエキス
(d)丁字またはそのエキス
(e)天麻またはそのエキス
(f)一般式
【化1】

「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキル基を、それぞれ示す。」
で表されるフェニルプロペン誘導体。
(g)一般式
【化2】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
で表されるフェノール誘導体。
【0011】
また、本発明は、有効成分として上記の(a)〜(g)のいずれかまたはその組み合わせを利用した低酸素応答因子の増強方法である。
【0012】
本発明において、特に断らない限り、アルキル基とは、メチル、エチル、プロピル、イソプロピルなどC1-6アルキル基を;アルコキシ基とは、メトキシ、エトキシ、プロポキシ、イソプロポキシなどC1-6アルキルオキシ基を;アルキルオキシカルボニル基とは、メチルオキシカルボニル、エトキシ、プロポキシ、イソプロポキシなどC1-6アルキル−O−C(=O)基を;アルキルカルボニルオキシアルキルとは、アセチルオキシ、プロピオニルオキシ、イソブチリルオキシなどのC1-6アルキル−C(=O)−O基を;アルカノイル基とは、アセチル、プロピオニル、ブチリル、イソブチリル、バレリルなどC2-10アルキルカルボニル基を;それぞれ意味する。
【0013】
本発明において、「低酸素応答因子」とは、細胞に対する酸素供給が不足状態になった場合に誘導されてくる蛋白質であり、低酸素誘導因子HIF−1と称される転写因子である。好ましいものとしてHIF−1のサブユニットであるHIF−1αが挙げられる。
【0014】
また、本発明の「低酸素応答因子」が標的とする遺伝子は、VEGF遺伝子および/またはGlut−1遺伝子が挙げられる。
【0015】
本発明において、「低酸素応答因子増強剤」とは、上記「低酸素応答因子」である蛋白質の量を増加させる物質または作用を強める物質のことを意味する。
【発明の効果】
【0016】
上記の(a)〜(e)の生薬またはそれらのエキス、一般式[1]で表されるフェニルプロペン誘導体および上記一般式[2]で表されるフェノール誘導体は、低酸素培養下の尿細管上皮細胞において、HIF−1αの蛋白量を増加させる。従って、(a)〜(e)の生薬またはそれらのエキス並びに一般式[1]のフェニルプロペン誘導体および上記一般式[2]のフェノール誘導体またはそれらから選ばれる複数の化学物質の混合物(植物エキス、精油、樹脂を含む)は、低酸素応答因子増強剤として、低酸素応答機構が関与する、腎障害、脳血管障害、肝障害などの治療に用いることができる。
【図面の簡単な説明】
【0017】
【図1】腎組織中における八味地黄丸のHIF−1α増加作用を示す図である。
【図2】八味地黄丸群おける低酸素関連遺伝子(VEGFおよびGLUT−1)のmRNAの増加を示す図である。
【図3】低酸素培養NRK−52Eにおける八味地黄丸のHIF−1αの増強作用を示す図である。
【図4】低酸素培養NRK−52Eにおける八味地黄丸の構成生薬のHIF−1αの増強示す図である。
【図5】低酸素培養NRK−52Eにおける川きゅう、丁字および天麻のHIF−1αの増強示す図である。
【図6】低酸素培養NRK−52Eにおけるフェニルプロペン誘導体(Cinnamaldehyde、Cinnamacid)、フェノール誘導体(Paeonol)のHIF−1αの増強示す図である。
【図7】低酸素培養NRK−52Eにおけるフェニルプロペン誘導体(Cinnamyl alcohol、Cinnamylacetate、Ferulic acid)、フェノール誘導体(Vanillin、Acetovanillone、Acetosyrigone)のHIF−1αの増強示す図である。
【図8】低酸素培養NRK−52Eにおけるフェノール誘導体(Eugenol、Ferulicadid)のHIF−1αの増強示す図である。
【発明を実施するための形態】
【0018】
本発明に使用されるフェニルプロペン誘導体は、以下の一般式[1]で表される。
【化3】

【0019】
「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキルを、それぞれ示す。」
【0020】
一般式[1]のフェニルプロペン誘導体の化合物として、例えば、桂皮酸、3-ヒドロキシけい皮酸、4-ヒドロキシけい皮酸、p-クマル酸、m-クマル酸、o-クマル酸、カフェー酸、カフェー酸メチル、カフェー酸ブチル、フェルラ酸、イソフェルラ酸、フェルラ酸メチル、シンナムアルデヒド、2-メトキシシンナムアルデヒド、桂皮アルコール、酢酸シンナミル、コニフェリルアルコール、アネトールなどが挙げられる。
上記したフェニルプロペン誘導体は、公知の有機合成方法に従って得られたもの、桂皮などの生薬またはフェニルプロペン誘導体を含有する植物から単離されたものを使用することができる。
【0021】
桂皮は、クスノキ科ニッケイ属のトンキンニッケイ(Cinnamomum cassia)、セイロンニッケイ(Cinnamomum
zeylanicum)またはニッケイ(Cinnamomum sieboldii)の樹皮を乾燥したものであればいずれであってもよいが、トンキンニッケイ(カシア)の樹皮を乾燥したものが好ましい。また、桂皮を粉末にしたケイヒ末を使用することができる。
【0022】
上記したフェニルプロペン誘導体を植物から得る方法としては、例えば、フェニルプロペン誘導体またはその混合物を含有する植物全体、葉、茎、樹皮根などの新鮮物または乾燥物を、有機溶媒(エタノールなどのアルコール類、アセトンなどのケトン類、エチルエーテルなどのエーテル類、酢酸エチルなどのエステル類、またはそれらの混合液)で抽出する、水または熱水での抽出する、含有機溶媒(前記有機溶媒に水を含有させたもの)で抽出する、液化炭酸ガスを用いて超臨界抽出するなどの方法が挙げられる。
【0023】
本発明で使用されるフェノール誘導体は、以下の一般式[2]で表される。
【化4】

【0024】
「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
【0025】
一般式[2]のフェノール誘導体は、例えば、以下の一般式[2a]、一般式[2b]、一般式[2c]のフェノール誘導体が含まれる。
【0026】
【化5】

「式中、R5は、アルコキシ基;R6aは、アシル基を、それぞれ示す。」
【0027】
【化6】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6aは、アルカノイル基を、それぞれ示す。」
【0028】
【化7】

「式中、R5は、アルコキシ基;R6bは、ホルミル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
【0029】
一般式[2a]のフェノール誘導体の具体的な化合物として、例えば、ペオノール(Peonol)、2‐ヒドロキシ‐4‐メトキシベンゾフェノンなどが挙げられる。
ペオノールは、公知の有機合成方法に従って得られたもの、牡丹皮などの生薬またはボタンなどペオノールを含有する植物から単離されたものを使用することができる。
【0030】
牡丹皮は、ボタン科ボタン属ボタン(Paeonia
suffruticosa)の根皮である。また、牡丹皮を粉末にしたボタンピ末を使用することができる。
【0031】
ボタン以外にペオノールを含有する植物として、ペオニア・スッフルチコーサ(Paeonia suffruticosa:ボタン)、ペオニア・ラクチフローラ(Paeonia
lactiflora:シャクヤク)、ペオニア・ベイチー(Paeonia veitchii:中国大輪ヤマシャクヤク)、ペオニア・オボバタ(Paeonia obovata: 紅花ヤマシャクヤク)などのボタン科ボタン属の植物;グリキリザ・グラブラ(Glycyrrhiza glabra:カンゾウ)などのマメ科カンゾウ属の植物;キナンクム・パニクラツム(Cynanchum panniculatum:スズサイコ)などのガガイモ科カモメヅル属の植物;レウム・パルマツム(Rheum palmatum:タングートダイオウ)などのタデ科ダイオウ属の植物;スクテラリア・バイカレンシス(Scutellaria baicalensis:コガネバナ)などのシソ科タツナミ属の植物などが挙げられる。
【0032】
一般式[2b]のフェノール誘導体の具体的な化合物として、例えば、アポシニン(Apocynin)、アセトシリンゴン(Acetosyringone)が挙げられる。
アポシニンは、公知の有機合成方法に従って得られたもの、胡黄連などの生薬またはラフマなどアポシニンを含有する植物から単離されたものを使用することができる。
アセトシリンゴンは、公知の有機合成方法に従って得られたもの、アセトシリンゴンを含有する植物から単離されたものを使用することができる。
【0033】
アポシニンを含有する植物として、例えば、ピクロリザ・クロア(Picrorhiza
kurrooa)などのゴマノハグサ科コオウレン属の植物:アポシナム・カンナビニウム(Apocynum
cannabinum:アメリカアサ)、アポシナム・ベネタム(Apocynum venetum: ラフマ)、アポシナム・アンドロサエミフォリウム(Apocynum androsaemifolium)などのキョウチクトウ科バシクルモン属の植物:バニラ・プラニフォリア(Vanilla planifolia:バニラ)などが挙げられる。
【0034】
一般式[2c]のフェノール誘導体の具体的な化合物として、例えば、バニリン(Vanillin)、バニルアルコール(Vanillyl alcohol)、オイゲノール(Eugenol)などが挙げられる。
バニリン(Vanillin)は、オイゲノールを原料とした合成、天麻、川きゅうなどの生薬またはバニラなどの植物から単離されたものを使用することができる。
バニルアルコール(Vanillyl alcohol)は、公知の有機合成方法に従って得られたもの、天麻などの生薬から単離されたものを使用することができる。
【0035】
オイゲノールは、精油から公知の方法に従って精製することにより得られた天然物であっても、公知の有機合成方法に従って得られたものであってもよい。オイゲノールを含有する精油は、例えば、クスノキ科のニッケイ(Cinnamomum zeylanicum)の葉から得られるシナモンリーフ油(Cinnamonleaf
oil)、フトモモ科のチョウジ(Eugenia caryophllata)から得られるクローブ油(Clove oil)、フトモモ科のピメンタ(Pimenta officinalis)から得られるピメンタ油(Pimenta oil)、フトモモ科のベイ(Pimenta racemosa)から得られるベイ油(Bay oil)が挙げられる。
【0036】
上記したフェノール誘導体を植物から得る方法としては、例えば、フェノール誘導体を含有する植物全体、葉、茎、樹皮根などの新鮮物または乾燥物を、有機溶媒(エタノールなどのアルコール類、アセトンなどのケトン類、エチルエーテルなどのエーテル類、酢酸エチルなどのエステル類、またはそれらの混合液)で抽出する、水または熱水で抽出する、含有機溶媒(前記有機溶媒に水を含有させたもの)で抽出する、液化炭酸ガスを用て超臨界抽出するなどの方法が挙げられる。
【0037】
本発明の低酸素応答因子増強剤は、生薬として漢方処方に配合するか、または、賦形剤、補助剤、添加剤などと組み合わせ、各種の医薬製剤、例えば、液剤、懸濁剤、シロップ剤、エリキシル剤、エキス剤、散剤、顆粒剤、細粒剤、錠剤、カプセル剤とすることができる。
【0038】
桂皮および牡丹皮を低酸素応答因子の増強剤として使用する場合、それらの配合比、含量などは特に限定されないが、例えば、八味地黄丸として処方する場合、生薬の比率は、桂皮1.0、 牡丹皮3.0、地黄6.0, 山茱萸3.0, 山薬3.0, 沢瀉3.0,茯苓3.0,附子0.5である。
【0039】
本発明の低酸素応答因子増強剤は、低酸素応答機構が関与する、腎障害、脳血管障害、肝障害などの治療に用いることができるが、腎不全の治療薬として用いることが好ましい。
【0040】
本発明の低酸素応答因子増強剤は、そのまま、または種々の栄養成分を加えて、食品・飲料の添加物として使用することができる。また、そのまま、または種々の栄養成分を加えて、顆粒状、粒状、ペースト状の形態の食品あるいは飲料とすることができる。
【実施例】
【0041】
以下、本発明を製造例、試験例で説明するが、本発明はこれらにより限定されるものではない。
八味地黄丸(地黄6.0, 山茱萸3.0, 山薬3.0, 沢瀉3.0,茯苓3.0, 牡丹皮3.0, 桂皮1.0,附子0.5)は、株式会社ツムラのエキス原末を使用した。
【0042】
製造例(生薬エキスの製造)
富山大学和漢薬研究所生薬ライブラリーから入手した生薬約45gを秤量した後、20倍量の水(900mL)を加え、煎じ器(ウチダ和漢薬製)を用いて抽出を行った。溶媒が沸騰するまで強火で加熱し(10〜15分)、その後トロ火で1時間加熱を行った。20〜30分間放置した後、綿栓濾過を行い、ろ液を得た。残渣に水800mLを加え同様の操作を行い,1回目のろ液に合わせた。ろ液は凍結乾燥により乾燥させた。乾燥物は4℃で保管した。
【0043】
試験例1
(生体試料調製)
体重260〜280gの雄のSprague-Dawleyラットを使用した。ラットは、7日間試験飼育の後、7日間の間隔で左腎2/3摘出と右腎全摘出をおこなった。1グループは正常対照群として疑似手術のみおこなった(ノーマル群)。腎摘群は対照群、低用量八味地黄丸群、高用量八味地黄丸群、Candesartan (ARB)群の10匹ずつに分けた。手術施行後5群の動物を7日間蒸留水投与で飼育し、血圧、体重測定、採血、採尿を実施した(9週齢)。その後、7日間、通常飼料と自由飲水で飼育し、低用量八味地黄丸群には220 mg/kg/day、高用量八味地黄丸群には660 mg/kg/dayの八味地黄丸を、胃管を用いて連日投与した。また、Candesartan群には3 mg/kg/dayのCandesartanを同様に投与した。採血は尾静脈から各々の薬物投与開始時と1週間後に実施した。また、採尿も同時期に実施した。実験終了時に、心臓採血により血液を採取し、腎臓を脱血して取りだし解析まで-80℃で凍結保存した。
【0044】
(細胞培養)
ラット近位尿細管上皮細胞(NRK-52E)をダルベッコ変法イーグル培地(Dulbecco’s modified Eagle’s medium;GIBCO,USA)を5%ウシ胎児血清 (fetal bovine serum;ICN
Biomedicals,USA)、1%非必須アミノ酸(Non-Essential
Amino Acids;GIBCO,USA)、100units/ml ペニシリン、100μg/ml ストレプトマイシンにて培養した。
各試料の細胞への添加濃度は、細胞増殖試薬WST-1(GIBCO, USA)により毒性の無いことを確認できた100μg/mlとした。低酸素培養は、94%窒素、5%二酸化炭素、1%酸素で行った。
【0045】
(VEGFおよびGLUT−1の測定)
腎組織からのtotal RNAの抽出および生成はRNeasy Mini kit (QIAGEN).を使用した。精製したtotal RNAに対してoligo dTプライマーを添加し、70℃で10分間の熱処理の後、4℃において5分以上急冷した。スーパースクリプト II 逆転写酵素(SuperScript II reverse transcriptase
;Invitrogen,USA)を用いた逆転写反応(42℃、50分間の後70℃、15分間)を行いcDNAを合成した。cDNAは各遺伝子に対するプライマーおよびSYBR Green I検出によるリアルタイムPCR専用のプレミックス試薬(SYBR Premix Ex Taq;タカラバイオ,日本)を用いて定量的に増幅を行い、PCR装置(Prism
7300 sequence detection system;Applied Biosystems, USA)を使用したリアルタイムRT-PCRを行った。なお、実験データは全てβ-actin mRNA量によって補正した。
【0046】
(HIFの測定)
サンプルをSDS-ポリアクリルアミドゲル(7.5%)にて電気泳動(30mA)した。ゲル内の蛋白質をメンブレンに転写(126mA、100min)した後、メンブレンをブロックエース(大日本製薬)でブロッキングした。抗HIF−1α抗体を10000倍で加え、24時間反応させた後、PBS-T (Phosphate Buffered Saline with Tween)で10分間の洗浄を3回行った。その後、2次抗体(HRP conjugated anti-mouse IgG)を2000倍希釈で加え、1時間反応させた。同様に洗浄した後、ECL Plusウェスタンブロッティング検出システム (GE healthcare)で発光させてX線フィルムを感光した。抗体の希釈溶液にはCanGetSignal(東洋紡)を用いた。
なお、抗HIF-1α(H1alpha67)抗体はabcam社製、抗LaminB(C-20)抗体はSanta Cruz Biotechnology社製を用いた。
【0047】
(結果1)
腎組織中のHIF−1αは、ノーマル群に比べて腎摘群はいずれも有意な上昇を認めた。さらに高用量八味地黄丸群は対照群に対しても有意な上昇を認めた(図1)。
VEGFは、ノーマル群に比べて、高用量八味地黄丸群において有意に上昇しており、対照群に比べても有意な上昇を認めた。GLUT−1はノーマル群に比べて、高用量八味地黄丸群において有意に上昇した(図2)。
尿細管上皮細胞に八味地黄丸ならびに構成生薬を添加し低酸素培養をした結果、八味地黄丸と構成生薬である桂皮、牡丹皮がHIF−1αの蛋白量の増加作用を示した(図3、図4)。
尿細管上皮細胞に、上記の生薬エキスの製造方法により調製した川きゅう、丁字、天麻の各エキスを添加(濃度100μg/mL)し、低酸素培養をした結果、各エキスは、HIF−1αの蛋白量の増加作用を示した(図5)。
【0048】
(結果2)
(1)尿細管上皮細胞に桂皮酸、シンナムアルデヒド、ペオノール、ペオニフロリン、エピガロカテキンを添加(濃度10μg/mL)し、低酸素培養をした結果、桂皮酸、シンナミルアルデヒド、ペオノールがHIF−1αの蛋白量の増加作用を示した(図6)。
(2)尿細管上皮細胞に桂皮アルコール、酢酸シンナミル、フェルラ酸、バニリン、アポシニン、アセトシリゴンを添加(濃度10μg/mL)し、低酸素培養をした結果、いずれの化合物もHIF−1αの蛋白量の増加作用を示した(図7)。
(3)尿細管上皮細胞にオイゲノール、バニルアルコールを添加(濃度10μg/mL)し、低酸素培養をした結果、いずれの化合物もHIF−1αの蛋白量の増加作用を示した(図8)。
【産業上の利用可能性】
【0049】
桂皮、牡丹皮、川きゅう、丁字および天麻は、HIF−αの増強作用を有し、慢性腎臓病のなどの低酸素応答因子が関与する疾患の予防・治療薬の成分として有用である。また、桂皮酸、シンナムアルデヒド、桂皮アルコール、酢酸シンナミル、フェルラ酸の含む一般式[1]のフェニルプロペン誘導体およびペオノール、バニリン、バニルアルコール、アポシニン、アセトシリゴン、オイゲノールを含む一般式[2]のフェノール誘導体は、HIF−αの増強作用を有し、慢性腎臓病のなどの低酸素応答因子が関与する疾患の予防・治療薬の成分として有用である。
【特許請求の範囲】
【請求項1】
有効成分として(a)〜(g)から選ばれる1種以上を含有する低酸素応答因子の増強剤。
(a)桂皮またはそのエキス、(b)牡丹皮またはそのエキス、(c)川きゅうまたはそのエキス、(d)丁字またはそのエキス、(e)天麻またはそのエキス
(f)一般式
【化1】

「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキル基を、それぞれ示す。」
で表されるフェニルプロペン誘導体。
(g)一般式
【化2】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
で表されるフェノール誘導体。
【請求項2】
有効成分が、(a)〜(e)から選ばれる1種以上の生薬または生薬エキスである請求項1の低酸素応答因子の増強剤。
【請求項3】
有効成分が(f)フェニルプロペン誘導体および/または(g)フェノール誘導体である請求項1の低酸素応答因子の増強剤。
【請求項4】
低酸素誘導因子が低酸素誘導因子HIF−1αである請求項1〜3記載の低酸素応答因子の増強剤。
【請求項5】
請求項1〜4のいずれかの有効成分を用いることを特徴とする低酸素応答因子の増強方法。
【請求項6】
低酸素誘導因子が低酸素誘導因子HIF−1αである請求項5記載の低酸素応答因子の増強方法。
【請求項1】
有効成分として(a)〜(g)から選ばれる1種以上を含有する低酸素応答因子の増強剤。
(a)桂皮またはそのエキス、(b)牡丹皮またはそのエキス、(c)川きゅうまたはそのエキス、(d)丁字またはそのエキス、(e)天麻またはそのエキス
(f)一般式
【化1】

「式中、R1およびR2は、同一または異なって水素原子、ヒドロキシル基またはアルコキシ基を;R3は、ホルミル基、カルボキシル基、アルキルオキシカルボニル基、ヒドロキシアルキル基、アルキルカルボニルオキシアルキル基を、それぞれ示す。」
で表されるフェニルプロペン誘導体。
(g)一般式
【化2】

「式中、R4は水素原子またはアルコキシ基;R5は、アルコキシ基;R6は、アシル基、アルケニル基またはヒドロキシアルキル基を、それぞれ示す。」
で表されるフェノール誘導体。
【請求項2】
有効成分が、(a)〜(e)から選ばれる1種以上の生薬または生薬エキスである請求項1の低酸素応答因子の増強剤。
【請求項3】
有効成分が(f)フェニルプロペン誘導体および/または(g)フェノール誘導体である請求項1の低酸素応答因子の増強剤。
【請求項4】
低酸素誘導因子が低酸素誘導因子HIF−1αである請求項1〜3記載の低酸素応答因子の増強剤。
【請求項5】
請求項1〜4のいずれかの有効成分を用いることを特徴とする低酸素応答因子の増強方法。
【請求項6】
低酸素誘導因子が低酸素誘導因子HIF−1αである請求項5記載の低酸素応答因子の増強方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−62305(P2012−62305A)
【公開日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願番号】特願2011−141415(P2011−141415)
【出願日】平成23年6月27日(2011.6.27)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
【公開日】平成24年3月29日(2012.3.29)
【国際特許分類】
【出願日】平成23年6月27日(2011.6.27)
【出願人】(305060567)国立大学法人富山大学 (194)
【Fターム(参考)】
[ Back to top ]

