低酸素領域イメージング用近赤外蛍光プローブ
【課題】確実かつ特異的に低酸素領域を標的として低酸素領域を非侵襲的にイメージングする近赤外蛍光プローブを提供する。
【解決手段】近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなる低酸素領域イメージング用近赤外蛍光プローブ。近赤外蛍光色素をシアニン系色素又はBODIPY系色素とできる。低酸素結合部位をベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットとできる。リンカー結合をポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットとできる。前記の低酸素領域イメージング用近赤外蛍光プローブを用いる低酸素領域のイメージング方法。
【解決手段】近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなる低酸素領域イメージング用近赤外蛍光プローブ。近赤外蛍光色素をシアニン系色素又はBODIPY系色素とできる。低酸素結合部位をベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットとできる。リンカー結合をポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットとできる。前記の低酸素領域イメージング用近赤外蛍光プローブを用いる低酸素領域のイメージング方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体内の低酸素領域を近赤外蛍光により特異的に可視化して非侵襲的にイメージングする近赤外線蛍光プローブに関する。
【背景技術】
【0002】
固形がんに存在する低酸素領域は、血管新生、転移、がんの悪性化を誘導し、化学療法剤及び放射線に抵抗性を示すので、低酸素領域をイメージングすることはがんの早期発見や最適な治療戦略の選択において重要である、また、近年、がんの発生、転移、再発の原因として注目されるがん幹細胞は低酸素ニッチに潜むと言われており、低酸素領域をイメージングすることはがん幹細胞に対する新しい検査や治療方法の開発研究において重要であると考えられる。
【0003】
従来、がんなどの病変部の場所、大きさ、形態などを診断する方法として、穿刺等の生検、X線造影、MRI造影などが挙げられるが、これらの診断方法は被験者の負担が大きく、またX線や電磁波の被爆のおそれがある侵襲性の高い診断方法とも言える。一方、近赤外光は、生体組織を透過しやすく、また安全性が高いため、非侵襲的に生体を診断する方法として、病変部を近赤外蛍光色素を用いてイメージングする近赤外蛍光造影剤が提案されている(特許文献1、特許文献2参照)。
【0004】
一方、生体の低酸素領域を標的とする画像診断用プローブとして利用可能な化合物の提案がある(特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−261464号公報
【特許文献2】特開2005−120026号公報
【特許文献3】特開2007−77036号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、特許文献1、2に記載の近赤外蛍光造影剤は、病変部を非侵襲的にイメージングできるものの、生体の低酸素領域を特異的に標的とできない。また、特許文献3に記載の画像診断用プローブは、機能部として蛍光性の化合物を用い得るものの、抑制部の電子移動により低酸素領域の還元性環境で遊離し、生体内の求核性の生体分子と結合するものではないので、低酸素領域に留まりにくく、低酸素領域のイメージングの確実性が不十分となるおそれがある。
【0007】
本発明は、上記の事情に鑑みなされたもので、確実かつ特異的に低酸素領域を標的として低酸素領域を非侵襲的にイメージングする近赤外蛍光プローブを提供することを課題とする。
【課題を解決するための手段】
【0008】
上記の課題を解決する本発明は、以下の通りである。
近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなることを特徴とする低酸素領域イメージング用近赤外蛍光プローブを要旨とする。ここで、低酸素領域とは、病変により低酸素微少環境にある生体内の領域をいい、固形がんの病変部、脳及び心臓などの虚血疾患あるいは網膜黄斑変性症の病変部などを挙げられる。
【0009】
上記の発明において、近赤外蛍光色素をシアニン系色素又はBODIPY系色素としてもよい。低酸素結合部位をベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットとしてもよい。リンカー結合をポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットとしてもよい。
【0010】
上記の低酸素領域イメージング用近赤外蛍光プローブを用いることを特徴とする低酸素領域のイメージング方法を要旨とする。
【発明の効果】
【0011】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、確実かつ特異的に低酸素領域を標的として非侵襲的に可視化しイメージングできるので、がんや虚血疾患などの病変部の重要な知見を得るために用いることができ、疾患の早期発見や最適な治療戦略に資することができ極めて有用である。
【0012】
本発明の低酸素領域のイメージング方法は、被験者に負担をかけることなく、疾患の早期発見や最適な治療戦略を選択することを可能とする。
【図面の簡単な説明】
【0013】
【図1】低酸素領域イメージング用近赤外蛍光プローブを模式的に示す図である。図中、「NIR 蛍光色素」は近赤外蛍光色素を表す。
【図2】実施例1で合成したGPU-167の励起−蛍光スペクトルである。
【図3】実施例2で合成したGPU-172の励起−蛍光スペクトルである。
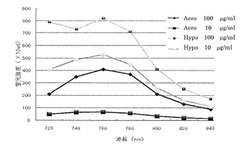
【図4】実施例2で合成したGPU-172の低酸素(hypoxia)下及び常酸素(aerobic)下の近赤外領域の蛍光強度を IVIS 200 imaging systemを用いて測定した図である。
【図5】図4の結果を示すグラフである。
【発明を実施するための形態】
【0014】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、近赤外領域で蛍光を発するイメージングプローブで、近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなるものである。
【0015】
近赤外蛍光色素は、励起光で励起され650nm〜2500nmの蛍光を有する色素であれば特に限定されないが、シアニン系色素、BODIPY系色素を挙げることができる。近赤外蛍光色素の発する蛍光は、生体組織の透過性が高く、また生体内の自家蛍光の影響を受けず、in vivo またはin vitroにおいて標的分子を生きたままで非侵襲的に高感度でイメージングできる。上記の近赤外蛍光色素は、下記の一般式群(1)で示される。近赤外蛍光色素は、市販の色素を利用しても、あるいは市販の色素を公知の方法によって半合成してもよい。
【0016】
【化1】

【0017】
上記一般式群(1)の近赤外蛍光色素は、低酸素領域イメージング用近赤外蛍光プローブの水溶性を調節するために色素の基本骨格に官能基を導入でき、例えば、シアニン系色素のA、B、X、Y、Zで示す箇所に合成化学上の公知の方法で官能基を導入することができる。
【0018】
低酸素結合部位は、ニトロ基により電子不足となったベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットで、低酸素環境でp450還元酵素などの還元的代謝により活性化されてタンパク質などの求核性の生体分子と結合し(Takasawa M, Moustafa RR, Baron JC. Applications of nitroimidazole in vivo hypoxia imaging in ischemic stroke. Stroke 2008; 39(5):1629-37)、低酸素領域に特異性を示すものである。このような化合物として、下記の一般式群(2)に示すユニットを挙げることができる。
【0019】
【化2】

【0020】
リンカー結合は、近赤外蛍光色素と低酸素結合性部位の間に介在するユニットである。
このようなユニットとして下記の一般式群(3)に示すポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットを挙げることができる。図中、ニトロ芳香環化合物は、低酸素結合部位(Arを含む一般式群(2)に示す化合物群である。)を、NIR発色団は近赤外蛍光色素を表す。また、上記の一般式群(2)で示したユニットのベンゼン、イミダゾール、トリアゾールのニトロ芳香環に結合する置換基は、リンカー結合に含まれる。
【0021】
【化3】

【0022】
本発明の低酸素領域イメージング用近赤外蛍光プローブを模式的に示せば図1のように、近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなる。
【0023】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、低酸素領域の還元的代謝により活性化されてタンパク質などの求核性の生体分子と結合し、低酸素領域に暫く留まるので、確実かつ特異的に低酸素領域をイメージングできる。低酸素領域イメージング用近赤外蛍光プローブは、一定期間経過後、代謝により体外に排泄される。なお、本発明の低酸素領域イメージング用近赤外蛍光プローブは、ヒト以外の動物にも広く用いることができる。
【0024】
本発明の低酸素領域のイメージング方法は、低酸素領域イメージング用近赤外蛍光プローブを被験者に投与した後、励起光源により励起光を被験者に照射し、当該励起光により励起された近赤外蛍光を検出器で検出することにより行うことができる。励起光は、可視光又は近赤外光を用い、低酸素領域イメージング用近赤外蛍光プローブの種類に応じた好適な波長を選択して行うことができる。励起光源は、イオンレーザー、色素レーザー、半導体レーザーなどのレーザー光源、ハロゲン光源、キセノン光源などを使用できる。このようにして、がんの病変部や虚血疾患の病変部などの低酸素領域を確実かつ特異的に標的化し、イメージングすることができる。
【0025】
本発明の低酸素領域イメージング用近赤外蛍光プローブが塩である場合、薬理上許容される塩であれば特に限定はなく、例えばナトリウム塩、カリウム塩のようなアルカリ金属塩、マグネシウム塩、カルシウム塩のようなアルカリ土類金属塩などとすることができる。また、注射用蒸留水、生理食塩水、リンゲル液など溶媒中に懸濁若しくは溶解して用いることができる。さらに、担体、賦形剤などの薬理上許容される添加物を加えてもよい。本発明の低酸素領域イメージング用近赤外蛍光プローブは、血管、経口、腹腔内、皮下、皮内などに注入、噴霧等を行うことにより投与できる。また、投与量は、診断する部位を検出できる量であれば適宜増減できるが、低酸素領域イメージング用近赤外蛍光プローブの種類、被験者の年齢、性別、体重、適用部位等を考慮して設定でき、通常、0.1〜100mg/kg・体重、好ましくは0.5〜20mg/kg・体重である。
【実施例】
【0026】
以下、本発明を実施例を挙げて説明するが、本発明はこれに限定されない。
【0027】
〔実施例1〕(低酸素領域イメージング用近赤外蛍光プローブの合成1)
1-[4-(aminomethyl)piperidin-1-yl]-3-(2-nitro-1H-imidazol-1-yl)-propan-2-ol(以下、「GPU-174」と記載)を以下のように合成した。化合物1は、Sercelらの方法に従い、ラセミのエピクロロヒドリン(epichlorohydrin)より合成した(Sercel AD, Beylin VG, Marlatt ME, Leja b, Showalter HDH, Michel A. Synthesis of the Enantiomers of the Dual Function 2-Nitroimidazole Radiation Sensitizer RB 6145. J Heterocylic Chem 2006;43:1597-604)。化合物2は、Dioufらの方法に従って1g(8.76mmol)の4−アミノメチルピペリジン(4-aminomethylpiperidine)および1330mg(13.1 mmol) のベンズアルデヒド(benzaldehyde)よりmolecular sieves 4A共存下、エタノール(10 mL)中にて調製し、未精製のまま化合物1との反応に付した(Diouf O, Depreux P, Chavatte P, Poupaert JH. Synthesis and preliminary pharmacological results on new naphthalene derivatives as 5-HT4 receptor ligands. Eur. J. Med. Chem. 2000;35:699-706)。即ち、化合物2を含む反応溶液に1407 mg(8.32 mmol) の化合物1の2-nitro-1-(2-oxiranylmethyl)-1H-imidazole を加え、窒素雰囲気下に20時間加熱還流を行った。放冷後、遠心分離(3000rpm、5 分)によりmolecular sievesを除去し、上清を減圧溜去した。得られた油状残渣3に10% 塩酸(20 mL) を加え、40 °Cにて4 時間加熱した。この水相をクロロホルム(30 mL x 4)にて洗浄し、得られた水相に10% NaOH水溶液をゆっくりと加えてアルカリ性に傾けた(pH 9)。次いでこの水相からクロロホルム(30mLx4)にて抽出した。合わせた有機層を無水MgSO4で乾燥後、減圧濃縮して1050 mgの黄色油状残渣を得た。さらに最小量の熱エタノールで希釈し、5 °Cにて12時間静置後、978 mg (42%) のGPU-174(淡黄色結晶)を得た。下記の式(4)にGPU-174の合成反応を示す。
1H NMR (CDCl3) δ: 7.29 (s, 1H), 7.12 (s, 1H), 4.70 (dd, J = 14.0, 2.4 Hz, 1H), 4.23 (dd, J = 7.1, 7.1 Hz, 1H), 4.05 (m, 1H), 2.94 (d, J = 11.6 Hz, 1H), 2.79 (d, J = 11.1 Hz, 1H), 2.55 (d, J = 6.3 Hz, 2H), 2.45 (dd, J = 12.3, 4.1 Hz, 1H), 2.26 (m, 2H), 2.00 (td, J = 11.6, 2.4 Hz, 1H), 1.72 (d, J = 12.1 Hz, 2H), 1.31-1.13 (m, 5H); 13C NMR (CDCl3) δ: 144.8, 127.8, 127.4, 65.7, 60.8, 55.1, 53.5, 52.5, 47.8, 38.9, 30.0, 29.8; HRMS (FAB+): calcd. for C12H22N5O3 ([M+H]+) m/z 284.1723,found 284.1742
【0028】
【化4】

【0029】
シアニン系色素4は、Mujumdarらに準じて合成した(Mujumdar RB, Ernst LA, Mujumdar SR, Lewis CJ, Waggoner AS. Cyanine dye labeling reagents: sulfoindocyanine succinimidyl esters. Bioconjugate Chem 1993;4:105-11)。窒素雰囲気下、300mg(0.34mmol)のシアニン系色素4と553.4mg(2.16mmol)のN,N'-ジスクシンイミジルカルボネート(N,N'-disuccineimidylcarbonate)を6.3mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide):無水ピリジン(pyridine)(20:1)混合溶液に溶かし、60℃にて2時間加熱した。冷後、反応混合液を50mLの無水酢酸エチルにあけて、得られた懸濁物を遠心し(3000rpm、5分)、上清を除いた。沈殿物を減圧乾燥して、活性エステルを得た。窒素雰囲気下、この活性エステルと102mg(0.32mmol)の上記で合成したGPU-174を6mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide)に溶かし、146.7mg(1.44mmol、202μL)のトリエチルアミン(triethylamine)を加え、室温にて1時間撹拌した。反応液50mLの冷クロロホルムにあけて、懸濁液を得た。これを遠心し(3000rpm、5分)、上清を除いた。沈殿物をアミンコートシリカゲルカラムクロマトグラフィー(クロロホルム/66%メタノール)にて精製し、暗緑色の固体(140mg)を得た。その粗精製物を逆相HPLCで精製し、低酸素領域イメージング用近赤外蛍光プローブのGPU-167(4.2mg、0.9%)を得た。下記の式(5)に合成反応を示す。
HRMS(ESI、positive):calcd. for C63H87N12O14S2([M+H]+)m/z 1299.5906、found 1299.5897
【0030】
【化5】

【0031】
〔実施例2〕(低酸素領域イメージング用近赤外蛍光プローブの合成2)
シアニン系色素5は、Narayananらの方法に従って合成した(Narayanan N, Patonay G. A New Method for the Synthesis of Heptamethine Cyanine Dyes: Synthesis of New Near-Infrared Fluorescent Labels. J. Org. Chem. 1995;60:2391-5)。50mg(0.077mmol)のシアニン系色素5と87mg(0.31mmol)のGPU-174を6.3mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide)に溶かし、85℃にて12時間加熱した。冷後、溶媒を減圧留去して得られた、残渣202mgをODSカラムクロマトグラフィー(水/50%メタノール)で分離し、青色固体(28mg)を得た。さらに、セミ分取逆相HPLCで精製し、低酸素領域イメージング用近赤外蛍光プローブのGPU-172(7.6mg、12%)を得た。下記の式(6)に合成反応を示す。
HRMS(ESI、positive):calcd. for C50H68N7O9S2([M+H]+)m/z 974.4520、found 974.4523
【0032】
【化6】

【0033】
〔実施例3〕(GPU-167及び GPU-172の励起−蛍光スペクトル)
図2に、GPU-167、DMSO溶媒、2.307×10-6Mにおける励起−蛍光スペクトルを示した。図2は、紫外−可視吸光スペクトルの結果から、励起光として765nmを選択し、蛍光波長、強度を測定したもので、左側の縦軸は励起光強度、右側の縦軸は蛍光強度を示す。図2から、GPU-167の蛍光波長は、λExmax=695nm、λEmmax=801nmであることが分かった。
【0034】
図3に、GPU-172、溶媒メタノール、6.833×10-6Mにおける励起−蛍光スペクトルを示した。図3は、紫外−可視吸光スペクトルの結果から、励起光として640nmを選択し、蛍光波長、強度を測定した。図3から、GPU-172の蛍光波長は、λExmax=632nm、λEmmax=763nmであることが分かった。
【0035】
下記表1にGPU-167及び GPU-172の励起−蛍光スペクトルのデータを纏めた。
【0036】
【表1】

【0037】
〔実施例4〕(細胞を用いた低酸素選択性の検討)
細胞を用い、GPU-172の低酸素選択性を検討した。常酸素(aerobic)下培養した細胞または低酸素(hypoxia)下培養した細胞を用い、細胞内に取り込まれたGPU-172を蛍光強度を測定することにより比較・評価した。すなわち、常酸素下または嫌気性培養装置にてヒト胎児腎臓細胞(HEK293)を、チャンバースライドに一定数播種した。常酸素下または低酸素下(酸素濃度0.02%)24時間の37℃にて培養した。次いで、それぞれにGPU-172を加えて2時間培養した。低酸素の場合は、低酸素状態を保ったまま培養した。培地を除いてから、PBSでウェルを数回洗浄した。IVIS 200 imaging system(Xenogen社製)を用い、近赤外領域の蛍光強度を測定して比較した。
【0038】
なお、GPU-172の濃度は、0.1-100μg/mL(7.7×10-8M-7.7×10-5M)に調製し添加した。
また、励起光は、640nmを選択し、得られた蛍光強度を20nmバンドパスにより測定、比較した。結果は、図4及び図5に示した。
【0039】
図4及び図5より、760nmにおいて最も強い蛍光強度が得られ、濃度依存性がみられた。GPU-172の濃度が100μg/mLでは、低酸素(hypoxia)において最も強い蛍光強度が得られたが、常酸素(aerobic)においては強い蛍光が観察され、低酸素(hypoxia)認識性は低く、濃度が高すぎる結果であった。低酸素(hypoxia)と常酸素(aerobic)の比、H/Aは10μg/mLが最大であった。
【産業上の利用可能性】
【0040】
本発明は、医薬の分野、特に診断薬の分野において利用ができる。
【技術分野】
【0001】
本発明は、生体内の低酸素領域を近赤外蛍光により特異的に可視化して非侵襲的にイメージングする近赤外線蛍光プローブに関する。
【背景技術】
【0002】
固形がんに存在する低酸素領域は、血管新生、転移、がんの悪性化を誘導し、化学療法剤及び放射線に抵抗性を示すので、低酸素領域をイメージングすることはがんの早期発見や最適な治療戦略の選択において重要である、また、近年、がんの発生、転移、再発の原因として注目されるがん幹細胞は低酸素ニッチに潜むと言われており、低酸素領域をイメージングすることはがん幹細胞に対する新しい検査や治療方法の開発研究において重要であると考えられる。
【0003】
従来、がんなどの病変部の場所、大きさ、形態などを診断する方法として、穿刺等の生検、X線造影、MRI造影などが挙げられるが、これらの診断方法は被験者の負担が大きく、またX線や電磁波の被爆のおそれがある侵襲性の高い診断方法とも言える。一方、近赤外光は、生体組織を透過しやすく、また安全性が高いため、非侵襲的に生体を診断する方法として、病変部を近赤外蛍光色素を用いてイメージングする近赤外蛍光造影剤が提案されている(特許文献1、特許文献2参照)。
【0004】
一方、生体の低酸素領域を標的とする画像診断用プローブとして利用可能な化合物の提案がある(特許文献3参照)。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特開2003−261464号公報
【特許文献2】特開2005−120026号公報
【特許文献3】特開2007−77036号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
しかし、特許文献1、2に記載の近赤外蛍光造影剤は、病変部を非侵襲的にイメージングできるものの、生体の低酸素領域を特異的に標的とできない。また、特許文献3に記載の画像診断用プローブは、機能部として蛍光性の化合物を用い得るものの、抑制部の電子移動により低酸素領域の還元性環境で遊離し、生体内の求核性の生体分子と結合するものではないので、低酸素領域に留まりにくく、低酸素領域のイメージングの確実性が不十分となるおそれがある。
【0007】
本発明は、上記の事情に鑑みなされたもので、確実かつ特異的に低酸素領域を標的として低酸素領域を非侵襲的にイメージングする近赤外蛍光プローブを提供することを課題とする。
【課題を解決するための手段】
【0008】
上記の課題を解決する本発明は、以下の通りである。
近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなることを特徴とする低酸素領域イメージング用近赤外蛍光プローブを要旨とする。ここで、低酸素領域とは、病変により低酸素微少環境にある生体内の領域をいい、固形がんの病変部、脳及び心臓などの虚血疾患あるいは網膜黄斑変性症の病変部などを挙げられる。
【0009】
上記の発明において、近赤外蛍光色素をシアニン系色素又はBODIPY系色素としてもよい。低酸素結合部位をベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットとしてもよい。リンカー結合をポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットとしてもよい。
【0010】
上記の低酸素領域イメージング用近赤外蛍光プローブを用いることを特徴とする低酸素領域のイメージング方法を要旨とする。
【発明の効果】
【0011】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、確実かつ特異的に低酸素領域を標的として非侵襲的に可視化しイメージングできるので、がんや虚血疾患などの病変部の重要な知見を得るために用いることができ、疾患の早期発見や最適な治療戦略に資することができ極めて有用である。
【0012】
本発明の低酸素領域のイメージング方法は、被験者に負担をかけることなく、疾患の早期発見や最適な治療戦略を選択することを可能とする。
【図面の簡単な説明】
【0013】
【図1】低酸素領域イメージング用近赤外蛍光プローブを模式的に示す図である。図中、「NIR 蛍光色素」は近赤外蛍光色素を表す。
【図2】実施例1で合成したGPU-167の励起−蛍光スペクトルである。
【図3】実施例2で合成したGPU-172の励起−蛍光スペクトルである。
【図4】実施例2で合成したGPU-172の低酸素(hypoxia)下及び常酸素(aerobic)下の近赤外領域の蛍光強度を IVIS 200 imaging systemを用いて測定した図である。
【図5】図4の結果を示すグラフである。
【発明を実施するための形態】
【0014】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、近赤外領域で蛍光を発するイメージングプローブで、近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなるものである。
【0015】
近赤外蛍光色素は、励起光で励起され650nm〜2500nmの蛍光を有する色素であれば特に限定されないが、シアニン系色素、BODIPY系色素を挙げることができる。近赤外蛍光色素の発する蛍光は、生体組織の透過性が高く、また生体内の自家蛍光の影響を受けず、in vivo またはin vitroにおいて標的分子を生きたままで非侵襲的に高感度でイメージングできる。上記の近赤外蛍光色素は、下記の一般式群(1)で示される。近赤外蛍光色素は、市販の色素を利用しても、あるいは市販の色素を公知の方法によって半合成してもよい。
【0016】
【化1】

【0017】
上記一般式群(1)の近赤外蛍光色素は、低酸素領域イメージング用近赤外蛍光プローブの水溶性を調節するために色素の基本骨格に官能基を導入でき、例えば、シアニン系色素のA、B、X、Y、Zで示す箇所に合成化学上の公知の方法で官能基を導入することができる。
【0018】
低酸素結合部位は、ニトロ基により電子不足となったベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットで、低酸素環境でp450還元酵素などの還元的代謝により活性化されてタンパク質などの求核性の生体分子と結合し(Takasawa M, Moustafa RR, Baron JC. Applications of nitroimidazole in vivo hypoxia imaging in ischemic stroke. Stroke 2008; 39(5):1629-37)、低酸素領域に特異性を示すものである。このような化合物として、下記の一般式群(2)に示すユニットを挙げることができる。
【0019】
【化2】

【0020】
リンカー結合は、近赤外蛍光色素と低酸素結合性部位の間に介在するユニットである。
このようなユニットとして下記の一般式群(3)に示すポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットを挙げることができる。図中、ニトロ芳香環化合物は、低酸素結合部位(Arを含む一般式群(2)に示す化合物群である。)を、NIR発色団は近赤外蛍光色素を表す。また、上記の一般式群(2)で示したユニットのベンゼン、イミダゾール、トリアゾールのニトロ芳香環に結合する置換基は、リンカー結合に含まれる。
【0021】
【化3】

【0022】
本発明の低酸素領域イメージング用近赤外蛍光プローブを模式的に示せば図1のように、近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなる。
【0023】
本発明の低酸素領域イメージング用近赤外蛍光プローブは、低酸素領域の還元的代謝により活性化されてタンパク質などの求核性の生体分子と結合し、低酸素領域に暫く留まるので、確実かつ特異的に低酸素領域をイメージングできる。低酸素領域イメージング用近赤外蛍光プローブは、一定期間経過後、代謝により体外に排泄される。なお、本発明の低酸素領域イメージング用近赤外蛍光プローブは、ヒト以外の動物にも広く用いることができる。
【0024】
本発明の低酸素領域のイメージング方法は、低酸素領域イメージング用近赤外蛍光プローブを被験者に投与した後、励起光源により励起光を被験者に照射し、当該励起光により励起された近赤外蛍光を検出器で検出することにより行うことができる。励起光は、可視光又は近赤外光を用い、低酸素領域イメージング用近赤外蛍光プローブの種類に応じた好適な波長を選択して行うことができる。励起光源は、イオンレーザー、色素レーザー、半導体レーザーなどのレーザー光源、ハロゲン光源、キセノン光源などを使用できる。このようにして、がんの病変部や虚血疾患の病変部などの低酸素領域を確実かつ特異的に標的化し、イメージングすることができる。
【0025】
本発明の低酸素領域イメージング用近赤外蛍光プローブが塩である場合、薬理上許容される塩であれば特に限定はなく、例えばナトリウム塩、カリウム塩のようなアルカリ金属塩、マグネシウム塩、カルシウム塩のようなアルカリ土類金属塩などとすることができる。また、注射用蒸留水、生理食塩水、リンゲル液など溶媒中に懸濁若しくは溶解して用いることができる。さらに、担体、賦形剤などの薬理上許容される添加物を加えてもよい。本発明の低酸素領域イメージング用近赤外蛍光プローブは、血管、経口、腹腔内、皮下、皮内などに注入、噴霧等を行うことにより投与できる。また、投与量は、診断する部位を検出できる量であれば適宜増減できるが、低酸素領域イメージング用近赤外蛍光プローブの種類、被験者の年齢、性別、体重、適用部位等を考慮して設定でき、通常、0.1〜100mg/kg・体重、好ましくは0.5〜20mg/kg・体重である。
【実施例】
【0026】
以下、本発明を実施例を挙げて説明するが、本発明はこれに限定されない。
【0027】
〔実施例1〕(低酸素領域イメージング用近赤外蛍光プローブの合成1)
1-[4-(aminomethyl)piperidin-1-yl]-3-(2-nitro-1H-imidazol-1-yl)-propan-2-ol(以下、「GPU-174」と記載)を以下のように合成した。化合物1は、Sercelらの方法に従い、ラセミのエピクロロヒドリン(epichlorohydrin)より合成した(Sercel AD, Beylin VG, Marlatt ME, Leja b, Showalter HDH, Michel A. Synthesis of the Enantiomers of the Dual Function 2-Nitroimidazole Radiation Sensitizer RB 6145. J Heterocylic Chem 2006;43:1597-604)。化合物2は、Dioufらの方法に従って1g(8.76mmol)の4−アミノメチルピペリジン(4-aminomethylpiperidine)および1330mg(13.1 mmol) のベンズアルデヒド(benzaldehyde)よりmolecular sieves 4A共存下、エタノール(10 mL)中にて調製し、未精製のまま化合物1との反応に付した(Diouf O, Depreux P, Chavatte P, Poupaert JH. Synthesis and preliminary pharmacological results on new naphthalene derivatives as 5-HT4 receptor ligands. Eur. J. Med. Chem. 2000;35:699-706)。即ち、化合物2を含む反応溶液に1407 mg(8.32 mmol) の化合物1の2-nitro-1-(2-oxiranylmethyl)-1H-imidazole を加え、窒素雰囲気下に20時間加熱還流を行った。放冷後、遠心分離(3000rpm、5 分)によりmolecular sievesを除去し、上清を減圧溜去した。得られた油状残渣3に10% 塩酸(20 mL) を加え、40 °Cにて4 時間加熱した。この水相をクロロホルム(30 mL x 4)にて洗浄し、得られた水相に10% NaOH水溶液をゆっくりと加えてアルカリ性に傾けた(pH 9)。次いでこの水相からクロロホルム(30mLx4)にて抽出した。合わせた有機層を無水MgSO4で乾燥後、減圧濃縮して1050 mgの黄色油状残渣を得た。さらに最小量の熱エタノールで希釈し、5 °Cにて12時間静置後、978 mg (42%) のGPU-174(淡黄色結晶)を得た。下記の式(4)にGPU-174の合成反応を示す。
1H NMR (CDCl3) δ: 7.29 (s, 1H), 7.12 (s, 1H), 4.70 (dd, J = 14.0, 2.4 Hz, 1H), 4.23 (dd, J = 7.1, 7.1 Hz, 1H), 4.05 (m, 1H), 2.94 (d, J = 11.6 Hz, 1H), 2.79 (d, J = 11.1 Hz, 1H), 2.55 (d, J = 6.3 Hz, 2H), 2.45 (dd, J = 12.3, 4.1 Hz, 1H), 2.26 (m, 2H), 2.00 (td, J = 11.6, 2.4 Hz, 1H), 1.72 (d, J = 12.1 Hz, 2H), 1.31-1.13 (m, 5H); 13C NMR (CDCl3) δ: 144.8, 127.8, 127.4, 65.7, 60.8, 55.1, 53.5, 52.5, 47.8, 38.9, 30.0, 29.8; HRMS (FAB+): calcd. for C12H22N5O3 ([M+H]+) m/z 284.1723,found 284.1742
【0028】
【化4】

【0029】
シアニン系色素4は、Mujumdarらに準じて合成した(Mujumdar RB, Ernst LA, Mujumdar SR, Lewis CJ, Waggoner AS. Cyanine dye labeling reagents: sulfoindocyanine succinimidyl esters. Bioconjugate Chem 1993;4:105-11)。窒素雰囲気下、300mg(0.34mmol)のシアニン系色素4と553.4mg(2.16mmol)のN,N'-ジスクシンイミジルカルボネート(N,N'-disuccineimidylcarbonate)を6.3mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide):無水ピリジン(pyridine)(20:1)混合溶液に溶かし、60℃にて2時間加熱した。冷後、反応混合液を50mLの無水酢酸エチルにあけて、得られた懸濁物を遠心し(3000rpm、5分)、上清を除いた。沈殿物を減圧乾燥して、活性エステルを得た。窒素雰囲気下、この活性エステルと102mg(0.32mmol)の上記で合成したGPU-174を6mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide)に溶かし、146.7mg(1.44mmol、202μL)のトリエチルアミン(triethylamine)を加え、室温にて1時間撹拌した。反応液50mLの冷クロロホルムにあけて、懸濁液を得た。これを遠心し(3000rpm、5分)、上清を除いた。沈殿物をアミンコートシリカゲルカラムクロマトグラフィー(クロロホルム/66%メタノール)にて精製し、暗緑色の固体(140mg)を得た。その粗精製物を逆相HPLCで精製し、低酸素領域イメージング用近赤外蛍光プローブのGPU-167(4.2mg、0.9%)を得た。下記の式(5)に合成反応を示す。
HRMS(ESI、positive):calcd. for C63H87N12O14S2([M+H]+)m/z 1299.5906、found 1299.5897
【0030】
【化5】

【0031】
〔実施例2〕(低酸素領域イメージング用近赤外蛍光プローブの合成2)
シアニン系色素5は、Narayananらの方法に従って合成した(Narayanan N, Patonay G. A New Method for the Synthesis of Heptamethine Cyanine Dyes: Synthesis of New Near-Infrared Fluorescent Labels. J. Org. Chem. 1995;60:2391-5)。50mg(0.077mmol)のシアニン系色素5と87mg(0.31mmol)のGPU-174を6.3mLの無水N,N−ジメチルフォルムアミド(N,N-dimethylformamide)に溶かし、85℃にて12時間加熱した。冷後、溶媒を減圧留去して得られた、残渣202mgをODSカラムクロマトグラフィー(水/50%メタノール)で分離し、青色固体(28mg)を得た。さらに、セミ分取逆相HPLCで精製し、低酸素領域イメージング用近赤外蛍光プローブのGPU-172(7.6mg、12%)を得た。下記の式(6)に合成反応を示す。
HRMS(ESI、positive):calcd. for C50H68N7O9S2([M+H]+)m/z 974.4520、found 974.4523
【0032】
【化6】

【0033】
〔実施例3〕(GPU-167及び GPU-172の励起−蛍光スペクトル)
図2に、GPU-167、DMSO溶媒、2.307×10-6Mにおける励起−蛍光スペクトルを示した。図2は、紫外−可視吸光スペクトルの結果から、励起光として765nmを選択し、蛍光波長、強度を測定したもので、左側の縦軸は励起光強度、右側の縦軸は蛍光強度を示す。図2から、GPU-167の蛍光波長は、λExmax=695nm、λEmmax=801nmであることが分かった。
【0034】
図3に、GPU-172、溶媒メタノール、6.833×10-6Mにおける励起−蛍光スペクトルを示した。図3は、紫外−可視吸光スペクトルの結果から、励起光として640nmを選択し、蛍光波長、強度を測定した。図3から、GPU-172の蛍光波長は、λExmax=632nm、λEmmax=763nmであることが分かった。
【0035】
下記表1にGPU-167及び GPU-172の励起−蛍光スペクトルのデータを纏めた。
【0036】
【表1】

【0037】
〔実施例4〕(細胞を用いた低酸素選択性の検討)
細胞を用い、GPU-172の低酸素選択性を検討した。常酸素(aerobic)下培養した細胞または低酸素(hypoxia)下培養した細胞を用い、細胞内に取り込まれたGPU-172を蛍光強度を測定することにより比較・評価した。すなわち、常酸素下または嫌気性培養装置にてヒト胎児腎臓細胞(HEK293)を、チャンバースライドに一定数播種した。常酸素下または低酸素下(酸素濃度0.02%)24時間の37℃にて培養した。次いで、それぞれにGPU-172を加えて2時間培養した。低酸素の場合は、低酸素状態を保ったまま培養した。培地を除いてから、PBSでウェルを数回洗浄した。IVIS 200 imaging system(Xenogen社製)を用い、近赤外領域の蛍光強度を測定して比較した。
【0038】
なお、GPU-172の濃度は、0.1-100μg/mL(7.7×10-8M-7.7×10-5M)に調製し添加した。
また、励起光は、640nmを選択し、得られた蛍光強度を20nmバンドパスにより測定、比較した。結果は、図4及び図5に示した。
【0039】
図4及び図5より、760nmにおいて最も強い蛍光強度が得られ、濃度依存性がみられた。GPU-172の濃度が100μg/mLでは、低酸素(hypoxia)において最も強い蛍光強度が得られたが、常酸素(aerobic)においては強い蛍光が観察され、低酸素(hypoxia)認識性は低く、濃度が高すぎる結果であった。低酸素(hypoxia)と常酸素(aerobic)の比、H/Aは10μg/mLが最大であった。
【産業上の利用可能性】
【0040】
本発明は、医薬の分野、特に診断薬の分野において利用ができる。
【特許請求の範囲】
【請求項1】
近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなることを特徴とする低酸素領域イメージング用近赤外蛍光プローブ。
【請求項2】
近赤外蛍光色素が、シアニン系色素又はBODIPY系色素であることを特徴とする請求項1に記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項3】
低酸素結合部位が、ベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットであることを特徴とする請求項1又は請求項2に記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項4】
リンカー結合が、ポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットであることを特徴とする請求項1〜請求項3のいずれかに記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項5】
請求項1〜請求項4のいずれかに記載の低酸素領域イメージング用近赤外蛍光プローブを用いることを特徴とする低酸素領域のイメージング方法。
【請求項1】
近赤外蛍光色素と、低酸素領域で還元的代謝により活性化されて求核性の生体分子と結合する低酸素結合部位と、リンカー結合とからなることを特徴とする低酸素領域イメージング用近赤外蛍光プローブ。
【請求項2】
近赤外蛍光色素が、シアニン系色素又はBODIPY系色素であることを特徴とする請求項1に記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項3】
低酸素結合部位が、ベンゼン、イミダゾール、トリアゾールのニトロ芳香環を含むユニットであることを特徴とする請求項1又は請求項2に記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項4】
リンカー結合が、ポリエーテル、トリアゾール、アミド、チオアミド、エステル、チオエステル、カルバメート、アミン、スルフィド、エーテル、アルキル基のいずれか又はそれらの組み合わせによる官能基を有する鎖状ユニットであることを特徴とする請求項1〜請求項3のいずれかに記載の低酸素領域イメージング用近赤外蛍光プローブ。
【請求項5】
請求項1〜請求項4のいずれかに記載の低酸素領域イメージング用近赤外蛍光プローブを用いることを特徴とする低酸素領域のイメージング方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−203966(P2010−203966A)
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願番号】特願2009−50992(P2009−50992)
【出願日】平成21年3月4日(2009.3.4)
【出願人】(591060289)岐阜市 (15)
【Fターム(参考)】
【公開日】平成22年9月16日(2010.9.16)
【国際特許分類】
【出願日】平成21年3月4日(2009.3.4)
【出願人】(591060289)岐阜市 (15)
【Fターム(参考)】
[ Back to top ]

