体内埋込医療器具
【課題】生体内の管腔に直接、局所的に適用することが可能であり、なおかつ血管平滑筋細胞の増殖を抑制すると共に血管内皮細胞の機能を改善させて血管の内皮化を促進し、再狭窄を確実に抑制する体内埋込医療器具の提供。
【解決手段】医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【解決手段】医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血管、胆管、気管、食道、尿道などの生体内の管腔に生じた狭窄部の改善に使用される体内埋込医療器具に関する。
【背景技術】
【0002】
ステントは、血管あるいはその他の生体内の管腔に生じた狭窄部を拡張させた状態に維持するための管状の器具であり、例えば経皮的冠動脈形成術(PTCA)後の狭窄部の改善に用いられている。PTCAは虚血性心疾患の極めて有効な治療法であるが、PTCA施行後数ヶ月以内に40〜50%の割合で再狭窄がおきるという問題点がある(Popma JJ,Topol EJ.Am J Med 88:1N−16N,1990)。PTCA後の再狭窄の原因は主として(1)血栓性閉塞、(2)バルーンによる拡張後の血管壁のエラスチンrecoilによる内腔の狭小化、(3)PTCAによって生じた冠動脈壁の傷害修復に伴う新生内膜の過剰肥厚、等が考えられる。そこで再狭窄を防止するため、PTCA後に、バルーンで血管狭窄部を拡張させ、金属製のメッシュ構造からなるステントを留置することでエラスチンrecoilを最小限に抑えるというステント療法が試みられてきた(Fischman DL,Leon MB et al.N Engl J Med 331:496−501,1994)。また、血栓性閉塞に対しては、ステント使用の場合は未使用の場合よりも多くの蔓延化した血栓が形成され、ステント挿入1〜2週間後に亜急性血栓性閉塞が生じるといった問題が生じたが、チクロピジン、アスピリンの併用により血栓形成の防止が可能になった。しかし、ステントを使用した場合、PTCAのみの場合と比べて再狭窄率は低いものの、主に内膜肥厚が原因で、約20〜30%の割合で再狭窄が認められ、この問題は依然として解決していない。
【0003】
ステント留置後の再狭窄の主な原因である内膜肥厚は、以下のようなメカニズムで起きると考えられている。PTCAやステント留置時に生じた内膜障害により、ステントワイヤー周囲に血小板が凝集して血栓が形成され、そこからPlatelet Derived Growth Factor(PDGF)やTransforming Growth Factor(TGF)等のサイトカインや12−hydroxyeicosatetraenoic(12−HETE)等の物質が放出される。一方、内膜障害部位では単球等の炎症細胞が、vascular cell adhesion molecule−1(VCAM−1)、intercellular adhesion molecule−1(ICAM−1)やセレクチン等の接着分子を介して血管壁に接着し、ステントワイヤー周辺部に集積するのと同時に血管壁内に侵入しながら、PDGF等の様々な生理活性物質を放出する。さらに血管平滑筋細胞の活性化を制御していた内皮細胞が内膜障害により脱落もしくは機能低下することに加え、PDGF等の様々な生理活性物質の刺激、あるいは血管拡張時に生じた血管壁の機械的破壊が引き金となり、血管中膜の平滑筋細胞が活性化されて、収縮型から合成型に形質転換される。そして、合成型平滑筋細胞は血管内膜へ遊走するとともに過剰増殖することによって内膜肥厚が生じる。
【0004】
そこで内膜肥厚の直接の原因である血管平滑筋細胞の遊走・増殖を抑制し得る薬剤をステントに搭載して、ステント留置部位で放出することにより、再狭窄を予防する検討が種々なされている。このような薬剤の具体的な例としては、特許文献1にタキソール(パクリタキセル)が、特許文献2にマイトマシンC、アドリアマイシン、ゲニステイン、チルフォスチンが、また、特許文献3にサイトカラシンが、それぞれ開示されている。また、最近ではシロリムス(ラパマイシン)を搭載したステントも報告されている。しかし、これらの薬剤は障害もしくは機能低下した血管内膜の改善・修復作用を有さず、血管平滑筋細胞の増殖・遊走を直接抑えているだけなので、薬剤が放出されてステント留置部における薬剤の濃度が低下した時に再狭窄の発症が危惧される。また、これらの薬剤は、血管の治癒過程で必要不可欠な血管内皮細胞の機能まで抑制してしまう可能性もある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表平9−503488号公報
【特許文献2】特開平9−56807号公報
【特許文献3】特表平11−500635号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで、本発明の目的は、生体内の管腔に直接、局所的に適用することが可能であり、なおかつ血管平滑筋細胞の増殖を抑制すると共に血管内皮細胞の機能を改善させて血管の内皮化を促進し、再狭窄を確実に抑制する体内埋込医療器具を提供することにある。
【課題を解決するための手段】
【0007】
このような目的は、下記1〜6の本発明により達成される。
【0008】
1. 医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
2. 前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記1に記載の体内埋込医療器具。
3. 前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記1に記載の体内埋込医療器具。
4. 前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、
前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする上記2または3に記載の体内埋込医療器具。
5. 前記医療器具本体が、ステントであることを特徴とする上記1〜4のいずれかに記載の体内埋込医療器具。
6. 前記NO産生を促進するものが、HMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬およびNO供与体からなる群から選ばれる少なくとも1種である上記1〜5のいずれかに記載の体内埋込医療器具。
【0009】
また、このような目的は、下記(1)〜(14)の本発明により達成される。
(1)医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されていることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【0010】
(2)前記血管内皮細胞機能改善薬が、HMG−CoA還元酵素阻害薬であることを特徴とする上記(1)に記載の体内埋込医療器具。
【0011】
(3)前記HMG−CoA還元酵素阻害薬が、シンバスタチン、セリバスタチンナトリウム、ピタバスタチン、ロバスタチン、アトルバスタチン、フルバスタチンナトリウム、プラバスタチンナトリウム、ロスバスタチンのいずれかであることを特徴とする上記(2)に記載の体内埋込医療器具。
【0012】
(4)前記血管内皮細胞機能改善薬が、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬のいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0013】
(5)前記血管内皮細胞機能改善薬が、NO供与体であることを特徴とする上記(1)に記載の体内埋込医療器具。
【0014】
(6)前記NO供与体が、S−Nitroso−N−acetyl−DL−penicillamine(SNAP)またはアルギニンであることを特徴とする上記(5)に記載の体内埋込医療器具。
【0015】
(7)前記血管平滑筋細胞増殖抑制薬が、免疫抑制剤、抗癌剤、抗生物質、ゲニステイン、チルフォスチン、サイトカラシンのいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0016】
(8)前記血管平滑筋細胞増殖抑制薬が、シロリムス(ラパマイシン)、タクロリムス水和物、エベロリムス、エベロリムスプラス、パクリタキセル(タキソール)、ドセタキセル水和物、アクチノマイシンD、マイトマイシンC、アドリアマイシンのいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0017】
(9)前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0018】
(10)前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0019】
(11)前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする上記(9)または(10)に記載の体内埋込医療器具。
【0020】
(12)前記医療器具本体が、ステントであることを特徴とする上記(1)〜(11)のいずれかに記載の体内埋込医療器具。
【0021】
(13)前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を、生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層中に含有させた形態にして前記医療器具本体に搭載したことを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0022】
(14)前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を、前記医療器具本体の表面に直接搭載し、かつ前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層で被覆したことを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【発明の効果】
【0023】
以上述べたように本発明は、生体内の管腔に留置するための体内埋込医療器具であって、医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されていることを特徴とするため、生体内の管腔に直接、局所的に適用することが可能である。そして、血管平滑筋細胞増殖抑制薬の放出により血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬を放出して血管内皮細胞の機能を改善させる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、再狭窄を確実に抑制することが可能である。
【0024】
また、前記医療器具本体が、ステントであることを特徴とする場合、生体内の管腔に生じた狭窄部を拡張し、その拡張された内腔を確保するためにそこに長期間留置することが可能である。
【図面の簡単な説明】
【0025】
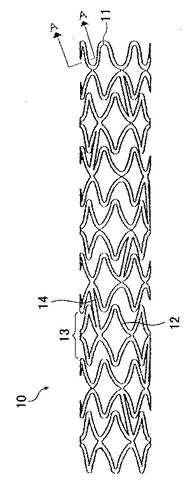
【図1】図1は、ステントの一態様を示す側面図である。
【図2】図2は、図1の線A−Aに沿って切断した拡大横断面図である。
【図3】図3は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図4】図4は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図5】図5は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図6】図6は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【発明を実施するための形態】
【0026】
以下、本発明の体内埋込医療器具について詳細に説明する。
【0027】
本発明の体内埋込医療器具は、医療器具本体と、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬で構成されている。
【0028】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬は、医療器具本体の表面にコートされていても良く、また医療器具本体自体に含有されていても良い。
【0029】
医療器具本体は、例えばステント、カテーテル、バルーン、血管補綴材、人工血管等が挙げられ、中でも生体内の管腔に生じた狭窄部を拡張し、その拡張された内腔を確保するためにそこに長期間留置することが可能であるステントが好ましい態様である。以下、医療器具本体がステントである場合について添付図面に示す好適な実施の形態に基づいてより詳細に説明する。
【0030】
図1はステントの一態様を示す側面図、図2は図1の線A−Aに沿って切断した拡大横断面図、図3〜図6は図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【0031】
ステントは、血管、胆管、気管、食道、尿道などの生体内の管腔に生じた狭窄部を拡張し、かつそこに留置することができれば、その材料、形状、大きさ等は特に限定されない。
【0032】
ステントを形成する材料は、適用箇所に応じて適宜選択すれば良く、例えば金属材料、高分子材料、セラミックス等が挙げられる。ステントを金属材料で形成した場合、金属材料は強度に優れているため、ステントを狭窄部に確実に留置することが可能である。また、ステントを高分子材料で形成した場合、高分子材料は柔軟性に優れているため、ステントの狭窄部への到達性(デリバリー性)という点で優れた効果を発揮する。
【0033】
金属材料としては、例えばステンレス鋼、Ni−Ti合金、タンタル、チタン、金、プラチナ、インコネル、イリジウム、タングステン、コバルト系合金等が挙げられる。そしてステンレス鋼の中では、耐食性が良好であるSUS316Lが好適である。
【0034】
高分子材料としては、例えばポリテトラフルオロエチレン、ポリエチレン、ポリプロピレン、ポリエチレンテレフタレート、セルロースアセテート、セルロースナイトレート等が挙げられる。
【0035】
ステントの形状は、生体内の管腔に生じた狭窄部に安定して留置するに足る強度を有するものであれば特に限定されず、例えば、金属材料のワイヤーや高分子材料の繊維をネット状にすることにより構成される円筒体等の任意の形状体や、図1に示すような金属材料や高分子材料で構成される円筒体に細孔を設けたものが好適に挙げられる。
図1に示す態様において、ステント10は、線状部材11からなり、内部に切り欠き部を有する略菱形の要素12を基本単位とする。複数の略菱形の要素12が、その短軸方向に連続して配置され結合することで環状ユニット13をなしている。環状ユニット13は、隣接する環状ユニットと線状の連結部材14を介して接続されている。これにより複数の環状ユニット13が一部結合した状態でその軸方向に連続して配置される。
【0036】
ステントは、バルーンエクスパンダブルタイプ、セルフエクスパンダブルタイプのいずれであってもよい。また、ステントの大きさは適用箇所に応じて適宜選択すれば良い。例えば、心臓の冠状動脈に用いる場合は、通常拡張前における外径は1.0〜3.0mm、長さは5〜50mmが好ましい。
【0037】
ステントの表面には血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がコートされており、ステントを生体内の管腔の狭窄部に留置した際に、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬はステントの留置部位およびその周辺組織内に放出される。
【0038】
血管平滑筋細胞増殖抑制薬と血管内皮細胞機能改善薬を両方コートすることにより以下の効果を有する。一般的に、血管平滑筋細胞増殖抑制薬は、血管内皮細胞の機能・増殖も抑制する。したがって、血管平滑筋細胞増殖抑制薬のみをステントにコートした場合、血管内皮細胞の機能・増殖も抑制してしまう可能性がある。しかしながら、ステントに血管平滑筋細胞増殖薬と血管内皮細胞機能改善薬を両方コートし、局所で放出されるようにすることによって、血管平滑筋細胞増殖抑制薬が血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬が血管内皮細胞の増殖および機能を改善するため、血管内膜の改善・修復がより完全に行われる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、長期間後での再狭窄(リバウンド)も起こり難くなる。
【0039】
血管内皮細胞の機能改善の程度を評価する方法としては、例えば、抗フォンビルブランドファクター抗体(Dako、CA、USA)による免疫染色が挙げられる。その結果、患部がフォンビルブランドファクター陽性の血管内皮細胞で覆われている場合、内膜修復・機能改善が確認され、一方、フォンビルブランドファクター陽性の血管内皮細胞が確認できない場合、内膜修復は認められないため、内膜肥厚が起こり、狭窄する可能性が高くなる。
【0040】
血管平滑筋細胞増殖抑制薬は、例えばシロリムス(ラパマイシン)、タクロリムス水和物、エベロリムス、エベロリムスプラス等の免疫抑制剤、パクリタキセル(タキソール)、ドセタキセル水和物等の抗癌剤、アクチノマイシンD、マイトマシンC、アドリアマイシン等の抗生物質、ゲニステイン、チルフォスチン、サイトカラシンが挙げられる。
【0041】
血管内皮細胞機能改善薬は、NO産生を促進するものが好ましく、例えばHMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬、NO供与体が挙げられる。
【0042】
HMG−CoA還元酵素阻害薬は、従来、肝臓でのコレステロール合成をブロックすることから、高脂血症治療薬として使用されているが、最近、血管壁に直接適用することによって、血管内膜の肥厚抑制に関係する効果がある事が報告されている。具体的には、LDLの酸化抑制(Massy Ziad A.,et al.,Biochem Biophys Res Commun 267 536−540(2000))、炎症反応の抑制(Sakai M.,et al.,Atherosclerosis 133 51−59(1997))、平滑筋細胞・マクロファジーの泡沫化抑制(Bellosta S.,et al.,Atherosclerosis 137 Suppl. S101−109(1998))等の効果が、それぞれ報告されている。
【0043】
そして、最近ではHMG−CoA還元酵素阻害薬のNO産性作用(Laufs U et al、Circulation (97) 1129−1135 1998)が注目されている。血管内皮細胞の機能が改善、NO産生が促進されることにより血管の内皮化が促進すると考えられている。そして、血管の内皮化促進により、平滑筋細胞の内膜側への遊走・増殖が抑制されると考えられている。
【0044】
ACE阻害薬は、生体内の強力な昇圧系であるレニン−アンギオテンシン系におけるアンギオテンシンIからアンギオテンシンIIの産生を阻害することにより、血管収縮を阻害したり、交感神経の亢進を抑制する。さらに、降圧系のカルクレイン−キニン−プロスタグランジン系に作用してブラジキニンの分解を抑制して血管を拡張させるだけでなく、プロスタグランジンの産生を促進することで血管を弛緩させ、血圧を下げる働きを有する。近年、このACE阻害薬も、内皮細胞に作用し、ブラジキニンを介してNO産生を促進することが報告されている。
【0045】
アンギオテンシンII受容体拮抗薬は、レニン−アンギオテンシン系において生成されたアンギオテンシンIIが、その主たる受容体であるアンギオテンシンII−I型受容体に結合するのを阻害することにより、血圧を下げる働きを有する。このアンギオテンシンII受容体拮抗薬も内皮細胞に作用し、アンギオテンシンII− II型受容体をアップレギュレートしてNO産生を促進することが報告されている。
【0046】
カルシウム拮抗薬は細胞膜上のカルシウムチャンネルと結合し阻害することにより、細胞内へのカルシウムイオンの流入を阻害し、血管収縮を抑制して血圧を降下させる。そして、このカルシウム拮抗薬の一種であるべシル酸アムロジピンも、内皮細胞に作用し、NO産生を促進することが報告されている(Kobayashi N,yanaka H,Tojo A,Kobayashi K,Matsuoka H.J Cardiovasc Pharm 34:173−181,1999)。
【0047】
以上より、HMG−CoA還元酵素阻害薬、アンギオテンシン変換酵素阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬の一部は、従来知られていた効能に加えて、血管内皮細胞の機能が改善、NO産生が促進されることにより血管の内皮化が促進することが期待される。
【0048】
HMG−CoA還元酵素阻害薬は、例えばシンバスタチン、セリバスタチンナトリウム、ピタバスタチン、ロバスタチン、アトルバスタチン、フルバスタチンナトリウム、プラバスタチンナトリウム、ロスバスタチンが挙げられる。
【0049】
ACE阻害薬は、例えばラミプリラット、カプトプリル、アラセプリル、マレイン酸エナラプリル、塩酸デラプリル、シラザプリル、リシノプリル、塩酸ベナゼプリル、塩酸イミダプリル、塩酸テモカプリル、塩酸キナプリル、トランドラプリル、ペリンドプリルエルブミンが挙げられる。
【0050】
アンギオテンシンII受容体拮抗薬は、例えばロサルタンカリウム、カンデサルタンシレキセチル、バルサルタンが挙げられる。
【0051】
カルシウム拮抗薬は、例えばべシル酸アムロジピンが挙げられる。
【0052】
NO供与体は、例えばS−Nitroso−N−acetyl−DL−penicillamine(SNAP)、アルギニンが挙げられる。
【0053】
ステントの表面にコートされる血管内皮細胞機能改善薬の量は、血管内皮細胞が死滅することなく、NO産生が促進される量であれば特に限定されない。また、ステントの表面にコートされる血管平滑筋細胞増殖抑制薬の量は、血管平滑筋細胞の増殖が抑制される量であれば特に限定されない。
【0054】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のステントへのコートの形態は特に限定されず、例えば、図2のように生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層21中に、血管平滑筋細胞増殖抑制薬22および血管内皮細胞機能改善薬23を含有(混合)させた形態にしてステントの表面にコートしてもよい。
また、図3のようにステントの表面に血管平滑筋細胞増殖抑制薬22および血管内皮細胞機能改善薬23を直接コートして薬剤からなる層(薬剤層31)を設け、さらにその外側を、生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層32で覆ってもよい。
【0055】
また、図4のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方41を含有させた生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層42を設け、さらにその外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方43を含有させた生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層44を設けてもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層45で覆ってもよい。これらの生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層42、44、45はそれぞれ同じであっても別であってもよい。
【0056】
また、図5のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層51を設け、さらにその外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層52を設けてもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層53で覆ってもよい。
【0057】
また、図6のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層61を設け、さらにその外側に生分解性ポリマーもしくは生体適合性ポリマーからなるバリヤー層62を設け、さらにそのバリヤー層62の外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層63を有してもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層64で覆ってもよい。生分解性ポリマーもしくは生体適合性ポリマーからなるバリヤー層62とポリマー層64は、同じであっても別であってもよい。
【0058】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生分解性ポリマーからなるポリマー層中に含有されている場合、あるいは血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬(薬剤層)の外側が生分解性ポリマーからなるポリマー層で覆われている場合は、生分解性ポリマーが分解することによって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がステントの留置部位およびその周辺組織内に直接放出される。
【0059】
生分解性ポリマーは、生体内で酵素的、非酵素的に分解され、分解産物が毒性を示さず、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の放出が可能なものであれば特に限定されないが、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸などが挙げられる。中でも長期間にわたって血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を放出することが可能であるポリ乳酸が好ましい。
【0060】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生体適合性ポリマーからなるポリマー層中に含有されている場合、あるいは血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬(薬剤層)の外側が生体適合性ポリマーからなるポリマー層で覆われている場合は、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生体適合性ポリマーの外表面に浸出することによって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がステントの留置部位およびその周辺組織に直接放出される。
【0061】
生体適合性ポリマーは、本質的に血小板が付着し難く、組織に対しても刺激性を示さず、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の浸出が可能なものであれば特に限定されないが、例えば、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンのブレンドもしくはブロック共重合体、セグメント化ポリウレタン等のポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリエチレンカーボネート、ポリプロピレンカーボネート等のポリカーボネート等、各種合成ポリマーが挙げられる。
【0062】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層中に含有されている場合、含有の態様は特に限定されず、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がポリマー層中に均一または不均一に存在していてもよく、また局所的に存在していても良い。
【0063】
本発明の体内埋込医療器具を製造する方法は特に限定されない。例えば、医療器具本体としてステントを、血管平滑筋細胞増殖抑制薬としてラパマイシンを、血管内皮細胞機能改善薬としてシンバスタチンを、生分解性ポリマーとしてポリ乳酸を、それぞれ用いる場合は、シンバスタチンとラパマイシンをジクロロエタンに溶解した溶液とポリ乳酸をジクロロエタンに溶解した溶液を混合し、この混合した溶液を、ステントにスプレーすることにより、シンバスタチンとラパマイシンを含有させたポリ乳酸層(ポリマー層)をステント表面に設ける方法等が挙げられる。
【0064】
このようにして得られた本発明の体内埋込医療器具は、生体内の管腔に直接、留置して用いることができる。そして、血管平滑筋細胞増殖抑制薬と血管内皮細胞機能改善薬はステントの留置部位およびその周辺組織内に放出され、血管平滑筋細胞増殖抑制薬により血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬によって血管内皮細胞の機能を改善させる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、再狭窄を確実に抑制することが可能である。
【実施例】
【0065】
以下、本発明を実施例によりさらに具体的に説明する。なお、本発明は下記の実施例に限定されるものではない。
(実施例1)
シンバスタチン20mgとラパマイシン20mgをジクロロエタン1mlに溶解した溶液とポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、シンバスタチンとラパマイシンを含有させたポリ乳酸層(ポリマー層)をステントの表面に設けて、本発明の体内埋込医療器具を作製した。
【0066】
(比較例1)
ラパマイシン20mgをジクロロエタン1mlに溶解した溶液とポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ラパマイシンを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0067】
(比較例2)
ポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を作製した。そして、この溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0068】
(評価1)
<ウサギ腸骨動脈バルーン擦過による血管傷害モデルを用いた治療効果比較試験>
ウサギの筋肉内にケタミン(30mg/kg)およびキシラジン(3mg/kg)を投与し麻酔した。右総頸動脈を組織より剥離した。耳介静脈よりヘパリンを約150U/kg導入後、所定の方法でシースイントロデューサーを導入した。予めガイドワイヤーを装填したPTCAバルーンを血管内に挿入し、腸骨動脈遠位部まで運んだ。バルーンを規定圧まで拡張した状態で腸骨動脈近位部までバルーンを引き血管を擦過した。このバルーン擦過を3回繰り返し実施した。続いて、実施例1にて作製した体内埋込医療器具、比較例1にて作製した体内埋込医療器具、比較例2にて作製した体内埋込医療器具をそれぞれ右腸骨動脈に導入し、規定圧で拡張留置した。バルーンを抜去後、総頸動脈を結紮し、3層縫合し、所定期間留置した。なお、留置期間は4週間および8週間とした。
【0069】
所定期間(4週間および8週間)留置後、体内埋込医療器具留置時と同様の方法で、左頸動脈から血管へアプローチし、左右腸骨動脈を造影後、開腹して腹部大静脈を露出した。頸動脈シースラインより2U/mlのヘパリン加生理食塩水による灌流を開始し、同時に腹部大静脈を切除し脱血死させた。ヘパリン加生理食塩水による全身灌流後、10%中性緩衝ホルマリン液にて全身灌流し、標的血管を固定した。固定した試料を定法に従い樹脂包埋し病理切片を作製し、ヘマトキシリン・エオジン染色を実施した。これを光学顕微鏡による観察に供し、内膜厚を測定した。実施例1、比較例1および比較例2の体内埋込医療器具についてそれぞれ3例ずつ測定を行った。これらの測定結果の平均値を表1に示す。
【0070】
また、4週間留置したものについては、内皮細胞を同定するべく抗フォンビルブランドファクター抗体(Dako、CA、USA)による免疫染色を行った。その結果、実施例1にて作製した体内埋込医療器具を留置した右腸骨動脈の血管内膜はフォンビルブランドファクター陽性の血管内皮細胞で覆われており、内膜修復・機能改善が確認されたのに対し、比較例1および比較例2の体内埋込医療器具を留置したものでは、フォンビルブランドファクター陽性の血管内皮細胞はほとんど確認できず、内膜修復は殆ど認められなかった。
【0071】
【表1】

【0072】
表1より、実施例1は、4週間後も8週間後も比較例2と比較して有意(p<0.05:pは統計処理の判定値)に肥厚抑制効果が確認され、4週間後と8週間後を比較しても内膜厚に変化は見られなかった。これに対して比較例1は、4週間後は肥厚抑制効果が見られるものの、8週間後の内膜厚が増大しており、肥厚のリバウンドが見られた。これは、ラパマイシンのみを搭載した比較例1は、前述のように4週間後の時点で内膜修復が殆ど認められていないため、体内埋込医療器具からラパマイシンが放出された後、血管平滑筋細胞の増殖抑制効果が無くなり、内膜厚が増大したものと思われる。一方、シンバスタチンとラパマイシンを搭載した実施例1は4週間後の時点で内膜が修復されていたため、体内埋込医療器具からシンバスタチンとラパマイシンが放出された後も機能改善・修復された内皮細胞により内膜肥厚が抑制されたと考えられる。
【0073】
(参考例1)
アルギニン20mgとパクリタキセル20mgをエタノール1mlに溶解した溶液とポリ乳酸40mgをアセトン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、アルギニンとパクリタキセルを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、本発明の体内埋込医療器具を作製した。
【0074】
(比較例3)
パクリタキセル20mgをエタノール1mlに溶解した溶液とポリ乳酸40mgをアセトン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、パクリタキセルを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0075】
(比較例4)
ポリ乳酸40mgをアセトン4mlに溶解した溶液を作製した。そして、この溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0076】
(評価2)
<ブタ冠動脈血管傷害モデルを用いた治療効果比較試験>
ブタ8頭に前麻酔としてアザペロンと硫酸アトロピンを筋肉内投与した。塩酸ケタミンの筋肉内投与で麻酔し、空気:酸素=1:1と2%セボフルレンの混合ガスで麻酔を維持した。
【0077】
ブタ冠動脈3枝内にそれぞれ、定法に従い参考例1で作製した体内埋込医療器具、比較例3で作製した体内埋込医療器具、比較例4で作製した体内埋込医療器具を留置した。これをブタ8頭に実施した。なお、留置期間は4週間および12週間とした。
所定期間(4週間および12週間)留置後、体内埋込医療器具留置時と同様に麻酔をし、冠動脈を血管造影した後、脱血死させ、心臓を取り出した。心臓より体内埋込医療器具を取り出し、10%中性緩衝ホルマリン液にて固定した。固定した試料を定法に従い樹脂包埋し病理切片を作製し、ヘマトキシリン・エオジン染色を実施した。これを光学顕微鏡による観察に供し、内膜断面積を測定した。参考例1、比較例3および比較例4の体内埋込医療器具についての測定結果の平均値を表2に示す。
【0078】
また、4週間留置したものについては、内皮細胞を同定するべく抗フォンビルブランドファクター抗体による免疫染色を行った。その結果、参考例1にて作製した体内埋込医療器具を留置した右腸骨動脈の血管内膜はフォンビルブランドファクター陽性の血管内皮細胞で全面覆われており、内膜修復が確認されたのに対し、比較例3および比較例4の体内埋込医療器具を留置したものでは、フォンビルブランドファクター陽性の血管内皮細胞は一部しか確認できず、内膜修復があまり進んでいないことが確認された。
【0079】
【表2】

【0080】
表2より、参考例1は4週間後も12週間後も比較例4と比較して有意(p<0.05)に肥厚抑制効果が確認され、4週間後と12週間後を比較しても内膜断面積に有意な変化は見られなかった。これに対して比較例3は、4週間後は肥厚抑制効果が見られるものの、12週間後の内膜断面積が増大しており、肥厚のリバウンドが見られた。これは、パクリタキセルのみを搭載した比較例3は、前述のように4週間後の時点で内膜修復があまり認められていないため、体内埋込医療器具からパクリタキセルが放出された後、血管平滑筋細胞の増殖抑制効果が無くなり、内膜断面積が増大したものと思われる。一方、アルギニンとパクリタキセルを搭載した参考例1は4週間後の時点で内膜が修復されていたため、体内埋込医療器具からアルギニンとパクリタキセルが放出された後も機能改善・修復された内皮細胞により内膜肥厚が抑制されたと考えられる。
【符号の説明】
【0081】
10 ステント
11 線状部材
12 略菱形の要素
13 環状ユニット
14 連結部材
21 ポリマー層
22 血管平滑筋細胞増殖抑制薬
23 血管内皮細胞機能改善薬
31 薬剤層
32 ポリマー層
41 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方
42 ポリマー層
43 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方
44 ポリマー層
45 ポリマー層
51 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層
52 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層
53 ポリマー層
61 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層
62 バリヤー層
63 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層
64 ポリマー層
【技術分野】
【0001】
本発明は、血管、胆管、気管、食道、尿道などの生体内の管腔に生じた狭窄部の改善に使用される体内埋込医療器具に関する。
【背景技術】
【0002】
ステントは、血管あるいはその他の生体内の管腔に生じた狭窄部を拡張させた状態に維持するための管状の器具であり、例えば経皮的冠動脈形成術(PTCA)後の狭窄部の改善に用いられている。PTCAは虚血性心疾患の極めて有効な治療法であるが、PTCA施行後数ヶ月以内に40〜50%の割合で再狭窄がおきるという問題点がある(Popma JJ,Topol EJ.Am J Med 88:1N−16N,1990)。PTCA後の再狭窄の原因は主として(1)血栓性閉塞、(2)バルーンによる拡張後の血管壁のエラスチンrecoilによる内腔の狭小化、(3)PTCAによって生じた冠動脈壁の傷害修復に伴う新生内膜の過剰肥厚、等が考えられる。そこで再狭窄を防止するため、PTCA後に、バルーンで血管狭窄部を拡張させ、金属製のメッシュ構造からなるステントを留置することでエラスチンrecoilを最小限に抑えるというステント療法が試みられてきた(Fischman DL,Leon MB et al.N Engl J Med 331:496−501,1994)。また、血栓性閉塞に対しては、ステント使用の場合は未使用の場合よりも多くの蔓延化した血栓が形成され、ステント挿入1〜2週間後に亜急性血栓性閉塞が生じるといった問題が生じたが、チクロピジン、アスピリンの併用により血栓形成の防止が可能になった。しかし、ステントを使用した場合、PTCAのみの場合と比べて再狭窄率は低いものの、主に内膜肥厚が原因で、約20〜30%の割合で再狭窄が認められ、この問題は依然として解決していない。
【0003】
ステント留置後の再狭窄の主な原因である内膜肥厚は、以下のようなメカニズムで起きると考えられている。PTCAやステント留置時に生じた内膜障害により、ステントワイヤー周囲に血小板が凝集して血栓が形成され、そこからPlatelet Derived Growth Factor(PDGF)やTransforming Growth Factor(TGF)等のサイトカインや12−hydroxyeicosatetraenoic(12−HETE)等の物質が放出される。一方、内膜障害部位では単球等の炎症細胞が、vascular cell adhesion molecule−1(VCAM−1)、intercellular adhesion molecule−1(ICAM−1)やセレクチン等の接着分子を介して血管壁に接着し、ステントワイヤー周辺部に集積するのと同時に血管壁内に侵入しながら、PDGF等の様々な生理活性物質を放出する。さらに血管平滑筋細胞の活性化を制御していた内皮細胞が内膜障害により脱落もしくは機能低下することに加え、PDGF等の様々な生理活性物質の刺激、あるいは血管拡張時に生じた血管壁の機械的破壊が引き金となり、血管中膜の平滑筋細胞が活性化されて、収縮型から合成型に形質転換される。そして、合成型平滑筋細胞は血管内膜へ遊走するとともに過剰増殖することによって内膜肥厚が生じる。
【0004】
そこで内膜肥厚の直接の原因である血管平滑筋細胞の遊走・増殖を抑制し得る薬剤をステントに搭載して、ステント留置部位で放出することにより、再狭窄を予防する検討が種々なされている。このような薬剤の具体的な例としては、特許文献1にタキソール(パクリタキセル)が、特許文献2にマイトマシンC、アドリアマイシン、ゲニステイン、チルフォスチンが、また、特許文献3にサイトカラシンが、それぞれ開示されている。また、最近ではシロリムス(ラパマイシン)を搭載したステントも報告されている。しかし、これらの薬剤は障害もしくは機能低下した血管内膜の改善・修復作用を有さず、血管平滑筋細胞の増殖・遊走を直接抑えているだけなので、薬剤が放出されてステント留置部における薬剤の濃度が低下した時に再狭窄の発症が危惧される。また、これらの薬剤は、血管の治癒過程で必要不可欠な血管内皮細胞の機能まで抑制してしまう可能性もある。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】特表平9−503488号公報
【特許文献2】特開平9−56807号公報
【特許文献3】特表平11−500635号公報
【発明の概要】
【発明が解決しようとする課題】
【0006】
そこで、本発明の目的は、生体内の管腔に直接、局所的に適用することが可能であり、なおかつ血管平滑筋細胞の増殖を抑制すると共に血管内皮細胞の機能を改善させて血管の内皮化を促進し、再狭窄を確実に抑制する体内埋込医療器具を提供することにある。
【課題を解決するための手段】
【0007】
このような目的は、下記1〜6の本発明により達成される。
【0008】
1. 医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
2. 前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記1に記載の体内埋込医療器具。
3. 前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記1に記載の体内埋込医療器具。
4. 前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、
前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする上記2または3に記載の体内埋込医療器具。
5. 前記医療器具本体が、ステントであることを特徴とする上記1〜4のいずれかに記載の体内埋込医療器具。
6. 前記NO産生を促進するものが、HMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬およびNO供与体からなる群から選ばれる少なくとも1種である上記1〜5のいずれかに記載の体内埋込医療器具。
【0009】
また、このような目的は、下記(1)〜(14)の本発明により達成される。
(1)医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されていることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【0010】
(2)前記血管内皮細胞機能改善薬が、HMG−CoA還元酵素阻害薬であることを特徴とする上記(1)に記載の体内埋込医療器具。
【0011】
(3)前記HMG−CoA還元酵素阻害薬が、シンバスタチン、セリバスタチンナトリウム、ピタバスタチン、ロバスタチン、アトルバスタチン、フルバスタチンナトリウム、プラバスタチンナトリウム、ロスバスタチンのいずれかであることを特徴とする上記(2)に記載の体内埋込医療器具。
【0012】
(4)前記血管内皮細胞機能改善薬が、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬のいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0013】
(5)前記血管内皮細胞機能改善薬が、NO供与体であることを特徴とする上記(1)に記載の体内埋込医療器具。
【0014】
(6)前記NO供与体が、S−Nitroso−N−acetyl−DL−penicillamine(SNAP)またはアルギニンであることを特徴とする上記(5)に記載の体内埋込医療器具。
【0015】
(7)前記血管平滑筋細胞増殖抑制薬が、免疫抑制剤、抗癌剤、抗生物質、ゲニステイン、チルフォスチン、サイトカラシンのいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0016】
(8)前記血管平滑筋細胞増殖抑制薬が、シロリムス(ラパマイシン)、タクロリムス水和物、エベロリムス、エベロリムスプラス、パクリタキセル(タキソール)、ドセタキセル水和物、アクチノマイシンD、マイトマイシンC、アドリアマイシンのいずれかであることを特徴とする上記(1)に記載の体内埋込医療器具。
【0017】
(9)前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0018】
(10)前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0019】
(11)前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする上記(9)または(10)に記載の体内埋込医療器具。
【0020】
(12)前記医療器具本体が、ステントであることを特徴とする上記(1)〜(11)のいずれかに記載の体内埋込医療器具。
【0021】
(13)前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を、生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層中に含有させた形態にして前記医療器具本体に搭載したことを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【0022】
(14)前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を、前記医療器具本体の表面に直接搭載し、かつ前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層で被覆したことを特徴とする上記(1)〜(8)のいずれかに記載の体内埋込医療器具。
【発明の効果】
【0023】
以上述べたように本発明は、生体内の管腔に留置するための体内埋込医療器具であって、医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されていることを特徴とするため、生体内の管腔に直接、局所的に適用することが可能である。そして、血管平滑筋細胞増殖抑制薬の放出により血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬を放出して血管内皮細胞の機能を改善させる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、再狭窄を確実に抑制することが可能である。
【0024】
また、前記医療器具本体が、ステントであることを特徴とする場合、生体内の管腔に生じた狭窄部を拡張し、その拡張された内腔を確保するためにそこに長期間留置することが可能である。
【図面の簡単な説明】
【0025】
【図1】図1は、ステントの一態様を示す側面図である。
【図2】図2は、図1の線A−Aに沿って切断した拡大横断面図である。
【図3】図3は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図4】図4は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図5】図5は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【図6】図6は、図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【発明を実施するための形態】
【0026】
以下、本発明の体内埋込医療器具について詳細に説明する。
【0027】
本発明の体内埋込医療器具は、医療器具本体と、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬で構成されている。
【0028】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬は、医療器具本体の表面にコートされていても良く、また医療器具本体自体に含有されていても良い。
【0029】
医療器具本体は、例えばステント、カテーテル、バルーン、血管補綴材、人工血管等が挙げられ、中でも生体内の管腔に生じた狭窄部を拡張し、その拡張された内腔を確保するためにそこに長期間留置することが可能であるステントが好ましい態様である。以下、医療器具本体がステントである場合について添付図面に示す好適な実施の形態に基づいてより詳細に説明する。
【0030】
図1はステントの一態様を示す側面図、図2は図1の線A−Aに沿って切断した拡大横断面図、図3〜図6は図2と同様の図であって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のコートの形態が異なる態様を示す。
【0031】
ステントは、血管、胆管、気管、食道、尿道などの生体内の管腔に生じた狭窄部を拡張し、かつそこに留置することができれば、その材料、形状、大きさ等は特に限定されない。
【0032】
ステントを形成する材料は、適用箇所に応じて適宜選択すれば良く、例えば金属材料、高分子材料、セラミックス等が挙げられる。ステントを金属材料で形成した場合、金属材料は強度に優れているため、ステントを狭窄部に確実に留置することが可能である。また、ステントを高分子材料で形成した場合、高分子材料は柔軟性に優れているため、ステントの狭窄部への到達性(デリバリー性)という点で優れた効果を発揮する。
【0033】
金属材料としては、例えばステンレス鋼、Ni−Ti合金、タンタル、チタン、金、プラチナ、インコネル、イリジウム、タングステン、コバルト系合金等が挙げられる。そしてステンレス鋼の中では、耐食性が良好であるSUS316Lが好適である。
【0034】
高分子材料としては、例えばポリテトラフルオロエチレン、ポリエチレン、ポリプロピレン、ポリエチレンテレフタレート、セルロースアセテート、セルロースナイトレート等が挙げられる。
【0035】
ステントの形状は、生体内の管腔に生じた狭窄部に安定して留置するに足る強度を有するものであれば特に限定されず、例えば、金属材料のワイヤーや高分子材料の繊維をネット状にすることにより構成される円筒体等の任意の形状体や、図1に示すような金属材料や高分子材料で構成される円筒体に細孔を設けたものが好適に挙げられる。
図1に示す態様において、ステント10は、線状部材11からなり、内部に切り欠き部を有する略菱形の要素12を基本単位とする。複数の略菱形の要素12が、その短軸方向に連続して配置され結合することで環状ユニット13をなしている。環状ユニット13は、隣接する環状ユニットと線状の連結部材14を介して接続されている。これにより複数の環状ユニット13が一部結合した状態でその軸方向に連続して配置される。
【0036】
ステントは、バルーンエクスパンダブルタイプ、セルフエクスパンダブルタイプのいずれであってもよい。また、ステントの大きさは適用箇所に応じて適宜選択すれば良い。例えば、心臓の冠状動脈に用いる場合は、通常拡張前における外径は1.0〜3.0mm、長さは5〜50mmが好ましい。
【0037】
ステントの表面には血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がコートされており、ステントを生体内の管腔の狭窄部に留置した際に、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬はステントの留置部位およびその周辺組織内に放出される。
【0038】
血管平滑筋細胞増殖抑制薬と血管内皮細胞機能改善薬を両方コートすることにより以下の効果を有する。一般的に、血管平滑筋細胞増殖抑制薬は、血管内皮細胞の機能・増殖も抑制する。したがって、血管平滑筋細胞増殖抑制薬のみをステントにコートした場合、血管内皮細胞の機能・増殖も抑制してしまう可能性がある。しかしながら、ステントに血管平滑筋細胞増殖薬と血管内皮細胞機能改善薬を両方コートし、局所で放出されるようにすることによって、血管平滑筋細胞増殖抑制薬が血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬が血管内皮細胞の増殖および機能を改善するため、血管内膜の改善・修復がより完全に行われる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、長期間後での再狭窄(リバウンド)も起こり難くなる。
【0039】
血管内皮細胞の機能改善の程度を評価する方法としては、例えば、抗フォンビルブランドファクター抗体(Dako、CA、USA)による免疫染色が挙げられる。その結果、患部がフォンビルブランドファクター陽性の血管内皮細胞で覆われている場合、内膜修復・機能改善が確認され、一方、フォンビルブランドファクター陽性の血管内皮細胞が確認できない場合、内膜修復は認められないため、内膜肥厚が起こり、狭窄する可能性が高くなる。
【0040】
血管平滑筋細胞増殖抑制薬は、例えばシロリムス(ラパマイシン)、タクロリムス水和物、エベロリムス、エベロリムスプラス等の免疫抑制剤、パクリタキセル(タキソール)、ドセタキセル水和物等の抗癌剤、アクチノマイシンD、マイトマシンC、アドリアマイシン等の抗生物質、ゲニステイン、チルフォスチン、サイトカラシンが挙げられる。
【0041】
血管内皮細胞機能改善薬は、NO産生を促進するものが好ましく、例えばHMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬、NO供与体が挙げられる。
【0042】
HMG−CoA還元酵素阻害薬は、従来、肝臓でのコレステロール合成をブロックすることから、高脂血症治療薬として使用されているが、最近、血管壁に直接適用することによって、血管内膜の肥厚抑制に関係する効果がある事が報告されている。具体的には、LDLの酸化抑制(Massy Ziad A.,et al.,Biochem Biophys Res Commun 267 536−540(2000))、炎症反応の抑制(Sakai M.,et al.,Atherosclerosis 133 51−59(1997))、平滑筋細胞・マクロファジーの泡沫化抑制(Bellosta S.,et al.,Atherosclerosis 137 Suppl. S101−109(1998))等の効果が、それぞれ報告されている。
【0043】
そして、最近ではHMG−CoA還元酵素阻害薬のNO産性作用(Laufs U et al、Circulation (97) 1129−1135 1998)が注目されている。血管内皮細胞の機能が改善、NO産生が促進されることにより血管の内皮化が促進すると考えられている。そして、血管の内皮化促進により、平滑筋細胞の内膜側への遊走・増殖が抑制されると考えられている。
【0044】
ACE阻害薬は、生体内の強力な昇圧系であるレニン−アンギオテンシン系におけるアンギオテンシンIからアンギオテンシンIIの産生を阻害することにより、血管収縮を阻害したり、交感神経の亢進を抑制する。さらに、降圧系のカルクレイン−キニン−プロスタグランジン系に作用してブラジキニンの分解を抑制して血管を拡張させるだけでなく、プロスタグランジンの産生を促進することで血管を弛緩させ、血圧を下げる働きを有する。近年、このACE阻害薬も、内皮細胞に作用し、ブラジキニンを介してNO産生を促進することが報告されている。
【0045】
アンギオテンシンII受容体拮抗薬は、レニン−アンギオテンシン系において生成されたアンギオテンシンIIが、その主たる受容体であるアンギオテンシンII−I型受容体に結合するのを阻害することにより、血圧を下げる働きを有する。このアンギオテンシンII受容体拮抗薬も内皮細胞に作用し、アンギオテンシンII− II型受容体をアップレギュレートしてNO産生を促進することが報告されている。
【0046】
カルシウム拮抗薬は細胞膜上のカルシウムチャンネルと結合し阻害することにより、細胞内へのカルシウムイオンの流入を阻害し、血管収縮を抑制して血圧を降下させる。そして、このカルシウム拮抗薬の一種であるべシル酸アムロジピンも、内皮細胞に作用し、NO産生を促進することが報告されている(Kobayashi N,yanaka H,Tojo A,Kobayashi K,Matsuoka H.J Cardiovasc Pharm 34:173−181,1999)。
【0047】
以上より、HMG−CoA還元酵素阻害薬、アンギオテンシン変換酵素阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬の一部は、従来知られていた効能に加えて、血管内皮細胞の機能が改善、NO産生が促進されることにより血管の内皮化が促進することが期待される。
【0048】
HMG−CoA還元酵素阻害薬は、例えばシンバスタチン、セリバスタチンナトリウム、ピタバスタチン、ロバスタチン、アトルバスタチン、フルバスタチンナトリウム、プラバスタチンナトリウム、ロスバスタチンが挙げられる。
【0049】
ACE阻害薬は、例えばラミプリラット、カプトプリル、アラセプリル、マレイン酸エナラプリル、塩酸デラプリル、シラザプリル、リシノプリル、塩酸ベナゼプリル、塩酸イミダプリル、塩酸テモカプリル、塩酸キナプリル、トランドラプリル、ペリンドプリルエルブミンが挙げられる。
【0050】
アンギオテンシンII受容体拮抗薬は、例えばロサルタンカリウム、カンデサルタンシレキセチル、バルサルタンが挙げられる。
【0051】
カルシウム拮抗薬は、例えばべシル酸アムロジピンが挙げられる。
【0052】
NO供与体は、例えばS−Nitroso−N−acetyl−DL−penicillamine(SNAP)、アルギニンが挙げられる。
【0053】
ステントの表面にコートされる血管内皮細胞機能改善薬の量は、血管内皮細胞が死滅することなく、NO産生が促進される量であれば特に限定されない。また、ステントの表面にコートされる血管平滑筋細胞増殖抑制薬の量は、血管平滑筋細胞の増殖が抑制される量であれば特に限定されない。
【0054】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬のステントへのコートの形態は特に限定されず、例えば、図2のように生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層21中に、血管平滑筋細胞増殖抑制薬22および血管内皮細胞機能改善薬23を含有(混合)させた形態にしてステントの表面にコートしてもよい。
また、図3のようにステントの表面に血管平滑筋細胞増殖抑制薬22および血管内皮細胞機能改善薬23を直接コートして薬剤からなる層(薬剤層31)を設け、さらにその外側を、生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層32で覆ってもよい。
【0055】
また、図4のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方41を含有させた生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層42を設け、さらにその外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方43を含有させた生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層44を設けてもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層45で覆ってもよい。これらの生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層42、44、45はそれぞれ同じであっても別であってもよい。
【0056】
また、図5のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層51を設け、さらにその外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層52を設けてもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層53で覆ってもよい。
【0057】
また、図6のようにステントの表面に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層61を設け、さらにその外側に生分解性ポリマーもしくは生体適合性ポリマーからなるバリヤー層62を設け、さらにそのバリヤー層62の外側に血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層63を有してもよく、さらにその外側を生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層64で覆ってもよい。生分解性ポリマーもしくは生体適合性ポリマーからなるバリヤー層62とポリマー層64は、同じであっても別であってもよい。
【0058】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生分解性ポリマーからなるポリマー層中に含有されている場合、あるいは血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬(薬剤層)の外側が生分解性ポリマーからなるポリマー層で覆われている場合は、生分解性ポリマーが分解することによって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がステントの留置部位およびその周辺組織内に直接放出される。
【0059】
生分解性ポリマーは、生体内で酵素的、非酵素的に分解され、分解産物が毒性を示さず、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の放出が可能なものであれば特に限定されないが、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸などが挙げられる。中でも長期間にわたって血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を放出することが可能であるポリ乳酸が好ましい。
【0060】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生体適合性ポリマーからなるポリマー層中に含有されている場合、あるいは血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬(薬剤層)の外側が生体適合性ポリマーからなるポリマー層で覆われている場合は、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生体適合性ポリマーの外表面に浸出することによって、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がステントの留置部位およびその周辺組織に直接放出される。
【0061】
生体適合性ポリマーは、本質的に血小板が付着し難く、組織に対しても刺激性を示さず、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の浸出が可能なものであれば特に限定されないが、例えば、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンのブレンドもしくはブロック共重合体、セグメント化ポリウレタン等のポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリエチレンカーボネート、ポリプロピレンカーボネート等のポリカーボネート等、各種合成ポリマーが挙げられる。
【0062】
血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬が生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層中に含有されている場合、含有の態様は特に限定されず、血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬がポリマー層中に均一または不均一に存在していてもよく、また局所的に存在していても良い。
【0063】
本発明の体内埋込医療器具を製造する方法は特に限定されない。例えば、医療器具本体としてステントを、血管平滑筋細胞増殖抑制薬としてラパマイシンを、血管内皮細胞機能改善薬としてシンバスタチンを、生分解性ポリマーとしてポリ乳酸を、それぞれ用いる場合は、シンバスタチンとラパマイシンをジクロロエタンに溶解した溶液とポリ乳酸をジクロロエタンに溶解した溶液を混合し、この混合した溶液を、ステントにスプレーすることにより、シンバスタチンとラパマイシンを含有させたポリ乳酸層(ポリマー層)をステント表面に設ける方法等が挙げられる。
【0064】
このようにして得られた本発明の体内埋込医療器具は、生体内の管腔に直接、留置して用いることができる。そして、血管平滑筋細胞増殖抑制薬と血管内皮細胞機能改善薬はステントの留置部位およびその周辺組織内に放出され、血管平滑筋細胞増殖抑制薬により血管平滑筋細胞の増殖を抑制すると共に、血管内皮細胞機能改善薬によって血管内皮細胞の機能を改善させる。したがって、血管平滑筋細胞増殖抑制薬の放出が終了した後でも、機能改善された内皮細胞により内膜肥厚が抑制されるため、再狭窄を確実に抑制することが可能である。
【実施例】
【0065】
以下、本発明を実施例によりさらに具体的に説明する。なお、本発明は下記の実施例に限定されるものではない。
(実施例1)
シンバスタチン20mgとラパマイシン20mgをジクロロエタン1mlに溶解した溶液とポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、シンバスタチンとラパマイシンを含有させたポリ乳酸層(ポリマー層)をステントの表面に設けて、本発明の体内埋込医療器具を作製した。
【0066】
(比較例1)
ラパマイシン20mgをジクロロエタン1mlに溶解した溶液とポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ラパマイシンを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0067】
(比較例2)
ポリ乳酸40mgをジクロロエタン4mlに溶解した溶液を作製した。そして、この溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0068】
(評価1)
<ウサギ腸骨動脈バルーン擦過による血管傷害モデルを用いた治療効果比較試験>
ウサギの筋肉内にケタミン(30mg/kg)およびキシラジン(3mg/kg)を投与し麻酔した。右総頸動脈を組織より剥離した。耳介静脈よりヘパリンを約150U/kg導入後、所定の方法でシースイントロデューサーを導入した。予めガイドワイヤーを装填したPTCAバルーンを血管内に挿入し、腸骨動脈遠位部まで運んだ。バルーンを規定圧まで拡張した状態で腸骨動脈近位部までバルーンを引き血管を擦過した。このバルーン擦過を3回繰り返し実施した。続いて、実施例1にて作製した体内埋込医療器具、比較例1にて作製した体内埋込医療器具、比較例2にて作製した体内埋込医療器具をそれぞれ右腸骨動脈に導入し、規定圧で拡張留置した。バルーンを抜去後、総頸動脈を結紮し、3層縫合し、所定期間留置した。なお、留置期間は4週間および8週間とした。
【0069】
所定期間(4週間および8週間)留置後、体内埋込医療器具留置時と同様の方法で、左頸動脈から血管へアプローチし、左右腸骨動脈を造影後、開腹して腹部大静脈を露出した。頸動脈シースラインより2U/mlのヘパリン加生理食塩水による灌流を開始し、同時に腹部大静脈を切除し脱血死させた。ヘパリン加生理食塩水による全身灌流後、10%中性緩衝ホルマリン液にて全身灌流し、標的血管を固定した。固定した試料を定法に従い樹脂包埋し病理切片を作製し、ヘマトキシリン・エオジン染色を実施した。これを光学顕微鏡による観察に供し、内膜厚を測定した。実施例1、比較例1および比較例2の体内埋込医療器具についてそれぞれ3例ずつ測定を行った。これらの測定結果の平均値を表1に示す。
【0070】
また、4週間留置したものについては、内皮細胞を同定するべく抗フォンビルブランドファクター抗体(Dako、CA、USA)による免疫染色を行った。その結果、実施例1にて作製した体内埋込医療器具を留置した右腸骨動脈の血管内膜はフォンビルブランドファクター陽性の血管内皮細胞で覆われており、内膜修復・機能改善が確認されたのに対し、比較例1および比較例2の体内埋込医療器具を留置したものでは、フォンビルブランドファクター陽性の血管内皮細胞はほとんど確認できず、内膜修復は殆ど認められなかった。
【0071】
【表1】

【0072】
表1より、実施例1は、4週間後も8週間後も比較例2と比較して有意(p<0.05:pは統計処理の判定値)に肥厚抑制効果が確認され、4週間後と8週間後を比較しても内膜厚に変化は見られなかった。これに対して比較例1は、4週間後は肥厚抑制効果が見られるものの、8週間後の内膜厚が増大しており、肥厚のリバウンドが見られた。これは、ラパマイシンのみを搭載した比較例1は、前述のように4週間後の時点で内膜修復が殆ど認められていないため、体内埋込医療器具からラパマイシンが放出された後、血管平滑筋細胞の増殖抑制効果が無くなり、内膜厚が増大したものと思われる。一方、シンバスタチンとラパマイシンを搭載した実施例1は4週間後の時点で内膜が修復されていたため、体内埋込医療器具からシンバスタチンとラパマイシンが放出された後も機能改善・修復された内皮細胞により内膜肥厚が抑制されたと考えられる。
【0073】
(参考例1)
アルギニン20mgとパクリタキセル20mgをエタノール1mlに溶解した溶液とポリ乳酸40mgをアセトン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、アルギニンとパクリタキセルを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、本発明の体内埋込医療器具を作製した。
【0074】
(比較例3)
パクリタキセル20mgをエタノール1mlに溶解した溶液とポリ乳酸40mgをアセトン4mlに溶解した溶液を混合した。そして、この混合した溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、パクリタキセルを含有させたポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0075】
(比較例4)
ポリ乳酸40mgをアセトン4mlに溶解した溶液を作製した。そして、この溶液を、直径2mmのステンレスパイプを加工して作製した長さ15mmのステントにスプレーすることにより、ポリ乳酸層(ポリマー層)をステント表面に設けて、体内埋込医療器具を作製した。
【0076】
(評価2)
<ブタ冠動脈血管傷害モデルを用いた治療効果比較試験>
ブタ8頭に前麻酔としてアザペロンと硫酸アトロピンを筋肉内投与した。塩酸ケタミンの筋肉内投与で麻酔し、空気:酸素=1:1と2%セボフルレンの混合ガスで麻酔を維持した。
【0077】
ブタ冠動脈3枝内にそれぞれ、定法に従い参考例1で作製した体内埋込医療器具、比較例3で作製した体内埋込医療器具、比較例4で作製した体内埋込医療器具を留置した。これをブタ8頭に実施した。なお、留置期間は4週間および12週間とした。
所定期間(4週間および12週間)留置後、体内埋込医療器具留置時と同様に麻酔をし、冠動脈を血管造影した後、脱血死させ、心臓を取り出した。心臓より体内埋込医療器具を取り出し、10%中性緩衝ホルマリン液にて固定した。固定した試料を定法に従い樹脂包埋し病理切片を作製し、ヘマトキシリン・エオジン染色を実施した。これを光学顕微鏡による観察に供し、内膜断面積を測定した。参考例1、比較例3および比較例4の体内埋込医療器具についての測定結果の平均値を表2に示す。
【0078】
また、4週間留置したものについては、内皮細胞を同定するべく抗フォンビルブランドファクター抗体による免疫染色を行った。その結果、参考例1にて作製した体内埋込医療器具を留置した右腸骨動脈の血管内膜はフォンビルブランドファクター陽性の血管内皮細胞で全面覆われており、内膜修復が確認されたのに対し、比較例3および比較例4の体内埋込医療器具を留置したものでは、フォンビルブランドファクター陽性の血管内皮細胞は一部しか確認できず、内膜修復があまり進んでいないことが確認された。
【0079】
【表2】

【0080】
表2より、参考例1は4週間後も12週間後も比較例4と比較して有意(p<0.05)に肥厚抑制効果が確認され、4週間後と12週間後を比較しても内膜断面積に有意な変化は見られなかった。これに対して比較例3は、4週間後は肥厚抑制効果が見られるものの、12週間後の内膜断面積が増大しており、肥厚のリバウンドが見られた。これは、パクリタキセルのみを搭載した比較例3は、前述のように4週間後の時点で内膜修復があまり認められていないため、体内埋込医療器具からパクリタキセルが放出された後、血管平滑筋細胞の増殖抑制効果が無くなり、内膜断面積が増大したものと思われる。一方、アルギニンとパクリタキセルを搭載した参考例1は4週間後の時点で内膜が修復されていたため、体内埋込医療器具からアルギニンとパクリタキセルが放出された後も機能改善・修復された内皮細胞により内膜肥厚が抑制されたと考えられる。
【符号の説明】
【0081】
10 ステント
11 線状部材
12 略菱形の要素
13 環状ユニット
14 連結部材
21 ポリマー層
22 血管平滑筋細胞増殖抑制薬
23 血管内皮細胞機能改善薬
31 薬剤層
32 ポリマー層
41 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方
42 ポリマー層
43 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方
44 ポリマー層
45 ポリマー層
51 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層
52 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層
53 ポリマー層
61 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の一方からなる薬剤層
62 バリヤー層
63 血管平滑筋細胞増殖抑制薬または血管内皮細胞機能改善薬の他方からなる薬剤層
64 ポリマー層
【特許請求の範囲】
【請求項1】
医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【請求項2】
前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする請求項1に記載の体内埋込医療器具。
【請求項3】
前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする請求項1に記載の体内埋込医療器具。
【請求項4】
前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、
前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする請求項2または3に記載の体内埋込医療器具。
【請求項5】
前記医療器具本体が、ステントであることを特徴とする請求項1〜4のいずれかに記載の体内埋込医療器具。
【請求項6】
前記NO産生を促進するものが、HMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬およびNO供与体からなる群から選ばれる少なくとも1種である請求項1〜5のいずれかに記載の体内埋込医療器具。
【請求項1】
医療器具本体と、前記医療器具本体に搭載された血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬から構成されており、前記血管平滑筋細胞増殖抑制薬が免疫抑制剤であり、前記血管内皮細胞機能改善薬がNO産生を促進するものであることを特徴とする生体内の管腔に留置するための体内埋込医療器具。
【請求項2】
前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を内部に含有する生分解性ポリマーもしくは生体適合性ポリマーからなるポリマー層を有することを特徴とする請求項1に記載の体内埋込医療器具。
【請求項3】
前記医療器具本体の表面に、前記血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬を有し、該血管平滑筋細胞増殖抑制薬および血管内皮細胞機能改善薬の外側に生分解性ポリマーまたは生体適合性ポリマーからなるポリマー層を有することを特徴とする請求項1に記載の体内埋込医療器具。
【請求項4】
前記生分解性ポリマーが、ポリ乳酸、ポリグリコール酸、ポリ乳酸−ポリグリコール酸共重合体、ポリヒドロキシ酪酸、ポリリンゴ酸、ポリα−アミノ酸、コラーゲン、ラミニン、ヘパラン硫酸、フィブロネクチン、ビトロネクチン、コンドロイチン硫酸、ヒアルロン酸のいずれかであり、
前記生体適合性ポリマーが、シリコーン、ポリエーテル型ポリウレタンとジメチルシリコンとのブレンドまたはブロック共重合体、ポリウレタン、ポリアクリルアミド、ポリエチレンオキサイド、ポリカーボネートのいずれかであることを特徴とする請求項2または3に記載の体内埋込医療器具。
【請求項5】
前記医療器具本体が、ステントであることを特徴とする請求項1〜4のいずれかに記載の体内埋込医療器具。
【請求項6】
前記NO産生を促進するものが、HMG−CoA還元酵素阻害薬、ACE阻害薬、アンギオテンシンII受容体拮抗薬、カルシウム拮抗薬およびNO供与体からなる群から選ばれる少なくとも1種である請求項1〜5のいずれかに記載の体内埋込医療器具。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2010−155095(P2010−155095A)
【公開日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願番号】特願2010−32442(P2010−32442)
【出願日】平成22年2月17日(2010.2.17)
【分割の表示】特願2003−296674(P2003−296674)の分割
【原出願日】平成15年8月20日(2003.8.20)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
【公開日】平成22年7月15日(2010.7.15)
【国際特許分類】
【出願日】平成22年2月17日(2010.2.17)
【分割の表示】特願2003−296674(P2003−296674)の分割
【原出願日】平成15年8月20日(2003.8.20)
【出願人】(000109543)テルモ株式会社 (2,232)
【Fターム(参考)】
[ Back to top ]

