体内臓器の動画像生成装置および体内臓器の動画像生成方法
【課題】断面画像において鮮明に表示され難い体内臓器の所定部位を、複数の断面画像から自動的に求めて3次元的な動画像を生成すること。
【解決手段】体内臓器における断面画像を各撮影位置において連続的に撮影する断面画像撮影手段2〜5,7〜14と、断面画像の画像解析を行う画像解析手段6とを有し、画像解析手段6は、連続的に撮影された断面画像のうち最初に撮影された断面画像に対して、ユーザにより設定された所定部位を示すマークを付加し、その後に撮影された断面画像に2次元連続DPを用いてマークを付加することにより全ての断面画像にマークを付加し、マークの重心位置を全ての断面画像について算出し、算出された重心位置に基づいて3次元空間における部位の座標情報求め、座標情報に基づいて3次元的なスプライン曲線を求めて部位の3次元的な形状を求め、部位における3次元的な動画像を生成する。
【解決手段】体内臓器における断面画像を各撮影位置において連続的に撮影する断面画像撮影手段2〜5,7〜14と、断面画像の画像解析を行う画像解析手段6とを有し、画像解析手段6は、連続的に撮影された断面画像のうち最初に撮影された断面画像に対して、ユーザにより設定された所定部位を示すマークを付加し、その後に撮影された断面画像に2次元連続DPを用いてマークを付加することにより全ての断面画像にマークを付加し、マークの重心位置を全ての断面画像について算出し、算出された重心位置に基づいて3次元空間における部位の座標情報求め、座標情報に基づいて3次元的なスプライン曲線を求めて部位の3次元的な形状を求め、部位における3次元的な動画像を生成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、体内臓器の動画像生成装置および体内臓器の動画像生成方法に関し、より詳細には、体内臓器を一定時間間隔で連続的に撮影した複数の撮影画像に基づいて、臓器の所定部位の状態を3次元的な動画像として提供することが可能な体内臓器の動画像生成装置および体内臓器の動画像生成方法に関する。
【背景技術】
【0002】
従来より、体内臓器の状態を医師が判断するために、超音波CT(Computed Tomography:コンピュータ断層撮影)、弱X線CT、MRI(Magnetic Resonance Imaging:磁気共鳴画像法)などの一般的な臓器撮影機器による臓器撮影方法を用いて、体内臓器の状態を2次元的な断面画像として撮影する(画像解析により断面画像を求める)方法が知られている。医師は、撮影タイミングあるいは撮影位置の異なる複数の2次元画像を比較・検討することにより、臓器の状態を判断している。
【0003】
ここで、上述した臓器撮影機器は、身体の一断面の画像、あるいは一方向からの画像を撮影するものであるため、画像全体から診断対象となる体内臓器の特定を行うことが容易ではないという問題があった。
【0004】
また、上述した臓器撮影機器では、断面画像において明確(鮮明)に映し出す(撮影する)ことが困難な体内臓器が存在する。例えば、弱X線CTでは、臓器が骨部の内側にあると、その骨によって臓器部分が遮断されてしまうという問題があった。また超音波CTでは、画像の解像度が十分でなく不鮮明な画像になってしまうという問題があった。さらにMRIでは、骨による臓器部分の遮断はないが、臓器の筋肉(例えば心臓の筋肉)や腱(例えば心臓の三尖弁など)の部位が画像において黒く映ってしまい、画像から直接筋肉や腱を特定することが困難であるという問題があった。
【0005】
MRIを用いる場合、心臓の心房のように血液で満たされている器官に関しては、その臓器の存在を比較的明確に断面画像に映し出す(撮影する)ことができる。しかしながら、血液で満たされていない腱や筋肉などは、MRI画像に鮮明に映し出す(撮影する)ことが困難であった。従って、医師は、明暗レベル調整などを行うことによりMRI画像の改善を図ったうえで、不鮮明な部位の予測・特定を行い、診断対象となる部位を診断しなければならかった。このため、腱や筋肉などの部位の状態を判断することが困難であり、医師の経験や技量によって判断が異なってしまうおそれがあるという問題があった。
【0006】
さらに、上述した臓器撮影機器は、臓器の2次元的な画像を撮影するものであるため、本来3次元的な動きを行う臓器の活動状況を3次元的な動きとして映像化することが困難であった。
【0007】
例えば、心臓の三尖弁の動きを3次元的に観察することができれば、弁が正常に働いているか否かの判断を容易に行うことが可能となる。しかしながら、上述したように三尖弁は腱であって、CT画像やMRI画像において鮮明に表示することが困難な部位であるため、3次元的な動きはもちろんのこと、2次元画像においてもその部位を特定することが容易ではなかった。
【0008】
このため、複数のCT画像から三尖弁の位置を推測して手作業で三尖弁リングの形状を推測する研究がなされている(例えば、非特許文献1参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Shota Fukuda, et al, "Three-Dimensional Geometry of the Tricuspid Annulus in Healthy subjects and in Patients with Functional Tricuspid Regurgitation -A Real-time, 3-Dimensional Echocardiographic Study-", American Heart Association, Circulation.2006, 114(Suppl I):I-492-498
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、上述した非特許文献1の手法では、複数のCT画像のそれぞれにおいて三尖弁リングの位置を推測し、位置の推測が行われたそれぞれの複数のCT画像から3次元的な位置を算出して、1つ1つ手作業で三尖弁リングの3次元的な位置を求める必要がある。このため、三尖弁リングの3次元画像を求めるだけで、多大な労力が必要となってしまう。さらに、このようにして求められる三尖弁リングの3次元画像を動画像にするためには、さらなる負担が必要とされ、3次元的な動画像を得ることが大変困難なものであった。
【0011】
本発明は上記課題に鑑みてなされたものであり、MRI画像等の断面画像において必ずしも鮮明に表示されない体内臓器の所定部位を、複数の断面画像において自動的に求めて、該当する所定部位における状態変化を3次元的な動画像として示すことが可能な体内臓器の動画像生成装置および体内臓器の動画像生成方法を提供することを課題とする。
【課題を解決するための手段】
【0012】
上記課題を解決するために、本発明に係る体内臓器の動画像生成装置は、体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段とを有し、前記撮影制御手段は、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、前記画像解析手段は、前記記録手段に記録された断面画像を読み出して、一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成することを特徴とする。
【0013】
また、本発明に係る体内臓器の動画像生成方法は、体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段とを有する体内臓器の動画像生成装置において、前記撮影制御手段が、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、前記画像解析手段が、前記記録手段に記録された断面画像を読み出して、一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成することを特徴とする。
【0014】
本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、一の撮影位置において連続的に撮影された複数の断面画像のうち、当該撮影位置において最初に(一番初めに)撮影された断面画像に対して、マーク付加手段により設定されたマーク位置にマークが付加され、マークが付加された断面画像の次に撮影された断面画像におけるマークが、当該マークが付加された断面画像のマーク位置に基づいて、2次元連続DPにより付加される。このように、連続的に撮影された全ての撮影位置における全ての断面画像に対して、2次元連続DPを用いて順番にマークを自動的に付加することが可能となる。従って、例えば、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、その部位に該当する部位を連続的に特定してマークを付加することが可能となる。
【0015】
このようにして、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、部位の位置および状態変化を、連続した断面画像より簡単に特定することができるので、体内臓器の部位の診断結果が医師の経験や技量によって異なってしまうことを低減させることができる。
【0016】
また、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、断面画像に付加されたマークの重心位置に基づいて体内臓器の部位の位置を求めて、その部位の位置を断面画像の画像平面および積層方向からなる3次元空間における座標位置として求めて、さらに、その座標位置から3次元的なスプライン曲線を求めて、体内臓器の3次元的な形状を求めることができる。
【0017】
このため、従来のように、医師が、体内臓器の部位に関する2次元的な断面画像に基づいて3次元的な形状を推測することにより部位の形状を判断していた場合に比べて、部位の3次元的な形状の信頼性を向上させることが可能になる。また、形状判断負担の軽減を図ることが可能となり、診断精度の向上を図ることが可能となる。
【0018】
さらに、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、撮影順番毎に求められた部位の3次元的な形状を、撮影順番に従って変化させることにより、部位の3次元的な形状の時間的な変化を求めて、部位における3次元的な動画像を生成することができる。このため、医師が部位の動きを容易に把握することが可能となり、3次元的な静止形状だけでなく、3次元的な動きを考慮した上で、体内臓器の診断を行うことができ、診断精度の向上を図ることが可能となる。また、3次元的な部位の動画像から、部位の可動体積を容易に算出することができるため、可動体積に基づいて統計的に正常あるいは異常を判断するための判断基準(検定指針など)を構築し、診断に利用することが可能となる。
【0019】
また、3次元的な動画像を求めることによって診断精度・判断手法に飛躍的な効果を果たすことが期待される体内臓器は心臓である。心臓は、常に鼓動に伴って動いているが、その動きが不自然である部位には何らかの異常が生じている可能性が高い。例えば、心臓の肺動脈弁、三尖弁、僧帽弁、大動脈弁などの弁機能部は、超音波CT、弱X線CT、MRIなどで鮮明(明確)に撮影することが難しく、断面画像において部位を特定するだけでも困難であることから、その状態を3次元的に求めることが困難であった。このため、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法により、弁機能部の形状を3次元的に求めるだけでなくその動画像をも生成することにより、心臓弁膜症などの診断精度および診断手法を飛躍的に向上させることが可能である。
【0020】
なお、断面画像撮影手段とは、例えば、超音波CT、弱X線CT、MRIなどの一般的な臓器撮影機器を意味する。また、断面画像とは、これらの臓器撮影機器により撮影された解析画像であって、被検者の体内臓器の断面状態をスライス状に示した画像を意味する。
【0021】
また、2次元連続DPとは、対応する2つの画像において共通するピクセルの対応を自動的に求めることが可能な画像解析技術であって、『岡隆一,外2名「連続DPの一般スキームについて−画像スポッティングのための全画素最適マッチング−」,信学技報,電子情報通信学会,IEICE Technical Report, PRMU2010-87,IBISML2010-59 (2010-09)』において公開され、広く知られた技術である。また、2次元連続DPに関しては、特開2010−165104号公報において説明がなされており、既に知られた技術に該当する。
【0022】
また、上述した体内臓器の動画像生成装置または体内臓器の動画像生成方法において、前記画像解析手段が、前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すものであってもよい。
【0023】
このように、画像解析手段が、マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された断面画像に対して、ダイレーションとエロージョンとによる画像処理を施す。この画像処理により、断面画像に付加されたマークを構成するピクセルの孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めを行うことが可能となる。このため、マークを示すピクセルをピクセル群として一塊にまとめて明確化することが可能となる。
【0024】
なお、ダイレーション(dilation)とエロージョン(erosion)とは、モルフォロジ処理と呼ばれる画像処理の代表的な処理である。上述したように、孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めのために利用される処理である。
【0025】
さらに、上述した体内臓器の動画像生成装置または体内臓器の動画像生成方法において、前記撮影制御手段が、前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させるものであってもよい。
【0026】
3次元的な動画像を求めることによって体内臓器の診断結果・判断手法に飛躍的な効果を果たすことが期待される心臓は、常に鼓動に伴って動くものである。このため、心臓の部位における3次元の動画像を生成する場合に、被検者の心臓における一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影して3次元的な動画像を生成することにより、心臓の鼓動に伴う部位の一連の動きを動画像として提供することが可能となる。このため、心臓に関連する部位の診断における精度の向上を図ることが可能となり、従来判断し難かった心臓の疾患などの早期発見・診断を実現することが可能となる。
【発明の効果】
【0027】
本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、一の撮影位置において連続的に撮影された複数の断面画像のうち、当該撮影位置において最初に(一番初めに)撮影された断面画像に対して、マーク付加手段により設定されたマーク位置にマークが付加され、マークが付加された断面画像の次に撮影された断面画像におけるマークが、当該マークが付加された断面画像のマーク位置に基づいて、2次元連続DPにより付加される。このように、連続的に撮影された全ての撮影位置における全ての断面画像に対して、2次元連続DPを用いて順番にマークを自動的に付加することが可能となる。従って、例えば、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、その部位に該当する部位を連続的に特定してマークを付加することが可能となる。
【0028】
このようにして、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、部位の位置および状態変化を、連続した断面画像より簡単に特定することができるので、体内臓器の部位の診断結果が医師の経験や技量によって異なってしまうことを低減させることができる。
【0029】
また、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、断面画像に付加されたマークの重心位置に基づいて体内臓器の部位の位置を求めて、その部位の位置を断面画像の画像平面および積層方向からなる3次元空間における座標位置として求めて、さらに、その座標位置から3次元的なスプライン曲線を求めて、体内臓器の3次元的な形状を求めることができる。
【0030】
このため、従来のように、医師が、体内臓器の部位に関する2次元的な断面画像に基づいて3次元的な形状を推測することにより部位の形状を判断していた場合に比べて、部位の3次元的な形状の信頼性を向上させることが可能になる。また、形状判断負担の軽減を図ることが可能となり、診断精度の向上を図ることが可能となる。
【0031】
さらに、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、撮影順番毎に求められた部位の3次元的な形状を、撮影順番に従って変化させることにより、部位の3次元的な形状の時間的な変化を求めて、部位における3次元的な動画像を生成することができる。このため、医師が部位の動きを容易に把握することが可能となり、3次元的な静止形状だけでなく、3次元的な動きを考慮した上で、体内臓器の診断を行うことができ、診断精度の向上を図ることが可能となる。また、3次元的な部位の動画像から、部位の可動体積を容易に算出することができるため、可動体積に基づいて定量的かつ統計的に正常あるいは異常を判断するための判断基準(検定指針など)を構築し、診断に利用することが可能となる。
【0032】
また、3次元的な動画像を求めることによって診断精度・判断手法に飛躍的な効果を果たすことが期待される体内臓器は心臓である。心臓は、常に鼓動に伴って動いているが、その動きが不自然である部位には何らかの異常が生じている可能性が高い。例えば、心臓の肺動脈弁、三尖弁、僧帽弁、大動脈弁などの弁機能部は、超音波CT、弱X線CT、MRIなどで鮮明(明確)に撮影することが難しく、断面画像において部位を特定するだけでも困難であることから、その状態を3次元的に求めることが困難であった。このため、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法により、弁機能部の形状を3次元的に求めるだけでなくその動画像をも生成することにより、心臓弁膜症などの診断精度および診断手法を飛躍的に向上させることが可能である。
【図面の簡単な説明】
【0033】
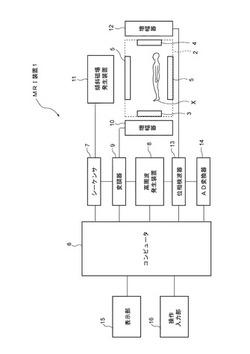
【図1】実施の形態に係るMRI装置の概略構成を示したブロック図である。
【図2】実施の形態に係るMRI装置のコンピュータの概略構成を示したブロック図である。
【図3】心臓の構造を模式的に示した図である。
【図4】実施の形態に係るCPUの処理を示したフローチャートである。
【図5】(a)は、MRI装置により撮影された心臓のスライス画像の一例を示した図であり、(b)は心臓におけるMRI画像の撮影位置をL=1〜6までずらして撮影する場合の位置関係を示した心臓の模式図である。
【図6】(a)は、時間t=1のMRI画像においてマーク処理を施す前の画像を示し、(b)は、マーク処理を施した後の画像を示している。
【図7】(a)は時間t=1のMRI画像を示し、(b)は、時間t=2におけるMRI画像であって、2次元連続DPによりマーク位置が求められた画像を示し、(c)は、(b)のMRI画像に対してダイレーションおよびエロージョンを実行した後の画像を示している。
【図8】(a)は、三尖弁の形状を3次元的に示した図であり、(b)は、三尖弁の可動体積を示した図である。
【発明を実施するための形態】
【0034】
以下、本発明に係る体内臓器の動画像生成装置について、一例であるMRI(Magnetic Resonance Imaging)装置(磁気共鳴画像法装置)を提示し、図面を用いて詳細に説明する。
【0035】
図1は、MRI装置の概略構成を示したブロック図である。
【0036】
MRI装置1は、静磁場発生磁石2と、高周波送信用コイル3と、高周波受信用コイル4と、傾斜磁場コイル5,5と、コンピュータ6と、シーケンサ7と、高周波発生装置8と、変調器9と、増幅器10と、傾斜磁場発生装置11と、増幅器12と、位相検波器13と、AD変換器14と、表示部15と、操作入力部(マーク付加手段)16とを備えている。
【0037】
静磁場発生磁石2は、被検者Xが置かれる空間に均一な静磁場を発生する役割を有している。傾斜磁場コイル5,5は、被検者Xが置かれる空間に直交3軸方向の傾斜磁場を発生する役割を有しており、傾斜磁場コイル5,5には、傾斜磁場発生装置11によって駆動電力が給電されている。
【0038】
高周波発生装置8は、高周波信号を出力する装置であり、高周波発生装置8から出力される高周波信号は、変調器9において適切な信号に変調され、増幅器10において増幅されて高周波送信用コイル3に供給される。高周波送信用コイル3に対して高周波信号が供給されることにより、被検者Xの生体組織を構成する静磁場中の原子核(プロトン)に核磁気共鳴を起こせる高周波パルスを照射することが可能となる。
【0039】
高周波送信用コイル3により高周波パルスが被検者Xに照射されると、プロトンに核磁気共鳴が起こり、エコー信号などの磁気共鳴信号が出力される。この磁気共鳴信号は、MRI装置1の高周波受信用コイル4によって受波され、増幅器12において増幅された後、位相検波器13においてアナログ信号として検出される。検出されたアナログ信号は、AD変換器14によってデジタル信号の計測データに変換され、コンピュータ6へ出力される。
【0040】
シーケンサ7は、コンピュータ6の制御指示に応じて、磁気共鳴撮影を行うのに必要な命令を、MRI装置1の磁場発生系統(傾斜磁場コイル5、5や傾斜磁場発生装置11など)や高周波送受信系統(高周波発生装置8、変調器9、増幅器10、12、高周波送信用コイル3、高周波受信用コイル4、位相検波器13、AD変換器14など)に送り、これらの動作を制御する役割を有している。
【0041】
コンピュータ6の制御指示に応じて、MRI装置1の磁場発生系統および高周波送受信系統が動作させることにより、被検者Xの体内臓器の断面画像を連続的に撮影することが可能となる。また、コンピュータ6の制御指示に従って、断面画像の撮影位置を被検者Xの身長方向(撮影される断面画像の積層方向)へ少しずつ移動させて、断面画像を撮影することが可能となっている。
【0042】
なお、このようにして断面画像を撮影するための処理を行う静磁場発生磁石2、高周波送信用コイル3、高周波受信用コイル4、傾斜磁場コイル5,5、シーケンサ7、高周波発生装置8、変調器9、増幅器10、傾斜磁場発生装置11、増幅器12、位相検波器13およびAD変換器14は、本発明に係る断面画像撮影手段に該当する。
【0043】
表示部15は、コンピュータ6により画像処理された体内臓器の部位画像および部位動画を表示する役割を有しており、コンピュータ6に接続されている。また、操作入力部16は、被検者XにおけるMRI画像の撮影位置設定・調整操作および撮影されたMRI画像に対して所定の画像処理を行うために必要な情報の入力操作など(後述するマーク位置の設定など)を行う役割を有している。
【0044】
コンピュータ6は、図2に示すように、CPU(撮影制御手段、画像解析手段)20と、ROM21と、RAM22、記憶部(記録手段)23を有している。ROM21は、CPU20における処理内容を記録したプログラム(例えば、図4に示すフローチャートからなるプログラム)や、MRI装置1における初期設定情報などを記録する役割を有している。RAM22は、CPU20の処理において利用されるワークエリアとしての役割を有している。
【0045】
CPU20は、ROM21に記録されるプログラムに従って、臓器における所定部位のMRI画像を、所定時間毎に連続的に撮影する処理を行う。また、CPU20は、医師等が操作入力部16を操作して一枚目のMRI画像にマークされた所定部位を基準として、その後に撮影された複数のMRI画像から所定部位の特定を行う処理(該当するマーク位置を設定してマークを追加(記録)する処理)を行う。さらに、CPU20は、所定部位におけるMRI画像の撮影位置を少しずつずらして撮影を行うことにより、所定部位における3次元的な動画像の生成を行う。
【0046】
また、CPU20は、処理内容に応じてシーケンサ7に制御指示を出力する。シーケンサ7は、CPU20による制御指示応じて、MRI装置1における磁場発生系統(傾斜磁場コイル5、5や傾斜磁場発生装置11など)や高周波送受信系統(高周波発生装置8、変調器9、増幅器10、12、高周波送信用コイル3、高周波受信用コイル4、位相検波器13、AD変換器14など)などの動作を行う。
【0047】
次に、CPU20の処理について説明する。本実施の形態においては、体内臓器の所定部位の一例として、心臓の三尖弁の動きを動画像として生成する場合について説明をする。ただし、臓器の所定部位として三尖弁の動きを検出することは、単なる一例であって、臓器の所定部位は必ずしも心臓の三尖弁に限定されるものではない。
【0048】
心臓の外科手術において弁膜症が関与する割合は大変高く、70%以上の手術において弁膜が起因しているというデータも存在する。心臓には、図3に示すように、肺動脈弁、三尖弁、僧帽弁、大動脈弁からなる4種類の弁が存在し、それらの弁の中で、弁の動きの低下による疾患の大きな原因に該当し得るものが、三尖弁である。三尖弁は、一種の腱であり、CTやMRIにより撮影された画像では鮮明にその状態を捕らえることが困難であった。そのため、MRI画像などから三尖弁の疾患の様相を視覚的に捕らえることが難しく、疾患が生じているか否かの判断基準となる三尖弁の動きを観察することはさらに困難なものとなっている。
【0049】
本実施の形態に係るMRI装置1では、MRI画像において鮮明に捕らえることが困難な三尖弁の3次元的な動画像を生成する処理を行う。
【0050】
図4は、MRI装置1のCPU20における処理内容を示したフローチャートである。CPU20は、心臓における特定の位置において複数のMRI画像を撮影し(例えば、図5(a)のような画像)、各MRI画像において、三尖弁の位置を自動的に特定する処理を行う(図4のステップS.11〜ステップS.21)。CPU20は、三尖弁の位置検出処理を、図5(b)に示すように、少しずつ位置(図5(b)における撮影位置L)をずらして数回測定を行う(撮影位置Lを図5(b)に示すようにL=1からL=6までずらして測定する、図4のステップS22〜S24)。本実施の形態に係るMRI装置1では、心臓の上下方向に12mmずつ検出位置をずらして合計6箇所の位置においてMRI画像の撮影を行う。
【0051】
そして、CPU20は、測定された全てのMRI画像より三尖弁の位置を検出し、検出された三尖弁の位置に基づいて、三尖弁の状態を3次元的に示した動画像を生成する(図4のステップS.25〜28)。これらの詳細な処理内容を、以下に説明する。
【0052】
まず、CPU20は、記憶部23に記録された初期情報を読み出して初期設定を行う(ステップS.11)。具体的には、MRI画像の撮影タイミング(撮影時間)を示すtの値を1に設定し(t=1)、MRI画像を撮影する位置を示すLの値を1に設定する(撮影位置L=1)処理を行う。この初期設定値は、RAM22に一時的に記録され、CPU20における処理に応じて適宜更新されることになる。
【0053】
次に、CPU20が、シーケンサ7に対して制御指示を出力することにより、MRI装置1の磁場発生系統や高周波送受信系統を動作させて、被検者Xの心臓の2次元画像(心臓が撮影範囲に含まれる2次元画像)をMRI装置1によって撮影する(ステップS.12)。2次元画像をMRI装置1により撮影する場合には、心臓の同じ位置(同じ撮影位置)における複数のMRI画像を一定の時間間隔で複数枚撮影する。
【0054】
撮影された画像は、記憶部23に一時的に記録される。撮影されたMRI画像は、最初に撮影されたMRI画像を、時間t=1において撮影されたMRI画像とし、その後に撮影されたMRI画像を、時間t=2のMRI画像、時間t=3のMRI画像、・・・時間t=TにおけるMRI画像として区別するものとする。また、本実施の形態においては、1つの鼓動(ビート)が開始された時をt=1とし、次の鼓動が開始される直前がt=Tとなるようにする。このようにして、1つの鼓動間隔で、t=1からt=TまでのT枚のMRI画像を撮影することにより、1つの鼓動の開始から終了までの心臓の状態を撮影することができる。
【0055】
次に、CPU20は、記憶部23に記録された2次元のMRI画像のそれぞれに対してラプラシアンと呼ばれる画像マスク処理を行う(ステップS.13)。MRI画像に画像マスク処理を施すことによって、MRI画像のエッジを強調することができ、画像を鮮明にすることが可能となる。なお、ラプラシアンによる画像マスク処理は、既に画像処理技術として一般的に知られた方法であるため、詳細なマスク処理の内容については説明を省略する。
【0056】
そして、CPU20は、時間t=1のMRI画像に対して、操作入力部16を介して医師等が三尖弁の位置をマークすることを可能な状態とする(医師等によるマークの許可処理)(ステップS.14)。MRI画像には、腱である三尖弁が鮮明には表示されにくい傾向がある。しかしながら、医師等は、MRI画像において鮮明に表示される部位(例えば、血液が多い部位)などの位置関係から、三尖弁の位置を推測することが可能である。このため、CPU20は、最初に撮影されたMRI画像(t=1において撮影されたMRI画像)に対して、医師等が三尖弁の位置をマークすることができるようにする(マーク処理を医師等に行わせる)ことにより、MRI画像における三尖弁の位置(マーク位置)を高い精度で特定することが可能となる。
【0057】
図6(a)は、t=1のMRI画像に対して、マーク処理が行われる前の画像を示し、図6(b)は、マーク処理が行われた後の画像を示している。三尖弁は円環状(リング状)の腱であるため、円環状の端部であれば、MRI画像においてマークされる箇所が1箇所となり、円環状の中央部(少なくとも端部以外)であれば、2箇所となる。図6(b)においては、2箇所のマークMが示されている。
【0058】
医師等は、操作入力部16の操作により三尖弁の位置をMRI画像にマークし終わった場合には、マークを終了した旨の操作(例えば、操作入力部16において予め設けられるマーク終了操作ボタンの押下など)を行う。マークを終了した旨の操作が行われていない場合(ステップS.15においてNoの場合)、CPU20は、三尖弁の位置のマーク処理が行われている最中であると判断して、処理をステップS.14の処理へ移行する。一方で、マークを終了した旨の操作が行われた場合(ステップS.15においてYesの場合)、CPU20は、三尖弁の位置のマーク処理が終了したものと判断する。
【0059】
三尖弁の位置のマーク処理が終了した場合(ステップS.15においてYesの場合)、CPU20は、2次元連続DP(weak spotting version)と呼ばれるアルゴリズムに基づいて、三尖弁の位置がマークされた時間tのMRI画像を参照画像とし、時間t+1のMRI画像を入力画像とすることにより、参照画像および入力画像における全ピクセルの対応関係を求める(ステップS.16)。ここで、2次元連続DPは、既に知られた技術であり、『岡隆一,外2名「連続DPの一般スキームについて−画像スポッティングのための全画素最適マッチング−」,信学技報,電子情報通信学会,IEICE Technical Report, PRMU2010-87,IBISML2010-59 (2010-09)』および特開2010−165104号公報おいて詳細な説明がなされているため、具体的な説明を省略する。
【0060】
そして、CPU20は、2次元連続DPに基づく全ピクセルの対応関係から、時間tのMRI画像においてマークした三尖弁の全ピクセルに対応するピクセルを、時間t+1のMRI画像において求める(ステップS.17)。
【0061】
次に、CPU20は、2次元連続DPによりマークの対応関係が求められた時間t+1のMRI画像のピクセル群に対して、ダイレーション(dilation)というピクセルの増大処理とエロージョン(erosion)というピクセル削減処理とを施す(ステップS.18)。時間t+1のMRI画像に対して、このダイレーションおよびエロージョンを施すことにより、時間t+1において三尖弁に対応するピクセルとして求められたピクセル群の孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めが行われ、時間t+1のMRI画像のマーク(マーク位置におけるピクセル群)が明確になる。
【0062】
本実施の形態に係るMRI装置1では、一例として、ダイレーション(dilation:ピクセルの増大処理)を2回行い、エロージョン(erosion:ピクセル削減処理)を4回行う。ただし、ダイレーション(dilation)とエロージョン(erosion)とのそれぞれの処理回数は、特に限定されるものではない。
【0063】
なお、ダイレーション(dilation)とエロージョン(erosion)とによるピクセルの増大・削減処理は、モルフォロジ処理と呼ばれる画像処理の代表的な処理であり、上述したように、孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めのために利用される処理である。この画像処理は既に知られた処理方法であるため、ここでの詳細な説明は省略する。
【0064】
図7は、t=1のMRI画像においてマークされた三尖弁のピクセル群から2次元連続DPに基づいて求められたt=2のMRI画像のマークを、ダイレーション(dilation)とエロージョン(erosion)とをそれぞれ複数回繰り返すことにより明確化する一例を示したMRI画像である。
【0065】
まず、図7(a)は、既に説明したように、t=1のMRI画像であって、既に三尖弁の位置にマークM1がなされた画像である。一方で図7(b)に示すMRI画像は、2次元連続DPに基づいて対応するマークが求められたt=2のMRI画像を示している。図7(b)の拡大画像に示すように、2次元連続DPに基づいて求められたt=2のMRI画像のマークM2は、(a)のマークM1と異なり、細かい点の集まりとして示されている。
【0066】
図7(b)に示すようにして求められたMRI画像に対して、CPU20がダイレーション(dilation)とエロージョン(erosion)とを複数回実行する。ダイレーションとエロージョンとを実行することにより、図7(c)に示すように、マークM3が一塊のピクセル群となり、マークM3の明確化を実現することが可能となる。
【0067】
その後、CPU20は、マークの明確化が図られたMRI画像を、記憶部23に記録する(ステップS.19)。なお、このMRI画像は、撮影位置Lの値と、撮影時間tの値とを関連付けて記録される。
【0068】
次に、CPU20は、時間t+1のMRI画像が時間TのMRI画像であるか否か(つまり、t+1=Tであるか否か、t+1の画像が各撮影位置における最後のMRI画像であるか否か)を判断する(ステップS.20)。時間t+1のMRI画像が時間TのMRI画像でない場合(ステップS.20においてNoの場合)、CPU20は、t=t+1の処理によって、tの値を1つ増加させて(ステップS.21)、処理を上述したステップS.16へと移行させて、上述した処理を繰り返し実行する。
【0069】
一方で、時間t+1のMRI画像が時間TのMRI画像である場合(ステップS.20においてYesの場合)、CPU20は、MRI画像の撮影位置Lが6箇所目の撮影位置であるか否か、つまりL=6であるか否かの判断を行う(ステップS.22)。
【0070】
MRI画像の撮影位置Lが6箇所目でない場合(ステップS.22においてNoの場合)、CPU20は、シーケンサ7に対して制御指示を出力することにより、MRI装置1におけるMRI画像の撮影位置を12mmだけ移動させる(ステップS.23)。そして、CPU20は、撮影位置Lの値を1つ増加させて(ステップS.24)、処理をステップS.12へと移行させる。
【0071】
ここで、撮影位置が移動する方向をZ軸方向とし、MRI画像の撮影が行われる心臓の断面(スライス面)をXY平面とする。MRI画像は、一般的に512ピクセル×512ピクセルの解像度で撮影され、この平面は、物理的に35cm×35cmの大きさに対応するものである。従って、1ピクセルの区間は、0.684mmに該当することになる。
【0072】
512ピクセル×512ピクセルのMRI画像の中で、心臓が映っている領域を切り出すと、250ピクセル×250ピクセルの大きさとなり、三尖弁の位置検出に利用されるMRI画像の大きさも250ピクセル×250ピクセルの大きさに含まれることになる。従って、切り出された領域の画像の一辺の実際の長さは、250ピクセル×0.684mm=170.9mmとなる。
【0073】
このことから、三尖弁の位置検出において求められる3次元空間は、X軸方向およびY軸方向の長さが170.9mm、Z軸報告の長さが、12mm×5(撮影位置L=1からL=6までの距離)=60mmとなる。従って、三尖弁の位置検出が行われる物理的な空間は、171mm×171mm×60mmの空間と相似したものとなる。なお、Z軸方向の長さ60mmは、ピクセル換算すると、60mm÷0.684mm(1ピクセルの長さ)=88となり、88ピクセルに対応する。
【0074】
MRI画像の撮影位置Lが6箇所目である場合(ステップS.22においてYesの場合)、つまり、最後の撮影位置(L=6)におけるT枚目のMRI画像のマーク処理が終わった場合、CPU20は、撮影された全てのMRI画像のマークから、マーク領域を構成するピクセル群の重心位置を算出する(ステップS.25)。このように各MRI画像におけるマークの重心位置を求めることにより、心臓の鼓動に伴って動く三尖弁の位置を時系列的に抽出することが可能となる。
【0075】
また、MRI画像による三尖弁のスライス画像は、上述した処理から明らかなように、一度に6箇所同時に撮影することができない。しかしながら、各撮影位置におけるMRI画像の撮影は、心臓の鼓動が開始されたタイミングで時間t=1のMRI画像が撮影され、次の鼓動が開始されるまでの間に時間t=TのMRI画像の撮影が行われる。この撮影タイミングは、撮影位置L=1からL=6まで同じタイミングであるため、鼓動の動きに対応してそれぞれの撮影位置で同じタイミングのMRI画像を撮影したものと判断することができる。従って、鼓動が開始したタイミングである時間t=1のMRI画像を初期時刻として同一視すれば、複数の撮影位置において撮影されたMRI画像を、同時期に撮影されたMRI画像として処理することが可能となり、三尖弁の3次元的な動きを求めることが可能となる。
【0076】
なお、三尖弁はリング状を呈するため、三尖弁のMRI画像(スライス画像)には、三尖弁のリング状断面が1断面あるいは2断面撮影されることになる。このリング状断面は、撮影位置によって異なり、三尖弁の端部側を撮影する場合には、三尖弁の断面が1断面となる。従って、撮影位置の異なる6箇所の撮影箇所のMRI画像から、時間tに応じて10〜12個の三尖弁のリング位置(マークの重心位置)を3次元的に求めることができる。3次元的に示される10〜12個の三尖弁のリング位置を、時間tに応じて、t=1からt=Tまで変化させることにより、3次元的に求められる三尖弁の状態を時系列に求めることが可能となり、三尖弁の動きを求めることができる。
【0077】
しかしながら、上述のようにして求められる三尖弁のリング位置は、時間tにおいて10〜12個の断片的な位置情報であって、3次元における全体的な三尖弁の位置情報の一部でしかない。一方で、多くの位置情報を得るためには多数の撮影位置においてMRI装置1で三尖弁のスライス撮影を行うことが好ましいが、現実的には困難である。
【0078】
このため、求められた時間t毎の三尖弁のリング位置を三尖弁の3次元的なサンプル点とし、3次元空間における三尖弁のリング形状が、サンプル点を繋ぐことにより形成される滑らかな3次元上の曲線によるものと想定することにより、合理性を備えた三尖弁のリング形状を求めることができる。
【0079】
従って、CPU20は、時間t毎に、それぞれのMRI画像から求められた10〜12個の三尖弁のリング位置(マークの重心位置)を通り滑らかな閉曲線を形成するスプライン曲線を算出する(ステップS.26)。いくつかのサンプル点に基づいてスプライン曲線を算出する手法は既に知られているため、ここでの詳細な説明は省略する。このようにして3次元的なスプライン曲線を求めることによって、3次元的な三尖弁のリング形状を、例えば1000点の空間点のつながりによって表現することが可能となる。
【0080】
図8(a)は、サンプル点(白い球体)を通るスプライン曲線状の各点に、小さな球体を配置することにより三尖弁のリング形状を表現した図である。心臓の1つの鼓動(ビート)の開始から次の鼓動の開始直前までの全体の時間を、前述した既出の時間Tとして考えると、T個のスプライン曲線を得ることが可能となる。従って、時間t=1からTまでのT個のスプライン曲線に基づいて、1つの鼓動の開始から終了までの時間における三尖弁の3次元的な動きを求めることができる。
【0081】
CPU20では、三尖弁の3次元的な座標情報を、時間t=1からTまでのT個のスプライン曲線に基づいて求めて(ステップS.27)、求められた三尖弁の3時次元的な座標情報の変化に基づいて、1つ鼓動に対応する三尖弁の3次元動画像を生成する(ステップS.28)。
【0082】
このようにして求められた三尖弁の3次元動画を繰り返し表示部15に表示させる(再生表示させる)ことにより、MRI装置1において鮮明に撮影できない腱などの部位の状態変化、本実施の形態では三尖弁の状態変化を明確に示した映像として抽出し、医師などに提供することが可能となる。このため、医師は、三尖弁の鮮明な3次元画像および3次元動画像に基づいて、リング形状に異常がないか否か、また、動きに異変がないか否かを、視覚的に判断することが可能となる。
【0083】
さらに、三尖弁の動画像は、三尖弁のリングの全て位置情報とその位置変化(動き)が、3次元的な電子データとして記録されている。このため、3次元空間を小さなサイコロ状に分割し、三尖弁の動画像に基づいて、1つの鼓動において三尖弁の移動の際に接触するサイコロ状の分割部分の個数を加算することにより、三尖弁の可動体積を算出することができる。サイコロ状の分割間隔は、既に説明したようにミリメートル(mm)単位で可能であるため、立法ミリメートル単位での可動体積を求めることが可能となる。
【0084】
図8(b)は、三尖弁の可動体積を示した3次元的な図である。正常な三尖弁の可動体積と異常がある三尖弁の可動体積とを、信頼できるサンプルに基づいて多数収集することにより、統計的な検定によって疾患の有無を判定することも可能である。
【0085】
以上、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法について、MRI装置1を一例として用い、MRI装置1で三尖弁を撮影する場合について説明を行ったが、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法は、上述した実施の形態に示したMRI装置1の構成およびその処理方法だけに限定されず、また、三尖弁を撮影する場合だけに限定されるものではない。
【0086】
例えば、実施の形態に係るMRI装置1では、心臓の三尖弁のリング形状の動画像を生成する場合について説明したが、他の部位を時間t=1のMRI画像にマークすることにより、マーク位置に該当する部位の動画像を生成することが可能である。従って、例えば、心臓の心房などの部位にマークを設定することにより心房における動画像を生成することができ、心房の動作状況の可視化や、可動体積の算出などを同様にして行うことが可能である。
【0087】
特に、本発明に係る体内臓器の動画像生成装置では、MRI画像において必ずしも鮮明に示されていない部位であっても、時間t=1のMRI画像においてマークを設定することによって、2次元連続DPにより対応関係が求められたピクセル群を自動的に求めることができる。このため、時間t=1のMRI画像において部位のマーク処理を確実に行うことにより、該当するマーク位置の部位の状態を自動的に求めることができる。従って、従来では視覚的に確認することができなかった部位の形状(様子)およびその動作状況を可視化することができ、臨床診断における診断精度の向上とその診断負担の軽減を図ることが可能となる。
【0088】
また、本実施の形態に係るMRI装置1では、断面画像の画像マスク処理や、2次元連続DPに基づくマークの特定処理や、ダイレーションおよびエロージョンによる画像処理や、3次元的なスプライン曲線を求める処理などを、CPU20だけで行う場合について説明した。しかしながら、これらの全ての処理を、1つのCPUだけに行わせる構成には限定されない。各処理に応じてそれぞれ異なるCPUを設けて、複数のCPUが順次処理を行うことによって、結果として体内臓器の3次元的な動画像を生成する構成であってもよい。
【符号の説明】
【0089】
1 …MRI装置
2 …静磁場発生磁石(断面画像撮影手段)
3 …高周波送信用コイル(断面画像撮影手段)
4 …高周波受信用コイル(断面画像撮影手段)
5 …傾斜磁場コイル(断面画像撮影手段)
6 …コンピュータ
7 …シーケンサ(断面画像撮影手段)
8 …高周波発生装置(断面画像撮影手段)
9 …変調器(断面画像撮影手段)
10 …増幅器(断面画像撮影手段)
11 …傾斜磁場発生装置(断面画像撮影手段)
12 …増幅器(断面画像撮影手段)
13 …位相検波器(断面画像撮影手段)
14 …AD変換器(断面画像撮影手段)
15 …表示部
16 …操作入力部(マーク付加手段)
20 …CPU(撮影制御手段、画像解析手段)
21 …ROM
22 …RAM
23 …記憶部(記録手段)
X …被検者
【技術分野】
【0001】
本発明は、体内臓器の動画像生成装置および体内臓器の動画像生成方法に関し、より詳細には、体内臓器を一定時間間隔で連続的に撮影した複数の撮影画像に基づいて、臓器の所定部位の状態を3次元的な動画像として提供することが可能な体内臓器の動画像生成装置および体内臓器の動画像生成方法に関する。
【背景技術】
【0002】
従来より、体内臓器の状態を医師が判断するために、超音波CT(Computed Tomography:コンピュータ断層撮影)、弱X線CT、MRI(Magnetic Resonance Imaging:磁気共鳴画像法)などの一般的な臓器撮影機器による臓器撮影方法を用いて、体内臓器の状態を2次元的な断面画像として撮影する(画像解析により断面画像を求める)方法が知られている。医師は、撮影タイミングあるいは撮影位置の異なる複数の2次元画像を比較・検討することにより、臓器の状態を判断している。
【0003】
ここで、上述した臓器撮影機器は、身体の一断面の画像、あるいは一方向からの画像を撮影するものであるため、画像全体から診断対象となる体内臓器の特定を行うことが容易ではないという問題があった。
【0004】
また、上述した臓器撮影機器では、断面画像において明確(鮮明)に映し出す(撮影する)ことが困難な体内臓器が存在する。例えば、弱X線CTでは、臓器が骨部の内側にあると、その骨によって臓器部分が遮断されてしまうという問題があった。また超音波CTでは、画像の解像度が十分でなく不鮮明な画像になってしまうという問題があった。さらにMRIでは、骨による臓器部分の遮断はないが、臓器の筋肉(例えば心臓の筋肉)や腱(例えば心臓の三尖弁など)の部位が画像において黒く映ってしまい、画像から直接筋肉や腱を特定することが困難であるという問題があった。
【0005】
MRIを用いる場合、心臓の心房のように血液で満たされている器官に関しては、その臓器の存在を比較的明確に断面画像に映し出す(撮影する)ことができる。しかしながら、血液で満たされていない腱や筋肉などは、MRI画像に鮮明に映し出す(撮影する)ことが困難であった。従って、医師は、明暗レベル調整などを行うことによりMRI画像の改善を図ったうえで、不鮮明な部位の予測・特定を行い、診断対象となる部位を診断しなければならかった。このため、腱や筋肉などの部位の状態を判断することが困難であり、医師の経験や技量によって判断が異なってしまうおそれがあるという問題があった。
【0006】
さらに、上述した臓器撮影機器は、臓器の2次元的な画像を撮影するものであるため、本来3次元的な動きを行う臓器の活動状況を3次元的な動きとして映像化することが困難であった。
【0007】
例えば、心臓の三尖弁の動きを3次元的に観察することができれば、弁が正常に働いているか否かの判断を容易に行うことが可能となる。しかしながら、上述したように三尖弁は腱であって、CT画像やMRI画像において鮮明に表示することが困難な部位であるため、3次元的な動きはもちろんのこと、2次元画像においてもその部位を特定することが容易ではなかった。
【0008】
このため、複数のCT画像から三尖弁の位置を推測して手作業で三尖弁リングの形状を推測する研究がなされている(例えば、非特許文献1参照)。
【先行技術文献】
【非特許文献】
【0009】
【非特許文献1】Shota Fukuda, et al, "Three-Dimensional Geometry of the Tricuspid Annulus in Healthy subjects and in Patients with Functional Tricuspid Regurgitation -A Real-time, 3-Dimensional Echocardiographic Study-", American Heart Association, Circulation.2006, 114(Suppl I):I-492-498
【発明の概要】
【発明が解決しようとする課題】
【0010】
しかしながら、上述した非特許文献1の手法では、複数のCT画像のそれぞれにおいて三尖弁リングの位置を推測し、位置の推測が行われたそれぞれの複数のCT画像から3次元的な位置を算出して、1つ1つ手作業で三尖弁リングの3次元的な位置を求める必要がある。このため、三尖弁リングの3次元画像を求めるだけで、多大な労力が必要となってしまう。さらに、このようにして求められる三尖弁リングの3次元画像を動画像にするためには、さらなる負担が必要とされ、3次元的な動画像を得ることが大変困難なものであった。
【0011】
本発明は上記課題に鑑みてなされたものであり、MRI画像等の断面画像において必ずしも鮮明に表示されない体内臓器の所定部位を、複数の断面画像において自動的に求めて、該当する所定部位における状態変化を3次元的な動画像として示すことが可能な体内臓器の動画像生成装置および体内臓器の動画像生成方法を提供することを課題とする。
【課題を解決するための手段】
【0012】
上記課題を解決するために、本発明に係る体内臓器の動画像生成装置は、体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段とを有し、前記撮影制御手段は、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、前記画像解析手段は、前記記録手段に記録された断面画像を読み出して、一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成することを特徴とする。
【0013】
また、本発明に係る体内臓器の動画像生成方法は、体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段とを有する体内臓器の動画像生成装置において、前記撮影制御手段が、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、前記画像解析手段が、前記記録手段に記録された断面画像を読み出して、一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成することを特徴とする。
【0014】
本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、一の撮影位置において連続的に撮影された複数の断面画像のうち、当該撮影位置において最初に(一番初めに)撮影された断面画像に対して、マーク付加手段により設定されたマーク位置にマークが付加され、マークが付加された断面画像の次に撮影された断面画像におけるマークが、当該マークが付加された断面画像のマーク位置に基づいて、2次元連続DPにより付加される。このように、連続的に撮影された全ての撮影位置における全ての断面画像に対して、2次元連続DPを用いて順番にマークを自動的に付加することが可能となる。従って、例えば、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、その部位に該当する部位を連続的に特定してマークを付加することが可能となる。
【0015】
このようにして、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、部位の位置および状態変化を、連続した断面画像より簡単に特定することができるので、体内臓器の部位の診断結果が医師の経験や技量によって異なってしまうことを低減させることができる。
【0016】
また、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、断面画像に付加されたマークの重心位置に基づいて体内臓器の部位の位置を求めて、その部位の位置を断面画像の画像平面および積層方向からなる3次元空間における座標位置として求めて、さらに、その座標位置から3次元的なスプライン曲線を求めて、体内臓器の3次元的な形状を求めることができる。
【0017】
このため、従来のように、医師が、体内臓器の部位に関する2次元的な断面画像に基づいて3次元的な形状を推測することにより部位の形状を判断していた場合に比べて、部位の3次元的な形状の信頼性を向上させることが可能になる。また、形状判断負担の軽減を図ることが可能となり、診断精度の向上を図ることが可能となる。
【0018】
さらに、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、撮影順番毎に求められた部位の3次元的な形状を、撮影順番に従って変化させることにより、部位の3次元的な形状の時間的な変化を求めて、部位における3次元的な動画像を生成することができる。このため、医師が部位の動きを容易に把握することが可能となり、3次元的な静止形状だけでなく、3次元的な動きを考慮した上で、体内臓器の診断を行うことができ、診断精度の向上を図ることが可能となる。また、3次元的な部位の動画像から、部位の可動体積を容易に算出することができるため、可動体積に基づいて統計的に正常あるいは異常を判断するための判断基準(検定指針など)を構築し、診断に利用することが可能となる。
【0019】
また、3次元的な動画像を求めることによって診断精度・判断手法に飛躍的な効果を果たすことが期待される体内臓器は心臓である。心臓は、常に鼓動に伴って動いているが、その動きが不自然である部位には何らかの異常が生じている可能性が高い。例えば、心臓の肺動脈弁、三尖弁、僧帽弁、大動脈弁などの弁機能部は、超音波CT、弱X線CT、MRIなどで鮮明(明確)に撮影することが難しく、断面画像において部位を特定するだけでも困難であることから、その状態を3次元的に求めることが困難であった。このため、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法により、弁機能部の形状を3次元的に求めるだけでなくその動画像をも生成することにより、心臓弁膜症などの診断精度および診断手法を飛躍的に向上させることが可能である。
【0020】
なお、断面画像撮影手段とは、例えば、超音波CT、弱X線CT、MRIなどの一般的な臓器撮影機器を意味する。また、断面画像とは、これらの臓器撮影機器により撮影された解析画像であって、被検者の体内臓器の断面状態をスライス状に示した画像を意味する。
【0021】
また、2次元連続DPとは、対応する2つの画像において共通するピクセルの対応を自動的に求めることが可能な画像解析技術であって、『岡隆一,外2名「連続DPの一般スキームについて−画像スポッティングのための全画素最適マッチング−」,信学技報,電子情報通信学会,IEICE Technical Report, PRMU2010-87,IBISML2010-59 (2010-09)』において公開され、広く知られた技術である。また、2次元連続DPに関しては、特開2010−165104号公報において説明がなされており、既に知られた技術に該当する。
【0022】
また、上述した体内臓器の動画像生成装置または体内臓器の動画像生成方法において、前記画像解析手段が、前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すものであってもよい。
【0023】
このように、画像解析手段が、マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された断面画像に対して、ダイレーションとエロージョンとによる画像処理を施す。この画像処理により、断面画像に付加されたマークを構成するピクセルの孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めを行うことが可能となる。このため、マークを示すピクセルをピクセル群として一塊にまとめて明確化することが可能となる。
【0024】
なお、ダイレーション(dilation)とエロージョン(erosion)とは、モルフォロジ処理と呼ばれる画像処理の代表的な処理である。上述したように、孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めのために利用される処理である。
【0025】
さらに、上述した体内臓器の動画像生成装置または体内臓器の動画像生成方法において、前記撮影制御手段が、前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させるものであってもよい。
【0026】
3次元的な動画像を求めることによって体内臓器の診断結果・判断手法に飛躍的な効果を果たすことが期待される心臓は、常に鼓動に伴って動くものである。このため、心臓の部位における3次元の動画像を生成する場合に、被検者の心臓における一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影して3次元的な動画像を生成することにより、心臓の鼓動に伴う部位の一連の動きを動画像として提供することが可能となる。このため、心臓に関連する部位の診断における精度の向上を図ることが可能となり、従来判断し難かった心臓の疾患などの早期発見・診断を実現することが可能となる。
【発明の効果】
【0027】
本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、一の撮影位置において連続的に撮影された複数の断面画像のうち、当該撮影位置において最初に(一番初めに)撮影された断面画像に対して、マーク付加手段により設定されたマーク位置にマークが付加され、マークが付加された断面画像の次に撮影された断面画像におけるマークが、当該マークが付加された断面画像のマーク位置に基づいて、2次元連続DPにより付加される。このように、連続的に撮影された全ての撮影位置における全ての断面画像に対して、2次元連続DPを用いて順番にマークを自動的に付加することが可能となる。従って、例えば、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、その部位に該当する部位を連続的に特定してマークを付加することが可能となる。
【0028】
このようにして、断面画像において鮮明(明確)に映し出されていない体内臓器の部位であっても、部位の位置および状態変化を、連続した断面画像より簡単に特定することができるので、体内臓器の部位の診断結果が医師の経験や技量によって異なってしまうことを低減させることができる。
【0029】
また、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、断面画像に付加されたマークの重心位置に基づいて体内臓器の部位の位置を求めて、その部位の位置を断面画像の画像平面および積層方向からなる3次元空間における座標位置として求めて、さらに、その座標位置から3次元的なスプライン曲線を求めて、体内臓器の3次元的な形状を求めることができる。
【0030】
このため、従来のように、医師が、体内臓器の部位に関する2次元的な断面画像に基づいて3次元的な形状を推測することにより部位の形状を判断していた場合に比べて、部位の3次元的な形状の信頼性を向上させることが可能になる。また、形状判断負担の軽減を図ることが可能となり、診断精度の向上を図ることが可能となる。
【0031】
さらに、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法では、撮影順番毎に求められた部位の3次元的な形状を、撮影順番に従って変化させることにより、部位の3次元的な形状の時間的な変化を求めて、部位における3次元的な動画像を生成することができる。このため、医師が部位の動きを容易に把握することが可能となり、3次元的な静止形状だけでなく、3次元的な動きを考慮した上で、体内臓器の診断を行うことができ、診断精度の向上を図ることが可能となる。また、3次元的な部位の動画像から、部位の可動体積を容易に算出することができるため、可動体積に基づいて定量的かつ統計的に正常あるいは異常を判断するための判断基準(検定指針など)を構築し、診断に利用することが可能となる。
【0032】
また、3次元的な動画像を求めることによって診断精度・判断手法に飛躍的な効果を果たすことが期待される体内臓器は心臓である。心臓は、常に鼓動に伴って動いているが、その動きが不自然である部位には何らかの異常が生じている可能性が高い。例えば、心臓の肺動脈弁、三尖弁、僧帽弁、大動脈弁などの弁機能部は、超音波CT、弱X線CT、MRIなどで鮮明(明確)に撮影することが難しく、断面画像において部位を特定するだけでも困難であることから、その状態を3次元的に求めることが困難であった。このため、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法により、弁機能部の形状を3次元的に求めるだけでなくその動画像をも生成することにより、心臓弁膜症などの診断精度および診断手法を飛躍的に向上させることが可能である。
【図面の簡単な説明】
【0033】
【図1】実施の形態に係るMRI装置の概略構成を示したブロック図である。
【図2】実施の形態に係るMRI装置のコンピュータの概略構成を示したブロック図である。
【図3】心臓の構造を模式的に示した図である。
【図4】実施の形態に係るCPUの処理を示したフローチャートである。
【図5】(a)は、MRI装置により撮影された心臓のスライス画像の一例を示した図であり、(b)は心臓におけるMRI画像の撮影位置をL=1〜6までずらして撮影する場合の位置関係を示した心臓の模式図である。
【図6】(a)は、時間t=1のMRI画像においてマーク処理を施す前の画像を示し、(b)は、マーク処理を施した後の画像を示している。
【図7】(a)は時間t=1のMRI画像を示し、(b)は、時間t=2におけるMRI画像であって、2次元連続DPによりマーク位置が求められた画像を示し、(c)は、(b)のMRI画像に対してダイレーションおよびエロージョンを実行した後の画像を示している。
【図8】(a)は、三尖弁の形状を3次元的に示した図であり、(b)は、三尖弁の可動体積を示した図である。
【発明を実施するための形態】
【0034】
以下、本発明に係る体内臓器の動画像生成装置について、一例であるMRI(Magnetic Resonance Imaging)装置(磁気共鳴画像法装置)を提示し、図面を用いて詳細に説明する。
【0035】
図1は、MRI装置の概略構成を示したブロック図である。
【0036】
MRI装置1は、静磁場発生磁石2と、高周波送信用コイル3と、高周波受信用コイル4と、傾斜磁場コイル5,5と、コンピュータ6と、シーケンサ7と、高周波発生装置8と、変調器9と、増幅器10と、傾斜磁場発生装置11と、増幅器12と、位相検波器13と、AD変換器14と、表示部15と、操作入力部(マーク付加手段)16とを備えている。
【0037】
静磁場発生磁石2は、被検者Xが置かれる空間に均一な静磁場を発生する役割を有している。傾斜磁場コイル5,5は、被検者Xが置かれる空間に直交3軸方向の傾斜磁場を発生する役割を有しており、傾斜磁場コイル5,5には、傾斜磁場発生装置11によって駆動電力が給電されている。
【0038】
高周波発生装置8は、高周波信号を出力する装置であり、高周波発生装置8から出力される高周波信号は、変調器9において適切な信号に変調され、増幅器10において増幅されて高周波送信用コイル3に供給される。高周波送信用コイル3に対して高周波信号が供給されることにより、被検者Xの生体組織を構成する静磁場中の原子核(プロトン)に核磁気共鳴を起こせる高周波パルスを照射することが可能となる。
【0039】
高周波送信用コイル3により高周波パルスが被検者Xに照射されると、プロトンに核磁気共鳴が起こり、エコー信号などの磁気共鳴信号が出力される。この磁気共鳴信号は、MRI装置1の高周波受信用コイル4によって受波され、増幅器12において増幅された後、位相検波器13においてアナログ信号として検出される。検出されたアナログ信号は、AD変換器14によってデジタル信号の計測データに変換され、コンピュータ6へ出力される。
【0040】
シーケンサ7は、コンピュータ6の制御指示に応じて、磁気共鳴撮影を行うのに必要な命令を、MRI装置1の磁場発生系統(傾斜磁場コイル5、5や傾斜磁場発生装置11など)や高周波送受信系統(高周波発生装置8、変調器9、増幅器10、12、高周波送信用コイル3、高周波受信用コイル4、位相検波器13、AD変換器14など)に送り、これらの動作を制御する役割を有している。
【0041】
コンピュータ6の制御指示に応じて、MRI装置1の磁場発生系統および高周波送受信系統が動作させることにより、被検者Xの体内臓器の断面画像を連続的に撮影することが可能となる。また、コンピュータ6の制御指示に従って、断面画像の撮影位置を被検者Xの身長方向(撮影される断面画像の積層方向)へ少しずつ移動させて、断面画像を撮影することが可能となっている。
【0042】
なお、このようにして断面画像を撮影するための処理を行う静磁場発生磁石2、高周波送信用コイル3、高周波受信用コイル4、傾斜磁場コイル5,5、シーケンサ7、高周波発生装置8、変調器9、増幅器10、傾斜磁場発生装置11、増幅器12、位相検波器13およびAD変換器14は、本発明に係る断面画像撮影手段に該当する。
【0043】
表示部15は、コンピュータ6により画像処理された体内臓器の部位画像および部位動画を表示する役割を有しており、コンピュータ6に接続されている。また、操作入力部16は、被検者XにおけるMRI画像の撮影位置設定・調整操作および撮影されたMRI画像に対して所定の画像処理を行うために必要な情報の入力操作など(後述するマーク位置の設定など)を行う役割を有している。
【0044】
コンピュータ6は、図2に示すように、CPU(撮影制御手段、画像解析手段)20と、ROM21と、RAM22、記憶部(記録手段)23を有している。ROM21は、CPU20における処理内容を記録したプログラム(例えば、図4に示すフローチャートからなるプログラム)や、MRI装置1における初期設定情報などを記録する役割を有している。RAM22は、CPU20の処理において利用されるワークエリアとしての役割を有している。
【0045】
CPU20は、ROM21に記録されるプログラムに従って、臓器における所定部位のMRI画像を、所定時間毎に連続的に撮影する処理を行う。また、CPU20は、医師等が操作入力部16を操作して一枚目のMRI画像にマークされた所定部位を基準として、その後に撮影された複数のMRI画像から所定部位の特定を行う処理(該当するマーク位置を設定してマークを追加(記録)する処理)を行う。さらに、CPU20は、所定部位におけるMRI画像の撮影位置を少しずつずらして撮影を行うことにより、所定部位における3次元的な動画像の生成を行う。
【0046】
また、CPU20は、処理内容に応じてシーケンサ7に制御指示を出力する。シーケンサ7は、CPU20による制御指示応じて、MRI装置1における磁場発生系統(傾斜磁場コイル5、5や傾斜磁場発生装置11など)や高周波送受信系統(高周波発生装置8、変調器9、増幅器10、12、高周波送信用コイル3、高周波受信用コイル4、位相検波器13、AD変換器14など)などの動作を行う。
【0047】
次に、CPU20の処理について説明する。本実施の形態においては、体内臓器の所定部位の一例として、心臓の三尖弁の動きを動画像として生成する場合について説明をする。ただし、臓器の所定部位として三尖弁の動きを検出することは、単なる一例であって、臓器の所定部位は必ずしも心臓の三尖弁に限定されるものではない。
【0048】
心臓の外科手術において弁膜症が関与する割合は大変高く、70%以上の手術において弁膜が起因しているというデータも存在する。心臓には、図3に示すように、肺動脈弁、三尖弁、僧帽弁、大動脈弁からなる4種類の弁が存在し、それらの弁の中で、弁の動きの低下による疾患の大きな原因に該当し得るものが、三尖弁である。三尖弁は、一種の腱であり、CTやMRIにより撮影された画像では鮮明にその状態を捕らえることが困難であった。そのため、MRI画像などから三尖弁の疾患の様相を視覚的に捕らえることが難しく、疾患が生じているか否かの判断基準となる三尖弁の動きを観察することはさらに困難なものとなっている。
【0049】
本実施の形態に係るMRI装置1では、MRI画像において鮮明に捕らえることが困難な三尖弁の3次元的な動画像を生成する処理を行う。
【0050】
図4は、MRI装置1のCPU20における処理内容を示したフローチャートである。CPU20は、心臓における特定の位置において複数のMRI画像を撮影し(例えば、図5(a)のような画像)、各MRI画像において、三尖弁の位置を自動的に特定する処理を行う(図4のステップS.11〜ステップS.21)。CPU20は、三尖弁の位置検出処理を、図5(b)に示すように、少しずつ位置(図5(b)における撮影位置L)をずらして数回測定を行う(撮影位置Lを図5(b)に示すようにL=1からL=6までずらして測定する、図4のステップS22〜S24)。本実施の形態に係るMRI装置1では、心臓の上下方向に12mmずつ検出位置をずらして合計6箇所の位置においてMRI画像の撮影を行う。
【0051】
そして、CPU20は、測定された全てのMRI画像より三尖弁の位置を検出し、検出された三尖弁の位置に基づいて、三尖弁の状態を3次元的に示した動画像を生成する(図4のステップS.25〜28)。これらの詳細な処理内容を、以下に説明する。
【0052】
まず、CPU20は、記憶部23に記録された初期情報を読み出して初期設定を行う(ステップS.11)。具体的には、MRI画像の撮影タイミング(撮影時間)を示すtの値を1に設定し(t=1)、MRI画像を撮影する位置を示すLの値を1に設定する(撮影位置L=1)処理を行う。この初期設定値は、RAM22に一時的に記録され、CPU20における処理に応じて適宜更新されることになる。
【0053】
次に、CPU20が、シーケンサ7に対して制御指示を出力することにより、MRI装置1の磁場発生系統や高周波送受信系統を動作させて、被検者Xの心臓の2次元画像(心臓が撮影範囲に含まれる2次元画像)をMRI装置1によって撮影する(ステップS.12)。2次元画像をMRI装置1により撮影する場合には、心臓の同じ位置(同じ撮影位置)における複数のMRI画像を一定の時間間隔で複数枚撮影する。
【0054】
撮影された画像は、記憶部23に一時的に記録される。撮影されたMRI画像は、最初に撮影されたMRI画像を、時間t=1において撮影されたMRI画像とし、その後に撮影されたMRI画像を、時間t=2のMRI画像、時間t=3のMRI画像、・・・時間t=TにおけるMRI画像として区別するものとする。また、本実施の形態においては、1つの鼓動(ビート)が開始された時をt=1とし、次の鼓動が開始される直前がt=Tとなるようにする。このようにして、1つの鼓動間隔で、t=1からt=TまでのT枚のMRI画像を撮影することにより、1つの鼓動の開始から終了までの心臓の状態を撮影することができる。
【0055】
次に、CPU20は、記憶部23に記録された2次元のMRI画像のそれぞれに対してラプラシアンと呼ばれる画像マスク処理を行う(ステップS.13)。MRI画像に画像マスク処理を施すことによって、MRI画像のエッジを強調することができ、画像を鮮明にすることが可能となる。なお、ラプラシアンによる画像マスク処理は、既に画像処理技術として一般的に知られた方法であるため、詳細なマスク処理の内容については説明を省略する。
【0056】
そして、CPU20は、時間t=1のMRI画像に対して、操作入力部16を介して医師等が三尖弁の位置をマークすることを可能な状態とする(医師等によるマークの許可処理)(ステップS.14)。MRI画像には、腱である三尖弁が鮮明には表示されにくい傾向がある。しかしながら、医師等は、MRI画像において鮮明に表示される部位(例えば、血液が多い部位)などの位置関係から、三尖弁の位置を推測することが可能である。このため、CPU20は、最初に撮影されたMRI画像(t=1において撮影されたMRI画像)に対して、医師等が三尖弁の位置をマークすることができるようにする(マーク処理を医師等に行わせる)ことにより、MRI画像における三尖弁の位置(マーク位置)を高い精度で特定することが可能となる。
【0057】
図6(a)は、t=1のMRI画像に対して、マーク処理が行われる前の画像を示し、図6(b)は、マーク処理が行われた後の画像を示している。三尖弁は円環状(リング状)の腱であるため、円環状の端部であれば、MRI画像においてマークされる箇所が1箇所となり、円環状の中央部(少なくとも端部以外)であれば、2箇所となる。図6(b)においては、2箇所のマークMが示されている。
【0058】
医師等は、操作入力部16の操作により三尖弁の位置をMRI画像にマークし終わった場合には、マークを終了した旨の操作(例えば、操作入力部16において予め設けられるマーク終了操作ボタンの押下など)を行う。マークを終了した旨の操作が行われていない場合(ステップS.15においてNoの場合)、CPU20は、三尖弁の位置のマーク処理が行われている最中であると判断して、処理をステップS.14の処理へ移行する。一方で、マークを終了した旨の操作が行われた場合(ステップS.15においてYesの場合)、CPU20は、三尖弁の位置のマーク処理が終了したものと判断する。
【0059】
三尖弁の位置のマーク処理が終了した場合(ステップS.15においてYesの場合)、CPU20は、2次元連続DP(weak spotting version)と呼ばれるアルゴリズムに基づいて、三尖弁の位置がマークされた時間tのMRI画像を参照画像とし、時間t+1のMRI画像を入力画像とすることにより、参照画像および入力画像における全ピクセルの対応関係を求める(ステップS.16)。ここで、2次元連続DPは、既に知られた技術であり、『岡隆一,外2名「連続DPの一般スキームについて−画像スポッティングのための全画素最適マッチング−」,信学技報,電子情報通信学会,IEICE Technical Report, PRMU2010-87,IBISML2010-59 (2010-09)』および特開2010−165104号公報おいて詳細な説明がなされているため、具体的な説明を省略する。
【0060】
そして、CPU20は、2次元連続DPに基づく全ピクセルの対応関係から、時間tのMRI画像においてマークした三尖弁の全ピクセルに対応するピクセルを、時間t+1のMRI画像において求める(ステップS.17)。
【0061】
次に、CPU20は、2次元連続DPによりマークの対応関係が求められた時間t+1のMRI画像のピクセル群に対して、ダイレーション(dilation)というピクセルの増大処理とエロージョン(erosion)というピクセル削減処理とを施す(ステップS.18)。時間t+1のMRI画像に対して、このダイレーションおよびエロージョンを施すことにより、時間t+1において三尖弁に対応するピクセルとして求められたピクセル群の孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めが行われ、時間t+1のMRI画像のマーク(マーク位置におけるピクセル群)が明確になる。
【0062】
本実施の形態に係るMRI装置1では、一例として、ダイレーション(dilation:ピクセルの増大処理)を2回行い、エロージョン(erosion:ピクセル削減処理)を4回行う。ただし、ダイレーション(dilation)とエロージョン(erosion)とのそれぞれの処理回数は、特に限定されるものではない。
【0063】
なお、ダイレーション(dilation)とエロージョン(erosion)とによるピクセルの増大・削減処理は、モルフォロジ処理と呼ばれる画像処理の代表的な処理であり、上述したように、孤立点(孤立したピクセル)の除去、不連続なピクセルの接続と穴埋めのために利用される処理である。この画像処理は既に知られた処理方法であるため、ここでの詳細な説明は省略する。
【0064】
図7は、t=1のMRI画像においてマークされた三尖弁のピクセル群から2次元連続DPに基づいて求められたt=2のMRI画像のマークを、ダイレーション(dilation)とエロージョン(erosion)とをそれぞれ複数回繰り返すことにより明確化する一例を示したMRI画像である。
【0065】
まず、図7(a)は、既に説明したように、t=1のMRI画像であって、既に三尖弁の位置にマークM1がなされた画像である。一方で図7(b)に示すMRI画像は、2次元連続DPに基づいて対応するマークが求められたt=2のMRI画像を示している。図7(b)の拡大画像に示すように、2次元連続DPに基づいて求められたt=2のMRI画像のマークM2は、(a)のマークM1と異なり、細かい点の集まりとして示されている。
【0066】
図7(b)に示すようにして求められたMRI画像に対して、CPU20がダイレーション(dilation)とエロージョン(erosion)とを複数回実行する。ダイレーションとエロージョンとを実行することにより、図7(c)に示すように、マークM3が一塊のピクセル群となり、マークM3の明確化を実現することが可能となる。
【0067】
その後、CPU20は、マークの明確化が図られたMRI画像を、記憶部23に記録する(ステップS.19)。なお、このMRI画像は、撮影位置Lの値と、撮影時間tの値とを関連付けて記録される。
【0068】
次に、CPU20は、時間t+1のMRI画像が時間TのMRI画像であるか否か(つまり、t+1=Tであるか否か、t+1の画像が各撮影位置における最後のMRI画像であるか否か)を判断する(ステップS.20)。時間t+1のMRI画像が時間TのMRI画像でない場合(ステップS.20においてNoの場合)、CPU20は、t=t+1の処理によって、tの値を1つ増加させて(ステップS.21)、処理を上述したステップS.16へと移行させて、上述した処理を繰り返し実行する。
【0069】
一方で、時間t+1のMRI画像が時間TのMRI画像である場合(ステップS.20においてYesの場合)、CPU20は、MRI画像の撮影位置Lが6箇所目の撮影位置であるか否か、つまりL=6であるか否かの判断を行う(ステップS.22)。
【0070】
MRI画像の撮影位置Lが6箇所目でない場合(ステップS.22においてNoの場合)、CPU20は、シーケンサ7に対して制御指示を出力することにより、MRI装置1におけるMRI画像の撮影位置を12mmだけ移動させる(ステップS.23)。そして、CPU20は、撮影位置Lの値を1つ増加させて(ステップS.24)、処理をステップS.12へと移行させる。
【0071】
ここで、撮影位置が移動する方向をZ軸方向とし、MRI画像の撮影が行われる心臓の断面(スライス面)をXY平面とする。MRI画像は、一般的に512ピクセル×512ピクセルの解像度で撮影され、この平面は、物理的に35cm×35cmの大きさに対応するものである。従って、1ピクセルの区間は、0.684mmに該当することになる。
【0072】
512ピクセル×512ピクセルのMRI画像の中で、心臓が映っている領域を切り出すと、250ピクセル×250ピクセルの大きさとなり、三尖弁の位置検出に利用されるMRI画像の大きさも250ピクセル×250ピクセルの大きさに含まれることになる。従って、切り出された領域の画像の一辺の実際の長さは、250ピクセル×0.684mm=170.9mmとなる。
【0073】
このことから、三尖弁の位置検出において求められる3次元空間は、X軸方向およびY軸方向の長さが170.9mm、Z軸報告の長さが、12mm×5(撮影位置L=1からL=6までの距離)=60mmとなる。従って、三尖弁の位置検出が行われる物理的な空間は、171mm×171mm×60mmの空間と相似したものとなる。なお、Z軸方向の長さ60mmは、ピクセル換算すると、60mm÷0.684mm(1ピクセルの長さ)=88となり、88ピクセルに対応する。
【0074】
MRI画像の撮影位置Lが6箇所目である場合(ステップS.22においてYesの場合)、つまり、最後の撮影位置(L=6)におけるT枚目のMRI画像のマーク処理が終わった場合、CPU20は、撮影された全てのMRI画像のマークから、マーク領域を構成するピクセル群の重心位置を算出する(ステップS.25)。このように各MRI画像におけるマークの重心位置を求めることにより、心臓の鼓動に伴って動く三尖弁の位置を時系列的に抽出することが可能となる。
【0075】
また、MRI画像による三尖弁のスライス画像は、上述した処理から明らかなように、一度に6箇所同時に撮影することができない。しかしながら、各撮影位置におけるMRI画像の撮影は、心臓の鼓動が開始されたタイミングで時間t=1のMRI画像が撮影され、次の鼓動が開始されるまでの間に時間t=TのMRI画像の撮影が行われる。この撮影タイミングは、撮影位置L=1からL=6まで同じタイミングであるため、鼓動の動きに対応してそれぞれの撮影位置で同じタイミングのMRI画像を撮影したものと判断することができる。従って、鼓動が開始したタイミングである時間t=1のMRI画像を初期時刻として同一視すれば、複数の撮影位置において撮影されたMRI画像を、同時期に撮影されたMRI画像として処理することが可能となり、三尖弁の3次元的な動きを求めることが可能となる。
【0076】
なお、三尖弁はリング状を呈するため、三尖弁のMRI画像(スライス画像)には、三尖弁のリング状断面が1断面あるいは2断面撮影されることになる。このリング状断面は、撮影位置によって異なり、三尖弁の端部側を撮影する場合には、三尖弁の断面が1断面となる。従って、撮影位置の異なる6箇所の撮影箇所のMRI画像から、時間tに応じて10〜12個の三尖弁のリング位置(マークの重心位置)を3次元的に求めることができる。3次元的に示される10〜12個の三尖弁のリング位置を、時間tに応じて、t=1からt=Tまで変化させることにより、3次元的に求められる三尖弁の状態を時系列に求めることが可能となり、三尖弁の動きを求めることができる。
【0077】
しかしながら、上述のようにして求められる三尖弁のリング位置は、時間tにおいて10〜12個の断片的な位置情報であって、3次元における全体的な三尖弁の位置情報の一部でしかない。一方で、多くの位置情報を得るためには多数の撮影位置においてMRI装置1で三尖弁のスライス撮影を行うことが好ましいが、現実的には困難である。
【0078】
このため、求められた時間t毎の三尖弁のリング位置を三尖弁の3次元的なサンプル点とし、3次元空間における三尖弁のリング形状が、サンプル点を繋ぐことにより形成される滑らかな3次元上の曲線によるものと想定することにより、合理性を備えた三尖弁のリング形状を求めることができる。
【0079】
従って、CPU20は、時間t毎に、それぞれのMRI画像から求められた10〜12個の三尖弁のリング位置(マークの重心位置)を通り滑らかな閉曲線を形成するスプライン曲線を算出する(ステップS.26)。いくつかのサンプル点に基づいてスプライン曲線を算出する手法は既に知られているため、ここでの詳細な説明は省略する。このようにして3次元的なスプライン曲線を求めることによって、3次元的な三尖弁のリング形状を、例えば1000点の空間点のつながりによって表現することが可能となる。
【0080】
図8(a)は、サンプル点(白い球体)を通るスプライン曲線状の各点に、小さな球体を配置することにより三尖弁のリング形状を表現した図である。心臓の1つの鼓動(ビート)の開始から次の鼓動の開始直前までの全体の時間を、前述した既出の時間Tとして考えると、T個のスプライン曲線を得ることが可能となる。従って、時間t=1からTまでのT個のスプライン曲線に基づいて、1つの鼓動の開始から終了までの時間における三尖弁の3次元的な動きを求めることができる。
【0081】
CPU20では、三尖弁の3次元的な座標情報を、時間t=1からTまでのT個のスプライン曲線に基づいて求めて(ステップS.27)、求められた三尖弁の3時次元的な座標情報の変化に基づいて、1つ鼓動に対応する三尖弁の3次元動画像を生成する(ステップS.28)。
【0082】
このようにして求められた三尖弁の3次元動画を繰り返し表示部15に表示させる(再生表示させる)ことにより、MRI装置1において鮮明に撮影できない腱などの部位の状態変化、本実施の形態では三尖弁の状態変化を明確に示した映像として抽出し、医師などに提供することが可能となる。このため、医師は、三尖弁の鮮明な3次元画像および3次元動画像に基づいて、リング形状に異常がないか否か、また、動きに異変がないか否かを、視覚的に判断することが可能となる。
【0083】
さらに、三尖弁の動画像は、三尖弁のリングの全て位置情報とその位置変化(動き)が、3次元的な電子データとして記録されている。このため、3次元空間を小さなサイコロ状に分割し、三尖弁の動画像に基づいて、1つの鼓動において三尖弁の移動の際に接触するサイコロ状の分割部分の個数を加算することにより、三尖弁の可動体積を算出することができる。サイコロ状の分割間隔は、既に説明したようにミリメートル(mm)単位で可能であるため、立法ミリメートル単位での可動体積を求めることが可能となる。
【0084】
図8(b)は、三尖弁の可動体積を示した3次元的な図である。正常な三尖弁の可動体積と異常がある三尖弁の可動体積とを、信頼できるサンプルに基づいて多数収集することにより、統計的な検定によって疾患の有無を判定することも可能である。
【0085】
以上、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法について、MRI装置1を一例として用い、MRI装置1で三尖弁を撮影する場合について説明を行ったが、本発明に係る体内臓器の動画像生成装置および体内臓器の動画像生成方法は、上述した実施の形態に示したMRI装置1の構成およびその処理方法だけに限定されず、また、三尖弁を撮影する場合だけに限定されるものではない。
【0086】
例えば、実施の形態に係るMRI装置1では、心臓の三尖弁のリング形状の動画像を生成する場合について説明したが、他の部位を時間t=1のMRI画像にマークすることにより、マーク位置に該当する部位の動画像を生成することが可能である。従って、例えば、心臓の心房などの部位にマークを設定することにより心房における動画像を生成することができ、心房の動作状況の可視化や、可動体積の算出などを同様にして行うことが可能である。
【0087】
特に、本発明に係る体内臓器の動画像生成装置では、MRI画像において必ずしも鮮明に示されていない部位であっても、時間t=1のMRI画像においてマークを設定することによって、2次元連続DPにより対応関係が求められたピクセル群を自動的に求めることができる。このため、時間t=1のMRI画像において部位のマーク処理を確実に行うことにより、該当するマーク位置の部位の状態を自動的に求めることができる。従って、従来では視覚的に確認することができなかった部位の形状(様子)およびその動作状況を可視化することができ、臨床診断における診断精度の向上とその診断負担の軽減を図ることが可能となる。
【0088】
また、本実施の形態に係るMRI装置1では、断面画像の画像マスク処理や、2次元連続DPに基づくマークの特定処理や、ダイレーションおよびエロージョンによる画像処理や、3次元的なスプライン曲線を求める処理などを、CPU20だけで行う場合について説明した。しかしながら、これらの全ての処理を、1つのCPUだけに行わせる構成には限定されない。各処理に応じてそれぞれ異なるCPUを設けて、複数のCPUが順次処理を行うことによって、結果として体内臓器の3次元的な動画像を生成する構成であってもよい。
【符号の説明】
【0089】
1 …MRI装置
2 …静磁場発生磁石(断面画像撮影手段)
3 …高周波送信用コイル(断面画像撮影手段)
4 …高周波受信用コイル(断面画像撮影手段)
5 …傾斜磁場コイル(断面画像撮影手段)
6 …コンピュータ
7 …シーケンサ(断面画像撮影手段)
8 …高周波発生装置(断面画像撮影手段)
9 …変調器(断面画像撮影手段)
10 …増幅器(断面画像撮影手段)
11 …傾斜磁場発生装置(断面画像撮影手段)
12 …増幅器(断面画像撮影手段)
13 …位相検波器(断面画像撮影手段)
14 …AD変換器(断面画像撮影手段)
15 …表示部
16 …操作入力部(マーク付加手段)
20 …CPU(撮影制御手段、画像解析手段)
21 …ROM
22 …RAM
23 …記憶部(記録手段)
X …被検者
【特許請求の範囲】
【請求項1】
体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、
該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、
前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、
前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、
前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段と
を有し、
前記撮影制御手段は、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、
前記画像解析手段は、
前記記録手段に記録された断面画像を読み出して、
一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、
2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、
前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、
算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、
同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、
前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成する
ことを特徴とする体内臓器の動画像生成装置。
【請求項2】
前記画像解析手段は、前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すこと
を特徴とする請求項1に記載の体内臓器の動画像生成装置。
【請求項3】
前記撮影制御手段は、前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させること
を特徴とする請求項1または請求項2に記載の体内臓器の動画像生成装置。
【請求項4】
体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、
該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、
前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、
前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、
前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段と
を有する体内臓器の動画像生成装置において、
前記撮影制御手段が、
前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、
前記画像解析手段が、
前記記録手段に記録された断面画像を読み出して、
一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、
2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、
前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、
算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、
同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、
前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成する
ことを特徴とする体内臓器の動画像生成方法。
【請求項5】
前記画像解析手段が、
前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すこと
を特徴とする請求項4に記載の体内臓器の動画像生成方法。
【請求項6】
前記撮影制御手段が、
前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させること
を特徴とする請求項4または請求項5に記載の体内臓器の動画像生成方法。
【請求項1】
体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、
該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、
前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、
前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、
前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段と
を有し、
前記撮影制御手段は、前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、
前記画像解析手段は、
前記記録手段に記録された断面画像を読み出して、
一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、
2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、
前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、
算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、
同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、
前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成する
ことを特徴とする体内臓器の動画像生成装置。
【請求項2】
前記画像解析手段は、前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すこと
を特徴とする請求項1に記載の体内臓器の動画像生成装置。
【請求項3】
前記撮影制御手段は、前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させること
を特徴とする請求項1または請求項2に記載の体内臓器の動画像生成装置。
【請求項4】
体内臓器における断面画像の撮影位置を当該断面画像の積層方向へ移動させることができ、かつ、前記断面画像を所定時間間隔で連続的に撮影することが可能な断面画像撮影手段と、
該断面画像撮影手段により撮影された前記断面画像を、同一撮影位置において連続して撮影された前記断面画像の撮影順番と、当該断面画像の撮影位置とに関連付けて記録する記録手段と、
前記断面画像撮影手段における前記撮影位置および撮影タイミングを制御する撮影制御手段と、
前記記録手段に記録された前記断面画像の画像解析を行う画像解析手段と、
前記断面画像に対してユーザがマーク位置を設定することにより、前記体内臓器における所定部位の位置をマークによって当該断面画像に記録させることが可能なマーク付加手段と
を有する体内臓器の動画像生成装置において、
前記撮影制御手段が、
前記断面画像撮影手段に、前記体内臓器の前記断面画像を一の撮影位置において連続的に撮影させ、かつ、当該連続的な前記断面画像の撮影を、前記体内臓器が収まる積層方向範囲において少しずつ撮影位置をずらして当該撮影位置毎に行わせ、
前記画像解析手段が、
前記記録手段に記録された断面画像を読み出して、
一の撮影位置において連続的に撮影された複数の前記断面画像のうち当該撮影位置において最初に撮影された断面画像に対して、前記マーク付加手段により設定されたマーク位置に前記マークを付加し、
2次元連続DPを用いて、前記マークが付加された前記断面画像のマーク位置に基づいて、前記マークが付加された前記断面画像の次に撮影された断面画像にマークを付加することにより、連続的に撮影された全ての撮影位置における全ての断面画像に自動的にマークを付加し、
前記断面画像に付加された前記マークの重心位置を、当該マークのピクセル群に基づいて全ての断面画像について算出し、
算出された重心位置に基づいて、前記断面画像の画像平面および前記積層方向からなる3次元空間における前記体内臓器の前記部位の座標情報を、異なる撮影位置であって前記連続的に撮影された断面画像のうち同じ撮影順番で撮影された断面画像毎に求め、
同じ撮影順番で撮影された前記座標情報に基づいて3次元的なスプライン曲線を求めて、撮影順番毎に前記部位の3次元的な形状を求め、
前記撮影順番毎に求められた前記部位の3次元的な形状を、前記撮影順番に従って変化させることにより、前記部位の3次元的な形状の時間的な変化を求めて、前記部位における3次元的な動画像を生成する
ことを特徴とする体内臓器の動画像生成方法。
【請求項5】
前記画像解析手段が、
前記マークの重心位置を全ての断面画像について算出する前に、当該マークが付加された前記断面画像に対して、ダイレーションとエロージョンとによる画像処理を施すこと
を特徴とする請求項4に記載の体内臓器の動画像生成方法。
【請求項6】
前記撮影制御手段が、
前記断面画像撮影手段に前記断面画像を連続的に撮影させる場合に、前記体内臓器を備える被検者の一の鼓動の開始から次の鼓動が開始されるまでの断面画像を連続的に撮影させること
を特徴とする請求項4または請求項5に記載の体内臓器の動画像生成方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−97586(P2013−97586A)
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2011−239897(P2011−239897)
【出願日】平成23年11月1日(2011.11.1)
【出願人】(506301140)公立大学法人会津大学 (23)
【出願人】(311012033)財団法人竹田綜合病院 (1)
【Fターム(参考)】
【公開日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年11月1日(2011.11.1)
【出願人】(506301140)公立大学法人会津大学 (23)
【出願人】(311012033)財団法人竹田綜合病院 (1)
【Fターム(参考)】
[ Back to top ]

