修飾核酸を用いた細胞内RNA量の変化の測定方法
【課題】細胞内の目的RNAの量の変化を簡便、高効率かつ正確に測定する。
【解決手段】細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
【解決手段】細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は修飾核酸を用いた細胞内RNA量の変化の測定方法に関する。
【背景技術】
【0002】
従来、培養細胞を用いてin vivoで合成される特定RNAの分解を調べるために、[3H]ウリジンを用いる方法が利用されてきた。この手法は高感度ではあるが、放射性同位体(RI)を使用するため、使用管理に制限が生じ、操作に危険及び煩雑さを伴うといった問題点がある。また、[3H]ウリジンを用いる方法ではプローブとハイブリダイゼーションさせた後にRIを検出するが、ハイブリダイゼーション法固有の問題点として類似RNA(ファミリー遺伝子由来RNA等)を区別して検出できない、すなわち配列特異性が低いという問題があった。
【0003】
また、転写反応阻害剤である5,6-Dichloro-1-β-D-ribofuranosylbenzimidazole(DRB)やActinomycin D等を用いる方法も利用されている。この手法は、転写反応阻害剤を細胞培養液に添加し、細胞内でのRNAの転写反応を阻害させた後、経時的に細胞を回収し、細胞からtotal RNAを抽出してNorthen Blot法やReal-time PCR法等を行うことで、特定の塩基配列を有するRNAの量の経時的変化を測定する方法である。この手法は現在広く用いられているが、細胞内の転写反応を阻害してしまうため細胞に負荷がかかり、それに付随した予期せぬ細胞への影響が懸念されている。実際に、ある種のRNAは阻害剤を用いた転写阻害により細胞内局在が変化して生理的分解を測定できないといった問題が生じている。また、転写阻害剤は細胞死を誘導するため、24時間以上のRNA分解測定が困難である。
【0004】
また、テトラサイクリン誘導性プロモーター直下流に測定対象RNA遺伝子をクローニングし、テトラサイクリン添加によって測定対象RNAの転写のみを停止させた後に経時的RNA分解をNorthen Blot法やReal-time PCR法等で測定する手法もある。この手法では、測定対象RNAをコードするcDNAをクローニングし、かつ構築したRNA発現用DNAを細胞へ遺伝子導入する必要がある。さらに、テトラサイクリン誘導のためのテトラサイクリンリプレッサータンパク質を発現する細胞をTet-off細胞として樹立することが必要である。そのため、煩雑であり、かつ、cDNAクローニングの技術的問題から長いRNAの分解を測定することが極めて困難である。また、細胞の種類によっては遺伝子導入が極めて困難な細胞があるため、手法の適用範囲が限定されるという問題点がある。
【0005】
ところで、5−ブロモデオキシウリジンや5−ブロモウリジンなどの修飾核酸は従来、細胞に取り込ませて細胞の増殖を評価したり、遺伝子の検出を行うために使用されてきたが(例えば、非特許文献1)、この様な天然には存在しないハロゲン化ウリジンを取り込んだRNAが細胞内で生理的な分解挙動を取るか不明であったため、細胞内RNAの量の変化を調べるために使用されたことはなかった。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Experimental Cell Research 234, 498-506 (1997)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は上記従来技術の問題点を解消する点にあり、使用管理に制限が生じるRIを用いず、細胞に負荷のある転写反応阻害剤を用いず、in vivoで合成される特定の目的RNAの量の変化を測定するための手段を提供する点にある。
【課題を解決するための手段】
【0008】
発明者らは上記課題を解決すべく鋭意研究した結果、ブロモウリジン(BrU)などのハロゲン化ウリジンを用いることで、特定の塩基配列を有する目的RNAの量の経時変化を簡便、高感度かつ特異的に測定することができることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下のとおりである。
[1]細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
[2]前記ハロゲン化ウリジンがブロモウリジンである、[1]に記載の方法。
[3]前記抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程を、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させた状態で行う、[1]または[2]に記載の方法。
[4]単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量の測定をRT-PCRにより行う、[1]〜[3]のいずれかに記載の方法。
[5]ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む細胞内RNA量の変動を測定するためのキット。
[6]さらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含む、[5]に記載のキット。
[7]さらに、RT-PCR用プライマーを含む、[5]または[6]に記載のキット。
【発明の効果】
【0010】
本発明では、ブロモウリジン(BrU)などのハロゲン化ウリジンを用いるため、RIを使用するときに問題となる使用管理に関する制限は特に生じない。また、転写反応阻害剤を用いる必要がないため、細胞への負荷を軽減することができ、予期せぬ細胞への影響を最小限に抑えてin vivoで合成されるRNAの生理的分解挙動を測定することができる。さらに、本発明では、測定対象RNAをコードするcDNAのクローニングを必要としないため、簡便であって、cDNAクローニングと遺伝子導入の技術的問題に起因する問題が生じない。また、長いRNAの量の変化も測定可能であり、長時間の変化も測定可能である。さらに、多数のRNAの量の変化を同時測定することも可能である。
【図面の簡単な説明】
【0011】
【図1】本発明の方法の一態様を示す模式図。
【図2】BrUで標識されたtotal RNAの量とそれに含まれる長いRNAであるMALAT-1 RNAの量との関係を示す値。(A)はBrU標識ルシフェラーゼ(Luc)RNAで補正しない場合であり、縦軸はMALAT-1 RNAのコピー数を示す。(B)はBrU標識ルシフェラーゼ(Luc)RNAで補正した場合であり、縦軸はルシフェラーゼRNAに対するMALAT-1 RNAの割合を示す。
【図3】本発明の方法によりMALAT-1のRNA量の経時変化を調べた結果を示す図。(A)はBrU標識ルシフェラーゼ(Luc)RNAで補正しない場合であり、(B)はBrU標識ルシフェラーゼ(Luc)RNAで補正した場合である。
【図4】本発明の方法によりGAPDH、MEN betaおよびXISTのRNA量(BrU標識ルシフェラーゼ(Luc)RNAで補正)の経時変化を調べた結果を示す図。
【図5】本発明の方法により、転写阻害剤Actinomycin D(ActD)の存在下または非存在下でのMALAT-1とMEN beta(MENb)のRNA量(BrU標識ルシフェラーゼRNAで補正)の経時変化を調べた結果を示す図。
【図6】本発明の方法により、HEK293T細胞とPM/Scl-100がノックダウンされたHEK293T細胞においてGAPDHとXISTのRNA量(BrU標識ルシフェラーゼRNAで補正)の経時変化を調べた結果を示す図。
【発明を実施するための形態】
【0012】
<本発明の方法>
本発明の方法は、
細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法である。
なお、「変化」とは「増加」および「減少」を含むが、RNAの分解に基づくRNA量の減少を測定する態様が好ましい。
【0013】
細胞の種類は特に制限されず、真核細胞であっても原核細胞であってもよいが真核細胞が好ましく、哺乳動物細胞がより好ましい。また、細胞は株化細胞であってもよいし、組織等から調製された初代培養細胞であってもよい。また、細胞を含む組織や器官等をそのまま培養してもよい。
【0014】
RNAの種類は細胞内に存在し、ハロゲン化ウリジンが取り込まれうるRNAであれば特に制限されないが、mRNA、ノンコーディングRNA、ウイルスゲノムRNAなどが挙げられ、mRNAやノンコーディングRNAが好ましく、これらの組み合わせでもよい。
量の変化を測定する対象の目的RNAとしては、特定の配列を有するRNAである。目的RNAは2種類以上であってもよい。
【0015】
ハロゲン化ウリジン(5−ハロゲン化ウリジンとも呼ばれる)としては、ブロモウリジンおよびヨードウリジンが例示される。これらは市販のものを使用することができる。
【0016】
細胞を培養するための培地は、細胞の種類に応じて適宜選択することができる。例えば、培養対象が哺乳動物細胞の場合、約5〜20%の胎仔ウシ血清を含んでもよい最小必須培地(MEM)、ダルベッコ改変イーグル培地(DMEM)、RPMI1640培地、199培地、F12培地などが例示される。
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンが取り込まれ、ハロゲン化ウリジンを含むRNAが合成される。
加えるハロゲン化ウリジンの濃度は10〜1000μMであることが好ましい。
ハロゲン化ウリジンを含む培地での培養時間はハロゲン化ウリジンがRNAに取り込まれるのに十分な時間であればよいが、1〜72時間が好ましい。
【0017】
ハロゲン化ウリジンを含む培地で培養した後、ハロゲン化ウリジンを含む培地を除去し、好ましくはPBSなどのバッファーあるいはハロゲン化ウリジンを含まない培地で洗浄を行った後、培地をハロゲン化ウリジンを含まない培地に交換して一定時間培養する。
ハロゲン化ウリジンを含まない培地の種類は特に制限されないが、ハロゲン化ウリジン
を含まないこと以外は上記ハロゲン化ウリジンを含む培地と同じでもよい。また、短時間の評価を行うときは、PBSなどのバッファーでもよい。
【0018】
ハロゲン化ウリジンを含まない培地での培養中に経時的に測定用細胞サンプルを採取する。
ハロゲン化ウリジンを含まない培地での培養時間および細胞サンプル採取のタイミングは実験系によって異なり全く任意であるが、例えば、ハロゲン化ウリジンを含まない培地で合計3時間培養し、その培養開始時、0.5時間後、1時間後、2時間後、3時間後のタイミングで細胞サンプルを採取するような態様が例示される。なお、24時間以上の長時間の測定も可能である。
【0019】
細胞サンプルの採取は、浮遊培養であれば、例えば、細胞を含む培養液の一部をその都度採取すればよい。
付着培養の場合は、例えば、同じ種類の細胞を、細胞数をそろえて、複数の培養皿または複数の培養ウェルにおいて、同条件で、ハロゲン化ウリジンを含む培地での培養、次いでハロゲン化ウリジンを含まない培地での培養を行い、経時的に、複数の培養皿または複数の培養ウェルの中から一つずつ細胞サンプルを回収する態様が例示される。
【0020】
細胞サンプルから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程については、細胞サンプルの抽出液から直接抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離してもよいが、細胞サンプルの抽出液からまず公知の手法によりtotal RNA、mRNAなどを分離し、その後、抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離することが好ましい。
なお、ここでいう単離とはハロゲン化ウリジンが取り込まれていないRNAが含まれない程度に分離されれば良く、ハロゲン化ウリジンが取り込まれたRNA以外は存在しない状態までは要求されない。
抗ハロゲン化ウリジン抗体はポリクローナル抗体でもモノクローナル抗体でもそれらの断片であってもよい。抗ハロゲン化ウリジン抗体は公知の手法で作成することができるが、市販の抗体を用いてもよい。
また、抗ハロゲン化ウリジン抗体はハロゲン化ウリジンを認識できる限り、抗ハロゲン化デオキシウリジン抗体でもよい。
【0021】
抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離するための方法としては、免疫沈降、抗体カラムを用いる方法などが例示されるが、ハロゲン化ウリジンが取り込まれたRNAが単離される限り、特に制限されない。
【0022】
抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離する際には、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させることが好ましい。内部標準ハロゲン化ウリジン含有RNAは配列が特定されたものであればどのような配列でもよいが、細胞に内在しない配列であることが好ましい。ルシフェラーゼなどが一般にはよく使用されるのでこれを用いてもよい。これにより、測定結果の定量性と精度が向上する。
【0023】
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定する工程は、目的RNAの配列に基づいたプライマーやプローブを使用したRT-PCR、ハイブリダイゼーションなどによって行うことができる。トランスクリプトーム解析によって複数の目的RNAの量を同時に測定してもよい。RT-PCRとしては、逆転写反応によりcDNAを合成した後、標識プローブを用いる定量リアルタイムPCRを行うことがより好ましい。
【0024】
ハロゲン化ウリジンを含まない培地での培養における各時点の細胞サンプル中のRNAの
量の測定結果を比較することで、RNA量の経時変化を調べることができる。
例えば、ハロゲン化ウリジンを含まない培地での培養開始時(0時間)の目的RNAの量に対して、培養開始から2時間後の目的RNAの量が80%であれば、20%が分解したと判断することができる。
【0025】
また、ハロゲン化ウリジンを含まない培地での培養開始時に化合物を添加し、RNA量の経時変化を調べることで、化合物のRNA分解活性あるいは分解阻害活性を評価することができ、これによりRNA分解剤あるいは分解阻害剤をスクリーニングすることができる。
【0026】
また、細胞に遺伝子を導入するか、あるいは遺伝子を不活性化させ、該細胞におけるRNAの分解速度を、同遺伝子が導入あるいは不活性化されない親細胞におけるRNAの分解速度と比較することにより、遺伝子がコードするタンパク質がRNA分解を制御する活性を有するかを調べることもできる。
【0027】
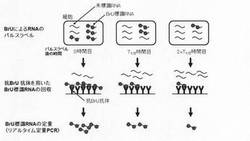
図1に基づいて、本発明の方法の手順の一例を具体的に示す。
まず、BrUを細胞培養液に添加し、細胞内で新たに転写されたRNAにBrUを取り込ませ、一定時間後に培養液を交換してBrUを取り除く(パルスラベル)。その後、経時的に細胞を回収し、細胞からtotal RNAを抽出して、BrU特異的抗体を用いてBrU標識されたRNAのみを回収し、逆転写反応後にリアルタイムPCRを行うことで、in vivoで合成された特定RNAの分解を測定することができる。
【0028】
<本発明のキット>
本発明のキットは、ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む、細胞内RNA量の変動を測定するためのキットである。好ましくは、本発明のキットはRNA分解測定用キットである。
本発明のキットはRT-PCR用のプライマーやハイブリダイゼーション用のプローブを含んでもよい。
本発明のキットはさらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含んでもよい。
本発明のキットはさらに、本発明の方法を実行するためのプロトコールを含んでもよい。
【実施例】
【0029】
以下、実施例を挙げて本発明をより具体的に説明するは、本発明は以下の実施例の態様に限定されるものではない。
【0030】
実験例1.定量性の検討
HeLa細胞(2×106 cells/10cm dish)の培養液(DMEM)に50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、RNAiso plus(TaKaRa)を用いて細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを0.5、1、2、4、7、10μg用いてBrU特異的抗体(anti-Bromodeoxyuridine 2B1; MBL)-Protein G Sepharose複合体(GE Healthcare)により免疫沈降を行った。1つの群ではそのまま免疫沈降を行ったが、他の群では、免疫沈降の際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNA(BrUTPとrNTP mixを基質として,Luc配列を有するプラスミドからT7 enzymeによりRNAを転写することで作製した)をtotal RNAにそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)により沈降物からRNAを回収し、逆転写反応、Real-time PCRにより、回収したRNA中に含まれるMALAT-1(Oncogene 22(39), 8031-8041)及びLuciferaseを定量した。結果を図2に示す。その結果、添加したtotal RNA量とMALAT-1の値に直線関係が得られ、Luciferaseの値で補正した場合はよりばらつきが少なくなることがわかった。
なお、Real-time PCRで用いたプライマーは以下のとおりである。
MALAT-1 forward primer : 5'-GCTGTGGAGTTCTTAAATATCAACC-3'(配列番号1)
MALAT-1 reverse primer : 5'-TTCTCAATCCTGAAATCCCCTA-3' (配列番号2)
Luc forward primer : 5'-TATGTGGCCAGCCAGGTTAC-3' (配列番号3)
Luc reverse primer : 5'-GTCCACGAACACAACACCAC-3' (配列番号4)
【0031】
実験例2.MALAT-1 RNAの分解パターンの測定
HeLa細胞(5×105 cells/10cm dish)の培養液(DMEM)に50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12、24時間後にRNAiso plus(TaKaRa)を用いて細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを2μg用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。1つの群ではそのまま免疫沈降を行ったが、他の群では、免疫沈降の際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるMALAT-1及びLuciferaseを定量した。結果を図3に示す。その結果、MALAT-1の分解の様子をモニタリングすることが可能であった。また、免疫沈降用内部標準化コントロールを加えた群では定量性の向上が見られた。
【0032】
実験例3.他の核局在型ノンコーディングRNAの分解パターンの測定
HeLa細胞(2.5×105 cells/6cm dish)もしくはHEK293T(4×105 cells/10cm dish)の培養液(DMEM)に150μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを2μg用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるGAPDH(glyceraldehyde-3-phosphate dehydrogenase)、MEN beta(Proc Natl Acad Sci USA, 2009, 106, 2525-2530)、XIST(Cold Spring Harb Symp Quant Biol., 2005, 69, 89-102)及びLuciferaseを定量した。Luciferase で補正したGAPDH、MEN beta、XISTのRNA量の経時変化を図4に示す。この結果より、GAPDH、MEN beta、XISTの各RNAの分解の様子をモニタリングすることが可能であった(図4)。
なお、Real-time PCRで用いたプライマーは以下のとおりである。
GAPDH forward primer : 5'-GCACCGTCAAGGCTGAGAAC-3' (配列番号5)
GAPDH reverse primer : 5'-TGGTGAAGACGCCAGTGGA-3' (配列番号6)
MEN beta forward primer : 5'-GATCTTTTCCACCCAAGAGTACATAA-3' (配列番号7)
MEN beta reverse primer : 5'-CTCACACAAACACAGATTCCACAAC-3' (配列番号8)
XIST forward primer : 5'-CTTGAAGACCTGGGGAAATCCC-3' (配列番号9)
XIST reverse primer : 5'-TGTCAATCTAAAGGTAACCGGC-3' (配列番号10)
【0033】
実験例4.転写阻害剤の効果の確認
HeLa細胞(2.5×105 cells/6cm dish)の培養液(DMEM)に、転写阻害剤Actinomycin D(ActD)(2μg/mL)の存在下または非存在下で、50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNA2μgを用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回
収したRNA中に含まれるMALAT-1、MEN beta及びLuciferaseを定量した。Luciferase で補正したMALAT-1とMEN betaのRNA量の経時変化を図5に示す。その結果、MALAT-1とMEN betaのいずれもActD添加時にはRNAの分解が抑制されており、転写阻害剤を加えることによりRNAの分解が低下していることがわかった。
【0034】
実験例5.RNaseノックダウン株における分解パターンの検証
HEK293T細胞、およびRNA分解に関与するPM/Scl-100がノックダウンされたHEK293T細胞(4×105 cells/10cm dish)(Molecular Cell 12, 675-687, 2003)の培養液(DMEM)に150μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、2μgのtotal RNAを用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるGAPDH、XIST及びLuciferaseを定量した。Luciferase で補正したGAPDHとXISTのRNA量の経時変化を図6に示す。PM/Scl-100がノックダウンされたHeLa細胞でのXISTのRNAの分解はノックダウンされていないHeLa細胞(control)における分解よりも少なかった。なお、GAPDHのRNA量は両細胞でほとんど変わらなかった。以上の結果より、本発明の方法による測定結果は生体内の分解因子による分解を正確に反映していることがわかった。
【産業上の利用可能性】
【0035】
本発明の方法は診断分野、検査分野、研究分野などにおいて使用できる。
【技術分野】
【0001】
本発明は修飾核酸を用いた細胞内RNA量の変化の測定方法に関する。
【背景技術】
【0002】
従来、培養細胞を用いてin vivoで合成される特定RNAの分解を調べるために、[3H]ウリジンを用いる方法が利用されてきた。この手法は高感度ではあるが、放射性同位体(RI)を使用するため、使用管理に制限が生じ、操作に危険及び煩雑さを伴うといった問題点がある。また、[3H]ウリジンを用いる方法ではプローブとハイブリダイゼーションさせた後にRIを検出するが、ハイブリダイゼーション法固有の問題点として類似RNA(ファミリー遺伝子由来RNA等)を区別して検出できない、すなわち配列特異性が低いという問題があった。
【0003】
また、転写反応阻害剤である5,6-Dichloro-1-β-D-ribofuranosylbenzimidazole(DRB)やActinomycin D等を用いる方法も利用されている。この手法は、転写反応阻害剤を細胞培養液に添加し、細胞内でのRNAの転写反応を阻害させた後、経時的に細胞を回収し、細胞からtotal RNAを抽出してNorthen Blot法やReal-time PCR法等を行うことで、特定の塩基配列を有するRNAの量の経時的変化を測定する方法である。この手法は現在広く用いられているが、細胞内の転写反応を阻害してしまうため細胞に負荷がかかり、それに付随した予期せぬ細胞への影響が懸念されている。実際に、ある種のRNAは阻害剤を用いた転写阻害により細胞内局在が変化して生理的分解を測定できないといった問題が生じている。また、転写阻害剤は細胞死を誘導するため、24時間以上のRNA分解測定が困難である。
【0004】
また、テトラサイクリン誘導性プロモーター直下流に測定対象RNA遺伝子をクローニングし、テトラサイクリン添加によって測定対象RNAの転写のみを停止させた後に経時的RNA分解をNorthen Blot法やReal-time PCR法等で測定する手法もある。この手法では、測定対象RNAをコードするcDNAをクローニングし、かつ構築したRNA発現用DNAを細胞へ遺伝子導入する必要がある。さらに、テトラサイクリン誘導のためのテトラサイクリンリプレッサータンパク質を発現する細胞をTet-off細胞として樹立することが必要である。そのため、煩雑であり、かつ、cDNAクローニングの技術的問題から長いRNAの分解を測定することが極めて困難である。また、細胞の種類によっては遺伝子導入が極めて困難な細胞があるため、手法の適用範囲が限定されるという問題点がある。
【0005】
ところで、5−ブロモデオキシウリジンや5−ブロモウリジンなどの修飾核酸は従来、細胞に取り込ませて細胞の増殖を評価したり、遺伝子の検出を行うために使用されてきたが(例えば、非特許文献1)、この様な天然には存在しないハロゲン化ウリジンを取り込んだRNAが細胞内で生理的な分解挙動を取るか不明であったため、細胞内RNAの量の変化を調べるために使用されたことはなかった。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Experimental Cell Research 234, 498-506 (1997)
【発明の概要】
【発明が解決しようとする課題】
【0007】
本発明の課題は上記従来技術の問題点を解消する点にあり、使用管理に制限が生じるRIを用いず、細胞に負荷のある転写反応阻害剤を用いず、in vivoで合成される特定の目的RNAの量の変化を測定するための手段を提供する点にある。
【課題を解決するための手段】
【0008】
発明者らは上記課題を解決すべく鋭意研究した結果、ブロモウリジン(BrU)などのハロゲン化ウリジンを用いることで、特定の塩基配列を有する目的RNAの量の経時変化を簡便、高感度かつ特異的に測定することができることを見出し、本発明を完成するに至った。
【0009】
すなわち、本発明は以下のとおりである。
[1]細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
[2]前記ハロゲン化ウリジンがブロモウリジンである、[1]に記載の方法。
[3]前記抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程を、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させた状態で行う、[1]または[2]に記載の方法。
[4]単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量の測定をRT-PCRにより行う、[1]〜[3]のいずれかに記載の方法。
[5]ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む細胞内RNA量の変動を測定するためのキット。
[6]さらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含む、[5]に記載のキット。
[7]さらに、RT-PCR用プライマーを含む、[5]または[6]に記載のキット。
【発明の効果】
【0010】
本発明では、ブロモウリジン(BrU)などのハロゲン化ウリジンを用いるため、RIを使用するときに問題となる使用管理に関する制限は特に生じない。また、転写反応阻害剤を用いる必要がないため、細胞への負荷を軽減することができ、予期せぬ細胞への影響を最小限に抑えてin vivoで合成されるRNAの生理的分解挙動を測定することができる。さらに、本発明では、測定対象RNAをコードするcDNAのクローニングを必要としないため、簡便であって、cDNAクローニングと遺伝子導入の技術的問題に起因する問題が生じない。また、長いRNAの量の変化も測定可能であり、長時間の変化も測定可能である。さらに、多数のRNAの量の変化を同時測定することも可能である。
【図面の簡単な説明】
【0011】
【図1】本発明の方法の一態様を示す模式図。
【図2】BrUで標識されたtotal RNAの量とそれに含まれる長いRNAであるMALAT-1 RNAの量との関係を示す値。(A)はBrU標識ルシフェラーゼ(Luc)RNAで補正しない場合であり、縦軸はMALAT-1 RNAのコピー数を示す。(B)はBrU標識ルシフェラーゼ(Luc)RNAで補正した場合であり、縦軸はルシフェラーゼRNAに対するMALAT-1 RNAの割合を示す。
【図3】本発明の方法によりMALAT-1のRNA量の経時変化を調べた結果を示す図。(A)はBrU標識ルシフェラーゼ(Luc)RNAで補正しない場合であり、(B)はBrU標識ルシフェラーゼ(Luc)RNAで補正した場合である。
【図4】本発明の方法によりGAPDH、MEN betaおよびXISTのRNA量(BrU標識ルシフェラーゼ(Luc)RNAで補正)の経時変化を調べた結果を示す図。
【図5】本発明の方法により、転写阻害剤Actinomycin D(ActD)の存在下または非存在下でのMALAT-1とMEN beta(MENb)のRNA量(BrU標識ルシフェラーゼRNAで補正)の経時変化を調べた結果を示す図。
【図6】本発明の方法により、HEK293T細胞とPM/Scl-100がノックダウンされたHEK293T細胞においてGAPDHとXISTのRNA量(BrU標識ルシフェラーゼRNAで補正)の経時変化を調べた結果を示す図。
【発明を実施するための形態】
【0012】
<本発明の方法>
本発明の方法は、
細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法である。
なお、「変化」とは「増加」および「減少」を含むが、RNAの分解に基づくRNA量の減少を測定する態様が好ましい。
【0013】
細胞の種類は特に制限されず、真核細胞であっても原核細胞であってもよいが真核細胞が好ましく、哺乳動物細胞がより好ましい。また、細胞は株化細胞であってもよいし、組織等から調製された初代培養細胞であってもよい。また、細胞を含む組織や器官等をそのまま培養してもよい。
【0014】
RNAの種類は細胞内に存在し、ハロゲン化ウリジンが取り込まれうるRNAであれば特に制限されないが、mRNA、ノンコーディングRNA、ウイルスゲノムRNAなどが挙げられ、mRNAやノンコーディングRNAが好ましく、これらの組み合わせでもよい。
量の変化を測定する対象の目的RNAとしては、特定の配列を有するRNAである。目的RNAは2種類以上であってもよい。
【0015】
ハロゲン化ウリジン(5−ハロゲン化ウリジンとも呼ばれる)としては、ブロモウリジンおよびヨードウリジンが例示される。これらは市販のものを使用することができる。
【0016】
細胞を培養するための培地は、細胞の種類に応じて適宜選択することができる。例えば、培養対象が哺乳動物細胞の場合、約5〜20%の胎仔ウシ血清を含んでもよい最小必須培地(MEM)、ダルベッコ改変イーグル培地(DMEM)、RPMI1640培地、199培地、F12培地などが例示される。
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンが取り込まれ、ハロゲン化ウリジンを含むRNAが合成される。
加えるハロゲン化ウリジンの濃度は10〜1000μMであることが好ましい。
ハロゲン化ウリジンを含む培地での培養時間はハロゲン化ウリジンがRNAに取り込まれるのに十分な時間であればよいが、1〜72時間が好ましい。
【0017】
ハロゲン化ウリジンを含む培地で培養した後、ハロゲン化ウリジンを含む培地を除去し、好ましくはPBSなどのバッファーあるいはハロゲン化ウリジンを含まない培地で洗浄を行った後、培地をハロゲン化ウリジンを含まない培地に交換して一定時間培養する。
ハロゲン化ウリジンを含まない培地の種類は特に制限されないが、ハロゲン化ウリジン
を含まないこと以外は上記ハロゲン化ウリジンを含む培地と同じでもよい。また、短時間の評価を行うときは、PBSなどのバッファーでもよい。
【0018】
ハロゲン化ウリジンを含まない培地での培養中に経時的に測定用細胞サンプルを採取する。
ハロゲン化ウリジンを含まない培地での培養時間および細胞サンプル採取のタイミングは実験系によって異なり全く任意であるが、例えば、ハロゲン化ウリジンを含まない培地で合計3時間培養し、その培養開始時、0.5時間後、1時間後、2時間後、3時間後のタイミングで細胞サンプルを採取するような態様が例示される。なお、24時間以上の長時間の測定も可能である。
【0019】
細胞サンプルの採取は、浮遊培養であれば、例えば、細胞を含む培養液の一部をその都度採取すればよい。
付着培養の場合は、例えば、同じ種類の細胞を、細胞数をそろえて、複数の培養皿または複数の培養ウェルにおいて、同条件で、ハロゲン化ウリジンを含む培地での培養、次いでハロゲン化ウリジンを含まない培地での培養を行い、経時的に、複数の培養皿または複数の培養ウェルの中から一つずつ細胞サンプルを回収する態様が例示される。
【0020】
細胞サンプルから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程については、細胞サンプルの抽出液から直接抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離してもよいが、細胞サンプルの抽出液からまず公知の手法によりtotal RNA、mRNAなどを分離し、その後、抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離することが好ましい。
なお、ここでいう単離とはハロゲン化ウリジンが取り込まれていないRNAが含まれない程度に分離されれば良く、ハロゲン化ウリジンが取り込まれたRNA以外は存在しない状態までは要求されない。
抗ハロゲン化ウリジン抗体はポリクローナル抗体でもモノクローナル抗体でもそれらの断片であってもよい。抗ハロゲン化ウリジン抗体は公知の手法で作成することができるが、市販の抗体を用いてもよい。
また、抗ハロゲン化ウリジン抗体はハロゲン化ウリジンを認識できる限り、抗ハロゲン化デオキシウリジン抗体でもよい。
【0021】
抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離するための方法としては、免疫沈降、抗体カラムを用いる方法などが例示されるが、ハロゲン化ウリジンが取り込まれたRNAが単離される限り、特に制限されない。
【0022】
抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジンが取り込まれたRNAを単離する際には、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させることが好ましい。内部標準ハロゲン化ウリジン含有RNAは配列が特定されたものであればどのような配列でもよいが、細胞に内在しない配列であることが好ましい。ルシフェラーゼなどが一般にはよく使用されるのでこれを用いてもよい。これにより、測定結果の定量性と精度が向上する。
【0023】
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定する工程は、目的RNAの配列に基づいたプライマーやプローブを使用したRT-PCR、ハイブリダイゼーションなどによって行うことができる。トランスクリプトーム解析によって複数の目的RNAの量を同時に測定してもよい。RT-PCRとしては、逆転写反応によりcDNAを合成した後、標識プローブを用いる定量リアルタイムPCRを行うことがより好ましい。
【0024】
ハロゲン化ウリジンを含まない培地での培養における各時点の細胞サンプル中のRNAの
量の測定結果を比較することで、RNA量の経時変化を調べることができる。
例えば、ハロゲン化ウリジンを含まない培地での培養開始時(0時間)の目的RNAの量に対して、培養開始から2時間後の目的RNAの量が80%であれば、20%が分解したと判断することができる。
【0025】
また、ハロゲン化ウリジンを含まない培地での培養開始時に化合物を添加し、RNA量の経時変化を調べることで、化合物のRNA分解活性あるいは分解阻害活性を評価することができ、これによりRNA分解剤あるいは分解阻害剤をスクリーニングすることができる。
【0026】
また、細胞に遺伝子を導入するか、あるいは遺伝子を不活性化させ、該細胞におけるRNAの分解速度を、同遺伝子が導入あるいは不活性化されない親細胞におけるRNAの分解速度と比較することにより、遺伝子がコードするタンパク質がRNA分解を制御する活性を有するかを調べることもできる。
【0027】
図1に基づいて、本発明の方法の手順の一例を具体的に示す。
まず、BrUを細胞培養液に添加し、細胞内で新たに転写されたRNAにBrUを取り込ませ、一定時間後に培養液を交換してBrUを取り除く(パルスラベル)。その後、経時的に細胞を回収し、細胞からtotal RNAを抽出して、BrU特異的抗体を用いてBrU標識されたRNAのみを回収し、逆転写反応後にリアルタイムPCRを行うことで、in vivoで合成された特定RNAの分解を測定することができる。
【0028】
<本発明のキット>
本発明のキットは、ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む、細胞内RNA量の変動を測定するためのキットである。好ましくは、本発明のキットはRNA分解測定用キットである。
本発明のキットはRT-PCR用のプライマーやハイブリダイゼーション用のプローブを含んでもよい。
本発明のキットはさらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含んでもよい。
本発明のキットはさらに、本発明の方法を実行するためのプロトコールを含んでもよい。
【実施例】
【0029】
以下、実施例を挙げて本発明をより具体的に説明するは、本発明は以下の実施例の態様に限定されるものではない。
【0030】
実験例1.定量性の検討
HeLa細胞(2×106 cells/10cm dish)の培養液(DMEM)に50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、RNAiso plus(TaKaRa)を用いて細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを0.5、1、2、4、7、10μg用いてBrU特異的抗体(anti-Bromodeoxyuridine 2B1; MBL)-Protein G Sepharose複合体(GE Healthcare)により免疫沈降を行った。1つの群ではそのまま免疫沈降を行ったが、他の群では、免疫沈降の際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNA(BrUTPとrNTP mixを基質として,Luc配列を有するプラスミドからT7 enzymeによりRNAを転写することで作製した)をtotal RNAにそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)により沈降物からRNAを回収し、逆転写反応、Real-time PCRにより、回収したRNA中に含まれるMALAT-1(Oncogene 22(39), 8031-8041)及びLuciferaseを定量した。結果を図2に示す。その結果、添加したtotal RNA量とMALAT-1の値に直線関係が得られ、Luciferaseの値で補正した場合はよりばらつきが少なくなることがわかった。
なお、Real-time PCRで用いたプライマーは以下のとおりである。
MALAT-1 forward primer : 5'-GCTGTGGAGTTCTTAAATATCAACC-3'(配列番号1)
MALAT-1 reverse primer : 5'-TTCTCAATCCTGAAATCCCCTA-3' (配列番号2)
Luc forward primer : 5'-TATGTGGCCAGCCAGGTTAC-3' (配列番号3)
Luc reverse primer : 5'-GTCCACGAACACAACACCAC-3' (配列番号4)
【0031】
実験例2.MALAT-1 RNAの分解パターンの測定
HeLa細胞(5×105 cells/10cm dish)の培養液(DMEM)に50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12、24時間後にRNAiso plus(TaKaRa)を用いて細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを2μg用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。1つの群ではそのまま免疫沈降を行ったが、他の群では、免疫沈降の際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるMALAT-1及びLuciferaseを定量した。結果を図3に示す。その結果、MALAT-1の分解の様子をモニタリングすることが可能であった。また、免疫沈降用内部標準化コントロールを加えた群では定量性の向上が見られた。
【0032】
実験例3.他の核局在型ノンコーディングRNAの分解パターンの測定
HeLa細胞(2.5×105 cells/6cm dish)もしくはHEK293T(4×105 cells/10cm dish)の培養液(DMEM)に150μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNAを2μg用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるGAPDH(glyceraldehyde-3-phosphate dehydrogenase)、MEN beta(Proc Natl Acad Sci USA, 2009, 106, 2525-2530)、XIST(Cold Spring Harb Symp Quant Biol., 2005, 69, 89-102)及びLuciferaseを定量した。Luciferase で補正したGAPDH、MEN beta、XISTのRNA量の経時変化を図4に示す。この結果より、GAPDH、MEN beta、XISTの各RNAの分解の様子をモニタリングすることが可能であった(図4)。
なお、Real-time PCRで用いたプライマーは以下のとおりである。
GAPDH forward primer : 5'-GCACCGTCAAGGCTGAGAAC-3' (配列番号5)
GAPDH reverse primer : 5'-TGGTGAAGACGCCAGTGGA-3' (配列番号6)
MEN beta forward primer : 5'-GATCTTTTCCACCCAAGAGTACATAA-3' (配列番号7)
MEN beta reverse primer : 5'-CTCACACAAACACAGATTCCACAAC-3' (配列番号8)
XIST forward primer : 5'-CTTGAAGACCTGGGGAAATCCC-3' (配列番号9)
XIST reverse primer : 5'-TGTCAATCTAAAGGTAACCGGC-3' (配列番号10)
【0033】
実験例4.転写阻害剤の効果の確認
HeLa細胞(2.5×105 cells/6cm dish)の培養液(DMEM)に、転写阻害剤Actinomycin D(ActD)(2μg/mL)の存在下または非存在下で、50μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、得られたtotal RNA2μgを用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回
収したRNA中に含まれるMALAT-1、MEN beta及びLuciferaseを定量した。Luciferase で補正したMALAT-1とMEN betaのRNA量の経時変化を図5に示す。その結果、MALAT-1とMEN betaのいずれもActD添加時にはRNAの分解が抑制されており、転写阻害剤を加えることによりRNAの分解が低下していることがわかった。
【0034】
実験例5.RNaseノックダウン株における分解パターンの検証
HEK293T細胞、およびRNA分解に関与するPM/Scl-100がノックダウンされたHEK293T細胞(4×105 cells/10cm dish)(Molecular Cell 12, 675-687, 2003)の培養液(DMEM)に150μMのBrUを添加し、37℃、5%CO2条件下で24時間インキュベートした後、BrU不含培地へ培地交換後、0、6、12時間後にChomczynski and Sacchiらの方法(Anal Biochem., 1987, 162, 156-159)に従い細胞回収及びtotal RNA抽出を行った。次に、2μgのtotal RNAを用いてBrU特異的抗体-Protein G Sepharose複合体により免疫沈降を行った。その際、免疫沈降用内部標準化コントロールとして、前もってBrU標識しておいたLuciferase RNAをそれぞれ0.8ng添加した。その後、ISOGEN LS(NIPPON GENE)によりRNAを回収し、逆転写反応及びReal-time PCRにより、回収したRNA中に含まれるGAPDH、XIST及びLuciferaseを定量した。Luciferase で補正したGAPDHとXISTのRNA量の経時変化を図6に示す。PM/Scl-100がノックダウンされたHeLa細胞でのXISTのRNAの分解はノックダウンされていないHeLa細胞(control)における分解よりも少なかった。なお、GAPDHのRNA量は両細胞でほとんど変わらなかった。以上の結果より、本発明の方法による測定結果は生体内の分解因子による分解を正確に反映していることがわかった。
【産業上の利用可能性】
【0035】
本発明の方法は診断分野、検査分野、研究分野などにおいて使用できる。
【特許請求の範囲】
【請求項1】
細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
【請求項2】
前記ハロゲン化ウリジンがブロモウリジンである、請求項1に記載の方法。
【請求項3】
前記抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程を、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させた状態で行う、請求項1または2に記載の方法。
【請求項4】
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量の測定をRT-PCRにより行う、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む細胞内RNA量の変動を測定するためのキット。
【請求項6】
さらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含む、請求項5に記載のキット。
【請求項7】
さらに、RT-PCR用プライマーを含む、請求項5または6に記載のキット。
【請求項1】
細胞内の目的RNAの量の変化を測定する方法であって、
ハロゲン化ウリジンを含む培地で細胞を培養することにより細胞にハロゲン化ウリジンを取り込ませてハロゲン化ウリジン含有RNAを合成させる工程、
ハロゲン化ウリジンを含む培地を除去した後、細胞をハロゲン化ウリジンを含まない培地で一定時間培養し、その培養中に経時的に細胞サンプルを取得する工程、
得られた複数の細胞サンプルのそれぞれから抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程、および
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量を測定し、該測定値を比較する工程、を含む方法。
【請求項2】
前記ハロゲン化ウリジンがブロモウリジンである、請求項1に記載の方法。
【請求項3】
前記抗ハロゲン化ウリジン抗体を用いてハロゲン化ウリジン含有RNAを単離する工程を、特定の配列のハロゲン化ウリジン含有RNAを内部標準として一定量存在させた状態で行う、請求項1または2に記載の方法。
【請求項4】
単離された各ハロゲン化ウリジン含有RNA中の目的RNAの量の測定をRT-PCRにより行う、請求項1〜3のいずれか一項に記載の方法。
【請求項5】
ハロゲン化ウリジンおよび抗ハロゲン化ウリジン抗体を含む細胞内RNA量の変動を測定するためのキット。
【請求項6】
さらに、内部標準としての特定の配列のハロゲン化ウリジン含有RNAを含む、請求項5に記載のキット。
【請求項7】
さらに、RT-PCR用プライマーを含む、請求項5または6に記載のキット。
【図2】


【図3】


【図1】


【図4】


【図5】


【図6】




【図3】


【図1】


【図4】


【図5】


【図6】


【公開番号】特開2012−10667(P2012−10667A)
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願番号】特願2010−152640(P2010−152640)
【出願日】平成22年7月5日(2010.7.5)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
【公開日】平成24年1月19日(2012.1.19)
【国際特許分類】
【出願日】平成22年7月5日(2010.7.5)
【出願人】(504137912)国立大学法人 東京大学 (1,942)
【Fターム(参考)】
[ Back to top ]

