個体において骨質量を増加させるために有用である化合物を同定するためにGPR119受容体を用いる方法
【課題】個体において骨形成を促進させること。
【解決手段】本発明は、GPR119受容体を用いて、個体において骨質量を増加させるために有用な化合物を同定する方法に関する。GPR119受容体のアゴニストは、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療するためまたは予防するための、および個体において骨質量を増加させるための治療剤として有用である。GPR119受容体のアゴニストは、個体において骨形成を促進する。ある実施形態において、上記個体はヒトである。
【解決手段】本発明は、GPR119受容体を用いて、個体において骨質量を増加させるために有用な化合物を同定する方法に関する。GPR119受容体のアゴニストは、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療するためまたは予防するための、および個体において骨質量を増加させるための治療剤として有用である。GPR119受容体のアゴニストは、個体において骨形成を促進する。ある実施形態において、上記個体はヒトである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、GPR119受容体を用いて個体において骨質量を増加させるのに有用な化合物を同定する方法に関する。GPR119受容体のアゴニストは、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防するための、および個体において骨質量を増加させるための治療剤として有用である。GPR119受容体のアゴニストは、個体において骨形成を促進する。
【背景技術】
【0002】
以下の議論は、本発明の理解を容易とさせることを意図するが、本発明に対する先行技術であることを認めることを意図しない。
A.骨粗鬆症
骨粗鬆症は骨質量の喪失および骨格構造のミクロ造型的劣化によって特徴付けられる廃疾病であり、危うい骨強度に導き、このことは患者を脆性骨折の増大した危険性に対して素因があるようにする。欧州、日本および合衆国において骨粗鬆症は7500万人を超える人々が罹っており、欧州および合衆国単独において230万を超える骨折を引き起こす。合衆国において、骨粗鬆症は、全ての閉経後白人の婦人の少なくとも25%が罹っており、該割合は80歳を超える婦人で70%まで上昇する。50歳を超える3人の婦人のうち一人は骨粗鬆症的骨折を有し、これは社会に対してかなりの社会的かつ経済的負担を引き起こす。該疾患は婦人に限定されず;老齢の男性も罹り得る。2050年までには、男性における臀部骨折の世界的な発生率は310%まで増加すると試算されており、女性においては240%まで増加すると試算されている。臀部、前腕、および脊椎骨折の臨床的に示される人生における危険性は合計40%程度であり、心血管病に対する危険性と匹敵する。従って、骨粗鬆症の特徴は実質的な死亡率、有病率、および経済的コストを引き起こす。老齢の集団では、骨粗鬆症骨折の数およびそのコストは、効果的な予防戦略が開発されるのでなければ、次の50年で少なくとも2倍となるであろう(例えば、非特許文献1;非特許文献2;および非特許文献3参照)。
B.グルコース−依存性インスリン向性ポリペプチド(GIP)
グルコース−依存性インスリン向性ポリペプチド(胃阻害性ポリペプチドとしても知られたGIP)は、食事摂取後に十二指腸内分泌K細胞から放出される42アミノ酸のペプチドインクレチンホルモンである。放出されるGIPの量は消費されるグルコースの量に大いに依存する。GIPは、膵臓ベータ細胞においてグルコース−依存性インスリン分泌を刺激することが示されている。GIPは特異的Gプロテイン−結合受容体、すなわち、GIPRを介してその作用を媒介する。
【0003】
GIPは2位においてアラニンを含有するため、GIPの分解を調節する酵素であるジペプチジルペプチダーゼ−4(DPP−IV)に対する優れた基質である。全長GIP(1−42)は腸K細胞からの分泌から数分以内に迅速に生物不活性GIP(3−42)に変換される。DPP−IVの阻害は、GIP生物活性を増加させることが示されている(例えば、非特許文献4;非特許文献5;非特許文献6;および非特許文献7参照)。例えば、血液中の全長生物活性GIPの分析は、N−末端−特異的アッセイを用いて行うことができる(例えば、非特許文献8参照)。
【0004】
最近、GIPは骨形成を促進することが示されている。GIPは骨芽細胞受容体を活性化し、その結果、共に骨形成に関連する、コラーゲンI型合成およびアルカリ性ホスファターゼ活性の増加をもたらす。GIPはイン・ビトロにて破骨細胞の活性および分化を阻害することが示されている。GIPの投与は卵巣摘出による骨喪失を妨げることが示されている。GIP受容体(GIPR)ノックアウトマウスは減少した骨のサイズ、より低い骨質量、変化した骨ミクロ造型(microarchitecture)および生化学的特性、および骨代謝回転についてのパラメーターの変化を、特に骨形成において示す(例えば、非特許文献9;非特許文献10;非特許文献11;非特許文献12;および非特許文献13参照)。
【0005】
骨の密度または形成を維持し、または増大させるためのGIPの有用性は、GIPペプチドの投与による低下した骨ミネラル化の治療のための、特許文献1の発行によって合衆国特許商標局によって認められている。しかしながら、現在のGIPペプチドアゴニストは経口生物学的利用性の欠如に悩んでおり、患者のコンプライアンスに負の影響を与える。魅力的な代替アプローチは、GIP活性の内因性レベルを増加させるための経口的に活性な組成物を開発することである。
C.GPR119
GPR119はGプロテイン−結合受容体である(GPR119:例えば、ヒトGPR119、GenBank(登録商標)アクセション No.AAP72125およびその対立遺伝子:例えば、マウスGPR119、GenBank(登録商標)アクセション No.AY288423およびその対立遺伝子)。アゴニストによるようなGPR119活性化は細胞内cAMPのレベルの上昇に至り、Gsに結合しているGPR119に合致する。特許文献においては、GPR119はRUP3と言われてきた(例えば、特許文献2);GPR119はグルコース−依存性インスリン向性受容体(GDIR)とも言われてきた。
D.Gプロテイン−結合受容体
多数の受容体クラスがヒトに存在するが、これまでに、最も豊富であって治療的に重要なのはGプロテイン−結合受容体(GPCR)クラスによって示される。ヒトゲノム内には30,000〜40,000ほどの遺伝子があると見積もられており、これらの内、ほぼ2%はGPCRをコードすると見積もられている。
【0006】
GPCRは医薬製品の開発のための重要な領域を代表する。GPCRにおいて活性な薬物は、疼痛、認識障害、高血圧、ペプシン潰瘍、鼻炎、および喘息のように多用なヒト疾患の広域スペクトルにわたって治療的効果を有する。ほぼ500の臨床的に市販されている薬物の内、30%を超えるものがGPCR機能のモジュレーターである。これらの薬物はほぼ30のよく性質決定されているGPCRにおいてその活性を発揮する(例えば、非特許文献14参照)。
【0007】
GPCRは、その各々が膜を貫く7つのアルファヘリックスを形成する22〜24の間の疎水性アミノ酸の7つの配列を有する共通の構造的モチーフを保有する(各スパンは数字によって確認される、すなわち、膜貫通−1(TM−1)、膜貫通−2(TM−2)等)。膜貫通ヘリックスは、細胞膜の外部または「細胞外」側の膜貫通−2および膜貫通−3、膜貫通−4および膜貫通−5、および膜貫通−6および膜貫通−7の間のアミノ酸の鎖によって連結される(これらを、各々、「細胞外」領域1、2および3(EC−1、EC−2およびEC−3)という)。膜貫通ヘリックスは、細胞膜の内部または「細胞内」側の膜貫通−1および膜貫通−2、膜貫通−3および膜貫通−4、および膜貫通−5および膜貫通−6の間のアミノ酸の鎖によってやはり連結されている(これらを、各々、「細胞内」領域1、2および3(IC−1、IC−2およびIC−3)という)。受容体の「カルボキシ」(「C」)末端は細胞内の細胞内空間に存在し、受容体の「アミノ」(「N」)末端は細胞の外側の細胞外空間に存在する。
【0008】
一般に、リガンドは受容体と結合する場合(しばしば、受容体の「活性化」という)、細胞内領域および細胞内「Gプロテイン」の間の結合を容易とする受容体の立体配座の変化がある。GPCRはGプロテインに対して「無差別的(promiscuous)」であり、すなわち、GPCRは1を超えるGプロテインと相互作用できると報告されている(非特許文献15参照)。他のGプロテインが存在するが、現在、Gq、Gs、Gi、GzおよびGoが同定されているGプロテインである。リガンド−活性化GPCRとG−プロテインとの結合はシグナルカスケードプロセス(「シグナル変換」という)を開始させる。通常の条件下では、シグナル変換は、最終的には、細胞活性化または細胞阻害をもたらす。理論に拘束されるつもりはないが、受容体のIC−3ループならびにカルボキシ末端はGプロテインと相互作用すると考えられている。
【0009】
また、G15またはG16のような、GPCRの数個のクラスをホスホリパーゼC経路に結合させるように見える無差別的なGプロテイン(非特許文献16)、または非常に多数のGPCRを同じ経路(例えば、ホスホリパーゼC経路)に結合させるように設計されたキメラGプロテイン(非特許文献17)がある。
【0010】
生理学的な条件下では、GPCRは二つの異なる立体配座:「不活性な」状態および「活性な」状態の間が平衡して細胞膜に存在する。不活性な状態の受容体は細胞内シグナリング変換経路に結合して、生物学的応答に導くシグナル変換を開始することができない。受容体の立体配座を活性な状態に変化させることは、(G−プロテインを介する)変換経路への連結を可能とし、生物学的応答を生じる。
【0011】
受容体はリガンド、または薬物のような化合物によって活性な状態に安定化させることができる。受容体のアミノ酸配列に対する改変を含むが、それに限定されない最近の発見は、活性な状態の立体配座において受容体を促進し、および安定化するためのリガンドまたは薬物以外の手段を提供する。これらの手段は、受容体へのリガンド結合の効果を刺激することによって活性な状態に受容体を効果的に安定化させる。そのようなリガンド−非依存性手段による安定化は「構成的受容体活性化」といわれる。
【図面の簡単な説明】
【0226】
本発明をここで添付する図面との関係で説明する。
【図1A】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。A.GPR119アゴニストとしての化合物1を用いて行うタイムコース分析。
【図1B】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。B.GPR119アゴニストとしての化合物3を用いて行われるタイムコース分析。
【図1C】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。C.GPR119アゴニストとしての化合物3を用いて行われる用量力価決定分析。
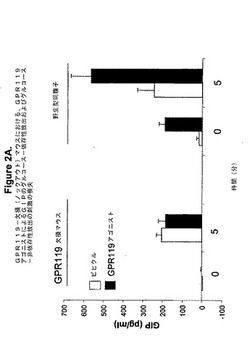
【図2A】図2は、野生型マウスと比較した、GPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果を示す。A.GPR119アゴニストとしての化合物1を用いて比較を行った。
【図2B】図2は、野生型マウスと比較した、GPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果を示す。B.比較は、GPR119アゴニストとしての化合物2を用いて比較を行った。
【発明を実施するための最良の形態】
【0227】
(発明の詳細な説明)
本発明は、GPR119受容体を用いて、個体において骨質量を増加させるのに有用な化合物を同定する方法をその要旨とする。GPR119受容体のアゴニストは、骨粗しょう症のような低骨質量によって特徴付けられる状態を治療または予防するための、および個体において骨質量を増加させるための治療剤として有用である。本発明は、少なくとも部分的には、経口投与によるなどの、GPR119アゴニストの個体への投与は、GPR119受容体において作用して、個体においてGIPレベルを増加させることができるという出願による驚くべき発見に基づく。
【0228】
本明細書中で用いるように、用語「リガンド」は、GPR119のような、ポリペプチドに特異的に結合する分子(例えば、テスト化合物)を意味するべきである。リガンドは、例えば、ポリペプチド、脂質、小分子、抗体であってよい。化合物1はGPR119受容体ポリペプチドの例示的なリガンドである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン(表A参照)は、GPR119受容体ポリペプチドの例示的なリガンドである。化合物2は、GPR119受容体ポリペプチドの例示的なリガンドである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3はGPR119受容体ポリペプチドの例示的なリガンドである。化合物3は、国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。内因性リガンドは、GPR119のような天然ポリペプチドに対する内因性天然リガンドであるリガンドである。リガンドは「アンタゴニスト」、「アゴニスト」、「部分的アゴニスト」または「逆アゴニスト」などであってよい。
表A.
【0229】
【化1】

本明細書中で用いるように、用語「アゴニスト」は、GPCRへの結合によって、GPCRによって媒介される細胞内応答を誘導するようにGPCRを活性化する剤(例えば、リガンド、テスト化合物)を意味するべきである。
【0230】
用語「部分的アゴニスト」は、本明細書中で用いるように、GPCRへの結合によって、全アゴニストよりも程度は低いが、GPCRによって媒介される細胞内応答を誘導するようにGPCRを活性化する剤(例えば、リガンド、テスト化合物)を意味すべきである。
【0231】
用語「アンタゴニスト」は、アゴニストまたは部分的アゴニストと同一の部位の辺りにてGPCRに結合し、好ましくは競合的に結合するが、GPCRの活性な形態によって開始される細胞内応答を活性化せず、それにより、アゴニストまたは部分的アゴニストによって細胞内応答を阻害することができる剤(例えば、リガンド、テスト化合物)を意味すべきである。アンタゴニストは、典型的には、アゴニストまたは部分アゴニストの非存在下でベースライン細胞内応答を減少させない。
【0232】
用語「逆アゴニスト(inverse agonist)」は、GPCRに結合し、かつアゴニストまたは部分的アゴニストの非存在下で観察される正常な基礎レベル活性未満の受容体の活性形態によって開始されるベースライン細胞内応答を阻害する剤(例えば、リガンド、テスト化合物)を意味すべきである。
【0233】
本明細書中で用いるように、用語「GPR119アゴニスト」とは、GPR119受容体に結合し、アゴニストとして作用する化合物をいう。化合物1は例示的なGPR119アゴニストである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンは例示的なGPR119アゴニストである。化合物2は例示的なGPR119アゴニストである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3は例示的なGPR119アゴニストである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
【0234】
本明細書中で用いるように、用語「選択的GPR119アゴニスト」とは、コルチコトロピン−放出因子−1(CRF−1)受容体のような1以上の関連受容体に対する選択性を超えるGPR119受容体に対する選択性を有するGPR119アゴニストをいう。化合物1は例示的な選択的GPR119アゴニストである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンは例示的な選択的GPR119アゴニストである。化合物2は例示的な選択的GPR119アゴニストである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3は例示的な選択的GPR119アゴニストである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
【0235】
用語「GIP分泌促進薬」は、細胞、例えば、腸内分泌細胞においてGIPの分泌を促進する、または脊椎動物または哺乳動物のような個体への投与に際して、全GIPのレベル、例えば、血中または血漿中全GIPのレベルを増加させる剤(例えば、リガンド、テスト化合物)を意味すべきである。ある実施形態において、GIP分泌促進薬は、個体において、全GIPのレベル、例えば、血中または血漿中全GIPのレベルを増加させるのに適当な化合物である。
【0236】
本明細書中で用いるように、用語「個体」とは、限定されるものではないが、(商業的に養殖された魚類、ペット魚類等のような)魚類、(カエル、ヒキガエル、ペット両生類等のような)両生類、(ヘビ、トカゲ、カメ、ペット爬虫類等のような)爬虫類、(ニワトリ、シチメンチョウ、ペット鳥類等のような)鳥類、および(マウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト霊長類、非−ヒト哺乳動物、ペット非−ヒト哺乳動物、ヒト等のような)哺乳動物を含めた脊椎動物をいう。ある実施形態において、個体は魚類である。ある実施形態において、個体は両生類である。ある実施形態において、個体は爬虫類である。ある実施形態において、個体は鳥類である。ある実施形態において、個体はシチメンチョウである。過去25年以上にわたって、より大きな胸筋肉質量を持つシチメンチョウに対する商業的な選択圧がかけられ、骨格一体性に対する要求を増大させた。しかしながら、増大した胸筋肉質量は、骨格の補償的変化によって達成されており、シチメンチョウ産業が脚問題の増加を経験するという結果を招いた。若い成体雄シチメンチョウにおける長骨の骨折が報告されている(例えば、Crespo et al,Poult Sci(2000)79:602−608参照)。ある実施形態において、個体は哺乳動物である。ある実施形態において、個体はマウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト霊長類または非−ヒトである(これは個々に、あるいはいずれかの組合せにて本発明の実施形態に含むことができる)。ある実施形態において、個体はウマである。競馬、馬術および他の競争イベントのような活動に関与するウマであるパフォーマンスウマは骨折に罹りやすい。ある実施形態において、個体はイヌまたはネコである。ある実施形態において、個体は(イヌ、ネコ等のような)ヒト愛玩動物、(ウシ、ヒツジ、ヤギ、ブタ、ニワトリ等のような)農場動物、(ウマ、イヌ等のような)スポーツ動物、(ラバ、ラクダ等のような)荷役用動物、または(動物園で見出される動物等のような)外国産動物であり、これは個々に、またはいずれかの組合せにて本発明の実施形態に含むことができる。ある実施形態において、個体は非−ヒト哺乳動物である。ある実施形態において、個体は(アカゲザル、チンパンジー等のような)非−ヒト霊長類である。ある実施形態において、個体はヒトである。
【0237】
本明細書中で用いるように、用語「予防または治療を必要とする」とは、個体が処置を必要とする、または処置から利益を受けるであろうという看護人(例えば、ヒトの場合には、医師、看護師、看護実行者;非−ヒト脊椎動物、および特別な実施形態において、非−ヒト哺乳動物の場合には獣医)によってなされる判断をここではいう。
【0238】
本明細書中で用いるように、用語「治療有効量」または「治療有効用量」とは、研究者、獣医、医療医師または他の臨床家によって求められている、組織、系、動物、個体またはヒトにおいて生物学的または医学的応答を誘導する活性な化合物または医薬剤の量をいい、該応答は以下のうちの1以上を含む:
(1)疾患の予防;例えば、疾患、状態または障害に対して素因があるが、疾患の病理学または兆候学を未だ経験したことがなく、または示したことがない個体における疾患、状態または障害の予防、
(2)疾患の阻害;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の阻害(すなわち、病理学および/または兆候学のさらなる発生の阻止)、および
(3)疾患の緩和;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の緩和(すなわち、病理学および/または兆候学の逆行)。
【0239】
本明細書中で用いるように、用語「治療効果」とは、研究者、獣医、医療医師または他の臨床家によって求められている組織、系、動物、個体またはヒトにおける生物学的または医学的応答の誘導をいい、それは以下のうちの1以上を含む:
(1)疾患の予防;例えば、疾患、状態または障害に対して素因があるが、疾患の病理学または兆候学を未だ経験していない、または示していない固体における疾患、状態または障害の予防、
(2)疾患の阻害;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の阻害(すなわち、病理学および/または兆候学のさらなる発生の阻止)、および
(3)疾患の緩和;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における、疾患、状態または障害の緩和(すなわち、病理学および/または、兆候学の逆行)。
【0240】
用語「予防するのに有効な量」とは、予防することが求められている生物学的または医学的事象の発生の危険性を予防し、または低下させる薬物の量をいう。多くの場合、予防するのに有効な量は治療有効量と同一である。
【0241】
用語「組成物」は、少なくとも1つの成分を含む物質を意味すべきである。
【0242】
用語「有効成分」は、疾患の診断、治癒、軽減、治療または予防において薬理学的活性または他の直接的効果を供するいずれの成分も意味すべきである。
【0243】
用語「医薬組成物」は、少なくとも1つの有効成分を含む組成物を意味し、それにより、該組成物は哺乳動物における調査および処置に使用することができる。
【0244】
「医学上許容できる」とは、担体、ビヒクル、希釈剤、賦形剤および/または塩が処方の他の成分と適合し、その受容者に有害でないことを意味する。
【0245】
用語「投与形態」は、錠剤、カプセル、または注射剤のような、薬物が生産され、分注される物理的形態を意味すべきである。
【0246】
「骨」とは、密な有機マトリックスおよび無機のミネラル成分を含む、ほとんどの脊椎動物の骨格の主な部分を形成する密な、半−剛性の、多孔性の石灰化された結合組織を意図する。骨は、脊椎動物の骨格を作り上げる多数の解剖学的に区別される構造のいずれかである。
【0247】
用語「骨質量」および「骨ミネラル密度(BMD)」は、本明細書中においては相互交換的に使用される。ヒトにおけるBMDは、通常、標準的なX線写真撮影技術、デュアルエネルギーX−線吸収測定(DXA)によって決定される。BMDにアクセスするために開発された多くの技術のうち、DXAは最も高度に技術的に開発され、かつ最も徹底的に生物学的に確証されている。適切に適合されたソフトウェアと共にDXA技術を用いて、動物実験において信頼性よくBMDを評価することもできる。DXAは骨粗鬆症の診断、予後(骨折予測)、障害の天然履歴のモニタリング、および治療に対する応答の評価で用いられる。
【0248】
本明細書中で用いるように、用語「低骨質量」は、個体における骨ミネラル密度(BMD)のいずれの減少または低下もいい、世界保健機構(WHO)による提案で定義されたように骨粗鬆症および骨減少症を共に含む。WHOは、若い成人参照平均の1標準偏差内のBMDの値として正常を定義している(T−スコア≧−1)。WHOは、若い成人平均から1標準偏差未満を超えるが、この値から2.5標準偏差未満未満であるBMDの値として骨減少症を定義している(T−スコア<−1および>−2.5)。WHOは、骨減少症のよりひどい形態として骨粗鬆症を特徴付けており、それを、若い成人の平均から2.5標準偏差以上低いBMDの値によってそれを定義している(T−スコア≦−2.5)(例えば、その開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Managemant of Osteoporosis参照)。より通常には、骨減少症は−1未満かつ−2を超えるT−スコアとして定義されており、骨粗鬆症は−2未満またはそれと同等なT−スコアとして定義されている。本発明のある実施形態において、T−スコアはDXAにて臀部で決定される。
【0249】
本明細書中で用いるように、用語「骨粗鬆症」は若い成人参照平均から2標準偏差以上低いBMD2の値によって定義され(T−スコア≦−2)、あるいは看護人(例えば、ヒトの場合には医師、看護師、看護実行者;非−ヒト脊椎動物の場合には獣医)によってなされた診断をいう。
【0250】
骨粗鬆症は一次または二次いずれかとして分類することができる(例えば、World
Health Organization Technical Report Series 921(2003),Prevention and Managemant
of Osteoporosis参照)。本明細書中で用いるように、用語「骨粗鬆症」は一次骨粗鬆症および二次骨粗鬆症を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。
【0251】
本明細書中で用いるように、「一次骨粗鬆症」は閉経(天然、未熟または外科的)、老化または双方に伴う。本発明においては、閉経(天然、未成熟または外科的)に関連する一次骨粗鬆症、老化に関連する一次骨粗鬆症、および閉経および老化に関連する一次骨粗鬆症は個々にまたはいずれかの組合せにて実施形態に含めることができる。
【0252】
本明細書中で用いるように、「二次骨粗鬆症」とは、閉経または老化に関連しないが、むしろ、医学的状態に、または投薬または薬物の使用に関連する骨粗鬆症をいう。骨粗鬆症の増大した危険性は、限定されるものではないが、内分泌および代謝障害、および悪性状態を含めた医学的状態の宿主に、およびある投薬および薬物(その例は当業者によく知られている)の使用に関連する(例えば、その開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Managemant of Osteoporosis;Williams Textbook of Endocrinology,10th Edition;参照)。二次骨粗鬆症は固定化にも関連し得る。医学的状態、投薬または薬物の使用に、または固定化に対して二次的である骨粗鬆症の診断は看護人(例えば、ヒトの場合には医師、看護師、看護実行者;非−ヒト脊椎動物の場合における獣医)によってなされ得る。
【0253】
「骨折」とは、骨の完全なまたは不完全な破断、または破壊またはひび割れを意図する。骨折の診断は、通常、臨床的調査および放射線学的知見に依存する。本発明においては、骨折は、限定されるものではないが、外傷骨折、長期骨折、および病理学的骨折を含む。
【0254】
本明細書中で用いるように、「外傷骨折」とは、骨の天然弾性を超える局所的損傷の程度を伴う閾値上外傷を含む即座の骨折をいうべきである。それには、柔軟組織および、非常にしばしば、皮膚に対する同時負傷を伴い得る。外傷骨折は閉鎖的であり得る(隣接する柔軟組織は負傷し得るが、被覆する柔軟部分はかなり維持される)。外傷骨折は開放的であり得る(骨の破断した端部は広範な柔軟組織負傷によって遊離され、従って、外側からの病原体が直接的に創傷に進入し得る)。
【0255】
本明細書中で用いるように、「長期骨折」とは、慢性骨折、疲労骨折、ストレス骨折または自然発生骨折型Iをいうべきである。
【0256】
本明細書中で用いるように、「病原性骨折」とは、自然発生骨折II型をいうべきである。病理学的骨折は、それを占める適切な外傷なくして、自然発生的に生起する。該骨は前進病(例えば、骨粗鬆症、骨ジストロフィー、またはパジェット変形性骨炎)によって、または局所的骨疾患病巣(例えば、転移、放射線骨壊死、または骨腫瘍)によって、従前に損傷されている。Adler,Claus−Peter,BONE DISEASES,p.114(Springer−Verlag,Germany 2000)参照。
【0257】
骨折は、限定されるものではないが、斜めトーション(oblique torsion)骨折、横方向骨折、細分化骨折、圧縮骨折、肋骨骨折、クリーピング骨折、および骨折した大腿頸部も含む(Adler,Claus−Peter,BONE DISEASES,Springer−Verlag,Germany 2000))。
【0258】
本明細書中で用いるように、用語「低骨質量によって特徴付けられる状態」は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出骨喪失、子供時代の原発性骨喪失、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。ある実施形態において、二次骨粗鬆症は医学的状態に関連する。ある実施形態において、二次骨粗鬆症は投薬または薬物の使用に関連する。ある実施形態において、二次骨粗鬆症は固定化に関連する。低骨質量によって特徴付けられる状態は、限定されるものではないが、パジェット病、転移性癌による骨喪失、および新形成病、放射線療法または化学療法によって引き起こされるもののような骨溶解病巣も含む。低骨質量によって特徴付けられる状態は、限定されるものではないが、脊髄の湾曲、高さの喪失、および補綴外科的処置のような骨粗鬆症の長期合併症を含む。本発明においては、低骨質量によって特徴付けられる状態は、個々に、またはいずれかの組合せにて実施形態に含めることができる(例えば、その各々の開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Management of Osteoporosis;Williams Textbook of Endocrinology,10th Edition,Larsen et al,Eds.(2002),W.B.Saunders Company;およびEndocrinology and Metabolism,4th Edition,Felig et al,Eds.(2001),McGraw−Hill Book
Company参照)。
【0259】
本明細書中で用いるように、「骨疾患」とは、骨の異常に関連する障害または状態をいう。骨質量または骨成長を増加させることによって、本発明に従って治療することができる骨疾患は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周病、歯槽骨喪失、骨摘出骨喪失、子供時代の原発性骨喪失、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。ある実施形態において、二次骨粗鬆症は医学的状態に関連する。ある実施形態において、二次骨粗鬆症は投薬または薬物の使用に関連する。ある実施形態において、二次骨粗鬆症は固定化に関連する。骨質量または骨成長を増加させることによって、本発明に従って治療することができる骨疾患は、限定されるものではないが、パジェット病および転移性癌による骨喪失も含む。骨質量または成長を増加させることによって、本発明に従って治療することができる破壊的骨障害は、限定されるものではないが、骨粗鬆症、変形性関節症、および新形成病、放射線療法もしくは化学療法によって引き起こされるもののような骨溶解病巣を含む。本発明において、骨の質量または成長を増加させることによって、本発明に従って治療することができる骨疾患は、個々に、またはいずれかの組合せにて実施形態に含めることができることは理解されるべきである。(例えば、その各々の開示をここで引用してその全体を援用するWorld Health Organization Technical Report
Series 921(2003),Prevention and Management of Osteoporosis;Williams Textbook of
Endocrinology,10th Edition,Larsen et al,Eds.(2002),W.B.Saunders Company;およびEndocrinology and Metabolism,4th Edition,Felig et al,Eds.(2001),McGraw−Hill Book Company参照)。
【0260】
本発明は、限定されるものではないが、顔面再形成、上顎再形成、下顎再形成、歯周病または抜歯後の増強された骨治癒、増強された長骨延長、増強された補綴内部成長および増大した骨結合を含めた、骨質量または骨成長を増加させることによって、本発明に従う治療からの利益を奪う他の状態にも関連する。
【0261】
用語「内因性」は、個体(例えば、限定されるものではないが、ヒト)が天然に生じる物質を意味すべきである。対照的には、「非−内因性」は、個体(例えば、限定されるものではないが、ヒト)によって天然に生産されないものを意味すべきである。
【0262】
Gプロテイン−結合受容体の、用語「生物学的に活性な断片」は、天然に生じるGPCRの構造的および生化学的機能を有するGPCRの断片を意味すべきである。ある実施形態において、生物学的に活性な断片はGプロテインに結合する。ある実施形態において、生物学的に活性な断片はGPCRの公知のリガンドに結合する。
【0263】
用語「プライマー」は、本明細書中においては、標的ヌクレオチド配列に対して相補的であって、それを用いて、標的ヌクレオチド配列にハイブリダイズする特異的ヌクレオチド配列を示すように用いる。プライマーは、DNAポリメラーゼ、RNAポリメラーゼ、または逆転写酵素によって触媒されるヌクレオチド重合についての開始点として働く。
【0264】
用語「発現ベクター」は、発現ベクターのための適切な宿主細胞組換え体において、クローン化DNAの転写、および転写されたmRNAの翻訳で必要なDNA配列を意味すべきである。適切に構築された発現ベクターは、宿主細胞における自律複製のための複製起点、選択マーカー、限定された数の有用な制限酵素部位、高コピー数の能力、および活性なプロモーターを含むべきである。転写すべきクローン化されたDNAは、発現ベクター内の構成的にまたは条件的に活性なプロモーターに作動可能に連結される。
【0265】
用語「宿主細胞」は、その中に取り込まれたベクターを有することができる細胞を意味すべきである。この関係においては、ベクターは、典型的には、適当なプロモーター配列と作動可能に連結された、GPCRまたはGPCR融合蛋白質をコードする核酸を含有して、GPCRまたはGPCR融合蛋白質の発現を起こるようにする。特別な実施形態において、宿主細胞は真核生物宿主細胞である。ある実施形態において、真核生物宿主細胞は哺乳動物宿主細胞である。ある実施形態において、真核生物宿主細胞は酵母宿主細胞である。ある実施形態において、真核生物宿主細胞はメラニン保有宿主細胞である。
【0266】
用語「接触する」または「接触している」は、少なくとも2つの部位を一緒にすることを意味すべきである。
【0267】
用語「調節する」または「改変する」は、特定の活性、機能または分子の量、質、または効果の増加または減少をいうように採用されるべきである。説明として、かつ限定されるものではないが、Gプロテイン−結合受容体のアゴニスト、部分的アゴニスト、逆アゴニスト、およびアンタゴニストは受容体のモジュレーターである。
【0268】
用語「小分子」は、ペプチド、ペプチドミメティック、アミノ酸、アミノ酸アナログ、ポリヌクレオチド、ポリヌクレオチドアナログ、ヌクレオチド、ヌクレオチドアナログ、有機化合物または無機化合物(すなわち、ヘテロ有機化合物または有機金属化合物を含む)、ならびにその塩、エステルおよび他の医薬的に許容される形態を含めた、モル当たり約10,000グラム未満の分子量を有する化合物を意味するように採用されるべきである。ある実施形態において、小分子は、モル当たり約5,000グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子はモル当たり約1,000グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子はモル当たり約800グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子は分子当たり約600グラム未満の分子量を有する無機または有機化合物である。ある実施形態において、小分子はモル当たり約500グラム未満の分子量を有する無機または有機化合物である。
【0269】
本明細書中で用いるアミノ酸の略語は表Bに記載する:
表B
【0270】
【化2−1】

【0271】
【化2−2】

用語「ポリペプチド」とは、ポリマーの長さに関係することなくアミノ酸のポリマーをいうべきである。したがって、ペプチド、オリゴペプチド、蛋白質はポリペプチドの定義内に含まれる。この用語は、ポリペプチドの発現後改変を特定したり排除したりしない。例えば、グリコシル基、アセチル基、リン酸基、脂質基等の共有結合を含むポリペプチドは、用語ポリペプチドによって例示的に含まれる。
【0272】
用語「ポリヌクレオチド」とは、単一鎖形態または二本鎖形態いずれかにて、1を超えるヌクレオチドのRNA、DNA、またはRNA/DNAハイブリッド配列をいうべきである。本発明のポリヌクレオチドは、合成、組換え、エクス・ビボ生成、またはその組合せを含めたいずれかの公知の方法、ならびに当該分野で知られたいずれかの精製方法の利用によって調製することができる。
【0273】
用語「抗体」は、本明細書中においては、モノクローナル抗体およびポリクローナル抗体を含むことを意図する。
【0274】
用語「第二のメッセンジャー」は、受容体活性化の結果として生じる細胞内応答を意味すべきである。第二のメッセンジャーは、例えば、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、環状AMP(cAMP)、環状GMP(cGMP)、MAPキナーゼ活性、MAPK/ERKキナーゼキナーゼ−1(MEKK1)活性、およびCa2+を含むことができる。第二のメッセンジャー応答は、受容体活性化の決定のために決定することができる。
【0275】
用語「受容体機能性」とは、限定されるものではないが、遺伝子転写の調節、イオンの流入または流失の調節、触媒反応の実行、および/または第二のメッセンジャー応答の誘導のようなG−プロテインを介する活性の調節を含めた、細胞において刺激を受け取り、および効果を和らげる受容体の正常な作動をいうべきである。
【0276】
用語「応答」または「受容体機能性」との関係での用語「刺激する」または「刺激している」は、受容体の応答または機能性が化合物の非存在下におけるのとは反対に化合物の存在下で増加することを意味すべきである。
【0277】
用語「応答」または「受容体機能性」との関係での用語「阻害する」または「阻害している」は、受容体の機能性の応答が化合物の非存在下におけるのとは反対に化合物の存在下で減少し、または予防されることを意味すべきである。
【0278】
用語「化合物の効力」は、受容体結合親和性とは反対に、受容体機能性を阻害し、または刺激する化合物の能力の測定値を意味すべきである。
【0279】
「候補化合物」と本明細書中においては相互交換的に用いられる用語「テスト化合物」は、スクリーニング技術に使用できる分子(例えば、限定されるものではないが、化学的化合物)を意味すべきである。
【0280】
Gプロテイン−結合受容体との関係での用語「構成的に活性」は、Gプロテイン−結合受容体がアゴニスト−非依存性活性を呈することを意味すべきである。
【0281】
句「テスト化合物」との関係での用語「直接的に同定する」または「直接的に同定された」は、Gプロテイン−結合受容体に対する公知のリガンド(例えば、公知アゴニスト)の非存在下におけるGプロテイン−結合受容体に対する化合物のスクリーニングを意味すべきである。
【0282】
ある範囲の値が供される場合、その範囲の上方および下方限界、および述べられた範囲におけるいずれかの他の述べられたまたは介入する値の間の、より低い限界の1/10に対する各介入値は、文脈が明瞭にそうではないことを指令するのでなければ、本発明に含まれることが理解される。これらのより小さな範囲の情報および下方限界は、独立して、より小さな範囲に含むことができ、また、述べられた範囲におけるいずれかの具体的に排除された範囲に従い、本発明にやはり含まれる。述べられた範囲が限界の一方または双方を含む場合、それらの含まれた限界のいずれかまたは双方を排除する範囲も本発明に含まれる。
A.導入
以下のセクションの順序は提示効率について記載されるものであって、開示または特許請求の範囲に対する限定と指定とされるものではなく、又そう解釈されるべきではない。B.受容体の発現
1.目的のGPCRポリペプチド
本発明のGPCRは;
(a)配列番号2のアミノ酸1〜335;
(b)配列番号2のアミノ酸2〜335;
(c)配列番号2のアミノ酸2〜335、ここで、GPCRは配列番号2のアミノ酸配列を含まない;
(d)特異的なプライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体のアミノ酸配列;
(e)高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGプロテイン−結合受容体のアミノ酸配列;
(f)配列番号2の改変体;
(g)
(i)配列番号2に対して少なくとも約80%同一性を有するGプロテイン−結合受容体のアミノ酸配列;および
(ii)配列番号2の少なくとも20連続アミノ酸を含むGプロテイン−結合受容体のアミノ酸配列;
よりなる群から選択される場合の(f)アミノ酸配列
(h)配列番号2を有するGプロテイン−結合受容体の構成的に活性なバージョンのアミノ酸配列;および
(i)(a)〜(h)のいずれか1つの生物学的活性な断片;
よりなる群から選択されるアミノ酸配列を含むことができる。ある実施形態において、本発明のGPCRは配列番号2のアミノ酸配列を含む。
【0283】
いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は内因性Gプロテイン−結合受容体である。いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能であるポリヌクレオチドによってコードされ、かつ内因性Gプロテイン−結合受容体であるGプロテイン−結合受容体は哺乳動物Gプロテイン−結合受容体であるいくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能であるポリヌクレオチドによってコードされ、かつ内因性Gプロテイン−結合受容体であるGプロテイン−結合受容体は哺乳動物GPR119受容体である。ある実施形態において、ポリメラーゼ連鎖反応のよって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、配列番号2またはその対立遺伝子である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、配列番号2の対立遺伝子である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は特異的に化合物1に結合する(化合物1の化学的構造および化学的名称を記載する表A参照)。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、特異的に(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける該受容体にてEC50値を有するアゴニストである受容体である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおいて該受容体にてEC50値を有するアゴニストである受容体である。いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0284】
いくつかの実施形態において、ヒトDNAはゲノムDNAである。
【0285】
いくつかの実施形態において、ポリメラーゼ連鎖反応は逆転写−ポリメラーゼ連鎖反応(RT−PCR)である。RT−PCR技術は当業者によく知られている。いくつかの実施形態において、ヒトDNAは、GPR119を発現する組織または細胞型に由来するヒトcDNAである。いくつかの実施形態において、GPR119を発現するヒト組織は膵臓または膵臓島である。ある実施形態において、cDNAは、GPR119を発現するヒト細胞型からのものである。いくつかの実施形態において、cDNAは膵臓ベータ細胞系からのものである。いくつかの実施形態において、本発明のGPCRは組換え体である。いくつかの実施形態において、組換えGPCRは組換えヒトGPR119である。
【0286】
ある実施形態において、主題の方法で用いてもよいGPCRは検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、本発明のGPCRは内因性である。いくつかの実施形態において、本発明のGPCRは哺乳動物GPR119である。いくつかの実施形態において、内因性である本発明のGPCRは哺乳動物GPR119である。
【0287】
説明であって限定されるものではないが、N−末端メチオニン残基の欠失は、主題の発明で用いてもよい生物学的活性な断片を供すると考えられる。ある実施形態において、本発明の生物学的に活性な断片は、そのN−末端において、化合物1に特異的に結合するN−末端メチオニン残基および(ヘマグルチニンインフルエンザウィルスからの)HAエピトープタグを含むペプチドに所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、そのN−末端において、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合するN−末端メチオニン残基および(ヘマグルチニンインフルエンザウィルスからの)HAエピトープタグを含むペプチドに所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおいて当該ペプチドにそのN−末端にて所望により融合した当該断片にてEC50値を有するアゴニストである、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端にて所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片であって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う前細胞アデニリルシクラーゼアッセイにおいて当該ペプチドにそのN−末端において所望により融合した当該断片におけるEC50値を有するアゴニストである、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。いくつかの実施形態において、本発明の生物学的に活性な断片は、検出可能なレベルの構成的な活性を呈するN−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ある実施形態において、断片は、実質的に、N−末端メチオリン残基およびHAエピトープタグよりなるペプチドにそのN−末端にて融合している。N−末端メチオニン残基およびHAエピトープタグを含む、または実質的にそれよりなるペプチドをポリペプチド断片のN−末端に融合させる技術は当該分野で良く知られており、商業的に入手することができる(例えば、Clontech Mountain View,CA)。
【0288】
配列番号2のヒトGPR119の対立遺伝子改変体は、本発明の範囲内にあると考えられる。ヒトGPR119は本発明の範囲内にあると考えられる。
【0289】
配列番号2のヒトGPR119の脊椎動物オルソログである改変体は、本発明の範囲内にあると考えられる。配列番号2のヒトGPR119の哺乳動物オルソログである改変体は、本発明の範囲内にあると考えられる。説明として、かつ限定されるものではないが、マウスGPR119(例えば、GenBank(登録商標)アクセションNo.AY288423)、ラットGPR119(例えば、GenBank(登録商標)アクセションNo.AAN95195)、ハムスターGPR119、イヌGPR119、および非−ヒト霊長類GPR119は本発明の範囲内にあると考えられる。
【0290】
ある実施形態において、配列番号2の改変体はGPCRである。
【0291】
配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有する配列番号2の改変体は本発明の範囲内にあると考えられる。ある実施形態において、配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有する配列番号2の改変体はGPCRである。いくつかの実施形態において、配列番号2の改変体は内因性GPCRである。いくつかの実施形態において、配列番号2の改変体は非−内因性GPCRである。いくつかの実施形態において、内因性GPCRである配列番号2の改変体は哺乳動物GPCRである。ある実施形態において、配列番号2の改変体は特異的に化合物1に結合する。ある実施形態において、配列番号2の改変体は、特異的に、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに結合する。ある実施形態において、配列番号2の改変体は、約50μM未満、約25μM未満、約10μM未満、5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従った受容体結合アッセイにおけるIC50値をもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値をもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体におけるEC50値を有するアゴニストである受容体である。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、配列番号2の改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性は、メラニン保有細胞が色素分散を受けるようにするためのものである。パーセント同一性は、公知のコンピュータプログラムを用いて慣用的に決定することができる。
【0292】
ある実施形態において、主題の方法で用いることができる改変体GPCRは、配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有するアミノ酸配列を有する。例えば、配列番号2に対して95%「同一性」を有する改変体GPCRとは、それが配列番号2の各100アミノ酸当たり5までのアミノ酸改変を含むことができる以外は、該改変体のアミノ酸配列が配列番号2のアミノ酸1〜335に対して同一であることを意味する。したがって、例えば、配列番号2のアミノ酸配列に対して少なくとも95%同一性を有するアミノ酸配列を得るためには、配列中のアミノ酸残基の5%(100のうち5)までが、配列番号2のアミノ酸1〜335と比較して挿入され得るか、欠失され得るか、またはもう1つのアミノ酸で置き換え得る。これらの改変は、アミノまたはカルボキシ末端における箇所、あるいはそれらの末端位置の間の、配列中の残基の間で各々に、あるいは配列内の1以上の連続基にとして介在した箇所の、いずれかの箇所で起こることができる。
【0293】
ある実施形態において、主題の方法で用いることができる改変体Gプロテイン−結合受容体は、いくつかのアミノ酸の欠失、置換、および/または付加を有する配列番号2に由来するアミノ酸配列を有するGプロテイン−結合受容体である。ある実施形態において、主題の方法で用いることができる改変体Gプロテイン−結合受容体は、配列番号2のアミノ酸配列において、10以下の保存的アミノ酸置換および/または3以下の非−保存的アミノ酸置換を有する、配列番号2に由来するアミノ酸配列を有するGプロテイン−結合受容体である。ある実施形態において、アルギニン、リジンおよびヒスチジンは、相互の代わりに保存的に置き換えることができ;グルタミン酸およびアスパラギン酸は相互に保存的に置き換えることができ;グルタミンおよびアスパラギン酸は相互に保存的に置き換えることができ;ロイシン、イソロイシンおよびバリンは相互に保存的に置き換えることができ;フェニルアラニン、トリプトファンおよびチロシンは相互に保存的に置き換えることができ;およびグリシン、アラニン、セリン、スレオニンおよびメチオニンは相互に保存的に置き換えることができる。アミノ酸置換、アミノ酸欠失、およびアミノ酸付加はいずれの位置(例えば、C−またはN−末端、または内部位置)におけるものであってもよい。いくつかの実施形態において、改変体は内因性Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性脊椎動物Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性哺乳動物Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性ヒトGプロテイン−結合受容体である。いくつかの実施形態において、改変体は非−内因性Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、化合物1がリガンドであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値を有するリガンドであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、化合物1がアゴニストであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおけるEC50値を有するアゴニストであるGプロテイン−結合受容体である。
【0294】
配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含むGプロテイン−結合受容体である配列番号2の改変体は、本発明の範囲内にあると考えられる。ある実施形態において、配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含む配列番号2の改変体はGPCRである。いくつかの実施形態において、配列番号2の改変体は内因性GPCRである。ある実施形態において、配列番号2の改変体は非−内因性GPCRである。いくつかの実施形態において、内因性GPCRである配列番号2の改変体は哺乳動物GPCRである。ある実施形態において、配列番号2の改変体は化合物1に特異的に結合する。ある実施形態において、配列番号2の改変体は(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従った受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、配列番号2の改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。いくつかの実施形態において、配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含むGプロテイン−結合受容体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0295】
いくつかの実施形態において、主題の方法で用いることができる改変体GPCRは、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは内因性GPCRである。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは非−内因性GPCRである。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされ、かつ内因性GPCRであるGPCRは、哺乳動物内因性GPCRである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、配列番号2またはその対立遺伝子である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、配列番号2の対立遺伝子である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは配列番号2のオルソログである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは化合物1に特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ハイブリダイゼーション技術は当業者によく知られている。いくつかの実施形態において、ストリンジェントなハイブリダイゼーション条件(例えば、高ストリンジェンシーの条件)は、50%ホルムアミド、5xSSC(1xSSC=150mM NaCl,15mMクエン酸三ナトリウム)、50nMリン酸ナトリウム(pH7.6)、5×デンハルト溶液、10%デキストラン硫酸、および20μg/mLの変性された剪断サケ精子DNAを含む溶液中での42℃における一晩のインキュベーション、続いての約65℃における0.1×SSC中でのフィルターの洗浄を含む。いくつかの実施形態において、ストリンジェントなハイブリダイゼーション条件(例えば、高ストリンジェンシーの条件)は、50%ホルムアミド、5xSSC(1xSSC=150mM NaCl,15mMクエン酸三ナトリウム)、50nMリン酸ナトリウム(pH7.6)、5×デンハルト溶液10%デキストラン硫酸、および20μg/mLの変性剪断サケ精子DNAを含む溶液中での42℃における一晩のインキュベーション、続いての、約50℃、約55℃、約60℃、または約65℃における0.1xSSC/0.1% SDS(ドデシル硫酸ナトリウム)中での、または0.2xSSC/0.1% SDS中での洗浄を含む。いくつかの実施形態において、該高ストリンジェンシーの条件は0.1×SSCでの65℃における洗浄を含む。いくつかの実施形態において、該高ストリンジェンシーの条件は、0.1xSSC/0.1% SDSでの、または0.2xSSC/0.1% SDSでの約50℃、約55℃、約60℃、または約65℃における洗浄を含む。
【0296】
いくつかの実施形態において、主題の方法で用いることができるGPCRは、配列番号2のアミノ酸配列を含む非−内因性の構成的に活性化された受容体であり、ここで、配列番号2のアミノ酸224位におけるロイシンはロイシン以外のアミノ酸で置き換えられている。いくつかの実施形態において、ロイシン以外のアミノ酸はリジンである。いくつかの実施形態において、ロイシン以外のアミノ酸はアラニンである。いくつかの実施形態において、ロイシン以外のアミノ酸はアルギニンである。いくつかの実施形態において、ロイシン以外のアミノ酸はヒスチジンである。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0297】
ある実施形態において、本発明のGPCRは、配列番号2を有するGプロテイン−結合受容体の構成的に活性なバージョンを含む。いくつかの実施形態において、受容体の構成的に活性なバージョンは、配列番号2を有する内因性の構成的に活性なバージョンである。いくつかの実施形態において、受容体の構成的に活性はバージョンは、配列番号2のアミノ酸224位に位置する突然変異を有する非−内因性の構成的に活性なバージョンである。いくつかの実施形態において、突然変異した残基はロイシン以外の残基に突然変異している。いくつかの実施形態において、突然変異した残基はリジン残基に突然変している。いくつかの実施形態において、突然変異した残基はアラニン残基に突然変異している。いくつかの実施形態において、突然変異した残基はアルギニン残基に突然変異している。いくつかの実施形態において、突然変異した残基はヒスチジン残基に突然変異している。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的な活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0298】
ある実施形態において、本発明のGPCRはGプロテインとで融合蛋白質の一部を形成する。
a.配列同一性
ある実施形態において、パーセント同一性は、当該分野で良く知られたBasic Local Allignment Search Tool(基本的局所整列サーチツール)(「BLAST」)を用いて評価される[例えば、その各々の開示をここで引用してその全体を援用するKarlin and Altschul,Proc Natl Acad Sci USA(1990)87:2264−2268;Altschul et al.,J Mol Biol(1990)215:403−410;Altschul et all,Nature Genetics(1993)3:266−272;およびAltschul et al.,Nucleic Acids Res(1997)25:3389−3402参照]。BLASTプログラムは、デフォルトパラメーターにて、またはユーザーによって供された改変されたパラメーターにて用いることができる。好ましくは、パラメーターはデフォルトパラメーターである。
【0299】
ある実施形態において、グローバル配列整列とも言われる、クエリー配列(例えば、配列番号2のアミノ酸配列)および照会される配列の間の最良な総マッチを決定するための好ましい方法は、Brutlag et al.(その開示をここで引用してその全体を援用するComp App Biosci(1990)6:237−245)のアルゴリズムに基づくFASTDBコンピュータプログラムを用いて決定することができる。配列整列において、クエリー配列および照会された配列は共にアミノ酸配列である。該グローバル配列整列の結果はパーセント同一性で表す。FASTDBアミノ酸整列で用いる好ましいパラメーターは:マトリックス=PAM 0、k−組=2、ミスマッチペナルティ=1、接合ペナルティ=20、ランダム化群=25、長さ=0、カットオフスコア=1、ウィンドウサイズ=配列の長さ、ギャップペナルティ=5、ギャップサイズペナルティ=0.05、ウィンドウサイズ=247、またはいずれがより短いかにかかわらず、照会されたアミノ酸配列の長さである。もし照会された配列が、内部欠失のためにではなく、N−またはC−末端欠失のためにクエリー配列よりも短いならば、パーセント同一性で表した結果は手動で修正しなければならない。なぜならば、FASTDBプログラムは、グローバルパーセント同一性を計算する場合に、照会された配列のN−およびC−末端切断を説明しないからである。クエリー配列に対し、N−およびC−末端において切断された照会された配列では、パーセント同一性は、対応する照会された配列残基とマッチ/整列しない、照会された配列のN−およびC−末端であるクエリー配列の残基の数を、クエリー配列の合計塩基のパーセントとして計算することによって修正される。残基がマッチ/整列されたか否かは、FASTDB配列整列の結果によって決定される。次いで、このパーセンテージを、特定のパラメーターを用いて上記FASTDBプログラムによって計算されたパーセント同一性から差し引いて、最終パーセント同一性スコアに到達する。この最終パーセント同一性スコアは、本発明の目的のために用いられるものである。クエリー配列とマッチ/整列しない照会された配列のN−およびC−末端に対する残基のみ(すなわち、照会された配列の最もN−およびC−末端側の残基の外側のクエリーアミノ酸残基のみ)が、パーセント同一性スコアを手動で調整する目的で考慮される。
【0300】
例えば、90アミノ酸残基の照会された配列を100−残基クエリー配列と整列させて、パーセント同一性を決定する。欠失は照会された配列のN−末端で起こり、従って、FASTDB整列はN−末端における第一の残基とマッチ/整列しない。10の不対残基は配列の10%を表し(マッチしないN−およびC−末端における残基の数/クエリー配列における残基の合計数)、従って、FASTDBプログラムによって計算されたパーセント同一性スコアから10%を差し引く。もし残りの90残基が完全にマッチすれば、最終パーセント同一性は90%となろう。もう1つの例において、90−残基の照会された配列は100−残基クエリー配列と比較される。今回、欠失は内部であり、従って、クエリーとマッチ/整列しない、照会された配列のN−またはC−末端において残基はない。この場合、FASTDBによって計算されたパーセント同一性は手動では修正されない。もう一度言うと、FASTDB整列に示されるように、クエリー配列とマッチ/整列されない、主題の配列のN−およびC−末端の外側の残基位置のみが手動で修正される。本発明の目的では他の修正はなされない。
b.融合蛋白質
ある実施形態において、目的のポリペプチドは融合蛋白質であり、例えば、アフィニティータグドメインまたはレポータードメインを含有することができる。適当なアフィニティータグは、もう1つの部位、通常もう1つのポリペプチド、最も通常には抗体に特異的に結合することができるいずれのアミノ酸配列も含む。適当なアフィニティータグは、当該分野で知られているように、エピトープタグ、例えば、V5タグ、FLAGタグ、(ヘマグルチニンインフルエンザウィルスからの)HAタグ、mycタグなどを含む。適当なアフィニティータグは、当該分野で公知のように、結合基質が知られているドメイン、例えば、HIS、GSTおよびMBPタグ、および特異的結合パートナー、例えば、抗体、特にモノクローナル抗体が利用できる他の蛋白質からのドメインも含む。適当なアフィニティータグは、適当な結合パートナー、例えば、IgG Fc受容体を用いて特異的に結合し、検出することができる、IgG Fc領域のようないずれかの蛋白質−蛋白質相互作用ドメインも含む。そのような融合蛋白質が、そのN−末端メチオニン残基が欠失されているか、または代替アミノ酸で置換されたかのいずれかであるGPCRとイン−フレーム融合された異種N−末端ドメイン(例えば、エピトープタグ)を含有することができると明示的に考えられる。
【0301】
適当なレポータードメインは、ポリペプチドの存在を報告することができるいずれのドメインも含む。アフィニティータグを用いて、例えば、タグに特異的に結合する標識された抗体を用いてポリペプチドの存在を報告することができるが、発光レポータードメインがより通常に用いられる。適当な発光レポータードメインは(例えば、ホタル、Vargula、Renilla reniformisまたはRenilla muelleriからの)ルシフェラーゼ、またはその発光改変体を含む。他の適当なレポータードメインは(例えば、クラゲ、サンゴ、およびAequoria、Renilla、Ptrilosarcus、Stylatula種からのもののような他の腔腸動物からの)蛍光蛋白質、またはその発光改変体を含む。これらのレポーター蛋白質の発光改変体は当該分野で非常によく知られており、天然レポーター蛋白質と比べてより明るく、より暗く、または異なる励起および/または発光スペクトルを有することができる。例えば、当該分野で知られているように、いくつかの改変体はそれらがもはや緑色ではなく、青色、シアン、黄色、増強された黄赤色(各々、BFP、CFP、YFP eYFPおよびRFPという)に見え得、または他の発光スペクトルを有し得るように改変される。他の適当なレポータードメインは、β−ガラクトシダーゼ、β−グルクロニダーゼ、クロラムフェニコールアセチルトランスフェラーゼ、および分泌された胚性アルカリ性ホスファターゼのような、生化学的または色の変化を通じてポリペプチドの存在を報告することができるドメインを含む。
【0302】
また、当該分野で知られているように、アフィニティータグまたはレポータードメインは目的のポリペプチドにおけるいずれの位置に存在してもよい。しかしながら、ほとんどの実施形態において、それらは目的のポリペプチドのC−またはN−末端に存在する。
2.目的のGPCRポリペプチドをコードする核酸 核酸を操作するための遺伝子暗号および組換え技術は知られており、かつ目的のGPCRポリペプチドのアミノ酸配列は上記のように記載されているため、目的のGPCRポリペプチドをコードする核酸の設計および生産は十分に当業者の技量内のものである。ある実施形態において、標準的な組換えDNA技術(Ausubel,et al,Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995;Sambrook,et al.,Molecular Cloning:A Laboratory Mannual,Second
Edition,(1989)Cold Spring Harbor,N.Y.)方法を用いる。例えば、本明細書中に記載する必要がない種々の組換え技術のいずれか1つ、またはその組合せを用い、GPCRコーディング配列をGPCRコーディング配列のライブラリーから単離することができる。蛋白質をコードする核酸配列におけるヌクレオチドの引き続いての置換、欠失および/または付加もまた標準的な組換えDNA技術を用いて行うこともできる。例えば、部位特異的突然変異誘発およびサブクローニングを用いて、目的のポリペプチドをコードするポリヌクレオチド中の核酸残基に導入し/それを欠失し/それを置換することができる。他の実施形態において、PCRを用いることができる。目的のポリペプチドをコードする核酸分子を、完全にオリゴヌクレオチドからの化学的合成によって作製することもできる(例えば、Cello et al.,Science(2002)297:1016−8)。いくつかの実施形態において、目的のポリペプチドをコードする核酸のコドンは、例えば、特定の種、特に哺乳動物、例えば、マウス、ラット、ハムスター、非−ヒト霊長類、またはヒト種の細胞で最適化される。いくつかの実施形態において、目的のポリペプチドをコードする核酸のコドンは、特定の種、特に両生類種の細胞における発現のために最適化される。
a.ベクター
本発明は、さらに、主題の核酸を含むベクター(「構築体」ともいう)を提供する。本発明の多くの実施形態において、主題の核酸配列は、この配列が、例えば、プロモーターを含めた発現制御配列に作動可能に連結された後に宿主において発現されるであろう。主題の核酸は、典型的には、エピソームとして、または宿主染色体DNAの一体的部分として宿主細胞中で複製することができる発現ベクターに入れられる。通常、発現ベクターは、所望のDNA配列で形質転換された細胞の検出を可能とするために、選択マーカー(例えば、テトラサイクリンまたはネオマイシン)を含有するであろう(例えば、ここで引用して援用する米国特許第4,704,362号参照)。単一およびデュアル発現カセットベクターを含めたベクターは当該分野で良く知られている(Ausubel,et al,Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995;Sambrook,et al.,Molecular Cloning:A Laboratory Mannual,Second Edition,(1989)Cold Spring Harbor,N.Y.)。適当なベクターはウィルスベクター、プラスミド、コスミド、人工染色体(ヒト人工染色体、細菌人工染色体、酵母人工染色体など)、ミニ−染色体などを含む。レトロウィルス、アデノウィルスおよびアデノ−関連ウィルスベクターを用いることができる。
【0303】
細胞中でポリペプチドを生産する目的で、種々の発現ベクターが当該分野で利用可能であり、それは(例えば、Invitrogen,Carlsbad,CA;Clontech,Mountain View,CA;Stratagene,La Jolla,CAから)商業的に入手可能な発現ベクターを含む。商業的に入手可能な発現ベクターは、非限定的例として、CMVプロモーター−ベースのベクターを含む。1つの適当な発現ベクターはpCMVである。発現ベクターはアデノウィルスであってよい。例示的なアデノウィルスベクターはObiogene(Carlsbad,CA)からのAdEasyTMとして購入することができる(その各々の開示をここで引用してその全体を援用するHeTC et al,Proc Natl Acad Sci USA(1998)95:2509−2514;および米国特許第5,922,576号)。他の発現ベクターは当業者に容易に明らかであろう。
【0304】
主題の核酸は通常、目的の主題のポリペプチドをコードする単一のオープンリーディングフレームを含み、しかしながら、ある実施形態においては、目的のポリペプチドの発現のための宿主細胞は真核生物細胞、例えば、ヒト細胞のような哺乳動物細胞であってよいため、オープンリーディングフレームはイントロンによって中断されていてもよい。主題の核酸は、典型的には、主題の核酸に加えて、RNA安定性、翻訳効率などを指令できる3’および5’非翻訳領域(UTR)を含有することができる転写単位の一部である。主題の核酸は、主題の核酸に加えて、目的のポリペプチドの転写および発現を指令するプロモーター、および転写ターミネーターを含有する発現カセットの一部でもあり得る。
【0305】
真核生物プロモーターは、ウィルスプロモーターおよび真核生物遺伝子に由来するプロモーターを含めた、真核生物宿主細胞において機能的ないずれのプロモーターでもあり得る。例示的な真核生物プロモーターは限定されるものではないが:マウスメタロチオネインI遺伝子配列のプロモーター(Hamer et al.,J.Mol.Appl.Gen.1:273−288,1982);ヘルペスウィルスのTKプロモーター(Mcknight,Cell 31:355−365,1982);SV40初期プロモーター(Benoist et al.,Nature(London)290:304−310,1981);酵母gall遺伝子配列プロモーター(Johnston et al.,Proc.Natl.Acad.Sci.(USA)79:6971−6975,1982);Silver et al.,Proc.Natl.Acad.Sci.(USA)81:5951−59SS,1984)、CMVプロモーター、EF−1プロモーター、エクジソン(Ecdysone)−応答性プロモーター、テトラサイクリン−応答性プロモーターなどを含む。ウィルスプロモーターは一般には特に強力なプロモーターであるため、特に目的のものであり得る。ある実施形態において、標的病原体のプロモーターであるプロモーターを用いる。本発明で用いるプロモーターは、それらが、導入される細胞型(および/または動物)で機能的であるように選択される。ある実施形態において、プロモーターはCMVプロモーターである。
【0306】
ある実施形態において、主題のベクターは選択可能なマーカーの発現を提供することができる。適当なベクターおよび選択マーカーは当該分野で良く知られており、Ausubel,et al,(Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995)およびSambrook,et al,(Molecular Cloning:A Laboratory Manual,Third Edition,(2001)Cold Spring Harbor,N.Y.)で議論されている。種々の異なる遺伝子が選択マーカーとして使用されており、選択マーカーとして主題のベクターで使用される特定の遺伝子は便宜のため主として選択される。公知の選択マーカー遺伝子は:チミジンキナーゼ遺伝子、ジヒドロ葉酸レダクターゼ遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼ遺伝子、CAD、アデノシンデアミナーゼ遺伝子、アスパラギンシンテターゼ遺伝子、抗生物質耐性遺伝子、例えば、tert、ampr、Cmrまたはcat、kanrまたはneor(アミノグリコシドトランスフェラーゼ遺伝子)ヒグロマイシンBホスホトランスフェラーゼ遺伝子などを含む。上記したように目的のポリペプチドは、アフィニティードメインおよび/またはレポータードメインを含有する融合蛋白質であってもよい。例えば、GPCRのC−またはN−末端における、レポーターまたはタグとGPCRとの間の融合を行うための方法は、十分に、当業者の技量内のものであり(例えば、McLean et al,Mol.Pharma.Mol Pharmacol.1999 56:1182−91;Ramsay et al.,Br.J.Pharmacology,2001,315−323)、さらには記載しない。そのような融合蛋白質は、そのN−末端メチオニン残基が欠失されたか、または代替アミノ酸で置換されたかのいずれかのGPCRとイン−フレーム融合された異種N−末端ドメイン(例えば、エピトープタグ)を含有することができると明示的に考えられる。目的のポリペプチドはまず天然ポリペプチドから作製され、次いで、上記したように適当なレポーター/タグに作動可能に連結することができると認められる。
【0307】
主題の核酸は、通常、目的のポリペプチドをコードする核酸の構築を容易とするために、制限部位、多数クローニング部位プライマー結合部位、連結可能末端、組換え部位などを含有してもよい。
b.宿主細胞
本発明は、さらに、主題の核酸を含むベクターを含む宿主細胞を提供する。適当な宿主細胞は原核生物、例えば、細菌細胞(例えば、E.coli)、ならびに真核生物細胞、例えば、動物細胞(例えば、昆虫、哺乳動物、魚類、両生類、鳥類または爬虫類細胞)、植物細胞(例えば、トウモロコシまたはArabidopsis細胞)、または真菌細胞(例えば、S.cerevisiae細胞)を含む。ある実施形態において、目的のポリペプチドをコードする核酸の発現に適したいずれの細胞も宿主細胞として用いることができる。通常、動物宿主細胞系が用いられ、その例は以下の通りである:サル腎臓細胞(COS細胞)、SV40によって形質転換されたサル腎臓CVI細胞(COS−7,ATCC CRL 165 1);ヒト胚腎臓細胞(HEK−293[「293」],Graham et al.J.Gen Virol.36:59(1977));HEK−293T[「293T」]細胞;ベビーハムスター腎臓細胞(BHK,ATCC CCL 10);チャイニーズハムスター卵巣−細胞(CHO,Urlaub and Chasin,Proc.Natl.Acad.Sci.(USA)77:4216,(1980);シリアンゴールドハムスター細胞MCB3901(ATCC CRL−9595);マウスセルトリ細胞(TM4,Mather,Biol.Reprod.23:243−251(1980));サル腎臓細胞(CVI ATCC CCL 70);アフリカミドリザル腎臓細胞(VERO−76,ATCC CRL−1587);ヒト頸部癌腫細胞(HELA,ATCC CCL 2);イヌ腎臓細胞(MDCK,ATCC CCL 34);バッファローラット肝臓細胞(BRL 3A,ATCC CRL 1442);ヒト肺細胞(W138,ATCC CCL 75);ヒト肝臓細胞(hep G2,HB 8065);マウス乳癌(MMT 060562,ATCC CCL 51);TRI細胞(Mather et al.,Annals N.Y.Acad.Sci 383:44−68(1982));NIH/3T3細胞(ATCC CRL−1658);およびマウスL細胞(ATCC CCL−1)。ある実施形態において、メラニン保有細胞を用いる。メラニン保有細胞は下等脊椎動物で見出される皮膚細胞である。関連する材料および方法は米国特許第5,462,856号および米国特許第6,051,386号の開示に従う。これらの特許の開示をここで引用してその全体を援用する。
【0308】
さらなる細胞系は当業者に明らかであり、広く種々の細胞系がAmerican Type Culture Collection,10801 University Boulevard,Manassas,Va.20110−2209から入手可能である。
C.候補化合物のスクリーニング
1.遺伝子GPCRスクリーニングアッセイ技術
Gプロテイン受容体が活性となると、それはGプロテイン(例えば、Gq、Gs、Gi、Gz、Go)に結合し、GTPのGプロテインへの結合を刺激する。次いで、GプロテインはGTPaseとして作用し、GTPをGDPへゆっくりと加水分解し、それにより、受容体は正常な条件下では脱活性化される。しかしながら、活性化された受容体はGDPをGTPへ変化させ続ける。GTPの加水分解不能アナログである[35S]GTPγSを用いて、活性化された受容体を発現する膜への増強された結合をモニターすることができる。[35S]GTPγSを用いて、リガンドの非存在下および存在下において膜へのGプロテイン結合をモニターすることができる。当業者によく知られ、利用され得る例の中でもこのモニタリングの例は、1995年にTrynor and Nahorskiによって報告された。このアッセイシステムの好ましい使用は候補化合物の初期スクリーニングのためのものである。何故ならば、システムは、受容体の細胞内ドメインと相互作用する特別なGプロテインと無関係に全てのGプロテイン−結合受容体に総括的に適応可能であるからである。
2.特異的GPCRスクリーニングアッセイ技術
一旦、候補化合物が「総括的」Gプロテイン−結合受容体アッセイ(すなわち、アゴニストまたは逆アゴニストである化合物を選択するためのアッセイ)を用いて同定されたならば、ある実施形態においては、化合物が受容体部位において相互作用したことを確認するためにさらにスクリーニングすることが好ましい。例えば、「総括的」アッセイによって同定された化合物は受容体に結合せず、代わりに、細胞内ドメインからのGプロテインから「結合解除」するにすぎない場合がある。
a.Gs、GzおよびGi
Gsは酵素アデニリルシクラーゼを刺激する。Gi(およびGzおよびGo)は、他方、アデニリルシクラーゼを阻害する。アデニリルシクラーゼはATPのcAMPへの変換を触媒する;したがって、Gsプロテインに結合する活性化されたGPCRは増大した細胞レベルのcAMPと会合する。他方、Gi(またはGz、Go)蛋白質に結合する活性化されたGPCRは減少した細胞レベルのcAMPに会合する。一般に、“Indirect Mechanisms of Synaptic Transmission,”Chpt.8,From Neuron To Brain(3rd Ed.)Nichols,J.G.et al eds.Sinauer Associates,Inc.(1992)参照。したがって、cAMPを検出するアッセイを利用して、候補化合物が、例えば、受容体に対する逆アゴニストであるかを(すなわち、そのような化合物がcAMPレベルを減少させるかを)決定することができる。cAMPを決定するための当分野で知られた種々のアプローチを利用することができ;いくつかの実施形態において、好ましいアプローチはELISA−ベースのフォーマットでの抗−cAMP抗体の使用に依拠する。利用することができるもう1つのタイプのアッセイは、全細胞第二メッセンジャーレポーター系アッセイである。遺伝子上のプロモーターは、特定の遺伝子がコードする蛋白質の発現を駆動する。環状AMPは、cAMP−応答性DNA結合蛋白質、または次いで、cAMP応答エレメントと呼ばれる特異的部位においてプロモーターに結合する転写因子(CREB)を促進することによって遺伝子発現を駆動し、遺伝子の発現を駆動する。レポーター遺伝子、例えば、β−ガラクトシダーゼまたはルシフェラーゼの前に複数cAMP応答エレメントを含有するプロモーターを有するレポーター系を構築することができる。したがって、活性化されたGs−結合受容体はcAMPの蓄積を引き起こし、これは、次いで、遺伝子、およびレポーター蛋白質の発現を活性化する。次いで、標準的な生化学アッセイを用い、β−ガラクトシダーゼまたはルシフェラーゼのようなレポーター蛋白質を検出することができる(Chen et al.1995)。
b.GoおよびGq
GqおよびGoは酵素ホスホリパーゼCの活性化に関連し、これは、今度は、リン脂質PIP2を加水分解し、2つの細胞内メッセンジャー:ジアシルグリセロール(DAG)およびイノシトール1,4,5−三リン酸(IP3)を放出する。IP3の増加した蓄積はGq−およびGo−関連受容体の活性化に関連する。一般に、“Indirect Mechanisms of Synaptic Transmission,”Chpt.8,From Neuron To Brain(3rd Ed.)Nichols,J.G.et al eds.Sinauer Associates,Inc.(1992)参照。IP3蓄積を検出するアッセイを利用して、候補化合物が、例えば、Gq−またはGo−関連受容体に対する逆アゴニストであるか(すなわち、そのような化合物はIP3のレベルを減少させるのであろうか)を決定することができる。Gq−関連受容体は、Gq−依存性ホスホリパーゼCがAP1エレメントを含有する遺伝子の活性化を引き起こし;したがって、活性化されたGq−関連受容体はそのような遺伝子の発現の増加を証明し、次いで、それに対する逆アゴニストはそのような発現の減少を証明し、アゴニストはそのような発現の増加を証明する点で、API受容体アッセイを用いて調べることもできる。そのような検出のための商業的に入手可能なアッセイが利用可能である。
3.GPCR融合蛋白質
逆アゴニストまたはアゴニストの直接的同定のための候補化合物のスクリーニングで用いるための、内因性の構成的に活性なGPCRまたは非−内因性の構成的に活性化されたGPCRの使用は、当然のこととして、受容体がそれに結合した内因性リガンドの非存在下においてさえ活性である点で、興味深いスクリーニングチャレンジを供する。したがって、例えば、候補化合物の存在下における非−内因性受容体とその化合物の非存在下における非−内因性受容体との間を、そのような化合物が逆アゴニストまたはアゴニストであり得るか、またはそのような影響を受容体に有しないかに関する理解を供する目的で識別するために、いくつかの実施形態においては、そのような識別を増強することができるアプローチを利用するのが好ましい。いくつかの実施形態において、好ましいアプローチはGPCR融合蛋白質の使用である。
【0309】
一般に、一旦、上記したアッセイ技術(ならびに当業者に知られた他のアッセイ技術)を用いて非−内因性GPCRが構成的に活性化されたことが決定されれば、内因性GPCRと結合する支配的なGプロテインを決定することが可能である。GプロテインのGPCRへの結合は、評価することができるシグナリング経路を提供する。いくつかの実施形態においては、スクリーニングは、哺乳動物またはメラニン保有細胞発現系(系それ自体は、内因性Gプロテインをその中で有すると予測される)を用いて行うのが好ましい。したがって、当然のこととして、そのような系においては、非−内因性の構成的に活性化されたGPCRは継続的にシグナルを発する。いくつかの実施形態において、このシグナルは、増強されることが好ましく、それにより、例えば、受容体に対する逆アゴニストの存在下で、逆アゴニストと接触する受容体との間を、特にスクリーニングの関係でより容易に識別できるようにする可能性が高い。
【0310】
GPCR融合蛋白質は、GPCRとのGプロテイン結合の効率を増強させることを意図する。GPCR融合蛋白質は、内因性の構成的に活性なGPCRまたは非−内因性の構成的に活性なGPCRいずれかでのスクリーニングに好ましいであろう。何故ならば、そのようなアプローチは、そのようなスクリーニング技術で一般化されたシグナルを増加させるからである。これは、有意な「ノイズに対するシグナル」比率を容易化するのに重要であり;そのような有意な比率は、本明細書中に開示された候補化合物のスクリーニングのために好ましい。
【0311】
GPCR融合蛋白質の発現で有用な構築体の構築は、当業者の技術範囲内のものである。商業的に入手可能な発現ベクターおよび系は、研究者の特別な要望に適合し得る種々のアプローチを供する。そのようなGPCR融合蛋白質構築体の構築における重要な基準は、限定されるものではないが、GPCR配列およびGプロテイン配列双方がイン−フレームであること(好ましくは、内因性GPCRについての配列がGプロテイン配列の上流にある)、およびGPCRの「停止」コドンは、GPCRの発現に際して、Gプロテインもまた発現することができるように欠失または置換されることを含む。GPCRは直接的にGプロテインに連結させることができ、あるいは2つの間にスペーサー残基が存在し得る(好ましくは、約12以下であるが、この数字は当業者によって容易に確認できる)。便宜上、スペーサーを用いるのが好ましい。いくつかの実施形態において、非−内因性GPCRに結合するG蛋白質はGPCR融合蛋白質構築体の作製に先立って同定されているのが好ましい。上記したように、Gi、GzおよびGoに結合する活性化されたGPCRは、チャレンジしたGPCRのタイプに基づいてcAMP作製アッセイの形成を阻害すると予測される(すなわち、cAMPシグナルは、例えば、アゴニスト(さらにこのシグナルを減少させるであろう)の活性化に際して減少し、それによって、アゴニストの直接的同定を行う)。本明細書中に開示されているように、これらのタイプの受容体について、生(viable)シクラーゼベースアッセイを確立する努力において、GPCRの内因性Gプロテインに基づかないGPCR融合蛋白質を作製することが可能であることが確かめられている。したがって、例えば、内因性Gi結合受容体をGs蛋白質に融合させることができ、そのような融合構築体は、発現に際して、内因性GPCRを、シクラーゼ−ベースアッセイを確立することができるように、「天然の」Gi蛋白質よりはむしろGsと結合するよう、「駆動する」または「強いる」。したがって、Gi、GzおよびGo結合受容体では、いくつかの実施形態において、GPCR融合蛋白質を用い、かつアッセイがアデニリルシクラーゼ活性の検出に基づく場合、融合構築体がGs(または酵素アデニリルシクラーゼの形成を刺激する同等なGプロテイン)で確立されるのが好ましい。
表C
【0312】
【化3】

同等に有効なのは、Gs、Gi、GzまたはGo蛋白質と融合したGq蛋白質を利用するG蛋白質融合構築体である。いくつかの実施形態において、好ましい融合構築体は、G−プロテインα−サブユニット(「Gαq」)の最初の6つのアミノ酸が欠失され、GαqのC−末端における最後の5つのアミノ酸が目的のGプロテインのGαの対応するアミノ酸で置き換えられたGq蛋白質で達成することができる。例えば、融合構築体は、Gi蛋白質と融合したGq(6アミノ酸欠失)を有することができ、その結果、「Gq/Gi融合構築体」がもたらされる。この融合構築体は、第二のメッセンジャー、例えば、イノシトール三リン酸またはジアシルグリセロールがcAMP生産の代わりに決定できるように、内因性Gi結合受容体を、その非−内因性GプロテインであるGqに結合させるであろう。
4.標的Gi結合GPCRのシグナル−増強剤Gs結合GPCRとの共−トランスフェクション(cAMPベースのアッセイ)
Gi結合受容体はアデニリルシクラーゼを阻害することが知られており、従って、cAMPレベルチャレンジの評価をすることができるcAMP生産のレベルを低下させる。ある実施形態においては、活性化に際して圧倒的にGiに結合する受容体の活性化の表示としてcAMPの生産の減少を決定する効果的な技術は、活性化に際して圧倒的にGsと結合するシグナル増強剤、例えば、非−内因性の構成的に活性化された受容体(例えば、TSHR−A623I;後記参照)を、Gi結合GPCRで共−トランスフェクトすることによって達成することができる。明らかなように、Gs結合受容体の活性化は、cAMPの生産の増加に基づいて決定することができる。Gi結合受容体の活性化は、cAMPの生産の減少に導く。したがって、共−トランスフェクションアプローチは、これらの「反対」効果を有利に利用することを意図する。例えば、非−内因性の構成的に活性化されたGs結合受容体(「シグナル増強剤」)の、発現ベクター単独との共−トランスフェクションは、ベースラインcAMPシグナルを供する(すなわち、Gi結合受容体はcAMPレベルを減少させるが、これが、この「減少」は、構成的に活性化されたGs結合シグナル増強剤によって確立されたcAMPレベルの実質的増加に対するものであろう)。次いで、標的増強剤を「標的受容体」で共−トランスフェクトすることによって、Gi結合標的受容体の逆アゴニストは測定されるcAMPシグナルを増加させ、他方、Gi結合標的受容体のアゴニストはこのシグナルを減少させるであろう。
【0313】
このアプローチを用いて直接的に同定される候補化合物を独立して評価して、これらがシグナル増強受容体を標的化しないことを確認すべきである(これは、共−トランスフェクトされた受容体に対するスクリーニングに先立って、または後に行うことができる)。組成物/処方および治療の方法
GPR119アゴニストは、当該分野でよく知られた技術を用い、本発明に従う使用のために医薬組成物および医薬に処方することができる。適当な処方は選択された投与経路に依存する。ある実施形態において、該投与は非−ヒト脊椎動物に対するもの、または非−ヒト哺乳動物に対するものである。
【0314】
本発明の療法、すなわち、GPR119アゴニストに関する療法に関するように、本発明による化合物はいずれかの適当な方法で投与することができる。適当な投与の経路は、当該分野で知られた方法を用いる、経口、鼻腔、直腸、経粘膜、経皮、または腸投与、筋肉内、皮下、脊髄内注射を含めた非経口送達、ならびにクモ膜下腔内、直接的心室内、静脈内、腹腔内、鼻腔内、肺内(吸入)または眼内注射を含む。他の適当な投与経路はエアロゾルおよびデポ処方物である。本発明の医薬の徐放性処方物、特に、デポ剤が明示的に考えられる。ある好ましい実施形態において、本発明による化合物は経口投与される。本発明による化合物は、錠剤、カプセル、粉末、シロップ、エリキシルなど、エアロゾル、滅菌溶液、懸濁液またはエマルジョンなどのような個体または液体形態で作製することができる。ある実施形態において、GPR119アゴニストは経口投与される。
【0315】
経口投与のための処方は、固体の錠剤およびカプセル処方物に加えて、水性溶液および懸濁液の形態とすることができる。水性溶液および懸濁液は滅菌粉末または顆粒から調製することができる。化合物は水、ポリエチレングリコール、プロピレングリコール、エタノール、トウモロコシ油、綿実油、落花生油、ゴマ油、ベンジルアルコール、塩化ナトリウム、および/または種々の緩衝液に溶解させることができる。他の補助剤は当該分野でよくかつ広く知られている。
【0316】
GPR119アゴニストの医薬組成物は、例えば、慣用的な混合、溶解、造粒、糖衣−作製、混練、乳化、カプセル化、包みこみ、凍結乾燥プロセスまたは噴霧乾燥によって、当該分野で良く知られた方法によって調製することができる。
【0317】
本発明に従って用いる医薬組成物は、医薬的に用いることができる製剤への活性化合物の加工を容易とする賦形剤および補助剤を含む1以上の生理学的に活性な担体を用いる慣用的な方法で処方することができる。適当な医薬上許容される担体は当業者に利用可能である(例えば、その各々の開示をここで引用してその全体を援用するRemington:The Science and Proctice of Pharmacy,(Gennaro et al.,eds.),20th Edition,2000,Lippincott Williams & Wilkins;and Handbook of Pharmaceutical Excipients(Rowe et al.,eds),4th Edition,2003,Pharmaceutical Press参照)。適当な処方は、選択された投与の経路に依存する。用語「担体」物質または「賦形剤」物質は、本明細書中においては、担体および/または希釈剤および/または補助剤、または治療剤の対象への送達のためのビヒクルとして用いられるため、またはその取扱いまたは貯蔵特性を改良するため、あるいは経口投与に適したカプセルまたは錠剤のような区別される製品への組成物の投与単位の形成を可能とするため、または容易とするために医薬組成物に加えられるそれ自体は治療剤でないいずれの物質も意味する。賦形剤は、例示として、限定されるものではないが、希釈剤、崩壊剤、結合剤、接着剤、湿潤剤、ポリマー、滑沢剤、グライダント、不快な味または匂いをマスクするかまたはそれに逆作用させるために加えられる物質、フレーバー剤、色素、フラグランス、および組成物の外観を改良するために加えられる物質を含むことができる。許容される賦形剤はステアリン酸、ステアリン酸マグネシウム、酸化マグネシウム、リン酸および硫酸のナトリウムおよびカルシウム塩、炭酸マグネシウム、タルク、ゼラチン、アカシアガム、アルギン酸ナトリウム、ペクチン、デキストリン、マンニトール、ソルビトール、ラクトース、スクロース、デンプン、ゼラチン、アルカン酸のセルロースエステルおよびセルロースアルキルエステルのようなセルロース物質、低融解ワックスカカオ脂または粉末、ポリビニル−ピロリドン、ポリビニルアルコール、およびポリエチレングリコールのようなポリマー、および他の医薬上許容される物質を含む。医薬組成物の成分は簡便な投与のためにカプセル化し、または錠剤化することができる。
【0318】
医薬上許容されるとは、薬理学的/毒物学的観点から患者に、および組成、処方、安定性、患者の許容性および生物学的利用性に関する物理的/化学的観点から製薬化学者に許容される特性および/または物質をいう。
【0319】
糖衣コアには適当なコーティングを施す。この目的では、濃縮糖溶液を用いることができ、これは、所望により、アラビアガム、タルク、ポリビニルピロリドン、カルボポルゲル、ポリエチレングリコールおよび/または二酸化チタン、ラッカー溶液、および適当な有機溶媒または溶媒混合液を含有してもよい。色素または顔料を、活性化合物の用量の異なる組合せを識別するためまたは特徴付けるために錠剤または糖衣コーティングに加えてもよい。
【0320】
経口的に用いることができる医薬組成物はゼラチンで作成されたプッシュ−フィットカプセル、ならびにゼラチン、およびグリセロールまたはソルビトールのような可塑剤で作製された柔軟なシールされたカプセルを含む。プッシュ−フィットカプセルはラクトースのような充填剤、デンプンのようなバインダーおよび/またはタルクまたはステアリン酸マグネシウムのような滑沢剤および、所望により、安定化剤と混合された有効成分を含有することができる。柔軟なカプセルにおいては、活性な化合物を脂肪油、流動パラフィン、液体ポリエチレングリコール、クレモフォール、カプムル、中鎖または長鎖モノ−、ジ−またはトリグリセリドのような適当な液体に溶解または懸濁することができる。また、安定化剤をこれらの処方物に加えることもできる。
【0321】
加えて、GPR119アゴニストは徐放系を用いて送達することができる。種々の徐放性物質は確立されており、当業者によく知られている。徐放性カプセルは特に好ましい。例えば、グリセリルモノステアレートまたはグリセリルジステアレート時間遅延物質を使用することができる。該投与形態は米国特許第4,256,108号、第4,166,452号、および第4,265,874号に記載された技術によって被覆して、制御放出のための浸透圧治療錠剤を形成することもできる。
【0322】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、単独で、あるいは1以上の他の医薬または生理学的な活性な化合物と組み合わせて投与し、または供することができる。本発明の1つの態様において、他の医薬上または薬理学上許容される化合物はGPR119アゴニストではない。本発明の1つの態様において、他の医薬上または生理学上許容される化合物はカルシウム、ビタミンD、エストロゲン、チボロン、選択的エストロゲン受容体モジュレーター(SERM:例えば、ラロキシフェン、タモキシフェン)、ビホスホネート(例えば、エチドロネート、アレンドロネート、リセドロネート)、カルシトニン、ビタミンDの1α−、ヒドロキシル化代謝産物、フッ化物、チアジド、同化ステロイド、イプリフラボン、ビタミンK、副甲状腺ホルモン(PTH)、ストロンチウム、スタチン、オステオプロテレシン、EP4受容体選択的アゴニスト、カンナビノイド受容体タイプ2(CB2)選択的アゴニストおよびp38 MAPキナーゼ阻害剤より成る群から選択される医薬剤である。(例えば、World Health Organization Technical Report Series 921(2003),Prevention and Management of Osteoporosis参照)。
【0323】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの実施形態において、本発明は、一定量の本発明によるGPR119アゴニスト、および少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。
【0324】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの態様において、本発明は、一定量の本発明によるGPR119アゴニスト、および少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。または、本発明は、GPR119アゴニストは骨粗鬆症のような低骨質量によって特徴付けられる状態を治療し、または予防するにおいて、および/または個体において骨質量を増加させるにおいて、効果を生じるに十分な量である組成物または医薬組成物の投与形態にも関する。
【0325】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストおよび少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。また、本発明はGPR119アゴニストが、個体においてGIPレベルを増加させるにおいて効果を生じるのに十分な量である組成物、または医薬組成物の投与形態にも関する。
【0326】
本発明で用いるのに適当な医薬組成物は、それらの意図した目的を達成する量で含有された組成物を含む。いくつかの実施形態において、本発明の医薬組成物は、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防するのに、または個体において骨質量を増加させるのに有用であると理解される。低骨質量によって特徴付けられる状態は、本発明に従うものである。いくつかの実施形態において、本発明の医薬組成物は個体においてGIPレベルを増加させるのに有用であると理解される。本発明に関するように、本発明による意図した目的を達成するのに十分なGPR119アゴニストの量の決定は、特に、ここで提供する詳細な開示に照らして、十分に当業者の能力内のものである。
【0327】
限定されるものではないが、マウス、ラット、ウサギ、ブタ、および非−ヒト霊長類を用いる実験を含めた、動物実験から得られたデータは、ヒトで用いられる一定範囲の用量を処方するのに用いることができる。一般に、当業者であれば、どのようにして動物モデル系で得られたイン・ビボデータをヒトのようなもう一つの動物に外挿するかを理解している。いくつかの状況において、これらの外挿が、ヒトのようなもう一つの動物と比較した、動物モデルの体重に単に基づくことができ;他の状況においては、これらの外挿は単に体重に基づくものではなく、むしろ種々の因子を取り込むものである。代表的な因子は、患者のタイプ、年齢、体重、性別、食餌および医学的状態、疾患の重症度、投与の経路、治療する特定の化合物の活性、効率、薬物動態学プロフィールおよび毒性学プロフィールのような薬理学的考慮、薬物送達系が利用されるか否か、急性または慢性のいずれの疾患状態が治療または予防が行われるか、あるいは本発明の化合物に加えて、および薬物組合せの一部としてさらなる活性化合物が投与されるか否かを含む。本発明の化合物および/または組成物で疾患状態を治療するための投与養生法は、上記した種々の因子に従って選択される。したがって、使用される現実の投与養生法は広く変動する可能性があり、従って、好ましい投与養生法から隔たる可能性があり、当業者であれば、これらの典型的な範囲外の投与および投与養生法をテストすることができ、適切であれば本発明の方法で用いることができるのを認識するであろう。
【0328】
例示的な動物モデル系はラット卵巣摘出(OVX)骨喪失モデルである。卵巣摘出ラットは、エストロゲン枯渇ヒト骨格筋の重要な臨床的特徴、および治療剤の応答を正しくエミュレートする優れた前臨床動物モデルである。このモデルにおいては、卵巣摘出に関連する骨喪失は部分的にまたは完全に妨げられる場合に、治療効果が達成される(例えば、Bollag et al,Mol Cell Endocrinol(2001)177:35−41;およびJee et al,J Musculoskel Neuron Interact(2001)1:193−207参照)。いくつかの実施形態において、卵巣摘出に関連する骨喪失は少なくとも約10%妨げられ、少なくとも約20%妨げられ、少なくとも約30%妨げられ、少なくとも約40%妨げられ、少なくとも約50%妨げられ、少なくとも約60%妨げられ、少なくとも約70%妨げられ、少なくとも約75%妨げられ、少なくとも約80%妨げられ、少なくとも約85%妨げられ、少なくとも約90%妨げられ、少なくとも約95%妨げられ、または100%妨げられる場合に治療効果が達成される。
【0329】
さらなる例示的な動物モデル系は、マウスにおけるグルコースチャレンジ後の血中GIPレベルの増加である。ある実施形態において、血中GIPレベルは血漿中GIPレベルである。ある実施形態において、GIPレベルはグルコース−非依存性GIPレベルである。ある実施形態において、GIPレベルはグルコース−非依存性GIPレベルである。ある実施形態において、GIPは合計GIPである。ある実施形態において、合計GIPは、中央に向けられたアッセイ、またはC−末端に向けられたアッセイを用いて決定される。ある実施形態において、GIPは生物活性GIPである。ある実施形態において、生物活性GIPはN−末端特異的アッセイを用いて決定される。ある実施形態において、生物活性GIPは骨形成を促進するための活性を有する。ある実施形態において、治療効果は、血中GIPレベルが少なくとも約10%、少なくとも約25%、少なくとも約50%、少なくとも約100%、少なくとも約150%、少なくとも約200%、少なくとも約300%、少なくとも約400%、少なくとも約500%増加する場合に達成される。
【0330】
投与量および間隔を調整して意図した治療効果を供することができる。本発明によるGPR119アゴニストの正確な用量はGPR119アゴニスト、その能力、投与の形態、患者の年齢および体重、および治療すべき状態の重症度に依存して変化するであろう。正確な処方、投与の経路、および用量は、患者の状態を考慮して個々の意思によって選択され得る。説明として、限定されるものではないが、本発明によるGPR119アゴニストの量は約0.001mg/kg未満、約0.005mg/kg未満、約0.01mg/kg未満、約0.05mg/kg未満、約0.1mg/kg未満、約0.5mg/kg未満、約1mg/kg未満、約5mg/kg未満、約10mg/kg未満、約50mg/kg未満、または約100mg/kg未満である。ある実施形態において、本発明によるGPR119アゴニストの量は約0.001〜100mg/kg体重未満、約0.001〜50mg/kg体重未満、約0.001〜10mg/kg体重未満、約0.001〜5mg/kg体重未満、約0.001〜1mg/kg体重未満、約0.001〜0.5mg/kg体重未満、約0.001〜0.1mg/kg体重未満、約0.001〜0.05mg/kg体重未満、約0.001〜0.01mg/kg体重未満、または約0.001〜0.005mg/kg体重未満である。
【0331】
毎日または規則的ベースで投与して所望の結果を達成することができる、本発明のモジュレータ(例えば、GPR119アゴニスト)の量についての好ましい用量範囲は0.1〜100mg/kg体重である。他の好ましい用量範囲は0.1〜30mg/kg体重である。他の好ましい用量範囲は0.1〜10kg/mg体重である。他の好ましい用量範囲は0.1〜3.0kg/mg体重である。もちろん、これらの日用量は、1日の間に周期的に少量ずつ送達、投与することができる。これらの用量範囲は好ましい範囲にすぎず、本発明を限定するつもりはないことを注記する。
【0332】
投与量および間隔は個々に調整して、意図した治療効果を達成する、本発明によるGPR119アゴニストの血漿中レベルを供することができる。投与の間隔は、選択された範囲のGPR119アゴニスト濃度についての値を用いて決定して、意図した治療効果を達成することもできる。GPR119アゴニストは、時間の10〜90%の間の、好ましくは、時間の30〜99%の間の、最も好ましくは時間の50〜90%の間のGPR119アゴニスト濃度の選択された範囲内に血漿中レベルを維持する養生法を用いて投与すべきである。局所的投与または選択的摂取の場合には、意図した治療効果を供するGPR119アゴニスト濃度の範囲は、血漿中濃度に関連しなくてもよい。
【0333】
投与される組成物の量はもちろん、治療すべき個体、個体の体重、疾患の重症度、投与の様式、および処方する医師の判断に依存するであろう。
【0334】
1つの態様において、本発明は、従って、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる、治療有効量の組成物をそれを必要とする個体に投与することを含む、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防し、または骨質量を増加させる方法をその要旨とする。他の実施形態において、該組成物は医薬組成物である。
【0335】
1つの態様において、本発明は、治療有効量の、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をそれを必要とする個体に投与することを含む、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防し、または骨質量を増加させる方法に関する。関連する態様において、本発明は、GPR119アゴニストが、個体においてGIPレベルを増加させるにおいて効果を与えるのに十分な量で投与される該方法をその要旨とする。ある実施形態において、該組成物は医薬組成物である。
【0336】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、個体において低骨質量によって特徴付けられる状態を治療または予防するにおいて、および個体において骨質量を増加させるのに有用である。
【0337】
低骨質量によって特徴付けられる状態は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出術骨喪失、子供時代の特発性骨喪失、パジェット病、転移性癌による骨喪失、骨溶解病巣、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、低骨質量によって特徴付けられる状態は骨粗鬆症である。ある実施形態において、低骨質量において特徴付けられる状態は骨粗鬆症である。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。低骨質量によって特徴付けられる状態は、限定されるものではないが、脊髄の湾曲、身長の喪失、および補鉄外科的処置のような骨粗鬆症の長期合併症も含む。低骨質量によって特徴付けられる状態は個々に、あるいはいずれかの組合せにて実施形態に含むことができると理解される。ある実施形態において、低骨質量によって特徴付けられる状態は一次骨粗鬆症である。
【0338】
ある実施形態において、増大した骨質量を必要とする個体は、若い成人参照平均の下で1を超える(T−スコア<−1)、1.5を超えるまたはそれと等しい(T−スコア≦―1.5)、2よりも大きな、またはそれと等しい(T−スコア≦−2)または2.5よりも大きな、またはそれと等しい(T−スコア≦−2.5)標準偏差の骨ミネラル密度(BMD)を有する。ある実施形態において、増加した骨質量を必要とする個体は骨折の治療を必要としている。ある実施形態において、骨折の治療を必要とする個体は外傷骨折、長期骨折、または骨粗鬆症骨折を有する。ある実施形態において、個体は骨疾患についての治療を必要としている。ある実施形態において、骨疾患に対する治療を必要とする個体は骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出術骨喪失、子供時代の特発性骨喪失、パジェット病、転移性癌による骨消失、骨溶解病巣、脊髄の湾曲、または身長の喪失を有する。ある実施形態において、骨疾患に対する治療を必要とする個体は骨粗鬆症を有する。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。本発明に従って治療することができる破壊的骨障害は、限定されるものではないが、骨粗鬆症、変形性関節症、および新形成病、放射線療法、または化学療法によって引き起こされるような骨溶解病巣を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。
【0339】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、顔面再形成、上顎再形成、下顎再形成、歯周状態または抜歯後の骨治癒、長骨延長の増強、補鉄内部成長の増強または個体における骨結合の増加で有用である。
【0340】
ある実施形態において、個体は脊椎動物である。ある実施形態において、脊椎動物である個体は魚類、両生類、爬虫類、鳥類または哺乳動物である。ある実施形態において、個体または脊椎動物は哺乳動物である。ある実施形態において、哺乳動物である個体または脊椎動物はマウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト哺乳動物、非−ヒト霊長類、またはヒトである。ある実施形態において、個体はヒトである。ある実施形態において、ヒトは閉経後の婦人、または50歳を超える男性である。
【0341】
さらなる努力を必要とせず、当業者であれば、これまでの記載を用い、本発明をその最大限まで実施することができると考えられる。こ本発明の範囲内にある改変は当業者に明らかとなるように、れまでの詳細な記載は理解の明瞭性のみのために掲げるものであり、不必要な限定と理解されるべきでない。
【0342】
本出願は、示された日付に合衆国特許商標局に合衆国速達便を介して出願された以下の仮特許出願からの優先権の利益を主張する:2006年4月11日に出願された米国仮特許出願番号60/791,550。上記仮特許出願の開示を、ここで、引用してその全体を援用する。
【0343】
本出願を通じて、種々の刊行物、特許および特許出願が引用される本出願中で引用されたこれらの刊行物、特許および特許出願の開示をここで引用してその全体を本開示に援用する。刊行物、特許または特許出願の出願人によるここでの引用は、該刊行物、特許または特許出願の出願人による先行技術としての自認ではない。
【実施例】
【0344】
さらなる努力を必要とせず、当業者であれば、これまでの記載を用いて本発明をその最大限まで実施することができる。以下の詳細な実施例は、単なる説明として解釈されるべきであり、断じてこれまでの開示を限定するものではない。当業者であれば、該手法から適当な変形をすぐに認識するであろう。
実施例1:野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析
A.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに帰属させた。図1Aに示すように、マウスにビヒクル(PET;80%PEG400、10%エタノール、10%Tween 80)を、または20mg/kgの本発明によるGPR119アゴニスト(化合物1;(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン)を経口投与した。処理から30分後、3g/kgのグルコースボーラスを経口送達し、グルコースボーラス後0(グルコースボーラスなし)、2、5、10、20、40および60分に血漿を収集した。供給業者によって供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。図1Aに示された結果から、GPR119アゴニストの投与は、マウスの血液中でのGIPのグルコース−依存性およびグルコース−非依存性の双方のレベルを増加させたことは明らかである。化合物1はマウスにおいて血漿中の全GIPを刺激した。化合物1は、国際特許出願番号PCT/US2004/001267(WO 2004/065380)として公開)に開示された化合物と同一である。
B.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに帰属させた。図1Bに示すようにマウスに、ビヒクル(20%ヒドロキシプロピル−β−シクロデキストリン(HPCD))を、または10mg/kgの本発明によるGPR119アゴニスト(化合物3)を経口投与した。処理から30分後に3g/kgのグルコースボーラスを経口送達し、グルコースボーラスから0(グルコースボーラスなし)、5、10、20、60および120分において血漿を収集した。供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入されたげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。統計学的分析を、Excelプログラムを用いて行った。GIP濃度の平均値は、各群における6匹のマウスでの結果に基づいて計算し、平均±SEMとして示される。図1Bに示される結果より、GPR119アゴニストの投与は、マウスの血液中におけるGIPのグルコース−依存性、およびグルコース−非依存性の双方のレベルを増大させたことは明らかである。化合物3は、マウスにおいて血漿中合計GIPを刺激した。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647)として公開)に開示された化合物と同一である。
C.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに割り当てた。マウスにビヒクル(20%ヒドロキシプロピル−β−シクロデキストリン(HPCD))を、または1、3、または10mg/kgの本発明によるGPR119アゴニスト(化合物3)を経口投与した。処理から30分後に3g/kgのグルコースボーラスを経口送達し、血漿をグルコースボーラス後0(グルコースボーラスなし)または5分において収集した。供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。GIP濃度の平均値を各群において6匹のマウスでの結果に基づいて計算し、図1Cに示す。図1Cから、GPR119アゴニスト(化合物3)はマウスにおいて用量依存的に血漿中合計GIPを刺激したのは明らかである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
実施例2:野生型マウスと比較したGPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果
A.GPR119−欠損雄マウスおよび野生型同腹子を18時間絶食させた。マウスに、示したように(n=5)、ビヒクル(PET;80%PEG400、10%エタノール、10%Tween80)を、または20mg/kgの本発明によるGPR119アゴニスト(化合物1;(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン)を経口投与した。処理から30分後に、眼の眼球後静脈を介して血液(100μL)を収集し(時刻0)、続いて、3g/kgのグルコースボーラスを与えた(経口)。グルコース送達から5分後に、もう一つの血液試料(100μL)を収集した(時刻5分)。血漿を遠心後に収集し、製造業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによってGIPレベルを決定した。図2Aに示される結果より、機能的GPR119受容体が、マウスの血液中にてGIPのグルコース−非依存性レベルおよびグルコース依存性レベルを増加させるための投与されたGPR119アゴニストで必要であったことが明らかである。化合物1は野生型マウスにおける血漿中合計GIPを刺激した。化合物1は、国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)で開示された化合物と同一である。
B.GPR119欠損雄マウスおよび野生型同腹子を18時間絶食させた。マウスに、示されたように(n=5)、ビヒクル(40%ヒドロキシプロピル−ベータ−シクロデキストリン(HPCD))を、または30mg/kgの本発明によるGPR119アゴニスト(化合物2)を経口投与した。処理から30分後に、血液(100μL)を眼の眼球後静脈を介して収集し(時刻0)、続いて3g/kgのグルコースボーラスを(経口)投与した。グルコース送達から5分後に、もう一つの血液試料(100マイクロリットル)を収集した(時刻5分)。遠心後に血漿を収集し、供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入されたげっ歯類GIP ELISAキットを用いることによってGIPレベルを決定した。GIP濃度の平均値は、各群において5匹のマウスでの結果に基づいて計算した。図2Bに示された結果から、投与されたGPR119アゴニストがマウスの血液中でのGIPのグルコース−非依存性レベルおよびグルコース−依存性レベルを増加させるために、機能的GPR119受容体がで必要であったことは明らかである。化合物2は野生型マウスにおいて血漿中合計GIPを刺激した。化合物2は国際特許出願番号PCT/US2004/022417(WO2005/007658として公開)に開示された化合物と同一である。
実施例3:卵巣摘出ラットにおける骨質量に対するGPR119アゴニストの投与の効果
本発明によるGPR119アゴニストは、後に記載するイン・ビボ卵巣摘出(OVX)ラットモデル(例えば、Bollag et al.,Mol Cell Endocrinol(2001)177:35−41参照)を用いて、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防することにおいて、および/または個体において骨質量を増加することにおいて効果的であることを示すことができる。
【0345】
8週齢の20匹の雌OVXおよび20匹の非−OVX Sprague−Dawley処女ラット(150〜175g)はHarlan Sprague−Dawley,Inc.(Indianapolis,IN)から購入する。動物に自由に通常の市販のペレット食餌Teklab Rodent食餌(1.46%カルシウム)を与え、水に自由にアクセスさせた。ラットを4つの体重がマッチした実験群にランダムに分割し、ビヒクル、または本発明によるGPR119アゴニストを経口的に受けるように選択する。処理は6週間の間、毎日ベースで継続する。
【0346】
1.対照。10匹の非−OVXラットにビヒクルを経口投与する。
【0347】
2.対照+処理。10匹の非−OVXラットにGPR119アゴニストを経口投与する。
【0348】
3.OVX。10匹のOVXラットにビヒクルを経口投与する。
【0349】
4.OVX+処理。10匹のOVXラットにGPR119アゴニストを経口投与する。ラットの体重を毎日計り、ベースラインにおいて、および6週間に再度身長を決定する。Hologic QDR1000/W(Waltham,MA)を用いるデュアルエネルギーX線吸収測定(DXA)を、処理の開始に先立って、および6週間において全ての動物で行い、ソフトウェアRat Whole Bodyバージョン5.53を用いてデータを分析する。骨ミネラル密度(BMD)を脊髄において決定する。
【0350】
処理から6週間後における脊椎動物の骨密度の%変化を決定する。GPR119アゴニストの投与は脊椎動物骨密度に対する卵巣摘出の負の効果を減衰させることが示される。脊椎動物骨密度に対する卵巣摘出の負の効果の減衰は、骨粗鬆症のような低骨密度によって特徴付けられる状態を治療および予防するのに、および/または個体において骨密度を増加させることにおいて効果を有する処理を示す。
実施例4:骨折治癒に対するGPR119アゴニストの投与の効果
本発明によるGPR119アゴニストは、後に記載するイン・ビトロアッセイを用いる骨折の治療で効果的であることを示すことができる。
骨折技術
3箇月齢のSprague−Dawleyラットをケタミンで麻酔する。右側脛骨、大腿骨の近位部分の前内側態様で1cm切開を行う。以下に脛骨外科的技術を記載する。切開を骨に至るまで行い、前側隆起に対して2mm内側の脛骨粗面の末端側態様に対して4mm近位にて1mm穴をドリルで開ける。脊髄内ネイリングを0.8mmステンレス鋼チューブで行う(最大負荷36.3N、最大硬さ61.8N−mm、骨と同一の条件下でテスト)。脊髄管のリーマ通しは行わない。標準化された閉鎖骨折が、平坦な顎をもつ特別に設計された調整可能な鉗子を用いる3点の曲げによって脛腓接合から2mm上方に生じる。柔軟組織の損傷を最小化するために、骨折を変位させないように注意を払う。皮膚をモノフィラメントナイロン縫合糸で閉じる。滅菌条件下で手術を実行する。全ての骨折のX線写真撮影はネイリング直後に取り、特定の骨幹領域の外側の骨折、または変位した爪を持つラットは排除する。残りの動物を、骨折治癒をテストするための時点当たりの各亜群当たり10〜12匹の動物を含む以下の群にランダムに分ける。ラットにビヒクルまたはGPR119アゴニストを日ベースで経口投与する。GPR119アゴニストは0.001mg/kg体重および100mg/kg体重の間の量で用いる。処理は10、20、40および80日の間継続する。
【0351】
10、20、40および80日において、各群からの10〜12匹のラットをケタミンで麻酔し、放血によって屠殺する。脛腓骨双方を切開によって取り出し、全ての柔軟組織を切片とする。各群について5〜6匹のラットからの骨を組織学的分析のために70%エタノール中で保存し、各群についてもう1つの5〜6匹のラットからの骨を、実行するX線写真および生体力学テストのために緩衝化されたリンゲル液中に保存する(+4℃,pH7.4)。
組織学的分析
骨折した骨の組織学的分析のための方法は、Mosekilde and Bak(Bone(1993)14:19−27)によって従前に公表されている。簡単に述べれば、骨折部位を骨折線の各側に対して8mm鋸でひき、メタクリル酸メチル中に脱石灰化せずに包埋し、Reichert−Jung Polycutミクロトームで前方セクションを8μm厚に切断する。(脛骨および腓骨双方を含めた)マッソン−トリクローム染色中央−前方セクションを、処置の有りおよび無しにて骨折治癒に対する細胞および組織応答の可視化のために用いる。シリウスレッド染色セクションを用いてカルス構造の特徴を示し、骨折部位における織られた骨(woven bone)とラメラ骨(lamellar bone)の間を識別する。以下の決定を行う:(1)骨折ギャップ(骨折における骨髄質端部の間の最も短い距離として決定される)、(2)カルス長さおよびカルス直径、(3)カルスの合計骨容量領域、(4)カルス領域の内側の組織面積当たりの骨組織、(5)カルスにおける繊維状組織、(6)カルスにおける軟骨領域。
生体力学分析
生体力学分析のための方法はBak and Andreassen(Calcif Tissue Int(1989)45:292−297)によって従前に公表されている。簡単に述べると、全ての骨折のX線写真は生体力学テストに先立って撮られる。治癒骨折の機械的特性は破壊的3−または4−点曲げ手法によって分析する。最大負荷、硬さ、最大負荷におけるエネルギー、最大負荷における撓みおよび最大ストレスを決定する。
実施例5
内因性ヒトGPR119の全長クローニング
内因性ヒトGPR119をコードするポリヌクレオチドは、GPR119特異的プライマー
【0352】
【化4】

および鋳型としてヒトゲノムDNAを用いるPCRによってクローン化した。TaqPlus PrecisionTM DNAポリメラーゼ(Stratagene)を工程2〜工程4を35回反復する以下のサイクルによる増幅で用いた:94℃、3分;94℃、1分;58℃、1分;72℃、2分;72℃、10分。予測されたサイズの1.0Kb PCR断片を単離し、pCRII−TOPOTM ベクター(Invitrogen)にクローン化し、T7 DNAシークエナーゼキット(Amersham)を用いて完全に配列決定した。核酸配列については配列番号1および推定されるアミノ酸配列については配列番号2参照。
実施例6
受容体の発現
種々の細胞がGプロテイン−結合受容体の発現について当該分野で利用可能であるが、真核生物細胞を利用するのが最も好ましい。ある実施形態において、哺乳動物細胞またはメラニン保有細胞を利用する。以下に例を示す;当業者には、当業者の必要性のため優先的に有利である技術を決定する能力が保証されている。例えば、それがメラニン保有細胞に関する場合、後記実施例9参照。
A.一過的トランスフェクション
1日目に、293細胞の6x106/10cm皿を平板培養する。2日目に、2つの反応チューブを調製し(各チューブについて以下の割合はプレート当たりである):チューブAは、0.5mLの無血清DMEM(Gibco BRL)中で4μg DNA(例えば、pCMVベクター;受容体cDNAなどを持つpCMVベクター)を混合することによって調製し;チューブBは0.5mLの無血清DMEM中で24μLのリポフェクタミン(Gibco BRL)を混合することによって調製する。チューブAおよびBは倒置(数回)によって混合し、引き続いて室温で30〜35分間インキュベーションする。該混合物を「トランスフェクション混合物」という。平板培養した293細胞を1×PBSで洗浄し、続いて5mLの無血清DMEMを加える。1mLのトランスフェクション混合物を細胞に加え、続いて、37℃/5%CO2において4時間インキュベートする。トランスフェクション混合物を吸引によって取り出し、続いて、10mLのDMEM/10%で胎児ウシ血清を加える。細胞を37℃/5% CO2でインキュベートする。48時間のインキュベーションの後に、細胞を収穫し、分析で利用する。
b.安定な細胞系
ほぼ12×106 293細胞を15cm組織培養プレート上で平板培養し、10パーセントの胎児ウシ血清および1パーセントのピルビン酸ナトリウム、L−グルタミン、抗生物質を含有するDME高グルコース培地中で培養する。293細胞の平板培養から24時間後に(または約80%密集)、細胞を12μgのDNA(例えば、受容体cDNAを持つpCMV−neorベクター)を用いて細胞をトランスフェクトする。12μgのDNAを、60μLのリポフェクタミン、および血清を含まない2mLのDME高グルコース培地と組み合わせる。該培地をプレートから吸引し、細胞を血清を含まない培地で1回洗浄する。DNA、リポフェクタミンおよび培地混合物を、血清無しの10mLの培地と共に平板培養する。37℃における4〜5時間のインキュベーションの後、培地を吸引し培地を25mLの血清を含有する培地を加える。トランスフェクションから24時間後に培地を再度吸引し、血清を含む新鮮な培地を加える。トランスフェクションから48時間後に培地を吸引し、ほぼ12×106 293細胞の最終濃度にてゲンタマイシン(G418薬物)を含有する血清を含む培地を加え、15cm組織培養プレート上で平板培養する。10パーセントの胎児ウシ血清および1パーセントのピルビン酸ナトリウムL−グルタミン、および抗生物質を含有するDME高グルコース培地中で増殖させる。293細胞の平板培養から24時間後に(または約80%密集まで)、12μgのDNA(例えば、受容体cDNAを持つpCMVベクター)を用いて細胞をトランスフェクトする。12μgのDNAを60μLのリポフェクタミンおよび血清を含まない2mLのDME高グルコース培地と合わせる。培地をプレートから吸引し、細胞を血清無しの培地で一回洗浄する。DNA、リポフェクタミン、および培地混合物を、血清を含まない10mLの培地と共にプレートに加える。37℃における4〜5時間のインキュベーションに続き培地を吸引し血清を含有する25mLの培地を加える。トランスフェクションから24時間後に培地を再度吸引し血清を含む新鮮な培地を加える。トランスフェクションから28時間後に、培地を吸引し、500μg/mLの最終濃度にてゲンタマイシン(G418薬物)を含有する血清を含む培地を加える。トランスフェクトされた細胞は、ここで、G418耐性遺伝子を含有する正にトランスフェクトされた細胞についての選択を受ける。選択が起こるに連れて、培地を4〜5日ごとに交換する。選択の間、細胞を増殖させて、安定なプールを作製し、または安定なクローン選択のために分割する。
実施例7
例えば、GPR119アゴニストとしての候補化合物をスクリーニングするためのアッセイ
例えば、GPR119アゴニストとしての候補化合物をスクリーニングするのに、種々のアプローチが利用可能である。以下に例を示す;当業者は、当業者の必要性について優先的に有利である技術を決定する能力が保証されている。Gプロテイン−結合受容体のアゴニストとしての化合物をスクリーニングするためのアッセイは当業者によく知られている(例えば、国際出願WO 02/42461参照)。
1.膜結合アッセイ:[35S]GTPγSアッセイ
Gプロテイン−結合受容体がその活性な状態にある場合、リガンド結合または構成的活性化の結果としてのいずれかで、受容体がGプロテインに結合し、GDPの放出、および引き続いてのGTPのGプロテインへの結合を刺激する。Gプロテイン−結合受容体複合体アルファサブユニットはGTPaseとして作用し、GTPをGDPへとゆっくりと加水分解しその時点において受容体は通常は脱活性化される。活性化された受容体はGTPの代わりにGDPで継続的に置き換える。加水分解不能GTPアナログである[35S]GTPγSを利用して、活性化された受容体を発現する膜への[35S]GTPγSの増強された結合を示すことができる。活性化を決定するために[35S]GTPγS結合を用いる利点は;(a)それは全てのGプロテイン−結合受容体に総括的に適応可能であり;(b)それは膜表面において近位であることにより、細胞内カスケードに影響する分子を余りピックアップしないようにする。
【0353】
該アッセイは、関連受容体を発現する膜への[35S]GTPγS結合を刺激するGプロテイン結合受容体の能力を利用する。該アッセイは総括的であって、全てのGプロテイン−結合受容体において薬物発見への適用を有する。
膜調製物
いくつかの実施形態において、本発明のGプロテイン−結合受容体を含み、かつ例えば、受容体のアゴニストとしての候補化合物の同定で用いる膜は好ましくは以下のように調製される;
a.材料
「膜掻き取り緩衝液」は20mM HEPESおよび10mM EDTA、pH7.4よりなり:
「膜洗浄緩衝液」は20mM HEPESおよび0.1mM EDTA、pH7.4よりなり;
「結合緩衝液」は20mM HEPES、100mM NaCL、および10mM MgCl2 pH7.4よりなる。
b.手法
全ての材料は該手法を通じて氷上に維持される。最初に、培地を細胞の密集単層から吸引し、続いて、10mL冷PBSで濯ぎ、続いて吸引する。その後、5mLの膜掻取緩衝液を加えて、細胞を掻き取り;これに続いて、細胞抽出物を50mLの遠心管に移動させる(4℃において20,000rpmで17分間遠心)。しかる後、上清を吸引し、ペレットを30mLの膜洗浄緩衝液に再度懸濁させ、続いて、20,000rpmにおいて4℃にて17分間遠心する。次いで、上清を吸引し、ペレットを結合緩衝液に再度懸濁させる。次いで、Brinkman PolytronTMホモゲナイザーを用いてこれをホモゲナイズする(全ての材料が懸濁するまでに15〜20秒のバースト)。これを本発明においては「膜蛋白質」という。
ブラッドフォード蛋白質アッセイ
ホモゲナイゼーションに続いて、膜の蛋白質濃度をブラッドファード蛋白質アッセイを用いて決定する(蛋白質を約1.5mg/mLまで希釈し、分注し、後に用いるために凍結することができ(−80℃);凍結する場合、用いるプロトコルは以下の通りとなろう:アッセイの日に、凍結された膜蛋白質を室温で解凍し、続いて、ボルテックスし、次いで、約12×1,000rpmにおいて約5〜10秒間Polytronでホモゲナイズする;複数の調製では、ホモゲナイザーを異なる調製物のホモゲナイゼーションの間に徹底的に洗浄すべきである)。
a.材料
(上記した)結合緩衝液;ブラッドフォード色素試薬;ブロッドフォード蛋白質標準は、製造業者の指示に従って利用する(Biorad,cat.no.500−0006)。
【0354】
b.手法
二連チューブを調製する。一つは膜を含み、一つは対照(ブランク)としてのものである。各々は800μLの結合緩衝液を含有するものであった。しかる後、10μLのブラッドフォード蛋白質標準(1mg/mL)を各チューブに加え、次いで、10μLの膜蛋白質をただ一つのチューブ(ブランクではない)に加える。しかる後、200μLのブラッドフォード色素試薬を各チューブに加え、続けて各々をボルテックスする。5分後にチューブを再度ボルテックスし、その中の材料をキュベットに移す。次いで、波長595において、CECIL 3041分光光度計で読み取る。
同定アッセイ
a.材料
GDP緩衝液は37.5mLの結合緩衝液および2mgのGDP(Sigma,cat.no.G−7127)よりなり、続いて、結合緩衝液中に系列希釈して、0.2μMのGDPを得る(各ウェル中のGDPの最終濃度は0.1μMのGDPであった);候補化合物を含む各ウェルは100μLのGDP緩衝液(最終濃度)0.1μL GDP、結合緩衝液中の50μLの膜蛋白質、および緩衝溶液中の50μL[35S]GTPγS(0.6nM)(10mL結合緩衝液当たり2.5μL[35S]GTPγS)よりなる200μLの最終容量を有する。
b.手法
候補化合物は、好ましくは、96−ウェルプレート様式を用いてスクリーニングする(これらを−80℃で凍結することができる)。膜蛋白質(または対照として、標的GPCRを排除する発現ベクターを含む膜)は、懸濁するまで軽くホモゲナイズする。次いで、上記したブラッドフォード蛋白質アッセイを用い、蛋白質濃度を決定する。次いで、膜蛋白質(および対照)を結合緩衝液中で0.25mg/mLまで希釈する(最終アッセイ濃度、12.5μg/ウェル)。しかる後、100mLのGDP緩衝液をWallac ScintistripTM(Wallac)の各ウェルに加えた。5μLのピン−ツールを用いて、5μLの候補化合物をそのようなウェルに移す(すなわち、200μLの合計アッセイ容量中の5μLは、候補化合物の最終スクリーニング濃度が10μMとなる1:40の比率である)。再度、汚染を回避するために、各移動工程の後に、水(1×)、エタノール(1×)、水(2×)を含む3つのレザバ中でピンツールを注ぐべきであり−過剰の液体を各濯ぎの後にツールから振り落とし、紙およびキムワイプで乾燥すべきである。その後、50μLの膜蛋白質を各ウェルに加え(標的GPCRを含まない膜を含む対照ウェルも利用した)、室温にて5〜10分間プレ−インキュベートした。しかる後、結合緩衝液中の50μLの[35S]GTPγS(0.6nM)を各ウェルに加え、続いて、室温にて60分間シェーカー上でインキュベートする(再度、本実施例においてはプレートをホイルで被覆する)。次いで、4000RPMにおける22℃での15分間のプレートの回転によってアッセイを停止させる。次いで、プレートを8チャネルマニホールドで吸引し、プレートカバーでシールする。次いで、(製造業者の指示のように)設定「Prot.#37」を用いてWallac 1450でプレートを読み取る。
2.アデニリルシクラーゼアッセイ
細胞−ベースのアッセイのために設計されたFlash PlateTM Adenylyl Cyclaseキット(New England Nuclear;Cat.No.SMP004A)は、粗製原形質膜で用いるために改変することができる。Flash Planteウェルは、cAMPを認識する特異的抗体も含有するシンチラントコーティングを含有することができる。ウェルで発生したcAMPは、cAMP抗体への放射性cAMPトレーサーの結合についての直接的競合によって定量することができる。以下は、受容体を発現する細胞におけるcAMPレベルの変化の決定用の簡単なプロトコルとして働く。
【0355】
ある実施形態において、改変されたFlash PlateTM Adenylyl Cyclaseキット(New England Nuclear;Cat.No.SMP004A)は、以下のプロトコルに従って、例えば、GPR119アゴニストとしての、候補化合物の同定で利用される。
【0356】
本発明のGプロテイン−結合受容体でトランスフェクトされた細胞は、トランスフェクションからほぼ3日後に収穫される。膜は、20mM HEPES、pH7.4および10mM MgCl2を含有する緩衝液中での懸濁化細胞のホモゲナイゼーションによって調製される。ホモゲナイゼーションは、Brinkman Polytronを用いて氷上でほぼ10秒間行う。得られたホモゲネートを49,000×gにおいて4℃にて15分間遠心する。次いで、得られたペレットを、20mM HEPES、pH7.4および0.1mM EDTAを含有する緩衝液に再懸濁させて、10秒間ホモゲナイズし、続いて、49,000×gにおいて4℃にて15分間遠心する。次いで、得られたペレットを利用するまで−80℃で保存する。直接的な同定スクリーニングの日に、膜ペレットを室温でゆっくりと解凍し、20mM HEPES、pH7.4および10mM MgCl2を含有する緩衝液に再懸濁し、0.60mg/mLの最終蛋白質濃度を得る(再懸濁させた膜を用いるまで氷上に置く)。
【0357】
cAMP標準、および(2μCiのトレーサー(11mL検出緩衝液に対し[125I]cAMP(100μL)))を含む)検出緩衝液を調製し、製造業者の指示に従って維持する。アッセイ緩衝液(20mM HEPES、pH7.4、10mM MgCl2 、20mMホスホクレアチン(Sigma)、0.1単位/mLクリアチンホスホキナーゼ(Sigma)、50μM GTP(Sigma)、および0.2mM ATP(Sigma)を含有するもの)をスクリーニングのために新たに調製し、次いで、アッセイ緩衝液を利用するまで氷上で保存した。
【0358】
候補化合物を、40μLの膜蛋白質(30μg/ウェル)および50μLのアッセイ緩衝液と共に、好ましくは、例えば、96−ウェルプレートのウェルに加える(3μL/ウェル:12μM最終アッセイ濃度)。次いで、温和に震盪しつつ、この混合物を室温にて30分間インキュベートする。
【0359】
インキュベーションに続き、100μLの検出緩衝液を各ウェルに加えて、続いて、2〜24時間インキュベートする。次いで、(製造業者の指示に従い)「Prot.#31」を用いてWallac MicroBetaTMプレートリーダーでプレートをカウントする。
3.CRE−Lucレポーターアッセイ
製造業者の指示に従い、293および293T細胞を、ウェル当たり2x104細胞の密度にて96ウェルプレート上で平板培養し、翌日、リポフェクタミン試薬(Lipofectamine Reagent)(BRL)を用いてトランスフェクトしたDNA脂質混合物を以下のように、各6−ウェルトランスフェクションのために調製する:100μLのDMEM中の260ngのプラスミドDNAを、100μLのDMEM中の2μLの脂質と温和に混合する(260ngのプラスミドDNAは、200ngの8×CRE−Lucレポータープラスミド、本発明のGプロテイン−結合受容体を含む50ngのpCMV、またはpCMV単独、および10ngのGPRS発現プラスミド(pcDNA3(Invitrogen)中のGPRSよりなる))。8×CRE−Lucレポータープラスミドは以下のように調製した:pβgal−Basic Bector(Clontech)中のBgIV−HindIII部位においてラットソマトスタチンプロモーター(−71/+51)をクローニングすることによって、ベクターSR1F−ベータ−galを得た。cAMP応答エレメントの8コピーは、アデノウィルス鋳型AdpCF126CCRE8[その開示をここで引用してその全体を援用する:Suzuki et al.,Hum Gene Ther(1996)7:1883−1893参照]からのPCRによって得られ、Kpn−BglV部位においてSRIF−β−galベクターにクローン化し、その結果、8×CRE−β−galレポーターベクターを得た。8×CRE−Lucレポータープラスミドは、8×CRE−β−galレポーターベクター中のベータ−ガクトシダーゼ遺伝子を、HindIII−BamHI部位において、pGL−3−Basic Bector(Promega)から得られたルシフェラーゼ遺伝子で置き換えることによって作製した。室温における30分間のインキュベーションの後、DNA/脂質化合物を400μLのDMEMで希釈し、100μLの希釈された混合物を各ウェルに加える。細胞培養インキュベーター中での4時間のインキュベーションの後に、10%FCSを含む100μLのDMEMを各ウェルに加える。翌日、トランスフェクトされた細胞を、10%FCSを含む200μL/ウェルのDMEMで交換する。8時間後に、PBSで1回洗浄した後に、ウェルをフェノールレッドを含まない100μL/ウェルのDMEMに交換する。製造業者の指示に従い、LucLiteTM レポーター遺伝子アッセイキット(Packard)を用い、ルシフェラーゼ活性を翌日に決定し、1450MicroBetaTM シンチレーションおよびルミネセンスカウンター(Wallac)で読む。
実施例8:例えば、GPR119アゴニスト活性についての全細胞アデニリルシクラーゼアッセイ
供給業者のプロトコルに従い、Flash PlateTM Adenylyl Cyclaseキット(New England Nuclear)で環状AMP決定を行う。HEK293細胞を、正規の増殖培地(DMEM/10%FBS)中にて、皿当たり12x106細胞にて、15−cm組織培養皿で平板培養する。翌日、製造業者のプロトコルに従い、10μgの空のベクターDNAまたは発現プラスミドDNAのいずれかをリポフェクタミン(Invitrogen,Carlsbad,CA)で細胞にトランスフェクトする。24時間の培養の後、トランスフェクトされた細胞をGIBCO細胞解離緩衝液(Cat # 13151−014)中で収穫し、1,100rpmにおける5分間の遠心によってプレート化し、適当な用量のアッセイ緩衝液(50%1×PBSおよび50%刺激緩衝液)に注意深く再懸濁して、2x106細胞/mLの最終細胞カウントを得る。テスト化合物を、示された所望のアッセイ濃度にて50μLのアッセイ緩衝液中で調製し、96−ウェルのFlash Plateのウェルにピペットで入れ、次いで、上記で調製した細胞懸濁液を加えた(ウェル当たり50μL)。室温にて60分のインキュベーション時間の後に、次いで、トレーサー[125I]−cAMPを含有する100μLの検出ミックスをウェルに加える。プレートをさらに2時間インキュベートし、続いて、Wallac MicroBetaシンチレーションカウンターでカウントする。cAMP/ウェルの値を、各アッセイプレートに含まれる標準cAMP曲線から外挿する。
【0360】
空のベクターでトランスフェクトされたHEK293細胞におけるcAMPレベルの増加に対する、GPR119−トランスフェクトHEK293細胞におけるcAMPレベルの増加は、テスト化合物がGPR119受容体機能性を刺激する化合物であることを示す。
実施例9:例えば、GPR119アゴニスト活性についてのメラニン保有細胞アッセイ
メラニン保有細胞を、Potenza et al[Pigment Cell Research(1992)5:372−378]によって報告されているように、培養に維持し、エレクトロポレーションを用い、GPR119受容体(GPR119;例えば、human GPR119,GenBank(登録商標)アクセション No.AAP72125およびその対立遺伝子)をコードする発現ベクターでトランスフェクトする。エレクトロポレーションに続き、トランスフェクトされた細胞をアッセイのために96ウェルプレートに平板培養する。次いで、細胞を48時間増殖させて、エレクトロポレーション手法から回収すると共に、最大受容体発現レベルを獲得する。
【0361】
アッセイの日に、細胞上の増殖培地を、10nMメラトニンを含有する無血清緩衝液で交換する。メラトニンはメラニン保有細胞において内因性gI−結合GPCRを介して作用して、細胞内cAMPレベルを降下させる。降下したcAMPレベルに応答して、メラニン保有細胞はその色素を細胞の中心に移動させる。この正味の効果は、600〜650nMで決定された、ウェル中の細胞単層の吸光度読み取りの有意な減少である。
【0362】
メラトニン中での1時間のインキュベーションの後、細胞は完全に色素−凝集となる。この時点において、ベースライン吸光度の読み取りを収集する。次いで、テスト化合物の系列希釈をプレートに加え、GPR119アゴニスト活性を有する化合物は、cAMPレベルの増加を生じる。これらの増大したcAMPレベルに応答して、メラニン保有細胞はその色素を細胞周囲に戻す。1時間後、刺激された細胞は、十分に色素が分散する。分散した細胞単層は、600〜650nm範囲においてより多くの光を吸収する。ベースラインの読みと比較した吸光度の決定された増加は、受容体刺激の程度を定量し、容量−応答曲線をプロットすることを可能とする。
【0363】
メラニン保有細胞アッセイに関する材料および方法は、その各々の開示をここで引用してその全体を援用する、米国特許第5,462,856号および第6,051,386号に見出される。
【0364】
空のベクターでトランスフェクトされたメラニン保有細胞におけるそれに対する、GPR119でトランスフェクトされたメラニン保有細胞における色素分散の増加は、テスト化合物がGPR119受容体の機能性を刺激する化合物であることを意味する。
【0365】
GPR119アゴニストとしての化合物を同定するための他のアッセイは、当業者に容易に明らかであろう(例えば、上記実施例7参照)。
実施例10:例えば、GPR119アゴニスト活性についての酵母レポーターアッセイ
酵母細胞−ベータのレポーターアッセイは文献で従前に記載されている。(例えば、Miret et al,J Biol Chem(2002)277:6881−6887;Campbell et al,Bioorg Med Chem Lett(1999)9:2413−2418;King et al,Science(1990)250:121−123;WO 99/14344;WO 00/12704;およびUS
6,100,042参照)。簡単に述べると、酵母細胞は、内因性酵母G−アルファ(GPA1)が欠失されており、多数の技術を用いて構築されたG−プロテインキメラで置き換えられているように作製されている。加えて、内因性酵母アルファ−細胞GPCR、Ste3は、選択される哺乳動物GPCRの同種発現を可能とするように欠失されている。酵母において、真核生物細胞において保存されたフェロモンシグナリング変換経路(例えば、マイトジェン活性化プロテインキナーゼ経路)のエレメントは、Fus1の発現を駆動する。Fus1プロモーター(Fus1p)の制御下にβ−ガラクトシターゼ(LacZ)を置き換えることによって、系が開発されており、それにより、受容体活性化は酵素読出に導く。
【0366】
酵母細胞は、Agatep et al(Agatep et al,1998,Transformation of Saccharomyces cerevisiae
by the lithium acetate/single−stranded carrier DNA/polyethylene glycol(LiAc/ss−DNA/PEG)protocol.Techncal Tips Online,Trends Journals,Elsevier)によって記載された酢酸リチウム方法の適合によって形質転換される。簡単に述べれば、酵母細胞を酵母トリプトンプレート(YT)上で一晩増殖させる。キャリアー一本鎖DNA(10μg)(2つのFus1p−LacZレポータープラスミド(1つはURA選択マーカーを持つものであり、1つはTRPを持つ者である)の各々の2μg、酵母発現ベクター(2μgの複製起点)中の2μgkGPR110(例えば、ヒト受容体)、および酢酸リチウム/ポリエチレングリコール/TE緩衝液をエッペンドルフチューブにピペットで入れる。受容体を含有するが、受容体対照を含有しない酵母発現プラスミドはLEUマーカーである。酵母細胞をこの混合物に摂取し、反応を30℃にて60分間進行させる。次いで、酵母細胞を42℃にて15分間熱ショックを与える。次いで、細胞を洗浄し、選択プレート上に広げる。選択プレートは合成基底酵母培地からLEU、URAおよびTRP(SE−LUT)を除いたものである。30℃における2〜3日間のインキュベーションの後に、次いで、選択プレートで増殖するコロニーをLacZアッセイでテストする。
【0367】
β−ガラクトシダーゼについてのフルオロメトリー酵素アッセイを行うために、主題のGPR119受容体を運ぶ酵母細胞を液体SD−LUT培地中で不飽和濃度まで一晩増殖させる(すなわち、細胞は依然として分裂しており、未だ静止層に到達していない)。それらを新鮮な培地中で最適なアッセイ濃度まで希釈し、90μLの酵母細胞を96−ウェル黒色ポリスチレンプレート(Costar)に加える。DMSOに溶解させ、10%DMSO溶液中に10×濃度まで希釈したテスト化合物をプレートに加え、プレートを30℃に4時間置く。4時間後に、β−ガラクトシダーゼに対する基質を各ウェルに加える。これらの実験において、フロオレセインジ(β−D−ガラクトピラノシド(フルオレセインを放出する酵素に対する基質)(FDG)を用い、フルオロメトリー読出を行う。500μM FDG/2.5% Triton X100のウェル当たり20μLを加える(洗剤は細胞を浸透性とするのに必要である)。60分間の細胞と基質とのインキュベーション後に1M炭酸ナトリウムのウェル当たり20μLを加えて、反応を停止させ、蛍光シグナルを増強させる。次いで、プレートを485/535nmにおいてフルオロメーターで読む。
【0368】
空のベクターで形質転換された酵母細胞における蛍光シグナルの増加に対して、GPR119−形質転換酵母細胞における蛍光シグナルの増加は、テスト化合物が、GPR119受容体機能性を刺激する化合物(例えば、GPR119のアゴニストまたは部分的アゴニストである化合物)であることを示す。ある実施形態において、本発明の化合物は、バックグラウンドシグナル(ビヒクル単独の存在下で得られたシグナル)の蛍光シグナルの増加を超える蛍光シグナルの増加を与える。
実施例11:放射性標識化合物
ある実施形態において、本発明のG−プロテイン結合受容体のリガンドであることが知られた化合物を放射性標識する。本明細書中に記載された放射性標識化合物をスクリーニングアッセイで用いて、化合物を同定/評価することができる。一般的な項目においては、新しく合成された、または同定された化合物(すなわち、テスト化合物)は、放射性標識された公知リガンドおよび受容体の間に複合体の形成を低下させるその能力によって、受容体に対する放射性標識された公知のリガンドの結合を低下させるその能力について評価することができる。本発明の化合物に取り込むことができる適当な放射性核種は、限定されるものではないが、(Tとも書かれる)3H、11C、14C、18F、125I、82Br、123I、124I、125I、131I、75Br、76Br、15O、13N、35Sおよび77Brを含む。3H、14C、125I、131I、35Sまたは82Brを取り込む化合物は一般的には最も有用である。
【0369】
「放射性標識された」化合物は、少なくとも1つの放射性核種を取り込んだ化合物であると理解される。いくつかの実施形態において、放射性核種は3H、14C、125I、35Sおよび82Brよりなる群から選択される。いくつかの実施形態において、放射性核種は3Hまたは14Cである。さらに、本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物において示される原子の全ては、その原子の最も普通に生じる同位体、あるいはより稀な放射性同位体または非−放射性同位体いずれかであり得ることが理解されるべきである。
【0370】
本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物に適用できるものを含めた有機化合物へ放射性同位体を取り込むための合成方法は当該分野でよく知られており、活性レベルのトリチウムを標的分子に取り込む方法は以下のものを含む:A.トリチウムガスでの接触還元−この手法は、通常、高特異的活性の産物を生じ、ハロゲン化された前駆体または不飽和の前駆体を必要とする。B.ホウ水素化ナトリウム[3H]での還元−この方法はむしろ安価であり、アルデヒド、ケトン、ラクトン、エステルなどのような還元可能な官能基を含有する前駆体を必要とする。C.水素化アルミニウムリチウム[3H]での還元−この手法は、ほとんど理論的な特異的活性における産物を提供する。また、それは、アルデヒド、ケトン、ラクトン、エステルなどのような還元可能な官能基を含有する前駆体も必要とする。D.トリチウムガス曝露標識:この手法は、適当な触媒の存在下で、交換可能なプロトンを含有する前駆体をトリチウムガスに曝露することを含む。E.ヨウ化メチル[3H]を用いるN−メチル化−この手法は、通常、適当な前駆体を高特異的活性のヨウ化メチル(3H)で処理することによってO−メチルまたはN−メチル(3H)産物を調製する。この方法は、一般には、約80〜87Ci/ミリモルのような高特異的活性を可能とする。
【0371】
活性レベルの125Iを標的分子に取り込むための合成方法は以下のものを含む:A.Sandmeyer等の反応:この手法は、テトラフルオロボレエート塩のようなジアゾニウム塩へアリールまたはヘテロアリールアミンを変換し、引き続いて、Na125Iを用いて125I標識化合物へ変換する。代表的な手法はZhu、D.−G.および共同研究者によってJ.Org.Chem.2002,67,943−948において報告された。B.フェノールのオルト125ヨウ素化−この手法は、Collier、T.L.および共同研究者によってJ.Labelled CompdRadiopharm.1999、42、S264−S266において報告されているように、フェノールのオルト位置における125Iの取込を可能とする。C.125Iでのアリールおよびヘテロアリールブロミド交換−この方法は、一般には、2工程プロセスである。第一の工程は、トリ−アルキルスズハライドまたはヘキサアルキル二スズ([例えば、(CH3)3SnSn(CH3)3)の存在下における、例えば、pD触媒反応、すなわち、Pd(Ph3P)4)を用いる、またはアリールまたはヘテロアリールリチウムを介する、アリールまたはヘテロアリールブロミドの対応するトリ−アルキルスズ中間体への変換である。示された手法はBas,M.−D.および共同研究者によってJ.Labelled Compd Radiopharm.2001,44,S280−S282において報告された。
【0372】
上記した技術は説明的であって、限定する意図のものではない。本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物を放射性標識するための他の技術は当業者によく知られている。
実施例12:受容体結合アッセイ
テスト化合物は、本発明のGプロテイン−結合受容体のリガンドであることが知られている化合物、および該受容体の間の複合体の形成を低下させるその能力について評価することができる。ある実施形態において、公知のリガンドが放射性標識される。放射性標識された公知のリガンドをスクリーニングアッセイで用い、化合物を同定/評価することができる。一般的な項目において、新たに合成されたまたは同定された化合物(すなわち、テスト化合物)は、放射性標識された公知のリガンドと該受容体との間の複合体の形成を低下させるその能力によって放射性標識された公知のリガンドの該受容体への結合を低下させるその能力について評価することができる。
【0373】
テスト化合物の非存在下における放射性標識された公知のリガンドの特異的結合のレベル未満のテスト化合物の存在下における放射性標識された公知のリガンドの特異的結合のレベルは、テスト化合物の非存在下におけるよりも、テスト化合物の存在下において該放射性標識された公知のリガンドと該受容体との間のより少ない受容体が形成されることを示す。
【0374】
本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物と該受容体の間の複合体を検出するためのアッセイプロトコル
A.受容体の調製
(15−cm皿当たり)60μLのリポフェクタミンを用い、本発明のGプロテイン−結合受容体をコードするポリヌクレオチドを含む10μg発現ベクターで293細胞を一過的にトランスフェクトする。一過的にトランスフェクトされた細胞を、培地を交換しつつ、皿中で24時間増殖させ(75%密集)、10mL/皿のHepes−EDTA緩衝液(20mM Hepes+10mM EDTA,pH7.4)で取り出す。次いで、細胞をBeckman Coulter遠心機にて17,000rpmにおいて細胞を20分間遠心する(JA−25.50ローター)。引き続いて、ペレットを20mM Hepes+1mM EDTA、pH7.4に再懸濁させ、50−mL Dounceホモゲナイザーでホモゲナイズし、再度、遠心する。上清を除去した後、結合アッセイで用いるまで、ペレットを−80℃で貯蔵する。アッセイで用いる場合、膜を氷上で20分間解凍し、次いで、10mLのインキュベーション緩衝液(20mM Hepes,1mM MgCl2,100mM NaCl,pH 7.4)を加える。次いで、膜をボルテックスして、組成膜ペレットを再懸濁させ、Brinkmann PT−3100 Polytronホモゲナイザーで設定6において15秒間ホモゲナイズする。膜蛋白質の濃度は、BRLブラッドフォード蛋白質アッセイを用いて決定する。
【0375】
B.結合アッセイ
全結合については、合計容量50μLの適当に希釈された膜(50mM トリス HCl(pH 7.4)、10mM MgCl2および1mM EDTAを含有するアッセイ緩衝液中に希釈;5〜50ug蛋白質)を96−ウェルのポリプロピレンマイクロタイタープレートに加え、続いて、100μLのアッセイ緩衝液および50μLの放射性標識された公知のリガンドを加える。非特異的結合では、100μLの代わりに50μLのアッセイ緩衝液を加え、放射性標識されていない10uMの該公知のリガンドのさらに50μLを加え、その後、50μLの該放射性標識された公知のリガンドを加える。次いで、プレートを室温にて60〜120分間インキュベートする。Brandell 96−ウェルプレートハーベスターを備えたMicroplate Devices GF/C Unifilter濾過プレートをとおしてアッセイプレートを濾過することによって、結合反応を停止させ、引き続いて、0.9%NaClを含有する冷50mM トリス HCL,pH 7.4で洗浄する。次いで、濾過プレートの底をシールし、50μLのOptiphase Supermixを各ウェルに加え、プレートの頂部をシールし、プレートをTrilux MicroBetaシンチレーションカウンターでカウントする。該放射性標識された公知のリガンドと該受容体との間のより少ない複合体がテスト化合物の存在下で形成されるか否かを決定するために、100μLのアッセイ緩衝液を加える代わりに、100μLの適当に希釈された該テスト化合物を適当なウェルに加え、引き続いて、50μLの該放射性標識された公知のリガンドを加える。
【0376】
C.計算
テスト化合物をまず、10、1および0.1μMでアッセイし、次いで、中央の用量が放射性標識された公知のリガンドの結合の約50%阻害(すなわち、IC50)を引き起こすように選択された濃度の範囲でアッセイする。テスト化合物の非存在下における特異的結合(BO)は、全結合(BT)から非特異的結合(NSB)を引いた差であり、(テスト化合物の存在下における)同様に特異的な結合(B)は、変位結合(BD)から非特異的結合(NSB)を引いた差である。IC50は、阻害応答曲線、%B/B0−対−テスト化合物の濃度のlogit−logプロットから決定される。
【0377】
Kiは、ChengおよびPrustoff変換:
Ki =IC50/(I+[L]/KD)
によって計算され、ここで、[L]はアッセイで用いた放射性標識された公知のリガンドの濃度であって、KDは同一の結合条件下で独立して決定される放射性標識公知リガンドの解離定数である。
実施例13: 腸内分泌細胞系において、または小腸のK細胞リッチな領域に由来する組織中の細胞におけるGIP分泌に対するGPR119アゴニストの効果
本発明に従い、GPR119アゴニストは、本明細書中に記載されたイン・ビトロアッセイを用い、腸内分泌細胞系において、または小腸のK細胞リッチな領域に由来する組織[例えば、十二指腸または空腸組織;例えばSondhi et al.参照 Pharmacogenetics J(2006)6:131−140参照]中の細胞において、GIP分泌を刺激することを示すことができる。1日目に、腸内分泌細胞、または小腸のK細胞リッチな領域に由来する組織中の細胞を、完全培養培地(DMEM/10%FBS)中で、24−ウェルプレートに入れる。2日目に、該培養培地を低グルコース培地(DMEM/3mMグルコース/10%FBS)で交換する。3日目に、細胞を1×PBSで2回洗浄する。洗浄された細胞を、組織培養インキュベーターにて、37℃および5%CO2において1時間、ビヒクルで、または(例えば、1nM〜20uMの範囲の)種々の濃度のGPR119アゴニストで、または15mMグルコースを含む無血清DMEM中の陽性対照としてのフォルスコリン(1uM)で刺激する。次いで、上清を収集し、500gおよび4℃にて5分間の遠心によって、清澄化する。供給業者によって提供された指示に従い、LINCO Research Laboratory[ラット/マウス胃阻害性ポリペプチド(全)ELISA カタログ#EZRMGIP−55K]から購入した試薬を用いるELISAによって、上清に放出されたGIPを決定する。
【0378】
これまでの明細書は、説明目的で掲げた実施例と共に本発明の原理を教示するが、本発明の実施は、特許請求の範囲およびその均等物の範囲内に入る、通常の変形、適合または改変の全てを含むと理解されるであろう。
【技術分野】
【0001】
本発明は、GPR119受容体を用いて個体において骨質量を増加させるのに有用な化合物を同定する方法に関する。GPR119受容体のアゴニストは、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防するための、および個体において骨質量を増加させるための治療剤として有用である。GPR119受容体のアゴニストは、個体において骨形成を促進する。
【背景技術】
【0002】
以下の議論は、本発明の理解を容易とさせることを意図するが、本発明に対する先行技術であることを認めることを意図しない。
A.骨粗鬆症
骨粗鬆症は骨質量の喪失および骨格構造のミクロ造型的劣化によって特徴付けられる廃疾病であり、危うい骨強度に導き、このことは患者を脆性骨折の増大した危険性に対して素因があるようにする。欧州、日本および合衆国において骨粗鬆症は7500万人を超える人々が罹っており、欧州および合衆国単独において230万を超える骨折を引き起こす。合衆国において、骨粗鬆症は、全ての閉経後白人の婦人の少なくとも25%が罹っており、該割合は80歳を超える婦人で70%まで上昇する。50歳を超える3人の婦人のうち一人は骨粗鬆症的骨折を有し、これは社会に対してかなりの社会的かつ経済的負担を引き起こす。該疾患は婦人に限定されず;老齢の男性も罹り得る。2050年までには、男性における臀部骨折の世界的な発生率は310%まで増加すると試算されており、女性においては240%まで増加すると試算されている。臀部、前腕、および脊椎骨折の臨床的に示される人生における危険性は合計40%程度であり、心血管病に対する危険性と匹敵する。従って、骨粗鬆症の特徴は実質的な死亡率、有病率、および経済的コストを引き起こす。老齢の集団では、骨粗鬆症骨折の数およびそのコストは、効果的な予防戦略が開発されるのでなければ、次の50年で少なくとも2倍となるであろう(例えば、非特許文献1;非特許文献2;および非特許文献3参照)。
B.グルコース−依存性インスリン向性ポリペプチド(GIP)
グルコース−依存性インスリン向性ポリペプチド(胃阻害性ポリペプチドとしても知られたGIP)は、食事摂取後に十二指腸内分泌K細胞から放出される42アミノ酸のペプチドインクレチンホルモンである。放出されるGIPの量は消費されるグルコースの量に大いに依存する。GIPは、膵臓ベータ細胞においてグルコース−依存性インスリン分泌を刺激することが示されている。GIPは特異的Gプロテイン−結合受容体、すなわち、GIPRを介してその作用を媒介する。
【0003】
GIPは2位においてアラニンを含有するため、GIPの分解を調節する酵素であるジペプチジルペプチダーゼ−4(DPP−IV)に対する優れた基質である。全長GIP(1−42)は腸K細胞からの分泌から数分以内に迅速に生物不活性GIP(3−42)に変換される。DPP−IVの阻害は、GIP生物活性を増加させることが示されている(例えば、非特許文献4;非特許文献5;非特許文献6;および非特許文献7参照)。例えば、血液中の全長生物活性GIPの分析は、N−末端−特異的アッセイを用いて行うことができる(例えば、非特許文献8参照)。
【0004】
最近、GIPは骨形成を促進することが示されている。GIPは骨芽細胞受容体を活性化し、その結果、共に骨形成に関連する、コラーゲンI型合成およびアルカリ性ホスファターゼ活性の増加をもたらす。GIPはイン・ビトロにて破骨細胞の活性および分化を阻害することが示されている。GIPの投与は卵巣摘出による骨喪失を妨げることが示されている。GIP受容体(GIPR)ノックアウトマウスは減少した骨のサイズ、より低い骨質量、変化した骨ミクロ造型(microarchitecture)および生化学的特性、および骨代謝回転についてのパラメーターの変化を、特に骨形成において示す(例えば、非特許文献9;非特許文献10;非特許文献11;非特許文献12;および非特許文献13参照)。
【0005】
骨の密度または形成を維持し、または増大させるためのGIPの有用性は、GIPペプチドの投与による低下した骨ミネラル化の治療のための、特許文献1の発行によって合衆国特許商標局によって認められている。しかしながら、現在のGIPペプチドアゴニストは経口生物学的利用性の欠如に悩んでおり、患者のコンプライアンスに負の影響を与える。魅力的な代替アプローチは、GIP活性の内因性レベルを増加させるための経口的に活性な組成物を開発することである。
C.GPR119
GPR119はGプロテイン−結合受容体である(GPR119:例えば、ヒトGPR119、GenBank(登録商標)アクセション No.AAP72125およびその対立遺伝子:例えば、マウスGPR119、GenBank(登録商標)アクセション No.AY288423およびその対立遺伝子)。アゴニストによるようなGPR119活性化は細胞内cAMPのレベルの上昇に至り、Gsに結合しているGPR119に合致する。特許文献においては、GPR119はRUP3と言われてきた(例えば、特許文献2);GPR119はグルコース−依存性インスリン向性受容体(GDIR)とも言われてきた。
D.Gプロテイン−結合受容体
多数の受容体クラスがヒトに存在するが、これまでに、最も豊富であって治療的に重要なのはGプロテイン−結合受容体(GPCR)クラスによって示される。ヒトゲノム内には30,000〜40,000ほどの遺伝子があると見積もられており、これらの内、ほぼ2%はGPCRをコードすると見積もられている。
【0006】
GPCRは医薬製品の開発のための重要な領域を代表する。GPCRにおいて活性な薬物は、疼痛、認識障害、高血圧、ペプシン潰瘍、鼻炎、および喘息のように多用なヒト疾患の広域スペクトルにわたって治療的効果を有する。ほぼ500の臨床的に市販されている薬物の内、30%を超えるものがGPCR機能のモジュレーターである。これらの薬物はほぼ30のよく性質決定されているGPCRにおいてその活性を発揮する(例えば、非特許文献14参照)。
【0007】
GPCRは、その各々が膜を貫く7つのアルファヘリックスを形成する22〜24の間の疎水性アミノ酸の7つの配列を有する共通の構造的モチーフを保有する(各スパンは数字によって確認される、すなわち、膜貫通−1(TM−1)、膜貫通−2(TM−2)等)。膜貫通ヘリックスは、細胞膜の外部または「細胞外」側の膜貫通−2および膜貫通−3、膜貫通−4および膜貫通−5、および膜貫通−6および膜貫通−7の間のアミノ酸の鎖によって連結される(これらを、各々、「細胞外」領域1、2および3(EC−1、EC−2およびEC−3)という)。膜貫通ヘリックスは、細胞膜の内部または「細胞内」側の膜貫通−1および膜貫通−2、膜貫通−3および膜貫通−4、および膜貫通−5および膜貫通−6の間のアミノ酸の鎖によってやはり連結されている(これらを、各々、「細胞内」領域1、2および3(IC−1、IC−2およびIC−3)という)。受容体の「カルボキシ」(「C」)末端は細胞内の細胞内空間に存在し、受容体の「アミノ」(「N」)末端は細胞の外側の細胞外空間に存在する。
【0008】
一般に、リガンドは受容体と結合する場合(しばしば、受容体の「活性化」という)、細胞内領域および細胞内「Gプロテイン」の間の結合を容易とする受容体の立体配座の変化がある。GPCRはGプロテインに対して「無差別的(promiscuous)」であり、すなわち、GPCRは1を超えるGプロテインと相互作用できると報告されている(非特許文献15参照)。他のGプロテインが存在するが、現在、Gq、Gs、Gi、GzおよびGoが同定されているGプロテインである。リガンド−活性化GPCRとG−プロテインとの結合はシグナルカスケードプロセス(「シグナル変換」という)を開始させる。通常の条件下では、シグナル変換は、最終的には、細胞活性化または細胞阻害をもたらす。理論に拘束されるつもりはないが、受容体のIC−3ループならびにカルボキシ末端はGプロテインと相互作用すると考えられている。
【0009】
また、G15またはG16のような、GPCRの数個のクラスをホスホリパーゼC経路に結合させるように見える無差別的なGプロテイン(非特許文献16)、または非常に多数のGPCRを同じ経路(例えば、ホスホリパーゼC経路)に結合させるように設計されたキメラGプロテイン(非特許文献17)がある。
【0010】
生理学的な条件下では、GPCRは二つの異なる立体配座:「不活性な」状態および「活性な」状態の間が平衡して細胞膜に存在する。不活性な状態の受容体は細胞内シグナリング変換経路に結合して、生物学的応答に導くシグナル変換を開始することができない。受容体の立体配座を活性な状態に変化させることは、(G−プロテインを介する)変換経路への連結を可能とし、生物学的応答を生じる。
【0011】
受容体はリガンド、または薬物のような化合物によって活性な状態に安定化させることができる。受容体のアミノ酸配列に対する改変を含むが、それに限定されない最近の発見は、活性な状態の立体配座において受容体を促進し、および安定化するためのリガンドまたは薬物以外の手段を提供する。これらの手段は、受容体へのリガンド結合の効果を刺激することによって活性な状態に受容体を効果的に安定化させる。そのようなリガンド−非依存性手段による安定化は「構成的受容体活性化」といわれる。
【図面の簡単な説明】
【0226】
本発明をここで添付する図面との関係で説明する。
【図1A】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。A.GPR119アゴニストとしての化合物1を用いて行うタイムコース分析。
【図1B】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。B.GPR119アゴニストとしての化合物3を用いて行われるタイムコース分析。
【図1C】図1は、野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析を示す。C.GPR119アゴニストとしての化合物3を用いて行われる用量力価決定分析。
【図2A】図2は、野生型マウスと比較した、GPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果を示す。A.GPR119アゴニストとしての化合物1を用いて比較を行った。
【図2B】図2は、野生型マウスと比較した、GPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果を示す。B.比較は、GPR119アゴニストとしての化合物2を用いて比較を行った。
【発明を実施するための最良の形態】
【0227】
(発明の詳細な説明)
本発明は、GPR119受容体を用いて、個体において骨質量を増加させるのに有用な化合物を同定する方法をその要旨とする。GPR119受容体のアゴニストは、骨粗しょう症のような低骨質量によって特徴付けられる状態を治療または予防するための、および個体において骨質量を増加させるための治療剤として有用である。本発明は、少なくとも部分的には、経口投与によるなどの、GPR119アゴニストの個体への投与は、GPR119受容体において作用して、個体においてGIPレベルを増加させることができるという出願による驚くべき発見に基づく。
【0228】
本明細書中で用いるように、用語「リガンド」は、GPR119のような、ポリペプチドに特異的に結合する分子(例えば、テスト化合物)を意味するべきである。リガンドは、例えば、ポリペプチド、脂質、小分子、抗体であってよい。化合物1はGPR119受容体ポリペプチドの例示的なリガンドである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン(表A参照)は、GPR119受容体ポリペプチドの例示的なリガンドである。化合物2は、GPR119受容体ポリペプチドの例示的なリガンドである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3はGPR119受容体ポリペプチドの例示的なリガンドである。化合物3は、国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。内因性リガンドは、GPR119のような天然ポリペプチドに対する内因性天然リガンドであるリガンドである。リガンドは「アンタゴニスト」、「アゴニスト」、「部分的アゴニスト」または「逆アゴニスト」などであってよい。
表A.
【0229】
【化1】

本明細書中で用いるように、用語「アゴニスト」は、GPCRへの結合によって、GPCRによって媒介される細胞内応答を誘導するようにGPCRを活性化する剤(例えば、リガンド、テスト化合物)を意味するべきである。
【0230】
用語「部分的アゴニスト」は、本明細書中で用いるように、GPCRへの結合によって、全アゴニストよりも程度は低いが、GPCRによって媒介される細胞内応答を誘導するようにGPCRを活性化する剤(例えば、リガンド、テスト化合物)を意味すべきである。
【0231】
用語「アンタゴニスト」は、アゴニストまたは部分的アゴニストと同一の部位の辺りにてGPCRに結合し、好ましくは競合的に結合するが、GPCRの活性な形態によって開始される細胞内応答を活性化せず、それにより、アゴニストまたは部分的アゴニストによって細胞内応答を阻害することができる剤(例えば、リガンド、テスト化合物)を意味すべきである。アンタゴニストは、典型的には、アゴニストまたは部分アゴニストの非存在下でベースライン細胞内応答を減少させない。
【0232】
用語「逆アゴニスト(inverse agonist)」は、GPCRに結合し、かつアゴニストまたは部分的アゴニストの非存在下で観察される正常な基礎レベル活性未満の受容体の活性形態によって開始されるベースライン細胞内応答を阻害する剤(例えば、リガンド、テスト化合物)を意味すべきである。
【0233】
本明細書中で用いるように、用語「GPR119アゴニスト」とは、GPR119受容体に結合し、アゴニストとして作用する化合物をいう。化合物1は例示的なGPR119アゴニストである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンは例示的なGPR119アゴニストである。化合物2は例示的なGPR119アゴニストである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3は例示的なGPR119アゴニストである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
【0234】
本明細書中で用いるように、用語「選択的GPR119アゴニスト」とは、コルチコトロピン−放出因子−1(CRF−1)受容体のような1以上の関連受容体に対する選択性を超えるGPR119受容体に対する選択性を有するGPR119アゴニストをいう。化合物1は例示的な選択的GPR119アゴニストである(化合物1の化学的構造および化学的名称を記載する表A参照)。化合物1は国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)に開示された化合物と同一である。(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンは例示的な選択的GPR119アゴニストである。化合物2は例示的な選択的GPR119アゴニストである。化合物2は国際特許出願番号PCT/US2004/022417(WO 2005/007658として公開)に開示された化合物と同一である。化合物3は例示的な選択的GPR119アゴニストである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
【0235】
用語「GIP分泌促進薬」は、細胞、例えば、腸内分泌細胞においてGIPの分泌を促進する、または脊椎動物または哺乳動物のような個体への投与に際して、全GIPのレベル、例えば、血中または血漿中全GIPのレベルを増加させる剤(例えば、リガンド、テスト化合物)を意味すべきである。ある実施形態において、GIP分泌促進薬は、個体において、全GIPのレベル、例えば、血中または血漿中全GIPのレベルを増加させるのに適当な化合物である。
【0236】
本明細書中で用いるように、用語「個体」とは、限定されるものではないが、(商業的に養殖された魚類、ペット魚類等のような)魚類、(カエル、ヒキガエル、ペット両生類等のような)両生類、(ヘビ、トカゲ、カメ、ペット爬虫類等のような)爬虫類、(ニワトリ、シチメンチョウ、ペット鳥類等のような)鳥類、および(マウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト霊長類、非−ヒト哺乳動物、ペット非−ヒト哺乳動物、ヒト等のような)哺乳動物を含めた脊椎動物をいう。ある実施形態において、個体は魚類である。ある実施形態において、個体は両生類である。ある実施形態において、個体は爬虫類である。ある実施形態において、個体は鳥類である。ある実施形態において、個体はシチメンチョウである。過去25年以上にわたって、より大きな胸筋肉質量を持つシチメンチョウに対する商業的な選択圧がかけられ、骨格一体性に対する要求を増大させた。しかしながら、増大した胸筋肉質量は、骨格の補償的変化によって達成されており、シチメンチョウ産業が脚問題の増加を経験するという結果を招いた。若い成体雄シチメンチョウにおける長骨の骨折が報告されている(例えば、Crespo et al,Poult Sci(2000)79:602−608参照)。ある実施形態において、個体は哺乳動物である。ある実施形態において、個体はマウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト霊長類または非−ヒトである(これは個々に、あるいはいずれかの組合せにて本発明の実施形態に含むことができる)。ある実施形態において、個体はウマである。競馬、馬術および他の競争イベントのような活動に関与するウマであるパフォーマンスウマは骨折に罹りやすい。ある実施形態において、個体はイヌまたはネコである。ある実施形態において、個体は(イヌ、ネコ等のような)ヒト愛玩動物、(ウシ、ヒツジ、ヤギ、ブタ、ニワトリ等のような)農場動物、(ウマ、イヌ等のような)スポーツ動物、(ラバ、ラクダ等のような)荷役用動物、または(動物園で見出される動物等のような)外国産動物であり、これは個々に、またはいずれかの組合せにて本発明の実施形態に含むことができる。ある実施形態において、個体は非−ヒト哺乳動物である。ある実施形態において、個体は(アカゲザル、チンパンジー等のような)非−ヒト霊長類である。ある実施形態において、個体はヒトである。
【0237】
本明細書中で用いるように、用語「予防または治療を必要とする」とは、個体が処置を必要とする、または処置から利益を受けるであろうという看護人(例えば、ヒトの場合には、医師、看護師、看護実行者;非−ヒト脊椎動物、および特別な実施形態において、非−ヒト哺乳動物の場合には獣医)によってなされる判断をここではいう。
【0238】
本明細書中で用いるように、用語「治療有効量」または「治療有効用量」とは、研究者、獣医、医療医師または他の臨床家によって求められている、組織、系、動物、個体またはヒトにおいて生物学的または医学的応答を誘導する活性な化合物または医薬剤の量をいい、該応答は以下のうちの1以上を含む:
(1)疾患の予防;例えば、疾患、状態または障害に対して素因があるが、疾患の病理学または兆候学を未だ経験したことがなく、または示したことがない個体における疾患、状態または障害の予防、
(2)疾患の阻害;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の阻害(すなわち、病理学および/または兆候学のさらなる発生の阻止)、および
(3)疾患の緩和;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の緩和(すなわち、病理学および/または兆候学の逆行)。
【0239】
本明細書中で用いるように、用語「治療効果」とは、研究者、獣医、医療医師または他の臨床家によって求められている組織、系、動物、個体またはヒトにおける生物学的または医学的応答の誘導をいい、それは以下のうちの1以上を含む:
(1)疾患の予防;例えば、疾患、状態または障害に対して素因があるが、疾患の病理学または兆候学を未だ経験していない、または示していない固体における疾患、状態または障害の予防、
(2)疾患の阻害;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における疾患、状態または障害の阻害(すなわち、病理学および/または兆候学のさらなる発生の阻止)、および
(3)疾患の緩和;例えば、疾患、状態または障害の病理学または兆候学を経験している、または示している個体における、疾患、状態または障害の緩和(すなわち、病理学および/または、兆候学の逆行)。
【0240】
用語「予防するのに有効な量」とは、予防することが求められている生物学的または医学的事象の発生の危険性を予防し、または低下させる薬物の量をいう。多くの場合、予防するのに有効な量は治療有効量と同一である。
【0241】
用語「組成物」は、少なくとも1つの成分を含む物質を意味すべきである。
【0242】
用語「有効成分」は、疾患の診断、治癒、軽減、治療または予防において薬理学的活性または他の直接的効果を供するいずれの成分も意味すべきである。
【0243】
用語「医薬組成物」は、少なくとも1つの有効成分を含む組成物を意味し、それにより、該組成物は哺乳動物における調査および処置に使用することができる。
【0244】
「医学上許容できる」とは、担体、ビヒクル、希釈剤、賦形剤および/または塩が処方の他の成分と適合し、その受容者に有害でないことを意味する。
【0245】
用語「投与形態」は、錠剤、カプセル、または注射剤のような、薬物が生産され、分注される物理的形態を意味すべきである。
【0246】
「骨」とは、密な有機マトリックスおよび無機のミネラル成分を含む、ほとんどの脊椎動物の骨格の主な部分を形成する密な、半−剛性の、多孔性の石灰化された結合組織を意図する。骨は、脊椎動物の骨格を作り上げる多数の解剖学的に区別される構造のいずれかである。
【0247】
用語「骨質量」および「骨ミネラル密度(BMD)」は、本明細書中においては相互交換的に使用される。ヒトにおけるBMDは、通常、標準的なX線写真撮影技術、デュアルエネルギーX−線吸収測定(DXA)によって決定される。BMDにアクセスするために開発された多くの技術のうち、DXAは最も高度に技術的に開発され、かつ最も徹底的に生物学的に確証されている。適切に適合されたソフトウェアと共にDXA技術を用いて、動物実験において信頼性よくBMDを評価することもできる。DXAは骨粗鬆症の診断、予後(骨折予測)、障害の天然履歴のモニタリング、および治療に対する応答の評価で用いられる。
【0248】
本明細書中で用いるように、用語「低骨質量」は、個体における骨ミネラル密度(BMD)のいずれの減少または低下もいい、世界保健機構(WHO)による提案で定義されたように骨粗鬆症および骨減少症を共に含む。WHOは、若い成人参照平均の1標準偏差内のBMDの値として正常を定義している(T−スコア≧−1)。WHOは、若い成人平均から1標準偏差未満を超えるが、この値から2.5標準偏差未満未満であるBMDの値として骨減少症を定義している(T−スコア<−1および>−2.5)。WHOは、骨減少症のよりひどい形態として骨粗鬆症を特徴付けており、それを、若い成人の平均から2.5標準偏差以上低いBMDの値によってそれを定義している(T−スコア≦−2.5)(例えば、その開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Managemant of Osteoporosis参照)。より通常には、骨減少症は−1未満かつ−2を超えるT−スコアとして定義されており、骨粗鬆症は−2未満またはそれと同等なT−スコアとして定義されている。本発明のある実施形態において、T−スコアはDXAにて臀部で決定される。
【0249】
本明細書中で用いるように、用語「骨粗鬆症」は若い成人参照平均から2標準偏差以上低いBMD2の値によって定義され(T−スコア≦−2)、あるいは看護人(例えば、ヒトの場合には医師、看護師、看護実行者;非−ヒト脊椎動物の場合には獣医)によってなされた診断をいう。
【0250】
骨粗鬆症は一次または二次いずれかとして分類することができる(例えば、World
Health Organization Technical Report Series 921(2003),Prevention and Managemant
of Osteoporosis参照)。本明細書中で用いるように、用語「骨粗鬆症」は一次骨粗鬆症および二次骨粗鬆症を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。
【0251】
本明細書中で用いるように、「一次骨粗鬆症」は閉経(天然、未熟または外科的)、老化または双方に伴う。本発明においては、閉経(天然、未成熟または外科的)に関連する一次骨粗鬆症、老化に関連する一次骨粗鬆症、および閉経および老化に関連する一次骨粗鬆症は個々にまたはいずれかの組合せにて実施形態に含めることができる。
【0252】
本明細書中で用いるように、「二次骨粗鬆症」とは、閉経または老化に関連しないが、むしろ、医学的状態に、または投薬または薬物の使用に関連する骨粗鬆症をいう。骨粗鬆症の増大した危険性は、限定されるものではないが、内分泌および代謝障害、および悪性状態を含めた医学的状態の宿主に、およびある投薬および薬物(その例は当業者によく知られている)の使用に関連する(例えば、その開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Managemant of Osteoporosis;Williams Textbook of Endocrinology,10th Edition;参照)。二次骨粗鬆症は固定化にも関連し得る。医学的状態、投薬または薬物の使用に、または固定化に対して二次的である骨粗鬆症の診断は看護人(例えば、ヒトの場合には医師、看護師、看護実行者;非−ヒト脊椎動物の場合における獣医)によってなされ得る。
【0253】
「骨折」とは、骨の完全なまたは不完全な破断、または破壊またはひび割れを意図する。骨折の診断は、通常、臨床的調査および放射線学的知見に依存する。本発明においては、骨折は、限定されるものではないが、外傷骨折、長期骨折、および病理学的骨折を含む。
【0254】
本明細書中で用いるように、「外傷骨折」とは、骨の天然弾性を超える局所的損傷の程度を伴う閾値上外傷を含む即座の骨折をいうべきである。それには、柔軟組織および、非常にしばしば、皮膚に対する同時負傷を伴い得る。外傷骨折は閉鎖的であり得る(隣接する柔軟組織は負傷し得るが、被覆する柔軟部分はかなり維持される)。外傷骨折は開放的であり得る(骨の破断した端部は広範な柔軟組織負傷によって遊離され、従って、外側からの病原体が直接的に創傷に進入し得る)。
【0255】
本明細書中で用いるように、「長期骨折」とは、慢性骨折、疲労骨折、ストレス骨折または自然発生骨折型Iをいうべきである。
【0256】
本明細書中で用いるように、「病原性骨折」とは、自然発生骨折II型をいうべきである。病理学的骨折は、それを占める適切な外傷なくして、自然発生的に生起する。該骨は前進病(例えば、骨粗鬆症、骨ジストロフィー、またはパジェット変形性骨炎)によって、または局所的骨疾患病巣(例えば、転移、放射線骨壊死、または骨腫瘍)によって、従前に損傷されている。Adler,Claus−Peter,BONE DISEASES,p.114(Springer−Verlag,Germany 2000)参照。
【0257】
骨折は、限定されるものではないが、斜めトーション(oblique torsion)骨折、横方向骨折、細分化骨折、圧縮骨折、肋骨骨折、クリーピング骨折、および骨折した大腿頸部も含む(Adler,Claus−Peter,BONE DISEASES,Springer−Verlag,Germany 2000))。
【0258】
本明細書中で用いるように、用語「低骨質量によって特徴付けられる状態」は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出骨喪失、子供時代の原発性骨喪失、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。ある実施形態において、二次骨粗鬆症は医学的状態に関連する。ある実施形態において、二次骨粗鬆症は投薬または薬物の使用に関連する。ある実施形態において、二次骨粗鬆症は固定化に関連する。低骨質量によって特徴付けられる状態は、限定されるものではないが、パジェット病、転移性癌による骨喪失、および新形成病、放射線療法または化学療法によって引き起こされるもののような骨溶解病巣も含む。低骨質量によって特徴付けられる状態は、限定されるものではないが、脊髄の湾曲、高さの喪失、および補綴外科的処置のような骨粗鬆症の長期合併症を含む。本発明においては、低骨質量によって特徴付けられる状態は、個々に、またはいずれかの組合せにて実施形態に含めることができる(例えば、その各々の開示をここで引用してその全体を援用するWorld Health Organization Technical Report Series 921(2003),Prevention and Management of Osteoporosis;Williams Textbook of Endocrinology,10th Edition,Larsen et al,Eds.(2002),W.B.Saunders Company;およびEndocrinology and Metabolism,4th Edition,Felig et al,Eds.(2001),McGraw−Hill Book
Company参照)。
【0259】
本明細書中で用いるように、「骨疾患」とは、骨の異常に関連する障害または状態をいう。骨質量または骨成長を増加させることによって、本発明に従って治療することができる骨疾患は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周病、歯槽骨喪失、骨摘出骨喪失、子供時代の原発性骨喪失、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。ある実施形態において、二次骨粗鬆症は医学的状態に関連する。ある実施形態において、二次骨粗鬆症は投薬または薬物の使用に関連する。ある実施形態において、二次骨粗鬆症は固定化に関連する。骨質量または骨成長を増加させることによって、本発明に従って治療することができる骨疾患は、限定されるものではないが、パジェット病および転移性癌による骨喪失も含む。骨質量または成長を増加させることによって、本発明に従って治療することができる破壊的骨障害は、限定されるものではないが、骨粗鬆症、変形性関節症、および新形成病、放射線療法もしくは化学療法によって引き起こされるもののような骨溶解病巣を含む。本発明において、骨の質量または成長を増加させることによって、本発明に従って治療することができる骨疾患は、個々に、またはいずれかの組合せにて実施形態に含めることができることは理解されるべきである。(例えば、その各々の開示をここで引用してその全体を援用するWorld Health Organization Technical Report
Series 921(2003),Prevention and Management of Osteoporosis;Williams Textbook of
Endocrinology,10th Edition,Larsen et al,Eds.(2002),W.B.Saunders Company;およびEndocrinology and Metabolism,4th Edition,Felig et al,Eds.(2001),McGraw−Hill Book Company参照)。
【0260】
本発明は、限定されるものではないが、顔面再形成、上顎再形成、下顎再形成、歯周病または抜歯後の増強された骨治癒、増強された長骨延長、増強された補綴内部成長および増大した骨結合を含めた、骨質量または骨成長を増加させることによって、本発明に従う治療からの利益を奪う他の状態にも関連する。
【0261】
用語「内因性」は、個体(例えば、限定されるものではないが、ヒト)が天然に生じる物質を意味すべきである。対照的には、「非−内因性」は、個体(例えば、限定されるものではないが、ヒト)によって天然に生産されないものを意味すべきである。
【0262】
Gプロテイン−結合受容体の、用語「生物学的に活性な断片」は、天然に生じるGPCRの構造的および生化学的機能を有するGPCRの断片を意味すべきである。ある実施形態において、生物学的に活性な断片はGプロテインに結合する。ある実施形態において、生物学的に活性な断片はGPCRの公知のリガンドに結合する。
【0263】
用語「プライマー」は、本明細書中においては、標的ヌクレオチド配列に対して相補的であって、それを用いて、標的ヌクレオチド配列にハイブリダイズする特異的ヌクレオチド配列を示すように用いる。プライマーは、DNAポリメラーゼ、RNAポリメラーゼ、または逆転写酵素によって触媒されるヌクレオチド重合についての開始点として働く。
【0264】
用語「発現ベクター」は、発現ベクターのための適切な宿主細胞組換え体において、クローン化DNAの転写、および転写されたmRNAの翻訳で必要なDNA配列を意味すべきである。適切に構築された発現ベクターは、宿主細胞における自律複製のための複製起点、選択マーカー、限定された数の有用な制限酵素部位、高コピー数の能力、および活性なプロモーターを含むべきである。転写すべきクローン化されたDNAは、発現ベクター内の構成的にまたは条件的に活性なプロモーターに作動可能に連結される。
【0265】
用語「宿主細胞」は、その中に取り込まれたベクターを有することができる細胞を意味すべきである。この関係においては、ベクターは、典型的には、適当なプロモーター配列と作動可能に連結された、GPCRまたはGPCR融合蛋白質をコードする核酸を含有して、GPCRまたはGPCR融合蛋白質の発現を起こるようにする。特別な実施形態において、宿主細胞は真核生物宿主細胞である。ある実施形態において、真核生物宿主細胞は哺乳動物宿主細胞である。ある実施形態において、真核生物宿主細胞は酵母宿主細胞である。ある実施形態において、真核生物宿主細胞はメラニン保有宿主細胞である。
【0266】
用語「接触する」または「接触している」は、少なくとも2つの部位を一緒にすることを意味すべきである。
【0267】
用語「調節する」または「改変する」は、特定の活性、機能または分子の量、質、または効果の増加または減少をいうように採用されるべきである。説明として、かつ限定されるものではないが、Gプロテイン−結合受容体のアゴニスト、部分的アゴニスト、逆アゴニスト、およびアンタゴニストは受容体のモジュレーターである。
【0268】
用語「小分子」は、ペプチド、ペプチドミメティック、アミノ酸、アミノ酸アナログ、ポリヌクレオチド、ポリヌクレオチドアナログ、ヌクレオチド、ヌクレオチドアナログ、有機化合物または無機化合物(すなわち、ヘテロ有機化合物または有機金属化合物を含む)、ならびにその塩、エステルおよび他の医薬的に許容される形態を含めた、モル当たり約10,000グラム未満の分子量を有する化合物を意味するように採用されるべきである。ある実施形態において、小分子は、モル当たり約5,000グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子はモル当たり約1,000グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子はモル当たり約800グラム未満の分子量を有する有機または無機化合物である。ある実施形態において、小分子は分子当たり約600グラム未満の分子量を有する無機または有機化合物である。ある実施形態において、小分子はモル当たり約500グラム未満の分子量を有する無機または有機化合物である。
【0269】
本明細書中で用いるアミノ酸の略語は表Bに記載する:
表B
【0270】
【化2−1】

【0271】
【化2−2】

用語「ポリペプチド」とは、ポリマーの長さに関係することなくアミノ酸のポリマーをいうべきである。したがって、ペプチド、オリゴペプチド、蛋白質はポリペプチドの定義内に含まれる。この用語は、ポリペプチドの発現後改変を特定したり排除したりしない。例えば、グリコシル基、アセチル基、リン酸基、脂質基等の共有結合を含むポリペプチドは、用語ポリペプチドによって例示的に含まれる。
【0272】
用語「ポリヌクレオチド」とは、単一鎖形態または二本鎖形態いずれかにて、1を超えるヌクレオチドのRNA、DNA、またはRNA/DNAハイブリッド配列をいうべきである。本発明のポリヌクレオチドは、合成、組換え、エクス・ビボ生成、またはその組合せを含めたいずれかの公知の方法、ならびに当該分野で知られたいずれかの精製方法の利用によって調製することができる。
【0273】
用語「抗体」は、本明細書中においては、モノクローナル抗体およびポリクローナル抗体を含むことを意図する。
【0274】
用語「第二のメッセンジャー」は、受容体活性化の結果として生じる細胞内応答を意味すべきである。第二のメッセンジャーは、例えば、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、環状AMP(cAMP)、環状GMP(cGMP)、MAPキナーゼ活性、MAPK/ERKキナーゼキナーゼ−1(MEKK1)活性、およびCa2+を含むことができる。第二のメッセンジャー応答は、受容体活性化の決定のために決定することができる。
【0275】
用語「受容体機能性」とは、限定されるものではないが、遺伝子転写の調節、イオンの流入または流失の調節、触媒反応の実行、および/または第二のメッセンジャー応答の誘導のようなG−プロテインを介する活性の調節を含めた、細胞において刺激を受け取り、および効果を和らげる受容体の正常な作動をいうべきである。
【0276】
用語「応答」または「受容体機能性」との関係での用語「刺激する」または「刺激している」は、受容体の応答または機能性が化合物の非存在下におけるのとは反対に化合物の存在下で増加することを意味すべきである。
【0277】
用語「応答」または「受容体機能性」との関係での用語「阻害する」または「阻害している」は、受容体の機能性の応答が化合物の非存在下におけるのとは反対に化合物の存在下で減少し、または予防されることを意味すべきである。
【0278】
用語「化合物の効力」は、受容体結合親和性とは反対に、受容体機能性を阻害し、または刺激する化合物の能力の測定値を意味すべきである。
【0279】
「候補化合物」と本明細書中においては相互交換的に用いられる用語「テスト化合物」は、スクリーニング技術に使用できる分子(例えば、限定されるものではないが、化学的化合物)を意味すべきである。
【0280】
Gプロテイン−結合受容体との関係での用語「構成的に活性」は、Gプロテイン−結合受容体がアゴニスト−非依存性活性を呈することを意味すべきである。
【0281】
句「テスト化合物」との関係での用語「直接的に同定する」または「直接的に同定された」は、Gプロテイン−結合受容体に対する公知のリガンド(例えば、公知アゴニスト)の非存在下におけるGプロテイン−結合受容体に対する化合物のスクリーニングを意味すべきである。
【0282】
ある範囲の値が供される場合、その範囲の上方および下方限界、および述べられた範囲におけるいずれかの他の述べられたまたは介入する値の間の、より低い限界の1/10に対する各介入値は、文脈が明瞭にそうではないことを指令するのでなければ、本発明に含まれることが理解される。これらのより小さな範囲の情報および下方限界は、独立して、より小さな範囲に含むことができ、また、述べられた範囲におけるいずれかの具体的に排除された範囲に従い、本発明にやはり含まれる。述べられた範囲が限界の一方または双方を含む場合、それらの含まれた限界のいずれかまたは双方を排除する範囲も本発明に含まれる。
A.導入
以下のセクションの順序は提示効率について記載されるものであって、開示または特許請求の範囲に対する限定と指定とされるものではなく、又そう解釈されるべきではない。B.受容体の発現
1.目的のGPCRポリペプチド
本発明のGPCRは;
(a)配列番号2のアミノ酸1〜335;
(b)配列番号2のアミノ酸2〜335;
(c)配列番号2のアミノ酸2〜335、ここで、GPCRは配列番号2のアミノ酸配列を含まない;
(d)特異的なプライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体のアミノ酸配列;
(e)高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGプロテイン−結合受容体のアミノ酸配列;
(f)配列番号2の改変体;
(g)
(i)配列番号2に対して少なくとも約80%同一性を有するGプロテイン−結合受容体のアミノ酸配列;および
(ii)配列番号2の少なくとも20連続アミノ酸を含むGプロテイン−結合受容体のアミノ酸配列;
よりなる群から選択される場合の(f)アミノ酸配列
(h)配列番号2を有するGプロテイン−結合受容体の構成的に活性なバージョンのアミノ酸配列;および
(i)(a)〜(h)のいずれか1つの生物学的活性な断片;
よりなる群から選択されるアミノ酸配列を含むことができる。ある実施形態において、本発明のGPCRは配列番号2のアミノ酸配列を含む。
【0283】
いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は内因性Gプロテイン−結合受容体である。いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能であるポリヌクレオチドによってコードされ、かつ内因性Gプロテイン−結合受容体であるGプロテイン−結合受容体は哺乳動物Gプロテイン−結合受容体であるいくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能であるポリヌクレオチドによってコードされ、かつ内因性Gプロテイン−結合受容体であるGプロテイン−結合受容体は哺乳動物GPR119受容体である。ある実施形態において、ポリメラーゼ連鎖反応のよって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、配列番号2またはその対立遺伝子である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、配列番号2の対立遺伝子である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は特異的に化合物1に結合する(化合物1の化学的構造および化学的名称を記載する表A参照)。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、特異的に(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける該受容体にてEC50値を有するアゴニストである受容体である。ある実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおいて該受容体にてEC50値を有するアゴニストである受容体である。いくつかの実施形態において、ポリメラーゼ連鎖反応によって増幅可能なポリヌクレオチドによってコードされるGプロテイン−結合受容体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0284】
いくつかの実施形態において、ヒトDNAはゲノムDNAである。
【0285】
いくつかの実施形態において、ポリメラーゼ連鎖反応は逆転写−ポリメラーゼ連鎖反応(RT−PCR)である。RT−PCR技術は当業者によく知られている。いくつかの実施形態において、ヒトDNAは、GPR119を発現する組織または細胞型に由来するヒトcDNAである。いくつかの実施形態において、GPR119を発現するヒト組織は膵臓または膵臓島である。ある実施形態において、cDNAは、GPR119を発現するヒト細胞型からのものである。いくつかの実施形態において、cDNAは膵臓ベータ細胞系からのものである。いくつかの実施形態において、本発明のGPCRは組換え体である。いくつかの実施形態において、組換えGPCRは組換えヒトGPR119である。
【0286】
ある実施形態において、主題の方法で用いてもよいGPCRは検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、本発明のGPCRは内因性である。いくつかの実施形態において、本発明のGPCRは哺乳動物GPR119である。いくつかの実施形態において、内因性である本発明のGPCRは哺乳動物GPR119である。
【0287】
説明であって限定されるものではないが、N−末端メチオニン残基の欠失は、主題の発明で用いてもよい生物学的活性な断片を供すると考えられる。ある実施形態において、本発明の生物学的に活性な断片は、そのN−末端において、化合物1に特異的に結合するN−末端メチオニン残基および(ヘマグルチニンインフルエンザウィルスからの)HAエピトープタグを含むペプチドに所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、そのN−末端において、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合するN−末端メチオニン残基および(ヘマグルチニンインフルエンザウィルスからの)HAエピトープタグを含むペプチドに所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値にて、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおいて当該ペプチドにそのN−末端にて所望により融合した当該断片にてEC50値を有するアゴニストである、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端にて所望により融合した断片である。ある実施形態において、本発明の生物学的に活性な断片であって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う前細胞アデニリルシクラーゼアッセイにおいて当該ペプチドにそのN−末端において所望により融合した当該断片におけるEC50値を有するアゴニストである、N−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。いくつかの実施形態において、本発明の生物学的に活性な断片は、検出可能なレベルの構成的な活性を呈するN−末端メチオニン残基およびHAエピトープタグを含むペプチドにそのN−末端において所望により融合した断片である。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ある実施形態において、断片は、実質的に、N−末端メチオリン残基およびHAエピトープタグよりなるペプチドにそのN−末端にて融合している。N−末端メチオニン残基およびHAエピトープタグを含む、または実質的にそれよりなるペプチドをポリペプチド断片のN−末端に融合させる技術は当該分野で良く知られており、商業的に入手することができる(例えば、Clontech Mountain View,CA)。
【0288】
配列番号2のヒトGPR119の対立遺伝子改変体は、本発明の範囲内にあると考えられる。ヒトGPR119は本発明の範囲内にあると考えられる。
【0289】
配列番号2のヒトGPR119の脊椎動物オルソログである改変体は、本発明の範囲内にあると考えられる。配列番号2のヒトGPR119の哺乳動物オルソログである改変体は、本発明の範囲内にあると考えられる。説明として、かつ限定されるものではないが、マウスGPR119(例えば、GenBank(登録商標)アクセションNo.AY288423)、ラットGPR119(例えば、GenBank(登録商標)アクセションNo.AAN95195)、ハムスターGPR119、イヌGPR119、および非−ヒト霊長類GPR119は本発明の範囲内にあると考えられる。
【0290】
ある実施形態において、配列番号2の改変体はGPCRである。
【0291】
配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有する配列番号2の改変体は本発明の範囲内にあると考えられる。ある実施形態において、配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有する配列番号2の改変体はGPCRである。いくつかの実施形態において、配列番号2の改変体は内因性GPCRである。いくつかの実施形態において、配列番号2の改変体は非−内因性GPCRである。いくつかの実施形態において、内因性GPCRである配列番号2の改変体は哺乳動物GPCRである。ある実施形態において、配列番号2の改変体は特異的に化合物1に結合する。ある実施形態において、配列番号2の改変体は、特異的に、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに結合する。ある実施形態において、配列番号2の改変体は、約50μM未満、約25μM未満、約10μM未満、5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従った受容体結合アッセイにおけるIC50値をもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値をもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体におけるEC50値を有するアゴニストである受容体である。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、配列番号2の改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性は、メラニン保有細胞が色素分散を受けるようにするためのものである。パーセント同一性は、公知のコンピュータプログラムを用いて慣用的に決定することができる。
【0292】
ある実施形態において、主題の方法で用いることができる改変体GPCRは、配列番号2に対して少なくとも約80%、少なくとも約85%、少なくとも約90%、少なくとも約95%、少なくとも約96%、少なくとも約97%、少なくとも約98%、または少なくとも約99%同一性を有するアミノ酸配列を有する。例えば、配列番号2に対して95%「同一性」を有する改変体GPCRとは、それが配列番号2の各100アミノ酸当たり5までのアミノ酸改変を含むことができる以外は、該改変体のアミノ酸配列が配列番号2のアミノ酸1〜335に対して同一であることを意味する。したがって、例えば、配列番号2のアミノ酸配列に対して少なくとも95%同一性を有するアミノ酸配列を得るためには、配列中のアミノ酸残基の5%(100のうち5)までが、配列番号2のアミノ酸1〜335と比較して挿入され得るか、欠失され得るか、またはもう1つのアミノ酸で置き換え得る。これらの改変は、アミノまたはカルボキシ末端における箇所、あるいはそれらの末端位置の間の、配列中の残基の間で各々に、あるいは配列内の1以上の連続基にとして介在した箇所の、いずれかの箇所で起こることができる。
【0293】
ある実施形態において、主題の方法で用いることができる改変体Gプロテイン−結合受容体は、いくつかのアミノ酸の欠失、置換、および/または付加を有する配列番号2に由来するアミノ酸配列を有するGプロテイン−結合受容体である。ある実施形態において、主題の方法で用いることができる改変体Gプロテイン−結合受容体は、配列番号2のアミノ酸配列において、10以下の保存的アミノ酸置換および/または3以下の非−保存的アミノ酸置換を有する、配列番号2に由来するアミノ酸配列を有するGプロテイン−結合受容体である。ある実施形態において、アルギニン、リジンおよびヒスチジンは、相互の代わりに保存的に置き換えることができ;グルタミン酸およびアスパラギン酸は相互に保存的に置き換えることができ;グルタミンおよびアスパラギン酸は相互に保存的に置き換えることができ;ロイシン、イソロイシンおよびバリンは相互に保存的に置き換えることができ;フェニルアラニン、トリプトファンおよびチロシンは相互に保存的に置き換えることができ;およびグリシン、アラニン、セリン、スレオニンおよびメチオニンは相互に保存的に置き換えることができる。アミノ酸置換、アミノ酸欠失、およびアミノ酸付加はいずれの位置(例えば、C−またはN−末端、または内部位置)におけるものであってもよい。いくつかの実施形態において、改変体は内因性Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性脊椎動物Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性哺乳動物Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は内因性ヒトGプロテイン−結合受容体である。いくつかの実施形態において、改変体は非−内因性Gプロテイン−結合受容体である。いくつかの実施形態において、改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、化合物1がリガンドであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値を有するリガンドであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、化合物1がアゴニストであるGプロテイン−結合受容体である。ある実施形態において、配列番号2に由来するアミノ酸配列を有する該Gプロテイン−結合受容体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおけるEC50値を有するアゴニストであるGプロテイン−結合受容体である。
【0294】
配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含むGプロテイン−結合受容体である配列番号2の改変体は、本発明の範囲内にあると考えられる。ある実施形態において、配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含む配列番号2の改変体はGPCRである。いくつかの実施形態において、配列番号2の改変体は内因性GPCRである。ある実施形態において、配列番号2の改変体は非−内因性GPCRである。いくつかの実施形態において、内因性GPCRである配列番号2の改変体は哺乳動物GPCRである。ある実施形態において、配列番号2の改変体は化合物1に特異的に結合する。ある実施形態において、配列番号2の改変体は(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従った受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。ある実施形態において、配列番号2の改変体は、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、配列番号2の改変体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。いくつかの実施形態において、配列番号2の少なくとも20、少なくとも30、少なくとも40、少なくとも50、少なくとも75、または少なくとも100連続アミノ酸を含むGプロテイン−結合受容体は検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0295】
いくつかの実施形態において、主題の方法で用いることができる改変体GPCRは、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは内因性GPCRである。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは非−内因性GPCRである。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされ、かつ内因性GPCRであるGPCRは、哺乳動物内因性GPCRである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、配列番号2またはその対立遺伝子である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、配列番号2の対立遺伝子である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは配列番号2のオルソログである。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは化合物1に特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、約50μM未満、約25μM未満、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、約10μM未満、約5μM未満、約1μM未満、約500nM未満、約100nM未満、または約50nM未満の、後記実施例12に従う受容体結合アッセイにおけるIC50値でもって、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンに特異的に結合する。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約5μM未満、約1μM未満、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。ある実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミンが、約100nM未満、約50nM未満、約25nM未満、約10nM未満、約5nM未満、または約1nM未満の、後記実施例8に従う全細胞アデニリルシクラーゼアッセイにおける当該受容体でのEC50値を有するアゴニストである受容体である。いくつかの実施形態において、高ストリンジェンシーの条件下で配列番号1の相補体にハイブリダイズするポリヌクレオチドによってコードされるGPCRは、検出可能なレベルの構成的活性を呈する。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。ハイブリダイゼーション技術は当業者によく知られている。いくつかの実施形態において、ストリンジェントなハイブリダイゼーション条件(例えば、高ストリンジェンシーの条件)は、50%ホルムアミド、5xSSC(1xSSC=150mM NaCl,15mMクエン酸三ナトリウム)、50nMリン酸ナトリウム(pH7.6)、5×デンハルト溶液、10%デキストラン硫酸、および20μg/mLの変性された剪断サケ精子DNAを含む溶液中での42℃における一晩のインキュベーション、続いての約65℃における0.1×SSC中でのフィルターの洗浄を含む。いくつかの実施形態において、ストリンジェントなハイブリダイゼーション条件(例えば、高ストリンジェンシーの条件)は、50%ホルムアミド、5xSSC(1xSSC=150mM NaCl,15mMクエン酸三ナトリウム)、50nMリン酸ナトリウム(pH7.6)、5×デンハルト溶液10%デキストラン硫酸、および20μg/mLの変性剪断サケ精子DNAを含む溶液中での42℃における一晩のインキュベーション、続いての、約50℃、約55℃、約60℃、または約65℃における0.1xSSC/0.1% SDS(ドデシル硫酸ナトリウム)中での、または0.2xSSC/0.1% SDS中での洗浄を含む。いくつかの実施形態において、該高ストリンジェンシーの条件は0.1×SSCでの65℃における洗浄を含む。いくつかの実施形態において、該高ストリンジェンシーの条件は、0.1xSSC/0.1% SDSでの、または0.2xSSC/0.1% SDSでの約50℃、約55℃、約60℃、または約65℃における洗浄を含む。
【0296】
いくつかの実施形態において、主題の方法で用いることができるGPCRは、配列番号2のアミノ酸配列を含む非−内因性の構成的に活性化された受容体であり、ここで、配列番号2のアミノ酸224位におけるロイシンはロイシン以外のアミノ酸で置き換えられている。いくつかの実施形態において、ロイシン以外のアミノ酸はリジンである。いくつかの実施形態において、ロイシン以外のアミノ酸はアラニンである。いくつかの実施形態において、ロイシン以外のアミノ酸はアルギニンである。いくつかの実施形態において、ロイシン以外のアミノ酸はヒスチジンである。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0297】
ある実施形態において、本発明のGPCRは、配列番号2を有するGプロテイン−結合受容体の構成的に活性なバージョンを含む。いくつかの実施形態において、受容体の構成的に活性なバージョンは、配列番号2を有する内因性の構成的に活性なバージョンである。いくつかの実施形態において、受容体の構成的に活性はバージョンは、配列番号2のアミノ酸224位に位置する突然変異を有する非−内因性の構成的に活性なバージョンである。いくつかの実施形態において、突然変異した残基はロイシン以外の残基に突然変異している。いくつかの実施形態において、突然変異した残基はリジン残基に突然変している。いくつかの実施形態において、突然変異した残基はアラニン残基に突然変異している。いくつかの実施形態において、突然変異した残基はアルギニン残基に突然変異している。いくつかの実施形態において、突然変異した残基はヒスチジン残基に突然変異している。いくつかの実施形態において、構成的活性は細胞内cAMPのレベルを増加させるためのものである。いくつかの実施形態において、構成的な活性はメラニン保有細胞が色素分散を受けるようにするためのものである。
【0298】
ある実施形態において、本発明のGPCRはGプロテインとで融合蛋白質の一部を形成する。
a.配列同一性
ある実施形態において、パーセント同一性は、当該分野で良く知られたBasic Local Allignment Search Tool(基本的局所整列サーチツール)(「BLAST」)を用いて評価される[例えば、その各々の開示をここで引用してその全体を援用するKarlin and Altschul,Proc Natl Acad Sci USA(1990)87:2264−2268;Altschul et al.,J Mol Biol(1990)215:403−410;Altschul et all,Nature Genetics(1993)3:266−272;およびAltschul et al.,Nucleic Acids Res(1997)25:3389−3402参照]。BLASTプログラムは、デフォルトパラメーターにて、またはユーザーによって供された改変されたパラメーターにて用いることができる。好ましくは、パラメーターはデフォルトパラメーターである。
【0299】
ある実施形態において、グローバル配列整列とも言われる、クエリー配列(例えば、配列番号2のアミノ酸配列)および照会される配列の間の最良な総マッチを決定するための好ましい方法は、Brutlag et al.(その開示をここで引用してその全体を援用するComp App Biosci(1990)6:237−245)のアルゴリズムに基づくFASTDBコンピュータプログラムを用いて決定することができる。配列整列において、クエリー配列および照会された配列は共にアミノ酸配列である。該グローバル配列整列の結果はパーセント同一性で表す。FASTDBアミノ酸整列で用いる好ましいパラメーターは:マトリックス=PAM 0、k−組=2、ミスマッチペナルティ=1、接合ペナルティ=20、ランダム化群=25、長さ=0、カットオフスコア=1、ウィンドウサイズ=配列の長さ、ギャップペナルティ=5、ギャップサイズペナルティ=0.05、ウィンドウサイズ=247、またはいずれがより短いかにかかわらず、照会されたアミノ酸配列の長さである。もし照会された配列が、内部欠失のためにではなく、N−またはC−末端欠失のためにクエリー配列よりも短いならば、パーセント同一性で表した結果は手動で修正しなければならない。なぜならば、FASTDBプログラムは、グローバルパーセント同一性を計算する場合に、照会された配列のN−およびC−末端切断を説明しないからである。クエリー配列に対し、N−およびC−末端において切断された照会された配列では、パーセント同一性は、対応する照会された配列残基とマッチ/整列しない、照会された配列のN−およびC−末端であるクエリー配列の残基の数を、クエリー配列の合計塩基のパーセントとして計算することによって修正される。残基がマッチ/整列されたか否かは、FASTDB配列整列の結果によって決定される。次いで、このパーセンテージを、特定のパラメーターを用いて上記FASTDBプログラムによって計算されたパーセント同一性から差し引いて、最終パーセント同一性スコアに到達する。この最終パーセント同一性スコアは、本発明の目的のために用いられるものである。クエリー配列とマッチ/整列しない照会された配列のN−およびC−末端に対する残基のみ(すなわち、照会された配列の最もN−およびC−末端側の残基の外側のクエリーアミノ酸残基のみ)が、パーセント同一性スコアを手動で調整する目的で考慮される。
【0300】
例えば、90アミノ酸残基の照会された配列を100−残基クエリー配列と整列させて、パーセント同一性を決定する。欠失は照会された配列のN−末端で起こり、従って、FASTDB整列はN−末端における第一の残基とマッチ/整列しない。10の不対残基は配列の10%を表し(マッチしないN−およびC−末端における残基の数/クエリー配列における残基の合計数)、従って、FASTDBプログラムによって計算されたパーセント同一性スコアから10%を差し引く。もし残りの90残基が完全にマッチすれば、最終パーセント同一性は90%となろう。もう1つの例において、90−残基の照会された配列は100−残基クエリー配列と比較される。今回、欠失は内部であり、従って、クエリーとマッチ/整列しない、照会された配列のN−またはC−末端において残基はない。この場合、FASTDBによって計算されたパーセント同一性は手動では修正されない。もう一度言うと、FASTDB整列に示されるように、クエリー配列とマッチ/整列されない、主題の配列のN−およびC−末端の外側の残基位置のみが手動で修正される。本発明の目的では他の修正はなされない。
b.融合蛋白質
ある実施形態において、目的のポリペプチドは融合蛋白質であり、例えば、アフィニティータグドメインまたはレポータードメインを含有することができる。適当なアフィニティータグは、もう1つの部位、通常もう1つのポリペプチド、最も通常には抗体に特異的に結合することができるいずれのアミノ酸配列も含む。適当なアフィニティータグは、当該分野で知られているように、エピトープタグ、例えば、V5タグ、FLAGタグ、(ヘマグルチニンインフルエンザウィルスからの)HAタグ、mycタグなどを含む。適当なアフィニティータグは、当該分野で公知のように、結合基質が知られているドメイン、例えば、HIS、GSTおよびMBPタグ、および特異的結合パートナー、例えば、抗体、特にモノクローナル抗体が利用できる他の蛋白質からのドメインも含む。適当なアフィニティータグは、適当な結合パートナー、例えば、IgG Fc受容体を用いて特異的に結合し、検出することができる、IgG Fc領域のようないずれかの蛋白質−蛋白質相互作用ドメインも含む。そのような融合蛋白質が、そのN−末端メチオニン残基が欠失されているか、または代替アミノ酸で置換されたかのいずれかであるGPCRとイン−フレーム融合された異種N−末端ドメイン(例えば、エピトープタグ)を含有することができると明示的に考えられる。
【0301】
適当なレポータードメインは、ポリペプチドの存在を報告することができるいずれのドメインも含む。アフィニティータグを用いて、例えば、タグに特異的に結合する標識された抗体を用いてポリペプチドの存在を報告することができるが、発光レポータードメインがより通常に用いられる。適当な発光レポータードメインは(例えば、ホタル、Vargula、Renilla reniformisまたはRenilla muelleriからの)ルシフェラーゼ、またはその発光改変体を含む。他の適当なレポータードメインは(例えば、クラゲ、サンゴ、およびAequoria、Renilla、Ptrilosarcus、Stylatula種からのもののような他の腔腸動物からの)蛍光蛋白質、またはその発光改変体を含む。これらのレポーター蛋白質の発光改変体は当該分野で非常によく知られており、天然レポーター蛋白質と比べてより明るく、より暗く、または異なる励起および/または発光スペクトルを有することができる。例えば、当該分野で知られているように、いくつかの改変体はそれらがもはや緑色ではなく、青色、シアン、黄色、増強された黄赤色(各々、BFP、CFP、YFP eYFPおよびRFPという)に見え得、または他の発光スペクトルを有し得るように改変される。他の適当なレポータードメインは、β−ガラクトシダーゼ、β−グルクロニダーゼ、クロラムフェニコールアセチルトランスフェラーゼ、および分泌された胚性アルカリ性ホスファターゼのような、生化学的または色の変化を通じてポリペプチドの存在を報告することができるドメインを含む。
【0302】
また、当該分野で知られているように、アフィニティータグまたはレポータードメインは目的のポリペプチドにおけるいずれの位置に存在してもよい。しかしながら、ほとんどの実施形態において、それらは目的のポリペプチドのC−またはN−末端に存在する。
2.目的のGPCRポリペプチドをコードする核酸 核酸を操作するための遺伝子暗号および組換え技術は知られており、かつ目的のGPCRポリペプチドのアミノ酸配列は上記のように記載されているため、目的のGPCRポリペプチドをコードする核酸の設計および生産は十分に当業者の技量内のものである。ある実施形態において、標準的な組換えDNA技術(Ausubel,et al,Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995;Sambrook,et al.,Molecular Cloning:A Laboratory Mannual,Second
Edition,(1989)Cold Spring Harbor,N.Y.)方法を用いる。例えば、本明細書中に記載する必要がない種々の組換え技術のいずれか1つ、またはその組合せを用い、GPCRコーディング配列をGPCRコーディング配列のライブラリーから単離することができる。蛋白質をコードする核酸配列におけるヌクレオチドの引き続いての置換、欠失および/または付加もまた標準的な組換えDNA技術を用いて行うこともできる。例えば、部位特異的突然変異誘発およびサブクローニングを用いて、目的のポリペプチドをコードするポリヌクレオチド中の核酸残基に導入し/それを欠失し/それを置換することができる。他の実施形態において、PCRを用いることができる。目的のポリペプチドをコードする核酸分子を、完全にオリゴヌクレオチドからの化学的合成によって作製することもできる(例えば、Cello et al.,Science(2002)297:1016−8)。いくつかの実施形態において、目的のポリペプチドをコードする核酸のコドンは、例えば、特定の種、特に哺乳動物、例えば、マウス、ラット、ハムスター、非−ヒト霊長類、またはヒト種の細胞で最適化される。いくつかの実施形態において、目的のポリペプチドをコードする核酸のコドンは、特定の種、特に両生類種の細胞における発現のために最適化される。
a.ベクター
本発明は、さらに、主題の核酸を含むベクター(「構築体」ともいう)を提供する。本発明の多くの実施形態において、主題の核酸配列は、この配列が、例えば、プロモーターを含めた発現制御配列に作動可能に連結された後に宿主において発現されるであろう。主題の核酸は、典型的には、エピソームとして、または宿主染色体DNAの一体的部分として宿主細胞中で複製することができる発現ベクターに入れられる。通常、発現ベクターは、所望のDNA配列で形質転換された細胞の検出を可能とするために、選択マーカー(例えば、テトラサイクリンまたはネオマイシン)を含有するであろう(例えば、ここで引用して援用する米国特許第4,704,362号参照)。単一およびデュアル発現カセットベクターを含めたベクターは当該分野で良く知られている(Ausubel,et al,Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995;Sambrook,et al.,Molecular Cloning:A Laboratory Mannual,Second Edition,(1989)Cold Spring Harbor,N.Y.)。適当なベクターはウィルスベクター、プラスミド、コスミド、人工染色体(ヒト人工染色体、細菌人工染色体、酵母人工染色体など)、ミニ−染色体などを含む。レトロウィルス、アデノウィルスおよびアデノ−関連ウィルスベクターを用いることができる。
【0303】
細胞中でポリペプチドを生産する目的で、種々の発現ベクターが当該分野で利用可能であり、それは(例えば、Invitrogen,Carlsbad,CA;Clontech,Mountain View,CA;Stratagene,La Jolla,CAから)商業的に入手可能な発現ベクターを含む。商業的に入手可能な発現ベクターは、非限定的例として、CMVプロモーター−ベースのベクターを含む。1つの適当な発現ベクターはpCMVである。発現ベクターはアデノウィルスであってよい。例示的なアデノウィルスベクターはObiogene(Carlsbad,CA)からのAdEasyTMとして購入することができる(その各々の開示をここで引用してその全体を援用するHeTC et al,Proc Natl Acad Sci USA(1998)95:2509−2514;および米国特許第5,922,576号)。他の発現ベクターは当業者に容易に明らかであろう。
【0304】
主題の核酸は通常、目的の主題のポリペプチドをコードする単一のオープンリーディングフレームを含み、しかしながら、ある実施形態においては、目的のポリペプチドの発現のための宿主細胞は真核生物細胞、例えば、ヒト細胞のような哺乳動物細胞であってよいため、オープンリーディングフレームはイントロンによって中断されていてもよい。主題の核酸は、典型的には、主題の核酸に加えて、RNA安定性、翻訳効率などを指令できる3’および5’非翻訳領域(UTR)を含有することができる転写単位の一部である。主題の核酸は、主題の核酸に加えて、目的のポリペプチドの転写および発現を指令するプロモーター、および転写ターミネーターを含有する発現カセットの一部でもあり得る。
【0305】
真核生物プロモーターは、ウィルスプロモーターおよび真核生物遺伝子に由来するプロモーターを含めた、真核生物宿主細胞において機能的ないずれのプロモーターでもあり得る。例示的な真核生物プロモーターは限定されるものではないが:マウスメタロチオネインI遺伝子配列のプロモーター(Hamer et al.,J.Mol.Appl.Gen.1:273−288,1982);ヘルペスウィルスのTKプロモーター(Mcknight,Cell 31:355−365,1982);SV40初期プロモーター(Benoist et al.,Nature(London)290:304−310,1981);酵母gall遺伝子配列プロモーター(Johnston et al.,Proc.Natl.Acad.Sci.(USA)79:6971−6975,1982);Silver et al.,Proc.Natl.Acad.Sci.(USA)81:5951−59SS,1984)、CMVプロモーター、EF−1プロモーター、エクジソン(Ecdysone)−応答性プロモーター、テトラサイクリン−応答性プロモーターなどを含む。ウィルスプロモーターは一般には特に強力なプロモーターであるため、特に目的のものであり得る。ある実施形態において、標的病原体のプロモーターであるプロモーターを用いる。本発明で用いるプロモーターは、それらが、導入される細胞型(および/または動物)で機能的であるように選択される。ある実施形態において、プロモーターはCMVプロモーターである。
【0306】
ある実施形態において、主題のベクターは選択可能なマーカーの発現を提供することができる。適当なベクターおよび選択マーカーは当該分野で良く知られており、Ausubel,et al,(Short Protocols in Molecular Biology,3rd ed.,Wiley & Sons,1995)およびSambrook,et al,(Molecular Cloning:A Laboratory Manual,Third Edition,(2001)Cold Spring Harbor,N.Y.)で議論されている。種々の異なる遺伝子が選択マーカーとして使用されており、選択マーカーとして主題のベクターで使用される特定の遺伝子は便宜のため主として選択される。公知の選択マーカー遺伝子は:チミジンキナーゼ遺伝子、ジヒドロ葉酸レダクターゼ遺伝子、キサンチン−グアニンホスホリボシルトランスフェラーゼ遺伝子、CAD、アデノシンデアミナーゼ遺伝子、アスパラギンシンテターゼ遺伝子、抗生物質耐性遺伝子、例えば、tert、ampr、Cmrまたはcat、kanrまたはneor(アミノグリコシドトランスフェラーゼ遺伝子)ヒグロマイシンBホスホトランスフェラーゼ遺伝子などを含む。上記したように目的のポリペプチドは、アフィニティードメインおよび/またはレポータードメインを含有する融合蛋白質であってもよい。例えば、GPCRのC−またはN−末端における、レポーターまたはタグとGPCRとの間の融合を行うための方法は、十分に、当業者の技量内のものであり(例えば、McLean et al,Mol.Pharma.Mol Pharmacol.1999 56:1182−91;Ramsay et al.,Br.J.Pharmacology,2001,315−323)、さらには記載しない。そのような融合蛋白質は、そのN−末端メチオニン残基が欠失されたか、または代替アミノ酸で置換されたかのいずれかのGPCRとイン−フレーム融合された異種N−末端ドメイン(例えば、エピトープタグ)を含有することができると明示的に考えられる。目的のポリペプチドはまず天然ポリペプチドから作製され、次いで、上記したように適当なレポーター/タグに作動可能に連結することができると認められる。
【0307】
主題の核酸は、通常、目的のポリペプチドをコードする核酸の構築を容易とするために、制限部位、多数クローニング部位プライマー結合部位、連結可能末端、組換え部位などを含有してもよい。
b.宿主細胞
本発明は、さらに、主題の核酸を含むベクターを含む宿主細胞を提供する。適当な宿主細胞は原核生物、例えば、細菌細胞(例えば、E.coli)、ならびに真核生物細胞、例えば、動物細胞(例えば、昆虫、哺乳動物、魚類、両生類、鳥類または爬虫類細胞)、植物細胞(例えば、トウモロコシまたはArabidopsis細胞)、または真菌細胞(例えば、S.cerevisiae細胞)を含む。ある実施形態において、目的のポリペプチドをコードする核酸の発現に適したいずれの細胞も宿主細胞として用いることができる。通常、動物宿主細胞系が用いられ、その例は以下の通りである:サル腎臓細胞(COS細胞)、SV40によって形質転換されたサル腎臓CVI細胞(COS−7,ATCC CRL 165 1);ヒト胚腎臓細胞(HEK−293[「293」],Graham et al.J.Gen Virol.36:59(1977));HEK−293T[「293T」]細胞;ベビーハムスター腎臓細胞(BHK,ATCC CCL 10);チャイニーズハムスター卵巣−細胞(CHO,Urlaub and Chasin,Proc.Natl.Acad.Sci.(USA)77:4216,(1980);シリアンゴールドハムスター細胞MCB3901(ATCC CRL−9595);マウスセルトリ細胞(TM4,Mather,Biol.Reprod.23:243−251(1980));サル腎臓細胞(CVI ATCC CCL 70);アフリカミドリザル腎臓細胞(VERO−76,ATCC CRL−1587);ヒト頸部癌腫細胞(HELA,ATCC CCL 2);イヌ腎臓細胞(MDCK,ATCC CCL 34);バッファローラット肝臓細胞(BRL 3A,ATCC CRL 1442);ヒト肺細胞(W138,ATCC CCL 75);ヒト肝臓細胞(hep G2,HB 8065);マウス乳癌(MMT 060562,ATCC CCL 51);TRI細胞(Mather et al.,Annals N.Y.Acad.Sci 383:44−68(1982));NIH/3T3細胞(ATCC CRL−1658);およびマウスL細胞(ATCC CCL−1)。ある実施形態において、メラニン保有細胞を用いる。メラニン保有細胞は下等脊椎動物で見出される皮膚細胞である。関連する材料および方法は米国特許第5,462,856号および米国特許第6,051,386号の開示に従う。これらの特許の開示をここで引用してその全体を援用する。
【0308】
さらなる細胞系は当業者に明らかであり、広く種々の細胞系がAmerican Type Culture Collection,10801 University Boulevard,Manassas,Va.20110−2209から入手可能である。
C.候補化合物のスクリーニング
1.遺伝子GPCRスクリーニングアッセイ技術
Gプロテイン受容体が活性となると、それはGプロテイン(例えば、Gq、Gs、Gi、Gz、Go)に結合し、GTPのGプロテインへの結合を刺激する。次いで、GプロテインはGTPaseとして作用し、GTPをGDPへゆっくりと加水分解し、それにより、受容体は正常な条件下では脱活性化される。しかしながら、活性化された受容体はGDPをGTPへ変化させ続ける。GTPの加水分解不能アナログである[35S]GTPγSを用いて、活性化された受容体を発現する膜への増強された結合をモニターすることができる。[35S]GTPγSを用いて、リガンドの非存在下および存在下において膜へのGプロテイン結合をモニターすることができる。当業者によく知られ、利用され得る例の中でもこのモニタリングの例は、1995年にTrynor and Nahorskiによって報告された。このアッセイシステムの好ましい使用は候補化合物の初期スクリーニングのためのものである。何故ならば、システムは、受容体の細胞内ドメインと相互作用する特別なGプロテインと無関係に全てのGプロテイン−結合受容体に総括的に適応可能であるからである。
2.特異的GPCRスクリーニングアッセイ技術
一旦、候補化合物が「総括的」Gプロテイン−結合受容体アッセイ(すなわち、アゴニストまたは逆アゴニストである化合物を選択するためのアッセイ)を用いて同定されたならば、ある実施形態においては、化合物が受容体部位において相互作用したことを確認するためにさらにスクリーニングすることが好ましい。例えば、「総括的」アッセイによって同定された化合物は受容体に結合せず、代わりに、細胞内ドメインからのGプロテインから「結合解除」するにすぎない場合がある。
a.Gs、GzおよびGi
Gsは酵素アデニリルシクラーゼを刺激する。Gi(およびGzおよびGo)は、他方、アデニリルシクラーゼを阻害する。アデニリルシクラーゼはATPのcAMPへの変換を触媒する;したがって、Gsプロテインに結合する活性化されたGPCRは増大した細胞レベルのcAMPと会合する。他方、Gi(またはGz、Go)蛋白質に結合する活性化されたGPCRは減少した細胞レベルのcAMPに会合する。一般に、“Indirect Mechanisms of Synaptic Transmission,”Chpt.8,From Neuron To Brain(3rd Ed.)Nichols,J.G.et al eds.Sinauer Associates,Inc.(1992)参照。したがって、cAMPを検出するアッセイを利用して、候補化合物が、例えば、受容体に対する逆アゴニストであるかを(すなわち、そのような化合物がcAMPレベルを減少させるかを)決定することができる。cAMPを決定するための当分野で知られた種々のアプローチを利用することができ;いくつかの実施形態において、好ましいアプローチはELISA−ベースのフォーマットでの抗−cAMP抗体の使用に依拠する。利用することができるもう1つのタイプのアッセイは、全細胞第二メッセンジャーレポーター系アッセイである。遺伝子上のプロモーターは、特定の遺伝子がコードする蛋白質の発現を駆動する。環状AMPは、cAMP−応答性DNA結合蛋白質、または次いで、cAMP応答エレメントと呼ばれる特異的部位においてプロモーターに結合する転写因子(CREB)を促進することによって遺伝子発現を駆動し、遺伝子の発現を駆動する。レポーター遺伝子、例えば、β−ガラクトシダーゼまたはルシフェラーゼの前に複数cAMP応答エレメントを含有するプロモーターを有するレポーター系を構築することができる。したがって、活性化されたGs−結合受容体はcAMPの蓄積を引き起こし、これは、次いで、遺伝子、およびレポーター蛋白質の発現を活性化する。次いで、標準的な生化学アッセイを用い、β−ガラクトシダーゼまたはルシフェラーゼのようなレポーター蛋白質を検出することができる(Chen et al.1995)。
b.GoおよびGq
GqおよびGoは酵素ホスホリパーゼCの活性化に関連し、これは、今度は、リン脂質PIP2を加水分解し、2つの細胞内メッセンジャー:ジアシルグリセロール(DAG)およびイノシトール1,4,5−三リン酸(IP3)を放出する。IP3の増加した蓄積はGq−およびGo−関連受容体の活性化に関連する。一般に、“Indirect Mechanisms of Synaptic Transmission,”Chpt.8,From Neuron To Brain(3rd Ed.)Nichols,J.G.et al eds.Sinauer Associates,Inc.(1992)参照。IP3蓄積を検出するアッセイを利用して、候補化合物が、例えば、Gq−またはGo−関連受容体に対する逆アゴニストであるか(すなわち、そのような化合物はIP3のレベルを減少させるのであろうか)を決定することができる。Gq−関連受容体は、Gq−依存性ホスホリパーゼCがAP1エレメントを含有する遺伝子の活性化を引き起こし;したがって、活性化されたGq−関連受容体はそのような遺伝子の発現の増加を証明し、次いで、それに対する逆アゴニストはそのような発現の減少を証明し、アゴニストはそのような発現の増加を証明する点で、API受容体アッセイを用いて調べることもできる。そのような検出のための商業的に入手可能なアッセイが利用可能である。
3.GPCR融合蛋白質
逆アゴニストまたはアゴニストの直接的同定のための候補化合物のスクリーニングで用いるための、内因性の構成的に活性なGPCRまたは非−内因性の構成的に活性化されたGPCRの使用は、当然のこととして、受容体がそれに結合した内因性リガンドの非存在下においてさえ活性である点で、興味深いスクリーニングチャレンジを供する。したがって、例えば、候補化合物の存在下における非−内因性受容体とその化合物の非存在下における非−内因性受容体との間を、そのような化合物が逆アゴニストまたはアゴニストであり得るか、またはそのような影響を受容体に有しないかに関する理解を供する目的で識別するために、いくつかの実施形態においては、そのような識別を増強することができるアプローチを利用するのが好ましい。いくつかの実施形態において、好ましいアプローチはGPCR融合蛋白質の使用である。
【0309】
一般に、一旦、上記したアッセイ技術(ならびに当業者に知られた他のアッセイ技術)を用いて非−内因性GPCRが構成的に活性化されたことが決定されれば、内因性GPCRと結合する支配的なGプロテインを決定することが可能である。GプロテインのGPCRへの結合は、評価することができるシグナリング経路を提供する。いくつかの実施形態においては、スクリーニングは、哺乳動物またはメラニン保有細胞発現系(系それ自体は、内因性Gプロテインをその中で有すると予測される)を用いて行うのが好ましい。したがって、当然のこととして、そのような系においては、非−内因性の構成的に活性化されたGPCRは継続的にシグナルを発する。いくつかの実施形態において、このシグナルは、増強されることが好ましく、それにより、例えば、受容体に対する逆アゴニストの存在下で、逆アゴニストと接触する受容体との間を、特にスクリーニングの関係でより容易に識別できるようにする可能性が高い。
【0310】
GPCR融合蛋白質は、GPCRとのGプロテイン結合の効率を増強させることを意図する。GPCR融合蛋白質は、内因性の構成的に活性なGPCRまたは非−内因性の構成的に活性なGPCRいずれかでのスクリーニングに好ましいであろう。何故ならば、そのようなアプローチは、そのようなスクリーニング技術で一般化されたシグナルを増加させるからである。これは、有意な「ノイズに対するシグナル」比率を容易化するのに重要であり;そのような有意な比率は、本明細書中に開示された候補化合物のスクリーニングのために好ましい。
【0311】
GPCR融合蛋白質の発現で有用な構築体の構築は、当業者の技術範囲内のものである。商業的に入手可能な発現ベクターおよび系は、研究者の特別な要望に適合し得る種々のアプローチを供する。そのようなGPCR融合蛋白質構築体の構築における重要な基準は、限定されるものではないが、GPCR配列およびGプロテイン配列双方がイン−フレームであること(好ましくは、内因性GPCRについての配列がGプロテイン配列の上流にある)、およびGPCRの「停止」コドンは、GPCRの発現に際して、Gプロテインもまた発現することができるように欠失または置換されることを含む。GPCRは直接的にGプロテインに連結させることができ、あるいは2つの間にスペーサー残基が存在し得る(好ましくは、約12以下であるが、この数字は当業者によって容易に確認できる)。便宜上、スペーサーを用いるのが好ましい。いくつかの実施形態において、非−内因性GPCRに結合するG蛋白質はGPCR融合蛋白質構築体の作製に先立って同定されているのが好ましい。上記したように、Gi、GzおよびGoに結合する活性化されたGPCRは、チャレンジしたGPCRのタイプに基づいてcAMP作製アッセイの形成を阻害すると予測される(すなわち、cAMPシグナルは、例えば、アゴニスト(さらにこのシグナルを減少させるであろう)の活性化に際して減少し、それによって、アゴニストの直接的同定を行う)。本明細書中に開示されているように、これらのタイプの受容体について、生(viable)シクラーゼベースアッセイを確立する努力において、GPCRの内因性Gプロテインに基づかないGPCR融合蛋白質を作製することが可能であることが確かめられている。したがって、例えば、内因性Gi結合受容体をGs蛋白質に融合させることができ、そのような融合構築体は、発現に際して、内因性GPCRを、シクラーゼ−ベースアッセイを確立することができるように、「天然の」Gi蛋白質よりはむしろGsと結合するよう、「駆動する」または「強いる」。したがって、Gi、GzおよびGo結合受容体では、いくつかの実施形態において、GPCR融合蛋白質を用い、かつアッセイがアデニリルシクラーゼ活性の検出に基づく場合、融合構築体がGs(または酵素アデニリルシクラーゼの形成を刺激する同等なGプロテイン)で確立されるのが好ましい。
表C
【0312】
【化3】

同等に有効なのは、Gs、Gi、GzまたはGo蛋白質と融合したGq蛋白質を利用するG蛋白質融合構築体である。いくつかの実施形態において、好ましい融合構築体は、G−プロテインα−サブユニット(「Gαq」)の最初の6つのアミノ酸が欠失され、GαqのC−末端における最後の5つのアミノ酸が目的のGプロテインのGαの対応するアミノ酸で置き換えられたGq蛋白質で達成することができる。例えば、融合構築体は、Gi蛋白質と融合したGq(6アミノ酸欠失)を有することができ、その結果、「Gq/Gi融合構築体」がもたらされる。この融合構築体は、第二のメッセンジャー、例えば、イノシトール三リン酸またはジアシルグリセロールがcAMP生産の代わりに決定できるように、内因性Gi結合受容体を、その非−内因性GプロテインであるGqに結合させるであろう。
4.標的Gi結合GPCRのシグナル−増強剤Gs結合GPCRとの共−トランスフェクション(cAMPベースのアッセイ)
Gi結合受容体はアデニリルシクラーゼを阻害することが知られており、従って、cAMPレベルチャレンジの評価をすることができるcAMP生産のレベルを低下させる。ある実施形態においては、活性化に際して圧倒的にGiに結合する受容体の活性化の表示としてcAMPの生産の減少を決定する効果的な技術は、活性化に際して圧倒的にGsと結合するシグナル増強剤、例えば、非−内因性の構成的に活性化された受容体(例えば、TSHR−A623I;後記参照)を、Gi結合GPCRで共−トランスフェクトすることによって達成することができる。明らかなように、Gs結合受容体の活性化は、cAMPの生産の増加に基づいて決定することができる。Gi結合受容体の活性化は、cAMPの生産の減少に導く。したがって、共−トランスフェクションアプローチは、これらの「反対」効果を有利に利用することを意図する。例えば、非−内因性の構成的に活性化されたGs結合受容体(「シグナル増強剤」)の、発現ベクター単独との共−トランスフェクションは、ベースラインcAMPシグナルを供する(すなわち、Gi結合受容体はcAMPレベルを減少させるが、これが、この「減少」は、構成的に活性化されたGs結合シグナル増強剤によって確立されたcAMPレベルの実質的増加に対するものであろう)。次いで、標的増強剤を「標的受容体」で共−トランスフェクトすることによって、Gi結合標的受容体の逆アゴニストは測定されるcAMPシグナルを増加させ、他方、Gi結合標的受容体のアゴニストはこのシグナルを減少させるであろう。
【0313】
このアプローチを用いて直接的に同定される候補化合物を独立して評価して、これらがシグナル増強受容体を標的化しないことを確認すべきである(これは、共−トランスフェクトされた受容体に対するスクリーニングに先立って、または後に行うことができる)。組成物/処方および治療の方法
GPR119アゴニストは、当該分野でよく知られた技術を用い、本発明に従う使用のために医薬組成物および医薬に処方することができる。適当な処方は選択された投与経路に依存する。ある実施形態において、該投与は非−ヒト脊椎動物に対するもの、または非−ヒト哺乳動物に対するものである。
【0314】
本発明の療法、すなわち、GPR119アゴニストに関する療法に関するように、本発明による化合物はいずれかの適当な方法で投与することができる。適当な投与の経路は、当該分野で知られた方法を用いる、経口、鼻腔、直腸、経粘膜、経皮、または腸投与、筋肉内、皮下、脊髄内注射を含めた非経口送達、ならびにクモ膜下腔内、直接的心室内、静脈内、腹腔内、鼻腔内、肺内(吸入)または眼内注射を含む。他の適当な投与経路はエアロゾルおよびデポ処方物である。本発明の医薬の徐放性処方物、特に、デポ剤が明示的に考えられる。ある好ましい実施形態において、本発明による化合物は経口投与される。本発明による化合物は、錠剤、カプセル、粉末、シロップ、エリキシルなど、エアロゾル、滅菌溶液、懸濁液またはエマルジョンなどのような個体または液体形態で作製することができる。ある実施形態において、GPR119アゴニストは経口投与される。
【0315】
経口投与のための処方は、固体の錠剤およびカプセル処方物に加えて、水性溶液および懸濁液の形態とすることができる。水性溶液および懸濁液は滅菌粉末または顆粒から調製することができる。化合物は水、ポリエチレングリコール、プロピレングリコール、エタノール、トウモロコシ油、綿実油、落花生油、ゴマ油、ベンジルアルコール、塩化ナトリウム、および/または種々の緩衝液に溶解させることができる。他の補助剤は当該分野でよくかつ広く知られている。
【0316】
GPR119アゴニストの医薬組成物は、例えば、慣用的な混合、溶解、造粒、糖衣−作製、混練、乳化、カプセル化、包みこみ、凍結乾燥プロセスまたは噴霧乾燥によって、当該分野で良く知られた方法によって調製することができる。
【0317】
本発明に従って用いる医薬組成物は、医薬的に用いることができる製剤への活性化合物の加工を容易とする賦形剤および補助剤を含む1以上の生理学的に活性な担体を用いる慣用的な方法で処方することができる。適当な医薬上許容される担体は当業者に利用可能である(例えば、その各々の開示をここで引用してその全体を援用するRemington:The Science and Proctice of Pharmacy,(Gennaro et al.,eds.),20th Edition,2000,Lippincott Williams & Wilkins;and Handbook of Pharmaceutical Excipients(Rowe et al.,eds),4th Edition,2003,Pharmaceutical Press参照)。適当な処方は、選択された投与の経路に依存する。用語「担体」物質または「賦形剤」物質は、本明細書中においては、担体および/または希釈剤および/または補助剤、または治療剤の対象への送達のためのビヒクルとして用いられるため、またはその取扱いまたは貯蔵特性を改良するため、あるいは経口投与に適したカプセルまたは錠剤のような区別される製品への組成物の投与単位の形成を可能とするため、または容易とするために医薬組成物に加えられるそれ自体は治療剤でないいずれの物質も意味する。賦形剤は、例示として、限定されるものではないが、希釈剤、崩壊剤、結合剤、接着剤、湿潤剤、ポリマー、滑沢剤、グライダント、不快な味または匂いをマスクするかまたはそれに逆作用させるために加えられる物質、フレーバー剤、色素、フラグランス、および組成物の外観を改良するために加えられる物質を含むことができる。許容される賦形剤はステアリン酸、ステアリン酸マグネシウム、酸化マグネシウム、リン酸および硫酸のナトリウムおよびカルシウム塩、炭酸マグネシウム、タルク、ゼラチン、アカシアガム、アルギン酸ナトリウム、ペクチン、デキストリン、マンニトール、ソルビトール、ラクトース、スクロース、デンプン、ゼラチン、アルカン酸のセルロースエステルおよびセルロースアルキルエステルのようなセルロース物質、低融解ワックスカカオ脂または粉末、ポリビニル−ピロリドン、ポリビニルアルコール、およびポリエチレングリコールのようなポリマー、および他の医薬上許容される物質を含む。医薬組成物の成分は簡便な投与のためにカプセル化し、または錠剤化することができる。
【0318】
医薬上許容されるとは、薬理学的/毒物学的観点から患者に、および組成、処方、安定性、患者の許容性および生物学的利用性に関する物理的/化学的観点から製薬化学者に許容される特性および/または物質をいう。
【0319】
糖衣コアには適当なコーティングを施す。この目的では、濃縮糖溶液を用いることができ、これは、所望により、アラビアガム、タルク、ポリビニルピロリドン、カルボポルゲル、ポリエチレングリコールおよび/または二酸化チタン、ラッカー溶液、および適当な有機溶媒または溶媒混合液を含有してもよい。色素または顔料を、活性化合物の用量の異なる組合せを識別するためまたは特徴付けるために錠剤または糖衣コーティングに加えてもよい。
【0320】
経口的に用いることができる医薬組成物はゼラチンで作成されたプッシュ−フィットカプセル、ならびにゼラチン、およびグリセロールまたはソルビトールのような可塑剤で作製された柔軟なシールされたカプセルを含む。プッシュ−フィットカプセルはラクトースのような充填剤、デンプンのようなバインダーおよび/またはタルクまたはステアリン酸マグネシウムのような滑沢剤および、所望により、安定化剤と混合された有効成分を含有することができる。柔軟なカプセルにおいては、活性な化合物を脂肪油、流動パラフィン、液体ポリエチレングリコール、クレモフォール、カプムル、中鎖または長鎖モノ−、ジ−またはトリグリセリドのような適当な液体に溶解または懸濁することができる。また、安定化剤をこれらの処方物に加えることもできる。
【0321】
加えて、GPR119アゴニストは徐放系を用いて送達することができる。種々の徐放性物質は確立されており、当業者によく知られている。徐放性カプセルは特に好ましい。例えば、グリセリルモノステアレートまたはグリセリルジステアレート時間遅延物質を使用することができる。該投与形態は米国特許第4,256,108号、第4,166,452号、および第4,265,874号に記載された技術によって被覆して、制御放出のための浸透圧治療錠剤を形成することもできる。
【0322】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、単独で、あるいは1以上の他の医薬または生理学的な活性な化合物と組み合わせて投与し、または供することができる。本発明の1つの態様において、他の医薬上または薬理学上許容される化合物はGPR119アゴニストではない。本発明の1つの態様において、他の医薬上または生理学上許容される化合物はカルシウム、ビタミンD、エストロゲン、チボロン、選択的エストロゲン受容体モジュレーター(SERM:例えば、ラロキシフェン、タモキシフェン)、ビホスホネート(例えば、エチドロネート、アレンドロネート、リセドロネート)、カルシトニン、ビタミンDの1α−、ヒドロキシル化代謝産物、フッ化物、チアジド、同化ステロイド、イプリフラボン、ビタミンK、副甲状腺ホルモン(PTH)、ストロンチウム、スタチン、オステオプロテレシン、EP4受容体選択的アゴニスト、カンナビノイド受容体タイプ2(CB2)選択的アゴニストおよびp38 MAPキナーゼ阻害剤より成る群から選択される医薬剤である。(例えば、World Health Organization Technical Report Series 921(2003),Prevention and Management of Osteoporosis参照)。
【0323】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの実施形態において、本発明は、一定量の本発明によるGPR119アゴニスト、および少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。
【0324】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの態様において、本発明は、一定量の本発明によるGPR119アゴニスト、および少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。または、本発明は、GPR119アゴニストは骨粗鬆症のような低骨質量によって特徴付けられる状態を治療し、または予防するにおいて、および/または個体において骨質量を増加させるにおいて、効果を生じるに十分な量である組成物または医薬組成物の投与形態にも関する。
【0325】
1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をその要旨とする。1つの態様において、本発明は、一定量の本発明によるGPR119アゴニストおよび少なくとも1つの医薬上許容される担体を含む、または実質的にそれよりなる医薬組成物をその要旨とする。また、本発明はGPR119アゴニストが、個体においてGIPレベルを増加させるにおいて効果を生じるのに十分な量である組成物、または医薬組成物の投与形態にも関する。
【0326】
本発明で用いるのに適当な医薬組成物は、それらの意図した目的を達成する量で含有された組成物を含む。いくつかの実施形態において、本発明の医薬組成物は、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防するのに、または個体において骨質量を増加させるのに有用であると理解される。低骨質量によって特徴付けられる状態は、本発明に従うものである。いくつかの実施形態において、本発明の医薬組成物は個体においてGIPレベルを増加させるのに有用であると理解される。本発明に関するように、本発明による意図した目的を達成するのに十分なGPR119アゴニストの量の決定は、特に、ここで提供する詳細な開示に照らして、十分に当業者の能力内のものである。
【0327】
限定されるものではないが、マウス、ラット、ウサギ、ブタ、および非−ヒト霊長類を用いる実験を含めた、動物実験から得られたデータは、ヒトで用いられる一定範囲の用量を処方するのに用いることができる。一般に、当業者であれば、どのようにして動物モデル系で得られたイン・ビボデータをヒトのようなもう一つの動物に外挿するかを理解している。いくつかの状況において、これらの外挿が、ヒトのようなもう一つの動物と比較した、動物モデルの体重に単に基づくことができ;他の状況においては、これらの外挿は単に体重に基づくものではなく、むしろ種々の因子を取り込むものである。代表的な因子は、患者のタイプ、年齢、体重、性別、食餌および医学的状態、疾患の重症度、投与の経路、治療する特定の化合物の活性、効率、薬物動態学プロフィールおよび毒性学プロフィールのような薬理学的考慮、薬物送達系が利用されるか否か、急性または慢性のいずれの疾患状態が治療または予防が行われるか、あるいは本発明の化合物に加えて、および薬物組合せの一部としてさらなる活性化合物が投与されるか否かを含む。本発明の化合物および/または組成物で疾患状態を治療するための投与養生法は、上記した種々の因子に従って選択される。したがって、使用される現実の投与養生法は広く変動する可能性があり、従って、好ましい投与養生法から隔たる可能性があり、当業者であれば、これらの典型的な範囲外の投与および投与養生法をテストすることができ、適切であれば本発明の方法で用いることができるのを認識するであろう。
【0328】
例示的な動物モデル系はラット卵巣摘出(OVX)骨喪失モデルである。卵巣摘出ラットは、エストロゲン枯渇ヒト骨格筋の重要な臨床的特徴、および治療剤の応答を正しくエミュレートする優れた前臨床動物モデルである。このモデルにおいては、卵巣摘出に関連する骨喪失は部分的にまたは完全に妨げられる場合に、治療効果が達成される(例えば、Bollag et al,Mol Cell Endocrinol(2001)177:35−41;およびJee et al,J Musculoskel Neuron Interact(2001)1:193−207参照)。いくつかの実施形態において、卵巣摘出に関連する骨喪失は少なくとも約10%妨げられ、少なくとも約20%妨げられ、少なくとも約30%妨げられ、少なくとも約40%妨げられ、少なくとも約50%妨げられ、少なくとも約60%妨げられ、少なくとも約70%妨げられ、少なくとも約75%妨げられ、少なくとも約80%妨げられ、少なくとも約85%妨げられ、少なくとも約90%妨げられ、少なくとも約95%妨げられ、または100%妨げられる場合に治療効果が達成される。
【0329】
さらなる例示的な動物モデル系は、マウスにおけるグルコースチャレンジ後の血中GIPレベルの増加である。ある実施形態において、血中GIPレベルは血漿中GIPレベルである。ある実施形態において、GIPレベルはグルコース−非依存性GIPレベルである。ある実施形態において、GIPレベルはグルコース−非依存性GIPレベルである。ある実施形態において、GIPは合計GIPである。ある実施形態において、合計GIPは、中央に向けられたアッセイ、またはC−末端に向けられたアッセイを用いて決定される。ある実施形態において、GIPは生物活性GIPである。ある実施形態において、生物活性GIPはN−末端特異的アッセイを用いて決定される。ある実施形態において、生物活性GIPは骨形成を促進するための活性を有する。ある実施形態において、治療効果は、血中GIPレベルが少なくとも約10%、少なくとも約25%、少なくとも約50%、少なくとも約100%、少なくとも約150%、少なくとも約200%、少なくとも約300%、少なくとも約400%、少なくとも約500%増加する場合に達成される。
【0330】
投与量および間隔を調整して意図した治療効果を供することができる。本発明によるGPR119アゴニストの正確な用量はGPR119アゴニスト、その能力、投与の形態、患者の年齢および体重、および治療すべき状態の重症度に依存して変化するであろう。正確な処方、投与の経路、および用量は、患者の状態を考慮して個々の意思によって選択され得る。説明として、限定されるものではないが、本発明によるGPR119アゴニストの量は約0.001mg/kg未満、約0.005mg/kg未満、約0.01mg/kg未満、約0.05mg/kg未満、約0.1mg/kg未満、約0.5mg/kg未満、約1mg/kg未満、約5mg/kg未満、約10mg/kg未満、約50mg/kg未満、または約100mg/kg未満である。ある実施形態において、本発明によるGPR119アゴニストの量は約0.001〜100mg/kg体重未満、約0.001〜50mg/kg体重未満、約0.001〜10mg/kg体重未満、約0.001〜5mg/kg体重未満、約0.001〜1mg/kg体重未満、約0.001〜0.5mg/kg体重未満、約0.001〜0.1mg/kg体重未満、約0.001〜0.05mg/kg体重未満、約0.001〜0.01mg/kg体重未満、または約0.001〜0.005mg/kg体重未満である。
【0331】
毎日または規則的ベースで投与して所望の結果を達成することができる、本発明のモジュレータ(例えば、GPR119アゴニスト)の量についての好ましい用量範囲は0.1〜100mg/kg体重である。他の好ましい用量範囲は0.1〜30mg/kg体重である。他の好ましい用量範囲は0.1〜10kg/mg体重である。他の好ましい用量範囲は0.1〜3.0kg/mg体重である。もちろん、これらの日用量は、1日の間に周期的に少量ずつ送達、投与することができる。これらの用量範囲は好ましい範囲にすぎず、本発明を限定するつもりはないことを注記する。
【0332】
投与量および間隔は個々に調整して、意図した治療効果を達成する、本発明によるGPR119アゴニストの血漿中レベルを供することができる。投与の間隔は、選択された範囲のGPR119アゴニスト濃度についての値を用いて決定して、意図した治療効果を達成することもできる。GPR119アゴニストは、時間の10〜90%の間の、好ましくは、時間の30〜99%の間の、最も好ましくは時間の50〜90%の間のGPR119アゴニスト濃度の選択された範囲内に血漿中レベルを維持する養生法を用いて投与すべきである。局所的投与または選択的摂取の場合には、意図した治療効果を供するGPR119アゴニスト濃度の範囲は、血漿中濃度に関連しなくてもよい。
【0333】
投与される組成物の量はもちろん、治療すべき個体、個体の体重、疾患の重症度、投与の様式、および処方する医師の判断に依存するであろう。
【0334】
1つの態様において、本発明は、従って、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる、治療有効量の組成物をそれを必要とする個体に投与することを含む、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防し、または骨質量を増加させる方法をその要旨とする。他の実施形態において、該組成物は医薬組成物である。
【0335】
1つの態様において、本発明は、治療有効量の、一定量の本発明によるGPR119アゴニストを含む、または実質的にそれよりなる組成物をそれを必要とする個体に投与することを含む、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防し、または骨質量を増加させる方法に関する。関連する態様において、本発明は、GPR119アゴニストが、個体においてGIPレベルを増加させるにおいて効果を与えるのに十分な量で投与される該方法をその要旨とする。ある実施形態において、該組成物は医薬組成物である。
【0336】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、個体において低骨質量によって特徴付けられる状態を治療または予防するにおいて、および個体において骨質量を増加させるのに有用である。
【0337】
低骨質量によって特徴付けられる状態は、限定されるものではないが、骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出術骨喪失、子供時代の特発性骨喪失、パジェット病、転移性癌による骨喪失、骨溶解病巣、脊髄の湾曲、および身長の喪失を含む。ある実施形態において、低骨質量によって特徴付けられる状態は骨粗鬆症である。ある実施形態において、低骨質量において特徴付けられる状態は骨粗鬆症である。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。低骨質量によって特徴付けられる状態は、限定されるものではないが、脊髄の湾曲、身長の喪失、および補鉄外科的処置のような骨粗鬆症の長期合併症も含む。低骨質量によって特徴付けられる状態は個々に、あるいはいずれかの組合せにて実施形態に含むことができると理解される。ある実施形態において、低骨質量によって特徴付けられる状態は一次骨粗鬆症である。
【0338】
ある実施形態において、増大した骨質量を必要とする個体は、若い成人参照平均の下で1を超える(T−スコア<−1)、1.5を超えるまたはそれと等しい(T−スコア≦―1.5)、2よりも大きな、またはそれと等しい(T−スコア≦−2)または2.5よりも大きな、またはそれと等しい(T−スコア≦−2.5)標準偏差の骨ミネラル密度(BMD)を有する。ある実施形態において、増加した骨質量を必要とする個体は骨折の治療を必要としている。ある実施形態において、骨折の治療を必要とする個体は外傷骨折、長期骨折、または骨粗鬆症骨折を有する。ある実施形態において、個体は骨疾患についての治療を必要としている。ある実施形態において、骨疾患に対する治療を必要とする個体は骨減少症、骨粗鬆症、慢性関節リウマチ、変形性関節症、歯周状態、歯槽骨喪失、骨摘出術骨喪失、子供時代の特発性骨喪失、パジェット病、転移性癌による骨消失、骨溶解病巣、脊髄の湾曲、または身長の喪失を有する。ある実施形態において、骨疾患に対する治療を必要とする個体は骨粗鬆症を有する。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。本発明に従って治療することができる破壊的骨障害は、限定されるものではないが、骨粗鬆症、変形性関節症、および新形成病、放射線療法、または化学療法によって引き起こされるような骨溶解病巣を含む。ある実施形態において、骨粗鬆症は一次骨粗鬆症である。ある実施形態において、骨粗鬆症は二次骨粗鬆症である。
【0339】
本発明の療法、すなわち、GPR119アゴニストに関する療法は、顔面再形成、上顎再形成、下顎再形成、歯周状態または抜歯後の骨治癒、長骨延長の増強、補鉄内部成長の増強または個体における骨結合の増加で有用である。
【0340】
ある実施形態において、個体は脊椎動物である。ある実施形態において、脊椎動物である個体は魚類、両生類、爬虫類、鳥類または哺乳動物である。ある実施形態において、個体または脊椎動物は哺乳動物である。ある実施形態において、哺乳動物である個体または脊椎動物はマウス、ラット、ハムスター、ウサギ、ブタ、イヌ、ネコ、ウマ、ウシ、ヒツジ、ヤギ、非−ヒト哺乳動物、非−ヒト霊長類、またはヒトである。ある実施形態において、個体はヒトである。ある実施形態において、ヒトは閉経後の婦人、または50歳を超える男性である。
【0341】
さらなる努力を必要とせず、当業者であれば、これまでの記載を用い、本発明をその最大限まで実施することができると考えられる。こ本発明の範囲内にある改変は当業者に明らかとなるように、れまでの詳細な記載は理解の明瞭性のみのために掲げるものであり、不必要な限定と理解されるべきでない。
【0342】
本出願は、示された日付に合衆国特許商標局に合衆国速達便を介して出願された以下の仮特許出願からの優先権の利益を主張する:2006年4月11日に出願された米国仮特許出願番号60/791,550。上記仮特許出願の開示を、ここで、引用してその全体を援用する。
【0343】
本出願を通じて、種々の刊行物、特許および特許出願が引用される本出願中で引用されたこれらの刊行物、特許および特許出願の開示をここで引用してその全体を本開示に援用する。刊行物、特許または特許出願の出願人によるここでの引用は、該刊行物、特許または特許出願の出願人による先行技術としての自認ではない。
【実施例】
【0344】
さらなる努力を必要とせず、当業者であれば、これまでの記載を用いて本発明をその最大限まで実施することができる。以下の詳細な実施例は、単なる説明として解釈されるべきであり、断じてこれまでの開示を限定するものではない。当業者であれば、該手法から適当な変形をすぐに認識するであろう。
実施例1:野生型マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果の薬物動態学分析
A.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに帰属させた。図1Aに示すように、マウスにビヒクル(PET;80%PEG400、10%エタノール、10%Tween 80)を、または20mg/kgの本発明によるGPR119アゴニスト(化合物1;(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン)を経口投与した。処理から30分後、3g/kgのグルコースボーラスを経口送達し、グルコースボーラス後0(グルコースボーラスなし)、2、5、10、20、40および60分に血漿を収集した。供給業者によって供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。図1Aに示された結果から、GPR119アゴニストの投与は、マウスの血液中でのGIPのグルコース−依存性およびグルコース−非依存性の双方のレベルを増加させたことは明らかである。化合物1はマウスにおいて血漿中の全GIPを刺激した。化合物1は、国際特許出願番号PCT/US2004/001267(WO 2004/065380)として公開)に開示された化合物と同一である。
B.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに帰属させた。図1Bに示すようにマウスに、ビヒクル(20%ヒドロキシプロピル−β−シクロデキストリン(HPCD))を、または10mg/kgの本発明によるGPR119アゴニスト(化合物3)を経口投与した。処理から30分後に3g/kgのグルコースボーラスを経口送達し、グルコースボーラスから0(グルコースボーラスなし)、5、10、20、60および120分において血漿を収集した。供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入されたげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。統計学的分析を、Excelプログラムを用いて行った。GIP濃度の平均値は、各群における6匹のマウスでの結果に基づいて計算し、平均±SEMとして示される。図1Bに示される結果より、GPR119アゴニストの投与は、マウスの血液中におけるGIPのグルコース−依存性、およびグルコース−非依存性の双方のレベルを増大させたことは明らかである。化合物3は、マウスにおいて血漿中合計GIPを刺激した。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647)として公開)に開示された化合物と同一である。
C.C57blk/6雄マウスを18時間絶食させ、各群についてn=6にて14の群にランダムに割り当てた。マウスにビヒクル(20%ヒドロキシプロピル−β−シクロデキストリン(HPCD))を、または1、3、または10mg/kgの本発明によるGPR119アゴニスト(化合物3)を経口投与した。処理から30分後に3g/kgのグルコースボーラスを経口送達し、血漿をグルコースボーラス後0(グルコースボーラスなし)または5分において収集した。供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによって血漿中GIPレベルを決定した。GIP濃度の平均値を各群において6匹のマウスでの結果に基づいて計算し、図1Cに示す。図1Cから、GPR119アゴニスト(化合物3)はマウスにおいて用量依存的に血漿中合計GIPを刺激したのは明らかである。化合物3は国際特許出願番号PCT/US2004/022327(WO 2005/007647として公開)に開示された化合物と同一である。
実施例2:野生型マウスと比較したGPR119−欠損(ノックアウト)マウスにおける血中GIPレベルに対するGPR119アゴニストの投与の効果
A.GPR119−欠損雄マウスおよび野生型同腹子を18時間絶食させた。マウスに、示したように(n=5)、ビヒクル(PET;80%PEG400、10%エタノール、10%Tween80)を、または20mg/kgの本発明によるGPR119アゴニスト(化合物1;(2−フルオロ−4−メタンスルホニル−フェニル)−{6−[4−(3−イソプロピル−[1,2,4]オキサジアゾール−5−イル)−ピペリジン−1−イル]−5−ニトロ−ピリミジン−4−イル}−アミン)を経口投与した。処理から30分後に、眼の眼球後静脈を介して血液(100μL)を収集し(時刻0)、続いて、3g/kgのグルコースボーラスを与えた(経口)。グルコース送達から5分後に、もう一つの血液試料(100μL)を収集した(時刻5分)。血漿を遠心後に収集し、製造業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入したげっ歯類GIP ELISAキットを用いることによってGIPレベルを決定した。図2Aに示される結果より、機能的GPR119受容体が、マウスの血液中にてGIPのグルコース−非依存性レベルおよびグルコース依存性レベルを増加させるための投与されたGPR119アゴニストで必要であったことが明らかである。化合物1は野生型マウスにおける血漿中合計GIPを刺激した。化合物1は、国際特許出願番号PCT/US2004/001267(WO 2004/065380として公開)で開示された化合物と同一である。
B.GPR119欠損雄マウスおよび野生型同腹子を18時間絶食させた。マウスに、示されたように(n=5)、ビヒクル(40%ヒドロキシプロピル−ベータ−シクロデキストリン(HPCD))を、または30mg/kgの本発明によるGPR119アゴニスト(化合物2)を経口投与した。処理から30分後に、血液(100μL)を眼の眼球後静脈を介して収集し(時刻0)、続いて3g/kgのグルコースボーラスを(経口)投与した。グルコース送達から5分後に、もう一つの血液試料(100マイクロリットル)を収集した(時刻5分)。遠心後に血漿を収集し、供給業者によって提供された指示書に従い、Linco Research Laboratory[Rat/Mouse Gastric Inhibitory Polypeptide(Total)ELISA Catalog#EZRMGIP−55K]から購入されたげっ歯類GIP ELISAキットを用いることによってGIPレベルを決定した。GIP濃度の平均値は、各群において5匹のマウスでの結果に基づいて計算した。図2Bに示された結果から、投与されたGPR119アゴニストがマウスの血液中でのGIPのグルコース−非依存性レベルおよびグルコース−依存性レベルを増加させるために、機能的GPR119受容体がで必要であったことは明らかである。化合物2は野生型マウスにおいて血漿中合計GIPを刺激した。化合物2は国際特許出願番号PCT/US2004/022417(WO2005/007658として公開)に開示された化合物と同一である。
実施例3:卵巣摘出ラットにおける骨質量に対するGPR119アゴニストの投与の効果
本発明によるGPR119アゴニストは、後に記載するイン・ビボ卵巣摘出(OVX)ラットモデル(例えば、Bollag et al.,Mol Cell Endocrinol(2001)177:35−41参照)を用いて、骨粗鬆症のような低骨質量によって特徴付けられる状態を治療または予防することにおいて、および/または個体において骨質量を増加することにおいて効果的であることを示すことができる。
【0345】
8週齢の20匹の雌OVXおよび20匹の非−OVX Sprague−Dawley処女ラット(150〜175g)はHarlan Sprague−Dawley,Inc.(Indianapolis,IN)から購入する。動物に自由に通常の市販のペレット食餌Teklab Rodent食餌(1.46%カルシウム)を与え、水に自由にアクセスさせた。ラットを4つの体重がマッチした実験群にランダムに分割し、ビヒクル、または本発明によるGPR119アゴニストを経口的に受けるように選択する。処理は6週間の間、毎日ベースで継続する。
【0346】
1.対照。10匹の非−OVXラットにビヒクルを経口投与する。
【0347】
2.対照+処理。10匹の非−OVXラットにGPR119アゴニストを経口投与する。
【0348】
3.OVX。10匹のOVXラットにビヒクルを経口投与する。
【0349】
4.OVX+処理。10匹のOVXラットにGPR119アゴニストを経口投与する。ラットの体重を毎日計り、ベースラインにおいて、および6週間に再度身長を決定する。Hologic QDR1000/W(Waltham,MA)を用いるデュアルエネルギーX線吸収測定(DXA)を、処理の開始に先立って、および6週間において全ての動物で行い、ソフトウェアRat Whole Bodyバージョン5.53を用いてデータを分析する。骨ミネラル密度(BMD)を脊髄において決定する。
【0350】
処理から6週間後における脊椎動物の骨密度の%変化を決定する。GPR119アゴニストの投与は脊椎動物骨密度に対する卵巣摘出の負の効果を減衰させることが示される。脊椎動物骨密度に対する卵巣摘出の負の効果の減衰は、骨粗鬆症のような低骨密度によって特徴付けられる状態を治療および予防するのに、および/または個体において骨密度を増加させることにおいて効果を有する処理を示す。
実施例4:骨折治癒に対するGPR119アゴニストの投与の効果
本発明によるGPR119アゴニストは、後に記載するイン・ビトロアッセイを用いる骨折の治療で効果的であることを示すことができる。
骨折技術
3箇月齢のSprague−Dawleyラットをケタミンで麻酔する。右側脛骨、大腿骨の近位部分の前内側態様で1cm切開を行う。以下に脛骨外科的技術を記載する。切開を骨に至るまで行い、前側隆起に対して2mm内側の脛骨粗面の末端側態様に対して4mm近位にて1mm穴をドリルで開ける。脊髄内ネイリングを0.8mmステンレス鋼チューブで行う(最大負荷36.3N、最大硬さ61.8N−mm、骨と同一の条件下でテスト)。脊髄管のリーマ通しは行わない。標準化された閉鎖骨折が、平坦な顎をもつ特別に設計された調整可能な鉗子を用いる3点の曲げによって脛腓接合から2mm上方に生じる。柔軟組織の損傷を最小化するために、骨折を変位させないように注意を払う。皮膚をモノフィラメントナイロン縫合糸で閉じる。滅菌条件下で手術を実行する。全ての骨折のX線写真撮影はネイリング直後に取り、特定の骨幹領域の外側の骨折、または変位した爪を持つラットは排除する。残りの動物を、骨折治癒をテストするための時点当たりの各亜群当たり10〜12匹の動物を含む以下の群にランダムに分ける。ラットにビヒクルまたはGPR119アゴニストを日ベースで経口投与する。GPR119アゴニストは0.001mg/kg体重および100mg/kg体重の間の量で用いる。処理は10、20、40および80日の間継続する。
【0351】
10、20、40および80日において、各群からの10〜12匹のラットをケタミンで麻酔し、放血によって屠殺する。脛腓骨双方を切開によって取り出し、全ての柔軟組織を切片とする。各群について5〜6匹のラットからの骨を組織学的分析のために70%エタノール中で保存し、各群についてもう1つの5〜6匹のラットからの骨を、実行するX線写真および生体力学テストのために緩衝化されたリンゲル液中に保存する(+4℃,pH7.4)。
組織学的分析
骨折した骨の組織学的分析のための方法は、Mosekilde and Bak(Bone(1993)14:19−27)によって従前に公表されている。簡単に述べれば、骨折部位を骨折線の各側に対して8mm鋸でひき、メタクリル酸メチル中に脱石灰化せずに包埋し、Reichert−Jung Polycutミクロトームで前方セクションを8μm厚に切断する。(脛骨および腓骨双方を含めた)マッソン−トリクローム染色中央−前方セクションを、処置の有りおよび無しにて骨折治癒に対する細胞および組織応答の可視化のために用いる。シリウスレッド染色セクションを用いてカルス構造の特徴を示し、骨折部位における織られた骨(woven bone)とラメラ骨(lamellar bone)の間を識別する。以下の決定を行う:(1)骨折ギャップ(骨折における骨髄質端部の間の最も短い距離として決定される)、(2)カルス長さおよびカルス直径、(3)カルスの合計骨容量領域、(4)カルス領域の内側の組織面積当たりの骨組織、(5)カルスにおける繊維状組織、(6)カルスにおける軟骨領域。
生体力学分析
生体力学分析のための方法はBak and Andreassen(Calcif Tissue Int(1989)45:292−297)によって従前に公表されている。簡単に述べると、全ての骨折のX線写真は生体力学テストに先立って撮られる。治癒骨折の機械的特性は破壊的3−または4−点曲げ手法によって分析する。最大負荷、硬さ、最大負荷におけるエネルギー、最大負荷における撓みおよび最大ストレスを決定する。
実施例5
内因性ヒトGPR119の全長クローニング
内因性ヒトGPR119をコードするポリヌクレオチドは、GPR119特異的プライマー
【0352】
【化4】

および鋳型としてヒトゲノムDNAを用いるPCRによってクローン化した。TaqPlus PrecisionTM DNAポリメラーゼ(Stratagene)を工程2〜工程4を35回反復する以下のサイクルによる増幅で用いた:94℃、3分;94℃、1分;58℃、1分;72℃、2分;72℃、10分。予測されたサイズの1.0Kb PCR断片を単離し、pCRII−TOPOTM ベクター(Invitrogen)にクローン化し、T7 DNAシークエナーゼキット(Amersham)を用いて完全に配列決定した。核酸配列については配列番号1および推定されるアミノ酸配列については配列番号2参照。
実施例6
受容体の発現
種々の細胞がGプロテイン−結合受容体の発現について当該分野で利用可能であるが、真核生物細胞を利用するのが最も好ましい。ある実施形態において、哺乳動物細胞またはメラニン保有細胞を利用する。以下に例を示す;当業者には、当業者の必要性のため優先的に有利である技術を決定する能力が保証されている。例えば、それがメラニン保有細胞に関する場合、後記実施例9参照。
A.一過的トランスフェクション
1日目に、293細胞の6x106/10cm皿を平板培養する。2日目に、2つの反応チューブを調製し(各チューブについて以下の割合はプレート当たりである):チューブAは、0.5mLの無血清DMEM(Gibco BRL)中で4μg DNA(例えば、pCMVベクター;受容体cDNAなどを持つpCMVベクター)を混合することによって調製し;チューブBは0.5mLの無血清DMEM中で24μLのリポフェクタミン(Gibco BRL)を混合することによって調製する。チューブAおよびBは倒置(数回)によって混合し、引き続いて室温で30〜35分間インキュベーションする。該混合物を「トランスフェクション混合物」という。平板培養した293細胞を1×PBSで洗浄し、続いて5mLの無血清DMEMを加える。1mLのトランスフェクション混合物を細胞に加え、続いて、37℃/5%CO2において4時間インキュベートする。トランスフェクション混合物を吸引によって取り出し、続いて、10mLのDMEM/10%で胎児ウシ血清を加える。細胞を37℃/5% CO2でインキュベートする。48時間のインキュベーションの後に、細胞を収穫し、分析で利用する。
b.安定な細胞系
ほぼ12×106 293細胞を15cm組織培養プレート上で平板培養し、10パーセントの胎児ウシ血清および1パーセントのピルビン酸ナトリウム、L−グルタミン、抗生物質を含有するDME高グルコース培地中で培養する。293細胞の平板培養から24時間後に(または約80%密集)、細胞を12μgのDNA(例えば、受容体cDNAを持つpCMV−neorベクター)を用いて細胞をトランスフェクトする。12μgのDNAを、60μLのリポフェクタミン、および血清を含まない2mLのDME高グルコース培地と組み合わせる。該培地をプレートから吸引し、細胞を血清を含まない培地で1回洗浄する。DNA、リポフェクタミンおよび培地混合物を、血清無しの10mLの培地と共に平板培養する。37℃における4〜5時間のインキュベーションの後、培地を吸引し培地を25mLの血清を含有する培地を加える。トランスフェクションから24時間後に培地を再度吸引し、血清を含む新鮮な培地を加える。トランスフェクションから48時間後に培地を吸引し、ほぼ12×106 293細胞の最終濃度にてゲンタマイシン(G418薬物)を含有する血清を含む培地を加え、15cm組織培養プレート上で平板培養する。10パーセントの胎児ウシ血清および1パーセントのピルビン酸ナトリウムL−グルタミン、および抗生物質を含有するDME高グルコース培地中で増殖させる。293細胞の平板培養から24時間後に(または約80%密集まで)、12μgのDNA(例えば、受容体cDNAを持つpCMVベクター)を用いて細胞をトランスフェクトする。12μgのDNAを60μLのリポフェクタミンおよび血清を含まない2mLのDME高グルコース培地と合わせる。培地をプレートから吸引し、細胞を血清無しの培地で一回洗浄する。DNA、リポフェクタミン、および培地混合物を、血清を含まない10mLの培地と共にプレートに加える。37℃における4〜5時間のインキュベーションに続き培地を吸引し血清を含有する25mLの培地を加える。トランスフェクションから24時間後に培地を再度吸引し血清を含む新鮮な培地を加える。トランスフェクションから28時間後に、培地を吸引し、500μg/mLの最終濃度にてゲンタマイシン(G418薬物)を含有する血清を含む培地を加える。トランスフェクトされた細胞は、ここで、G418耐性遺伝子を含有する正にトランスフェクトされた細胞についての選択を受ける。選択が起こるに連れて、培地を4〜5日ごとに交換する。選択の間、細胞を増殖させて、安定なプールを作製し、または安定なクローン選択のために分割する。
実施例7
例えば、GPR119アゴニストとしての候補化合物をスクリーニングするためのアッセイ
例えば、GPR119アゴニストとしての候補化合物をスクリーニングするのに、種々のアプローチが利用可能である。以下に例を示す;当業者は、当業者の必要性について優先的に有利である技術を決定する能力が保証されている。Gプロテイン−結合受容体のアゴニストとしての化合物をスクリーニングするためのアッセイは当業者によく知られている(例えば、国際出願WO 02/42461参照)。
1.膜結合アッセイ:[35S]GTPγSアッセイ
Gプロテイン−結合受容体がその活性な状態にある場合、リガンド結合または構成的活性化の結果としてのいずれかで、受容体がGプロテインに結合し、GDPの放出、および引き続いてのGTPのGプロテインへの結合を刺激する。Gプロテイン−結合受容体複合体アルファサブユニットはGTPaseとして作用し、GTPをGDPへとゆっくりと加水分解しその時点において受容体は通常は脱活性化される。活性化された受容体はGTPの代わりにGDPで継続的に置き換える。加水分解不能GTPアナログである[35S]GTPγSを利用して、活性化された受容体を発現する膜への[35S]GTPγSの増強された結合を示すことができる。活性化を決定するために[35S]GTPγS結合を用いる利点は;(a)それは全てのGプロテイン−結合受容体に総括的に適応可能であり;(b)それは膜表面において近位であることにより、細胞内カスケードに影響する分子を余りピックアップしないようにする。
【0353】
該アッセイは、関連受容体を発現する膜への[35S]GTPγS結合を刺激するGプロテイン結合受容体の能力を利用する。該アッセイは総括的であって、全てのGプロテイン−結合受容体において薬物発見への適用を有する。
膜調製物
いくつかの実施形態において、本発明のGプロテイン−結合受容体を含み、かつ例えば、受容体のアゴニストとしての候補化合物の同定で用いる膜は好ましくは以下のように調製される;
a.材料
「膜掻き取り緩衝液」は20mM HEPESおよび10mM EDTA、pH7.4よりなり:
「膜洗浄緩衝液」は20mM HEPESおよび0.1mM EDTA、pH7.4よりなり;
「結合緩衝液」は20mM HEPES、100mM NaCL、および10mM MgCl2 pH7.4よりなる。
b.手法
全ての材料は該手法を通じて氷上に維持される。最初に、培地を細胞の密集単層から吸引し、続いて、10mL冷PBSで濯ぎ、続いて吸引する。その後、5mLの膜掻取緩衝液を加えて、細胞を掻き取り;これに続いて、細胞抽出物を50mLの遠心管に移動させる(4℃において20,000rpmで17分間遠心)。しかる後、上清を吸引し、ペレットを30mLの膜洗浄緩衝液に再度懸濁させ、続いて、20,000rpmにおいて4℃にて17分間遠心する。次いで、上清を吸引し、ペレットを結合緩衝液に再度懸濁させる。次いで、Brinkman PolytronTMホモゲナイザーを用いてこれをホモゲナイズする(全ての材料が懸濁するまでに15〜20秒のバースト)。これを本発明においては「膜蛋白質」という。
ブラッドフォード蛋白質アッセイ
ホモゲナイゼーションに続いて、膜の蛋白質濃度をブラッドファード蛋白質アッセイを用いて決定する(蛋白質を約1.5mg/mLまで希釈し、分注し、後に用いるために凍結することができ(−80℃);凍結する場合、用いるプロトコルは以下の通りとなろう:アッセイの日に、凍結された膜蛋白質を室温で解凍し、続いて、ボルテックスし、次いで、約12×1,000rpmにおいて約5〜10秒間Polytronでホモゲナイズする;複数の調製では、ホモゲナイザーを異なる調製物のホモゲナイゼーションの間に徹底的に洗浄すべきである)。
a.材料
(上記した)結合緩衝液;ブラッドフォード色素試薬;ブロッドフォード蛋白質標準は、製造業者の指示に従って利用する(Biorad,cat.no.500−0006)。
【0354】
b.手法
二連チューブを調製する。一つは膜を含み、一つは対照(ブランク)としてのものである。各々は800μLの結合緩衝液を含有するものであった。しかる後、10μLのブラッドフォード蛋白質標準(1mg/mL)を各チューブに加え、次いで、10μLの膜蛋白質をただ一つのチューブ(ブランクではない)に加える。しかる後、200μLのブラッドフォード色素試薬を各チューブに加え、続けて各々をボルテックスする。5分後にチューブを再度ボルテックスし、その中の材料をキュベットに移す。次いで、波長595において、CECIL 3041分光光度計で読み取る。
同定アッセイ
a.材料
GDP緩衝液は37.5mLの結合緩衝液および2mgのGDP(Sigma,cat.no.G−7127)よりなり、続いて、結合緩衝液中に系列希釈して、0.2μMのGDPを得る(各ウェル中のGDPの最終濃度は0.1μMのGDPであった);候補化合物を含む各ウェルは100μLのGDP緩衝液(最終濃度)0.1μL GDP、結合緩衝液中の50μLの膜蛋白質、および緩衝溶液中の50μL[35S]GTPγS(0.6nM)(10mL結合緩衝液当たり2.5μL[35S]GTPγS)よりなる200μLの最終容量を有する。
b.手法
候補化合物は、好ましくは、96−ウェルプレート様式を用いてスクリーニングする(これらを−80℃で凍結することができる)。膜蛋白質(または対照として、標的GPCRを排除する発現ベクターを含む膜)は、懸濁するまで軽くホモゲナイズする。次いで、上記したブラッドフォード蛋白質アッセイを用い、蛋白質濃度を決定する。次いで、膜蛋白質(および対照)を結合緩衝液中で0.25mg/mLまで希釈する(最終アッセイ濃度、12.5μg/ウェル)。しかる後、100mLのGDP緩衝液をWallac ScintistripTM(Wallac)の各ウェルに加えた。5μLのピン−ツールを用いて、5μLの候補化合物をそのようなウェルに移す(すなわち、200μLの合計アッセイ容量中の5μLは、候補化合物の最終スクリーニング濃度が10μMとなる1:40の比率である)。再度、汚染を回避するために、各移動工程の後に、水(1×)、エタノール(1×)、水(2×)を含む3つのレザバ中でピンツールを注ぐべきであり−過剰の液体を各濯ぎの後にツールから振り落とし、紙およびキムワイプで乾燥すべきである。その後、50μLの膜蛋白質を各ウェルに加え(標的GPCRを含まない膜を含む対照ウェルも利用した)、室温にて5〜10分間プレ−インキュベートした。しかる後、結合緩衝液中の50μLの[35S]GTPγS(0.6nM)を各ウェルに加え、続いて、室温にて60分間シェーカー上でインキュベートする(再度、本実施例においてはプレートをホイルで被覆する)。次いで、4000RPMにおける22℃での15分間のプレートの回転によってアッセイを停止させる。次いで、プレートを8チャネルマニホールドで吸引し、プレートカバーでシールする。次いで、(製造業者の指示のように)設定「Prot.#37」を用いてWallac 1450でプレートを読み取る。
2.アデニリルシクラーゼアッセイ
細胞−ベースのアッセイのために設計されたFlash PlateTM Adenylyl Cyclaseキット(New England Nuclear;Cat.No.SMP004A)は、粗製原形質膜で用いるために改変することができる。Flash Planteウェルは、cAMPを認識する特異的抗体も含有するシンチラントコーティングを含有することができる。ウェルで発生したcAMPは、cAMP抗体への放射性cAMPトレーサーの結合についての直接的競合によって定量することができる。以下は、受容体を発現する細胞におけるcAMPレベルの変化の決定用の簡単なプロトコルとして働く。
【0355】
ある実施形態において、改変されたFlash PlateTM Adenylyl Cyclaseキット(New England Nuclear;Cat.No.SMP004A)は、以下のプロトコルに従って、例えば、GPR119アゴニストとしての、候補化合物の同定で利用される。
【0356】
本発明のGプロテイン−結合受容体でトランスフェクトされた細胞は、トランスフェクションからほぼ3日後に収穫される。膜は、20mM HEPES、pH7.4および10mM MgCl2を含有する緩衝液中での懸濁化細胞のホモゲナイゼーションによって調製される。ホモゲナイゼーションは、Brinkman Polytronを用いて氷上でほぼ10秒間行う。得られたホモゲネートを49,000×gにおいて4℃にて15分間遠心する。次いで、得られたペレットを、20mM HEPES、pH7.4および0.1mM EDTAを含有する緩衝液に再懸濁させて、10秒間ホモゲナイズし、続いて、49,000×gにおいて4℃にて15分間遠心する。次いで、得られたペレットを利用するまで−80℃で保存する。直接的な同定スクリーニングの日に、膜ペレットを室温でゆっくりと解凍し、20mM HEPES、pH7.4および10mM MgCl2を含有する緩衝液に再懸濁し、0.60mg/mLの最終蛋白質濃度を得る(再懸濁させた膜を用いるまで氷上に置く)。
【0357】
cAMP標準、および(2μCiのトレーサー(11mL検出緩衝液に対し[125I]cAMP(100μL)))を含む)検出緩衝液を調製し、製造業者の指示に従って維持する。アッセイ緩衝液(20mM HEPES、pH7.4、10mM MgCl2 、20mMホスホクレアチン(Sigma)、0.1単位/mLクリアチンホスホキナーゼ(Sigma)、50μM GTP(Sigma)、および0.2mM ATP(Sigma)を含有するもの)をスクリーニングのために新たに調製し、次いで、アッセイ緩衝液を利用するまで氷上で保存した。
【0358】
候補化合物を、40μLの膜蛋白質(30μg/ウェル)および50μLのアッセイ緩衝液と共に、好ましくは、例えば、96−ウェルプレートのウェルに加える(3μL/ウェル:12μM最終アッセイ濃度)。次いで、温和に震盪しつつ、この混合物を室温にて30分間インキュベートする。
【0359】
インキュベーションに続き、100μLの検出緩衝液を各ウェルに加えて、続いて、2〜24時間インキュベートする。次いで、(製造業者の指示に従い)「Prot.#31」を用いてWallac MicroBetaTMプレートリーダーでプレートをカウントする。
3.CRE−Lucレポーターアッセイ
製造業者の指示に従い、293および293T細胞を、ウェル当たり2x104細胞の密度にて96ウェルプレート上で平板培養し、翌日、リポフェクタミン試薬(Lipofectamine Reagent)(BRL)を用いてトランスフェクトしたDNA脂質混合物を以下のように、各6−ウェルトランスフェクションのために調製する:100μLのDMEM中の260ngのプラスミドDNAを、100μLのDMEM中の2μLの脂質と温和に混合する(260ngのプラスミドDNAは、200ngの8×CRE−Lucレポータープラスミド、本発明のGプロテイン−結合受容体を含む50ngのpCMV、またはpCMV単独、および10ngのGPRS発現プラスミド(pcDNA3(Invitrogen)中のGPRSよりなる))。8×CRE−Lucレポータープラスミドは以下のように調製した:pβgal−Basic Bector(Clontech)中のBgIV−HindIII部位においてラットソマトスタチンプロモーター(−71/+51)をクローニングすることによって、ベクターSR1F−ベータ−galを得た。cAMP応答エレメントの8コピーは、アデノウィルス鋳型AdpCF126CCRE8[その開示をここで引用してその全体を援用する:Suzuki et al.,Hum Gene Ther(1996)7:1883−1893参照]からのPCRによって得られ、Kpn−BglV部位においてSRIF−β−galベクターにクローン化し、その結果、8×CRE−β−galレポーターベクターを得た。8×CRE−Lucレポータープラスミドは、8×CRE−β−galレポーターベクター中のベータ−ガクトシダーゼ遺伝子を、HindIII−BamHI部位において、pGL−3−Basic Bector(Promega)から得られたルシフェラーゼ遺伝子で置き換えることによって作製した。室温における30分間のインキュベーションの後、DNA/脂質化合物を400μLのDMEMで希釈し、100μLの希釈された混合物を各ウェルに加える。細胞培養インキュベーター中での4時間のインキュベーションの後に、10%FCSを含む100μLのDMEMを各ウェルに加える。翌日、トランスフェクトされた細胞を、10%FCSを含む200μL/ウェルのDMEMで交換する。8時間後に、PBSで1回洗浄した後に、ウェルをフェノールレッドを含まない100μL/ウェルのDMEMに交換する。製造業者の指示に従い、LucLiteTM レポーター遺伝子アッセイキット(Packard)を用い、ルシフェラーゼ活性を翌日に決定し、1450MicroBetaTM シンチレーションおよびルミネセンスカウンター(Wallac)で読む。
実施例8:例えば、GPR119アゴニスト活性についての全細胞アデニリルシクラーゼアッセイ
供給業者のプロトコルに従い、Flash PlateTM Adenylyl Cyclaseキット(New England Nuclear)で環状AMP決定を行う。HEK293細胞を、正規の増殖培地(DMEM/10%FBS)中にて、皿当たり12x106細胞にて、15−cm組織培養皿で平板培養する。翌日、製造業者のプロトコルに従い、10μgの空のベクターDNAまたは発現プラスミドDNAのいずれかをリポフェクタミン(Invitrogen,Carlsbad,CA)で細胞にトランスフェクトする。24時間の培養の後、トランスフェクトされた細胞をGIBCO細胞解離緩衝液(Cat # 13151−014)中で収穫し、1,100rpmにおける5分間の遠心によってプレート化し、適当な用量のアッセイ緩衝液(50%1×PBSおよび50%刺激緩衝液)に注意深く再懸濁して、2x106細胞/mLの最終細胞カウントを得る。テスト化合物を、示された所望のアッセイ濃度にて50μLのアッセイ緩衝液中で調製し、96−ウェルのFlash Plateのウェルにピペットで入れ、次いで、上記で調製した細胞懸濁液を加えた(ウェル当たり50μL)。室温にて60分のインキュベーション時間の後に、次いで、トレーサー[125I]−cAMPを含有する100μLの検出ミックスをウェルに加える。プレートをさらに2時間インキュベートし、続いて、Wallac MicroBetaシンチレーションカウンターでカウントする。cAMP/ウェルの値を、各アッセイプレートに含まれる標準cAMP曲線から外挿する。
【0360】
空のベクターでトランスフェクトされたHEK293細胞におけるcAMPレベルの増加に対する、GPR119−トランスフェクトHEK293細胞におけるcAMPレベルの増加は、テスト化合物がGPR119受容体機能性を刺激する化合物であることを示す。
実施例9:例えば、GPR119アゴニスト活性についてのメラニン保有細胞アッセイ
メラニン保有細胞を、Potenza et al[Pigment Cell Research(1992)5:372−378]によって報告されているように、培養に維持し、エレクトロポレーションを用い、GPR119受容体(GPR119;例えば、human GPR119,GenBank(登録商標)アクセション No.AAP72125およびその対立遺伝子)をコードする発現ベクターでトランスフェクトする。エレクトロポレーションに続き、トランスフェクトされた細胞をアッセイのために96ウェルプレートに平板培養する。次いで、細胞を48時間増殖させて、エレクトロポレーション手法から回収すると共に、最大受容体発現レベルを獲得する。
【0361】
アッセイの日に、細胞上の増殖培地を、10nMメラトニンを含有する無血清緩衝液で交換する。メラトニンはメラニン保有細胞において内因性gI−結合GPCRを介して作用して、細胞内cAMPレベルを降下させる。降下したcAMPレベルに応答して、メラニン保有細胞はその色素を細胞の中心に移動させる。この正味の効果は、600〜650nMで決定された、ウェル中の細胞単層の吸光度読み取りの有意な減少である。
【0362】
メラトニン中での1時間のインキュベーションの後、細胞は完全に色素−凝集となる。この時点において、ベースライン吸光度の読み取りを収集する。次いで、テスト化合物の系列希釈をプレートに加え、GPR119アゴニスト活性を有する化合物は、cAMPレベルの増加を生じる。これらの増大したcAMPレベルに応答して、メラニン保有細胞はその色素を細胞周囲に戻す。1時間後、刺激された細胞は、十分に色素が分散する。分散した細胞単層は、600〜650nm範囲においてより多くの光を吸収する。ベースラインの読みと比較した吸光度の決定された増加は、受容体刺激の程度を定量し、容量−応答曲線をプロットすることを可能とする。
【0363】
メラニン保有細胞アッセイに関する材料および方法は、その各々の開示をここで引用してその全体を援用する、米国特許第5,462,856号および第6,051,386号に見出される。
【0364】
空のベクターでトランスフェクトされたメラニン保有細胞におけるそれに対する、GPR119でトランスフェクトされたメラニン保有細胞における色素分散の増加は、テスト化合物がGPR119受容体の機能性を刺激する化合物であることを意味する。
【0365】
GPR119アゴニストとしての化合物を同定するための他のアッセイは、当業者に容易に明らかであろう(例えば、上記実施例7参照)。
実施例10:例えば、GPR119アゴニスト活性についての酵母レポーターアッセイ
酵母細胞−ベータのレポーターアッセイは文献で従前に記載されている。(例えば、Miret et al,J Biol Chem(2002)277:6881−6887;Campbell et al,Bioorg Med Chem Lett(1999)9:2413−2418;King et al,Science(1990)250:121−123;WO 99/14344;WO 00/12704;およびUS
6,100,042参照)。簡単に述べると、酵母細胞は、内因性酵母G−アルファ(GPA1)が欠失されており、多数の技術を用いて構築されたG−プロテインキメラで置き換えられているように作製されている。加えて、内因性酵母アルファ−細胞GPCR、Ste3は、選択される哺乳動物GPCRの同種発現を可能とするように欠失されている。酵母において、真核生物細胞において保存されたフェロモンシグナリング変換経路(例えば、マイトジェン活性化プロテインキナーゼ経路)のエレメントは、Fus1の発現を駆動する。Fus1プロモーター(Fus1p)の制御下にβ−ガラクトシターゼ(LacZ)を置き換えることによって、系が開発されており、それにより、受容体活性化は酵素読出に導く。
【0366】
酵母細胞は、Agatep et al(Agatep et al,1998,Transformation of Saccharomyces cerevisiae
by the lithium acetate/single−stranded carrier DNA/polyethylene glycol(LiAc/ss−DNA/PEG)protocol.Techncal Tips Online,Trends Journals,Elsevier)によって記載された酢酸リチウム方法の適合によって形質転換される。簡単に述べれば、酵母細胞を酵母トリプトンプレート(YT)上で一晩増殖させる。キャリアー一本鎖DNA(10μg)(2つのFus1p−LacZレポータープラスミド(1つはURA選択マーカーを持つものであり、1つはTRPを持つ者である)の各々の2μg、酵母発現ベクター(2μgの複製起点)中の2μgkGPR110(例えば、ヒト受容体)、および酢酸リチウム/ポリエチレングリコール/TE緩衝液をエッペンドルフチューブにピペットで入れる。受容体を含有するが、受容体対照を含有しない酵母発現プラスミドはLEUマーカーである。酵母細胞をこの混合物に摂取し、反応を30℃にて60分間進行させる。次いで、酵母細胞を42℃にて15分間熱ショックを与える。次いで、細胞を洗浄し、選択プレート上に広げる。選択プレートは合成基底酵母培地からLEU、URAおよびTRP(SE−LUT)を除いたものである。30℃における2〜3日間のインキュベーションの後に、次いで、選択プレートで増殖するコロニーをLacZアッセイでテストする。
【0367】
β−ガラクトシダーゼについてのフルオロメトリー酵素アッセイを行うために、主題のGPR119受容体を運ぶ酵母細胞を液体SD−LUT培地中で不飽和濃度まで一晩増殖させる(すなわち、細胞は依然として分裂しており、未だ静止層に到達していない)。それらを新鮮な培地中で最適なアッセイ濃度まで希釈し、90μLの酵母細胞を96−ウェル黒色ポリスチレンプレート(Costar)に加える。DMSOに溶解させ、10%DMSO溶液中に10×濃度まで希釈したテスト化合物をプレートに加え、プレートを30℃に4時間置く。4時間後に、β−ガラクトシダーゼに対する基質を各ウェルに加える。これらの実験において、フロオレセインジ(β−D−ガラクトピラノシド(フルオレセインを放出する酵素に対する基質)(FDG)を用い、フルオロメトリー読出を行う。500μM FDG/2.5% Triton X100のウェル当たり20μLを加える(洗剤は細胞を浸透性とするのに必要である)。60分間の細胞と基質とのインキュベーション後に1M炭酸ナトリウムのウェル当たり20μLを加えて、反応を停止させ、蛍光シグナルを増強させる。次いで、プレートを485/535nmにおいてフルオロメーターで読む。
【0368】
空のベクターで形質転換された酵母細胞における蛍光シグナルの増加に対して、GPR119−形質転換酵母細胞における蛍光シグナルの増加は、テスト化合物が、GPR119受容体機能性を刺激する化合物(例えば、GPR119のアゴニストまたは部分的アゴニストである化合物)であることを示す。ある実施形態において、本発明の化合物は、バックグラウンドシグナル(ビヒクル単独の存在下で得られたシグナル)の蛍光シグナルの増加を超える蛍光シグナルの増加を与える。
実施例11:放射性標識化合物
ある実施形態において、本発明のG−プロテイン結合受容体のリガンドであることが知られた化合物を放射性標識する。本明細書中に記載された放射性標識化合物をスクリーニングアッセイで用いて、化合物を同定/評価することができる。一般的な項目においては、新しく合成された、または同定された化合物(すなわち、テスト化合物)は、放射性標識された公知リガンドおよび受容体の間に複合体の形成を低下させるその能力によって、受容体に対する放射性標識された公知のリガンドの結合を低下させるその能力について評価することができる。本発明の化合物に取り込むことができる適当な放射性核種は、限定されるものではないが、(Tとも書かれる)3H、11C、14C、18F、125I、82Br、123I、124I、125I、131I、75Br、76Br、15O、13N、35Sおよび77Brを含む。3H、14C、125I、131I、35Sまたは82Brを取り込む化合物は一般的には最も有用である。
【0369】
「放射性標識された」化合物は、少なくとも1つの放射性核種を取り込んだ化合物であると理解される。いくつかの実施形態において、放射性核種は3H、14C、125I、35Sおよび82Brよりなる群から選択される。いくつかの実施形態において、放射性核種は3Hまたは14Cである。さらに、本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物において示される原子の全ては、その原子の最も普通に生じる同位体、あるいはより稀な放射性同位体または非−放射性同位体いずれかであり得ることが理解されるべきである。
【0370】
本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物に適用できるものを含めた有機化合物へ放射性同位体を取り込むための合成方法は当該分野でよく知られており、活性レベルのトリチウムを標的分子に取り込む方法は以下のものを含む:A.トリチウムガスでの接触還元−この手法は、通常、高特異的活性の産物を生じ、ハロゲン化された前駆体または不飽和の前駆体を必要とする。B.ホウ水素化ナトリウム[3H]での還元−この方法はむしろ安価であり、アルデヒド、ケトン、ラクトン、エステルなどのような還元可能な官能基を含有する前駆体を必要とする。C.水素化アルミニウムリチウム[3H]での還元−この手法は、ほとんど理論的な特異的活性における産物を提供する。また、それは、アルデヒド、ケトン、ラクトン、エステルなどのような還元可能な官能基を含有する前駆体も必要とする。D.トリチウムガス曝露標識:この手法は、適当な触媒の存在下で、交換可能なプロトンを含有する前駆体をトリチウムガスに曝露することを含む。E.ヨウ化メチル[3H]を用いるN−メチル化−この手法は、通常、適当な前駆体を高特異的活性のヨウ化メチル(3H)で処理することによってO−メチルまたはN−メチル(3H)産物を調製する。この方法は、一般には、約80〜87Ci/ミリモルのような高特異的活性を可能とする。
【0371】
活性レベルの125Iを標的分子に取り込むための合成方法は以下のものを含む:A.Sandmeyer等の反応:この手法は、テトラフルオロボレエート塩のようなジアゾニウム塩へアリールまたはヘテロアリールアミンを変換し、引き続いて、Na125Iを用いて125I標識化合物へ変換する。代表的な手法はZhu、D.−G.および共同研究者によってJ.Org.Chem.2002,67,943−948において報告された。B.フェノールのオルト125ヨウ素化−この手法は、Collier、T.L.および共同研究者によってJ.Labelled CompdRadiopharm.1999、42、S264−S266において報告されているように、フェノールのオルト位置における125Iの取込を可能とする。C.125Iでのアリールおよびヘテロアリールブロミド交換−この方法は、一般には、2工程プロセスである。第一の工程は、トリ−アルキルスズハライドまたはヘキサアルキル二スズ([例えば、(CH3)3SnSn(CH3)3)の存在下における、例えば、pD触媒反応、すなわち、Pd(Ph3P)4)を用いる、またはアリールまたはヘテロアリールリチウムを介する、アリールまたはヘテロアリールブロミドの対応するトリ−アルキルスズ中間体への変換である。示された手法はBas,M.−D.および共同研究者によってJ.Labelled Compd Radiopharm.2001,44,S280−S282において報告された。
【0372】
上記した技術は説明的であって、限定する意図のものではない。本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物を放射性標識するための他の技術は当業者によく知られている。
実施例12:受容体結合アッセイ
テスト化合物は、本発明のGプロテイン−結合受容体のリガンドであることが知られている化合物、および該受容体の間の複合体の形成を低下させるその能力について評価することができる。ある実施形態において、公知のリガンドが放射性標識される。放射性標識された公知のリガンドをスクリーニングアッセイで用い、化合物を同定/評価することができる。一般的な項目において、新たに合成されたまたは同定された化合物(すなわち、テスト化合物)は、放射性標識された公知のリガンドと該受容体との間の複合体の形成を低下させるその能力によって放射性標識された公知のリガンドの該受容体への結合を低下させるその能力について評価することができる。
【0373】
テスト化合物の非存在下における放射性標識された公知のリガンドの特異的結合のレベル未満のテスト化合物の存在下における放射性標識された公知のリガンドの特異的結合のレベルは、テスト化合物の非存在下におけるよりも、テスト化合物の存在下において該放射性標識された公知のリガンドと該受容体との間のより少ない受容体が形成されることを示す。
【0374】
本発明のGプロテイン−結合受容体のリガンドであることが知られた化合物と該受容体の間の複合体を検出するためのアッセイプロトコル
A.受容体の調製
(15−cm皿当たり)60μLのリポフェクタミンを用い、本発明のGプロテイン−結合受容体をコードするポリヌクレオチドを含む10μg発現ベクターで293細胞を一過的にトランスフェクトする。一過的にトランスフェクトされた細胞を、培地を交換しつつ、皿中で24時間増殖させ(75%密集)、10mL/皿のHepes−EDTA緩衝液(20mM Hepes+10mM EDTA,pH7.4)で取り出す。次いで、細胞をBeckman Coulter遠心機にて17,000rpmにおいて細胞を20分間遠心する(JA−25.50ローター)。引き続いて、ペレットを20mM Hepes+1mM EDTA、pH7.4に再懸濁させ、50−mL Dounceホモゲナイザーでホモゲナイズし、再度、遠心する。上清を除去した後、結合アッセイで用いるまで、ペレットを−80℃で貯蔵する。アッセイで用いる場合、膜を氷上で20分間解凍し、次いで、10mLのインキュベーション緩衝液(20mM Hepes,1mM MgCl2,100mM NaCl,pH 7.4)を加える。次いで、膜をボルテックスして、組成膜ペレットを再懸濁させ、Brinkmann PT−3100 Polytronホモゲナイザーで設定6において15秒間ホモゲナイズする。膜蛋白質の濃度は、BRLブラッドフォード蛋白質アッセイを用いて決定する。
【0375】
B.結合アッセイ
全結合については、合計容量50μLの適当に希釈された膜(50mM トリス HCl(pH 7.4)、10mM MgCl2および1mM EDTAを含有するアッセイ緩衝液中に希釈;5〜50ug蛋白質)を96−ウェルのポリプロピレンマイクロタイタープレートに加え、続いて、100μLのアッセイ緩衝液および50μLの放射性標識された公知のリガンドを加える。非特異的結合では、100μLの代わりに50μLのアッセイ緩衝液を加え、放射性標識されていない10uMの該公知のリガンドのさらに50μLを加え、その後、50μLの該放射性標識された公知のリガンドを加える。次いで、プレートを室温にて60〜120分間インキュベートする。Brandell 96−ウェルプレートハーベスターを備えたMicroplate Devices GF/C Unifilter濾過プレートをとおしてアッセイプレートを濾過することによって、結合反応を停止させ、引き続いて、0.9%NaClを含有する冷50mM トリス HCL,pH 7.4で洗浄する。次いで、濾過プレートの底をシールし、50μLのOptiphase Supermixを各ウェルに加え、プレートの頂部をシールし、プレートをTrilux MicroBetaシンチレーションカウンターでカウントする。該放射性標識された公知のリガンドと該受容体との間のより少ない複合体がテスト化合物の存在下で形成されるか否かを決定するために、100μLのアッセイ緩衝液を加える代わりに、100μLの適当に希釈された該テスト化合物を適当なウェルに加え、引き続いて、50μLの該放射性標識された公知のリガンドを加える。
【0376】
C.計算
テスト化合物をまず、10、1および0.1μMでアッセイし、次いで、中央の用量が放射性標識された公知のリガンドの結合の約50%阻害(すなわち、IC50)を引き起こすように選択された濃度の範囲でアッセイする。テスト化合物の非存在下における特異的結合(BO)は、全結合(BT)から非特異的結合(NSB)を引いた差であり、(テスト化合物の存在下における)同様に特異的な結合(B)は、変位結合(BD)から非特異的結合(NSB)を引いた差である。IC50は、阻害応答曲線、%B/B0−対−テスト化合物の濃度のlogit−logプロットから決定される。
【0377】
Kiは、ChengおよびPrustoff変換:
Ki =IC50/(I+[L]/KD)
によって計算され、ここで、[L]はアッセイで用いた放射性標識された公知のリガンドの濃度であって、KDは同一の結合条件下で独立して決定される放射性標識公知リガンドの解離定数である。
実施例13: 腸内分泌細胞系において、または小腸のK細胞リッチな領域に由来する組織中の細胞におけるGIP分泌に対するGPR119アゴニストの効果
本発明に従い、GPR119アゴニストは、本明細書中に記載されたイン・ビトロアッセイを用い、腸内分泌細胞系において、または小腸のK細胞リッチな領域に由来する組織[例えば、十二指腸または空腸組織;例えばSondhi et al.参照 Pharmacogenetics J(2006)6:131−140参照]中の細胞において、GIP分泌を刺激することを示すことができる。1日目に、腸内分泌細胞、または小腸のK細胞リッチな領域に由来する組織中の細胞を、完全培養培地(DMEM/10%FBS)中で、24−ウェルプレートに入れる。2日目に、該培養培地を低グルコース培地(DMEM/3mMグルコース/10%FBS)で交換する。3日目に、細胞を1×PBSで2回洗浄する。洗浄された細胞を、組織培養インキュベーターにて、37℃および5%CO2において1時間、ビヒクルで、または(例えば、1nM〜20uMの範囲の)種々の濃度のGPR119アゴニストで、または15mMグルコースを含む無血清DMEM中の陽性対照としてのフォルスコリン(1uM)で刺激する。次いで、上清を収集し、500gおよび4℃にて5分間の遠心によって、清澄化する。供給業者によって提供された指示に従い、LINCO Research Laboratory[ラット/マウス胃阻害性ポリペプチド(全)ELISA カタログ#EZRMGIP−55K]から購入した試薬を用いるELISAによって、上清に放出されたGIPを決定する。
【0378】
これまでの明細書は、説明目的で掲げた実施例と共に本発明の原理を教示するが、本発明の実施は、特許請求の範囲およびその均等物の範囲内に入る、通常の変形、適合または改変の全てを含むと理解されるであろう。
【特許請求の範囲】
【請求項1】
GIP分泌促進薬を同定するための方法であって、以下の工程:
(a) テスト化合物をイン・ビトロにて宿主細胞またはGプロテイン−結合受容体(GPCR)を含む宿主細胞の膜と接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 該受容体の機能性を刺激するテスト化合物の能力を決定する工程であって、
該GPCRの機能性を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示す、工程;
(c) 該化合物が、工程(b)における前記受容体の機能性を刺激する化合物を前もって投与した脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程を含み、
該脊椎動物におけるGIPレベルを増加させるテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項2】
GIP分泌促進薬を同定するための方法であって、以下の工程:
(a) テスト化合物をイン・ビトロにて宿主細胞またはGプロテイン−結合受容体(GPCR)を含む宿主細胞の膜と接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 該受容体の機能性を刺激するテスト化合物の能力を決定する工程であって、
該GPCRの機能性を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示す、工程;
(c) 試料が由来する脊椎動物における骨質量のレベルを該化合物が増加させるか否かを決定する工程であって、該脊椎動物が工程(b)における前記受容体の機能性を刺激する化合物を前もって投与されている工程を含み、
該脊椎動物における骨質量を増加させるテスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項3】
前記GPCRが組換え体である、請求項1または2に記載の方法。
【請求項4】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記決定する工程が、第二のメッセンジャーのレベルの決定を介するものである請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記第二のメッセンジャーが環状AMP(cAMP)、環状GMP(cGMP)、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、MAPキナーゼ活性、MAPK/ERKキナーゼキナーゼ−1(MEKK1)活性およびCa2+よりなる群から選択される請求項5に記載の方法。
【請求項7】
cAMPのレベルが増加する請求項6に記載の方法。
【請求項8】
前記決定する工程が、メラニン保有細胞アッセイの使用を介するもの、前記GPCRを含む膜へのGTPγS結合の決定を介するもの、またはレポーターアッセイを介するものである請求項1〜4のいずれか1項に記載の方法。
【請求項9】
前記宿主細胞が哺乳動物宿主細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記宿主細胞が酵母宿主細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項11】
前記宿主細胞がメラニン保有細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項12】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記分子量が、モル当たり5,000グラム未満である請求項12に記載の方法。
【請求項14】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%の同一性を有する請求項1〜13のいずれか1項に記載の方法。
【請求項15】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項1〜13いずれか1項記載の方法。
【請求項16】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体119(GPR119)アゴニストが、GPR119アゴニストを前もって投与した脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程を含み、
脊椎動物におけるGIPレベルを増加させるGPR119アゴニストの能力が、該GPR119アゴニストが、GIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項17】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項16に記載の方法。
【請求項18】
前記分子量が、モル当たり5,000グラム未満である請求項17に記載の方法。
【請求項19】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項16〜18のいずれか1項に記載の方法。
【請求項20】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項16〜19のいずれか1項に記載の方法。
【請求項21】
前記GPR119アゴニストは10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項16〜20いずれか1項記載の方法。
【請求項22】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための、Gプロテイン−結合受容体(GPCR)の使用であって、
(a) 該GPCRがテスト化合物の存在下または非存在下で該受容体に対する公知のリガンドと接触し、ここで該GPCRは:
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含み、
(b) 前記公知のリガンドとGPCRの間の複合体が、検出可能であり;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程が、該テスト化合物が、GIP分泌促進薬であることを示し、
(i) 前記テスト化合物が、脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程であって、該脊椎動物は該テスト化合物を前もって投与されており、該テスト化合物はその存在下で、より少数の前記複合体が形成される、工程をさらに含み、
ここで脊椎動物におけるGIPのレベルを増加させる該テスト化合物の能力が、該テスト化合物が、GIP分泌促進薬、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、使用。
【請求項23】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための、Gプロテイン−結合受容体(GPCR)の使用であって、
(a) 該GPCRがテスト化合物の存在下または非存在下で該受容体に対する公知のリガンドと接触し、ここで該GPCRは:
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含み、
(b) 前記公知のリガンドとGPCRの間の複合体が、検出可能であり;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程が、該テスト化合物が、GIP分泌促進薬であることを示し、
(i) 前記テスト化合物が、試料の由来する脊椎動物中の骨質量のレベルを増加させるか否かを決定する工程であって、該脊椎動物は該テスト化合物を投与されており、該テスト化合物はその存在下で、より少数の前記複合体が形成される、工程をさらに含み、
ここで脊椎動物における骨質量のレベルを増加させる該テスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、使用。
【請求項24】
前記公知のリガンドが標識されている、請求項22または23に記載の使用。
【請求項25】
請求項22〜24のいずれか一項に記載の使用であって、以下:
(i) その存在下で、より少数の前記複合体が形成される前記テスト化合物をイン・ビトロにて脊椎動物腸内分泌細胞またはGIPを分泌可能な細胞と接触させる工程;および、
(ii) 該化合物が該脊椎動物腸内分泌細胞または該GIPを分泌可能な細胞からのGIP分泌を刺激するか否かを決定する工程をさらに含み、
該脊椎動物腸内分泌細胞またはGIPを分泌可能な細胞からのGIP分泌を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示す、使用。
【請求項26】
前記GPCRが、組換え体である請求項22〜25のいずれか1項に記載の使用。
【請求項27】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項22〜26のいずれか1項に記載の使用。
【請求項28】
前記公知のアゴニストがプロテイン−結合受容体119(GPR119)アゴニストである請求項22〜27のいずれか1項に記載の使用。
【請求項29】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項28に記載の使用。
【請求項30】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項28または29に記載の使用。
【請求項31】
前記GPR119アゴニストは10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項28〜30のいずれか1項に記載の使用。
【請求項32】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項28〜31のいずれか1項記載の使用。
【請求項33】
前記アゴニストの分子量が、モル当たり5,000グラム未満である請求項31に記載の使用。
【請求項34】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項22〜32のいずれか1項に記載の使用。
【請求項35】
前記テスト化合物の分子量が、モル当たり5,000グラム未満である請求項34に記載の使用。
【請求項36】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%同一性を有する請求項22〜35のいずれか1項に記載の使用。
【請求項37】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項22〜36のいずれか1項に記載の使用。
【請求項38】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体(GPCR)を、テスト化合物の存在下または非存在下で該受容体に対する公知のリガンドとイン・ビトロにて接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 前記公知のリガンドとGPCRの間の複合体を検出する工程;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程であって、ここで該決定する工程は、該テスト化合物が、GIP分泌促進薬であることを示す、工程;
(d)その存在下で、より少数の前記複合体が工程(c)で形成される化合物を、前もって投与した脊椎動物から得られた試料中のGIPのレベルを、テスト化合物が増加させるか否かを決定する工程を含み、
脊椎動物においてGIPのレベルを増加させる該テスト化合物の能力が、該テスト化合物が、GIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項39】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体(GPCR)を、テスト化合物の存在下または非存在下で該受容体に対する公知のリガンドとイン・ビトロにて接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 前記公知のリガンドとGPCRの間の複合体を検出する工程;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程であって、ここで該決定する工程は、該テスト化合物が、GIP分泌促進薬であることを示す、工程;
(d)その存在下で、より少数の前記複合体が工程(c)で形成される化合物が、前もって投与される、試料が由来する脊椎動物の骨質量のレベルを、テスト化合物が増加させるか否かを決定する工程を含み、
脊椎動物において骨質量のレベルを増加させる該テスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項40】
前記公知のリガンドが標識されている、請求項38〜39のいずれか1項に記載の方法。
【請求項41】
前記GPCRが組換え体である、請求項38〜40のいずれか1項に記載の方法。
【請求項42】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項38〜41のいずれか1項に記載の方法。
【請求項43】
前記公知のリガンドがGプロテイン−結合受容体119(GPR119)アゴニストである請求項38〜42いずれか1項に記載の方法。
【請求項44】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項43に記載の方法。
【請求項45】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項43または44に記載の方法。
【請求項46】
前記GPR119アゴニストが、10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項43〜45のいずれか1項に記載の方法。
【請求項47】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項43〜46のいずれか1項に記載の方法。
【請求項48】
前記アゴニストの分子量が、モル当たり5,000グラム未満である請求項47に記載の方法。
【請求項49】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項43〜48のいずれか1項に記載の方法。
【請求項50】
前記テスト化合物の分子量が、モル当たり5,000グラム未満である請求項49に記載の方法。
【請求項51】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%同一性を有する請求項43〜50のいずれか1項に記載の方法。
【請求項52】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項43〜50のいずれか1項に記載の方法。
【請求項1】
GIP分泌促進薬を同定するための方法であって、以下の工程:
(a) テスト化合物をイン・ビトロにて宿主細胞またはGプロテイン−結合受容体(GPCR)を含む宿主細胞の膜と接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 該受容体の機能性を刺激するテスト化合物の能力を決定する工程であって、
該GPCRの機能性を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示す、工程;
(c) 該化合物が、工程(b)における前記受容体の機能性を刺激する化合物を前もって投与した脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程を含み、
該脊椎動物におけるGIPレベルを増加させるテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項2】
GIP分泌促進薬を同定するための方法であって、以下の工程:
(a) テスト化合物をイン・ビトロにて宿主細胞またはGプロテイン−結合受容体(GPCR)を含む宿主細胞の膜と接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 該受容体の機能性を刺激するテスト化合物の能力を決定する工程であって、
該GPCRの機能性を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬であることを示す、工程;
(c) 試料が由来する脊椎動物における骨質量のレベルを該化合物が増加させるか否かを決定する工程であって、該脊椎動物が工程(b)における前記受容体の機能性を刺激する化合物を前もって投与されている工程を含み、
該脊椎動物における骨質量を増加させるテスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項3】
前記GPCRが組換え体である、請求項1または2に記載の方法。
【請求項4】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記決定する工程が、第二のメッセンジャーのレベルの決定を介するものである請求項1〜4のいずれか1項に記載の方法。
【請求項6】
前記第二のメッセンジャーが環状AMP(cAMP)、環状GMP(cGMP)、イノシトール1,4,5−三リン酸(IP3)、ジアシルグリセロール(DAG)、MAPキナーゼ活性、MAPK/ERKキナーゼキナーゼ−1(MEKK1)活性およびCa2+よりなる群から選択される請求項5に記載の方法。
【請求項7】
cAMPのレベルが増加する請求項6に記載の方法。
【請求項8】
前記決定する工程が、メラニン保有細胞アッセイの使用を介するもの、前記GPCRを含む膜へのGTPγS結合の決定を介するもの、またはレポーターアッセイを介するものである請求項1〜4のいずれか1項に記載の方法。
【請求項9】
前記宿主細胞が哺乳動物宿主細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項10】
前記宿主細胞が酵母宿主細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項11】
前記宿主細胞がメラニン保有細胞である請求項1〜8のいずれか1項に記載の方法。
【請求項12】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項1〜11のいずれか1項に記載の方法。
【請求項13】
前記分子量が、モル当たり5,000グラム未満である請求項12に記載の方法。
【請求項14】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%の同一性を有する請求項1〜13のいずれか1項に記載の方法。
【請求項15】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項1〜13いずれか1項記載の方法。
【請求項16】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体119(GPR119)アゴニストが、GPR119アゴニストを前もって投与した脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程を含み、
脊椎動物におけるGIPレベルを増加させるGPR119アゴニストの能力が、該GPR119アゴニストが、GIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項17】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項16に記載の方法。
【請求項18】
前記分子量が、モル当たり5,000グラム未満である請求項17に記載の方法。
【請求項19】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項16〜18のいずれか1項に記載の方法。
【請求項20】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項16〜19のいずれか1項に記載の方法。
【請求項21】
前記GPR119アゴニストは10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項16〜20いずれか1項記載の方法。
【請求項22】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための、Gプロテイン−結合受容体(GPCR)の使用であって、
(a) 該GPCRがテスト化合物の存在下または非存在下で該受容体に対する公知のリガンドと接触し、ここで該GPCRは:
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含み、
(b) 前記公知のリガンドとGPCRの間の複合体が、検出可能であり;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程が、該テスト化合物が、GIP分泌促進薬であることを示し、
(i) 前記テスト化合物が、脊椎動物から得られる試料中のGIPレベルを増加させるか否かを決定する工程であって、該脊椎動物は該テスト化合物を前もって投与されており、該テスト化合物はその存在下で、より少数の前記複合体が形成される、工程をさらに含み、
ここで脊椎動物におけるGIPのレベルを増加させる該テスト化合物の能力が、該テスト化合物が、GIP分泌促進薬、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、使用。
【請求項23】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための、Gプロテイン−結合受容体(GPCR)の使用であって、
(a) 該GPCRがテスト化合物の存在下または非存在下で該受容体に対する公知のリガンドと接触し、ここで該GPCRは:
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含み、
(b) 前記公知のリガンドとGPCRの間の複合体が、検出可能であり;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程が、該テスト化合物が、GIP分泌促進薬であることを示し、
(i) 前記テスト化合物が、試料の由来する脊椎動物中の骨質量のレベルを増加させるか否かを決定する工程であって、該脊椎動物は該テスト化合物を投与されており、該テスト化合物はその存在下で、より少数の前記複合体が形成される、工程をさらに含み、
ここで脊椎動物における骨質量のレベルを増加させる該テスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、使用。
【請求項24】
前記公知のリガンドが標識されている、請求項22または23に記載の使用。
【請求項25】
請求項22〜24のいずれか一項に記載の使用であって、以下:
(i) その存在下で、より少数の前記複合体が形成される前記テスト化合物をイン・ビトロにて脊椎動物腸内分泌細胞またはGIPを分泌可能な細胞と接触させる工程;および、
(ii) 該化合物が該脊椎動物腸内分泌細胞または該GIPを分泌可能な細胞からのGIP分泌を刺激するか否かを決定する工程をさらに含み、
該脊椎動物腸内分泌細胞またはGIPを分泌可能な細胞からのGIP分泌を刺激するテスト化合物の能力が、該テスト化合物がGIP分泌促進薬、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示す、使用。
【請求項26】
前記GPCRが、組換え体である請求項22〜25のいずれか1項に記載の使用。
【請求項27】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項22〜26のいずれか1項に記載の使用。
【請求項28】
前記公知のアゴニストがプロテイン−結合受容体119(GPR119)アゴニストである請求項22〜27のいずれか1項に記載の使用。
【請求項29】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項28に記載の使用。
【請求項30】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項28または29に記載の使用。
【請求項31】
前記GPR119アゴニストは10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項28〜30のいずれか1項に記載の使用。
【請求項32】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項28〜31のいずれか1項記載の使用。
【請求項33】
前記アゴニストの分子量が、モル当たり5,000グラム未満である請求項31に記載の使用。
【請求項34】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項22〜32のいずれか1項に記載の使用。
【請求項35】
前記テスト化合物の分子量が、モル当たり5,000グラム未満である請求項34に記載の使用。
【請求項36】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%同一性を有する請求項22〜35のいずれか1項に記載の使用。
【請求項37】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項22〜36のいずれか1項に記載の使用。
【請求項38】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体(GPCR)を、テスト化合物の存在下または非存在下で該受容体に対する公知のリガンドとイン・ビトロにて接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 前記公知のリガンドとGPCRの間の複合体を検出する工程;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程であって、ここで該決定する工程は、該テスト化合物が、GIP分泌促進薬であることを示す、工程;
(d)その存在下で、より少数の前記複合体が工程(c)で形成される化合物を、前もって投与した脊椎動物から得られた試料中のGIPのレベルを、テスト化合物が増加させるか否かを決定する工程を含み、
脊椎動物においてGIPのレベルを増加させる該テスト化合物の能力が、該テスト化合物が、GIP分泌促進薬であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項39】
グルコース依存性インスリン分泌性ペプチド(GIP)分泌促進薬を同定するための方法であって、以下の工程:
(a) Gプロテイン−結合受容体(GPCR)を、テスト化合物の存在下または非存在下で該受容体に対する公知のリガンドとイン・ビトロにて接触させる工程であって、ここで該GPCRが、
(i) 配列番号2のアミノ酸1〜335;
(ii) 配列番号2のアミノ酸2〜335;
(iii) 特異的プライマー配列番号3および配列番号4を用いてヒトDNA試料にてポリメラーゼ連鎖反応(PCR)によって増幅可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(iv) 0.1×SSC中での65℃における洗浄をともなう高ストリンジェンシーの条件下で配列番号1の相補体とハイブリダイズ可能なポリヌクレオチドによってコードされるGPCRのアミノ酸配列;
(v) 配列番号2を有するGPCRの構成的に活性なバージョンのアミノ酸配列;または
(vi) (i)〜(v)で定義されるアミノ酸配列中の一個または数個のアミノ酸の置換、欠失、または付加による、(i)〜(v)のGPCR由来のGPCR;
を含む、工程;
(b) 前記公知のリガンドとGPCRの間の複合体を検出する工程;そして
(c) 該テスト化合物の非存在下におけるよりも該テスト化合物の存在下において該複合体のより少数が形成されるか否かを決定する工程であって、ここで該決定する工程は、該テスト化合物が、GIP分泌促進薬であることを示す、工程;
(d)その存在下で、より少数の前記複合体が工程(c)で形成される化合物が、前もって投与される、試料が由来する脊椎動物の骨質量のレベルを、テスト化合物が増加させるか否かを決定する工程を含み、
脊椎動物において骨質量のレベルを増加させる該テスト化合物の能力が、該テスト化合物が、低骨質量によって特徴付けられる状態を治療または予防するのに有用な化合物、または個体において骨質量を増加させるのに有用な化合物であることを示し、ここで該脊椎動物はヒトであり、該ヒトは、工程(b)における受容体の機能性を刺激する該化合物を投与されることに既に同意している、方法。
【請求項40】
前記公知のリガンドが標識されている、請求項38〜39のいずれか1項に記載の方法。
【請求項41】
前記GPCRが組換え体である、請求項38〜40のいずれか1項に記載の方法。
【請求項42】
前記宿主細胞が発現ベクターを含み、該発現ベクターがGPCRをコードするポリヌクレオチドを含む請求項38〜41のいずれか1項に記載の方法。
【請求項43】
前記公知のリガンドがGプロテイン−結合受容体119(GPR119)アゴニストである請求項38〜42いずれか1項に記載の方法。
【請求項44】
前記GPR119アゴニストがヒトGPR119のアゴニストである請求項43に記載の方法。
【請求項45】
前記GPR119アゴニストは選択的GPR119アゴニストであるかどうかを決定する工程をさらに含む、請求項43または44に記載の方法。
【請求項46】
前記GPR119アゴニストが、10μM、1μMおよび100nMよりなる群から選択される値未満のEC50を有するかどうかを決定する工程をさらに含む、請求項43〜45のいずれか1項に記載の方法。
【請求項47】
前記GPR119アゴニストが、モル当たり10,000グラム未満の分子量を有する小分子である請求項43〜46のいずれか1項に記載の方法。
【請求項48】
前記アゴニストの分子量が、モル当たり5,000グラム未満である請求項47に記載の方法。
【請求項49】
前記テスト化合物が、モル当たり10,000グラム未満の分子量を有する小分子である請求項43〜48のいずれか1項に記載の方法。
【請求項50】
前記テスト化合物の分子量が、モル当たり5,000グラム未満である請求項49に記載の方法。
【請求項51】
前記GPCRのアミノ酸配列が、配列番号2に対してその全長にわたって少なくとも80%同一性を有する請求項43〜50のいずれか1項に記載の方法。
【請求項52】
前記GPCRが、配列番号2のアミノ酸配列を含む請求項43〜50のいずれか1項に記載の方法。
【図1A】


【図1B】


【図1C】


【図2A】


【図2B】




【図1B】


【図1C】


【図2A】


【図2B】


【公開番号】特開2009−240328(P2009−240328A)
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願番号】特願2009−170622(P2009−170622)
【出願日】平成21年7月21日(2009.7.21)
【分割の表示】特願2009−505445(P2009−505445)の分割
【原出願日】平成19年4月10日(2007.4.10)
【出願人】(500478097)アリーナ ファーマシューティカルズ, インコーポレイテッド (97)
【Fターム(参考)】
【公開日】平成21年10月22日(2009.10.22)
【国際特許分類】
【出願日】平成21年7月21日(2009.7.21)
【分割の表示】特願2009−505445(P2009−505445)の分割
【原出願日】平成19年4月10日(2007.4.10)
【出願人】(500478097)アリーナ ファーマシューティカルズ, インコーポレイテッド (97)
【Fターム(参考)】
[ Back to top ]

