個別化抗癌化学療法(PAC)のための包括的な診断試験
【課題】本発明は、癌に対する治療モダリティーの評価および選択方法を提供する。
【解決手段】本発明は、in vitro画像化技術を介する個別化抗癌化学療法(PAC)のための分子診断試験を確立する。PACは、個々の患者から得られる腫瘍細胞を薬物反応性指標/バイオマーカー(DRI)に関して特徴付けることを必要とする。この方法は、標的化学療法薬の出現、および機構的に関連した薬物に対する腫瘍の抵抗性と相関させることのできる腫瘍細胞バイオマーカーの発現を解明することによって有望になる。新鮮細胞としての、またはパラフィンブロック中に保たれた保存細胞としての腫瘍細胞のin vitro画像化は、コンピューター蛍光顕微鏡装置を用いて実施される。数字で表した測定値は、対照としての蛍光ミクロスフェアを用いて正規化される。
【解決手段】本発明は、in vitro画像化技術を介する個別化抗癌化学療法(PAC)のための分子診断試験を確立する。PACは、個々の患者から得られる腫瘍細胞を薬物反応性指標/バイオマーカー(DRI)に関して特徴付けることを必要とする。この方法は、標的化学療法薬の出現、および機構的に関連した薬物に対する腫瘍の抵抗性と相関させることのできる腫瘍細胞バイオマーカーの発現を解明することによって有望になる。新鮮細胞としての、またはパラフィンブロック中に保たれた保存細胞としての腫瘍細胞のin vitro画像化は、コンピューター蛍光顕微鏡装置を用いて実施される。数字で表した測定値は、対照としての蛍光ミクロスフェアを用いて正規化される。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願への相互参照)
本願は、2005年9月21日に出願された、米国仮特許出願第60/718,724号および2006年3月6日に出願された米国仮特許出願第60/778,901号に対する優先権を主張する。米国仮特許出願第60/718,724号および米国仮特許出願第60/778,901号の内容は、本明細書中に参考として援用される。
【0002】
(政府によって支援された研究に関する声明)
CCC Diagnostic,LLCに対して授与された米国立癌研究所中小企業技術革新研究助成金(NCI SBIR Grant)CA081903号により一部支援された。政府は本発明に関して特定の権利を有することができる。
【0003】
(本発明の技術分野)
本発明は、癌療法の領域に関する。詳細には、個々の患者の癌に対して最も効果的な療法を識別することに関する。
【背景技術】
【0004】
(背景技術)
癌は、高度に個別化された疾患であり、単一薬剤を用いる治療に対する現在の好ましい反応率は低い(約20%)。反応率を高めるためには、各患者に対して適切な薬物を選択することが、この上なく重要である。異なる患者は、同じ薬物に対して異なる仕方で反応することが広く認識されており、おそらく、遺伝的形質に由来する個別的変動性によるものであろう。薬物の効果における遺伝的に受け継がれた差異に関する臨床的観察が、ファーマコゲノミクスの分野を立ち上げた。薬物反応性における個体間の差異が、薬物代謝酵素、薬物輸送担体または薬物標的をコードする遺伝子の配列変異体によるものであるいくつかの事例が報告されている(例えば、非特許文献1;および非特許文献2を参照されたい)。
【0005】
薬物代謝に対する宿主の不均一性に加え、所定の薬物に対する腫瘍の反応性に影響を及ぼす腫瘍の変形形態が存在し、例えば、
1)ほとんどの結腸癌患者は、彼らがチミジル酸シンターゼ、チミジンホスホリラーゼおよびジヒドロピリミジンデヒドロゲナーゼの低レベルの発現を有するなら、5−FU化学療法に反応する。患者は、1種または複数の酵素の発現が高レベルにあるなら、極めて低い反応性を有し、
2)β−チューブリンの突然変異を伴う患者は、パクリタキセルをベースにした化学療法に十分には反応しないが、一方、野生型β−チュプリンを伴う患者の約40%は、完全な、または少なくとも部分的な反応性を有した。さらに、野生型β−チューブリン遺伝子を所持する患者の場合、生存期間中央値も向上し、
3)受容体タンパク質のHER−2/neu遺伝子の増殖または強力な過剰発現(免疫組織化学で+3)を利用して、細胞障害性化学療法とトラスツズマブの組合せに対してより反応する可能性のある患者の部分集団を識別できる。単一薬物トラスツズマブは、HER−2/neuの過剰発現または遺伝子増幅を示す転移性乳癌を有する女性に対する一次治療として活性があり十分に許容され、かつ
4)高いヌクレオチド除去修復活性は、非小肺癌細胞におけるシスプラチン抵抗性と密接に相関しており、ヒト卵巣癌細胞におけるERCC−1発現レベルとシスプラチン誘発性DNA損傷の間の関連が報告されている。
【0006】
上記の例は、腫瘍細胞上の1種または複数の特定バイオマーカーの発現レベルが、特定薬物に対する腫瘍の反応性に関連していることを示唆している。より最近の抗癌薬は、極めて重要な過程(例えば、修復、有糸分裂)の特定の細胞成分(例えば、受容体、酵素)に対して設計されるので、機構的に関連のある抗癌薬で治療した場合に、腫瘍細胞の反応性を指示する可能性のあるバイオマーカーを見出すことができそうである(例えば、非特許文献3、および非特許文献4を参照されたい)。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Evans,W.E.Johnson,J.A.、Annu.Rev.Genomics Hum.Genet.2001年、2巻、9〜39頁
【非特許文献2】McLeod,H.L.Evans,W.E.、Annu.Rev.Pharmacol.Toxicol.、2001年、41巻、101〜121頁
【非特許文献3】Parkら、Clinical Cancer Research、2004年、10巻、3885〜3896頁
【非特許文献4】Vande Woude,G.F.ら、Clinical Cancer Research、2004年、10巻、3897〜3907頁
【発明の概要】
【発明が解決しようとする課題】
【0008】
個体の特定の腫瘍を最も効果的な治療モダリティーに合わせる必要性、すなわち、個別化抗癌化学療法(PAC)に対する必要性が存在することは、当技術分野で一般的に認識されている。本発明は、この、またはその他の必要性に対処する。
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、in vitro画像化技術を介する個別化抗癌化学療法(PAC)のための分子診断試験を確立する。PACは、個々の患者から得られる腫瘍細胞を薬物反応性指標/バイオマーカー(DRI)に関して特徴付けることを必要とする。この方法は、標的化学療法薬の出現、および機構的に関連した薬物に対する腫瘍の抵抗性と相関させることのできる腫瘍細胞バイオマーカーの発現を解明することによって有望になる。新鮮細胞としての、またはパラフィンブロック中に保たれた保存細胞としての腫瘍細胞のin vitro画像化は、コンピューター蛍光顕微鏡装置を用いて実施される。数字で表した測定値は、対照としての蛍光ミクロスフェアを用いて正規化される。
【0010】
いくつかの実施形態において、本発明は、患者から1つまたは複数の腫瘍細胞を得ること、および該腫瘍細胞を特徴付けることを含む。特徴付けは、腫瘍を抗体、特にモノクローナル抗体で特徴付けることを含むことができる。典型的には、このような抗体は、化学療法薬の作用機構に関連する腫瘍細胞成分に向けて標的化される。これらの成分の存否または量は、治療で使用される関連薬物に対する腫瘍細胞の感受性または抵抗性を反映する。本明細書中で使用する場合、特定の化学療法薬の作用機構に関連する細胞成分は、その化学療法薬に対する薬物反応性指標(DRI)と見なすことができる。
【0011】
いくつかの実施形態では、抗体を標識することができ、例えば、各抗体を、同時個別的検出のために異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で標識できる。これら種々の蛍光標識抗体の結合を測定、例えば、定量的に測定できる。いくつかの実施形態において、測定は、コンピューター蛍光顕微鏡装置を使用し、光学および記録装置を標準化するための対照と対照して蛍光強度を定量化することによって行なうことができる。細胞中の薬物反応性指標を標的とした染料標識抗体の蛍光によって測定した場合に種々の化学療法薬に特異的に対応する種々の反応性指標の量を、所定の抗癌化学療法薬に対して様々な度合いの細胞障害性反応を示す種々の関連癌細胞系と対比できる。患者の腫瘍に由来する薬物反応性指標データの解釈は、培養において関連のある薬物治療に反応している様々な細胞障害感受性に関する各種関連癌細胞系から得られる薬物反応性指標に対する外挿によって確立される。化学療法薬の予測的効果は、所定の薬物に関連のある薬物反応性指標の肯定的および/または否定的影響に留意することによって見きわめられる。すなわち、腫瘍細胞中の特定の薬物反応性指標の存否、および低い量または高い量は、腫瘍を所定の薬物治療に対して反応させない(または敏感でない)。この予測は、政府(FDA)が承認したいずれの化学療法薬が、個々の患者の腫瘍に対して有効でない可能性が最も高いかを説明できる。したがって、いくつかの実施形態において、個々の患者に対して有効な化学療法薬の選択は、個々の癌患者に由来する腫瘍細胞の薬物反応性指標によって明らかにされるような、効果的でない薬物でのすべての治療を排除することによってなされる。本発明は、薬物反応性指標の量と薬物作用の直接的相関を、薬物処理を伴う細胞培養データの統計解析によって確認する。
【0012】
いくつかの実施形態において、腫瘍細胞検体は、体内の転移性癌を提示する血液中の循環癌細胞から得ることができる。いくつかの実施形態において、腫瘍細胞検体は、リンパ系中で循環している癌細胞として原発性腫瘍に近接したリンパ節から得ることができ、気管支鏡生検などの生検によって得られる。いくつかの実施形態において、腫瘍細胞検体は、生検でまたは外科標本から腫瘍組織が得られる場合には、原発性腫瘍から得ることができる。原発性腫瘍から検体が得られる場合のようないくつかの実施形態では、腫瘍組織を、ホルマリン中で固定し、パラフィンブロック中に包埋し、薄い切片に切断して、検査のために顕微鏡スライド上に置くことができる。いくつかの実施形態では、腫瘍細胞のパラフィンブロックから得た切片スライドを、キシレンおよびアルコール洗浄によってパラフィン除去することができ、例えば、加熱/加水分解/再生を用いる抗原回復法により処理することができ、次いで、薬物反応性指標の識別処理および定量的測定のために、種々の細胞成分に対して適切な蛍光標識モノクローナル抗体で染色できる。いくつかの実施形態では、処理されたスライド上で組織を、コンピューター蛍光顕微鏡装置で検査、画像化、分析、および記録することができる。いくつかの実施形態では、5つまたはそれ以上の蛍光抗体を、切片スライド上で同一視野から同時的に測定、画像化、分析および記録することができる。
【0013】
本発明は、任意起源の癌および任意の治療モダリティーを分析するのに使用できる。例えば、政府(FDA)承認の種々の細胞障害性薬物に対して様々な度合いの抵抗性(または感受性)を示す、乳、肺、結腸、およびその他の上皮細胞起源の癌を源とする癌細胞系である。細胞障害性薬物としては、限定はされないが、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン(ビンカアルカロイド)、5−フルオロウラシル関連薬物(ゼロ−ダなど)、ゲムシタビン、およびアントラサイクリンを挙げることができる。いくつかの実施形態において、抗癌薬は、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)などのヒト化モノクローナル抗体を含むことができる。
【0014】
いくつかの実施形態において、薬物反応性指標は、次の細胞成分(抗原)を含むことができ、FDAにより承認された対応抗癌薬の有効性を評価するのに使用できる。
薬物反応性指標 薬物
ERCC1 カルボプラチン
シスプラチン
オキサロプラチン
エストロゲン受容体 タモキシフェン
アロマターゼ阻害薬
β−チューブリンIIIアイソフォーム ドセタキセル
パクリタキセル
タキサン
ビノレルビン
チミジル酸シンターゼ 5−FU関連薬物
ゼローダ
リボヌクレオチドレダクターゼ ゲムシタビン
トポイソメラーゼII アントラクリン
HER−2/neu受容体、PTEN トラスツズマブ(ハーセプチン)
いくつかの実施形態において、薬物反応性指標は、適切に蛍光標識されたトラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)およびベラシズマブ(アバスチン)など、適切に標識されたモノクローナル抗体治療薬によって標的とされる抗原を含むことができる。
【0015】
一実施形態において、本発明は、患者から腫瘍細胞検体を得ること、抗体を使用して検体中の複数の薬物反応性指標を測定すること、および化学療法薬を選択することを含む、個々の癌患者に向けて癌を治療するための化学療法薬を選択する方法を提供する。いくつかの実施形態において、抗体は、蛍光標識された、例えばモノクローナル抗体でよい。抗体が、測定予定の各薬物反応性指標に特異的な蛍光標識抗体である場合には、複数の薬物反応性指標の同時定量化を可能にする、異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で抗体を標識できる。典型的には、薬物反応性指標は、化学療法薬の作用機構に関連した細胞成分であり、選択は、検体の細胞中に存在する薬物反応性指標の存在/不在または量に基づく。1種または複数の薬物指標の存在が検出され、かつ、存在する薬物反応性指標を定量化することが所望される場合には、このような定量化は、検体中の薬物反応性指標の蛍光強度を1種または複数の参照標準と比較することを含むことができる。典型的には、本発明の方法は、少なくとも5種の薬物反応性指標を測定することを含むことができる。いくつかの実施形態において、測定は、検体中の複数の薬物反応性指標、例えば5種またはそれ以上の量を、該薬物反応性指標を介して作用する化学療法薬に対して既知の反応性をもつ細胞中の同一薬物反応性指標の量に対比することを含む。本発明を実施する際には任意の検体種を使用することができ、例えば、検体は、患者の血液中の循環癌細胞から得ることができ、患者の原発性腫瘍に近接したリンパ節から得ることができ、あるいは患者の原発性腫瘍から得ることができる。本発明の方法は、当技術分野で周知の任意の適切な化学療法薬、例えば、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン、ビンカアルカロイド、5−フルオウラシル関連薬物、ゼローダ、ゲムシタビン、アントラサイクリン、ヒト化モノクローナル抗体、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)を選択するのに使用できる。いくつかの実施形態において、少なくとも1種の薬物反応性指標はERCC1であり、化学療法薬は、カルボプラチン、シスプラチン、およびオキサロプラチンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はβ−チューブリンIIIアイソフォームであり、化学療法薬は、ドセタキセル、パクリタキセル、タキサン、およびビノレルビンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はチミジル酸シンターゼであり、化学療法薬は、5−FU関連薬物、ロイコボリン、ペメトレキセルおよびゼローダからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はトポイソメラーゼIIであり、化学療法薬は、アントラサイクリン、ドキソルビシン、およびエピルビシンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はトポイソメラーゼIであり、化学療法薬は、イリノテカンである。いくつかの実施形態において、少なくとも1種の薬物反応性指標はリボヌクレアーセレダクターゼであり、化学療法薬は、ゲムシタビンである。
【0016】
この方法を実行するために3種の診断試験を確立した。これらの診断試験は、(1)薬物反応性指標試験(DRIT)、(2)HER−2/neu過剰発現陽性である乳癌患者のためのハーセプチン−タキサン反応性試験(HER−Tax試験)、(3)循環癌細胞試験(CCCT)である。
【0017】
DRITおよびHER−Taxは、DRIの定量的測定のための試験であり、CCCTは、循環癌細胞(CCC)の数およびCCC中のDRIバイオマーカー発現を測定する。これら3種の試験は、個々の患者における腫瘍の薬物反応性に関する包括的情報を提供し、それを介して最も効果的な化学療法治療を選択できる。
【0018】
例えば、乳および肺癌細胞中の、または腫瘍組織切片スライド中のDRI発現レベルは、標本を染色するための蛍光染料で標識されたモノクローナル抗体(MAB)を利用して測定できる。指標化システムは、薬物に対して様々な抵抗性を有する種々の癌細胞系のDRI発現と細胞障害性反応(IC50)を相関させるように確立される。細胞障害性反応のこの相関を、パラフィンブロック中に包埋された癌細胞のDRI測定に拡張して、パラフィンブロックから切断されたヒト腫瘍組織切片中でのDRI発現に対する対照として役立つことのできる細胞系標準を確立する。腫瘍断片中で測定される各DRIに対する参照領域は、培養での癌細胞の(IC50)に基づいた対応薬物に対応する抵抗性/反応性の確率から構成できる。記録された臨床結果を用いた回顧的臨床研究を実施して、DRI指標に対するこの参照領域を確認する。本出願の革新性は、(1)in vitro画像化システムの進歩、(2)DRIレベルに相関させた細胞障害性反応のインデックスシステム、(3)腫瘍抵抗性の確率によって示されるような腫瘍の反応性に対応するDRIインデックスのための参照領域に基づく。患者のDRIインデックス、および臨床的反応性の参照領域を調べた後、診療する医師は、この患者のための薬物処方について情報に基づいた決定をすることができる。
例えば、本願発明は以下の項目を提供する。
(項目1)
個々の癌患者のための癌治療用化学療法薬の選択方法であって、
該患者が患うタイプの癌を治療するために政府が承認した化学療法薬のパネルを選択すること、
該患者から腫瘍細胞検体を得ること、
該腫瘍細胞検体中の少なくとも1つの細胞中の抗体を使用して、化学療法薬のパネルに対応する薬物反応性指標のパネルの発現を測定すること、および
該薬物反応性指標の発現に基づいて化学療法薬を選択すること
を含む方法。
(項目2)
前記抗体が蛍光標識されている、項目1に記載の方法。
(項目3)
前記薬物反応性指標が、化学療法薬の作用機構に関連した細胞成分である、項目1に記載の方法。
(項目4)
前記抗体が、異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で蛍光標識される、項目1に記載の方法。
(項目5)
測定することが、前記薬物反応性指標を定量化することを含む、項目1に記載の方法。
(項目6)
定量化することが、蛍光強度を参照標準と対比することを含む、項目5に記載の方法。
(項目7)
測定することが、1回の試験で少なくとも5種の薬物反応指標を定量化することを含む、項目5に記載の方法。
(項目8)
測定することが、検体中の複数の薬物反応性指標の発現量を、該薬物反応性指標を介して作用する化学療法薬に対して既知の反応性を有する細胞中の同一薬物反応性指標の量に相関させることを含む、項目5に記載の方法。
(項目9)
1回の試験中に少なくとも5種の薬物反応性指標の発現量が比較される、項目8に記載の方法。
(項目10)
前記腫瘍細胞検体が、循環癌細胞、原発性腫瘍に近接したリンパ節からの検体、原発性腫瘍からの検体、および固定されパラフィンブロック中に包埋された原発性腫瘍からの検体からなる群から選択される、項目1に記載の方法。
(項目11)
前記化学療法薬が、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン、ビンカアルカロイド、5−フルオウラシル関連薬物、ゼローダ、ゲムシタビン、アントラサイクリン、イリノテカンからなる群から選択される、項目1に記載の方法。
(項目12)
前記化学療法薬が、ヒト化モノクローナル抗体、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)からなる群から選択される、項目1に記載の方法。
(項目13)
少なくとも1種の薬物反応性指標がERCC1であり、かつ前記化学療法薬が、カルボプラチン、シスプラチンおよびオキサロプラチンからなる群から選択される、項目1に記載の方法。
(項目14)
少なくとも1種の薬物反応性指標がβ−チューブリンIIIアイソフォームであり、かつ前記化学療法薬が、ドセタキセル、パクリタキセル、タキサン、およびビノレルビンからなる群から選択される、項目1に記載の方法。
(項目15)
少なくとも1種の薬物反応性指標がチミジル酸シンターゼであり、かつ前記化学療法薬が、5−FU関連薬物、ロイコボリン、ペメトレキセルおよびゼローダからなる群から選択される、項目1に記載の方法。
(項目16)
少なくとも1種の薬物反応性指標がトポイソメラーゼIIであり、かつ前記化学療法薬が、アントラサイクリン、ドキソルビシン、およびエピルビシンからなる群から選択される、項目1に記載の方法。
(項目17)
少なくとも1種の薬物反応性指標がトポイソメラーゼIであり、かつ前記化学療法薬がイリノテカンである、項目1に記載の方法。
(項目18)
少なくとも1種の薬物反応性指標がリボヌクレアーゼレダクターゼであり、かつ前記化学療法薬がゲムシタビンである、項目1に記載の方法。
(項目19)
測定することが、乳癌、肺癌、結腸癌、胃癌、膵臓癌、および食道癌からなる群から選択される1種または複数の癌について薬物反応性指標試験を実施することを含み、該薬物反応性指標試験が、診断される癌のタイプについて米国総合癌ネットワークの患者治療ガイドライン中に列挙されたすべての化学療法薬に対する腫瘍抵抗性/感受性データを提供する、項目1に記載の方法。
(項目20)
腫瘍抵抗性/感受性データが、相関的臨床研究の統計解析に基づいて、個々の被試験患者に対する薬物反応性不全のパーセント確率によって解釈され得る、項目19に記載の方法。
【図面の簡単な説明】
【0019】
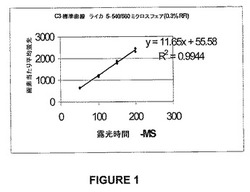
【図1】図1は、InSpeck Microscope Image Intensity Calibration Kit(6ミクロン蛍光性ミクロスフェア)を用いて作成された、種々の腫瘍細胞標本からのHER−2/neuの定量データを対比する際に使用するための標準曲線である。
【図2】図2は、乳癌患者からの組織切片中のHER−2/neu蛍光シグナルを示すデジタル画像である。切片は、パラフィンブロック中に包埋された腫瘍組織から切断され、トラスツズマブ−Alexa532で染色するために処理され、蛍光顕微鏡法で分析され、CCDカメラで画像化された。
【図3】図3は、HER−2/neuを定量化するために選択されたトラスツズマブ−Alexa532で染色された細胞膜の注目区域(AOI)の領域を示す。
【発明を実施するための形態】
【0020】
(発明の詳細な説明)
用語、生物学的マーカー(バイオマーカー)は、「正常な生物学的過程、発病過程、または治療介入に対する薬理学的反応性の指標として客観的に測定および評価される特性」として定義される。本出願の目的の場合、細胞中の薬物反応性指標は、該細胞が薬物に対してどのように反応するかに関する情報を提供する。
【0021】
本発明は、以下をベースにしたPACの開発を提供する。(1)参照標準に対して正規化された蛍光強度に基づいた各細胞の注目区域における薬物反応性指標(DRI)の定量的同時測定。蛍光は、DRIに対する標識MABの染色量を示す。(2)種々の抗癌薬に対して異なる抵抗性を有する一群の癌細胞系を利用すること、および各薬物によるin vitroでの細胞増殖の抑制をその薬物に関連するDRI測定と統計的に相関させること。(3)DRI測定のための個々の癌患者からの癌細胞および腫瘍組織の供給源。
【0022】
PACの開発は、化学療法薬の低い効力およびかなりの副作用、ならびに新規抗癌薬を開発するのに必要とされる大きな費用および時間によって推進される。現行の抗癌薬を個々の患者に対してより効果的に利用する大きな必要性がある。PACの臨床的応用は、次の利益の1つまたは複数を提供できる、すなわち
1)医師による薬物または薬物セットの処方が、患者のDRI発現によって示される、この患者に対して処方される薬物の薬物抵抗性の確率に対する対照を提供する指標化システムによって導かれる。
2)試験を、いくつかのFDA承認薬物(3〜6種)に対して同時的に、および同一薬物に対して適任であるいくつかのバイオマーカーに適用できる。この仕方で、効果のない薬物を治療としての検討から迅速に除外し、代案としてより有効な薬物で置き換えることができる。
3)試験は、リアルタイム(2〜3日)で、かなり安価(千ドル未満)、大量(専用実験室の場合1日当たり最大で百件)に行なうことができ、かつ一般病院で実施することができる。
4)画像化技術は、腫瘍の不均一性の評価を含む、腫瘍のDRI値の定量的測定に対する基礎を提供する。この不均一性の測定は、この薬物に対するこの患者の反応持続期間を指示することができる。
【0023】
文献、FDA承認リストの入念な調査から、乳、肺および結腸癌に対して広く利用される薬物、およびそれらの個々の機構的に関連したDRIを次表に列挙する。
【0024】
【表1】

6種の癌の標的化抗癌化学療法に対する薬物反応性指標(DRI)を提供する次表中に、さらなる薬物反応性指標を提供する。列挙した化学療法は、米国立総合癌ネットワーク(National Comprehensive Cancer Network)(NCCN)の癌臨床実践ガイドライン(Clinical Guidelines in
Oncology)、2006年より引用した。化学療法に関連するDRIは文献より引用した。
【0025】
【表2】

注:
1)DRIは、パラホルムアルデヒド中で固定後の生検新鮮癌細胞から、およびホルマリン中で固定しパラフィンブロック中に包埋した腫瘍組織の切片から判定できる。
2)DRI試験に関する相関臨床研究は、ステージIVまたは転移性の患者で実施される。より明確な臨床的反応性は、この患者集団からの腫瘍の大きさまたは数から得ることができる。しかし、結果は、補助ステージを含むすべてのステージの化学療法に対して適用できる。
3)肺癌の場合、これらの薬物は、ドキソルビシンが小細胞肺癌に対して使用されることを除いて、小細胞肺癌(アステリクスで示される)および非小細胞肺癌の双方に対して使用される。
4)ベバシズマブ(アバスチン)は、乳、結腸、肺癌に対して組み合わせて使用される。腫瘍細胞に対するアバスチンの結合を評価するために、別個のDRI試験を確立できる。
【0026】
上で言及したように、インデックスシステムを設定するには、種々の抗癌薬に対して異なる抵抗性を有する一群の癌細胞系が必要とされる。腫瘍由来の不死細胞系は、一般に、頑健な増殖を示し、機能性癌細胞モデル系に対する必要性を満たす。癌細胞系は、抗癌薬物に対する反応性の予測にある程度の成功をもって利用されている。ある研究では、39種のヒト癌細胞系を、55種の細胞障害性癌薬物に対するそれらの感受性に関して分析した。遺伝子発現および化学的感受性プロフィールの統合データベースは、薬物効力を予測するためのシステムを開発するのに有用であることが結論付けられた。別の研究では、31種の細胞障害性薬物に関するフェーズII試験の結果を、米国国立癌研究所のヒト腫瘍細胞系パネルのスクリーニングと相関させた。in vitro細胞系モデルは、小細胞肺癌、乳癌および卵巣癌について様々な接近手段で予言的であると結論付けられた。臨床的応用に向けたシステムに特定した研究ではないが、それらは、ヒト癌細胞系の細胞障害感受性が、臨床試験の結果の相関または予測のために有用である場合があることを示している。
【0027】
標的抗癌療法の効果的な応用は、その療法を分子診断技術と連結して、個別化抗癌化学療法(PAC)を形成することである。PACは、現在、癌治療に対する最も見込みのある開発である。転移性乳癌(MBC)患者に対するトラスツズマブ治療と対にしたHER−2/neu発現は、FDAが承認した最初のRx−Dxカップリングであり、PACに対するモデル系として役立つ。
【0028】
本発明は、薬物反応性指標/バイオマーカー(DRI)を定量化し、この情報を患者に対する適切な治療モダリティーを選択するのに使用するための、個々の患者から得られた腫瘍細胞の特徴付けにおけるin vitro画像化技術および分子診断の利用を含む。分子診断の方法は、次の3つのステップから構成される。すなわち、
(1)個々の癌患者から癌細胞検体を入手するステップ;これらの癌細胞は、凍結腫瘍切片、生検材料、血中循環癌細胞から得られる新鮮癌細胞、あるいはパラフィンブロック中に包埋されたホルマリン固定腫瘍組織から切断された連続切片から得られる保存細胞でよい。
(2)腫瘍細胞中で発現したバイオマーカー(薬物反応性指標、DRI)を定量的に評価するステップ;なぜなら、これらのバイオマーカーの発現レベルは、所定の標的療法に対する腫瘍細胞の抵抗性に関連するからである。評価には、標的療法に対する腫瘍細胞の抵抗性の原因である細胞バイオマーカーを標的とする適切に標識されたモノクローナル抗体(Mab)の適用を含めることがでる。定量は、コンピューター蛍光顕微鏡システム、適切なソフトウェア、および参照標準を用いて完遂できる。
(3)腫瘍細胞中の薬物反応性指標の発現と、機構的に関連した薬物に対する腫瘍細胞の細胞障害性反応との相関に基づいて適切な治療モダリティーを選択するステップ;種々の抗癌薬に対して異なる抵抗性を有する一群の関連細胞系を利用できる。培養中の癌細胞系の増殖に対するこれらの薬物の効果は、これらの細胞系中の対応するDRIの発現レベルと一緒に測定される。このデータは、標的療法用薬物に対する腫瘍の抵抗性に相関させた場合に、腫瘍細胞のDRI発現レベル(蛍光による)の解釈を可能にする。in vitroでの薬物の細胞障害性−DRIの関係は、DRI発現の所定の薬物に対する相関を、その薬物での治療に対する所定の患者の臨床的反応を用いて拡張するための実験的基礎を形成する。この相関は、パラフィンブロックから切断されたヒト腫瘍組織切片中でのDRIの発現に対する対照として役立つことができる、パラフィンブロック中に包埋された癌細胞のDRI測定に拡張される。培養中の癌細胞の(IC50)に基づいた、薬物に対応する抵抗性/反応性の確率を示す、腫瘍切片中で測定される各DRIの対照領域を構成できる。
【0029】
患者の腫瘍に適用した場合の標的療法の効力予測は、腫瘍細胞中のDRIの肯定的および/または否定的影響に基づく。すなわち、腫瘍細胞中のDRIの不在/存在または低い/高い量が、所定の薬物治療に反応しない腫瘍を引き起こす。したがって、患者に対する有効な標的療法の選択は、癌患者からの腫瘍細胞のDRI測定によって明らかにされるような効果のない薬物での治療をすべて除外することによって完遂される。
【0030】
個々の患者の腫瘍による所定の薬物に対する反応性持続期間は、また、薬物に対して抵抗性でない腫瘍細胞の割合に対する薬物に対して抵抗性である腫瘍細胞の割合(腫瘍の均一性)によって評価できる。腫瘍の非抵抗性部分が、薬物によって攻撃され、絶滅される場合、残りの抵抗性細胞は、支配的な部分になり、全腫瘍が、薬物に対して抵抗性になる。この推論は、腫瘍均一性の測定が抵抗性のマーカーであり、さらに、患者の生存を延長するためには、別の有効な薬物を、併用および/またはフォローアップ治療として使用しなければならないことを示している。
【0031】
臨床応用では、患者の反応率(RR)および/または進行期間(TTP)を、彼らの腫瘍のDRI測定値と統計的に相関させることができ、かつ、異なるDRIインデックスの各個々の患者に対する抵抗性(非反応性)の確率の参照領域を構成される。個々の患者のDRIインデックス、臨床的反応性の参照領域を調べた後、診療する医師は、この患者に対する薬物処方について情報に基づいた決定を下すことができる。
【0032】
PACの方法を実行するために、癌患者の便宜のために3つの診断試験が、確立されている。これらの診断試験は、(1)薬物反応性指標試験(DRIT)、(2)ハーセプチンタキサン反応性試験(HER−TAX試験)、および(3)循環癌細胞試験(CCCT)である。これらの試験を、以下でさらに説明する。
【0033】
癌細胞は、2つの明確な特徴を有する。すなわち、
1)宿主の制御下にない複製が、腫瘍になり、かつ
2)該腫瘍が、増大し、転移し、身体の死活にかかわる機能を妨害し、死に導く。
【0034】
癌/腫瘍を物理力(手術または照射)で除去または破壊できない場合には、全身性抗癌化学療法が必要である。
【0035】
抗癌化学療法の成功の鍵は、宿主細胞の中の絶対多数である正常細胞を傷つけないで癌細胞を破壊する能力である。制御不能の複製が、癌細胞の特徴であり、かつ正常な機能を妨害するので、癌に向けられた細胞障害性薬物のほとんどは、細胞実体および複製進行に必要とされる過程を攻撃するように設計される。
【0036】
現代の抗癌細胞障害性薬物は、標的療法であり、DNA複製酵素、ヌクレオチド(核酸の構成要素)酵素、DNA修復酵素、複製シグナルを伝達するための受容体など、死活にかかわる過程に必要とされる細胞成分に狙いを定めている。これらの鍵となるタンパク質部分から、1011〜13/モルの範囲の高い親和定数を有することのできる抗体、特にモノクローナル抗体(Mab)を容易に生じさせることができる。したがって、これらのMabは、これらの標的タンパク質に選択的かつ強固に結合できる。また、これらのMabが蛍光染料に化学的に連結される場合には、蛍光性Mab−標的複合体の量および位置を検出し、画像化し、記録することができる。種々のMabを、励起/発光スペクトルの位置が異なりかつ重なりあわない別の蛍光染料でそれぞれ標識する場合には、これらの種々のMab−標的を注目領域(ROI)で、同時的ではあるが別個の検出で画像化できる。
【0037】
蛍光複合体を測定するのに効果的な1つの装置は、コンピューター蛍光顕微鏡装置(FMS)である。これらの複合体を含む細胞内部の区域を画定することができ、蛍光の測定値を、画定した空間領域の総蛍光で、または画素当たりの平均蛍光、あるいはさらにこの領域における画素当たりの最大強度として表現できる。この可能性を実施例1で示す。
【0038】
数字で定量化できる測定を有することに加えて、FMSによる測定は、蛍光性ミクロスフェアの使用を介して標準化できる。蛍光性ミクロスフェアを介して異なる波長でFMSを較正した後、FMS測定値を、一時的意味でまたは異なるFMSからの双方で比較できる。この操作を実施例2に示す。
【0039】
個々の患者からの腫瘍組織を、3種の供給源、すなわち、一般には(1)腫瘍または腫瘍に近接したリンパ節を探査することに由来する生検材料、(2)腫瘍を除去する手術から得られる外科的材料、(3)転移性腫瘍を代表する血中循環癌細胞から得た。本発明者らは、これらすべての供給源からの腫瘍細胞を調べ、各供給源は、その特有の要件を呈示する。生検からの腫瘍細胞を特徴付ける場合、最も重要な要件は、腫瘍細胞を正常細胞から識別することである。腫瘍細胞が上皮起源である場合、周囲の細胞は、(血液細胞またはリンパ細胞でなく)、それゆえ、識別は、上皮細胞の特徴的なサイトケラチン骨格によって比較的簡単である。細胞骨格中のタンパク質に対して特異的であるMabは、入手可能である。血液からの循環腫瘍細胞を特徴付けるために濃縮方法が使用され、その方法により、正常血液細胞のほとんどが排除され、癌性上皮細胞が特徴づけのために後に残る。最も一般的には、外科的標本から腫瘍組織を集め、これらの組織をホルマリン中で固定し、パラフィンブロック中に包埋して保管する。次いで、脱パラフィン、洗浄、および抗原回復の処理の後に、観察のためにこれらのブロックから切片スライドを得ることができる。実施例3は、これらの調製を示す。各抗原、またはタンパク質標的さえも、別個の活性化/回復手順を必要とする可能性がある。
【0040】
実施例4で、本発明者らは、切片スライドの観察区域(ROI)における蛍光性Mab−抗原複合体のFMSによる定量的測定および記録のための実験方法を説明する。該方法は、コンピューター化された装置によるバックグラウンド自己蛍光の差し引きを必要とする。このバックグラウンドは、蛍光性Mabで染色していないパラフィンブロックの連続切片化により類似領域を観察したFMSから得られる。さもなければ、光学測定法は同じままで、バックグラウンドに関する情報を、コンピューター中に保管し、続いてバックグラウンドとして差し引くために使用する。
【0041】
実施例5では、パラフィンブロック中に包埋されたホルマリン固定腫瘍の組織切片における薬物反応性指標の染色および数値測定を説明する。
【0042】
実施例6では、腫瘍切片中の異なる区域内における不均一性の評価について説明する。個々の患者の腫瘍による所定の薬物に対する反応性の持続期間は、また、薬物に対して非抵抗性である腫瘍細胞の割合に対する薬物に対して抵抗性である腫瘍細胞の割合によって評価できる(腫瘍の不均一性)。腫瘍の不均一性の測定は、抵抗性に関するマーカーを構成し、さらに、患者の生存を延長するためにフォローアップ治療として別の有効薬物を使用しなければならないことを指示する。
【0043】
化学療法薬の細胞障害作用を機構的に関連したDRIの発現と相関させるためのDRIインデックスの構成を実施例7で説明する。この方法は、化学療法薬に対する培養ヒト腫瘍細胞の反応性と薬物の作用方式に機構的に関連しているDRIの発現との間の統計的に有意な相関を確立する。実施例9に記載のように統計解析を実施して、これら2つの値を相関させ、臨床的反応性を指示するためのインデックスとして使用できるDRI発現レベルを確立する。
【0044】
パラフィン包埋培養細胞標準をベースにしたDRIインデックスシステムの構成に対する上記in vitro指標化システムの拡張を、実施例8で説明する。この技術は、組織固定および処理の影響を反映する参照標準を確立する。
【0045】
個々の癌患者に対する疾患管理のための情報を提供できる3つの分子診断試験を実施例10で詳述する。PACの方法を実施するために、これらの診断試験を癌患者の便宜のために確立する。該診断試験は、(1)薬物反応性指標試験(DRIT)、(2)ハーセプチンタキサン反応性試験(HER−TAX試験)、および(3)循環癌細胞試験(CCCT)である。それぞれを、実施例中で詳細に説明する。
【0046】
実施例11では、乳癌患者においてPACを確立するのに必須であるステップを詳述し、この戦略を支援するための関連データを提供する。
【0047】
PACシステムを確認するのに必須の臨床的相関研究計画を実施例12で説明する。既知の臨床結果をそれら同一患者の腫瘍細胞からのDRIの測定と相関させるために、まず、遡及的研究を実施する。続いて、DRIデータの予測的研究を治療下の患者の結果と相関させる。この試験から得られるデータは、IDEとして役立ち、FDAからのPMAにつながる。
【0048】
上記の戦略が特に十分に機能する状況は、乳癌の場合のトラスツズマブ(ハーセプチン)、および結腸癌の場合のセツキシマブ(エルビタックス)など、ヒト化モノクローナル抗体治療薬の使用である。この方法において、本発明者らは、標的−受容体に対するプローブとして、治療用Mab上に蛍光染料を結合した後のモノクローナル薬それ自体を使用した。明らかに、治療用Mabが腫瘍細胞に結合できないなら、腫瘍細胞は、治療用Mabに反応しない。その逆が真実でない可能性があること、すなわち、腫瘍細胞に対するMabの結合が、細胞障害性反応をもたらさない可能性があることに留意すべきである。したがって、薬物反応性指標の定量的測定というこの方法に由来する本質的情報は、いずれの細胞が、該薬物反応性指標の不在のために、薬物に対して細胞障害性反応を示さないかに関する判断である。しかし、薬物反応性指標の好ましい測定は、これらの腫瘍細胞が細胞障害性反応を示すという確かな情報を提供しない可能性がある。換言すれば、否定的な薬物反応性指標は、腫瘍細胞が細胞障害性反応を示さないことを予測するが、肯定的な薬物反応性指標は、腫瘍細胞がその他の重要な因子の影響のために細胞障害性反応を示すことを保証しない。したがって、本発明者らは、個々の患者における腫瘍について無効(しかし、それにもかかわらず副作用を示す)薬物の使用を排除するために「無効薬物指標」を有することができる。この結論は細胞培養中の限定された条件集合下で統計的に支持されるので、無効薬物指標に関する知識は、極めて有用で信頼性がある。
【0049】
一般に、上記説明は、「個別化抗癌療法」(PAC)に必要とされる要素を概説している。第1に、標的治療薬が、開発され、FDAによって承認される。第2に、本質的な細胞標的を、実験室および臨床研究で突きとめる。第3に、このタンパク質標的に特異的に向けられた抗体(特定のモノクローナル抗体)を、発生させ、適切な蛍光染料で標識する。第4に、コンピューター蛍光顕微鏡装置を組み立てて、腫瘍細胞中のこれら蛍光性Mab−標的複合体の量および位置を測定し、画像化し、かつ記録する。第5に、代表的腫瘍細胞の供給源を、生検処置、外科標本、または血中循環腫瘍細胞を介して入手できる。第6に、十分に規定されたin vitroの状況で、薬物反応性マーカーの量が腫瘍細胞の細胞障害性反応と統計的に相関していることを示すために行なわれた相関研究を使用して適切な化学療法を選択すること。
【0050】
これら6つの要素の連結は「個別化抗癌療法」の基礎を形成し、情報に基づいた勧告は、所定の癌患者に対するそれらの無効薬の使用を排除する。この戦略は、臨床的相関研究において、「無効薬物指標」に関する情報の医学的貢献を立証した。この立証の最初のステージは、トラスツズマブの使用に対するFDAの承認手順で与えられ、別項で説明する。
【0051】
PACシステムをまとめるに際して、本発明者らは、個々の患者から得られる腫瘍細胞からバイオマーカーの定量的測定におけるFMSの応用に際しての手順を提供した。種々の供給源から得られる腫瘍細胞に対する具体的な手順を、実施例中に記載する。
【実施例】
【0052】
(実施例1)
顕微鏡スライド上の固定された細胞中の蛍光複合体の測定
本発明者らの装置は、CCDカメラ、8−フィルターキューブターレット、ならびに画像取込みおよび画像処理のためのImage−Pro Plusソフトウェアを備えたコンピューター支援ライカDMRXA蛍光顕微鏡である。現在、本発明者らは、同一細胞から5つのスペクトル域の蛍光を測定することができ、2つを細胞識別に使用し、3つをバイオマーカーの測定に使用する。複数のマウスモノクローナル抗体で細胞を染色するためには、各抗体を直接的に標識することが必須である。このことは、イソチオチアン酸フルオレセインおよびMolecular ProbesからのAlexa染料のスクシンイミジルエステル誘導体を用いて完遂される。
【0053】
この実施例では、乳癌細胞系におけるHER−2/neuの定量化を示す。モノクローナル抗体、トラスツズマブを、Alexa532で標識し、抗−パンサイトケラチンをFITCで標識した。乳癌細胞系(SKBR−3)を、上記抗体と共にインキュベートし、次いで、洗浄し、抗退色性培地中でDAPIを用いる対比染色のために台に載せた。同一細胞中のDAPI、FITCおよびAlex532のシグナルの区別を可能にするフィルターキューブを使用して、適切な露出時間でデジタル画像を得た。サイトケラチンの蛍光を使用して各細胞の空間領域の輪郭を描いた。これらの輪郭を、記憶装置に保管し、呼び戻して、Alexa532の画像、すなわちHER−2/neuのシグナル上に重ねた。次表に4つの細胞中でのHER−2/neu発現に関する定量的データを示す。縦欄1は、対象番号を与え、縦欄2は画素数としての細胞面積を表し、縦欄3は各細胞における画素当たり平均蛍光強度を与え、縦欄4は、各細胞に対する積分蛍光強度を与える。データは、細胞中でのHER−2/neu発現が変動する場合があることを示している。
【0054】
【表3】

(実施例2)
顕微鏡システムの較正
定量的免疫蛍光研究を実施するには、デジタル画像を取得し、種々の時間にわたっておよび異なる顕微鏡で得られた蛍光測定値を比較できなければならない。このことは、Molecular Probesから得られる容易に利用できる蛍光標準を用いて本発明者らのライカ顕微鏡装置を較正することによって完遂される。蛍光標準は、直径6ミクロンの蛍光ミクロスフェア(Inspeck顕微鏡画像強度較正キット)から構成される。ミクロスフェア懸濁液を顕微鏡スライド上に載せ、空気乾燥し、カバーガラス下の抗退色性培地に載せる。飽和レベル、すなわち、12−ビット画像の場合には画素当たり4096の蛍光単位をもたらす時間を超えないことが確実である種々の露出時間で画像を取得する。画像を、Image−Pro Plusソフトウェアを用いて処理して、各露出時間で画素当たり約4または5個のミクロスフェアの平均蛍光強度を得る。画素当たりの平均蛍光強度をミリ秒の露出時間に対してプロットすることによって、各フィルターキューブに対して標準曲線を得る。このような線形標準曲線の例を図1に示す。勾配および切片を使用して、参照標準を用いて2000単位の平均蛍光をもたらすのに必要な露出時間を計算する、すなわち、図1に示したプロットの場合、176ミリ秒の値が得られた。したがって、同じ蛍光標準を使用することによって、適切な露出時間を選択して各顕微鏡/フィルターキューブを同じ蛍光強度を与えるように較正できる。
【0055】
(実施例3)
識別および特徴付けのための腫瘍細胞標本の調製および染色
肺癌細胞は、気管支鏡生検によって得ることができる。生検材料は、患者から摘出した後は中性の生理食塩水中に浸漬しておけばよい。細胞をPBS中で洗浄し、計数のために指定の容積にすればよい。適当な数の細胞を、顕微鏡スライド上のパップペン(PapPen)で輪郭を描いた区域内に置けばよい。乾燥後、細胞を2%パラホルムアルデヒド中で固定し、抗−パンサイトケラチン−FITCと共にインキュベートし、上皮細胞を識別するためにDAPIで対比染色した。画像を取得し、無傷の核を有する上皮細胞数を計数できる。腫瘍細胞は、スライド上の細胞の上皮細胞/wbc核DNA比率を異数性の尺度として測定することによって、および特定のモノクローナル抗体で染色して上皮細胞中のα−フェトプロテインの発現を定量化することによって正常上皮細胞から区別できる。蛍光標識抗体を利用する定量化は、実施例1で説明したように実施すればよい。
【0056】
手術中にまたは生検で得られた組織切片を、ホルマリン中で固定し、パラフィンブロック中に包埋できる。連続した4ミクロン切片を、これらのパラフィンブロックから切り出し、顕微鏡スライド上に載せることができる。切片は、次のように、すなわち、キシレン中で2回、各5分間;95%エタノール中で2回、各3分間;70%エタノール中で2回、各3分間;次いで水道水中で少なくとも10分間で脱パラフィンできる。抗原回復のためには、スライドを、pH8の10mM EDTA、またはpH6の10mMクエン酸塩中、95℃で30分間加熱し、続いて同一溶液中に室温で20分間浸けておけばよい。スライドを、PBS中で洗浄し、抗パンサイトケラチン−FITCおよび選択したその他の蛍光標識抗体で染色することができる。
【0057】
次のプロトコル、すなわち、15〜20mLの血液から血液細胞のほとんどを除去するための二重勾配遠心分離、続いて免疫磁気ビーズを使用して癌細胞を濃縮すること(陰性選択);顕微鏡スライド上のパップペンで輪郭を描かれた区域内に細胞を置き、抗体カクテル(9種のサイトケラチンペプチドに対して反応性を有するFITC標識抗体、およびヒト癌腫上に発現した腫瘍関連糖タンパク質)と共にインキュベートすること;DAPI含有抗退色性培地を用いて載せることによって対比染色すること;蛍光顕微鏡を用いてスライドを走査し、無傷の核を有するFITC陽性細胞を数えることにより血中の循環癌細胞(CCC)を単離、識別できる。
【0058】
標準的なCCC試験では、100,000を超える白血球細胞(WBC)が、CCCと共に回収される。WBCは、場合によっては、染料−MAB複合体による癌細胞の染色を妨害する(しかし、HER−2/neuまたはサイトケラチンでは妨害されない)。したがって、癌細胞と共に3000未満のWBCの回収をもたらす超濃縮法が開発された。これらの調製において、細胞の染色は、少数のWBCによって影響されない。この手順を以下で詳述する。
【0059】
CCCの超濃縮プロトコル:
15〜20mLの抗凝固剤処理末梢血液(6時間、100MCF−7乳癌細胞でスパイクされた)をPBSで全量30mLまで希釈;
15mLを超える希釈された細胞懸濁液を50mLのコニカルチューブ中、1.083勾配で注意深く層化して、揺動バスケットローター中、20℃で30分間、2000rpmで遠心(ブレーキなし);
ピペットで上清液を完全に移し、1.083Gの界面の6〜8mL上部部分を集め;
ハンクス液を用い1200rpmで10分間遠心することによって2回洗浄し;
上清液を注意して完全に除去し;
1x希釈緩衝液を40mLの最終容積まで添加し、十分混合し;
5mLのMACS細胞浸透液を添加し、十分混合し、室温で正確に5分間インキュベートし、続いて、5mLのMACS細胞固定液を添加し、十分混合し、30分間インキュベートし;
細胞懸濁液を1200rpmで10分間遠心し;
細胞ペレットを1xMACS細胞染色液に600μLの最終容積で再懸濁し;
200μLのFcRブロッキング試薬を添加し、十分混合し;
200μLのMACS CKマイクロビーズを添加し、20〜25℃で45分間インキュベートし;
100μLの抗サイトケラチン−FITCを添加し、さらに10分間インキュベートし;
4mLの1xMACS細胞染色液を添加し、細胞懸濁液を1200rpmで遠心し;
陽性選択カラムをMACSセパレーターの磁場中に置き;
再懸濁細胞をカラムにかけ、白血球細胞(WBC)がカラムを通過するのを可能にし、3x500μLの脱気1x希釈緩衝液で洗浄し;
セパレーターからカラムを取り外し、カラムを15mLチューブ上に置き;
ピペットで1mLの脱気1X希釈緩衝液をカラムの頂部に移し、カラムで適用されるプランジャーを使用して保持した循環癌細胞を溶離する;
細胞ペレットを回転して落下させ、スライド上に直接置き、RTで8〜24時間空気乾燥し;
台の中央にDAPIを添加し、検体をコンピューター支援顕微鏡分析にかける。
【0060】
(実施例4)
パラフィンブロックから切断した腫瘍組織切片中でのバイオマーカー発現の定量化
組織断片の全域で測定された蛍光強度は、抗原に結合した蛍光標識一次抗体の量を反映し、したがって、細胞中の標的タンパク質(バイオマーカー)の量を表す。しかし、再現性のある定量的データを生み出すためには、ホルマリン固定組織に固有の自己蛍光を考慮する必要がある。自己蛍光は、対照スライド、同一腫瘍の連続切片の1つを、蛍光標識一次抗体を除くプロトコルで処理することによって測定される。
【0061】
各腫瘍からの3〜4つの異なる区域のデジタル画像を、本発明者らの参照標準で2000蛍光単位をもたらすであろう露出時間(実施例2参照)を使用して、C1(DAPI)、C2(FITC)、C3(Alexa532)、C4(Alexa594)およびC5(Alexa647)フィルターキューブで取得した。対照および実験スライドは、まったく同様に処理した。さらに、画像を、組織を含有しないスライド上のバックグラウンド領域の各フィルターで得る。画像は、Image−Pro Plusソフトウェアを用いて処理した。各バックグラウンド画像に対する画素当たりの平均蛍光をヒストグラムから取得し、その値を、適切な実験画像から差し引く。バイオマーカーの定量化のため、各画像上の各々約10個の細胞を含む3〜4つの注目区域(AOI)を選択する。HER−2/neu染色乳癌腫瘍切片の代表的な画像を図2に示す。膜の濃く完全な染色を観察できる。膜区域の蛍光強度を定量化し、5人の異なる乳癌患者に関するデータを次表に示す。4人の患者のHER−2/neu発現は、自己蛍光の約2〜4倍大きかった。1人の患者で、自己蛍光とTER−2/neuシグナルが類似していた。腫瘍の異なる区域にわたるHER−2/neu発現の不均一性が存在した。本発明者らは、高発現区域とより低い発現領域の間に3.3倍の差異を観察した。
【0062】
UMMおよびWRに由来する乳癌組織のハーセプチン−Alexa532染色−877ミリ秒露出
【0063】
【表4】

*各画像の3〜4区域を分析し、その平均を示す。ABYは、染色するのに使用した標識モノクローナル抗体を示す。
【0064】
本発明者らは、また、乳房腫瘍組織におけるエストロゲン受容体、および結腸腫瘍組織におけるβ−チューブリンアイソフォームIIIおよびERCC−1(DNA修復酵素)の発現を定量化した。データを次表に示す。自己蛍光(抗体なし)に対する染色組織の平均蛍光は、ERCC−1、β−チューブリンIIIおよびエストロゲン受容体に対して、それぞれ5.7、3.6および15.8であった。
【0065】
パラフィンブロックから切断された組織切片における薬物反応性指標の定量的測定
【0066】
【表5】

(実施例5)
例として乳癌を使用する、パラフィンブロック中に包埋されたホルマリン固定腫瘍の組織切片における薬物反応性指標の染色および数値測定
本発明者らは、パラフィンブロックから切断された乳房腫瘍組織切片におけるHER−2/neu受容体の発現を定量化するための再現性のある蛍光顕微鏡法を確立した。顕微鏡スライド上に載せた組織切片を次のように脱パラフィンする。すなわち、スライドをキシレン中に5分間浸し、もう1度繰り返し;スライドを95%エタノール中に3分間浸し、もう1度繰り返し;スライドを70%エタノール中に3分間浸し、もう1度繰り返し;スライドを蒸留水で洗浄する。次いで、抗体を回復するために、スライドを、pH6.0の10mMクエン酸塩中、95℃で30分間加熱すること、続いて室温で20分間冷却することによって処理する。スライドを、トラスツズマブ−Alexa532複合体および抗パンサイトケラチン−FITCと共に同時にインキュベートする。標準対照で2000蛍光単位をもたらす露出時間を使用して、各腫瘍切片の3〜4つのデジタル画像を取得する。HER−2/neuを過剰発現する細胞は、全部の細胞膜の極めて強い蛍光染色を示す。3〜4つの注目区域(AOI)を各デジタル画像上で試験する。AOIに関する定量的蛍光データ(画素当たり平均蛍光、標準偏差、最小および最大値、および積分蛍光強度)を示すヒストグラムを作成できる。この蛍光データを使用して、HER−2/neu発現を定量化するための被染色膜の区域を選択する。図3は、定量化のために選択され、輪郭を明らかにされた上記AOIの1つに関する区域を示す。定量的測定データ(画素数としての面積、および画素当たり平均蛍光、発光密度)を次表に示す。
【0067】
【表6】

(実施例6)
腫瘍切片の異なる区域内におけるHER−2/neu発現の不均一性の評価
患者の腫瘍における細胞間でのHER−2/neu発現の不均一性は、トラスツズマブでの治療に対する全般的反応性および反応性の持続時間を決定する可能性がある。本発明者らは、上述の定量的アッセイを利用して患者腫瘍組織切片におけるこの不均一性を評価することができた。2人の乳癌患者の腫瘍組織に関するデジタル画像中の4つのAOIに由来するデータを次表に示す。本発明者らは、HER−2/neu染色膜の最大と最小蛍光強度の間に2.1(患者1)〜3.3(患者2)倍の差異を観察した。
【0068】
患者の腫瘍の異なる区域内におけるHer−2/Neu発現の不均一性の評価
【0069】
【表7】

**膜測定値の数
(実施例7)
化学療法薬の細胞障害作用を機構的に関連する薬物反応性指標の発現と相関させるためのin vitroシステム
この実施例では、培養ヒト癌細胞系の抗癌薬に対する細胞障害反応性を機構的に関連した細胞中の薬物反応性指標(DRI)の発現レベルと相関させるin vitroシステムについて説明する。細胞障害反応性を明確に示すのに使用できるDRI発現レベルを確立するために、このデータに基づいて統計解析を実施する。
【0070】
腫瘍に由来する不死細胞系は、一般に、強い増殖を示し、実用的な癌細胞モデル系のための必要性を満たす。癌細胞系は、抗癌薬に対する反応性の予測にある程度の成功をもって利用されており、化学感受性プロフィールが、薬物効果を予測するためのシステムを開発するのに有用である可能性があることを示している。
【0071】
この実施例で、DRIは、蛍光染料と連結したモノクローナル抗体をプローブとして利用して、いくつかの乳癌由来細胞系で定量化される。DRI発現レベルは、データの日間および実験室間比較を可能にする容易に入手できる蛍光標準に対して正規化されたデジタル値として表現される。すべての薬物は、作用方式に機構的に関連した潜在的細胞標的を有する。
【0072】
乳癌細胞系を固定し、Alexa532と複合したハーセプチン(トラスツズマブ、抗−HER−2/neu受容体)またはAlexa594と複合した抗−ER、あるいはAlex647と複合した抗−TUB IIIおよびFITCと複合した抗−サイトケラチンと共に同時にインキュベートすることによって顕微鏡スライド上で染色する。FITCシグナル(470nm/497nm/522nm)、Alexa647シグナル(630nm/649nm/667nm)、Alexa594シグナル(581nm/593nm/617nm)およびAlexa532シグナル(546nm/557nm/567nm)のデジタル画像を、適切な露出時間(蛍光標準で2000の値をもたらす)で取得し、解析して、各ROI(癌細胞)中の画素当たり平均蛍光を確定した。各ROIの空間領域は、極めて強力であるサイトケラチンの蛍光から判断した。輪郭を記憶装置に保管し、呼び戻し、同一細胞野のAlexa532画像、Alexa594画像、またはAlexa647画像と重ねた。ソフトウェアは、各ROIの面積および画素当たり平均蛍光を示す表を作成する。
【0073】
実験条件については、104個の生存細胞を含む細胞懸濁液を、96ウェルプレート中の100μLの培地に播種し、5%CO2雰囲気中、37℃で24時間付着させておいた。このインキュベーション時間の後に、細胞を、発表済みの薬物動態分析により決定された通りのピーク血漿濃度(PPC)に基づいた指定用量で薬物に曝露した。タモキシフェンの場合、細胞を集密するまで72時間増殖させた。次いで、ER発現を最大にするため、各ウェルに0.5%FCSを含む培地を添加した。100μLの適切な培地を含む対照ウェルを試験ウェルとまったく同様に処理した。処理の72時間後に、プレートをWST−8分析に付した。WST−8は、細胞のデヒドロゲナーゼで生物還元されて着色したフォルマザン生成物を産生するテトラゾリウム塩である。フォルマザン生成物の量は、生存細胞数に直接的に比例する。フォルマザンをベースにしたアッセイは、化学感受性試験に成功裡に利用されている。各ウェルの吸光度を、Biotekマイクロリーダーを使用して460nmで測定した。各薬物濃度に対して、平均吸光度±SEを計算した。結果は、薬物濃度と対比した%増殖阻害として表される。IC50値は、(logfa/log
fu)対log Cのメジアン効果プロットを使用して決定される(ここで、fu=非影
響部分、fa=影響部分、C=薬物濃度である)。
【0074】
種々の乳癌細胞系の化学療養薬に対する生物学的反応性は、関連するDRIの発現と十分に対応している。モデル系を確認するために、十分に特徴付けられているDRI、HER−2/neuおよびエストロゲン受容体(ER)を用いて初期研究を実施した。HER−2/neu癌遺伝子は、上皮増殖因子受容体に対して広範な相同を有する膜貫通チロシンキナーゼ受容体をコードしている。HER−2/neuの過剰発現は、ハーセプチン(トラスツズマブ)療法に対して高い感受性をもたらす。乳癌に対するもう1つの効果的な標的療法は、癌細胞表面のエストロゲン受容体に結合し、細胞増殖に対するエストロゲンの効果を遮断するタモキシフェンである。ERは、タモキシフェン療法に対する感受性を判定する際にかなりの予測的価値を有することが知られている。
【0075】
それらの表面に結合している蛍光標識ハーセプチンの最も高いレベルを示す細胞系は、ハーセプチンでの治療に最も大きな反応性を示す。これらの特定の細胞系、HCC2218およびSKBR−3は、用量関連性の増殖抑制を示し、それぞれ0.032および0.125mg/mLのような低い濃度で反応性を有した。対照的に、次表に示すように、低レベルのハーセプチン結合を示す乳癌細胞系では、増殖は乱されていないか、あるいは、高用量の薬物でのみ、反応性が誘発された。
【0076】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:Her−2/neu/ハーセプチン
【0077】
【表8】

注:*NR−ハーセプチン治療に対して2mg/mLまで反応しない
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
同様の仕方で、高いER発現を示す細胞系(MCF−7)は、タモキシフェンでの治療に対して高い感受性を示した。対照的に、より小さなER結合度を示す細胞系(SKBR−3、MDA−MB231)は、次表に見られるようにタモキシフェンでの治療に対して感受性のより小さな反応性を示す。
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:エストロゲン受容体/タモキシフェン
【0078】
【表9】

注:*NR−タモキシフェン治療に対して50μg/mLまで反応性なし
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
これらの実験を拡張して、β−チューブリンIII(TUB III)発現と、抗癌薬
、パクリタキセル(PTX)およびドセタキセル(DTX)に対する生物学的反応性の間の相関を検討した。これらの薬物は、TUBIIIに結合し、微小管の安定化を介してそれらの増殖抑制効果を発揮する。これらの薬物の抗癌作用は、乳房腫瘍をはじめとするいくつかのヒト癌におけるTUBIIIの発現レベルによって変更される場合があると推
測される。
【0079】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:パクリタキセル/β−チューブリンIII
【0080】
【表10】

注:*NR−パクリタキセル治療に対して50μg/mLまで反応性なし
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:ドセタキセル/β−チューブリンIII
【0081】
【表11】

**規定時間曝露した場合に2000単位をもたらす対象標準に比較した平均蛍光/画素
ハーセプチンおよびタモキシフェンの場合のように、各種乳癌細胞系のPTXおよびDTXに対する生物学的反応性は、TUB IIIの発現とよく対応している。低レベルの
TUBIII結合を示す細胞系(T47D、MCF−7、SKBR−3)は、PTXおよびDTXの双方での治療に対して感受性があった。対照的に、より高レベルのTUB I
IIを示す細胞系(HCC2218、HCC38)は、より高用量のDTXに対してのみ反応性を示した。これらの細胞系は、また、PTXに対して反応性を示したが、IC50値は明確でなかった。1つの細胞系(HCC202)は、DTXおよびPTX治療の双方に対して抵抗性であることがわかった。
【0082】
もう1つの例では、チミジル酸シンターゼ(TS)の発現を、乳癌細胞の化学療法薬5−フルオロウラシル(5−FU)に対する反応性と相関させた。TSは、DNA生合成の鍵となる酵素であり、5−FUをベースにした化学療法に対する反応性を予測するうえで重要な役割を演じると主張されている。実験は、この関係を調べるために実施した。実験条件および分析方法は、ハーセプチンで使用したものと同様とした。用量は、5〜300μg/mLの範囲とした。
【0083】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:5−フルオロウラシル/チミジル酸シンターゼ
【0084】
【表12】

**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素。ND=測定せず
各種乳癌細胞系の5−FUに対する生物学的反応性は、TS発現とよく対応している。より低用量の5−FUに反応する細胞系(T47D、MCF−7およびSKBR−3)は、より高用量に対してのみ反応する細胞系(HCC38、HCC202、HCC2218)よりもより高いTSの発現を示した。5−FUに対する反応性ランクとTS発現との相関は、下記で見られるように、ピアソンの相関係数によって判定すると統計的に有意である。
【0085】
DRIは、ピアソンの相関係数を使用して、機構的に関連した薬物によるin vitro細胞増殖の抑制と相関させることができる。この方法は、2変数間の線形関係の強度を測る。ピアソンの相関係数は、通常、r(ロー)で表され、−1.0〜1.0の値を取ることができ、−1.0は完全陰性(逆)相関であり、0.0は相関がなく、1.0は完全陽性相関である。ピアソンの相関計数は、下式を使用して計算できる。
【0086】
【数1】

ピアソンの相関係数分析は、次表で見られるように、IC50値とDRI発現の間に強い有意の統計的相関を示した。
【0087】
生物学的反応性とDRI発現の相関
【0088】
【表13】

単純なクラスター分析または変化点分析を介してDRI発現のカットオフポイントをさらに確認して、生物学的反応性を明確に示すのに使用できるDRI発現レベルが存在するか否かを判定するために、この相関データを分析する。
【0089】
(実施例8)
パラフィン包埋培養細胞標準に基づいたDRIインデックスシステム
パラフィンブロック中に保存されたヒト腫瘍組織のDRI発現を指標化するためには、組織固定および処理の影響を反映する参照標準を確立することが必須である。いくつかの研究所は、この目的のために標的抗原の変動する発現を示す細胞系を利用してきた。これらの細胞系は、臨床検体と同一の仕方で固定され、処理され、分析される。この技術は、HER−2/neuアッセイ感度の標準化、エストロゲン受容体の免疫細胞化学分析、DNA倍数性分析および増殖マーカーMIB−1の品質管理に成功裡に応用されている。
【0090】
培養ヒト乳癌細胞は、培養ヒト腫瘍細胞系に対して使用されるのと同じバッチから採取した。次いで、これらの細胞を寒天プラグ中に包埋し、パラフィンで処理した。スライドを、4μm切片で調製し、固定し、HER−2−Alexa532(546nm/557nm/567nmm)で染色した。次いで、検体を上述のように顕微鏡分析に付した。結果(次表)は、培養腫瘍細胞標準系で観察されたものに極めて類似していた。HCC2218およびSKBR−3の双方とも、高いハーセプチン結合値を示し、一方、MCF−7およびHCC38は、より低い値を示した。これらの細胞をハーセプチンに曝露することによって得られるIC50およびハーセプチン結合の比較は、培養腫瘍細胞系で観察されるものにやはり極めて類似した−0.9のピアソンの相関係数をもたらした。このモデルは、パラフィン包埋培養細胞標準が、パラフィン包埋ヒト癌組織の生物学的反応性を指標化するための実行可能な内部標準として役立つ可能性があることを示している。
【0091】
【表14】

ND=測定せず NR=反応なし
(実施例9)
DRI参照領域インデックスを構成するための、DRI発現と抗癌薬に対する反応性との相関に関する統計解析
腫瘍反応性のDRI参照領域を構成するための原理および方法は、(1)in vitro指標化システム、(2)パラフィンブロックin vitro指標化システムを基礎にする。これら2つのin vitro指標化システムの構成における成功は、腫瘍細胞の細胞障害性反応をパラフィン包埋後のDRI測定に統計的に相関させることができるという確信を提供する。
【0092】
このインデックスの目的は、個々の患者の腫瘍におけるDRI発現の異なるレベルでの薬物に対する抵抗性の確率を算定することである。次いで、特定レベルのDRI発現を有する所定の癌患者に対して抗癌薬を処方するために、診察する医師はこの参照領域を調べることができる。
【0093】
本発明者らは、統計的回帰の方法を使用して、その薬物に関連するDRI発現レベルを有する各薬物によるin vitro細胞増殖の抑制をモデル化する。この方法は、培養腫瘍細胞標準およびパラフィン包埋培養細胞標準の双方に適用できる。結果変数は、細胞系に対する用量反応曲線から決定されるIC50の対数であり、独立変数は、DRIレベルである。本発明者らの予備的データおよび文献中のデータのためにlogIC50が使用される。13の細胞系を用いるこの企画された研究において、本発明者らは、真の相関が、5%の有意水準で少なくとも60%であることを示すのに十分な力(80%のチャンス)を有する。本発明者らは、ピアソンの相関が上で引用した実験例で.90を超えるまで観測されたので、妥当と思われる計算において、0.90である相関に対して代わりの仮説を設定した。
【0094】
本発明者らは、この相関データを、さらに単純クラスター分析または変化点分析を介して分析する。この分析は、生物学的反応性の確率を明確に示すのに使用できるDRI発現レベルが存在するかどうかを判定する。
【0095】
(実施例10)
個々の癌患者に関して疾患を管理するための情報を提供するに際しての3つの分子診断試験
薬物反応性指標試験(DRIT)
解説
1)原発性腫瘍の細胞(パラフィンブロックに包埋された)中に発現し、腫瘍抵抗性および標的化学療法の双方に関連する6〜8種の細胞バイオマーカーを、蛍光標識モノクローナル抗体(fMAb)で染色する。これらのマーカーの発現レベルは、コンピューター支援蛍光顕微鏡装置を利用して定量化することができ、かつ標的化学療法のために使用できる。
2)これらのバイオマーカーの数値で表した蛍光測定値を、市販の蛍光標準に対して正規化して、日間−実験室間データの比較を可能にする。
3)標的療法での治療に対して様々な度合いの抵抗性を有する、癌型(乳房または肺など)の細胞系由来の培養癌細胞から構成されるin vitro較正システムを確立した。抵抗性の度合い(IC50として測定されるような)とバイオマーカーの発現(画素当たりの蛍光)との間での有意の相関が、ピアソンの係数によって確立された。統計的回帰の方法を使用して、その薬物に関連するDRI発現レベルを有する各薬物によるin vitro細胞増殖の抑制をモデル化する。結果変数は、細胞系に対する用量反応曲線から決定されるIC50の対数であり、独立変数は、DRIレベルである。単純クラスター分析または変化点分析を採用して、好ましくない生物学的反応性の確率を示すのに使用できるDRI発現レベルが存在するかどうかを判定する。
4)また、原発性腫瘍と同じ手法でこれらの細胞系を固定し、パラフィンブロック中に包埋した。スライド上のこれら細胞の切片を上述のように染色し、測定する。これらの細胞のIC50と対応するバイオマーカーの発現との間にやはり相関が確立される。
5)IC50と対応するバイオマーカーの発現との間の上記相関研究(癌細胞系での)を使用して、バイオマーカーのためのDRIインデックスを確立した。このようなインデックスは、腫瘍のバイオマーカー発現と、機構的に関連した薬物での治療に対するこの腫瘍の抵抗性の度合いを相関させるのに使用できる。DRIインデックスを使用して抵抗性の確率(治療の失敗)を叙述することができる。
6)これらの実験室的研究は、遡及的臨床相関研究および予測的臨床相関研究によって確認および変更され、DRIインデックスおよびその確率参照領域が臨床データに基づくように変更される。
7)試験は、原発性腫瘍の4ミクロン厚パラフィンブロック切片(二重測定に必要な6スライド)上で実施され、2日間を費やす。包埋されていない固定化腫瘍細胞も、容易に試験することができる。
応用
1)信用のおける試験報告は、DRIインデックス、および米国癌協会が利用可能にした全米総合癌ネットワーク(NCCN)のガイドライン中に含まれるFDAが承認し広範に使用される5〜6種の化学療法薬に対する個別患者の腫瘍の抵抗性に関する統計的に算定された確率を提供する。医師は、試験結果に基づいてこの患者に対する最も適切な治療計画について情報に基づいた決定をすることができる。
【0096】
HER−tax試験
解説
1)HER−tax試験は、HER−2/neu受容体陽性(IHC3+またはFISH+で示される過剰発現)である乳癌患者に適用すべきである。
2)試験は、HER−2/neu受容体(蛍光標識ハーセプチンで)、PTEN、およびβ−チューブリンIII(タキサンのためのDRI)に対する染色を除けばDRITに類似した仕方でパラフィンブロック中に包埋された原発性腫瘍に対して実施される。
3)目的は、低領域(しかし、なおIHC3+)のHER−2/neu過剰発現を示す、さらに低いPTEN発現値および高いβ−チューブリンIII発現値を示す患者の腫瘍についてスクリーニングすることである。この患者集団の腫瘍は、ハーセプチンおよびタキサンの双方に対して抵抗性である可能性がある。抵抗性に関する確率が提供される。
4)HER−2/neuおよびβ−チューブリンIIIの発現に関する腫瘍中の癌細胞の不均一性が測定される。不均一性の度合いは、ハーセプチン−タキサンの治療計画に対する好ましい反応性の持続期間に関連する可能性がある。
応用
1)HER−2/neu陽性患者の40〜50%のみが、ハーセプチン−タキサンの治療計画に限られた期間(おそらくは1年を超えない)好ましく反応するので、このHER−tax試験は、抵抗性のある患者を選別し、治療下の患者に対する好ましい反応性の推定持続期間を予測する。ハーセプチンは、かなり高価な薬物であり、心臓毒性を有する。
【0097】
乳癌患者に対する循環癌細胞試験(CCCT)
解説
1)患者の静脈血20mLを集め、密度勾配遠心分離および磁気細胞ソーティングを介して正常血液細胞を除去することによって循環癌細胞(CCC)を濃縮する。これらの癌細胞を、ネガティブ選択法により集め、顕微鏡スライド上に載せ、次いで、蛍光モノクローナル抗体で染色し、コンピューター蛍光顕微鏡装置を利用して数え上げる。
2)試験は、血液検体を集めた後、24時間以内に実施される。検体は、CCC Dia
gnosticsによって確証された特殊輸送容器に入れ、至急便で送ることができる。3)CCC中に発現した薬物反応性バイオマーカーを特徴付けることができる。
4)転移性癌(ステージIV)中に見出されるCCCの数は、ステージI、II、およびIIIの癌中のそれよりも多い。CCCの大きな数は、思わしくない予後および薬物治療に対する不十分な反応性に統計的に関連している。
5)企画された薬物治療研究において、治療前の試験ならびに治療中および治療後の2〜3回の試験(2〜3ヶ月の時間間隔)におけるCCCの数え上げは、治療の影響を反映している可能性がある。CCC数が治療後に高いままなら、該薬物はおそらく有効ではなく、CCC数が治療後により低くなったら、該薬物はおそらく有効であろう。この予備的知見を臨床的に試験する。血液中のCCCを見出す技術を、7種の癌(前立腺、肺、胃、膵臓、肝臓、結腸、および乳房)について開発した。
応用
1)ステージIIIまたはステージIVの乳癌患者の場合には、治療前にCCCTを実施して予後を見きわめることができ、治療に続いて、反応性を把握するために2〜3回のCCCTを実施できる。結果は、患者の画像検査(X線およびCT)の前に得ることができる。
2)腫瘍の薬物抵抗性が発生する可能性のある場合には、次の薬物治療について新たな選択をするために、CCCTを実施してCCC中のバイオマーカーのステータス変化を測定できる。これらの結果を、標的療法の治療に対して様々な度合いの抵抗性を有する癌タイプ(乳房または肺など)の細胞系に由来する培養癌細胞からなるin vitro較正システムと相関させることができる。相関は、指定されたDRIの発現および培養細胞の薬物治療に対する抵抗性に基づく。
3)CCC数に関するデータは、画像検査に取って代わることはできないが、CCCTは、より迅速であり、転移性癌の薬物抵抗特性の変化に関する識見を提供する。バイオマーカーとの関連で腫瘍の抵抗性を特徴付けることは、画像法では行なうことができない。
【0098】
(実施例11)
PACは、3つの戦略ステップを必要とする。ステップI:腫瘍中に同時に存在するいくつかの標的の定量的測定。薬物反応性指標(DRI)と称されるこれらの標的は、標的モノクローナル抗体およびコンピューター蛍光顕微鏡を利用する免疫蛍光によって評価できる。数値を得て、比較のための蛍光参照標準に対して正規化できる。
【0099】
ステップII:DRI発現と、関連薬物に対する腫瘍細胞の細胞障害反応性との統計的に有意な相関性の確立。in vitro指標化システムを確立し、各薬物の細胞障害効果を対応するDRI測定値に相関させた。種々の抗癌薬に対して異なる感受性を有する7種の乳癌(BC)細胞系を利用した。タモキシフェン、パクリタキセル、トラスツズマブ、およびドキソルビシンの効果をこれらの細胞系における各薬物に対するDRI発現と相関させた。DRIは、それぞれエストロゲン受容体、β−チューブリンIII、HER−2/neuおよびトポイソメラーゼIIである。ピアソンの順位相関係数は、0.77〜1の範囲に、p値は0.005〜0.02の範囲に見出される。
【0100】
ステップIII:個々の癌患者から癌細胞を得るための技術。転移性癌の場合、ネガティブ選択法(Cancer 2000:88巻、12号、2787頁)を使用して、末梢血から循環癌細胞(CCC)を取得し、数え上げ、HER−2/neu発現を定量化するために標識化トラスツズマブで染色した。101名のBC患者を研究し、402の血液検体を抜き取り、患者当たり抜き取られた検体の中位数は4(1〜7)であった。CCCは、遠方転移と関連しており、ステージIVの患者の88%が、サンプリング中のどこかの時点でCCCを有する。CCC数は、検体当たり1〜1283の範囲である。
【0101】
20名の患者が、HER−2/neu発現について試験するための4個またはそれ以上のCCCを有し、また、利用可能な腫瘍組織データを有した。18人の患者で、CCCおよび原発性腫瘍データは、6名のHER−2/neu陽性および12名のHER−2/neu陰性で一致(90%)した。1名の患者は、腫瘍組織中でHER−2/neu陰性であるが、CCC中でHER−2/neu陽性であった。1名の患者は、腫瘍組織中でHER−2/neu陽性、CCC中でHER−2/neu陰性と確認された。
【0102】
療法(トラスツズマブ)−診断(HER−2/neu発現)の結合は、BCに対するPACのためにFDAが承認した最初のモデルであった。しかし、HER−2陽性転移性BC患者の30%未満が、単一薬剤療法としてのトラスツズマブに反応するが、HER−2陰性患者では、有意に反応性がより低い。BC腫瘍組織およびCCCにおけるDRI測定値の改善は、より予測可能な治療結果につながる可能性がある。BC患者の原発性腫瘍組織から切断された切片スライドからのDRI測定も報告する。
【0103】
(実施例12)
乳、結腸および肺癌患者からのホルマリン固定パラフィン包埋(FFPE)組織中のDRIの定量化
顕微鏡スライド上に載せたFFPE組織切片の調製、および蛍光標識モノクローナル抗体とのインキュベーションは、実施例1および4で説明している。同一野の細胞のデジタル画像は、実施例2に記載の標準曲線から決定される露出時間を利用し、DAPI、FITC、Alexa532、Alexa594、およびAlexa647の蛍光を区別するフィルターキューブを用いて得られた。各腫瘍組織切片からの5つの異なる区域の画像を取得し、記憶装置に保管した。組織をまったく含まないスライドを利用し、適切な露出時間の各フィルターキューブでバックグラウンド画像を取得した。組織の自己蛍光を評価するため、上記フィルターキューブのそれぞれを用い、抗パンサイトケラチン−FITCとのみインキュベートされた各腫瘍からの連続切片の画像も取得し、正確に試験検体のように処理した。
【0104】
DRIの蛍光強度を定量化するため、DRI画像から適切なバックグラウンド画像を差し引くことによって画像を初めに平坦化した。これにより、照明野におけるなんらかの変動を除去する。次いで、バックグラウンド画像の画素当たり平均蛍光(F/P)(画像ヒストグラムから得られる)を平坦化画像から差し引く。処理済みDRI画像を対話的に吟味し、最も明るい蛍光をもつ区域の輪郭を描く(通常的には50〜100細胞)。この注目区域(AOI)を複写して切取り画像として記憶装置に保管する。保管した切取り画像を呼び戻し、AOI中のすべての細胞がサイトケラチン陽性の上皮細胞であることを保証するためのFITCフィルターを用いて取得した同一野の細胞画像上に配置する。各切取りDRI画像中の蛍光シグナルを、Image−Proソフトウェアで分析して、バックグラウンドから蛍光性目標(細胞または細胞クラスター)を分離する強度を選択する。次いで、Image−Proは、輪郭を描き、計数し、切取りDRI画像中の目標に関する定量的データを提供する。データをエクセルに取り込み、各腫瘍からの5つの画像のそれぞれにおける目標に対する平均F/Pの平均を計算し、参照標準に対して正規化する。試験スライドに対して使用したのと正確に同一の方法を利用して、各フィルターキューブについて同一腫瘍の連続切片の自己蛍光を計算する。各DRI画像(腫瘍当たり5つ、全部で250〜500細胞)の画素当たり平均蛍光から組織の自己蛍光を差し引いたものを、標準対照のパーセントとして報告する。
【0105】
6名の乳癌患者のFFPE組織に関するDRI結果を下記の最初の表に示す。エストロゲン受容体(ER)、β−チューブリンアイソフォームIII(TUB)、チミジル酸シンターゼ(TS)、トポイソメラーゼII(TOP)、リボヌクレオチドレダクターゼ(RR),HER−2/neu(HER)および除去修復交差相補−1酵素(ERCC−1)を定量化した。6名の異なる患者で測定された各DRIの5つの切取り画像中の選択された目標の平均F/P(参照標準に対して正規化された)を、5つの値の平均(太字)および5の値の変動係数(CV)(括弧内)と一緒に示す。6名の患者からの5つのDRI画像に対するCV値は、8.9(患者39のTS)から37.4(患者39のER)の範囲であり、18の測定中の5つでは、DRI値が極めて低いのでCVはあてはまらなかった。同一患者の複写連続切片を分析した場合、DRI値は次表からわかるように同じ比較上の範囲にあった。
【0106】
【表15】

DRI値は、標準対照(蛍光ミクロスフェア)のパーセントとして表され、*使用した二次抗体はヤギ抗マウスIgG−Alexa532、括弧内の数字は、5つの異なる区域の腫瘍細胞において測定されたDRI値に対する変動係数である。
【0107】
乳、肺および結腸癌患者のFFPE組織のスライドは、NCI Cooperative Human Tissue Network(CHTN)、Mid−Atlantic Divisionから入手した。下表は、3つの異なるタイプの癌患者に関するDRI測定値を示し、また、2つの異なる顕微鏡で2名の異なるオペレーターによって得られた同一患者からの連続切片のERCC−1発現値を比較している。異なる区域の腫瘍組織からの5つの切取り画像中で測定されるDRI値を、変動係数と一緒に示す。結果は、これら4つのDRIを3つの癌タイプに由来するFFPE組織の上皮細胞(サイトケラチン染色陽性)中で測定できること、および2つの異なる顕微鏡および2名の技術員によるDRI測定で同様のデータが得られたことを示している。個々の患者に対して適切な薬物を選択する際に医師が使用するためのこのアッセイ法の可能性を評価するために、各DRI測定を、関連する抗癌薬に対する患者の反応性と相関させることに留意されたい。このような情報は、初めに遡及的研究で、それに続く予測的臨床試験で得られる。
【0108】
乳房、結腸および肺組織切片におけるDRI定量化の比較
【0109】
【表16】

CVは、5つの異なる区域の腫瘍組織中で測定されたDRI値に対する変動係数である。DRI値は、標準対照のパーセントとして表され、平均を太字で示す。
【0110】
理解を明快にする目的で、説明および実施例によって本発明をある程度詳細に十分説明してきたが、本発明の範囲またはその任意の具体的実施形態に影響を与えないで広範かつ等価な範囲の条件、処方およびその他のパラメーターの範囲内で本発明を修正または変更することによって同じことを実施できること、ならびに、このような修正または変更は、添付の特許請求の範囲に記載の範囲に包含されると解釈されることは、当業者にとって明白であろう。この明細書中で言及したすべての刊行物、特許および特許出願は、本発明が属する分野の当業者の技術レベルを示し、かつ、あたかも各個々の刊行物、特許または特許出願が具体的かつ個別的に参照により組み込まれていると解釈されるかの如き程度まで参照により本明細書に組み込まれる。
【技術分野】
【0001】
(関連出願への相互参照)
本願は、2005年9月21日に出願された、米国仮特許出願第60/718,724号および2006年3月6日に出願された米国仮特許出願第60/778,901号に対する優先権を主張する。米国仮特許出願第60/718,724号および米国仮特許出願第60/778,901号の内容は、本明細書中に参考として援用される。
【0002】
(政府によって支援された研究に関する声明)
CCC Diagnostic,LLCに対して授与された米国立癌研究所中小企業技術革新研究助成金(NCI SBIR Grant)CA081903号により一部支援された。政府は本発明に関して特定の権利を有することができる。
【0003】
(本発明の技術分野)
本発明は、癌療法の領域に関する。詳細には、個々の患者の癌に対して最も効果的な療法を識別することに関する。
【背景技術】
【0004】
(背景技術)
癌は、高度に個別化された疾患であり、単一薬剤を用いる治療に対する現在の好ましい反応率は低い(約20%)。反応率を高めるためには、各患者に対して適切な薬物を選択することが、この上なく重要である。異なる患者は、同じ薬物に対して異なる仕方で反応することが広く認識されており、おそらく、遺伝的形質に由来する個別的変動性によるものであろう。薬物の効果における遺伝的に受け継がれた差異に関する臨床的観察が、ファーマコゲノミクスの分野を立ち上げた。薬物反応性における個体間の差異が、薬物代謝酵素、薬物輸送担体または薬物標的をコードする遺伝子の配列変異体によるものであるいくつかの事例が報告されている(例えば、非特許文献1;および非特許文献2を参照されたい)。
【0005】
薬物代謝に対する宿主の不均一性に加え、所定の薬物に対する腫瘍の反応性に影響を及ぼす腫瘍の変形形態が存在し、例えば、
1)ほとんどの結腸癌患者は、彼らがチミジル酸シンターゼ、チミジンホスホリラーゼおよびジヒドロピリミジンデヒドロゲナーゼの低レベルの発現を有するなら、5−FU化学療法に反応する。患者は、1種または複数の酵素の発現が高レベルにあるなら、極めて低い反応性を有し、
2)β−チューブリンの突然変異を伴う患者は、パクリタキセルをベースにした化学療法に十分には反応しないが、一方、野生型β−チュプリンを伴う患者の約40%は、完全な、または少なくとも部分的な反応性を有した。さらに、野生型β−チューブリン遺伝子を所持する患者の場合、生存期間中央値も向上し、
3)受容体タンパク質のHER−2/neu遺伝子の増殖または強力な過剰発現(免疫組織化学で+3)を利用して、細胞障害性化学療法とトラスツズマブの組合せに対してより反応する可能性のある患者の部分集団を識別できる。単一薬物トラスツズマブは、HER−2/neuの過剰発現または遺伝子増幅を示す転移性乳癌を有する女性に対する一次治療として活性があり十分に許容され、かつ
4)高いヌクレオチド除去修復活性は、非小肺癌細胞におけるシスプラチン抵抗性と密接に相関しており、ヒト卵巣癌細胞におけるERCC−1発現レベルとシスプラチン誘発性DNA損傷の間の関連が報告されている。
【0006】
上記の例は、腫瘍細胞上の1種または複数の特定バイオマーカーの発現レベルが、特定薬物に対する腫瘍の反応性に関連していることを示唆している。より最近の抗癌薬は、極めて重要な過程(例えば、修復、有糸分裂)の特定の細胞成分(例えば、受容体、酵素)に対して設計されるので、機構的に関連のある抗癌薬で治療した場合に、腫瘍細胞の反応性を指示する可能性のあるバイオマーカーを見出すことができそうである(例えば、非特許文献3、および非特許文献4を参照されたい)。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】Evans,W.E.Johnson,J.A.、Annu.Rev.Genomics Hum.Genet.2001年、2巻、9〜39頁
【非特許文献2】McLeod,H.L.Evans,W.E.、Annu.Rev.Pharmacol.Toxicol.、2001年、41巻、101〜121頁
【非特許文献3】Parkら、Clinical Cancer Research、2004年、10巻、3885〜3896頁
【非特許文献4】Vande Woude,G.F.ら、Clinical Cancer Research、2004年、10巻、3897〜3907頁
【発明の概要】
【発明が解決しようとする課題】
【0008】
個体の特定の腫瘍を最も効果的な治療モダリティーに合わせる必要性、すなわち、個別化抗癌化学療法(PAC)に対する必要性が存在することは、当技術分野で一般的に認識されている。本発明は、この、またはその他の必要性に対処する。
【課題を解決するための手段】
【0009】
(発明の要旨)
本発明は、in vitro画像化技術を介する個別化抗癌化学療法(PAC)のための分子診断試験を確立する。PACは、個々の患者から得られる腫瘍細胞を薬物反応性指標/バイオマーカー(DRI)に関して特徴付けることを必要とする。この方法は、標的化学療法薬の出現、および機構的に関連した薬物に対する腫瘍の抵抗性と相関させることのできる腫瘍細胞バイオマーカーの発現を解明することによって有望になる。新鮮細胞としての、またはパラフィンブロック中に保たれた保存細胞としての腫瘍細胞のin vitro画像化は、コンピューター蛍光顕微鏡装置を用いて実施される。数字で表した測定値は、対照としての蛍光ミクロスフェアを用いて正規化される。
【0010】
いくつかの実施形態において、本発明は、患者から1つまたは複数の腫瘍細胞を得ること、および該腫瘍細胞を特徴付けることを含む。特徴付けは、腫瘍を抗体、特にモノクローナル抗体で特徴付けることを含むことができる。典型的には、このような抗体は、化学療法薬の作用機構に関連する腫瘍細胞成分に向けて標的化される。これらの成分の存否または量は、治療で使用される関連薬物に対する腫瘍細胞の感受性または抵抗性を反映する。本明細書中で使用する場合、特定の化学療法薬の作用機構に関連する細胞成分は、その化学療法薬に対する薬物反応性指標(DRI)と見なすことができる。
【0011】
いくつかの実施形態では、抗体を標識することができ、例えば、各抗体を、同時個別的検出のために異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で標識できる。これら種々の蛍光標識抗体の結合を測定、例えば、定量的に測定できる。いくつかの実施形態において、測定は、コンピューター蛍光顕微鏡装置を使用し、光学および記録装置を標準化するための対照と対照して蛍光強度を定量化することによって行なうことができる。細胞中の薬物反応性指標を標的とした染料標識抗体の蛍光によって測定した場合に種々の化学療法薬に特異的に対応する種々の反応性指標の量を、所定の抗癌化学療法薬に対して様々な度合いの細胞障害性反応を示す種々の関連癌細胞系と対比できる。患者の腫瘍に由来する薬物反応性指標データの解釈は、培養において関連のある薬物治療に反応している様々な細胞障害感受性に関する各種関連癌細胞系から得られる薬物反応性指標に対する外挿によって確立される。化学療法薬の予測的効果は、所定の薬物に関連のある薬物反応性指標の肯定的および/または否定的影響に留意することによって見きわめられる。すなわち、腫瘍細胞中の特定の薬物反応性指標の存否、および低い量または高い量は、腫瘍を所定の薬物治療に対して反応させない(または敏感でない)。この予測は、政府(FDA)が承認したいずれの化学療法薬が、個々の患者の腫瘍に対して有効でない可能性が最も高いかを説明できる。したがって、いくつかの実施形態において、個々の患者に対して有効な化学療法薬の選択は、個々の癌患者に由来する腫瘍細胞の薬物反応性指標によって明らかにされるような、効果的でない薬物でのすべての治療を排除することによってなされる。本発明は、薬物反応性指標の量と薬物作用の直接的相関を、薬物処理を伴う細胞培養データの統計解析によって確認する。
【0012】
いくつかの実施形態において、腫瘍細胞検体は、体内の転移性癌を提示する血液中の循環癌細胞から得ることができる。いくつかの実施形態において、腫瘍細胞検体は、リンパ系中で循環している癌細胞として原発性腫瘍に近接したリンパ節から得ることができ、気管支鏡生検などの生検によって得られる。いくつかの実施形態において、腫瘍細胞検体は、生検でまたは外科標本から腫瘍組織が得られる場合には、原発性腫瘍から得ることができる。原発性腫瘍から検体が得られる場合のようないくつかの実施形態では、腫瘍組織を、ホルマリン中で固定し、パラフィンブロック中に包埋し、薄い切片に切断して、検査のために顕微鏡スライド上に置くことができる。いくつかの実施形態では、腫瘍細胞のパラフィンブロックから得た切片スライドを、キシレンおよびアルコール洗浄によってパラフィン除去することができ、例えば、加熱/加水分解/再生を用いる抗原回復法により処理することができ、次いで、薬物反応性指標の識別処理および定量的測定のために、種々の細胞成分に対して適切な蛍光標識モノクローナル抗体で染色できる。いくつかの実施形態では、処理されたスライド上で組織を、コンピューター蛍光顕微鏡装置で検査、画像化、分析、および記録することができる。いくつかの実施形態では、5つまたはそれ以上の蛍光抗体を、切片スライド上で同一視野から同時的に測定、画像化、分析および記録することができる。
【0013】
本発明は、任意起源の癌および任意の治療モダリティーを分析するのに使用できる。例えば、政府(FDA)承認の種々の細胞障害性薬物に対して様々な度合いの抵抗性(または感受性)を示す、乳、肺、結腸、およびその他の上皮細胞起源の癌を源とする癌細胞系である。細胞障害性薬物としては、限定はされないが、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン(ビンカアルカロイド)、5−フルオロウラシル関連薬物(ゼロ−ダなど)、ゲムシタビン、およびアントラサイクリンを挙げることができる。いくつかの実施形態において、抗癌薬は、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)などのヒト化モノクローナル抗体を含むことができる。
【0014】
いくつかの実施形態において、薬物反応性指標は、次の細胞成分(抗原)を含むことができ、FDAにより承認された対応抗癌薬の有効性を評価するのに使用できる。
薬物反応性指標 薬物
ERCC1 カルボプラチン
シスプラチン
オキサロプラチン
エストロゲン受容体 タモキシフェン
アロマターゼ阻害薬
β−チューブリンIIIアイソフォーム ドセタキセル
パクリタキセル
タキサン
ビノレルビン
チミジル酸シンターゼ 5−FU関連薬物
ゼローダ
リボヌクレオチドレダクターゼ ゲムシタビン
トポイソメラーゼII アントラクリン
HER−2/neu受容体、PTEN トラスツズマブ(ハーセプチン)
いくつかの実施形態において、薬物反応性指標は、適切に蛍光標識されたトラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)およびベラシズマブ(アバスチン)など、適切に標識されたモノクローナル抗体治療薬によって標的とされる抗原を含むことができる。
【0015】
一実施形態において、本発明は、患者から腫瘍細胞検体を得ること、抗体を使用して検体中の複数の薬物反応性指標を測定すること、および化学療法薬を選択することを含む、個々の癌患者に向けて癌を治療するための化学療法薬を選択する方法を提供する。いくつかの実施形態において、抗体は、蛍光標識された、例えばモノクローナル抗体でよい。抗体が、測定予定の各薬物反応性指標に特異的な蛍光標識抗体である場合には、複数の薬物反応性指標の同時定量化を可能にする、異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で抗体を標識できる。典型的には、薬物反応性指標は、化学療法薬の作用機構に関連した細胞成分であり、選択は、検体の細胞中に存在する薬物反応性指標の存在/不在または量に基づく。1種または複数の薬物指標の存在が検出され、かつ、存在する薬物反応性指標を定量化することが所望される場合には、このような定量化は、検体中の薬物反応性指標の蛍光強度を1種または複数の参照標準と比較することを含むことができる。典型的には、本発明の方法は、少なくとも5種の薬物反応性指標を測定することを含むことができる。いくつかの実施形態において、測定は、検体中の複数の薬物反応性指標、例えば5種またはそれ以上の量を、該薬物反応性指標を介して作用する化学療法薬に対して既知の反応性をもつ細胞中の同一薬物反応性指標の量に対比することを含む。本発明を実施する際には任意の検体種を使用することができ、例えば、検体は、患者の血液中の循環癌細胞から得ることができ、患者の原発性腫瘍に近接したリンパ節から得ることができ、あるいは患者の原発性腫瘍から得ることができる。本発明の方法は、当技術分野で周知の任意の適切な化学療法薬、例えば、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン、ビンカアルカロイド、5−フルオウラシル関連薬物、ゼローダ、ゲムシタビン、アントラサイクリン、ヒト化モノクローナル抗体、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)を選択するのに使用できる。いくつかの実施形態において、少なくとも1種の薬物反応性指標はERCC1であり、化学療法薬は、カルボプラチン、シスプラチン、およびオキサロプラチンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はβ−チューブリンIIIアイソフォームであり、化学療法薬は、ドセタキセル、パクリタキセル、タキサン、およびビノレルビンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はチミジル酸シンターゼであり、化学療法薬は、5−FU関連薬物、ロイコボリン、ペメトレキセルおよびゼローダからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はトポイソメラーゼIIであり、化学療法薬は、アントラサイクリン、ドキソルビシン、およびエピルビシンからなる群から選択される。いくつかの実施形態において、少なくとも1種の薬物反応性指標はトポイソメラーゼIであり、化学療法薬は、イリノテカンである。いくつかの実施形態において、少なくとも1種の薬物反応性指標はリボヌクレアーセレダクターゼであり、化学療法薬は、ゲムシタビンである。
【0016】
この方法を実行するために3種の診断試験を確立した。これらの診断試験は、(1)薬物反応性指標試験(DRIT)、(2)HER−2/neu過剰発現陽性である乳癌患者のためのハーセプチン−タキサン反応性試験(HER−Tax試験)、(3)循環癌細胞試験(CCCT)である。
【0017】
DRITおよびHER−Taxは、DRIの定量的測定のための試験であり、CCCTは、循環癌細胞(CCC)の数およびCCC中のDRIバイオマーカー発現を測定する。これら3種の試験は、個々の患者における腫瘍の薬物反応性に関する包括的情報を提供し、それを介して最も効果的な化学療法治療を選択できる。
【0018】
例えば、乳および肺癌細胞中の、または腫瘍組織切片スライド中のDRI発現レベルは、標本を染色するための蛍光染料で標識されたモノクローナル抗体(MAB)を利用して測定できる。指標化システムは、薬物に対して様々な抵抗性を有する種々の癌細胞系のDRI発現と細胞障害性反応(IC50)を相関させるように確立される。細胞障害性反応のこの相関を、パラフィンブロック中に包埋された癌細胞のDRI測定に拡張して、パラフィンブロックから切断されたヒト腫瘍組織切片中でのDRI発現に対する対照として役立つことのできる細胞系標準を確立する。腫瘍断片中で測定される各DRIに対する参照領域は、培養での癌細胞の(IC50)に基づいた対応薬物に対応する抵抗性/反応性の確率から構成できる。記録された臨床結果を用いた回顧的臨床研究を実施して、DRI指標に対するこの参照領域を確認する。本出願の革新性は、(1)in vitro画像化システムの進歩、(2)DRIレベルに相関させた細胞障害性反応のインデックスシステム、(3)腫瘍抵抗性の確率によって示されるような腫瘍の反応性に対応するDRIインデックスのための参照領域に基づく。患者のDRIインデックス、および臨床的反応性の参照領域を調べた後、診療する医師は、この患者のための薬物処方について情報に基づいた決定をすることができる。
例えば、本願発明は以下の項目を提供する。
(項目1)
個々の癌患者のための癌治療用化学療法薬の選択方法であって、
該患者が患うタイプの癌を治療するために政府が承認した化学療法薬のパネルを選択すること、
該患者から腫瘍細胞検体を得ること、
該腫瘍細胞検体中の少なくとも1つの細胞中の抗体を使用して、化学療法薬のパネルに対応する薬物反応性指標のパネルの発現を測定すること、および
該薬物反応性指標の発現に基づいて化学療法薬を選択すること
を含む方法。
(項目2)
前記抗体が蛍光標識されている、項目1に記載の方法。
(項目3)
前記薬物反応性指標が、化学療法薬の作用機構に関連した細胞成分である、項目1に記載の方法。
(項目4)
前記抗体が、異なる励起および重ならない発光スペクトルを有する種々の蛍光染料で蛍光標識される、項目1に記載の方法。
(項目5)
測定することが、前記薬物反応性指標を定量化することを含む、項目1に記載の方法。
(項目6)
定量化することが、蛍光強度を参照標準と対比することを含む、項目5に記載の方法。
(項目7)
測定することが、1回の試験で少なくとも5種の薬物反応指標を定量化することを含む、項目5に記載の方法。
(項目8)
測定することが、検体中の複数の薬物反応性指標の発現量を、該薬物反応性指標を介して作用する化学療法薬に対して既知の反応性を有する細胞中の同一薬物反応性指標の量に相関させることを含む、項目5に記載の方法。
(項目9)
1回の試験中に少なくとも5種の薬物反応性指標の発現量が比較される、項目8に記載の方法。
(項目10)
前記腫瘍細胞検体が、循環癌細胞、原発性腫瘍に近接したリンパ節からの検体、原発性腫瘍からの検体、および固定されパラフィンブロック中に包埋された原発性腫瘍からの検体からなる群から選択される、項目1に記載の方法。
(項目11)
前記化学療法薬が、カルボプラチン、シスプラチン、オキサリプラチン、ドセタキセル、パクリタキセル、タキソール、ビノレルビン、ビンカアルカロイド、5−フルオウラシル関連薬物、ゼローダ、ゲムシタビン、アントラサイクリン、イリノテカンからなる群から選択される、項目1に記載の方法。
(項目12)
前記化学療法薬が、ヒト化モノクローナル抗体、トラスツズマブ(ハーセプチン)、セツキシマブ(エルビタックス)、およびベラシズマブ(アバスチン)からなる群から選択される、項目1に記載の方法。
(項目13)
少なくとも1種の薬物反応性指標がERCC1であり、かつ前記化学療法薬が、カルボプラチン、シスプラチンおよびオキサロプラチンからなる群から選択される、項目1に記載の方法。
(項目14)
少なくとも1種の薬物反応性指標がβ−チューブリンIIIアイソフォームであり、かつ前記化学療法薬が、ドセタキセル、パクリタキセル、タキサン、およびビノレルビンからなる群から選択される、項目1に記載の方法。
(項目15)
少なくとも1種の薬物反応性指標がチミジル酸シンターゼであり、かつ前記化学療法薬が、5−FU関連薬物、ロイコボリン、ペメトレキセルおよびゼローダからなる群から選択される、項目1に記載の方法。
(項目16)
少なくとも1種の薬物反応性指標がトポイソメラーゼIIであり、かつ前記化学療法薬が、アントラサイクリン、ドキソルビシン、およびエピルビシンからなる群から選択される、項目1に記載の方法。
(項目17)
少なくとも1種の薬物反応性指標がトポイソメラーゼIであり、かつ前記化学療法薬がイリノテカンである、項目1に記載の方法。
(項目18)
少なくとも1種の薬物反応性指標がリボヌクレアーゼレダクターゼであり、かつ前記化学療法薬がゲムシタビンである、項目1に記載の方法。
(項目19)
測定することが、乳癌、肺癌、結腸癌、胃癌、膵臓癌、および食道癌からなる群から選択される1種または複数の癌について薬物反応性指標試験を実施することを含み、該薬物反応性指標試験が、診断される癌のタイプについて米国総合癌ネットワークの患者治療ガイドライン中に列挙されたすべての化学療法薬に対する腫瘍抵抗性/感受性データを提供する、項目1に記載の方法。
(項目20)
腫瘍抵抗性/感受性データが、相関的臨床研究の統計解析に基づいて、個々の被試験患者に対する薬物反応性不全のパーセント確率によって解釈され得る、項目19に記載の方法。
【図面の簡単な説明】
【0019】
【図1】図1は、InSpeck Microscope Image Intensity Calibration Kit(6ミクロン蛍光性ミクロスフェア)を用いて作成された、種々の腫瘍細胞標本からのHER−2/neuの定量データを対比する際に使用するための標準曲線である。
【図2】図2は、乳癌患者からの組織切片中のHER−2/neu蛍光シグナルを示すデジタル画像である。切片は、パラフィンブロック中に包埋された腫瘍組織から切断され、トラスツズマブ−Alexa532で染色するために処理され、蛍光顕微鏡法で分析され、CCDカメラで画像化された。
【図3】図3は、HER−2/neuを定量化するために選択されたトラスツズマブ−Alexa532で染色された細胞膜の注目区域(AOI)の領域を示す。
【発明を実施するための形態】
【0020】
(発明の詳細な説明)
用語、生物学的マーカー(バイオマーカー)は、「正常な生物学的過程、発病過程、または治療介入に対する薬理学的反応性の指標として客観的に測定および評価される特性」として定義される。本出願の目的の場合、細胞中の薬物反応性指標は、該細胞が薬物に対してどのように反応するかに関する情報を提供する。
【0021】
本発明は、以下をベースにしたPACの開発を提供する。(1)参照標準に対して正規化された蛍光強度に基づいた各細胞の注目区域における薬物反応性指標(DRI)の定量的同時測定。蛍光は、DRIに対する標識MABの染色量を示す。(2)種々の抗癌薬に対して異なる抵抗性を有する一群の癌細胞系を利用すること、および各薬物によるin vitroでの細胞増殖の抑制をその薬物に関連するDRI測定と統計的に相関させること。(3)DRI測定のための個々の癌患者からの癌細胞および腫瘍組織の供給源。
【0022】
PACの開発は、化学療法薬の低い効力およびかなりの副作用、ならびに新規抗癌薬を開発するのに必要とされる大きな費用および時間によって推進される。現行の抗癌薬を個々の患者に対してより効果的に利用する大きな必要性がある。PACの臨床的応用は、次の利益の1つまたは複数を提供できる、すなわち
1)医師による薬物または薬物セットの処方が、患者のDRI発現によって示される、この患者に対して処方される薬物の薬物抵抗性の確率に対する対照を提供する指標化システムによって導かれる。
2)試験を、いくつかのFDA承認薬物(3〜6種)に対して同時的に、および同一薬物に対して適任であるいくつかのバイオマーカーに適用できる。この仕方で、効果のない薬物を治療としての検討から迅速に除外し、代案としてより有効な薬物で置き換えることができる。
3)試験は、リアルタイム(2〜3日)で、かなり安価(千ドル未満)、大量(専用実験室の場合1日当たり最大で百件)に行なうことができ、かつ一般病院で実施することができる。
4)画像化技術は、腫瘍の不均一性の評価を含む、腫瘍のDRI値の定量的測定に対する基礎を提供する。この不均一性の測定は、この薬物に対するこの患者の反応持続期間を指示することができる。
【0023】
文献、FDA承認リストの入念な調査から、乳、肺および結腸癌に対して広く利用される薬物、およびそれらの個々の機構的に関連したDRIを次表に列挙する。
【0024】
【表1】

6種の癌の標的化抗癌化学療法に対する薬物反応性指標(DRI)を提供する次表中に、さらなる薬物反応性指標を提供する。列挙した化学療法は、米国立総合癌ネットワーク(National Comprehensive Cancer Network)(NCCN)の癌臨床実践ガイドライン(Clinical Guidelines in
Oncology)、2006年より引用した。化学療法に関連するDRIは文献より引用した。
【0025】
【表2】

注:
1)DRIは、パラホルムアルデヒド中で固定後の生検新鮮癌細胞から、およびホルマリン中で固定しパラフィンブロック中に包埋した腫瘍組織の切片から判定できる。
2)DRI試験に関する相関臨床研究は、ステージIVまたは転移性の患者で実施される。より明確な臨床的反応性は、この患者集団からの腫瘍の大きさまたは数から得ることができる。しかし、結果は、補助ステージを含むすべてのステージの化学療法に対して適用できる。
3)肺癌の場合、これらの薬物は、ドキソルビシンが小細胞肺癌に対して使用されることを除いて、小細胞肺癌(アステリクスで示される)および非小細胞肺癌の双方に対して使用される。
4)ベバシズマブ(アバスチン)は、乳、結腸、肺癌に対して組み合わせて使用される。腫瘍細胞に対するアバスチンの結合を評価するために、別個のDRI試験を確立できる。
【0026】
上で言及したように、インデックスシステムを設定するには、種々の抗癌薬に対して異なる抵抗性を有する一群の癌細胞系が必要とされる。腫瘍由来の不死細胞系は、一般に、頑健な増殖を示し、機能性癌細胞モデル系に対する必要性を満たす。癌細胞系は、抗癌薬物に対する反応性の予測にある程度の成功をもって利用されている。ある研究では、39種のヒト癌細胞系を、55種の細胞障害性癌薬物に対するそれらの感受性に関して分析した。遺伝子発現および化学的感受性プロフィールの統合データベースは、薬物効力を予測するためのシステムを開発するのに有用であることが結論付けられた。別の研究では、31種の細胞障害性薬物に関するフェーズII試験の結果を、米国国立癌研究所のヒト腫瘍細胞系パネルのスクリーニングと相関させた。in vitro細胞系モデルは、小細胞肺癌、乳癌および卵巣癌について様々な接近手段で予言的であると結論付けられた。臨床的応用に向けたシステムに特定した研究ではないが、それらは、ヒト癌細胞系の細胞障害感受性が、臨床試験の結果の相関または予測のために有用である場合があることを示している。
【0027】
標的抗癌療法の効果的な応用は、その療法を分子診断技術と連結して、個別化抗癌化学療法(PAC)を形成することである。PACは、現在、癌治療に対する最も見込みのある開発である。転移性乳癌(MBC)患者に対するトラスツズマブ治療と対にしたHER−2/neu発現は、FDAが承認した最初のRx−Dxカップリングであり、PACに対するモデル系として役立つ。
【0028】
本発明は、薬物反応性指標/バイオマーカー(DRI)を定量化し、この情報を患者に対する適切な治療モダリティーを選択するのに使用するための、個々の患者から得られた腫瘍細胞の特徴付けにおけるin vitro画像化技術および分子診断の利用を含む。分子診断の方法は、次の3つのステップから構成される。すなわち、
(1)個々の癌患者から癌細胞検体を入手するステップ;これらの癌細胞は、凍結腫瘍切片、生検材料、血中循環癌細胞から得られる新鮮癌細胞、あるいはパラフィンブロック中に包埋されたホルマリン固定腫瘍組織から切断された連続切片から得られる保存細胞でよい。
(2)腫瘍細胞中で発現したバイオマーカー(薬物反応性指標、DRI)を定量的に評価するステップ;なぜなら、これらのバイオマーカーの発現レベルは、所定の標的療法に対する腫瘍細胞の抵抗性に関連するからである。評価には、標的療法に対する腫瘍細胞の抵抗性の原因である細胞バイオマーカーを標的とする適切に標識されたモノクローナル抗体(Mab)の適用を含めることがでる。定量は、コンピューター蛍光顕微鏡システム、適切なソフトウェア、および参照標準を用いて完遂できる。
(3)腫瘍細胞中の薬物反応性指標の発現と、機構的に関連した薬物に対する腫瘍細胞の細胞障害性反応との相関に基づいて適切な治療モダリティーを選択するステップ;種々の抗癌薬に対して異なる抵抗性を有する一群の関連細胞系を利用できる。培養中の癌細胞系の増殖に対するこれらの薬物の効果は、これらの細胞系中の対応するDRIの発現レベルと一緒に測定される。このデータは、標的療法用薬物に対する腫瘍の抵抗性に相関させた場合に、腫瘍細胞のDRI発現レベル(蛍光による)の解釈を可能にする。in vitroでの薬物の細胞障害性−DRIの関係は、DRI発現の所定の薬物に対する相関を、その薬物での治療に対する所定の患者の臨床的反応を用いて拡張するための実験的基礎を形成する。この相関は、パラフィンブロックから切断されたヒト腫瘍組織切片中でのDRIの発現に対する対照として役立つことができる、パラフィンブロック中に包埋された癌細胞のDRI測定に拡張される。培養中の癌細胞の(IC50)に基づいた、薬物に対応する抵抗性/反応性の確率を示す、腫瘍切片中で測定される各DRIの対照領域を構成できる。
【0029】
患者の腫瘍に適用した場合の標的療法の効力予測は、腫瘍細胞中のDRIの肯定的および/または否定的影響に基づく。すなわち、腫瘍細胞中のDRIの不在/存在または低い/高い量が、所定の薬物治療に反応しない腫瘍を引き起こす。したがって、患者に対する有効な標的療法の選択は、癌患者からの腫瘍細胞のDRI測定によって明らかにされるような効果のない薬物での治療をすべて除外することによって完遂される。
【0030】
個々の患者の腫瘍による所定の薬物に対する反応性持続期間は、また、薬物に対して抵抗性でない腫瘍細胞の割合に対する薬物に対して抵抗性である腫瘍細胞の割合(腫瘍の均一性)によって評価できる。腫瘍の非抵抗性部分が、薬物によって攻撃され、絶滅される場合、残りの抵抗性細胞は、支配的な部分になり、全腫瘍が、薬物に対して抵抗性になる。この推論は、腫瘍均一性の測定が抵抗性のマーカーであり、さらに、患者の生存を延長するためには、別の有効な薬物を、併用および/またはフォローアップ治療として使用しなければならないことを示している。
【0031】
臨床応用では、患者の反応率(RR)および/または進行期間(TTP)を、彼らの腫瘍のDRI測定値と統計的に相関させることができ、かつ、異なるDRIインデックスの各個々の患者に対する抵抗性(非反応性)の確率の参照領域を構成される。個々の患者のDRIインデックス、臨床的反応性の参照領域を調べた後、診療する医師は、この患者に対する薬物処方について情報に基づいた決定を下すことができる。
【0032】
PACの方法を実行するために、癌患者の便宜のために3つの診断試験が、確立されている。これらの診断試験は、(1)薬物反応性指標試験(DRIT)、(2)ハーセプチンタキサン反応性試験(HER−TAX試験)、および(3)循環癌細胞試験(CCCT)である。これらの試験を、以下でさらに説明する。
【0033】
癌細胞は、2つの明確な特徴を有する。すなわち、
1)宿主の制御下にない複製が、腫瘍になり、かつ
2)該腫瘍が、増大し、転移し、身体の死活にかかわる機能を妨害し、死に導く。
【0034】
癌/腫瘍を物理力(手術または照射)で除去または破壊できない場合には、全身性抗癌化学療法が必要である。
【0035】
抗癌化学療法の成功の鍵は、宿主細胞の中の絶対多数である正常細胞を傷つけないで癌細胞を破壊する能力である。制御不能の複製が、癌細胞の特徴であり、かつ正常な機能を妨害するので、癌に向けられた細胞障害性薬物のほとんどは、細胞実体および複製進行に必要とされる過程を攻撃するように設計される。
【0036】
現代の抗癌細胞障害性薬物は、標的療法であり、DNA複製酵素、ヌクレオチド(核酸の構成要素)酵素、DNA修復酵素、複製シグナルを伝達するための受容体など、死活にかかわる過程に必要とされる細胞成分に狙いを定めている。これらの鍵となるタンパク質部分から、1011〜13/モルの範囲の高い親和定数を有することのできる抗体、特にモノクローナル抗体(Mab)を容易に生じさせることができる。したがって、これらのMabは、これらの標的タンパク質に選択的かつ強固に結合できる。また、これらのMabが蛍光染料に化学的に連結される場合には、蛍光性Mab−標的複合体の量および位置を検出し、画像化し、記録することができる。種々のMabを、励起/発光スペクトルの位置が異なりかつ重なりあわない別の蛍光染料でそれぞれ標識する場合には、これらの種々のMab−標的を注目領域(ROI)で、同時的ではあるが別個の検出で画像化できる。
【0037】
蛍光複合体を測定するのに効果的な1つの装置は、コンピューター蛍光顕微鏡装置(FMS)である。これらの複合体を含む細胞内部の区域を画定することができ、蛍光の測定値を、画定した空間領域の総蛍光で、または画素当たりの平均蛍光、あるいはさらにこの領域における画素当たりの最大強度として表現できる。この可能性を実施例1で示す。
【0038】
数字で定量化できる測定を有することに加えて、FMSによる測定は、蛍光性ミクロスフェアの使用を介して標準化できる。蛍光性ミクロスフェアを介して異なる波長でFMSを較正した後、FMS測定値を、一時的意味でまたは異なるFMSからの双方で比較できる。この操作を実施例2に示す。
【0039】
個々の患者からの腫瘍組織を、3種の供給源、すなわち、一般には(1)腫瘍または腫瘍に近接したリンパ節を探査することに由来する生検材料、(2)腫瘍を除去する手術から得られる外科的材料、(3)転移性腫瘍を代表する血中循環癌細胞から得た。本発明者らは、これらすべての供給源からの腫瘍細胞を調べ、各供給源は、その特有の要件を呈示する。生検からの腫瘍細胞を特徴付ける場合、最も重要な要件は、腫瘍細胞を正常細胞から識別することである。腫瘍細胞が上皮起源である場合、周囲の細胞は、(血液細胞またはリンパ細胞でなく)、それゆえ、識別は、上皮細胞の特徴的なサイトケラチン骨格によって比較的簡単である。細胞骨格中のタンパク質に対して特異的であるMabは、入手可能である。血液からの循環腫瘍細胞を特徴付けるために濃縮方法が使用され、その方法により、正常血液細胞のほとんどが排除され、癌性上皮細胞が特徴づけのために後に残る。最も一般的には、外科的標本から腫瘍組織を集め、これらの組織をホルマリン中で固定し、パラフィンブロック中に包埋して保管する。次いで、脱パラフィン、洗浄、および抗原回復の処理の後に、観察のためにこれらのブロックから切片スライドを得ることができる。実施例3は、これらの調製を示す。各抗原、またはタンパク質標的さえも、別個の活性化/回復手順を必要とする可能性がある。
【0040】
実施例4で、本発明者らは、切片スライドの観察区域(ROI)における蛍光性Mab−抗原複合体のFMSによる定量的測定および記録のための実験方法を説明する。該方法は、コンピューター化された装置によるバックグラウンド自己蛍光の差し引きを必要とする。このバックグラウンドは、蛍光性Mabで染色していないパラフィンブロックの連続切片化により類似領域を観察したFMSから得られる。さもなければ、光学測定法は同じままで、バックグラウンドに関する情報を、コンピューター中に保管し、続いてバックグラウンドとして差し引くために使用する。
【0041】
実施例5では、パラフィンブロック中に包埋されたホルマリン固定腫瘍の組織切片における薬物反応性指標の染色および数値測定を説明する。
【0042】
実施例6では、腫瘍切片中の異なる区域内における不均一性の評価について説明する。個々の患者の腫瘍による所定の薬物に対する反応性の持続期間は、また、薬物に対して非抵抗性である腫瘍細胞の割合に対する薬物に対して抵抗性である腫瘍細胞の割合によって評価できる(腫瘍の不均一性)。腫瘍の不均一性の測定は、抵抗性に関するマーカーを構成し、さらに、患者の生存を延長するためにフォローアップ治療として別の有効薬物を使用しなければならないことを指示する。
【0043】
化学療法薬の細胞障害作用を機構的に関連したDRIの発現と相関させるためのDRIインデックスの構成を実施例7で説明する。この方法は、化学療法薬に対する培養ヒト腫瘍細胞の反応性と薬物の作用方式に機構的に関連しているDRIの発現との間の統計的に有意な相関を確立する。実施例9に記載のように統計解析を実施して、これら2つの値を相関させ、臨床的反応性を指示するためのインデックスとして使用できるDRI発現レベルを確立する。
【0044】
パラフィン包埋培養細胞標準をベースにしたDRIインデックスシステムの構成に対する上記in vitro指標化システムの拡張を、実施例8で説明する。この技術は、組織固定および処理の影響を反映する参照標準を確立する。
【0045】
個々の癌患者に対する疾患管理のための情報を提供できる3つの分子診断試験を実施例10で詳述する。PACの方法を実施するために、これらの診断試験を癌患者の便宜のために確立する。該診断試験は、(1)薬物反応性指標試験(DRIT)、(2)ハーセプチンタキサン反応性試験(HER−TAX試験)、および(3)循環癌細胞試験(CCCT)である。それぞれを、実施例中で詳細に説明する。
【0046】
実施例11では、乳癌患者においてPACを確立するのに必須であるステップを詳述し、この戦略を支援するための関連データを提供する。
【0047】
PACシステムを確認するのに必須の臨床的相関研究計画を実施例12で説明する。既知の臨床結果をそれら同一患者の腫瘍細胞からのDRIの測定と相関させるために、まず、遡及的研究を実施する。続いて、DRIデータの予測的研究を治療下の患者の結果と相関させる。この試験から得られるデータは、IDEとして役立ち、FDAからのPMAにつながる。
【0048】
上記の戦略が特に十分に機能する状況は、乳癌の場合のトラスツズマブ(ハーセプチン)、および結腸癌の場合のセツキシマブ(エルビタックス)など、ヒト化モノクローナル抗体治療薬の使用である。この方法において、本発明者らは、標的−受容体に対するプローブとして、治療用Mab上に蛍光染料を結合した後のモノクローナル薬それ自体を使用した。明らかに、治療用Mabが腫瘍細胞に結合できないなら、腫瘍細胞は、治療用Mabに反応しない。その逆が真実でない可能性があること、すなわち、腫瘍細胞に対するMabの結合が、細胞障害性反応をもたらさない可能性があることに留意すべきである。したがって、薬物反応性指標の定量的測定というこの方法に由来する本質的情報は、いずれの細胞が、該薬物反応性指標の不在のために、薬物に対して細胞障害性反応を示さないかに関する判断である。しかし、薬物反応性指標の好ましい測定は、これらの腫瘍細胞が細胞障害性反応を示すという確かな情報を提供しない可能性がある。換言すれば、否定的な薬物反応性指標は、腫瘍細胞が細胞障害性反応を示さないことを予測するが、肯定的な薬物反応性指標は、腫瘍細胞がその他の重要な因子の影響のために細胞障害性反応を示すことを保証しない。したがって、本発明者らは、個々の患者における腫瘍について無効(しかし、それにもかかわらず副作用を示す)薬物の使用を排除するために「無効薬物指標」を有することができる。この結論は細胞培養中の限定された条件集合下で統計的に支持されるので、無効薬物指標に関する知識は、極めて有用で信頼性がある。
【0049】
一般に、上記説明は、「個別化抗癌療法」(PAC)に必要とされる要素を概説している。第1に、標的治療薬が、開発され、FDAによって承認される。第2に、本質的な細胞標的を、実験室および臨床研究で突きとめる。第3に、このタンパク質標的に特異的に向けられた抗体(特定のモノクローナル抗体)を、発生させ、適切な蛍光染料で標識する。第4に、コンピューター蛍光顕微鏡装置を組み立てて、腫瘍細胞中のこれら蛍光性Mab−標的複合体の量および位置を測定し、画像化し、かつ記録する。第5に、代表的腫瘍細胞の供給源を、生検処置、外科標本、または血中循環腫瘍細胞を介して入手できる。第6に、十分に規定されたin vitroの状況で、薬物反応性マーカーの量が腫瘍細胞の細胞障害性反応と統計的に相関していることを示すために行なわれた相関研究を使用して適切な化学療法を選択すること。
【0050】
これら6つの要素の連結は「個別化抗癌療法」の基礎を形成し、情報に基づいた勧告は、所定の癌患者に対するそれらの無効薬の使用を排除する。この戦略は、臨床的相関研究において、「無効薬物指標」に関する情報の医学的貢献を立証した。この立証の最初のステージは、トラスツズマブの使用に対するFDAの承認手順で与えられ、別項で説明する。
【0051】
PACシステムをまとめるに際して、本発明者らは、個々の患者から得られる腫瘍細胞からバイオマーカーの定量的測定におけるFMSの応用に際しての手順を提供した。種々の供給源から得られる腫瘍細胞に対する具体的な手順を、実施例中に記載する。
【実施例】
【0052】
(実施例1)
顕微鏡スライド上の固定された細胞中の蛍光複合体の測定
本発明者らの装置は、CCDカメラ、8−フィルターキューブターレット、ならびに画像取込みおよび画像処理のためのImage−Pro Plusソフトウェアを備えたコンピューター支援ライカDMRXA蛍光顕微鏡である。現在、本発明者らは、同一細胞から5つのスペクトル域の蛍光を測定することができ、2つを細胞識別に使用し、3つをバイオマーカーの測定に使用する。複数のマウスモノクローナル抗体で細胞を染色するためには、各抗体を直接的に標識することが必須である。このことは、イソチオチアン酸フルオレセインおよびMolecular ProbesからのAlexa染料のスクシンイミジルエステル誘導体を用いて完遂される。
【0053】
この実施例では、乳癌細胞系におけるHER−2/neuの定量化を示す。モノクローナル抗体、トラスツズマブを、Alexa532で標識し、抗−パンサイトケラチンをFITCで標識した。乳癌細胞系(SKBR−3)を、上記抗体と共にインキュベートし、次いで、洗浄し、抗退色性培地中でDAPIを用いる対比染色のために台に載せた。同一細胞中のDAPI、FITCおよびAlex532のシグナルの区別を可能にするフィルターキューブを使用して、適切な露出時間でデジタル画像を得た。サイトケラチンの蛍光を使用して各細胞の空間領域の輪郭を描いた。これらの輪郭を、記憶装置に保管し、呼び戻して、Alexa532の画像、すなわちHER−2/neuのシグナル上に重ねた。次表に4つの細胞中でのHER−2/neu発現に関する定量的データを示す。縦欄1は、対象番号を与え、縦欄2は画素数としての細胞面積を表し、縦欄3は各細胞における画素当たり平均蛍光強度を与え、縦欄4は、各細胞に対する積分蛍光強度を与える。データは、細胞中でのHER−2/neu発現が変動する場合があることを示している。
【0054】
【表3】

(実施例2)
顕微鏡システムの較正
定量的免疫蛍光研究を実施するには、デジタル画像を取得し、種々の時間にわたっておよび異なる顕微鏡で得られた蛍光測定値を比較できなければならない。このことは、Molecular Probesから得られる容易に利用できる蛍光標準を用いて本発明者らのライカ顕微鏡装置を較正することによって完遂される。蛍光標準は、直径6ミクロンの蛍光ミクロスフェア(Inspeck顕微鏡画像強度較正キット)から構成される。ミクロスフェア懸濁液を顕微鏡スライド上に載せ、空気乾燥し、カバーガラス下の抗退色性培地に載せる。飽和レベル、すなわち、12−ビット画像の場合には画素当たり4096の蛍光単位をもたらす時間を超えないことが確実である種々の露出時間で画像を取得する。画像を、Image−Pro Plusソフトウェアを用いて処理して、各露出時間で画素当たり約4または5個のミクロスフェアの平均蛍光強度を得る。画素当たりの平均蛍光強度をミリ秒の露出時間に対してプロットすることによって、各フィルターキューブに対して標準曲線を得る。このような線形標準曲線の例を図1に示す。勾配および切片を使用して、参照標準を用いて2000単位の平均蛍光をもたらすのに必要な露出時間を計算する、すなわち、図1に示したプロットの場合、176ミリ秒の値が得られた。したがって、同じ蛍光標準を使用することによって、適切な露出時間を選択して各顕微鏡/フィルターキューブを同じ蛍光強度を与えるように較正できる。
【0055】
(実施例3)
識別および特徴付けのための腫瘍細胞標本の調製および染色
肺癌細胞は、気管支鏡生検によって得ることができる。生検材料は、患者から摘出した後は中性の生理食塩水中に浸漬しておけばよい。細胞をPBS中で洗浄し、計数のために指定の容積にすればよい。適当な数の細胞を、顕微鏡スライド上のパップペン(PapPen)で輪郭を描いた区域内に置けばよい。乾燥後、細胞を2%パラホルムアルデヒド中で固定し、抗−パンサイトケラチン−FITCと共にインキュベートし、上皮細胞を識別するためにDAPIで対比染色した。画像を取得し、無傷の核を有する上皮細胞数を計数できる。腫瘍細胞は、スライド上の細胞の上皮細胞/wbc核DNA比率を異数性の尺度として測定することによって、および特定のモノクローナル抗体で染色して上皮細胞中のα−フェトプロテインの発現を定量化することによって正常上皮細胞から区別できる。蛍光標識抗体を利用する定量化は、実施例1で説明したように実施すればよい。
【0056】
手術中にまたは生検で得られた組織切片を、ホルマリン中で固定し、パラフィンブロック中に包埋できる。連続した4ミクロン切片を、これらのパラフィンブロックから切り出し、顕微鏡スライド上に載せることができる。切片は、次のように、すなわち、キシレン中で2回、各5分間;95%エタノール中で2回、各3分間;70%エタノール中で2回、各3分間;次いで水道水中で少なくとも10分間で脱パラフィンできる。抗原回復のためには、スライドを、pH8の10mM EDTA、またはpH6の10mMクエン酸塩中、95℃で30分間加熱し、続いて同一溶液中に室温で20分間浸けておけばよい。スライドを、PBS中で洗浄し、抗パンサイトケラチン−FITCおよび選択したその他の蛍光標識抗体で染色することができる。
【0057】
次のプロトコル、すなわち、15〜20mLの血液から血液細胞のほとんどを除去するための二重勾配遠心分離、続いて免疫磁気ビーズを使用して癌細胞を濃縮すること(陰性選択);顕微鏡スライド上のパップペンで輪郭を描かれた区域内に細胞を置き、抗体カクテル(9種のサイトケラチンペプチドに対して反応性を有するFITC標識抗体、およびヒト癌腫上に発現した腫瘍関連糖タンパク質)と共にインキュベートすること;DAPI含有抗退色性培地を用いて載せることによって対比染色すること;蛍光顕微鏡を用いてスライドを走査し、無傷の核を有するFITC陽性細胞を数えることにより血中の循環癌細胞(CCC)を単離、識別できる。
【0058】
標準的なCCC試験では、100,000を超える白血球細胞(WBC)が、CCCと共に回収される。WBCは、場合によっては、染料−MAB複合体による癌細胞の染色を妨害する(しかし、HER−2/neuまたはサイトケラチンでは妨害されない)。したがって、癌細胞と共に3000未満のWBCの回収をもたらす超濃縮法が開発された。これらの調製において、細胞の染色は、少数のWBCによって影響されない。この手順を以下で詳述する。
【0059】
CCCの超濃縮プロトコル:
15〜20mLの抗凝固剤処理末梢血液(6時間、100MCF−7乳癌細胞でスパイクされた)をPBSで全量30mLまで希釈;
15mLを超える希釈された細胞懸濁液を50mLのコニカルチューブ中、1.083勾配で注意深く層化して、揺動バスケットローター中、20℃で30分間、2000rpmで遠心(ブレーキなし);
ピペットで上清液を完全に移し、1.083Gの界面の6〜8mL上部部分を集め;
ハンクス液を用い1200rpmで10分間遠心することによって2回洗浄し;
上清液を注意して完全に除去し;
1x希釈緩衝液を40mLの最終容積まで添加し、十分混合し;
5mLのMACS細胞浸透液を添加し、十分混合し、室温で正確に5分間インキュベートし、続いて、5mLのMACS細胞固定液を添加し、十分混合し、30分間インキュベートし;
細胞懸濁液を1200rpmで10分間遠心し;
細胞ペレットを1xMACS細胞染色液に600μLの最終容積で再懸濁し;
200μLのFcRブロッキング試薬を添加し、十分混合し;
200μLのMACS CKマイクロビーズを添加し、20〜25℃で45分間インキュベートし;
100μLの抗サイトケラチン−FITCを添加し、さらに10分間インキュベートし;
4mLの1xMACS細胞染色液を添加し、細胞懸濁液を1200rpmで遠心し;
陽性選択カラムをMACSセパレーターの磁場中に置き;
再懸濁細胞をカラムにかけ、白血球細胞(WBC)がカラムを通過するのを可能にし、3x500μLの脱気1x希釈緩衝液で洗浄し;
セパレーターからカラムを取り外し、カラムを15mLチューブ上に置き;
ピペットで1mLの脱気1X希釈緩衝液をカラムの頂部に移し、カラムで適用されるプランジャーを使用して保持した循環癌細胞を溶離する;
細胞ペレットを回転して落下させ、スライド上に直接置き、RTで8〜24時間空気乾燥し;
台の中央にDAPIを添加し、検体をコンピューター支援顕微鏡分析にかける。
【0060】
(実施例4)
パラフィンブロックから切断した腫瘍組織切片中でのバイオマーカー発現の定量化
組織断片の全域で測定された蛍光強度は、抗原に結合した蛍光標識一次抗体の量を反映し、したがって、細胞中の標的タンパク質(バイオマーカー)の量を表す。しかし、再現性のある定量的データを生み出すためには、ホルマリン固定組織に固有の自己蛍光を考慮する必要がある。自己蛍光は、対照スライド、同一腫瘍の連続切片の1つを、蛍光標識一次抗体を除くプロトコルで処理することによって測定される。
【0061】
各腫瘍からの3〜4つの異なる区域のデジタル画像を、本発明者らの参照標準で2000蛍光単位をもたらすであろう露出時間(実施例2参照)を使用して、C1(DAPI)、C2(FITC)、C3(Alexa532)、C4(Alexa594)およびC5(Alexa647)フィルターキューブで取得した。対照および実験スライドは、まったく同様に処理した。さらに、画像を、組織を含有しないスライド上のバックグラウンド領域の各フィルターで得る。画像は、Image−Pro Plusソフトウェアを用いて処理した。各バックグラウンド画像に対する画素当たりの平均蛍光をヒストグラムから取得し、その値を、適切な実験画像から差し引く。バイオマーカーの定量化のため、各画像上の各々約10個の細胞を含む3〜4つの注目区域(AOI)を選択する。HER−2/neu染色乳癌腫瘍切片の代表的な画像を図2に示す。膜の濃く完全な染色を観察できる。膜区域の蛍光強度を定量化し、5人の異なる乳癌患者に関するデータを次表に示す。4人の患者のHER−2/neu発現は、自己蛍光の約2〜4倍大きかった。1人の患者で、自己蛍光とTER−2/neuシグナルが類似していた。腫瘍の異なる区域にわたるHER−2/neu発現の不均一性が存在した。本発明者らは、高発現区域とより低い発現領域の間に3.3倍の差異を観察した。
【0062】
UMMおよびWRに由来する乳癌組織のハーセプチン−Alexa532染色−877ミリ秒露出
【0063】
【表4】

*各画像の3〜4区域を分析し、その平均を示す。ABYは、染色するのに使用した標識モノクローナル抗体を示す。
【0064】
本発明者らは、また、乳房腫瘍組織におけるエストロゲン受容体、および結腸腫瘍組織におけるβ−チューブリンアイソフォームIIIおよびERCC−1(DNA修復酵素)の発現を定量化した。データを次表に示す。自己蛍光(抗体なし)に対する染色組織の平均蛍光は、ERCC−1、β−チューブリンIIIおよびエストロゲン受容体に対して、それぞれ5.7、3.6および15.8であった。
【0065】
パラフィンブロックから切断された組織切片における薬物反応性指標の定量的測定
【0066】
【表5】

(実施例5)
例として乳癌を使用する、パラフィンブロック中に包埋されたホルマリン固定腫瘍の組織切片における薬物反応性指標の染色および数値測定
本発明者らは、パラフィンブロックから切断された乳房腫瘍組織切片におけるHER−2/neu受容体の発現を定量化するための再現性のある蛍光顕微鏡法を確立した。顕微鏡スライド上に載せた組織切片を次のように脱パラフィンする。すなわち、スライドをキシレン中に5分間浸し、もう1度繰り返し;スライドを95%エタノール中に3分間浸し、もう1度繰り返し;スライドを70%エタノール中に3分間浸し、もう1度繰り返し;スライドを蒸留水で洗浄する。次いで、抗体を回復するために、スライドを、pH6.0の10mMクエン酸塩中、95℃で30分間加熱すること、続いて室温で20分間冷却することによって処理する。スライドを、トラスツズマブ−Alexa532複合体および抗パンサイトケラチン−FITCと共に同時にインキュベートする。標準対照で2000蛍光単位をもたらす露出時間を使用して、各腫瘍切片の3〜4つのデジタル画像を取得する。HER−2/neuを過剰発現する細胞は、全部の細胞膜の極めて強い蛍光染色を示す。3〜4つの注目区域(AOI)を各デジタル画像上で試験する。AOIに関する定量的蛍光データ(画素当たり平均蛍光、標準偏差、最小および最大値、および積分蛍光強度)を示すヒストグラムを作成できる。この蛍光データを使用して、HER−2/neu発現を定量化するための被染色膜の区域を選択する。図3は、定量化のために選択され、輪郭を明らかにされた上記AOIの1つに関する区域を示す。定量的測定データ(画素数としての面積、および画素当たり平均蛍光、発光密度)を次表に示す。
【0067】
【表6】

(実施例6)
腫瘍切片の異なる区域内におけるHER−2/neu発現の不均一性の評価
患者の腫瘍における細胞間でのHER−2/neu発現の不均一性は、トラスツズマブでの治療に対する全般的反応性および反応性の持続時間を決定する可能性がある。本発明者らは、上述の定量的アッセイを利用して患者腫瘍組織切片におけるこの不均一性を評価することができた。2人の乳癌患者の腫瘍組織に関するデジタル画像中の4つのAOIに由来するデータを次表に示す。本発明者らは、HER−2/neu染色膜の最大と最小蛍光強度の間に2.1(患者1)〜3.3(患者2)倍の差異を観察した。
【0068】
患者の腫瘍の異なる区域内におけるHer−2/Neu発現の不均一性の評価
【0069】
【表7】

**膜測定値の数
(実施例7)
化学療法薬の細胞障害作用を機構的に関連する薬物反応性指標の発現と相関させるためのin vitroシステム
この実施例では、培養ヒト癌細胞系の抗癌薬に対する細胞障害反応性を機構的に関連した細胞中の薬物反応性指標(DRI)の発現レベルと相関させるin vitroシステムについて説明する。細胞障害反応性を明確に示すのに使用できるDRI発現レベルを確立するために、このデータに基づいて統計解析を実施する。
【0070】
腫瘍に由来する不死細胞系は、一般に、強い増殖を示し、実用的な癌細胞モデル系のための必要性を満たす。癌細胞系は、抗癌薬に対する反応性の予測にある程度の成功をもって利用されており、化学感受性プロフィールが、薬物効果を予測するためのシステムを開発するのに有用である可能性があることを示している。
【0071】
この実施例で、DRIは、蛍光染料と連結したモノクローナル抗体をプローブとして利用して、いくつかの乳癌由来細胞系で定量化される。DRI発現レベルは、データの日間および実験室間比較を可能にする容易に入手できる蛍光標準に対して正規化されたデジタル値として表現される。すべての薬物は、作用方式に機構的に関連した潜在的細胞標的を有する。
【0072】
乳癌細胞系を固定し、Alexa532と複合したハーセプチン(トラスツズマブ、抗−HER−2/neu受容体)またはAlexa594と複合した抗−ER、あるいはAlex647と複合した抗−TUB IIIおよびFITCと複合した抗−サイトケラチンと共に同時にインキュベートすることによって顕微鏡スライド上で染色する。FITCシグナル(470nm/497nm/522nm)、Alexa647シグナル(630nm/649nm/667nm)、Alexa594シグナル(581nm/593nm/617nm)およびAlexa532シグナル(546nm/557nm/567nm)のデジタル画像を、適切な露出時間(蛍光標準で2000の値をもたらす)で取得し、解析して、各ROI(癌細胞)中の画素当たり平均蛍光を確定した。各ROIの空間領域は、極めて強力であるサイトケラチンの蛍光から判断した。輪郭を記憶装置に保管し、呼び戻し、同一細胞野のAlexa532画像、Alexa594画像、またはAlexa647画像と重ねた。ソフトウェアは、各ROIの面積および画素当たり平均蛍光を示す表を作成する。
【0073】
実験条件については、104個の生存細胞を含む細胞懸濁液を、96ウェルプレート中の100μLの培地に播種し、5%CO2雰囲気中、37℃で24時間付着させておいた。このインキュベーション時間の後に、細胞を、発表済みの薬物動態分析により決定された通りのピーク血漿濃度(PPC)に基づいた指定用量で薬物に曝露した。タモキシフェンの場合、細胞を集密するまで72時間増殖させた。次いで、ER発現を最大にするため、各ウェルに0.5%FCSを含む培地を添加した。100μLの適切な培地を含む対照ウェルを試験ウェルとまったく同様に処理した。処理の72時間後に、プレートをWST−8分析に付した。WST−8は、細胞のデヒドロゲナーゼで生物還元されて着色したフォルマザン生成物を産生するテトラゾリウム塩である。フォルマザン生成物の量は、生存細胞数に直接的に比例する。フォルマザンをベースにしたアッセイは、化学感受性試験に成功裡に利用されている。各ウェルの吸光度を、Biotekマイクロリーダーを使用して460nmで測定した。各薬物濃度に対して、平均吸光度±SEを計算した。結果は、薬物濃度と対比した%増殖阻害として表される。IC50値は、(logfa/log
fu)対log Cのメジアン効果プロットを使用して決定される(ここで、fu=非影
響部分、fa=影響部分、C=薬物濃度である)。
【0074】
種々の乳癌細胞系の化学療養薬に対する生物学的反応性は、関連するDRIの発現と十分に対応している。モデル系を確認するために、十分に特徴付けられているDRI、HER−2/neuおよびエストロゲン受容体(ER)を用いて初期研究を実施した。HER−2/neu癌遺伝子は、上皮増殖因子受容体に対して広範な相同を有する膜貫通チロシンキナーゼ受容体をコードしている。HER−2/neuの過剰発現は、ハーセプチン(トラスツズマブ)療法に対して高い感受性をもたらす。乳癌に対するもう1つの効果的な標的療法は、癌細胞表面のエストロゲン受容体に結合し、細胞増殖に対するエストロゲンの効果を遮断するタモキシフェンである。ERは、タモキシフェン療法に対する感受性を判定する際にかなりの予測的価値を有することが知られている。
【0075】
それらの表面に結合している蛍光標識ハーセプチンの最も高いレベルを示す細胞系は、ハーセプチンでの治療に最も大きな反応性を示す。これらの特定の細胞系、HCC2218およびSKBR−3は、用量関連性の増殖抑制を示し、それぞれ0.032および0.125mg/mLのような低い濃度で反応性を有した。対照的に、次表に示すように、低レベルのハーセプチン結合を示す乳癌細胞系では、増殖は乱されていないか、あるいは、高用量の薬物でのみ、反応性が誘発された。
【0076】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:Her−2/neu/ハーセプチン
【0077】
【表8】

注:*NR−ハーセプチン治療に対して2mg/mLまで反応しない
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
同様の仕方で、高いER発現を示す細胞系(MCF−7)は、タモキシフェンでの治療に対して高い感受性を示した。対照的に、より小さなER結合度を示す細胞系(SKBR−3、MDA−MB231)は、次表に見られるようにタモキシフェンでの治療に対して感受性のより小さな反応性を示す。
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:エストロゲン受容体/タモキシフェン
【0078】
【表9】

注:*NR−タモキシフェン治療に対して50μg/mLまで反応性なし
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
これらの実験を拡張して、β−チューブリンIII(TUB III)発現と、抗癌薬
、パクリタキセル(PTX)およびドセタキセル(DTX)に対する生物学的反応性の間の相関を検討した。これらの薬物は、TUBIIIに結合し、微小管の安定化を介してそれらの増殖抑制効果を発揮する。これらの薬物の抗癌作用は、乳房腫瘍をはじめとするいくつかのヒト癌におけるTUBIIIの発現レベルによって変更される場合があると推
測される。
【0079】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:パクリタキセル/β−チューブリンIII
【0080】
【表10】

注:*NR−パクリタキセル治療に対して50μg/mLまで反応性なし
**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:ドセタキセル/β−チューブリンIII
【0081】
【表11】

**規定時間曝露した場合に2000単位をもたらす対象標準に比較した平均蛍光/画素
ハーセプチンおよびタモキシフェンの場合のように、各種乳癌細胞系のPTXおよびDTXに対する生物学的反応性は、TUB IIIの発現とよく対応している。低レベルの
TUBIII結合を示す細胞系(T47D、MCF−7、SKBR−3)は、PTXおよびDTXの双方での治療に対して感受性があった。対照的に、より高レベルのTUB I
IIを示す細胞系(HCC2218、HCC38)は、より高用量のDTXに対してのみ反応性を示した。これらの細胞系は、また、PTXに対して反応性を示したが、IC50値は明確でなかった。1つの細胞系(HCC202)は、DTXおよびPTX治療の双方に対して抵抗性であることがわかった。
【0082】
もう1つの例では、チミジル酸シンターゼ(TS)の発現を、乳癌細胞の化学療法薬5−フルオロウラシル(5−FU)に対する反応性と相関させた。TSは、DNA生合成の鍵となる酵素であり、5−FUをベースにした化学療法に対する反応性を予測するうえで重要な役割を演じると主張されている。実験は、この関係を調べるために実施した。実験条件および分析方法は、ハーセプチンで使用したものと同様とした。用量は、5〜300μg/mLの範囲とした。
【0083】
培養乳癌細胞における生物学的反応性とDRI発現レベルの対比:5−フルオロウラシル/チミジル酸シンターゼ
【0084】
【表12】

**規定時間露出した場合に2000単位をもたらす参照標準に比較した平均蛍光/画素。ND=測定せず
各種乳癌細胞系の5−FUに対する生物学的反応性は、TS発現とよく対応している。より低用量の5−FUに反応する細胞系(T47D、MCF−7およびSKBR−3)は、より高用量に対してのみ反応する細胞系(HCC38、HCC202、HCC2218)よりもより高いTSの発現を示した。5−FUに対する反応性ランクとTS発現との相関は、下記で見られるように、ピアソンの相関係数によって判定すると統計的に有意である。
【0085】
DRIは、ピアソンの相関係数を使用して、機構的に関連した薬物によるin vitro細胞増殖の抑制と相関させることができる。この方法は、2変数間の線形関係の強度を測る。ピアソンの相関係数は、通常、r(ロー)で表され、−1.0〜1.0の値を取ることができ、−1.0は完全陰性(逆)相関であり、0.0は相関がなく、1.0は完全陽性相関である。ピアソンの相関計数は、下式を使用して計算できる。
【0086】
【数1】

ピアソンの相関係数分析は、次表で見られるように、IC50値とDRI発現の間に強い有意の統計的相関を示した。
【0087】
生物学的反応性とDRI発現の相関
【0088】
【表13】

単純なクラスター分析または変化点分析を介してDRI発現のカットオフポイントをさらに確認して、生物学的反応性を明確に示すのに使用できるDRI発現レベルが存在するか否かを判定するために、この相関データを分析する。
【0089】
(実施例8)
パラフィン包埋培養細胞標準に基づいたDRIインデックスシステム
パラフィンブロック中に保存されたヒト腫瘍組織のDRI発現を指標化するためには、組織固定および処理の影響を反映する参照標準を確立することが必須である。いくつかの研究所は、この目的のために標的抗原の変動する発現を示す細胞系を利用してきた。これらの細胞系は、臨床検体と同一の仕方で固定され、処理され、分析される。この技術は、HER−2/neuアッセイ感度の標準化、エストロゲン受容体の免疫細胞化学分析、DNA倍数性分析および増殖マーカーMIB−1の品質管理に成功裡に応用されている。
【0090】
培養ヒト乳癌細胞は、培養ヒト腫瘍細胞系に対して使用されるのと同じバッチから採取した。次いで、これらの細胞を寒天プラグ中に包埋し、パラフィンで処理した。スライドを、4μm切片で調製し、固定し、HER−2−Alexa532(546nm/557nm/567nmm)で染色した。次いで、検体を上述のように顕微鏡分析に付した。結果(次表)は、培養腫瘍細胞標準系で観察されたものに極めて類似していた。HCC2218およびSKBR−3の双方とも、高いハーセプチン結合値を示し、一方、MCF−7およびHCC38は、より低い値を示した。これらの細胞をハーセプチンに曝露することによって得られるIC50およびハーセプチン結合の比較は、培養腫瘍細胞系で観察されるものにやはり極めて類似した−0.9のピアソンの相関係数をもたらした。このモデルは、パラフィン包埋培養細胞標準が、パラフィン包埋ヒト癌組織の生物学的反応性を指標化するための実行可能な内部標準として役立つ可能性があることを示している。
【0091】
【表14】

ND=測定せず NR=反応なし
(実施例9)
DRI参照領域インデックスを構成するための、DRI発現と抗癌薬に対する反応性との相関に関する統計解析
腫瘍反応性のDRI参照領域を構成するための原理および方法は、(1)in vitro指標化システム、(2)パラフィンブロックin vitro指標化システムを基礎にする。これら2つのin vitro指標化システムの構成における成功は、腫瘍細胞の細胞障害性反応をパラフィン包埋後のDRI測定に統計的に相関させることができるという確信を提供する。
【0092】
このインデックスの目的は、個々の患者の腫瘍におけるDRI発現の異なるレベルでの薬物に対する抵抗性の確率を算定することである。次いで、特定レベルのDRI発現を有する所定の癌患者に対して抗癌薬を処方するために、診察する医師はこの参照領域を調べることができる。
【0093】
本発明者らは、統計的回帰の方法を使用して、その薬物に関連するDRI発現レベルを有する各薬物によるin vitro細胞増殖の抑制をモデル化する。この方法は、培養腫瘍細胞標準およびパラフィン包埋培養細胞標準の双方に適用できる。結果変数は、細胞系に対する用量反応曲線から決定されるIC50の対数であり、独立変数は、DRIレベルである。本発明者らの予備的データおよび文献中のデータのためにlogIC50が使用される。13の細胞系を用いるこの企画された研究において、本発明者らは、真の相関が、5%の有意水準で少なくとも60%であることを示すのに十分な力(80%のチャンス)を有する。本発明者らは、ピアソンの相関が上で引用した実験例で.90を超えるまで観測されたので、妥当と思われる計算において、0.90である相関に対して代わりの仮説を設定した。
【0094】
本発明者らは、この相関データを、さらに単純クラスター分析または変化点分析を介して分析する。この分析は、生物学的反応性の確率を明確に示すのに使用できるDRI発現レベルが存在するかどうかを判定する。
【0095】
(実施例10)
個々の癌患者に関して疾患を管理するための情報を提供するに際しての3つの分子診断試験
薬物反応性指標試験(DRIT)
解説
1)原発性腫瘍の細胞(パラフィンブロックに包埋された)中に発現し、腫瘍抵抗性および標的化学療法の双方に関連する6〜8種の細胞バイオマーカーを、蛍光標識モノクローナル抗体(fMAb)で染色する。これらのマーカーの発現レベルは、コンピューター支援蛍光顕微鏡装置を利用して定量化することができ、かつ標的化学療法のために使用できる。
2)これらのバイオマーカーの数値で表した蛍光測定値を、市販の蛍光標準に対して正規化して、日間−実験室間データの比較を可能にする。
3)標的療法での治療に対して様々な度合いの抵抗性を有する、癌型(乳房または肺など)の細胞系由来の培養癌細胞から構成されるin vitro較正システムを確立した。抵抗性の度合い(IC50として測定されるような)とバイオマーカーの発現(画素当たりの蛍光)との間での有意の相関が、ピアソンの係数によって確立された。統計的回帰の方法を使用して、その薬物に関連するDRI発現レベルを有する各薬物によるin vitro細胞増殖の抑制をモデル化する。結果変数は、細胞系に対する用量反応曲線から決定されるIC50の対数であり、独立変数は、DRIレベルである。単純クラスター分析または変化点分析を採用して、好ましくない生物学的反応性の確率を示すのに使用できるDRI発現レベルが存在するかどうかを判定する。
4)また、原発性腫瘍と同じ手法でこれらの細胞系を固定し、パラフィンブロック中に包埋した。スライド上のこれら細胞の切片を上述のように染色し、測定する。これらの細胞のIC50と対応するバイオマーカーの発現との間にやはり相関が確立される。
5)IC50と対応するバイオマーカーの発現との間の上記相関研究(癌細胞系での)を使用して、バイオマーカーのためのDRIインデックスを確立した。このようなインデックスは、腫瘍のバイオマーカー発現と、機構的に関連した薬物での治療に対するこの腫瘍の抵抗性の度合いを相関させるのに使用できる。DRIインデックスを使用して抵抗性の確率(治療の失敗)を叙述することができる。
6)これらの実験室的研究は、遡及的臨床相関研究および予測的臨床相関研究によって確認および変更され、DRIインデックスおよびその確率参照領域が臨床データに基づくように変更される。
7)試験は、原発性腫瘍の4ミクロン厚パラフィンブロック切片(二重測定に必要な6スライド)上で実施され、2日間を費やす。包埋されていない固定化腫瘍細胞も、容易に試験することができる。
応用
1)信用のおける試験報告は、DRIインデックス、および米国癌協会が利用可能にした全米総合癌ネットワーク(NCCN)のガイドライン中に含まれるFDAが承認し広範に使用される5〜6種の化学療法薬に対する個別患者の腫瘍の抵抗性に関する統計的に算定された確率を提供する。医師は、試験結果に基づいてこの患者に対する最も適切な治療計画について情報に基づいた決定をすることができる。
【0096】
HER−tax試験
解説
1)HER−tax試験は、HER−2/neu受容体陽性(IHC3+またはFISH+で示される過剰発現)である乳癌患者に適用すべきである。
2)試験は、HER−2/neu受容体(蛍光標識ハーセプチンで)、PTEN、およびβ−チューブリンIII(タキサンのためのDRI)に対する染色を除けばDRITに類似した仕方でパラフィンブロック中に包埋された原発性腫瘍に対して実施される。
3)目的は、低領域(しかし、なおIHC3+)のHER−2/neu過剰発現を示す、さらに低いPTEN発現値および高いβ−チューブリンIII発現値を示す患者の腫瘍についてスクリーニングすることである。この患者集団の腫瘍は、ハーセプチンおよびタキサンの双方に対して抵抗性である可能性がある。抵抗性に関する確率が提供される。
4)HER−2/neuおよびβ−チューブリンIIIの発現に関する腫瘍中の癌細胞の不均一性が測定される。不均一性の度合いは、ハーセプチン−タキサンの治療計画に対する好ましい反応性の持続期間に関連する可能性がある。
応用
1)HER−2/neu陽性患者の40〜50%のみが、ハーセプチン−タキサンの治療計画に限られた期間(おそらくは1年を超えない)好ましく反応するので、このHER−tax試験は、抵抗性のある患者を選別し、治療下の患者に対する好ましい反応性の推定持続期間を予測する。ハーセプチンは、かなり高価な薬物であり、心臓毒性を有する。
【0097】
乳癌患者に対する循環癌細胞試験(CCCT)
解説
1)患者の静脈血20mLを集め、密度勾配遠心分離および磁気細胞ソーティングを介して正常血液細胞を除去することによって循環癌細胞(CCC)を濃縮する。これらの癌細胞を、ネガティブ選択法により集め、顕微鏡スライド上に載せ、次いで、蛍光モノクローナル抗体で染色し、コンピューター蛍光顕微鏡装置を利用して数え上げる。
2)試験は、血液検体を集めた後、24時間以内に実施される。検体は、CCC Dia
gnosticsによって確証された特殊輸送容器に入れ、至急便で送ることができる。3)CCC中に発現した薬物反応性バイオマーカーを特徴付けることができる。
4)転移性癌(ステージIV)中に見出されるCCCの数は、ステージI、II、およびIIIの癌中のそれよりも多い。CCCの大きな数は、思わしくない予後および薬物治療に対する不十分な反応性に統計的に関連している。
5)企画された薬物治療研究において、治療前の試験ならびに治療中および治療後の2〜3回の試験(2〜3ヶ月の時間間隔)におけるCCCの数え上げは、治療の影響を反映している可能性がある。CCC数が治療後に高いままなら、該薬物はおそらく有効ではなく、CCC数が治療後により低くなったら、該薬物はおそらく有効であろう。この予備的知見を臨床的に試験する。血液中のCCCを見出す技術を、7種の癌(前立腺、肺、胃、膵臓、肝臓、結腸、および乳房)について開発した。
応用
1)ステージIIIまたはステージIVの乳癌患者の場合には、治療前にCCCTを実施して予後を見きわめることができ、治療に続いて、反応性を把握するために2〜3回のCCCTを実施できる。結果は、患者の画像検査(X線およびCT)の前に得ることができる。
2)腫瘍の薬物抵抗性が発生する可能性のある場合には、次の薬物治療について新たな選択をするために、CCCTを実施してCCC中のバイオマーカーのステータス変化を測定できる。これらの結果を、標的療法の治療に対して様々な度合いの抵抗性を有する癌タイプ(乳房または肺など)の細胞系に由来する培養癌細胞からなるin vitro較正システムと相関させることができる。相関は、指定されたDRIの発現および培養細胞の薬物治療に対する抵抗性に基づく。
3)CCC数に関するデータは、画像検査に取って代わることはできないが、CCCTは、より迅速であり、転移性癌の薬物抵抗特性の変化に関する識見を提供する。バイオマーカーとの関連で腫瘍の抵抗性を特徴付けることは、画像法では行なうことができない。
【0098】
(実施例11)
PACは、3つの戦略ステップを必要とする。ステップI:腫瘍中に同時に存在するいくつかの標的の定量的測定。薬物反応性指標(DRI)と称されるこれらの標的は、標的モノクローナル抗体およびコンピューター蛍光顕微鏡を利用する免疫蛍光によって評価できる。数値を得て、比較のための蛍光参照標準に対して正規化できる。
【0099】
ステップII:DRI発現と、関連薬物に対する腫瘍細胞の細胞障害反応性との統計的に有意な相関性の確立。in vitro指標化システムを確立し、各薬物の細胞障害効果を対応するDRI測定値に相関させた。種々の抗癌薬に対して異なる感受性を有する7種の乳癌(BC)細胞系を利用した。タモキシフェン、パクリタキセル、トラスツズマブ、およびドキソルビシンの効果をこれらの細胞系における各薬物に対するDRI発現と相関させた。DRIは、それぞれエストロゲン受容体、β−チューブリンIII、HER−2/neuおよびトポイソメラーゼIIである。ピアソンの順位相関係数は、0.77〜1の範囲に、p値は0.005〜0.02の範囲に見出される。
【0100】
ステップIII:個々の癌患者から癌細胞を得るための技術。転移性癌の場合、ネガティブ選択法(Cancer 2000:88巻、12号、2787頁)を使用して、末梢血から循環癌細胞(CCC)を取得し、数え上げ、HER−2/neu発現を定量化するために標識化トラスツズマブで染色した。101名のBC患者を研究し、402の血液検体を抜き取り、患者当たり抜き取られた検体の中位数は4(1〜7)であった。CCCは、遠方転移と関連しており、ステージIVの患者の88%が、サンプリング中のどこかの時点でCCCを有する。CCC数は、検体当たり1〜1283の範囲である。
【0101】
20名の患者が、HER−2/neu発現について試験するための4個またはそれ以上のCCCを有し、また、利用可能な腫瘍組織データを有した。18人の患者で、CCCおよび原発性腫瘍データは、6名のHER−2/neu陽性および12名のHER−2/neu陰性で一致(90%)した。1名の患者は、腫瘍組織中でHER−2/neu陰性であるが、CCC中でHER−2/neu陽性であった。1名の患者は、腫瘍組織中でHER−2/neu陽性、CCC中でHER−2/neu陰性と確認された。
【0102】
療法(トラスツズマブ)−診断(HER−2/neu発現)の結合は、BCに対するPACのためにFDAが承認した最初のモデルであった。しかし、HER−2陽性転移性BC患者の30%未満が、単一薬剤療法としてのトラスツズマブに反応するが、HER−2陰性患者では、有意に反応性がより低い。BC腫瘍組織およびCCCにおけるDRI測定値の改善は、より予測可能な治療結果につながる可能性がある。BC患者の原発性腫瘍組織から切断された切片スライドからのDRI測定も報告する。
【0103】
(実施例12)
乳、結腸および肺癌患者からのホルマリン固定パラフィン包埋(FFPE)組織中のDRIの定量化
顕微鏡スライド上に載せたFFPE組織切片の調製、および蛍光標識モノクローナル抗体とのインキュベーションは、実施例1および4で説明している。同一野の細胞のデジタル画像は、実施例2に記載の標準曲線から決定される露出時間を利用し、DAPI、FITC、Alexa532、Alexa594、およびAlexa647の蛍光を区別するフィルターキューブを用いて得られた。各腫瘍組織切片からの5つの異なる区域の画像を取得し、記憶装置に保管した。組織をまったく含まないスライドを利用し、適切な露出時間の各フィルターキューブでバックグラウンド画像を取得した。組織の自己蛍光を評価するため、上記フィルターキューブのそれぞれを用い、抗パンサイトケラチン−FITCとのみインキュベートされた各腫瘍からの連続切片の画像も取得し、正確に試験検体のように処理した。
【0104】
DRIの蛍光強度を定量化するため、DRI画像から適切なバックグラウンド画像を差し引くことによって画像を初めに平坦化した。これにより、照明野におけるなんらかの変動を除去する。次いで、バックグラウンド画像の画素当たり平均蛍光(F/P)(画像ヒストグラムから得られる)を平坦化画像から差し引く。処理済みDRI画像を対話的に吟味し、最も明るい蛍光をもつ区域の輪郭を描く(通常的には50〜100細胞)。この注目区域(AOI)を複写して切取り画像として記憶装置に保管する。保管した切取り画像を呼び戻し、AOI中のすべての細胞がサイトケラチン陽性の上皮細胞であることを保証するためのFITCフィルターを用いて取得した同一野の細胞画像上に配置する。各切取りDRI画像中の蛍光シグナルを、Image−Proソフトウェアで分析して、バックグラウンドから蛍光性目標(細胞または細胞クラスター)を分離する強度を選択する。次いで、Image−Proは、輪郭を描き、計数し、切取りDRI画像中の目標に関する定量的データを提供する。データをエクセルに取り込み、各腫瘍からの5つの画像のそれぞれにおける目標に対する平均F/Pの平均を計算し、参照標準に対して正規化する。試験スライドに対して使用したのと正確に同一の方法を利用して、各フィルターキューブについて同一腫瘍の連続切片の自己蛍光を計算する。各DRI画像(腫瘍当たり5つ、全部で250〜500細胞)の画素当たり平均蛍光から組織の自己蛍光を差し引いたものを、標準対照のパーセントとして報告する。
【0105】
6名の乳癌患者のFFPE組織に関するDRI結果を下記の最初の表に示す。エストロゲン受容体(ER)、β−チューブリンアイソフォームIII(TUB)、チミジル酸シンターゼ(TS)、トポイソメラーゼII(TOP)、リボヌクレオチドレダクターゼ(RR),HER−2/neu(HER)および除去修復交差相補−1酵素(ERCC−1)を定量化した。6名の異なる患者で測定された各DRIの5つの切取り画像中の選択された目標の平均F/P(参照標準に対して正規化された)を、5つの値の平均(太字)および5の値の変動係数(CV)(括弧内)と一緒に示す。6名の患者からの5つのDRI画像に対するCV値は、8.9(患者39のTS)から37.4(患者39のER)の範囲であり、18の測定中の5つでは、DRI値が極めて低いのでCVはあてはまらなかった。同一患者の複写連続切片を分析した場合、DRI値は次表からわかるように同じ比較上の範囲にあった。
【0106】
【表15】

DRI値は、標準対照(蛍光ミクロスフェア)のパーセントとして表され、*使用した二次抗体はヤギ抗マウスIgG−Alexa532、括弧内の数字は、5つの異なる区域の腫瘍細胞において測定されたDRI値に対する変動係数である。
【0107】
乳、肺および結腸癌患者のFFPE組織のスライドは、NCI Cooperative Human Tissue Network(CHTN)、Mid−Atlantic Divisionから入手した。下表は、3つの異なるタイプの癌患者に関するDRI測定値を示し、また、2つの異なる顕微鏡で2名の異なるオペレーターによって得られた同一患者からの連続切片のERCC−1発現値を比較している。異なる区域の腫瘍組織からの5つの切取り画像中で測定されるDRI値を、変動係数と一緒に示す。結果は、これら4つのDRIを3つの癌タイプに由来するFFPE組織の上皮細胞(サイトケラチン染色陽性)中で測定できること、および2つの異なる顕微鏡および2名の技術員によるDRI測定で同様のデータが得られたことを示している。個々の患者に対して適切な薬物を選択する際に医師が使用するためのこのアッセイ法の可能性を評価するために、各DRI測定を、関連する抗癌薬に対する患者の反応性と相関させることに留意されたい。このような情報は、初めに遡及的研究で、それに続く予測的臨床試験で得られる。
【0108】
乳房、結腸および肺組織切片におけるDRI定量化の比較
【0109】
【表16】

CVは、5つの異なる区域の腫瘍組織中で測定されたDRI値に対する変動係数である。DRI値は、標準対照のパーセントとして表され、平均を太字で示す。
【0110】
理解を明快にする目的で、説明および実施例によって本発明をある程度詳細に十分説明してきたが、本発明の範囲またはその任意の具体的実施形態に影響を与えないで広範かつ等価な範囲の条件、処方およびその他のパラメーターの範囲内で本発明を修正または変更することによって同じことを実施できること、ならびに、このような修正または変更は、添付の特許請求の範囲に記載の範囲に包含されると解釈されることは、当業者にとって明白であろう。この明細書中で言及したすべての刊行物、特許および特許出願は、本発明が属する分野の当業者の技術レベルを示し、かつ、あたかも各個々の刊行物、特許または特許出願が具体的かつ個別的に参照により組み込まれていると解釈されるかの如き程度まで参照により本明細書に組み込まれる。
【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−177706(P2012−177706A)
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−108724(P2012−108724)
【出願日】平成24年5月10日(2012.5.10)
【分割の表示】特願2008−532365(P2008−532365)の分割
【原出願日】平成18年9月21日(2006.9.21)
【出願人】(508085062)シーシーシー ダイアグノスティックス, エルエルシー (2)
【Fターム(参考)】
【公開日】平成24年9月13日(2012.9.13)
【国際特許分類】
【出願番号】特願2012−108724(P2012−108724)
【出願日】平成24年5月10日(2012.5.10)
【分割の表示】特願2008−532365(P2008−532365)の分割
【原出願日】平成18年9月21日(2006.9.21)
【出願人】(508085062)シーシーシー ダイアグノスティックス, エルエルシー (2)
【Fターム(参考)】
[ Back to top ]

