先天免疫を調節することによる感染の処置および予防を含む、免疫関連疾患障害の処置および予防のための新規ペプチド
【課題】被験体において先天免疫を調節するのに用い得る、および/または、先天免疫を調節することによる感染の処置および予防を含む免疫関連障害の処置のために用い得る、単離された新規ペプチドの提供。
【解決手段】提供されるのは、そのペプチドと反応性がある因子、そのペプチドを含む薬学的な組成物、そのペプチドをコードする単離された核酸分子、その核酸分子を含む組み換え核酸構築物、組み換え核酸構築物を含む少なくとも一つの宿主細胞、およびその宿主細胞を用いてそのペプチドを生産する方法である。本発明はさらに、被験体に本発明のペプチドを投与し、その結果被験体における先天免疫を調節することにより被験体において感染を処置および/または予防するための方法を提供する。加えて、本発明は、被験体が本発明のペプチドを用いた処置に反応性であるか否かを予想するための方法を提供する。
【解決手段】提供されるのは、そのペプチドと反応性がある因子、そのペプチドを含む薬学的な組成物、そのペプチドをコードする単離された核酸分子、その核酸分子を含む組み換え核酸構築物、組み換え核酸構築物を含む少なくとも一つの宿主細胞、およびその宿主細胞を用いてそのペプチドを生産する方法である。本発明はさらに、被験体に本発明のペプチドを投与し、その結果被験体における先天免疫を調節することにより被験体において感染を処置および/または予防するための方法を提供する。加えて、本発明は、被験体が本発明のペプチドを用いた処置に反応性であるか否かを予想するための方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
(関連出願)
本出願は、2005年10月4日に出願された米国仮特許出願60/722,962号;同第60/722,958号;および同第60/722,959号(全て「Novel
Peptides For Treating And Preventing Infection By Modulating Innate Immunity」と題し、そして、本明細書により、その全体が参考として援用される)に対する優先権を主張する。
【0002】
(発明の分野)
本発明は、先天免疫を調節することによる感染の処置および予防を含む、免疫関連障害の処置および予防において用いるためのペプチドに関する。一つの局面において、本発明は、先天免疫を調節するための組成物およびその使用に関する。別の局面において、本発明は、DPPIV活性を減少させるうえで効果がある新規ペプチドおよびその使用を提供する。
【背景技術】
【0003】
(発明の背景)
ウイルス、細菌、真菌、および寄生体を含めた多様な微生物が、疾患をひきおこし得る。微生物の細胞は、動物および植物の細胞と異なり、それらは、自然界では単独では生存できず、多細胞生物の一部分としてのみ存在する。微生物の細胞は、その微生物およびその宿主の状態に一部分依存して、病原性または非病原性であり得る。例えば、普通は無害な細菌が、免疫無防備状態の宿主において病原体となり得る。宿主細胞への侵入は、細胞内環境において複製する細菌性の病原体の生存にとって重要である。細胞外の部位で複製する生物に関しては、宿主細胞への細菌の侵入のその重要性はよくわかっていない。
【0004】
薬剤耐性は、感染と戦う進行中の努力において、障害として残っている。例えば、ペニシリンは、Staphylococcus aureusの処置において、その細菌が耐性となるまでは、有効であった。20世紀の後半をとおして、新しい抗生物質(例えば、バンコマイシンおよびメチシリン)が、開発された;これらは、成功裡に、S.aureus感染を治療した。しかしながら、S.aureusのメチシリン耐性株が、1970年代に進化し、そしてそれ以来ずっと世界中の病院を悩ませている。より最近、S.aureusのバンコマイシン耐性株が表面化した。
【0005】
抗微生物薬への耐性の、増大する脅威および新しい感染性疾患の出現にともない、新しい治療用化合物の、継続的な必要性が存在する。病原体にではなく、宿主に作用する治療薬が、望ましい。なぜならば、それらは病原体の耐性を助長しないからである。特に、先天免疫系を介して宿主に作用する薬剤は、治療薬の将来有望な供給源を提供する。
【0006】
微生物に対する宿主の防御は、宿主の体の上皮のバリアおよび先天免疫系で開始され、そして適応免疫応答の誘導に達する。その宿主の先天免疫応答は、微生物の感染を認識し迎え撃つ、ひとそろいの、高度に保存された機構を含む。先天免疫の要素は、低いレベルで連続的に維持されており、そして刺激を受けたとき非常に迅速に活性化される。その先天免疫応答は、微生物病原体に曝された直後に起こる事象で始まる。免疫グロブリンレセプター遺伝子の再配列のような、適応免疫に関連する事象は、その先天性の反応の一部とは考えられない。
【0007】
先天性の反応が、大抵の感染症の調節において助けになり、そしてまた、炎症反応の一因となることを示す証拠がある。感染によって引き起こされる炎症反応は、疾患の病因の中心となる構成要素であることが知られている。その先天免疫応答におけるToll様レセプター(TLR)の重要性もまた、特性がよくわかっている。TLRの哺乳動物ファミリーは保存された分子を認識し、その多くは、微生物病原体の表面で見られるか、または微生物病原体によって放出される。宿主の先天性の防御を開始する、および/または先天性の防御に寄与する、特性がよくわかっていない多くの他の機構がある。
【0008】
その先天免疫系は、上皮のバリア機能ならびにサイトカインおよびケモカインの分泌を含む、ある範囲の防御メカニズムを提供する。現在までのところ、四つのファミリーのケモカインが、保存されたN末端のシステインモチーフ(C、CC、CXC、およびCX3Cであり、Xは非保存アミノ酸残基である)の数により、類別されている。CXCケモカインは、CXCR3レセプターを持つ細胞(単球、活性化T細胞(Th1)およびNK細胞が挙げられる)に関して走化性があることが知られている。ヒト気道上皮初代細胞、および16−HBE細胞株は、CXCR3レセプターおよびそのリガンドであるIP−10、I−TAC、およびMIGを構成的に発現している(例えば、非特許文献1を参照のこと)。さらに、CXCR3リガンドは、走化性応答およびアクチンの再構成を、16−HBE細胞において誘導する(例えば、非特許文献1を参照のこと)。
【0009】
さらに、II型膜貫通セリンプロテアーゼジペプチジルペプチダーゼIV(DPPIV)は、CD26またはアデノシンデアミナーゼ結合タンパク質としても知られており、免疫機能を含めた多様な生理的過程の主要な調節因子である。CD26/DPPIVは、110kDの細胞表面の糖タンパク質であり、成熟胸腺細胞、活性化T細胞、B細胞、NK細胞、マクロファージ、および上皮細胞上で主として発現している。DPPIVは、少なくとも二つの機能(シグナル伝達機能および蛋白分解機能)を持つ(例えば、非特許文献2を参照のこと)。DPPIVの、細胞での役割のうちの1つとしては、ケモカインのN末端からジペプチドを切断することによる、ケモカイン活性の調節が挙げられる。ケモカインのNH2末端の調節は、それらのレセプターへの結合およびその後の反応のためだけではなく、そのプロセシングされたケモカインのレセプター特異性を変えるうえでも、非常に重要である。DPPIV活性は、多くの、免疫関連状態と関連付けられる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Kelsen et al.,The chemokine receptor CXCR3 and its splice variant are expressed in human airway epithelial cells, Am. J. Physiol. Lung Cell Mol. Physiol.,287:L584,2004
【非特許文献2】Morimoto C,Schlossman SF.The structure and function of CD26 in the T−cell immune response. Immunol.Review.1998,161:55−70.
【発明の概要】
【課題を解決するための手段】
【0011】
(発明の要旨)
本発明者たちは、表1で列挙され記述されたペプチドのうちの一つのアミノ酸配列を持つペプチド、またはそれの類似物、誘導体、または変異体が、宿主の先天免疫を増強し得ることを、発見した。一つの局面において、本発明のその免疫調節性ペプチドが、抗微生物活性を欠くが、一方で、感染した宿主の生存を改善する能力を示すことが見いだされた。別の局面において、本発明は、DPPIV活性を調節するペプチドを提供する。一つの局面において、本発明は、DPPIV活性を減少させるペプチドを提供する。さらに別の局面において、本発明は、免疫学的障害(例えば、DPPIV活性および/または先天免疫と関連したもの)の診断、処置または予防において用いられ得るペプチドを提供する。
【0012】
それゆえに、一つの局面において、本発明は、表1のどれか一つのアミノ酸配列またはそのアミノ酸配列の類似物、誘導体、もしくは変異体を含む単離されたペプチドを提供するか、またはそれらの明白な化学的な同等物を提供するか、または上記ペプチドを含むペプチドを提供する。一つの実施形態において、そのペプチドは、上記ペプチドを含めて10アミノ酸以下である。例として、その単離されたペプチドは、改変されたC末端(例えば、アミド化されたC末端)および/または改変されたN末端を持ち得る。本発明のその単離されたペプチドは、Dアミノ酸の少なくとも一つの置換により改変された表1のそのアミノ酸配列を、さらに含み得る。その単離されたペプチドは、例として、改変された骨格をさらに含み得、それはそのN末端がアミドからN−メチルに改変されている。一つの局面において、親ペプチドの免疫学的な活性を保持する、それらの改変されたペプチド、および上記活性を保持する、それらのペプチドの明白な化学的な同等物は、本発明の範囲に含まれる。
【0013】
別の局面において、本発明はさらに、表1のアミノ酸配列を含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体を含む単離されたペプチドと反応性のある因子を提供する。一つの実施形態において、その因子は、天然に存在しない抗体(例えば、ポリクローナル抗体またはモノクローナル抗体)である。一つの実施形態において、その抗体は、MAPS抗原を用いて作製され、そのMAPS抗原は本発明のペプチドにそのペプチドのC末端に挿入された二つのグリシン残基を介して取り付けられている。その構築物は、そして、動物(例えば、ウサギ)に投与され得、そしてその抗体は当該分野で周知の手順により採取される。一つの局面において、そのような因子は、標識され得るか、または本発明のペプチドを標識するために用いられ得る。別の局面において、そのような因子は、診断方法およびスクリーニング方法において、ペプチドの活性を調整し得る因子をモニターするか、またはそのペプチドの量を定量するために使用され得る。
【0014】
さらに別の局面において、本発明は、単離された核酸分子を提供し、その核酸分子は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含む単離されたペプチドをコードする。そしてまた提供されるものは、組み換え核酸構築物であり、この組み換え核酸構築物は、発現ベクターに作動可能に連結された核酸分子を含む。
【0015】
さらなる局面において、本発明は、少なくとも一つの宿主細胞を提供し、その細胞は、本発明の組み換え核酸構築物を含有する。そしてまた提供されるものは、表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチドを生産するための方法であり、この方法は、(a)そのペプチドの発現を許容する条件下で、少なくとも一つの宿主細胞を培養すること;そして(b)そのペプチドを、少なくとも一つの宿主細胞またはその培養培地から取り出すことによる。
【0016】
さらに別の局面において、本発明は、薬学的組成物を提供し、その組成物は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体(薬学的に受け入れられる塩、付加塩、または上記のいずれかのエステルもしくは多形体を包含する)を持つかもしくは含む単離されたペプチドを、薬学的に受け入れられるキャリア、希釈剤、または賦形剤との組み合わせで、含む。
【0017】
別の局面において、本発明は、被験体における感染(例えば、微生物感染)を処置および/または予防するための方法を提供し、その方法は表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチド、またはそれらの明白な化学的な同等物を被験体に投与することによる。例として、その被験体は、感染していてもよく、または感染のリスクを持っていてもよい。一つの実施形態において、そのペプチドは、その被験体において先天免疫を調節し、それにより、被験体における感染を処置および/または予防する。本発明は、さらに、本発明のペプチドで処置し得る微生物感染を同定するための方法を提供する。別の局面において、本発明は、DPPIV関連状態またはDPPIV関連障害を、処置または予防するための方法を提供する。
【0018】
本発明の方法により処置および/または予防され得る典型的な感染は、細菌(例えば、グラム陽性細菌またはグラム陰性細菌)による感染、真菌による感染、寄生体による感染、およびウイルスによる感染を包含する。本発明の一つの実施形態において、その感染は、細菌感染(例えば、E.coli、Klebsiella pneumoniae、Pseudomonas aeruginosa、Salmonella spp.、Staphylococcus aureus、Streptococcus spp.、またはバンコマイシン耐性腸球菌による感染)である。別の実施形態において、その感染は真菌感染(例えば、糸状菌、酵母、または高等真菌による感染)である。さらに別の実施形態において、その感染は寄生体感染(例えば、Giardia duodenalis、Cryptosporidium parvum、Cyclospora cayetanensis、およびToxoplasma gondiiを包含する、単細胞寄生体または多細胞寄生体による感染)である。さらに別の実施形態において、その感染は、ウイルス感染(例えば、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎、伝染性単核球症、インフルエンザ、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および下気道感染または上気道感染に関係するウイルス(例えば、RSウイルス)による感染)である。
【0019】
本発明の方法に従って、表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチドが、被験体に直接的に(すなわち、そのペプチドそのものを投与することにより)、または間接的に(例えば、被験体においてそのペプチドの発現を許容する方法で、そのペプチドをコードする核酸配列を被験体に投与することにより)、投与され得る。本発明のそのペプチド(またそれをコードする核酸)は、被験体に、経口的に、非経口的に(例えば、皮内に、筋内に、腹腔内に、静脈内に、または皮下に)、経皮的に、鼻腔内に、肺への投与により(例えば、気管内投与により)、および/または浸透圧ポンプにより投与され得る。
【0020】
さらに別の局面において、本発明は、被験体の診断サンプルのDPPIV活性を測定することにより、被験体が、表1のアミノ酸配列を含むペプチド、またはその類似物、誘導体、もしくは変異体を含むペプチドを用いる処置に反応するか予測するための方法を提供し、ここで、DPPIV活性の減少のような調節は、その被験体がそのペプチドによる処置に反応することを示す。一つの局面において、被験体は、DPPIV関連状態またはDPPIV関連障害を持っているか、または持つ疑がいがある。
【0021】
本発明のさらなる局面および利点は、以下に続くその説明を考慮すれば明らかである。詳細な説明およびその特定の例は、しかしながら、本発明の好ましい実施形態を示しているとはいえ、例示のためにのみ与えられることが理解されるべきである。なぜならば、本発明の意図および範囲における多様な変化および改変は、この詳細な説明から当業者には明白となるからである。
例えば、本願発明は以下の項目を提供する。
(項目1)
表1のアミノ酸配列、またはその類似物、誘導体もしくは変異体を含む、単離されたペプチド。
(項目2)
項目1に記載の単離されたペプチドであって、改変されたC末端および/または改変されたN末端を持つ、ペプチド。
(項目3)
項目2に記載の単離されたペプチドであって、改変されたC末端を持つ、ペプチド。
(項目4)
項目3に記載の単離されたペプチドであって、アミド化されたC末端を持つ、ペプチド。
(項目5)
項目1に記載の単離されたペプチドであって、Dアミノ酸の少なくとも一つの置換により改変された表1のアミノ酸配列を含む、ペプチド。
(項目6)
項目1に記載のペプチドと反応性のある、因子。
(項目7)
項目6に記載の因子であって、抗体である、因子。
(項目8)
項目7に記載の因子であって、モノクローナル抗体である、因子。
(項目9)
項目1に記載のペプチドをコードする、単離された核酸分子。
(項目10)
発現ベクターに作動可能に連結された項目9に記載の核酸分子を含む、組み換え核酸構築物。
(項目11)
項目10に記載の組み換え核酸構築物を含む、少なくとも一つの宿主細胞。
(項目12)
表1に列挙されたアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを生産するための方法であって、該方法は、以下の工程:
(a)該ペプチドの発現を許容する条件下で項目11に記載の少なくとも一つの細胞を培養する工程;および
(b)該少なくとも一つの宿主細胞またはその培養培地から該ペプチドを回収する工程を包含する、方法。
(項目13)
項目1に記載のペプチド、および薬学的に受け入れられる、キャリア、希釈剤、または賦形剤を含む、薬学的組成物。
(項目14)
被験体における感染を処置および/または予防するための方法であって、表1に列挙されたアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを、該被験体に投与する工程を包含する、方法。
(項目15)
項目14に記載の方法であって、前記ペプチドが配列番号1、3〜16、18〜60のアミノ酸配列を持つ、方法。
(項目16)
項目14に記載の方法であって、前記被験体における先天免疫を前記ペプチドが調節し、その結果、該被験体において、前記感染が処置および/または予防される、方法。
(項目17)
項目14に記載の方法であって、前記感染は微生物感染である、方法。
(項目18)
項目17に記載の方法であって、前記感染は、細菌による感染、真菌による感染、寄生体による感染、およびウイルスによる感染からなる群より選択される、方法。
(項目19)
項目18に記載の方法であって、前記細菌は、グラム陽性細菌またはグラム陰性細菌である、方法。
(項目20)
項目19に記載の方法であって、前記細菌は、E.coli、Klebsiella
pneumoniae、Pseudomonas aeruginosa、Salmonella spp.、Staphylococcus aureus、Streptococcus spp.、またはバンコマイシン耐性腸球菌からなる群より選択される、方法。
(項目21)
項目18に記載の方法であって、前記真菌は、糸状菌、酵母、または高等真菌からなる群より選択される、方法。
(項目22)
項目18に記載の方法であって、前記寄生体は、単細胞寄生体または多細胞寄生体である、方法。
(項目23)
項目22に記載の方法であって、前記寄生体は、Giardia duodenalis、Cryptosporidium parvum、Cyclospora cayetanensis、およびToxoplasma gondiiからなる群より選択される、方法。
(項目24)
項目18に記載の方法であって、前記ウイルスは、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎、伝染性単核球症、インフルエンザ、下気道感染、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および上気道感染に関係するウイルスからなる群より選択される状態に関連している、方法。
(項目25)
項目24に記載の方法であって、前記ウイルスは、呼吸器合胞体ウイルス(RSV)である、方法。
(項目26)
項目14に記載の方法であって、前記被験体は、感染しているか、または感染のリスクを持っている、方法。
(項目27)
項目26に記載の方法であって、前記ペプチドは、経口的に、非経口的に、経皮的に、鼻腔内に、肺への投与により、または浸透圧ポンプにより投与される、方法。
(項目28)
被験体が、微生物感染または免疫関連障害のための処置に反応するか否かを予想するための方法であって、該処置は、表1のアミノ酸配列またはその類似物、誘導体、もしくは変異体を含むペプチドの該被験体への投与を含み、該方法は、DPPIV基質の存在下で、DPPIVが該基質と反応することを許容する条件下で、本発明のペプチドを該被験体の診断サンプルに投与することにより該被験体の診断サンプルをDPPIV活性に関してアッセイする工程を包含し、ここで、該ペプチドなしでの対照と比較してのDPPIV活性の減少は、該被験体が該処置に対して反応性であることを示す、方法。
(項目29)
配列番号1〜60からなる群より選択されるアミノ酸配列を含む、単離されたペプチド。
(項目30)
項目29に記載の単離されたペプチドであって、前記アミノ酸配列が、配列番号1、3〜16、18〜60からなる群より選択される、単離されたペプチド。
(項目31)
項目30に記載の単離されたペプチドであって、前記アミノ酸配列が、配列番号1、3〜16、18〜54からなる群より選択される、単離されたペプチド。
(項目32)
項目29または項目30のいずれか一項に記載の単離されたペプチドであって、免疫学的活性を持つ、単離されたペプチド。
(項目33)
項目32に記載の単離されたペプチドであって、10までのアミノ酸からなる、単離されたペプチド。
(項目34)
DPPIV関連状態の処置における、項目32または項目33のいずれか一項に記載の単離されたペプチドの使用。
(項目35)
感染の処置または先天免疫関連状態の処置のための、項目32または項目33のいずれか一項に記載のペプチドの使用。
【図面の簡単な説明】
【0022】
本発明が、ここで図面に関して記述される。
【図1A】図1Aは、実施例2において記述された実験の結果を描く。生存率%=ベヒクル対照(トリス)に対する細菌の増殖の量であり、対照の細菌生存率を100%として、配列番号5のペプチドとともに示す;Erythr.=エリスロマイシン。
【図1B】図1Bは、実施例2において記述された実験の結果を描く。生存率%=ベヒクル対照(トリス)に対する細菌の増殖の量であり、対照の細菌生存率を100%として、配列番号47のペプチドとともに示す;Erythr.=エリスロマイシン。
【図2A】図2Aは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2B】図2Bは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
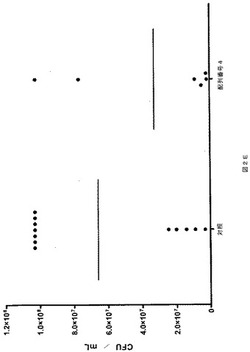
【図2C】図2Cは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号5=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2D】図2Dは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号47=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2E】図2Eは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号4=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2F】図2Fは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号6=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2G】図2Gは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号45=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図3A】図3Aは、実施例4において記述された実験の結果を描く。そのグラフは、Y軸上に、1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図3B】図3Bは、実施例4において記述された実験の結果を描く。そのグラフは、Y軸上に、1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号5=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【発明を実施するための形態】
【0023】
(発明の詳細な説明)
(定義)
本明細書で用いられる場合、「DPPIV関連障害」または「DPPIV関連状態」または「DPPIVに関連した状態」とは、DPPIV活性と相互に関連付けられている任意の医学的な状態を意味しており、そして上記活性の調節は上記状態を処置および/または予防または診断するために用いられ得る。そのような状態の例としては、HIV/AIDS、自己免疫状態(例えば、関節リウマチ)、多発性硬化症、癌(例えば、大腸癌および肺癌)、糖尿病、およびグレーヴズ病が挙げられるが、それらに限定されない。
【0024】
「免疫関連障害」は、免疫系の活性化または阻害のどちらかによって、被験体の免疫系と関連した状態、あるいは、被験体における免疫応答(例えば、先天免疫応答)の特定の構成要素を標的とすることによって、処置、予防または診断され得る状態である。
【0025】
本明細書で用いられる場合、「免疫学的に活性」は、先天免疫活性(例えば、被験体において、先天免疫応答またはその構成要素を調節する能力)またはDPPIV活性を調節する能力を指す。
【0026】
本明細書で用いられる場合、「調節する」または「調節」(例えば、DPPIV活性の調節または特定の反応の調節のような)は、特定の条件下での対照または正常もしくは基準線のレベルの活性もしくは反応に対する、活性もしくは反応の増大もしくは減少を包含する。それはまた、そのペプチドの活性のレベルを通常は増大もしくは減少させる条件下での活性もしくは反応のレベルの維持を包含しうる。
【0027】
「薬学的に受け入れられる塩」は、製薬産業で一般的に用いられる非毒性のアルカリ金属塩、アルカリ土類金属塩、およびアンモニウム塩を指しており、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、バリウム、アンモニウムおよびプロタミン亜鉛の塩を包含し、それらは、当該分野で周知の方法により調製される。その用語はまた、本発明の化合物を適切な有機酸または無機酸と反応させることにより一般的に調製される、非毒性の酸付加塩を包含する。代表的な塩としては、塩酸塩、臭化水素酸塩、硫酸塩、重硫酸塩、酢酸塩、シュウ酸塩、吉草酸塩、オレイン酸塩、ラウリン酸塩、ホウ酸塩、安息香酸塩、乳酸塩、リン酸塩、トシラート、クエン酸塩、マレイン酸塩、フマル酸塩、コハク酸塩、酒石酸塩、ナプシラート(napsylate)、トリフルオロ酢酸塩などが挙げられる。
【0028】
「薬学的に受け入れられる酸付加塩」は、遊離塩基の生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではない塩を指しており、それらは、無機酸(例えば、塩酸、臭化水素酸、硫酸、硝酸、リン酸など)ならびに有機酸(例えば、トリフルオロ酢酸、酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、リンゴ酸、マロン酸、コハク酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、桂皮酸、マンデル酸、メンタンスルホン酸(menthanesulfonic acid)、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸など)より形成される。プロドラッグとしての薬学的に受け入れられる酸付加塩の詳細に関しては、Bundgaard, H.,ed.,(1985)Design of Prodrugs,Elsevier Science Publishers, Amsterdamを参照のこと。
【0029】
「薬学的に受け入れられるエステル」は、エステル結合が加水分解されたときに、カルボン酸またはアルコールの生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではないエステルを指す。プロドラッグとしての薬学的に受け入れられるエステルの詳細に関しては、上記のBundgaard,H.を参照のこと。これらのエステルは、対応するカルボン酸およびアルコールから典型的には形成される。一般的に、エステル形成は、従来の合成技術を介して達成され得る(例えば、March, Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York(1985)p.1157、およびその中で援用された参考文献、ならびにMark et al., Encyclopedia of Chemical Technology, John Wiley &
Sons, New York(1980)を参照のこと)。そのエステルのアルコール構成要素は、(i)一つまたはそれより多くのの二重結合を持っていても持っていなくてもよく、そして分岐した炭素鎖を持っていても持っていなくてもよい、C.2〜C.12脂肪族アルコール、または(ii)C.7〜C.12芳香族またはヘテロ芳香族アルコールを、一般に含む。本発明は、ここで記述されるエステルであると同時に、薬学的に受け入れられるそれらの酸付加塩でもある組成物の使用もまた企図する。
【0030】
「薬学的に受け入れられるアミド」は、アミド結合が加水分解されたときにカルボン酸またはアミンの生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではないアミドを指す。プロドラッグとして薬学的に受け入れられるアミドの詳細については、上記のBundgaard,H.,ed.を参照のこと。これらのアミドは、対応するカルボン酸およびアミンから、典型的に形成される。一般的に、アミド形成は、従来の合成技術を用いて達成されうる(例えば、March, Advanced
Organic Chemistry, 3rd Ed., John Wiley & Sons, New York(1985)p.1152およびMark et al., Encyclopedia of Chemical Technology,
John Wiley & Sons, New York(1980))。本発明はまた、ここに記述したアミドであると同時に、薬学的に受け入れられるその酸付加塩でもある組成物の使用を企図する。
【0031】
「薬学的または治療上で受け入れられるキャリア」は、活性な成分の生物学的な活性の効果に干渉せず、かつ宿主にも患者にも毒性ではないキャリア媒体を指す。
【0032】
「立体異性体」は、別のものと同じ分子量、化学的組成および構造を持つが、原子が異なってグループ分けされている化学的化合物を指す。すなわち、特定の同一の化学的部分は、空間において異なる配向にあり、それゆえ、純粋な場合、偏光面を回転させる能力がある。しかしながら、いくつかの純粋な立体異性体は、非常にわずかであるゆえに現在の計測装置では検出できない光学回転を持ちうる。本発明の化合物は、一つまたはそれより多くの不斉炭素原子を持ってよく、そしてそれゆえ、多様な立体異性体を包含しうる。全ての免疫的に活性な立体異性体が、本発明の範囲に含まれる。
【0033】
本発明の組成物に適用される場合、「治療上または薬学的に効果的な量」は、望ましい生物学的結果を誘導するのに十分な組成物の量を指す。その結果は、徴候、症状、もしくは疾患の原因の軽減、または生物学的システムにおけるほかの任意の望ましい変化であり得る。例えば、本発明では、その結果は、先天免疫応答の増強、DPPIV活性の減少、および/または感染もしくは組織の傷害に対する炎症反応の調節(例えば、阻害または減少または非刺激)を典型的には包含する。
【0034】
ペプチドにおけるアミノ酸残基は、以下のように略記される:フェニルアラニンはPheまたはFであり;ロイシンはLeuまたはLであり;イソロイシンはIleまたはIであり;メチオニンはMetまたはMであり;バリンはValまたはVであり;セリンはSerまたはSであり;プロリンはProまたはPであり;スレオニンはThrまたはTであり;アラニンはAlaまたはAであり;チロシンはTyrまたはYであり;ヒスチジンはHisまたはHであり;グルタミンはGlnまたはQであり;アスパラギンはAsnまたはNであり;リジンはLysまたはKであり;アスパラギン酸はAspまたはDであり;グルタミン酸はGluまたはEであり;システインはCysまたはCであり;トリプトファンはTrpまたはWであり;アルギニンはArgまたはRであり;そしてグリシンはGlyまたはGである。加えて、略語Nalは1−ナフチルアラニンを示すのに用い;オルニチンはOrnまたはOであり、Citはシトルリンであり、Hciはメチレン基をもう一つ持つシトルリンであり、そしてVxまたはバリンx、ここで、「x」は、アミノ酸の骨格における変化を指し、アミノ酸結合はもはやアミド結合ではないが、しかしメチル化されたアミンであり、このことは「x」の表示をもつ他のアミノ酸に同様に適用される。また、2,4−ジアミノ酪酸はDabであり;2,3−ジアミノプロピオン酸はDprまたはDapaであり;N−(4−アミノブチル)−グリシンはNlysであり;hSerはホモセリンであり;Hypはヒドロキシプロリンであり;Val(betaOH)はヒドロキシバリンであり;D−Proは3,4−デヒドロプロリンであり;Pyrはピログルタミン(環中にC=Oをもつプロリン);その環にフッ素置換をもつプロリン;1,3−チアゾリジン−4−カルボン酸(環中にSをもつプロリン)であり;Thiはベータ−(2チエニル)−アラニンであり;Abuは2−アミノ酪酸であり;Nvaはノルバリンであり;Nleはノルロイシンであり;Holはホモロイシンであり;そしてAibはアルファ−アミノイソ酪酸である。
【0035】
天然に存在するアミノ酸のみからなるペプチドに加えて、ペプチド模倣薬またはペプチド類似物もまた提供される。ペプチド類似物は、鋳型ペプチドの特性に類似の特性を持った非ペプチド薬として、製薬産業において、一般的に用いられる。これらのタイプの非ペプチド化合物は、「ペプチド模倣物(peptide mimetics)」または「ペプチド模倣薬」(Fauchere,J.,Adv. Drug Res.15:29(1986);Veber and Freidinger, TINS p.392(1985);およびEvans et al.,J Med. Chem.30:1229(1987)、これらは本明細書により参考として援用される)と呼ばれる。治療上で役に立つペプチドに構造的に類似しているペプチド模倣物が、等しいかもしくは増強された、治療上もしくは予防上の効果を生じるために用いられ得る。一般的に、ペプチド模倣薬は、模範ペプチド(すなわち、生物学的または薬理学的活性を持つペプチド(例えば、天然に存在するレセプター結合ペプチド))に構造的に類似するが、しかし、以下からなる群より選択された結合によって必要に応じて置き換えられる一つまたはそれより多くのペプチド結合をもつ:−−CH2NH−−、−−CH2.S−−、−−CH2=CH2−−、−−CH=CH−−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−および−−CH2SO−−。その置き換えは当該分野で既知の方法、および以下の参考文献にさらに記述された方法により行われる:Spatola, A. F.,in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p.267(1983);Spatola, A. F., Vega Data(March 1983), Vol.1, Issue 3, PEPTIDE BACKBONE MODIFICATIONS(general review);Morley, Trends Pharm Sci(1980) pp.463 468(general review);Hudson, D. et al., Int J Pept Prot
Res 14:177 185(1979):(−−CH2NH−−、CH2CH2−−);Spatola et al., Life Sci 38:1243 1249(1986):(−−CH2−−S);Hann J. Chem. Soc. Perkin Trans.I307 314(1982):(−−CH−−CH、シスおよびトランス);Almquist et al., J Med Chem 23:1392 1398(1980):(−−COCH2−−);Jennings−White et al.,Tetrahedron Lett23:2533(1982):(−−COCH2−−):Szelke et al.,European Application.EP45665 CA:97:39405(1982)(−−CH(OH)CH2.);Holladay et al., Tetrahedron Lett 24:4401 4404(1983):(−−C(OH)CH2−−);およびHruby
Life Sci 31:189 199(1982):(−−CH2−−S−−)であり;そのそれぞれが参考として援用される。一つの局面において、非ペプチド結合は、−−CH2NH−−である。そのようなペプチド擬似物は、ポリペプチドの実施形態を超える顕著な利点(例えば、より経済的な生産、より高い化学的安定性、増強された薬理学的特性(半減期、吸収、効力、効能、その他)、改変された特異性(例えば、広いスペクトルの生物学的活性)、低減された抗原性などが挙げられる)を持ち得る。ペプチド模倣薬の標識は、定量的な構造活性データおよび/または分子モデリングにより予想されるペプチド模倣薬上の非干渉位置への、直接あるいはスペーサー(例えば、アミド基)を介した、一つまたはそれより多くの標識の共有結合による付加を通常は含む。そのような非干渉位置は一般的に、ペプチド模倣薬が結合して治療上の効果を生じる高分子(例えば、免疫グロブリンスーパーファミリー分子)と直接の接触を形成しない位置である。ペプチド模倣薬の誘導体化(例えば、標識)は、そのペプチド模倣薬の望ましい生物学的な活性または薬理学的な活性を、実質上妨げるべきではない。一般的に、レセプター結合タンパクのペプチド模倣薬は、そのレセプターに高い親和性で結合し、かつ検出可能な生物学的活性をもつ(すなわち、レセプターにより媒介される一つまたはそれより多くの表現型の変化に対して、アゴニストまたはアンタゴニストとして作用する)。
【0036】
コンセンサス配列の一つまたはそれより多くのアミノ酸の、同じ型のD−アミノ酸(例えば、L−リジンの代わりのD−リジン)による系統的な置換が、より安定なペプチドを生じるために用いられうる。そのペプチドの免疫学的な活性が保持されるD−アミノ酸置換が望まれることは理解される。
【0037】
(説明)
ここに記述するように、本発明者達は、表1に示されたアミノ酸配列を持ち、かつ/もしくは含む新規ペプチド、または表1に開示されたアミノ酸配列の類似物、誘導体、もしくは変異体を持ち、かつ/もしくは含む新規ペプチドを同定した。本発明者達はまた、表1のアミノ酸配列のうちの一つおよびアミド化されたC末端を持つかもしくは含むペプチドが、先天免疫の増強において、治療上の有用性を持つことを明らかにした。特に、本発明者達は、表1のアミノ酸配列を含むペプチドが、S.aureusに対する抗微生物効力を欠くが、S.aureusを感染させたマウスにおいて生体内での防御をなお提供することを示した。そのペプチドは、感染に対する宿主の反応を増強し、結果として、細菌除去および宿主の生存を改善した。したがって、記述されたその新規ペプチドは、感染症の処置のための治療剤として使用されうる。別の実施形態において、本発明のペプチドが、DPPIV活性を減少させることが示されており、DPPIV活性は多くの免疫関連障害(例えば、AIDSの進行およびHIV病の進行(Blazquez et al.1992;Vanham et al.1993;Schols et al.1998 Oravecz et al.1995)、グレーヴズ病(Eguchi et al.1989;Nishikawa et al.1995)、ならびに癌(Stecca et al.1997)(例えば、肺癌および大腸癌)、ならびに糖尿病(Hinke et al.2000;Marguet et al.2000)に関与することが示されている。さらに、T細胞活性化のインジケーターとしてDPPIVは、関節リウマチ(Nakao et al.,1989)および自己免疫性甲状腺炎(Eguchi et
al.,1989)のようないくつかの自己免疫疾患と並行して変動することが示されている。DPPIVは、これらの疾患の活性のレベルとよく相関するマーカーとして記述されている。さらに、DPPIVは慢性進行性多発性硬化症における疾患進行のインジケーターとして研究されている(Constantinescu et al.,1995)。本発明のペプチドは、そのような状態の処置において使用され得る。
【0038】
(本発明のペプチド)
したがって、本発明は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、または免疫学的に活性である、その類似物、誘導体、もしくは変異体を持つかもしくは含む単離されたペプチドを提供する。また提供されるものは、本発明のペプチド、そのペプチドの類似物、誘導体、および変異体であるペプチドの薬学的に受け入れられる塩、酸付加塩、およびエステルであり、本明細書に記述されたもの(例えば、本明細書に記述された、保存性の置換、ならびにN末端およびC末端の改変、ならびに骨格の改変である)を包含する。本明細書で用いられる場合、本発明の「単離された」ペプチドは、天然に存在する対応物を持たないか、またはそれに天然に付随する成分から分離もしくは精製されたペプチドである。本発明の単離されたペプチドは、例えば、そのペプチドをコードする組み換え核酸の発現により、または化学的な合成により得られうる。化学的に合成されたペプチドは、本来、それに天然に付随する成分から隔てられているため、その合成ペプチドは「単離」されている。
【0039】
一つの局面において、本発明の単離されたペプチドは式「X1X2P」(配列番号55)を持つアミノ酸配列を含み、ここでX1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、N末端において塩基性官能基で置換されたグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択されるか、または別の実施形態においてはK、R、S、O、およびCitからなる群より選択されるか、または別の実施形態においてはK、R、およびSからなる群より選択されるかもしくはRであり、またここでX2はV、I、K、P、およびHからなる群より選択される。一つの実施形態において、本発明の単離されたペプチドは、配列番号55である。別の局面において、本発明の単離されたペプチドは、配列番号55のアミノ酸配列を含む10アミノ酸までのペプチドである。一つの実施形態において、配列番号55の単離されたペプチドは、配列番号8、9、26、39、40、41および45〜53であるか、または、上記配列を含む10アミノ酸までの単離されたペプチドである。別の実施形態において、配列番号55を含む単離されたペプチドは、配列番号44であり、それは13アミノ酸までである。
【0040】
別の実施形態において、本発明は、式「X1X2X3P」(配列番号56)を含む単離されたペプチドを提供し、ここでX1はK、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端において塩基性官能基で置換されたグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択されるか、または別の実施形態においてはK、H、R、S、T、およびOからなる群より選択されるか、または別の実施形態においてはK、H、R、S、およびTからなる群より選択されるか、または別の実施形態においてはK、H、R、S、およびOからなる群より選択されるか、または別の実施形態においてはR、H、K、およびSからなる群より選択される。ここでX2は、A、I、L、V、K、P、G、H、R、S、O、Dab、Dpr、Cit、Hci、Abu、Nva、およびNleからなる群より選択され、X2はN−メチル化されてもよく、あるいは別の実施形態においては、A、I、L、V、K、P、G、H、およびRからなる群より選択され、ここでN−メチル化されてもよく、ここでX3はI、V、およびPからなる群より選択され、ここで一つの実施形態においてX3はN−メチル化されていない。一つの実施形態において、単離されたペプチドは、配列番号1、3〜7、10〜16、18、21〜25、27、28、31〜39、42、43、または47を含め、配列番号56を含む10アミノ酸までのアミノ酸配列でも、または配列番号54を含む11アミノ酸までの単離されたペプチドでもよい。しかしながら、一つの実施形態において、配列番号56が六量体である場合、それは配列番号2ではなく、あるいは一つの実施形態における場合、配列番号56が五量体である場合、それは配列番号17ではない。一つの実施形態において、本発明で単離されたペプチドは、配列番号2または配列番号17を含むペプチドを含まない。
【0041】
別の実施形態において、本発明は、配列番号56の式を含むペプチドを含む単離されたペプチドを五量体または六量体において提供する。一つの実施形態において、上記ペプチドは、免疫学的に活性である。
【0042】
一つの実施形態において、本発明の単離されたペプチドは、式「aX1X2X3P」(配列番号57)のペプチドを含み、ここでX1、X2、およびX3は配列番号56について定義されたとおりであり、かつ「a」はS、P、I、R、C、T、L、V、A、G、K、H、R、O、C、M、およびFからなる群より選択されるか、または別の実施形態においては、S、P、I、R、C、T、L、V、A、G、K、H、R、O、C、およびMからなる群より選択されるか、または別の実施形態においては、S、P、I、R、およびCからなる群より選択されるか、または別の実施形態においてはSである。一つの実施形態において、単離されたペプチドは、配列番号57を含むか、または上記配列を含む10アミノ酸までのペプチドである。別の実施形態において、単離されたペプチドは、配列番号4、47であるか、または単離されたペプチドが六量体の場合は、配列番号39であるか、または上記配列を含む10アミノ酸までの単離されたペプチドである。
【0043】
別の実施形態において、本発明の単離されたペプチドは、式「X1X2X3Pb」(配列番号58)のペプチドを含み、ここでX1X2X3は配列番号56で定義されたとおりであり、かつ「b」は、A、A*、G、S、L、F、K、C、I、V、T、Y、R、H、O、およびMからなる群より選択されるが、しかし一つの実施形態においてはPではなく、あるいは別の実施形態においては、A、A*、G、S、L、F、およびKからなる群より選択され、あるいは別の実施形態においては、A、A*、G、S、L、K、およびCからなる群より選択され、あるいは一つの実施形態においては、A、A*、G、S、L、およびKからなる群より選択される。ここでA*は、アラニンのDアミノ酸を表す。一つの実施形態において、単離されたペプチドは、配列番号58を含む10アミノ酸までのアミノ酸である。一つの実施形態において、単離されたペプチドは、配列番号5〜8、10、11、13〜16、21〜25、27、28、31、33〜38および42〜43であるか、またはそれらを含む。別の実施形態において、そのペプチドは、配列番号58のペプチドであり、ここで「b」はPでもYでもないか、またはRIVPP(配列番号17)ではないか、あるいはここでX3はGではないか、またはRIGPAではなく、あるいはX3は、VxではなくまたはX3はRIVxPAではない。
【0044】
一つの実施形態において、配列番号58に類似のペプチドであるか、あるいはそれを含むペプチドであるが、しかしここでX1は、かわりに、G、GG、またはCitからなる群より選択されるか、あるいはここで「b」はAであり、X2はIであり、X3はVであり、X1はG、GG、もしくはCitであるが、あるいはそのペプチドは配列番号19、20、および36である。一つの実施形態において、単離されたペプチドは、配列番号31を含む。別の実施形態において、単離されたペプチドは、配列番号58の逆の配列を含むかまたは配列番号30を含む。
【0045】
一つの実施形態において、本発明の単離されたペプチドは、配列番号29のアミノ酸配列を持つペプチドであるか、あるいはそのペプチドを含むペプチドである。
【0046】
本発明のペプチドはまた、式「a1a2X1X2X3P」(配列番号59)を含む単離されたペプチドを提供し、ここでX1、X2、およびX3は配列番号56で定義されたとおりであり、かつa1は、K、I、R、H、O、L、V、A、およびGからなる群より選択されるか、または一つの実施形態においては、KおよびIからなる群より選択されるか、または一つの実施形態においてKであり、かつa2はS、P、R、T、H、K、O、L、V、A、G、S、およびIからなる群より選択され、または一つの実施形態において、S、P、およびRからなる群より選択されるか、または別の実施形態において、SおよびPからなる群より選択されるか、または別の実施形態においてはPである。一つの実施形態において、a1はアセチル化されておらず、あるいはa1がKの場合、Kはアセチル化されておらず、また配列番号2でもない。一つの実施形態において、単離されたペプチドは、配列番号1および47であるか、または配列番号59を含む10アミノ酸までのペプチドであるか、あるいはそれらを含むペプチドである。
【0047】
別の実施形態において、本発明の単離されたペプチドは、式「aX1X2X3Pb」(配列番号60)のペプチドであるか、あるいはそのペプチドを含むペプチドであり、ここでX1、X2、およびX3は配列番号56で定義されたとおりであり、かつここで「a」はS、R、K、H、O、T、I、L、V、A、Gからなる群より選択されるか、あるいは別の実施形態において、S、R、およびIからなる群より選択されるか、あるいは別の実施形態において、SおよびRからなる群より選択され、かつここで「b」はA、V、I、L、G、K、H、R、O、S、T、Fからなる群より選択されるか、あるいは別の実施形態においてはAである。別の実施形態において、配列番号60のペプチドは、配列番号3、12、および39であるか、あるいは配列番号60または配列番号3、12もしくは39を含む10アミノ酸までのペプチドである。
【0048】
本明細書で用いられる場合、「表1の配列のアミノ酸配列を含むペプチド」または「表1の配列のアミノ酸配列を含むペプチド」は、そのペプチドそのもの、そのペプチドの明白な化学的同等物、そのペプチドの異性体(例えば、それらの異性体、立体異性体、レトロ異性体、レトロインベルソ異性体、全ての−[D]異性体、全ての−[L]異性体、または混合された[L]異性体および[D]異性体)、そのペプチドの保存性の置換物、そのペプチドの前駆体形、そのペプチドのタンパク分子内プロセシング形(例えば、N末端もしくはC末端からの一つのアミノ酸の切断物または本発明のペプチドの免疫学的に活性な代謝産物)、そのペプチドの薬学的に受け入れられる塩およびエステル、および翻訳後修飾の結果生じる他の形であるペプチドを包含する。また包含されるものは、長さが10、9、8、7、6、5、および4アミノ酸まで、およびそれを含む、(環状化した、または直線状の、または中心となる親配列から分岐した)任意の親配列であり、そのうち指定された配列は部分配列である。表中におけるペプチドは三量体であるが、それが10、9、8、7、6、5、および4マーの部分配列であり得ることを、一方、もし表1に記載されたペプチドが六量体でも、それが10、9、8、および7マーの部分配列であり得るが、5マーでも4マーでもないことを、当業者は認める。加えて、本発明は、10マーより大きい配列(配列番号44および配列番号54)を含む。本発明のペプチドの免疫学的活性を保持する改変されたペプチドは、本発明の範囲内に含まれる。
【0049】
明細書でさらに用いられる場合、本発明のペプチドの「明白な化学的同等物」は、明細書で記述されたペプチドと同じ望ましい活性(例えば、明細書で記述されたペプチドと同じ免疫学的活性)を持ち、かつささいな化学的相違を示す分子であるか、あるいはマイルドな条件下で本発明のペプチドに転換される分子(例えば、本発明のペプチドのエステル、エーテル、還元産物、および複合体)である。
【0050】
加えて、明細書で用いられる場合、「保存性の置換」は、類似した極性または立体的配置を持つか、または置換された残基と同じクラス(例えば、疎水性、酸性、または塩基性)に属するかのどちらかであることにより、置換されたアミノ酸残基と機能上同等であるアミノ酸置換である。明細書で定義された用語「保存性の置換」は、本発明のペプチドの先天免疫増強能力への取るに足らない影響を持つ置換を包含する。保存性の置換の例は、極性(親水性)残基による別の残基の置換(例えば、アルギニン/リジン、グルタミン/アスパラギン、またはスレオニン/セリン)、非極性(疎水性)残基(例えば、イソロイシン、ロイシン、メチオニン、フェニルアラニン、チロシン、またはバリン)による別の残基の置換、酸性残基(例えば、アスパラギン酸またはグルタミン酸)による別の残基の置換、または塩基性残基(例えば、アルギニン、ヒスチジン、リジンまたはオルニチン)による別の残基の置換を含む。
【0051】
明細書で用いられる場合、用語「類似物」は、明細書で記述される配列に実質上同一のアミノ酸配列を持つ任意のペプチドであって、その少なくとも一つの残基が機能上類似の残基によって保存性の置換がされているペプチドを包含する。「類似物」は、60%またはそれより大きい(好ましくは、70%またはそれより大きい、80%またはそれより大きい、85%またはそれより大きい、90%またはそれより大きい、95%またはそれより大きい、または99%の)アミノ酸配列のホモロジーが、表1のアミノ酸配列とあり、そして表1のアミノ酸配列の機能上の変異体である。さらに明細書で用いられる場合、用語「機能上の変異体」は、明細書で記述されるように先天免疫を増強するか、またはDPPIV活性を減少させる能力を示すペプチドの活性を指す。「類似物」は、表1のアミノ酸と類似した三次元の立体配座を持つ、表1のアミノ酸の変異体を包含する。「類似物」は、明細書に記述されるとおりの類似物の任意の薬学的に受け入れられる塩をさらに含包含する。「変異体」は、明細書に記述されるとおりの変異体の任意の薬学的に受け入れられる塩をさらに包含する。
【0052】
「誘導体」は、明細書で用いられる場合、官能性の側基の反応により化学的に誘導された一つあるいはより多くのアミノ酸を持つ本発明のペプチドを指す。模範的な誘導された分子としては、遊離アミノ基が、アセチル基、アミン塩酸塩、カルボベンゾイル基、クロロアセチル基、ホルミル基、p−トルエンスルホニル基、またはt−ブチルオキシカルボニル基を付加することにより、塩またはアミドを形成するように誘導されたペプチド分子が挙げられるがこれらに限定されない。遊離ヒドロキシル基は、O−アシル誘導体またはO−アルキル誘導体を形成するように誘導され得る。さらに、遊離カルボキシル基は、塩、エステル(例えば、メチルエステルおよびエチルエステル)、またはヒドラジドを形成するように誘導され得る。従って、「誘導体」は、さらに、明細書に記述されるとおりの誘導体の薬学的に受け入れられる任意の塩を包含する。
【0053】
本発明の一つの実施形態において、本発明の単離されたペプチドは、改変されたC末端および/または改変されたN末端を持つ。例えば、単離されたペプチドは、アミド化されたC末端を持ち得る。例えば、アミノ末端は、アセチル化(Ac)され得るし、あるいはカルボキシ末端はアミド化(NH2)され得る。しかしながら、本発明の一つの実施形態において、仮にそのような改変が、望ましい免疫学的活性の消失を結果として生じる場合は、本発明のペプチドは、好ましくはアセチル化されない。アミノ末端の改変としては、メチル化(すなわち、−−NHCH3または−−NH(CH3)2)、アセチル化、カルボベンゾイル基(carbobenzoyl group)の付加、またはカルボキシレートの官能性を持つ(RCOO−−で定義され、ここでRはナフチル基、アクリジニル基、ステロイジル基、および類似の基からなる群より選択される)任意のブロッキング基でアミノ末端をブロックすることが挙げられる。カルボキシ末端の改変としては、遊離酸をカルボキサミド基で置き換えること、または構造的な制約を導入するためにカルボキシ末端で環状ラクタムを形成することが挙げられる。
【0054】
一つの実施形態において、骨格の置換(例えば、NCH3へのNHの置換)がされうる。単離されたペプチドはまた、表1のアミノ酸配列のペプチドの改変物(例えば、1挿入もしくは1欠失のような点変異、または先端の切断)でも、または表1のアミノ酸配列を含む改変物(例えば、挿入もしくは欠失のような点変異、または先端の切断)でもよい。例として、そのペプチドは、望ましい免疫学的活性が保持されさえすれば、Dアミノ酸の少なくとも一つの点挿入により改変される表1のアミノ酸配列を含み得る。特に、プロリン残基の環の大きさが5員から4員、6員、または7員に変えられたプロリン類似物が用いられうる。環状基は、飽和でも非飽和でもよく、そして非飽和の場合、芳香性でも非芳香性でもよい。
【0055】
20種類の遺伝的にコードされたアミノ酸(またはDアミノ酸)の天然に存在する側鎖を、類似の特性を持つ他の側鎖(例えば、アルキル、低級アルキル、環状4員アルキル、環状5員アルキル、環状6員アルキル、環状7員アルキル、アミド、アミド低級アルキル、アミドジ(低級アルキル)、低級アルコキシ、ヒドロキシ、カルボキシ、およびそれらの低級エステル誘導体)で、ならびに4員複素環、5員複素環、6員複素環、7員複素環で置き換えることができる。
【0056】
そのような置換は、以下のものを含み得るが必ずしもそれに限定はされない。(1)正に荷電した非標準アミノ酸(例えば、オルニチン、Dab(2,4−ジアミノ酪酸(それはオルニチンからメチレン基を一つ除いたようなもの(またはリジンからメチレン基を二つ除いたようなもの)である)、DprまたはDapa(2,3−ジアミノプロピオン酸(それはオルニチンからメチレン基を二つ除いたようなもの(またはリジンからメチレン基を三つ除いたようなもの、またはヒドロキシルのかわりにアミノ基を持つセリンのようなもの)である))、Nlys((N−(4−アミノブチル)−グリシンであり「N末端」に取り付けられたリジン側鎖およびグリシンのアミノ基に取り付けられたアミノプロピル基またはアミノエチル基を持つ化合物を持つ))(2)電荷を持たない、アルガニン様の非天然のアミノ酸。例えば、Cit(シトルリン)およびHci(メチレン基をもう一つ持つシトルリン)。(3)OHをもつ(例えば、セリンのように)、非標準の天然には存在しないアミノ酸(例えば、hSer(ホモセリン(メチレン基をもう一つ持つ))、Hyp(ヒドロキシプロリン)、Val(ベータOH)(ヒドロキシバリン)、Pen(ペニシラミン)(Val(ベータSH))。(4)プロリン誘導体(例えば、D−Pro。例えば、3,4−デヒドロプロリン、Pyr(ピログルタミン、環中にC=Oを持つプロリン)、環上にフッ素置換を持つプロリン、1,3−チアゾリジン−4−カルボン酸(環中にSを持つプロリン))。(5)ヒスチジン誘導体(例えば、Thi(ベータ−(2チエニル)−アラニン))。または(6)アルキル誘導体(例えば、Abu(2−アミノ酪酸(Cアルファ上にエチル基))、Nva(ノルバリン(Cアルファ上にプロピル基))、Nle(ノルロイシン(Cアルファ上にブチル基))、Hol(ホモロイシン(Cアルファ上にプロピル基))、Aib(アルファ−アミノイソ酪酸(メチレン基を持たないバリン))。それらの置換が親ペプチド/配列の免疫学的な活性を保持することを当業者は認める。
【0057】
別の代わりになる実施形態において、C末端カルボキシル基またはC末端エステルが、それぞれ、カルボキシル基の−−OHまたはカルボキシルエステルのエステル(−−OR)のN末端アミノ基による内部置換により環化して環状ペプチドを形成するよう誘導され得る。例えば、ペプチド酸を与える合成と切断後、遊離酸は、(例えば、塩化メチレン(CH2Cl2)、ジメチルホルムアミド(DMF)混合物中の)とけたジシクロヘキシルカルボジイミド(DCC)のような適切なカルボキシル基のアクチベーターにより、活性化されたエステルに変えられる。環状ペプチドが、その後、活性化されたエステルのN末端アミンによる内部置換により形成される。重合と対照的に、内部環化は、非常に希薄な溶液の使用により増進されうる。そのような方法は、当該分野で周知である。
【0058】
末端アミノ基または末端カルボキシル基が存在しないように、本発明のペプチドを環化するか、またはペプチド末端へデスアミノ残基を組み込むか、もしくはペプチド末端へデスカルボキシ残基を組み込むことによって、そのペプチドのプロテアーゼに対する感受性を減少させるか、またはそのペプチドの立体配座を制限することもまた可能である。本発明の化合物のC末端官能基としては、アミド、アミド低級アルキル、アミドジ(低級アルキル)、低級アルコキシ、ヒドロキシ、およびカルボキシ、ならびにそれらの低級エステル誘導体、ならびに薬学的に受け入れられるそれらの塩が挙げられる。
【0059】
また、N末端システインおよび/またはC末端システインを付加し、そしてジスルフィド結合または他の側鎖の相互作用を介してそのペプチドを環化することによってそのペプチドを環化し得る。
【0060】
末端アミノ基または末端カルボキシル基が存在しないように、デスアミノ残基またはデスカルボキシ残基をペプチドの末端に組み込んで、そのペプチドのプロテアーゼに対する感受性を減少させるかまたはそのペプチドの立体配座を制限することも可能である。
【0061】
(ペプチドの製造方法)
本発明は、ペプチドの類似物、誘導体、および変異体を含むペプチドであって、合成により生産されたか、組み換えにより生じたか、または天然の細胞から単離されたペプチドを企図する。本発明のペプチドは、当業者に周知の方法により合成され得る(例えば、Modern Techniques of Peptide and Amino Acid Analysis(New York:John Wiley & Sons,1981)、およびBodansky, M.,Principles of Peptide Synthesis(New York:Springer−Verlag N.Y.,Inc.,1984)に記述されたとおり)。本発明のペプチドの合成において用いられ得る方法の例は、固相ペプチド合成、溶液または液体法ペプチド合成、および任意の商業的に入手できるペプチド合成装置を用いた合成を含むが、しかしそれに限定はされない。一つの実施形態において、本発明のペプチドはインビトロで合成される(例えば、化学的な方法またはmRNAのインビトロトランスレーションにより)。別の実施形態において、本発明のペプチドは、従来技術およびペプチドをコードするcDNAを用いて、組み換えにより生産される。本発明のアミノ酸配列は、ペプチド配列の合成において用いられる当業者に周知のカップリング剤および保護基をさらに含み得る。
【0062】
本発明のペプチド類似物、誘導体、および変異体は、当業者に周知の、広い種類の異なる変異誘発技法により作られ得る。これらの技法は、任意の分子生物学実験室マニュアル(例えば、Sambrook et al.,Molecular Cloning−A
Laboratory Manual,2nd ed.(Plainview,NY:Cold Spring Harbor Press,1989)、またはAusubel et al., Current Protocols in Molecular
Biology(John Wiley & Sons)が挙げられる)において見いだされ得る。変異キットはまた、多くの商業的な分子生物学の供給者から入手できる。初めのアミノ酸配列において部位特異的変異誘発、領域特異的変異誘発、またはランダム変異誘発を行なう方法が入手できる。類似物、誘導体、および変異体が生産された後、それらは、明細書に記述されたように、先天免疫を増強する望ましい能力に関してスクリーニングされ得る。
【0063】
(ペプチドと反応性のある因子)
本発明は、表1のアミノ酸配列を含むペプチド、またはその類似物、誘導体、もしくは変異体を含むペプチドと反応性のある因子をさらに提供する。明細書で用いられる場合、「反応性の」は、本発明のペプチドに親和性があるか、結合するか、または指向する因子を意味する。さらに、明細書で用いられる場合、「因子」は、タンパク質、ポリペプチド、ペプチド、核酸(DNAまたはRNAが挙げられる)、天然には存在しない抗体、Fab断片、F(ab’)2断片、分子、化合物、抗生物質、薬物、およびそれらの任意の組み合わせを包含するものとする。Fab断片は、抗体の一価の抗原結合断片であり、パパイン消化により産生される。F(ab’)2断片は、抗体の二価の抗原結合断片であり、ペプシン消化により産生される。好ましくは、本発明の因子は、検出可能なマーカーまたは標識で標識される。天然に存在しない抗体は、二つのC末端グリシン残基およびMAPSのような、別の化合物と結合したペプチドを用いて生成される抗体を意味する。MAPS抗原は、本発明のペプチドに、そのペプチドのC末端に挿入された2個のグリシン残基を介して取り付けられる。その構築物はその後、ウサギのような動物に投与され得、そして、抗体は、当該分野で周知の手順を用いて収集され得る。
【0064】
本発明の一つの実施形態において、本発明のペプチドと反応性のある因子は、抗体である。明細書で用いられる場合、本発明の抗体は、ポリクローナルでもモノクローナルでもよい。加えて、本発明の抗体は、当業者には周知の技術により生産され得る。例えば、ポリクローナル抗体は、マウス、ウサギ、またはラットを本発明の精製されたペプチドで免疫することにより生産され得る。次に、モノクローナル抗体は、免疫した動物から脾臓を取り出し、脾臓細胞を骨髄腫細胞と融合させ、培養して増殖させた場合、モノクローナル抗体を産生するハイブリドーマを形成させることにより生産されうる。例えば、J.G.R.Hurrel,Monoclonal Hybridoma Antibodies:Techniques and Applications (Boco Raton, FL:CRC Press Inc.,1982)を参照のこと。
【0065】
本発明の抗体は、検出可能なマーカーまたは標識で標識され得る。抗体の標識は、ペルオキシダーゼ標識、当該分野で公知の化学発光標識、および当該分野で公知の放射性標識を含めた多様な標識技術のうちの一つを用いて実行され得る。本発明の検出可能なマーカーまたは標識は、例えば、非放射性マーカーまたは蛍光マーカー(例えば、ビオチン、フルオレセイン(FITC)、アクリジン、コレステロール、またはカルボキシ−X−ローダミン)であり得、それらは当該分野で容易に知られる蛍光イメージング技術または他のイメージング技術を用いて検出され得る。あるいは、検出可能なマーカーまたは標識は、例えば放射性同位体を含め、放射性マーカーでもよい。放射性同位体は、検出可能な放射線を放射する任意の同位体(例えば、35S、32P、125I、3H、または14C)でありうる。放射性同位体により放射される放射能は、当該分野で周知の技術により検出され得る。例えば、放射性同位体からのガンマ放射は、ガンマイメージング技術、特にシンチグラフィーイメージングを用いて検出され得る。好ましくは、本発明の因子は、検出可能なマーカーまたは標識で標識された高親和性抗体である。
【0066】
(単離された核酸分子)
加えて、本発明は、表1のアミノ酸配列を含むペプチドをコードする単離された核酸分子を、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド(結合ペプチド(例えば、キャリアペプチド構築物)を含む)をコードする単離された核酸分子を、または他のペプチドをコードする単離された核酸分子を、または免疫学的に活性な表1のペプチドへと代謝される、または切り離されるプロペプチドをコードする単離された核酸分子を提供する。遺伝コードの縮重により、本発明の核酸分子は、本発明のペプチドをまたコードする多数の核酸置換物を含む。本発明はさらに、表1のアミノ酸配列またはその類似物、誘導体、もしくは変異体をコードする単離された核酸分子にハイブリダイズする核酸を提供する。
【0067】
本発明の核酸分子は、DNAまたはRNAであり得る。それらは、当業者に公知の多様な技術により調製され得、それらの方法としては、商業的に入手可能なオリゴヌクレオチド合成装置(例えば、Applied Biosystems Model 392 DNA/RNA 合成装置)を用いたオリゴヌクレオチドの自動化された合成が挙げられるが、これに限定されるわけではない。加えて、本発明の核酸分子は、一つまたはそれより多い検出可能なマーカーまたは標識で標識され得る。核酸分子の標識は、当該分野で公知の多くの方法のうちの一つ(例えば、ニックトランスレーション、末端標識、フィルイン末端標識、ポリヌクレオチドキナーゼ変換反応、ランダムプライミング、または(リボプローブ(riboprobe)調製のための)SP6ポリメラーゼ)を、多様な標識(例えば、35S、32P、もしくは3Hのような放射性標識、またはビオチン、フルオレセイン(FITC)、アクリジン、コレステロール、もしくはカルボキシ−X−ローダミン(ROX)のような非放射性標識)のうちの一つとともに用いて実行され得る。
【0068】
本発明はまた、発現ベクターに作動可能に連結された本発明の核酸分子を含む組み換え核酸構築物を提供する。明細書で用いられる場合、「発現ベクター」は、適切な宿主においてそのDNAの発現をもたらす能力のある適切な調節配列に作動可能に連結されたDNA配列を含むDNA構築物である。例えば、ベクターは、プラスミド、ファージ粒子、または可能性のあるゲノム挿入物であり得る。さらに明細書で用いられる場合、用語「作動可能に連結された」は、二つのDNA領域間の機能上の関係を記述する。本発明における使用に適切な発現ベクターは、本発明のペプチドをコードする核酸分子に作動可能に連結された少なくとも一つの発現調節エレメント(例えば、オペレーター、プロモーター、lacシステム、リーダー配列、終結コドン、および/またはポリアデニル化シグナル)を含む。一つの実施形態において、その発現ベクターは、真核細胞において機能する真核細胞の発現ベクター(例えば、レトロウイルスベクター、ワクシニアウイルスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、または鶏痘ウイルスベクター)である。
【0069】
いったん本発明の核酸分子に作動可能に連結されると、その発現ベクターは、核酸の移入に適切な任意のインビボまたはエキソビボの方法により、受容者細胞中に導入され得る。それらの方法としては、エレクトロポレーション、DEAEデキストラントランスフェクション、リン酸カルシウムトランスフェクション、リポフェクション、モノカチオンリポソーム融合、ポリカチオンリポソーム融合、プロトプラスト融合、インビボ電場の形成、DNA被覆微粒子銃、複製欠損組み換えウイルスの注入、相同組み換え、ウイルスベクター、むき出しのDNAの移入、またはそれらの任意の組み合わせが挙げられるが、これらに限定されるわけではない。核酸の移入に適切な組み換えウイルスベクターとしては、ウイルス(例えば、レトロウイルス、HSV、アデノウイルス、アデノ随伴ウイルス、セムリキ森林ウイルス(Semiliki Forest virus)、サイトメガロウイルス、およびワクシニアウイルス)のゲノム由来のベクターが挙げられるが、これらに限定されるわけではない。
【0070】
本発明はさらに、本発明の組み換え核酸構築物を含む少なくとも一つの宿主細胞を提供する。本発明の宿主細胞は、明細書に記述された核酸構築物で形質転換される。宿主細胞は、真核細胞(例えば、動物細胞、植物細胞、昆虫細胞、または酵母細胞)でも原核細胞(例えば、E.coli)でもよい。
【0071】
加えて、本発明は、表1のアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを生産するための方法を提供する。その方法は次の工程を包含する:(a)そのペプチドの発現を許容する条件下で、明細書で記述されたとおりの組み換え核酸構築物を含む少なくとも一つの宿主細胞を培養すること;および(b)少なくとも一つの宿主細胞から、またはその培養培地からそのペプチドを回収すること。その組み換えペプチドは、粗溶解産物として回収されうる;その組み換えペプチドはまた、当該分野で公知の標準的なタンパク質精製手順(アフィニティクロマトグラフィーおよび免疫アフィニティクロマトグラフィー、ディファレンシャル沈澱、ゲル電気泳動、イオン交換クロマトグラフィー、等電点電気泳動、サイズ排除クロマトグラフィーなどが挙げられるが、それらに限定されるわけではない)により精製され得る。
【0072】
(薬学的組成物)
本発明はさらに、表1のアミノ酸配列、または配列番号1、配列番号3〜16、もしくは配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体(前述のいずれかの薬学的に受け入れられる塩、酸付加塩、もしくはエステルが挙げられる)を含むペプチドを、少なくとも一つの薬学的に受け入れられるキャリア、希釈剤、または賦形剤との組み合わせで含む薬学的な組成物を提供する。薬学的に受け入れられるキャリア、希釈剤または賦形剤は、組成物の他の成分と適合し、そしてその受容者に有害ではないという意味で「受け入れられる」でなければならない。受け入れられる薬学的キャリア、希釈剤、および賦形剤の例は、数ある中で、カルボキシメチルセルロース、結晶セルロース、グリセリン、アラビアゴム、ラクトース、ステアリン酸マグネシウム、メチルセルロース、粉剤、生理食塩水、アルギン酸ナトリウム、スクロース、でんぷん、タルク、および水が挙げられるが、それに限定されるものではい。明細書に記述されるように、本発明の薬学的な組成物の調合物は、単位投薬量で都合よく与えられ得る。
【0073】
(使用)
本発明のペプチドは、先天免疫の増強において治療上の有用性があることが示された。先天免疫の増強は、抗微生物活性の欠損(実施例2)ならびにインビボモデルにおける抗感染防御(実施例3および実施例4)により、そしてまた実施例5のDPPIVアッセイにより示される。従って、本発明はまた、被験体において感染を処置および/または予防するための方法を提供する。明細書で用いられる場合、「被験体」は、鳥類(例えば、ニワトリ、七面鳥等)または哺乳動物(例えば、ウシ、イヌ、ヒト、サル、マウス、ブタ、ラット等)である。一つの実施形態において、被験体はヒトである。被験体は、感染していてもよく、または感染のリスクを持っていてもよい。例として、感染は、微生物感染でありうる。本発明の方法により処置され得る微生物感染としては、細菌による感染、真菌による感染、寄生体による感染、およびウイルスによる感染が挙げられるが、それらに限定されるわけではない。
【0074】
ほとんどの細菌性病原体は、一般的な環境中に、または宿主の正常な細菌叢中に存在する。細菌は、コロニーを形成し、宿主の組織中に広まり、そして宿主の組織を侵略することを可能にする、異なる機構(毒性因子と呼ばれる)を獲得することによって、ひどい疾患をひきおこす能力を進化させた。これらの病原性因子が抑制される場合、細菌は、宿主組織中でもはやそれ自体を維持できず、そしてそれゆえ、疾患をひきおこすことができない。本発明の方法により処置され得る典型的な細菌としては、E.coli、Klebsiella pneumoniae、Pseudomonas aeruginosa、Salmonella spp.(例えば、Salmonella typhimurium)、Staphylococcus aureus、Streptococcus spp.、およびバンコマイシン耐性腸球菌が挙げられるが、それらに限定されるわけではない。
【0075】
Pseudomonas aeruginosaは、どこにでもいるグラム陰性細菌であり、環境の融通性、感受性のある個体において疾患をひきおこす能力、および抗生物質に対する耐性のために注目される。Pseudomonas aeruginosaは、融通のきく生物であり、土壌、沼地、および海岸に近い海の生息環境、ならびに植物上および動物組織中で増殖する。嚢胞性線維症の最も重大な合併症は、P. aeruginosaによる、気道感染である。免疫系欠損症を持つ特定の他の個体がかかるのと同様に、癌患者および熱傷患者もまた普通にこの生物体によるひどい感染にかかる。多くの環境中の細菌とは異なり、P. aeruginosaは、感受性の宿主において疾患をひきおこす顕著な能力を持つ。
【0076】
Staphylococcus aureusは、直径約1マイクロメートルのグラム陽性の球状の細菌であり、微視的な群で増殖する。S.aureusは、ヒトの最も重要な病原体の一つであり、心内膜炎から肺炎までの範囲の、市中感染および院内感染の両方をひきおこす。S.aureusは、一般的に細胞外病原体として分類されるが、最近のデータは、多様な型の宿主細胞(例えば、プロフェッショナル食細胞(professional phagocyte)および非食細胞(内皮細胞、線維芽細胞等が挙げられる)の両方)にS.aureusが感染する能力を示した。この侵入は、細胞表面へのS.aureusの付着によって開始され、それはブドウ球菌のフィブロネクチン結合タンパク質が重要な役割をはたすプロセスである。貪食されたS.aureusは、宿主細胞のアポトーシスを誘導するか、または細胞質中で数日間生存することが可能であり、このことは抗ブドウ球菌エフェクター機構の欠損によると考えられる。
【0077】
S.aureusは、鼻の通路、皮膚表面、粘膜、ならびに口、生殖器および直腸の周りの領域にコロニーを形成する。S.aureusは、表面の皮膚病巣(例えば、腫脹、麦粒腫、およびフルンケル)をひきおこし得る。よりひどい感染としては、肺炎、乳腺炎、静脈炎、髄膜炎、および尿路感染が挙げられ、根深い感染としては、骨髄炎および心内膜炎が挙げられる。
【0078】
本発明の方法により処置されうる典型的な真菌としては、糸状菌、酵母、および高等真菌が挙げられるが、それらに限定されるわけではない。全ての真菌は、真核細胞であり、そしてその細胞膜にステロールを持つが、ペプチドグリカンを持たない。真菌の感染、すなわち真菌症は、組織の関与の程度および宿主中への侵入の様式により分類される。免疫無防備状態の宿主において、多様な非病原性真菌、または通常は軽度の真菌が、致死的な可能性をもつ感染をひきおこし得る。
【0079】
寄生体は、他の生体(宿主として知られる)から、食物および保護を得ている生物である。寄生体は、動物からヒトへ、ヒトからヒトへ、またはヒトから動物へと伝えられ得る。いくつかの寄生体は、食品伝染疾患および水系感染性疾患の重要な原因として現れた。それらは、汚染された食物および水の消費により、または感染したヒトもしくは動物の便(糞便)と接触した物質の経口摂取により、宿主から宿主へと伝えられ得る。寄生体は、感染したヒトおよび動物宿主の組織および臓器中で生存および繁殖し、そしてしばしば糞便中に排出される。大きさにおいて異なる型(小さい単細胞の微視的な生物体(原生動物)から、顕微鏡を用いずに見ることができる、より大きな多細胞の蠕虫(腸内寄生虫)までの範囲にわたる)の寄生体がある。本発明の方法により処置され得る一般的な寄生体の例としては、Giardia duodenalis、Cryptosporidium
parvum、Cyclospora cayetanensis、およびToxoplasma gondiiが挙げられるが、それらに限定されるわけではない。
【0080】
真菌および細菌と異なり、ウイルスは、自由生活細胞の多くの特性を欠いている。一つのウイルス粒子は、固定的な構造であり、きわめて安定で、そしてその一部を変化させたりまたは置き換えたりすることができない。細胞と会合した場合にのみ、ウイルスは、複製し、そして生命のある系の特性のいくつかを獲得することができるようになる。ウイルスは、多数の疾患(例えば、感冒および咽頭炎(咽喉炎)のような上気道感染(URTI)が挙げられる)をひきおこす。本発明の方法により処置され得るウイルスの他の例としては、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎(特に子供の)、伝染性単核球症、インフルエンザ、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および下気道感染(例えば、RSウイルス、すなわちRSV)に関係するウイルスが挙げられるが、それらに限定されるものではない。
【0081】
本発明者達は、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドが、感染の予防および/または処置において有効であることを、明細書で示した。従って、被験体における感染を処置および/または予防する本方法は、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドを、被験体に投与することを含む。本発明のペプチドを、感染の処置および/もしくは予防の有効性を増大させるため、ならびに/またはターゲティングの有効性を増大させるために、別の因子と結合させ得ること、または抗生物質(例えば、ペニシリン、メチシリン、またはバンコマイシン)のような別の因子との組み合わせで投与し得ることは、本発明の範囲にある。
【0082】
本発明の一つの実施形態において、本発明のペプチドは、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列のペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドを含む。別の実施形態において、本発明のペプチドは、被験体の先天免疫を調節し、それゆえ、被験体における感染を処置および/または予防する。先天免疫応答は、病原体との遭遇に対する最前線の反応である。先天免疫応答は、感染性疾患の発症を予防する多数の機構を含む。そのような機構の一つは、免疫エフェクター細胞のプライミングおよび動員を含む。
【0083】
一つの実施形態において、本発明のペプチドは、炎症を抑制すると同時に、先天免疫または先天免疫応答を増強しうる。
【0084】
別の実施形態において、本発明のペプチドが、DPPIV活性の調節因子であることが示された。本発明のペプチドは、DPPIV活性を減少させることが示された。それゆえ、本発明のペプチドは特定の免疫学的状態を処置するペプチドの投与から利益を得られうる被験体のスクリーニングにおいて有用である。そのスクリーニングは、DPPIV関連状態を有することが疑われるか、または知られている被験体からサンプルを採取し、このサンプルを本発明のペプチドおよびDPPIVの基質とともにインキュベートし、そしてDPPIV活性の減少に対するそのペプチドの効果を、対照との比較においてモニターすることを含む。ここで、活性の減少は、DPPIV関連状態を処置するための被験体へのペプチドの投与の可能性のある利益を示す。別の実施形態において、対照と比較しての、そのペプチドの存在下でのDPPIV活性の調節が、DPPIV関連状態を示し得る。それゆえ、本発明のペプチドを、DPPIV関連状態の診断において用いうる。別の局面において、本発明のペプチドは、DPPIV関連障害(例えば、HIV/AIDS、グレーヴズ病、癌(例えば、肺癌および大腸癌)、糖尿病、および自己免疫障害(例えば、関節リウマチおよび多発性硬化症))のような多くの免疫学的障害の処置において有用である。
【0085】
(投与)
本発明の方法に従って、明細書に記述されたとおりの本発明のペプチドは、被験体において感染を処置および/または予防するのに、ならびに、あるいはDPPIV関連状態を処置または予防するのに有効な量(例えば、治療上の有効量)で、被験体に直接投与され得る。同様に、明細書で記述されたペプチドは、被験体におけるそのペプチドの発現を許容する方法で、そして感染を処置および/または予防するのに有効な量で、そのペプチドをコードする核酸配列を被験体に投与することによって、被験体に間接的に投与され得る。
【0086】
さらに、本発明のペプチド、またはこれをコードする核酸分子が、被験体において感染を処置するのに有効な量で、被験体に投与され得る。明細書で用いられる場合、「感染を処置するのに有効な」の語句は、感染(細菌、真菌、寄生体、ウイルス等による)の結果生じる臨床的な障害または症状を、改善または最小化するのに有効であることを意味する。例えば、被験体が、微生物に感染した場合、微生物感染の処置に有効なペプチド(またはこれをコードする核酸)の量は、微生物感染の症状(例えば、頭痛、項硬直、食欲不振、悪心、嘔吐、下痢、腹部不快感、急性腎不全、複数の臓器への虚血性ダメージの症状発現の変化、発熱および血小板減少を含むが、それらに制限されるものではない)を改善または最小化し得る量である。被験体において、感染を処置するのに有効なペプチド(またはこれをコードする核酸)の量は、それぞれの症例の特定の要因(被験体の体重および被験体の状態の重大さを含む)に依存して変化する。ペプチド(またはこれをコードする核酸)の適切な量は、当業者により容易に決定され得る。同様に、DPPIV関連状態の処置に有効な量は、当業者に知られた多くの類似の要因に依存して変化し得る。
【0087】
同様に、本発明の方法において、本発明のペプチド、またはこれをコードする核酸分子はまた、被験体における感染を予防するのに有効な量で、感染を発症するリスクのある被験体に投与され得る。明細書で用いられる場合、「感染を予防するのに有効な」の語句は、感染(細菌、真菌、寄生体、ウイルス等による)に由来する臨床的な障害または症状の発症または症状発現を、妨げるかまたは予防するのに有効なものを包含する。被験体において感染を予防するのに有効な、ペプチド(またはこれをコードする核酸)の量は、個々の症例の特定の因子(被験体の性別、体重、および被験体の状態の重大さ、状態の性質、感染部位、および投与の方法が挙げられる)に依存して変化する。ペプチド(またはこれをコードする核酸)の適切な量は、当業者により容易に決定され得る。
【0088】
明細書で開示されるとおりの本発明のペプチド、またはこれをコードする核酸配列は、、ヒトまたは動物の被験体に、公知の手順により投与され得、その手順は経口投与、非経口投与(例えば、筋膜上投与、包内投与、皮内投与、皮膚の内側への投与、筋内投与、眼窩内投与、腹腔内投与、脊椎内投与、胸骨内投与、脈管内投与、静脈内投与、実質投与、または皮下投与)、経皮投与、鼻腔内投与、肺への投与(例えば、気管内投与により)、および浸透圧ポンプによる投与が挙げられるが、それらに限定されるわけではない。一つの実施形態において、投与の方法は、静脈内注射または皮下注射による非経口投与である。
【0089】
経口投与に関して、そのペプチド(またはこれをコードする核酸)の処方物は、カプセル、錠剤、粉末、顆粒、または懸濁剤もしくは液体として提供され得る。その処方物は、従来の添加剤(例えば、ラクトース、マンニトール、トウモロコシでんぷん、またはジャガイモでんぷん)を含み得る。その処方物はまた、結合剤(例えば、結晶セルロース、セルロース誘導体、アラビアゴム、トウモロコシでんぷん、またはゼラチン)を与えられ得る。加えて、その処方物は、崩壊剤(例えば、トウモロコシでんぷん、ジャガイモでんぷん、またはカルボキシメチルセルロースナトリウム)を与えられ得る。その処方物はさらに、二塩基性無水リン酸水素カルシウムまたはでんぷんグリコール酸ナトリウムを与えられ得る。最後に、その処方物は、滑沢剤(例えば、タルクまたはステアリン酸マグネシウム)を与えられ得る。
【0090】
非経口投与に関して、そのペプチド(または、これをコードする核酸)は、好ましくは被験体の血液と等張の滅菌水性溶液と組み合わせられ得る。そのような処方物は、固体の活性成分を水(この水は生理的に適合性のある物質(例えば、塩化ナトリウム、グリシンなど)を含み、かつ生理的条件に適合する緩衝されたpHを持っている)中に溶解して水性溶液を得て、その後、この溶液を滅菌することによって調製され得る。その処方物は、一個でまたは複数投与量の容器(例えば、密封されたアンプルまたは小瓶)で提供され得る。その処方物はまた、明細書で記述されたもの任意のものを含め、任意の注入方法により送達され得る。
【0091】
経皮投与に関して、そのペプチド(またはこれをコードする核酸)は、皮膚浸透エンハンサー(例えば、プロピレングリコール、ポリエチレングリコール、イソプロパノール、エタノール、オレイン酸、N−メチルピロリドンなど)と組み合わされ得る。皮膚浸透エンハンサーはペプチドまたは核酸に対する皮膚の透過性を増大させ、そしてペプチドまたは核酸が皮膚をとおって浸透して血流中へ入り込むのを許容する。エンハンサーおよびペプチドまたは核酸の組成物はまた、高分子の物質(例えば、エチルセルロース、ヒドロキシプロピルセルロース、エチレン/酢酸ビニル、ポリビニルピロリドンなど)とさらに組み合わせてゲル状の組成物を提供することが可能であり、これは、塩化メチレンのような溶媒に溶解され、望ましい粘度まで蒸発、そしてその後裏張り材料に適用されてパッチが提供されうる。そのペプチドまたは核酸は、感染が位置し得る被験体部位またはその近くに、経皮的に投与され得る。あるいは、そのペプチドまたは核酸は、全身性の投与を達成するために、感染領域とは別の部位に経皮的に投与され得る。
【0092】
鼻腔内投与(例えば、鼻内噴霧)および/または肺への投与(吸入による投与)に関して、ペプチドまたは核酸の処方物(エアゾール処方物が挙げられる)は、当業者に周知の手順によって調製され得る。エアゾール処方物は、固体粒子または溶液(水性または非水性)のどちらをも含み得る。ネブライザ(例えば、ジェットネブライザ、超音波ネブライザ等)およびアトマイザが、溶液(例えば、エタノールのような溶媒を用いる)からエアゾールを作るのに用いられ得る。定量吸入器および乾燥粉末吸入器が、小粒子エアゾールを発生させるために用いられうる。エアゾール粒子の望ましい大きさは、当該分野で公知の多くの方法(ジェット−ミリング、噴霧乾燥、および臨界点凝縮が挙げられるが、それらに限定されるわけではない)の任意の一つを用いることにより獲得され得る。
【0093】
鼻腔内投与のための薬学的な組成物は、固体処方物(例えば、粗い粉末)でよく、そして賦形剤(例えば、ラクトース)を含み得る。固体処方物は、鼻腔をとおしての迅速な吸入を用いて、鼻まで持ち上げられた粉末容器から投与され得る。鼻腔内投与のための組成物はまた、鼻内噴霧または点鼻薬の水性または油性の溶液を含み得る。噴霧器での使用については、そのペプチドまたは核酸の処方物は、水性溶液およびさらなる因子(例えば、賦形剤、緩衝剤、等浸透圧剤、保存剤、または界面活性剤が挙げられる)を含み得る。鼻内噴霧は、例えば、そのペプチドまたは核酸の懸濁物または溶液を、圧力下でノズルをとおして出すことにより作られ得る。
【0094】
肺への投与のためのそのペプチドまたは核酸の処方物は、吸入デバイスによる送達のために適切な形態で提供されてもよく、そして肺または洞の下気道に到達するために有効な粒子の大きさを持ち得る。肺粘膜を含む粘膜表面をとおしての吸収に関しては、本発明の処方物は、エマルジョン(例えば、生物活性のあるペプチド、複数個のサブミクロンの粒子、粘膜付着性の巨大分子、および/または水性の連続した層を含む)を含み得る。粘膜表面をとおしての吸収は、そのエマルジョン粒子の粘膜付着をとおして達成され得る。
【0095】
定量吸入器デバイスを用いる使用のための薬学的組成物は、非水性媒体中の懸濁物としてそのペプチドまたは核酸を含む細かく分割した粉末を含み得る。例えば、そのペプチドまたは核酸は、界面活性剤(例えば、トリオレイン酸ソルビタン、ダイズレシチン、またはオレイン酸)の助けでプロペラント中に懸濁され得る。定量吸入器は、典型的には、混合物(例えば、液化された圧縮ガスとして)として、容器(例えば、キャニスター)中に貯蔵されたプロペラントガス(例えば、クロロフルオロカーボン、ヒドロクロロフルオロカーボン、ヒドロフルオロカーボン、または炭化水素)を用いる。吸入器は、吸息中の作動を必要とする。例えば、定量バルブの作動が、その混合物をエアゾールとして放出させ得る。乾燥粉末吸入器は、混合粉末の吸息作動を用いる。
【0096】
本発明のペプチドまたは核酸はまた、浸透圧ミニポンプまたは他の時限放出(timed−release)デバイスから放出または送達され得る。基本浸透圧ミニポンプからの放出速度は、放出開口部に配置された、微孔性の高速反応ゲル(fast−response gel)で調節され得る。浸透圧ミニポンプは、そのペプチドまたは核酸の放出を調節するうえで、またはその送達を標的化するうえで有用である。
【0097】
明細書で記述された方法に従って、本発明のペプチドは、被験体にペプチドそのものを導入することにより、またはそのペプチドをコードする核酸を、そのペプチドの発現を許容する方法で被験体に導入することにより、被験体に投与され得る。従って、本発明の一つの実施形態において、被験体における感染は、ある量の本発明のペプチドを被験体に投与することにより処置または予防され得る。本発明のさらなる実施形態において、被験体における感染は、被験体においてそのペプチドの発現を許容する方法で本発明のペプチドをコードする核酸配列を被験体に投与することにより、処置または予防され得る。
【0098】
本発明のペプチドは、タンパク質および他の薬の導入に用いられる公知の方法(例えば、注射および輸液)により、被験体に投与または導入され得る。感染が、被験体の身体の特定の部分に限局されている場合、治療のためのペプチドをその領域に、注射またはなにか別の手段(例えば、そのペプチドを血液または別の体液中に導入することにより)により、直接導入することが望まれ得る。ペプチドの用いられる量は、先に定義したように、被験体において感染を処置および/または予防するのに有効な量であり、当業者によって容易に決定され得る。
【0099】
本発明の方法において、そのペプチドはまた、そのペプチドの発現を許容する方法で、そのペプチドをコードする核酸を被験体の十分な数の細胞に導入することにより、被験体に投与または導入され得る。治療のためのペプチドをコードする核酸の量は、先に定義したように、被験体において感染を処置および/または予防するのに有効な量のペプチドを生産する量である。この量は、当業者によって容易に決定され得る。
【0100】
本発明のペプチドをコードする核酸は、当該分野で公知の従来の手順(エレクトロポレーション、DEAEデキストラントランスフェクション、リン酸カルシウムトランスフェクション、リポフェクション、モノカチオンリポソーム融合、ポリカチオンリポソーム融合、プロトプラスト融合、インビボ電場の形成、DNA被覆微粒子銃、複製欠損組み換えウイルスの注入、相同組み換え、インビボ遺伝子治療、エキソビボ遺伝子治療、ウイルスベクター、むき出しのDNAの移入、またはそれらの任意の組み合わせが挙げられるが、それらに限定されるわけではない)を用いて、被験体に導入され得る。遺伝子治療に適切な組み換えウイルスベクターは、ウイルス(例えば、レトロウイルス、HSV、アデノウイルス、アデノ随伴ウイルス、セムリキ森林ウイルス(Semiliki Forest
virus)、サイトメガロウイルス、およびワクシニアウイルス)のゲノム由来のベクターが挙げられるが、それらに限定されるわけではない。
【0101】
本発明のペプチドをコードする核酸が、細胞における治療のためのペプチドの発現を成し遂げるために、従来の手順を用いて、適切な細胞にインビトロで導入され得ることもまた、本発明の範囲の中にある。そのペプチドを発現している細胞は、その後、インビボで感染を処置および/または予防するために被験体中に導入され得る。そのような、エキソビボ遺伝子治療の取り組みにおいて、その細胞は好ましくは被験体から取り出され、治療のためのペプチドをコードする核酸を組み込むDNA技術の対象とされ、そしてその後、被験体中に再導入される。
【0102】
本発明のペプチド、またはこれをコードする核酸を含む処方物が、薬学的に受け入れられるキャリア、希釈剤、または賦形剤と、さらに混在させてもよく、したがって、薬学的な組成物を構成することもまた本発明の範囲の中にある。本発明の薬学的な組成物ならびに典型的なキャリア、希釈剤、および賦形剤は、先に記述される。
【0103】
本発明の処方物は、薬学分野で周知の方法により調製され得る。例えば、本発明のペプチド、またはこれをコードする核酸は、懸濁物または溶液として、キャリア、希釈剤、または賦形剤と混在させられ得る。一つまたはそれより多い補助成分(例えば、緩衝剤、矯味矯臭剤、界面活性剤など)もまた、随意に、加えられ得る。キャリアの選択は、投与の経路に依存する。感染を処置および/または予防するため、本発明のペプチド、またはこれをコードする核酸分子を被験体に投与するうえで、その薬学的な組成物は有用である。そのペプチドまたは核酸は、薬学的な組成物が投与される被験体において、感染を処置および/または予防するのに有効な量で提供される。この量は、先に記述されたように、当業者により容易に決定され得る。
【0104】
(診断およびスクリーニングアッセイ)
本発明は、先天免疫状態、またはDPPIV関連状態を有することが疑われる被験体を診断するための方法、被験体が本発明のペプチド(例えば、表1に列挙されたペプチド、またはその類似物、誘導体、もしくは変異体)による処置に反応するか否かを予想するための方法、および本発明のペプチドの免疫学的な影響を調節(例えば、増強、阻害または模倣)する因子についてスクリーニングするための方法を提供する。別の実施形態において、本発明は、本発明のペプチドの免疫学的に活性な類似物、誘導体および変異体、または表1に列挙されたペプチドまたは免疫学的に活性なそれらの改変物についてスクリーニングするための方法を提供する。
【0105】
一つの実施形態において、免疫学的な障害(例えば先天免疫関連状態)を持つ患者が、本発明のペプチドによる処置に反応するか予想するための方法は、被験体から生物学的サンプルを獲得すること、本発明のペプチドをこのサンプルに投与すること、ならびに、その状態を示す、予め決定されたマーカー(例えば、DPPIV関連状態に関してはDPPIV、感染に関しては炎症バイオマーカー、細胞生存率または細菌量)のレベルを、正の対照および/または負の対照との比較においてモニターすることを含む。その正の対照は、公知の免疫学的状態の被験体由来のサンプルでもよい。負の対照は、そのペプチドを投与されていない同じ被験体由来のサンプルでもよい。もしそのペプチドが、対照と比べて、その活性、マーカーのレベル、または細胞生存率を調節するなら、その被験体はそのような免疫学的な障害を持つ可能性があり、そしてそのペプチドでの処置から利益をうけ得る。
【0106】
さらにとりわけ、本発明の一つの局面において、もし被験体がDPPIV関連状態を有するか、またはその疑いがあるならば、その状態についてのマーカーとしてDPPIV活性をモニターすることは適切である。一つの局面において、対照と比較してのDPPIV活性の減少は、その被験体が、そのペプチドでの処置に反応することを示す。あるいは、仮に被験体が感染を有するかまたは感染を有する疑いがある場合、その患者からサンプルを獲得し、そのペプチドの投与後に患者からのサンプルと比較して病原体量または細胞生存率についてそのサンプルをモニターする(ここで、そのペプチドの投与後の患者において病原体量がより低いか、または細胞生存率がより高いことは、その被験体が、ペプチド処置から利益を得るか、あるいは免疫学的な障害を持っていることを示す)。
【0107】
別の実施形態において、ペプチドまたは表1のペプチドの改変物または他の因子が、本発明のペプチドと同じ免疫学的な活性を持つか知りたい場合、サンプル(因子に感染したマウスまたは既知のDPPIV関連状態に感染したマウスのいずれか由来)に対して公知の調節作用をもつ参照ペプチドと比較したDPPIV活性へのそのペプチドの影響をモニターしてもよく、あるいは、予防をモニターしたい場合は、サンプルにそのペプチドまたは因子を投与し、この感染またはDPPIV関連状態をこのサンプル中で誘導し、そしてその後、この感染もしくはDPPIV関連状態の発症、または免疫応答を、そのペプチドが調節または阻害するかモニターしうる。このサンプルは動物モデルでよく、DPPIV関連状態または感染の誘導は、倫理指針に従って、認められた動物モデルにおいて実施され、そしてその後、その動物またはその動物の適切な生物学的サンプルが、そのペプチドの影響についてスクリーニングされる。
【0108】
本発明はさらに、被験体が、微生物感染に対する処置に反応するか否かを予想するための方法を提供し、その処置は、表1のアミノ酸配列を含むペプチドまたはその類似物、誘導体もしくは変異体を含むペプチドを被験体へ投与することを含む。その方法は、一つまたはそれより多い数のバイオマーカー(例えば、炎症バイオマーカー)について、被験体の診断サンプルをアッセイすることを含み、少なくとも一つのバイオマーカー(例えば、炎症バイオマーカー)の存在は、その被験体がその処置に対して反応することを示す。
【0109】
明細書で用いられる場合、「バイオマーカー」または「マーカー」は、その状態(例えば、免疫状態、感染、炎症状態、DPPIV関連状態、先天免疫状態)に関係することが知られているか、または認識されている任意の適切なバイオマーカーであり、そして遺伝子から得られる任意の分子(例えば、遺伝子の転写物)、遺伝子から得られたセンス(コーディング)プローブ配列もしくはアンチセンス(ノンコーディング)プローブ配列、または遺伝子の部分長もしくは完全長の翻訳産物、またはそれらに対する抗体を含み、それらは、免疫応答、先天免疫応答、炎症および/またはDPPIV関連状態と関連する状態、障害、または疾患をモニターするために用いられうる。
【0110】
本発明の方法により、被験体の診断サンプルがインビトロまたはインビボでアッセイされ得る。そのアッセイが、インビトロで実行される場合、被験体由来の診断サンプルは、標準的な手順により取り出され得る。診断サンプルは、組織(任意の筋肉組織、皮膚組織、または軟組織が挙げられる)であってよく、それらは標準的なバイオプシーにより取り出され得る。加えて、診断サンプルは、体液であってよく、血液、唾液、血清、または尿が挙げられる。被験体または患者は、微生物感染もしくは他の免疫学的な障害(例えば、DPPIV関連状態)を有することが知られていてもよく、微生物感染もしくは他の免疫学的な状態(例えば、先天免疫状態もしくはDPPIV関連状態)が疑われていてもよく、または微生物感染もしくは他の免疫学的な状態(例えば、先天免疫状態もしくはDPPIV関連状態)ではないと信じられていてもよい。
【0111】
本発明の方法に従って、被験体の診断サンプルは、一つまたはそれより多い望ましいマーカーの発現についてアッセイされ得る。明細書で用いられる場合、「発現」は、炎症マーカー遺伝子の少なくとも一つのmRNA転写物への転写、または少なくとも一つのmRNAのマーカータンパク質への翻訳を意味する。従って、診断サンプルは、マーカータンパク質、マーカーcDNA、またはマーカーmRNAについてアッセイすることにより、マーカー発現に関してアッセイされ得る。マーカーの適切な形は、明細書で討議した特定の技術に基づき明白である。
【0112】
アッセイされるタンパク質は、被験体または患者の診断サンプルから、当該分野で公知の標準的な方法を用いて単離および精製され得る。その方法は、組織からの抽出(例えば、タンパク質を可溶化する洗浄剤を用いる)(必要な場合、カラムでのアフィニティー精製、クロマトグラフィー(例えば、FPLCおよびHPLC)、免疫沈降(目的の炎症マーカーに対する抗体を用いる)、および沈殿(例えば、イソプロパノールおよびTrizolのような試薬を用いる)が後に続く)が挙げられるが、それらに限定されるわけではない。そのタンパク質の単離と精製には、電気泳動(例えば、SDSポリアクリルアミドゲルでの)があとに続き得る。診断サンプルは、いずれかの形または全ての形のマーカータンパク質(前駆体、末端タンパク質分解でプロセシングされた形、および翻訳後修飾の結果として得られる他の形が挙げられる)の発現についてアッセイされ得ると考えられる。核酸は、診断サンプルから、当業者に公知の標準的な技術を用いて単離され得る。
【0113】
本発明の方法に従って、当該分野から容易に決定されるアッセイおよび検出方法(例えば、免疫学的な技術、ハイブリダイゼーション分析、蛍光イメージング技術、および/または放射線検出)、ならびに明細書で開示された任意のアッセイおよび検出方法(例えば、免疫沈降、ウエスタンブロット分析等)を用いて、被験体の診断サンプルはマーカーの発現についてアッセイされ得、そしてマーカーの発現は診断サンプル中で検出され得る。例えば、被験体の診断サンプルは、炎症マーカーと反応性のある因子を用いて、マーカーの発現についてアッセイされ得る。明細書で用いられる場合、「反応性の」は、その因子が、そのマーカーに親和性をもつ、そのマーカーに結合する、またはそのマーカーを指向することを意味する。さらに、明細書で用いられる場合、「因子」は、タンパク質、ポリペプチド、ペプチド、核酸(DNAまたはRNAが挙げられる)、抗体、Fab断片、F(ab’)2断片、分子、化合物、抗生物質、薬物、およびそれらの任意の組み合わせを包含するものとする。好ましくは、本発明のその因子は、明細書に記述された技術に従って、検出可能なマーカーまたは標識で標識される。本発明の一つの実施形態において、マーカーと反応性のある因子は抗体である。
【0114】
本発明のその因子が、望ましいマーカーと反応性のある抗体である場合、被験体から取り出される診断サンプルは、アフィニティーカラムを通すことにより精製され得るが、そのカラムは、そのマーカーに対する抗体を含み、その抗体はリガンドとして固体支持体(例えば、ビーズ、ゲル、またはプレートの形態における不溶性有機ポリマー)に取り付けられている。固体支持体に取り付けられたその抗体は、カラムの形態において用いられ得る。適切な固体支持体の例は、アガロース、セルロース、デキストラン、ポリアクリルアミド、ポリスチレン、セファロース、および他の不溶性有機ポリマーが挙げられるが、それらに限定されるわけではない。そのマーカーに対する抗体はさらに、望まれるなら、スペーサー分子を介して、固体支持体に取り付けられ得る。その因子およびその抗体の結合を保障するための適切な結合条件(例えば、温度、pH、および塩濃度)は、当業者により容易に決定され得る。好ましい実施形態において、そのマーカーに対するその抗体は、Sepharose 4Bのようなセファロースカラムに取り付けられる。
【0115】
加えて、その因子が抗体であるとき、被験体の診断サンプルは、標準的な免疫学的検出技術に沿って、そのマーカーと反応性のある一つまたはそれより多い抗体を利用する結合調査を用い、免疫学的なマーカーの発現についてアッセイされ得る。例えば、アフィニティーカラムから溶出されたそのマーカータンパク質は、ELISAアッセイ、ウエスタンブロット分析、フローサイトメトリー、または抗原抗体相互作用を用いる任意の他の免疫染色法に供され得る。好ましくは、その診断サンプルは、ウエスタンブロッティングを用いてマーカーの発現についてアッセイされる。
【0116】
あるいは、被験体の診断サンプルは、被験体から取り出した診断サンプルより抽出された核酸のハイブリダイゼーション分析を用いて、マーカーの発現についてアッセイされ得る。本発明のこの方法に従って、そのハイブリダイゼーション分析は、mRNAのノーザンブロット分析を用いて行われ得る。この方法は、そのマーカーをコードする核酸にハイブリダイズする、一つまたはそれより多い核酸プローブを用いてのDNAのサザンブロット分析を行うことによってもまた行われ得る。その核酸プローブは、当業者に公知の多様な技術により調製され得、この技術としては以下が挙げられるが、それらに限定されるものではない:マーカー核酸の制限酵素消化;およびApplied Biosystems Model 392 DNA/RNA 合成装置のような商業的に入手可能なオリゴヌクレオチド合成装置を用いる、マーカー核酸のヌクレオチド配列の選択された部分に対応する配列をもつオリゴヌクレオチドの自動化された合成。
【0117】
本発明において用いられる核酸プローブは、DNAでもRNAでもよく、そして、長さは約8ヌクレオチドから炎症マーカー核酸の全長まで変化し得る。加えて、本発明の核酸プローブは、一つまたはそれより多い数の検出可能なマーカーまたは標識で標識され得る。核酸プローブの標識は、明細書で記述された方法の任意のものを含め、当該分野で知られた多くの方法のうちの一つを用いて達成され得る。マーカー核酸の異なる領域または重なり合う領域に対応する、二つまたはそれより多い核酸プローブ(またはプライマー)の組み合わせもまた、マーカー発現についての診断サンプルのアッセイ(例えばPCRまたはRT−PCRを用いる)に用いられ得る。
【0118】
本発明の方法におけるマーカー発現の検出には、被験体の診断サンプル中のマーカー発現の程度を測定または定量するアッセイが続き得る。そのようなアッセイは、当業者には周知であり、そして、免疫組織化学/免疫細胞化学、フローサイトメトリー、質量分析、ウエスタンブロット分析、またはマーカータンパク質の量を測定するためのELISAを含み得る。例えば、免疫組織化学アッセイを用いるには、組織の組織学的(パラフィン包埋)切片が、スライド上に載せられ、そしてその後、マーカーに対する抗体とともにインキュベートされ得る。そのスライドは、それから、(一次抗体に対する)二次抗体、(これは色素または熱量測定系(例えば、蛍光色素、放射活性因子、または高電子走査容量をもつ因子)で標識されている)とともにインキュベートされて、その切片中に存在するそのマーカーが可視化されうる。
【0119】
本発明は、以下の実施例において詳述され、それらの実施例は本発明の理解を助けるために示されており、そしてその後に続く請求の範囲において定義される本発明の範囲をいずれにせよ制限するとは解釈されるべきではない。
【実施例】
【0120】
(実施例1−ペプチド合成)
表1におけるペプチドを、固相ペプチド合成技術を用いて合成した。
【0121】
Fmocで保護された、全ての必要とされたアミノ酸を、1ミリモルの望ましいペプチドに対して3倍のモル過剰量の重さで量りとった。そのアミノ酸を、次に、ジメチルホルムアミド(Dimethylformaide)(DMF)(7.5ml)に溶解し、3mMの溶液を作製した。適切な量のリンクアミドMBHAレジン(Rink amide
MBHA resin)を、そのレジンの置換を考慮した重さで量りとった。そのレジンを、次に、自動合成装置の反応容器中に移し、そして、ジクロロメタン(DCM)で15分間、前浸漬した。
【0122】
そのレジンを、DMF(30ml)中の25%ピペリジンをそのレジンに加え、そして20分間混合することにより、脱保護した。そのレジンの脱保護後、その3mMのアミノ酸溶液を4mMの2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェート(2−(1H−benzitriazole−1−yl)−1,1,3,3−tetramethyluronium hexafluorophosphate)(HBTU)および8mMのN,N−ジイソプロピルエチルアミン(DIEPA)と混合することにより、最初の連結を生じさせた。その溶液を、そのレジンに加える前に5分間にわたって前活性化させた。そのアミノ酸を、45分間にわたって連結させた。
【0123】
連結後、そのレジンを、DMFおよびジメチルアセトアミド(DMA)で入念にリンスした。その取り付けられた、Fmocで保護されたアミノ酸を、前述した同じ方法で脱保護し、そして、次のアミノ酸を、同じ連結のスキームAA:HBTU:DIEPAを用いて取り付けた。
【0124】
その合成の完了後、そのペプチドを、97.5%のトリフルオロ酢酸(TFA)および2.5%の水を含有する切断用カクテルを使用することで、そのレジンから切り離した。そのレジンを、その切断用カクテル中に1と2分の1時間にわたって懸濁した。その溶液を、次に、ブーフナー漏斗を用いて重力により濾過し、そして、その濾過液を、50mlの遠心分離用チューブに集めた。そのペプチドを、冷却したジエチルエーテルで沈殿させることにより単離した。遠心分離およびジエチルエーテルのデカンテーション後、その粗精製ペプチドを、ジエチルエーテルでもう一度洗浄した後、吸引乾燥機中で2時間乾燥させた。そのペプチドを、次に、脱イオン水(10ml)中に溶解し、−80℃で凍結させ、そして凍結乾燥した。その乾燥ペプチドは、HPLC精製に用いることができた。
【0125】
これらのペプチドの親水性の性質によって、ジエチルエーテルによるペプチドの単離は機能しなかった。それゆえに、クロロホルム抽出を必要とした。そのTFAを蒸発させ、そして、得られたペプチド残基を、10%酢酸(15ml)中に溶解した。不純物およびスカベンジャーを、その酢酸ペプチド溶液から、その溶液をクロロホルム(30ml)で二回洗浄することにより、除去した。その水性ペプチド溶液を、次に、−80℃で凍結させ、そして、凍結乾燥させることで、HPLC精製の準備ができた、粉末にしたペプチドを結果として得た。
【0126】
配列番号33および配列番号34のペプチドは、それぞれが一つのN−メチルアミノ酸を含有した。そのN−メチルアミノ酸、PyBrop、およびN−ヒドロキシベンゾトリアゾール*H2O(HOBt)、ならびにDIEPA溶液を、そのレジンを含有する、そのRV中で一緒に合わせることにより、この連結を実行した。45分間連結させた後、そのN−メチルアミノ酸を次に、もう一度連結させて、完全な連結を確実にした。N−メチルアミノ酸に続く連結が、十分に完全ではないことが観察された。それゆえに、この連結を、N,N,N’,N’−テトラメチル−O−(7−アザベンゾトリアゾール−1−イル)ウロニウムヘキサフルオロホスフェート(HATU)をHBTUの代わりに用いて、実行した。これによって、なお、合計で全純度の30〜40%になる二つの不純物を典型的に含有する、粗精製ペプチドを生じた。そのペプチドを、改変したHPLC条件下で精製し、接近して溶出する不純物から離れた、純粋なペプチドのピークを単離した。
【0127】
(実施例2−非抗微生物活性)
細菌(S.aureus 25923)を、ペプチド(200μM)、ベヒクル(トリス(Tris))、または抗生物質(エリスロマイシン;120μg/ml)を含有するウエル中に播種した。その細菌を、2時間増殖させた。その後、細菌の生存率を、WST−1比色生存率試験(カタログ番号1644807;Roche Diagnostics)を利用して決定した。DMEMおよびDMEM+WST−1を、バックグラウンドの対照として含めた。図1Aおよび図1Bに示したように、配列番号5および配列番号47のペプチドが、抗生物質の対照と比較して、活性の欠如を明白に示した。
【0128】
(実施例3−生体内での防御)
マウスを、腹腔内(IP)注射によりS.aureus 25923で感染させた。四時間後、配列番号1、4、5、6、45、および47のペプチドを、配列番号1に関しては12mg/kgおよび24mg/kgで(図2Aおよび図2B)、配列番号5に関しては9.6mg/kgで(図2C)、配列番号47に関しては13mg/kgで(図2D)、配列番号4に関しては12mg/kgで(図2E)、配列番号6に関しては9mg/kgで(図2F)、そして、配列番号45に関しては13mg/kgで(図2G)、IP注射により投与した。感染の24時間後、生存している動物を殺し、そして、腹腔内洗浄液をプレートにまき、ペプチド処置の有無における残存細菌数(1ml当たりのコロニー形成ユニット数(CFU/ml))を決定した。
【0129】
死亡動物は、本研究におけるあらゆる動物において最も高い細菌数が割り当てられた。配列番号1、4、5、6、45、および47のペプチドは、図2A〜2Gに示したように、対照と比較して、防御をあきらかに示した。
【0130】
(実施例4−予防的な生体内での防御)
感染24時間前に、ペプチドを、12mg/kg(配列番号1、図3A)および11.5mg/kg(配列番号5、図3B)で、IP注射により、投与した。マウスを、その後、IP注射によりS.aureus 25923に感染させた。感染の24時間後、生存している動物を殺し、そして、腹腔内洗浄液をプレートにまき、ペプチド処置の有無における残存細菌数(1ml当たりのコロニー形成ユニット数(CFU/ml))を決定した。
【0131】
死亡動物は、本研究におけるあらゆる動物において最も高い細菌数が割り当てられた。配列番号1および配列番号5のペプチドが、防御をあきらかに示した(死亡マウス2匹(対照)に対して、死亡マウス0匹(ペプチド処置))。図3Aおよび図3Bを参照のこと。
【0132】
以下に述べるのは、実施例1〜4の実験に関して発明者らにより得られた結果である:
発明者らは、表1で示したペプチドのアミノ酸配列を持つか、あるいは本発明の一部としてここに述べたとおりのペプチドが先天免疫を増強し得ることを示した。特に、配列番号1、4、5、6、45、および47のペプチドは、生体内のモデル(図2および実施例3;図3および実施例4)において示したように、感染を予防する能力および防御する能力を有していた。しかしながら、配列番号5および配列番号47のペプチドは、実施例1および図1において示したように、抗微生物活性を欠いていた。それゆえに、配列番号5および/または配列番号47のペプチドによる先天免疫の調節は、これらのペプチドが感染性疾患の処置のための治療剤として用いられ得ることを示す。
【0133】
(実施例5−マウス血液を用いた血漿DPPIV活性アッセイ)
マウス血液を、心臓穿刺によりICRマウスより得、そして、ヘパリン処理した採血管中に集めた。数匹のマウスからの血液をプールして、そして、300μLの等量に分けた。そのペプチドを、pH5.5の酢酸緩衝食塩水中に9mMの濃度になるように溶解した。この貯蔵溶液のうち30μLを、300μLの血液に加え、そして再懸濁により混合した(血液中の濃度は0.82mM)。対照として、30μLのブランク酢酸緩衝食塩水を、300μLの血液に加えた。それぞれのペプチド群を、3回反復実験で調製し、一方、対照は6回反復実験で調製した。そのサンプルを、密閉したマイクロチューブ中で2時間にわたって37℃でインキュベートした。インキュベーション後、血漿を、4000rcfの遠心分離により、そのサンプルから単離した。その血漿を、DPPIVアッセイのため、96ウエルアッセイプレートに移した。そのアッセイを、DPPIVの基質のgly−pro−p−ニトロアニリド(脱イオン水中で16mM)5μLを95μLの血漿(血漿中の濃度は0.8mM)に加えることにより開始し、そして、UV吸光度(405nm)における増大を、20分間にわたってモニターした。gly−pro−p−ニトロアニリドの酵素的切断によるp−ニトロアニリンの産生の速度を、DPPIVの活性とした(Durinx C et al.,(2001)「血漿ジペプチジルペプチダーゼIV活性のための参照値および、それらの、他の実験パラメーターとの関係」.Clin Chem Lab Med.39(2):155−9)。
【0134】
その結果を、表1において見ることができる。DPPIVの活性に対するそのペプチドの影響が観察された。結果を、食塩水の対照(100%とする)に関して、正規化され、平均化された活性%として示す。100%より少ないいずれもが、DPPIVの活性における減少を示す。
【0135】
本発明の一つの局面において、おおよそ25%のDPPIV活性の減少、または一つの実施形態において、少なくとも25%(言い換えると、約75%まで)のDPPIV活性の減少が、活性であるとみなされた。望まれる活性の水準が、そのペプチドの用途に依存して変化し得るということを、当業者は認める。
【0136】
(論考)
CD26あるいはアデノシンデアミナーゼ結合タンパク質としても知られている、II型膜貫通セリンプロテアーゼジペプチジルペプチダーゼIV(DPPIV)は、免疫機能を含む多様な生理的過程の主要な調節因子である。CD26/DPPIVは、110kDの細胞表面の糖タンパク質であり、成熟胸腺細胞、活性化T細胞、B細胞、NK細胞、マクロファージ、および上皮細胞上で主として発現している。DPPIVは、少なくとも二つの機能(シグナル伝達機能および蛋白分解機能)を持つ(Morimoto C,Schlossman SF.The structure and function of CD26 in.−. The T−cell immune response.
Immunol.Review.1998,161:55−70)。DPPIVの、細胞での役割のうちの1つは、ケモカインのN末端からジペプチドを切断することによる、ケモカイン活性の調節を含む。ケモカインのNH2末端の調節は、それらのレセプターへの結合およびその後の反応のためだけではなく、そのプロセシングされたケモカインのレセプター特異性を変えるうえでも、非常に重要である。さらに、可溶性rCD26は、単球の遊走反応を減少させるのに対して、T細胞の経内皮移動を増強することが実証された[Oravecz, T. et. al.,(1997)Regulation of
the receptor specificity and formation of the chemokine RANTES(regulated on activation, normal T cell expressed and secreted) by dipeptydyl peptidase IV (CD26)−mediated cleavage. J.Exp.Med.186:1865〜1872;Iwata, S., et. al.,(1999)CD26/dipeptidyl peptidase IV differentially regulates the chemotaxis of T cells and monocytes toward RANTES: possible mechanism for
the switch from innate to acquired immune response. Int.Immunol.11:417〜426]。これらの結果は、CD26/DPPIVがT細胞および単球の走化性反応を差別的に調節し、そして、先天免疫応答から獲得免疫応答への切替えに関係することを、示した。それゆえ、DPPIVの活性の減少は、それから、逆の効果を持ち、先天免疫応答およびマクロファージ遊走反応を促進する。DPPIV酵素活性の薬理学的な阻害が、RAの実験ラットモデルにおいて、関節炎の進行を減じうることもまた報告されており(Tanaka S et al.,Anti−arthritic effects of the novel dipeptidyl peptidase IV inhibitors TMC−2A and TSL−225. Immunopharmacology 1998,40:21−26;Tanaka S,et al.,:Suppression of arthritis by the inhibitors of dipeptidyl peptidase IV. Int J Immunopharmacol
1997,19:15−24)、DPPIV活性の減少が、ある状況下では炎症を緩和し得ることを示唆している。抗炎症の役割、および、そのケモカイン活性のその調節を合わせて考えると、DPPIVを、これらの活性に関係する新規化合物のスクリーニングのための良好な分子ということになる。
【0137】
CD26/DPPIVは、多様な疾患(例えば、AIDSおよびHIVという疾患の進行(Blazquez et al.1992;Vanham et al.1993;Schols et al.1998 Oravecz et al.1995)、グレーヴズ病(Eguchi et al.1989;Nishikawa et al.1995)、および癌(Stecca et al.1997)、ならびに糖尿病(Hinke et al.2000;Marguet et al.2000))の病理に関係している。
【0138】
さらに、T細胞活性のインジケーターとしてのCD26は、関節リウマチ(Nakao
et al.,1989)および自己免疫性甲状腺炎(Eguchi et al.,1989)のようないくつかの自己免疫疾患と並行して変動することが示されている。CD26は、これらの疾患の活性のレベルとよく相関するマーカーとして記述された。CD26は、さらに、慢性進行性多発性硬化症における疾患進行のインジケーターとして研究された(Constantinescu et al.,1995)。
【0139】
本発明のペプチドがDPPIV活性を減じ得ることが示された。それゆえ、それらは、DPPIVに関係した状態またはDPPIVに関連した状態のような、特定の免疫状態の処置において用いられ得、そして、一つの局面において、先天免疫、および敗血症に至る炎症のような炎症を調節し得る。
【0140】
前述の発明が、明快さおよび理解の目的のために、いくらか詳細に記述されたとはいえ、本開示を読むことにより、付加された特許請求の範囲におけるその発明の真の範囲から、はずれることなく、形式および詳細における多様な変更がされ得ることを、当業者は認めるものである。
【0141】
【表1−1】

【0142】
【表1−2】

【0143】
(表1続き)
表1のノート1:
X1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端で置換された塩基性官能基をもつグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択される。
【0144】
X2は、配列番号55のアミノ酸配列を含む、10アミノ酸までの単離されたペプチドを含め、V、I、K、P、およびHからなる群より選択される。
【0145】
表1のノート2:
X1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端で置換された塩基性官能基をもつグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択され、そしてX2は、A、I、L、V、K、P、G、H、R、S、O、Dab、Dpr、Cit、Hci、Abu、Nva、Nleからなる群より選択され、そしてX2は、N−メチル化され得、そしてX3は、I、V、Pからなる群より選択され、一つの実施形態において、X3は、N−メチル化されていない。一つの実施形態において、その単離されたペプチドは、10アミノ酸までのアミノ酸配列であり得るが、配列番号2でも配列番号17でもない。
【0146】
表1のノート3:
X1、X2およびX3は、配列番号56においてのとおりに定義され、そして「a」は、S、P、I、R、C、T、L、V、A、G、K、H、R、O、C、M、およびFからなる群より選択されるかまたは上記配列を含む10アミノ酸までの単離されたペプチドである。
【0147】
表1のノート4:
X1X2X3Pは、配列番号56において定義されるとおりであり、そして「b」はA、A*、G、S、L、F、K、C、I、V、T、Y、R、H、O、およびMからなる群より選択されるが、一つの実施形態においてPではない。一つの実施形態において、単離されたペプチドは、配列番号58を含むが配列番号17は含まない、10アミノ酸までのペプチドである。
【0148】
表1のノート5:
X1、X2およびX3は、配列番号56において定義されるとおりであり、そして「a1」は、K、I、R、H、O、L、V、A、およびGからなる群より選択され、そして「a2」は、S、P、R、T、H、K、O、L、V、A、G、S、およびIからなる群より選択される。一つの実施形態において、「a1」は、アセチル化されていないか、またはa1がKであるとき、Kはアセチル化されていないか、または配列番号2ではない。一つの実施形態において、その単離されたペプチドは、配列番号59を含む10アミノ酸までを含む。
【0149】
表1のノート6:
X1、X2およびX3は、配列番号56において定義されるとおりであり、そして、「a」は、S、R、K、H、O、T、I、L、V、A、およびGからなる群より選択され、そして、「b」はA、V、I、L、G、K、H、R、O、S、T、およびFからなる群より選択されるか、または配列番号60を含む10アミノ酸までのペプチドである。
【0150】
(引用された参考文献)
【0151】
【表2】

【0152】
【表3】

【技術分野】
【0001】
(関連出願)
本出願は、2005年10月4日に出願された米国仮特許出願60/722,962号;同第60/722,958号;および同第60/722,959号(全て「Novel
Peptides For Treating And Preventing Infection By Modulating Innate Immunity」と題し、そして、本明細書により、その全体が参考として援用される)に対する優先権を主張する。
【0002】
(発明の分野)
本発明は、先天免疫を調節することによる感染の処置および予防を含む、免疫関連障害の処置および予防において用いるためのペプチドに関する。一つの局面において、本発明は、先天免疫を調節するための組成物およびその使用に関する。別の局面において、本発明は、DPPIV活性を減少させるうえで効果がある新規ペプチドおよびその使用を提供する。
【背景技術】
【0003】
(発明の背景)
ウイルス、細菌、真菌、および寄生体を含めた多様な微生物が、疾患をひきおこし得る。微生物の細胞は、動物および植物の細胞と異なり、それらは、自然界では単独では生存できず、多細胞生物の一部分としてのみ存在する。微生物の細胞は、その微生物およびその宿主の状態に一部分依存して、病原性または非病原性であり得る。例えば、普通は無害な細菌が、免疫無防備状態の宿主において病原体となり得る。宿主細胞への侵入は、細胞内環境において複製する細菌性の病原体の生存にとって重要である。細胞外の部位で複製する生物に関しては、宿主細胞への細菌の侵入のその重要性はよくわかっていない。
【0004】
薬剤耐性は、感染と戦う進行中の努力において、障害として残っている。例えば、ペニシリンは、Staphylococcus aureusの処置において、その細菌が耐性となるまでは、有効であった。20世紀の後半をとおして、新しい抗生物質(例えば、バンコマイシンおよびメチシリン)が、開発された;これらは、成功裡に、S.aureus感染を治療した。しかしながら、S.aureusのメチシリン耐性株が、1970年代に進化し、そしてそれ以来ずっと世界中の病院を悩ませている。より最近、S.aureusのバンコマイシン耐性株が表面化した。
【0005】
抗微生物薬への耐性の、増大する脅威および新しい感染性疾患の出現にともない、新しい治療用化合物の、継続的な必要性が存在する。病原体にではなく、宿主に作用する治療薬が、望ましい。なぜならば、それらは病原体の耐性を助長しないからである。特に、先天免疫系を介して宿主に作用する薬剤は、治療薬の将来有望な供給源を提供する。
【0006】
微生物に対する宿主の防御は、宿主の体の上皮のバリアおよび先天免疫系で開始され、そして適応免疫応答の誘導に達する。その宿主の先天免疫応答は、微生物の感染を認識し迎え撃つ、ひとそろいの、高度に保存された機構を含む。先天免疫の要素は、低いレベルで連続的に維持されており、そして刺激を受けたとき非常に迅速に活性化される。その先天免疫応答は、微生物病原体に曝された直後に起こる事象で始まる。免疫グロブリンレセプター遺伝子の再配列のような、適応免疫に関連する事象は、その先天性の反応の一部とは考えられない。
【0007】
先天性の反応が、大抵の感染症の調節において助けになり、そしてまた、炎症反応の一因となることを示す証拠がある。感染によって引き起こされる炎症反応は、疾患の病因の中心となる構成要素であることが知られている。その先天免疫応答におけるToll様レセプター(TLR)の重要性もまた、特性がよくわかっている。TLRの哺乳動物ファミリーは保存された分子を認識し、その多くは、微生物病原体の表面で見られるか、または微生物病原体によって放出される。宿主の先天性の防御を開始する、および/または先天性の防御に寄与する、特性がよくわかっていない多くの他の機構がある。
【0008】
その先天免疫系は、上皮のバリア機能ならびにサイトカインおよびケモカインの分泌を含む、ある範囲の防御メカニズムを提供する。現在までのところ、四つのファミリーのケモカインが、保存されたN末端のシステインモチーフ(C、CC、CXC、およびCX3Cであり、Xは非保存アミノ酸残基である)の数により、類別されている。CXCケモカインは、CXCR3レセプターを持つ細胞(単球、活性化T細胞(Th1)およびNK細胞が挙げられる)に関して走化性があることが知られている。ヒト気道上皮初代細胞、および16−HBE細胞株は、CXCR3レセプターおよびそのリガンドであるIP−10、I−TAC、およびMIGを構成的に発現している(例えば、非特許文献1を参照のこと)。さらに、CXCR3リガンドは、走化性応答およびアクチンの再構成を、16−HBE細胞において誘導する(例えば、非特許文献1を参照のこと)。
【0009】
さらに、II型膜貫通セリンプロテアーゼジペプチジルペプチダーゼIV(DPPIV)は、CD26またはアデノシンデアミナーゼ結合タンパク質としても知られており、免疫機能を含めた多様な生理的過程の主要な調節因子である。CD26/DPPIVは、110kDの細胞表面の糖タンパク質であり、成熟胸腺細胞、活性化T細胞、B細胞、NK細胞、マクロファージ、および上皮細胞上で主として発現している。DPPIVは、少なくとも二つの機能(シグナル伝達機能および蛋白分解機能)を持つ(例えば、非特許文献2を参照のこと)。DPPIVの、細胞での役割のうちの1つとしては、ケモカインのN末端からジペプチドを切断することによる、ケモカイン活性の調節が挙げられる。ケモカインのNH2末端の調節は、それらのレセプターへの結合およびその後の反応のためだけではなく、そのプロセシングされたケモカインのレセプター特異性を変えるうえでも、非常に重要である。DPPIV活性は、多くの、免疫関連状態と関連付けられる。
【先行技術文献】
【非特許文献】
【0010】
【非特許文献1】Kelsen et al.,The chemokine receptor CXCR3 and its splice variant are expressed in human airway epithelial cells, Am. J. Physiol. Lung Cell Mol. Physiol.,287:L584,2004
【非特許文献2】Morimoto C,Schlossman SF.The structure and function of CD26 in the T−cell immune response. Immunol.Review.1998,161:55−70.
【発明の概要】
【課題を解決するための手段】
【0011】
(発明の要旨)
本発明者たちは、表1で列挙され記述されたペプチドのうちの一つのアミノ酸配列を持つペプチド、またはそれの類似物、誘導体、または変異体が、宿主の先天免疫を増強し得ることを、発見した。一つの局面において、本発明のその免疫調節性ペプチドが、抗微生物活性を欠くが、一方で、感染した宿主の生存を改善する能力を示すことが見いだされた。別の局面において、本発明は、DPPIV活性を調節するペプチドを提供する。一つの局面において、本発明は、DPPIV活性を減少させるペプチドを提供する。さらに別の局面において、本発明は、免疫学的障害(例えば、DPPIV活性および/または先天免疫と関連したもの)の診断、処置または予防において用いられ得るペプチドを提供する。
【0012】
それゆえに、一つの局面において、本発明は、表1のどれか一つのアミノ酸配列またはそのアミノ酸配列の類似物、誘導体、もしくは変異体を含む単離されたペプチドを提供するか、またはそれらの明白な化学的な同等物を提供するか、または上記ペプチドを含むペプチドを提供する。一つの実施形態において、そのペプチドは、上記ペプチドを含めて10アミノ酸以下である。例として、その単離されたペプチドは、改変されたC末端(例えば、アミド化されたC末端)および/または改変されたN末端を持ち得る。本発明のその単離されたペプチドは、Dアミノ酸の少なくとも一つの置換により改変された表1のそのアミノ酸配列を、さらに含み得る。その単離されたペプチドは、例として、改変された骨格をさらに含み得、それはそのN末端がアミドからN−メチルに改変されている。一つの局面において、親ペプチドの免疫学的な活性を保持する、それらの改変されたペプチド、および上記活性を保持する、それらのペプチドの明白な化学的な同等物は、本発明の範囲に含まれる。
【0013】
別の局面において、本発明はさらに、表1のアミノ酸配列を含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体を含む単離されたペプチドと反応性のある因子を提供する。一つの実施形態において、その因子は、天然に存在しない抗体(例えば、ポリクローナル抗体またはモノクローナル抗体)である。一つの実施形態において、その抗体は、MAPS抗原を用いて作製され、そのMAPS抗原は本発明のペプチドにそのペプチドのC末端に挿入された二つのグリシン残基を介して取り付けられている。その構築物は、そして、動物(例えば、ウサギ)に投与され得、そしてその抗体は当該分野で周知の手順により採取される。一つの局面において、そのような因子は、標識され得るか、または本発明のペプチドを標識するために用いられ得る。別の局面において、そのような因子は、診断方法およびスクリーニング方法において、ペプチドの活性を調整し得る因子をモニターするか、またはそのペプチドの量を定量するために使用され得る。
【0014】
さらに別の局面において、本発明は、単離された核酸分子を提供し、その核酸分子は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含む単離されたペプチドをコードする。そしてまた提供されるものは、組み換え核酸構築物であり、この組み換え核酸構築物は、発現ベクターに作動可能に連結された核酸分子を含む。
【0015】
さらなる局面において、本発明は、少なくとも一つの宿主細胞を提供し、その細胞は、本発明の組み換え核酸構築物を含有する。そしてまた提供されるものは、表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチドを生産するための方法であり、この方法は、(a)そのペプチドの発現を許容する条件下で、少なくとも一つの宿主細胞を培養すること;そして(b)そのペプチドを、少なくとも一つの宿主細胞またはその培養培地から取り出すことによる。
【0016】
さらに別の局面において、本発明は、薬学的組成物を提供し、その組成物は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、またはその類似物、誘導体、もしくは変異体(薬学的に受け入れられる塩、付加塩、または上記のいずれかのエステルもしくは多形体を包含する)を持つかもしくは含む単離されたペプチドを、薬学的に受け入れられるキャリア、希釈剤、または賦形剤との組み合わせで、含む。
【0017】
別の局面において、本発明は、被験体における感染(例えば、微生物感染)を処置および/または予防するための方法を提供し、その方法は表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチド、またはそれらの明白な化学的な同等物を被験体に投与することによる。例として、その被験体は、感染していてもよく、または感染のリスクを持っていてもよい。一つの実施形態において、そのペプチドは、その被験体において先天免疫を調節し、それにより、被験体における感染を処置および/または予防する。本発明は、さらに、本発明のペプチドで処置し得る微生物感染を同定するための方法を提供する。別の局面において、本発明は、DPPIV関連状態またはDPPIV関連障害を、処置または予防するための方法を提供する。
【0018】
本発明の方法により処置および/または予防され得る典型的な感染は、細菌(例えば、グラム陽性細菌またはグラム陰性細菌)による感染、真菌による感染、寄生体による感染、およびウイルスによる感染を包含する。本発明の一つの実施形態において、その感染は、細菌感染(例えば、E.coli、Klebsiella pneumoniae、Pseudomonas aeruginosa、Salmonella spp.、Staphylococcus aureus、Streptococcus spp.、またはバンコマイシン耐性腸球菌による感染)である。別の実施形態において、その感染は真菌感染(例えば、糸状菌、酵母、または高等真菌による感染)である。さらに別の実施形態において、その感染は寄生体感染(例えば、Giardia duodenalis、Cryptosporidium parvum、Cyclospora cayetanensis、およびToxoplasma gondiiを包含する、単細胞寄生体または多細胞寄生体による感染)である。さらに別の実施形態において、その感染は、ウイルス感染(例えば、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎、伝染性単核球症、インフルエンザ、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および下気道感染または上気道感染に関係するウイルス(例えば、RSウイルス)による感染)である。
【0019】
本発明の方法に従って、表1のアミノ酸配列を持つかもしくは含むペプチド、またはその類似物、誘導体、もしくは変異体を持つかもしくは含むペプチドが、被験体に直接的に(すなわち、そのペプチドそのものを投与することにより)、または間接的に(例えば、被験体においてそのペプチドの発現を許容する方法で、そのペプチドをコードする核酸配列を被験体に投与することにより)、投与され得る。本発明のそのペプチド(またそれをコードする核酸)は、被験体に、経口的に、非経口的に(例えば、皮内に、筋内に、腹腔内に、静脈内に、または皮下に)、経皮的に、鼻腔内に、肺への投与により(例えば、気管内投与により)、および/または浸透圧ポンプにより投与され得る。
【0020】
さらに別の局面において、本発明は、被験体の診断サンプルのDPPIV活性を測定することにより、被験体が、表1のアミノ酸配列を含むペプチド、またはその類似物、誘導体、もしくは変異体を含むペプチドを用いる処置に反応するか予測するための方法を提供し、ここで、DPPIV活性の減少のような調節は、その被験体がそのペプチドによる処置に反応することを示す。一つの局面において、被験体は、DPPIV関連状態またはDPPIV関連障害を持っているか、または持つ疑がいがある。
【0021】
本発明のさらなる局面および利点は、以下に続くその説明を考慮すれば明らかである。詳細な説明およびその特定の例は、しかしながら、本発明の好ましい実施形態を示しているとはいえ、例示のためにのみ与えられることが理解されるべきである。なぜならば、本発明の意図および範囲における多様な変化および改変は、この詳細な説明から当業者には明白となるからである。
例えば、本願発明は以下の項目を提供する。
(項目1)
表1のアミノ酸配列、またはその類似物、誘導体もしくは変異体を含む、単離されたペプチド。
(項目2)
項目1に記載の単離されたペプチドであって、改変されたC末端および/または改変されたN末端を持つ、ペプチド。
(項目3)
項目2に記載の単離されたペプチドであって、改変されたC末端を持つ、ペプチド。
(項目4)
項目3に記載の単離されたペプチドであって、アミド化されたC末端を持つ、ペプチド。
(項目5)
項目1に記載の単離されたペプチドであって、Dアミノ酸の少なくとも一つの置換により改変された表1のアミノ酸配列を含む、ペプチド。
(項目6)
項目1に記載のペプチドと反応性のある、因子。
(項目7)
項目6に記載の因子であって、抗体である、因子。
(項目8)
項目7に記載の因子であって、モノクローナル抗体である、因子。
(項目9)
項目1に記載のペプチドをコードする、単離された核酸分子。
(項目10)
発現ベクターに作動可能に連結された項目9に記載の核酸分子を含む、組み換え核酸構築物。
(項目11)
項目10に記載の組み換え核酸構築物を含む、少なくとも一つの宿主細胞。
(項目12)
表1に列挙されたアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを生産するための方法であって、該方法は、以下の工程:
(a)該ペプチドの発現を許容する条件下で項目11に記載の少なくとも一つの細胞を培養する工程;および
(b)該少なくとも一つの宿主細胞またはその培養培地から該ペプチドを回収する工程を包含する、方法。
(項目13)
項目1に記載のペプチド、および薬学的に受け入れられる、キャリア、希釈剤、または賦形剤を含む、薬学的組成物。
(項目14)
被験体における感染を処置および/または予防するための方法であって、表1に列挙されたアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを、該被験体に投与する工程を包含する、方法。
(項目15)
項目14に記載の方法であって、前記ペプチドが配列番号1、3〜16、18〜60のアミノ酸配列を持つ、方法。
(項目16)
項目14に記載の方法であって、前記被験体における先天免疫を前記ペプチドが調節し、その結果、該被験体において、前記感染が処置および/または予防される、方法。
(項目17)
項目14に記載の方法であって、前記感染は微生物感染である、方法。
(項目18)
項目17に記載の方法であって、前記感染は、細菌による感染、真菌による感染、寄生体による感染、およびウイルスによる感染からなる群より選択される、方法。
(項目19)
項目18に記載の方法であって、前記細菌は、グラム陽性細菌またはグラム陰性細菌である、方法。
(項目20)
項目19に記載の方法であって、前記細菌は、E.coli、Klebsiella
pneumoniae、Pseudomonas aeruginosa、Salmonella spp.、Staphylococcus aureus、Streptococcus spp.、またはバンコマイシン耐性腸球菌からなる群より選択される、方法。
(項目21)
項目18に記載の方法であって、前記真菌は、糸状菌、酵母、または高等真菌からなる群より選択される、方法。
(項目22)
項目18に記載の方法であって、前記寄生体は、単細胞寄生体または多細胞寄生体である、方法。
(項目23)
項目22に記載の方法であって、前記寄生体は、Giardia duodenalis、Cryptosporidium parvum、Cyclospora cayetanensis、およびToxoplasma gondiiからなる群より選択される、方法。
(項目24)
項目18に記載の方法であって、前記ウイルスは、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎、伝染性単核球症、インフルエンザ、下気道感染、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および上気道感染に関係するウイルスからなる群より選択される状態に関連している、方法。
(項目25)
項目24に記載の方法であって、前記ウイルスは、呼吸器合胞体ウイルス(RSV)である、方法。
(項目26)
項目14に記載の方法であって、前記被験体は、感染しているか、または感染のリスクを持っている、方法。
(項目27)
項目26に記載の方法であって、前記ペプチドは、経口的に、非経口的に、経皮的に、鼻腔内に、肺への投与により、または浸透圧ポンプにより投与される、方法。
(項目28)
被験体が、微生物感染または免疫関連障害のための処置に反応するか否かを予想するための方法であって、該処置は、表1のアミノ酸配列またはその類似物、誘導体、もしくは変異体を含むペプチドの該被験体への投与を含み、該方法は、DPPIV基質の存在下で、DPPIVが該基質と反応することを許容する条件下で、本発明のペプチドを該被験体の診断サンプルに投与することにより該被験体の診断サンプルをDPPIV活性に関してアッセイする工程を包含し、ここで、該ペプチドなしでの対照と比較してのDPPIV活性の減少は、該被験体が該処置に対して反応性であることを示す、方法。
(項目29)
配列番号1〜60からなる群より選択されるアミノ酸配列を含む、単離されたペプチド。
(項目30)
項目29に記載の単離されたペプチドであって、前記アミノ酸配列が、配列番号1、3〜16、18〜60からなる群より選択される、単離されたペプチド。
(項目31)
項目30に記載の単離されたペプチドであって、前記アミノ酸配列が、配列番号1、3〜16、18〜54からなる群より選択される、単離されたペプチド。
(項目32)
項目29または項目30のいずれか一項に記載の単離されたペプチドであって、免疫学的活性を持つ、単離されたペプチド。
(項目33)
項目32に記載の単離されたペプチドであって、10までのアミノ酸からなる、単離されたペプチド。
(項目34)
DPPIV関連状態の処置における、項目32または項目33のいずれか一項に記載の単離されたペプチドの使用。
(項目35)
感染の処置または先天免疫関連状態の処置のための、項目32または項目33のいずれか一項に記載のペプチドの使用。
【図面の簡単な説明】
【0022】
本発明が、ここで図面に関して記述される。
【図1A】図1Aは、実施例2において記述された実験の結果を描く。生存率%=ベヒクル対照(トリス)に対する細菌の増殖の量であり、対照の細菌生存率を100%として、配列番号5のペプチドとともに示す;Erythr.=エリスロマイシン。
【図1B】図1Bは、実施例2において記述された実験の結果を描く。生存率%=ベヒクル対照(トリス)に対する細菌の増殖の量であり、対照の細菌生存率を100%として、配列番号47のペプチドとともに示す;Erythr.=エリスロマイシン。
【図2A】図2Aは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2B】図2Bは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2C】図2Cは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号5=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2D】図2Dは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号47=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2E】図2Eは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号4=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2F】図2Fは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号6=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図2G】図2Gは、実施例3において記述された実験の結果を描く。そのグラフは、Y軸上に1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号45=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図3A】図3Aは、実施例4において記述された実験の結果を描く。そのグラフは、Y軸上に、1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号1=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【図3B】図3Bは、実施例4において記述された実験の結果を描く。そのグラフは、Y軸上に、1ml当たりのコロニー形成単位(CFU/ml)を、そしてX軸上に処置群(対照=ペプチド無し;配列番号5=そのアミノ酸配列を持つペプチドで処置)を示す。個々のマウスの細菌数を示す。
【発明を実施するための形態】
【0023】
(発明の詳細な説明)
(定義)
本明細書で用いられる場合、「DPPIV関連障害」または「DPPIV関連状態」または「DPPIVに関連した状態」とは、DPPIV活性と相互に関連付けられている任意の医学的な状態を意味しており、そして上記活性の調節は上記状態を処置および/または予防または診断するために用いられ得る。そのような状態の例としては、HIV/AIDS、自己免疫状態(例えば、関節リウマチ)、多発性硬化症、癌(例えば、大腸癌および肺癌)、糖尿病、およびグレーヴズ病が挙げられるが、それらに限定されない。
【0024】
「免疫関連障害」は、免疫系の活性化または阻害のどちらかによって、被験体の免疫系と関連した状態、あるいは、被験体における免疫応答(例えば、先天免疫応答)の特定の構成要素を標的とすることによって、処置、予防または診断され得る状態である。
【0025】
本明細書で用いられる場合、「免疫学的に活性」は、先天免疫活性(例えば、被験体において、先天免疫応答またはその構成要素を調節する能力)またはDPPIV活性を調節する能力を指す。
【0026】
本明細書で用いられる場合、「調節する」または「調節」(例えば、DPPIV活性の調節または特定の反応の調節のような)は、特定の条件下での対照または正常もしくは基準線のレベルの活性もしくは反応に対する、活性もしくは反応の増大もしくは減少を包含する。それはまた、そのペプチドの活性のレベルを通常は増大もしくは減少させる条件下での活性もしくは反応のレベルの維持を包含しうる。
【0027】
「薬学的に受け入れられる塩」は、製薬産業で一般的に用いられる非毒性のアルカリ金属塩、アルカリ土類金属塩、およびアンモニウム塩を指しており、ナトリウム、カリウム、リチウム、カルシウム、マグネシウム、バリウム、アンモニウムおよびプロタミン亜鉛の塩を包含し、それらは、当該分野で周知の方法により調製される。その用語はまた、本発明の化合物を適切な有機酸または無機酸と反応させることにより一般的に調製される、非毒性の酸付加塩を包含する。代表的な塩としては、塩酸塩、臭化水素酸塩、硫酸塩、重硫酸塩、酢酸塩、シュウ酸塩、吉草酸塩、オレイン酸塩、ラウリン酸塩、ホウ酸塩、安息香酸塩、乳酸塩、リン酸塩、トシラート、クエン酸塩、マレイン酸塩、フマル酸塩、コハク酸塩、酒石酸塩、ナプシラート(napsylate)、トリフルオロ酢酸塩などが挙げられる。
【0028】
「薬学的に受け入れられる酸付加塩」は、遊離塩基の生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではない塩を指しており、それらは、無機酸(例えば、塩酸、臭化水素酸、硫酸、硝酸、リン酸など)ならびに有機酸(例えば、トリフルオロ酢酸、酢酸、プロピオン酸、グリコール酸、ピルビン酸、シュウ酸、リンゴ酸、マロン酸、コハク酸、マレイン酸、フマル酸、酒石酸、クエン酸、安息香酸、桂皮酸、マンデル酸、メンタンスルホン酸(menthanesulfonic acid)、エタンスルホン酸、p−トルエンスルホン酸、サリチル酸など)より形成される。プロドラッグとしての薬学的に受け入れられる酸付加塩の詳細に関しては、Bundgaard, H.,ed.,(1985)Design of Prodrugs,Elsevier Science Publishers, Amsterdamを参照のこと。
【0029】
「薬学的に受け入れられるエステル」は、エステル結合が加水分解されたときに、カルボン酸またはアルコールの生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではないエステルを指す。プロドラッグとしての薬学的に受け入れられるエステルの詳細に関しては、上記のBundgaard,H.を参照のこと。これらのエステルは、対応するカルボン酸およびアルコールから典型的には形成される。一般的に、エステル形成は、従来の合成技術を介して達成され得る(例えば、March, Advanced Organic Chemistry, 3rd Ed., John Wiley & Sons, New York(1985)p.1157、およびその中で援用された参考文献、ならびにMark et al., Encyclopedia of Chemical Technology, John Wiley &
Sons, New York(1980)を参照のこと)。そのエステルのアルコール構成要素は、(i)一つまたはそれより多くのの二重結合を持っていても持っていなくてもよく、そして分岐した炭素鎖を持っていても持っていなくてもよい、C.2〜C.12脂肪族アルコール、または(ii)C.7〜C.12芳香族またはヘテロ芳香族アルコールを、一般に含む。本発明は、ここで記述されるエステルであると同時に、薬学的に受け入れられるそれらの酸付加塩でもある組成物の使用もまた企図する。
【0030】
「薬学的に受け入れられるアミド」は、アミド結合が加水分解されたときにカルボン酸またはアミンの生物学的な効果および特性を保持し、かつ生物学的にも他の点でも望ましくないわけではないアミドを指す。プロドラッグとして薬学的に受け入れられるアミドの詳細については、上記のBundgaard,H.,ed.を参照のこと。これらのアミドは、対応するカルボン酸およびアミンから、典型的に形成される。一般的に、アミド形成は、従来の合成技術を用いて達成されうる(例えば、March, Advanced
Organic Chemistry, 3rd Ed., John Wiley & Sons, New York(1985)p.1152およびMark et al., Encyclopedia of Chemical Technology,
John Wiley & Sons, New York(1980))。本発明はまた、ここに記述したアミドであると同時に、薬学的に受け入れられるその酸付加塩でもある組成物の使用を企図する。
【0031】
「薬学的または治療上で受け入れられるキャリア」は、活性な成分の生物学的な活性の効果に干渉せず、かつ宿主にも患者にも毒性ではないキャリア媒体を指す。
【0032】
「立体異性体」は、別のものと同じ分子量、化学的組成および構造を持つが、原子が異なってグループ分けされている化学的化合物を指す。すなわち、特定の同一の化学的部分は、空間において異なる配向にあり、それゆえ、純粋な場合、偏光面を回転させる能力がある。しかしながら、いくつかの純粋な立体異性体は、非常にわずかであるゆえに現在の計測装置では検出できない光学回転を持ちうる。本発明の化合物は、一つまたはそれより多くの不斉炭素原子を持ってよく、そしてそれゆえ、多様な立体異性体を包含しうる。全ての免疫的に活性な立体異性体が、本発明の範囲に含まれる。
【0033】
本発明の組成物に適用される場合、「治療上または薬学的に効果的な量」は、望ましい生物学的結果を誘導するのに十分な組成物の量を指す。その結果は、徴候、症状、もしくは疾患の原因の軽減、または生物学的システムにおけるほかの任意の望ましい変化であり得る。例えば、本発明では、その結果は、先天免疫応答の増強、DPPIV活性の減少、および/または感染もしくは組織の傷害に対する炎症反応の調節(例えば、阻害または減少または非刺激)を典型的には包含する。
【0034】
ペプチドにおけるアミノ酸残基は、以下のように略記される:フェニルアラニンはPheまたはFであり;ロイシンはLeuまたはLであり;イソロイシンはIleまたはIであり;メチオニンはMetまたはMであり;バリンはValまたはVであり;セリンはSerまたはSであり;プロリンはProまたはPであり;スレオニンはThrまたはTであり;アラニンはAlaまたはAであり;チロシンはTyrまたはYであり;ヒスチジンはHisまたはHであり;グルタミンはGlnまたはQであり;アスパラギンはAsnまたはNであり;リジンはLysまたはKであり;アスパラギン酸はAspまたはDであり;グルタミン酸はGluまたはEであり;システインはCysまたはCであり;トリプトファンはTrpまたはWであり;アルギニンはArgまたはRであり;そしてグリシンはGlyまたはGである。加えて、略語Nalは1−ナフチルアラニンを示すのに用い;オルニチンはOrnまたはOであり、Citはシトルリンであり、Hciはメチレン基をもう一つ持つシトルリンであり、そしてVxまたはバリンx、ここで、「x」は、アミノ酸の骨格における変化を指し、アミノ酸結合はもはやアミド結合ではないが、しかしメチル化されたアミンであり、このことは「x」の表示をもつ他のアミノ酸に同様に適用される。また、2,4−ジアミノ酪酸はDabであり;2,3−ジアミノプロピオン酸はDprまたはDapaであり;N−(4−アミノブチル)−グリシンはNlysであり;hSerはホモセリンであり;Hypはヒドロキシプロリンであり;Val(betaOH)はヒドロキシバリンであり;D−Proは3,4−デヒドロプロリンであり;Pyrはピログルタミン(環中にC=Oをもつプロリン);その環にフッ素置換をもつプロリン;1,3−チアゾリジン−4−カルボン酸(環中にSをもつプロリン)であり;Thiはベータ−(2チエニル)−アラニンであり;Abuは2−アミノ酪酸であり;Nvaはノルバリンであり;Nleはノルロイシンであり;Holはホモロイシンであり;そしてAibはアルファ−アミノイソ酪酸である。
【0035】
天然に存在するアミノ酸のみからなるペプチドに加えて、ペプチド模倣薬またはペプチド類似物もまた提供される。ペプチド類似物は、鋳型ペプチドの特性に類似の特性を持った非ペプチド薬として、製薬産業において、一般的に用いられる。これらのタイプの非ペプチド化合物は、「ペプチド模倣物(peptide mimetics)」または「ペプチド模倣薬」(Fauchere,J.,Adv. Drug Res.15:29(1986);Veber and Freidinger, TINS p.392(1985);およびEvans et al.,J Med. Chem.30:1229(1987)、これらは本明細書により参考として援用される)と呼ばれる。治療上で役に立つペプチドに構造的に類似しているペプチド模倣物が、等しいかもしくは増強された、治療上もしくは予防上の効果を生じるために用いられ得る。一般的に、ペプチド模倣薬は、模範ペプチド(すなわち、生物学的または薬理学的活性を持つペプチド(例えば、天然に存在するレセプター結合ペプチド))に構造的に類似するが、しかし、以下からなる群より選択された結合によって必要に応じて置き換えられる一つまたはそれより多くのペプチド結合をもつ:−−CH2NH−−、−−CH2.S−−、−−CH2=CH2−−、−−CH=CH−−(シスおよびトランス)、−−COCH2−−、−−CH(OH)CH2−−および−−CH2SO−−。その置き換えは当該分野で既知の方法、および以下の参考文献にさらに記述された方法により行われる:Spatola, A. F.,in Chemistry and Biochemistry of Amino Acids, Peptides and Proteins, B. Weinstein, eds., Marcel Dekker, New York, p.267(1983);Spatola, A. F., Vega Data(March 1983), Vol.1, Issue 3, PEPTIDE BACKBONE MODIFICATIONS(general review);Morley, Trends Pharm Sci(1980) pp.463 468(general review);Hudson, D. et al., Int J Pept Prot
Res 14:177 185(1979):(−−CH2NH−−、CH2CH2−−);Spatola et al., Life Sci 38:1243 1249(1986):(−−CH2−−S);Hann J. Chem. Soc. Perkin Trans.I307 314(1982):(−−CH−−CH、シスおよびトランス);Almquist et al., J Med Chem 23:1392 1398(1980):(−−COCH2−−);Jennings−White et al.,Tetrahedron Lett23:2533(1982):(−−COCH2−−):Szelke et al.,European Application.EP45665 CA:97:39405(1982)(−−CH(OH)CH2.);Holladay et al., Tetrahedron Lett 24:4401 4404(1983):(−−C(OH)CH2−−);およびHruby
Life Sci 31:189 199(1982):(−−CH2−−S−−)であり;そのそれぞれが参考として援用される。一つの局面において、非ペプチド結合は、−−CH2NH−−である。そのようなペプチド擬似物は、ポリペプチドの実施形態を超える顕著な利点(例えば、より経済的な生産、より高い化学的安定性、増強された薬理学的特性(半減期、吸収、効力、効能、その他)、改変された特異性(例えば、広いスペクトルの生物学的活性)、低減された抗原性などが挙げられる)を持ち得る。ペプチド模倣薬の標識は、定量的な構造活性データおよび/または分子モデリングにより予想されるペプチド模倣薬上の非干渉位置への、直接あるいはスペーサー(例えば、アミド基)を介した、一つまたはそれより多くの標識の共有結合による付加を通常は含む。そのような非干渉位置は一般的に、ペプチド模倣薬が結合して治療上の効果を生じる高分子(例えば、免疫グロブリンスーパーファミリー分子)と直接の接触を形成しない位置である。ペプチド模倣薬の誘導体化(例えば、標識)は、そのペプチド模倣薬の望ましい生物学的な活性または薬理学的な活性を、実質上妨げるべきではない。一般的に、レセプター結合タンパクのペプチド模倣薬は、そのレセプターに高い親和性で結合し、かつ検出可能な生物学的活性をもつ(すなわち、レセプターにより媒介される一つまたはそれより多くの表現型の変化に対して、アゴニストまたはアンタゴニストとして作用する)。
【0036】
コンセンサス配列の一つまたはそれより多くのアミノ酸の、同じ型のD−アミノ酸(例えば、L−リジンの代わりのD−リジン)による系統的な置換が、より安定なペプチドを生じるために用いられうる。そのペプチドの免疫学的な活性が保持されるD−アミノ酸置換が望まれることは理解される。
【0037】
(説明)
ここに記述するように、本発明者達は、表1に示されたアミノ酸配列を持ち、かつ/もしくは含む新規ペプチド、または表1に開示されたアミノ酸配列の類似物、誘導体、もしくは変異体を持ち、かつ/もしくは含む新規ペプチドを同定した。本発明者達はまた、表1のアミノ酸配列のうちの一つおよびアミド化されたC末端を持つかもしくは含むペプチドが、先天免疫の増強において、治療上の有用性を持つことを明らかにした。特に、本発明者達は、表1のアミノ酸配列を含むペプチドが、S.aureusに対する抗微生物効力を欠くが、S.aureusを感染させたマウスにおいて生体内での防御をなお提供することを示した。そのペプチドは、感染に対する宿主の反応を増強し、結果として、細菌除去および宿主の生存を改善した。したがって、記述されたその新規ペプチドは、感染症の処置のための治療剤として使用されうる。別の実施形態において、本発明のペプチドが、DPPIV活性を減少させることが示されており、DPPIV活性は多くの免疫関連障害(例えば、AIDSの進行およびHIV病の進行(Blazquez et al.1992;Vanham et al.1993;Schols et al.1998 Oravecz et al.1995)、グレーヴズ病(Eguchi et al.1989;Nishikawa et al.1995)、ならびに癌(Stecca et al.1997)(例えば、肺癌および大腸癌)、ならびに糖尿病(Hinke et al.2000;Marguet et al.2000)に関与することが示されている。さらに、T細胞活性化のインジケーターとしてDPPIVは、関節リウマチ(Nakao et al.,1989)および自己免疫性甲状腺炎(Eguchi et
al.,1989)のようないくつかの自己免疫疾患と並行して変動することが示されている。DPPIVは、これらの疾患の活性のレベルとよく相関するマーカーとして記述されている。さらに、DPPIVは慢性進行性多発性硬化症における疾患進行のインジケーターとして研究されている(Constantinescu et al.,1995)。本発明のペプチドは、そのような状態の処置において使用され得る。
【0038】
(本発明のペプチド)
したがって、本発明は、表1のアミノ酸配列を持つかもしくは含む単離されたペプチド、または免疫学的に活性である、その類似物、誘導体、もしくは変異体を持つかもしくは含む単離されたペプチドを提供する。また提供されるものは、本発明のペプチド、そのペプチドの類似物、誘導体、および変異体であるペプチドの薬学的に受け入れられる塩、酸付加塩、およびエステルであり、本明細書に記述されたもの(例えば、本明細書に記述された、保存性の置換、ならびにN末端およびC末端の改変、ならびに骨格の改変である)を包含する。本明細書で用いられる場合、本発明の「単離された」ペプチドは、天然に存在する対応物を持たないか、またはそれに天然に付随する成分から分離もしくは精製されたペプチドである。本発明の単離されたペプチドは、例えば、そのペプチドをコードする組み換え核酸の発現により、または化学的な合成により得られうる。化学的に合成されたペプチドは、本来、それに天然に付随する成分から隔てられているため、その合成ペプチドは「単離」されている。
【0039】
一つの局面において、本発明の単離されたペプチドは式「X1X2P」(配列番号55)を持つアミノ酸配列を含み、ここでX1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、N末端において塩基性官能基で置換されたグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択されるか、または別の実施形態においてはK、R、S、O、およびCitからなる群より選択されるか、または別の実施形態においてはK、R、およびSからなる群より選択されるかもしくはRであり、またここでX2はV、I、K、P、およびHからなる群より選択される。一つの実施形態において、本発明の単離されたペプチドは、配列番号55である。別の局面において、本発明の単離されたペプチドは、配列番号55のアミノ酸配列を含む10アミノ酸までのペプチドである。一つの実施形態において、配列番号55の単離されたペプチドは、配列番号8、9、26、39、40、41および45〜53であるか、または、上記配列を含む10アミノ酸までの単離されたペプチドである。別の実施形態において、配列番号55を含む単離されたペプチドは、配列番号44であり、それは13アミノ酸までである。
【0040】
別の実施形態において、本発明は、式「X1X2X3P」(配列番号56)を含む単離されたペプチドを提供し、ここでX1はK、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端において塩基性官能基で置換されたグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択されるか、または別の実施形態においてはK、H、R、S、T、およびOからなる群より選択されるか、または別の実施形態においてはK、H、R、S、およびTからなる群より選択されるか、または別の実施形態においてはK、H、R、S、およびOからなる群より選択されるか、または別の実施形態においてはR、H、K、およびSからなる群より選択される。ここでX2は、A、I、L、V、K、P、G、H、R、S、O、Dab、Dpr、Cit、Hci、Abu、Nva、およびNleからなる群より選択され、X2はN−メチル化されてもよく、あるいは別の実施形態においては、A、I、L、V、K、P、G、H、およびRからなる群より選択され、ここでN−メチル化されてもよく、ここでX3はI、V、およびPからなる群より選択され、ここで一つの実施形態においてX3はN−メチル化されていない。一つの実施形態において、単離されたペプチドは、配列番号1、3〜7、10〜16、18、21〜25、27、28、31〜39、42、43、または47を含め、配列番号56を含む10アミノ酸までのアミノ酸配列でも、または配列番号54を含む11アミノ酸までの単離されたペプチドでもよい。しかしながら、一つの実施形態において、配列番号56が六量体である場合、それは配列番号2ではなく、あるいは一つの実施形態における場合、配列番号56が五量体である場合、それは配列番号17ではない。一つの実施形態において、本発明で単離されたペプチドは、配列番号2または配列番号17を含むペプチドを含まない。
【0041】
別の実施形態において、本発明は、配列番号56の式を含むペプチドを含む単離されたペプチドを五量体または六量体において提供する。一つの実施形態において、上記ペプチドは、免疫学的に活性である。
【0042】
一つの実施形態において、本発明の単離されたペプチドは、式「aX1X2X3P」(配列番号57)のペプチドを含み、ここでX1、X2、およびX3は配列番号56について定義されたとおりであり、かつ「a」はS、P、I、R、C、T、L、V、A、G、K、H、R、O、C、M、およびFからなる群より選択されるか、または別の実施形態においては、S、P、I、R、C、T、L、V、A、G、K、H、R、O、C、およびMからなる群より選択されるか、または別の実施形態においては、S、P、I、R、およびCからなる群より選択されるか、または別の実施形態においてはSである。一つの実施形態において、単離されたペプチドは、配列番号57を含むか、または上記配列を含む10アミノ酸までのペプチドである。別の実施形態において、単離されたペプチドは、配列番号4、47であるか、または単離されたペプチドが六量体の場合は、配列番号39であるか、または上記配列を含む10アミノ酸までの単離されたペプチドである。
【0043】
別の実施形態において、本発明の単離されたペプチドは、式「X1X2X3Pb」(配列番号58)のペプチドを含み、ここでX1X2X3は配列番号56で定義されたとおりであり、かつ「b」は、A、A*、G、S、L、F、K、C、I、V、T、Y、R、H、O、およびMからなる群より選択されるが、しかし一つの実施形態においてはPではなく、あるいは別の実施形態においては、A、A*、G、S、L、F、およびKからなる群より選択され、あるいは別の実施形態においては、A、A*、G、S、L、K、およびCからなる群より選択され、あるいは一つの実施形態においては、A、A*、G、S、L、およびKからなる群より選択される。ここでA*は、アラニンのDアミノ酸を表す。一つの実施形態において、単離されたペプチドは、配列番号58を含む10アミノ酸までのアミノ酸である。一つの実施形態において、単離されたペプチドは、配列番号5〜8、10、11、13〜16、21〜25、27、28、31、33〜38および42〜43であるか、またはそれらを含む。別の実施形態において、そのペプチドは、配列番号58のペプチドであり、ここで「b」はPでもYでもないか、またはRIVPP(配列番号17)ではないか、あるいはここでX3はGではないか、またはRIGPAではなく、あるいはX3は、VxではなくまたはX3はRIVxPAではない。
【0044】
一つの実施形態において、配列番号58に類似のペプチドであるか、あるいはそれを含むペプチドであるが、しかしここでX1は、かわりに、G、GG、またはCitからなる群より選択されるか、あるいはここで「b」はAであり、X2はIであり、X3はVであり、X1はG、GG、もしくはCitであるが、あるいはそのペプチドは配列番号19、20、および36である。一つの実施形態において、単離されたペプチドは、配列番号31を含む。別の実施形態において、単離されたペプチドは、配列番号58の逆の配列を含むかまたは配列番号30を含む。
【0045】
一つの実施形態において、本発明の単離されたペプチドは、配列番号29のアミノ酸配列を持つペプチドであるか、あるいはそのペプチドを含むペプチドである。
【0046】
本発明のペプチドはまた、式「a1a2X1X2X3P」(配列番号59)を含む単離されたペプチドを提供し、ここでX1、X2、およびX3は配列番号56で定義されたとおりであり、かつa1は、K、I、R、H、O、L、V、A、およびGからなる群より選択されるか、または一つの実施形態においては、KおよびIからなる群より選択されるか、または一つの実施形態においてKであり、かつa2はS、P、R、T、H、K、O、L、V、A、G、S、およびIからなる群より選択され、または一つの実施形態において、S、P、およびRからなる群より選択されるか、または別の実施形態において、SおよびPからなる群より選択されるか、または別の実施形態においてはPである。一つの実施形態において、a1はアセチル化されておらず、あるいはa1がKの場合、Kはアセチル化されておらず、また配列番号2でもない。一つの実施形態において、単離されたペプチドは、配列番号1および47であるか、または配列番号59を含む10アミノ酸までのペプチドであるか、あるいはそれらを含むペプチドである。
【0047】
別の実施形態において、本発明の単離されたペプチドは、式「aX1X2X3Pb」(配列番号60)のペプチドであるか、あるいはそのペプチドを含むペプチドであり、ここでX1、X2、およびX3は配列番号56で定義されたとおりであり、かつここで「a」はS、R、K、H、O、T、I、L、V、A、Gからなる群より選択されるか、あるいは別の実施形態において、S、R、およびIからなる群より選択されるか、あるいは別の実施形態において、SおよびRからなる群より選択され、かつここで「b」はA、V、I、L、G、K、H、R、O、S、T、Fからなる群より選択されるか、あるいは別の実施形態においてはAである。別の実施形態において、配列番号60のペプチドは、配列番号3、12、および39であるか、あるいは配列番号60または配列番号3、12もしくは39を含む10アミノ酸までのペプチドである。
【0048】
本明細書で用いられる場合、「表1の配列のアミノ酸配列を含むペプチド」または「表1の配列のアミノ酸配列を含むペプチド」は、そのペプチドそのもの、そのペプチドの明白な化学的同等物、そのペプチドの異性体(例えば、それらの異性体、立体異性体、レトロ異性体、レトロインベルソ異性体、全ての−[D]異性体、全ての−[L]異性体、または混合された[L]異性体および[D]異性体)、そのペプチドの保存性の置換物、そのペプチドの前駆体形、そのペプチドのタンパク分子内プロセシング形(例えば、N末端もしくはC末端からの一つのアミノ酸の切断物または本発明のペプチドの免疫学的に活性な代謝産物)、そのペプチドの薬学的に受け入れられる塩およびエステル、および翻訳後修飾の結果生じる他の形であるペプチドを包含する。また包含されるものは、長さが10、9、8、7、6、5、および4アミノ酸まで、およびそれを含む、(環状化した、または直線状の、または中心となる親配列から分岐した)任意の親配列であり、そのうち指定された配列は部分配列である。表中におけるペプチドは三量体であるが、それが10、9、8、7、6、5、および4マーの部分配列であり得ることを、一方、もし表1に記載されたペプチドが六量体でも、それが10、9、8、および7マーの部分配列であり得るが、5マーでも4マーでもないことを、当業者は認める。加えて、本発明は、10マーより大きい配列(配列番号44および配列番号54)を含む。本発明のペプチドの免疫学的活性を保持する改変されたペプチドは、本発明の範囲内に含まれる。
【0049】
明細書でさらに用いられる場合、本発明のペプチドの「明白な化学的同等物」は、明細書で記述されたペプチドと同じ望ましい活性(例えば、明細書で記述されたペプチドと同じ免疫学的活性)を持ち、かつささいな化学的相違を示す分子であるか、あるいはマイルドな条件下で本発明のペプチドに転換される分子(例えば、本発明のペプチドのエステル、エーテル、還元産物、および複合体)である。
【0050】
加えて、明細書で用いられる場合、「保存性の置換」は、類似した極性または立体的配置を持つか、または置換された残基と同じクラス(例えば、疎水性、酸性、または塩基性)に属するかのどちらかであることにより、置換されたアミノ酸残基と機能上同等であるアミノ酸置換である。明細書で定義された用語「保存性の置換」は、本発明のペプチドの先天免疫増強能力への取るに足らない影響を持つ置換を包含する。保存性の置換の例は、極性(親水性)残基による別の残基の置換(例えば、アルギニン/リジン、グルタミン/アスパラギン、またはスレオニン/セリン)、非極性(疎水性)残基(例えば、イソロイシン、ロイシン、メチオニン、フェニルアラニン、チロシン、またはバリン)による別の残基の置換、酸性残基(例えば、アスパラギン酸またはグルタミン酸)による別の残基の置換、または塩基性残基(例えば、アルギニン、ヒスチジン、リジンまたはオルニチン)による別の残基の置換を含む。
【0051】
明細書で用いられる場合、用語「類似物」は、明細書で記述される配列に実質上同一のアミノ酸配列を持つ任意のペプチドであって、その少なくとも一つの残基が機能上類似の残基によって保存性の置換がされているペプチドを包含する。「類似物」は、60%またはそれより大きい(好ましくは、70%またはそれより大きい、80%またはそれより大きい、85%またはそれより大きい、90%またはそれより大きい、95%またはそれより大きい、または99%の)アミノ酸配列のホモロジーが、表1のアミノ酸配列とあり、そして表1のアミノ酸配列の機能上の変異体である。さらに明細書で用いられる場合、用語「機能上の変異体」は、明細書で記述されるように先天免疫を増強するか、またはDPPIV活性を減少させる能力を示すペプチドの活性を指す。「類似物」は、表1のアミノ酸と類似した三次元の立体配座を持つ、表1のアミノ酸の変異体を包含する。「類似物」は、明細書に記述されるとおりの類似物の任意の薬学的に受け入れられる塩をさらに含包含する。「変異体」は、明細書に記述されるとおりの変異体の任意の薬学的に受け入れられる塩をさらに包含する。
【0052】
「誘導体」は、明細書で用いられる場合、官能性の側基の反応により化学的に誘導された一つあるいはより多くのアミノ酸を持つ本発明のペプチドを指す。模範的な誘導された分子としては、遊離アミノ基が、アセチル基、アミン塩酸塩、カルボベンゾイル基、クロロアセチル基、ホルミル基、p−トルエンスルホニル基、またはt−ブチルオキシカルボニル基を付加することにより、塩またはアミドを形成するように誘導されたペプチド分子が挙げられるがこれらに限定されない。遊離ヒドロキシル基は、O−アシル誘導体またはO−アルキル誘導体を形成するように誘導され得る。さらに、遊離カルボキシル基は、塩、エステル(例えば、メチルエステルおよびエチルエステル)、またはヒドラジドを形成するように誘導され得る。従って、「誘導体」は、さらに、明細書に記述されるとおりの誘導体の薬学的に受け入れられる任意の塩を包含する。
【0053】
本発明の一つの実施形態において、本発明の単離されたペプチドは、改変されたC末端および/または改変されたN末端を持つ。例えば、単離されたペプチドは、アミド化されたC末端を持ち得る。例えば、アミノ末端は、アセチル化(Ac)され得るし、あるいはカルボキシ末端はアミド化(NH2)され得る。しかしながら、本発明の一つの実施形態において、仮にそのような改変が、望ましい免疫学的活性の消失を結果として生じる場合は、本発明のペプチドは、好ましくはアセチル化されない。アミノ末端の改変としては、メチル化(すなわち、−−NHCH3または−−NH(CH3)2)、アセチル化、カルボベンゾイル基(carbobenzoyl group)の付加、またはカルボキシレートの官能性を持つ(RCOO−−で定義され、ここでRはナフチル基、アクリジニル基、ステロイジル基、および類似の基からなる群より選択される)任意のブロッキング基でアミノ末端をブロックすることが挙げられる。カルボキシ末端の改変としては、遊離酸をカルボキサミド基で置き換えること、または構造的な制約を導入するためにカルボキシ末端で環状ラクタムを形成することが挙げられる。
【0054】
一つの実施形態において、骨格の置換(例えば、NCH3へのNHの置換)がされうる。単離されたペプチドはまた、表1のアミノ酸配列のペプチドの改変物(例えば、1挿入もしくは1欠失のような点変異、または先端の切断)でも、または表1のアミノ酸配列を含む改変物(例えば、挿入もしくは欠失のような点変異、または先端の切断)でもよい。例として、そのペプチドは、望ましい免疫学的活性が保持されさえすれば、Dアミノ酸の少なくとも一つの点挿入により改変される表1のアミノ酸配列を含み得る。特に、プロリン残基の環の大きさが5員から4員、6員、または7員に変えられたプロリン類似物が用いられうる。環状基は、飽和でも非飽和でもよく、そして非飽和の場合、芳香性でも非芳香性でもよい。
【0055】
20種類の遺伝的にコードされたアミノ酸(またはDアミノ酸)の天然に存在する側鎖を、類似の特性を持つ他の側鎖(例えば、アルキル、低級アルキル、環状4員アルキル、環状5員アルキル、環状6員アルキル、環状7員アルキル、アミド、アミド低級アルキル、アミドジ(低級アルキル)、低級アルコキシ、ヒドロキシ、カルボキシ、およびそれらの低級エステル誘導体)で、ならびに4員複素環、5員複素環、6員複素環、7員複素環で置き換えることができる。
【0056】
そのような置換は、以下のものを含み得るが必ずしもそれに限定はされない。(1)正に荷電した非標準アミノ酸(例えば、オルニチン、Dab(2,4−ジアミノ酪酸(それはオルニチンからメチレン基を一つ除いたようなもの(またはリジンからメチレン基を二つ除いたようなもの)である)、DprまたはDapa(2,3−ジアミノプロピオン酸(それはオルニチンからメチレン基を二つ除いたようなもの(またはリジンからメチレン基を三つ除いたようなもの、またはヒドロキシルのかわりにアミノ基を持つセリンのようなもの)である))、Nlys((N−(4−アミノブチル)−グリシンであり「N末端」に取り付けられたリジン側鎖およびグリシンのアミノ基に取り付けられたアミノプロピル基またはアミノエチル基を持つ化合物を持つ))(2)電荷を持たない、アルガニン様の非天然のアミノ酸。例えば、Cit(シトルリン)およびHci(メチレン基をもう一つ持つシトルリン)。(3)OHをもつ(例えば、セリンのように)、非標準の天然には存在しないアミノ酸(例えば、hSer(ホモセリン(メチレン基をもう一つ持つ))、Hyp(ヒドロキシプロリン)、Val(ベータOH)(ヒドロキシバリン)、Pen(ペニシラミン)(Val(ベータSH))。(4)プロリン誘導体(例えば、D−Pro。例えば、3,4−デヒドロプロリン、Pyr(ピログルタミン、環中にC=Oを持つプロリン)、環上にフッ素置換を持つプロリン、1,3−チアゾリジン−4−カルボン酸(環中にSを持つプロリン))。(5)ヒスチジン誘導体(例えば、Thi(ベータ−(2チエニル)−アラニン))。または(6)アルキル誘導体(例えば、Abu(2−アミノ酪酸(Cアルファ上にエチル基))、Nva(ノルバリン(Cアルファ上にプロピル基))、Nle(ノルロイシン(Cアルファ上にブチル基))、Hol(ホモロイシン(Cアルファ上にプロピル基))、Aib(アルファ−アミノイソ酪酸(メチレン基を持たないバリン))。それらの置換が親ペプチド/配列の免疫学的な活性を保持することを当業者は認める。
【0057】
別の代わりになる実施形態において、C末端カルボキシル基またはC末端エステルが、それぞれ、カルボキシル基の−−OHまたはカルボキシルエステルのエステル(−−OR)のN末端アミノ基による内部置換により環化して環状ペプチドを形成するよう誘導され得る。例えば、ペプチド酸を与える合成と切断後、遊離酸は、(例えば、塩化メチレン(CH2Cl2)、ジメチルホルムアミド(DMF)混合物中の)とけたジシクロヘキシルカルボジイミド(DCC)のような適切なカルボキシル基のアクチベーターにより、活性化されたエステルに変えられる。環状ペプチドが、その後、活性化されたエステルのN末端アミンによる内部置換により形成される。重合と対照的に、内部環化は、非常に希薄な溶液の使用により増進されうる。そのような方法は、当該分野で周知である。
【0058】
末端アミノ基または末端カルボキシル基が存在しないように、本発明のペプチドを環化するか、またはペプチド末端へデスアミノ残基を組み込むか、もしくはペプチド末端へデスカルボキシ残基を組み込むことによって、そのペプチドのプロテアーゼに対する感受性を減少させるか、またはそのペプチドの立体配座を制限することもまた可能である。本発明の化合物のC末端官能基としては、アミド、アミド低級アルキル、アミドジ(低級アルキル)、低級アルコキシ、ヒドロキシ、およびカルボキシ、ならびにそれらの低級エステル誘導体、ならびに薬学的に受け入れられるそれらの塩が挙げられる。
【0059】
また、N末端システインおよび/またはC末端システインを付加し、そしてジスルフィド結合または他の側鎖の相互作用を介してそのペプチドを環化することによってそのペプチドを環化し得る。
【0060】
末端アミノ基または末端カルボキシル基が存在しないように、デスアミノ残基またはデスカルボキシ残基をペプチドの末端に組み込んで、そのペプチドのプロテアーゼに対する感受性を減少させるかまたはそのペプチドの立体配座を制限することも可能である。
【0061】
(ペプチドの製造方法)
本発明は、ペプチドの類似物、誘導体、および変異体を含むペプチドであって、合成により生産されたか、組み換えにより生じたか、または天然の細胞から単離されたペプチドを企図する。本発明のペプチドは、当業者に周知の方法により合成され得る(例えば、Modern Techniques of Peptide and Amino Acid Analysis(New York:John Wiley & Sons,1981)、およびBodansky, M.,Principles of Peptide Synthesis(New York:Springer−Verlag N.Y.,Inc.,1984)に記述されたとおり)。本発明のペプチドの合成において用いられ得る方法の例は、固相ペプチド合成、溶液または液体法ペプチド合成、および任意の商業的に入手できるペプチド合成装置を用いた合成を含むが、しかしそれに限定はされない。一つの実施形態において、本発明のペプチドはインビトロで合成される(例えば、化学的な方法またはmRNAのインビトロトランスレーションにより)。別の実施形態において、本発明のペプチドは、従来技術およびペプチドをコードするcDNAを用いて、組み換えにより生産される。本発明のアミノ酸配列は、ペプチド配列の合成において用いられる当業者に周知のカップリング剤および保護基をさらに含み得る。
【0062】
本発明のペプチド類似物、誘導体、および変異体は、当業者に周知の、広い種類の異なる変異誘発技法により作られ得る。これらの技法は、任意の分子生物学実験室マニュアル(例えば、Sambrook et al.,Molecular Cloning−A
Laboratory Manual,2nd ed.(Plainview,NY:Cold Spring Harbor Press,1989)、またはAusubel et al., Current Protocols in Molecular
Biology(John Wiley & Sons)が挙げられる)において見いだされ得る。変異キットはまた、多くの商業的な分子生物学の供給者から入手できる。初めのアミノ酸配列において部位特異的変異誘発、領域特異的変異誘発、またはランダム変異誘発を行なう方法が入手できる。類似物、誘導体、および変異体が生産された後、それらは、明細書に記述されたように、先天免疫を増強する望ましい能力に関してスクリーニングされ得る。
【0063】
(ペプチドと反応性のある因子)
本発明は、表1のアミノ酸配列を含むペプチド、またはその類似物、誘導体、もしくは変異体を含むペプチドと反応性のある因子をさらに提供する。明細書で用いられる場合、「反応性の」は、本発明のペプチドに親和性があるか、結合するか、または指向する因子を意味する。さらに、明細書で用いられる場合、「因子」は、タンパク質、ポリペプチド、ペプチド、核酸(DNAまたはRNAが挙げられる)、天然には存在しない抗体、Fab断片、F(ab’)2断片、分子、化合物、抗生物質、薬物、およびそれらの任意の組み合わせを包含するものとする。Fab断片は、抗体の一価の抗原結合断片であり、パパイン消化により産生される。F(ab’)2断片は、抗体の二価の抗原結合断片であり、ペプシン消化により産生される。好ましくは、本発明の因子は、検出可能なマーカーまたは標識で標識される。天然に存在しない抗体は、二つのC末端グリシン残基およびMAPSのような、別の化合物と結合したペプチドを用いて生成される抗体を意味する。MAPS抗原は、本発明のペプチドに、そのペプチドのC末端に挿入された2個のグリシン残基を介して取り付けられる。その構築物はその後、ウサギのような動物に投与され得、そして、抗体は、当該分野で周知の手順を用いて収集され得る。
【0064】
本発明の一つの実施形態において、本発明のペプチドと反応性のある因子は、抗体である。明細書で用いられる場合、本発明の抗体は、ポリクローナルでもモノクローナルでもよい。加えて、本発明の抗体は、当業者には周知の技術により生産され得る。例えば、ポリクローナル抗体は、マウス、ウサギ、またはラットを本発明の精製されたペプチドで免疫することにより生産され得る。次に、モノクローナル抗体は、免疫した動物から脾臓を取り出し、脾臓細胞を骨髄腫細胞と融合させ、培養して増殖させた場合、モノクローナル抗体を産生するハイブリドーマを形成させることにより生産されうる。例えば、J.G.R.Hurrel,Monoclonal Hybridoma Antibodies:Techniques and Applications (Boco Raton, FL:CRC Press Inc.,1982)を参照のこと。
【0065】
本発明の抗体は、検出可能なマーカーまたは標識で標識され得る。抗体の標識は、ペルオキシダーゼ標識、当該分野で公知の化学発光標識、および当該分野で公知の放射性標識を含めた多様な標識技術のうちの一つを用いて実行され得る。本発明の検出可能なマーカーまたは標識は、例えば、非放射性マーカーまたは蛍光マーカー(例えば、ビオチン、フルオレセイン(FITC)、アクリジン、コレステロール、またはカルボキシ−X−ローダミン)であり得、それらは当該分野で容易に知られる蛍光イメージング技術または他のイメージング技術を用いて検出され得る。あるいは、検出可能なマーカーまたは標識は、例えば放射性同位体を含め、放射性マーカーでもよい。放射性同位体は、検出可能な放射線を放射する任意の同位体(例えば、35S、32P、125I、3H、または14C)でありうる。放射性同位体により放射される放射能は、当該分野で周知の技術により検出され得る。例えば、放射性同位体からのガンマ放射は、ガンマイメージング技術、特にシンチグラフィーイメージングを用いて検出され得る。好ましくは、本発明の因子は、検出可能なマーカーまたは標識で標識された高親和性抗体である。
【0066】
(単離された核酸分子)
加えて、本発明は、表1のアミノ酸配列を含むペプチドをコードする単離された核酸分子を、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド(結合ペプチド(例えば、キャリアペプチド構築物)を含む)をコードする単離された核酸分子を、または他のペプチドをコードする単離された核酸分子を、または免疫学的に活性な表1のペプチドへと代謝される、または切り離されるプロペプチドをコードする単離された核酸分子を提供する。遺伝コードの縮重により、本発明の核酸分子は、本発明のペプチドをまたコードする多数の核酸置換物を含む。本発明はさらに、表1のアミノ酸配列またはその類似物、誘導体、もしくは変異体をコードする単離された核酸分子にハイブリダイズする核酸を提供する。
【0067】
本発明の核酸分子は、DNAまたはRNAであり得る。それらは、当業者に公知の多様な技術により調製され得、それらの方法としては、商業的に入手可能なオリゴヌクレオチド合成装置(例えば、Applied Biosystems Model 392 DNA/RNA 合成装置)を用いたオリゴヌクレオチドの自動化された合成が挙げられるが、これに限定されるわけではない。加えて、本発明の核酸分子は、一つまたはそれより多い検出可能なマーカーまたは標識で標識され得る。核酸分子の標識は、当該分野で公知の多くの方法のうちの一つ(例えば、ニックトランスレーション、末端標識、フィルイン末端標識、ポリヌクレオチドキナーゼ変換反応、ランダムプライミング、または(リボプローブ(riboprobe)調製のための)SP6ポリメラーゼ)を、多様な標識(例えば、35S、32P、もしくは3Hのような放射性標識、またはビオチン、フルオレセイン(FITC)、アクリジン、コレステロール、もしくはカルボキシ−X−ローダミン(ROX)のような非放射性標識)のうちの一つとともに用いて実行され得る。
【0068】
本発明はまた、発現ベクターに作動可能に連結された本発明の核酸分子を含む組み換え核酸構築物を提供する。明細書で用いられる場合、「発現ベクター」は、適切な宿主においてそのDNAの発現をもたらす能力のある適切な調節配列に作動可能に連結されたDNA配列を含むDNA構築物である。例えば、ベクターは、プラスミド、ファージ粒子、または可能性のあるゲノム挿入物であり得る。さらに明細書で用いられる場合、用語「作動可能に連結された」は、二つのDNA領域間の機能上の関係を記述する。本発明における使用に適切な発現ベクターは、本発明のペプチドをコードする核酸分子に作動可能に連結された少なくとも一つの発現調節エレメント(例えば、オペレーター、プロモーター、lacシステム、リーダー配列、終結コドン、および/またはポリアデニル化シグナル)を含む。一つの実施形態において、その発現ベクターは、真核細胞において機能する真核細胞の発現ベクター(例えば、レトロウイルスベクター、ワクシニアウイルスベクター、アデノウイルスベクター、ヘルペスウイルスベクター、または鶏痘ウイルスベクター)である。
【0069】
いったん本発明の核酸分子に作動可能に連結されると、その発現ベクターは、核酸の移入に適切な任意のインビボまたはエキソビボの方法により、受容者細胞中に導入され得る。それらの方法としては、エレクトロポレーション、DEAEデキストラントランスフェクション、リン酸カルシウムトランスフェクション、リポフェクション、モノカチオンリポソーム融合、ポリカチオンリポソーム融合、プロトプラスト融合、インビボ電場の形成、DNA被覆微粒子銃、複製欠損組み換えウイルスの注入、相同組み換え、ウイルスベクター、むき出しのDNAの移入、またはそれらの任意の組み合わせが挙げられるが、これらに限定されるわけではない。核酸の移入に適切な組み換えウイルスベクターとしては、ウイルス(例えば、レトロウイルス、HSV、アデノウイルス、アデノ随伴ウイルス、セムリキ森林ウイルス(Semiliki Forest virus)、サイトメガロウイルス、およびワクシニアウイルス)のゲノム由来のベクターが挙げられるが、これらに限定されるわけではない。
【0070】
本発明はさらに、本発明の組み換え核酸構築物を含む少なくとも一つの宿主細胞を提供する。本発明の宿主細胞は、明細書に記述された核酸構築物で形質転換される。宿主細胞は、真核細胞(例えば、動物細胞、植物細胞、昆虫細胞、または酵母細胞)でも原核細胞(例えば、E.coli)でもよい。
【0071】
加えて、本発明は、表1のアミノ酸配列、またはその類似物、誘導体、もしくは変異体を含むペプチドを生産するための方法を提供する。その方法は次の工程を包含する:(a)そのペプチドの発現を許容する条件下で、明細書で記述されたとおりの組み換え核酸構築物を含む少なくとも一つの宿主細胞を培養すること;および(b)少なくとも一つの宿主細胞から、またはその培養培地からそのペプチドを回収すること。その組み換えペプチドは、粗溶解産物として回収されうる;その組み換えペプチドはまた、当該分野で公知の標準的なタンパク質精製手順(アフィニティクロマトグラフィーおよび免疫アフィニティクロマトグラフィー、ディファレンシャル沈澱、ゲル電気泳動、イオン交換クロマトグラフィー、等電点電気泳動、サイズ排除クロマトグラフィーなどが挙げられるが、それらに限定されるわけではない)により精製され得る。
【0072】
(薬学的組成物)
本発明はさらに、表1のアミノ酸配列、または配列番号1、配列番号3〜16、もしくは配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体(前述のいずれかの薬学的に受け入れられる塩、酸付加塩、もしくはエステルが挙げられる)を含むペプチドを、少なくとも一つの薬学的に受け入れられるキャリア、希釈剤、または賦形剤との組み合わせで含む薬学的な組成物を提供する。薬学的に受け入れられるキャリア、希釈剤または賦形剤は、組成物の他の成分と適合し、そしてその受容者に有害ではないという意味で「受け入れられる」でなければならない。受け入れられる薬学的キャリア、希釈剤、および賦形剤の例は、数ある中で、カルボキシメチルセルロース、結晶セルロース、グリセリン、アラビアゴム、ラクトース、ステアリン酸マグネシウム、メチルセルロース、粉剤、生理食塩水、アルギン酸ナトリウム、スクロース、でんぷん、タルク、および水が挙げられるが、それに限定されるものではい。明細書に記述されるように、本発明の薬学的な組成物の調合物は、単位投薬量で都合よく与えられ得る。
【0073】
(使用)
本発明のペプチドは、先天免疫の増強において治療上の有用性があることが示された。先天免疫の増強は、抗微生物活性の欠損(実施例2)ならびにインビボモデルにおける抗感染防御(実施例3および実施例4)により、そしてまた実施例5のDPPIVアッセイにより示される。従って、本発明はまた、被験体において感染を処置および/または予防するための方法を提供する。明細書で用いられる場合、「被験体」は、鳥類(例えば、ニワトリ、七面鳥等)または哺乳動物(例えば、ウシ、イヌ、ヒト、サル、マウス、ブタ、ラット等)である。一つの実施形態において、被験体はヒトである。被験体は、感染していてもよく、または感染のリスクを持っていてもよい。例として、感染は、微生物感染でありうる。本発明の方法により処置され得る微生物感染としては、細菌による感染、真菌による感染、寄生体による感染、およびウイルスによる感染が挙げられるが、それらに限定されるわけではない。
【0074】
ほとんどの細菌性病原体は、一般的な環境中に、または宿主の正常な細菌叢中に存在する。細菌は、コロニーを形成し、宿主の組織中に広まり、そして宿主の組織を侵略することを可能にする、異なる機構(毒性因子と呼ばれる)を獲得することによって、ひどい疾患をひきおこす能力を進化させた。これらの病原性因子が抑制される場合、細菌は、宿主組織中でもはやそれ自体を維持できず、そしてそれゆえ、疾患をひきおこすことができない。本発明の方法により処置され得る典型的な細菌としては、E.coli、Klebsiella pneumoniae、Pseudomonas aeruginosa、Salmonella spp.(例えば、Salmonella typhimurium)、Staphylococcus aureus、Streptococcus spp.、およびバンコマイシン耐性腸球菌が挙げられるが、それらに限定されるわけではない。
【0075】
Pseudomonas aeruginosaは、どこにでもいるグラム陰性細菌であり、環境の融通性、感受性のある個体において疾患をひきおこす能力、および抗生物質に対する耐性のために注目される。Pseudomonas aeruginosaは、融通のきく生物であり、土壌、沼地、および海岸に近い海の生息環境、ならびに植物上および動物組織中で増殖する。嚢胞性線維症の最も重大な合併症は、P. aeruginosaによる、気道感染である。免疫系欠損症を持つ特定の他の個体がかかるのと同様に、癌患者および熱傷患者もまた普通にこの生物体によるひどい感染にかかる。多くの環境中の細菌とは異なり、P. aeruginosaは、感受性の宿主において疾患をひきおこす顕著な能力を持つ。
【0076】
Staphylococcus aureusは、直径約1マイクロメートルのグラム陽性の球状の細菌であり、微視的な群で増殖する。S.aureusは、ヒトの最も重要な病原体の一つであり、心内膜炎から肺炎までの範囲の、市中感染および院内感染の両方をひきおこす。S.aureusは、一般的に細胞外病原体として分類されるが、最近のデータは、多様な型の宿主細胞(例えば、プロフェッショナル食細胞(professional phagocyte)および非食細胞(内皮細胞、線維芽細胞等が挙げられる)の両方)にS.aureusが感染する能力を示した。この侵入は、細胞表面へのS.aureusの付着によって開始され、それはブドウ球菌のフィブロネクチン結合タンパク質が重要な役割をはたすプロセスである。貪食されたS.aureusは、宿主細胞のアポトーシスを誘導するか、または細胞質中で数日間生存することが可能であり、このことは抗ブドウ球菌エフェクター機構の欠損によると考えられる。
【0077】
S.aureusは、鼻の通路、皮膚表面、粘膜、ならびに口、生殖器および直腸の周りの領域にコロニーを形成する。S.aureusは、表面の皮膚病巣(例えば、腫脹、麦粒腫、およびフルンケル)をひきおこし得る。よりひどい感染としては、肺炎、乳腺炎、静脈炎、髄膜炎、および尿路感染が挙げられ、根深い感染としては、骨髄炎および心内膜炎が挙げられる。
【0078】
本発明の方法により処置されうる典型的な真菌としては、糸状菌、酵母、および高等真菌が挙げられるが、それらに限定されるわけではない。全ての真菌は、真核細胞であり、そしてその細胞膜にステロールを持つが、ペプチドグリカンを持たない。真菌の感染、すなわち真菌症は、組織の関与の程度および宿主中への侵入の様式により分類される。免疫無防備状態の宿主において、多様な非病原性真菌、または通常は軽度の真菌が、致死的な可能性をもつ感染をひきおこし得る。
【0079】
寄生体は、他の生体(宿主として知られる)から、食物および保護を得ている生物である。寄生体は、動物からヒトへ、ヒトからヒトへ、またはヒトから動物へと伝えられ得る。いくつかの寄生体は、食品伝染疾患および水系感染性疾患の重要な原因として現れた。それらは、汚染された食物および水の消費により、または感染したヒトもしくは動物の便(糞便)と接触した物質の経口摂取により、宿主から宿主へと伝えられ得る。寄生体は、感染したヒトおよび動物宿主の組織および臓器中で生存および繁殖し、そしてしばしば糞便中に排出される。大きさにおいて異なる型(小さい単細胞の微視的な生物体(原生動物)から、顕微鏡を用いずに見ることができる、より大きな多細胞の蠕虫(腸内寄生虫)までの範囲にわたる)の寄生体がある。本発明の方法により処置され得る一般的な寄生体の例としては、Giardia duodenalis、Cryptosporidium
parvum、Cyclospora cayetanensis、およびToxoplasma gondiiが挙げられるが、それらに限定されるわけではない。
【0080】
真菌および細菌と異なり、ウイルスは、自由生活細胞の多くの特性を欠いている。一つのウイルス粒子は、固定的な構造であり、きわめて安定で、そしてその一部を変化させたりまたは置き換えたりすることができない。細胞と会合した場合にのみ、ウイルスは、複製し、そして生命のある系の特性のいくつかを獲得することができるようになる。ウイルスは、多数の疾患(例えば、感冒および咽頭炎(咽喉炎)のような上気道感染(URTI)が挙げられる)をひきおこす。本発明の方法により処置され得るウイルスの他の例としては、AIDS、鳥インフルエンザ、水痘、単純疱疹、感冒、胃腸炎(特に子供の)、伝染性単核球症、インフルエンザ、麻疹、ムンプス、咽頭炎、肺炎、風疹、SARS、および下気道感染(例えば、RSウイルス、すなわちRSV)に関係するウイルスが挙げられるが、それらに限定されるものではない。
【0081】
本発明者達は、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドが、感染の予防および/または処置において有効であることを、明細書で示した。従って、被験体における感染を処置および/または予防する本方法は、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列を含むペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドを、被験体に投与することを含む。本発明のペプチドを、感染の処置および/もしくは予防の有効性を増大させるため、ならびに/またはターゲティングの有効性を増大させるために、別の因子と結合させ得ること、または抗生物質(例えば、ペニシリン、メチシリン、またはバンコマイシン)のような別の因子との組み合わせで投与し得ることは、本発明の範囲にある。
【0082】
本発明の一つの実施形態において、本発明のペプチドは、表1のアミノ酸配列、もしくは配列番号1、配列番号3〜16、配列番号18〜60のアミノ酸配列のペプチド、またはそれらの類似物、誘導体、もしくは変異体を含むペプチド、またはそれらの明白な化学的同等物を含むペプチドを含む。別の実施形態において、本発明のペプチドは、被験体の先天免疫を調節し、それゆえ、被験体における感染を処置および/または予防する。先天免疫応答は、病原体との遭遇に対する最前線の反応である。先天免疫応答は、感染性疾患の発症を予防する多数の機構を含む。そのような機構の一つは、免疫エフェクター細胞のプライミングおよび動員を含む。
【0083】
一つの実施形態において、本発明のペプチドは、炎症を抑制すると同時に、先天免疫または先天免疫応答を増強しうる。
【0084】
別の実施形態において、本発明のペプチドが、DPPIV活性の調節因子であることが示された。本発明のペプチドは、DPPIV活性を減少させることが示された。それゆえ、本発明のペプチドは特定の免疫学的状態を処置するペプチドの投与から利益を得られうる被験体のスクリーニングにおいて有用である。そのスクリーニングは、DPPIV関連状態を有することが疑われるか、または知られている被験体からサンプルを採取し、このサンプルを本発明のペプチドおよびDPPIVの基質とともにインキュベートし、そしてDPPIV活性の減少に対するそのペプチドの効果を、対照との比較においてモニターすることを含む。ここで、活性の減少は、DPPIV関連状態を処置するための被験体へのペプチドの投与の可能性のある利益を示す。別の実施形態において、対照と比較しての、そのペプチドの存在下でのDPPIV活性の調節が、DPPIV関連状態を示し得る。それゆえ、本発明のペプチドを、DPPIV関連状態の診断において用いうる。別の局面において、本発明のペプチドは、DPPIV関連障害(例えば、HIV/AIDS、グレーヴズ病、癌(例えば、肺癌および大腸癌)、糖尿病、および自己免疫障害(例えば、関節リウマチおよび多発性硬化症))のような多くの免疫学的障害の処置において有用である。
【0085】
(投与)
本発明の方法に従って、明細書に記述されたとおりの本発明のペプチドは、被験体において感染を処置および/または予防するのに、ならびに、あるいはDPPIV関連状態を処置または予防するのに有効な量(例えば、治療上の有効量)で、被験体に直接投与され得る。同様に、明細書で記述されたペプチドは、被験体におけるそのペプチドの発現を許容する方法で、そして感染を処置および/または予防するのに有効な量で、そのペプチドをコードする核酸配列を被験体に投与することによって、被験体に間接的に投与され得る。
【0086】
さらに、本発明のペプチド、またはこれをコードする核酸分子が、被験体において感染を処置するのに有効な量で、被験体に投与され得る。明細書で用いられる場合、「感染を処置するのに有効な」の語句は、感染(細菌、真菌、寄生体、ウイルス等による)の結果生じる臨床的な障害または症状を、改善または最小化するのに有効であることを意味する。例えば、被験体が、微生物に感染した場合、微生物感染の処置に有効なペプチド(またはこれをコードする核酸)の量は、微生物感染の症状(例えば、頭痛、項硬直、食欲不振、悪心、嘔吐、下痢、腹部不快感、急性腎不全、複数の臓器への虚血性ダメージの症状発現の変化、発熱および血小板減少を含むが、それらに制限されるものではない)を改善または最小化し得る量である。被験体において、感染を処置するのに有効なペプチド(またはこれをコードする核酸)の量は、それぞれの症例の特定の要因(被験体の体重および被験体の状態の重大さを含む)に依存して変化する。ペプチド(またはこれをコードする核酸)の適切な量は、当業者により容易に決定され得る。同様に、DPPIV関連状態の処置に有効な量は、当業者に知られた多くの類似の要因に依存して変化し得る。
【0087】
同様に、本発明の方法において、本発明のペプチド、またはこれをコードする核酸分子はまた、被験体における感染を予防するのに有効な量で、感染を発症するリスクのある被験体に投与され得る。明細書で用いられる場合、「感染を予防するのに有効な」の語句は、感染(細菌、真菌、寄生体、ウイルス等による)に由来する臨床的な障害または症状の発症または症状発現を、妨げるかまたは予防するのに有効なものを包含する。被験体において感染を予防するのに有効な、ペプチド(またはこれをコードする核酸)の量は、個々の症例の特定の因子(被験体の性別、体重、および被験体の状態の重大さ、状態の性質、感染部位、および投与の方法が挙げられる)に依存して変化する。ペプチド(またはこれをコードする核酸)の適切な量は、当業者により容易に決定され得る。
【0088】
明細書で開示されるとおりの本発明のペプチド、またはこれをコードする核酸配列は、、ヒトまたは動物の被験体に、公知の手順により投与され得、その手順は経口投与、非経口投与(例えば、筋膜上投与、包内投与、皮内投与、皮膚の内側への投与、筋内投与、眼窩内投与、腹腔内投与、脊椎内投与、胸骨内投与、脈管内投与、静脈内投与、実質投与、または皮下投与)、経皮投与、鼻腔内投与、肺への投与(例えば、気管内投与により)、および浸透圧ポンプによる投与が挙げられるが、それらに限定されるわけではない。一つの実施形態において、投与の方法は、静脈内注射または皮下注射による非経口投与である。
【0089】
経口投与に関して、そのペプチド(またはこれをコードする核酸)の処方物は、カプセル、錠剤、粉末、顆粒、または懸濁剤もしくは液体として提供され得る。その処方物は、従来の添加剤(例えば、ラクトース、マンニトール、トウモロコシでんぷん、またはジャガイモでんぷん)を含み得る。その処方物はまた、結合剤(例えば、結晶セルロース、セルロース誘導体、アラビアゴム、トウモロコシでんぷん、またはゼラチン)を与えられ得る。加えて、その処方物は、崩壊剤(例えば、トウモロコシでんぷん、ジャガイモでんぷん、またはカルボキシメチルセルロースナトリウム)を与えられ得る。その処方物はさらに、二塩基性無水リン酸水素カルシウムまたはでんぷんグリコール酸ナトリウムを与えられ得る。最後に、その処方物は、滑沢剤(例えば、タルクまたはステアリン酸マグネシウム)を与えられ得る。
【0090】
非経口投与に関して、そのペプチド(または、これをコードする核酸)は、好ましくは被験体の血液と等張の滅菌水性溶液と組み合わせられ得る。そのような処方物は、固体の活性成分を水(この水は生理的に適合性のある物質(例えば、塩化ナトリウム、グリシンなど)を含み、かつ生理的条件に適合する緩衝されたpHを持っている)中に溶解して水性溶液を得て、その後、この溶液を滅菌することによって調製され得る。その処方物は、一個でまたは複数投与量の容器(例えば、密封されたアンプルまたは小瓶)で提供され得る。その処方物はまた、明細書で記述されたもの任意のものを含め、任意の注入方法により送達され得る。
【0091】
経皮投与に関して、そのペプチド(またはこれをコードする核酸)は、皮膚浸透エンハンサー(例えば、プロピレングリコール、ポリエチレングリコール、イソプロパノール、エタノール、オレイン酸、N−メチルピロリドンなど)と組み合わされ得る。皮膚浸透エンハンサーはペプチドまたは核酸に対する皮膚の透過性を増大させ、そしてペプチドまたは核酸が皮膚をとおって浸透して血流中へ入り込むのを許容する。エンハンサーおよびペプチドまたは核酸の組成物はまた、高分子の物質(例えば、エチルセルロース、ヒドロキシプロピルセルロース、エチレン/酢酸ビニル、ポリビニルピロリドンなど)とさらに組み合わせてゲル状の組成物を提供することが可能であり、これは、塩化メチレンのような溶媒に溶解され、望ましい粘度まで蒸発、そしてその後裏張り材料に適用されてパッチが提供されうる。そのペプチドまたは核酸は、感染が位置し得る被験体部位またはその近くに、経皮的に投与され得る。あるいは、そのペプチドまたは核酸は、全身性の投与を達成するために、感染領域とは別の部位に経皮的に投与され得る。
【0092】
鼻腔内投与(例えば、鼻内噴霧)および/または肺への投与(吸入による投与)に関して、ペプチドまたは核酸の処方物(エアゾール処方物が挙げられる)は、当業者に周知の手順によって調製され得る。エアゾール処方物は、固体粒子または溶液(水性または非水性)のどちらをも含み得る。ネブライザ(例えば、ジェットネブライザ、超音波ネブライザ等)およびアトマイザが、溶液(例えば、エタノールのような溶媒を用いる)からエアゾールを作るのに用いられ得る。定量吸入器および乾燥粉末吸入器が、小粒子エアゾールを発生させるために用いられうる。エアゾール粒子の望ましい大きさは、当該分野で公知の多くの方法(ジェット−ミリング、噴霧乾燥、および臨界点凝縮が挙げられるが、それらに限定されるわけではない)の任意の一つを用いることにより獲得され得る。
【0093】
鼻腔内投与のための薬学的な組成物は、固体処方物(例えば、粗い粉末)でよく、そして賦形剤(例えば、ラクトース)を含み得る。固体処方物は、鼻腔をとおしての迅速な吸入を用いて、鼻まで持ち上げられた粉末容器から投与され得る。鼻腔内投与のための組成物はまた、鼻内噴霧または点鼻薬の水性または油性の溶液を含み得る。噴霧器での使用については、そのペプチドまたは核酸の処方物は、水性溶液およびさらなる因子(例えば、賦形剤、緩衝剤、等浸透圧剤、保存剤、または界面活性剤が挙げられる)を含み得る。鼻内噴霧は、例えば、そのペプチドまたは核酸の懸濁物または溶液を、圧力下でノズルをとおして出すことにより作られ得る。
【0094】
肺への投与のためのそのペプチドまたは核酸の処方物は、吸入デバイスによる送達のために適切な形態で提供されてもよく、そして肺または洞の下気道に到達するために有効な粒子の大きさを持ち得る。肺粘膜を含む粘膜表面をとおしての吸収に関しては、本発明の処方物は、エマルジョン(例えば、生物活性のあるペプチド、複数個のサブミクロンの粒子、粘膜付着性の巨大分子、および/または水性の連続した層を含む)を含み得る。粘膜表面をとおしての吸収は、そのエマルジョン粒子の粘膜付着をとおして達成され得る。
【0095】
定量吸入器デバイスを用いる使用のための薬学的組成物は、非水性媒体中の懸濁物としてそのペプチドまたは核酸を含む細かく分割した粉末を含み得る。例えば、そのペプチドまたは核酸は、界面活性剤(例えば、トリオレイン酸ソルビタン、ダイズレシチン、またはオレイン酸)の助けでプロペラント中に懸濁され得る。定量吸入器は、典型的には、混合物(例えば、液化された圧縮ガスとして)として、容器(例えば、キャニスター)中に貯蔵されたプロペラントガス(例えば、クロロフルオロカーボン、ヒドロクロロフルオロカーボン、ヒドロフルオロカーボン、または炭化水素)を用いる。吸入器は、吸息中の作動を必要とする。例えば、定量バルブの作動が、その混合物をエアゾールとして放出させ得る。乾燥粉末吸入器は、混合粉末の吸息作動を用いる。
【0096】
本発明のペプチドまたは核酸はまた、浸透圧ミニポンプまたは他の時限放出(timed−release)デバイスから放出または送達され得る。基本浸透圧ミニポンプからの放出速度は、放出開口部に配置された、微孔性の高速反応ゲル(fast−response gel)で調節され得る。浸透圧ミニポンプは、そのペプチドまたは核酸の放出を調節するうえで、またはその送達を標的化するうえで有用である。
【0097】
明細書で記述された方法に従って、本発明のペプチドは、被験体にペプチドそのものを導入することにより、またはそのペプチドをコードする核酸を、そのペプチドの発現を許容する方法で被験体に導入することにより、被験体に投与され得る。従って、本発明の一つの実施形態において、被験体における感染は、ある量の本発明のペプチドを被験体に投与することにより処置または予防され得る。本発明のさらなる実施形態において、被験体における感染は、被験体においてそのペプチドの発現を許容する方法で本発明のペプチドをコードする核酸配列を被験体に投与することにより、処置または予防され得る。
【0098】
本発明のペプチドは、タンパク質および他の薬の導入に用いられる公知の方法(例えば、注射および輸液)により、被験体に投与または導入され得る。感染が、被験体の身体の特定の部分に限局されている場合、治療のためのペプチドをその領域に、注射またはなにか別の手段(例えば、そのペプチドを血液または別の体液中に導入することにより)により、直接導入することが望まれ得る。ペプチドの用いられる量は、先に定義したように、被験体において感染を処置および/または予防するのに有効な量であり、当業者によって容易に決定され得る。
【0099】
本発明の方法において、そのペプチドはまた、そのペプチドの発現を許容する方法で、そのペプチドをコードする核酸を被験体の十分な数の細胞に導入することにより、被験体に投与または導入され得る。治療のためのペプチドをコードする核酸の量は、先に定義したように、被験体において感染を処置および/または予防するのに有効な量のペプチドを生産する量である。この量は、当業者によって容易に決定され得る。
【0100】
本発明のペプチドをコードする核酸は、当該分野で公知の従来の手順(エレクトロポレーション、DEAEデキストラントランスフェクション、リン酸カルシウムトランスフェクション、リポフェクション、モノカチオンリポソーム融合、ポリカチオンリポソーム融合、プロトプラスト融合、インビボ電場の形成、DNA被覆微粒子銃、複製欠損組み換えウイルスの注入、相同組み換え、インビボ遺伝子治療、エキソビボ遺伝子治療、ウイルスベクター、むき出しのDNAの移入、またはそれらの任意の組み合わせが挙げられるが、それらに限定されるわけではない)を用いて、被験体に導入され得る。遺伝子治療に適切な組み換えウイルスベクターは、ウイルス(例えば、レトロウイルス、HSV、アデノウイルス、アデノ随伴ウイルス、セムリキ森林ウイルス(Semiliki Forest
virus)、サイトメガロウイルス、およびワクシニアウイルス)のゲノム由来のベクターが挙げられるが、それらに限定されるわけではない。
【0101】
本発明のペプチドをコードする核酸が、細胞における治療のためのペプチドの発現を成し遂げるために、従来の手順を用いて、適切な細胞にインビトロで導入され得ることもまた、本発明の範囲の中にある。そのペプチドを発現している細胞は、その後、インビボで感染を処置および/または予防するために被験体中に導入され得る。そのような、エキソビボ遺伝子治療の取り組みにおいて、その細胞は好ましくは被験体から取り出され、治療のためのペプチドをコードする核酸を組み込むDNA技術の対象とされ、そしてその後、被験体中に再導入される。
【0102】
本発明のペプチド、またはこれをコードする核酸を含む処方物が、薬学的に受け入れられるキャリア、希釈剤、または賦形剤と、さらに混在させてもよく、したがって、薬学的な組成物を構成することもまた本発明の範囲の中にある。本発明の薬学的な組成物ならびに典型的なキャリア、希釈剤、および賦形剤は、先に記述される。
【0103】
本発明の処方物は、薬学分野で周知の方法により調製され得る。例えば、本発明のペプチド、またはこれをコードする核酸は、懸濁物または溶液として、キャリア、希釈剤、または賦形剤と混在させられ得る。一つまたはそれより多い補助成分(例えば、緩衝剤、矯味矯臭剤、界面活性剤など)もまた、随意に、加えられ得る。キャリアの選択は、投与の経路に依存する。感染を処置および/または予防するため、本発明のペプチド、またはこれをコードする核酸分子を被験体に投与するうえで、その薬学的な組成物は有用である。そのペプチドまたは核酸は、薬学的な組成物が投与される被験体において、感染を処置および/または予防するのに有効な量で提供される。この量は、先に記述されたように、当業者により容易に決定され得る。
【0104】
(診断およびスクリーニングアッセイ)
本発明は、先天免疫状態、またはDPPIV関連状態を有することが疑われる被験体を診断するための方法、被験体が本発明のペプチド(例えば、表1に列挙されたペプチド、またはその類似物、誘導体、もしくは変異体)による処置に反応するか否かを予想するための方法、および本発明のペプチドの免疫学的な影響を調節(例えば、増強、阻害または模倣)する因子についてスクリーニングするための方法を提供する。別の実施形態において、本発明は、本発明のペプチドの免疫学的に活性な類似物、誘導体および変異体、または表1に列挙されたペプチドまたは免疫学的に活性なそれらの改変物についてスクリーニングするための方法を提供する。
【0105】
一つの実施形態において、免疫学的な障害(例えば先天免疫関連状態)を持つ患者が、本発明のペプチドによる処置に反応するか予想するための方法は、被験体から生物学的サンプルを獲得すること、本発明のペプチドをこのサンプルに投与すること、ならびに、その状態を示す、予め決定されたマーカー(例えば、DPPIV関連状態に関してはDPPIV、感染に関しては炎症バイオマーカー、細胞生存率または細菌量)のレベルを、正の対照および/または負の対照との比較においてモニターすることを含む。その正の対照は、公知の免疫学的状態の被験体由来のサンプルでもよい。負の対照は、そのペプチドを投与されていない同じ被験体由来のサンプルでもよい。もしそのペプチドが、対照と比べて、その活性、マーカーのレベル、または細胞生存率を調節するなら、その被験体はそのような免疫学的な障害を持つ可能性があり、そしてそのペプチドでの処置から利益をうけ得る。
【0106】
さらにとりわけ、本発明の一つの局面において、もし被験体がDPPIV関連状態を有するか、またはその疑いがあるならば、その状態についてのマーカーとしてDPPIV活性をモニターすることは適切である。一つの局面において、対照と比較してのDPPIV活性の減少は、その被験体が、そのペプチドでの処置に反応することを示す。あるいは、仮に被験体が感染を有するかまたは感染を有する疑いがある場合、その患者からサンプルを獲得し、そのペプチドの投与後に患者からのサンプルと比較して病原体量または細胞生存率についてそのサンプルをモニターする(ここで、そのペプチドの投与後の患者において病原体量がより低いか、または細胞生存率がより高いことは、その被験体が、ペプチド処置から利益を得るか、あるいは免疫学的な障害を持っていることを示す)。
【0107】
別の実施形態において、ペプチドまたは表1のペプチドの改変物または他の因子が、本発明のペプチドと同じ免疫学的な活性を持つか知りたい場合、サンプル(因子に感染したマウスまたは既知のDPPIV関連状態に感染したマウスのいずれか由来)に対して公知の調節作用をもつ参照ペプチドと比較したDPPIV活性へのそのペプチドの影響をモニターしてもよく、あるいは、予防をモニターしたい場合は、サンプルにそのペプチドまたは因子を投与し、この感染またはDPPIV関連状態をこのサンプル中で誘導し、そしてその後、この感染もしくはDPPIV関連状態の発症、または免疫応答を、そのペプチドが調節または阻害するかモニターしうる。このサンプルは動物モデルでよく、DPPIV関連状態または感染の誘導は、倫理指針に従って、認められた動物モデルにおいて実施され、そしてその後、その動物またはその動物の適切な生物学的サンプルが、そのペプチドの影響についてスクリーニングされる。
【0108】
本発明はさらに、被験体が、微生物感染に対する処置に反応するか否かを予想するための方法を提供し、その処置は、表1のアミノ酸配列を含むペプチドまたはその類似物、誘導体もしくは変異体を含むペプチドを被験体へ投与することを含む。その方法は、一つまたはそれより多い数のバイオマーカー(例えば、炎症バイオマーカー)について、被験体の診断サンプルをアッセイすることを含み、少なくとも一つのバイオマーカー(例えば、炎症バイオマーカー)の存在は、その被験体がその処置に対して反応することを示す。
【0109】
明細書で用いられる場合、「バイオマーカー」または「マーカー」は、その状態(例えば、免疫状態、感染、炎症状態、DPPIV関連状態、先天免疫状態)に関係することが知られているか、または認識されている任意の適切なバイオマーカーであり、そして遺伝子から得られる任意の分子(例えば、遺伝子の転写物)、遺伝子から得られたセンス(コーディング)プローブ配列もしくはアンチセンス(ノンコーディング)プローブ配列、または遺伝子の部分長もしくは完全長の翻訳産物、またはそれらに対する抗体を含み、それらは、免疫応答、先天免疫応答、炎症および/またはDPPIV関連状態と関連する状態、障害、または疾患をモニターするために用いられうる。
【0110】
本発明の方法により、被験体の診断サンプルがインビトロまたはインビボでアッセイされ得る。そのアッセイが、インビトロで実行される場合、被験体由来の診断サンプルは、標準的な手順により取り出され得る。診断サンプルは、組織(任意の筋肉組織、皮膚組織、または軟組織が挙げられる)であってよく、それらは標準的なバイオプシーにより取り出され得る。加えて、診断サンプルは、体液であってよく、血液、唾液、血清、または尿が挙げられる。被験体または患者は、微生物感染もしくは他の免疫学的な障害(例えば、DPPIV関連状態)を有することが知られていてもよく、微生物感染もしくは他の免疫学的な状態(例えば、先天免疫状態もしくはDPPIV関連状態)が疑われていてもよく、または微生物感染もしくは他の免疫学的な状態(例えば、先天免疫状態もしくはDPPIV関連状態)ではないと信じられていてもよい。
【0111】
本発明の方法に従って、被験体の診断サンプルは、一つまたはそれより多い望ましいマーカーの発現についてアッセイされ得る。明細書で用いられる場合、「発現」は、炎症マーカー遺伝子の少なくとも一つのmRNA転写物への転写、または少なくとも一つのmRNAのマーカータンパク質への翻訳を意味する。従って、診断サンプルは、マーカータンパク質、マーカーcDNA、またはマーカーmRNAについてアッセイすることにより、マーカー発現に関してアッセイされ得る。マーカーの適切な形は、明細書で討議した特定の技術に基づき明白である。
【0112】
アッセイされるタンパク質は、被験体または患者の診断サンプルから、当該分野で公知の標準的な方法を用いて単離および精製され得る。その方法は、組織からの抽出(例えば、タンパク質を可溶化する洗浄剤を用いる)(必要な場合、カラムでのアフィニティー精製、クロマトグラフィー(例えば、FPLCおよびHPLC)、免疫沈降(目的の炎症マーカーに対する抗体を用いる)、および沈殿(例えば、イソプロパノールおよびTrizolのような試薬を用いる)が後に続く)が挙げられるが、それらに限定されるわけではない。そのタンパク質の単離と精製には、電気泳動(例えば、SDSポリアクリルアミドゲルでの)があとに続き得る。診断サンプルは、いずれかの形または全ての形のマーカータンパク質(前駆体、末端タンパク質分解でプロセシングされた形、および翻訳後修飾の結果として得られる他の形が挙げられる)の発現についてアッセイされ得ると考えられる。核酸は、診断サンプルから、当業者に公知の標準的な技術を用いて単離され得る。
【0113】
本発明の方法に従って、当該分野から容易に決定されるアッセイおよび検出方法(例えば、免疫学的な技術、ハイブリダイゼーション分析、蛍光イメージング技術、および/または放射線検出)、ならびに明細書で開示された任意のアッセイおよび検出方法(例えば、免疫沈降、ウエスタンブロット分析等)を用いて、被験体の診断サンプルはマーカーの発現についてアッセイされ得、そしてマーカーの発現は診断サンプル中で検出され得る。例えば、被験体の診断サンプルは、炎症マーカーと反応性のある因子を用いて、マーカーの発現についてアッセイされ得る。明細書で用いられる場合、「反応性の」は、その因子が、そのマーカーに親和性をもつ、そのマーカーに結合する、またはそのマーカーを指向することを意味する。さらに、明細書で用いられる場合、「因子」は、タンパク質、ポリペプチド、ペプチド、核酸(DNAまたはRNAが挙げられる)、抗体、Fab断片、F(ab’)2断片、分子、化合物、抗生物質、薬物、およびそれらの任意の組み合わせを包含するものとする。好ましくは、本発明のその因子は、明細書に記述された技術に従って、検出可能なマーカーまたは標識で標識される。本発明の一つの実施形態において、マーカーと反応性のある因子は抗体である。
【0114】
本発明のその因子が、望ましいマーカーと反応性のある抗体である場合、被験体から取り出される診断サンプルは、アフィニティーカラムを通すことにより精製され得るが、そのカラムは、そのマーカーに対する抗体を含み、その抗体はリガンドとして固体支持体(例えば、ビーズ、ゲル、またはプレートの形態における不溶性有機ポリマー)に取り付けられている。固体支持体に取り付けられたその抗体は、カラムの形態において用いられ得る。適切な固体支持体の例は、アガロース、セルロース、デキストラン、ポリアクリルアミド、ポリスチレン、セファロース、および他の不溶性有機ポリマーが挙げられるが、それらに限定されるわけではない。そのマーカーに対する抗体はさらに、望まれるなら、スペーサー分子を介して、固体支持体に取り付けられ得る。その因子およびその抗体の結合を保障するための適切な結合条件(例えば、温度、pH、および塩濃度)は、当業者により容易に決定され得る。好ましい実施形態において、そのマーカーに対するその抗体は、Sepharose 4Bのようなセファロースカラムに取り付けられる。
【0115】
加えて、その因子が抗体であるとき、被験体の診断サンプルは、標準的な免疫学的検出技術に沿って、そのマーカーと反応性のある一つまたはそれより多い抗体を利用する結合調査を用い、免疫学的なマーカーの発現についてアッセイされ得る。例えば、アフィニティーカラムから溶出されたそのマーカータンパク質は、ELISAアッセイ、ウエスタンブロット分析、フローサイトメトリー、または抗原抗体相互作用を用いる任意の他の免疫染色法に供され得る。好ましくは、その診断サンプルは、ウエスタンブロッティングを用いてマーカーの発現についてアッセイされる。
【0116】
あるいは、被験体の診断サンプルは、被験体から取り出した診断サンプルより抽出された核酸のハイブリダイゼーション分析を用いて、マーカーの発現についてアッセイされ得る。本発明のこの方法に従って、そのハイブリダイゼーション分析は、mRNAのノーザンブロット分析を用いて行われ得る。この方法は、そのマーカーをコードする核酸にハイブリダイズする、一つまたはそれより多い核酸プローブを用いてのDNAのサザンブロット分析を行うことによってもまた行われ得る。その核酸プローブは、当業者に公知の多様な技術により調製され得、この技術としては以下が挙げられるが、それらに限定されるものではない:マーカー核酸の制限酵素消化;およびApplied Biosystems Model 392 DNA/RNA 合成装置のような商業的に入手可能なオリゴヌクレオチド合成装置を用いる、マーカー核酸のヌクレオチド配列の選択された部分に対応する配列をもつオリゴヌクレオチドの自動化された合成。
【0117】
本発明において用いられる核酸プローブは、DNAでもRNAでもよく、そして、長さは約8ヌクレオチドから炎症マーカー核酸の全長まで変化し得る。加えて、本発明の核酸プローブは、一つまたはそれより多い数の検出可能なマーカーまたは標識で標識され得る。核酸プローブの標識は、明細書で記述された方法の任意のものを含め、当該分野で知られた多くの方法のうちの一つを用いて達成され得る。マーカー核酸の異なる領域または重なり合う領域に対応する、二つまたはそれより多い核酸プローブ(またはプライマー)の組み合わせもまた、マーカー発現についての診断サンプルのアッセイ(例えばPCRまたはRT−PCRを用いる)に用いられ得る。
【0118】
本発明の方法におけるマーカー発現の検出には、被験体の診断サンプル中のマーカー発現の程度を測定または定量するアッセイが続き得る。そのようなアッセイは、当業者には周知であり、そして、免疫組織化学/免疫細胞化学、フローサイトメトリー、質量分析、ウエスタンブロット分析、またはマーカータンパク質の量を測定するためのELISAを含み得る。例えば、免疫組織化学アッセイを用いるには、組織の組織学的(パラフィン包埋)切片が、スライド上に載せられ、そしてその後、マーカーに対する抗体とともにインキュベートされ得る。そのスライドは、それから、(一次抗体に対する)二次抗体、(これは色素または熱量測定系(例えば、蛍光色素、放射活性因子、または高電子走査容量をもつ因子)で標識されている)とともにインキュベートされて、その切片中に存在するそのマーカーが可視化されうる。
【0119】
本発明は、以下の実施例において詳述され、それらの実施例は本発明の理解を助けるために示されており、そしてその後に続く請求の範囲において定義される本発明の範囲をいずれにせよ制限するとは解釈されるべきではない。
【実施例】
【0120】
(実施例1−ペプチド合成)
表1におけるペプチドを、固相ペプチド合成技術を用いて合成した。
【0121】
Fmocで保護された、全ての必要とされたアミノ酸を、1ミリモルの望ましいペプチドに対して3倍のモル過剰量の重さで量りとった。そのアミノ酸を、次に、ジメチルホルムアミド(Dimethylformaide)(DMF)(7.5ml)に溶解し、3mMの溶液を作製した。適切な量のリンクアミドMBHAレジン(Rink amide
MBHA resin)を、そのレジンの置換を考慮した重さで量りとった。そのレジンを、次に、自動合成装置の反応容器中に移し、そして、ジクロロメタン(DCM)で15分間、前浸漬した。
【0122】
そのレジンを、DMF(30ml)中の25%ピペリジンをそのレジンに加え、そして20分間混合することにより、脱保護した。そのレジンの脱保護後、その3mMのアミノ酸溶液を4mMの2−(1H−ベンゾトリアゾール−1−イル)−1,1,3,3−テトラメチルウロニウムヘキサフルオロホスフェート(2−(1H−benzitriazole−1−yl)−1,1,3,3−tetramethyluronium hexafluorophosphate)(HBTU)および8mMのN,N−ジイソプロピルエチルアミン(DIEPA)と混合することにより、最初の連結を生じさせた。その溶液を、そのレジンに加える前に5分間にわたって前活性化させた。そのアミノ酸を、45分間にわたって連結させた。
【0123】
連結後、そのレジンを、DMFおよびジメチルアセトアミド(DMA)で入念にリンスした。その取り付けられた、Fmocで保護されたアミノ酸を、前述した同じ方法で脱保護し、そして、次のアミノ酸を、同じ連結のスキームAA:HBTU:DIEPAを用いて取り付けた。
【0124】
その合成の完了後、そのペプチドを、97.5%のトリフルオロ酢酸(TFA)および2.5%の水を含有する切断用カクテルを使用することで、そのレジンから切り離した。そのレジンを、その切断用カクテル中に1と2分の1時間にわたって懸濁した。その溶液を、次に、ブーフナー漏斗を用いて重力により濾過し、そして、その濾過液を、50mlの遠心分離用チューブに集めた。そのペプチドを、冷却したジエチルエーテルで沈殿させることにより単離した。遠心分離およびジエチルエーテルのデカンテーション後、その粗精製ペプチドを、ジエチルエーテルでもう一度洗浄した後、吸引乾燥機中で2時間乾燥させた。そのペプチドを、次に、脱イオン水(10ml)中に溶解し、−80℃で凍結させ、そして凍結乾燥した。その乾燥ペプチドは、HPLC精製に用いることができた。
【0125】
これらのペプチドの親水性の性質によって、ジエチルエーテルによるペプチドの単離は機能しなかった。それゆえに、クロロホルム抽出を必要とした。そのTFAを蒸発させ、そして、得られたペプチド残基を、10%酢酸(15ml)中に溶解した。不純物およびスカベンジャーを、その酢酸ペプチド溶液から、その溶液をクロロホルム(30ml)で二回洗浄することにより、除去した。その水性ペプチド溶液を、次に、−80℃で凍結させ、そして、凍結乾燥させることで、HPLC精製の準備ができた、粉末にしたペプチドを結果として得た。
【0126】
配列番号33および配列番号34のペプチドは、それぞれが一つのN−メチルアミノ酸を含有した。そのN−メチルアミノ酸、PyBrop、およびN−ヒドロキシベンゾトリアゾール*H2O(HOBt)、ならびにDIEPA溶液を、そのレジンを含有する、そのRV中で一緒に合わせることにより、この連結を実行した。45分間連結させた後、そのN−メチルアミノ酸を次に、もう一度連結させて、完全な連結を確実にした。N−メチルアミノ酸に続く連結が、十分に完全ではないことが観察された。それゆえに、この連結を、N,N,N’,N’−テトラメチル−O−(7−アザベンゾトリアゾール−1−イル)ウロニウムヘキサフルオロホスフェート(HATU)をHBTUの代わりに用いて、実行した。これによって、なお、合計で全純度の30〜40%になる二つの不純物を典型的に含有する、粗精製ペプチドを生じた。そのペプチドを、改変したHPLC条件下で精製し、接近して溶出する不純物から離れた、純粋なペプチドのピークを単離した。
【0127】
(実施例2−非抗微生物活性)
細菌(S.aureus 25923)を、ペプチド(200μM)、ベヒクル(トリス(Tris))、または抗生物質(エリスロマイシン;120μg/ml)を含有するウエル中に播種した。その細菌を、2時間増殖させた。その後、細菌の生存率を、WST−1比色生存率試験(カタログ番号1644807;Roche Diagnostics)を利用して決定した。DMEMおよびDMEM+WST−1を、バックグラウンドの対照として含めた。図1Aおよび図1Bに示したように、配列番号5および配列番号47のペプチドが、抗生物質の対照と比較して、活性の欠如を明白に示した。
【0128】
(実施例3−生体内での防御)
マウスを、腹腔内(IP)注射によりS.aureus 25923で感染させた。四時間後、配列番号1、4、5、6、45、および47のペプチドを、配列番号1に関しては12mg/kgおよび24mg/kgで(図2Aおよび図2B)、配列番号5に関しては9.6mg/kgで(図2C)、配列番号47に関しては13mg/kgで(図2D)、配列番号4に関しては12mg/kgで(図2E)、配列番号6に関しては9mg/kgで(図2F)、そして、配列番号45に関しては13mg/kgで(図2G)、IP注射により投与した。感染の24時間後、生存している動物を殺し、そして、腹腔内洗浄液をプレートにまき、ペプチド処置の有無における残存細菌数(1ml当たりのコロニー形成ユニット数(CFU/ml))を決定した。
【0129】
死亡動物は、本研究におけるあらゆる動物において最も高い細菌数が割り当てられた。配列番号1、4、5、6、45、および47のペプチドは、図2A〜2Gに示したように、対照と比較して、防御をあきらかに示した。
【0130】
(実施例4−予防的な生体内での防御)
感染24時間前に、ペプチドを、12mg/kg(配列番号1、図3A)および11.5mg/kg(配列番号5、図3B)で、IP注射により、投与した。マウスを、その後、IP注射によりS.aureus 25923に感染させた。感染の24時間後、生存している動物を殺し、そして、腹腔内洗浄液をプレートにまき、ペプチド処置の有無における残存細菌数(1ml当たりのコロニー形成ユニット数(CFU/ml))を決定した。
【0131】
死亡動物は、本研究におけるあらゆる動物において最も高い細菌数が割り当てられた。配列番号1および配列番号5のペプチドが、防御をあきらかに示した(死亡マウス2匹(対照)に対して、死亡マウス0匹(ペプチド処置))。図3Aおよび図3Bを参照のこと。
【0132】
以下に述べるのは、実施例1〜4の実験に関して発明者らにより得られた結果である:
発明者らは、表1で示したペプチドのアミノ酸配列を持つか、あるいは本発明の一部としてここに述べたとおりのペプチドが先天免疫を増強し得ることを示した。特に、配列番号1、4、5、6、45、および47のペプチドは、生体内のモデル(図2および実施例3;図3および実施例4)において示したように、感染を予防する能力および防御する能力を有していた。しかしながら、配列番号5および配列番号47のペプチドは、実施例1および図1において示したように、抗微生物活性を欠いていた。それゆえに、配列番号5および/または配列番号47のペプチドによる先天免疫の調節は、これらのペプチドが感染性疾患の処置のための治療剤として用いられ得ることを示す。
【0133】
(実施例5−マウス血液を用いた血漿DPPIV活性アッセイ)
マウス血液を、心臓穿刺によりICRマウスより得、そして、ヘパリン処理した採血管中に集めた。数匹のマウスからの血液をプールして、そして、300μLの等量に分けた。そのペプチドを、pH5.5の酢酸緩衝食塩水中に9mMの濃度になるように溶解した。この貯蔵溶液のうち30μLを、300μLの血液に加え、そして再懸濁により混合した(血液中の濃度は0.82mM)。対照として、30μLのブランク酢酸緩衝食塩水を、300μLの血液に加えた。それぞれのペプチド群を、3回反復実験で調製し、一方、対照は6回反復実験で調製した。そのサンプルを、密閉したマイクロチューブ中で2時間にわたって37℃でインキュベートした。インキュベーション後、血漿を、4000rcfの遠心分離により、そのサンプルから単離した。その血漿を、DPPIVアッセイのため、96ウエルアッセイプレートに移した。そのアッセイを、DPPIVの基質のgly−pro−p−ニトロアニリド(脱イオン水中で16mM)5μLを95μLの血漿(血漿中の濃度は0.8mM)に加えることにより開始し、そして、UV吸光度(405nm)における増大を、20分間にわたってモニターした。gly−pro−p−ニトロアニリドの酵素的切断によるp−ニトロアニリンの産生の速度を、DPPIVの活性とした(Durinx C et al.,(2001)「血漿ジペプチジルペプチダーゼIV活性のための参照値および、それらの、他の実験パラメーターとの関係」.Clin Chem Lab Med.39(2):155−9)。
【0134】
その結果を、表1において見ることができる。DPPIVの活性に対するそのペプチドの影響が観察された。結果を、食塩水の対照(100%とする)に関して、正規化され、平均化された活性%として示す。100%より少ないいずれもが、DPPIVの活性における減少を示す。
【0135】
本発明の一つの局面において、おおよそ25%のDPPIV活性の減少、または一つの実施形態において、少なくとも25%(言い換えると、約75%まで)のDPPIV活性の減少が、活性であるとみなされた。望まれる活性の水準が、そのペプチドの用途に依存して変化し得るということを、当業者は認める。
【0136】
(論考)
CD26あるいはアデノシンデアミナーゼ結合タンパク質としても知られている、II型膜貫通セリンプロテアーゼジペプチジルペプチダーゼIV(DPPIV)は、免疫機能を含む多様な生理的過程の主要な調節因子である。CD26/DPPIVは、110kDの細胞表面の糖タンパク質であり、成熟胸腺細胞、活性化T細胞、B細胞、NK細胞、マクロファージ、および上皮細胞上で主として発現している。DPPIVは、少なくとも二つの機能(シグナル伝達機能および蛋白分解機能)を持つ(Morimoto C,Schlossman SF.The structure and function of CD26 in.−. The T−cell immune response.
Immunol.Review.1998,161:55−70)。DPPIVの、細胞での役割のうちの1つは、ケモカインのN末端からジペプチドを切断することによる、ケモカイン活性の調節を含む。ケモカインのNH2末端の調節は、それらのレセプターへの結合およびその後の反応のためだけではなく、そのプロセシングされたケモカインのレセプター特異性を変えるうえでも、非常に重要である。さらに、可溶性rCD26は、単球の遊走反応を減少させるのに対して、T細胞の経内皮移動を増強することが実証された[Oravecz, T. et. al.,(1997)Regulation of
the receptor specificity and formation of the chemokine RANTES(regulated on activation, normal T cell expressed and secreted) by dipeptydyl peptidase IV (CD26)−mediated cleavage. J.Exp.Med.186:1865〜1872;Iwata, S., et. al.,(1999)CD26/dipeptidyl peptidase IV differentially regulates the chemotaxis of T cells and monocytes toward RANTES: possible mechanism for
the switch from innate to acquired immune response. Int.Immunol.11:417〜426]。これらの結果は、CD26/DPPIVがT細胞および単球の走化性反応を差別的に調節し、そして、先天免疫応答から獲得免疫応答への切替えに関係することを、示した。それゆえ、DPPIVの活性の減少は、それから、逆の効果を持ち、先天免疫応答およびマクロファージ遊走反応を促進する。DPPIV酵素活性の薬理学的な阻害が、RAの実験ラットモデルにおいて、関節炎の進行を減じうることもまた報告されており(Tanaka S et al.,Anti−arthritic effects of the novel dipeptidyl peptidase IV inhibitors TMC−2A and TSL−225. Immunopharmacology 1998,40:21−26;Tanaka S,et al.,:Suppression of arthritis by the inhibitors of dipeptidyl peptidase IV. Int J Immunopharmacol
1997,19:15−24)、DPPIV活性の減少が、ある状況下では炎症を緩和し得ることを示唆している。抗炎症の役割、および、そのケモカイン活性のその調節を合わせて考えると、DPPIVを、これらの活性に関係する新規化合物のスクリーニングのための良好な分子ということになる。
【0137】
CD26/DPPIVは、多様な疾患(例えば、AIDSおよびHIVという疾患の進行(Blazquez et al.1992;Vanham et al.1993;Schols et al.1998 Oravecz et al.1995)、グレーヴズ病(Eguchi et al.1989;Nishikawa et al.1995)、および癌(Stecca et al.1997)、ならびに糖尿病(Hinke et al.2000;Marguet et al.2000))の病理に関係している。
【0138】
さらに、T細胞活性のインジケーターとしてのCD26は、関節リウマチ(Nakao
et al.,1989)および自己免疫性甲状腺炎(Eguchi et al.,1989)のようないくつかの自己免疫疾患と並行して変動することが示されている。CD26は、これらの疾患の活性のレベルとよく相関するマーカーとして記述された。CD26は、さらに、慢性進行性多発性硬化症における疾患進行のインジケーターとして研究された(Constantinescu et al.,1995)。
【0139】
本発明のペプチドがDPPIV活性を減じ得ることが示された。それゆえ、それらは、DPPIVに関係した状態またはDPPIVに関連した状態のような、特定の免疫状態の処置において用いられ得、そして、一つの局面において、先天免疫、および敗血症に至る炎症のような炎症を調節し得る。
【0140】
前述の発明が、明快さおよび理解の目的のために、いくらか詳細に記述されたとはいえ、本開示を読むことにより、付加された特許請求の範囲におけるその発明の真の範囲から、はずれることなく、形式および詳細における多様な変更がされ得ることを、当業者は認めるものである。
【0141】
【表1−1】

【0142】
【表1−2】

【0143】
(表1続き)
表1のノート1:
X1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端で置換された塩基性官能基をもつグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択される。
【0144】
X2は、配列番号55のアミノ酸配列を含む、10アミノ酸までの単離されたペプチドを含め、V、I、K、P、およびHからなる群より選択される。
【0145】
表1のノート2:
X1は、K、H、R、S、T、O、Cit、Hci、Dab、Dpr、またはN末端で置換された塩基性官能基をもつグリシンを基本とする化合物(例えば、Nlys)、hSer、Val(ベータOH)からなる群より選択され、そしてX2は、A、I、L、V、K、P、G、H、R、S、O、Dab、Dpr、Cit、Hci、Abu、Nva、Nleからなる群より選択され、そしてX2は、N−メチル化され得、そしてX3は、I、V、Pからなる群より選択され、一つの実施形態において、X3は、N−メチル化されていない。一つの実施形態において、その単離されたペプチドは、10アミノ酸までのアミノ酸配列であり得るが、配列番号2でも配列番号17でもない。
【0146】
表1のノート3:
X1、X2およびX3は、配列番号56においてのとおりに定義され、そして「a」は、S、P、I、R、C、T、L、V、A、G、K、H、R、O、C、M、およびFからなる群より選択されるかまたは上記配列を含む10アミノ酸までの単離されたペプチドである。
【0147】
表1のノート4:
X1X2X3Pは、配列番号56において定義されるとおりであり、そして「b」はA、A*、G、S、L、F、K、C、I、V、T、Y、R、H、O、およびMからなる群より選択されるが、一つの実施形態においてPではない。一つの実施形態において、単離されたペプチドは、配列番号58を含むが配列番号17は含まない、10アミノ酸までのペプチドである。
【0148】
表1のノート5:
X1、X2およびX3は、配列番号56において定義されるとおりであり、そして「a1」は、K、I、R、H、O、L、V、A、およびGからなる群より選択され、そして「a2」は、S、P、R、T、H、K、O、L、V、A、G、S、およびIからなる群より選択される。一つの実施形態において、「a1」は、アセチル化されていないか、またはa1がKであるとき、Kはアセチル化されていないか、または配列番号2ではない。一つの実施形態において、その単離されたペプチドは、配列番号59を含む10アミノ酸までを含む。
【0149】
表1のノート6:
X1、X2およびX3は、配列番号56において定義されるとおりであり、そして、「a」は、S、R、K、H、O、T、I、L、V、A、およびGからなる群より選択され、そして、「b」はA、V、I、L、G、K、H、R、O、S、T、およびFからなる群より選択されるか、または配列番号60を含む10アミノ酸までのペプチドである。
【0150】
(引用された参考文献)
【0151】
【表2】

【0152】
【表3】

【特許請求の範囲】
【請求項1】
本願明細書に記載された発明。
【請求項1】
本願明細書に記載された発明。
【図1A】


【図1B】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図2G】


【図3A】


【図3B】




【図1B】


【図2A】


【図2B】


【図2C】


【図2D】


【図2E】


【図2F】


【図2G】


【図3A】


【図3B】


【公開番号】特開2012−223199(P2012−223199A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−175961(P2012−175961)
【出願日】平成24年8月8日(2012.8.8)
【分割の表示】特願2008−533838(P2008−533838)の分割
【原出願日】平成18年10月4日(2006.10.4)
【出願人】(508102370)イニメックス ファーマシューティカルズ インコーポレイテッド (3)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2012−175961(P2012−175961)
【出願日】平成24年8月8日(2012.8.8)
【分割の表示】特願2008−533838(P2008−533838)の分割
【原出願日】平成18年10月4日(2006.10.4)
【出願人】(508102370)イニメックス ファーマシューティカルズ インコーポレイテッド (3)
【Fターム(参考)】
[ Back to top ]

