光シグナル解析方法
【課題】本発明の目的は、光感受性タンパク質を活性化するための刺激光と、シグナル
物質の蛍光プローブの励起光との間で生じる干渉の問題を解消し、シグナル物質のモニタリングを容易かつ正確に行うことができる光シグナル解析方法を提供することにある。
【解決手段】本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、前記シグナル物質を解析するための発光プローブを発現する遺伝子を導入した生物試料に対して、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、を含む、光シグナル解析方法を提供する。
物質の蛍光プローブの励起光との間で生じる干渉の問題を解消し、シグナル物質のモニタリングを容易かつ正確に行うことができる光シグナル解析方法を提供することにある。
【解決手段】本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、前記シグナル物質を解析するための発光プローブを発現する遺伝子を導入した生物試料に対して、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、を含む、光シグナル解析方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光感受性タンパク質によって誘導されるシグナル物質、例えばシグナルタンパク質を解析する光シグナル解析方法に関する。
【背景技術】
【0002】
シグナルタンパク質は、受容体等の特定のタンパク質(以下、開始タンパク質ともいう)の活性化によって始まる一連の反応系を構成するタンパク質群であり、シグナルタンパク質による反応カスケードを経て、最終的に病的遺伝子等の表現型を決定する遺伝子が発現する(以下、表現型決定遺伝子ともいう)。シグナルタンパク質の解析は、病的遺伝子の発現制御を可能にする新たな薬剤の開発に必要不可欠であり、薬剤開発現場において広く行われている。
【0003】
シグナルタンパク質を活性化する開始タンパク質には、様々なものが存在するが、細胞膜中に存在するチャネルタンパク質は、複雑かつ重要なシグナルタンパク質による反応カスケードの引金となるため、特に注目されている。そして、このチャネルタンパク質の1つとして、特定の波長の光刺激によってチャネルの脱分極および過分極(すなわち、チャネルの開閉)が起こる、光感受性のチャネルタンパク質が存在する。
【0004】
例えば、チャネルロドプシン-2(ChR2)やハロロドプシン(NpHR)は、緑藻類由来の光感
受性のイオンチャネルタンパク質であり、ChR2およびNpHRを、哺乳類の神経細胞などに発現させ、特定の波長の光刺激を与えることによって、神経細胞のナトリウムイオンや塩素イオンのチャネルの開閉を制御することができる。そして、光刺激によるイオンチャネルの開閉の応答は、神経細胞の活動電位の変化として電気生理学的に電極からの信号を通して検出される(非特許文献1)。
【0005】
個体レベルでは、これら光感受性のイオンチャネルタンパク質の遺伝子を恒常的に発現
しているトランスジェニックマウスをつくり、運動中枢などの特定領域のみに光ファイバ
ーを通して光照射できるような外科的手術を加え、光刺激とともにマウスの行動の変化を
観察する(非特許文献2および3)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Boyden et al, Nature Neuroscience, 8: 1263-1268 (2005)
【非特許文献2】Zhang et al, Nature Reviews, Neuroscience, 8: 577-581 (2007)
【非特許文献3】Gradinaru et al, J. Neuroscience, 27: 14231-14238 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述した神経細胞の活動電位は、開始タンパク質であるチャネルの開閉によってもたらされる。また、マウスの行動の変化は、表現型決定遺伝子の発現によってもたらされる。
しかしながら、開始タンパク質と表現型決定遺伝子との間をつなぐシグナルタンパク質
の発現を解析するためには、新たな標識が必要となる。
【0008】
これらのシグナルタンパク質をモニタリングする手法として、蛍光プローブを用いた蛍
光顕微鏡での観察手法が挙げられる。例えば、代表的なシグナルタンパク質であるカルシ
ウムイオンと結合したときに蛍光強度や蛍光波長の比が変化する蛍光プローブを用いて、
カルシウムイオンのモニタリングを行うことができる。また、同じく代表的なシグナルタ
ンパク質である転写因子と緑色蛍光タンパク質(GFP)を融合させた蛍光プローブを用
いて、転写因子のモニタリングを行うことができる。蛍光プローブを用いた蛍光顕微鏡で
の観察は、特定の波長の励起光を照射し、蛍光物質から発せられる特定の蛍光波長の強度
変化をモニタリングすることによって行われる。
【0009】
例えば、上述したチャネルタンパク質ChR2およびNpHRの下流に位置するシグナルトランスミッターであるカルシウムイオン濃度の変化をモニタリングする場合、ナトリウムのイオンチャネルであるChR2は470nm付近の青色の光刺激に応答し、塩素のイオンチャネルであるNpHRは580nm付近のオレンジ色の光刺激に応答する。しかしながら、カルシウムプローブとしてよく用いられるFluo3は480nm付近の青色の光によって励起され、500nm付近の緑色の光を発する。このため、チャネルタンパク質CHR2の光刺激の波長域(470nm)と、蛍光プローブの励起光の波長域(480nm)とが干渉してしまう。すなわち、蛍光プローブの励起光が、同時にチャネルタンパク質(開始タンパク質)の光刺激にもなってしまい、チャネルタンパク質の光刺激が過多となり、正確なシグナル解析を行うことができなくなる。
【0010】
また、転写因子をモニタリングする場合、転写因子に結合させる蛍光プローブには様々
な励起波長のものが存在するが、チャネルタンパク質の光刺激に用いる波長域を使用する
ことができず、例えば、DsRedのようなオレンジ色の波長域で励起するものを使用できな
いなど、使用可能な蛍光プローブの種類が著しく限定されてしまう。
【0011】
従って、本発明の目的は、光感受性タンパク質を活性化するための刺激光と、上述したようなシグナルタンパク質の蛍光プローブの励起光との間で生じる干渉の問題を解消し、シグナル物質のモニタリングを容易かつ正確に行うことができる光シグナル解析方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、鋭意研究の結果、シグナルタンパク質のモニタリングに蛍光プローブではなく、発光プローブを用いることによって上記課題を解決するに至った。
【0013】
即ち、本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、前記シグナル物質を解析するための発光プローブを発現する遺伝子を、生物試料に導入する遺伝子導入ステップと、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、を含む、光シグナル解析方法を提供する。
【0014】
また、本発明は、光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析方法であって、第1のシグナル物質を解析するための第1の発光プローブを発現する遺伝子と、第2のシグナル物質を解析するための第2の発光プローブを発現する遺伝子とを、生物試料に導入する遺伝子導入ステップと、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを検出する光シグナル検出ステップと、を含むことを特徴とする、光シグナル解析方法を提供する。
【0015】
さらにまた、本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、前記生物試料が発する光シグナルを結像した発光画像を撮像する発光画像撮像手段と、を備えた、光シグナル解析システムを提供する。
【0016】
さらにまた、本発明は、光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像手段と、を備えた、光シグナル解析システムを提供する。
【発明の効果】
【0017】
本発明の光シグナル解析方法によって、光感受性タンパク質を活性化するための刺激光と、シグナルタンパク質のモニタリングを容易かつ正確に行うことができる。
【図面の簡単な説明】
【0018】
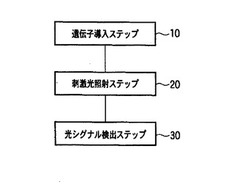
【図1】第1の実施形態における光シグナル解析方法のフローチャート
【図2】第1の実施形態において使用する光シグナル解析システム100の模式図
【図3】第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第1の模式図
【図4】第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第2の模式図
【発明を実施するための形態】
【0019】
以下、図面を用いて本発明の実施形態について説明する。なお、以下に示す各実施形態は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の各実施形態に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の各実施形態の種々の変形、改良形態を含む全ての実施形態が含まれる。
【0020】
1.光シグナル解析方法
<第1の実施形態>
図1は、第1の実施形態における光シグナル解析方法のフローチャートである。
【0021】
前提として、第1の実施形態は、光感受性タンパク質によって誘導されるシグナルタンパク質(以下、標的シグナルタンパク質ともいう)を解析する光シグナル解析方法である。
【0022】
第1の実施形態に用いる光感受性タンパク質とは、特定の波長の光刺激によって活性化される種々のタンパク質を意味し、特に、特定の波長の光刺激によってチャネルの脱分極および過分極(すなわち、チャネルの開閉)が起こる、光感受性のチャネルタンパク質、例えば、これに限定するわけではないが、チャネルロドプシン-2(ChR2)やハロロドプシン(NpHR)などの緑藻類由来の光感受性のイオンチャネル膜タンパク質を意味する。
【0023】
(1)遺伝子導入ステップ
先ず、標的シグナルタンパク質を解析するための発光プローブを発現する遺伝子を、生物試料に導入する(10)。 この導入ステップは、必ずしも、シグナル解析を行う直前である必要はなく、所望の目的で予め導入ステップを行った生物試料を生存可能な条件で保存(例えば培養)され、または別の使用目的(例えば明視野観察等)に使用された後の生物試料をシグナル解析を行うために使用してもよい。
【0024】
「標的シグナルタンパク質」とは、前記光感受性タンパク質によって誘導されるシグナルタンパク質を意味する。より具体的には、受容体等の特定のタンパク質(以下、開始タンパク質ともいう)の活性化によって始まる一連の反応系を構成するタンパク質群であり、シグナルタンパク質による反応カスケードを経て、最終的にシグナル系の最下流に位置する表現型を決定する遺伝子(すなわち、表現型決定遺伝子)が発現する。表現を変えれば、第1の実施形態における標的シグナルタンパク質は、細胞内シグナル伝達物質であり、いわゆるセカンド メッセンジャーを意味する。セカンド メッセンジャーには様々なものが存在するが、例えば、環状AMP(cAMP)、イノシトール三リン酸(IP3)、ジアシルグリセロール(DG)、または細胞内遊離カルシウムなどがその代表例である。
【0025】
第1の実施形態に用いる生物試料は、特に制限されることなく、例えば、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物からなる群から選択された生物体など、任意の生物種を選択することができる。また、生物試料は、生物個体から取り出した各種の器官もしくはその組織片であってもよく、あるいは前記組織片から取り出した細胞であってもよい。また、いわゆるin vivoイメージングと呼ばれる小動物(例えばマウス)等の生体観察のように、非ヒト動物の体内における医学的現象や薬物応答を生きた動物個体に対し直接アクセスして観察する場面にも適用してよい。
【0026】
標的シグナルタンパク質を解析するための発光プローブを発現する遺伝子(以下、発光プローブ遺伝子ともいう)には、任意の発光基質を添加することによって発光を誘導可能な発光プローブを発現する遺伝子が含まれる。代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンを酸化し、発光を誘導する。その他の例として、例えば、オワンクラゲに由来する発光性タンパク質であるエクオリン(aequorin)が知られている。エクオリンは、カルシウム結合性タンパク質であるアポエクオリンと発光基質のセレンテラジン(coelenterazine)との複合体で,これにカルシウムが結合することで高次構造の変化が起こり,基質が酸化されて青色発光が誘導される。また、エクオリン類似の発光タンパク質であるオベリンは、特に、カルシウムイメージングに適した発光タンパク質である。オベリン(obeline)も、アポオベリン(カルシウム結合タンパク質)とセレンテラジン(発光基質)との複合タンパク質であり、これにカルシウムが結合すると、490nm付近の青色の光を発する。アポオベリン遺伝子は、例えばルクソー・バイオテクノロジー社から入手可能である。
【0027】
前記発光プローブ遺伝子は、当業者に既知の任意の遺伝子組換え技術によって生物試料
内に導入することができる。例えば、プラスミドなどの発現ベクターに発光プローブ遺伝
子を組み込み、該発現ベクターを、リン酸カルシウム法、パーティクルガン法、エレクト
ロポーレーション法、マイクロインジェクション法などを用いて生物試料内に導入しても
よい。また、アデノウイルスやレトロウイルスベクターの感染力を利用して、発光プロー
ブ遺伝子を生物試料内に導入してもよい。さらにまた、発光プローブ遺伝子を発現するト
ランスジェニック生物を作製してもよい。
【0028】
なお、前記発光プローブ遺伝子とともに、光感受性タンパク質を発現する遺伝子(以下
、光感受性タンパク質遺伝子ともいう)を前記生物試料に導入してもよい。前記光感受性
タンパク質を十分に発現する生物試料を用いて標的シグナルタンパク質の発現を評価する
場合、光感受性タンパク質遺伝子を導入する必要は必ずしもないが、前記光感受性タンパ
ク質を全く発現していない、あるいは発現量が少ない生物試料を用いる場合、標的シグナ
ルタンパク質の発現を評価するのに適した実験系を構築する必要がある。このとき、前記
発光プローブ遺伝子とともに、光感受性タンパク質遺伝子を前記生物試料に導入すること
ができる。光感受性タンパク質遺伝子を新たに導入することで、光刺激に対する開始シグ
ナルが飽和状態となり、下流に位置するシグナル伝達系が十分に促進される。その結果、
シグナル伝達系のイメージングを高感度に行うことができる。
【0029】
一般に、光感受性タンパク質、特に、光感受性のチャネルタンパク質は、光刺激後の応
答速度が速く、光刺激後直ちに下流のシグナル伝達系が進行する。したがって、光刺激後
のシグナル伝達系を解析しようとする場合、光刺激系とシグナル解析系とを独立した系と
して構築することはできない。したがって、シグナル遺伝子(セカンド メッセンジャー)の解析系は、表現型決定遺伝子など、光刺激後、相当期間経過後に発現し、それ自体を独立した解析系として構築することができる諸般の遺伝子の解析系とは明らかに相違する。本発明は、光刺激系と重複せざるを得ない、このシグナル遺伝子の解析系について、従来問題であった光干渉の障害を解消するためになされたものである。なお、表現型決定遺伝子の解析系では、それ自体を独立した系として構築することができるので、そもそも光干渉の障害が生じ得ない。
【0030】
(2)刺激光照射ステップ
続いて、前記光感受性タンパク質を活性化する刺激光を照射する(20)。
【0031】
光刺激は、対象である光感受性タンパク質を活性化させるために適した刺激であり、例えば、上述した光感受性のチャネルタンパク質のうち、ナトリウムのイオンチャネルであるChR2は470nm付近の青色の光刺激に応答し、塩素のイオンチャネルであるNpHRは580nm付近のオレンジ色の光刺激に応答する。チャネルタンパク質が活性化されることによって、下流の細胞内シグナル伝達物質(セカンド メッセンジャー)が起動し、一連のシグナル伝達が行われる。
【0032】
(3)光シグナル検出ステップ
最後に、前記生物試料が発する光シグナルを検出する(30)。
【0033】
光シグナルは、標的シグナルタンパク質の発現を観察するために用いた発光プローブによる発光シグナルであり、例えば、ルシフェラーゼ遺伝子を導入した場合、該遺伝子の発現によって生成されたルシフェラーゼによって発光基質であるルシフェリンがオキシルシフェリンに酸化され、その際に530nm付近の黄色の光が発生する。発生した発光をCCDカメラなどの撮像手段で検出し、画像処理を行うことによって、標的シグナルタンパク質の局在性を特定することができる。また、画像処理によって特定された各位置での光シグナルの光量計測を行うことによって、標的シグナルタンパク質の発現量を発現部位ごとに精度よく定量化することができる。
【0034】
発光プローブは、標的シグナルタンパク質のイメージングに用いているため、標的シグナルタンパク質と連動して発現する必要がある。例えば、発光プローブにルシフェラーゼを使用する場合、標的シグナルタンパク質をコードする遺伝子とともに共発現するような位置にルシフェラーゼ遺伝子を組み込んだベクターを構築することによって、標的シグナルタンパク質の発現を正確にイメージングすることができる。一方、エクオリンやオベリンのような発光プローブは、セカンド メッセンジャーである細胞内遊離カルシウムと結合することによって発光するため、発光基質であるセレンテラジンを生物試料に予め添加しておけば、カルシウムの発現を正確にイメージングすることができる。
【0035】
<第2の実施形態>
第2の実施形態として、解析対象となるシグナル物質としてのシグナル標的シグナルタンパク質は2以上存在してもよい。
【0036】
例えば、2種類の標的シグナルタンパク質(第1および第2のシグナルタンパク質)を検出する場合、第1のシグナルタンパク質を解析するための第1の発光プローブを発現する遺伝子(第1の発光プローブ遺伝子)と、第2のシグナルタンパク質を解析するための第2の発光プローブを発現する遺伝子(第2の発光プローブ遺伝子)とを、生物試料に導入する。第1および第2の発光プローブ遺伝子は、互いに異なる波長の光を発する発光プローブをコードする遺伝子であり、各発光プローブが発した光は異なる光シグナルとして識別し、それぞれ別個に画像化および定量化することができる。
【0037】
このとき、第1および第2のシグナルタンパク質は、それぞれ第1および第2の発光プローブによって可視化されイメージング(撮像)されるため、各シグナルタンパク質と各発光プローブとの発現は互いに連動している必要がある。
【0038】
例えば、ChR2やNpHRのような光感受性のイオンチャネルタンパク質によって誘導さる、カルシウムイオン(第1のシグナルトランスミッター)およびc-Fosタンパク質(第2のシグナルタンパク質)を発光プローブを用いてモニタリングする場合、カルシウムイオンの発光プローブとしてオベリン(第1の発光プローブ)を使用し、c-Fosタンパク質の発光プロブとしてルシフェラーゼ(第2の発光プローブ)を使用することができる。
【0039】
上記場合において、ルシフェラーゼ遺伝子は、c-Fosタンパク質をコードするc-fos遺伝子のプロモーターに隣接して配置する。ルシフェラーゼ遺伝子をc-fos遺伝子のプロモーターに隣接して配置したベクターを細胞(生物試料)に導入することによって、両遺伝子は細胞内で共発現し、その結果、c-fosの遺伝子発現をルシフェラーゼを通してイメージングすることができる。なお、c-fos遺伝子の産物であるc-Fosタンパク質は、核内タンパク質であるc-Junと二量化し、転写因子c-Fos/AP-1複合体を構成する。c-Fos/AP-1は、遺伝子プロモーター上にある特定のAP-1結合部位に結合し、下流の遺伝子の発現を促進する。
【0040】
また、生物試料には、発光基質であるルシフェリンおよびセレンテラジン(以下、ルシフェリン等ともいう)を導入する。ルシフェリン等を導入する方法としては、例えば、ルシフェリン等溶液を観察対象部位に直接噴霧する方法や、ルシフェリン等を培養液など、生物試料を保持する溶液に添加する方法などがある。
【0041】
2以上の標的シグナルをイメージングする場合、従来の蛍光検出では励起光と刺激光との波長のオーバーラップが一層激しくなり、非特異的な蛍光が発生し易くなる等、光干渉の問題が深刻化する。一方、本発明のイメージング方法では、標的シグナルを発光プローブを用いてイメージングするので、標的シグナルの種類が増えても、光干渉の問題が生じることがなく、極めて有効な手法となる。
【0042】
2.光シグナル解析システム
図2は、第1の実施形態において使用する光シグナル解析システム100の模式図である
。
【0043】
図2の光シグナル解析システム100は、観察対象を下方から観察するいわゆる倒立型の
光学設計となっており、観察光感受性タンパク質によって誘導されるシグナル物質を解析するための光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段110と、前記生物試料が発する光シグナルを結像した発光画を撮像する発光画像撮像手段120と、を備えている。
【0044】
前記刺激光照射手段110には、対象である光感受性タンパク質を活性化させるために適した波長の刺激光を照射可能な任意の光照射手段を用いることができる。その具体的構成としては、例えば、前記刺激光照射手段110は、光源101、分光フィルター102、光ファイバー103、コンデンサーレンズ104、およびシャッター105により構成される。光源101か
ら発せられた刺激光は、分光フィルター102を通して波長領域の異なる複数の刺激光に分離され、分離された各刺激光のうち、対象である光感受性タンパク質を活性化させるために適した波長の刺激光を、光ファイバー103およびコンデンサーレンズ104を通して生物試料A全体にほぼ一様の明るさで照射する。ここで、一様な明るさで照明するための照明に関わる構成は、他の照明装置を採用してもよい。例えば、470nm付近の青色光を細胞に照射することによって、光感受性イオンチャネルタンパク質ChR2が光刺激され、ナトリウムイオンが流入して細胞が脱分極する。脱分極した細胞内ではカルシウム伝達系が働き、c-fos遺伝子の発現が促進される。なお、シャッター105は、光ファイバー103から照射される刺激光を透過または遮断することによって、生物試料Aへの刺激光の照射を切り替える。このシャッター105による刺激光の照射の切り替えは、予め所定のタイミングで1回以上照射するようにパーソナルコンピュータ130により自動制御してもよいし、コンピュータ130に付随するディスプレーと入力手段(キーボード、マウス等)を用いてディスプレーに表示された生物試料に関する画像を見ながら入力手段により使用者が手動で照射を実行するようにしてもよい。
【0045】
なお、生物試料Aは、例えば、サンプル用容器50に収納された状態で観察される。サンプル用容器50には、これに限定されるわけではないが、例えば、シャーレ、スライドガラ
ス、マイクロプレート、ゲル支持体、微粒子担体、多孔性フィルタなどが含まれ、光透過性を有するガラス、プラスチック、樹脂等を材質とする任意の収容手段であり得る。また、サンプル用容器50は、下方からの観察を可能にするための開口部または観察窓を底面に設けた観察用ステージ60上に配置される。生物試料がマウス等の小動物や他の生物個体である場合には、容器の代わりに生物個体の所定の撮像領域が動かないようにするような固定器具を用いて不動化するのが好ましく、この場合には、正立型のように生物試料の上方から撮像を行う構成の方が好ましい。
【0046】
続いて、前記発光画像撮像手段120には、前記生物試料が発する光シグナルを結像した発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、前記発光画像撮像手段120は、対物レンズ111、発光分光フィルター112、結像レンズ113、およびCCDカメラ114により構成される。生物試料Aから放出された光は、対物レンズ111を通過し、発光分光フィルター112に至る。対物レンズ111および/または結
レンズ113の光学的条件は、「(開口数/倍率)2の値が0.01以上」を満たすものであることが、遺伝子の発現に応じた発光画像を時系列に撮像する上で必要な時間間隔ごとの連続的な撮像を鮮明ないし高感度で且つ短時間に行うことができる点で好ましい。刺激光遮断手段としての発光分光フィルター112は、刺激光照射手段110による生物試料Aへの光刺激に用いた照射光を遮断し、生物試料Aから放出された発光のみを検出手段としてのカメラ(例えばCCDカメラやCMOSカメラ等)へ向けて通過させる。発光分光フィルター112を通過した発光は、結像レンズ113を通過し、CCDカメラ114によって検出される。ここで、刺激光照射手段により生物試料Aがほぼ均一に照明されているので、撮像手段としてのCCDの撮像範囲(撮像視野)全体に亘り光刺激による応答状況を同時に撮像することが可能となる。CCDカメラによって検出された発光シグナルは、パーソナルコンピュータ130に送信され、公知の種々のソフトウェアを用いた画像処理および光量計測が行われ、発光シグナルに連動した標的シグナルタンパク質の挙動性の解析が行われる。解析結果は、コンピュータ130に付随のディスプレーに所望の形式(例えば動画表示、グラフ、数値表等)で表示されることにより出力される。
【0047】
図3は、第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第1の模式図である。
【0048】
光シグナル解析システムの基本的構成は、図2と同じであるが、2以上の発光プローブを別々に検出可能な発光画像撮像手段120が必要となる。すなわち、前記発光画像撮像手段120には、生物試料が発する光シグナルのうち、第1のシグナルタンパク質に由来する光シグナルと、第2のシグナルタンパク質に由来する光シグナルとを別々に結像した発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、図2に示した構成に加え、結像レンズ113とCCDカメラ114との間にバンドパスフィルター115を設置し、生物試料から放出された発光を波長ごとに検出する。例えば、オベリンとルシフェラーゼの発光を検出する場合、オベリンによる発光の受光時には、490nm付近のバンドパスフィルター115を光経路に配置する。一方、ルシフェラーゼによる発光の受光時には、530nm付近のバンドパスフィルター115を光経路に配置する。バンドバスフィ
ルターの切り替えは、手動であっても自動であってもよい。
【0049】
図4は、第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第2の模式図である。
【0050】
バンドパスフィルター115を設ける代わりに、ダイクロックミラー135を光経路に設置し、生物試料から得られた発光を波長別に分けてもよい。分岐した光経路の先には、それぞれ結像レンズ131、132と、CCDカメラ133、134が設置されており、異なる波長の発光を
別々に検出することができる。図4の構成では、バンドパスフィルターの切り替えが不要
であり、発光シグナルを同時に検出することができる。したがって、2つの標的シグナルタンパク質を同時かつ連続的にイメージングすることができる。特に、シグナル伝達系において同じ段階に位置する2以上の標的シグナルタンパク質を検出する場合に有効である。
【0051】
なお、上述した実施形態において、刺激光遮断手段は、波長等の種類に応じて選択的に光を遮断し、それ以外の光を通過させるので、光刺激と発光シグナルの検出を同時に行うことが出来る。従って、光刺激した瞬間を含むシグナル解析を行ったり、任意のタイミングおよび/または刺激時間(パルス状、連続的刺激の何れでもよい)で光刺激したとしても、常にその光刺激直後から得られる検出光を取り逃すことなく、正確な解析を実行できる。また、上述した実施形態では下方から観察する倒立型の光学設計を採用したが、他の方向、例えば上方から観察対象を観察する正立型の設計であってもよく、内視鏡のように任意の方向から観察対象へアクセスするタイプの光学機器であってもよい。
【0052】
また、上述した説明では、視覚に必要な視細胞のうち、桿体(かんたい)細胞(rod cell)にある光受容体色素であるロドプシンについて説明したが、錐体(すいたい)細胞(cone cell)にあるフォトプシンについても応用が可能である。また、これら受容体以外にも、視交叉上核への投射経路を有することで知られる神経節細胞(ipRGC)への適用も可能と考えらる。これら各種の光受容体に応用することにより、メラトニン分泌に対する感受性についの検査や分泌改善を行う光療法への貢献も可能である。光療法に関係する光学的パラメーーとしては、光の照度や色温度を種々異ならせた場合の解析を行うことが有効である。例えば、光照度に関しては、夜間における500nm以下(とくに484nm付近)の短波長光による強照度(例:1500〜5000 lx)または低照度(例:100〜500 lx)の作用を、色温度に関しては、色温度が高い(例:3500〜5000 K)または色温度が低い(例:1000〜2700 K)光による作用に基づいて、メラトニン分泌量と概日リズムとの関係を特定し、該リズム障害に関係する種々の病態等を改善するために貢献し得る。概日リズムは時間治療にも関係するので、抗がん剤、抗アレルギー剤等の投薬効果の改善にも貢献する可能性がある。
【符号の説明】
【0053】
10・・・遺伝子導入ステップ、20・・・刺激光照射ステップ、30・・・光シグナル検出ステップ、50・・・サンプル用容器、60・・・観察用ステージ、100・・・光シグナル解析システム、101・・・光源、102・・・分光フィルター、103・・・光ファイバー、104・・・コンデンサーレンズ、105・・・シャッター、110・・・刺激光照射手段、111・・・対物レンズ、112・・・発光分光フィルター、113・・・結像レンズ、114・・・CCDカメラ、115・・・バンドパスフィルター、120・・・発光画像撮像手段、130・・・パーソナルコンピュータ、131、132・・・結像レンズ、133、134・・CCDカメラ、135・・・ダイクロックミラー、A・・・生物試料
【技術分野】
【0001】
本発明は、光感受性タンパク質によって誘導されるシグナル物質、例えばシグナルタンパク質を解析する光シグナル解析方法に関する。
【背景技術】
【0002】
シグナルタンパク質は、受容体等の特定のタンパク質(以下、開始タンパク質ともいう)の活性化によって始まる一連の反応系を構成するタンパク質群であり、シグナルタンパク質による反応カスケードを経て、最終的に病的遺伝子等の表現型を決定する遺伝子が発現する(以下、表現型決定遺伝子ともいう)。シグナルタンパク質の解析は、病的遺伝子の発現制御を可能にする新たな薬剤の開発に必要不可欠であり、薬剤開発現場において広く行われている。
【0003】
シグナルタンパク質を活性化する開始タンパク質には、様々なものが存在するが、細胞膜中に存在するチャネルタンパク質は、複雑かつ重要なシグナルタンパク質による反応カスケードの引金となるため、特に注目されている。そして、このチャネルタンパク質の1つとして、特定の波長の光刺激によってチャネルの脱分極および過分極(すなわち、チャネルの開閉)が起こる、光感受性のチャネルタンパク質が存在する。
【0004】
例えば、チャネルロドプシン-2(ChR2)やハロロドプシン(NpHR)は、緑藻類由来の光感
受性のイオンチャネルタンパク質であり、ChR2およびNpHRを、哺乳類の神経細胞などに発現させ、特定の波長の光刺激を与えることによって、神経細胞のナトリウムイオンや塩素イオンのチャネルの開閉を制御することができる。そして、光刺激によるイオンチャネルの開閉の応答は、神経細胞の活動電位の変化として電気生理学的に電極からの信号を通して検出される(非特許文献1)。
【0005】
個体レベルでは、これら光感受性のイオンチャネルタンパク質の遺伝子を恒常的に発現
しているトランスジェニックマウスをつくり、運動中枢などの特定領域のみに光ファイバ
ーを通して光照射できるような外科的手術を加え、光刺激とともにマウスの行動の変化を
観察する(非特許文献2および3)。
【先行技術文献】
【非特許文献】
【0006】
【非特許文献1】Boyden et al, Nature Neuroscience, 8: 1263-1268 (2005)
【非特許文献2】Zhang et al, Nature Reviews, Neuroscience, 8: 577-581 (2007)
【非特許文献3】Gradinaru et al, J. Neuroscience, 27: 14231-14238 (2007)
【発明の概要】
【発明が解決しようとする課題】
【0007】
上述した神経細胞の活動電位は、開始タンパク質であるチャネルの開閉によってもたらされる。また、マウスの行動の変化は、表現型決定遺伝子の発現によってもたらされる。
しかしながら、開始タンパク質と表現型決定遺伝子との間をつなぐシグナルタンパク質
の発現を解析するためには、新たな標識が必要となる。
【0008】
これらのシグナルタンパク質をモニタリングする手法として、蛍光プローブを用いた蛍
光顕微鏡での観察手法が挙げられる。例えば、代表的なシグナルタンパク質であるカルシ
ウムイオンと結合したときに蛍光強度や蛍光波長の比が変化する蛍光プローブを用いて、
カルシウムイオンのモニタリングを行うことができる。また、同じく代表的なシグナルタ
ンパク質である転写因子と緑色蛍光タンパク質(GFP)を融合させた蛍光プローブを用
いて、転写因子のモニタリングを行うことができる。蛍光プローブを用いた蛍光顕微鏡で
の観察は、特定の波長の励起光を照射し、蛍光物質から発せられる特定の蛍光波長の強度
変化をモニタリングすることによって行われる。
【0009】
例えば、上述したチャネルタンパク質ChR2およびNpHRの下流に位置するシグナルトランスミッターであるカルシウムイオン濃度の変化をモニタリングする場合、ナトリウムのイオンチャネルであるChR2は470nm付近の青色の光刺激に応答し、塩素のイオンチャネルであるNpHRは580nm付近のオレンジ色の光刺激に応答する。しかしながら、カルシウムプローブとしてよく用いられるFluo3は480nm付近の青色の光によって励起され、500nm付近の緑色の光を発する。このため、チャネルタンパク質CHR2の光刺激の波長域(470nm)と、蛍光プローブの励起光の波長域(480nm)とが干渉してしまう。すなわち、蛍光プローブの励起光が、同時にチャネルタンパク質(開始タンパク質)の光刺激にもなってしまい、チャネルタンパク質の光刺激が過多となり、正確なシグナル解析を行うことができなくなる。
【0010】
また、転写因子をモニタリングする場合、転写因子に結合させる蛍光プローブには様々
な励起波長のものが存在するが、チャネルタンパク質の光刺激に用いる波長域を使用する
ことができず、例えば、DsRedのようなオレンジ色の波長域で励起するものを使用できな
いなど、使用可能な蛍光プローブの種類が著しく限定されてしまう。
【0011】
従って、本発明の目的は、光感受性タンパク質を活性化するための刺激光と、上述したようなシグナルタンパク質の蛍光プローブの励起光との間で生じる干渉の問題を解消し、シグナル物質のモニタリングを容易かつ正確に行うことができる光シグナル解析方法を提供することにある。
【課題を解決するための手段】
【0012】
本発明者は、鋭意研究の結果、シグナルタンパク質のモニタリングに蛍光プローブではなく、発光プローブを用いることによって上記課題を解決するに至った。
【0013】
即ち、本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、前記シグナル物質を解析するための発光プローブを発現する遺伝子を、生物試料に導入する遺伝子導入ステップと、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、を含む、光シグナル解析方法を提供する。
【0014】
また、本発明は、光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析方法であって、第1のシグナル物質を解析するための第1の発光プローブを発現する遺伝子と、第2のシグナル物質を解析するための第2の発光プローブを発現する遺伝子とを、生物試料に導入する遺伝子導入ステップと、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを検出する光シグナル検出ステップと、を含むことを特徴とする、光シグナル解析方法を提供する。
【0015】
さらにまた、本発明は、光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、前記生物試料が発する光シグナルを結像した発光画像を撮像する発光画像撮像手段と、を備えた、光シグナル解析システムを提供する。
【0016】
さらにまた、本発明は、光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像手段と、を備えた、光シグナル解析システムを提供する。
【発明の効果】
【0017】
本発明の光シグナル解析方法によって、光感受性タンパク質を活性化するための刺激光と、シグナルタンパク質のモニタリングを容易かつ正確に行うことができる。
【図面の簡単な説明】
【0018】
【図1】第1の実施形態における光シグナル解析方法のフローチャート
【図2】第1の実施形態において使用する光シグナル解析システム100の模式図
【図3】第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第1の模式図
【図4】第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第2の模式図
【発明を実施するための形態】
【0019】
以下、図面を用いて本発明の実施形態について説明する。なお、以下に示す各実施形態は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の各実施形態に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の各実施形態の種々の変形、改良形態を含む全ての実施形態が含まれる。
【0020】
1.光シグナル解析方法
<第1の実施形態>
図1は、第1の実施形態における光シグナル解析方法のフローチャートである。
【0021】
前提として、第1の実施形態は、光感受性タンパク質によって誘導されるシグナルタンパク質(以下、標的シグナルタンパク質ともいう)を解析する光シグナル解析方法である。
【0022】
第1の実施形態に用いる光感受性タンパク質とは、特定の波長の光刺激によって活性化される種々のタンパク質を意味し、特に、特定の波長の光刺激によってチャネルの脱分極および過分極(すなわち、チャネルの開閉)が起こる、光感受性のチャネルタンパク質、例えば、これに限定するわけではないが、チャネルロドプシン-2(ChR2)やハロロドプシン(NpHR)などの緑藻類由来の光感受性のイオンチャネル膜タンパク質を意味する。
【0023】
(1)遺伝子導入ステップ
先ず、標的シグナルタンパク質を解析するための発光プローブを発現する遺伝子を、生物試料に導入する(10)。 この導入ステップは、必ずしも、シグナル解析を行う直前である必要はなく、所望の目的で予め導入ステップを行った生物試料を生存可能な条件で保存(例えば培養)され、または別の使用目的(例えば明視野観察等)に使用された後の生物試料をシグナル解析を行うために使用してもよい。
【0024】
「標的シグナルタンパク質」とは、前記光感受性タンパク質によって誘導されるシグナルタンパク質を意味する。より具体的には、受容体等の特定のタンパク質(以下、開始タンパク質ともいう)の活性化によって始まる一連の反応系を構成するタンパク質群であり、シグナルタンパク質による反応カスケードを経て、最終的にシグナル系の最下流に位置する表現型を決定する遺伝子(すなわち、表現型決定遺伝子)が発現する。表現を変えれば、第1の実施形態における標的シグナルタンパク質は、細胞内シグナル伝達物質であり、いわゆるセカンド メッセンジャーを意味する。セカンド メッセンジャーには様々なものが存在するが、例えば、環状AMP(cAMP)、イノシトール三リン酸(IP3)、ジアシルグリセロール(DG)、または細胞内遊離カルシウムなどがその代表例である。
【0025】
第1の実施形態に用いる生物試料は、特に制限されることなく、例えば、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物からなる群から選択された生物体など、任意の生物種を選択することができる。また、生物試料は、生物個体から取り出した各種の器官もしくはその組織片であってもよく、あるいは前記組織片から取り出した細胞であってもよい。また、いわゆるin vivoイメージングと呼ばれる小動物(例えばマウス)等の生体観察のように、非ヒト動物の体内における医学的現象や薬物応答を生きた動物個体に対し直接アクセスして観察する場面にも適用してよい。
【0026】
標的シグナルタンパク質を解析するための発光プローブを発現する遺伝子(以下、発光プローブ遺伝子ともいう)には、任意の発光基質を添加することによって発光を誘導可能な発光プローブを発現する遺伝子が含まれる。代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンを酸化し、発光を誘導する。その他の例として、例えば、オワンクラゲに由来する発光性タンパク質であるエクオリン(aequorin)が知られている。エクオリンは、カルシウム結合性タンパク質であるアポエクオリンと発光基質のセレンテラジン(coelenterazine)との複合体で,これにカルシウムが結合することで高次構造の変化が起こり,基質が酸化されて青色発光が誘導される。また、エクオリン類似の発光タンパク質であるオベリンは、特に、カルシウムイメージングに適した発光タンパク質である。オベリン(obeline)も、アポオベリン(カルシウム結合タンパク質)とセレンテラジン(発光基質)との複合タンパク質であり、これにカルシウムが結合すると、490nm付近の青色の光を発する。アポオベリン遺伝子は、例えばルクソー・バイオテクノロジー社から入手可能である。
【0027】
前記発光プローブ遺伝子は、当業者に既知の任意の遺伝子組換え技術によって生物試料
内に導入することができる。例えば、プラスミドなどの発現ベクターに発光プローブ遺伝
子を組み込み、該発現ベクターを、リン酸カルシウム法、パーティクルガン法、エレクト
ロポーレーション法、マイクロインジェクション法などを用いて生物試料内に導入しても
よい。また、アデノウイルスやレトロウイルスベクターの感染力を利用して、発光プロー
ブ遺伝子を生物試料内に導入してもよい。さらにまた、発光プローブ遺伝子を発現するト
ランスジェニック生物を作製してもよい。
【0028】
なお、前記発光プローブ遺伝子とともに、光感受性タンパク質を発現する遺伝子(以下
、光感受性タンパク質遺伝子ともいう)を前記生物試料に導入してもよい。前記光感受性
タンパク質を十分に発現する生物試料を用いて標的シグナルタンパク質の発現を評価する
場合、光感受性タンパク質遺伝子を導入する必要は必ずしもないが、前記光感受性タンパ
ク質を全く発現していない、あるいは発現量が少ない生物試料を用いる場合、標的シグナ
ルタンパク質の発現を評価するのに適した実験系を構築する必要がある。このとき、前記
発光プローブ遺伝子とともに、光感受性タンパク質遺伝子を前記生物試料に導入すること
ができる。光感受性タンパク質遺伝子を新たに導入することで、光刺激に対する開始シグ
ナルが飽和状態となり、下流に位置するシグナル伝達系が十分に促進される。その結果、
シグナル伝達系のイメージングを高感度に行うことができる。
【0029】
一般に、光感受性タンパク質、特に、光感受性のチャネルタンパク質は、光刺激後の応
答速度が速く、光刺激後直ちに下流のシグナル伝達系が進行する。したがって、光刺激後
のシグナル伝達系を解析しようとする場合、光刺激系とシグナル解析系とを独立した系と
して構築することはできない。したがって、シグナル遺伝子(セカンド メッセンジャー)の解析系は、表現型決定遺伝子など、光刺激後、相当期間経過後に発現し、それ自体を独立した解析系として構築することができる諸般の遺伝子の解析系とは明らかに相違する。本発明は、光刺激系と重複せざるを得ない、このシグナル遺伝子の解析系について、従来問題であった光干渉の障害を解消するためになされたものである。なお、表現型決定遺伝子の解析系では、それ自体を独立した系として構築することができるので、そもそも光干渉の障害が生じ得ない。
【0030】
(2)刺激光照射ステップ
続いて、前記光感受性タンパク質を活性化する刺激光を照射する(20)。
【0031】
光刺激は、対象である光感受性タンパク質を活性化させるために適した刺激であり、例えば、上述した光感受性のチャネルタンパク質のうち、ナトリウムのイオンチャネルであるChR2は470nm付近の青色の光刺激に応答し、塩素のイオンチャネルであるNpHRは580nm付近のオレンジ色の光刺激に応答する。チャネルタンパク質が活性化されることによって、下流の細胞内シグナル伝達物質(セカンド メッセンジャー)が起動し、一連のシグナル伝達が行われる。
【0032】
(3)光シグナル検出ステップ
最後に、前記生物試料が発する光シグナルを検出する(30)。
【0033】
光シグナルは、標的シグナルタンパク質の発現を観察するために用いた発光プローブによる発光シグナルであり、例えば、ルシフェラーゼ遺伝子を導入した場合、該遺伝子の発現によって生成されたルシフェラーゼによって発光基質であるルシフェリンがオキシルシフェリンに酸化され、その際に530nm付近の黄色の光が発生する。発生した発光をCCDカメラなどの撮像手段で検出し、画像処理を行うことによって、標的シグナルタンパク質の局在性を特定することができる。また、画像処理によって特定された各位置での光シグナルの光量計測を行うことによって、標的シグナルタンパク質の発現量を発現部位ごとに精度よく定量化することができる。
【0034】
発光プローブは、標的シグナルタンパク質のイメージングに用いているため、標的シグナルタンパク質と連動して発現する必要がある。例えば、発光プローブにルシフェラーゼを使用する場合、標的シグナルタンパク質をコードする遺伝子とともに共発現するような位置にルシフェラーゼ遺伝子を組み込んだベクターを構築することによって、標的シグナルタンパク質の発現を正確にイメージングすることができる。一方、エクオリンやオベリンのような発光プローブは、セカンド メッセンジャーである細胞内遊離カルシウムと結合することによって発光するため、発光基質であるセレンテラジンを生物試料に予め添加しておけば、カルシウムの発現を正確にイメージングすることができる。
【0035】
<第2の実施形態>
第2の実施形態として、解析対象となるシグナル物質としてのシグナル標的シグナルタンパク質は2以上存在してもよい。
【0036】
例えば、2種類の標的シグナルタンパク質(第1および第2のシグナルタンパク質)を検出する場合、第1のシグナルタンパク質を解析するための第1の発光プローブを発現する遺伝子(第1の発光プローブ遺伝子)と、第2のシグナルタンパク質を解析するための第2の発光プローブを発現する遺伝子(第2の発光プローブ遺伝子)とを、生物試料に導入する。第1および第2の発光プローブ遺伝子は、互いに異なる波長の光を発する発光プローブをコードする遺伝子であり、各発光プローブが発した光は異なる光シグナルとして識別し、それぞれ別個に画像化および定量化することができる。
【0037】
このとき、第1および第2のシグナルタンパク質は、それぞれ第1および第2の発光プローブによって可視化されイメージング(撮像)されるため、各シグナルタンパク質と各発光プローブとの発現は互いに連動している必要がある。
【0038】
例えば、ChR2やNpHRのような光感受性のイオンチャネルタンパク質によって誘導さる、カルシウムイオン(第1のシグナルトランスミッター)およびc-Fosタンパク質(第2のシグナルタンパク質)を発光プローブを用いてモニタリングする場合、カルシウムイオンの発光プローブとしてオベリン(第1の発光プローブ)を使用し、c-Fosタンパク質の発光プロブとしてルシフェラーゼ(第2の発光プローブ)を使用することができる。
【0039】
上記場合において、ルシフェラーゼ遺伝子は、c-Fosタンパク質をコードするc-fos遺伝子のプロモーターに隣接して配置する。ルシフェラーゼ遺伝子をc-fos遺伝子のプロモーターに隣接して配置したベクターを細胞(生物試料)に導入することによって、両遺伝子は細胞内で共発現し、その結果、c-fosの遺伝子発現をルシフェラーゼを通してイメージングすることができる。なお、c-fos遺伝子の産物であるc-Fosタンパク質は、核内タンパク質であるc-Junと二量化し、転写因子c-Fos/AP-1複合体を構成する。c-Fos/AP-1は、遺伝子プロモーター上にある特定のAP-1結合部位に結合し、下流の遺伝子の発現を促進する。
【0040】
また、生物試料には、発光基質であるルシフェリンおよびセレンテラジン(以下、ルシフェリン等ともいう)を導入する。ルシフェリン等を導入する方法としては、例えば、ルシフェリン等溶液を観察対象部位に直接噴霧する方法や、ルシフェリン等を培養液など、生物試料を保持する溶液に添加する方法などがある。
【0041】
2以上の標的シグナルをイメージングする場合、従来の蛍光検出では励起光と刺激光との波長のオーバーラップが一層激しくなり、非特異的な蛍光が発生し易くなる等、光干渉の問題が深刻化する。一方、本発明のイメージング方法では、標的シグナルを発光プローブを用いてイメージングするので、標的シグナルの種類が増えても、光干渉の問題が生じることがなく、極めて有効な手法となる。
【0042】
2.光シグナル解析システム
図2は、第1の実施形態において使用する光シグナル解析システム100の模式図である
。
【0043】
図2の光シグナル解析システム100は、観察対象を下方から観察するいわゆる倒立型の
光学設計となっており、観察光感受性タンパク質によって誘導されるシグナル物質を解析するための光シグナル解析システムであって、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段110と、前記生物試料が発する光シグナルを結像した発光画を撮像する発光画像撮像手段120と、を備えている。
【0044】
前記刺激光照射手段110には、対象である光感受性タンパク質を活性化させるために適した波長の刺激光を照射可能な任意の光照射手段を用いることができる。その具体的構成としては、例えば、前記刺激光照射手段110は、光源101、分光フィルター102、光ファイバー103、コンデンサーレンズ104、およびシャッター105により構成される。光源101か
ら発せられた刺激光は、分光フィルター102を通して波長領域の異なる複数の刺激光に分離され、分離された各刺激光のうち、対象である光感受性タンパク質を活性化させるために適した波長の刺激光を、光ファイバー103およびコンデンサーレンズ104を通して生物試料A全体にほぼ一様の明るさで照射する。ここで、一様な明るさで照明するための照明に関わる構成は、他の照明装置を採用してもよい。例えば、470nm付近の青色光を細胞に照射することによって、光感受性イオンチャネルタンパク質ChR2が光刺激され、ナトリウムイオンが流入して細胞が脱分極する。脱分極した細胞内ではカルシウム伝達系が働き、c-fos遺伝子の発現が促進される。なお、シャッター105は、光ファイバー103から照射される刺激光を透過または遮断することによって、生物試料Aへの刺激光の照射を切り替える。このシャッター105による刺激光の照射の切り替えは、予め所定のタイミングで1回以上照射するようにパーソナルコンピュータ130により自動制御してもよいし、コンピュータ130に付随するディスプレーと入力手段(キーボード、マウス等)を用いてディスプレーに表示された生物試料に関する画像を見ながら入力手段により使用者が手動で照射を実行するようにしてもよい。
【0045】
なお、生物試料Aは、例えば、サンプル用容器50に収納された状態で観察される。サンプル用容器50には、これに限定されるわけではないが、例えば、シャーレ、スライドガラ
ス、マイクロプレート、ゲル支持体、微粒子担体、多孔性フィルタなどが含まれ、光透過性を有するガラス、プラスチック、樹脂等を材質とする任意の収容手段であり得る。また、サンプル用容器50は、下方からの観察を可能にするための開口部または観察窓を底面に設けた観察用ステージ60上に配置される。生物試料がマウス等の小動物や他の生物個体である場合には、容器の代わりに生物個体の所定の撮像領域が動かないようにするような固定器具を用いて不動化するのが好ましく、この場合には、正立型のように生物試料の上方から撮像を行う構成の方が好ましい。
【0046】
続いて、前記発光画像撮像手段120には、前記生物試料が発する光シグナルを結像した発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、前記発光画像撮像手段120は、対物レンズ111、発光分光フィルター112、結像レンズ113、およびCCDカメラ114により構成される。生物試料Aから放出された光は、対物レンズ111を通過し、発光分光フィルター112に至る。対物レンズ111および/または結
レンズ113の光学的条件は、「(開口数/倍率)2の値が0.01以上」を満たすものであることが、遺伝子の発現に応じた発光画像を時系列に撮像する上で必要な時間間隔ごとの連続的な撮像を鮮明ないし高感度で且つ短時間に行うことができる点で好ましい。刺激光遮断手段としての発光分光フィルター112は、刺激光照射手段110による生物試料Aへの光刺激に用いた照射光を遮断し、生物試料Aから放出された発光のみを検出手段としてのカメラ(例えばCCDカメラやCMOSカメラ等)へ向けて通過させる。発光分光フィルター112を通過した発光は、結像レンズ113を通過し、CCDカメラ114によって検出される。ここで、刺激光照射手段により生物試料Aがほぼ均一に照明されているので、撮像手段としてのCCDの撮像範囲(撮像視野)全体に亘り光刺激による応答状況を同時に撮像することが可能となる。CCDカメラによって検出された発光シグナルは、パーソナルコンピュータ130に送信され、公知の種々のソフトウェアを用いた画像処理および光量計測が行われ、発光シグナルに連動した標的シグナルタンパク質の挙動性の解析が行われる。解析結果は、コンピュータ130に付随のディスプレーに所望の形式(例えば動画表示、グラフ、数値表等)で表示されることにより出力される。
【0047】
図3は、第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第1の模式図である。
【0048】
光シグナル解析システムの基本的構成は、図2と同じであるが、2以上の発光プローブを別々に検出可能な発光画像撮像手段120が必要となる。すなわち、前記発光画像撮像手段120には、生物試料が発する光シグナルのうち、第1のシグナルタンパク質に由来する光シグナルと、第2のシグナルタンパク質に由来する光シグナルとを別々に結像した発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、図2に示した構成に加え、結像レンズ113とCCDカメラ114との間にバンドパスフィルター115を設置し、生物試料から放出された発光を波長ごとに検出する。例えば、オベリンとルシフェラーゼの発光を検出する場合、オベリンによる発光の受光時には、490nm付近のバンドパスフィルター115を光経路に配置する。一方、ルシフェラーゼによる発光の受光時には、530nm付近のバンドパスフィルター115を光経路に配置する。バンドバスフィ
ルターの切り替えは、手動であっても自動であってもよい。
【0049】
図4は、第2の実施形態において使用する光シグナル解析システムにおける発光画像撮像手段120の第2の模式図である。
【0050】
バンドパスフィルター115を設ける代わりに、ダイクロックミラー135を光経路に設置し、生物試料から得られた発光を波長別に分けてもよい。分岐した光経路の先には、それぞれ結像レンズ131、132と、CCDカメラ133、134が設置されており、異なる波長の発光を
別々に検出することができる。図4の構成では、バンドパスフィルターの切り替えが不要
であり、発光シグナルを同時に検出することができる。したがって、2つの標的シグナルタンパク質を同時かつ連続的にイメージングすることができる。特に、シグナル伝達系において同じ段階に位置する2以上の標的シグナルタンパク質を検出する場合に有効である。
【0051】
なお、上述した実施形態において、刺激光遮断手段は、波長等の種類に応じて選択的に光を遮断し、それ以外の光を通過させるので、光刺激と発光シグナルの検出を同時に行うことが出来る。従って、光刺激した瞬間を含むシグナル解析を行ったり、任意のタイミングおよび/または刺激時間(パルス状、連続的刺激の何れでもよい)で光刺激したとしても、常にその光刺激直後から得られる検出光を取り逃すことなく、正確な解析を実行できる。また、上述した実施形態では下方から観察する倒立型の光学設計を採用したが、他の方向、例えば上方から観察対象を観察する正立型の設計であってもよく、内視鏡のように任意の方向から観察対象へアクセスするタイプの光学機器であってもよい。
【0052】
また、上述した説明では、視覚に必要な視細胞のうち、桿体(かんたい)細胞(rod cell)にある光受容体色素であるロドプシンについて説明したが、錐体(すいたい)細胞(cone cell)にあるフォトプシンについても応用が可能である。また、これら受容体以外にも、視交叉上核への投射経路を有することで知られる神経節細胞(ipRGC)への適用も可能と考えらる。これら各種の光受容体に応用することにより、メラトニン分泌に対する感受性についの検査や分泌改善を行う光療法への貢献も可能である。光療法に関係する光学的パラメーーとしては、光の照度や色温度を種々異ならせた場合の解析を行うことが有効である。例えば、光照度に関しては、夜間における500nm以下(とくに484nm付近)の短波長光による強照度(例:1500〜5000 lx)または低照度(例:100〜500 lx)の作用を、色温度に関しては、色温度が高い(例:3500〜5000 K)または色温度が低い(例:1000〜2700 K)光による作用に基づいて、メラトニン分泌量と概日リズムとの関係を特定し、該リズム障害に関係する種々の病態等を改善するために貢献し得る。概日リズムは時間治療にも関係するので、抗がん剤、抗アレルギー剤等の投薬効果の改善にも貢献する可能性がある。
【符号の説明】
【0053】
10・・・遺伝子導入ステップ、20・・・刺激光照射ステップ、30・・・光シグナル検出ステップ、50・・・サンプル用容器、60・・・観察用ステージ、100・・・光シグナル解析システム、101・・・光源、102・・・分光フィルター、103・・・光ファイバー、104・・・コンデンサーレンズ、105・・・シャッター、110・・・刺激光照射手段、111・・・対物レンズ、112・・・発光分光フィルター、113・・・結像レンズ、114・・・CCDカメラ、115・・・バンドパスフィルター、120・・・発光画像撮像手段、130・・・パーソナルコンピュータ、131、132・・・結像レンズ、133、134・・CCDカメラ、135・・・ダイクロックミラー、A・・・生物試料
【特許請求の範囲】
【請求項1】
光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、
前記シグナル物質を解析するための発光プローブを発現する遺伝子を導入した生物試料に対して、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、
前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、
を含む、光シグナル解析方法。
【請求項2】
光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析方法であって、
第1のシグナル物質を解析するための第1の発光プローブを発現する遺伝子と、第2のシグナル物質を解析するための第2の発光プローブを発現する遺伝子とを導入した生物試料に対して、前記代および第2の光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、
前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを検出する光シグナル検出ステップと、
を含む、光シグナル解析方法。
【請求項3】
前記生物試料が、前記光感受性タンパク質を発現する遺伝子を含む、請求項1または2
に記載の方法。
【請求項4】
前記発光プローブを発現する遺伝子が前記光感受性タンパク質を発現する遺伝子である、請求項1または2に記載の方法。
【請求項5】
前記光感受性タンパク質がチャネルタンパク質である、請求項1または2に記載の方法。
【請求項6】
前記シグナル物質が細胞内シグナル伝達物質である、請求項1または2に記載の方法。
【請求項7】
前記光シグナル検出ステップが、前記生物試料が発する光シグナルを結像した発光画像
を撮像する発光画像撮像ステップである、請求項1に記載の方法。
【請求項8】
前記光シグナル検出ステップが、前記生物試料が発する光シグナルのうち、第1のシグ
ナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像ステップである、請求項2に記載の方法。
【請求項9】
前記刺激光照射ステップが、前記発光画像撮像ステップにおける撮像視野全体をほぼ一様に照射する、請求項7または8に記載の方法。
【請求項10】
前記光シグナル検出ステップが、刺激光照射ステップで照射された刺激光を遮断するス
テップをさらに含む請求項1、7、8、9の何れかに記載の方法。
【請求項11】
前記生物試料が、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物
からなる群から選択された生物体である、請求項1または2に記載の方法。
【請求項12】
前記生物試料が、生物体の器官またはその組織片である、請求項1または2に記載の方
法。
【請求項13】
前記生物試料が、細胞である、請求項1または2に記載の方法。
【請求項14】
光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析システムであって、
前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、
前記生物試料が発する光シグナルを結像した発光画像を撮像する発光画像撮像手段と、
を備えた、光シグナル解析システム。
【請求項15】
光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析システムであって、
前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、
前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像手段と、
を備えた、光シグナル解析システム。
【請求項16】
前記刺激光照射手段が、前記発光画像撮像手段による撮像視野全体をほぼ一様に照射する手段である、請求項13から15の何れかに記載の光シグナル解析システム。
【請求項17】
前記刺激光照射手段により照射される刺激光を遮断する刺激光遮断手段をさらに備えることを特徴とする請求項13から16の何れかに記載の光シグナル解析システム。
【請求項1】
光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析方法であって、
前記シグナル物質を解析するための発光プローブを発現する遺伝子を導入した生物試料に対して、前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、
前記生物試料が発する光シグナルを検出する光シグナル検出ステップと、
を含む、光シグナル解析方法。
【請求項2】
光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析方法であって、
第1のシグナル物質を解析するための第1の発光プローブを発現する遺伝子と、第2のシグナル物質を解析するための第2の発光プローブを発現する遺伝子とを導入した生物試料に対して、前記代および第2の光感受性タンパク質を活性化する刺激光を照射する刺激光照射ステップと、
前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを検出する光シグナル検出ステップと、
を含む、光シグナル解析方法。
【請求項3】
前記生物試料が、前記光感受性タンパク質を発現する遺伝子を含む、請求項1または2
に記載の方法。
【請求項4】
前記発光プローブを発現する遺伝子が前記光感受性タンパク質を発現する遺伝子である、請求項1または2に記載の方法。
【請求項5】
前記光感受性タンパク質がチャネルタンパク質である、請求項1または2に記載の方法。
【請求項6】
前記シグナル物質が細胞内シグナル伝達物質である、請求項1または2に記載の方法。
【請求項7】
前記光シグナル検出ステップが、前記生物試料が発する光シグナルを結像した発光画像
を撮像する発光画像撮像ステップである、請求項1に記載の方法。
【請求項8】
前記光シグナル検出ステップが、前記生物試料が発する光シグナルのうち、第1のシグ
ナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像ステップである、請求項2に記載の方法。
【請求項9】
前記刺激光照射ステップが、前記発光画像撮像ステップにおける撮像視野全体をほぼ一様に照射する、請求項7または8に記載の方法。
【請求項10】
前記光シグナル検出ステップが、刺激光照射ステップで照射された刺激光を遮断するス
テップをさらに含む請求項1、7、8、9の何れかに記載の方法。
【請求項11】
前記生物試料が、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物
からなる群から選択された生物体である、請求項1または2に記載の方法。
【請求項12】
前記生物試料が、生物体の器官またはその組織片である、請求項1または2に記載の方
法。
【請求項13】
前記生物試料が、細胞である、請求項1または2に記載の方法。
【請求項14】
光感受性タンパク質によって誘導されるシグナル物質を解析する光シグナル解析システムであって、
前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、
前記生物試料が発する光シグナルを結像した発光画像を撮像する発光画像撮像手段と、
を備えた、光シグナル解析システム。
【請求項15】
光感受性タンパク質によって誘導される第1および第2のシグナル物質を解析する光シグナル解析システムであって、
前記光感受性タンパク質を活性化する刺激光を照射する刺激光照射手段と、
前記生物試料が発する光シグナルのうち、第1のシグナル物質に由来する光シグナルと、第2のシグナル物質に由来する光シグナルとを別々に結像した発光画像を撮像する発光画像撮像手段と、
を備えた、光シグナル解析システム。
【請求項16】
前記刺激光照射手段が、前記発光画像撮像手段による撮像視野全体をほぼ一様に照射する手段である、請求項13から15の何れかに記載の光シグナル解析システム。
【請求項17】
前記刺激光照射手段により照射される刺激光を遮断する刺激光遮断手段をさらに備えることを特徴とする請求項13から16の何れかに記載の光シグナル解析システム。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2010−246534(P2010−246534A)
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願番号】特願2010−68174(P2010−68174)
【出願日】平成22年3月24日(2010.3.24)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願日】平成22年3月24日(2010.3.24)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

