光化学反応装置及び光化学反応方法
【課題】 光化学反応による分析において、サンプルの移動や分注などの付随作業を軽減し、分析の効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる分析装置を実現する。
【解決手段】 タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする。
【解決手段】 タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体サンプルに含まれるタンパク質と核酸の相互作用分析を行う光化学反応装置及び光化学反応方法に関する。
【背景技術】
【0002】
近年の生物学の分野において、転写及び翻訳を調節する機構の解明は重要課題として位置付けられている。生体の設計図であるDNAから、mRNAへの転写、機能体であるタンパク質が合成される翻訳までの一連のセントラルドグマをコントールする上で、DNA結合タンパク質(DBP)やRNA結合タンパク質(RBP)が必要不可欠な存在として知られている。
【0003】
DBPは対象となるDNAに対して親和性を示す部位を有しており、DNAのある配列と特異的に結合するタンパク質と非特異的に結合するタンパク質の大きく2つの種類に分類される。
【0004】
特定のDNA配列と特異的に結合するタンパク質の代表として、転写調節タンパク質がある。転写調節タンパク質は、DNA上のプロモーターやエンハンサーと呼ばれる配列に結合し、DNAの遺伝情報をRNAに転写する過程を促進、あるいは逆に抑制する機能をもち、1,800以上存在する。
【0005】
非特異的に結合するタンパク質の代表としては、酵素タンパク質が挙げられる。酵素タンパク質は、DNAの複製、修復、組み換えなどに関与し、例えば、DNA変異配列の修復やメチル化などの役割を担うことが知られている。
【0006】
一方、DNAから転写されたRNAは一次RNAと呼ばれるが、この一次RNAは、タンパク質に翻訳されるまでの過程で、プレRNAスプライシング、RNAエディティング、核と細胞質の間のmRNAのシャッフリング、など様々な制御を受ける。近年の研究によって、RNA結合タンパク質(RBP)はこのようなRNAの制御に必要不可欠な分子であり、RBPの欠損は様々な疾患、例えば神経疾患、免疫疾患、代謝疾患の直接的な原因になることが明らかにされてきた(非特許文献1)。
【0007】
このようにDBP及びRBPは、生体現象の根幹となる転写及び翻訳機構の調節因子であり、医学、分子生物学、農学、薬学など生命科学の学際分野で広く、その理解が求められている。そして、これらの研究は、同定及び機能解析の二つの観点から進められている。
【0008】
RNAとタンパク質の分析においては、光化学反応法の一種であるCLIP法(crosslinking and immunoprecipitation assay)が知られている(非特許文献2)。
【0009】
また、特定のタンパク質と特定のDNA配列が結合することを確認する手法としては、紫外光による光化学反応を利用するUV(ultraviolet)クロスリンキング法(以下、UVクロスリンキング法と記す。)が知られている(特許文献1、非特許文献3、非特許文献4)。
【0010】
タンパク質とDNAの結合は、共有結合以外の化学結合で結ばれ、結合が不安定で分析が困難であることが多い。例えば、タンパク質の電気泳動でSDS−PAGE(SDS−ポリアクリルアミドゲル電気泳動)は最も汎用性のある方法であるが、タンパク質にSDS(sodium dodecyl sulfate:ドデシル硫酸ナトリウム、ラウリル硫酸ナトリウム)を修飾するとタンパク質が変性し、DNAとの結合がはずれるため、SDS−PAGEによってDNAとタンパク質の複合体を確認することができない。
【0011】
UVクロスリンキング法はこのような、問題点を鑑み、タンパク質とDNAの結合を共有結合によって安定化させる技術である。具体的には、任意のタンパク質とDNA断片を紫外線領域の光波長(254nm、260nm、305nm、310nm、320nm、などから選択される波長)を照射し、光化学反応によって特定のアミノ酸と塩基を共有結合させ、核酸タンパク質複合体を形成させる。このような核酸タンパク質複合体をSDS−PAGEによって分離展開する。UV照射によってタンパク質とDNAが共有結合した強固な複合体を形成するため、SDSによってタンパク質とDNAは解離することなく、電気泳動による分離展開が可能となる。電気泳動後はさらに、質量分析によるタンパク質の同定や、ウェスタンブロッティングによる解析を行うことができる。
【0012】
または、光化学反応で形成した核酸タンパク質複合体を免疫沈降によって任意のタンパク質を回収することも可能である。一般的な免疫沈降は、目的のタンパク質(DBP、RBP)を認識、結合する磁性ビーズ結合抗体(磁性ビーズと抗体を結合したもの)を用意し、抗原抗体反応によって、目的のタンパクを捉えた上、磁力によってこの目的のタンパク質のみを回収する手段である。その後、シーケンス解読作業によって、DNAまたはRNA配列を決定することができる。
【0013】
UVクロスリンキング法などの光化学反応法は、一般的に最適な照射条件を決定することが重要とされ、一般的な作業工程として、まずサンプルの内容を分析して、光照射条件を決定し、次に光照射反応を行った後、電気泳動による分析の順で行う。ここで、光照射反応に先だって、サンプルの内容を解析し、それに応じて光照射条件の設定を変更することが必要である。この場合の光照射条件とは、紫外線領域の光線の波長、出力、照射時間や、光照射時のサンプルの温度調節、撹拌条件を指す。この光照射条件は、サンプルごとに最適化する必要があり、概して、光照射が不十分でタンパク質とDNAへの照射量が低い場合は、結合が弱く、その後のSDS−PAGEによって分離ができない。また、照射量が大きい場合は、DNAにダメージを与え、DNA鎖を切断してしまうなどの不具合が生じる。したがって、光照射反応に先立って行うサンプル分析と光条件の最適化は、タンパク質と核酸の相互作用分析にとって重要な工程といえる。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特表2007−515186号公報(平成19年6月14日公表)
【非特許文献】
【0015】
【非特許文献1】Lynne E.Maquat,et.al., Cell,Vol.104,173−176(2001)
【非特許文献2】Kirk B.Jensen,et.al., RNA−protein interaction protocols second edition,85−98(2008)
【非特許文献3】J.G.Peak,et.al.,Photochemistry and Photobiology,Vol.41, No.3,295−302(1985)
【非特許文献4】礒辺 俊明他 「分子相互作用解析ハンドブック」羊土社 164−167
【発明の概要】
【発明が解決しようとする課題】
【0016】
しかしながら、電気泳動分析に先立って行われる光化学反応法においては、上記に示したように、一般的にはまず、サンプルの内容を分析して光照射条件を決定し、次に該サンプルに対し、光照射して反応を起こすという手順で進められるが、サンプルの内容を分析する吸光度測定装置あるいは蛍光測定装置などの分析装置と、光を照射して光化学反応を起こす照射装置はそれぞれ別の装置を必要としていた。
【0017】
具体的には、分析装置によって行われるサンプル分析においては、一般に吸光度測定や蛍光測定などの光学的分析方法によって、サンプル中のタンパク質濃度やDNA濃度を測定するが、これらの光学的分析に必要な波長の単色光は、光源からの光を分光器を介して得られ、サンプルに対し、常に一定の光照射距離をおいて照射される。そして、このサンプル分析には、分析対象のサンプルの分注作業、濃度分析作業を伴い、これらの作業を経て光照射条件が決定される。
【0018】
この後、光照射装置によって行われる光照射反応においては、光照射装置へサンプルを移動し、光照射装置の仕様に応じた量にサンプルを分注する作業などを経て光照射が行われる。ここで、UVクロスリンキング法などを用いて光化学反応を起こす場合には、一般に光源からの光を集光レンズを介して、照射距離を変化させながら、サンプルに光を均一に照射し、光化学反応を進行させる。
【0019】
このように分析装置と光照射装置が別々であった場合は、分析装置から光照射装置へのサンプルの移動に伴う作業、すなわち実際の測定、照射等の装置動作に伴う付随作業が必要となり、時間的、労力的なロスが発生する。さらに、微量で貴重な生体由来のサンプルの取り扱いには慎重を期すため、時間をかけてサンプルを何度も容器に移し替えることは、サンプル量のロスやサンプル変性の原因となるという課題があった。
【0020】
そこで、本発明は、上述課題に鑑みてなされたものであり、光化学反応による分析において、サンプルの移動や分注などの付随作業を軽減し、分析の効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる分析装置を実現することを目的とする。
【課題を解決するための手段】
【0021】
本発明に係る光化学反応装置は、タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする。
【0022】
また、前記光化学反応装置は、前記光学的解析に用いる分光手段と、前記光化学反応に用いる集光手段と、前記分光手段と前記集光手段に用いる、各々のレンズを切り替える切り替え手段を備えることを特徴としてもよい。また、前記光化学反応装置は、前記光照射手段と前記生体サンプルとの距離を変更する照射距離変更手段を備えることを特徴としてもよい。
【0023】
また、前記光学的解析手段は、吸収波長または蛍光を指標とすることを特徴としてもよい。また、前記光化学反応においては、紫外光によるクロスリンキング法を用いることを特徴としてもよい。
【0024】
また、前記光化学反応の条件は、生体サンプル内のタンパク質濃度と前記光化学反応に用いられる光照射出力との相関関係に基づいて決定されることを特徴としてもよい。また、前記光化学反応の条件は、生体サンプル内のタンパク質濃度とサンプル撹拌強度との相関関係に基づくものであることを特徴としてもよい。
【0025】
本発明に係る光化学反応方法は、タンパク質と核酸を含む生体サンプルに光を照射する光照射工程と、前記光照射工程において光を照射した前記生体サンプルの光学的解析を行う光学的解析工程と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定工程と、前記決定された条件に基づき、前記生体サンプルに光を照射して光化学反応を起こさせる光化学反応工程を含むことを特徴とする。
【発明の効果】
【0026】
本発明によれば、光化学反応による分析フローにおいて、サンプルの移動や分注などの付随作業を軽減し、分析フローの効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる光化学反応装置を実現することが可能となる。
【図面の簡単な説明】
【0027】
【図1】本実施形態に係る光化学反応装置の構成を示す概略図である。
【図2】本実施形態に係るレボルバーの構成を示す概略図である。
【図3】本実施形態に係る光化学反応工程のフローチャートである。
【図4】光化学反応におけるタンパク質濃度とそれに対応する最適な条件の例を示したグラフである。
【発明を実施するための形態】
【0028】
以下、本発明の実施の形態について図1〜図4を用いて説明する。なお、本発明の図面において、同一の参照符号は、同一部分または相当部分を表わすものとする。本実施形態は、本発明を利用した一例であり、これに限られない。本実施形態では、光化学反応によるタンパク質−核酸の特異性の高い結合を再現性よく、効率的に進める方法の一例として、UVクロスリンキング法を用いた光化学反応によって、DNAとタンパク質を共有結合させ、次の工程である分析工程に進めるための方法を説明する。なお、以下の説明におけるサンプルとは、タンパク質と核酸を含有する溶液を示す。
【0029】
ここで、溶液とは、主に核酸とタンパク質を安定的に保持する緩衝液を示す。DNAやタンパク質など生体高分子を安定的に取り扱うためのものとして、酢酸緩衝液、リン酸緩衝液、クエン酸緩衝液、ホウ酸緩衝液、酒石酸緩衝液、トリス緩衝液、リン酸緩衝生理食塩水、HEPES緩衝液、MOPS緩衝液などが利用可能である。溶液に関するデータとしては、緩衝液の種類、pH、温度、体積、含まれるタンパク質、核酸の濃度、またはきょう雑物の組成等がある。
【0030】
また、タンパク質とは、動物由来、植物由来、微生物由来、人工合成由来のもの、または、これらが混成されたもの、さらに糖鎖修飾など翻訳後修飾されたものをいう。動物由来のタンパク質としては、ヒト及びキイロショウジョウバエ、線虫、マウス、モルモット、アフリカツメカエル、メダカ、カニクイザル、ニホンザルなどの実験動物、家畜並びに培養細胞から得られた組織サンプル、抽出サンプルをいう。植物由来のタンパク質とは、農業用植物、トウモロコシやサトウキビなど、一般的にバイオエタノールを得るための植物、薬理効果のある植物、漢方薬剤の原料とされる植物などをいう。微生物由来とは、ウイルス、細菌、真菌類、原虫類を指し、特に病原性微生物由来のものをいう。タンパク質に関するデータとして、ポリペプチドの分子量、アミノ酸配列、翻訳後修飾の状態等の情報がある。
【0031】
核酸とは2本鎖デオキシリボ核酸、1本鎖デオキシリボ核酸、cDNA、リボ核酸(伝令RNA(mRNA)、MRNA前駆体(pre−mRNA)、転移RNA(tRNA)、リボゾームRNA(rRNA)、アンチセンスRNA(aRNA)、ガイドRNA(gRNA)、MiRNA(miRNA)、ノンコーディングRNA(ncRNA)、PiRNA(piRNA)、ShRNA(shRNA)、SiRNA(siRNA)、)さらにグリセロール核酸(GNA)、ペプチド核酸(PNA)、トレオース核酸(TNA)などの核酸アナログをいう。また、核酸に関するデータとしては、分子量、塩基配列などの情報がある。
【0032】
さらに、上記タンパク質、核酸を人工的に表面に結合させた磁性ビーズ、蛍光物質も包括して意味する。磁性ビーズとは、直径0.1um〜100um程度の蛍光体、磁性体であり、表面に核酸・抗体・細胞などを結合させ、外部磁場による分離、回収、誘導操作を行うことができる粒子である。また、蛍光物質とは、緑色蛍光タンパク質(GFP)、フルオレセイン・イソチオシアネート(FITC)、ローダミン、Cy2、Cy3、Cy5、フルオレセイン、フィコエリスリン、PE−Texas Red、PE−Cy5、Propidium Iodide、Peridinin Chlorophyll Protein、Texas Red、Allophycocyanin、APC−Cy7など、生体有機物に任意に結合可能な蛍光分子をいう。
【0033】
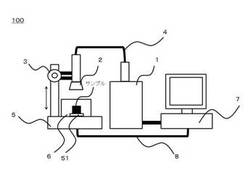
図1は、本発明の一実施形態である光化学反応装置100の構成を示す概略図である。光化学反応装置100は、光源1、レボルバー2、照射距離可変部3、光ファイバ4、解析装置5、撹拌・温度調節装置6、入力・演算装置7、通信ケーブル8より構成される。
【0034】
光源1は、光化学反応に必要な光照射条件を解析するために、サンプルに光を照射するものであり、かつ、解析に基づいて決定された光照射条件により、サンプルの光化学反応を促進するための光を照射するものである。光源1は、キセノンランプ、低圧水銀ランプ、高圧水銀ランプ、超高圧水銀ランプ、ナトリウムランプ、気体レーザ、液体レーザ、固体レーザなどが好適に用いられる。UVクロスリンキング法においては200nmから400nmの範囲の光波長照射可能な性能が求められる。さらに、光源1は、狭い光波長帯域において、高い分光特性を任意に設定できるように光学フィルタを備えるのが望ましい。光学フィルタの種類としては、バンドパスフィルタ、カットオフフィルタ、NDフィルタ、コールドミラーフィルタ、コールドフィルタなどが利用できる。
【0035】
レボルバー2には、分光器と集光レンズが取り付けられ、これらを切り替えることができる構成となっている。詳細は後述するが、これにより一つの光源を光学的解析と、光化学反応に用いることができる。照射距離可変部3は照射距離を任意に変更するための機構で、例えば、顕微鏡の対物レンズを上下方向に可変するのに利用されるハンドル構造を用いることができる。
【0036】
光ファイバ4は、光源1からの光線を集光レンズへ送るケーブルで、純粋石英ファイバ、多成分ファイバなどが利用可能である。なお、光ファイバ4を用いず、光源1と集光レンズを直接接続する構成であっても構わない。
【0037】
解析装置5は、サンプルを通過した光の吸光度、蛍光光度を解析するものであり、サンプルを収納したセルを保持するステージ51を備える。光源1から出射された光が集光レンズを透過してサンプルに照射される。例えば、一般的に280nmの吸光度を測定し、サンプル中のタンパク質濃度を定量することが可能であり、また260nmの吸光度を測定し、サンプル中のDNA濃度を定量することが可能である。
【0038】
さらに、タンパク質やDNAに蛍光物質を標識し、サンプルに励起光を照射し透過したときの蛍光を測定すれば、蛍光量の多寡によって、タンパク質量、DNA量を定量できる。例えば、230nm、280nmの分光測定によって、サンプル中のタンパク質濃度、核酸濃度、きょう雑物濃度を定量化することが可能である。また、例えばDNAやタンパク質に蛍光物質が標識してある場合、蛍光光度によって、濃度測定が可能となる。
【0039】
撹拌・温度調節装置6は、サンプルの撹拌・温度制御を行うものであり、撹拌機構、温度調節機構は入力・演算装置7からの命令によって、制御される。撹拌機構とは具体的に遠心、振動、超音波などによってサンプルを撹拌する機構であり、撹拌によってサンプル中のタンパク質とDNAの結合を促進することができる。温度制御機構とは具体的にはペルチェ素子を用いたものであり、ペルチェ効果を利用し、高精度の温度制御を行うことができる。
【0040】
入力・演算装置7は、一般的なパーソナルコンピューターが利用できる。通信ケーブル8を通じて、解析装置5により解析されたサンプルデータが入力・演算装置7に入力されると、入力・演算装置7に記憶されたあらかじめ設計されたアルゴリズムをもとに、光化学反応に最適な光照射条件を決定する。具体的な光照射条件としては、光波長、出力、サンプルまでの距離、照射時間、サンプルの温度、振とうの有無、さらに、光源1とサンプル間の温度、湿度、明度などである。また、入力・演算装置7は、光化学反応装置100の全体の制御もつかさどり、出力された最適な光照射条件に基づいて、光源1、集光レンズ、ステージ51等の設定を制御する。
【0041】
図2は、レボルバー2の構成の一例を示す平面図である。図2は、光化学反応装置100の解析装置5側から見上げた平面図である。レボルバー2には、分光器21と集光レンズ22が備えられ、レボルバー2が回転することによって、サンプルに対して、任意に分光器21と集光レンズ22を切り替えること可能である。
【0042】
分光器21は、サンプルの吸光度測定、蛍光測定に必要となるもので、回折格子に光を当てて光を分散させ、スリットを通すことで目的波長の単色光を得るものである。集光レンズ22は、主にUVクロスリンクのための光照射に必要となり、光源1から供給する光線を集光し、サンプルに均一に照射するための発射部材であって、クラウン、BK7、合成石英材などの素材のレンズが利用可能である。またサンプルと集光レンズ22間の距離は、入力・演算装置7からの命令によって、機械的に変更可能な仕様であり、集光レンズ22をサンプルへ近づけて照射面積を小さく、照度を大きく制御、あるいは集光レンズ22を任意の距離に遠ざけて照射面積を大きく、照度を小さく制御することができる。また、光源1と集光レンズ22を固定し、分析装置5に設けられたステージ51を昇降させて、照射面積と照度を調整する方法でも構わない。
【実施例】
【0043】
図3は、本実施の形態に基づく光化学反応工程のフローチャートである。なお、フローチャートにおけるSは各ステップを表す。
【0044】
まず、解析装置5のステージ51にセルに収納されたサンプルをセットする(S301)。サンプルを収納するセルは、サンプルの解析のための光照射(以下、プレ照射と記す。)で透過光の分光、蛍光を解析するため、一方から照射した光を反対方向に透過できる透過性の高いものを利用する。セルの材料としては、例えば、石英ガラスセルなどが適している。溶液の選定は従来方法を参考にすることができる。
【0045】
サンプルは任意の配列に設計されたDNA(10bp〜300bp)、タンパク質を結合バッファに溶解する。結合バッファの組成は、15mMのTris−HCl(pH7.5)、75mMのNaCl、1.5mMのEDTA(pH 8.0)、1.5mMのDTT、7.52%のGlycerol、0.3%のNP−40、1mg/mlのBSA、1μg/μlのpoly(dI−dC)とした。
【0046】
次に、サンプルに対してプレ照射を行う(S302)。本実施例では、重水素ランプとタングステンランプを備えた光源1を用いて、レボルバー2を操作して分光器21をセットして200nm〜700nmの範囲で光照射し、解析装置5に備えられている光電子増倍管またはフォトダイオードなどの検出器によって、紫外可視光スペクトルを解析する。
【0047】
次に、サンプルの上部より照射された光がサンプルを透過した光を、サンプル下部に位置する解析装置4によって、解析する(S303)。吸収波長、蛍光など様々な指標を元に解析することができるが、例えば、サンプルに光をあて、その光がサンプルを通過する際の、対象となる物質による光の吸収の程度、すなわち吸光度を測定することにより、その物質の濃度を定量的に分析する吸光光度法が有用である。280nm波長の光を照射し、その吸光度を測定することによって、サンプルの中のタンパク質濃度を求めることができる。また、同様に260nmの吸光度を測定することによって、サンプルの中のDNA濃度を求めることができる。さらに、事前にタンパク質やDNAに蛍光体を標識しておけば、サンプル中の蛍光波長、蛍光量を測定することによって、タンパク質やDNAの同定や濃度換算を行うことができる。また、280nmや280nm波長以外のバックグラウンド波長を測定することによって、きょう雑物を分析することができる。
【0048】
上記の方法で、220nm〜700nmの範囲を網羅的に分析した場合、サンプル中にタンパク質のみを含有する場合、280nmをピークとする山なりのデータを得られた。DNAのみを含有する場合260nmをピークとする山なりのデータを得られた。
【0049】
次に、入力・演算装置7において、上記解析で得られたサンプルデータを指標として、最適な光化学反応条件の演算を行う(S304)。入力・演算装置7には、各測定データに対する最適条件を示す情報があらかじめ記憶されており、この情報を元に測定データに対する光化学反応の最適条件を導き出す。
【0050】
例えば、波長280nmの吸光度を[Abs280]とすると、このときのタンパク質濃度P(mg/ml)は、下記の式(1)により概算できる。
【0051】
P=1.55×[Abs280]−[Abs280]・・・式(1)
図4は、光化学反応におけるタンパク質濃度とそれに対応する最適な条件の例を示したグラフである。図4(a)は、タンパク質濃度と照度あるいはサンプルまでの距離との関係、図4(b)はタンパク質濃度と撹拌強度の関係を示している。例えば、図4(a)において、タンパク質濃度がxであった場合、最適な照度はy(W/cm2)となる。タンパク質濃度と照度の関係においては、一定のタンパク質濃度zまでは、タンパク質濃度が高くなるにつれて、照度は低くなるという負の相関関係にあり、一定のタンパク質濃度zを超えて高くなると、照度は低下せず、一定の照度で推移する。これは、UVクロスリンキング法には、最低限一定以上の光エネルギーが必要となるためである。このため、図4(a)に示したような、あるタンパク質濃度まではタンパク質濃度と照度は負の相関関係にあり、あるタンパク質濃度を超えると一定の照度が必要であるという関係が成り立つ。このような相関関係に基づき、最適な照度y(W/cm2)となる集光レンズ2とサンプル間の距離も決定される。あるいは、集光レンズ2とサンプル間の距離は固定したまま、光源1の照射強度を変更される。
【0052】
同様に、図4(b)で示すように、タンパク質濃度に応じて、適切な撹拌強度を決定することができる。タンパク質濃度が高いと、非特異的にタンパク質と核酸が結合する可能性が高くなるという正の相関関係がある。そこで、この正の相関関係に基づき、光化学反応中、適切に撹拌することによって非特異的結合を抑えることができる。各種パラメーターに対して照射条件を演算する方法はこれ以外にも、DNA濃度、きょう雑物濃度等を元に最適な照射波長、照射時間、サンプルの温度などを決定する方法がある。
【0053】
次に、レボルバー2を操作して、集光レンズ22を光源1にセットし、上記で決定された最適な光化学反応条件に基づいて、光源1、集光レンズ22、ステージ51等の設定を変更する(S305)。例えば、上記において、最適な照度がyとなるように、集光レンズ22とステージ51の距離を変更するか、光源1の発光強度を変更する。
【0054】
最後に、光化学反応を進めるためにステップS305で設定された最適条件の下、サンプルに光を照射する(S306)。なお、光照射中は、生体サンプルが変性することを抑制するため、4℃に冷却することが望ましいが、光照射中に限らず、光化学反応の全工程において、ほぼ4℃の条件下で行うのが更に望ましい。ここで、従来の方法であれば、光化学反応を起こすために、光化学反応装置にサンプルを移動させなければならなかったが、本発明においては、ステップS302におけるプレ照射のための光源1と、光化学反応のための光源1が同じものであるため、照射対象となるサンプルの移動を必要とせず、自動的に効率よく光化学反応を進めることができる。また、同じステージで照射を行うため、サンプルの不要な移し変えによるロスや変性も軽減することができる。更に、従来はサンプル解析のための照射装置と光化学反応装置が別々であったところ、装置を1台にしたので設置面積が小さくて済み、装置の小型化も実現することができた。
【0055】
光化学反応後は、SDS−PAGEによって分離、展開することが可能である。本発明による光化学反応装置100を用いてサンプルの分析を行い、分析結果に応じた適切な条件に基づくUVクロスリンキング法によるUV照射によってタンパク質とDNAが共有結合した強固な複合体を形成するため、SDS−PAGEによってタンパク質とDNAは解離することなく、電気泳動による分離展開が可能となる。電気泳動の実験条件は10%SDSポリアクリルアミドゲルで電気泳動することで、DNAとタンパク質の複合体(DBP)を分離することができる。さらにこの分離したDBPをポリアクリルアミドゲルから単理し、プロテアーゼで切断し回収すれば、質量分析によってタンパク質のアミノ酸残基を同定することができる。
【0056】
以上説明したように、生体サンプルの光学的解析を行う光源と、光化学反応を進めるための光源を兼ねる構成としたことにより、サンプルの移動や分注などの付随作業を軽減し、分析フローの効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる光化学反応装置を実現することができた。
【0057】
本発明において、サンプル分析と光照射条件の最適化を効率化することにより、タンパク質と核酸の相互作用分析の全フローの効率化に寄与することができた。
【産業上の利用可能性】
【0058】
本発明に係る光化学反応装置は、実験用生体サンプル解析の理化学機器、環境中の生体サンプル解析の環境測定機器、臨床サンプル解析の医療診断機器に好適に利用できる。
【符号の説明】
【0059】
1 光源
2 レボルバー
3 照射距離可変部
4 光ファイバ
5 解析装置
6 撹拌・温度調節装置
7 入力・演算装置
8 通信ケーブル
21 分光器
22 集光レンズ
51 ステージ
100 光化学反応装置
【技術分野】
【0001】
本発明は、生体サンプルに含まれるタンパク質と核酸の相互作用分析を行う光化学反応装置及び光化学反応方法に関する。
【背景技術】
【0002】
近年の生物学の分野において、転写及び翻訳を調節する機構の解明は重要課題として位置付けられている。生体の設計図であるDNAから、mRNAへの転写、機能体であるタンパク質が合成される翻訳までの一連のセントラルドグマをコントールする上で、DNA結合タンパク質(DBP)やRNA結合タンパク質(RBP)が必要不可欠な存在として知られている。
【0003】
DBPは対象となるDNAに対して親和性を示す部位を有しており、DNAのある配列と特異的に結合するタンパク質と非特異的に結合するタンパク質の大きく2つの種類に分類される。
【0004】
特定のDNA配列と特異的に結合するタンパク質の代表として、転写調節タンパク質がある。転写調節タンパク質は、DNA上のプロモーターやエンハンサーと呼ばれる配列に結合し、DNAの遺伝情報をRNAに転写する過程を促進、あるいは逆に抑制する機能をもち、1,800以上存在する。
【0005】
非特異的に結合するタンパク質の代表としては、酵素タンパク質が挙げられる。酵素タンパク質は、DNAの複製、修復、組み換えなどに関与し、例えば、DNA変異配列の修復やメチル化などの役割を担うことが知られている。
【0006】
一方、DNAから転写されたRNAは一次RNAと呼ばれるが、この一次RNAは、タンパク質に翻訳されるまでの過程で、プレRNAスプライシング、RNAエディティング、核と細胞質の間のmRNAのシャッフリング、など様々な制御を受ける。近年の研究によって、RNA結合タンパク質(RBP)はこのようなRNAの制御に必要不可欠な分子であり、RBPの欠損は様々な疾患、例えば神経疾患、免疫疾患、代謝疾患の直接的な原因になることが明らかにされてきた(非特許文献1)。
【0007】
このようにDBP及びRBPは、生体現象の根幹となる転写及び翻訳機構の調節因子であり、医学、分子生物学、農学、薬学など生命科学の学際分野で広く、その理解が求められている。そして、これらの研究は、同定及び機能解析の二つの観点から進められている。
【0008】
RNAとタンパク質の分析においては、光化学反応法の一種であるCLIP法(crosslinking and immunoprecipitation assay)が知られている(非特許文献2)。
【0009】
また、特定のタンパク質と特定のDNA配列が結合することを確認する手法としては、紫外光による光化学反応を利用するUV(ultraviolet)クロスリンキング法(以下、UVクロスリンキング法と記す。)が知られている(特許文献1、非特許文献3、非特許文献4)。
【0010】
タンパク質とDNAの結合は、共有結合以外の化学結合で結ばれ、結合が不安定で分析が困難であることが多い。例えば、タンパク質の電気泳動でSDS−PAGE(SDS−ポリアクリルアミドゲル電気泳動)は最も汎用性のある方法であるが、タンパク質にSDS(sodium dodecyl sulfate:ドデシル硫酸ナトリウム、ラウリル硫酸ナトリウム)を修飾するとタンパク質が変性し、DNAとの結合がはずれるため、SDS−PAGEによってDNAとタンパク質の複合体を確認することができない。
【0011】
UVクロスリンキング法はこのような、問題点を鑑み、タンパク質とDNAの結合を共有結合によって安定化させる技術である。具体的には、任意のタンパク質とDNA断片を紫外線領域の光波長(254nm、260nm、305nm、310nm、320nm、などから選択される波長)を照射し、光化学反応によって特定のアミノ酸と塩基を共有結合させ、核酸タンパク質複合体を形成させる。このような核酸タンパク質複合体をSDS−PAGEによって分離展開する。UV照射によってタンパク質とDNAが共有結合した強固な複合体を形成するため、SDSによってタンパク質とDNAは解離することなく、電気泳動による分離展開が可能となる。電気泳動後はさらに、質量分析によるタンパク質の同定や、ウェスタンブロッティングによる解析を行うことができる。
【0012】
または、光化学反応で形成した核酸タンパク質複合体を免疫沈降によって任意のタンパク質を回収することも可能である。一般的な免疫沈降は、目的のタンパク質(DBP、RBP)を認識、結合する磁性ビーズ結合抗体(磁性ビーズと抗体を結合したもの)を用意し、抗原抗体反応によって、目的のタンパクを捉えた上、磁力によってこの目的のタンパク質のみを回収する手段である。その後、シーケンス解読作業によって、DNAまたはRNA配列を決定することができる。
【0013】
UVクロスリンキング法などの光化学反応法は、一般的に最適な照射条件を決定することが重要とされ、一般的な作業工程として、まずサンプルの内容を分析して、光照射条件を決定し、次に光照射反応を行った後、電気泳動による分析の順で行う。ここで、光照射反応に先だって、サンプルの内容を解析し、それに応じて光照射条件の設定を変更することが必要である。この場合の光照射条件とは、紫外線領域の光線の波長、出力、照射時間や、光照射時のサンプルの温度調節、撹拌条件を指す。この光照射条件は、サンプルごとに最適化する必要があり、概して、光照射が不十分でタンパク質とDNAへの照射量が低い場合は、結合が弱く、その後のSDS−PAGEによって分離ができない。また、照射量が大きい場合は、DNAにダメージを与え、DNA鎖を切断してしまうなどの不具合が生じる。したがって、光照射反応に先立って行うサンプル分析と光条件の最適化は、タンパク質と核酸の相互作用分析にとって重要な工程といえる。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】特表2007−515186号公報(平成19年6月14日公表)
【非特許文献】
【0015】
【非特許文献1】Lynne E.Maquat,et.al., Cell,Vol.104,173−176(2001)
【非特許文献2】Kirk B.Jensen,et.al., RNA−protein interaction protocols second edition,85−98(2008)
【非特許文献3】J.G.Peak,et.al.,Photochemistry and Photobiology,Vol.41, No.3,295−302(1985)
【非特許文献4】礒辺 俊明他 「分子相互作用解析ハンドブック」羊土社 164−167
【発明の概要】
【発明が解決しようとする課題】
【0016】
しかしながら、電気泳動分析に先立って行われる光化学反応法においては、上記に示したように、一般的にはまず、サンプルの内容を分析して光照射条件を決定し、次に該サンプルに対し、光照射して反応を起こすという手順で進められるが、サンプルの内容を分析する吸光度測定装置あるいは蛍光測定装置などの分析装置と、光を照射して光化学反応を起こす照射装置はそれぞれ別の装置を必要としていた。
【0017】
具体的には、分析装置によって行われるサンプル分析においては、一般に吸光度測定や蛍光測定などの光学的分析方法によって、サンプル中のタンパク質濃度やDNA濃度を測定するが、これらの光学的分析に必要な波長の単色光は、光源からの光を分光器を介して得られ、サンプルに対し、常に一定の光照射距離をおいて照射される。そして、このサンプル分析には、分析対象のサンプルの分注作業、濃度分析作業を伴い、これらの作業を経て光照射条件が決定される。
【0018】
この後、光照射装置によって行われる光照射反応においては、光照射装置へサンプルを移動し、光照射装置の仕様に応じた量にサンプルを分注する作業などを経て光照射が行われる。ここで、UVクロスリンキング法などを用いて光化学反応を起こす場合には、一般に光源からの光を集光レンズを介して、照射距離を変化させながら、サンプルに光を均一に照射し、光化学反応を進行させる。
【0019】
このように分析装置と光照射装置が別々であった場合は、分析装置から光照射装置へのサンプルの移動に伴う作業、すなわち実際の測定、照射等の装置動作に伴う付随作業が必要となり、時間的、労力的なロスが発生する。さらに、微量で貴重な生体由来のサンプルの取り扱いには慎重を期すため、時間をかけてサンプルを何度も容器に移し替えることは、サンプル量のロスやサンプル変性の原因となるという課題があった。
【0020】
そこで、本発明は、上述課題に鑑みてなされたものであり、光化学反応による分析において、サンプルの移動や分注などの付随作業を軽減し、分析の効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる分析装置を実現することを目的とする。
【課題を解決するための手段】
【0021】
本発明に係る光化学反応装置は、タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする。
【0022】
また、前記光化学反応装置は、前記光学的解析に用いる分光手段と、前記光化学反応に用いる集光手段と、前記分光手段と前記集光手段に用いる、各々のレンズを切り替える切り替え手段を備えることを特徴としてもよい。また、前記光化学反応装置は、前記光照射手段と前記生体サンプルとの距離を変更する照射距離変更手段を備えることを特徴としてもよい。
【0023】
また、前記光学的解析手段は、吸収波長または蛍光を指標とすることを特徴としてもよい。また、前記光化学反応においては、紫外光によるクロスリンキング法を用いることを特徴としてもよい。
【0024】
また、前記光化学反応の条件は、生体サンプル内のタンパク質濃度と前記光化学反応に用いられる光照射出力との相関関係に基づいて決定されることを特徴としてもよい。また、前記光化学反応の条件は、生体サンプル内のタンパク質濃度とサンプル撹拌強度との相関関係に基づくものであることを特徴としてもよい。
【0025】
本発明に係る光化学反応方法は、タンパク質と核酸を含む生体サンプルに光を照射する光照射工程と、前記光照射工程において光を照射した前記生体サンプルの光学的解析を行う光学的解析工程と、前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定工程と、前記決定された条件に基づき、前記生体サンプルに光を照射して光化学反応を起こさせる光化学反応工程を含むことを特徴とする。
【発明の効果】
【0026】
本発明によれば、光化学反応による分析フローにおいて、サンプルの移動や分注などの付随作業を軽減し、分析フローの効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる光化学反応装置を実現することが可能となる。
【図面の簡単な説明】
【0027】
【図1】本実施形態に係る光化学反応装置の構成を示す概略図である。
【図2】本実施形態に係るレボルバーの構成を示す概略図である。
【図3】本実施形態に係る光化学反応工程のフローチャートである。
【図4】光化学反応におけるタンパク質濃度とそれに対応する最適な条件の例を示したグラフである。
【発明を実施するための形態】
【0028】
以下、本発明の実施の形態について図1〜図4を用いて説明する。なお、本発明の図面において、同一の参照符号は、同一部分または相当部分を表わすものとする。本実施形態は、本発明を利用した一例であり、これに限られない。本実施形態では、光化学反応によるタンパク質−核酸の特異性の高い結合を再現性よく、効率的に進める方法の一例として、UVクロスリンキング法を用いた光化学反応によって、DNAとタンパク質を共有結合させ、次の工程である分析工程に進めるための方法を説明する。なお、以下の説明におけるサンプルとは、タンパク質と核酸を含有する溶液を示す。
【0029】
ここで、溶液とは、主に核酸とタンパク質を安定的に保持する緩衝液を示す。DNAやタンパク質など生体高分子を安定的に取り扱うためのものとして、酢酸緩衝液、リン酸緩衝液、クエン酸緩衝液、ホウ酸緩衝液、酒石酸緩衝液、トリス緩衝液、リン酸緩衝生理食塩水、HEPES緩衝液、MOPS緩衝液などが利用可能である。溶液に関するデータとしては、緩衝液の種類、pH、温度、体積、含まれるタンパク質、核酸の濃度、またはきょう雑物の組成等がある。
【0030】
また、タンパク質とは、動物由来、植物由来、微生物由来、人工合成由来のもの、または、これらが混成されたもの、さらに糖鎖修飾など翻訳後修飾されたものをいう。動物由来のタンパク質としては、ヒト及びキイロショウジョウバエ、線虫、マウス、モルモット、アフリカツメカエル、メダカ、カニクイザル、ニホンザルなどの実験動物、家畜並びに培養細胞から得られた組織サンプル、抽出サンプルをいう。植物由来のタンパク質とは、農業用植物、トウモロコシやサトウキビなど、一般的にバイオエタノールを得るための植物、薬理効果のある植物、漢方薬剤の原料とされる植物などをいう。微生物由来とは、ウイルス、細菌、真菌類、原虫類を指し、特に病原性微生物由来のものをいう。タンパク質に関するデータとして、ポリペプチドの分子量、アミノ酸配列、翻訳後修飾の状態等の情報がある。
【0031】
核酸とは2本鎖デオキシリボ核酸、1本鎖デオキシリボ核酸、cDNA、リボ核酸(伝令RNA(mRNA)、MRNA前駆体(pre−mRNA)、転移RNA(tRNA)、リボゾームRNA(rRNA)、アンチセンスRNA(aRNA)、ガイドRNA(gRNA)、MiRNA(miRNA)、ノンコーディングRNA(ncRNA)、PiRNA(piRNA)、ShRNA(shRNA)、SiRNA(siRNA)、)さらにグリセロール核酸(GNA)、ペプチド核酸(PNA)、トレオース核酸(TNA)などの核酸アナログをいう。また、核酸に関するデータとしては、分子量、塩基配列などの情報がある。
【0032】
さらに、上記タンパク質、核酸を人工的に表面に結合させた磁性ビーズ、蛍光物質も包括して意味する。磁性ビーズとは、直径0.1um〜100um程度の蛍光体、磁性体であり、表面に核酸・抗体・細胞などを結合させ、外部磁場による分離、回収、誘導操作を行うことができる粒子である。また、蛍光物質とは、緑色蛍光タンパク質(GFP)、フルオレセイン・イソチオシアネート(FITC)、ローダミン、Cy2、Cy3、Cy5、フルオレセイン、フィコエリスリン、PE−Texas Red、PE−Cy5、Propidium Iodide、Peridinin Chlorophyll Protein、Texas Red、Allophycocyanin、APC−Cy7など、生体有機物に任意に結合可能な蛍光分子をいう。
【0033】
図1は、本発明の一実施形態である光化学反応装置100の構成を示す概略図である。光化学反応装置100は、光源1、レボルバー2、照射距離可変部3、光ファイバ4、解析装置5、撹拌・温度調節装置6、入力・演算装置7、通信ケーブル8より構成される。
【0034】
光源1は、光化学反応に必要な光照射条件を解析するために、サンプルに光を照射するものであり、かつ、解析に基づいて決定された光照射条件により、サンプルの光化学反応を促進するための光を照射するものである。光源1は、キセノンランプ、低圧水銀ランプ、高圧水銀ランプ、超高圧水銀ランプ、ナトリウムランプ、気体レーザ、液体レーザ、固体レーザなどが好適に用いられる。UVクロスリンキング法においては200nmから400nmの範囲の光波長照射可能な性能が求められる。さらに、光源1は、狭い光波長帯域において、高い分光特性を任意に設定できるように光学フィルタを備えるのが望ましい。光学フィルタの種類としては、バンドパスフィルタ、カットオフフィルタ、NDフィルタ、コールドミラーフィルタ、コールドフィルタなどが利用できる。
【0035】
レボルバー2には、分光器と集光レンズが取り付けられ、これらを切り替えることができる構成となっている。詳細は後述するが、これにより一つの光源を光学的解析と、光化学反応に用いることができる。照射距離可変部3は照射距離を任意に変更するための機構で、例えば、顕微鏡の対物レンズを上下方向に可変するのに利用されるハンドル構造を用いることができる。
【0036】
光ファイバ4は、光源1からの光線を集光レンズへ送るケーブルで、純粋石英ファイバ、多成分ファイバなどが利用可能である。なお、光ファイバ4を用いず、光源1と集光レンズを直接接続する構成であっても構わない。
【0037】
解析装置5は、サンプルを通過した光の吸光度、蛍光光度を解析するものであり、サンプルを収納したセルを保持するステージ51を備える。光源1から出射された光が集光レンズを透過してサンプルに照射される。例えば、一般的に280nmの吸光度を測定し、サンプル中のタンパク質濃度を定量することが可能であり、また260nmの吸光度を測定し、サンプル中のDNA濃度を定量することが可能である。
【0038】
さらに、タンパク質やDNAに蛍光物質を標識し、サンプルに励起光を照射し透過したときの蛍光を測定すれば、蛍光量の多寡によって、タンパク質量、DNA量を定量できる。例えば、230nm、280nmの分光測定によって、サンプル中のタンパク質濃度、核酸濃度、きょう雑物濃度を定量化することが可能である。また、例えばDNAやタンパク質に蛍光物質が標識してある場合、蛍光光度によって、濃度測定が可能となる。
【0039】
撹拌・温度調節装置6は、サンプルの撹拌・温度制御を行うものであり、撹拌機構、温度調節機構は入力・演算装置7からの命令によって、制御される。撹拌機構とは具体的に遠心、振動、超音波などによってサンプルを撹拌する機構であり、撹拌によってサンプル中のタンパク質とDNAの結合を促進することができる。温度制御機構とは具体的にはペルチェ素子を用いたものであり、ペルチェ効果を利用し、高精度の温度制御を行うことができる。
【0040】
入力・演算装置7は、一般的なパーソナルコンピューターが利用できる。通信ケーブル8を通じて、解析装置5により解析されたサンプルデータが入力・演算装置7に入力されると、入力・演算装置7に記憶されたあらかじめ設計されたアルゴリズムをもとに、光化学反応に最適な光照射条件を決定する。具体的な光照射条件としては、光波長、出力、サンプルまでの距離、照射時間、サンプルの温度、振とうの有無、さらに、光源1とサンプル間の温度、湿度、明度などである。また、入力・演算装置7は、光化学反応装置100の全体の制御もつかさどり、出力された最適な光照射条件に基づいて、光源1、集光レンズ、ステージ51等の設定を制御する。
【0041】
図2は、レボルバー2の構成の一例を示す平面図である。図2は、光化学反応装置100の解析装置5側から見上げた平面図である。レボルバー2には、分光器21と集光レンズ22が備えられ、レボルバー2が回転することによって、サンプルに対して、任意に分光器21と集光レンズ22を切り替えること可能である。
【0042】
分光器21は、サンプルの吸光度測定、蛍光測定に必要となるもので、回折格子に光を当てて光を分散させ、スリットを通すことで目的波長の単色光を得るものである。集光レンズ22は、主にUVクロスリンクのための光照射に必要となり、光源1から供給する光線を集光し、サンプルに均一に照射するための発射部材であって、クラウン、BK7、合成石英材などの素材のレンズが利用可能である。またサンプルと集光レンズ22間の距離は、入力・演算装置7からの命令によって、機械的に変更可能な仕様であり、集光レンズ22をサンプルへ近づけて照射面積を小さく、照度を大きく制御、あるいは集光レンズ22を任意の距離に遠ざけて照射面積を大きく、照度を小さく制御することができる。また、光源1と集光レンズ22を固定し、分析装置5に設けられたステージ51を昇降させて、照射面積と照度を調整する方法でも構わない。
【実施例】
【0043】
図3は、本実施の形態に基づく光化学反応工程のフローチャートである。なお、フローチャートにおけるSは各ステップを表す。
【0044】
まず、解析装置5のステージ51にセルに収納されたサンプルをセットする(S301)。サンプルを収納するセルは、サンプルの解析のための光照射(以下、プレ照射と記す。)で透過光の分光、蛍光を解析するため、一方から照射した光を反対方向に透過できる透過性の高いものを利用する。セルの材料としては、例えば、石英ガラスセルなどが適している。溶液の選定は従来方法を参考にすることができる。
【0045】
サンプルは任意の配列に設計されたDNA(10bp〜300bp)、タンパク質を結合バッファに溶解する。結合バッファの組成は、15mMのTris−HCl(pH7.5)、75mMのNaCl、1.5mMのEDTA(pH 8.0)、1.5mMのDTT、7.52%のGlycerol、0.3%のNP−40、1mg/mlのBSA、1μg/μlのpoly(dI−dC)とした。
【0046】
次に、サンプルに対してプレ照射を行う(S302)。本実施例では、重水素ランプとタングステンランプを備えた光源1を用いて、レボルバー2を操作して分光器21をセットして200nm〜700nmの範囲で光照射し、解析装置5に備えられている光電子増倍管またはフォトダイオードなどの検出器によって、紫外可視光スペクトルを解析する。
【0047】
次に、サンプルの上部より照射された光がサンプルを透過した光を、サンプル下部に位置する解析装置4によって、解析する(S303)。吸収波長、蛍光など様々な指標を元に解析することができるが、例えば、サンプルに光をあて、その光がサンプルを通過する際の、対象となる物質による光の吸収の程度、すなわち吸光度を測定することにより、その物質の濃度を定量的に分析する吸光光度法が有用である。280nm波長の光を照射し、その吸光度を測定することによって、サンプルの中のタンパク質濃度を求めることができる。また、同様に260nmの吸光度を測定することによって、サンプルの中のDNA濃度を求めることができる。さらに、事前にタンパク質やDNAに蛍光体を標識しておけば、サンプル中の蛍光波長、蛍光量を測定することによって、タンパク質やDNAの同定や濃度換算を行うことができる。また、280nmや280nm波長以外のバックグラウンド波長を測定することによって、きょう雑物を分析することができる。
【0048】
上記の方法で、220nm〜700nmの範囲を網羅的に分析した場合、サンプル中にタンパク質のみを含有する場合、280nmをピークとする山なりのデータを得られた。DNAのみを含有する場合260nmをピークとする山なりのデータを得られた。
【0049】
次に、入力・演算装置7において、上記解析で得られたサンプルデータを指標として、最適な光化学反応条件の演算を行う(S304)。入力・演算装置7には、各測定データに対する最適条件を示す情報があらかじめ記憶されており、この情報を元に測定データに対する光化学反応の最適条件を導き出す。
【0050】
例えば、波長280nmの吸光度を[Abs280]とすると、このときのタンパク質濃度P(mg/ml)は、下記の式(1)により概算できる。
【0051】
P=1.55×[Abs280]−[Abs280]・・・式(1)
図4は、光化学反応におけるタンパク質濃度とそれに対応する最適な条件の例を示したグラフである。図4(a)は、タンパク質濃度と照度あるいはサンプルまでの距離との関係、図4(b)はタンパク質濃度と撹拌強度の関係を示している。例えば、図4(a)において、タンパク質濃度がxであった場合、最適な照度はy(W/cm2)となる。タンパク質濃度と照度の関係においては、一定のタンパク質濃度zまでは、タンパク質濃度が高くなるにつれて、照度は低くなるという負の相関関係にあり、一定のタンパク質濃度zを超えて高くなると、照度は低下せず、一定の照度で推移する。これは、UVクロスリンキング法には、最低限一定以上の光エネルギーが必要となるためである。このため、図4(a)に示したような、あるタンパク質濃度まではタンパク質濃度と照度は負の相関関係にあり、あるタンパク質濃度を超えると一定の照度が必要であるという関係が成り立つ。このような相関関係に基づき、最適な照度y(W/cm2)となる集光レンズ2とサンプル間の距離も決定される。あるいは、集光レンズ2とサンプル間の距離は固定したまま、光源1の照射強度を変更される。
【0052】
同様に、図4(b)で示すように、タンパク質濃度に応じて、適切な撹拌強度を決定することができる。タンパク質濃度が高いと、非特異的にタンパク質と核酸が結合する可能性が高くなるという正の相関関係がある。そこで、この正の相関関係に基づき、光化学反応中、適切に撹拌することによって非特異的結合を抑えることができる。各種パラメーターに対して照射条件を演算する方法はこれ以外にも、DNA濃度、きょう雑物濃度等を元に最適な照射波長、照射時間、サンプルの温度などを決定する方法がある。
【0053】
次に、レボルバー2を操作して、集光レンズ22を光源1にセットし、上記で決定された最適な光化学反応条件に基づいて、光源1、集光レンズ22、ステージ51等の設定を変更する(S305)。例えば、上記において、最適な照度がyとなるように、集光レンズ22とステージ51の距離を変更するか、光源1の発光強度を変更する。
【0054】
最後に、光化学反応を進めるためにステップS305で設定された最適条件の下、サンプルに光を照射する(S306)。なお、光照射中は、生体サンプルが変性することを抑制するため、4℃に冷却することが望ましいが、光照射中に限らず、光化学反応の全工程において、ほぼ4℃の条件下で行うのが更に望ましい。ここで、従来の方法であれば、光化学反応を起こすために、光化学反応装置にサンプルを移動させなければならなかったが、本発明においては、ステップS302におけるプレ照射のための光源1と、光化学反応のための光源1が同じものであるため、照射対象となるサンプルの移動を必要とせず、自動的に効率よく光化学反応を進めることができる。また、同じステージで照射を行うため、サンプルの不要な移し変えによるロスや変性も軽減することができる。更に、従来はサンプル解析のための照射装置と光化学反応装置が別々であったところ、装置を1台にしたので設置面積が小さくて済み、装置の小型化も実現することができた。
【0055】
光化学反応後は、SDS−PAGEによって分離、展開することが可能である。本発明による光化学反応装置100を用いてサンプルの分析を行い、分析結果に応じた適切な条件に基づくUVクロスリンキング法によるUV照射によってタンパク質とDNAが共有結合した強固な複合体を形成するため、SDS−PAGEによってタンパク質とDNAは解離することなく、電気泳動による分離展開が可能となる。電気泳動の実験条件は10%SDSポリアクリルアミドゲルで電気泳動することで、DNAとタンパク質の複合体(DBP)を分離することができる。さらにこの分離したDBPをポリアクリルアミドゲルから単理し、プロテアーゼで切断し回収すれば、質量分析によってタンパク質のアミノ酸残基を同定することができる。
【0056】
以上説明したように、生体サンプルの光学的解析を行う光源と、光化学反応を進めるための光源を兼ねる構成としたことにより、サンプルの移動や分注などの付随作業を軽減し、分析フローの効率化が図れるとともに、サンプルの不要な移し変えによるロスや変性を軽減することができる光化学反応装置を実現することができた。
【0057】
本発明において、サンプル分析と光照射条件の最適化を効率化することにより、タンパク質と核酸の相互作用分析の全フローの効率化に寄与することができた。
【産業上の利用可能性】
【0058】
本発明に係る光化学反応装置は、実験用生体サンプル解析の理化学機器、環境中の生体サンプル解析の環境測定機器、臨床サンプル解析の医療診断機器に好適に利用できる。
【符号の説明】
【0059】
1 光源
2 レボルバー
3 照射距離可変部
4 光ファイバ
5 解析装置
6 撹拌・温度調節装置
7 入力・演算装置
8 通信ケーブル
21 分光器
22 集光レンズ
51 ステージ
100 光化学反応装置
【特許請求の範囲】
【請求項1】
タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、
前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、
前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、
前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする光化学反応装置。
【請求項2】
前記光化学反応装置は、
前記光学的解析に用いる分光手段と、
前記光化学反応に用いる集光手段と、
前記分光手段と前記集光手段に用いる、各々のレンズを切り替える切り替え手段を備えることを特徴とする請求項1記載の光化学反応装置。
【請求項3】
前記光化学反応装置は、
前記光照射手段と前記生体サンプルとの距離を変更する照射距離変更手段を備えることを特徴とする請求項1記載の光化学反応装置。
【請求項4】
前記光学的解析手段は、吸収波長または蛍光を指標とすることを特徴とする請求項1ないし請求項3のいずれかに記載の光化学反応装置。
【請求項5】
前記光化学反応においては、紫外光によるクロスリンキング法を用いることを特徴とする請求項1ないし請求項4のいずれかに記載の光化学反応装置。
【請求項6】
前記光化学反応の条件は、生体サンプル内のタンパク質濃度と前記光化学反応に用いられる光照射出力との相関関係に基づいて決定されることを特徴とする請求項1ないし請求項5のいずれかに記載の光化学反応装置。
【請求項7】
前記光化学反応の条件は、生体サンプル内のタンパク質濃度とサンプル撹拌強度との相関関係に基づくものであることを特徴とする請求項1ないし請求項5のいずれかに記載の光化学反応装置。
【請求項8】
タンパク質と核酸を含む生体サンプルに光を照射する光照射工程と、
前記光照射工程において光を照射した前記生体サンプルの光学的解析を行う光学的解析工程と、
前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定工程と、
前記決定された条件に基づき、前記生体サンプルに光を照射して光化学反応を起こさせる光化学反応工程を含むことを特徴とする光化学反応方法。
【請求項1】
タンパク質と核酸とを含む生体サンプルに光を照射する光照射手段と、
前記光照射手段により光を照射した前記生体サンプルの光学的解析を行う光学的解析手段と、
前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定手段とを備え、
前記決定された光化学反応の条件に基づき、前記光照射手段により光を照射して光化学反応を起こさせることを特徴とする光化学反応装置。
【請求項2】
前記光化学反応装置は、
前記光学的解析に用いる分光手段と、
前記光化学反応に用いる集光手段と、
前記分光手段と前記集光手段に用いる、各々のレンズを切り替える切り替え手段を備えることを特徴とする請求項1記載の光化学反応装置。
【請求項3】
前記光化学反応装置は、
前記光照射手段と前記生体サンプルとの距離を変更する照射距離変更手段を備えることを特徴とする請求項1記載の光化学反応装置。
【請求項4】
前記光学的解析手段は、吸収波長または蛍光を指標とすることを特徴とする請求項1ないし請求項3のいずれかに記載の光化学反応装置。
【請求項5】
前記光化学反応においては、紫外光によるクロスリンキング法を用いることを特徴とする請求項1ないし請求項4のいずれかに記載の光化学反応装置。
【請求項6】
前記光化学反応の条件は、生体サンプル内のタンパク質濃度と前記光化学反応に用いられる光照射出力との相関関係に基づいて決定されることを特徴とする請求項1ないし請求項5のいずれかに記載の光化学反応装置。
【請求項7】
前記光化学反応の条件は、生体サンプル内のタンパク質濃度とサンプル撹拌強度との相関関係に基づくものであることを特徴とする請求項1ないし請求項5のいずれかに記載の光化学反応装置。
【請求項8】
タンパク質と核酸を含む生体サンプルに光を照射する光照射工程と、
前記光照射工程において光を照射した前記生体サンプルの光学的解析を行う光学的解析工程と、
前記光学的解析に基づき、生体サンプルの光化学反応の条件を決定する条件決定工程と、
前記決定された条件に基づき、前記生体サンプルに光を照射して光化学反応を起こさせる光化学反応工程を含むことを特徴とする光化学反応方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−110968(P2013−110968A)
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願番号】特願2011−257002(P2011−257002)
【出願日】平成23年11月25日(2011.11.25)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
【公開日】平成25年6月10日(2013.6.10)
【国際特許分類】
【出願日】平成23年11月25日(2011.11.25)
【出願人】(000005049)シャープ株式会社 (33,933)
【Fターム(参考)】
[ Back to top ]

