光増感色素及びこれを用いた色素増感太陽電池
【課題】光電変換効率の優れる光増感色素及びこれを用いた色素増感太陽電池を提供する。
【解決手段】光増感色素は、式(1)又は(2)で表される。

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【解決手段】光増感色素は、式(1)又は(2)で表される。

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、光増感色素及びこれを用いた色素増感太陽電池に関する。
【背景技術】
【0002】
太陽電池としては、単結晶、多結晶あるいはアモルファスのシリコン半導体を用いた太陽電池が、電卓などの電気製品や住宅用などに広く用いられている。しかしながら、このようなシリコン半導体を用いた太陽電池の製造には、プラズマCVDや高温結晶成長プロセスなどの高精度プロセスが用いられるため、多大のエネルギーを必要とするとともに、真空を必要とする高価な装置が必要なために製造コストが高くなっている。
【0003】
そこで、低コストで製造可能な太陽電池として、色素増感太陽電池が提案されている。例えば、酸化チタンのような酸化物半導体にルテニウム金属錯体のような光増感色素を吸着させた材料を用いた色素増感太陽電池が提案されている。
【0004】
色素増感太陽電池は、少なくとも導電性支持体と光増感色素によって増感された色素吸着金属酸化物層を有する。具体的には、導電性支持体は、インジウム添加酸化スズのような透明導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料からなる。色素吸着金属酸化物層は、例えば色素を表面に吸着した酸化チタンのような半導体層からなる。
【0005】
色素増感太陽電池は、導電性支持体の透明導電層側に、例えばルテニウム錯体からなる色素を表面に吸着した色素吸着金属酸化物層を半導体層として形成した負極と、正極となる白金などの金属層あるいは導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料との間に電解質の液を封入したものがある。色素増感太陽電池に光が照射されると、負極では光を吸収した色素の電子が励起し、励起した電子が半導体層に移動し、更に透明電極へと導かれ、正極では導電層からくる電子により電解質を還元する。還元された電解質は色素に電子を伝えることで酸化され、このサイクルで色素増感太陽電池が発電すると考えられている。
【0006】
また、増感色素として上記の金属錯体のほか、有機色素を用いた色素増感太陽電池も提案されている(例えば、特許文献1、2)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2011−06053号公報
【特許文献2】特開2010−126724号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1、2等の有機色素を用いた色素増感太陽電池では光電変換効率のさらなる向上が必要であり、光電変換効率の優れた光増感色素が求められている。
【0009】
本発明は上記事項に鑑みてなされたものであり、その目的とするところは、良好な光電変換効率を示す光増感色素及びこれを用いた色素増感太陽電池を提供することにある。
【課題を解決するための手段】
【0010】
本発明の第1の観点に係る光増感色素は、
式(1)又は(2)で表される、
ことを特徴とする。
【化1】

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【0011】
また、前記R2が、式(3)で表されることが好ましい。
【化2】

(式(3)中、R3はそれぞれ独立して水素又はアルキル基を表す。)
【0012】
本発明の第2の観点に係る光増感色素は、
式(11)(12)又は(13)で表される、
ことを特徴とする。
【化3】

(式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。)
【0013】
本発明の第3の観点に係る色素増感太陽電池は、上記本発明の第1の観点に係る光増感色素又は本発明の第2の観点に係る光増感色素を備えることを特徴とする。
【発明の効果】
【0014】
本発明に係る光増感色素は、良好な光電変換効率を示し、色素増感太陽電池として利用可能である。
【図面の簡単な説明】
【0015】
【図1】色素増感太陽電池の概略構成を示す断面図である。
【図2】実施例における電流密度−電圧特性のグラフである。
【発明を実施するための形態】
【0016】
(光増感色素)
本実施の形態に係る光増感色素は、ベンゾチオフェン(以下、BDT)骨格にシアノアクリル酸基を備えており、式(1)又は(2)で表される。
【化4】

【0017】
式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基である。また、R2は水素又は電子供与性基である。また、nは1以上の整数を表す。
【0018】
光増感色素を用いた色素増感太陽電池では良好な光電変換効率を示す。後述のように、光増感色素を酸化チタン(TiO2)等の酸化物半導体に吸着させて色素増感太陽電池に用いた場合、光増感色素は光照射を受けて励起し、分子内で分極する。BDTがドナー、シアノアクリル酸基がアクセプターとしてそれぞれ機能し、マイナスに帯電したシアノアクリル酸基から、電子が酸化物半導体に移動する。
【0019】
式(1)及び(2)中、R1がアルキル基である場合、アルキル鎖が長いと分子の凝集が抑制される。分子が凝集すると、分子内で分極した後に、電子とホールが再度結合してしまい、変換効率が低下する。
【0020】
式(1)及び(2)中、R2が電子供与性基である場合では、電子供与性基がドナー、BDTはスペーサー、シアノアクリル酸基がアクセプターとして機能し、分子内の分極がより大きくなるのでより好ましい。
【0021】
また、BDT骨格が長くなると、光の吸収領域が広くなる。このため、光増感色素はより効率的に光を吸収し励起されて分極する。
【0022】
上記電子供与性基としては、アミン誘導体や式(3)に示すチオフェン或いはオリゴチオフェンが挙げられる。
【化5】

【0023】
式(3)中、R3は、それぞれ独立して水素又はアルキル基である。また、nは1以上の整数である。オリゴチオフェンは、それ自体色素として機能する。このため、光増感色素は光をより吸収しやすくなり、分子内により大きな分極をもたらす。
【0024】
また、光増感色素のより具体的な例として、式(11)、(12)又は(13)のいずれかで表される化合物が挙げられる。
【化6】

式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。
【0025】
式(11)で表される光増感色素は、例えば、アルキルBDTをホルミル化した後、Knoevenagel反応によって合成することができる。
【0026】
また、式(12)で表される光増感色素は、例えば、以下のようにして合成することができる。アルキルBDTにn−BuLi等のリチオ化試薬を作用させ、鉄(III)アセチルアセトン錯体等の酸化剤で処理することにより、BDTダイマーに導く。その後、Vilsmeir反応によってホルミル化し、Knoevenagel縮合により合成することができる。
【0027】
また、式(13)で表される光増感色素は、例えば、以下のようにして合成することができる。ジハロゲン化アルキルBDTにn−BuLi等のリチオ化試薬を作用させ、N−ホルミルピペリジン等のホルミル化剤で処理してホルミル体に変換する。その後、クアテルチオフェントリブチルスズ誘導体等のオリゴチオフェン化合物とのStilleカップリング反応を行った後、Knoevenagel縮合により合成することができる。
【0028】
(色素増感太陽電池)
本実施の形態に係る色素増感太陽電池は、上述した負極に上述した光増感色素を備える。色素増感太陽電池1の基本的な構成を図1に示す。色素増感太陽電池1は、負極11、正極12、スペーサー14を介し負極11と正極12との間のスペースに充填された電解液層13を備える。
【0029】
負極11は、FTO(Fluorine doped Tin Oxide)ガラス、ITO(Indium Tin Oxide)ガラス等の透明導電性ガラス11aに形成された酸化チタン等の酸化物半導体層11bを有し、酸化物半導体層11bに光増感色素層11cを備える。光増感色素層11cの光増感色素は上述のようにシアノアクリル酸基を有し、シアノアクリル酸基のカルボキシル基が吸着基として機能するため、シアノアクリル酸基が酸化物半導体層に吸着した形態である。
【0030】
電解液層13中の電解質は、光励起され酸化物半導体への電子注入を果たした後の色素を還元するための酸化還元種を含んでいれば特に限定されず、例えば、ヨウ素とヨウ化物(LiI、NaI、KI、CaI2等)の組み合わせ、臭素と臭化物(LiBr、NaBr、KBr、CaBr2等)の組み合わせ等が挙げられる。
【0031】
色素増感太陽電池1では、透明導電性ガラス11aを通過した光によって、光増感色素が励起され分極する。そして、光増感色素のシアノアクリル酸基がアクセプターとなり、酸化物半導体層11bに電子が注入される。電子を放出して酸化された光増感色素は、電解液層13のヨウ素等から電子を受け取り還元される。このように酸化還元反応が光照射によって連続して起こり、外部に電流を創り出す。
【0032】
なお、本実施の形態に係る色素増感太陽電池1は、光増感色素に特徴を有し、その他の層や材料は公知の構造又は材料とすることができ、図1に示す構造のものに限られない。
【実施例】
【0033】
各種光増感色素である化合物を合成し、得られた化合物を用いて色素増感太陽電池を作製し、特性を評価した。なお、合成した化合物の同定は、1H NMR及び質量分析により行った。
【0034】
(合成例1A)
(2’−Cyano−1−(4,8−dihexylbenzo[1,2−b:4,5−b’]dithiophene−2−yl)−acrylic acid(以下、化合物1A)の合成)
以下に記すように、段階的に化合物1Aを合成した。
【0035】
(2−Formyl−4,8−dihexylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物5A)の合成)
窒素雰囲気下で、1,2‐ジクロロエタン(10mL)に4,8−ジヘキシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(以下、化合物4A)(356mg,1.0mmol)を溶解した溶液に、DMF(0.5mL、5.0mmol)を添加した。
0℃に冷却した後、オキシ塩化リン(0.50mL、5.4mmol)をゆっくりと加えた。
この溶液を24時間還流した後、1M塩化アンモニウム溶液(6mL)を添加した。
そして、反応混合物をクロロホルム(30mL×3回)で抽出した。
抽出物を塩水(5mL)で洗浄した後、無水MgSO4で乾燥した。
溶媒を蒸発させて除去した後、残留物をカラムクロマトグラフィー(シリカゲル、ヘキサン、クロロホルム、Rf=0.8)で精製し、淡黄色粉体の化合物5A(339mg、収率90%)を得た。
【0036】
上記の反応式を以下に示す。
【化7】

【0037】
また、得られた化合物5Aの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS):δ 10.15 (s, 1H), 8.21 (s, 1H), 7.59 (d, 1H, J=5.4 Hz), 7.49(d, 1H, J=5.4 Hz), 3.20 (m, 4H), 1.83-1.25 (m, 16H), 0.88(t, 6H, J=7.6 Hz).
【0038】
(化合物1Aの合成)
窒素雰囲気下でシアノ酢酸(680mg、8.0mmol)と5a(285mg、0.80mmol)を50mLフラスコに入れた。そして、クロロホルム(6mL)とアセトニトリル(6mL)を加えた。
更に、ピペリジン(2.0mL、23.4mmol)を加えた。
反応混合物を15時間還流し、10%の酢酸溶液(30mL)を加えた。
混合物をクロロホルム(5mL×3回)で抽出した。
有機相を塩水(10mL)で洗浄した後、無水MgSO4で乾燥し、濾過して真空中で濃縮した。
残留物をカラムクロマトグラフィー(SiO2、クロロホルム及び酢酸エチル(溶離剤として))で精製し、オレンジ粉体の化合物1A(247mg、収率74%)を得た。
【0039】
上記の反応式を以下に示す。
【化8】

【0040】
また、得られた化合物1Aの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.54 (s, 1H), 8.11 (s, 1H), 7.60 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.18 (m, 4H), 1.90-1.25 (m, 16H), 0.89 (t, 6H, J=7.3 Hz).
【0041】
(合成例1B)
(2−Cyano−1−(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene−2−yl)−acrylic acid(以下、化合物1B)の合成)
以下のようにして、段階的に化合物1Bを合成した。
【0042】
(2−Formyl−4,8−didecylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物5B)の合成)
上記化合物5Aの合成における化合物4Aに代えて4,8−ジドデシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(以下、化合物4B)(522mg,0.99mmol)を用いた以外、同様の条件にて合成を行い、淡黄色粉末の化合物5B(385mg、収率70%)を得た。
【0043】
上記の反応式を以下に示す。
【化9】

【0044】
また、得られた化合物5Bの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS):δ 10.15 (s, 1H), 8.21 (s, 1H), 7.59 (d, 1H, J=5.4 Hz), 7.49(d, 1H, J=5.4 Hz), 3.20 (m, 4H), 1.90-1.25 (m, 40H), 0.89(t, 6H, J=7.6 Hz).
【0045】
(化合物1Bの合成)
上記化合物1Aの合成における化合物5Aに代えて化合物5B(279mg,0.50mmol)を用いた以外、同様の条件で合成を行い、オレンジ色粉末の化合物1B(125mg、収率40%)を得た。
【0046】
上記の反応式を以下に示す。
【化10】

【0047】
また、得られた化合物1Bの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.52 (s, 1H), 8.14 (s, 1H), 7.60 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.18 (m, 4H), 1.90-1.25 (m, 40H), 0.89 (t, 6H, J=7.3 Hz).
【0048】
(合成例2)
(2−Cyano−1−{2,2’−Bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)−6−yl}acrylic acid(以下、化合物2)の合成)
以下に記すように、段階的に化合物2を合成した。
【0049】
(2,2’−Bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)(以下、化合物6)の合成)
窒素空気の下で、4,8−ジドデシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(100mg、0.19mmol)をTHF(12mL)に溶解した。
溶液を0℃まで冷やした後、n−ブチルリチウム(0.13mL、0.21mmol)を溶解した1.67Mヘキサン溶液をゆっくり加え、そして、室温で1.5時間攪拌した。
Fe(acac)3(35mg、0.20mmol)を加え、そして、溶液を18時間還流した。
溶液を室温まで冷却した後、飽和塩化アンモニウム溶液(3mL)で希釈し、クロロホルム(10mL×2回)で抽出した。
抽出物を塩水(20mL×3)で洗浄し、無水MgSO4で乾燥した。
溶媒を蒸発し、残留した油分をカラムクロマトグラフィー(Rf=0.2、シリカゲル、ヘキサン)に通し、ヘキサンから再結晶して精製し、黄色固体の化合物6(58mg、収率58%)を得た。
【0050】
上記の反応式を以下に示す。
【化11】

【0051】
また、得られた化合物6の測定値は以下の通りである。
1H-NMR (400MHz, CDCl3) δ 7.34(d, J=4.0 Hz, 2H), 7.33(d, J=4.0Hz, 2H), 3.40(t, J=9.0 Hz, 4H), 2.78(t, J=9.0 Hz, 4H), 1.82-1.20(m, 80H), 0.88(t, J=9.0Hz, 12H).
【0052】
(6−Formyl−2,2’−bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)(以下、化合物7)の合成)
上記化合物5Aの合成おける化合物4Aに代えて化合物6(105mg,0.10mmol)を、トリ塩化メタン(CHCl3)に代えてジクロロエタン(ClCH2CH2Cl)を用いた以外、同様の条件で合成し、淡黄色粉体の化合物7(78mg、収率72%)を得た。
【0053】
上記の反応式を以下に示す。
【化12】

【0054】
また、得られた化合物7の測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 10.16 (s, 1H), 7.99 (s, 1H), 7.24 (d, 2H, J=5.4 Hz), 7.22(d, 2H, J=5.4 Hz), 3.40 (m, 4H), , 1.83-1.25 (m, 16H), 0.88(t, 6H, J=7.6 Hz).
【0055】
(化合物2の合成)
上記化合物1Aの合成における化合物5Aに代えて化合物7(75mg,0.52mmol)を、また、トリ塩化メタン(CHCl3)に代えてTHFを用いた以外、同様の条件で合成し、オレンジ色粉体の化合物2(125mg、収率40%)を得た。
【0056】
上記の反応式を以下に示す。
【化13】

【0057】
また、得られた化合物2の測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.52 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 8.05(s, 1H), 7.59 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.40 (m, 4H), 1.90-1.25 (m, 40H), 0.89(t, 6H, J=7.3 Hz).
【0058】
(合成例3)
(2−Cyano−1−{(benzo[1,2−b:4,5−b’]dithiophene−2−yl)−3,3’’’−dihexyl−2,2’;5’,2’’;5’’,2’’’−quaterthiophene−5−yl}acrylic acid(以下、化合物3)の合成)
以下に記すように、段階的に化合物2を合成した。
【0059】
(2−Formyl−6−bromo−4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物9)の合成)
窒素雰囲気下、1.67M n−ブチルリチウム・ヘキサン溶液(0.07mL、0.12mmol)に、2,6−ジブロモ−4,8−didodecylbenzo[1,2−b:4.5−bジチオフェン(70mg、0.12mmol)をTHFに溶解した溶液(3mL)を−78℃でゆっくり添加した。
−78℃で1時間攪拌した後に、ピペリジン−1−カルバルデヒド(0.012mL、0.21mmol)を加えた。
溶液を室温で一晩攪拌した後、反応を1M HCl水溶液(3mL)を用い0℃でクエンチした。
45分間攪拌した後に、沈殿物をクロロホルム(5mL×2回)で抽出した。そして、有機相を水(5mL)と塩水(5mL)で洗浄し、無水MgSO4で乾燥した後、減圧して濃縮した。
残留物をカラムクロマトグラフィー(シリカゲル)で精製し、淡黄色粉体の化合物9(42mg、収率62%)を得た。
【0060】
上記の反応式を以下に示す。
【化14】

【0061】
また、得られた化合物9の測定値は以下の通りである。
1H-NMR (270 MHz, CDCl3, TMS) δ 7.41 (1 H, s), 7.39 (1 H,s ) 3.17 (t, J = 7.9 Hz, 4H), 1.83-1.30 (m, 24 H), 0.88 (t, J = 7.0 Hz, 6H).
【0062】
(5−(2−formylbenzo[1,2−b:4,5−b’]dithiophene−6−yl)−3,3’’’−dihexyl−2,2’;5’,2’’;5’’,2’’’−quaterthiophene(以下、化合物10)の合成)
50mLフラスコに、化合物9(100mg、0.12mmol)の脱気トルエン溶液(20mL))及び4T−SnBu3(72.7mg、0.12mmol)を入れた。
これに、Pd(PPh3)4(48mg、42μmol)を加えた。
そして、混合物を16時間還流し、室温に冷却した。
反応混合物をセライト・パッドの上に濾過し、トルエンで洗浄した。
濾過水を真空で蒸発した。
残りをシリカゲル・フラッシュ・カラムクロマトグラフィー(ジクロロメタン)及びヘキサン−クロロホルムからの再結晶によって精製し、赤色粉体の化合物10(52mg、収率55%)を得た。
【0063】
上記の反応式を以下に示す。
【化15】

【0064】
また、得られた化合物10の測定値は以下の通りである。
1H-NMR (400 MHz, CDCl3, TMS) δ 10.13 (s, 1H), 8.17 (s, 1H), 7.48 (s, 1H), 7.23 (s, 1H), 7.21 (d, 1H, J = 5.2 Hz), 7.17 (d, 1H, J = 3.8 Hz), 7.16 (d, 1H, J = 3.8 Hz), 7.11 (d, 1H, J = 3.8 Hz), 7.04 (d, 1H, J = 3.8 Hz), 6.95 (d, 1H, J = 5.2 Hz), 3.12-3.21 (m, 4H), 2.79-2.84 (m, 4H), 1.66-1.86 (m, 8H), 1.47-1.26 (m, 48H), 0.84-0.92 (m, 12H).
【0065】
(化合物3の合成)
上記化合物1Aの合成例における化合物5Aに代えて化合物10(35mg,0.031mmol)を用いた以外、同様の条件にて、赤色粉末の化合物3(27mg、収率71%)を得た。
【0066】
上記の反応式を以下に示す。
【化16】

【0067】
また、得られた化合物3の測定値は以下の通りである。
1H-NMR (400 MHz, CDCl3, TMS) δ 8.33 (s, 1H), 8.06 (s, 1H), 7.47 (s, 1H), 7.23 (s, 1H), 7.20 (d, 1H, J = 6.0 Hz), 7.15 (d, 1H, J = 3.4 Hz), 7.14 (d, 1H, J = 3.7 Hz), 7.09 (d, 1H, J = 3.7 Hz), 7.04 (d, 1H, J = 3.4 Hz), 6.95 (d, 1H, J = 6.0 Hz), 3.04-3.18 (m, 4H), 2.71-2.81 (m, 4H), 1.59-1.84 (m, 8H), 1.10-1.48 (m, 48H), 0.81-0.94 (m, 12H).
【0068】
(色素増感太陽電池の作製)
続いて、上述のようにして得られた化合物1A、1B、2、3を用い、図1に示した構成と同様の色素増感太陽電池を作製した。
【0069】
まず、チタニアペースト(日揮触媒化成製)をFTOガラス上にドクターブレード法により塗布した後、電気炉で450℃、35分間焼結を行い、FTOガラス上にチタニア層を形成した。
【0070】
FTOガラスを放冷した後、化合物を溶解させた0.3mMクロロホルム溶液に室温で一晩色素を吸着させた。FTOガラスを溶液から取り出し、スペーサー、電解液(0.8M 1,2−ジメチル−3−プロピルイミダゾリウム ヨージド(DMPII)、0.2M ヨウ素、4−t−ブチルピリジン、アセトニトリル)、白金を蒸着させた対極電極で挟み色素増感太陽電池を作製した。
【0071】
(色素増感太陽電池の特性評価)
作製した色素増感太陽電池の光電変換特性を評価した。光電変換特性の評価はソーラーシミュレータ(朝日分光株式会社製)を用いてAM1.5G 100mWcm−2疑似太陽光条件下で行った。
【0072】
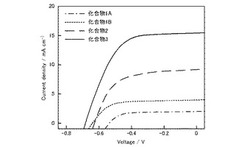
J−V特性を図2に、特性データを表1に示す。表1中、Jscは短絡電流密度、Vocは開放端電圧、ffはフィルファクター、ηは光電変換効率である。
【0073】
【表1】

【0074】
いずれも光増感色素として機能し、色素増感太陽電池が動作することを確認した。特に、オリゴチオフェンを有する化合物3を用いた色素増感太陽電池では最大6.0%の光電変換効率を示した。
【産業上の利用可能性】
【0075】
本発明に係る光増感色素は良好な光電変換効率を示すので、色素増感太陽電池として利用することができる。
【符号の説明】
【0076】
1 色素増感太陽電池
11 負極
11a 透明導電性ガラス
11b 酸化物半導体層
11c 光増感色素
12 正極
13 電解液層
14 スペーサー
【技術分野】
【0001】
本発明は、光増感色素及びこれを用いた色素増感太陽電池に関する。
【背景技術】
【0002】
太陽電池としては、単結晶、多結晶あるいはアモルファスのシリコン半導体を用いた太陽電池が、電卓などの電気製品や住宅用などに広く用いられている。しかしながら、このようなシリコン半導体を用いた太陽電池の製造には、プラズマCVDや高温結晶成長プロセスなどの高精度プロセスが用いられるため、多大のエネルギーを必要とするとともに、真空を必要とする高価な装置が必要なために製造コストが高くなっている。
【0003】
そこで、低コストで製造可能な太陽電池として、色素増感太陽電池が提案されている。例えば、酸化チタンのような酸化物半導体にルテニウム金属錯体のような光増感色素を吸着させた材料を用いた色素増感太陽電池が提案されている。
【0004】
色素増感太陽電池は、少なくとも導電性支持体と光増感色素によって増感された色素吸着金属酸化物層を有する。具体的には、導電性支持体は、インジウム添加酸化スズのような透明導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料からなる。色素吸着金属酸化物層は、例えば色素を表面に吸着した酸化チタンのような半導体層からなる。
【0005】
色素増感太陽電池は、導電性支持体の透明導電層側に、例えばルテニウム錯体からなる色素を表面に吸着した色素吸着金属酸化物層を半導体層として形成した負極と、正極となる白金などの金属層あるいは導電層を設けた透明ガラス板あるいは透明樹脂板のような透明絶縁材料との間に電解質の液を封入したものがある。色素増感太陽電池に光が照射されると、負極では光を吸収した色素の電子が励起し、励起した電子が半導体層に移動し、更に透明電極へと導かれ、正極では導電層からくる電子により電解質を還元する。還元された電解質は色素に電子を伝えることで酸化され、このサイクルで色素増感太陽電池が発電すると考えられている。
【0006】
また、増感色素として上記の金属錯体のほか、有機色素を用いた色素増感太陽電池も提案されている(例えば、特許文献1、2)。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特開2011−06053号公報
【特許文献2】特開2010−126724号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
特許文献1、2等の有機色素を用いた色素増感太陽電池では光電変換効率のさらなる向上が必要であり、光電変換効率の優れた光増感色素が求められている。
【0009】
本発明は上記事項に鑑みてなされたものであり、その目的とするところは、良好な光電変換効率を示す光増感色素及びこれを用いた色素増感太陽電池を提供することにある。
【課題を解決するための手段】
【0010】
本発明の第1の観点に係る光増感色素は、
式(1)又は(2)で表される、
ことを特徴とする。
【化1】

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【0011】
また、前記R2が、式(3)で表されることが好ましい。
【化2】

(式(3)中、R3はそれぞれ独立して水素又はアルキル基を表す。)
【0012】
本発明の第2の観点に係る光増感色素は、
式(11)(12)又は(13)で表される、
ことを特徴とする。
【化3】

(式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。)
【0013】
本発明の第3の観点に係る色素増感太陽電池は、上記本発明の第1の観点に係る光増感色素又は本発明の第2の観点に係る光増感色素を備えることを特徴とする。
【発明の効果】
【0014】
本発明に係る光増感色素は、良好な光電変換効率を示し、色素増感太陽電池として利用可能である。
【図面の簡単な説明】
【0015】
【図1】色素増感太陽電池の概略構成を示す断面図である。
【図2】実施例における電流密度−電圧特性のグラフである。
【発明を実施するための形態】
【0016】
(光増感色素)
本実施の形態に係る光増感色素は、ベンゾチオフェン(以下、BDT)骨格にシアノアクリル酸基を備えており、式(1)又は(2)で表される。
【化4】

【0017】
式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基である。また、R2は水素又は電子供与性基である。また、nは1以上の整数を表す。
【0018】
光増感色素を用いた色素増感太陽電池では良好な光電変換効率を示す。後述のように、光増感色素を酸化チタン(TiO2)等の酸化物半導体に吸着させて色素増感太陽電池に用いた場合、光増感色素は光照射を受けて励起し、分子内で分極する。BDTがドナー、シアノアクリル酸基がアクセプターとしてそれぞれ機能し、マイナスに帯電したシアノアクリル酸基から、電子が酸化物半導体に移動する。
【0019】
式(1)及び(2)中、R1がアルキル基である場合、アルキル鎖が長いと分子の凝集が抑制される。分子が凝集すると、分子内で分極した後に、電子とホールが再度結合してしまい、変換効率が低下する。
【0020】
式(1)及び(2)中、R2が電子供与性基である場合では、電子供与性基がドナー、BDTはスペーサー、シアノアクリル酸基がアクセプターとして機能し、分子内の分極がより大きくなるのでより好ましい。
【0021】
また、BDT骨格が長くなると、光の吸収領域が広くなる。このため、光増感色素はより効率的に光を吸収し励起されて分極する。
【0022】
上記電子供与性基としては、アミン誘導体や式(3)に示すチオフェン或いはオリゴチオフェンが挙げられる。
【化5】

【0023】
式(3)中、R3は、それぞれ独立して水素又はアルキル基である。また、nは1以上の整数である。オリゴチオフェンは、それ自体色素として機能する。このため、光増感色素は光をより吸収しやすくなり、分子内により大きな分極をもたらす。
【0024】
また、光増感色素のより具体的な例として、式(11)、(12)又は(13)のいずれかで表される化合物が挙げられる。
【化6】

式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。
【0025】
式(11)で表される光増感色素は、例えば、アルキルBDTをホルミル化した後、Knoevenagel反応によって合成することができる。
【0026】
また、式(12)で表される光増感色素は、例えば、以下のようにして合成することができる。アルキルBDTにn−BuLi等のリチオ化試薬を作用させ、鉄(III)アセチルアセトン錯体等の酸化剤で処理することにより、BDTダイマーに導く。その後、Vilsmeir反応によってホルミル化し、Knoevenagel縮合により合成することができる。
【0027】
また、式(13)で表される光増感色素は、例えば、以下のようにして合成することができる。ジハロゲン化アルキルBDTにn−BuLi等のリチオ化試薬を作用させ、N−ホルミルピペリジン等のホルミル化剤で処理してホルミル体に変換する。その後、クアテルチオフェントリブチルスズ誘導体等のオリゴチオフェン化合物とのStilleカップリング反応を行った後、Knoevenagel縮合により合成することができる。
【0028】
(色素増感太陽電池)
本実施の形態に係る色素増感太陽電池は、上述した負極に上述した光増感色素を備える。色素増感太陽電池1の基本的な構成を図1に示す。色素増感太陽電池1は、負極11、正極12、スペーサー14を介し負極11と正極12との間のスペースに充填された電解液層13を備える。
【0029】
負極11は、FTO(Fluorine doped Tin Oxide)ガラス、ITO(Indium Tin Oxide)ガラス等の透明導電性ガラス11aに形成された酸化チタン等の酸化物半導体層11bを有し、酸化物半導体層11bに光増感色素層11cを備える。光増感色素層11cの光増感色素は上述のようにシアノアクリル酸基を有し、シアノアクリル酸基のカルボキシル基が吸着基として機能するため、シアノアクリル酸基が酸化物半導体層に吸着した形態である。
【0030】
電解液層13中の電解質は、光励起され酸化物半導体への電子注入を果たした後の色素を還元するための酸化還元種を含んでいれば特に限定されず、例えば、ヨウ素とヨウ化物(LiI、NaI、KI、CaI2等)の組み合わせ、臭素と臭化物(LiBr、NaBr、KBr、CaBr2等)の組み合わせ等が挙げられる。
【0031】
色素増感太陽電池1では、透明導電性ガラス11aを通過した光によって、光増感色素が励起され分極する。そして、光増感色素のシアノアクリル酸基がアクセプターとなり、酸化物半導体層11bに電子が注入される。電子を放出して酸化された光増感色素は、電解液層13のヨウ素等から電子を受け取り還元される。このように酸化還元反応が光照射によって連続して起こり、外部に電流を創り出す。
【0032】
なお、本実施の形態に係る色素増感太陽電池1は、光増感色素に特徴を有し、その他の層や材料は公知の構造又は材料とすることができ、図1に示す構造のものに限られない。
【実施例】
【0033】
各種光増感色素である化合物を合成し、得られた化合物を用いて色素増感太陽電池を作製し、特性を評価した。なお、合成した化合物の同定は、1H NMR及び質量分析により行った。
【0034】
(合成例1A)
(2’−Cyano−1−(4,8−dihexylbenzo[1,2−b:4,5−b’]dithiophene−2−yl)−acrylic acid(以下、化合物1A)の合成)
以下に記すように、段階的に化合物1Aを合成した。
【0035】
(2−Formyl−4,8−dihexylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物5A)の合成)
窒素雰囲気下で、1,2‐ジクロロエタン(10mL)に4,8−ジヘキシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(以下、化合物4A)(356mg,1.0mmol)を溶解した溶液に、DMF(0.5mL、5.0mmol)を添加した。
0℃に冷却した後、オキシ塩化リン(0.50mL、5.4mmol)をゆっくりと加えた。
この溶液を24時間還流した後、1M塩化アンモニウム溶液(6mL)を添加した。
そして、反応混合物をクロロホルム(30mL×3回)で抽出した。
抽出物を塩水(5mL)で洗浄した後、無水MgSO4で乾燥した。
溶媒を蒸発させて除去した後、残留物をカラムクロマトグラフィー(シリカゲル、ヘキサン、クロロホルム、Rf=0.8)で精製し、淡黄色粉体の化合物5A(339mg、収率90%)を得た。
【0036】
上記の反応式を以下に示す。
【化7】

【0037】
また、得られた化合物5Aの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS):δ 10.15 (s, 1H), 8.21 (s, 1H), 7.59 (d, 1H, J=5.4 Hz), 7.49(d, 1H, J=5.4 Hz), 3.20 (m, 4H), 1.83-1.25 (m, 16H), 0.88(t, 6H, J=7.6 Hz).
【0038】
(化合物1Aの合成)
窒素雰囲気下でシアノ酢酸(680mg、8.0mmol)と5a(285mg、0.80mmol)を50mLフラスコに入れた。そして、クロロホルム(6mL)とアセトニトリル(6mL)を加えた。
更に、ピペリジン(2.0mL、23.4mmol)を加えた。
反応混合物を15時間還流し、10%の酢酸溶液(30mL)を加えた。
混合物をクロロホルム(5mL×3回)で抽出した。
有機相を塩水(10mL)で洗浄した後、無水MgSO4で乾燥し、濾過して真空中で濃縮した。
残留物をカラムクロマトグラフィー(SiO2、クロロホルム及び酢酸エチル(溶離剤として))で精製し、オレンジ粉体の化合物1A(247mg、収率74%)を得た。
【0039】
上記の反応式を以下に示す。
【化8】

【0040】
また、得られた化合物1Aの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.54 (s, 1H), 8.11 (s, 1H), 7.60 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.18 (m, 4H), 1.90-1.25 (m, 16H), 0.89 (t, 6H, J=7.3 Hz).
【0041】
(合成例1B)
(2−Cyano−1−(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene−2−yl)−acrylic acid(以下、化合物1B)の合成)
以下のようにして、段階的に化合物1Bを合成した。
【0042】
(2−Formyl−4,8−didecylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物5B)の合成)
上記化合物5Aの合成における化合物4Aに代えて4,8−ジドデシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(以下、化合物4B)(522mg,0.99mmol)を用いた以外、同様の条件にて合成を行い、淡黄色粉末の化合物5B(385mg、収率70%)を得た。
【0043】
上記の反応式を以下に示す。
【化9】

【0044】
また、得られた化合物5Bの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS):δ 10.15 (s, 1H), 8.21 (s, 1H), 7.59 (d, 1H, J=5.4 Hz), 7.49(d, 1H, J=5.4 Hz), 3.20 (m, 4H), 1.90-1.25 (m, 40H), 0.89(t, 6H, J=7.6 Hz).
【0045】
(化合物1Bの合成)
上記化合物1Aの合成における化合物5Aに代えて化合物5B(279mg,0.50mmol)を用いた以外、同様の条件で合成を行い、オレンジ色粉末の化合物1B(125mg、収率40%)を得た。
【0046】
上記の反応式を以下に示す。
【化10】

【0047】
また、得られた化合物1Bの測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.52 (s, 1H), 8.14 (s, 1H), 7.60 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.18 (m, 4H), 1.90-1.25 (m, 40H), 0.89 (t, 6H, J=7.3 Hz).
【0048】
(合成例2)
(2−Cyano−1−{2,2’−Bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)−6−yl}acrylic acid(以下、化合物2)の合成)
以下に記すように、段階的に化合物2を合成した。
【0049】
(2,2’−Bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)(以下、化合物6)の合成)
窒素空気の下で、4,8−ジドデシルベンゾ[1,2−b:4,5−b’:5,6−b’’]ビチオフェン(100mg、0.19mmol)をTHF(12mL)に溶解した。
溶液を0℃まで冷やした後、n−ブチルリチウム(0.13mL、0.21mmol)を溶解した1.67Mヘキサン溶液をゆっくり加え、そして、室温で1.5時間攪拌した。
Fe(acac)3(35mg、0.20mmol)を加え、そして、溶液を18時間還流した。
溶液を室温まで冷却した後、飽和塩化アンモニウム溶液(3mL)で希釈し、クロロホルム(10mL×2回)で抽出した。
抽出物を塩水(20mL×3)で洗浄し、無水MgSO4で乾燥した。
溶媒を蒸発し、残留した油分をカラムクロマトグラフィー(Rf=0.2、シリカゲル、ヘキサン)に通し、ヘキサンから再結晶して精製し、黄色固体の化合物6(58mg、収率58%)を得た。
【0050】
上記の反応式を以下に示す。
【化11】

【0051】
また、得られた化合物6の測定値は以下の通りである。
1H-NMR (400MHz, CDCl3) δ 7.34(d, J=4.0 Hz, 2H), 7.33(d, J=4.0Hz, 2H), 3.40(t, J=9.0 Hz, 4H), 2.78(t, J=9.0 Hz, 4H), 1.82-1.20(m, 80H), 0.88(t, J=9.0Hz, 12H).
【0052】
(6−Formyl−2,2’−bi(4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene)(以下、化合物7)の合成)
上記化合物5Aの合成おける化合物4Aに代えて化合物6(105mg,0.10mmol)を、トリ塩化メタン(CHCl3)に代えてジクロロエタン(ClCH2CH2Cl)を用いた以外、同様の条件で合成し、淡黄色粉体の化合物7(78mg、収率72%)を得た。
【0053】
上記の反応式を以下に示す。
【化12】

【0054】
また、得られた化合物7の測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 10.16 (s, 1H), 7.99 (s, 1H), 7.24 (d, 2H, J=5.4 Hz), 7.22(d, 2H, J=5.4 Hz), 3.40 (m, 4H), , 1.83-1.25 (m, 16H), 0.88(t, 6H, J=7.6 Hz).
【0055】
(化合物2の合成)
上記化合物1Aの合成における化合物5Aに代えて化合物7(75mg,0.52mmol)を、また、トリ塩化メタン(CHCl3)に代えてTHFを用いた以外、同様の条件で合成し、オレンジ色粉体の化合物2(125mg、収率40%)を得た。
【0056】
上記の反応式を以下に示す。
【化13】

【0057】
また、得られた化合物2の測定値は以下の通りである。
1H-NMR(270 MHz, CDCl3, TMS) δ 8.52 (s, 1H), 8.25 (s, 1H), 8.14 (s, 1H), 8.05(s, 1H), 7.59 (d, 1H, J=5.9 Hz), 7.48(d, 1H, J=5.9 Hz), 3.40 (m, 4H), 1.90-1.25 (m, 40H), 0.89(t, 6H, J=7.3 Hz).
【0058】
(合成例3)
(2−Cyano−1−{(benzo[1,2−b:4,5−b’]dithiophene−2−yl)−3,3’’’−dihexyl−2,2’;5’,2’’;5’’,2’’’−quaterthiophene−5−yl}acrylic acid(以下、化合物3)の合成)
以下に記すように、段階的に化合物2を合成した。
【0059】
(2−Formyl−6−bromo−4,8−didodecylbenzo[1,2−b:4,5−b’]dithiophene(以下、化合物9)の合成)
窒素雰囲気下、1.67M n−ブチルリチウム・ヘキサン溶液(0.07mL、0.12mmol)に、2,6−ジブロモ−4,8−didodecylbenzo[1,2−b:4.5−bジチオフェン(70mg、0.12mmol)をTHFに溶解した溶液(3mL)を−78℃でゆっくり添加した。
−78℃で1時間攪拌した後に、ピペリジン−1−カルバルデヒド(0.012mL、0.21mmol)を加えた。
溶液を室温で一晩攪拌した後、反応を1M HCl水溶液(3mL)を用い0℃でクエンチした。
45分間攪拌した後に、沈殿物をクロロホルム(5mL×2回)で抽出した。そして、有機相を水(5mL)と塩水(5mL)で洗浄し、無水MgSO4で乾燥した後、減圧して濃縮した。
残留物をカラムクロマトグラフィー(シリカゲル)で精製し、淡黄色粉体の化合物9(42mg、収率62%)を得た。
【0060】
上記の反応式を以下に示す。
【化14】

【0061】
また、得られた化合物9の測定値は以下の通りである。
1H-NMR (270 MHz, CDCl3, TMS) δ 7.41 (1 H, s), 7.39 (1 H,s ) 3.17 (t, J = 7.9 Hz, 4H), 1.83-1.30 (m, 24 H), 0.88 (t, J = 7.0 Hz, 6H).
【0062】
(5−(2−formylbenzo[1,2−b:4,5−b’]dithiophene−6−yl)−3,3’’’−dihexyl−2,2’;5’,2’’;5’’,2’’’−quaterthiophene(以下、化合物10)の合成)
50mLフラスコに、化合物9(100mg、0.12mmol)の脱気トルエン溶液(20mL))及び4T−SnBu3(72.7mg、0.12mmol)を入れた。
これに、Pd(PPh3)4(48mg、42μmol)を加えた。
そして、混合物を16時間還流し、室温に冷却した。
反応混合物をセライト・パッドの上に濾過し、トルエンで洗浄した。
濾過水を真空で蒸発した。
残りをシリカゲル・フラッシュ・カラムクロマトグラフィー(ジクロロメタン)及びヘキサン−クロロホルムからの再結晶によって精製し、赤色粉体の化合物10(52mg、収率55%)を得た。
【0063】
上記の反応式を以下に示す。
【化15】

【0064】
また、得られた化合物10の測定値は以下の通りである。
1H-NMR (400 MHz, CDCl3, TMS) δ 10.13 (s, 1H), 8.17 (s, 1H), 7.48 (s, 1H), 7.23 (s, 1H), 7.21 (d, 1H, J = 5.2 Hz), 7.17 (d, 1H, J = 3.8 Hz), 7.16 (d, 1H, J = 3.8 Hz), 7.11 (d, 1H, J = 3.8 Hz), 7.04 (d, 1H, J = 3.8 Hz), 6.95 (d, 1H, J = 5.2 Hz), 3.12-3.21 (m, 4H), 2.79-2.84 (m, 4H), 1.66-1.86 (m, 8H), 1.47-1.26 (m, 48H), 0.84-0.92 (m, 12H).
【0065】
(化合物3の合成)
上記化合物1Aの合成例における化合物5Aに代えて化合物10(35mg,0.031mmol)を用いた以外、同様の条件にて、赤色粉末の化合物3(27mg、収率71%)を得た。
【0066】
上記の反応式を以下に示す。
【化16】

【0067】
また、得られた化合物3の測定値は以下の通りである。
1H-NMR (400 MHz, CDCl3, TMS) δ 8.33 (s, 1H), 8.06 (s, 1H), 7.47 (s, 1H), 7.23 (s, 1H), 7.20 (d, 1H, J = 6.0 Hz), 7.15 (d, 1H, J = 3.4 Hz), 7.14 (d, 1H, J = 3.7 Hz), 7.09 (d, 1H, J = 3.7 Hz), 7.04 (d, 1H, J = 3.4 Hz), 6.95 (d, 1H, J = 6.0 Hz), 3.04-3.18 (m, 4H), 2.71-2.81 (m, 4H), 1.59-1.84 (m, 8H), 1.10-1.48 (m, 48H), 0.81-0.94 (m, 12H).
【0068】
(色素増感太陽電池の作製)
続いて、上述のようにして得られた化合物1A、1B、2、3を用い、図1に示した構成と同様の色素増感太陽電池を作製した。
【0069】
まず、チタニアペースト(日揮触媒化成製)をFTOガラス上にドクターブレード法により塗布した後、電気炉で450℃、35分間焼結を行い、FTOガラス上にチタニア層を形成した。
【0070】
FTOガラスを放冷した後、化合物を溶解させた0.3mMクロロホルム溶液に室温で一晩色素を吸着させた。FTOガラスを溶液から取り出し、スペーサー、電解液(0.8M 1,2−ジメチル−3−プロピルイミダゾリウム ヨージド(DMPII)、0.2M ヨウ素、4−t−ブチルピリジン、アセトニトリル)、白金を蒸着させた対極電極で挟み色素増感太陽電池を作製した。
【0071】
(色素増感太陽電池の特性評価)
作製した色素増感太陽電池の光電変換特性を評価した。光電変換特性の評価はソーラーシミュレータ(朝日分光株式会社製)を用いてAM1.5G 100mWcm−2疑似太陽光条件下で行った。
【0072】
J−V特性を図2に、特性データを表1に示す。表1中、Jscは短絡電流密度、Vocは開放端電圧、ffはフィルファクター、ηは光電変換効率である。
【0073】
【表1】

【0074】
いずれも光増感色素として機能し、色素増感太陽電池が動作することを確認した。特に、オリゴチオフェンを有する化合物3を用いた色素増感太陽電池では最大6.0%の光電変換効率を示した。
【産業上の利用可能性】
【0075】
本発明に係る光増感色素は良好な光電変換効率を示すので、色素増感太陽電池として利用することができる。
【符号の説明】
【0076】
1 色素増感太陽電池
11 負極
11a 透明導電性ガラス
11b 酸化物半導体層
11c 光増感色素
12 正極
13 電解液層
14 スペーサー
【特許請求の範囲】
【請求項1】
式(1)又は(2)で表される、
ことを特徴とする光増感色素。
【化1】

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【請求項2】
前記R2が、式(3)で表される、
ことを特徴とする請求項1に記載の光増感色素。
【化2】

(式(3)中、R3はそれぞれ独立して水素又はアルキル基を表す。)
【請求項3】
式(11)(12)又は(13)で表される、
ことを特徴とする光増感色素。
【化3】

(式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。)
【請求項4】
請求項1乃至請求項3のいずれか一項に記載の光増感色素を備える、
ことを特徴とする色素増感太陽電池。
【請求項1】
式(1)又は(2)で表される、
ことを特徴とする光増感色素。
【化1】

(式(1)及び(2)中、R1はそれぞれ独立して水素、アルキル基、アルコキシ基又はアミノ基であり、R2は水素又は電子供与性基であり、nは1以上の整数を表す。)
【請求項2】
前記R2が、式(3)で表される、
ことを特徴とする請求項1に記載の光増感色素。
【化2】

(式(3)中、R3はそれぞれ独立して水素又はアルキル基を表す。)
【請求項3】
式(11)(12)又は(13)で表される、
ことを特徴とする光増感色素。
【化3】

(式(11)、(12)及び(13)中、R4はそれぞれ独立して水素又はアルキル基を表す。)
【請求項4】
請求項1乃至請求項3のいずれか一項に記載の光増感色素を備える、
ことを特徴とする色素増感太陽電池。
【図1】


【図2】




【図2】


【公開番号】特開2012−236890(P2012−236890A)
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願番号】特願2011−106165(P2011−106165)
【出願日】平成23年5月11日(2011.5.11)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
【公開日】平成24年12月6日(2012.12.6)
【国際特許分類】
【出願日】平成23年5月11日(2011.5.11)
【出願人】(504136568)国立大学法人広島大学 (924)
【Fターム(参考)】
[ Back to top ]

