光学分析装置及び光学分析方法
【課題】 検出精度が良好な光学分析装置を提供すること。
【解決手段】 単数又は複数の光源から入射された光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置;単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
【解決手段】 単数又は複数の光源から入射された光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置;単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、光学分析装置及び光学分析方法に関する。より詳細には、遺伝子発現解析、感染症検査、またSNP解析等の遺伝子解析、タンパク質解析、細胞解析等に供せられる光学分析装置及び光学分析方法に関する。
【背景技術】
【0002】
近年、医療分野、創薬分野、臨床検査分野、食品分社、農業分野、工学分野等の様々な分野で、遺伝子解析、タンパク質解析、細胞解析等に関する技術研究が進められている。特に最近では、核酸やタンパク質、細胞等の検出や解析等の各種反応を、チップに設けられたマイクロスケールの流路やウェル内で行うラボ・オン・チップの技術開発や実用化が進められている。これらは、生体分子等を簡便に計測する手法として注目を集めている。
このとき、微量の検体でも検出・測定できるように、例えば、DNA断片を数十万倍にも増幅させるPCR法による核酸増幅反応を利用する方法が一般的に用いられている。
【0003】
さらに、多数のウェルを有するマイクロプレートなどを用いて、吸光、蛍光及び発光にて多数の検体を少量の目的物質でも検出・測定する光学分析装置の開発がなされている。
近年、タングステンハロゲンランプや放電管に代えて、発光ダイオード(LED)や半導体レーザを光源とする光学分析装置が主流となってきている。そして、発光ダイオードからの光を直接的に試料へ照射させる照射機構を備える吸光光度計が知られている(例えば、特許文献1参照)。この第2の実施形態として、被験体の複数の測定部位がマトリックス状に配置されていることに対応して、複数のLED及びこれらとそれぞれ対の複数の受光素子を有する構成が挙げられている。
しかしながら、光学分析装置において迷光(クロストーク)は発生しやすく、この迷光は誤検出の原因となるため、光学分析装置の検出精度が低下するという問題点があった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平9−264845号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本開示は、検出精度が良好な光学分析装置及び光学分析方法を提供することを主目的とするものである。
【課題を解決するための手段】
【0006】
本開示は、光源から入射された光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置である。
また、本開示は、光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法である。
前記遮光構造体により、誤検出の原因となる反応領域からの迷光(クロストーク)を抑制することが可能となる。
前記導光板により、面での一括励起/検出が可能となり、多数の反応領域でも精度良く分析でき、また分析の作業効率も向上することが可能である。さらに、スペースの低減が可能であるので、装置の小型化も可能であり、そして複数波長光源が可能となり、多色検出の展開も可能となる。
よって、吸光、蛍光及び発光等の光学分析において、多数の検体でも光検出の精度を向上させることが可能となる。そして、反応領域中の目的物質が少量でも精度良く分析することが可能となる。
【0007】
前記励起光源として単数又は複数のレーザ光源及び/又はLED光源を有するのが好適である。レーザ光源により、狭スペクトル幅で高出力であり、励起フィルタが備えなくともよいので小型化が可能である。また、LED光源により、低コストで複数設置が可能であり、一括励起により多色検出も可能である。
前記光源からの波長の異なる励起光の照射により前記反応領域内から発生する光を時分割に検出するのが好適である。これにより、多色での励起が可能であり、異なる波長の蛍光を精度良く検出することが可能となる。
【0008】
前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置されるのが好適である。
前記遮光構造体が、光の出射方向を制限する開口部を複数有するのが好適である。
前記遮光構造体が、フィルタを挟むように複数配置されるのが好適である。
前記光学分析装置又は光学分析方法が、核酸増幅反応装置又は核酸増幅反応の分析方法であるのが好適である。微量な検体でも良好に分析可能である。
【発明の効果】
【0009】
本開示は、検出精度が良好な光学分析装置等を提供するものである。
【図面の簡単な説明】
【0010】
【図1】本開示の光学分析装置1の第1実施形態を模式的に示す断面図である。
【図2】本開示の光学分析装置1の第2実施形態を模式的に示す断面図である。
【図3】本開示の光学分析装置1の第3実施形態を模式的に示す断面図である。
【図4】本開示の光学分析装置1の変形例を模式的に示す断面図である。
【図5】検出フィルタへの入射角度を示す模式図である。
【図6】本開示の光学分析装置1のレーザ光源の励起光の波長を示す例示図である。
【図7】本開示の光学分析装置1の異なるLED光源の異なる励起光の波長を示す例示図である。
【図8】本開示の光学分析装置1の多色検出系の例示図ある。
【発明を実施するための形態】
【0011】
以下、本開示を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本開示の代表的な実施形態の一例を示したものであり、これにより本開示の範囲が狭く解釈されることはない。
【0012】
1.光学分析装置
(1)光源
(2)反応領域
(3)遮光構造体
(4)検出系
2.本開示の光学分析装置1の第1実施形態
3.本開示の光学分析装置1の第2実施形態
4.本開示の光学分析装置1の第3実施形態
5.本開示の光学分析装置1の変形例
【0013】
1.光学分析装置
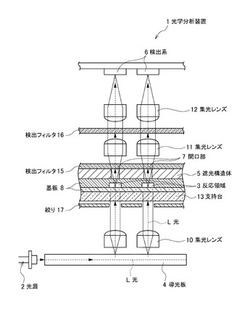
本開示に係わる光学分析装置1は、光源2と、遮光構造体5と、検出系6とを備えるものである(例えば、図1〜4参照)。
前記光学分析装置1は、単数又は複数の光源2から入射された光を反応領域3のそれぞれに導光する導光板4を備えるのが好適である。前記光学分析装置1は、反応領域3内からの光の出射方向を制限する前記遮光構造体5を備えるのが好適である。前記光学分析装置1は、励起光により反応領域3内から発生する光を検出する検出系6を備えるものが好適である。さらに、反応領域3は、光学分析装置1に搭載される脱着可能なものである。
【0014】
(1)光源
光源2の数は、単数又は複数の何れでもよい。複数の光源を設けることで、多色光源を構築することが可能であり、結果として多色での励起が可能となる。これにより異なる波長での光学分析を行うことが可能である。また、時分割による検出も可能である。なお、単数又は複数の光源2の出射タイミング、出力(励起光波長や光量等)を制御部にて制御してもよい。
【0015】
前記光源2は、光源から出射される光が反応領域3に照射できる形状や配置であればよい。
また、前記光源2から入射された光を反応領域3のそれぞれに導光する導光板4を配置するのが好適である。前記導光板4には、単数又は複数の光入射部が端部等に設けられており、当該光入射部に、単数又は複数の光源2から出射された光が入射される。入射された光を反応領域3のそれぞれに導光させるような部材(例えば、プリズム、反射板、凹凸等)が、前記導光板の内部に設けられている。
【0016】
因みに、導光板の採用により、多数の反応領域を面で一括励起が可能となるので、部品点数の削減が可能であり、さらに装置の小型化や薄型化、軽量化も可能である。また、各反応領域に均一な光を照射することが可能である。従来、反応領域のそれぞれと対応する複数の光源が必要であったが、導光板の採用により少ない光源でも面での一括励起が可能となり、これにより多色検出への展開も可能となる。
また、導光板の採用により複数種の光源を使用することで多色での励起も可能となる。多色によるメリットとしては以下のものが挙げられる。各反応領域に内部標準を採用でき、光分析の精度を向上できる。各反応領域で反応をさせる場合、反応速度のキャリブレーションが可能になり、定量性を向上させることができる。複数の反応領域を有する1つの基板(チップ)で検出できる数(例えば、病原体等)を倍に増やすことができ(マルチプレックス検出)、作業効率が向上する。
【0017】
尚、前記光源2は、特に限定されないが、分析目的物質(検体)に応じた所望の光を出射するものが好適である。前記光源2としては、例えば、レーザ光源、発光ダイオード(LED)光源、水銀灯、タングステンランプ等が挙げられる。これらを単独で又は複数組み合わせて使用してもよい。
レーザ光源の場合、狭いスペクトル幅で高出力であるので、従来必要であった励起フィルタ(Ex.fiilter)を排除することが可能となる。また、導光板を採用することで、発振波長の異なる複数種のレーザ光源による多色での励起が可能となり、このとき時分割も可能である。
LED光源の場合、赤色、橙色、黄色、緑色、青色、白色、紫外線等のLED光源が挙げられ、これらを単独で又は複数組み合わせて使用してもよい。多色LED光源として、例えば3色LED光源や4色LED光源等が挙げられる。これらは励起フィルタにより所望の励起光とすることが可能である。また、導光板を採用することで、複数種のLED光源による多色での励起が可能となり、このとき時分割も可能となる。また、多色LED光源の場合、一括励起の他、導光板を用いなくとも順次励起が可能である。
【0018】
(2)反応領域
前記反応領域3は、光学分析する試料が存在するエリアであり、該エリアは光学分析用の反応の場として使用してもよいし、反応後の試料を光学分析のために充填し使用してもよい。この光学分析用の反応としては、例えば、吸光検出、蛍光検出、濁度検出等のための反応が挙げられる。このとき該エリアは、核酸増幅反応等の反応場として使用できるのが、リアルタイム検出が可能となるので、望ましい。前記反応領域3が、装置に搭載されることが可能な反応容器内に複数形成されているのが望ましい。
【0019】
前記反応領域3は、単数又は複数の基板により形成される。該基板はガラス製基板層のウェットエッチングや射出形成、切削加工によって形成することができる。また、前記反応領域3の形状は適宜設定することができ、例えばウェル状や細管状等が挙げられる。
前記基板の材料は、特に限定されず、検出方法、加工容易性、耐久性等を考慮して適宜選択可能である。該材料としては、耐熱性や光透過性等のある素材で所望の光学分析に応じて適宜選択すればよく、例えば、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネイト、シクロオレフィンポリマー、ポリジメチルシロキサン等)等が挙げられる。
なお、反応領域内部に、適宜目的の光学分析に応じた(例えば核酸増幅反応等の)試薬類が充填されていてもよい。
【0020】
(3)遮光構造体
前記遮光構造体5は、前記反応領域3内からの光の出射方向を制限するものである。これにより、誤検出の原因となる周辺の反応領域(特に隣接する反応領域)からの迷光を抑制でき、このことで検出精度が向上する。前記遮光構造体5は、単数又は複数の所定形状の開口部7を有し、所定の厚みを有する板状の構造体であるのが好適である。
【0021】
前記開口部7は、反応領域3に対向する領域に設けられているのが好適である。
また、各開口部7は、前記反応領域3内からの光の出射方向を制限するために、所定の開口形状と深さを有しているのが好適である。この開口形状及び深さを調整することで、前記反応領域3内からの光の出射方向を制限することが可能である。例えば、この開口形状及び深さを調整することで、検出フィルタへの光の入射角度を調整することも可能である。このように光の入射角度の調整が可能であることから、開口部分を調整することで種々の検出フィルタに対応することも可能である。
【0022】
図5を参照して説明すると、例えば、検出フィルタが干渉フィルタ(誘電体多層膜)の場合、前記開口部7は、光が開口部内部を通過する際のフィルタへの入射角度(θ)が小さくなるように開口部(内部)の形状の長さと深さが調整されたものが好適である。この開口部内部の幅(a部分:縦横の辺又は径)が短く、かつ開口部の深さ(b部分)が長いと、より良好に迷光を抑制することができる。該入射角(θ)は、小さい程迷光を抑制できるので好ましく、具体的にはθ<20°程度が好適である。これによりSN比を向上させることが可能である。
【0023】
また、例えば、検出フィルタが吸収フィルタの場合、前記開口部7は、光が開口部内部を通過する際のフィルタへの入射角度(θ)が大きくなるように開口部(内部)の形状の長さと深さが調整されたものが好適である。この開口部内部の幅(a部分:縦横の辺又は径)が長く、かつ開口部の深さ(b部分)が短いと、検出フィルタ中の光の通過距離が長くなり、より良好に迷光を抑制することができる。該入射角(θ)は、大きい程迷光を抑制できるので好ましく、具体的には、20°<θ<70°程度が好適である。これによりSN比を向上させることが可能である。
例えば、開口部7は、反応領域からの光の略中央部分を遮り、その周辺部分の光を通過させるような形状であってもよい。一例として、この略中央部分に遮光用の部材(例えば、円盤状等:図示せず)を配置し、この遮光用の部材は開口部と架橋するような架橋部材(図示せず)を配置してもよい。
また、検出フィルタを通過した光は、検出系6へ導入されるように、集光レンズや反射板等を適宜配置すればよい。
【0024】
開口形状は、円形状に限らず、方形状や多角形状でもよい。開口形状の面は、反応領域と略平行に設けられているのが好適である。
開口部7の立体形状は、円柱状、角柱形状、多面体形状等が挙げられる。例えば、この内部にテーパが付いていてもよい。
前記開口部7は、反応領域3のそれぞれに対向する領域に、遮光構造体5を貫通した部分(穴や孔等)を単数又は複数形成するのが、コスト的に好適である。
【0025】
前記遮光構造体は、例えば、ステンレス、銅(Cu)、ニッケル(Ni)等の金属膜に、例えばフォトリソグラフィ法を用いたエッチングによって、単数又は複数の開口部をパターン形成することにより作製することが可能である。
【0026】
前記遮光構造体5は、励起光入射側及び蛍光出射側の少なくとも何れか一方に設置すればよい。このとき装置に搭載される前記反応領域3が形成された基板8の表面に接触可能に備えるのが好適である。これにより、周辺反応領域からの迷光の侵入が更に良好に低減できる。
また、複数の遮光構造体で光学フィルタ(励起フィルタ、検出フィルタ等)を挟持する構成を採用することも可能である。これにより、光学フィルタを通過する光線角度を制限でき、所望の波長成分のみを効果的に抽出することも可能になる。
また、遮光構造体5は、スライド式等による着脱可能な構造としていてもよい。これにより、検出フィルタの種類(干渉フィルタ又は吸収フィルタ)に応じて、所定の開口形状及び深さを有する遮光構造体に適宜変更することが可能である。なお、光の入射角度を調整するため、複数の遮光構造体を重ね合わせて使用してもよい。
【0027】
従来、迷光による誤検出を回避するため、反応領域のそれぞれに時分割に励起/光検出を行っていた。そのため1つの反応領域に対して1つの光源及び1つの検出器を配置する必要があった。また、検出の1サイクルに要する時間が反応領域の数に比例するため、例えば96穴プレート等を使用するように、多数の検体を測定する場合には、スループットの点において問題となっていた。
しかしながら、前記遮光構造体を採用することによって、周辺の反応領域からの迷光を抑制することが可能となる。そして、従来時分割で行っていた励起/光検出を一括で行うことも可能となる。さらに導光板を採用することで、面での一括励起も可能となり、均一的な光で検出することが可能となり、また複数の反応領域の検出に要する時間も大幅に短縮することが可能となる。
【0028】
(4)検出系
前記検出系6は、前記反応領域3内から発生する光成分(例えば、透過光、蛍光、散乱光等)を検出できるように配置されていればよい。
また、前記検出系6は、目的とする光成分を検出できる光検出器(例えば、蛍光検出器、濁度検出器、散乱光検出器、紫外可視分光検出器等)を備えていればよい。該検出器としては、例えばCCDやCMOS素子等のエリア撮像素子、PMT(光電子倍増管)、フォトダイオード、小型センサ等が挙げられる。
尚、蛍光色素を複数し、各反応領域内で各々異なる波長にて励起された蛍光色素は、それぞれ異なる波長の蛍光を発することとなる。これら光成分を効率よく検出するためには、例えば複数の蛍光スペクトルに対応した透過帯を有するマルチバンドパスフィルタを搭載することで可能となる。そして、複数波長の励起光をそれぞれ時分割照射し、それと同期して光検出器により各蛍光の強度検出を行うことが可能となる。
【0029】
更に、本開示に係わる光学分析装置1は、集光レンズ10,11,12、支持台13、励起フィルタ14、検出フィルタ15,16、絞り17、各部を支持したり反応領域を搭載するための支持体、温度制御部(ヒータ等)等を適宜単数又は複数備えてもよい。また、前記光学分析装置1に、励起光の出射タイミングや出力(励起光波長や光量等)、時分割、多色時分割等を制御する制御部を設けて、上述の各部を制御してもよい。
【0030】
前記励起フィルタは、各種光分析方法に応じて所望とされる特定波長の光成分にすることが可能なフィルタを適宜選択すればよい。
前記検出フィルタは、検出に必要な光成分(蛍光、散乱光、透過光等)に応じて適宜フィルタを選択すればよい。
これら励起フィルタや検出フィルタは、前記光学分析装置1に、必要に応じて単数又は複数を備えればよく、場合によっては備えなくともよい。これにより、必要な光成分とすることができ、また不要な光成分が除去できる。さらに前記光学分析装置1の検出感度や検出精度が向上できる。
また、前記検出フィルタとして、各々の蛍光スペクトルに対応した透過帯を有するマルチバンドパスフィルタを搭載し、光源の発光を時分割にすることで蛍光検出を行うことが可能である。例えば、2種の蛍光色素による検出方法を採用した場合、マルチバンドパスフィルタ(この場合Dual)により、2種の蛍光検出を行うことが挙げられる。
【0031】
また、前記温度制御部として、特に限定されないが、光透過性のあるITOヒータ等の透明導電膜等が挙げられる。前記温度制御部は、反応領域3の温度を制御できる位置に配置されるのが好適である。前記温度制御は、反応領域3の基板に近接する位置が好ましく、さらに光出射方向及び/又は光入射方向に配置されるのが好適である。また、装置小型化のため、前記温度制御部を、支持台13として使用してもよい。これにより、反応領域3内の各検体の温度制御が可能となるので、安定的な検出結果を得ることができ、検出精度を向上させることが可能となる。さらに、反応領域3内での反応を制御できるので、検出に際し反応が必要な検体(例えば、核酸増幅反応)での検出が可能となる。これにより光学分析装置を反応装置、光学分析及び反応が可能な装置(例えば核酸増幅反応装置等)としても使用することができる。
【0032】
以下、本開示の光学分析装置1の動作について、図1及び2を参照して説明する。
光源2からの光Lが検体を含む反応領域3に出射される。このとき、導光板4を使用して各反応領域3に光Lを照射してもよい。そして、励起された光Lが各反応領域3に照射される。
これにより生じた各反応領域3内からの光成分(蛍光、透過光、散乱光等)Lは、該各反応領域に対応する位置に設けられた所定形状の開口部7を通過する。このようにして、該光成分Lの出射方向が、遮光構造体5にある各開口部7を経ることで制限されることとなる。これにより誤検出の原因となる周辺の反応領域(特に隣接する反応領域)からの迷光を抑制することが可能となる。そして、この出射方向の制限された光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て所望の光成分Lとなる。該光成分Lを検出系6の光検出器にて検出する。このとき周辺の反応領域からの迷光が抑制されることから、各反応領域の検体の検出精度が向上する。測定に際し、反応領域3を反応場として使用することで、リアルタイムに検出することが可能であり、反応と検出が連続して可能であるので、利便性も高い。
【0033】
因みに、光源2がレーザ光源の場合には、励起フィルタを使用しなくともよく、これからの励起光が反応領域3に照射される(図1参照)。また、光源2がLED等の場合には、励起フィルタ14を経た励起光が反応領域3に照射される。
また、励起フィルタはマルチバンドパスフィルタでもよく、このマルチバンドパスフィルタにより異なる複数の励起光が反応領域3に照射することが可能となる。このとき検出フィルタは、これに対応したマルチバンドパスフィルタを適宜使用すればよい。これにより、複数の光分析が可能となり、時分割に光検出が可能となる。
また、導光板4を使用した場合、単数又は複数の光源から入射された光を各反応領域に導光することが可能となる。
また、励起フィルタ、検出フィルタ、集光レンズは適宜必要に応じた個数や種類を使用すればよく、上述に限定されない。
【0034】
2.本開示の光学分析装置1の第1実施形態
本開示に係わる光学分析装置1の第1実施形態(以下、「第1実施形態の装置」ともいう)は、レーザ光源2と、遮光構造体5と、検出系6とを備えるものである(例えば、図1参照)。上述で説明した構成の説明については省略する。
前記第1実施形態の装置は、単数又は複数のレーザ光源2から入射された励起光を反応領域3のそれぞれに導光する導光板4を備えるのが好適である。当該レーザ光源2は、導光板4の側方や側面に単数又は複数配置することが好適である。
前記導光板5と装置に搭載される反応領域3が形成された基板8との間には、適宜集光レンズ10を配置するのが望ましい。また、遮光構造体5と検出系6との間には、適宜集光レンズ及び検出フィルタを単数又は複数配置するのが望ましい。
また、前記遮光構造体5は、装置に搭載される反応領域3が形成された基板8の表面に接触可能に備えるのが好適である。さらに、前記遮光構造体5は、検出フィルタ15に接触可能に備えるのが好適である。さらに、遮光構造体5は基板8と検出フィルタ15とに挟むように備えるのが好適である。なお、前記遮光構造体5は、複数配置してもよく、導光板4と基板8との間や、検出フィルタ15から検出系6との間に配置してもよい。また、遮光構造体は、後述する変形例のように複数用いてもよい。
なお、光源2や検出系6は適宜支持体によって支持されていてもよい。
【0035】
第1実施形態の装置の光源として使用するレーザは狭スペクトル幅で高出力であるので、励起フィルタを任意に排除することもできる(例えば図6参照)。光の不要な成分を除くため光学フィルタを配置することは可能である。
具体的には、一般的にレーザはスペクトル半値幅〜数nmと、LEDの数〜10nmよりも狭線幅であるため、励起系での励起フィルタ設置が不要となる。さらに、導光板を採用することで、発振波長の異なる複数種のレーザを設けることで、多色での励起が可能となる。また、面での一括励起が可能となり、時分割での多色検出も可能となる。斯様に従来の光源の配置スペースでは実現困難であった複数波長光源が可能となる。これにより、検出精度が向上し、作業効率も向上する。また、装置の小型化も可能となる。
【0036】
以下、本開示の第1実施形態の装置の動作の一例について、図1を参照して説明する。
前記光源2からレーザ(特定波長の励起光)Lが照射される。該励起光Lは導光板4の光入射部より入射され、入射された励起光Lは導光板5を経て複数の略均一の励起光Lとなり、略同時にそれぞれ対応する各反応領域3に導光される。該導光板4を経た励起光は、絞り8、支持台9を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)は、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域からの迷光を抑制することが可能となる。前記光成分は、検出フィルタ15,16を経て、検出系6の光検出器にて検出される。
【0037】
3.本開示の光学分析装置1の第2実施形態
本開示に係わる光学分析装置1の第2実施形態(以下、「第2実施形態の装置」ともいう)は、LED光源2と、励起フィルタ14と、遮光構造体5と、検出系6とを備えるものである(例えば、図3参照)。上述で説明した構成の説明については省略する。
前記第2実施形態の装置は、単数又は複数のLED光源2から入射された光Lを反応領域3のそれぞれに導光する導光板4を備えるのが好適である。LED光源2は、導光板4の側方又は側面に単数又は複数配置することが好適である。
【0038】
LED光源2からの光は、反応領域3に照射されるまでに、所望の特定波長の励起光となっていればよい。
LEDの光を所望の特定波長の励起光とする励起フィルタ14は、光源2から反応領域3の間に設ければよい。励起フィルタの配置位置としては、例えば、LED光源2と導光板4の光入射部との間;導光板4と反応領域3との間等が挙げられる。
LED光源2と導光板4の光入射部との間の場合、LED光源2からの光が励起フィルタを経て特定波長の励起光とし、その励起光が導光板に入射されてもよく、また、前記光入射部に励起フィルタが設置されていてもよい。
【0039】
また、導光板4と反応領域3との間の場合、導光板4と装置に搭載される反応領域3が形成された基板8との間に設けるのがより好適である。
さらに、該励起フィルタ14は、バンドパスフィルタが望ましい。LED光源を複数配置し、バンドパスフィルタの励起フィルタを採用した場合に、多色励起が可能となる。これにより、多色検出が可能となる。さらに、時分割により、複数の検出(複数の蛍光物質等)が可能となる。
なお、集光レンズ、検出フィルタ、遮光構造体については、上記の光学分析装置1及び実施形態1の装置で述べているので、省略する。また、遮光構造体は、後述する変形例のように複数用いてもよい。
【0040】
以下、本開示の第2実施形態の装置の動作の一例について、図2を参照して説明する。
1つのLED光源2から光Lが照射される。該光は導光板4の光入射部より入射され、入射された光Lは導光板4を経て各反応領域3に導光されるように面で一括照射される。照射された各光Lは、励起フィルタ14にて特定波長の励起光Lとなる。この励起光Lは、集光レンズ10、絞り17、支持台13を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)Lは、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域(特に隣接する反応領域)からの迷光を抑制することが可能となる。前記光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て、検出系6の光検出器にて検出される。
また、励起フィルタ14にマルチバンドパスフィルタを採用することにより、複数のLED光源を利用し、時分割にてそれぞれを照射することも可能である(図6参照)。例えば、一方の光源からの光を照射した場合、他方の光源からの光を照射しない等が挙げられる。より具体的には、450nm付近の励起光を照射して検出し、この間620nm付近の励起光を照射しない;620nm付近の励起光を照射して検出し、この間450nm付近の励起光を照射しない;これを交互で繰り返すこと等が挙げられる。
これにより、反応領域内にある複数の光に反応する物質(例えば複数の蛍光物質等)に対応するように、1色ずつ検出することが可能となる。よって、作業効率及び検出精度が向上する。
【0041】
4.本開示の光学分析装置1の第3実施形態
本開示に係わる光学分析装置1の第3実施形態(以下、「第3実施形態の装置」ともいう)は、LED光源2と、励起フィルタ14と、遮光構造体5と、検出系6とを備えるものである(例えば、図3参照)。上述で説明した構成の説明については省略する。
前記第3実施形態の装置は、反応領域3のそれぞれに対応するようにLED光源が複数配置されている。これにより、反応領域を一括に照射することが可能である。そして、該LED光源は、多色LEDが望ましい。多色LEDとマルチパスフィルタの励起フィルタを併用することにより、順次励起し、時分割による検出が可能である。なお、導光板を併用することで、LED光源を減らすことも可能である。
LED光源2からの光は、反応領域3に照射されるまでに、所望の特定波長励起光となっているのが望ましい。励起フィルタ14は、LED光源と装置に搭載される反応領域が形成された基板との間に設けるのがより好適である。
なお、集光レンズ、検出フィルタ、遮光構造体については、上記の光学分析装置1及び実施形態1〜2の装置で述べているので、省略する。また、遮光構造体は、後述する変形例のように複数用いてもよい。
【0042】
以下、本開示の第3実施形態の装置の動作の一例について、図3を参照して説明する。
LED光源2から光Lが照射される。該光Lは、光源から同時に照射されることで各反応領域3に面で一括照射することが可能である。照射された各光Lは、励起フィルタ14にて特定波長の励起光Lとなる。この励起光Lは、絞り17、支持台13を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)Lは、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域からの迷光を抑制することが可能となる。前記光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て、検出系6の光検出器にて検出される。
また、励起フィルタ14にマルチバンドパスフィルタを採用することにより、複数のLED光源2を利用し、時分割にてそれぞれを照射することも可能である。これにより、反応領域内にある複数の蛍光物質に対応するように、1色ずつ検出することが可能となる。よって、作業効率及び検出精度が向上する。
【0043】
5.本開示の光学分析装置1の変形例
本開示に係わる光学分析装置1の変形例(以下、「変形例の装置」ともいう)は、光源2と、励起フィルタと、複数の遮光構造体5と、検出系6とを備えるものである(例えば、図6参照)。上述で説明した構成の説明については省略する。
前記変形例の装置は、複数の遮光構造体で光学フィルタが挟持されている。これにより集光レンズを反応領域3と光源2との間に設けなくとも、反応領域を面で一括に照射することが可能となる。そして、装置の小型化が可能となる。また、迷光を抑制することも可能となるので、検出精度も向上する。なお、上述の実施形態1〜3の装置に斯様な構成を採用してもよいし、上述の実施形態1〜3の装置に本開示の効果を損なわない範囲でこの機構を組み込んでもよい。
【0044】
本開示の光学分析装置1は、各種光分析(例えば、核酸増幅検出、金属検出等)を行うことが可能である。またリアルタイムに行うことも可能である。そして、前記光学分析装置1は、温度制御部を設け、温度制御を行うことで、反応装置としても利用可能である。例えば、核酸増幅反応装置等が挙げられる。一例として、核酸増幅反応を以下に示す。
【0045】
〔核酸増幅反応〕
本開示において、「核酸増幅反応」には、温度サイクルを実施する従来のPCR(polymerase chain reaction)法や、温度サイクルを伴わない各種等温増幅法が含まれる。等温増幅法としては、例えば、LAMP(Loop-Mediated Isothermal Amplification)法やSMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription-reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription-mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。
この他、「核酸増幅反応」には、核酸の増幅を目的とする変温あるいは等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイムPCR(RT−PCR)法やRT−LAMP法などの増幅核酸鎖の定量を伴う反応も包含される。
【0046】
また、「試薬」には、上記の核酸増幅反応において、増幅核酸鎖を得るために必要な試薬であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質等が含まれる。
【0047】
前記PCR法は、「熱変性(約95℃)→プライマーのアニーリング(約55〜60℃)→伸長反応(約72℃)」という増幅サイクルを連続的に行う。
また、前記LAMP法とは、DNAのループ形成を利用して、一定温度でDNAやRNAからdsDNAを増幅産物として得る方法である。一例として、成分(i)、(ii)、(iii)を加え、インナープライマーが鋳型核酸上の相補的配列に対して安定的な塩基対結合を形成することができ、かつ鎖置換型ポリメラーゼが酵素活性を維持しうる温度でインキュベートすることにより進行する。このときのインキュベート温度は50〜70℃、時間は1分〜10時間程度が好適である。
成分(i)インナープラマー2種、又は更にアウタープライマー2種、又は更にループプライマー2種;成分(ii)鎖置換型ポリメラーゼ;成分(iii)基質ヌクレオチド。
【0048】
〔核酸増幅(産物)の検出方法〕
前記核酸増幅の検出方法としては、例えば、濁度物質、蛍光物質や化学発光物質等を用いる方法が挙げられる。
【0049】
また、前記濁度物質を用いる方法としては、例えば核酸増幅反応の結果生じるピロリン酸とこれに結合可能な金属イオンにより生じた析出物質を用いる方法等が挙げられる。当該金属イオンは、一価又は二価の金属イオンであり、ピロリン酸と結合すると水に不溶又は難溶性の塩を形成して濁度物質となる。
当該金属イオンとしては、具体的には、アルカリ金属イオン、アルカリ土類金属イオン及び二価遷移金属イオン等が挙げられる。このうち、例えば、マグネシウム(II)、カルシウム(II)及びバリウム(II)等のアルカリ土類金属イオン;亜鉛(II)、鉛(II)、マンガン(II)、ニッケル(II)及び鉄(II)等の二価遷移金属イオン等から選ばれる1種又は2以上が好ましい。更に好ましくは、マグネシウム(II)、マンガン(II)、ニッケル(II)及び鉄(II)である。
当該金属イオンを添加するときの濃度は、0.01〜100mMの範囲であれば好適である。検出波長は、300〜800nmとするのが好適である。
【0050】
また、前記蛍光物質や化学発光物質を用いる方法としては、例えば、二本鎖核酸に特異的に挿入されて蛍光を発する蛍光色素(誘導体)を用いるインターカレート方法、増幅する核酸配列に特異的なオリゴヌクレオチドに蛍光色素を結合させたプローブを用いる標識プローブ方法等が挙げられる。
前記標識プローブ法としては、例えばハイブリダイゼーション(Hyb)プローブ法、加水分解(TaqMan)プローブ法等が挙げられる。
前記Hybプローブ法は、予め2種のプローブが近接するようにデザインされたドナー色素でラベルされたプローブとアクセプター色素でラベルされたプローブという2種のプローブを用いる方法である。そして、当該2種のプローブが標的核酸にハイブリダイズするとドナー色素により励起されたアクセプター色素が蛍光を発する。
また、前記TaqManプローブ法は、レポーター色素とクエンチャー色素の2つが近接するようにラベルされているプローブを用いる方法である。そして、当該プローブが核酸伸長の際に加水分解され、このときクエンチャー色素とレポーター色素とが離れ、レポーター色素が励起されると蛍光を発する。
【0051】
前記蛍光物質を用いる方法に使用する蛍光色素(誘導体)としては、SYBR(登録商標) Green I、SYBR(登録商標) Green II、SYBR(登録商標)Gold、YO (Oxazole Yellow)、TO (Thiazole Orange)、PG (Pico(登録商標)Green)、臭化エチジウム等が挙げられる。
前記化学発光物質を用いる方法に使用する有機化合物としては、ルミノール、ロフィン、ルシゲニン、シュウ酸エステル等が挙げられる。
【0052】
〔本開示のRT−PCR装置〕
本開示の光分析装置1をPCR装置(RT―PCR装置)として使用した場合について説明する。
RT−PCR装置のステップSp1(熱変性)、ステップSp2(プライマーのアニーリング)、ステップSp3(DNA伸長)の手順での核酸の検出方法について説明する。
熱変性ステップ(ステップSp1)では、反応領域3内が95℃になるように前記温度制御手段にて制御し、二本鎖DNAを変性させ一本鎖DNAとする。
続くアニーリングステップ(ステップSp2)では、反応領域3内が55℃となるように設定することで、プライマーが当該一本鎖DNAと相補的な塩基配列と結合させる。
次のDNA伸長ステップ(ステップSp3)では、反応領域3内が72℃となるように制御することで、プライマーをDNA合成の開始点として、ポリメラーゼ反応を進行させてcDNAを伸長させる。
このようなステップSp1〜Sp3の温度サイクルを繰り返すことによって、各反応領域3内のDNAは増幅されてゆく。反応領域3内から発生する蛍光をリアルタイムに検出系で検出し、核酸量を定量化する。
【0053】
また、本開示の光分析装置1は、LAMP装置(RT−LAMP装置)として使用することも可能である。
反応領域3内を一定温度(60〜65℃)になるように設定することで、各反応領域3内の核酸が増幅されてゆく。尚、このLAMP法では、二本鎖から一本鎖への熱変性が必要なく、この等温条件下、プライマーのアニーリングと核酸伸長とが繰り返り行われる。
この核酸増幅反応の結果、ピロリン酸が生成され、このピロリン酸に金属イオンが結合して不溶性又は難溶性の塩が形成され、この塩が濁度物質となる(測定波長300〜800nm)。この濁度物質に入射光が照射されることで、散乱光となる。この散乱光の散乱光量をリアルタイムに検出系5で測定し、定量化する。また、透過光量からも定量化することは可能である。
【0054】
なお、本技術は以下のような構成も取ることができる。
[1] 単数又は複数の光源から入射された励起光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置。
[2] 前記光源からの波長の異なる光の照射により前記反応領域内から発生する光を時分割に検出する前記[1]記載の光学分析装置。
[3] 前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される前記[1]又は[2]記載の光学分析装置。
[4] 前記遮光構造体が、光の出射方向を制限する開口部を複数有する前記[1]〜[3]の何れか1記載の光学分析装置。
[5] 前記遮光構造体が、フィルタを挟むように複数配置される前記[1]〜[4]の何れか1記載の光学分析装置。
[6] 前記光学分析装置が、核酸増幅反応装置である前記[1]〜[5]の何れか1記載の光学分析装置。
【0055】
[7] 単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
[8] 前記光源からの波長の異なる励起光の照射により前記反応領域内から発生する光を時分割に検出する前記[7]記載の光学分析方法。
[9] 前記遮光構造体が装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される前記[7]又は[8]記載の光学分析方法。
[10] 前記遮光構造体が光の出射方向を制限する開口部を複数有する前記[7]〜[9]の何れか1記載の光学分析方法。
[11] 前記遮光構造体がフィルタを挟むように複数配置されて光の出射方向を制限する前記[7]〜[10]の何れか1記載の光学分析方法。
[12] 核酸増幅反応における光学分析方法である前記[7]〜[11]の何れか1記載の光学分析方法。
【符号の説明】
【0056】
1光学分析装置,2光源,3反応領域,4導光板,5遮光構造体,6検出系,7開口部
【技術分野】
【0001】
本開示は、光学分析装置及び光学分析方法に関する。より詳細には、遺伝子発現解析、感染症検査、またSNP解析等の遺伝子解析、タンパク質解析、細胞解析等に供せられる光学分析装置及び光学分析方法に関する。
【背景技術】
【0002】
近年、医療分野、創薬分野、臨床検査分野、食品分社、農業分野、工学分野等の様々な分野で、遺伝子解析、タンパク質解析、細胞解析等に関する技術研究が進められている。特に最近では、核酸やタンパク質、細胞等の検出や解析等の各種反応を、チップに設けられたマイクロスケールの流路やウェル内で行うラボ・オン・チップの技術開発や実用化が進められている。これらは、生体分子等を簡便に計測する手法として注目を集めている。
このとき、微量の検体でも検出・測定できるように、例えば、DNA断片を数十万倍にも増幅させるPCR法による核酸増幅反応を利用する方法が一般的に用いられている。
【0003】
さらに、多数のウェルを有するマイクロプレートなどを用いて、吸光、蛍光及び発光にて多数の検体を少量の目的物質でも検出・測定する光学分析装置の開発がなされている。
近年、タングステンハロゲンランプや放電管に代えて、発光ダイオード(LED)や半導体レーザを光源とする光学分析装置が主流となってきている。そして、発光ダイオードからの光を直接的に試料へ照射させる照射機構を備える吸光光度計が知られている(例えば、特許文献1参照)。この第2の実施形態として、被験体の複数の測定部位がマトリックス状に配置されていることに対応して、複数のLED及びこれらとそれぞれ対の複数の受光素子を有する構成が挙げられている。
しかしながら、光学分析装置において迷光(クロストーク)は発生しやすく、この迷光は誤検出の原因となるため、光学分析装置の検出精度が低下するという問題点があった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開平9−264845号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本開示は、検出精度が良好な光学分析装置及び光学分析方法を提供することを主目的とするものである。
【課題を解決するための手段】
【0006】
本開示は、光源から入射された光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置である。
また、本開示は、光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法である。
前記遮光構造体により、誤検出の原因となる反応領域からの迷光(クロストーク)を抑制することが可能となる。
前記導光板により、面での一括励起/検出が可能となり、多数の反応領域でも精度良く分析でき、また分析の作業効率も向上することが可能である。さらに、スペースの低減が可能であるので、装置の小型化も可能であり、そして複数波長光源が可能となり、多色検出の展開も可能となる。
よって、吸光、蛍光及び発光等の光学分析において、多数の検体でも光検出の精度を向上させることが可能となる。そして、反応領域中の目的物質が少量でも精度良く分析することが可能となる。
【0007】
前記励起光源として単数又は複数のレーザ光源及び/又はLED光源を有するのが好適である。レーザ光源により、狭スペクトル幅で高出力であり、励起フィルタが備えなくともよいので小型化が可能である。また、LED光源により、低コストで複数設置が可能であり、一括励起により多色検出も可能である。
前記光源からの波長の異なる励起光の照射により前記反応領域内から発生する光を時分割に検出するのが好適である。これにより、多色での励起が可能であり、異なる波長の蛍光を精度良く検出することが可能となる。
【0008】
前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置されるのが好適である。
前記遮光構造体が、光の出射方向を制限する開口部を複数有するのが好適である。
前記遮光構造体が、フィルタを挟むように複数配置されるのが好適である。
前記光学分析装置又は光学分析方法が、核酸増幅反応装置又は核酸増幅反応の分析方法であるのが好適である。微量な検体でも良好に分析可能である。
【発明の効果】
【0009】
本開示は、検出精度が良好な光学分析装置等を提供するものである。
【図面の簡単な説明】
【0010】
【図1】本開示の光学分析装置1の第1実施形態を模式的に示す断面図である。
【図2】本開示の光学分析装置1の第2実施形態を模式的に示す断面図である。
【図3】本開示の光学分析装置1の第3実施形態を模式的に示す断面図である。
【図4】本開示の光学分析装置1の変形例を模式的に示す断面図である。
【図5】検出フィルタへの入射角度を示す模式図である。
【図6】本開示の光学分析装置1のレーザ光源の励起光の波長を示す例示図である。
【図7】本開示の光学分析装置1の異なるLED光源の異なる励起光の波長を示す例示図である。
【図8】本開示の光学分析装置1の多色検出系の例示図ある。
【発明を実施するための形態】
【0011】
以下、本開示を実施するための好適な形態について図面を参照しながら説明する。なお、以下に説明する実施形態は、本開示の代表的な実施形態の一例を示したものであり、これにより本開示の範囲が狭く解釈されることはない。
【0012】
1.光学分析装置
(1)光源
(2)反応領域
(3)遮光構造体
(4)検出系
2.本開示の光学分析装置1の第1実施形態
3.本開示の光学分析装置1の第2実施形態
4.本開示の光学分析装置1の第3実施形態
5.本開示の光学分析装置1の変形例
【0013】
1.光学分析装置
本開示に係わる光学分析装置1は、光源2と、遮光構造体5と、検出系6とを備えるものである(例えば、図1〜4参照)。
前記光学分析装置1は、単数又は複数の光源2から入射された光を反応領域3のそれぞれに導光する導光板4を備えるのが好適である。前記光学分析装置1は、反応領域3内からの光の出射方向を制限する前記遮光構造体5を備えるのが好適である。前記光学分析装置1は、励起光により反応領域3内から発生する光を検出する検出系6を備えるものが好適である。さらに、反応領域3は、光学分析装置1に搭載される脱着可能なものである。
【0014】
(1)光源
光源2の数は、単数又は複数の何れでもよい。複数の光源を設けることで、多色光源を構築することが可能であり、結果として多色での励起が可能となる。これにより異なる波長での光学分析を行うことが可能である。また、時分割による検出も可能である。なお、単数又は複数の光源2の出射タイミング、出力(励起光波長や光量等)を制御部にて制御してもよい。
【0015】
前記光源2は、光源から出射される光が反応領域3に照射できる形状や配置であればよい。
また、前記光源2から入射された光を反応領域3のそれぞれに導光する導光板4を配置するのが好適である。前記導光板4には、単数又は複数の光入射部が端部等に設けられており、当該光入射部に、単数又は複数の光源2から出射された光が入射される。入射された光を反応領域3のそれぞれに導光させるような部材(例えば、プリズム、反射板、凹凸等)が、前記導光板の内部に設けられている。
【0016】
因みに、導光板の採用により、多数の反応領域を面で一括励起が可能となるので、部品点数の削減が可能であり、さらに装置の小型化や薄型化、軽量化も可能である。また、各反応領域に均一な光を照射することが可能である。従来、反応領域のそれぞれと対応する複数の光源が必要であったが、導光板の採用により少ない光源でも面での一括励起が可能となり、これにより多色検出への展開も可能となる。
また、導光板の採用により複数種の光源を使用することで多色での励起も可能となる。多色によるメリットとしては以下のものが挙げられる。各反応領域に内部標準を採用でき、光分析の精度を向上できる。各反応領域で反応をさせる場合、反応速度のキャリブレーションが可能になり、定量性を向上させることができる。複数の反応領域を有する1つの基板(チップ)で検出できる数(例えば、病原体等)を倍に増やすことができ(マルチプレックス検出)、作業効率が向上する。
【0017】
尚、前記光源2は、特に限定されないが、分析目的物質(検体)に応じた所望の光を出射するものが好適である。前記光源2としては、例えば、レーザ光源、発光ダイオード(LED)光源、水銀灯、タングステンランプ等が挙げられる。これらを単独で又は複数組み合わせて使用してもよい。
レーザ光源の場合、狭いスペクトル幅で高出力であるので、従来必要であった励起フィルタ(Ex.fiilter)を排除することが可能となる。また、導光板を採用することで、発振波長の異なる複数種のレーザ光源による多色での励起が可能となり、このとき時分割も可能である。
LED光源の場合、赤色、橙色、黄色、緑色、青色、白色、紫外線等のLED光源が挙げられ、これらを単独で又は複数組み合わせて使用してもよい。多色LED光源として、例えば3色LED光源や4色LED光源等が挙げられる。これらは励起フィルタにより所望の励起光とすることが可能である。また、導光板を採用することで、複数種のLED光源による多色での励起が可能となり、このとき時分割も可能となる。また、多色LED光源の場合、一括励起の他、導光板を用いなくとも順次励起が可能である。
【0018】
(2)反応領域
前記反応領域3は、光学分析する試料が存在するエリアであり、該エリアは光学分析用の反応の場として使用してもよいし、反応後の試料を光学分析のために充填し使用してもよい。この光学分析用の反応としては、例えば、吸光検出、蛍光検出、濁度検出等のための反応が挙げられる。このとき該エリアは、核酸増幅反応等の反応場として使用できるのが、リアルタイム検出が可能となるので、望ましい。前記反応領域3が、装置に搭載されることが可能な反応容器内に複数形成されているのが望ましい。
【0019】
前記反応領域3は、単数又は複数の基板により形成される。該基板はガラス製基板層のウェットエッチングや射出形成、切削加工によって形成することができる。また、前記反応領域3の形状は適宜設定することができ、例えばウェル状や細管状等が挙げられる。
前記基板の材料は、特に限定されず、検出方法、加工容易性、耐久性等を考慮して適宜選択可能である。該材料としては、耐熱性や光透過性等のある素材で所望の光学分析に応じて適宜選択すればよく、例えば、ガラスや各種プラスチック(ポリプロピレン、ポリカーボネイト、シクロオレフィンポリマー、ポリジメチルシロキサン等)等が挙げられる。
なお、反応領域内部に、適宜目的の光学分析に応じた(例えば核酸増幅反応等の)試薬類が充填されていてもよい。
【0020】
(3)遮光構造体
前記遮光構造体5は、前記反応領域3内からの光の出射方向を制限するものである。これにより、誤検出の原因となる周辺の反応領域(特に隣接する反応領域)からの迷光を抑制でき、このことで検出精度が向上する。前記遮光構造体5は、単数又は複数の所定形状の開口部7を有し、所定の厚みを有する板状の構造体であるのが好適である。
【0021】
前記開口部7は、反応領域3に対向する領域に設けられているのが好適である。
また、各開口部7は、前記反応領域3内からの光の出射方向を制限するために、所定の開口形状と深さを有しているのが好適である。この開口形状及び深さを調整することで、前記反応領域3内からの光の出射方向を制限することが可能である。例えば、この開口形状及び深さを調整することで、検出フィルタへの光の入射角度を調整することも可能である。このように光の入射角度の調整が可能であることから、開口部分を調整することで種々の検出フィルタに対応することも可能である。
【0022】
図5を参照して説明すると、例えば、検出フィルタが干渉フィルタ(誘電体多層膜)の場合、前記開口部7は、光が開口部内部を通過する際のフィルタへの入射角度(θ)が小さくなるように開口部(内部)の形状の長さと深さが調整されたものが好適である。この開口部内部の幅(a部分:縦横の辺又は径)が短く、かつ開口部の深さ(b部分)が長いと、より良好に迷光を抑制することができる。該入射角(θ)は、小さい程迷光を抑制できるので好ましく、具体的にはθ<20°程度が好適である。これによりSN比を向上させることが可能である。
【0023】
また、例えば、検出フィルタが吸収フィルタの場合、前記開口部7は、光が開口部内部を通過する際のフィルタへの入射角度(θ)が大きくなるように開口部(内部)の形状の長さと深さが調整されたものが好適である。この開口部内部の幅(a部分:縦横の辺又は径)が長く、かつ開口部の深さ(b部分)が短いと、検出フィルタ中の光の通過距離が長くなり、より良好に迷光を抑制することができる。該入射角(θ)は、大きい程迷光を抑制できるので好ましく、具体的には、20°<θ<70°程度が好適である。これによりSN比を向上させることが可能である。
例えば、開口部7は、反応領域からの光の略中央部分を遮り、その周辺部分の光を通過させるような形状であってもよい。一例として、この略中央部分に遮光用の部材(例えば、円盤状等:図示せず)を配置し、この遮光用の部材は開口部と架橋するような架橋部材(図示せず)を配置してもよい。
また、検出フィルタを通過した光は、検出系6へ導入されるように、集光レンズや反射板等を適宜配置すればよい。
【0024】
開口形状は、円形状に限らず、方形状や多角形状でもよい。開口形状の面は、反応領域と略平行に設けられているのが好適である。
開口部7の立体形状は、円柱状、角柱形状、多面体形状等が挙げられる。例えば、この内部にテーパが付いていてもよい。
前記開口部7は、反応領域3のそれぞれに対向する領域に、遮光構造体5を貫通した部分(穴や孔等)を単数又は複数形成するのが、コスト的に好適である。
【0025】
前記遮光構造体は、例えば、ステンレス、銅(Cu)、ニッケル(Ni)等の金属膜に、例えばフォトリソグラフィ法を用いたエッチングによって、単数又は複数の開口部をパターン形成することにより作製することが可能である。
【0026】
前記遮光構造体5は、励起光入射側及び蛍光出射側の少なくとも何れか一方に設置すればよい。このとき装置に搭載される前記反応領域3が形成された基板8の表面に接触可能に備えるのが好適である。これにより、周辺反応領域からの迷光の侵入が更に良好に低減できる。
また、複数の遮光構造体で光学フィルタ(励起フィルタ、検出フィルタ等)を挟持する構成を採用することも可能である。これにより、光学フィルタを通過する光線角度を制限でき、所望の波長成分のみを効果的に抽出することも可能になる。
また、遮光構造体5は、スライド式等による着脱可能な構造としていてもよい。これにより、検出フィルタの種類(干渉フィルタ又は吸収フィルタ)に応じて、所定の開口形状及び深さを有する遮光構造体に適宜変更することが可能である。なお、光の入射角度を調整するため、複数の遮光構造体を重ね合わせて使用してもよい。
【0027】
従来、迷光による誤検出を回避するため、反応領域のそれぞれに時分割に励起/光検出を行っていた。そのため1つの反応領域に対して1つの光源及び1つの検出器を配置する必要があった。また、検出の1サイクルに要する時間が反応領域の数に比例するため、例えば96穴プレート等を使用するように、多数の検体を測定する場合には、スループットの点において問題となっていた。
しかしながら、前記遮光構造体を採用することによって、周辺の反応領域からの迷光を抑制することが可能となる。そして、従来時分割で行っていた励起/光検出を一括で行うことも可能となる。さらに導光板を採用することで、面での一括励起も可能となり、均一的な光で検出することが可能となり、また複数の反応領域の検出に要する時間も大幅に短縮することが可能となる。
【0028】
(4)検出系
前記検出系6は、前記反応領域3内から発生する光成分(例えば、透過光、蛍光、散乱光等)を検出できるように配置されていればよい。
また、前記検出系6は、目的とする光成分を検出できる光検出器(例えば、蛍光検出器、濁度検出器、散乱光検出器、紫外可視分光検出器等)を備えていればよい。該検出器としては、例えばCCDやCMOS素子等のエリア撮像素子、PMT(光電子倍増管)、フォトダイオード、小型センサ等が挙げられる。
尚、蛍光色素を複数し、各反応領域内で各々異なる波長にて励起された蛍光色素は、それぞれ異なる波長の蛍光を発することとなる。これら光成分を効率よく検出するためには、例えば複数の蛍光スペクトルに対応した透過帯を有するマルチバンドパスフィルタを搭載することで可能となる。そして、複数波長の励起光をそれぞれ時分割照射し、それと同期して光検出器により各蛍光の強度検出を行うことが可能となる。
【0029】
更に、本開示に係わる光学分析装置1は、集光レンズ10,11,12、支持台13、励起フィルタ14、検出フィルタ15,16、絞り17、各部を支持したり反応領域を搭載するための支持体、温度制御部(ヒータ等)等を適宜単数又は複数備えてもよい。また、前記光学分析装置1に、励起光の出射タイミングや出力(励起光波長や光量等)、時分割、多色時分割等を制御する制御部を設けて、上述の各部を制御してもよい。
【0030】
前記励起フィルタは、各種光分析方法に応じて所望とされる特定波長の光成分にすることが可能なフィルタを適宜選択すればよい。
前記検出フィルタは、検出に必要な光成分(蛍光、散乱光、透過光等)に応じて適宜フィルタを選択すればよい。
これら励起フィルタや検出フィルタは、前記光学分析装置1に、必要に応じて単数又は複数を備えればよく、場合によっては備えなくともよい。これにより、必要な光成分とすることができ、また不要な光成分が除去できる。さらに前記光学分析装置1の検出感度や検出精度が向上できる。
また、前記検出フィルタとして、各々の蛍光スペクトルに対応した透過帯を有するマルチバンドパスフィルタを搭載し、光源の発光を時分割にすることで蛍光検出を行うことが可能である。例えば、2種の蛍光色素による検出方法を採用した場合、マルチバンドパスフィルタ(この場合Dual)により、2種の蛍光検出を行うことが挙げられる。
【0031】
また、前記温度制御部として、特に限定されないが、光透過性のあるITOヒータ等の透明導電膜等が挙げられる。前記温度制御部は、反応領域3の温度を制御できる位置に配置されるのが好適である。前記温度制御は、反応領域3の基板に近接する位置が好ましく、さらに光出射方向及び/又は光入射方向に配置されるのが好適である。また、装置小型化のため、前記温度制御部を、支持台13として使用してもよい。これにより、反応領域3内の各検体の温度制御が可能となるので、安定的な検出結果を得ることができ、検出精度を向上させることが可能となる。さらに、反応領域3内での反応を制御できるので、検出に際し反応が必要な検体(例えば、核酸増幅反応)での検出が可能となる。これにより光学分析装置を反応装置、光学分析及び反応が可能な装置(例えば核酸増幅反応装置等)としても使用することができる。
【0032】
以下、本開示の光学分析装置1の動作について、図1及び2を参照して説明する。
光源2からの光Lが検体を含む反応領域3に出射される。このとき、導光板4を使用して各反応領域3に光Lを照射してもよい。そして、励起された光Lが各反応領域3に照射される。
これにより生じた各反応領域3内からの光成分(蛍光、透過光、散乱光等)Lは、該各反応領域に対応する位置に設けられた所定形状の開口部7を通過する。このようにして、該光成分Lの出射方向が、遮光構造体5にある各開口部7を経ることで制限されることとなる。これにより誤検出の原因となる周辺の反応領域(特に隣接する反応領域)からの迷光を抑制することが可能となる。そして、この出射方向の制限された光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て所望の光成分Lとなる。該光成分Lを検出系6の光検出器にて検出する。このとき周辺の反応領域からの迷光が抑制されることから、各反応領域の検体の検出精度が向上する。測定に際し、反応領域3を反応場として使用することで、リアルタイムに検出することが可能であり、反応と検出が連続して可能であるので、利便性も高い。
【0033】
因みに、光源2がレーザ光源の場合には、励起フィルタを使用しなくともよく、これからの励起光が反応領域3に照射される(図1参照)。また、光源2がLED等の場合には、励起フィルタ14を経た励起光が反応領域3に照射される。
また、励起フィルタはマルチバンドパスフィルタでもよく、このマルチバンドパスフィルタにより異なる複数の励起光が反応領域3に照射することが可能となる。このとき検出フィルタは、これに対応したマルチバンドパスフィルタを適宜使用すればよい。これにより、複数の光分析が可能となり、時分割に光検出が可能となる。
また、導光板4を使用した場合、単数又は複数の光源から入射された光を各反応領域に導光することが可能となる。
また、励起フィルタ、検出フィルタ、集光レンズは適宜必要に応じた個数や種類を使用すればよく、上述に限定されない。
【0034】
2.本開示の光学分析装置1の第1実施形態
本開示に係わる光学分析装置1の第1実施形態(以下、「第1実施形態の装置」ともいう)は、レーザ光源2と、遮光構造体5と、検出系6とを備えるものである(例えば、図1参照)。上述で説明した構成の説明については省略する。
前記第1実施形態の装置は、単数又は複数のレーザ光源2から入射された励起光を反応領域3のそれぞれに導光する導光板4を備えるのが好適である。当該レーザ光源2は、導光板4の側方や側面に単数又は複数配置することが好適である。
前記導光板5と装置に搭載される反応領域3が形成された基板8との間には、適宜集光レンズ10を配置するのが望ましい。また、遮光構造体5と検出系6との間には、適宜集光レンズ及び検出フィルタを単数又は複数配置するのが望ましい。
また、前記遮光構造体5は、装置に搭載される反応領域3が形成された基板8の表面に接触可能に備えるのが好適である。さらに、前記遮光構造体5は、検出フィルタ15に接触可能に備えるのが好適である。さらに、遮光構造体5は基板8と検出フィルタ15とに挟むように備えるのが好適である。なお、前記遮光構造体5は、複数配置してもよく、導光板4と基板8との間や、検出フィルタ15から検出系6との間に配置してもよい。また、遮光構造体は、後述する変形例のように複数用いてもよい。
なお、光源2や検出系6は適宜支持体によって支持されていてもよい。
【0035】
第1実施形態の装置の光源として使用するレーザは狭スペクトル幅で高出力であるので、励起フィルタを任意に排除することもできる(例えば図6参照)。光の不要な成分を除くため光学フィルタを配置することは可能である。
具体的には、一般的にレーザはスペクトル半値幅〜数nmと、LEDの数〜10nmよりも狭線幅であるため、励起系での励起フィルタ設置が不要となる。さらに、導光板を採用することで、発振波長の異なる複数種のレーザを設けることで、多色での励起が可能となる。また、面での一括励起が可能となり、時分割での多色検出も可能となる。斯様に従来の光源の配置スペースでは実現困難であった複数波長光源が可能となる。これにより、検出精度が向上し、作業効率も向上する。また、装置の小型化も可能となる。
【0036】
以下、本開示の第1実施形態の装置の動作の一例について、図1を参照して説明する。
前記光源2からレーザ(特定波長の励起光)Lが照射される。該励起光Lは導光板4の光入射部より入射され、入射された励起光Lは導光板5を経て複数の略均一の励起光Lとなり、略同時にそれぞれ対応する各反応領域3に導光される。該導光板4を経た励起光は、絞り8、支持台9を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)は、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域からの迷光を抑制することが可能となる。前記光成分は、検出フィルタ15,16を経て、検出系6の光検出器にて検出される。
【0037】
3.本開示の光学分析装置1の第2実施形態
本開示に係わる光学分析装置1の第2実施形態(以下、「第2実施形態の装置」ともいう)は、LED光源2と、励起フィルタ14と、遮光構造体5と、検出系6とを備えるものである(例えば、図3参照)。上述で説明した構成の説明については省略する。
前記第2実施形態の装置は、単数又は複数のLED光源2から入射された光Lを反応領域3のそれぞれに導光する導光板4を備えるのが好適である。LED光源2は、導光板4の側方又は側面に単数又は複数配置することが好適である。
【0038】
LED光源2からの光は、反応領域3に照射されるまでに、所望の特定波長の励起光となっていればよい。
LEDの光を所望の特定波長の励起光とする励起フィルタ14は、光源2から反応領域3の間に設ければよい。励起フィルタの配置位置としては、例えば、LED光源2と導光板4の光入射部との間;導光板4と反応領域3との間等が挙げられる。
LED光源2と導光板4の光入射部との間の場合、LED光源2からの光が励起フィルタを経て特定波長の励起光とし、その励起光が導光板に入射されてもよく、また、前記光入射部に励起フィルタが設置されていてもよい。
【0039】
また、導光板4と反応領域3との間の場合、導光板4と装置に搭載される反応領域3が形成された基板8との間に設けるのがより好適である。
さらに、該励起フィルタ14は、バンドパスフィルタが望ましい。LED光源を複数配置し、バンドパスフィルタの励起フィルタを採用した場合に、多色励起が可能となる。これにより、多色検出が可能となる。さらに、時分割により、複数の検出(複数の蛍光物質等)が可能となる。
なお、集光レンズ、検出フィルタ、遮光構造体については、上記の光学分析装置1及び実施形態1の装置で述べているので、省略する。また、遮光構造体は、後述する変形例のように複数用いてもよい。
【0040】
以下、本開示の第2実施形態の装置の動作の一例について、図2を参照して説明する。
1つのLED光源2から光Lが照射される。該光は導光板4の光入射部より入射され、入射された光Lは導光板4を経て各反応領域3に導光されるように面で一括照射される。照射された各光Lは、励起フィルタ14にて特定波長の励起光Lとなる。この励起光Lは、集光レンズ10、絞り17、支持台13を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)Lは、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域(特に隣接する反応領域)からの迷光を抑制することが可能となる。前記光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て、検出系6の光検出器にて検出される。
また、励起フィルタ14にマルチバンドパスフィルタを採用することにより、複数のLED光源を利用し、時分割にてそれぞれを照射することも可能である(図6参照)。例えば、一方の光源からの光を照射した場合、他方の光源からの光を照射しない等が挙げられる。より具体的には、450nm付近の励起光を照射して検出し、この間620nm付近の励起光を照射しない;620nm付近の励起光を照射して検出し、この間450nm付近の励起光を照射しない;これを交互で繰り返すこと等が挙げられる。
これにより、反応領域内にある複数の光に反応する物質(例えば複数の蛍光物質等)に対応するように、1色ずつ検出することが可能となる。よって、作業効率及び検出精度が向上する。
【0041】
4.本開示の光学分析装置1の第3実施形態
本開示に係わる光学分析装置1の第3実施形態(以下、「第3実施形態の装置」ともいう)は、LED光源2と、励起フィルタ14と、遮光構造体5と、検出系6とを備えるものである(例えば、図3参照)。上述で説明した構成の説明については省略する。
前記第3実施形態の装置は、反応領域3のそれぞれに対応するようにLED光源が複数配置されている。これにより、反応領域を一括に照射することが可能である。そして、該LED光源は、多色LEDが望ましい。多色LEDとマルチパスフィルタの励起フィルタを併用することにより、順次励起し、時分割による検出が可能である。なお、導光板を併用することで、LED光源を減らすことも可能である。
LED光源2からの光は、反応領域3に照射されるまでに、所望の特定波長励起光となっているのが望ましい。励起フィルタ14は、LED光源と装置に搭載される反応領域が形成された基板との間に設けるのがより好適である。
なお、集光レンズ、検出フィルタ、遮光構造体については、上記の光学分析装置1及び実施形態1〜2の装置で述べているので、省略する。また、遮光構造体は、後述する変形例のように複数用いてもよい。
【0042】
以下、本開示の第3実施形態の装置の動作の一例について、図3を参照して説明する。
LED光源2から光Lが照射される。該光Lは、光源から同時に照射されることで各反応領域3に面で一括照射することが可能である。照射された各光Lは、励起フィルタ14にて特定波長の励起光Lとなる。この励起光Lは、絞り17、支持台13を透過し、基板8内の各反応領域3に照射される。照射により各反応領域3内から生じた光成分(蛍光等)Lは、それぞれに対応する位置に設けられた遮光構造体5の開口部7を通過する。これにより、反応領域内からの光の出射方向を制限し、周辺の反応領域からの迷光を抑制することが可能となる。前記光成分Lは、検出フィルタ15、集光レンズ11、検出フィルタ16及び集光レンズ12を経て、検出系6の光検出器にて検出される。
また、励起フィルタ14にマルチバンドパスフィルタを採用することにより、複数のLED光源2を利用し、時分割にてそれぞれを照射することも可能である。これにより、反応領域内にある複数の蛍光物質に対応するように、1色ずつ検出することが可能となる。よって、作業効率及び検出精度が向上する。
【0043】
5.本開示の光学分析装置1の変形例
本開示に係わる光学分析装置1の変形例(以下、「変形例の装置」ともいう)は、光源2と、励起フィルタと、複数の遮光構造体5と、検出系6とを備えるものである(例えば、図6参照)。上述で説明した構成の説明については省略する。
前記変形例の装置は、複数の遮光構造体で光学フィルタが挟持されている。これにより集光レンズを反応領域3と光源2との間に設けなくとも、反応領域を面で一括に照射することが可能となる。そして、装置の小型化が可能となる。また、迷光を抑制することも可能となるので、検出精度も向上する。なお、上述の実施形態1〜3の装置に斯様な構成を採用してもよいし、上述の実施形態1〜3の装置に本開示の効果を損なわない範囲でこの機構を組み込んでもよい。
【0044】
本開示の光学分析装置1は、各種光分析(例えば、核酸増幅検出、金属検出等)を行うことが可能である。またリアルタイムに行うことも可能である。そして、前記光学分析装置1は、温度制御部を設け、温度制御を行うことで、反応装置としても利用可能である。例えば、核酸増幅反応装置等が挙げられる。一例として、核酸増幅反応を以下に示す。
【0045】
〔核酸増幅反応〕
本開示において、「核酸増幅反応」には、温度サイクルを実施する従来のPCR(polymerase chain reaction)法や、温度サイクルを伴わない各種等温増幅法が含まれる。等温増幅法としては、例えば、LAMP(Loop-Mediated Isothermal Amplification)法やSMAP(SMartAmplification Process)法、NASBA(Nucleic Acid Sequence-Based Amplification)法、ICAN(Isothermal and Chimeric primer-initiated Amplification of Nucleic acids)法(登録商標)、TRC(transcription-reverse transcription concerted)法、SDA(strand displacement amplification)法、TMA(transcription-mediated amplification)法、RCA(rolling circle amplification)法等が挙げられる。
この他、「核酸増幅反応」には、核酸の増幅を目的とする変温あるいは等温による核酸増幅反応が広く包含されるものとする。また、これらの核酸増幅反応には、リアルタイムPCR(RT−PCR)法やRT−LAMP法などの増幅核酸鎖の定量を伴う反応も包含される。
【0046】
また、「試薬」には、上記の核酸増幅反応において、増幅核酸鎖を得るために必要な試薬であって、具体的には、標的核酸鎖に相補的な塩基配列とされたオリゴヌクレオチドプライマー、核酸モノマー(dNTP)、酵素、反応緩衝液(バッファー)溶質等が含まれる。
【0047】
前記PCR法は、「熱変性(約95℃)→プライマーのアニーリング(約55〜60℃)→伸長反応(約72℃)」という増幅サイクルを連続的に行う。
また、前記LAMP法とは、DNAのループ形成を利用して、一定温度でDNAやRNAからdsDNAを増幅産物として得る方法である。一例として、成分(i)、(ii)、(iii)を加え、インナープライマーが鋳型核酸上の相補的配列に対して安定的な塩基対結合を形成することができ、かつ鎖置換型ポリメラーゼが酵素活性を維持しうる温度でインキュベートすることにより進行する。このときのインキュベート温度は50〜70℃、時間は1分〜10時間程度が好適である。
成分(i)インナープラマー2種、又は更にアウタープライマー2種、又は更にループプライマー2種;成分(ii)鎖置換型ポリメラーゼ;成分(iii)基質ヌクレオチド。
【0048】
〔核酸増幅(産物)の検出方法〕
前記核酸増幅の検出方法としては、例えば、濁度物質、蛍光物質や化学発光物質等を用いる方法が挙げられる。
【0049】
また、前記濁度物質を用いる方法としては、例えば核酸増幅反応の結果生じるピロリン酸とこれに結合可能な金属イオンにより生じた析出物質を用いる方法等が挙げられる。当該金属イオンは、一価又は二価の金属イオンであり、ピロリン酸と結合すると水に不溶又は難溶性の塩を形成して濁度物質となる。
当該金属イオンとしては、具体的には、アルカリ金属イオン、アルカリ土類金属イオン及び二価遷移金属イオン等が挙げられる。このうち、例えば、マグネシウム(II)、カルシウム(II)及びバリウム(II)等のアルカリ土類金属イオン;亜鉛(II)、鉛(II)、マンガン(II)、ニッケル(II)及び鉄(II)等の二価遷移金属イオン等から選ばれる1種又は2以上が好ましい。更に好ましくは、マグネシウム(II)、マンガン(II)、ニッケル(II)及び鉄(II)である。
当該金属イオンを添加するときの濃度は、0.01〜100mMの範囲であれば好適である。検出波長は、300〜800nmとするのが好適である。
【0050】
また、前記蛍光物質や化学発光物質を用いる方法としては、例えば、二本鎖核酸に特異的に挿入されて蛍光を発する蛍光色素(誘導体)を用いるインターカレート方法、増幅する核酸配列に特異的なオリゴヌクレオチドに蛍光色素を結合させたプローブを用いる標識プローブ方法等が挙げられる。
前記標識プローブ法としては、例えばハイブリダイゼーション(Hyb)プローブ法、加水分解(TaqMan)プローブ法等が挙げられる。
前記Hybプローブ法は、予め2種のプローブが近接するようにデザインされたドナー色素でラベルされたプローブとアクセプター色素でラベルされたプローブという2種のプローブを用いる方法である。そして、当該2種のプローブが標的核酸にハイブリダイズするとドナー色素により励起されたアクセプター色素が蛍光を発する。
また、前記TaqManプローブ法は、レポーター色素とクエンチャー色素の2つが近接するようにラベルされているプローブを用いる方法である。そして、当該プローブが核酸伸長の際に加水分解され、このときクエンチャー色素とレポーター色素とが離れ、レポーター色素が励起されると蛍光を発する。
【0051】
前記蛍光物質を用いる方法に使用する蛍光色素(誘導体)としては、SYBR(登録商標) Green I、SYBR(登録商標) Green II、SYBR(登録商標)Gold、YO (Oxazole Yellow)、TO (Thiazole Orange)、PG (Pico(登録商標)Green)、臭化エチジウム等が挙げられる。
前記化学発光物質を用いる方法に使用する有機化合物としては、ルミノール、ロフィン、ルシゲニン、シュウ酸エステル等が挙げられる。
【0052】
〔本開示のRT−PCR装置〕
本開示の光分析装置1をPCR装置(RT―PCR装置)として使用した場合について説明する。
RT−PCR装置のステップSp1(熱変性)、ステップSp2(プライマーのアニーリング)、ステップSp3(DNA伸長)の手順での核酸の検出方法について説明する。
熱変性ステップ(ステップSp1)では、反応領域3内が95℃になるように前記温度制御手段にて制御し、二本鎖DNAを変性させ一本鎖DNAとする。
続くアニーリングステップ(ステップSp2)では、反応領域3内が55℃となるように設定することで、プライマーが当該一本鎖DNAと相補的な塩基配列と結合させる。
次のDNA伸長ステップ(ステップSp3)では、反応領域3内が72℃となるように制御することで、プライマーをDNA合成の開始点として、ポリメラーゼ反応を進行させてcDNAを伸長させる。
このようなステップSp1〜Sp3の温度サイクルを繰り返すことによって、各反応領域3内のDNAは増幅されてゆく。反応領域3内から発生する蛍光をリアルタイムに検出系で検出し、核酸量を定量化する。
【0053】
また、本開示の光分析装置1は、LAMP装置(RT−LAMP装置)として使用することも可能である。
反応領域3内を一定温度(60〜65℃)になるように設定することで、各反応領域3内の核酸が増幅されてゆく。尚、このLAMP法では、二本鎖から一本鎖への熱変性が必要なく、この等温条件下、プライマーのアニーリングと核酸伸長とが繰り返り行われる。
この核酸増幅反応の結果、ピロリン酸が生成され、このピロリン酸に金属イオンが結合して不溶性又は難溶性の塩が形成され、この塩が濁度物質となる(測定波長300〜800nm)。この濁度物質に入射光が照射されることで、散乱光となる。この散乱光の散乱光量をリアルタイムに検出系5で測定し、定量化する。また、透過光量からも定量化することは可能である。
【0054】
なお、本技術は以下のような構成も取ることができる。
[1] 単数又は複数の光源から入射された励起光を反応領域のそれぞれに導光する導光板と、前記反応領域内からの光の出射方向を制限する遮光構造体と、前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、備える光学分析装置。
[2] 前記光源からの波長の異なる光の照射により前記反応領域内から発生する光を時分割に検出する前記[1]記載の光学分析装置。
[3] 前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される前記[1]又は[2]記載の光学分析装置。
[4] 前記遮光構造体が、光の出射方向を制限する開口部を複数有する前記[1]〜[3]の何れか1記載の光学分析装置。
[5] 前記遮光構造体が、フィルタを挟むように複数配置される前記[1]〜[4]の何れか1記載の光学分析装置。
[6] 前記光学分析装置が、核酸増幅反応装置である前記[1]〜[5]の何れか1記載の光学分析装置。
【0055】
[7] 単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
[8] 前記光源からの波長の異なる励起光の照射により前記反応領域内から発生する光を時分割に検出する前記[7]記載の光学分析方法。
[9] 前記遮光構造体が装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される前記[7]又は[8]記載の光学分析方法。
[10] 前記遮光構造体が光の出射方向を制限する開口部を複数有する前記[7]〜[9]の何れか1記載の光学分析方法。
[11] 前記遮光構造体がフィルタを挟むように複数配置されて光の出射方向を制限する前記[7]〜[10]の何れか1記載の光学分析方法。
[12] 核酸増幅反応における光学分析方法である前記[7]〜[11]の何れか1記載の光学分析方法。
【符号の説明】
【0056】
1光学分析装置,2光源,3反応領域,4導光板,5遮光構造体,6検出系,7開口部
【特許請求の範囲】
【請求項1】
光源から入射された光を反応領域のそれぞれに導光する導光板と、
前記反応領域内からの光の出射方向を制限する遮光構造体と、
前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、
備える光学分析装置。
【請求項2】
前記励起光源として単数又は複数のレーザ光源及び/又はLED光源を有する請求項1記載の光学分析装置。
【請求項3】
前記光源からの波長の異なる光の照射により前記反応領域内から発生する光を時分割に検出する請求項2記載の光学分析装置。
【請求項4】
前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される請求項3記載の光学分析装置。
【請求項5】
前記遮光構造体が、光の出射方向を制限する開口部を複数有する請求項4記載の光学分析装置。
【請求項6】
前記光学分析装置が、核酸増幅反応装置である請求項2記載の光学分析装置。
【請求項7】
単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
【請求項1】
光源から入射された光を反応領域のそれぞれに導光する導光板と、
前記反応領域内からの光の出射方向を制限する遮光構造体と、
前記励起光の照射により前記反応領域内から発生する光を検出する検出系とを、
備える光学分析装置。
【請求項2】
前記励起光源として単数又は複数のレーザ光源及び/又はLED光源を有する請求項1記載の光学分析装置。
【請求項3】
前記光源からの波長の異なる光の照射により前記反応領域内から発生する光を時分割に検出する請求項2記載の光学分析装置。
【請求項4】
前記遮光構造体が、装置に搭載される前記反応領域が形成された基板の表面に接触するように配置される請求項3記載の光学分析装置。
【請求項5】
前記遮光構造体が、光の出射方向を制限する開口部を複数有する請求項4記載の光学分析装置。
【請求項6】
前記光学分析装置が、核酸増幅反応装置である請求項2記載の光学分析装置。
【請求項7】
単数又は複数の光源から照射された光が導光板にて反応領域のそれぞれに導光され、該反応領域内から発生する光を光の射出方向に制限する遮光構造体を経て検出系にて検出する光学分析方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2013−33008(P2013−33008A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2011−169993(P2011−169993)
【出願日】平成23年8月3日(2011.8.3)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成23年8月3日(2011.8.3)
【出願人】(000002185)ソニー株式会社 (34,172)
【Fターム(参考)】
[ Back to top ]

