光学療法治療装置
【解決手段】生きたバイオフィルム狙い撃ち熱分解法(LBTT)の方法と装置を開示している。開示しているLBTT法は、白熱光と、熱シンクとしての標的剤とを使用して、生きた歯周バイオフィルムを熱分解し凝固させるのに使用することができる。送達アッセンブリを使用すれば、「高温先端部」とも呼ばれる炭化した近赤外線ダイオードレーザー送達ファイバーからの二次量子の光学発光と熱放出によって作り出された白熱光を、生きたバイオフィルムを含んでいる適用領域に送達することができる。白熱高温先端部の放射エネルギー(即ち、その光学発光と熱放出)を活用するというこの新規な狙い撃ち方式を使用すれば、歯周ポケット内の標的である生きたバイオフィルムの物理的性質は、粘液性液体ゲルから半固体凝塊へと変化し、半固体凝塊であれば、作用を受けたポケットから従来の機械的SRP歯周技法で容易に除去できるようになる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、目標部位の生物学的汚染のレベルを選択的に低減するための方法と装置に関する。より具体的には、本発明は、光学的及び熱的放射を使用した、歯周ポケット内の細菌汚染除去及びバイオフィルム排除のための方法及び装置に関する。
【背景技術】
【0002】
本出願は、関連出願である2005年11月30日出願の米国仮特許出願第60/740,776号「光学療法治療装置」の恩典を請求し、同仮特許出願の内容全体を参考文献としてここに援用する。
【0003】
「バイオフィルム」という用語は、自らの粘液性ゲル状高分子分泌物で取り囲んだ微生物の群集を表し、これは、他の感染性及び炎症性のヒトの疾患の宿主になると共に、歯周及びインプラント周囲の疾病の原因となっている(非特許文献1)。歯周疾病では、歯根及び歯周ポケット上皮に付着しているのは生きたバイオフィルムであって、これが、抗生物質の様な補助治療療法、及び補体活性化、食細胞の化学走性、及び多形核白血球の脱顆粒の様な内因的免疫機能から、病原菌を保護している(非特許文献2)。バイオフィルムのこれら独特の防護特性は、一部には、細菌及びバイオフィルムが生息している(歯周ポケットの)生態学的壁凹部の性質から明らかであり、この遮断された場所に居ることが歯周疾病の恒久的な治療を困難且つ複雑にしている。事実、生きたバイオフィルムを排除するための物理的、抗微生物的、及び化学的手法を包含する典型的な治療法が、普通は必要である(非特許文献1)。歯周疾病を非外科的方式で治療するためにこれまで採用及び研究されてきた2大レーザー療法に、FRP Nd:YAGレーザーを使用したレーザー歯肉溝壊死組織除去法(非特許文献3、4、5)、及び(ソフト)低レベル赤色レーザーと各種光感作剤を使用した細菌光感作法がある(非特許文献6、7、8、9、10)。
【特許文献1】国際公開第2005/034790号パンフレット
【非特許文献1】Socransky, S.とHaffajee, A.、歯のバイオフィルム:困難な治療標的、Periodontology、2000年、28巻、2002、12−55
【非特許文献2】Wilson, M.、細菌性バイオフィルムとヒトの病気、Science Progress、2001年、84(3)、235−254
【非特許文献3】White、JM、HE Goodis、CL Rose、口腔内軟組織外科処置でのパルス型Nd:YAGレーザーの使用、Laser Surg Med、1991年、11、455−461
【非特許文献4】Greenwell H、DM Harris、K Pickman他、歯周炎及び歯周病原体に対するNd:YAGレーザー掻爬術の臨床評価、J Dent Res、1999年、78、138
【非特許文献5】Gregg RH、McCarthy DK、歯周靭帯再生のためのレーザーENAP、Dentistry Today、1998年、17、86−89
【非特許文献6】Wilson他、慢性歯周炎の治療における酸化還元剤の使用の予備的評価、J Periodontal Res、1992年、9月号、27(5)、522−7
【非特許文献7】DobsonとWilson、低パワーレーザーの光によるバイオフィルム口内細菌の光感作致死、Arch Oral Biol.、1992年、11月号、37(11)、883−7
【非特許文献8】SarkarとWilson、慢性歯周炎患者の歯肉縁下歯垢内の細菌の致死的光感作、J Periodontal Res、1993年、5月号、28(3)、204−10
【非特許文献9】Wilson、Dobson、Sakar、低パワーレーザーの光によるバイオフィルム口内細菌の光感作致死、Oral Microbiol lmmunol、1993年、6月号、8(3)、182−7
【非特許文献10】Wilson他、歯肉縁上歯垢内の細菌を光感作剤の存在下に低パワーレーザー光により死滅させる、J Appl Bacteriol、1995年、5月号、78(5)、569−74
【非特許文献11】Harris, D、編集者への書簡、レーザー歯肉溝壊死組織除去の線量測定、Laser Surg Med、2003年、33、217−218
【非特許文献12】Neill ME、JT Mellonig、組合せ型歯周炎療法でのNd:YAGレーザーの臨床効能、1997年、9(6補遺)、1−5
【非特許文献13】Gregg RH、McCarthy DK、レーザー歯周療法、Caser reports、 Dentistry Today、2001年、20、74−81
【非特許文献14】Harris, D.、Gregg, RH.、McCarthy DK.他、個人開業でのレーザー支援型の新しい付着処置、General Density、9−10月号、2004年、152巻、第5、396−403頁
【非特許文献15】Yukana RA、Evans GH他、ヒトの歯周再生のためのレーザー利用による新しい付着処置、International Association Dental research、2003年、要約、第2411
【非特許文献16】ALD(The Academy of Laser Dentistry)、特徴付けられた波長:ダイオード−歯科のダイオードレーザー(学術報告書)Wavelengths 2000年、8、13
【非特許文献17】Bornstein E、近赤外線歯科ダイオードレーザー、科学的及び光生物学的原理と応用、Dent Today.、2004年、3月号、23(3)、102−8
【非特許文献18】Grant SA、Soufiane A、Shirk G他、石英光ファイバーの分解誘導伝達損失、Lasers Surg Med、1997年、21、65−71
【非特許文献19】Kuhn TS、黒体理論と量子不連続性、1894−1912、イリノイ州シカゴ、University of Chicago press、1978
【非特許文献20】Verdaasdonk RM、van Swol CF、医療用レーザー光送達システム、Phys Med Biol、1997年、42、869−894
【非特許文献21】Janda P、Sroka R、Mundweil B他、ファイバー誘導型レーザーシステムの接触使用により誘発させた熱組織効果の比較、Lasers Surg Med、2003年、33、93−101
【非特許文献22】Manni, J、進化したレーザーの歯科応用、マサチューセッツ州バーリントン、JGM Associates,Inc.、2000年
【非特許文献23】Ower他、徐放装置における歯肉縁下に設置された酸化還元剤の慢性歯周炎に対する効果、J Clin Periodontol、1995年、6月号、22(6)、494−500
【非特許文献24】Yilmaz他、ヒトの歯周疾病に対するガリウムヒ素ダイオードレーザーの効果:微生物学的及び臨床学的研究、Lasers Surg Med.、2002年、30(1)、60−6
【非特許文献25】O’Neill J他、光殺菌剤の抗溶連菌活性比較、J Chemother、2003年、8月号、15(4)、329−34
【非特許文献26】Chan他、光力学療法における歯周病原菌に対する異なるレーザー波長の殺菌効果、Lasers Med Sci、2003年、18(1)、51−5
【非特許文献27】Niems MH、レーザー対組織相互作用:基礎と応用、ドイツ、ベルリン、Springer Verlag、2002年
【非特許文献28】Atherton, S.J.とHarriman, A.J.、American Chemical Society、1993年、115、1816−1822
【非特許文献29】Hewitt P、Conceptual Physics 第9版、米国、サンフランシスコ、Addison Wesley、2002年
【非特許文献30】Jass, J.、Surman, S.、Walker, J.、医学的バイオフィルム:検出、予防、及び制御、英国、ウエストサセックス、John Wiley&Sons.LTD.、2003年
【非特許文献31】Listgarten MA、歯垢及び他の口内バイオフィルムの形成、In:Newman HN、Wilson Med、Dental Plaque revisited、Cardif:Bioline、1999年、187−210
【非特許文献32】Listgarten MA、ヒトにおける歯周の健康と病気に関係付けられる微生物叢の構造、光学及び電子顕微鏡的研究、J Periodontal、1976年、47、1−18
【非特許文献33】Listgarten MA、Mayo HE、Tremblay R.、ヒトにおけるエポキシ樹脂歯冠上の歯垢の改善、光学及び電子顕微鏡的研究、J Periodontal、1975年、46、10−26
【発明の開示】
【発明が解決しようとする課題】
【0004】
歯周ポケットの「細菌汚染除去」には、レーザー及びレーザー波長の多様なグループによる多くの技法が提案されているが、文字通り「レーザーを使用した歯周バイオフィルム排除」という1つの目的に重点を置いている文献は数少ない。従って、歯周ポケット内のバイオフィルム排除を実現するために、補助的装置として期待できる安価な近赤外線ダイオードレーザーの固有の熱特性を探究する必要がある。
【0005】
従って、本発明の主な目的は、歯周ポケット内のバイオフィルムを排除する方法と装置を提供することである。
このことは、CW近赤外線ダイオードレーザーにより生み出される「高温先端部」からの白熱光と、光エネルギーを選択的に吸収する標的剤を用いた、生きたバイオフィルム狙い撃ち熱分解法(LBTT)により実現される。
【課題を解決するための手段】
【0006】
本発明は、生きたバイオフィルムを狙い撃ちにし、前記バイオフィルムを熱分解し、除去するための方法と装置に着眼している。本発明の或る実施形態では、熱分解させるバイオフィルムを含んでいる部位に標的剤を導入する。標的剤は、歯周ポケットのバイオフィルムに作用するメチレンブルーの様な、バイオフィルムが選択的に吸収する物質であるのが望ましい。近位端と遠位端の間を伸長している光ファイバーが提供されている。遠位端を、例えば、歯周ポケット内の標的であるバイオフィルム付近の組織に導入する。次いで、光ファイバーの近位端の中に光を導入すると、導入された光がファイバーの遠位端に向けて伝播し、遠位端から出て行く。光は可干渉性であるのが望ましいが、非可干渉性であってもよいし、また、単色又は多色の何れであってもよい。光の輝度は、光がファイバーの遠位端から出る際に、遠位端付近の組織及び/又は流体を、遠位端上で先ず炭化させ、その後、炭化した遠位端を白熱させることができるだけの熱が発生するように制御される。得られた白熱放射は、標的物質の優先吸収スペクトル内の波長であるため、白熱放射の少なくとも幾分かは、標的物質を加熱できる程度まで当該標的物質により吸収されて、この物質を含浸させたバイオフィルムを熱分解させ、とりわけ、バイオフィルムを或る種の半固体凝塊として特徴付けられる凝集物に変えることができる。このバイオフィルムの熱分解に続き、歯周部位用器具を介して凝集物を除去し、その後、例えば、水の様な搬送流体を流して洗浄する。
【0007】
本発明の別の実施形態では、必要なエネルギーを治療域(例えば、MB溶液)に送達するのに、光学療法装置が使用されている。光学療法装置は、その様な光エネルギーをMB溶液に送達するのに必要となる様々な要素を含め、1つ又はそれ以上の構成要素を備えている。一例として、光学療法装置は、可撓性を有する光ファイバーをその遠位端が白熱光の発生と治療に使用できるように固定するハウジングを備えている手持ち式装置である。
【0008】
本発明の別の目的及び利点は、一部は以下の説明に記載しており、また一部は説明から明らかになるか、本発明を実施することにより修得されるであろう。本発明の目的及び利点は、特許請求の範囲に具体的に指摘されている要素及び組み合わせを用いることにより実現され、達成されるであろう。
【0009】
上記概要及び以下の詳細な説明は、共に、説明を目的として一例を示したに過ぎず、特許請求の対象である本発明を制限するものではないことを理解頂きたい。
添付図面は、本明細書に組み込まれ、その一部を構成するものであり、本発明の1つ(幾つかの)実施形態を示しており、説明文と共に本発明の原理を説明する働きをする。
【発明を実施するための最良の形態】
【0010】
本開示の方法及び装置をより深く理解して頂くために、これより、添付図面に関連付けて詳細な説明を参照してゆく。
本発明の1つの態様によれば、LBTTは、歯周ポケット内の生きたバイオフィルムを特定的に熱シンクで狙い撃ちにして、その後で、熱分解して除去し易くするための処置である。バイオフィルムを狙い撃ちにした後、次に、ダイオードレーザーにより作り出された高温先端部からの固有の放射放出は、バイオフィルムの物理特性を液体ゲルから半固体凝塊へと熱的に変化させ、それを歯周領域から機械的に除去できるようにするために、使用、活用される。
【0011】
LBTTは、CW近赤外線ダイオードレーザーを採用しており、FRP Nd:YAGレーザーを使用したレーザー歯肉溝壊死組織除去法、及び各種光感作剤と共に(ソフト)低レベル赤色レーザーを使用した細菌光感作法として知られている方法の何れとも基本的に異なる線量測定パラメータ及び論理を有している。
歯周ポケットのレーザー線量測定管理
線量測定の視点から見てCWダイオードレーザーを使ったLBTTに付随する最も近い治療法は、従来的には自励パルス型Nd:YAGレーザーを使って実施されているレーザー歯肉溝壊死組織除去処置である。1992年に、Myersは、Nd:YAGを使用した場合の歯周ポケット用の具体的な線量測定計算を提案しており、彼の業績により、各歯周ポケットの個々の探針深度に基づくレーザー線量測定表が作成された(非特許文献11)。この一般原則と定量式を使用して、FRP Nd:YAGレーザーを使用した場合のデータが生成され、これにより、FRP Nd:YAGレーザーでの、「歯肉指数、歯肉出血指数、探針深度、付着レベル、及び歯の可動度を含め、臨床学的指数を向上させるための歯周ポケットの病変又は炎症のある軟組織の除去」という特定の言語を使用した「レーザー歯肉溝壊死組織除去法」の最初のFDA市場認可に至った(非特許文献11、12)。
【0012】
GreggとMcArthy(非特許文献13)は、歯周ポケットレーザー線量測定の概念を更に取り入れ、「光線量」計算を利用した歯肉溝壊死組織除去の第1症例報告書を引用して、「治療部位に送達されるレーザーエネルギーの量」を画定した。表1参照。
【0013】
【表1】

【0014】
この新規な(ジュール/mm pd)の測定は、薬物投与量が組織中の薬物の濃度を画定するのと殆ど同じ様に、総光線量が治療部位(歯周ポケット)におけるレーザーエネルギーの濃度を画定することになる点で、(mg/kg体重)で示される薬物投与量の値に似ていることを、2003年にHarrisが述べている(非特許文献11)。Harrisは、「光線量」が、潜在的に異なるレーザーシステムを使用した同様の研究を比較するための均一な尺度を提供するのに有用なパラメータであると結論付けている(非特許文献11)。極最近では、Harris、Gregg、McCarthy他(非特許文献14)が、近年FDAにより認可されたレーザー支援型の新しい付着処置(LANAP)の遡及的分析を公表しており、ここでは、歯周ポケット当たりの送達される総光線量は10〜15J/mm pdとされている。LANAPは、Yukna他(非特許文献15)により報告されている処置でもあり、この報告では、長い連接上皮を欠く場合のレーザー処置を使った歯周靭帯の再付着及び再生の組織学的証拠が初めて提供された。LANAPの公表されている主要目的は、歯周ポケット上皮とその下層の歯周ポケット内の感染した組織を完全に取り除き、根面に付着している石化した歯垢と歯石を取り除く、壊死組織除去である(表2)(非特許文献14)。最後に、Harrisは、(他の研究を再検討した結果)パルス型FRP Nd:YAGを使用した場合での、根面を傷つける恐れがある光エネルギーの「有害量」は、20〜60J/mm pdの範囲内であると推定し、各固有のレーザー療法にとって適切な異なる線量測定を開発する必要があることを予測した。
【0015】
【表2】

【0016】
FRP Nd:YAG及びCWダイオードレーザーのパルス発振性能
FRP Nd:YAGレーザーは、歯周ポケットの歯肉溝上皮を安全且つ迅速にアブレーションするための非常に高いピークパワー(1000〜2000ワット/パルス)を可能にする百万分の1秒(10−6秒)単位のパルス持続時間が可能である(非特許文献14)。このレーザー対組織の相互反応を活用することで、FRP Nd:YAGレーザーを歯肉溝壊死組織除去に使用する臨床医は、歯周ポケットの歯肉溝上皮に対して非常に短い時間間隔でレーザーエネルギーの強力なバーストを浴びせる能力を有することになる。この能力のおかげで、(10−6秒)という相互反応の光生物学が、レーザー対組織の相互反応のアブレーション前線をレーザー対組織相互反応の熱前線の前方に維持することから、上皮組織の速くて正確なアブレーションが起こる。歯周ポケットに挿入されたCW又はゲート型ダイオードレーザーは、FRP Nd:YAGの高いピークパワー又はマイクロ秒パルスを有していない。CWダイオードレーザーは、ミリ秒単位(10−3、又は千分の1秒)の遙かに長いパルス持続時間と、遙かに低いピークパワーを有しており、これは軟組織のアブレーション閾値に達しない(非特許文献16、17)。そこで、CWダイオードレーザーでは、出力パワーがかなりの範囲まで「高温先端部」として知られているものによる熱と放射エネルギーに転換されることから、閉鎖型(歯周ポケット)処置には基本的に異なる論理と線量測定方式が必要となる(非特許文献16、17)。
【0017】
【表3】

【0018】
CWダイオードの物理的パルス限界を科学的既成事実として捉えた上で、CWダイオードレーザーを使用した場合の歯周ポケットの「光線量」計算の論理は、近年公表されたFRP Nd:YAGを使用したLANAP方式に実質的に修正を加えたものにせねばならない。ダイオードとFRP Nd:YAGの間の固有の物理的及び光生物学的差異(即ち、ダイオードの「高温先端部」接触蒸散対FRP Nd:YAGアブレーション)は、ダイオードについては、白熱先端部における実質的な熱生成により許容誤差範囲がかなり狭まることが考慮されるため(非特許文献17)、この重大な区別を臨床医が理解していることが肝要である。それぞれ固有のレーザー療法毎に「光線量」の定量値が必要となるというHarrisの提案(非特許文献11)に従って、本発明の1つの態様は、閉鎖型歯周ポケットの処置におけるCWダイオードレーザーに合わせて明示的に仕立てられた、異なる線量測定値と論理の実施例を伴うパラメータの新しいセットの画定を含んでいる。それらパラメータは、ダイオードレーザー歯周ポケットパラメータ(DLPP)と呼ばれ、過剰な熱、パワー、及び/又は治療時間による、隣接する組織のやけど及び損傷に対する安全対策を同時に講じながら、歯周ポケット内で白熱先端部を生成するダイオードレーザー固有の現象を活用している。
CWダイオードレーザーを使用した場合の「高温先端部」の発生
量子放射及び光生物学の物理的変化は、ダイオードレーザーファイバー(500mWを上回るエネルギーを送給中)が組織と接触しファイバーの先端が炭化した際に瞬間的に起こるものであるが、この変化は詳しく説明されている(非特許文献17)。ダイオードレーザーファイバー先端部の炭化と同時に、熱誘導白熱の形態でファイバーから発せられる量子放出に瞬時的且つ顕著な変化が見られることが説明されている。
【0019】
熱力学の第1法則は、エネルギーは作り出されることも破壊されることもなく、単に形態が変化するだけであると述べている。この法則を歯周ポケット内のCWダイオードレーザーに当てはめた事例を考えると、レーザービームの電磁エネルギーは、炭化した先端部に吸収されるが、その際、先端部の分子を振動させ、熱エネルギーに変換される、ということである。先端部が瞬時に高温(726℃より高温)になるので、この熱は白熱形態の電磁エネルギーに再変換され、そこで、先端部は可視の赤外線光を放出し、このとき「赤色高温」となる(非特許文献18、19)。これにより得られた「高温先端部」(白熱部)の二次量子放出は、ダイオードレーザーの一次赤外線光子で観測されるものとは基本的に異なる熱伝達及び光生物学的事象を歯周ポケット及び組織に発生させる(非特許文献17)。それら変化の光生物学は、熱力学の第2法則により部分的には説明することができる。
【0020】
熱力学の第2法則は、レーザーの一次エネルギーが或る形態から別の形態に変換されるとき、エネルギーの幾分かはそれ以上の使用に利用できなくなると述べている。このことは、レーザーエネルギーの幾分かが破壊されるという意味ではなく、伝達時のエネルギーの一部は、一次的光子エネルギーと同じ仕事に使用することのできない拡散形態(本例では熱)の「廃エネルギー」となるのである。レーザーの一次光子は、炭化していないファイバーから直接放出されるので、十分にコリメートされ、集束され、均一になっていることから、この高温先端部からの「熱」又は「廃エネルギー」は、レーザーからの一次光子よりも低品質であると言える(非特許文献19、21)。ダイオード高温先端部が熱で光を放ち始めると(図1)、まず赤色光を、次いで橙色の可視光を放出する。このことは、先端部が(900Cから1200C)に達する際の黒体の軌跡を重ねたC.I.E.色度マップ(図2)により証明される(非特許文献19)。このエネルギー変換現象の別の表れ方は、従来のブンゼンバーナーの中で約1000℃に熱した「赤色高温」細菌運搬ループで観察することができる(図3)。
【0021】
高温先端部と化し劣化した光ファイバーでは、レーザーからの一次光子の順方向ビーム品質及び放出は(エネルギー、集束性、均一性の点から評価すると)実質的に低下し、高品質エネルギーのより深い場所の組織への効率的な送達を適切に継続することができない(非特許文献18)。「高温先端部」及びCWダイオードに伴うそれら量子変化は本当であり、歯科開業医に、このことが習慣的に理解されている、或いは考慮されているわけではないが、この量子変化はVerdaasdonkとSwol、並びにJanda他によりこれまでにも詳しく説明されてきた(非特許文献20、21)。従って、Harrisが説明している閉鎖型歯周ポケットFRP Nd:YAG処置の「光線量」計算は、ダイオードレーザーの異なる物理学、先端部の放出、及び光生物学の現実を反映していない。
35
FRP Nd:YAGとCWダイオードレーザーの間のエネルギー伝達差
歯周ポケットにFRP Nd:YAGを使用した場合のアブレーションのレーザー対組織相互反応についての従来のパワー密度方程式は、画定されたビーム径を有する照射領域での一次FRP Nd:YAGレーザー光子の潜在的熱効果を測定している。
【0022】
【数1】

【0023】
しかしながら、CWダイオードレーザーを使用した場合、出力パワーの順方向放出の内かなりの量が炭化したファイバー先端部で局所的な放射熱に変換され、これが光ファイバーに大きな損傷を与えるため、画定されたビーム領域を削除してしまう。この(先端部からの)熱は、次いで、接触熱伝導のメカニズムにより近接する歯周組織に伝達される(非特許文献17、18、19、20、21、22)。熱伝導は、組織アブレーションを実現するためにファイバーから適切な「ピーク」順方向パワー伝達を作り出すことができるFRP Nd:YAGで観察されるものとは基本的に異なる、組織に対するエネルギー伝達のメカニズムと方式である。アブレーションは、Nd:YAGが非常に大きい(ピークパワー)エネルギーを、送達先端部直下の小さい組織体積の中に百万分の一秒単位で注入したときに起こる。この急速且つ封じ込められたエネルギー伝達は、アブレーションという生体力学的な仕事を生み出す(非特許文献22)。従って、FRP Nd:YAGの物理学は、レーザーパルスの大部分を先端部下方の組織の中に直接伝達できるようにし、そこで、レーザーエネルギーは、高温先端部及びCWダイオードレーザーからの熱伝導を介した、接触蒸発で見られるよりも更にエネルギー効率が高いやり方で、組織を迅速に切除する。更に、FRPレーザーの高ピークパワーパルスは、アブレーション、及び除去しなければ順方向レーザー放出を阻止しファイバー内に不要な熱を貯め込む恐れのあるNd:YAGファイバー先端部に引っかかった壊死組織片や残骸の除去、を支援する可能性が高い(非特許文献22)。反対に、CWダイオードでは、レーザーの出力パワーの多くが熱に変換されるので、実際に、先端の近傍360度に多量の白熱放射熱エネルギーを発生させる。これは一部には、異なるレーザーでは、かなり変わったレーザー対組織相互作用(熱接触蒸発対アブレーション)の見られることが理由である(非特許文献17、22)。
治療時間−歯周ポケットにCWダイオードレーザーを使用した場合に不可欠なパラメータ
CWダイオードレーザーを使用したときに、白熱先端部からの放射熱を考慮すると、FRP Nd:YAGを使用した閉鎖型歯周ポケット処置に関する従来の線量測定の方程式と論理は変えなければならず、望ましくない組織損傷を防ぐために、臨床学的に治療時間の点から考察せねばならない。例えば、表2には、FRP Nd:YAGレーザーを使用して、歯周ポケット内で、時間とは無関係に、上皮層壊死組織片がファイバー先端に堆積しなくなるまで、レーザー溝走査(LANAPによる)を継続すべきであると示されている。この歯肉溝壊死組織除去処置は、アブレーションを起こすことができる平均出力パワー4ワット、パルス幅150usで安全に達成される。しかしながら、CWダイオードレーザーの白熱先端部を使用した場合、臨床医は、4ワットの出力パワーでは1乃至2秒間しかCWシステムを安全に使用することができず、それを超えると、近接する歯周組織が取り返しのつかない傷又は火傷を負うことになる。従って、FRP Nd:YAGに関するこのレーザー溝走査論理及び線量測定は、CWダイオードでは使用できないし、実施すべきではない、というのも、出力パワー4ワットでは、多量のエネルギーがファイバー先端部で局所熱に変換されてしまうからである。FRP Nd:YAG及びCWダイオードレーザーでのレーザー線量測定に必要な基本的なレーザー算術計算を以下に示し表4で説明する。
【0024】
【表4】

【0025】
CWダイオードレーザーからの過剰な出力パワーが直接(熱へ)エネルギー変換されることで、ファイバー先端部から更に多くの熱が伝導によって近接する歯周組織に伝達されるのは有害である。上記(表4)より、CWダイオードレーザーを使用した閉鎖型(歯周ポケット)処置に対する臨床学的考察過程を変え、治療時間(表4の数式4a参照)の値をそれらに応用することにより、歯周ポケットに適用される、時間に基づく線量測定パラメータを使用した、新しい「光線量」論理を作り出せることが分かるはずである。また、それらレーザーを使用した場合の白熱先端部の強力な熱により、安全を確保するための追加的な臨床上の修正には、更に、所与の閉鎖型歯周ポケット処置に対する総エネルギー値を下げることが伴うことになる。歯周ポケット内のCWダイオードレーザーシステムでは、(先に説明したように)白熱高温先端部という損なわれた光学器に伴い「ビーム面積」に相当する実際の値が存在しないことから、これら特別な修正が必要である。画定されたビーム面積がない状況では、従来なら損なわれていないファイバー先端部直下の治療部位に送達される一次レーザー光子により画定されていた有効光線量を求めるために機能する実際的なパワー密度又はエネルギー密度の式は存在し得ない。
【0026】
歯周ポケットにCWダイオードレーザーを使用した安全な処置を行うために、総エネルギーの値を変更することは、レーザー出力パワー(表4の式2参照)を、LANAPの様な歯肉溝壊死組織除去処置用の公表されているNd:YAGパラメータの約1/3に下げるだけで簡単に達成される(非特許文献14)。CWダイオードレーザーについての上記変更は、各固有のレーザー療法に適合する新しい定量的線量測定を開発するためのHarrisの要件を満たすはずであり(非特許文献11)、ダイオードレーザー歯周パラメータ(DLPP)と呼ぶことにする。この新しいCWダイオードパラメータの論理は、表4の従来の総エネルギーの式を、治療時間の値を反映するように構築し直すだけで簡単に描き出すことができる。
【0027】
【数2】

【0028】
DLPPのこの論理を使用すると、臨床医は、CWダイオードレーザーを使用した場合の最大安全と成功を確保するために、閉鎖型歯周処置におけるレーザー出力パワー及び/又は治療時間の両方を簡単に操作することができる。従って、DLPPでは、FRP Nd:YAG(平均4ワット)を使用した場合の閉鎖型歯周溝内処置にとって安全で効果的な出力パワーは、CWダイオードで安全に使用できるもの(1〜12ワット)よりも、約3倍(3x)大きい出力パワーとなることが分かるであろう。更に、FRP Nd:YAGを使用した歯肉溝内処置は、時間に関係なく(即ち、上皮層壊死組織片がファイバー先端に堆積しなくなるまで)行われるが、CWダイオード処置は、近接する歯周組織への望ましくない熱による損傷を避けるために、先端部を迅速に動かして、約20秒乃至25秒で完了させねばならない。
ピークパワー−接触蒸発対アブレーションを規制するパラメータ
CWダイオードレーザーに伴う新しい線量測定パラメータの案内役としてのDLPPの必要性を更に定量化するために、Nd:YAGとCWダイオードを使用した場合のピークパワーの値、及びピークパワーが生体力学的仕事を遂行する能力を、表5及び表6に算定数値と共に載せている。
【0029】
【表5】

【0030】
ここ(表5)では、歯肉溝壊死組織除去に、平均パワー3.9W、25HzのFRP Nd:YAGをパルス持続時間150μsで30秒間用いた場合について、総エネルギー14.6Jmm pdは、LANAPの様な安全で効果的な歯肉溝壊死組織除去処置のためのHarrisとGreggによる治療パラメータの範囲内に十分入ることが分かる(非特許文献14)。これらパラメータでは、パルス当たりのピークパワー−又は、「アブレーションという生体力学的仕事に利用可能なパワー」は、FRP Nd:YAGレーザーについては1040W/パルスである。しかしながら、CWダイオードレーザーについて、この装置を使用した場合に歯周ポケットでは前記3.9Wという平均パワーが、エネルギー生産及びその生体力学的仕事を行う能力の観点から、どんな意味を持つかを理解するために、計算を行うと、レーザー同士の間で能力(レーザー対組織相互作用)に有意な差のあることが明らかになる。
【0031】
【表6】

【0032】
従って、本例より明らかなように、CWダイオードレーザーは、1秒間にNd:YAG(3.9ジュール/秒)と同じエネルギーを歯周ポケットに送達してはいるが、「組織アブレーションパワー」は{3.9W(CW)/1040W/パルス*100=0.375%}又は3分の1パーセントしかない!。この(非常に重要な計算)は、ダイオードが、同じ1秒間間隔で同じエネルギーでFRP Nd:YAGの各パルスが生成する「アブレーションという生体力学的仕事に利用可能なパワー」よりも99.625%少ないパワーしか作り出していないことを意味する。この注目すべき計算は、異なるレーザー性能を生体力学的仕事のアブレーションの概念と結び付けた場合のエネルギーとパワーという2つの基本的な定義の結果として正しい。表7を参照されたい。
【0033】
【表7】

【0034】
表5及び表6の計算より、CWダイオードレーザーが、FRP Nd:YAGと同じ生体力学的仕事(アブレーション)を行う理論的な能力を有していることは、両方のレーザーシステムが30秒間に117ジュールのエネルギーを作り出すことから明白である。しかしながら、調べるべき決定的な因子はパワーの関数であり、なぜなら、FRP Nd:YAGレーザーは、ダイオードに比べ、単位時間当たり遙かに高いパワー(10−6秒単位の遙かに速い速度で、99.625%高いピークパワー)を出すからである。従って、パワーは仕事をする速さと定義されていることから(非特許文献22)、CWダイオードレーザーは、アブレーションを起こせるだけの単位時間当たり順方向放出パワーを作り出さない。更に、CWダイオードレーザーからの利用可能なエネルギーの大部分は、熱の拡散形態として「廃エネルギー」に変換される、という熱力学の第2法則の先の論議を思い出して頂きたい。最後に、このことは絶えず心に留めておいて頂きたいのだが、歯肉溝壊死組織除去パラメータについては、熱への変換により、白熱ファイバーが閉じている歯周ポケット内に(FRP Nd:YAGと同じエネルギーで)安全に留まれる時間は遙かに短い。
【0035】
理解しておくべき最後の重大な問題は、CWダイオードが「パルス型」か「ゲート型」である場合、実際には、より少ない総パワー、ひいてはより少ないエネルギーが歯周ポケットに送達され、治療用に使用できる(FRP Nd:YAGでのような)ピークパワーの増加は無い。このことは、組織アブレーションという生体力学的仕事をするための「理論上の能力」さえも低いと解釈できる。従って、閉じている歯周ポケットで上記各ダイオード装置を使用した場合の最も率直な計算と熱伝達評価は、DLPPを使用した場合のCWモードのレーザー(非特許文献22)により求められる。
【0036】
DLPPという新たな論理に連結したCWダイオードレーザーに対して上で推奨している調整を行ったとしても、閉鎖型歯周処置に幾らかでも時間超過があれば(出力パワーが最大1.2Wの場合でさえ)、白熱部に近接する歯周組織に対する熱に関係する有害な影響を引き起こす恐れがある。これは、ダイオードレーザーの高温先端部にとって優先的に白熱の熱エネルギーを吸収するという「熱シンク」の概念が、より深い場所の歯周組織を損傷から護るためのみならず、CWダイオードを使用して熱分解させるために歯周ポケット内の生きたバイオフィルムを狙い撃ちにするのにも、潜在的に有用性があるという理由からである。
メチレンブルー(MB)を使用して生きたバイオフィルムを狙い撃ちにする
MBは、酸化還元指標、シアン化合物の解毒剤、及び低刺激性消毒薬として従来から医薬として使用されている。歯科では、MBは、歯周ポケット内の個々の細菌の光感作剤として主に使用されており、(ソフト)低レベル可視赤色レーザー(レーザー出力パワー100mW以下)で活性化する。低レベル赤色レーザーを用いたこれらの適用例は、歯周ポケットにおいて、過去10年に生体内での実用的な成功にはほとんど出会っていない(非特許文献6、7、8、9、10)。選択された歯周病原菌の「光感作剤」として一般に採用されている可視ソフト赤色レーザーは、白熱先端部を作り出せるだけの出力パワーを発生させず、この効果に対して文献を再検討したものを表8で評価することにした。
【0037】
【表8】

【0038】
一見すると、赤外線レーザーを、MBで染めた何かと組み合わせた器具として使用するのは、赤外線レーザーの一次スペクトル放出が従来のMB吸収スペクトルよりも長い150nmで始まることから、不適当に見える(非特許文献27)。しかしながら、生きたバイオフィルムの狙い撃ち熱分解法(LBTT)では、MBは、バイオフィルム標的剤であり、且つ歯周ポケット内でファイバーから作り出される二次的な白熱(可視)「高温先端部」放射エネルギーにとっての「熱シンク」である。白熱先端部からの橙色及び赤色の可視放射(600nm〜700nm)は、MBの従来の吸収曲線内で利用できるものである。これは、MBが、可視橙色又は赤色スペクトルの609nm及び668nmに吸収ピークを有しており(非特許文献28)、高温先端部の白熱温度のC.I.E.色度マップ(黒体軌道を重ねたもの)(図2)の面積内にぴったり収まっていることから、容易に達成される。
【0039】
バイオフィルムは、エキソポリサッカリド(EPS)、水、及び微生物を、概ね5%(EPS)、92%(水)、及び3%(微生物)の割合で含んで形成されたマトリクスで構成されている(非特許文献1、30)。EPSの成分は、バイオフィルムの3次元構造を構築している極度に水和したゲル状(粘液性)生体高分子である。バイオフィルム内の細菌を、細菌にとって有害な抗菌剤(抗生物質)及び免疫系による攻撃から保護しているのは、このEPSマトリクスである(非特許文献1、2、30)。Listgarten他は、歯肉縁下の歯垢(バイオフィルム)を有する領域のバイオフィルムと病的な上皮は、MBに対する透過性が高いことを示した(非特許文献31、32、33)。これこそ正にLBTT処置の狙い撃ちのメカニズムである。この論理は、(細菌が生息している)バイオフィルムを、熱分解のための熱シンク(MB)を使用して狙い撃ちにするものである。
【0040】
上記のバイオフィルムを狙い撃ちにするメカニズムが確立されると、次に進み、白熱ファイバー先端部からの光子の強力なエネルギーが、バイオフィルムに浸透しているMB分子に吸収され、その後瞬時にしてMB分子内で振動及び回転エネルギーに変換される、これが熱に関する分子の基本である。この熱は、常に、MB又はMBを染み込ませたものの温度を上昇させる(非特許文献29)。従って、本方法によれば、ダイオード高温先端部からの二次的な白熱エネルギーの吸収によって、MBを染み込ませた生きたバイオフィルム及び病的な歯肉溝上皮に対する極めて大きなエネルギー伝達が生じる。生きたバイオフィルムへの、この新規な的を絞り制御された熱伝達は、次いで、バイオフィルム及び染めた病的上皮から半固体凝塊を形成するので、これにより、従来の根面平滑化及びスケーリング処置で容易に取り除くことができるようになる。
【0041】
バイオフィルムの物理的特性(組成ではない)を、生卵の白身と潜在的に同様のものと考えると、熱分解及び凝固の上記メカニズムと論理は明白になるであろう。陶磁器陶タイルの床(歯根面)から鋼鉄のスプーン(歯周スケーラー)で生卵の白身(バイオフィルム)を取り除こうと試みても、全体がゲル状のバイオフィルムマトリクスをそのままのゲル状の形態で取り除くことは実質的に不可能であろう。しかしながら、生卵の白身を選択的に狙って加熱すれば、白身はその物理的特性が固体凝塊(調理卵)のそれに変化するので、ずっと容易にタイルの床から剥がすことができる。以上が、歯周ポケット内でMB及び/又は他の標的剤を熱シンクとして使用した、生きたバイオフィルム狙い撃ちの論理と設計である。この方法を使用すると、開業医は、DLPPの大要に従って、不安なく、ダイオードレーザーの出力パワーを約1.0W CWまで下げ、ゲル状マトリクスの凝固と熱分解により、生きたバイオフィルムの相変化を達成することができる。これは、歯科患者にとってより安全な処置につながり、歯周ポケット内の、より多くのコラーゲン、骨、及び粘膜を処置中の取り返しのつかない熱による損傷から護り温存することができると同時に、バイオフィルムの除去がやり易くなる。一旦、バイオフィルムが除去されると、歯周ポケットは即座に治癒が見込めるようになる。歯周ポケットの治癒過程において、身体からは、微生物の増殖を助長した独自の生態学的壁凹、即ち歯周ポケットの歯肉縁下8〜10mmの生息場所が無くなる。
【0042】
或る代表的な実施形態では、生きたバイオフィルムを狙い撃ちにする熱分解法は、1%のメチレンブルー溶液を歯周ポケットに導入し、小型ファイバーブラシで送達して、歯周ポケットの3次元領域に到達させ、全体がバイオフィルム標的溶液で覆われるようにすることで始まる(図4−5)。次いで、MB溶液を歯周ポケット内に1分間放置し、その後、歯周ポケットを軽くすすぎ、余分な溶液を当該領域から取り除く。次いで、近赤外線ダイオードレーザーファイバーを、出力パワーを1ワットCWに設定して歯周ポケットに挿入し、レーザーをオンにする。1秒以内に、白熱先端部が(先に説明したメカニズムによって)発生するので、次いで、先端部を歯周ポケットの全領域に亘って素早く動かすと、狙ったバイオフィルムと病的な上皮組織の凝固が始まる(図6−7)。20秒間、歯周ポケット全体に亘ってファイバーを素早く動かした後、ファイバーを取り出し、歯周スケーラーを導入して、バイオフィルム及び組織凝塊を、歯石及び他の壊死組織片と共に、歯周ポケット全域から取り除く(図8)。次いで、歯周ポケットを、細くて可撓性を有する套管及び洗浄シリンジを使って、滅菌された生理食塩水で洗浄し、その後、湿らせたガーゼで2分間組織を歯に強く押し付ける。次に、患者には、椅子に座らせたままでイブプロフェン400mg与え、3日間はLBTTの領域を避け、その後は通常の衛生法を再開するように指示を与えてから退出させる。本症例では、8日後、歯周プローブで歯周ポケットにアクセスすることはできなかったが、これは、歯冠部組織が分岐したためであり、このことは、長い連接上皮になると考えられる歯根面への新たな付着の表れである(図9)。術後5週間後、当該領域へのアクセスを再度試みたが、同様の結果を得た。2mmの健康な歯肉溝を有する新しい付着が見られ、歯周ポケットは消散した(図10)。
【0043】
ここに説明した実施形態、又はここで具体的に開示していない等価物においては、何れも、治療領域(例えば、MB溶液)に必要なエネルギーを送達するのに光学療法装置が使用されている。光学療法装置は、MB溶液にその様な光エネルギーを送達するのに必要とされる各種要素を含む1つ又はそれ以上の構成要素から成っている。一例として、光学療法装置は、可撓性を有する光ファイバーを、ファイバーの遠位部分が治療に使用できるように固定するハウジングを備えている手持ち式装置である。
【0044】
或る代表的な実施形態では、本開示の光学療法装置は、実質的に2つの構成要素、即ち、図11と12に示すように、(1)ハンドルと、(2)発光プローブとを備えている。その様な実施形態では、ハンドルは、例えば、成形プラスチック又は類似物で作られており、エネルギーを受け入れ、光エネルギーを発光プローブの光ファイバーの中へと向けるためのシステムを含んでいる。例えば、ハンドル内には、ハンドルの嵌合部と係合させたときに、光を発光プローブの嵌合部の中に向かわせるために、レンズシステムが含まれている。発光プローブは、使い捨て可能に作られており、ハンドル部分は再使用可能である。プローブは、少なくとも1つの可撓領域を含んでいるか、少なくとも1つの可撓部分の利点を実現できるように1つ又はそれ以上の領域に十分な柔軟性又は可撓性を持たせている。プローブは、プラスチック及び類似物を含め、様々な材料の何れで作ってもよい。その様な可撓性は、プローブ及び光ファイバーを、治療部位の中及び周囲に、容易且つ快適に位置決めできるようにする。光ファイバーは、その遠位端から光エネルギーを送達することに加え、又はそれに代えて、例えば、エネルギー散布に使用されるブラッグ格子型ファイバー(WO第2005/034790号参照)を採用することにより、エネルギーをその側方部分に沿って送達することができるように構成してもよい。その様な構成は、それを使用とする特定の用途に基づいて決められる。
【0045】
提示した処置と論理は、近赤外線CWダイオードレーザーと、熱シンクとして1%MBを使用した、歯周ポケット内の生きたバイオフィルムの狙い撃ちと熱分解に適用することができる代表的な実施形態である。この処置には、閉じている歯周ポケット環境内でのCWダイオードレーザーと白熱先端部現象に伴うより安全な歯肉溝内線量測定のための新たな計算論理が結び付けられている。レーザー歯周関連の文献は、FRP Nd:YAGレーザーとLANAPの様な歯肉溝壊死組織除去処置を扱っているものが圧倒的多数であることから、開業医は、CWダイオードとFRP:YAGレーザーの間の相違を理解することが不可欠である。公表されているLANAP手順と線量測定は、歯周ポケットの閉鎖環境内でCWダイオードレーザーを使用する場合に、準拠できるものではなく、また準拠すべきではなく、というのも、それら2つのシステムの物理学と光生物学は、この中で数学的に提示したように大いに異なっているからである。それら大きな相違は、歯周ポケット内に、全く異なるレーザー対組織反応を引き起こすことになる。LBTTは、熱分解と除去を目的に生きたバイオフィルムを狙い攻撃することにより、白熱先端部のCWダイオードレーザーに付帯する物理的現象を活用する試みである。DLPPは、CWダイオードレーザーを使用した閉鎖型歯周処置にとって、白熱先端部を有効且つより安全にする試みのための線量測定パラメータの新しいセットである。
【0046】
ここに開示した本発明の明細書と実施方法を考察頂ければ、当業者には本発明の他の実施形態も自明であろう。本明細書では、0.5ワット及び1〜1.2ワットのレーザーパワー出力を開示しているが、出願人は、0.5ワット乃至2ワットのパワー出力を使用したレーザーなら、本発明の方法と装置で安全に使用できるものと確信する。本明細書及び実施例は一例に過ぎないものと見なされるべきであり、本発明の真の範囲と精神は、特許請求の範囲により示されるものとする。
【図面の簡単な説明】
【0047】
【図1】歯肉と歯肉に埋め込まれている歯を示しており、歯の1つの傍らの歯周ポケット内でダイオードの高温先端部が光を放っている状態を示している。
【図2】ダイオード高温先端部が、最初に赤色可視光を、そして次に橙色可視光を放射することを、C.I.E.色度マップを図1に重ねることにより証明しているグラフ表示である。
【図3】従来のブンゼバーナー内で約1000℃まで熱せられた「赤色高温」細菌運搬ループに見られる白熱形態電磁エネルギーへの熱変換を表している図である。
【図4】歯の側部の深さ11mmの歯周ポケットを示している。
【図5】ファイバーブラシによる歯周ポケットへのメチレンブルーの塗布を示している。
【図6】歯周ポケット内に光ファイバーの遠位端を挿入し、歯周ポケット内で先端部を白熱させた状態を示している。
【図7】白熱先端部が歯周ポケット全体を通して15秒から20秒間動けるところを示す手段として、歯周ポケット内の白熱先端部の位置の変化を示している。
【図8】バイオフィルムと組織の凝塊を、照射された歯周ポケットからグレーシィスケーラーで除去しているところを示している。
【図9】施術後8日目の白化する歯肉溝組織と推定される新たな付着を示している。
【図10】施術後5週目の歯肉組織の治癒と歯への付着を示している。
【図11】一方の端がレーザー源に接続され、他方の端が発光プローブに接続されているLBTT装置のハンドルの一例を示している。
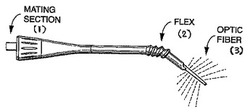
【図12】ハンドルと係合させる嵌合部(1)と、可撓部分(2)と、中を通して遠位端までレーザーを伝播させ白熱光を発生させる光ファイバー(3)を有する、LBTT装置の発光プローブの一例を示している。
【技術分野】
【0001】
本発明は、目標部位の生物学的汚染のレベルを選択的に低減するための方法と装置に関する。より具体的には、本発明は、光学的及び熱的放射を使用した、歯周ポケット内の細菌汚染除去及びバイオフィルム排除のための方法及び装置に関する。
【背景技術】
【0002】
本出願は、関連出願である2005年11月30日出願の米国仮特許出願第60/740,776号「光学療法治療装置」の恩典を請求し、同仮特許出願の内容全体を参考文献としてここに援用する。
【0003】
「バイオフィルム」という用語は、自らの粘液性ゲル状高分子分泌物で取り囲んだ微生物の群集を表し、これは、他の感染性及び炎症性のヒトの疾患の宿主になると共に、歯周及びインプラント周囲の疾病の原因となっている(非特許文献1)。歯周疾病では、歯根及び歯周ポケット上皮に付着しているのは生きたバイオフィルムであって、これが、抗生物質の様な補助治療療法、及び補体活性化、食細胞の化学走性、及び多形核白血球の脱顆粒の様な内因的免疫機能から、病原菌を保護している(非特許文献2)。バイオフィルムのこれら独特の防護特性は、一部には、細菌及びバイオフィルムが生息している(歯周ポケットの)生態学的壁凹部の性質から明らかであり、この遮断された場所に居ることが歯周疾病の恒久的な治療を困難且つ複雑にしている。事実、生きたバイオフィルムを排除するための物理的、抗微生物的、及び化学的手法を包含する典型的な治療法が、普通は必要である(非特許文献1)。歯周疾病を非外科的方式で治療するためにこれまで採用及び研究されてきた2大レーザー療法に、FRP Nd:YAGレーザーを使用したレーザー歯肉溝壊死組織除去法(非特許文献3、4、5)、及び(ソフト)低レベル赤色レーザーと各種光感作剤を使用した細菌光感作法がある(非特許文献6、7、8、9、10)。
【特許文献1】国際公開第2005/034790号パンフレット
【非特許文献1】Socransky, S.とHaffajee, A.、歯のバイオフィルム:困難な治療標的、Periodontology、2000年、28巻、2002、12−55
【非特許文献2】Wilson, M.、細菌性バイオフィルムとヒトの病気、Science Progress、2001年、84(3)、235−254
【非特許文献3】White、JM、HE Goodis、CL Rose、口腔内軟組織外科処置でのパルス型Nd:YAGレーザーの使用、Laser Surg Med、1991年、11、455−461
【非特許文献4】Greenwell H、DM Harris、K Pickman他、歯周炎及び歯周病原体に対するNd:YAGレーザー掻爬術の臨床評価、J Dent Res、1999年、78、138
【非特許文献5】Gregg RH、McCarthy DK、歯周靭帯再生のためのレーザーENAP、Dentistry Today、1998年、17、86−89
【非特許文献6】Wilson他、慢性歯周炎の治療における酸化還元剤の使用の予備的評価、J Periodontal Res、1992年、9月号、27(5)、522−7
【非特許文献7】DobsonとWilson、低パワーレーザーの光によるバイオフィルム口内細菌の光感作致死、Arch Oral Biol.、1992年、11月号、37(11)、883−7
【非特許文献8】SarkarとWilson、慢性歯周炎患者の歯肉縁下歯垢内の細菌の致死的光感作、J Periodontal Res、1993年、5月号、28(3)、204−10
【非特許文献9】Wilson、Dobson、Sakar、低パワーレーザーの光によるバイオフィルム口内細菌の光感作致死、Oral Microbiol lmmunol、1993年、6月号、8(3)、182−7
【非特許文献10】Wilson他、歯肉縁上歯垢内の細菌を光感作剤の存在下に低パワーレーザー光により死滅させる、J Appl Bacteriol、1995年、5月号、78(5)、569−74
【非特許文献11】Harris, D、編集者への書簡、レーザー歯肉溝壊死組織除去の線量測定、Laser Surg Med、2003年、33、217−218
【非特許文献12】Neill ME、JT Mellonig、組合せ型歯周炎療法でのNd:YAGレーザーの臨床効能、1997年、9(6補遺)、1−5
【非特許文献13】Gregg RH、McCarthy DK、レーザー歯周療法、Caser reports、 Dentistry Today、2001年、20、74−81
【非特許文献14】Harris, D.、Gregg, RH.、McCarthy DK.他、個人開業でのレーザー支援型の新しい付着処置、General Density、9−10月号、2004年、152巻、第5、396−403頁
【非特許文献15】Yukana RA、Evans GH他、ヒトの歯周再生のためのレーザー利用による新しい付着処置、International Association Dental research、2003年、要約、第2411
【非特許文献16】ALD(The Academy of Laser Dentistry)、特徴付けられた波長:ダイオード−歯科のダイオードレーザー(学術報告書)Wavelengths 2000年、8、13
【非特許文献17】Bornstein E、近赤外線歯科ダイオードレーザー、科学的及び光生物学的原理と応用、Dent Today.、2004年、3月号、23(3)、102−8
【非特許文献18】Grant SA、Soufiane A、Shirk G他、石英光ファイバーの分解誘導伝達損失、Lasers Surg Med、1997年、21、65−71
【非特許文献19】Kuhn TS、黒体理論と量子不連続性、1894−1912、イリノイ州シカゴ、University of Chicago press、1978
【非特許文献20】Verdaasdonk RM、van Swol CF、医療用レーザー光送達システム、Phys Med Biol、1997年、42、869−894
【非特許文献21】Janda P、Sroka R、Mundweil B他、ファイバー誘導型レーザーシステムの接触使用により誘発させた熱組織効果の比較、Lasers Surg Med、2003年、33、93−101
【非特許文献22】Manni, J、進化したレーザーの歯科応用、マサチューセッツ州バーリントン、JGM Associates,Inc.、2000年
【非特許文献23】Ower他、徐放装置における歯肉縁下に設置された酸化還元剤の慢性歯周炎に対する効果、J Clin Periodontol、1995年、6月号、22(6)、494−500
【非特許文献24】Yilmaz他、ヒトの歯周疾病に対するガリウムヒ素ダイオードレーザーの効果:微生物学的及び臨床学的研究、Lasers Surg Med.、2002年、30(1)、60−6
【非特許文献25】O’Neill J他、光殺菌剤の抗溶連菌活性比較、J Chemother、2003年、8月号、15(4)、329−34
【非特許文献26】Chan他、光力学療法における歯周病原菌に対する異なるレーザー波長の殺菌効果、Lasers Med Sci、2003年、18(1)、51−5
【非特許文献27】Niems MH、レーザー対組織相互作用:基礎と応用、ドイツ、ベルリン、Springer Verlag、2002年
【非特許文献28】Atherton, S.J.とHarriman, A.J.、American Chemical Society、1993年、115、1816−1822
【非特許文献29】Hewitt P、Conceptual Physics 第9版、米国、サンフランシスコ、Addison Wesley、2002年
【非特許文献30】Jass, J.、Surman, S.、Walker, J.、医学的バイオフィルム:検出、予防、及び制御、英国、ウエストサセックス、John Wiley&Sons.LTD.、2003年
【非特許文献31】Listgarten MA、歯垢及び他の口内バイオフィルムの形成、In:Newman HN、Wilson Med、Dental Plaque revisited、Cardif:Bioline、1999年、187−210
【非特許文献32】Listgarten MA、ヒトにおける歯周の健康と病気に関係付けられる微生物叢の構造、光学及び電子顕微鏡的研究、J Periodontal、1976年、47、1−18
【非特許文献33】Listgarten MA、Mayo HE、Tremblay R.、ヒトにおけるエポキシ樹脂歯冠上の歯垢の改善、光学及び電子顕微鏡的研究、J Periodontal、1975年、46、10−26
【発明の開示】
【発明が解決しようとする課題】
【0004】
歯周ポケットの「細菌汚染除去」には、レーザー及びレーザー波長の多様なグループによる多くの技法が提案されているが、文字通り「レーザーを使用した歯周バイオフィルム排除」という1つの目的に重点を置いている文献は数少ない。従って、歯周ポケット内のバイオフィルム排除を実現するために、補助的装置として期待できる安価な近赤外線ダイオードレーザーの固有の熱特性を探究する必要がある。
【0005】
従って、本発明の主な目的は、歯周ポケット内のバイオフィルムを排除する方法と装置を提供することである。
このことは、CW近赤外線ダイオードレーザーにより生み出される「高温先端部」からの白熱光と、光エネルギーを選択的に吸収する標的剤を用いた、生きたバイオフィルム狙い撃ち熱分解法(LBTT)により実現される。
【課題を解決するための手段】
【0006】
本発明は、生きたバイオフィルムを狙い撃ちにし、前記バイオフィルムを熱分解し、除去するための方法と装置に着眼している。本発明の或る実施形態では、熱分解させるバイオフィルムを含んでいる部位に標的剤を導入する。標的剤は、歯周ポケットのバイオフィルムに作用するメチレンブルーの様な、バイオフィルムが選択的に吸収する物質であるのが望ましい。近位端と遠位端の間を伸長している光ファイバーが提供されている。遠位端を、例えば、歯周ポケット内の標的であるバイオフィルム付近の組織に導入する。次いで、光ファイバーの近位端の中に光を導入すると、導入された光がファイバーの遠位端に向けて伝播し、遠位端から出て行く。光は可干渉性であるのが望ましいが、非可干渉性であってもよいし、また、単色又は多色の何れであってもよい。光の輝度は、光がファイバーの遠位端から出る際に、遠位端付近の組織及び/又は流体を、遠位端上で先ず炭化させ、その後、炭化した遠位端を白熱させることができるだけの熱が発生するように制御される。得られた白熱放射は、標的物質の優先吸収スペクトル内の波長であるため、白熱放射の少なくとも幾分かは、標的物質を加熱できる程度まで当該標的物質により吸収されて、この物質を含浸させたバイオフィルムを熱分解させ、とりわけ、バイオフィルムを或る種の半固体凝塊として特徴付けられる凝集物に変えることができる。このバイオフィルムの熱分解に続き、歯周部位用器具を介して凝集物を除去し、その後、例えば、水の様な搬送流体を流して洗浄する。
【0007】
本発明の別の実施形態では、必要なエネルギーを治療域(例えば、MB溶液)に送達するのに、光学療法装置が使用されている。光学療法装置は、その様な光エネルギーをMB溶液に送達するのに必要となる様々な要素を含め、1つ又はそれ以上の構成要素を備えている。一例として、光学療法装置は、可撓性を有する光ファイバーをその遠位端が白熱光の発生と治療に使用できるように固定するハウジングを備えている手持ち式装置である。
【0008】
本発明の別の目的及び利点は、一部は以下の説明に記載しており、また一部は説明から明らかになるか、本発明を実施することにより修得されるであろう。本発明の目的及び利点は、特許請求の範囲に具体的に指摘されている要素及び組み合わせを用いることにより実現され、達成されるであろう。
【0009】
上記概要及び以下の詳細な説明は、共に、説明を目的として一例を示したに過ぎず、特許請求の対象である本発明を制限するものではないことを理解頂きたい。
添付図面は、本明細書に組み込まれ、その一部を構成するものであり、本発明の1つ(幾つかの)実施形態を示しており、説明文と共に本発明の原理を説明する働きをする。
【発明を実施するための最良の形態】
【0010】
本開示の方法及び装置をより深く理解して頂くために、これより、添付図面に関連付けて詳細な説明を参照してゆく。
本発明の1つの態様によれば、LBTTは、歯周ポケット内の生きたバイオフィルムを特定的に熱シンクで狙い撃ちにして、その後で、熱分解して除去し易くするための処置である。バイオフィルムを狙い撃ちにした後、次に、ダイオードレーザーにより作り出された高温先端部からの固有の放射放出は、バイオフィルムの物理特性を液体ゲルから半固体凝塊へと熱的に変化させ、それを歯周領域から機械的に除去できるようにするために、使用、活用される。
【0011】
LBTTは、CW近赤外線ダイオードレーザーを採用しており、FRP Nd:YAGレーザーを使用したレーザー歯肉溝壊死組織除去法、及び各種光感作剤と共に(ソフト)低レベル赤色レーザーを使用した細菌光感作法として知られている方法の何れとも基本的に異なる線量測定パラメータ及び論理を有している。
歯周ポケットのレーザー線量測定管理
線量測定の視点から見てCWダイオードレーザーを使ったLBTTに付随する最も近い治療法は、従来的には自励パルス型Nd:YAGレーザーを使って実施されているレーザー歯肉溝壊死組織除去処置である。1992年に、Myersは、Nd:YAGを使用した場合の歯周ポケット用の具体的な線量測定計算を提案しており、彼の業績により、各歯周ポケットの個々の探針深度に基づくレーザー線量測定表が作成された(非特許文献11)。この一般原則と定量式を使用して、FRP Nd:YAGレーザーを使用した場合のデータが生成され、これにより、FRP Nd:YAGレーザーでの、「歯肉指数、歯肉出血指数、探針深度、付着レベル、及び歯の可動度を含め、臨床学的指数を向上させるための歯周ポケットの病変又は炎症のある軟組織の除去」という特定の言語を使用した「レーザー歯肉溝壊死組織除去法」の最初のFDA市場認可に至った(非特許文献11、12)。
【0012】
GreggとMcArthy(非特許文献13)は、歯周ポケットレーザー線量測定の概念を更に取り入れ、「光線量」計算を利用した歯肉溝壊死組織除去の第1症例報告書を引用して、「治療部位に送達されるレーザーエネルギーの量」を画定した。表1参照。
【0013】
【表1】

【0014】
この新規な(ジュール/mm pd)の測定は、薬物投与量が組織中の薬物の濃度を画定するのと殆ど同じ様に、総光線量が治療部位(歯周ポケット)におけるレーザーエネルギーの濃度を画定することになる点で、(mg/kg体重)で示される薬物投与量の値に似ていることを、2003年にHarrisが述べている(非特許文献11)。Harrisは、「光線量」が、潜在的に異なるレーザーシステムを使用した同様の研究を比較するための均一な尺度を提供するのに有用なパラメータであると結論付けている(非特許文献11)。極最近では、Harris、Gregg、McCarthy他(非特許文献14)が、近年FDAにより認可されたレーザー支援型の新しい付着処置(LANAP)の遡及的分析を公表しており、ここでは、歯周ポケット当たりの送達される総光線量は10〜15J/mm pdとされている。LANAPは、Yukna他(非特許文献15)により報告されている処置でもあり、この報告では、長い連接上皮を欠く場合のレーザー処置を使った歯周靭帯の再付着及び再生の組織学的証拠が初めて提供された。LANAPの公表されている主要目的は、歯周ポケット上皮とその下層の歯周ポケット内の感染した組織を完全に取り除き、根面に付着している石化した歯垢と歯石を取り除く、壊死組織除去である(表2)(非特許文献14)。最後に、Harrisは、(他の研究を再検討した結果)パルス型FRP Nd:YAGを使用した場合での、根面を傷つける恐れがある光エネルギーの「有害量」は、20〜60J/mm pdの範囲内であると推定し、各固有のレーザー療法にとって適切な異なる線量測定を開発する必要があることを予測した。
【0015】
【表2】

【0016】
FRP Nd:YAG及びCWダイオードレーザーのパルス発振性能
FRP Nd:YAGレーザーは、歯周ポケットの歯肉溝上皮を安全且つ迅速にアブレーションするための非常に高いピークパワー(1000〜2000ワット/パルス)を可能にする百万分の1秒(10−6秒)単位のパルス持続時間が可能である(非特許文献14)。このレーザー対組織の相互反応を活用することで、FRP Nd:YAGレーザーを歯肉溝壊死組織除去に使用する臨床医は、歯周ポケットの歯肉溝上皮に対して非常に短い時間間隔でレーザーエネルギーの強力なバーストを浴びせる能力を有することになる。この能力のおかげで、(10−6秒)という相互反応の光生物学が、レーザー対組織の相互反応のアブレーション前線をレーザー対組織相互反応の熱前線の前方に維持することから、上皮組織の速くて正確なアブレーションが起こる。歯周ポケットに挿入されたCW又はゲート型ダイオードレーザーは、FRP Nd:YAGの高いピークパワー又はマイクロ秒パルスを有していない。CWダイオードレーザーは、ミリ秒単位(10−3、又は千分の1秒)の遙かに長いパルス持続時間と、遙かに低いピークパワーを有しており、これは軟組織のアブレーション閾値に達しない(非特許文献16、17)。そこで、CWダイオードレーザーでは、出力パワーがかなりの範囲まで「高温先端部」として知られているものによる熱と放射エネルギーに転換されることから、閉鎖型(歯周ポケット)処置には基本的に異なる論理と線量測定方式が必要となる(非特許文献16、17)。
【0017】
【表3】

【0018】
CWダイオードの物理的パルス限界を科学的既成事実として捉えた上で、CWダイオードレーザーを使用した場合の歯周ポケットの「光線量」計算の論理は、近年公表されたFRP Nd:YAGを使用したLANAP方式に実質的に修正を加えたものにせねばならない。ダイオードとFRP Nd:YAGの間の固有の物理的及び光生物学的差異(即ち、ダイオードの「高温先端部」接触蒸散対FRP Nd:YAGアブレーション)は、ダイオードについては、白熱先端部における実質的な熱生成により許容誤差範囲がかなり狭まることが考慮されるため(非特許文献17)、この重大な区別を臨床医が理解していることが肝要である。それぞれ固有のレーザー療法毎に「光線量」の定量値が必要となるというHarrisの提案(非特許文献11)に従って、本発明の1つの態様は、閉鎖型歯周ポケットの処置におけるCWダイオードレーザーに合わせて明示的に仕立てられた、異なる線量測定値と論理の実施例を伴うパラメータの新しいセットの画定を含んでいる。それらパラメータは、ダイオードレーザー歯周ポケットパラメータ(DLPP)と呼ばれ、過剰な熱、パワー、及び/又は治療時間による、隣接する組織のやけど及び損傷に対する安全対策を同時に講じながら、歯周ポケット内で白熱先端部を生成するダイオードレーザー固有の現象を活用している。
CWダイオードレーザーを使用した場合の「高温先端部」の発生
量子放射及び光生物学の物理的変化は、ダイオードレーザーファイバー(500mWを上回るエネルギーを送給中)が組織と接触しファイバーの先端が炭化した際に瞬間的に起こるものであるが、この変化は詳しく説明されている(非特許文献17)。ダイオードレーザーファイバー先端部の炭化と同時に、熱誘導白熱の形態でファイバーから発せられる量子放出に瞬時的且つ顕著な変化が見られることが説明されている。
【0019】
熱力学の第1法則は、エネルギーは作り出されることも破壊されることもなく、単に形態が変化するだけであると述べている。この法則を歯周ポケット内のCWダイオードレーザーに当てはめた事例を考えると、レーザービームの電磁エネルギーは、炭化した先端部に吸収されるが、その際、先端部の分子を振動させ、熱エネルギーに変換される、ということである。先端部が瞬時に高温(726℃より高温)になるので、この熱は白熱形態の電磁エネルギーに再変換され、そこで、先端部は可視の赤外線光を放出し、このとき「赤色高温」となる(非特許文献18、19)。これにより得られた「高温先端部」(白熱部)の二次量子放出は、ダイオードレーザーの一次赤外線光子で観測されるものとは基本的に異なる熱伝達及び光生物学的事象を歯周ポケット及び組織に発生させる(非特許文献17)。それら変化の光生物学は、熱力学の第2法則により部分的には説明することができる。
【0020】
熱力学の第2法則は、レーザーの一次エネルギーが或る形態から別の形態に変換されるとき、エネルギーの幾分かはそれ以上の使用に利用できなくなると述べている。このことは、レーザーエネルギーの幾分かが破壊されるという意味ではなく、伝達時のエネルギーの一部は、一次的光子エネルギーと同じ仕事に使用することのできない拡散形態(本例では熱)の「廃エネルギー」となるのである。レーザーの一次光子は、炭化していないファイバーから直接放出されるので、十分にコリメートされ、集束され、均一になっていることから、この高温先端部からの「熱」又は「廃エネルギー」は、レーザーからの一次光子よりも低品質であると言える(非特許文献19、21)。ダイオード高温先端部が熱で光を放ち始めると(図1)、まず赤色光を、次いで橙色の可視光を放出する。このことは、先端部が(900Cから1200C)に達する際の黒体の軌跡を重ねたC.I.E.色度マップ(図2)により証明される(非特許文献19)。このエネルギー変換現象の別の表れ方は、従来のブンゼンバーナーの中で約1000℃に熱した「赤色高温」細菌運搬ループで観察することができる(図3)。
【0021】
高温先端部と化し劣化した光ファイバーでは、レーザーからの一次光子の順方向ビーム品質及び放出は(エネルギー、集束性、均一性の点から評価すると)実質的に低下し、高品質エネルギーのより深い場所の組織への効率的な送達を適切に継続することができない(非特許文献18)。「高温先端部」及びCWダイオードに伴うそれら量子変化は本当であり、歯科開業医に、このことが習慣的に理解されている、或いは考慮されているわけではないが、この量子変化はVerdaasdonkとSwol、並びにJanda他によりこれまでにも詳しく説明されてきた(非特許文献20、21)。従って、Harrisが説明している閉鎖型歯周ポケットFRP Nd:YAG処置の「光線量」計算は、ダイオードレーザーの異なる物理学、先端部の放出、及び光生物学の現実を反映していない。
35
FRP Nd:YAGとCWダイオードレーザーの間のエネルギー伝達差
歯周ポケットにFRP Nd:YAGを使用した場合のアブレーションのレーザー対組織相互反応についての従来のパワー密度方程式は、画定されたビーム径を有する照射領域での一次FRP Nd:YAGレーザー光子の潜在的熱効果を測定している。
【0022】
【数1】

【0023】
しかしながら、CWダイオードレーザーを使用した場合、出力パワーの順方向放出の内かなりの量が炭化したファイバー先端部で局所的な放射熱に変換され、これが光ファイバーに大きな損傷を与えるため、画定されたビーム領域を削除してしまう。この(先端部からの)熱は、次いで、接触熱伝導のメカニズムにより近接する歯周組織に伝達される(非特許文献17、18、19、20、21、22)。熱伝導は、組織アブレーションを実現するためにファイバーから適切な「ピーク」順方向パワー伝達を作り出すことができるFRP Nd:YAGで観察されるものとは基本的に異なる、組織に対するエネルギー伝達のメカニズムと方式である。アブレーションは、Nd:YAGが非常に大きい(ピークパワー)エネルギーを、送達先端部直下の小さい組織体積の中に百万分の一秒単位で注入したときに起こる。この急速且つ封じ込められたエネルギー伝達は、アブレーションという生体力学的な仕事を生み出す(非特許文献22)。従って、FRP Nd:YAGの物理学は、レーザーパルスの大部分を先端部下方の組織の中に直接伝達できるようにし、そこで、レーザーエネルギーは、高温先端部及びCWダイオードレーザーからの熱伝導を介した、接触蒸発で見られるよりも更にエネルギー効率が高いやり方で、組織を迅速に切除する。更に、FRPレーザーの高ピークパワーパルスは、アブレーション、及び除去しなければ順方向レーザー放出を阻止しファイバー内に不要な熱を貯め込む恐れのあるNd:YAGファイバー先端部に引っかかった壊死組織片や残骸の除去、を支援する可能性が高い(非特許文献22)。反対に、CWダイオードでは、レーザーの出力パワーの多くが熱に変換されるので、実際に、先端の近傍360度に多量の白熱放射熱エネルギーを発生させる。これは一部には、異なるレーザーでは、かなり変わったレーザー対組織相互作用(熱接触蒸発対アブレーション)の見られることが理由である(非特許文献17、22)。
治療時間−歯周ポケットにCWダイオードレーザーを使用した場合に不可欠なパラメータ
CWダイオードレーザーを使用したときに、白熱先端部からの放射熱を考慮すると、FRP Nd:YAGを使用した閉鎖型歯周ポケット処置に関する従来の線量測定の方程式と論理は変えなければならず、望ましくない組織損傷を防ぐために、臨床学的に治療時間の点から考察せねばならない。例えば、表2には、FRP Nd:YAGレーザーを使用して、歯周ポケット内で、時間とは無関係に、上皮層壊死組織片がファイバー先端に堆積しなくなるまで、レーザー溝走査(LANAPによる)を継続すべきであると示されている。この歯肉溝壊死組織除去処置は、アブレーションを起こすことができる平均出力パワー4ワット、パルス幅150usで安全に達成される。しかしながら、CWダイオードレーザーの白熱先端部を使用した場合、臨床医は、4ワットの出力パワーでは1乃至2秒間しかCWシステムを安全に使用することができず、それを超えると、近接する歯周組織が取り返しのつかない傷又は火傷を負うことになる。従って、FRP Nd:YAGに関するこのレーザー溝走査論理及び線量測定は、CWダイオードでは使用できないし、実施すべきではない、というのも、出力パワー4ワットでは、多量のエネルギーがファイバー先端部で局所熱に変換されてしまうからである。FRP Nd:YAG及びCWダイオードレーザーでのレーザー線量測定に必要な基本的なレーザー算術計算を以下に示し表4で説明する。
【0024】
【表4】

【0025】
CWダイオードレーザーからの過剰な出力パワーが直接(熱へ)エネルギー変換されることで、ファイバー先端部から更に多くの熱が伝導によって近接する歯周組織に伝達されるのは有害である。上記(表4)より、CWダイオードレーザーを使用した閉鎖型(歯周ポケット)処置に対する臨床学的考察過程を変え、治療時間(表4の数式4a参照)の値をそれらに応用することにより、歯周ポケットに適用される、時間に基づく線量測定パラメータを使用した、新しい「光線量」論理を作り出せることが分かるはずである。また、それらレーザーを使用した場合の白熱先端部の強力な熱により、安全を確保するための追加的な臨床上の修正には、更に、所与の閉鎖型歯周ポケット処置に対する総エネルギー値を下げることが伴うことになる。歯周ポケット内のCWダイオードレーザーシステムでは、(先に説明したように)白熱高温先端部という損なわれた光学器に伴い「ビーム面積」に相当する実際の値が存在しないことから、これら特別な修正が必要である。画定されたビーム面積がない状況では、従来なら損なわれていないファイバー先端部直下の治療部位に送達される一次レーザー光子により画定されていた有効光線量を求めるために機能する実際的なパワー密度又はエネルギー密度の式は存在し得ない。
【0026】
歯周ポケットにCWダイオードレーザーを使用した安全な処置を行うために、総エネルギーの値を変更することは、レーザー出力パワー(表4の式2参照)を、LANAPの様な歯肉溝壊死組織除去処置用の公表されているNd:YAGパラメータの約1/3に下げるだけで簡単に達成される(非特許文献14)。CWダイオードレーザーについての上記変更は、各固有のレーザー療法に適合する新しい定量的線量測定を開発するためのHarrisの要件を満たすはずであり(非特許文献11)、ダイオードレーザー歯周パラメータ(DLPP)と呼ぶことにする。この新しいCWダイオードパラメータの論理は、表4の従来の総エネルギーの式を、治療時間の値を反映するように構築し直すだけで簡単に描き出すことができる。
【0027】
【数2】

【0028】
DLPPのこの論理を使用すると、臨床医は、CWダイオードレーザーを使用した場合の最大安全と成功を確保するために、閉鎖型歯周処置におけるレーザー出力パワー及び/又は治療時間の両方を簡単に操作することができる。従って、DLPPでは、FRP Nd:YAG(平均4ワット)を使用した場合の閉鎖型歯周溝内処置にとって安全で効果的な出力パワーは、CWダイオードで安全に使用できるもの(1〜12ワット)よりも、約3倍(3x)大きい出力パワーとなることが分かるであろう。更に、FRP Nd:YAGを使用した歯肉溝内処置は、時間に関係なく(即ち、上皮層壊死組織片がファイバー先端に堆積しなくなるまで)行われるが、CWダイオード処置は、近接する歯周組織への望ましくない熱による損傷を避けるために、先端部を迅速に動かして、約20秒乃至25秒で完了させねばならない。
ピークパワー−接触蒸発対アブレーションを規制するパラメータ
CWダイオードレーザーに伴う新しい線量測定パラメータの案内役としてのDLPPの必要性を更に定量化するために、Nd:YAGとCWダイオードを使用した場合のピークパワーの値、及びピークパワーが生体力学的仕事を遂行する能力を、表5及び表6に算定数値と共に載せている。
【0029】
【表5】

【0030】
ここ(表5)では、歯肉溝壊死組織除去に、平均パワー3.9W、25HzのFRP Nd:YAGをパルス持続時間150μsで30秒間用いた場合について、総エネルギー14.6Jmm pdは、LANAPの様な安全で効果的な歯肉溝壊死組織除去処置のためのHarrisとGreggによる治療パラメータの範囲内に十分入ることが分かる(非特許文献14)。これらパラメータでは、パルス当たりのピークパワー−又は、「アブレーションという生体力学的仕事に利用可能なパワー」は、FRP Nd:YAGレーザーについては1040W/パルスである。しかしながら、CWダイオードレーザーについて、この装置を使用した場合に歯周ポケットでは前記3.9Wという平均パワーが、エネルギー生産及びその生体力学的仕事を行う能力の観点から、どんな意味を持つかを理解するために、計算を行うと、レーザー同士の間で能力(レーザー対組織相互作用)に有意な差のあることが明らかになる。
【0031】
【表6】

【0032】
従って、本例より明らかなように、CWダイオードレーザーは、1秒間にNd:YAG(3.9ジュール/秒)と同じエネルギーを歯周ポケットに送達してはいるが、「組織アブレーションパワー」は{3.9W(CW)/1040W/パルス*100=0.375%}又は3分の1パーセントしかない!。この(非常に重要な計算)は、ダイオードが、同じ1秒間間隔で同じエネルギーでFRP Nd:YAGの各パルスが生成する「アブレーションという生体力学的仕事に利用可能なパワー」よりも99.625%少ないパワーしか作り出していないことを意味する。この注目すべき計算は、異なるレーザー性能を生体力学的仕事のアブレーションの概念と結び付けた場合のエネルギーとパワーという2つの基本的な定義の結果として正しい。表7を参照されたい。
【0033】
【表7】

【0034】
表5及び表6の計算より、CWダイオードレーザーが、FRP Nd:YAGと同じ生体力学的仕事(アブレーション)を行う理論的な能力を有していることは、両方のレーザーシステムが30秒間に117ジュールのエネルギーを作り出すことから明白である。しかしながら、調べるべき決定的な因子はパワーの関数であり、なぜなら、FRP Nd:YAGレーザーは、ダイオードに比べ、単位時間当たり遙かに高いパワー(10−6秒単位の遙かに速い速度で、99.625%高いピークパワー)を出すからである。従って、パワーは仕事をする速さと定義されていることから(非特許文献22)、CWダイオードレーザーは、アブレーションを起こせるだけの単位時間当たり順方向放出パワーを作り出さない。更に、CWダイオードレーザーからの利用可能なエネルギーの大部分は、熱の拡散形態として「廃エネルギー」に変換される、という熱力学の第2法則の先の論議を思い出して頂きたい。最後に、このことは絶えず心に留めておいて頂きたいのだが、歯肉溝壊死組織除去パラメータについては、熱への変換により、白熱ファイバーが閉じている歯周ポケット内に(FRP Nd:YAGと同じエネルギーで)安全に留まれる時間は遙かに短い。
【0035】
理解しておくべき最後の重大な問題は、CWダイオードが「パルス型」か「ゲート型」である場合、実際には、より少ない総パワー、ひいてはより少ないエネルギーが歯周ポケットに送達され、治療用に使用できる(FRP Nd:YAGでのような)ピークパワーの増加は無い。このことは、組織アブレーションという生体力学的仕事をするための「理論上の能力」さえも低いと解釈できる。従って、閉じている歯周ポケットで上記各ダイオード装置を使用した場合の最も率直な計算と熱伝達評価は、DLPPを使用した場合のCWモードのレーザー(非特許文献22)により求められる。
【0036】
DLPPという新たな論理に連結したCWダイオードレーザーに対して上で推奨している調整を行ったとしても、閉鎖型歯周処置に幾らかでも時間超過があれば(出力パワーが最大1.2Wの場合でさえ)、白熱部に近接する歯周組織に対する熱に関係する有害な影響を引き起こす恐れがある。これは、ダイオードレーザーの高温先端部にとって優先的に白熱の熱エネルギーを吸収するという「熱シンク」の概念が、より深い場所の歯周組織を損傷から護るためのみならず、CWダイオードを使用して熱分解させるために歯周ポケット内の生きたバイオフィルムを狙い撃ちにするのにも、潜在的に有用性があるという理由からである。
メチレンブルー(MB)を使用して生きたバイオフィルムを狙い撃ちにする
MBは、酸化還元指標、シアン化合物の解毒剤、及び低刺激性消毒薬として従来から医薬として使用されている。歯科では、MBは、歯周ポケット内の個々の細菌の光感作剤として主に使用されており、(ソフト)低レベル可視赤色レーザー(レーザー出力パワー100mW以下)で活性化する。低レベル赤色レーザーを用いたこれらの適用例は、歯周ポケットにおいて、過去10年に生体内での実用的な成功にはほとんど出会っていない(非特許文献6、7、8、9、10)。選択された歯周病原菌の「光感作剤」として一般に採用されている可視ソフト赤色レーザーは、白熱先端部を作り出せるだけの出力パワーを発生させず、この効果に対して文献を再検討したものを表8で評価することにした。
【0037】
【表8】

【0038】
一見すると、赤外線レーザーを、MBで染めた何かと組み合わせた器具として使用するのは、赤外線レーザーの一次スペクトル放出が従来のMB吸収スペクトルよりも長い150nmで始まることから、不適当に見える(非特許文献27)。しかしながら、生きたバイオフィルムの狙い撃ち熱分解法(LBTT)では、MBは、バイオフィルム標的剤であり、且つ歯周ポケット内でファイバーから作り出される二次的な白熱(可視)「高温先端部」放射エネルギーにとっての「熱シンク」である。白熱先端部からの橙色及び赤色の可視放射(600nm〜700nm)は、MBの従来の吸収曲線内で利用できるものである。これは、MBが、可視橙色又は赤色スペクトルの609nm及び668nmに吸収ピークを有しており(非特許文献28)、高温先端部の白熱温度のC.I.E.色度マップ(黒体軌道を重ねたもの)(図2)の面積内にぴったり収まっていることから、容易に達成される。
【0039】
バイオフィルムは、エキソポリサッカリド(EPS)、水、及び微生物を、概ね5%(EPS)、92%(水)、及び3%(微生物)の割合で含んで形成されたマトリクスで構成されている(非特許文献1、30)。EPSの成分は、バイオフィルムの3次元構造を構築している極度に水和したゲル状(粘液性)生体高分子である。バイオフィルム内の細菌を、細菌にとって有害な抗菌剤(抗生物質)及び免疫系による攻撃から保護しているのは、このEPSマトリクスである(非特許文献1、2、30)。Listgarten他は、歯肉縁下の歯垢(バイオフィルム)を有する領域のバイオフィルムと病的な上皮は、MBに対する透過性が高いことを示した(非特許文献31、32、33)。これこそ正にLBTT処置の狙い撃ちのメカニズムである。この論理は、(細菌が生息している)バイオフィルムを、熱分解のための熱シンク(MB)を使用して狙い撃ちにするものである。
【0040】
上記のバイオフィルムを狙い撃ちにするメカニズムが確立されると、次に進み、白熱ファイバー先端部からの光子の強力なエネルギーが、バイオフィルムに浸透しているMB分子に吸収され、その後瞬時にしてMB分子内で振動及び回転エネルギーに変換される、これが熱に関する分子の基本である。この熱は、常に、MB又はMBを染み込ませたものの温度を上昇させる(非特許文献29)。従って、本方法によれば、ダイオード高温先端部からの二次的な白熱エネルギーの吸収によって、MBを染み込ませた生きたバイオフィルム及び病的な歯肉溝上皮に対する極めて大きなエネルギー伝達が生じる。生きたバイオフィルムへの、この新規な的を絞り制御された熱伝達は、次いで、バイオフィルム及び染めた病的上皮から半固体凝塊を形成するので、これにより、従来の根面平滑化及びスケーリング処置で容易に取り除くことができるようになる。
【0041】
バイオフィルムの物理的特性(組成ではない)を、生卵の白身と潜在的に同様のものと考えると、熱分解及び凝固の上記メカニズムと論理は明白になるであろう。陶磁器陶タイルの床(歯根面)から鋼鉄のスプーン(歯周スケーラー)で生卵の白身(バイオフィルム)を取り除こうと試みても、全体がゲル状のバイオフィルムマトリクスをそのままのゲル状の形態で取り除くことは実質的に不可能であろう。しかしながら、生卵の白身を選択的に狙って加熱すれば、白身はその物理的特性が固体凝塊(調理卵)のそれに変化するので、ずっと容易にタイルの床から剥がすことができる。以上が、歯周ポケット内でMB及び/又は他の標的剤を熱シンクとして使用した、生きたバイオフィルム狙い撃ちの論理と設計である。この方法を使用すると、開業医は、DLPPの大要に従って、不安なく、ダイオードレーザーの出力パワーを約1.0W CWまで下げ、ゲル状マトリクスの凝固と熱分解により、生きたバイオフィルムの相変化を達成することができる。これは、歯科患者にとってより安全な処置につながり、歯周ポケット内の、より多くのコラーゲン、骨、及び粘膜を処置中の取り返しのつかない熱による損傷から護り温存することができると同時に、バイオフィルムの除去がやり易くなる。一旦、バイオフィルムが除去されると、歯周ポケットは即座に治癒が見込めるようになる。歯周ポケットの治癒過程において、身体からは、微生物の増殖を助長した独自の生態学的壁凹、即ち歯周ポケットの歯肉縁下8〜10mmの生息場所が無くなる。
【0042】
或る代表的な実施形態では、生きたバイオフィルムを狙い撃ちにする熱分解法は、1%のメチレンブルー溶液を歯周ポケットに導入し、小型ファイバーブラシで送達して、歯周ポケットの3次元領域に到達させ、全体がバイオフィルム標的溶液で覆われるようにすることで始まる(図4−5)。次いで、MB溶液を歯周ポケット内に1分間放置し、その後、歯周ポケットを軽くすすぎ、余分な溶液を当該領域から取り除く。次いで、近赤外線ダイオードレーザーファイバーを、出力パワーを1ワットCWに設定して歯周ポケットに挿入し、レーザーをオンにする。1秒以内に、白熱先端部が(先に説明したメカニズムによって)発生するので、次いで、先端部を歯周ポケットの全領域に亘って素早く動かすと、狙ったバイオフィルムと病的な上皮組織の凝固が始まる(図6−7)。20秒間、歯周ポケット全体に亘ってファイバーを素早く動かした後、ファイバーを取り出し、歯周スケーラーを導入して、バイオフィルム及び組織凝塊を、歯石及び他の壊死組織片と共に、歯周ポケット全域から取り除く(図8)。次いで、歯周ポケットを、細くて可撓性を有する套管及び洗浄シリンジを使って、滅菌された生理食塩水で洗浄し、その後、湿らせたガーゼで2分間組織を歯に強く押し付ける。次に、患者には、椅子に座らせたままでイブプロフェン400mg与え、3日間はLBTTの領域を避け、その後は通常の衛生法を再開するように指示を与えてから退出させる。本症例では、8日後、歯周プローブで歯周ポケットにアクセスすることはできなかったが、これは、歯冠部組織が分岐したためであり、このことは、長い連接上皮になると考えられる歯根面への新たな付着の表れである(図9)。術後5週間後、当該領域へのアクセスを再度試みたが、同様の結果を得た。2mmの健康な歯肉溝を有する新しい付着が見られ、歯周ポケットは消散した(図10)。
【0043】
ここに説明した実施形態、又はここで具体的に開示していない等価物においては、何れも、治療領域(例えば、MB溶液)に必要なエネルギーを送達するのに光学療法装置が使用されている。光学療法装置は、MB溶液にその様な光エネルギーを送達するのに必要とされる各種要素を含む1つ又はそれ以上の構成要素から成っている。一例として、光学療法装置は、可撓性を有する光ファイバーを、ファイバーの遠位部分が治療に使用できるように固定するハウジングを備えている手持ち式装置である。
【0044】
或る代表的な実施形態では、本開示の光学療法装置は、実質的に2つの構成要素、即ち、図11と12に示すように、(1)ハンドルと、(2)発光プローブとを備えている。その様な実施形態では、ハンドルは、例えば、成形プラスチック又は類似物で作られており、エネルギーを受け入れ、光エネルギーを発光プローブの光ファイバーの中へと向けるためのシステムを含んでいる。例えば、ハンドル内には、ハンドルの嵌合部と係合させたときに、光を発光プローブの嵌合部の中に向かわせるために、レンズシステムが含まれている。発光プローブは、使い捨て可能に作られており、ハンドル部分は再使用可能である。プローブは、少なくとも1つの可撓領域を含んでいるか、少なくとも1つの可撓部分の利点を実現できるように1つ又はそれ以上の領域に十分な柔軟性又は可撓性を持たせている。プローブは、プラスチック及び類似物を含め、様々な材料の何れで作ってもよい。その様な可撓性は、プローブ及び光ファイバーを、治療部位の中及び周囲に、容易且つ快適に位置決めできるようにする。光ファイバーは、その遠位端から光エネルギーを送達することに加え、又はそれに代えて、例えば、エネルギー散布に使用されるブラッグ格子型ファイバー(WO第2005/034790号参照)を採用することにより、エネルギーをその側方部分に沿って送達することができるように構成してもよい。その様な構成は、それを使用とする特定の用途に基づいて決められる。
【0045】
提示した処置と論理は、近赤外線CWダイオードレーザーと、熱シンクとして1%MBを使用した、歯周ポケット内の生きたバイオフィルムの狙い撃ちと熱分解に適用することができる代表的な実施形態である。この処置には、閉じている歯周ポケット環境内でのCWダイオードレーザーと白熱先端部現象に伴うより安全な歯肉溝内線量測定のための新たな計算論理が結び付けられている。レーザー歯周関連の文献は、FRP Nd:YAGレーザーとLANAPの様な歯肉溝壊死組織除去処置を扱っているものが圧倒的多数であることから、開業医は、CWダイオードとFRP:YAGレーザーの間の相違を理解することが不可欠である。公表されているLANAP手順と線量測定は、歯周ポケットの閉鎖環境内でCWダイオードレーザーを使用する場合に、準拠できるものではなく、また準拠すべきではなく、というのも、それら2つのシステムの物理学と光生物学は、この中で数学的に提示したように大いに異なっているからである。それら大きな相違は、歯周ポケット内に、全く異なるレーザー対組織反応を引き起こすことになる。LBTTは、熱分解と除去を目的に生きたバイオフィルムを狙い攻撃することにより、白熱先端部のCWダイオードレーザーに付帯する物理的現象を活用する試みである。DLPPは、CWダイオードレーザーを使用した閉鎖型歯周処置にとって、白熱先端部を有効且つより安全にする試みのための線量測定パラメータの新しいセットである。
【0046】
ここに開示した本発明の明細書と実施方法を考察頂ければ、当業者には本発明の他の実施形態も自明であろう。本明細書では、0.5ワット及び1〜1.2ワットのレーザーパワー出力を開示しているが、出願人は、0.5ワット乃至2ワットのパワー出力を使用したレーザーなら、本発明の方法と装置で安全に使用できるものと確信する。本明細書及び実施例は一例に過ぎないものと見なされるべきであり、本発明の真の範囲と精神は、特許請求の範囲により示されるものとする。
【図面の簡単な説明】
【0047】
【図1】歯肉と歯肉に埋め込まれている歯を示しており、歯の1つの傍らの歯周ポケット内でダイオードの高温先端部が光を放っている状態を示している。
【図2】ダイオード高温先端部が、最初に赤色可視光を、そして次に橙色可視光を放射することを、C.I.E.色度マップを図1に重ねることにより証明しているグラフ表示である。
【図3】従来のブンゼバーナー内で約1000℃まで熱せられた「赤色高温」細菌運搬ループに見られる白熱形態電磁エネルギーへの熱変換を表している図である。
【図4】歯の側部の深さ11mmの歯周ポケットを示している。
【図5】ファイバーブラシによる歯周ポケットへのメチレンブルーの塗布を示している。
【図6】歯周ポケット内に光ファイバーの遠位端を挿入し、歯周ポケット内で先端部を白熱させた状態を示している。
【図7】白熱先端部が歯周ポケット全体を通して15秒から20秒間動けるところを示す手段として、歯周ポケット内の白熱先端部の位置の変化を示している。
【図8】バイオフィルムと組織の凝塊を、照射された歯周ポケットからグレーシィスケーラーで除去しているところを示している。
【図9】施術後8日目の白化する歯肉溝組織と推定される新たな付着を示している。
【図10】施術後5週目の歯肉組織の治癒と歯への付着を示している。
【図11】一方の端がレーザー源に接続され、他方の端が発光プローブに接続されているLBTT装置のハンドルの一例を示している。
【図12】ハンドルと係合させる嵌合部(1)と、可撓部分(2)と、中を通して遠位端までレーザーを伝播させ白熱光を発生させる光ファイバー(3)を有する、LBTT装置の発光プローブの一例を示している。
【特許請求の範囲】
【請求項1】
患者の歯周バイオフィルムを除去する方法において、
治療域に、放射エネルギーを選択的に吸収する有効量の標的剤を投与する段階と、
前記治療域に、近赤外線ダイオードレーザー源によって作り出された白熱光を照射する段階と、から成り、
前記光は、前記標的剤により吸収され、これによって微生物を熱分解し、前記治療域から排除する、方法。
【請求項2】
患者の歯周バイオフィルムを除去する方法において、
前記バイオフィルムに有効量の標的剤を投与する段階と、
前記バイオフィルムに、近赤外線ダイオードレーザー源によって作り出された白熱光を照射する段階と、から成り、
前記光は、前記標的剤により選択的に吸収され、これによって前記バイオフィルムを凝塊に熱変質させ、除去し易くする、方法。
【請求項3】
前記バイオフィルムは、歯周ポケット、インプラント周り、又は根管内に存在している、請求項2に記載の方法。
【請求項4】
前記標的剤は1%メチレンブルーである、請求項1に記載の方法。
【請求項5】
前記近赤外線ダイオードレーザーはCWレーザーである、請求項1に記載の方法。
【請求項6】
前記近赤外線ダイオードレーザーはパルス型レーザーである、請求項1に記載の方法。
【請求項7】
前記近赤外線ダイオードレーザーは、0.5〜2ワットの間の出力パワーを有している、請求項1に記載の方法。
【請求項8】
歯周バイオフィルムを排除するための光学療法装置において、
ハンドルと、
光ファイバーが収納されている発光プローブと、を備えており、
前記光ファイバーは、近赤外線ダイオードレーザーエネルギーを送達して、治療域内及び治療域付近で、その先端部に白熱光を発生させる、光学療法装置。
【請求項9】
前記ハンドルは再使用可能である、請求項8に記載の光学療法装置。
【請求項10】
前記プローブは再使用可能である、請求項8に記載の光学療法装置。
【請求項11】
前記プローブは使い捨てである、請求項8に記載の光学療法装置。
【請求項12】
前記プローブは、前記光ファイバー先端部を治療域内及び治療域付近に位置決めできるようにするため、少なくとも1つの可撓部分を含んでいる、請求項8に記載の光学療法装置。
【請求項13】
前記光ファイバーは、その側方部分に沿ってエネルギーを送達することができるように構成されている、請求項8に記載の光学療法装置。
【請求項14】
前記治療域は、歯周ポケット、インプラント周り、又は根管である、請求項8に記載の光学療法装置。
【請求項15】
前記近赤外線ダイオードレーザーはCWレーザーである、請求項8に記載の光学療法装置。
【請求項16】
前記近赤外線ダイオードレーザーはパルス型レーザーである、請求項8に記載の光学治療装置。
【請求項17】
前記近赤外線ダイオードレーザーは、0.5〜2ワットの間の出力パワーを有している、請求項8に記載の光学療法装置。
【請求項18】
歯周バイオフィルムを排除するためのキットにおいて、
(a)光学治療装置と、(b)治療域に投与される標的剤と、を備えており、
前記(a)光学治療装置は、
近赤外線レーザーを発生させるための手段を含んでいる光源と、
ハンドルと、光ファイバーが収納されている発光プローブとを含んでいるレーザー送達装置であって、前記光ファイバーは前記治療域に白熱光を発生させるために使用されており、前記ファイバーは、
前記光源に取り付けられている近位先端部と、
前記ファイバーの前記近位先端部とは反対側の端の遠位先端部であって、前記遠位先端部は前記治療域内及び治療域付近に配置され、前記レーザーは前記遠位先端部で白熱光に変換される、遠位先端部と、
前記光源を前記光ファイバーに連結するための手段と、を含んでいる、レーザー送達装置と、を含んでおり、
前記(b)標的剤は、前記光源により作り出された光エネルギーを選択的に吸収し、これにより熱分解を起こさせる、キット。
【請求項1】
患者の歯周バイオフィルムを除去する方法において、
治療域に、放射エネルギーを選択的に吸収する有効量の標的剤を投与する段階と、
前記治療域に、近赤外線ダイオードレーザー源によって作り出された白熱光を照射する段階と、から成り、
前記光は、前記標的剤により吸収され、これによって微生物を熱分解し、前記治療域から排除する、方法。
【請求項2】
患者の歯周バイオフィルムを除去する方法において、
前記バイオフィルムに有効量の標的剤を投与する段階と、
前記バイオフィルムに、近赤外線ダイオードレーザー源によって作り出された白熱光を照射する段階と、から成り、
前記光は、前記標的剤により選択的に吸収され、これによって前記バイオフィルムを凝塊に熱変質させ、除去し易くする、方法。
【請求項3】
前記バイオフィルムは、歯周ポケット、インプラント周り、又は根管内に存在している、請求項2に記載の方法。
【請求項4】
前記標的剤は1%メチレンブルーである、請求項1に記載の方法。
【請求項5】
前記近赤外線ダイオードレーザーはCWレーザーである、請求項1に記載の方法。
【請求項6】
前記近赤外線ダイオードレーザーはパルス型レーザーである、請求項1に記載の方法。
【請求項7】
前記近赤外線ダイオードレーザーは、0.5〜2ワットの間の出力パワーを有している、請求項1に記載の方法。
【請求項8】
歯周バイオフィルムを排除するための光学療法装置において、
ハンドルと、
光ファイバーが収納されている発光プローブと、を備えており、
前記光ファイバーは、近赤外線ダイオードレーザーエネルギーを送達して、治療域内及び治療域付近で、その先端部に白熱光を発生させる、光学療法装置。
【請求項9】
前記ハンドルは再使用可能である、請求項8に記載の光学療法装置。
【請求項10】
前記プローブは再使用可能である、請求項8に記載の光学療法装置。
【請求項11】
前記プローブは使い捨てである、請求項8に記載の光学療法装置。
【請求項12】
前記プローブは、前記光ファイバー先端部を治療域内及び治療域付近に位置決めできるようにするため、少なくとも1つの可撓部分を含んでいる、請求項8に記載の光学療法装置。
【請求項13】
前記光ファイバーは、その側方部分に沿ってエネルギーを送達することができるように構成されている、請求項8に記載の光学療法装置。
【請求項14】
前記治療域は、歯周ポケット、インプラント周り、又は根管である、請求項8に記載の光学療法装置。
【請求項15】
前記近赤外線ダイオードレーザーはCWレーザーである、請求項8に記載の光学療法装置。
【請求項16】
前記近赤外線ダイオードレーザーはパルス型レーザーである、請求項8に記載の光学治療装置。
【請求項17】
前記近赤外線ダイオードレーザーは、0.5〜2ワットの間の出力パワーを有している、請求項8に記載の光学療法装置。
【請求項18】
歯周バイオフィルムを排除するためのキットにおいて、
(a)光学治療装置と、(b)治療域に投与される標的剤と、を備えており、
前記(a)光学治療装置は、
近赤外線レーザーを発生させるための手段を含んでいる光源と、
ハンドルと、光ファイバーが収納されている発光プローブとを含んでいるレーザー送達装置であって、前記光ファイバーは前記治療域に白熱光を発生させるために使用されており、前記ファイバーは、
前記光源に取り付けられている近位先端部と、
前記ファイバーの前記近位先端部とは反対側の端の遠位先端部であって、前記遠位先端部は前記治療域内及び治療域付近に配置され、前記レーザーは前記遠位先端部で白熱光に変換される、遠位先端部と、
前記光源を前記光ファイバーに連結するための手段と、を含んでいる、レーザー送達装置と、を含んでおり、
前記(b)標的剤は、前記光源により作り出された光エネルギーを選択的に吸収し、これにより熱分解を起こさせる、キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図10】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図11】


【図12】


【図10】


【公表番号】特表2009−518064(P2009−518064A)
【公表日】平成21年5月7日(2009.5.7)
【国際特許分類】
【出願番号】特願2008−543453(P2008−543453)
【出願日】平成18年11月30日(2006.11.30)
【国際出願番号】PCT/US2006/045832
【国際公開番号】WO2007/064787
【国際公開日】平成19年6月7日(2007.6.7)
【出願人】(507184579)ノミール・メディカル・テクノロジーズ・インコーポレーテッド (6)
【Fターム(参考)】
【公表日】平成21年5月7日(2009.5.7)
【国際特許分類】
【出願日】平成18年11月30日(2006.11.30)
【国際出願番号】PCT/US2006/045832
【国際公開番号】WO2007/064787
【国際公開日】平成19年6月7日(2007.6.7)
【出願人】(507184579)ノミール・メディカル・テクノロジーズ・インコーポレーテッド (6)
【Fターム(参考)】
[ Back to top ]

