光導波型バイオケミカルセンサチップ、光導波型バイオセンサ及び物質測定用キット
【課題】測定対象物質の検出感度を向上させることが可能な光導波型バイオケミカルセンサチップを提供する。
【解決手段】本実施形態の光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、を備える。
【解決手段】本実施形態の光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、を備える。
【発明の詳細な説明】
【技術分野】
【0001】
本発明の実施形態は、光導波型バイオケミカルセンサチップ、光導波型バイオセンサ及び物質測定用キットに関する。
【背景技術】
【0002】
従来の抗原抗体反応を利用した免疫測定は、通常、測定対象とする検体中の測定対象物質(例えば、タンパク質等)に対応する一次抗体をウエル状の基材表面に固定化する。ウエル内に各々所定量の検体溶液、二次抗体液、発色試薬を順次滴下する。各溶液の滴下毎に、所定の洗浄液により洗浄を行う。このような免疫測定は、各溶液及び洗浄液を測定者が秤量しつつ加え、かつ排出するという複雑な手順で行われる。更に、100μLの規模の溶液を用いることから、各反応に数十分から数時間という時間を要するのが一般的である。
【0003】
そこで、酵素反応により発色した際に沈殿する酵素反応産物を生成する発色試薬を用い、沈殿したその酵素反応産物に起因する光の物理量の変化を光導波路のエバネッセント波で測定することで、検体溶液の容量が不正確でも測定が可能な方法が提案されている。
【0004】
これらの方法においては,発色反応を触媒する酵素で標識された抗体等を用い、通常、1つの抗体に標識される酵素(発色触媒酵素)は1つである。つまり、一対の抗原抗体反応により、発色触媒酵素1つ分の発色が生じる。従って、発色量(すなわち、測定対象物質を検出する感度)は抗体の数に規定され、より高感度化を図ることは難しい。
【0005】
一方、微粒子を光導波型バイオケミカルセンサチップの光導波路上に分散させることで、微粒子が光を吸収及び散乱し、余剰の検体溶液や二次抗体を洗浄する手順を含まずに測定対象物質を定量することが可能な技術が提案されている。この技術においては、微粒子が光導波路表面に一層分最密配列された場合に、測定対象物質を検出する感度が最大になると考えられる。
【0006】
いずれの方式においても、より高感度な検出が必要とされる検査項目を想定すると、測定対象物質の検出感度を向上させる技術の開発が望まれていた。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4231051号公報
【特許文献2】特開2009-133842号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明が解決しようとする課題は、測定対象物質の検出感度を向上させることが可能な光導波型バイオケミカルセンサチップ、光導波型バイオセンサ及び物質測定用キットを提供することである。
【課題を解決するための手段】
【0009】
本実施形態の光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、を備える。
【図面の簡単な説明】
【0010】
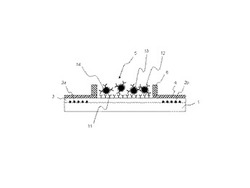
【図1】第1の実施形態に係る光導波路型バイオケミカルセンサチップの断面図
【図2】同実施形態に係る微粒子の形態を示す模式図
【図3】同実施形態に係る微粒子の別の形態を示す模式図
【図4】同実施形態に係る光導波路型バイオセンサの模式図
【図5】同実施形態に係る被測定検体中の測定対象物質を測定する工程を示す図
【図6】同実施形態に係る検出信号強度の経時変化の例を示す図
【図7】第2の実施形態に係る物質測定用キットの断面図
【図8】第3の実施形態に係る物質測定用キットの断面図
【図9】第4の実施形態に係る測定方法の手順を説明する図
【発明を実施するための形態】
【0011】
以下、本発明の実施形態を図面を参照しながら説明する。
【0012】
(第1の実施形態)
図1は、第1の実施形態に係る光導波路型バイオケミカルセンサチップの断面図である。
【0013】
第1実施形態に係る光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質11が表面に固定化された光導波路3と、前記測定対象物質と特異的に反応する第2物質12及び発色反応を触媒する酵素14が固定化された微粒子13と、を備える。
【0014】
ここで測定対象物質は、例えば血液、血清、血漿、生体試料、食品等の中に含まれる蛋白質、ペプチド、遺伝子等が挙げられる。具体的には、インスリン、カゼイン、β−ラクトグロブリン、オボアルブミン、カルシトニン、C−ペプチド、レプチン、β−2−ミクログロブリン、レチノール結合タンパク、α−1−ミクログロブリン、α−フェトプロテイン、癌胎児性抗原、トロポニン−I、クルカゴン様ペプチド、インスリン様ペプチド、腫瘍増殖因子、繊維芽細胞増殖因子、血小板成長因子、上皮増殖因子、コルチゾール、トリヨードサイロニン、サイロキシン等のハプテンホルモン、ジゴキシン、テオフィリン等の薬物、細菌、ウイルス等の感染性物質、肝炎抗体、IgEの他、そばの主要タンパク質複合体、落花生のArah2を含む可溶性タンパク質等が挙げられるが、これらに限定されるものではない。
【0015】
光導波路3は、例えば平面光導波路を用いることができる。この光導波路3は、例えばフェノール樹脂、エポキシ樹脂のような熱硬化性樹脂または無アルカリガラスから形成することができる。詳細には、ここで用いる材料とは、所定の光の透過性を有する材料であって、特に、ポリスチレンを主たる構造とするエポキシ樹脂等であることが好ましい。光導波路3への被測定検体中の測定対象物質と特異的に反応する第1物質11の固定化は、例えば光導波路3の表面との疎水性相互作用や化学結合により固定化する。
【0016】
第1物質11は、例えば被測定検体の測定対象物質が抗原の場合、抗体(一次抗体)を用いることができる。
【0017】
微粒子13は、光導波路3上に分散している。ここで「光導波路上に微粒子が分散する」とは、微粒子13が光導波路3の上方(基板1に接する面と反対側の面)に直接的または間接的に分散されることを意味する。「微粒子が光導波路上方に間接的に分散する」形態は、例えば微粒子13が光導波路3の表面にブロッキング層を介して分散される形態が挙げられる。ブロッキング層は、例えばポリビニルアルコール、ウシ血清アルブミン(BSA)、ポリエチレングリコール、リン脂質ポリマー、ゼラチン、カゼイン,糖類(例えばスクロース、トレハロース)のような水溶性物質を含む。ブロッキング層は、さらにプロテアーゼインヒビターを含んでも良い。あるいは、図1では微粒子13が光導波路に近接して配置されている例を示しているが、別の例として、微粒子13が光導波路3の上方に空間を空けて配置される形態が挙げられる。例えば、光導波路3に対向して支持板(図示せず)が配置され、その支持板の光導波路3と対向する面に、微粒子13が分散していてもよい。
【0018】
微粒子13は、金属、金属酸化物、金属と金属酸化物の複合体のうちいずれかのコロイド、又は球状樹脂である。例えば、微粒子13として、ポリスチレン製のラテックスビーズ(商品名)のような樹脂ビーズもしくは金コロイドのような金属コロイド、または酸化チタン粒子のような無機酸化物粒子を用いることができる。微粒子13は、アルブミンのようなタンパク質、アガロースのような多糖類、シリカ粒子、カーボン粒子のような非金属粒子も用いることができる。特に、ラテックスビーズ、金属コロイドが好ましい。ラテックスビーズの中で、後述する光導波路を伝播させる光が赤色レーザの場合、青色ラテックスビーズが好ましい。微粒子13は、50nm〜10μmの径を有することが好ましい。
【0019】
図2は、微粒子13の形態を示す模式図である。微粒子13の表面には、第2物質12と酵素14とが固定化される。第2物質12は、例えば被測定検体の測定対象物質が抗原の場合、抗体(二次抗体)を用いることができる。酵素14は、発色反応を触媒する発色触媒酵素である。例えば、酵素14としてペルオキシダーゼが用いられる。本実施形態では、1つの微粒子13に対して、複数の酵素14を固定化することができる。
【0020】
図3は、微粒子13の別の形態を示す模式図である。図3に示すように、微粒子13の表面に、酵素14によって酵素標識された第2物質を固定化してもよい。発色酵素によって酵素標識された第2物質とは、例えば、ペルオキシダーゼ標識二次抗体である。
【0021】
次に、第1の実施形態に係る光導波路型バイオケミカルセンサチップを図1を参照して具体的に説明する。
【0022】
基板1の主面の両端部には、入射側グレーティング2aおよび出射側グレーティング2bが設けられている。基板1は例えば、無アルカリガラスである。グレーティング2a,2bは、基板よりも高い屈折率を有する材料で形成される。例えば、グレーティング2a,2bは、酸化チタン(TiO2)、酸化錫(SnO2)、酸化亜鉛、ニオブ酸リチウム、ガリウム砒素(GaAs)、インジウム錫酸化物(ITO)、ポリイミド等から形成される。例えば熱硬化性樹脂からなる平面光導波路3は、グレーティング2a,2bを含む基板1主面に形成されている。低屈折率樹脂膜4は、平面光導波路3上に被覆されている。低屈折率樹脂は、例えば、市販されている旭硝子株式会社製のサイトップ(登録商標)のポリ(パーフルオロブテニルビニルエーテル)等を用いることができる。低屈折率樹脂膜4には、グレーティング2a,2b間に位置する平面光導波路3の一部が露出するよう開口して例えば矩形状のセンシングエリア5を形成している。枠状のセル壁6は、平面光導波路3を露出させるセンシングエリア5を囲むように低屈折率樹脂膜4上に形成されている。
【0023】
被測定検体の測定対象物質と特異的に反応する第1物質11は、センシングエリア5から露出する平面光導波路3表面に、例えばシランカップリング剤による疎水化処理により固定化されている。被測定検体の測定対象物質と特異的に反応する第2物質12は、微粒子13に、例えば物理吸着、あるいはカルボキシル基やアミノ基等を介した化学結合により固定化されている。さらに、発色反応を触媒する酵素14が、微粒子13に固定化されている。第2物質12および酵素14が固定化された微粒子13は、前記物質11が固定化された平面光導波路3表面に分散されている。この微粒子13の分散は、例えば微粒子13および水溶性物質を含むスラリを平面光導波路3に塗布、凍結乾燥することにより形成される。あるいは、微粒子13は液体に溶解させて光導波路3上に塗布あるいは滴下してもよいし、固体として光導波路3上に分散させてもよい。
【0024】
図4は、第1の実施形態に係る光導波路型バイオセンサの模式図である。第1の実施形態に係る光導波路型バイオセンサは、前述した光導波路型バイオケミカルセンサチップの入射側グレーティング2aから光導波路3に光を入射させるための光源(例えば赤色レーザダイオード)21と、出射側グレーティング2bから出射される光を受光する受光素子(例えばフォトダイオード)22をさらに備える。光源21から前述の光導波路型バイオケミカルセンサチップに光を照射し、入射側グレーティング2aにより光が回折される。入射側グレーティング2aから入射された光は、光導波路3内を伝播し、出射側グレーティング2bにより回折されて出射される。出射された光は受光素子22により受光され、光の強度が測定される。入射した光と出射された光との強度を比較し、光の吸収率を測定することで、被測定物の濃度が測定される。
【0025】
次に、前述した光導波路型バイオセンサを用いて測定対象物質を測定する測定方法を図5の(a)〜(c)を参照して説明する。
【0026】
まず、図4に示す光導波路型バイオセンサを用意する。次いで、図5(a)に示すように、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、被測定検体溶液と、第2物質(二次抗体)12および酵素14が固定化された微粒子13の分散液との混合液を導入する。導入の方法は、例えば滴下や流入が考えられる。導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する測定対象物質(抗原)が存在すると、図5(a)に示すように抗原15は光導波路3表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合し、さらに微粒子13の第2物質(二次抗体)12は抗原と抗原抗体反応を生じて結合する。つまり、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で抗原を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に対して固定化される。
【0027】
さらに、図5(b)に示すように、余剰の検体液及び微粒子13を洗浄除去した後、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、発色試薬を導入する。導入の方法は、例えば滴下や流入が考えられる。被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する測定対象物質(抗原)が存在する場合、発色試薬の導入により酵素14が発色を触媒し、色素が発色する。ところで上述のように、1つの測定対象物質(抗原)は1つの第1物質(一次抗体)11と抗原抗体反応を生じて結合し、さらに微粒子13のいずれか1つの第2物質(二次抗体)12は1つの測定対象物質(抗原)と抗原抗体反応を生じて結合する。本実施形態では、微粒子13には複数の酵素が固定化されているため、1対の抗原抗体反応に対して、複数の酵素が発色反応を触媒し、複数の酵素分の発色反応が生じる。
【0028】
この状態で、赤色レーザダイオード21から赤色レーザ光を入射側グレーティング2aから平面光導波路3に入射させ、その光導波路3を伝播させて表面(センシングエリア5での露出表面)付近にエバネッセント光を発生させる。すると、微粒子13が光導波路3表面に対して固定化されているため、微粒子13がエバネッセント光領域に存在することになる。すなわち、微粒子13がエバネッセント光の吸収や散乱に関与するため、エバネッセント光の強度が減衰する。さらに、酵素と発色試薬により色素が発色しているので、エバネッセント光が色素により吸光される。その結果、出射側グレーティング2bから出射される赤色レーザ光をフォトダイオード22で受光すると、出射されるレーザ光強度は、固定化された微粒子13及び発色色素の影響によって時間の経過に伴って低下する。
【0029】
フォトダイオード22で受光したレーザ光強度の低下率は、光導波路3表面に対して固定化される微粒子13の量、および、発色する色素濃度に依存する。つまり、抗原抗体反応に関与する被測定検体溶液中の抗原濃度に比例する。したがって、抗原濃度が既知の被測定検体溶液において時間の経過に伴うレーザ光強度の低下曲線を作成し、この曲線の所定の時間でのレーザ光強度の低下率を求め、抗原濃度とレーザ光強度の低下率との関係を示す検量線を予め作成する。前記方法で測定した時間とレーザ光強度の低下曲線から所定の時間でのレーザ光強度の低下率を求め、このレーザ光強度の低下率を前記検量線と照合させることにより、被測定検体溶液中の抗原濃度を測定できる。
【0030】
一方、導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する抗原が存在しない場合、微粒子13の第2物質(二次抗体)12は光導波路3表面の第1物質(一次抗体)11と結合することなく被測定検体溶液中に分散する。さらに、余剰の検体液及び微粒子13を洗浄除去した後、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、発色試薬を導入しても、導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する抗原が存在しない場合、抗原抗体反応が生じないため、酵素が存在せず発色反応が生じない。
【0031】
この状態で、赤色レーザダイオード21から赤色レーザ光を入射側グレーティング2aから平面光導波路3に入射させ、その光導波路3を伝播させて表面(センシングエリア5での露出表面)付近にエバネッセント光を発生させても、センシングエリア5内の被測定検体溶液中の微粒子13がエバネッセント光領域に殆ど存在しなくなる。すなわち、微粒子13がエバネッセント光の吸収や散乱に殆ど関与しないため、エバネッセント光の強度の減衰が殆ど起きない。さらに、発色の色素によって赤色レーザ光が吸光されないので、出射側グレーティング2bから出射される赤色レーザ光をフォトダイオード22で受光した際、そのレーザ光強度が殆ど変化しない。その結果、受光したレーザ光強度の低下率を前記検量線と照合させると、被測定検体溶液中に測定対象物質(抗原)が存在しないことがわかる。
【0032】
本実施形態では、検体溶液と、第2物質(二次抗体)12および酵素14が固定化された微粒子13の分散液とを混合後、センシングエリア5の内部に導入した。この際、例えば微粒子分散液を導入後、検体溶液を導入して混合するといったように、微粒子分散液と検体溶液を別々にセンシングエリア5に導入してもよい。
【0033】
図6に本実施形態に係る検出の信号強度比の経時変化の例を示す。図6において、信号強度比[%]が低下するほど、入射したレーザ光が吸収されて減衰し、測定対象物質を検出する感度が高いことを表す。図6における実線は本発明方式を、長二点鎖線は比較方式を示している。ここで、比較方式とは、酵素を標識していない微粒子を用いた抗原抗体反応のみの場合である。また、実験では、酵素として西洋ワサビペルオキシダーゼを用いた。
【0034】
本発明方式において、まずビーズ液と検体溶液とを混合、検出面に導入すると、抗原抗体反応によってビーズが光導波路表面に結合する量に応じて検出信号強度が低下し、およそ600秒間で約35%の信号低下率が得られた。その後、余剰のビーズ及び検体混合液を洗浄した後、発色試薬溶液を滴下すると、抗原抗体反応によりチップ表面に捕捉された微粒子に結合してある酵素による発色反応が始まる。この発色反応により、大きな信号低下が確認され、測定開始から1500秒後で約72%の信号低下率が得られた。
【0035】
一方、酵素を標識していない微粒子を用いた抗原抗体反応のみの比較方式では、1500秒後の信号低下率が47%程度であることがわかる。
【0036】
つまり、図6の結果例より、酵素を標識していない微粒子を用いた抗原抗体反応のみの比較方式(長二点鎖線)と比べて、本発明方式(実線)は酵素の発色増幅を併せることにより、実質25%程度、測定感度が向上することが可能となった。
【0037】
以上、第1の実施形態によれば、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、従来の微粒子のみによる測定方法、あるいは酵素の発色のみによる測定方法よりも対象物質を検出する感度を向上させることができる。さらに、色素反応の前に第2物質(二次抗体)と複数の酵素が固定された微粒子を導入することにより、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させることができる。これにより、一対の抗原抗体反応によって生じる発色量が大きくなるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0038】
(第2の実施形態)
第2の実施形態に係る物質測定用キットを以下に説明する。図7に本実施形態に係る物質測定用キットの断面図を示す。
【0039】
図7に示すように、本実施形態の物質測定用キットは、第1の実施形態の光導波路型バイオケミカルセンサチップとキャップ31とを備える。よって、図7における基板1、グレーティング2a、2b、光導波路3、低屈折率樹脂膜4、センシングエリア5は第1の実施形態の光導波路型バイオケミカルセンサチップと同様である。
【0040】
キャップ31は、前記光導波路型バイオケミカルセンサチップにおける光導波路3の主面および側面を覆うように配置され、光導波路3表面との間でセンシングエリア5を形成するための凹部を有する。
【0041】
微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13は光導波路3の上方に空間を空けて配置される。すなわち、光導波路3に対向するキャップ31の面に、微粒子13が付着あるいは収容されている。微粒子13は乾燥した固体の状態でキャップ31の面に付着していてもよいし、微粒子13を含む分散液を包装体(図示せず)が収容していてもよい。
【0042】
微粒子13を含む分散液は、例えばリン酸、トリスヒドロキシメチルアミノメタン、ホウ酸、酢酸、クエン酸、炭酸等を含む緩衝液あるいはグッドバッファーに、ウシ血清アルプミン(BSA)、カゼイン、ポリエチレングリコール等の安定化剤、Tween、Triton−X等の非イオン界面活性剤やCHAPS等の両性界面活性剤を添加したもの、またはリン酸緩衝生理食塩水(PBS)等を含む。
【0043】
包装体は、例えばポリエチレン膜またはポリエチレンとポリエチレンテレフタレートの
積層膜から作ることができる。また、包装体はマイクロチューブ、プラスチックボトル、
ガラス瓶を用いることができる。
【0044】
キャップ31は、光導波路3表面との間で例えば矩形状のセンシングエリア5を形成するための矩形凹部を有する。また、キャップ31には、センシングエリア5と連通する導入孔30が開口されている。この導入孔から、例えばポンプなどを用いて検体溶液や発色試薬などをセンシングエリア5に導入する。キャップ31は、導入孔30とは別に、各種溶液を排出する排出孔を有していてもよい。キャップ31は、例えばアクリル樹脂のような樹脂から作られる。キャップ31の材料として、所定の低屈折率を有する他の樹脂等を代用することも可能である。
【0045】
次に、本実施形態に係る物質測定用キットを用いた測定方法を説明する。
【0046】
まず、図7に示す物質測定用キットを用意する。次いで、センシングエリア5内に被測定検体溶液を導入孔30を通して導入する。導入の方法は、例えば滴下や流入が考えられる。このとき、導入した被測定検体溶液中の測定対象物質(抗原)は、光導波路3
表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合する。
【0047】
次いで、例えばポンプにより導入孔30を介して被測定検体溶液を吸引及び押し出し導入することにより、キャップに付着した微粒子13と被測定検体溶液とを混合する。あるいは、包装体に保持された微粒子3を含む分散液と被測定検体溶液とを混合する。これにより、センシングエリア5に微粒子13が導入され、微粒子13の第2物質(二次抗体)12が光導波路3表面の第1物質(一次抗体)11と抗原抗体反応した測定対象物質(抗原)と抗原抗体反応して結合される。すなわち、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0048】
この後、例えばポンプにより導入孔30を介して発色試薬をセンシングエリア5に導入する。微粒子13に固定化された酵素14により、発色反応が触媒され、色素が発色する。
【0049】
発色試薬を導入する前に、微粒子3と被測定検体溶液との余剰な混合液を、ポンプなどで吸引して排出してもよい。あるいは、排出孔から外部に排出してもよい。
【0050】
この状態で、第1の実施形態と同様に、光源21からレーザ光を入射側グレーティング2aを介して光導波路3に入射させる。レーザ光は光導波路3内を伝播し、出射側グレーティング2bから受光素子22へと出射される。出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定することができる。
【0051】
以上、第2の実施形態に係る物質測定用キットによれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0052】
(第3の実施形態)
第3の実施形態に係る物質測定用キットを以下に説明する。図8に本実施形態に係る物質測定用キットの断面図を示す。
【0053】
図8に示すように、本実施形態の物質測定用キットは、第1の実施形態の光導波路型バイオケミカルセンサチップを、キャップ44上に逆様に設置した形態である。
【0054】
微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13はセンシングエリア5に配置されているのではなく、キャップ44に設けられた空隙48に収容されている。微粒子13は乾燥した固体の状態で空隙48の内面に付着していてもよいし、微粒子13を含む分散液が空隙48に収容されていてもよい。
【0055】
微粒子13を含む分散液は、例えばリン酸、トリスヒドロキシメチルアミノメタン、ホウ酸、酢酸、クエン酸、炭酸等を含む緩衝液あるいはグッドバッファーに、ウシ血清アルプミン(BSA)、カゼイン、ポリエチレングリコール等の安定化剤、Tween、Triton−X等の非イオン界面活性剤やCHAPS等の両性界面活性剤を添加したもの、またはリン酸緩衝生理食塩水(PBS)等を含む。
【0056】
キャップ44は、光導波路3表面との間で例えば矩形状のセンシングエリア5を形成するための空隙43を有する。また、キャップ44には、センシングエリア5と連通する導入孔45が開口されている。この導入孔から、例えばポンプ40などを用いて被測定検体溶液や発色試薬などをセンシングエリア5に導入する。キャップ44は、各種溶液を排出する排出孔41を有していてもよい。排出孔41は逆止弁42を備え、溶液の排出を制御する。
【0057】
キャップ44は、例えばアクリル樹脂のような樹脂から作られる。キャップ44の材料として、所定の低屈折率を有する他の樹脂等を代用することも可能である。
【0058】
また、キャップ44は、被測定検体溶液を導入する空隙46を有する。
【0059】
次に、本実施形態に係る物質測定用キットを用いた測定方法を説明する。
【0060】
まず、図8に示す物質測定用キットを用意する。次いで、被測定検体溶液を空隙46を通して導入する。ポンプ40を用いて空気を吸引することにより、被測定検体溶液を空隙46から空隙48に導入する。空隙48において、被測定検体溶液と微粒子13が混合される。このとき、ポンプ40を用いて空気を吸引及び押し出しすることにより、混合を促進してもよい。
【0061】
次いで、ポンプ40から空気を押し出すことにより、被測定検体溶液と微粒子13の混合液を空隙43に導入する。導入した混合液中の測定対象物質(抗原)は、光導波路3表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合する。また、センシングエリア5に微粒子13が導入されるので、微粒子13の第2物質(二次抗体)12が光導波路3表面の第1物質(一次抗体)11と抗原抗体反応した測定対象物質(抗原)と抗原抗体反応して結合される。すなわち、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0062】
この後、ポンプで空気を押し出すことにより、排出孔41から、微粒子3と被測定検体溶液との余剰な混合液を外に排出する。これにより、抗体と反応しなかった余剰な測定対象物質(抗原)は洗い流される。
【0063】
この後、同様にポンプを吸引及び押し出しすることで、空隙46を介して発色試薬を空隙43に導入し、センシングエリア5に発色試薬を提供する。あるいは、光導波路型バイオケミカルセンサチップをキャップ44から取り外し、センシングエリア5に発色試薬を滴下してもよい。センシングエリア5に発色試薬が提供されることにより、微粒子13に固定化された酵素14により発色反応が触媒され、色素が発色する。
【0064】
この状態で、第1の実施形態および第2の実施形態と同様に、光源21からレーザ光を入射側グレーティング2aを介して光導波路3に入射させる。レーザ光は光導波路3内を伝播し、出射側グレーティング2bから受光素子22へと出射される。出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定することができる。
【0065】
以上、第3の実施形態に係る物質測定用キットによれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0066】
(第4の実施形態)
第4の実施形態に係る測定対象物質の測定方法を以下に説明する。図9に本実施形態に係る測定方法を説明する図を示す。
【0067】
図9に示すように、本実施形態で用いる光導波路型バイオケミカルセンサチップは実施形態1と同様の構成である。微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13はセンシングエリア5に配置されているのではなく、別の容器あるいは包装に収容されている。微粒子13は乾燥した固体の状態でもよいし、微粒子13を含む分散液でもよい。ここでは、別の容器あるいは包装に収容された微粒子13を、微粒子試薬という。
【0068】
まず、図9に示す光導波路型バイオケミカルセンサチップと微粒子試薬を用意する。次いで、被測定検体溶液を光導波路型バイオケミカルセンサチップのセンシングエリア5に滴下する。続いて、微粒子試薬を光導波路型バイオケミカルセンサチップのセンシングエリア5に滴下する。これにより、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0069】
その後、第1の実施形態と同様に、余剰の検体液及び微粒子13を洗浄除去した後、発色試薬をセンシングエリア5に滴下し、微粒子13に固定化された酵素14により発色反応が触媒され、色素が発色する。光源21からレーザ光を入射させ、受光素子22に出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定する。
【0070】
なお、被測定検体溶液と微粒子試薬をセンシングエリア5に滴下する順番は、上述の順番と逆であってもよい。すなわち、最初に微粒子試薬をセンシングエリア5に滴下し、次に被測定検体溶液をセンシングエリア5に滴下してもよい。
【0071】
さらには、被測定検体溶液と微粒子試薬を別々にセンシングエリア5に滴下するのではなく、被測定検体溶液と微粒子試薬を混合した混合液を作成し、この混合液をセンシングエリア5に滴下してもよい。
【0072】
以上、第4の実施形態に係る測定方法によれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0073】
本発明のいくつかの実施形態を説明したが、これらの実施形態は、例として提示したものであり、発明の範囲を限定することは意図していない。これら実施形態は、その他の様々な形態で実施されることが可能であり、発明の要旨を逸脱しない範囲で、種々の省略、置き換え、変更を行うことができる。これら実施形態やその変形は、発明の範囲や要旨に含まれると同様に、特許請求の範囲に記載された発明とその均等の範囲に含まれるものである。
【符号の説明】
【0074】
1・・・基板
2a、2b・・・グレーティング
3・・・光導波路
4・・・低屈折率樹脂膜
5・・・センシングエリア
6・・・セル壁
10・・・酵素標識(二次)抗体
11・・・第1物質(一次抗体)
12・・・第2物質(二次抗体)
13・・・微粒子
14・・・酵素
21・・・光源
22・・・受光素子
【技術分野】
【0001】
本発明の実施形態は、光導波型バイオケミカルセンサチップ、光導波型バイオセンサ及び物質測定用キットに関する。
【背景技術】
【0002】
従来の抗原抗体反応を利用した免疫測定は、通常、測定対象とする検体中の測定対象物質(例えば、タンパク質等)に対応する一次抗体をウエル状の基材表面に固定化する。ウエル内に各々所定量の検体溶液、二次抗体液、発色試薬を順次滴下する。各溶液の滴下毎に、所定の洗浄液により洗浄を行う。このような免疫測定は、各溶液及び洗浄液を測定者が秤量しつつ加え、かつ排出するという複雑な手順で行われる。更に、100μLの規模の溶液を用いることから、各反応に数十分から数時間という時間を要するのが一般的である。
【0003】
そこで、酵素反応により発色した際に沈殿する酵素反応産物を生成する発色試薬を用い、沈殿したその酵素反応産物に起因する光の物理量の変化を光導波路のエバネッセント波で測定することで、検体溶液の容量が不正確でも測定が可能な方法が提案されている。
【0004】
これらの方法においては,発色反応を触媒する酵素で標識された抗体等を用い、通常、1つの抗体に標識される酵素(発色触媒酵素)は1つである。つまり、一対の抗原抗体反応により、発色触媒酵素1つ分の発色が生じる。従って、発色量(すなわち、測定対象物質を検出する感度)は抗体の数に規定され、より高感度化を図ることは難しい。
【0005】
一方、微粒子を光導波型バイオケミカルセンサチップの光導波路上に分散させることで、微粒子が光を吸収及び散乱し、余剰の検体溶液や二次抗体を洗浄する手順を含まずに測定対象物質を定量することが可能な技術が提案されている。この技術においては、微粒子が光導波路表面に一層分最密配列された場合に、測定対象物質を検出する感度が最大になると考えられる。
【0006】
いずれの方式においても、より高感度な検出が必要とされる検査項目を想定すると、測定対象物質の検出感度を向上させる技術の開発が望まれていた。
【先行技術文献】
【特許文献】
【0007】
【特許文献1】特許第4231051号公報
【特許文献2】特開2009-133842号公報
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明が解決しようとする課題は、測定対象物質の検出感度を向上させることが可能な光導波型バイオケミカルセンサチップ、光導波型バイオセンサ及び物質測定用キットを提供することである。
【課題を解決するための手段】
【0009】
本実施形態の光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、を備える。
【図面の簡単な説明】
【0010】
【図1】第1の実施形態に係る光導波路型バイオケミカルセンサチップの断面図
【図2】同実施形態に係る微粒子の形態を示す模式図
【図3】同実施形態に係る微粒子の別の形態を示す模式図
【図4】同実施形態に係る光導波路型バイオセンサの模式図
【図5】同実施形態に係る被測定検体中の測定対象物質を測定する工程を示す図
【図6】同実施形態に係る検出信号強度の経時変化の例を示す図
【図7】第2の実施形態に係る物質測定用キットの断面図
【図8】第3の実施形態に係る物質測定用キットの断面図
【図9】第4の実施形態に係る測定方法の手順を説明する図
【発明を実施するための形態】
【0011】
以下、本発明の実施形態を図面を参照しながら説明する。
【0012】
(第1の実施形態)
図1は、第1の実施形態に係る光導波路型バイオケミカルセンサチップの断面図である。
【0013】
第1実施形態に係る光導波路型バイオケミカルセンサチップは、測定対象物質と特異的に反応する第1物質11が表面に固定化された光導波路3と、前記測定対象物質と特異的に反応する第2物質12及び発色反応を触媒する酵素14が固定化された微粒子13と、を備える。
【0014】
ここで測定対象物質は、例えば血液、血清、血漿、生体試料、食品等の中に含まれる蛋白質、ペプチド、遺伝子等が挙げられる。具体的には、インスリン、カゼイン、β−ラクトグロブリン、オボアルブミン、カルシトニン、C−ペプチド、レプチン、β−2−ミクログロブリン、レチノール結合タンパク、α−1−ミクログロブリン、α−フェトプロテイン、癌胎児性抗原、トロポニン−I、クルカゴン様ペプチド、インスリン様ペプチド、腫瘍増殖因子、繊維芽細胞増殖因子、血小板成長因子、上皮増殖因子、コルチゾール、トリヨードサイロニン、サイロキシン等のハプテンホルモン、ジゴキシン、テオフィリン等の薬物、細菌、ウイルス等の感染性物質、肝炎抗体、IgEの他、そばの主要タンパク質複合体、落花生のArah2を含む可溶性タンパク質等が挙げられるが、これらに限定されるものではない。
【0015】
光導波路3は、例えば平面光導波路を用いることができる。この光導波路3は、例えばフェノール樹脂、エポキシ樹脂のような熱硬化性樹脂または無アルカリガラスから形成することができる。詳細には、ここで用いる材料とは、所定の光の透過性を有する材料であって、特に、ポリスチレンを主たる構造とするエポキシ樹脂等であることが好ましい。光導波路3への被測定検体中の測定対象物質と特異的に反応する第1物質11の固定化は、例えば光導波路3の表面との疎水性相互作用や化学結合により固定化する。
【0016】
第1物質11は、例えば被測定検体の測定対象物質が抗原の場合、抗体(一次抗体)を用いることができる。
【0017】
微粒子13は、光導波路3上に分散している。ここで「光導波路上に微粒子が分散する」とは、微粒子13が光導波路3の上方(基板1に接する面と反対側の面)に直接的または間接的に分散されることを意味する。「微粒子が光導波路上方に間接的に分散する」形態は、例えば微粒子13が光導波路3の表面にブロッキング層を介して分散される形態が挙げられる。ブロッキング層は、例えばポリビニルアルコール、ウシ血清アルブミン(BSA)、ポリエチレングリコール、リン脂質ポリマー、ゼラチン、カゼイン,糖類(例えばスクロース、トレハロース)のような水溶性物質を含む。ブロッキング層は、さらにプロテアーゼインヒビターを含んでも良い。あるいは、図1では微粒子13が光導波路に近接して配置されている例を示しているが、別の例として、微粒子13が光導波路3の上方に空間を空けて配置される形態が挙げられる。例えば、光導波路3に対向して支持板(図示せず)が配置され、その支持板の光導波路3と対向する面に、微粒子13が分散していてもよい。
【0018】
微粒子13は、金属、金属酸化物、金属と金属酸化物の複合体のうちいずれかのコロイド、又は球状樹脂である。例えば、微粒子13として、ポリスチレン製のラテックスビーズ(商品名)のような樹脂ビーズもしくは金コロイドのような金属コロイド、または酸化チタン粒子のような無機酸化物粒子を用いることができる。微粒子13は、アルブミンのようなタンパク質、アガロースのような多糖類、シリカ粒子、カーボン粒子のような非金属粒子も用いることができる。特に、ラテックスビーズ、金属コロイドが好ましい。ラテックスビーズの中で、後述する光導波路を伝播させる光が赤色レーザの場合、青色ラテックスビーズが好ましい。微粒子13は、50nm〜10μmの径を有することが好ましい。
【0019】
図2は、微粒子13の形態を示す模式図である。微粒子13の表面には、第2物質12と酵素14とが固定化される。第2物質12は、例えば被測定検体の測定対象物質が抗原の場合、抗体(二次抗体)を用いることができる。酵素14は、発色反応を触媒する発色触媒酵素である。例えば、酵素14としてペルオキシダーゼが用いられる。本実施形態では、1つの微粒子13に対して、複数の酵素14を固定化することができる。
【0020】
図3は、微粒子13の別の形態を示す模式図である。図3に示すように、微粒子13の表面に、酵素14によって酵素標識された第2物質を固定化してもよい。発色酵素によって酵素標識された第2物質とは、例えば、ペルオキシダーゼ標識二次抗体である。
【0021】
次に、第1の実施形態に係る光導波路型バイオケミカルセンサチップを図1を参照して具体的に説明する。
【0022】
基板1の主面の両端部には、入射側グレーティング2aおよび出射側グレーティング2bが設けられている。基板1は例えば、無アルカリガラスである。グレーティング2a,2bは、基板よりも高い屈折率を有する材料で形成される。例えば、グレーティング2a,2bは、酸化チタン(TiO2)、酸化錫(SnO2)、酸化亜鉛、ニオブ酸リチウム、ガリウム砒素(GaAs)、インジウム錫酸化物(ITO)、ポリイミド等から形成される。例えば熱硬化性樹脂からなる平面光導波路3は、グレーティング2a,2bを含む基板1主面に形成されている。低屈折率樹脂膜4は、平面光導波路3上に被覆されている。低屈折率樹脂は、例えば、市販されている旭硝子株式会社製のサイトップ(登録商標)のポリ(パーフルオロブテニルビニルエーテル)等を用いることができる。低屈折率樹脂膜4には、グレーティング2a,2b間に位置する平面光導波路3の一部が露出するよう開口して例えば矩形状のセンシングエリア5を形成している。枠状のセル壁6は、平面光導波路3を露出させるセンシングエリア5を囲むように低屈折率樹脂膜4上に形成されている。
【0023】
被測定検体の測定対象物質と特異的に反応する第1物質11は、センシングエリア5から露出する平面光導波路3表面に、例えばシランカップリング剤による疎水化処理により固定化されている。被測定検体の測定対象物質と特異的に反応する第2物質12は、微粒子13に、例えば物理吸着、あるいはカルボキシル基やアミノ基等を介した化学結合により固定化されている。さらに、発色反応を触媒する酵素14が、微粒子13に固定化されている。第2物質12および酵素14が固定化された微粒子13は、前記物質11が固定化された平面光導波路3表面に分散されている。この微粒子13の分散は、例えば微粒子13および水溶性物質を含むスラリを平面光導波路3に塗布、凍結乾燥することにより形成される。あるいは、微粒子13は液体に溶解させて光導波路3上に塗布あるいは滴下してもよいし、固体として光導波路3上に分散させてもよい。
【0024】
図4は、第1の実施形態に係る光導波路型バイオセンサの模式図である。第1の実施形態に係る光導波路型バイオセンサは、前述した光導波路型バイオケミカルセンサチップの入射側グレーティング2aから光導波路3に光を入射させるための光源(例えば赤色レーザダイオード)21と、出射側グレーティング2bから出射される光を受光する受光素子(例えばフォトダイオード)22をさらに備える。光源21から前述の光導波路型バイオケミカルセンサチップに光を照射し、入射側グレーティング2aにより光が回折される。入射側グレーティング2aから入射された光は、光導波路3内を伝播し、出射側グレーティング2bにより回折されて出射される。出射された光は受光素子22により受光され、光の強度が測定される。入射した光と出射された光との強度を比較し、光の吸収率を測定することで、被測定物の濃度が測定される。
【0025】
次に、前述した光導波路型バイオセンサを用いて測定対象物質を測定する測定方法を図5の(a)〜(c)を参照して説明する。
【0026】
まず、図4に示す光導波路型バイオセンサを用意する。次いで、図5(a)に示すように、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、被測定検体溶液と、第2物質(二次抗体)12および酵素14が固定化された微粒子13の分散液との混合液を導入する。導入の方法は、例えば滴下や流入が考えられる。導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する測定対象物質(抗原)が存在すると、図5(a)に示すように抗原15は光導波路3表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合し、さらに微粒子13の第2物質(二次抗体)12は抗原と抗原抗体反応を生じて結合する。つまり、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で抗原を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に対して固定化される。
【0027】
さらに、図5(b)に示すように、余剰の検体液及び微粒子13を洗浄除去した後、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、発色試薬を導入する。導入の方法は、例えば滴下や流入が考えられる。被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する測定対象物質(抗原)が存在する場合、発色試薬の導入により酵素14が発色を触媒し、色素が発色する。ところで上述のように、1つの測定対象物質(抗原)は1つの第1物質(一次抗体)11と抗原抗体反応を生じて結合し、さらに微粒子13のいずれか1つの第2物質(二次抗体)12は1つの測定対象物質(抗原)と抗原抗体反応を生じて結合する。本実施形態では、微粒子13には複数の酵素が固定化されているため、1対の抗原抗体反応に対して、複数の酵素が発色反応を触媒し、複数の酵素分の発色反応が生じる。
【0028】
この状態で、赤色レーザダイオード21から赤色レーザ光を入射側グレーティング2aから平面光導波路3に入射させ、その光導波路3を伝播させて表面(センシングエリア5での露出表面)付近にエバネッセント光を発生させる。すると、微粒子13が光導波路3表面に対して固定化されているため、微粒子13がエバネッセント光領域に存在することになる。すなわち、微粒子13がエバネッセント光の吸収や散乱に関与するため、エバネッセント光の強度が減衰する。さらに、酵素と発色試薬により色素が発色しているので、エバネッセント光が色素により吸光される。その結果、出射側グレーティング2bから出射される赤色レーザ光をフォトダイオード22で受光すると、出射されるレーザ光強度は、固定化された微粒子13及び発色色素の影響によって時間の経過に伴って低下する。
【0029】
フォトダイオード22で受光したレーザ光強度の低下率は、光導波路3表面に対して固定化される微粒子13の量、および、発色する色素濃度に依存する。つまり、抗原抗体反応に関与する被測定検体溶液中の抗原濃度に比例する。したがって、抗原濃度が既知の被測定検体溶液において時間の経過に伴うレーザ光強度の低下曲線を作成し、この曲線の所定の時間でのレーザ光強度の低下率を求め、抗原濃度とレーザ光強度の低下率との関係を示す検量線を予め作成する。前記方法で測定した時間とレーザ光強度の低下曲線から所定の時間でのレーザ光強度の低下率を求め、このレーザ光強度の低下率を前記検量線と照合させることにより、被測定検体溶液中の抗原濃度を測定できる。
【0030】
一方、導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する抗原が存在しない場合、微粒子13の第2物質(二次抗体)12は光導波路3表面の第1物質(一次抗体)11と結合することなく被測定検体溶液中に分散する。さらに、余剰の検体液及び微粒子13を洗浄除去した後、センシングエリア5内の微粒子13の分散領域を含む光導波路3表面に、発色試薬を導入しても、導入した被測定検体溶液中に光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12と特異的に反応する抗原が存在しない場合、抗原抗体反応が生じないため、酵素が存在せず発色反応が生じない。
【0031】
この状態で、赤色レーザダイオード21から赤色レーザ光を入射側グレーティング2aから平面光導波路3に入射させ、その光導波路3を伝播させて表面(センシングエリア5での露出表面)付近にエバネッセント光を発生させても、センシングエリア5内の被測定検体溶液中の微粒子13がエバネッセント光領域に殆ど存在しなくなる。すなわち、微粒子13がエバネッセント光の吸収や散乱に殆ど関与しないため、エバネッセント光の強度の減衰が殆ど起きない。さらに、発色の色素によって赤色レーザ光が吸光されないので、出射側グレーティング2bから出射される赤色レーザ光をフォトダイオード22で受光した際、そのレーザ光強度が殆ど変化しない。その結果、受光したレーザ光強度の低下率を前記検量線と照合させると、被測定検体溶液中に測定対象物質(抗原)が存在しないことがわかる。
【0032】
本実施形態では、検体溶液と、第2物質(二次抗体)12および酵素14が固定化された微粒子13の分散液とを混合後、センシングエリア5の内部に導入した。この際、例えば微粒子分散液を導入後、検体溶液を導入して混合するといったように、微粒子分散液と検体溶液を別々にセンシングエリア5に導入してもよい。
【0033】
図6に本実施形態に係る検出の信号強度比の経時変化の例を示す。図6において、信号強度比[%]が低下するほど、入射したレーザ光が吸収されて減衰し、測定対象物質を検出する感度が高いことを表す。図6における実線は本発明方式を、長二点鎖線は比較方式を示している。ここで、比較方式とは、酵素を標識していない微粒子を用いた抗原抗体反応のみの場合である。また、実験では、酵素として西洋ワサビペルオキシダーゼを用いた。
【0034】
本発明方式において、まずビーズ液と検体溶液とを混合、検出面に導入すると、抗原抗体反応によってビーズが光導波路表面に結合する量に応じて検出信号強度が低下し、およそ600秒間で約35%の信号低下率が得られた。その後、余剰のビーズ及び検体混合液を洗浄した後、発色試薬溶液を滴下すると、抗原抗体反応によりチップ表面に捕捉された微粒子に結合してある酵素による発色反応が始まる。この発色反応により、大きな信号低下が確認され、測定開始から1500秒後で約72%の信号低下率が得られた。
【0035】
一方、酵素を標識していない微粒子を用いた抗原抗体反応のみの比較方式では、1500秒後の信号低下率が47%程度であることがわかる。
【0036】
つまり、図6の結果例より、酵素を標識していない微粒子を用いた抗原抗体反応のみの比較方式(長二点鎖線)と比べて、本発明方式(実線)は酵素の発色増幅を併せることにより、実質25%程度、測定感度が向上することが可能となった。
【0037】
以上、第1の実施形態によれば、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、従来の微粒子のみによる測定方法、あるいは酵素の発色のみによる測定方法よりも対象物質を検出する感度を向上させることができる。さらに、色素反応の前に第2物質(二次抗体)と複数の酵素が固定された微粒子を導入することにより、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させることができる。これにより、一対の抗原抗体反応によって生じる発色量が大きくなるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0038】
(第2の実施形態)
第2の実施形態に係る物質測定用キットを以下に説明する。図7に本実施形態に係る物質測定用キットの断面図を示す。
【0039】
図7に示すように、本実施形態の物質測定用キットは、第1の実施形態の光導波路型バイオケミカルセンサチップとキャップ31とを備える。よって、図7における基板1、グレーティング2a、2b、光導波路3、低屈折率樹脂膜4、センシングエリア5は第1の実施形態の光導波路型バイオケミカルセンサチップと同様である。
【0040】
キャップ31は、前記光導波路型バイオケミカルセンサチップにおける光導波路3の主面および側面を覆うように配置され、光導波路3表面との間でセンシングエリア5を形成するための凹部を有する。
【0041】
微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13は光導波路3の上方に空間を空けて配置される。すなわち、光導波路3に対向するキャップ31の面に、微粒子13が付着あるいは収容されている。微粒子13は乾燥した固体の状態でキャップ31の面に付着していてもよいし、微粒子13を含む分散液を包装体(図示せず)が収容していてもよい。
【0042】
微粒子13を含む分散液は、例えばリン酸、トリスヒドロキシメチルアミノメタン、ホウ酸、酢酸、クエン酸、炭酸等を含む緩衝液あるいはグッドバッファーに、ウシ血清アルプミン(BSA)、カゼイン、ポリエチレングリコール等の安定化剤、Tween、Triton−X等の非イオン界面活性剤やCHAPS等の両性界面活性剤を添加したもの、またはリン酸緩衝生理食塩水(PBS)等を含む。
【0043】
包装体は、例えばポリエチレン膜またはポリエチレンとポリエチレンテレフタレートの
積層膜から作ることができる。また、包装体はマイクロチューブ、プラスチックボトル、
ガラス瓶を用いることができる。
【0044】
キャップ31は、光導波路3表面との間で例えば矩形状のセンシングエリア5を形成するための矩形凹部を有する。また、キャップ31には、センシングエリア5と連通する導入孔30が開口されている。この導入孔から、例えばポンプなどを用いて検体溶液や発色試薬などをセンシングエリア5に導入する。キャップ31は、導入孔30とは別に、各種溶液を排出する排出孔を有していてもよい。キャップ31は、例えばアクリル樹脂のような樹脂から作られる。キャップ31の材料として、所定の低屈折率を有する他の樹脂等を代用することも可能である。
【0045】
次に、本実施形態に係る物質測定用キットを用いた測定方法を説明する。
【0046】
まず、図7に示す物質測定用キットを用意する。次いで、センシングエリア5内に被測定検体溶液を導入孔30を通して導入する。導入の方法は、例えば滴下や流入が考えられる。このとき、導入した被測定検体溶液中の測定対象物質(抗原)は、光導波路3
表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合する。
【0047】
次いで、例えばポンプにより導入孔30を介して被測定検体溶液を吸引及び押し出し導入することにより、キャップに付着した微粒子13と被測定検体溶液とを混合する。あるいは、包装体に保持された微粒子3を含む分散液と被測定検体溶液とを混合する。これにより、センシングエリア5に微粒子13が導入され、微粒子13の第2物質(二次抗体)12が光導波路3表面の第1物質(一次抗体)11と抗原抗体反応した測定対象物質(抗原)と抗原抗体反応して結合される。すなわち、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0048】
この後、例えばポンプにより導入孔30を介して発色試薬をセンシングエリア5に導入する。微粒子13に固定化された酵素14により、発色反応が触媒され、色素が発色する。
【0049】
発色試薬を導入する前に、微粒子3と被測定検体溶液との余剰な混合液を、ポンプなどで吸引して排出してもよい。あるいは、排出孔から外部に排出してもよい。
【0050】
この状態で、第1の実施形態と同様に、光源21からレーザ光を入射側グレーティング2aを介して光導波路3に入射させる。レーザ光は光導波路3内を伝播し、出射側グレーティング2bから受光素子22へと出射される。出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定することができる。
【0051】
以上、第2の実施形態に係る物質測定用キットによれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0052】
(第3の実施形態)
第3の実施形態に係る物質測定用キットを以下に説明する。図8に本実施形態に係る物質測定用キットの断面図を示す。
【0053】
図8に示すように、本実施形態の物質測定用キットは、第1の実施形態の光導波路型バイオケミカルセンサチップを、キャップ44上に逆様に設置した形態である。
【0054】
微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13はセンシングエリア5に配置されているのではなく、キャップ44に設けられた空隙48に収容されている。微粒子13は乾燥した固体の状態で空隙48の内面に付着していてもよいし、微粒子13を含む分散液が空隙48に収容されていてもよい。
【0055】
微粒子13を含む分散液は、例えばリン酸、トリスヒドロキシメチルアミノメタン、ホウ酸、酢酸、クエン酸、炭酸等を含む緩衝液あるいはグッドバッファーに、ウシ血清アルプミン(BSA)、カゼイン、ポリエチレングリコール等の安定化剤、Tween、Triton−X等の非イオン界面活性剤やCHAPS等の両性界面活性剤を添加したもの、またはリン酸緩衝生理食塩水(PBS)等を含む。
【0056】
キャップ44は、光導波路3表面との間で例えば矩形状のセンシングエリア5を形成するための空隙43を有する。また、キャップ44には、センシングエリア5と連通する導入孔45が開口されている。この導入孔から、例えばポンプ40などを用いて被測定検体溶液や発色試薬などをセンシングエリア5に導入する。キャップ44は、各種溶液を排出する排出孔41を有していてもよい。排出孔41は逆止弁42を備え、溶液の排出を制御する。
【0057】
キャップ44は、例えばアクリル樹脂のような樹脂から作られる。キャップ44の材料として、所定の低屈折率を有する他の樹脂等を代用することも可能である。
【0058】
また、キャップ44は、被測定検体溶液を導入する空隙46を有する。
【0059】
次に、本実施形態に係る物質測定用キットを用いた測定方法を説明する。
【0060】
まず、図8に示す物質測定用キットを用意する。次いで、被測定検体溶液を空隙46を通して導入する。ポンプ40を用いて空気を吸引することにより、被測定検体溶液を空隙46から空隙48に導入する。空隙48において、被測定検体溶液と微粒子13が混合される。このとき、ポンプ40を用いて空気を吸引及び押し出しすることにより、混合を促進してもよい。
【0061】
次いで、ポンプ40から空気を押し出すことにより、被測定検体溶液と微粒子13の混合液を空隙43に導入する。導入した混合液中の測定対象物質(抗原)は、光導波路3表面の第1物質(一次抗体)11と抗原抗体反応を生じて結合する。また、センシングエリア5に微粒子13が導入されるので、微粒子13の第2物質(二次抗体)12が光導波路3表面の第1物質(一次抗体)11と抗原抗体反応した測定対象物質(抗原)と抗原抗体反応して結合される。すなわち、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0062】
この後、ポンプで空気を押し出すことにより、排出孔41から、微粒子3と被測定検体溶液との余剰な混合液を外に排出する。これにより、抗体と反応しなかった余剰な測定対象物質(抗原)は洗い流される。
【0063】
この後、同様にポンプを吸引及び押し出しすることで、空隙46を介して発色試薬を空隙43に導入し、センシングエリア5に発色試薬を提供する。あるいは、光導波路型バイオケミカルセンサチップをキャップ44から取り外し、センシングエリア5に発色試薬を滴下してもよい。センシングエリア5に発色試薬が提供されることにより、微粒子13に固定化された酵素14により発色反応が触媒され、色素が発色する。
【0064】
この状態で、第1の実施形態および第2の実施形態と同様に、光源21からレーザ光を入射側グレーティング2aを介して光導波路3に入射させる。レーザ光は光導波路3内を伝播し、出射側グレーティング2bから受光素子22へと出射される。出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定することができる。
【0065】
以上、第3の実施形態に係る物質測定用キットによれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0066】
(第4の実施形態)
第4の実施形態に係る測定対象物質の測定方法を以下に説明する。図9に本実施形態に係る測定方法を説明する図を示す。
【0067】
図9に示すように、本実施形態で用いる光導波路型バイオケミカルセンサチップは実施形態1と同様の構成である。微粒子13も第1の実施形態における図2または図3と同様に、第2物質(二次抗体)12と酵素14とが固定化された構成とする。ただし、本実施形態では、微粒子13はセンシングエリア5に配置されているのではなく、別の容器あるいは包装に収容されている。微粒子13は乾燥した固体の状態でもよいし、微粒子13を含む分散液でもよい。ここでは、別の容器あるいは包装に収容された微粒子13を、微粒子試薬という。
【0068】
まず、図9に示す光導波路型バイオケミカルセンサチップと微粒子試薬を用意する。次いで、被測定検体溶液を光導波路型バイオケミカルセンサチップのセンシングエリア5に滴下する。続いて、微粒子試薬を光導波路型バイオケミカルセンサチップのセンシングエリア5に滴下する。これにより、光導波路3表面の第1物質(一次抗体)11と微粒子13の第2物質(二次抗体)12の間で測定対象物質(抗原)を介して抗原抗体反応を生じるために、微粒子13が光導波路3表面に固定化される。
【0069】
その後、第1の実施形態と同様に、余剰の検体液及び微粒子13を洗浄除去した後、発色試薬をセンシングエリア5に滴下し、微粒子13に固定化された酵素14により発色反応が触媒され、色素が発色する。光源21からレーザ光を入射させ、受光素子22に出射されたレーザ光の強度の低下率より、被測定検体溶液中の測定対象物質(抗原)の濃度を測定する。
【0070】
なお、被測定検体溶液と微粒子試薬をセンシングエリア5に滴下する順番は、上述の順番と逆であってもよい。すなわち、最初に微粒子試薬をセンシングエリア5に滴下し、次に被測定検体溶液をセンシングエリア5に滴下してもよい。
【0071】
さらには、被測定検体溶液と微粒子試薬を別々にセンシングエリア5に滴下するのではなく、被測定検体溶液と微粒子試薬を混合した混合液を作成し、この混合液をセンシングエリア5に滴下してもよい。
【0072】
以上、第4の実施形態に係る測定方法によれば、第1の実施形態と同様の効果を得ることができる。すなわち、微粒子による光の吸収および散乱に加え、酵素に触媒された発色による吸光が生じるので、対象物質を検出する感度を向上させることができる。さらに、一対の抗原抗体反応に対して複数の発色触媒酵素を作用させるので、極低濃度の測定対象物質であっても発色しやすく、高感度で定量することが可能になる。
【0073】
本発明のいくつかの実施形態を説明したが、これらの実施形態は、例として提示したものであり、発明の範囲を限定することは意図していない。これら実施形態は、その他の様々な形態で実施されることが可能であり、発明の要旨を逸脱しない範囲で、種々の省略、置き換え、変更を行うことができる。これら実施形態やその変形は、発明の範囲や要旨に含まれると同様に、特許請求の範囲に記載された発明とその均等の範囲に含まれるものである。
【符号の説明】
【0074】
1・・・基板
2a、2b・・・グレーティング
3・・・光導波路
4・・・低屈折率樹脂膜
5・・・センシングエリア
6・・・セル壁
10・・・酵素標識(二次)抗体
11・・・第1物質(一次抗体)
12・・・第2物質(二次抗体)
13・・・微粒子
14・・・酵素
21・・・光源
22・・・受光素子
【特許請求の範囲】
【請求項1】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と
を備えることを特徴とする光導波路型バイオケミカルセンサチップ。
【請求項2】
1つの前記微粒子に対して複数個の前記酵素が固定化されている
ことを特徴とする請求項1に記載の光導波路型バイオケミカルセンサチップ。
【請求項3】
前記酵素は、前記第2物質に標識している
ことを特徴とする請求項1に記載の光導波路型バイオケミカルセンサチップ。
【請求項4】
前記微粒子は、前記光導波路上に分散している
ことを特徴とする請求項1乃至請求項3いずれか一項記載の光導波路型バイオケミカルセンサチップ。
【請求項5】
前記光導波路と対向して配置された支持板をさらに備え、
前記微粒子は、前記支持板の前記光導波路と対向する表面に分散している
ことを特徴とする請求項1乃至請求項3いずれか一項記載の光導波路型バイオケミカルセンサチップ。
【請求項6】
請求項1乃至請求項5いずれか一項記載の光導波路型バイオケミカルセンサチップと、
前記光導波路に光を入射させる光源と、
前記光導波路から出射される光を受光する受光素子と
を備えることを特徴とする光導波路型バイオセンサ。
【請求項7】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記光導波路の主面および側面を覆うように配置され、前記光導波路表面との間でセンシングエリアを形成するための凹部を有するキャップと、
前記キャップにおける前記凹部の内側に分散され、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と
を備えることを特徴とする物質測定用キット。
【請求項8】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、
前記光導波路表面との間で矩形状のセンシングエリアを形成するための第1の空隙と、前記測定対象物質を含む検体溶液を導入するための第2の空隙と、前記微粒子を内部に収容する第3の空隙とを有するキャップと
を備えることを特徴とする物質測定用キット。
【請求項9】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路を有する光導波路型バイオケミカルセンサチップと、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子とを備え、
前記光導波路型バイオケミカルセンサチップ及び前記微粒子がそれぞれ個別に収容されて組み合わされた測定対象物質の物質測定用キット。
【請求項1】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と
を備えることを特徴とする光導波路型バイオケミカルセンサチップ。
【請求項2】
1つの前記微粒子に対して複数個の前記酵素が固定化されている
ことを特徴とする請求項1に記載の光導波路型バイオケミカルセンサチップ。
【請求項3】
前記酵素は、前記第2物質に標識している
ことを特徴とする請求項1に記載の光導波路型バイオケミカルセンサチップ。
【請求項4】
前記微粒子は、前記光導波路上に分散している
ことを特徴とする請求項1乃至請求項3いずれか一項記載の光導波路型バイオケミカルセンサチップ。
【請求項5】
前記光導波路と対向して配置された支持板をさらに備え、
前記微粒子は、前記支持板の前記光導波路と対向する表面に分散している
ことを特徴とする請求項1乃至請求項3いずれか一項記載の光導波路型バイオケミカルセンサチップ。
【請求項6】
請求項1乃至請求項5いずれか一項記載の光導波路型バイオケミカルセンサチップと、
前記光導波路に光を入射させる光源と、
前記光導波路から出射される光を受光する受光素子と
を備えることを特徴とする光導波路型バイオセンサ。
【請求項7】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記光導波路の主面および側面を覆うように配置され、前記光導波路表面との間でセンシングエリアを形成するための凹部を有するキャップと、
前記キャップにおける前記凹部の内側に分散され、前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と
を備えることを特徴とする物質測定用キット。
【請求項8】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路と、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子と、
前記光導波路表面との間で矩形状のセンシングエリアを形成するための第1の空隙と、前記測定対象物質を含む検体溶液を導入するための第2の空隙と、前記微粒子を内部に収容する第3の空隙とを有するキャップと
を備えることを特徴とする物質測定用キット。
【請求項9】
測定対象物質と特異的に反応する第1物質が表面に固定化された光導波路を有する光導波路型バイオケミカルセンサチップと、
前記測定対象物質と特異的に反応する第2物質及び発色反応を触媒する酵素が固定化された微粒子とを備え、
前記光導波路型バイオケミカルセンサチップ及び前記微粒子がそれぞれ個別に収容されて組み合わされた測定対象物質の物質測定用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2012−173220(P2012−173220A)
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願番号】特願2011−37590(P2011−37590)
【出願日】平成23年2月23日(2011.2.23)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
【公開日】平成24年9月10日(2012.9.10)
【国際特許分類】
【出願日】平成23年2月23日(2011.2.23)
【出願人】(000003078)株式会社東芝 (54,554)
【Fターム(参考)】
[ Back to top ]

